LAMPIRAN A
BAHAN DAN PERALATAN
Lampiran A.1:Bahan yang dipakai pada pembuatan serbuk LiFeMnNiPO4/C
Serbuk LiOH.H2O Serbuk Fe2O3
Serbuk MnO2 Serbuk Ni
Tepung Tapioka
Lampiran A.2 :Peralatan pada pembuatan serbuk LiFeMnNiPO4/C
Neraca Analitik Mortar dan Pastel
Sendok dan spatula
Chamber dan Bola milling
High Temperature Furnace (46200) Oven Pemanas
Alat Milling (SFM-1 Desk-Top Planetary Alat XRD (X-Ray Diffraction)
LAMPIRAN B
PROSES PEMBUATAN SERBUK LiFeMnNiPO4/C
Lampiran B.1 :Pembuatan Serbuk LiFeMnNiPO4/C
Serbuk LiOH.H2O Serbuk Ni
Serbuk MnO2 Bahan dicampur dengan merata
Bahan dihaluskan/digerus Bahan diayak 200 mesh
Precursor sebelum dikalsinasi Precursor sesudah dikalsinasi
LAMPIRAN C
PERHITUNGAN STOIKIOMETRI
Lampiran C.1 : Perhitungan Stoikiometri Kuantitatif (secara manual)
= ��������� ��ℎ������ ������ ℎ���
��������� ����0,7 ��0,2 �� 0,1 ��4
x n LiFe0.7 Mn0.2 Ni0.1 PO4 x Mr bahan
yang dibutuhkan
Lampiran C.2 :Perhitungan Stoikiometri Kualitatif (secara manual)
Lampiran C.3 :Analisis Kuantitatif dengan Metode RIR
1. Menetukan hkl [104]A dan [102]B
- Fe →1,164−1
2. Menentukan LPF (Lorentz-Polarization Factor ) - Untuk LPF hkl [104]A
3. Mencari fraksi volume (C)
LAMPIRAN D
PENGAMATAN SEM
Hasil mapping dari LiFe0.7Mn0.2Ni0.1PO4/C
Hasil mapping dari LiFe0.8Mn0.1Ni0.1PO4/C
Hasil SEM dari LiFe0.8Mn0.1Ni0.1PO4/C
Hasil mapping dari LiFe0.9Ni0.1PO4/C
2θ
10.1883 8.675020 3m 1 1 0 32.9675 2.714710 m -1 -3 3 43.4378 2.081540 m
10.1883 8.675020 m -1 1 0 33.1153 2.702930 16 1 1 3 43.5837 2.074910 8
11.1545 7.925720 3 -1 1 1 33.2391 2.693140 47m 0 -4 2 43.8615 2.062410 14m
11.2472 7.860610 3 -1 -1 1 33.2391 2.693140 m 1 -1 3 43.8615 2.062410 m
13.4675 6.569210 1 0 2 0 33.5336 2.670160 4 -2 0 4 44.1942 2.047650 48m
13.8474 6.389860 11 -2 0 1 33.8845 2.643310 132m 4 2 0 44.1942 2.047650 m
15.9489 5.552300 5m 1 1 1 33.8845 2.643310 m -4 2 0 44.6145 2.029330 11
15.9489 5.552300 m 1 -1 1 34.1925 2.620200 8 -3 -3 3 44.7636 2.022920 9m
16.3123 5.429420 20 0 2 1 34.7094 2.582350 24m 2 4 1 44.7636 2.022920 m
16.4438 5.386290 24 0 -2 1 34.7094 2.582350 m -3 1 4 45.0614 2.010240 11m
17.8551 4.963600 3 -1 1 2 34.8114 2.575020 17m 2 -4 1 45.0614 2.010240 m
17.9739 4.931060 5m -1 -1 2 34.8114 2.575020 m -3 -1 4 45.4012 1.995980 16m
17.9739 4.931060 m -2 0 2 34.9889 2.562360 6m 1 5 0 45.4012 1.995980 m
18.6164 4.762320 14 0 0 2 34.9889 2.562360 m -1 5 0 45.5697 1.988990 8m
19.3099 4.592800 95 -2 2 1 35.2392 2.544730 13m 3 3 1 45.5697 1.988990 m
19.4153 4.568120 88 -2 -2 1 35.2392 2.544730 m -1 5 1 45.7534 1.981430 49m
20.4583 4.337510 139m 2 2 0 35.4110 2.532780 9m 3 -3 1 45.7534 1.981430 m
20.4583 4.337510 m -2 2 0 35.4110 2.532780 m -1 1 4 46.0042 1.971210 5
21.2965 4.168660 210 2 0 1 35.5591 2.522570 19 -1 -1 4 46.1543 1.965150 14
21.6869 4.094480 11m 1 3 0 36.3679 2.468300 65m -2 -2 4 46.4034 1.955180 12
21.6869 4.094480 m -1 3 0 36.3679 2.468300 m -4 0 4 46.5276 1.950250 4
22.4164 3.962860 999 -2 2 2 36.7223 2.445290 7m 3 1 2 46.7441 1.941720 5
22.6045 3.930310 925 -2 -2 2 36.7223 2.445290 m 3 -1 2 46.8973 1.935730 14m
22.9528 3.871450 98 0 2 2 36.8235 2.438800 10 -5 1 3 46.8973 1.935730 m
23.1423 3.840180 105m 0 -2 2 36.9118 2.433170 9 -5 -1 3 47.2000 1.924020 14m
23.1423 3.840180 m -3 -1 2 37.1149 2.420320 40m 1 5 1 47.2000 1.924020 m
24.0733 3.693730 23m 1 1 2 37.1149 2.420320 m -2 4 3 47.3025 1.920090 12
24.0733 3.693730 m -3 1 0 37.2956 2.409010 8 1 -5 1 47.3931 1.916630 16m
24.2218 3.671420 40 1 -1 2 37.4749 2.397890 43 -2 -4 3 47.3931 1.916630 m
25.1073 3.543900 137m 1 -3 1 37.7482 2.381160 36 0 0 4 47.5810 1.909500 3
25.1073 3.543900 m -2 0 3 38.0155 2.365030 61m 2 0 3 47.9603 1.895280 4
25.2362 3.526090 652 2 2 1 38.0155 2.365030 m -1 5 2 48.7311 1.867090 9
25.3281 3.513510 632 2 -2 1 38.2855 2.348970 4 -1 -5 2 49.1820 1.851020 29m
26.1717 3.402140 14 -1 3 2 38.4125 2.341490 5 1 3 3 49.1820 1.851020 m
26.3113 3.384400 4 -1 1 3 38.6830 2.325740 23 1 -3 3 49.4158 1.842810 30m
26.4191 3.370830 6m -1 -1 3 38.8323 2.317140 24m 4 2 1 49.4158 1.842810 m
26.4191 3.370830 m -1 -3 2 38.8323 2.317140 m -4 2 4 49.6984 1.832990 60m
27.1258 3.284600 26 0 4 0 38.9714 2.309190 21 4 -2 1 49.6984 1.832990 m
27.9822 3.185990 83m -3 -1 3 39.0615 2.304070 36 -4 -2 4 49.9192 1.825400 18
27.9822 3.185990 m -4 0 2 39.2653 2.292580 136m 0 4 3 50.0354 1.821430 11m
28.4818 3.131230 63 -2 2 3 39.2653 2.292580 m -4 4 1 50.0354 1.821430 m
28.7097 3.106890 34m 0 4 1 39.4178 2.284060 102m -4 -4 1 50.4211 1.808400 38m
28.7097 3.106890 m -2 -2 3 39.4178 2.284060 m -4 -4 2 50.4211 1.808400 m
28.8031 3.097020 22 0 -4 1 39.6156 2.273110 128m 0 -4 3 50.5485 1.804140 17m
28.9761 3.078930 22 -3 3 1 39.6156 2.273110 m -5 1 0 50.5485 1.804140 m
29.0807 3.068090 10 -3 -3 1 39.7966 2.263190 11 -3 3 4 50.8439 1.794350 21m
29.2073 3.055080 4 2 0 2 40.0818 2.247740 11m -3 5 1 50.8439 1.794350 m
29.4580 3.029650 10m 3 1 1 40.0818 2.247740 m -3 -3 4 50.9302 1.791510 20m
29.4580 3.029650 m 3 -1 1 40.4916 2.225930 21m -1 3 4 50.9302 1.791510 m
30.0621 2.970130 4 -3 3 2 40.4916 2.225930 m -5 -3 2 51.0490 1.787620 17
30.2738 2.949840 4 -3 -3 2 40.7020 2.214910 13 -5 1 4 51.1994 1.782720 13m
30.5085 2.927680 56 -2 4 1 40.8776 2.205800 16m -3 5 2 51.1994 1.782720 m
30.6457 2.914880 48 -2 -4 1 40.8776 2.205800 m -5 -1 4 51.4079 1.775980 10m
30.9493 2.886980 102m 3 3 0 41.1477 2.191940 27m 0 6 0 51.4079 1.775980 m
30.9493 2.886980 m 4 0 0 41.1477 2.191940 m -3 -5 2 51.5555 1.771240 10m
31.0343 2.879260 159m 1 -3 2 41.2335 2.187580 27m -5 3 1 51.5555 1.771240 m
31.0343 2.879260 m -4 2 2 41.2335 2.187580 m -5 -3 1 51.6918 1.766890 24m
31.1695 2.867080 158m 0 2 3 41.6078 2.168760 38m 4 4 0 51.6918 1.766890 m
31.1695 2.867080 m -4 -2 2 41.6078 2.168760 m -4 4 0 51.8128 1.763050 46m
31.3008 2.855350 218m 2 4 0 42.2338 2.138050 5 0 6 1 51.8128 1.763050 m
31.3008 2.855350 m -2 4 0 42.3990 2.130100 33m 0 -6 1 52.0124 1.756750 38m
LAMPIRAN E
PENGAMATAN XRD
Lampiran E.1 : Pengamatan XRD Material Aktif LiFe0.7Mn0.2Ni0.1PO4/C
04- 011- 4864 Feb 24, 2015 2
:40 PM (DELL)
Status Primary QM:Star Pressure/Temperature: Ambient Chemical Formula: FeP4O11 EmpiricalFormula: FeO11 P4 Weight%: Fe15.70O49.47 P34.83 Atomic%: Fe6.25O68.75P25.00 ANX: AB4X11 CompoundName: Iron PhosphorusOxide
DAFTAR PUSTAKA
Abbas,Askamal.1997.Pengembangan Material Untuk Baterai Padat dengan Elektrolit Berbasis Senyawa Perak,Serpong.
A.Veluchanny,et al.2011. Boron Substitued Manganese Spinel Cathode for
Lithium Ion Battery. Solid state ionic.
Celine,Widjojo.2010. Pembuatan dan Karakterisasi LiFePO4/Soda Lime Silica
Sebagai Bahan Katoda Pada Baterai Lithium. Institut Fur Gesteinhutten
Kunde RWTH Acchen Germany.
Chunfu,Lin. 2014. Li4Ti5O12 Based Anode Materials For High Power Lithium Ion
Batteries, Singapura.National University of Singapore.
H.A,Kiehne.1989. Batterry Technology Handbook. Federal Republic of Jerman. Hongbo,shu et al.2013. Improved Electrochemical Performance of LiFePO4/C
Cathode Via Ni and Mn Co-doping Lithium-ion Batteries.
Jin,B.and Jiang.Q. 2009. Lithium Batteries Research Technology and
Applications: LiFePO4 Cathode Materials for Lithium-ion Batteries. Nova
Science Publisher.
Koseva,N.V, et al.2011. Synthesis of LixMn2O4 Cathoda Material for Lithium
Batteries. Journal of Mechanochemical, Institute of solid state chemistry,
Rusia.
Linden,David.1994. Handbook of Batteries. Mc Graw Hill.Second edition.
Manjhunata,H.et al.2010. Electrode Materials for Equeus Rechargable Lithium
Batteries. Journal of American chemical society.
Minami,Tsutomo dkk.2005. Solid State Ionics for Batteries. Japan : Osaka Prefecture University.
Myounggu,Park.2010. A Review of Conduction Phenomena in Li-ionBatteries, Power source.
Prihandoko,Bambang.2007. Pemanfaatan Soda Lime Silica dalam Pembuatan Komposit Elektrolit Baterai Lithium. Disertasi Fakultas Tekhnik UI.
Triwibowo,Joko.2011. Rekayasa Bahan LixTiMnyFez(PO4)3 Sebagai Katoda Solid Polymer Battery (SPB) Lithium.
Tsutomo,Ohzuku, et al.2005. Zero-Strain Insertion Mechanism of (Li1/3Ti5/3)O4
for advances Lithium-Ion (Shutlecock) Batteries. Journal of advanced
energy materials.
Xianyou,Wang.2013. Improved Electrochemical Performance of LiFePO4/C
Cathode Via Ni and Mn co-doping for Lithium-ion Batteries.
Xu,Bo.et al.2012. Rencent Progress in Chatode Materials Research for edvanced
Lithium Ion Batteries. Journal of Materials science and engineering.
Zhao,xin.et al.2011. In-Plane Vacancy Enabled High Power Si Graphene
Composite Electrode ForLithium Ion Batteries. Journal of advanced
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Tempat pelaksanaan penelitian dilakukan di laboraturium Baterai Lithium, Pusat Penelitian Fisika-Lembaga Ilmu Pengetahuan Indonesia (P2P LIPI). Kawasan Puspiptek Serpong, Gedung 442 Tangerang Selatan.
3.2 Peralatan dan Bahan Penelitian
3.2.1 Peralatan
Adapun peralatan yang digunakan dalam penelitian ini antara lain: 1. Timbangan Digital
Berfungsi untuk menimbang bahan-bahan yang diperlukan untuk membuat LiFe0.7Mn0.2Ni0.1PO4/C.
2. Mortar dan Pastel
Berfungsi Untuk menggerus bahan LiFeMnNiPO4/C. 3. Ayakan 200 mesh
Berfungsi untuk menyaring bahan yang bahan yang selesai digerus. 4. Kuas
Berfungsi untuk memudahkan bahan lolos dari saringan. 5. Piring
Berfungsi sebagai wadah untuk meletakkan hasil dari ayakan yang diletakkan di bawah ayakan.
6. Gelas ukur
Berfungsi untuk meletakkan bahan-bahan yang akan ditimbang.
7. Chamber
Berfungsi sebagai wadah untuk meletakkan bahan yang akan di milling. 8. Bola milling
Berfungsi sebagai alat untuk milling (pencampur bahan). 9. Cawan
10.Oven
Berfungsi sebagai untuk mengeringkan sampel.
11.Crucible
Berfungsi sebagai wadah bahan untuk proses kalsinasi.
12.Furnance
Berfungsi sebagai alat pemanasan (kalsinasi dan sintering).
3.2.2 Bahan
Adapun bahan-bahan yang digunakan dalam penelitian ini antara lain: 1. Serbuk LiOH.H2O (China)
2. Serbuk Fe2O3 (Lokal) 3. Serbuk MnO2 (Lokal) 4. Serbuk Ni (Merck) 5. Cairan H3PO4 (China)
6. Tepung Tapioka murni sebagai sumber coating carbon
3.3 Prosedur Penelitian
3.3.1 Tahap persiapan komposisi bahan baku
Bahan baku yang digunakan dalam penelitian ini ditentukan berdasarkan perhitungan stoikiometri (lihat lampiran). Adapun komposisi bahan baku yang digunakan pada setiap sampel dapat dilihat pada tabel berikut ini:
Reaksi kimia : LiOH.H2O(s) + 0.4 Fe2O3(s) + 0.1 MnO2(s) + 0.1 Ni(s) + H3PO4→
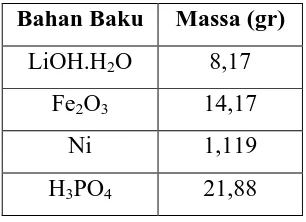
Tabel 3.3 Komposisi bahan baku LiFe0.9Ni0.1PO4/C
Bahan Baku Massa (gr)
LiOH.H2O 8,17 Fe2O3 14,17
Ni 1,119
H3PO4 21,88
3.3.2 Tahap proses penimbangan
Bahan baku untuk LiFe0.7Mn0.2Ni0.1PO4/C ditimbang satu persatu.
3.3.3 Tahap proses pencampuran
1. Untuk bahan baku LiFe0.7Mn0.2Ni0.1PO4/C:
Tahap pertama pencampuran adalah: dimasukkan Lithium ditambah Nikel diaduk sampai merata sehabis itu dimasukkan Mangan diaduk sampai merata sehingga bahan homogen. Setelah tercampur semua bahan lalu dicampur dengan larutan H3PO4.
2. Untuk bahan baku LiFe0.8Mn0.1Ni0.1PO4/C:
3. Untuk bahan baku LiFe0.9Ni0.1PO4/C:
Tahap pertama yaitu: campurkan tapioka dengan larutan ethanol setelah itu diaduk larutan sampai merata. Kemudian masukkan material aktif dengan komposisi dan diaduk sampai merata.
3.3.3 Tahap proses pengeringan
Setelah bahan LiFe0.7Mn0.2Ni0.1PO4 dicampur dengan larutan H3PO4 kemudian diaduk sampai merata, lalu bahan dimasukkan kedalam oven dengan suhu 80℃ dan lebih kurang dari 24 jam agar campuran dapat digerus.
3.3.4 Tahap proses pembakaran (sintering)
Setelah digerus kemudian dimasukkan serbuk kedalam Chumber disertai dengan bola-bola milling dengan perbandingan 1:10 untuk bahan bola milling, kemudian di milling selama 3 jam. Kemudian bahan diayak dengan ayakan 200 mesh kemudian dimasukkan kedalam crucible dan selanjutnya di kalsinasi pada suhu
3.4 Diagram Alir Penelitian
3.4.1 Tahapan penelitian dapat dilihat pada Diagram Alir berikut ini:
Pencampuran Bahan LiOH.H2O + Fe2O3 + MnO2 + Ni Dengan Planetary Ball Mill ( selama 3 jam )
+ H3PO4
Pengeringan di Oven ( T lebih kurang dari 80°C, 1 hari
Penghalusan bahan 200 mesh
Kalsinasi ( inert ,700°C / 2 jam )
Sintering ( Inert , 800°C / 8 jam )
Hasil Pembakaran
Karakterisasi
• XRD (X-Ray Diffraction)
• SEM (Scanning Electron Microscopy)
• Konduktivitas (EIS )
BAB 4
HASIL DAN PEMBAHASAN
4.1 Karakterisasi Material Aktif dengan X-Ray Diffraction (XRD)
4.1.1 Hasil XRD Material Aktif LiFe0.7Mn0.2Ni0.1PO4/C
Pada hasil pengamatan XRD dapat dilihat bentuk fasa dan struktur kristal yang muncul pada material aktif tersebut.
Grafik 4.1 Hasil XRD Material Aktif LiFe0.7Mn0.2Ni0.1PO4/C
Dari hasil pengamatan XRD yang dilakukan pada serbuk LiFe0.7Mn0.2Ni0.1PO4/C terdapat satu fasa tunggal yang terbentuk yaitu Lithium Iron Phospate.Lithium
Iron Phospate mempunyai parameter kisi a= 6,007Ǻ, b= 10,320 Ǻ, c= 4,699 Ǻ,dan �=�=�=90°. Dapat dikatakan bahwa a≠b≠c sehingga membentuk struktur kristal orthorombik. Fasa Lithium Iron Phospat memiliki densitas sebesar 3,597 gr/cm3.
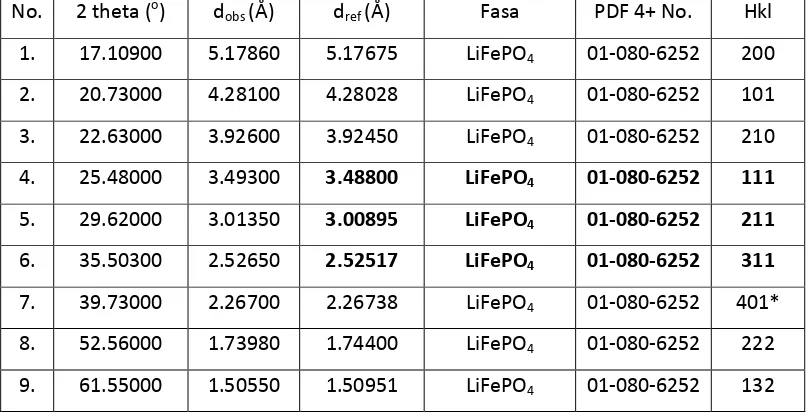
Tabel 4.1. Material Aktif LiFe0.7Mn0.2Ni0.1PO4/C
1 1001 2001 3001 4001 5001 6001 7001
4. 25.51300 3.48860 3.48394 LiFePO4 01-080-6319 111
Berdasarkan Tabel 4.1 menunjukkan bahwa nilai 2� dari hkl [111] sebesar 25.51300, hkl [211] sebesar 29.65800, dan hkl [311] sebesar 35.57600. Dapat disimpulkan bahwa dari data LiFe0.7Mn0.2Ni0.1PO4/C yang didapat ternyata hkl yang sama atau yang serumah yaitu hkl dari [111], hkl [211], dan hkl dari [311]. Karena dari hkl ini terdapat puncak yang paling tinggi dan yang paling tajam dari hkl yang muncul.
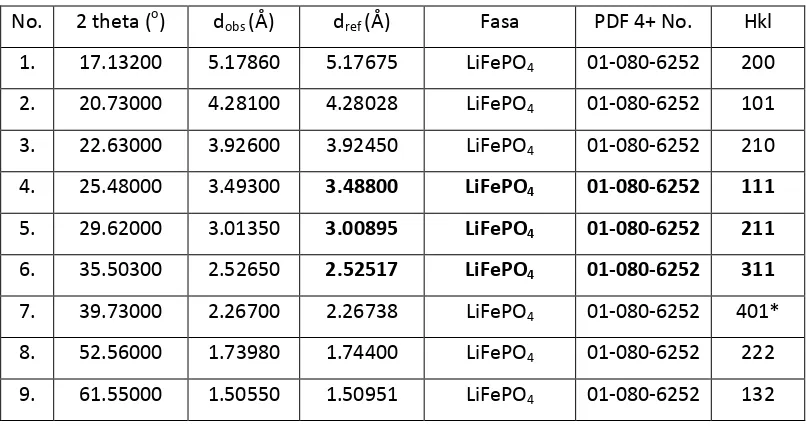
4.1.2 Hasil XRD Material Aktif LiFe0.8Mn0.1Ni0.1PO4/C
Pada hasil karakterisasi XRD terdapat satu fasa yaitu Lithium Iron Phospate.
Lithium Iron Phospat mempunyai parameter kisi a= 6,018 Ǻ, b= 10,354 Ǻ, dan c=
4,701 Ǻ sehingga membentuk struktur kristal orthorombik.
Grafik 4.2 Hasil XRD Material Aktif LiFe0.8Mn0.1Ni0.1PO4/C
1 1001 2001 3001 4001 5001 6001 7001
Berdasarkan hasil XRD dari LiFe0.8Mn0.1Ni0.1PO4/C terdapat fasa Lithium Iron Phospat memilikidensitas sebesar 3,578 g/cm3.
Tabel 4.2. Material Aktif LiFe0.8Mn0.1Ni0.1PO4/C
Dari Tabel 4.2. untuk mengetahui puncak yang paling tajam dan paling tinggi dapat dilihat pada hkl [111] dengan nilai 2� sebesar 25.48000, hkl [211]
dengan nilai 2� sebesar 29.62000, sedangkan hkl [311] dengan nilai 2� sebesar 35.50300.
4.1.3 Hasil XRD Material Aktif LiFe0.9Ni0.1PO4/C
Pada hasil pengamatan XRD terdapat satu fasa tunggal yaitu fasa Lithium Iron Phospat dan mempunyai sistem kristal adalah Orthorombik dan strukutr kristalnya adalah Simple Cubic (Sc).
Grafik 4.3 Hasil XRD Material Aktif LiFe0.9Ni0.1PO4/C
Berdasarkan hasil XRD ternyata puncak yang paling tinggi yaitu hkl dari [111], dan hkl [211]. Dan terdapat fasa Lithium Iron Phospate dan membentuk struktur kristal orthorombik, yang memiliki densitas sebesar 3.601g/cm3.
Tabel 4.3. Material Aktif LiFe0.9Ni0.1PO4/C
Pada Tabel 4.3. diatas melalui pengujian XRD menunjukkan material aktif LiFe0.9Ni0.1PO4 yang hkl sama terdapat pada hkl [111], [211] dan hkl [311] tetapi hkl [311] puncak yang muncul sedikit jauh dari hkl yang sebelumnya. Jadi nilai 2� dari hkl [111] senilai 25.48000, sedangkan hkl dari [211] senilai 29.62000, dan
hkl [311] senilai 35.50300. Dan fasa yang terbentuk adalah Lithium Iron Phospat.
4.2 Morfologi Material dengan SEM (Scanning Electron Microscope)
4.2.1 Morfologi material aktif dari LiFe0.7Mn0.2Ni0.1PO4/C
a.
Gambar 4.4. Hasil Mapping a) Mix UnsurLiFe0.7Mn0.2Ni0.1PO4/C.
Untuk mempermudah melihat unsur apa saja yang terdapat pada serbuk katoda LiFe0.7Mn0.2Ni0.1PO4/C maka dibedakan warna dari unsurnya dengan ditandai unsur Fe (besi) yang berwarna merah, unsur Ni (nikel) yang berwarna biru, unsur O (oksigen) yang berwarna hijau, unsur P (phospat) yang berwarna ungu, dan karbon yang berwarna abu-abu. Hasil gambar mapping dari mix unsur terlihat 5 unsur yaitu Fe,Ni,O,P, dan elektron. Dapat dilihat bahwa unsur yang paling dominan adalah unsur Ni yang berwarna biru dan unsur Ni tersebar hampir merata dipermukaan.
a.
C
Mn O
P
Fe e
b.
Gambar 4.5. Hasil SEM serbuk katoda LiFe0.7Mn0.2Ni0.1PO4/C perbesaran a) 3000x dan b) 5000 x
Dari hasil Gambar 4.5 dapat kita ketahui bahwa hasil analisis morphologi pada serbuk katoda LiFe0.7Mn0.2Ni0.1PO4/C terlihat pada perbesaran 3000x dimana pori-pori terlihat sedikit yang muncul sedangkan pada perbesaran 5000x pori-pori yang muncul terlihat jelas banyak.
4.2.2Analisis Morfologi material aktif dari LiFe0.8Mn0.1Ni0.1PO4/C
Pada pengujian mikrostruktur dari LiFe0.8Mn0.1Ni0.1PO4/C ini ditembakkan
Secondary Electron yang berfungsi untuk melihat morfologi suatu material serta
mengetahui komposisi unsur kimia serbuk katoda LiFe0.8Mn0.1Ni0.1PO4/C.
a.
Gambar 4.6. Hasil Mapping a) Mix Unsur C
Fe
Mn
Ni
O
P
Untuk mempermudah melihat unsur apa saja yang terdapat pada serbuk katoda LiFe0.8Mn0.1Ni0.1PO4/C maka dibedakan warna dari unsurnya dengan ditandai unsur Fe (besi) yang berwarna merah, unsur Ni (nikel) yang berwarna biru, unsur O (oksigen) yang berwarna hijau, unsur P (phospat) yang berwarna ungu, dan karbon yang berwarna abu-abu. Hasil gambar mapping dari mix unsur terlihat 5 unsur yaitu Fe,Ni,O,P, dan elektron. Dapat dilihat bahwa unsur yang paling dominan adalah elektron yang berwarna abu-abu tersebar hampir sebagian merata dipermukaan.
Gambar 4.7. Hasil SEM serbuk katoda LiFe0.8Mn0.1Ni0.1PO4/C perbesaran a) 3000x dan b) 5000x.
Dari Gambar 4.7 dapat kita ketahui bahwa hasil analisis permukaan katoda LiFe0.8Mn0.1Ni0.1PO4/C terlihat bentuk butirannya yang tidak beraturan dan terlihat bahwa unsur yang paling dominan adalah karbon. Hal ini diperkuat dengan hasil mapping. Dari gambar 4.8 terlihat partikel yang berbentuk gumpalan. Partikel yang berbentuk gumpalan merupakan partikel yang mengalami aglomerasi.
4.2.3Analisis Morfologi material aktif dari LiFe0.9Ni0.1PO4/C
Pengamatan mikrostruktur sampel LiFe0.9Ni0.1PO4/C dilakukan dengan menggunakan alat SEM. Pengambilan gambar sampel pada SEM dilakukan dengan perbesaran 3000 kali dan 5000 kali perbesaran. Pada pengujian mikrostruktur dari LiFe0.9Ni0.1PO4/C ini ditembakkan Secondary Electron yang berfungsi untuk melihat morfologi suatu material serta mengetahui komposisi unsur kimia serbuk LiFe0.9Ni0.1PO4/C.
a.
Gambar 4.8. Hasil Mapping a) Mix Unsur LiFe0.9Ni0.1PO4/C.
C O
Untuk melihat unsur apa saja yang terdapat pada serbuk katoda LiFe0.9Ni0.1PO4/C maka dibedakan warna dari unsurnya dengan ditandai unsur Fe (besi) yang berwarna merah, unsur O (oksigen) yang berwarna hijau, dan karbon yang berwarna abu-abu. Hasil gambar mapping dari mix unsur terlihat 3 unsur yaitu Fe,O, dan elektron. Dapat dilihat bahwa unsur yang paling dominan adalah O (oksigen) yang berwarna hijau dan tersebar hampir sebagian merata dipermukaan.
b.
c.
Berdasarkan Gambar 4.10 dapat kita ketahui bahwa hasil analisis permukaan katoda LiFe0.9Ni0.1PO4/C pada perbesaran 3000 kali terlihat pori-pori tidak terlihat sama sekali. Sedangkan pada perbesaran 5000 kali juga tidak terlihat bahwa pori-pori pada sampel ini mungkin banyaknya elektron makanya tidak ada pori-pori pori-pori.
4.3Konduktivitas EIS ( Electrochemical Impedance Spectrometry)
4.3.1 Impedansi material aktif LiFe0.7Mn0.2Ni0.1PO4/C
Dari hasil grafik yang ditunjukkan pada grafik 4.10 terlihat bahwa sumbu x merupakan impedansi real dan sumbu y merupakan impedansi imajiner.
Grafik 4.10. Grafik X-Vs-Rs dari material aktif LiFe0.7Mn0.2Ni0.1PO4/C
Berdasarkan Gambar diatas dengan melihat profil EISnya akan dapat dilihat apakah telah membentuk kurva dengan baik. Katoda yang baik akan membentuk pola busur setengah lingakaran (semicirle). Daerah setengah lingkaran pada Gambar 4.10 menujukkan terjadinya proses perpindahan ion-ion dan untuk daerah
warbugmenyatakan terjadinya proses perpindahan muatan pada bidang
antarmuka. Dari hasil pengukuran konduktifitas pada Tabel 4.4 diperoleh 3.1 x 10 -5
S/cm dengan nilai jumlah impedansi reel yaitu 136 Ω.
Tabel 4.4. X-Vs-Rs Material Aktif LiFe0.7Mn0.2Ni0.1PO4/C.
0,00E+00 2,00E+02 4,00E+02 6,00E+02 8,00E+02
2,22E+01 2,87E+01
Hasil perhitungan konduktifitas dari sampel pertama dapat dilihat pada tabel 4.4.
Tabel 4.4. Hasil pengukuran Konduktivitas EIS dari LiFe0.7Mn0.2Ni0.1PO4/C.
Sampel 1 t [cm] A [cm2] R [Ω] σ [S/cm]
Berdasarkan Tabel 4.4. dengan hasil pengukuran konduktivitas pada sampel 1 dapat disimpulkan bahwa diperoleh nilai konduktivitas 3.1 x 10-5 S/cm dengan nilai jumlah impedansi reel yaitu 136 Ω.
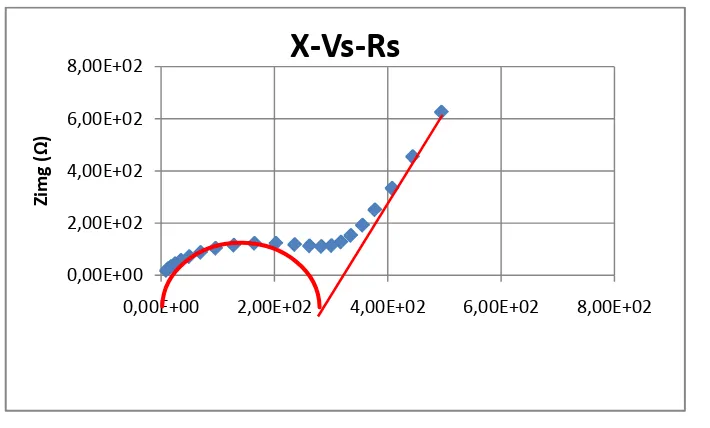
4.3.2 Impedansi Material aktif LiFe0.8Mn0.1Ni0.1PO4/C
Sama halnya dengan sampel pertama, nilai konduktifitas dapat dihitung dengan mengetahui nilai resistansi pada masing-masing sumbu yang terdapat pada Grafik 4.11.
X-Vs-Rs
Grafik 4.11. Grafik X-Vs-Rs dari LiFe0.8Mn0.1Ni0.1PO4/C
Berdasarkan Gambar diatas bahwa grafiknya tidak terbentuk membentuk kurva dengan baik, karena katoda yang baik akan membentuk setengah lingkaran. titik yang muncul cuman satu titik disebabkan karena tidak mempunyai elektrolit. Makanya Rion tidak muncul dan tidak terdeteksi karena masih bentuk lembaran, dimana titik Rbahan ini terdapat suatau hambatan.
Tabel X-Vs-Rs Material Aktif LiFe0.8Mn0.1Ni0.1PO4/C
Rs (ohm) X (ohm)
13,041 0,047924
13,034 0,028278
13,023 0,014304
13,018 0,007257
13,03 0,004653
13,012 0,00096
Dan tabel 4.5. merupakan hasil perhitungan konduktifitas dari setiap resistansi yang didapat pada Grafik.
Tabel 4.5. Hasil Perhitungan konduktifitas LiFe0.8Mn0.1Ni0.1PO4/C
Sampel 2 t [cm] A [cm2] R [Ω] σ [S/cm]
Konduktifitas bahan 7 x 10-3 2.417 12,97 3.97 x 10-3 Konduktifitas ion 7 x 10-3 2.417 13,008 3.98 x 10-3 Konduktifitas total 7 x 10-3 2.417 25,978 7,96 x 10-3 Pada tabel diatas dapat disimpulkan bahwa nilai konduktifitas 7,96 x 10-3 dan nilai impedansi reelnya adalah 25,978Ω. Dimana perhitungan konduktifitas ionik menggunakan hubungan antara teba sampel (t = 7 x 10-3cm), luas lembaran (2,417cm2), dan hambatan (R = 25,978 ohm), dan nilai konduktifitas (σ)
adalah7,96 x 10-3.
4.3.3Impedansi Material aktif LiFe0.9Ni0.1PO4/C
Berdasarkan Grafik 4.12 dapat dilihat dari resistansi bahan dan resistansi ion. Dari
Grafik 4.12. Grafik X-Vs-Rsdari LiFe0.9Ni0.1PO4/C
Berdasarkan Grafik 4.12. menunjukkan hasil perhitungan konduktifitas dari sampel ketiga dapat dilihat pada tabel 4.6.
Tabel 4.6. Grafik X-Vs-Rs Material Aktif LiFe0.9Ni0.1PO4/C
Rs (ohm) X (ohm)
0,00E+00 1,00E+02 2,00E+02 3,00E+02 4,00E+02
8,34E+02 4,49E+02
Dari hasil perhitungan konduktifitas menunjukkan pada sampel ketiga dapat dilihat pada tabel 4.7.
Tabel 4.6. Hasil Perhitungan konduktifitas LiFe0.9Ni0.1PO4/C
Sampel 1 t (cm) A (cm2) R (Ω) � (10-3S/cm)
�ion 0,011 1,88 331,522 0,176 �bahan 0,011 1,88 70,638 0,082
Extraplorasi ke sumbu x dari setengah lingkaran akan didapat harga impedansi reel atau resistor. Didalam perhitungan konduktifitas ionik menggunakan hubungan antara tebal sampel (t = 0,011cm), luas lembaran yang diolesi slari (A = 1,88cm2), dan hambatan (R = 70,638 ohm), maka nilai konduktifitas (σ) adalah
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari seluruh kegiatan hasil penelitian dan pembahasan tentang material katoda LiFe0.9-xMnxNi0.1PO4/C sebagai bahan aktif katoda, dapat disimpulkan bahwa pembuatan material katoda dapat dilakukan dengan cara sebagai berikut:
1. Telah diketahui cara pembuatan LiFe0.9-xMnxNi0.1PO4/C adalah dengan Metode Metalurgi Serbuk.
2. Pengaruh doping Mn pada LFP adalah setelah didoping dengan Mn maka nilai konduktivitas semakin tinggi.
3. Dari hasil analisa XRD (X-Ray Diffraction) pada serbuk LiFe
0.9-xMnxPO4/C bahwa fasa yang terbentuk adalah fasa tunggal yaitu LiFePO4, dan hasil dari analisa SEM (Scanning Electrochemical Spectroscopy) terlihat bahwa pori-pori yang paling banyak terdapat pada serbuk
LiFe0.8Mn0.1Ni0.1PO4/C, sedangkan hasil analisa konduktivitas EIS (Electrochemical Impedance Spectrometry) dimana dari ketiga sampel bahwa nilai konduktivitas yang paling tinggi adalah 7,96 x 10-3S/cm pada serbuk material katoda LiFe0.8Mn0.1Ni0.1PO4/C.
5.2. Saran
1. Untuk penelitian lanjutan material katoda LiFe0.9-xMnxNi0.1PO4/C bisa dilakukan dengan pengujian XRD, SEM, dan EIS.
2. Untuk penelitian lanjutan dapat memvariasikan suhu sampel dengan komposisi yang sama untuk melihat pengaruh Mn pada terhada LFP.
3. Untuk memperoleh hasil yang lebih spesifik sesuai dengan pengukuran konduktivitas dapat digunakan dengan karakterisasi EIS (Electrochemical
BAB 2
TINJAUAN PUSTAKA
2.1 Pengertian Baterai
Secara umum, pengertian baterai mencakup satu atau beberapa sel baterai yang digabungkan secara seri atau paralel sesuai dengan tegangan dan kapasitas listrik yang digunakan. Sel baterai adalah unit terkecil dari suatu sistem proses elektrokimia yang terdiri dari elektroda, elektrolit, separator, wadah, dan terminal. Adapun komponen penting pada sel baterai yaitu sebagai berikut.
a. Elektroda negatif (anoda) adalah elektroda yang melepaskan elektron ke rangkaian luar serta mengalami proses oksidasi pada proses elektrokimia.
b. Elekttroda positif (katoda) adalah elektroda yang menerima
elektron dari rangkaian luar serta mengalami proses reduksi pada proses elektrokimia.
c. Penghantar ion (elektrolit) adalah media transfer ion yang bergerak dari anoda ke katoda ke dalam sel baterai saat penggunaan. (Linden,2002)
2.1.1 Baterai Primer
Baterai Primer adalah baterai dengan penggunaan sekali saja. Struktur dan sifat material elektroda yang digunakan tidak menunjukkan penambahan energi listrik pada baterai yang efektif saat diisi ulang/ recharged. Pada umumnya baterai primer murah, mudah digunakan sebagai sumber listrik untuk peralatan portabel, memiliki densitas energi listrik yang besar dengan kecepatan discharge yang rendah dan tidak memerlukan perawatan. (Cheline,2009).
2.1.2 Baterai Sekunder
berlawanan. Baterai jenis ini disebut juga disebut juga sebagai baterai penyimpan/
strorange battery atau accumulator. Baterai sekunder diaplikasikan dalam dua
kategori, yaitu :
a. Sebagai alat penyimpan energi/ Energy-storage Device. Umumnya baterai jenis ini tersambung dengan jaringan listrik primer saat digunakan. Contoh penggunaanya adalah dalam otomotif, pesawat terbang.
b. Sebagai sumber energi listrik pada portabel divais, pengganti baterai primer dan pada semua divais yang menggunakan baterai primer, seperti telephone genggam, kamera, notebook dan lain-lain.(Abbas,1997)
2.2 Baterai Lithium
Baterai Lithium teori adalah baterai yang digerakkan oleh ion lithium. Dalam kondisi discharge dan recharge baterai lithium bekerja menurut fenomena interkalasi, di mana ion lithium melakukan migrasi dari katoda melalui elektrolit
ke anoda atau sebaliknya tanpa terjadi perubahan struktur kristal dari banyak keunggulan antara lain mempunyai tegangan yang bahan katoda ke anoda. Baterai lithium sangat menarik untuk dikembangkan karena besar, waktu hidup yang lama dan material elektrodanya tidak beracun.
Lithium Ion Battery memiliki pada umumnya memiliki empat komponen utama yaitu elektroda positif (katoda), elektroda negatif (anoda), elektrolit, dan separator.
2.2.1 Elektroda negatif (anoda)
Anoda merupakan elektroda yang berfungsi sebagai pengumpul ion lithium serta merupakan material aktif. Parameter pengembangan dari material untuk digunakan sebagai anoda ini antara lain kepadatan energi yang dihasilkan serta siklus pemakaian atau
cyclability.Material yang dapat dipakai sebagai anoda harus
berperan sebagai anoda adalah material yang berbasis carbon seperti LiC6
2.2.2 Elektroda positif (katoda)
atau grafit.Kepadatan energi secara teori yang dihasilkan dari material ini adalah berkisar 372 A.h/kg. Selain grafit, material berbasis karbon yang dapat digunakan untuk anoda yaitu soft
carbon, graphene dan hard carbon.(Manjhunata,2010).
Katoda merupakan elektroda yang fungsinya sama seperti anoda yaitu pengumpul ion serta material aktif. Namun perbedaannya adalah katoda merupakan elektroda positif. Beberapa karakteristik yang harus dipenuhi suatu material yang digunakan sebagai katoda antara lain material tersebut terdiri dari ion yang mudah melakukan reaksi reduksi dan oksidasi, memiliki konduktifitas yang tinggi seperti logam, memiliki kerapatan energi yang tinggi, memiliki kapasitas energi yang tinggi, memiliki kestabilan yang tinggi (tidak mudah berubah strukturnya atau terdegradasi baik saat pemakaian
maupun pengisian ulang), harganya murah dan ramah lingkungan. Pada tahun 1980 material LiCoO2 menjadi kandidat material pertama yang digunakan sebagai katoda pada LIBs.Kerapatan energi yang dimiliki LiCoO2
2.2.3 Elektrolit
sebesar 140A.h/kg. Walaupun demikian material tersebut memiliki kestabilan yang rendah dan harganya relative mahal.(Bo Xu,2012).
energi. Beberapa material yang dapat digunakan sebagai elektrolit cair antara lain LiNO3 , LiClO ,Li2SO4 , garam LiNO3 , garam Li2SO4, LiPF6
2.2.4 Separator adalah suatu material berpori yang terletak di antara anoda dan katoda berfungsi untuk menjegah agar tidak terjadi hubungan singkat dan kontak antara katoda dan anoda. Beberapa hal yang penting untuk memilih material agar diplih sebagai separator antara lain material tersebut bersifat insulator, memiliki hambatan listrik yang kecil, kestabilan mekanik (tidak mudah rusak), memiliki sifat hambatan kimiawi untuk tidak mudah terdegradasi dengan elektrolit serta memiliki ketebalan lapisan yang seragam atau sama di seluruh permukaan. Beberapa material yang dapat digunakan sebagai separator antara lain polyolefins (PE
dan PP), Poly(vinylidene fluodire) (PVdF),danpoly(ethylene oxide).(Zhao,2011).
. Elektrolit padat sendiri keuntungannya yaitu memiliki konduktivitas yang besar serta dapat tahan lama dibandingkan dengan elektrolit yang cair.(Jin,2009).
Struktur sel sebuah baterai terdiri dari katoda (elektroda positif), anoda (elektroda negatif), elektrolit, dan separator.
Gambar 2.4. struktur sel sebuah baterai
menuju anoda sedangkan pada saat discharging elektron dari anoda mengalir ke katoda melalui kabel konektor sedangkan lithium yang berada pada sistem (di dalam baterai) lepas dari anoda karena kekurangan elektron untuk berpindah menuju katoda melalui elektrolit.
Pembuatan sel baterai selama ini dari thin film menggunakan metode penguraian terlebih dahulu. Pada prisnsipnya ada beberapa keuntungan baterai lithium yaitu:(Abbas,1997).
1. Tegangan maksimum (lebih besar dari baterai lain) dan energi tinggi. Baterai Lithium mempunyai energi pelepasan muatan 3 V, kira-kira 2 kali dari baterai kering yang konvensional ( umum). Karena keuntungan ini satu baterai Lithium dapat menggantikan 2 baterai konvensional.
2. Karakteristik pelepasan muatan yang baik.
Karena baterai Lithium mampu menjaga kestabilan tegangan selama pelepasan muatan, satu baterai dapat digunakan sebagai sumber
tenaga internal.
3. Tahan terhadap kebocoran.
Penggunaan larutan organik dari alkali untuk elektrolit menghasilkan suatu yang lebih, yaitu mengurangi korosi dan kemungkinan kebocoran elektrolit.
4. Karakteristik penyimpanan muatan yang besar.
Baterai Lithium yang mengandung Lithium Ferro Phospat dan elektrolit yang stabil, dapat mengurangi resiko terjadinya self discharge.
5. Tidak berbahaya terhadap lingkungan. Kerugiannya :
-Tak tahan terhadap kelembaban -Densitas relatif kecil
-Produksi relatif mahal
2.3 Material Katoda
Salah satu komponen dalam sistem sel baterai lithium adalah katoda. Material katoda ini dapat menjadi salah satu acuan untuk menentukan kapasitas sel baterai secara teoritik.
Untuk setiap berat molekul katoda, jumlah ion lithium yang dilepaskan material katoda saat discharging menggambarkan densitas energi dan power sel baterai. Semakin banyak lithium dari katoda ke anoda, maka densitas energi sel baterai semakin besar dan semakin banyak lithium yang kembali ke katoda dari anoda, densitas powernya maka akan semakin besar.(Myounggu,2010).
Material katoda dapat disintesin dengan beberapa metode, antara lain yaitu metode kimia, metode presipitasi, dan metode metalurgi serbuk. Solid state method atau metode metalurgi serbuk adalah metode yang cukup sederhana dan mudah dilakukan, tetapi pada metode ini membutuhkan energi yang besar, waktu yang lama dan suhu pemanasan (sintering) yang lama untuk mendapatkan material katoda tanpa pengotor (impuritas).
2.3.1 Lithium Mangan oksida (LiMn2O4
Lithium mangan oksida merupakan bahan katoda yang cukup populer pada baterai lithium. Lithium mangan oksida mempunyai struktur spinel dengan kemampuan interkalasi tiga dimensi. Hal ini menyebabkan bahan katoda ini mampu disisipi ion lithium dalam tiga arah. Baterai lithium merupakan baterai yang berbasis ion dengan ion lithium sebagai motor penggerak.(Kiehne,1989).
)
Bahan katoda baterai lithium yang ada pada saat ini antara lain Lithium
Cobalt oxide (LiCoO2), Lithium nickel oxide (LiNiO2), Lithium mangan oxide
(LiMn2O4
Kebanyakan baterai lithium yang sudah diproduksi di pasaran masih banyak menggunakan LiCoO
).(A,Veluchanny,2001).
Susunan atom oksigen dan octahedral mangan membentuk sebuah spinel
framework dalam spinel LixMn2O4. Hal ini membuat gerak ion lithium dalam
proses interkalasi menjadi bebas dalam tiga dimensi. Dan framework ini cukup stabil ketikan ion lithium berpindah-pindah dalam proses interkalasi.(Koseva,2000).
2.3.2Lithium Iron Phosphate (LiFePO4
Lithium ferro phospat (LiFePO4) mempunyai bentuk struktur yang serupa, tetapi memiliki saling kelarutan yang rendah, tetapi memiliki saling kelarutan yang rendah. hal ini memastikan jarak dekat biaya atau debit tegangan (3,5V)dan oksidasi aktifnya lebih rendah dari komponen elektrolit dalam libs. Di dalam LiFePO4 partikel dilapisi dengan karbon tingkat pengisian dan pengosongan proses dibatasi oleh konduktvitas ion dari bahan. LiFePO
)
4/C komposit disusun melalui sederhana dan suhu tinggi metode keadaan padat (solid-state) untuk lebih efektif meningkatkan kinerja elektrokimia LiFePO4/C, LiFePO4/C dengan Ni dan Mn co-doping disintesis oleh suhu tinggi dengan solid-state. Pengaruh Ni dan Mn co-doping dengan jumlah yang berbeda pada struktur, morfologi dan properti elektrokimia LiFePO4/C.(Hongbo,2013).
Bockenfeldetal. jugatelah menunjukkansebagaiAC-LiFePO4 elektrodamemungkinkanpeningkatan kinerjatingkattinggi, sehubungan
denganorang-orangyang hanya berisiLiFePO4(LFP) danaditifkonduktif. PenambahanACdiusulkanuntuk memiliki
beberapaefek yaitu : MenipiskanpartikelLFPdan, sehingga menghindarikekurangan garamLi
menyediakan kapasitastambahan karenaformasidouble-layer.
2.4 Bahan baku pada serbuk LiFe0.9-xMnxNi0.1PO Serbuk senyawa dari LiFe
4
2.4.1 LiOH.H2
Lithium adalah logam yang lunak, merupakan unsur padat yang paling ringan dan dapat mengapung pada produk minyak bumi. Bahan ini digunakan dalam industri porselen, keramik, agen pemutih, farmasi.
O
Reaksi berlangsung lambat bila dibandingkan dengan reaksi alkali yang lain, sehingga tidak berbahaya dibandingkan logam alkali lainnya. Oleh karena titik didihnya lebih tinggi dari air, maka bila bereaksi dengan air akan tetap sebagai padatan, sedangkan logam alkali lainnya akan meleleh. Lithium hydroxide merupakan senyawa inorganik, material higroskopis, tersedia secara komersial dalam bentuk monohidrat (yaitu LiOH.H2O) yang merupakan basa kuat. Senyawa ini memiliki kemurnian hampir 99%.
Gambar 2.5 Serbuk Lithium Hydroxida
2.4.2 Besi Oksida
Iron Oxide atau sering juga disebut hematite memiliki kemurnian 95-100%. Hematite adalah bentuk mineral besi oksida (Fe2O3). Hematite mengkristalisasi dalam sistem hingga abu-abu perak atau baja, coklat hingga merah kecoklatan atau merah.
Dalam skala kekerasan, hematit berada dalam skala 5 dari 6.
2.4.3 Mangan Oksida
Mangan dioxide adalah senyawa anorganik dengan rumus MnO2. Kengunaan utama dari MnO2 adalah untuk sel baterai kering , seperti baterai alkaline dan baterai seng - karbon. Mangan dioxide memiliki kemurnian 100%.
Gambar 2.5 Serbuk Mangan dioxide (http://id.wikipedia.org/wiki/ManganDioxide)
2.4.4 Nikel (Ni)
Nikel memiliki kemurnian hamper 100%. Nikel biasa digunakan sebagai bahan pembuat paduan. Logam paduan nikel memiliki karakteristik kuat, tahan panas, serta tanan korosi.
Gambar 2.6 Serbuk Nikel
2.4.5 Asam Phospat
Gambar 2.7 Cairan Phosphoric Acid
2.5 XRD (X-Ray Diffraction)
XRD (X-Ray Diffraction) merupakan alat yang digunakan untuk mengkarakterisasi struktur kristal, dan ukuran kristal dari suatu bahan padat. Semua bahan yang mengandung kristal tertentu ketika dianalisa menggunakan XRD akan memunculkan puncak – puncak yang spesifik. Sehingga kelemahan alat ini tidak dapat untuk mengkarakterisasi bahan yang bersifat amorf. Metode difraksi umumnya digunakan untuk mengidentifikasi senyawa yang belum diketahui yang terkandung dalam suatu padatan dengan cara membandingkan dengan data difraksi dengan database yang dikeluarkan oleh International Centre
for Diffraction data berupa PDF Powder Diffraction File (PDF).
Gejala difraksi akan ditunjukkan oleh sinar X disaat sinar yang merupakan gelombang elektromagnetik ini jatuh pada permukaan sampel dengan panjang gelombang kira-kira sama dengan jarak antar atom sampel. Atom-atom yang berjarak teratur ini akan berfungsi sebagai pusat penghambur sinar X. Percobaan yang dilakukan pertama kali ini adalah oleh Laue pada tahun 1912, dikembangkqn oleh Bragg untuk mendapatkan persamaan matematis. Sinar yang menumbuk atom akan didifraksikan, dengan demikian sinar yang sefase akan diperkuat sementara yang berbeda fase akan saling menghilangkan. Prinsip dasar difraksi sinar X diperlihat kan pada gambar 2.2.
Sinar X (sinar 1) yang datang membentuk sudut � terhadap permukaan sampel dan menumbuk atom, akan dipantulkan dengan sudut yang sama. Begitu pula
dengan sinar X (sinar 2) yang jatuh pada bidang dibawahnya yang berjarak d. Sinar ini akan dipantulkan dengan sudut �, namun memiliki beda fase. Jika perbedaan fasa ini sama dengan kelipatan panjang gelombang, maka akan didapatkan persamaan Bragg :
2d Sin �= n λ...(2.2)
Setiap senyawa memiliki struktur kristal yang unik, baik itu fasa tunggal atau beberapa fasa. Oleh karenanya difraksi sinar yang didapat sangat karakteristik untuk senyawa tertentu. Informasi yang dihasilkan dari pola difraksi sinar X
adalah posisi puncak (2�) dalam satuan derajat, jarak antar bidang (d) dalam Angmstrong, intensitas (I) dalam counts/second, lebar penuh pada setengah puncak (Full Width at Half Maximum FWHM).(Triwibowo,2011)
2.6 SEM ( Scanning Electrochemical Microscopy)
Analisa SEM dilakukan untuk mengetahui permukaan serbuk hasil sinter terkait dengan fasa-fasa yang terbentuk, porositas dan besar butir. Analisa SEM juga dilakukan pada lembar kathoda. Hal ini dilakukan untuk mengetahui distribusi serbuk pada matriks, porositas dan kemampuan basahan serbuk terhadap matriks.
SEM mempunyai prinsip kerja bahwa suatu berkas insiden elektron yang sangat halus di-scan menyilangi permukaan sampel dalam sinkronisasi dengan berkas tersebut dalam tabung sinar katoda. Elektron-elektron yang terhambur digunakan untuk memproduksi sinyal yang memodulasi berkas dalam tabung sinar katoda, yang memproduksi suatu citra dengan kedalaman medan yang besar dan penampakan hampir tiga dimensi.
Sampel baik berupa serbuk maupun lembar kathoda tidak perlu di-coating terlebih dahulu dengan unsur Au,Pd, karena sampel sudah cukup konduktif untuk menghantarkan elektron dengan baik.
SEM memiliki tiga komponen pokok yaitu kolom elektron, ruang sampel, sistem pompa vakum, kontrol elektron dan sistem lensa magnetik. Didalam kolom elektron dapat penembak elektron yang terdiri dari katoda dan anoda. Katoda umumnya terbuat dari Wolfram (W). Elektron yang terlepas dari katoda bergerak ke arah anoda yang dalam perjalanannya berkas elektron ini dipengaruhi oleh lensa magnetik hingga didapatkan berkas elektron yang terfokus ke arah sampel. Saat elektron menumbuk sampel, akan terjadi beberapa fenomena yaitu terbentuknya dua jenis hamburan/scattering, sinar X dan foton.
Hamburan terbagi menjadi dua jenis yaitu hamburan elastis dan non elastis. Hamburan elastis dihasilkan dari tumbukan berkas elektron dengan inti atom sampel tanpa terjadi perubahan energi. Gejala ini disebut juga Back
Scaterred Electron/BSE. Kebalikannya dengan BSE, hamburan non elastis
ditimbulkan dari berkas elektron yang dipancarkan oleh penembak elektron menumbuk elektron sampel hingga terjadi perpindahan energi dari elektron asal ke elektron sampel yang lebih rendah.
2.7 EIS ( Electrochemical Impedance Spectrometry)
Pergerakan elektron dan ion dalam baterai lithium dapat diamati secara elektrokimia dengan menggunakan metode EIS (Electrochemical Impedance
Spectrometry). Impedansi elektrokimia biasa diukur dengan menggunakan sebuah
tegangan AC (U) pada sebuah sel elektrokimia dan mengukur arus listrik yang melalui sel. Arus massa dalam elektrolit dipengaruhi oleh besaran frekuensi, dimana kontrol kinetik sangat menonjol ketika frekuensi masih tinggi.
Kontrol arus akan dipengaruhi oleh transfer massa saat frekuensi rendah.
Impedance Spectroscopy merupakan tekhnik yang sangat penting untuk
karakterisasi elektroda baterai ion Li. Pertama, impedansi merupakan partikel tunggal yang rendah perpindahan ion Li pada permukaan lapisan (Solid Electroyte
Sebuah sel elektrokimia mirip dengan sebuah hambatan.Contohnya larutan elektrolit berkelakuan sebagai sebuah hambatan ohmik.Kapasitor juga merupakan elemen penting dalam impedansi elektrokimia spektroskopi electrochemical
impedance spectroscopy (EIS).
Ruang diantara elektroda dan larutan secara ideal berkelakuan sebagai sebuah kapasitor yang disebut kapasitansi keping ganda elektrik-elecrical double layer
capacitance.Besar impedansi kapasitor adalah 1/w C, dan sudut fasa 90° dimana
impedansi merupakan pembagian antara tegangan potensial dan arus listrik.
Pengujian EIS dilakukan untuk mengetahui perilaku impedansi material serbuk LiFe0.9-xMnxNi0.1PO4
Pemilihan skala log (f) penting dilakukan untuk menghasilkan sebaran f pada frekuensi rendah.Gambar 2.9. Skema dan peralatan pengukuran EIS.
.alat yang digunakan adalah LCR meter, HIOKI 3532-50 Chemical Impedance Meter. Parameter yang dapat dihasilkan adalah:impedansi ril, impedansi imaginer, pergeseran sudut fasa, dan impedansi total, dengan variasi spektrum frekuensi dalam skala logaritmik.(Subhan,2011)
Gambar 2.9. (a) Skematik setup pengukuran EIS. (b)Peralatanpengujian
electrochemical impedance spectroscopy (EIS).
hambatan. Ruang diantara elektroda dan elektron kolektor membentuk ruang yang bersifat sebagai kapasitor.
Adapun prosedur dari pengukuran konduktifitas adalah sebagai berikut:
1. lembar kathoda yang berupa komposit digunting dengan ukuran 35mm x 30 mm.
2. Sampel dijepit pada alat uji (sample holder) berbentuk pelat konduktor. 3. Atur rentang frekuensi yang digunakan pada pengujian (10Hz-100kHz),
kemudian start dan mulailah pengujian.
4. Alat uji konduktifitas akan menghasilkan data-data dari hasil respon bahan terhadap rentang frekuensi yang diberikan berupa nilai impedansi reel (Z’) dan impedansi imajiner (Z’’).
5. Jika diplot diantara Z’ dan Z’’ maka akan dihasilkan kurva nyquist 6. Tentukan Rtot
Kapasitas dari double layer secara umum dituliskan seperti dibawah ini:
dari grafik nyquist ini dengan melakukan ektrapolasi berupa
garis setengah lingkaran.
Z = 1
��...(2.2)
Untuk mendapatkan nilai Rtot maka kita harus mendapatkan Z” = 0 dengan cara melakukan ekstrapolasi membentuk setengah lingkaran. Dari nilai Z = Rtot
R = � �
�...(2.3)
kita dapat menentukan konduktivitas bahan dengan menggunakan persamaan :
Dimana :� = Hambatan jenis bahan [ohm.m] R = Resistivitas bahan [ohm] t = Tebal bahan [m]
A = Luas penampang bahan [m2
Dikarenakan � = 1
� maka rumus persamaannya adalah :
]
� = �
��...(2.4)
Dimana :� adalah Konduktivitas [Ω-1m-1] atau [S/m].
BAB 1
PENDAHULUAN
1.1Latar Belakang
Baterai Lithium merupakan baterai yang saat ini banyak menjadi bahan penelitian karena mempunyai kapasitas penyimpanan yang optimal. Baterai Lithium
mempunyai optimasi pemakaian sampai 80% dari kemampuannya, ringan, tidak ada memory effect dan tahan lama. Dari sudut pandang lain telah kemungkinan untuk dioperasikan beberapa perangkat listrik kecil bahkan dengan sumber daya yang kecil seperti baterai film tipis karena perangkat elektronik dengan daya rendah telah digunakan karena kemajuan teknologi baru-baru ini. Baterai harus memiliki keamanan yang baik dan juga dapat digunakan untuk mobil listrik . Tidak hanya kendaraan listrik dan kendaraan listrik hibrida, tetapi juga kendaraan sel bahan bakar isi ulang dengan keamanan tinggi dan kehandalan yang tinggi.(Minami,2005).
Pada tahun 1990 Sony berhasil mengembangkan jenis baru sel elektrokimia dengan elektrolit non-liquid, anoda karbon lithiated dan katoda LiCoO2, yaitu bernama baterai sekunder ion Lithium (Libs) dan diperkenalkan ke dalam pasar untuk pertama kali pada tahun 1991 oleh Sony. Baterai Litium sekunder adalah sebagai sumber daya untuk perangkat listrik seperti telepon seluler, komputer, maupun kamera, karena baterai ini memiliki sifat unggul. Baterai Lithium terdiri dari tiga komponen utama yaitu elektroli, anoda dan katoda. Beberapa material katoda pada baterai ion Lithium yang telah disintesis yaitu lithium mangan oxide (LiMn2O4), lithiumcobalt oxide (LiCoO2
Lithium Ferro Mangan Nikel Phospat(LiFeMnNiPO
) dan lithium
iron phospate (LFP).(Minami,2005).
Namun dengan berbagai kelebihan tersebut, LFP memiliki konduktivitas listrik yang rendah, yaitu sebsar 10-9 S/cm, hal tersebut sangat kurang bila dihubungkan dengan tingkat konduktivitas baterai yang sangat rendah untuk digunakan pada aplikasi daya tinggi. LiFePO4/C komposit disusun melalui sederhana dengan suhu tinggi untuk lebih efektif meningkatkan kinerja elektrokimia LiFePO4/C. LiFePO4/C dengan Ni dan Mn didoping disintesis oleh suhu tinggi dengan solid state, pengaruh Ni dan Mn didoping dengan jumlah yang berbeda pada struktur, morfologi dan properti elektrokimia LiFePO4/C. LiMnPO4 merupakan kandidat yang sangat menarik untuk digunakan sebagai bahan aktif dalam sel Lithium Ion. Materi yang menggabungkan keselamatan yang tinggi di negara dibebankan dengan kepadatan energi yang sebanding dengan bahan yang digunakan secara komersial dan biaya bahan baku yang rendah.(Xianyou,2013).
1.2Perumusan Masalah
Rumusan masalah dari penelitian ini sebagai berikut :
1. Bagaimana pengaruh doping Mn pada sintesis LFP?
2. Bagaimana cara pembuatan LiFe0.9-xMnxNi0.1PO4 sebagai bahan aktif katoda?
1.3Tujuan Penelitian
1. Mengetahui cara pembuatan LiFe0.9-xMnxNi0.1PO4
2. Mengetahui pengaruh doping Mn pada LFP.
sebagai bahan aktif katoda.
3. Mengetahui dan menganalisa serbuk katoda LiFe0.9-xMnxNi0.1PO4.
1.4Manfaat Penelitian
1.5Batasan Masalah
Batasan masalah dalam penelitian ini adalah : 1. Membuat LiFe0.9-xMnxNi0.1PO4
2. Pembuatan serbuk dilakukan dengan metode metalurgi serbuk, yaitu kalsinasi 700℃ selama 2 jam dan sintering awal selama 8 jam dan sintering kedua selama 2 jam dalam kondisi inert gas nitrogen.
sebagai material aktif katoda pada baterai lithium dengan variasi 0 ≤ x ≤ 0.2.
1.6 Sistematika Penulisan
Laporan tugas akhir ini disusun dengan sistematika sebagai berikut: Bab 1 Pendahuluan
Bab ini berisi tentang latar belakang penelitian, perumusan masalah, tujuan penelitian, manfaat penelitian, batasan masalah dan sistematika penulisan. Bab 2 Tinjauan Pustaka
Bab ini membahas tentang landasan teori yang menjadi acuan untuk proses pengembilan data, analisa data serta pembahasan.
Bab 3 Metodologi Penelitian
Bab ini membahas tentang rancangan penelitian, tempat dan waktu penelitian, peralatan dan bahan penelitian, prosedur penelitian serta diagram alir penelitian.
Bab 4 Hasil dan PembahasanPenelitian
Bab ini membahas tentang data hasil penelitian dan analisa data yang diperoleh dari penelitian.
Bab 5 Kesimpulan dan Saran
Bab ini menyajikan kesimpulan dari seluruh kegiatan dan hasil penelitian dan berisi saran-saran yang diperlukan untuk pengembangan dan penelitian lebih lanjut.
Daftar Pustaka
ABSTRAK
Salah satu komponen dalam sistem sel baterai Lithium adalah kathoda. Sintesa
material katoda dapat dilakukan dalam berbagai methode, salah satunya adalah metalurgi serbuk. Metalurgi serbuk adalah methoda yang paling mudah, namun prosesnya memakan banyak waktu dan energi. Dalam penelitian ini dilakukan sintesa material katoda LiFeMnNiPO4/C melalui route metalurgi serbuk. Bahan yang digunakan adalah serbuk LiOH.H2O, Fe2O3, MnO2, Ni, cairan H3PO4 dan Tepung tapioka. Proses sintesa diawali dengan dengan proses kalsinasi pada suhu 700℃ selama 2 jam. Setelah bahan setengah jadi ini menjadi serbuk, kemudian di
sintering pada suhu 800℃ selama 8 jam. Material katoda LiFeMnNiPO4/C yang didapat selanjutnya direduksi menjadi serbuk melalui penggerusan dengan mortar dan ayakan berukuran 200 mesh atau ball milling selama 3 jam. Untuk menentukan methoda yang homogen dalam serbuk, dilakukan analisa besar serbuk dengan X-ray Diffraction (XRD). Fasa yang terbentuk dari proses sinter dikarakterisasi dengan XRD, sementara morfologi serbuk dan kandungan serbuk dianalisa dengan SEM. Konduktifitas material kathoda diuji dengan alat
Electrochemical Impedance Spectroscopy (EIS). Dari penelitian ini didapat serbuk
katoda LiFeMnNiPO4/C dengan konduktifitas tertinggi sebesar 3 x 98 10-3 S/cm.
ABSTRACT
Cathode is a component of the Lithium Battery. Cathode material can be synthesized by different methods, i.e. powder metallurgy. This method is simple, but it consumes much time and energy as well. Cathode material LiFeMnNiPO4/C was synthesized in this research using a powder of LiOH.H2O, Fe2O3, MnO2, Ni, liquid H3PO4 and carbon as the start materials. Calcination, powder, and sintering are steps in powder metallurgy. Variasi of sintering time and temperature had been exercised in this reserach to get an optimum sinter condition. The phases resulted from this method were analyzed by XRD. The size of the cathode
material was further reduced by ball milling for 3 hours or crushing manually in a mortar and sieved 200 mesh. The powder homogenisation was analyzed by X-Ray Diffraction (XRD) equipment. Morphology and the element content of the powder were analyzed by SEM. Conductivity of this sheet is observed by Electrochemical Impedance Spectroscopy (EIS) equipment. showed highest conductivity, i.e. 3 x 98 103 S/cm.
SKRIPSI
ELMARISKA KHAIRANI
110801004
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
SINTESIS MATERIAL AKTIF KATODA
LiFe0.9-xMnxNi0.1PO4/C KONSENTRASI Mn 0
≤ x≤ 0.2
SKRIPSI
Diajukan untuk melengkapi tugas akhir dan memenuhi syarat
mencapai gelar Sarjana Sains
ELMARISKA KHAIRANI
110801004
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
Judul : SINTESIS MATERIAL AKTIF KATODA
LiFe0.9-xMnxNi0.1PO4/C KONSENTRASI
ANTARA Mn 0 ≤ x ≤ 0.2
Kategori : SKRIPSI
Nama : ELMARISKA KHAIRANI
Nomor Induk Mahasiswa : 110801004
Program Studi : SARJANA (S1) FISIKA
Departemen : FISIKA
Fakultas : MATEMATIKA DAN ILMU
PENGETAHUAN ALAM (MIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Agustus 2015
Disetujui Oleh
Departemen Fisika FMIPA USU
Ketua, Pembimbing,
SINTESIS MATERIAL AKTIF KATODA LiFe0.9-xMnxNi0.1PO4
KONSENTRASI Mn ANTARA 0 ≤ x ≤ 0.2
/C
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan-ringkasan masing-masing disebutkan sumbernya.
Medan, Agustus 2015
Syukur alhamdulillah, puji syukur kepada Allah SWT, Tuhan semesta alam yang telah memberikan rahmat dan karunia-nya sehingga penulis dapat menyelesaikan tugas akhir. Salawat beriring salam teruntuk nabi besar Muhammad SAW yang menjadi teladan dalam menjalani kehidupan.
Tugas akhir merupakan salah satu persyaratan untuk memperoleh gelar sarjana pada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara Medan. Untuk memenuhi persyaratan diatas penulis mengerjakan tugas akhir dengan judul : “ SINTESIS MATERIAL AKTIF LiFe 0.9-xMnxNi0.1PO4
Penulis menyadari bahwa selama proses hingga akhir terselesaikannya
penyusunan skripsi ini bayak sekali bimbingan dan bantuan dari berbagai pihak. Dengan segala kerendahan hati, penulis ingin menyampaikan rasa terima kasih dan penghargaan yang sebesar-besarnya kepada :
/C KONSENTRASI Mn ANTARA 0 ≤ x ≤ 0.2 ”. Yang
dilaksanakan di Laboratorium Baterai Lithium Lembaga Ilmu Pengetahuan Indonesia, Serpong, Tangerang Selatan, Banten.
1. Kedua orangtua saya yang tersayang Ayahanda Sotar Harahap dan Ibunda Kholijah Ray S.Pd dan adik saya Nanda Mulia Riski yang tulus menyayangi penulis dan tak henti-hentinya memberikan nasehat, doa, serta materi maupun moril.
2. Bapak Dr. Sutarman M.Sc selaku Dekan Departemen Fisika Fakultas Matematika dan ilmu Pengetahuan Alam Universitas Sumatera Utara Medan.
3. Bapak Dr. Marhaposan Situmorang selaku ketua Departemen Fisika Fakultas Matematika dan Pengetahuan Alam Universitas Sumatera Utara Medan.
6. Bapak Dr. Bambang Widyatmoko, M. Eng, selaku Kepala Laboratorium Pusat Penelitian Fisika P2F-LIPI Serpong.
7. Bapak Ibrahim Purwiardi M,Si, Bapak Abdul Majid,Bapak Slamet Priyono M,Si, Kak Reza, selaku pembimbing lapangan yang telah memberikan bimbingan, waktu dan tenaga kepada penulis dalam menyelesaikan skripsi ini.
8. Bapak Poltak Sihombing Ph.D selaku Dosen wali penulis selama mengikuti perkuliahan.
9. Seluruh Staf dosen, Pembantu Dekan, Pegawai Departemen Fisika FMIPA USU
10.Sahabat terbaik saya Andi S Lubis dan Wiriya Sasmita,Paulina Auliya Lubis buat motivasi, doa dan dukungannya yang tak henti-henti kepada penulis..
11.Sahabat-sahabat saya Leni Daulay, Sri Rakhmawati, Intan Zahar, Tri Mala Sari, Henni Setia Ningsih, Yuni Aluia Umi, Khairani Nasution, Kartika Sari, Sri Handika Pratiwi, Shelly Maharani, Meilia Krisanti, Suci Purnama Sari, Nur Aliyah Pulungan, Nur Samsi Hutabarat, Sefrina, dan Lily Fahlilah Hadifuro, Sahrina Dewi Nasution, Mutiara, Rina Windayani dan Mas Bintang, dan Suwita Army. Yang tak henti-hentinya memberikan semangat, doa, dukungan kepada penulis.
12.Seluruh teman – teman angkatan 2011 yang telah memberikan dukungan dan bantuan.
Medan, Agustus 2015
ABSTRAK
Salah satu komponen dalam sistem sel baterai Lithium adalah kathoda. Sintesa
material katoda dapat dilakukan dalam berbagai methode, salah satunya adalah metalurgi serbuk. Metalurgi serbuk adalah methoda yang paling mudah, namun prosesnya memakan banyak waktu dan energi. Dalam penelitian ini dilakukan sintesa material katoda LiFeMnNiPO4/C melalui route metalurgi serbuk. Bahan yang digunakan adalah serbuk LiOH.H2O, Fe2O3, MnO2, Ni, cairan H3PO4 dan Tepung tapioka. Proses sintesa diawali dengan dengan proses kalsinasi pada suhu 700℃ selama 2 jam. Setelah bahan setengah jadi ini menjadi serbuk, kemudian di
sintering pada suhu 800℃ selama 8 jam. Material katoda LiFeMnNiPO4/C yang didapat selanjutnya direduksi menjadi serbuk melalui penggerusan dengan mortar dan ayakan berukuran 200 mesh atau ball milling selama 3 jam. Untuk menentukan methoda yang homogen dalam serbuk, dilakukan analisa besar serbuk dengan X-ray Diffraction (XRD). Fasa yang terbentuk dari proses sinter dikarakterisasi dengan XRD, sementara morfologi serbuk dan kandungan serbuk dianalisa dengan SEM. Konduktifitas material kathoda diuji dengan alat
Electrochemical Impedance Spectroscopy (EIS). Dari penelitian ini didapat serbuk
katoda LiFeMnNiPO4/C dengan konduktifitas tertinggi sebesar 3 x 98 10-3 S/cm.
ABSTRACT
Cathode is a component of the Lithium Battery. Cathode material can be synthesized by different methods, i.e. powder metallurgy. This method is simple, but it consumes much time and energy as well. Cathode material LiFeMnNiPO4/C was synthesized in this research using a powder of LiOH.H2O, Fe2O3, MnO2, Ni, liquid H3PO4 and carbon as the start materials. Calcination, powder, and sintering are steps in powder metallurgy. Variasi of sintering time and temperature had been exercised in this reserach to get an optimum sinter condition. The phases resulted from this method were analyzed by XRD. The size of the cathode
material was further reduced by ball milling for 3 hours or crushing manually in a mortar and sieved 200 mesh. The powder homogenisation was analyzed by X-Ray Diffraction (XRD) equipment. Morphology and the element content of the powder were analyzed by SEM. Conductivity of this sheet is observed by Electrochemical Impedance Spectroscopy (EIS) equipment. showed highest conductivity, i.e. 3 x 98 103 S/cm.
DAFTAR ISI
Daftar Tabel viii
Daftar Gambar x
Daftar Grafik xi
Daftar Lampiran xiii
BAB 1. PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Rumusan Masalah 2
1.3 Tujuan Penelitian 2
1.4 Manfaat Penelitian 2
1.5 Batasan Masalah 3
1.6 Sistematika Penulisan 4
BAB 2. TINJAUAN PUSTAKA 5
2.1 Pengertian Baterai 5
2.1.1 Baterai Primer 5
2.1.2Baterai Sekunder 5
2.2 Baterai Lithium 6
2.3.1 Lithium Mangan Oxide (LiMnO2 2.3.2 Lithium Iron Phospate (LiFePO
) 10
3.2.1 Peralatan 19
3.2.2 Bahan 20
3.3 Prosedur Penelitian 20
3.3.1 Tahap Persiapan Komposisi Bahan Baku 20
3.3.2Tahap Proses Penimbangan 21
3.3.3 Tahap Proses Pencampuran 21
3.3.4 Tahap Proses Pengeringan 22
3.3.5 Tahap Proses Pembakaran (Sintering) 22
3.4 Diagram Alir Penelitian 23
3.4.1 Tahap Penelitian 23
BAB 4. HASIL DAN PEMBAHASAN 24
4.1 Karakterisasi Materia Aktif dengan XRD 24 4.1.1 Hasil XRD LiFe0.7Mn0.2Ni0.1PO4
4.3 Konduktivitas EIS (Electrochemical Impedance Spectroscopy) 33
/C 31
BAB 5. KESIMPULAN DAN SARAN 39
/C 36
5.1 Kesimpulan 39
5.2 Saran 39
Nomor Judul Halaman
Tabel
Tabel 3.1 Komposisi Sampel LiFe0.7Mn0.2Ni0.1PO4 Tabel 3.2 Komposisi Sampel LiFe
/C 20
0.8Mn0.1Ni0.1PO4 Tabel 3.3 Komposisi Sampel LiFe
/C 22
0.9Ni0.1PO4 Tabel 4.1 Material Aktif LiFe
/C 22
0.7Mn0.2Ni0.1PO4 Tabel 4.2 Material Aktif LiFe
/C 24
0.8Mn0.1Ni0.1PO4 Tabel 4.3 Material Aktif LiFe
/C 26
0.9Ni0.1PO4 Tabel 4.4 X-Vs-Rs Material Aktif dari LiFe
/C 27
0.7Mn0.2Ni0,1PO4 Tabel 4.5 Hasil Pengukuran Konduktivitas LiFe
/C 33
0.7Mn0.2Ni0.1PO4 Tabel 4.6 X-Vs-Rs Material Aktif dari LiFe
/C 34
0.8Mn0.1Ni0.1PO4 Tabel 4.7 Hasil Pengukuran Konduktivitas LiFe
/C 35
0.8Mn0.1Ni0.1PO4 Tabel 4.8 X-Vs-Rs Material Aktif dari LiFe
/C 36
0.9Ni0.1PO4 Tabel 4.9 Hasil Pengukuran Konduktivitas LiFe
/C 37
Nomor Judul Halaman
Gambar
Gambar 2.1 Struktur Sel Sebuah Baterai 8
Gambar 2.2 Serbuk Lithium Hydroxida 12
Gambar 2.3Serbuk Hematite 12
Gambar 2.4 Serbuk Mangan dioxide 13
Gambar 2.5 Serbuk Nikel 13
Gambar 2.6 Cairan Phosporic Acid 14
Gambar 2.7 Difraksi Sinar X oleh Atom-Atom Pada Bidang Kristal 14
Gambar 2.8 Skema sebuah peralatan SEM 15
Gambar 2.9 Skemati setup pengukuran EIS 19
Gambar 4.1 Hasil Mapping LiFe0.7Mn0.2Ni0.1PO4 Gambar 4.2 Hasil SEM LiFe
/C 28
0.7Mn0.2Ni0.1PO4 Gambar 4.3 Hasil Mapping LiFe
/C 29
0.8Mn0.1Ni0.1PO4 Gambar 4.4 Hasil SEM LiFe
/C 29
0.8Mn0.1Ni0.1PO4 Gambar 4.5 Hasil Mapping LiFe
/C 31
0.9Ni0.1PO4 Gambar 4.6 Hasil SEM LiFe
/C 31
Nomor Judul Halaman
Grafik
Grafik 4.1 Hasil XRD Material Aktif LiFe0.7Mn0.2Ni0.1PO4 Grafik 4.2 Hasil XRD Material Aktif LiFe
/C 24
0.8Mn0.1Ni0.1PO4 Grafik 4.3 Hasil XRD Material Aktif LiFe
/C 25
0.9Ni0.1PO4 Grafik 4.4 Grafik Cole-Cole Material Aktif LiFe
/C 26
0.7Mn0.2Ni0.1PO4 Grafik 4.5 Grafik Cole-Cole Material Aktif LiFe
/C 33
0.8Mn0.1Ni0.1PO4 Grafik 4.6 Grafik Cole-Cole Material Aktif LiFe
/C 35
Nomor Lampiran Judul Halaman
LAMPIRAN A Alat dan Bahan 42
LAMPIRAN B Proses Pembuatan Serbuk LiFeMnNiPO4
LAMPIRAN C Perhitungan Stoikiometri Secara Manual 48
/C 46
LAMPIRAND Pengamatan SEM 53