Lampiran 1. Gambar Sampel
Gambar 1. Daun Ubi Jalar Berumbi Ungu
1. Hasil analisis kualitatif kalsium dengan menggunakan mikroskop perbesaran (10×10)
Gambar 4. Kristal Kalsium Sulfat pada Daun Ubi Jalar Berumbi Ungu
Gambar 5. Kristal Kalsium Sulfat pada Daun Ubi Jalar Berumbi Kuning
Lampiran 3. (Lanjutan)
Gambar 6. Kristal Kalsium Sulfat pada Daun Ubi Jalar Berumbi Putih
2. Hasil analisis kualitatif besi
Gambar 7. Analisis Kualitatif Besi Menggunakan Larutan Amonium Tiosianat 1,5N
Kristal Kalsium Sulfat
Larutan Sampel Daun Ubi Jalar
Putih Larutan Sampel
Daun Ubi Jalar Kuning Larutan Sampel
Ubi Jalar Ungu Larutan
Daun Ubi Jalar
Ditimbang 0,5 kg
Dibersihkan dari pengotor Dicuci bersih menggunakan aqua demineralisata, kemudian tiriskan Dihaluskan menggunakan blender Sampel yang telah halus
Ditimbang ± 25 gram
Dimasukkan ke dalam krus porselen Diarangkan di atas hotplate
Diabukan dalam tanur dengan temperatur awal 100°C dan perlahan-lahan temperatur dinaikkan hingga suhu 500°C dengan interval 25°C setiap 5 menit
Dilakukan selama 40 jam dan dibiarkan hingga dingin pada desikator
Abu
Ditambahkan 5 mL HNO3 (1:1) Diuapkan pada hotplate sampai kering
Dimasukkan kembali dalam tanur dengan temperatur awal 100°C dan perlahan-lahan temperatur dinaikkan hingga suhu 500°C
Lampiran 5. Bagan Alir Proses Pembuatan Larutan Sampel
Sampel Hasil Destruksi
Dilarutkan dengan 5 mL HNO3 (1:1) Dipindahkan ke dalam labu tentukur 50,0 mL
Dibilas krus porselen sebanyak tiga kali mengunakan aqua
demineralisata. Dicukupkan hingga garis tanda
Disaring menggunakan kertas saring
Whatman No.42
Dibuang 5 mL filtrat pertama
Filtrat
Dimasukkan ke dalam botol
Larutan Sampel
Dilakukan analisis kualitatif Dilakukan analisis kuantitatif dengan Spektrofotometer Serapan Atom pada λ 422,7 nm untuk mineral kalsium dan λ 248,3 nm untuk mineral besi
Lampiran 6. (Lanjutan)
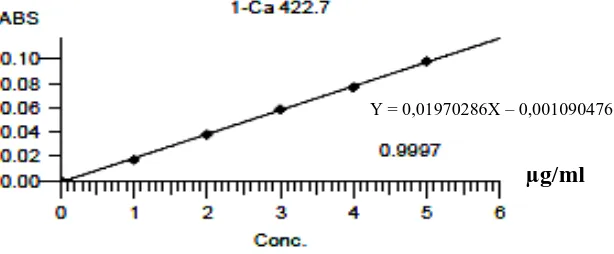
Maka persamaan garis regresinya adalah Y= 0,01970286 X -0,001090476
Lampiran 7. (Lanjutan)
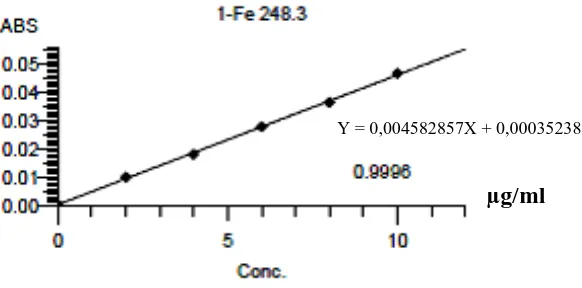
Maka persamaan garis regresinya adalah Y = 0,004582857 X + 0,000352381
Lampiran 11. Contoh Perhitungan Kadar Kalsium dan Besi pada Daun Ubi Jalar.
1. Contoh perhitungan kadar kalsium pada daun ubi jalar. Berat sampel yang ditimbang : 25,0734 g
Absorbansi : 0,0477
Faktor Pengenceran : 400
Persamaan garis regresi : Y = 0,01970286 X - 0,001090476 Konsentrasi : 0,0477 = 0,01970286 X-0,001090476
X = 0,0477+0,001090476 0,01970286 X = 2,4763 µg/mL
Kadar : Konsentrasi (µg/mL) ×Volume (mL) × FP Berat sampel (g)
: 2,4763 µg/mL×50 mL ×400 25,0734 g
: 1975,252 µg/g : 197,5252 mg/100 g
2. Contoh perhitungan kadar besi dalam daun ubi jalar Berat sampel yang ditimbang : 25,0734 g
Absorbansi : 0,0103
Faktor Pengenceran : 20
Persamaan garis regresi : Y= 0,004582857 X+0,000352381 Konsentrasi : 0,0103 = 0,004582857X+ 0,000352381
Kadar: Konsentrasi (µg/mL) × Volume (mL) × FP Berat sampel (g)
: 2,1706 µg/mL×50 mL ×20 25,0734 g
Lampiran 12. Perhitungan Statistik Kadar Kalsium pada Sampel.
1. Perhitungan Statistik Kadar Kalsium pada Daun Ubi Jalar Berumbi Ungu
No. Xi
∑ 1170,2828 33,33477158
X� 195,0471 Data diterima jika thitung < ttabel.
thitung 2 = |1,9312|
Berdasarkan hasil perhitungan di atas diperoleh semua thitung < ttabel, maka semua data tersebut diterima.
Lampiran 12. (Lanjutan)
2. Perhitungan Statistik Kadar Kalsium pada Daun Ubi Jalar Berumbi Kuning
No. Xi
∑ 1053,5321 7,29065555
X Data diterima jika thitung < ttabel.
thitung3= |0,7772|
Berdasarkan hasil perhitungan di atas diperoleh semua thitung < ttabel, maka semua data tersebut diterima.
Kadar kalsium dalam daun ubi jalar beerumbi kuning : μ = X �± (t(α
Lampiran 12. (Lanjutan)
3. Perhitungan Statistik Kadar Kalsium pada Daun Ubi Jalar Berumbi Putih
No. Xi
∑ 1941,2285 85,02582925
X Data diterima jika thitung < ttabel.
thitung3 = |6,3841|
Berdasarkan hasil perhitungan di atas diperoleh semua t hitung < ttabel, maka semua data tersebut diterima.
Lampiran 13. Perhitungan Statistik Kadar Besi pada Sampel.
1. Perhitungan Statistik Kadar Besi pada Daun Ubi Jalar Berumbi Ungu
No. Xi
∑ 52,2953 0,09852747
X Data diterima jika thitung < ttabel.
thitung3 = |0,1176|
Berdasarkan hasil perhitungan di atas diperoleh semua thitung < ttabel, maka semua data tersebut diterima.
Lampiran 13. (Lanjutan)
2. Perhitungan Statistik Kadar Besi pada Daun Ubi Jalar Berumbi Kuning
No. Xi
∑ 90,0550 0,99470852
X Data diterima jika thitung < ttabel.
thitung 3 = |0,3509|
Berdasarkan hasil perhitungan di atas diperoleh semua thitung < ttabel, maka semua data tersebut diterima.
Lampiran 13. (Lanjutan)
3. Perhitungan Statistik Kadar Besi pada Daun Ubi Jalar Berumbi Putih
No. Xi
∑ 179,5316 1,48761004
X Data diterima jika thitung < ttabel.
thitung 3= |0,0755|
Berdasarkan hasil perhitungan di atas diperoleh semua thitung < ttabel, maka semua data tersebut diterima.
Lampiran 14. Rekapitulasi Data Kadar Kalsium Setelah Uji t pada Sampel
Mineral Sampel No
Berat Sampel
(g)
Absorbansi Konsentrasi (µg/mL)
Kadar Sebenarnya 195,0471±4,2502
Daun
Kadar Sebenarnya 175,5887±1,9878
Daun
Mineral Sampel No Berat
Sampel (g) Absorbansi
Lampiran 16. Hasil Uji Perolehan Kembali dan Besi Setelah Penambahan Larutan Standar pada Sampel
1. Hasil analisis kalsium setelah ditambahkan larutan standar kalsium
NNo. Berat Sampel
2. Hasil analisis besi setelah ditambahkan larutan standar besi
Jalar
Jumlah baku yang ditambahkan dihitung menggunakan rumus berikut : CA = 10% × X�
V = CA × BS
Konsentrasi baku yang digunakan Keterangan :
CA = Jumlah larutan yang ditambahkan (µ g/g) X
� = Kadar rata-rata mineral dalam sampel (mg/100 g) CA V = Jumlah larutan baku yang ditambahkan (mL)
BS = Berat rata-rata sampel untuk uji perolehan kembali (g) 1. Kalsium
BS = 25,0748 g X
� = 175,5887 mg/100 g
CA = 10% × X�
= 10 % × 175,5887 mg/100 g = 17,55887 mg/100 g
= 175,5887 µg/g
V = CA × BS
Konsentrasi baku yang digunakan
Lampiran 17. (Lanjutan)
2. Besi
BS = 25,0748 g X
� = 15,0092 mg/100 g
CA = 10% × X�
= 10 % × 15,0092 mg/100 g = 1,50092 mg/100 g
= 15,0092 µg/g
V = CA × BS
Konsentrasi baku yang digunakan = 15,0092 µg/g × 25,0748 g
1. Contoh Perhitungan Uji Perolehan Kembali Kalsium
Berat sampel : 25,0681 g
Absorbansi : 0,0468
Faktor Pengenceran : 400
Persamaan Regresi : Y = 0,01970286 X – 0,001090476 Konsentrasi : 0,0468 = 0,01970286 X – 0,001090476
X = 0,0468+0,001090476 0,01970286 X=2,4306 µg/mL Konsentrasi setelah penambahan baku = 2,4306 µ g/mL
CF = Konsentrasi (μg/mL) × Volume ( mL) × FP Berat sampel (g)
= 2,4306 μg/mL ×50 mL × 400 25,0681 g
= 1939,2263 µg/g =193,9226 mg/100g
Kadar sampel setelah penambahan larutan baku (CF) = 193,9226 mg/100 g Kadar rata-rata sampel sebelum penambahan larutan baku (CA) = 175,5887 mg/100 g
Kadar larutan baku yang ditambahkan (C*A) :
C*A=Konsentrasi baku yang ditambahkan
Lampiran 18. (Lanjutan)
= 17,5475 mg/100 g
Maka % perolehan kembali kalsium : ��− ��
�∗� × 100%∶
= 193,9226 mg/100 g - 175,5887 mg/100 g
17,5475 mg/100 g ×100% = 104,4817%
2. Contoh Perhitungan Uji Perolehan Kembali Besi Berat sampel : 25,0681 g
Absorbansi : 0,0195 Faktor Pengenceran : 20
Persamaan Regresi : Y = 0,004582857 X + 0,000352381 Konsentrasi : 0,0195 = 0,004582857 X + 0,000352381
X= 0,0195 - 0,000352381 0,004582857 X =4,1781 µg/mL Konsentrasi setelah penambahan baku = 4,1781µ g/mL
CF = Konsentrasi (μg/mL) ×Volume ( mL) ×FP
Kadar larutan baku yang ditambahkan (C*A) :
C*A=Konsentrasi baku yang ditambahkan
Berat sampel rata-rata uji recovery × Volume yang ditambahkan = 1000 µg/mL
25,0748 g × 0,4 mL = 15,9523 µg/g
= 1,5952 mg/100 g
Maka % perolehan kembali besi : ��− ��
� ∗� × 100%∶
= 16,6669mg/100 g – 15,0092 mg/100 g
Lampiran 19. Perhitungan Simpangan Baku Relatif (RSD) Kadar Kalsium dan Besi pada Sampel
1. Perhitungan simpangan baku relatif (RSD) kadar kalsium
2. Perhitungan simpangan baku relatif (RSD) kadar besi
No. % Perolehan Kembali Xi - X� (Xi-X�)2
1 103,9217 3,0041 9,02461681
2 97,8762 -3,0414 9,25011396
3 104,0546 3,1370 9,840769
4 91,8751 -9,0425 81,76680625
5 109,1435 8,2259 67,66543081
6 98,6347 -2,2829 5,21163241
∑ 605,5058 182,7593692
X
� 100,9176
SD = �∑(Xi-X�) 2
n-1
= �182,7593692 6-1 = �36,55187385 = 6,0458
RSD = SD
X� × 100% = 6,0458
Lampiran 20. Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ)
1. Perhitungan batas deteksi dan batas kuantitasi kalsium Y= 0,01970286 X - 0,001090476
Slope = 0,01970286
2. Perhitungan batas deteksi dan batas kuantitasi besi Y = 0,004582857 X + 0,000352381
Slope = 0,004582857
No. Konsentrasi X (µg/mL)
Absorbansi
Y Yi Y - Yi (Y - Yi)2 × 10-7
Lampiran 22. (Lanjutan)
Gambar 10. Timbangan Analitik (Boeco Germany)
Almatsier, S. (2009). Prinsip Dasar Ilmu Gizi. Cetakan VIII. Jakarta: PT. Gramedia Pustaka Utama. Hal. 228, 250-255.
Arifin, Z. (2008). Beberapa Unsur Mineral Esensial Mikro Dalam Sistem Biologi dan Metode Analisisnya. Jurnal Litbang Pertanian. Vol. 27(3): 99.
Basset, J., Denny, R.C., Jeffrey, G.H., dan Mendham, J. (1991). Vogel’s Textbook
of Quantitative Inorganic Analysis Including Elementary Instrumental Analysis. Penerjemah: A. Handayana P., dan L. Setiono. (1994). Buku Ajar Vogel: Kimia Analisis Kuantitatif Anorganik. Edisi IV. Jakarta: Penerbit
Buku Kedokteran EGC. Hal. 954, 956-957.
Budiyanto, M.A.K. (2004). Dasar-Dasar Ilmu Gizi. Cetakan III. Malang: UMM Press. Hal. 59-61.
Ditjen POM RI. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan RI. Hal. 650.
Ditjen POM RI. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan RI. Hal. 1127, 1135.
Ermer, J., dan McB. Miller, J.H. (2005). Method Validation in Pharmaceutical
Analysis A Guide to Best Practice. Weinheim: Wiley-VCH Verlag GmbH
& Co. KGaA. Hal. 171.
Gandjar, I.G., dan Rohman, A. (2012). Kimia Farmasi Analisis. Cetakkan X. Yogyakarta: Pustaka Pelajar. Hal. 17-18, 184, 298-322, 464-470.
Gardjito, M., Djuwardi, A., dan Harmayani, E. (2013). Pangan Nusantara
Karakteristik dan Prospek untuk Percepatan Diversifikasi Pangan. Jakarta:
Kencana Prenada Media Group. Hal. 184, 189.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Review Artikel. Majalah Ilmu Kefarmasian. Vol.1(3): 117-133.
Harris, D.C. (2007). Quantitative Chemical Analysis. Edisi VII. New York: W.H. Freeman and Company. Hal. 455.
Issac, R.A. (1990). Plants. Dalam: Helrich, K. (1990). Official Methods of Analysis
of the Association of Official Analytical Chemists. Edisi XV. Virginia:
Association of Official Analytical Chemist, Inc. Hal. 42.
Khopkar, S.M. (1985). Basic Concepts Of Analytical Chemistry. Penerjemah: A. Saptorahardjo, dan Agus N. (1990). Konsep Dasar Kimia Analitik. Jakarta: UI-Press. Hal. 274, 283.
Motsa, N.M., Modi, A.T., Mabhaudhi, T. (2015). Sweetpotato (Ipomoea batatas L.) As A Drought Tolerant and Food Security Crop. Review Artikel. South
African Journal of Science. Vol.111(11/12): 3.
Permentan RI. (2015). Rencana Strategis Kementerian Pertanian Tahun
2015-2019. Jakarta: Kementerian Pertanian RI. Hal. 214.
Richana, N. (2013). Menggali Potensi Ubi Kayu dan Ubi Jalar. Cetakan II. Bandung: Nuansa Cendekia. Hal. 10-17.
Rosmarkam, A., dan Yuwono, N.W. (2006). Ilmu Kesuburan Tanah. Cetakan V. Yogyakarta: Kanisisus. Hal. 44.
Sudjana. (2005). Metode Statistika . Edisi VI. Bandung: Tarsito. Hal. 93, 168, 239. Tjitrosoepomo, G. (2007). Taksonomi Tumbuhan (Spermatophyta). Cetakan IX.
Yogyakarta: Gadjah Mada University Press. Hal. 353-354
Tongco, M.D.C. (2007). Purposive Sampling As A Tool For Informant Selection.
A Journal of Plants, People, and Applied Research . Vol. 5(147-158): 147.
USDA. (2016). Classification For Kingdom Plantae Down to Species Ipomoea
batatas (L.) Lam. Diakses pada tanggal 6 Agustus 2016.
PBA2.
Vogel, A.I. (1979). TextBook of Macro And Semimicro Qualitative Inorganic
Analysis. Penerjemah: L. Setiono., dan A. Handayana P. (1990). Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro. Bagian I. Direvisi
oleh : Svehla, G. Jakarta: PT. Kalman Media Pustaka. Hal. 263, 303.
METODE PENELITIAN
Metode yang digunakan dalam penelitian ini adalah metode penelitian deskriptif, yaitu untuk mengetahui kadar mineral kalsium dan besi yang terkandung pada daun ubi jalar berumbi ungu, kuning, dan putih secara spektrofotometri serapan atom.
3.1 Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Kimia Farmasi Kualitatif dan Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara pada bulan Maret-Mei 2016.
3.2 Bahan-Bahan
3.2.1 Sampel
Sampel yang digunakan dalam penelitian adalah daun ubi jalar (Ipomoea
batatas (L.) Lam.) berumbi ungu dan kuning yang tumbuh di daerah Tanjung Sari
dan putih di daerah Marindal. 3.2.2 Pereaksi
3.3 Alat
Spektrofotometer Serapan Atom (Hitachi Zeeman-2000) dengan nyala udara-asetilen lengkap dengan lampu katoda Ca dan Fe, blender, timbangan analitik (Boeco Germany), krus porselen, lemari asam, tanur, hotplate, mikroskop (Boeco Germany), kertas saring Whatman No.42, spatula, botol kaca, rak tabung reaksi dan alat-alat gelas (Oberoi).
3.4 Identifikasi Sampel
Identifikasi sampel dilakukan oleh bagian Herbarium Bogoriense Bidang Botani Pusat Penelitian Biologi-LIPI Bogor.
3.5 Pembuatan Pereaksi
3.5.1 Larutan HNO3 (1:1)
Campur asam nitrat P sebanyak 50 mL dengan 50 mL aqua demineralisata (Ditjen POM RI, 1979).
3.5.2 Larutan asam sulfat encer
Campur 57 mL asam sulfat P ke dalam lebih kurang 100 mL aqua demineralisata, dinginkan hingga suhu kamar dan encerkan dengan aqua demineralisata hingga 1000 mL (Ditjen POM RI, 1995).
3.5.3 Ammonium tiosianat 1,5 N
Larutkan 8 g amonium tiosianat P dalam aqua demineralisata hingga 100 mL (Ditjen POM RI, 1995).
3.6.1 Pengambilan Sampel
Metode pengambilan sampel dilakukan secara sampling purposif yakni pengambilan sampel yang ditentukan atas pertimbangan tertentu dimana sampel yang diambil dipandang mempunyai ciri-ciri yang sama dengan populasinya (Tongco, 2007). Kriteria sampel yang diambil yaitu daun muda, segar, dan terbebas dari serangan hama. Daun muda yakni daun yang baru terbentuk, dipilih daun muda sebab daun muda lebih lembut jika dibandingkan dengan daun tua, sehingga cocok untuk dimasak.
3.6.2 Penyiapan Sampel
Daun ubi jalar berumbi ungu, kuning, dan putih masing-masing 0,5 kg dibersihkan dari pengotornya dengan dicuci bersih menggunakan aqua demineralisata, kemudian ditiriskan sampai air cuciannya kering. Selanjutnya masing-masing sampel dihaluskan dengan menggunakan blender.
3.6.3 Proses Destruksi Kering
(Issac, 1990). Bagan alir proses destruksi kering dapat dilihat pada Lampiran 4, halaman 40.
3.6.4 Pembuatan Larutan Sampel
Sampel hasil destruksi dilarutkan dalam 5 mL HNO3 (1:1), lalu dipindahkan ke dalam labu tentukur 50 mL, dibilas krus porselen dengan 10 mL aqua demineralisata sebanyak tiga kali dan dicukupkan dengan aqua demineralisata hingga tanda batas. Kemudian disaring menggunakan kertas saring
Whatman No. 42 dimana 5 mL filtrat pertama dibuang untuk menjenuhkan kertas
saring kemudian filtrat selanjutnya ditampung ke dalam botol (Issac, 1990). Larutan ini digunakan untuk analisis kualitatif dan kuantitatif kalsium dan besi. Perlakuan yang sama diulang sebanyak enam kali untuk masing-masing sampel. Bagan alir pembuatan larutan sampel dapat dilihat pada Lampiran 5, halaman 41. 3.6.5 Analisis Kualitatif
3.6.5.1 Kalsium
Uji kristal kalsium menggunakan asam sulfat encer
Dua tetes larutan sampel hasil destruksi diteteskan pada object glass kemudian ditetesi dengan larutan asam sulfat encer. Selanjutnya diamati di bawah mikroskop. Jika terdapat kalsium akan terlihat kristal berbentuk jarum (Vogel, 1979).
3.6.5.2 Besi
Reaksi kualitatif menggunakan larutan ammonium tiosianat
3.6.6.1 Pembuatan Kurva Kalibrasi Kalsium
Larutan baku kalsium (1000 µg/mL) sebanyak 5 mL dimasukkan ke dalam labu tentukur 100 mL dan dicukupkan hingga tanda batas dengan menggunakan aqua demineralisata (konsentrasi 50 µg/mL). Masing-masing dipipet 0,5 mL ; 1,0 mL ; 1,5 mL ; 2,0 mL ; dan 2,5 mL kemudian dimasukkan ke dalam labu tentukur 25 mL dan dicukupkan dengan aqua demineralisata hingga tanda batas, sehingga diperoleh larutan dengan konsentrasi 1 µg/mL ; 2 µg/mL; 3 µg/mL; 4 µg/mL; dan 5 µg/mL. Lakukan pengukuran pada panjang gelombang 422,7 nm dengan tipe nyala udara-asetilen. Dari data akan diperoleh kurva kalibrasi kalsium.
3.6.6.2 Pembuatan Kurva Kalibrasi Besi
Larutan baku besi (1000 µg/mL) sebanyak 2,5 mL dimasukkan ke dalam labu tentukur 50 mL dan dicukupkan hingga tanda batas dengan menggunakan aqua demineralisata (konsentrasi 50 µg/mL). Masing-masing dipipet 1,0 mL ; 2,0 mL ; 3,0 mL ; 4,0 mL ; dan 5,0 mL kemudian dimasukkan ke dalam labu tentukur 25 mL dan dicukupkan dengan aqua demineralisata hingga tanda batas sehingga diperoleh larutan dengan konsentrasi 2 µg/mL; 4 µg/mL; 6 µg/mL; 8 µ g/mL; dan 10 µg/mL. Lakukan pengukuran pada panjang gelombang 248,3 nm dengan nyala udara-asetilen. Dari data akan diperoleh kurva kalibrasi besi.
3.6.6.3 Penetapan Kadar Kalsium dalam Sampel
panjang gelombang 422,7 nm dengan nyala udara-asetilen. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku kalsium, sehingga konsentrasi kalsium dalam sampel dapat ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasinya.
3.6.6.4 Penetapan Kadar Besi dalam Sampel
Larutan sampel hasil destruksi dipipet sebanyak 2,5 mL dimasukkan ke dalam labu tentukur 50 mL dan dicukupkan menggunakan aqua demineralisata sampai tanda batas (Faktor pengenceran = 50 mL/2,5 mL = 20 kali). Lalu diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada panjang gelombang 248,3 nm dengan nyala udara-asetilen. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku besi, sehingga konsentrasi besi dalam sampel dapat ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasinya.
3.6.6.5 Perhitungan Kadar Kalsium dan Besi dalam Sampel
Menurut Issac (1990) kadar kalsium dan besi dalam sampel dapat dihitung dengan cara sebagai berikut :
Kadar (μg/g)= C × V × Fp W Keterangan :
C = Konsentrasi (µ g/mL)
V = Volume larutan sampel (mL) Fp = Faktor pengenceran
3.6.7.1 Penolakkan Hasil Pengamatan
Diantara hasil yang diperoleh adakalanya terdapat hasil yang menyimpang, sehingga timbul kecenderungan untuk menolak hasil yang menyimpang tersebut (Gandjar dan Rohman, 2012).
Menurut Sudjana (2005), penyimpangan dari hasil yang diperoleh dapat diketahui dengan menggunakan uji distribusi t sebagai berikut :
thitung=
|Xi- X�| SD
√n
Data diterima jika thitung < ttabel dengan nilai ttabel didapat dari daftar distribusi t dengan dk = n-1. Tabel distribusi t dapat dilihat pada Lampiran 21, halaman 75.
Standar deviasi (SD) dapat dihitung dengan :
SD= �∑( Xi- X�)
n = Jumlah pengulangan pengukuran
untuk menentukan kadar mineral dalam sampel dengan interval kepercayaan 99%,
α = 0,01, dk = n-1, dapat digunakan rumus :
μ = X ���± (t(α
2,dk)× SD
dk = Derajat kebebasan SD = Standar deviasi
n = Jumlah pengulangan pengukuran 3.6.8 Validasi Metode
3.6.8.1 Kecermatan (Akurasi)
Akurasi diukur sebagai banyaknya analit yang diperoleh kembali
(recovery) pada suatu pengukuran dengan melakukan penambahan baku (standard
addition method) pada suatu sampel. Dalam metode ini, sampel dianalisis terlebih
dahulu, lalu sejumlah tertentu larutan baku kalsium dan besi ditambahkan ke dalam sampel dicampur dan dianalisis lagi (Harmita, 2004).
Sampel yang telah dihaluskan ditimbang lebih kurang 25 gram ke dalam krus porselen. Kemudian ditambahkan 4,4 mL larutan baku kalsium (1000 µg/mL) dan 0,4 mL larutan baku besi (1000 µg/mL), dan dilanjutkan dengan prosedur destruksi kering seperti yang telah dilakukan sebelumnya. Perlakuan ini dilakukan sebanyak 6 kali pengulangan. Pengukuran uji perolehan kembali dilakukan sama dengan prosedur penetapan kadar sampel.
Menurut Harmita (2004), persen perolehan kembali (uji recovery) dapat ditetapkan dengan rumus sebagai berikut :
% Perolehan kembali = CF - CA
C*A × 100% Keterangan :
CF : Kadar setelah penambahan larutan baku
Menurut Harmita (2004), presisi merupakan ukuran keterulangan metode analisis dan diekspresikan sebagai simpangan baku relatif yang dapat ditentukan dengan rumus berikut :
RSD= SD
X� ×100 % Keterangan :
RSD : Simpangan baku relatif SD : Standar deviasi
X
� : Kadar rata-rata sampel
3.6.8.3 Penentuan Batas Deteksi dan Batas Kuantitasi
Batas deteksi (Limit of Detection) didefinisikan sebagai konsentrasi analit terendah dalam sampel yang masih dapat dideteksi, meskipun tidak selalu kuantifikasi. Sedangkan batas kuantitasi (Limit of Quantitation) merupakan konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan (Gandjar dan Rohman, 2012).
Menurut Harmita (2004), batas deteksi dan batas kuantitasi dapat ditentukan dengan rumus sebagai berikut :
Simpangan baku�SY� �X = �∑(Y - Yi) 2
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Sampel
Hasil identifikasi sampel yang dilakukan oleh bagian Herbarium Bogoriense Bidang Botani Pusat Penelitian Biologi LIPI Bogor terhadap tumbuhan ubi jalar adalah jenis Ipomoea batatas (L.) Lam., suku Convolvulaceae. Hasil identifikasi sampel dapat dilihat pada Lampiran 2, halaman 37.
4.2 Analisis Kualitatif
Analisis kualitatif dilakukan sebagai analisis pendahuluan untuk mengetahui ada atau tidaknya kalsium dan besi di dalam sampel. Data dapat dilihat pada Tabel 4.1 di bawah ini :
Tabel 4.1 Hasil Analisis Kualitatif Kalsium dan Besi Daun Ubi Jalar
Mineral No. Sampel Pereaksi Hasil Reaksi Keterangan
Kalsium tiosianat 1,5 N
jalar berumbi ungu, kuning, dan putih yang diperiksa mengandung kalsium dan besi. Sampel positif mengandung kalsium karena menghasilkan kristal seperti kumpulan jarum dengan penambahan asam sulfat 2 N, serta positif mengandung besi karena terbentuk kompleks besi(III) tiosianat yang ditandai larutan menjadi berwarna merah dengan penambahan amonium tiosianat. Perubahan warna yang terbentuk tidak seperti yang dinyatakan dalam literatur yakni merah darah (Vogel, 1979). Hal ini dikarena adanya pengaruh dari mineral lain yang terkandung di dalam sampel. Gambar kristal kalsium dan hasil reaksi dapat dilihat pada Lampiran 3, halaman 38-39.
4.3 Analisis Kuantitatif
4.3.1 Kurva Kalibrasi Kalsium dan Besi
Gambar 4.2 Kurva Kalibrasi Besi
Berdasarkan kurva di atas diperoleh hubungan yang linear antara konsentrasi dengan serapan. Nilai koefisien korelasi (r) yang diperoleh 0,9997 untuk kalsium dan 0,9996 untuk besi. Nilai r > 0,97 menyatakan adanya korelasi linier antara hubungan konsentrasi (X) dengan absorbansi (Y) (Ermer dan McB. Miller, 2005). Data hasil pengukuran serapan larutan baku kalsium dan besi serta perhitungan persamaan regresinya dapat dilihat pada Lampiran 6-7, halaman 42-45.
4.3.2 Kadar Kalsium dan Besi dalam Sampel
Pengukuran sampel dilakukan pengenceran sampel sebesar 400 kali untuk kalsium, dan 20 kali untuk besi. Hal ini dilakukan agar diperoleh nilai serapan yang berada dalam rentang kalibrasi karena sampel memiliki kadar mineral yang tinggi. Konsentrasi kalsium dan besi ditentukan berdasarkan persamaan garis regresi kurva kalibrasi larutan baku kalsium dan besi. Data dan contoh perhitungan dapat dilihat pada Lampiran 8–11, halaman 46-50.
Analisis dilanjutkan dengan perhitungan statistik terhadap hasil analisis menggunakan uji t dengan taraf kepercayaan 99% (perhitungan dapat dilihat pada Lampiran 12–13, halaman 51-62 dan rekapitulasi data kadar kalsium dan besi dalam sampel setelah uji t dapat dilihat pada Lampiran 14-15, halaman 63-64).
µg/ml
berikut ini :
Tabel 4.2 Hasil Analisis Kuantitatif Kalsium dan Besi Daun Ubi Jalar
No Sampel Kadar
Kalsium (mg/100 g) Besi (mg/100 g) 1 Daun Ubi Jalar Ungu 195,0471 ± 4,2502 8,7159 ± 0,2310 2 Daun Ubi Jalar Kuning 175,5887 ± 1,9878 15,0092 ± 0,7342 3 Daun Ubi Jalar Putih 323,5381 ± 6,7880 29,9219 ± 0,8979
Berdasarkan data di atas, diketahui bahwa terdapat perbedaan yang signifikan dari kadar kalsium dan besi yang terkandung pada ketiga sampel. Perbedaan kadar ini dapat disebabkan oleh beberapa hal, yaitu :
1. Faktor genetik dari tanaman
Faktor genetik yang berbeda akan menentukan perkembangan sampai ukuran, warna, serta kandungan nutrisi pada tanaman (Harris dan Karmas, 1975).
2. Lokasi tumbuh tanaman,
Pada penelitian ini, kadar kalsium yang diperoleh belum mewakili nilai kadar kalsium yang sebenarnya di dalam sampel. Hal ini dikarenakan dalam pelaksanaan penelitian tidak dilakukan penambahan senyawa penyangga seperti Sr dan La. Penambahan Sr atau La perlu dilakukan sebab di dalam sampel mengandung gugusan pengganggu seperti fosfat, dimana fosfat ini jika bertemu dengan kalsium akan membentuk kalsium fosfat yang bersifat refraktorik (sukar diuraikan di dalam nyala api), terbentuknya senyawa yang bersifat refraktorik ini, maka akan mengurangi jumlah atom netral yang ada di dalam nyala. Dengan dilakukannya penambahan senyawa penyangga maka ion fosfat akan terikat dan tidak akan membentuk kalsium fosfat (Gandjar dan Rohman, 2012).
4.3.3 Validasi Metode Analisis
4.3.3.1 Kecermatan (Akurasi)
Hasil uji perolehan kembali (recovery) kadar kalsium dan besi setelah penambahan masing-masing larutan baku kalsium dan besi dalam sampel dapat dilihat pada Lampiran 16, halaman 65. Perhitungan persen recovery kalsium dan besi dalam sampel dapat dilihat pada Lampiran 18, halaman 68-70.
Persen recovery kalsium dan besi dalam sampel dapat dilihat pada Tabel 4.3 berikut ini :
Tabel 4.3 Persen Uji Perolehan Kembali (Recovery) Kalsium dan Besi pada Sampel
No. Mineral Recovery (%) Syarat Rentang Persen Recovery (%)
1 Kalsium 101,1297
80-120%
2 Besi 100,9176
recovery yang memenuhi syarat akurasi menunjukkan kecermatan atau akurasi
yang baik pada saat pemeriksaan kadar kalsium dan besi dalam sampel. 4.3.3.2 Keseksamaan (Presisi)
Berdasarkan data hasil pengukuran kadar mineral kalsium dan besi pada daun ubi jalar berumbi ungu, kuning, dan putih, diperoleh nilai simpangan baku relatif (RSD) sebesar 5,2308% untuk kalsium dan untuk besi 5,9908%. Menurut Harmita (2004), nilai simpangan baku relatif (RSD) untuk analit dengan kadar part
per million (ppm) adalah tidak lebih dari 16%. Dari hasil yang diperoleh dapat
dilihat bahwa semua hasil tidak ada yang melebihi persyaratan. Hal ini menunjukkan bahwa metode yang dilakukan memiliki presisi yang baik. Perhitungan simpangan baku relatif (RSD) mineral kalsium dan besi dapat dilihat pada Lampiran 19, halaman 71-72.
4.3.3.3 Batas Deteksi dan Batas Kuantitasi
Batas deteksi dan batas kuantitasi untuk mineral kalsium dan besi ditentukan berdasarkan data kurva kalibrasi. Dari hasil perhitungan diperoleh batas deteksi untuk kalsium sebesar 0,1616 µg/mL dan 0,3452 µ g/mL untuk besi. Sedangkan untuk uji batas kuantitasinya diperoleh sebesar 0,5388 µg/mL untuk kalsium dan 1,1508 µg/mL untuk besi.
BAB V
KESIMPULAN
5.1 Kesimpulan
a. Hasil penetapan kadar kalsium dan besi dengan menggunakan spektrofotometri serapan atom pada daun ubi jalar berumbi ungu, kuning, dan putih berturut-turut diperoleh kadar kalsium sebesar (195,0471 ± 4,2502) mg/100 g, (175,5887 ± 1,9878) mg/100 g, dan (323,5381 ± 6,7880) mg/100 g, sedangkan untuk kadar besinya diperoleh (8,7159 ± 0,2310) mg/100 g, (15,0092 ± 0,7342) mg/100 g, dan (29,9219 ± 0,8979) mg/100 g.
b. Hasil penelitian menunjukkan terdapat perbedaan signifikan kadar kalsium dan besi antara daun ubi jalar berumbi ungu, kuning, dan putih. Daun ubi jalar berumbi putih mengandung kadar kalsium dan besi yang lebih tinggi dibandingkan daun ubi jalar berumbi ungu dan kuning.
5.2 Saran
a. Berdasarkan uraian di atas, diharapkan masyarakat saat ini tidak hanya menggunakan umbi dari ubi jalar saja sebagai makanan, namun dapat menjadikan daun ubi jalar sebagai bahan makanan alternatif karena tingginya mineral bermanfaat yang terkandung di dalamnya.
TINJAUAN PUSTAKA
2.1 Uraian Tanaman
2.1.1 Sejarah dan Klasifikasi Ilmiah Tanaman Ubi Jalar
Ubi jalar (Ipomoea batatas (L.) Lam.) atau ketela rambat atau “sweetpotato” diduga berasal dari Benua Amerika. Para ahli botani memperkirakan daerah asal tanaman ubi jalar adalah Selandia Baru, Polinesia, dan Amerika bagian Tengah. Nikolai Ivanovich Vavilov, seorang ahli botani Soviet, memastikan daerah sentrum primer asal tanaman ubi jalar adalah Amerika bagian Tengan (Gardjito, dkk., 2013).
Ubi jalar merupakan tanaman dikotil yang masih dalam kelompok keluarga Convolvulaceae. Menurut United State Departement of Agriculture (USDA) tahun 2016 klasifikasi tanaman ubi jalar adalah sebagai berikut :
Kingdom : Plantae
2.1.2 Karakteristik Tanaman Ubi Jalar
Ubi jalar merupakan tanaman semak yang merayap atau membelit, dengan daun tunggal, sering bertoreh-toreh (Tjitrosoepomo, 2007). Batang ubi jalar tidak berkayu, berbentuk bulat yang terdiri dari gabus. Batang ubi jalar mempunyai ruas yang panjangnya antara 1-3 cm. Pada setiap batas ruas tumbuh daun, akar, dan tunas/cabang. Bunga ubi jalar menyerupai terompet, panjang 3-5 cm dan lebar bagian ujungnya 3-4 cm. Ubi jalar merupakan jenis umbi yang unik, karena memiliki berbagai warna kulit maupun daging umbinya. Warna kulit ubi jalar sangat beragam, yaitu putih, kuning, ungu, dan ungu merah. Sedangkan daging ubi warnanya putih, kuning, jingga, dan ungu. Tidak terdapat korelasi antara warna daging ubi dengan kulit ari (Richana, 2013).
Ubi jalar termasuk tanaman tropis dan dapat tumbuh di daerah subtropis dengan persyaratan iklim pertumbuhannya 21-27°C. Di Indonesia, ubi jalar umumnya ditanam di dataran rendah (kurang dari 500 m dari permukaan laut). Lokasi pertumbuhan ubi jalar yang baik yakni pada tempat terbuka dengan perbedaan suhu antara siang dan malam tidak jauh berbeda. Sedangkan untuk derajat keasaman tanah antara 5,5-7,5 (Richana, 2013).
2.1.3 Daun Ubi Jalar
Daun ubi jalar mempunyai bentuknya yang dapat dibedakan menjadi 3 golongan, yakni bulat, lonjong, dan runcing. Sedangkan untuk warna tangkai daun dan tulang daun bervariasi antara hijau dan ungu, sesuai dengan warna batangnya (Richana, 2013).
2.1.4 Nilai Nutrisi Daun Ubi Jalar
tersimpan didalam akarnya. Daun ubi jalar juga merupakan sumber lutein yang sangat luar biasa, dimana lutein bertanggung jawab terhadap penglihatan pada mata manusia dan melindungi mata dari stress oksidatif (Motsa, dkk., 2015).
Jumlah besi, kalsium, dan karoten mempunyai nilai yang paling tinggi dibandingkan dengan sayuran utama lainnya. Beberapa penelitian memperlihatkan bahwa daun ubi jalar mengandung vitamin, mineral, dan nutrisi yang sebanding dengan bayam, serta kandungan asam oksalat pada daun ubi jalar 1-5 kali lebih sedikit dibandingkan yang terdapat pada bayam (Islam, 2007).
Tabel 2.1 Kandungan Nutrisi Daun Ubi Jalar Dibandingkan dengan Sayuran Lain
Tanaman
Total Protein
β
-karoten Kalsium Besi Riboflavin
Asam
(Sumber: Motsa, dkk., 2015).
2.2 Mineral
dikenal sebagai zat anorganik atau kadar abu. Berbagai unsur anorganik (mineral) terdapat dalam bahan biologi, tetapi tidak atau belum semua mineral tersebut terbukti esensial, sehingga ada mineral esensial dan non-esensial. Mineral esensial yaitu mineral yang sangat diperlukan dalam proses fisiologi makhluk hidup untuk membantu kerja enzim atau pembentukkan organ. Unsur-unsur esensial dalam tubuh terdiri atas dua golongan, yaitu mineral makro dan mineral mikro. Mineral non-esensial adalah logam yang perannya dalam tubuh makhluk hidup belum diketahui dan kandungannya dalam jaringan sangat kecil. Bila kandungannya tinggi dapat merusak organ tubuh makhluk hidup yang bersangkutan (Arifin, 2008).
Sampai sekarang telah diketahui ada empat belas unsur mineral yang berbeda jenisnya diperlukan manusia agar memiliki kesehatan dan pertumbuhan yang baik. Natrium, klor, kalsium, fosfor, magnesium, dan belerang terdapat dalam tubuh dalam jumlah yang cukup besar dan karenanya disebut mineral makro. Sedangkan unsur mineral lain seperti besi, iodium, mangan, tembaga, zink, kobalt hanya terdapat dalam tubuh dalam jumlah yang kecil, karena itu disebut mineral mikro (Winarno, 1995).
2.2.1 Kalsium
per orang per hari dan dewasa 0,5 – 0,7 g per orang per hari (Winarno, 1995). Menurut Budiyanto (2004) susu, ikan, udang kering, sar-dencis, bayam, keju, es krim, melinjo, dan sawi merupakan sumber kalsium yang baik bagi tubuh. Kalsium juga dapat diperoleh dalam jumlah cukup dari air mineral yang dapat mengandung sampai 50 mg/L. Peranan kalsium tidak saja sebagai pembentukkan tulang dan gigi, tetapi juga memegang peranan penting pada berbagai proses fisiologik dan biokhemik di dalam tubuh, fungsi lain dari kalsium yaitu :
1. Iritabilitas otot.
2. Proses pembekuan darah (dalam sintesis trombin).
3. Memberikan kekerasan dan ketahanan terhadap pengeroposan. 4. Transmisi impuls.
5. Relaksasi dan kontraksi.
6. Bersama fosfor membentuk matriks tulang yang dipengaruhi oleh vitamin D.
2.2.2 Besi
Kandungan besi dalam badan sangat kecil yaitu 35 mg per kg berat badan wanita atau 50 mg per kg berat badan pria. Besi di dalam tubuh terletak di dalam sel-sel darah merah sebagai heme, suatu pigmen yang mengandung inti sebuah atom besi. Besi juga terdapat dalam sel-sel otot. Jumlah besi yang dikeluarkan tubuh sekitar 1,0 mg per hari, untuk wanita ditambah 0,5 mg hilang karena menstruasi. Karena jumlah besi yang diserap hanya sekitar 10%, maka konsumsi yang dianjurkan adalah 10 mg untuk orang dewasa per hari, atau 18 mg untuk wanita dengan usia 11-50 tahun (Winarno, 1995).
Menurut Almatsier (2009) besi mempunyai beberapa fungsi esensial di dalam tubuh, yaitu :
1. Sebagai alat angkut oksigen dari paru-paru ke jaringan tubuh.
2. Sebagai bagian terpadu berbagai reaksi enzim di dalam jaringan tubuh. 3. Meningkatkan kemampuan belajar.
4. Meningkatkan sistem kekebalan tubuh.
Walaupun terdapat luas di dalam makanan, masih banyak penduduk dunia mengalami kekurangan besi, termasuk di Indonesia. Kekurangan besi sejak 30 tahun terakhir diakui berpengaruh terhadap produktivitas kerja, penampilan kognitif, serta menurunkan sistem kekebalan sehingga sangat peka terhadap serangan bibit penyakit (Almatsier, 2009).
2.3 Analisis Kualitatif
menggunakan mikroskop maka akan terlihat kristal berbentuk jarum. Sedangkan untuk identifikasi besi digunakan larutan amonium tiosianat 1,5 N yang mana akan terbentuk larutan yang berwarnah merah darah. Hal ini dikarenakan terbentuknya senyawa kompleks besi(III) tiosianat (Vogel, 1979).
2.4 Spektroskopi Serapan Atom
Menurut Khopkar (1985), peristiwa serapan atom pertama kali diamati oleh Fraunhofer, ketika menelaah garis-garis hitam pada spektrum matahari. Sedangkan yang memanfaatkan prinsip serapan atom pada bidang analisis adalah seorang Australia bernama Alan Walsh di tahun 1955.
Spektroskopi serapan atom digunakan untuk analisis kuantitatif unsur-unsur logam dalam jumlah sekelumit (ppm) dan sangat kelumit (ppb). Dalam garis besarnya prinsip spektroskopi serapan atom sama saja dengan spektrofotometri sinar tampak dan ultraviolet. Perbedaannya terletak pada bentuk spektrum, cara pengerjaan sampel, dan peralatan (Gandjar dan Rohman, 2012).
masing-2.4.1 Instrumen Spektrofotometer Serapan Atom
Sistem peralatan spektrofotometer serapan atom terdiri dari : 1. Sumber sinar
Sumber yang dapat memberikan suatu garis emisi yang tajam dari suatu unsur spesifik tertentu dikenal sebagai lampu pijar hollow cathode. Lampu ini memiliki dua elektroda, satu diantaranya berbentuk silinder dan terbuat dari unsur yang sama dengan unsur yang dianalisis (Khopkar, 1985)
2. Tempat sampel
Dalam analisis dengan spektrofotometri serapan atom, sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan asas. Ada berbagai macam alat yang dapat digunakan untuk mengubah suatu sampel menjadi uap atom-atom yaitu dengan nyala (flame) dan dengan tanpa nyala (flameless) (Gandjar dan Rohman, 2012).
3. Monokromator
Menurut Basset, dkk (1991) tujuan monokromator adalah untuk memilih garis pancaran tertentu dan memisahkannya dari garis-garis lain dan kadang-kadang dari pancaran pita molekul. Dalam AAS fungsi monokromator adalah untuk memencilkan garis resonansi dari semua garis yang tak diserap yang dipancarkan oleh sumber radiasi.
4. Detektor
Detektor digunakan untuk mengukur intensitas cahaya yang melalui tempat pengatoman (Gandjar dan Rohman, 2012).
5. Readout
Readout merupakan sistem pencatatan hasil. Pencatatan hasil dilakukan
menggambarkan absorbansi (Gandjar dan Rohman 2012).
Gambar 2.1 Instrumen Spektrofotometer Serapan Atom (Sumber: Harris, 2007)
2.4.2 Gangguan-Gangguan pada Spektrofotometri Serapan Atom
Menurut Gandjar dan Rohman (2012), gangguan (interference) pada Spektrofotometri Serapan Atom adalah peristiwa yang menyebabkan pembacaan absorbansi unsur yang dianalisis menjadi lebih kecil atau lebih besar dari nilai yang sesuai dengan konsentrasi dalam sampel. Gangguan-gangguan yang dapat terjadi sebagai berikut :
1. Gangguan yang berasal dari matriks sampel yang mana dapat mempengaruhi banyaknya sampel yang mencapai sampel.
2. Gangguan kimia yang dapat mempengaruhi jumlah/banyaknya atom yang terjadi di dalam nyala.
Menurut Basset, dkk (1991) penggunaan suhu yang tinggi sering menyebabkan pembentukkan atom gas bebas, misalnya suatu gangguan kalsium-alumunium yang timbul dari pembentukkan kalsium aluminat dapat diatasi dengan bekerja pada temperatur nyala asetilena dinitrogen oksida yang lebih tinggi.
b. Penggunaan senyawa penyangga
Senyawa penyangga akan mengikat gugusan pengganggu (silikat, fosfat,aluminat, sulfat, dan sebagainya). Contoh unsur penyangga adalah Sr dan La yang ditambahkan pada analisis Ca. Dengan penambahan senyawa penyangga ini maka ion fosfat akan terikat dan tidak akan membentuk Ca-fosfat yang bersifat refraktoris (Gandjar dan Rohman, 2012).
c. Pengekstraksian ion atau gugus pengganggu
Metode ekstraksi merupakan suatu metode yang jelas untuk mengatasi efek gangguan. Suatu ekstraksi pelarut yang sederhana dapat untuk menyingkirkan sebagian besar zat pengganggu. Jika perlu, ekstraksi pelarut ulangan akan mengurangi efek gangguan itu lebih banyak lagi (Basset, dkk., 1991).
4. Gangguan oleh penyerapan non atomik
Validasi dilakukan untuk menjamin bahwa metode analisis akurat, spesifik, reprodusibel, dan tahan pada kisaran analit yang akan dianalisis. Suatu metode analisis divalidasi untuk melakukan verifikasi bahwa parameter-parameter kinerjanya cukup mampu untuk mengatasi problem analisis (Gandjar dan Rohman, 2012).
Beberapa parameter analisis yang dalam validasi metode analisis, yaitu : 1. Kecermatan (akurasi)
Kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan (Harmita, 2004).
2. Keseksamaan (Presisi)
Keseksamaan merupakan ukuran keterulangan metode analisis. Diukur melalui penyebaran hasil individual dari rata-rata jika prosedur diterapkan secara berulang pada sampel-sampel yang diambil dari campuran yang homogen (Harmita, 2004).
3. Spesifisitas
Spesifisitas suatu metode adalah kemampuannya yang hanya mengukur zat tertentu saja secara cermat dan seksama dengan adanya komponen lain yang mungkin ada dalam matriks sampel (Harmita, 2004).
4. Linieritas dan rentang
ditetapkan dengan kecermatan, keseksamaan, dan linieritas yang dapat diterima (Harmita, 2004).
5. Batas deteksi dan batas kuantitasi
Batas deteksi didefinisikan sebagai konsentrasi analit terendah dalam sampel yang masih dapat dideteksi, meskipun tidak selalu dapat dikuantifikasikan. Sedangkan batas kuantifikasi adalah konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan (Gandjar dan Rohman, 2012).
6. Ketanggguhan metode (Ruggedness)
Ketangguhan metode adalah derajat ketertiruan hasil uji yang diperoleh dari analisis sampel yang sama dalam berbagai kondisi uji normal, seperti laboratorium, analisis, instrumen, bahan pereaksi, dll (Harmita, 2004).
7. Kekuatan (Robustness)
Kekuatan adalah kapasitas metode untuk tetap tidak terpengaruh oleh adanya variasi parameter metode yang kecil, seperti suhu dan pH (Gandjar dan Rohman, 2012).
BAB I
PENDAHULUAN
1.1 Latar Belakang
Ubi jalar (Ipomoea batatas (L.) Lam.) atau ketela rambat “sweetpotato” diduga berasal dari Benua Amerika. Ubi jalar mulai menyebar ke seluruh dunia terutama negara-negara beriklim tropik diperkirakan pada abad ke-16 (Gardjito, dkk., 2013). Sifat pertumbuhan ubi jalar yang lebih toleran terhadap penyakit, hama, dan kelembaban tinggi dari pada banyak tanaman lain yang tumbuh di daerah tropis serta dapat dipanen beberapa kali dalam setahun menyebabkan pada tahun 1960-an penanaman ubi jalar mulai meluas hampir disemua provinsi di Indonesia (Islam, 2007).
Sasaran produksi ubi jalar di Indonesia pada tahun 2016 mencapai 2,6 juta ton dan meningkat menjadi 2,85 juta ton pada tahun 2019 (Permentan RI, 2015). Tingginya sasaran tingkat produksi ini memperlihatkan besarnya minat masyarakat dalam mengkonsumsi ubi jalar. Namun, selama ini masyarakat Indonesia kebanyakan hanya menggunakan umbi dari ubi jalar saja sebagai bahan pangan. Sedangkan bagian yang lainnya berakhir sebagai limbah. Limbah ubi jalar berupa daun dimanfaatkan untuk pakan ternak. Di Irian Jaya, limbah daun ubi jalar digunakan sebagai pakan ternak kelinci (Gardjito, dkk., 2013).
daun ubi jalar segar (mentah) mengandung sumber gizi yang cukup tinggi (Gardjito, dkk., 2013). Jumlah nutrisi yang terkandung pada daun ubi jalar pada
tiap 100 g yakni protein total 29 g, β-karoten 2700 µg, kalsium 75-183 mg, besi 1,8-3,9 mg, riboflavin 0,35 mg, dan asam askorbat 32-136 mg (Motsa, dkk., 2015).
Kadar gizi tanaman pangan dapat berbeda-beda. Keragaman ini diakibatkan oleh banyaknya faktor yang saling bergantungan, terutama faktor genetik, sinar matahari, curah hujan, topografi, tanah, lokasi, musim, dan derajat kemasakkan (Harris dan Karmas, 1975).
Mineral terdapat di dalam tubuh dan memegang peranan penting dalam pemeliharaan fungsi tubuh, baik pada tingkat sel, jaringan, organ, maupun fungsi tubuh secara keseluruhan. Kalsium dan besi salah satu diantara mineral lainnya yang memegang peranan penting bagi fungsi tubuh (Almatsier, 2009).
Berdasarkan uraian diatas, penggunaan daun ubi jalar sebagai sayuran dan untuk pengolahan makanan harus didukung. Oleh karena itu, maka penulis tertarik untuk meneliti kandungan kalsium dan besi yang terdapat pada daun ubi jalar berdasarkan perbedaan dari warna umbinya. Berdasarkan umbinya, ubi jalar memiliki empat macam warna umbi yang berbeda, yakni berumbi putih, kuning, jingga dan ungu. Penelitian ini dilakukan pada daun ubi jalar berumbi ungu, kuning dan putih. Tidak dilakukan penelitian daun ubi jalar berumbi jingga dikarenakan keterbatasan ketersediaan sampel di wilayah penelitian.
logam karena mempunyai kepekaan yang tinggi (batas deteksi kurang dari 1 ppm) (Gandjar dan Rohman, 2012).
1.2 Perumusan Masalah
Berdasarkan uraian di atas, maka permasalahan dalam penelitian ini dapat dirumuskan sebagai berikut :
a. berapa kadar kalsium dan besi yang terkandung pada daun ubi jalar berumbi ungu, kuning dan putih ?
b. apakah ada perbedaan antara kadar kalsium dan besi pada daun ubi jalar berumbi ungu, kuning dan putih ?
1.3 Hipotesis
a. kadar kalsium dan besi pada daun ubi jalar berumbi ungu, kuning, dan putih dalam jumlah tertentu.
b. ada perbedaan kadar kalsium dan besi pada daun ubi jalar berumbi ungu, kuning, dan putih dalam jumlah tertentu.
1.4 Tujuan Penelitian
a. untuk mengetahui kadar mineral kalsium dan besi pada daun ubi jalar berumbi ungu, kuning dan putih.
1.5 Manfaat Penelitian
Memberikan informasi kepada masyarakat tentang kandungan mineral kalsium dan besi yang terkandung pada daun ubi jalar berumbi ungu, kuning dan putih, sehingga daun ubi jalar dapat digunakan sebagai bahan pangan alternatif untuk dikonsumsi bagi masyarakat.
SPEKTROFOTOMETRI SERAPAN ATOM
ABSTRAK
Ubi jalar (Ipomoea batatas (L.) Lam.) mulai menyebar ke seluruh dunia terutama negara-negara beriklim tropik diperkirakan pada abad ke-16. Sifat pertumbuhan ubi jalar yang lebih toleran terhadap penyakit, hama, serta dapat dipanen beberapa kali dalam setahun menyebabkan penanaman ubi jalar hampir meluas disemua provinsi di Indonesia. Namun, selama ini penggunaan ubi jalar di Indonesia hanya sebatas pada umbinya saja. Padahal pada daun ubi jalar banyak mengandung vitamin, mineral, dan nutrisi lainnya yang sebanding dengan bayam. Bahkan kandungan kalsium, besi, dan karoten pada daun ubi jalar lebih tinggi dibandingkan dengan sayuran utama lainnya. Kalsium dan besi merupakan mineral yang sangat dibutuhkan oleh tubuh. Tujuan penelitian ini adalah untuk penentuan kadar kalsium dan besi yang terkandung pada daun ubi jalar.
Penelitian ini dilakukan pada daun ubi jalar berdasarkan perbedaan warna umbinya, yakni pada daun ubi jalar berumbi ungu, kuning, dan putih. Penelitian dilakukan secara analisis kualitatif dan kuantitatif. Analisis kualitatif dilakukan menggunakan pereaksi H2SO4 untuk kalsium, dan pereaksi amonium tiosianat untuk besi. Sedangkan analisis kuantitatif dilakukan secara spektrofotometri serapan atom pada panjang gelombang 422,7 nm untuk kalsium dan 248,3 nm untuk besi.
Hasil penetapan kadar kalsium pada daun ubi jalar berumbi ungu, kuning, dan putih diperoleh 195,0471 ± 4,2502 mg/100 g; 175,5887 ± 1,9878 mg/100 g, dan 323,5381 ± 6,7880 mg/100 g. Sedangkan untuk kadar besinya diperoleh 8,7159 ± 0,2310 mg/100 g; 15,0092 ± 0,7342 mg/100 g, dan 29,9219 ± 0,8979 mg/100 g. Daun ubi jalar berumbi putih mengandung kadar kalsium dan besi yang lebih tinggi dibandingkan dengan daun ubi jalar berumbi ungu dan kuning. Berdasarkan hasil penelitian ini dapat disimpulkan bahwa daun ubi jalar dapat digunakan sebagai bahan pangan alternatif bagi masyarakat karena tingginya mineral bermanfaat yang terkandung di dalamnya.
DETERMINATION OF MINERAL LEVELS OF CALCIUM
AND IRON IN SWEETPOTATO LEAVES (Ipomoea batatas (L.)
Lam.) BY ATOMIC ABSORPTION SPECTROFOTOMETRY
ABSTRACT
The sweet potatoes (Ipomoea batatas (L.) Lam.) began to spread around the world, especially to the tropical countries was predicted in the 16th century. The nature of their growth were more tolerant to disease, pests, and can be harvested several times a year leads to their widespread planting almost in all provinces in Indonesia. However, during this time, the use of sweet potato in Indonesia was limited in tuber only. Though their leaves are rich of vitamins, minerals, and other nutrients that are comparable to spinach. Even the content of calcium, iron, and carotene in sweet potato leaves is higher compared to other major vegetables. Calcium and iron are minerals that are needed by the body. The aim of this research was to determine level of calcium and iron in a sweetpotato leaves.
This research was conducted on the leaves of sweet potato based on the color difference of their tubers, namely the leaves of purple, yellow, and white sweet potato. The research was conducted by qualitative and quantitative analysis. Qualitative analysis was performed using H2SO4 reagent for calcium and ammonium thiocyanate reagent for iron. Quantitative analyzes conducted by atomic absorption spectrophotometry at a wavelength of 422.7 nm for calcium and at 248.3 nm for iron.
The results of the assay of calcium in purple, yellow, and white sweet potato leaves obtained 195.0471 ± 4.2502 mg/100 g; 175.5887 ± 1.9878 mg/100 g, and 323.5381 ± 6.7880 mg/100 g. Whereas the iron content is obtained 8.7159 ± 0.2310 mg/100 g; 15.0092 ± 0.7342 mg/100 g, and 29.9219 ± 0.8979 mg/100 g. The calcium and iron level of white sweet potato leaves were higher than the purple and yellow one. Based on the results it can be concluded that the sweet potato leaves can be used as alternative food because of their high beneficial minerals contained.
Keyword : Sweetpotato Leaves, Calcium, Iron, Atomic Absorption
SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
OLEH:
PENENTUAN KADAR MINERAL KALSIUM DAN BESI
PADA DAUN UBI JALAR (Ipomoea batatas (L.) Lam.) SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh
gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
TOHA BUDI SRI DESTY RAHMAWARDINI
NIM 141524038
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
DAUN UBI JALAR (Ipomoea batatas (L.) Lam.) SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
OLEH:
TOHA BUDI SRI DESTY RAHMAWARDINI NIM 141524038
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 18 Agustus 2016
Disetujui Oleh: Pembimbing I,
Prof. Dr. Ginda Haro, M.Sc., Apt. NIP 195108161980031002
Prof. Dr. Ginda Haro, M.Sc., Apt.
Pembimbing II, NIP 195108161980031002
Dr. Masfria, M.S., Apt. Drs. Fathur Rahman Harun, M.Si., Apt. NIP 195707231986012001 NIP 195201041980031002
Dra. Sudarmi, M.Si., Apt. NIP 195409101983032001
Medan, September 2016 Fakultas Farmasi
Panitia Penguji,
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT yang telah melimpahkan berkat dan rahmatNya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul “Penentuan Kadar Mineral Kalsium dan Besi pada Daun Ubi Jalar (Ipomoea batatas (L.) Lam.) secara Spektrofotometri Serapan Atom”. Skripsi ini diajukan sebagai salah satu syarat guna memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
M.Si., Apt., selaku Kepala Laboratorium Penelitian dan Ibu Dr. Masfria, M.S., Apt., selaku Kepala Laboratorium Kimia Farmasi Kualitatif yang telah memberikan bantuan dan fasilitas selama penulis melakukan penelitian.
Penulis mengucapkan terima kasih dan penghargaan yang tiada terhingga kepada Ayahanda Agus Subakti dan Ibunda Lie Jun Lan yang telah memberikan cinta, kasih sayang, doa dan dukungan baik moril maupun materil, kakakku tercinta Toha Budi Sri Utami Ningrum dan Toha Budi Sri Puji Astuti yang selalu mendoakan, memberikan semangat, dan selalu menjadi inspirasi. Penulis dengan tulus mengucapkan terima kasih kepada sahabat tercinta Kak maya, Kak ratna, Bang sawal, Kak Metha, Reffie, Deska, Wita, Dini, Puput, Nurma Zuhria dan teman-teman seperjuangan ekstensi 2014.
Penulis menyadari bahwa penulisan skripsi ini masih belum sempurna. Oleh karena itu sangat diharapkan kritik dan saran yang bersifat membangun dari semua pihak demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini dapat memberikan manfaat bagi kita semua khususnya di bidang farmasi.
Medan, 05 Agustus 2016 Penulis,
SURAT PERNYATAAN TIDAK PLAGIAT
Saya yang bertanda tangan dibawah ini:
Nama : Toha Budi Sri Desty Rahmawardini
Nomor Induk Mahasiswa : 141524038
Program Studi : S-1 Ekstensi Farmasi
Judul Skripsi : Penentuan Kadar Mineral Kalsium dan Besi pada Daun Ubi Jalar (Ipomoea batatas (L.) Lam.) Secara Spektrofotometri Serapan Atom
Dengan ini menyatakan bahwa skripsi ini ditulis berdasarkan data dari hasil pekerjaan yang saya lakukan sendiri, dan belum pernah diajukan oleh orang lain untuk memperoleh gelar kesarjanaan di perguruan tinggi lain, dan bukan plagiat karena kutipan yang ditulis telah disebutkan sumbernya di dalam daftar pustaka. Apabila di kemudian hari ada pengaduan dari pihak lain karena didalam skripsi ini ditemukan plagiat karena kesalahan saya sendiri, maka saya bersedia menerima sanksi apapun oleh Program Studi Farmasi Fakultas Farmasi Universitas Sumatera Utara, dan bukan menjadi tanggung jawab pembimbing.
Demikianlah surat pernyataan ini saya perbuat dengan sebenarnya untuk dapat digunakan jika diperlukan sebagaimana mestinya.
Medan, 05 Agustus 2016 Yang membuat pernyataan,
SPEKTROFOTOMETRI SERAPAN ATOM
ABSTRAK
Ubi jalar (Ipomoea batatas (L.) Lam.) mulai menyebar ke seluruh dunia terutama negara-negara beriklim tropik diperkirakan pada abad ke-16. Sifat pertumbuhan ubi jalar yang lebih toleran terhadap penyakit, hama, serta dapat dipanen beberapa kali dalam setahun menyebabkan penanaman ubi jalar hampir meluas disemua provinsi di Indonesia. Namun, selama ini penggunaan ubi jalar di Indonesia hanya sebatas pada umbinya saja. Padahal pada daun ubi jalar banyak mengandung vitamin, mineral, dan nutrisi lainnya yang sebanding dengan bayam. Bahkan kandungan kalsium, besi, dan karoten pada daun ubi jalar lebih tinggi dibandingkan dengan sayuran utama lainnya. Kalsium dan besi merupakan mineral yang sangat dibutuhkan oleh tubuh. Tujuan penelitian ini adalah untuk penentuan kadar kalsium dan besi yang terkandung pada daun ubi jalar.
Penelitian ini dilakukan pada daun ubi jalar berdasarkan perbedaan warna umbinya, yakni pada daun ubi jalar berumbi ungu, kuning, dan putih. Penelitian dilakukan secara analisis kualitatif dan kuantitatif. Analisis kualitatif dilakukan menggunakan pereaksi H2SO4 untuk kalsium, dan pereaksi amonium tiosianat untuk besi. Sedangkan analisis kuantitatif dilakukan secara spektrofotometri serapan atom pada panjang gelombang 422,7 nm untuk kalsium dan 248,3 nm untuk besi.
Hasil penetapan kadar kalsium pada daun ubi jalar berumbi ungu, kuning, dan putih diperoleh 195,0471 ± 4,2502 mg/100 g; 175,5887 ± 1,9878 mg/100 g, dan 323,5381 ± 6,7880 mg/100 g. Sedangkan untuk kadar besinya diperoleh 8,7159 ± 0,2310 mg/100 g; 15,0092 ± 0,7342 mg/100 g, dan 29,9219 ± 0,8979 mg/100 g. Daun ubi jalar berumbi putih mengandung kadar kalsium dan besi yang lebih tinggi dibandingkan dengan daun ubi jalar berumbi ungu dan kuning. Berdasarkan hasil penelitian ini dapat disimpulkan bahwa daun ubi jalar dapat digunakan sebagai bahan pangan alternatif bagi masyarakat karena tingginya mineral bermanfaat yang terkandung di dalamnya.
DETERMINATION OF MINERAL LEVELS OF CALCIUM
AND IRON IN SWEETPOTATO LEAVES (Ipomoea batatas (L.)
Lam.) BY ATOMIC ABSORPTION SPECTROFOTOMETRY
ABSTRACT
The sweet potatoes (Ipomoea batatas (L.) Lam.) began to spread around the world, especially to the tropical countries was predicted in the 16th century. The nature of their growth were more tolerant to disease, pests, and can be harvested several times a year leads to their widespread planting almost in all provinces in Indonesia. However, during this time, the use of sweet potato in Indonesia was limited in tuber only. Though their leaves are rich of vitamins, minerals, and other nutrients that are comparable to spinach. Even the content of calcium, iron, and carotene in sweet potato leaves is higher compared to other major vegetables. Calcium and iron are minerals that are needed by the body. The aim of this research was to determine level of calcium and iron in a sweetpotato leaves.
This research was conducted on the leaves of sweet potato based on the color difference of their tubers, namely the leaves of purple, yellow, and white sweet potato. The research was conducted by qualitative and quantitative analysis. Qualitative analysis was performed using H2SO4 reagent for calcium and ammonium thiocyanate reagent for iron. Quantitative analyzes conducted by atomic absorption spectrophotometry at a wavelength of 422.7 nm for calcium and at 248.3 nm for iron.
The results of the assay of calcium in purple, yellow, and white sweet potato leaves obtained 195.0471 ± 4.2502 mg/100 g; 175.5887 ± 1.9878 mg/100 g, and 323.5381 ± 6.7880 mg/100 g. Whereas the iron content is obtained 8.7159 ± 0.2310 mg/100 g; 15.0092 ± 0.7342 mg/100 g, and 29.9219 ± 0.8979 mg/100 g. The calcium and iron level of white sweet potato leaves were higher than the purple and yellow one. Based on the results it can be concluded that the sweet potato leaves can be used as alternative food because of their high beneficial minerals contained.
Keyword : Sweetpotato Leaves, Calcium, Iron, Atomic Absorption
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
SURAT PERNYATAAN TIDAK PLAGIAT ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR GAMBAR DALAM LAMPIRAN ... xv
DAFTAR LAMPIRAN ... xvi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1.4 Nilai Nutrisi Daun Ubi Jalar ... 6
2.2 Mineral ... 7
2.2.1 Kalsium ... 8
2.2.2 Besi ... 10
2.3 Analisis Kualitatif ... 10
2.4 Spekroskopi Serapan Atom ... 11
2.4.1 Instrumen Spektrofotometer Serapan Atom (SSA) ... 12
2.4.2 Gangguan-Gangguan pada SSA ... 13
2.5 Validasi Metode Analisis ... 15
BAB III METODE PENELITIAN ... 17
3.1 Tempat dan Waktu Penelitian ... 17
3.2 Bahan-Bahan ... 17
3.2.1 Sampel ... 17
3.2.2 Pereaksi ... 17
3.3 Alat ... 18
3.4 Identifikasi Sampel ... 18
3.5 Pembuatan Pereaksi ... 18
3.5.1 Larutan HNO3 (1:1) ... 18
3.5.2 Larutan Asam Sulfat Encer ... 18
3.5.3 Ammonium tiosianat 1,5 N ... 18
3.6 Prosedur Penelitian ... 19
3.6.1 Pengambilan Sampel ... 19
3.6.2 Penyiapan Sampel ... 19
3.6.3 Proses Destruksi Kering ... 19
3.6.5.1 Kalsium ... 20
3.6.5.2 Besi ... 20
3.6.6 Analisis Kuantitatif ... 21
3.6.6.1 Pembuatan Kurva Kalibrasi Kalsium ... 21
3.6.6.2 Pembuatan Kurva Kalibrasi Besi ... 21
3.6.6.3 Penetapan Kadar Kalsium dalam Sampel ... 21
3.6.6.4 Penetapan Kadar Besi dalam Sampel ... 22
3.6.6.5 Perhitungan Kadar Kalsium dan Besi dalam Sampel ... 22
3.6.7 Analisis Data Secara Statistik ... 23
3.6.7.1 Penolakkan Hasil Pengamatan ... 23
3.6.8 Validasi Metode ... 24
3.6.8.1 Kecermatan (Akurasi) ... 24
3.6.8.2 Keseksamaan (Presisi) ... 25
3.6.8.3 Penentuan Batas Deteksi dan Batas Kuantitasi 25
BAB IV HASIL DAN PEMBAHASAN ... 26
4.1 Identifikasi Sampel ... 26
4.2 Analisis Kualitatif ... 26
4.3 Analisis Kuantitatif ... 27
4.3.1 Kurva Kalibrasi Kalsium dan Besi ... 27
4.3.3.3 Batas deteksi dan batas kuantitasi ... 31
BAB V KESIMPULAN DAN SARAN ... 32
5.1 Kesimpulan ... 32
5.2 Saran ... 32
DAFTAR PUSTAKA ... 33
Tabel Halaman 4.1 Hasil Analisis Kualitatif Kalsium dan Besi Daun Ubi Jalar ... 26 4.2 Hasil Analisis Kuantitatif Kalsium dan Besi Daun Ubi Jalar ... 29 4.3 Persen Uji Perolehan Kembali (Recovery) Kalsium dan Besi pada
DAFTAR GAMBAR
Gambar Halaman
Gambar Halaman
1 Daun Ubi Jalar Berumbi Ungu ... 37
2 Daun Ubi Jalar Berumbi Kuning ... 37
3 Daun Ubi Jalar Berumbi Putih ... 38
4 Kristal Kalsium Sulfat pada Daun Ubi Jalar Berumbi Ungu ... 38
5 Kristal Kalsium Sulfat pada Daun Ubi Jalar Berumbi Kuning .... 38
6 Kristal Kalsium Sulfat pada Daun Ubi Jalar Berumbi Putih ... 39
7 Analisis Kualitatif Besi Menggunakan Larutan Ammonium Tiosianat1,5 N ... 39
8 Spektrofotometer Serapan Atom (Hitachi Zeeman-2000) ... 76
9 Tanur (Stuart) ... 76
10 Timbangan Analitik (Boeco Germany) ... 77
DAFTAR LAMPIRAN
Lampiran Halaman
1 Gambar Sampel ... 35
2 Hasil Identifikasi Tanaman ... 37
3 Hasil Analisis Kualitatif Kalsium dan Besi ... 38
4 Bagan Alir Proses Destruksi Kering ... 40
5 Bagan Alir Proses Pembuatan Larutan Sampel ... 41
6 Data Kalibrasi Kalsium dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 42
7 Data Kalibrasi Besi dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r)... 44
8 Hasil Analisis Kadar Kalsium dan Besi pada Daun Ubi Jalar Berumbi Ungu ... 46
9 Hasil Analisis Kadar Kalsium dan Besi pada Daun Ubi Jalar Berumbi Kuning ... 47
10 Hasil Analisis Kadar Kalsium dan Besi pada Daun Ubi Jalar Berumbi Putih ... 48
11 Contoh Perhitungan Kadar Kalsium dan Besi pada Daun Ubi Jalar ... 49
12 Perhitungan Statistik Kadar Kalsium pada Sampel ... 51
13 Perhitungan Statistik Kadar Besi pada Sampel ... 57
14 Rekapitulasi Data Kadar Kalsium Setelah Uji t pada Sampel ... 63
15 Rekapitulasi Data Kadar Besi Setelah Uji t pada Sampel ... 64
16 Hasil Uji Perolehan Kembali Kalsium dan Besi Setelah Penambahan Larutan Standar pada Sampel ... 65
19 Perhitungan Simpangan Baku Relatif (RSD) Kadar Kalsium
dan Besi pada Sampel ... 71 20 Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi
(LOQ) ... 73 21 Tabel Distribusi t ... 75 22 Gambar Spektrofotometer Serapan Atom, Tanur, Timbangan