KEBERADAAN Ganoderma DAN Trichoderma
DI LANTAI HUTAN AKASIA
SAMINGAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Suksesi Fungi dan Dekomposisi Serasah Daun Acacia mangium Willd. dalam Kaitan dengan Keberadaan Ganoderma dan Trichoderma di Lantai Hutan Akasia adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, 3 Juli 2009
Samingan
ABSTRACT
SAMINGAN. Fungal Succession and Decomposition of Acacia mangium willd. Leaf Litters in Relation to Existence of Ganoderma and Trichoderma on Acacia’s Standing Floors, Under Direction of LISDAR I. SUDIRMAN, DEDE SETIADI, ALEX HARTANA and BUDI TJAHJONO
Fungi are an important role in litter decomposition process, because majority of them capable to decompose lignocelluloses of litters. A study of decomposition of Acacia mangium leaf litters by fungi was carried out in HTI Sector Baserah RAPP Riau. Fungal succession and litter decomposition rate in two years’ old of health standing (2S) and Ganoderma attacked standing (2G) were observed for eight months (March to November 2007) using litterbag method. The results showed that after eight months of decomposition, litter weight losses (WL) were low up to 34.61% (k = 0.7 year-1) in 2S and 30.64% (k = 0.51 year-1) in 2G, as well as lignin WL were low up to 20.05% in 2S and 13.87% in 2G and cellulose WL were 16.34% in 2S and 14.71% in 2G. In both standings, the numbers of fungal species were 21 and 20 respectively, while the totals of fungal species were low on March and April dominated by Penicillium, and tends to increase on May to July dominated by Penicillium and Aspergillus, then decrease again on August to November dominated by Trichoderma, Phialophora, and Pythium. The highest diversity indices were found on July in 2S and on November in 2G, while the lowest evenness indices were found on October in 2S and on April in 2G. Fungal communities in three litter layers of two and five years’ old standings (2S, 2G, 5S, 5G) and harvested area (BT) were observed. The results showed that the highest fungal populations were found in 5G followed by 5S, 2S, 2G and BT respectively. Fungal populations were high at L layer in all standings except in BT at F layer due to their height organic contents. The distributions of Trichoderma sp (TBPH isolate) in litter layers of 2S and 2G standings were observed during eight months. The results showed that populations of Trichoderma were fluctuating and the highest population at F layer in both standings followed by H and L layers. Antagonistic ability of Trichoderma sp TBPH against Ganoderma sp (GBR isolate) were tested using PDA and PDA with litter powder (PDAS). This test showed that inhibition percentage of PDAS was lower than those of PDA. The abilities of Ganoderma sp GBR and Trichoderma sp TBPH to decompose 100 g of leaf litters in polybag during six months were observed. The results showed that WL of litters, lignin and cellulose by Ganoderma were low. WL of L and F litters were 3.99% and 4.57% respectively, while WL of L and F lignin were 8.17% and 7.11% respectively, and WL of L and F cellulose were 3.63% and F 2.59% respectively. WL of L and F litters by Trichoderma were 3.20% and 3.20% respectively, while WL of L and F lignin were 3.83% and 3.85% respectively, and WL of L and F cellulose were 2.43% and 3.17% respectively. In addition the growth of Ganoderma was better at PDAS than PDA, therefore L litter layer was suitable for growing Ganoderma.
RINGKASAN
SAMINGAN. Suksesi Fungi dan Dekomposisi Serasah Daun Acacia mangium Willd. dalam Kaitan dengan Keberadaan Ganoderma dan Trichoderma di Lantai Hutan Akasia, Dibimbing oleh LISDAR I. SUDIRMAN, DEDE SETIADI, ALEX HARTANA DAN BUDI TJAHJONO
Fungi berperan penting dalam proses dekomposisi serasah di lantai hutan, karena sebagian besar fungi dapat mendekomposisi senyawa lignoselulosa. Studi dekomposisi serasah daun Acacia mangium oleh fungi telah dilakukan di HTI Sektor Baserah RAPP Riau, bertujuan untuk mengetahui (1) laju dekomposisi serasah A. mangium dan suksesi fungi selama proses dekomposisi pada tegakan dua tahun sehat (2S) dan terserang Ganoderma (2G). (2) komunitas fungi (termasuk Trichoderma dan Ganoderma) yang tumbuh pada tiga lapisan serasah (L, F dan H) pada umur tegakan dua dan lima tahun baik sehat (2S dan 5S) maupun terserang Ganoderma (2G dan 5G) serta pada areal bekas tebangan (BT), dan juga untuk mengetahui keterkaitan kandungan bahan organik serasah dengan populasi fungi, (3) penyebaran Trichoderma sp (isolate TBPH) pada tiga lapisan serasah A. mangium, (4) Kemampuan penghambatannya Trichoderma (isolate TBPH) terhadap Ganoderma sp (isolate GBR) dalam media serasah, dan (5) Kemampuan Ganoderma sp (isolate GBR) dan Trichoderma sp (isolate TBPH) dalam mendekomposisi serasah A. mangium.
diperoleh pada bulan Oktober (E= 0.501) pada 2S dan bulan April (E= 0.560) pada 2G.
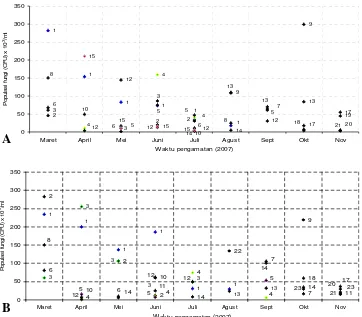
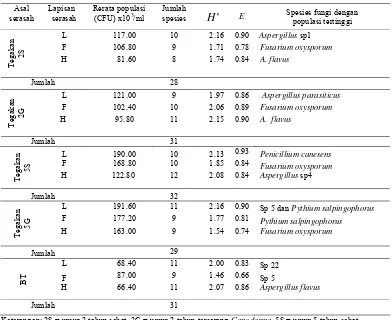
Komunitas fungi diamati dengan cara mengisolasi fungi pada lapisan serasah L, F dan H dari tegakan 2S, 2G, 5S, 5G dan BT dengan metode pengenceran, sedangkan bahan organik serasah dianalisis dengan analisis proksimat. Hasil pengamatan terhadap populasi fungi yang terdapat pada tiga lapisan serasah menunjukkan adanya perbedaan antara tegakan dua dan lima tahun serta bekas tebangan (BT). Rata-rata populasi fungi tertinggi terdapat pada serasah dari tegakan umur lima tahun diikuti tegakan umur dua tahun dan BT. Jika dihubungkan dengan lapisan serasahnya maka semua populasi tertinggi ditemukan pada lapisan L kecuali untuk BT yaitu pada lapisan F dan fungi yang mendominasi lapisan L adalah Aspergillus, Fusarium dan Pythium, sedangkan pada lapisan F di BT didominasi oleh Sp 22. Tingginya populasi fungi pada serasah lapisan L tegakan dua dan lima tahun berkaitan dengan kandungan bahan organik yang dikandungnya, yaitu kandungan serat kasar dan karbohidrat-nya lebih tinggi dibandingkan dengan lapisan F maupun H. Jumlah spesies fungi yang ditemukan di setiap lapisan serasah pada semua tegakan yang diamati jumlahnya hampir sama dengan kisaran 8 sampai 11 spesies. Indeks keanekaragaman fungi tertinggi diperoleh di lapisan L pada 2S (H’= 2.16), 5S (H’= 2.13) dan 5G (H’= 2.16), di lapisan H pada 2G (H’= 2,15) dan BT (H’= 2.07), sedangkan indeks kemerataan spesies fungi yang terendah diperoleh di lapisan L pada 2G (E= 0.86), di lapisan F pada 2S (E= 0.78), 5S (E= 0.84), dan BT (E= 0.66), di lapisan H pada 5G (E= 0.74).
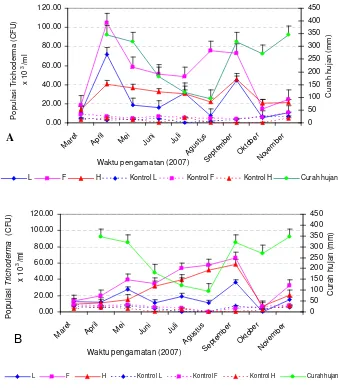
Penyebaran Trichoderma sp. TBPH pada lapisan serasah di 2S dan 2G diamati dengan cara menaburkan inokulum Trichoderma pada lapisan F lalu diamati penyebarannya pada lapisan L, F dan H selama delapan bulan. Kemampuan antagonistik Trichoderma sp. TBPH terhadap Ganoderma sp GBR diuji pada media PDA, PDA yang mengandung serbuk serasah akasia lapisan L (PDAS) dan diuji juga pada media serasah akasia (di dalam kantong plastik). Hasil pengamatan terhadap penyebaran Trichoderma di lapisan serasah menunjukkan bahwa Trichoderma mampu tumbuh dengan baik pada serasah tegakan 2S maupun 2G. Populasi Trichoderma terlihat fluktuatif selama delapan bulan pengamatan dan total populasi yang tinggi selalu terdapat pada lapisan F diikuti oleh lapisan H dan L pada kedua tegakan yang diamati. Hasil pengujian antagonistik Trichoderma terhadap Ganoderma pada media PDA dan PDAS setelah tiga hari pengamatan tidak menunjukkan perbedaan persentase hambatan pada kedua media tersebut (P = 0.13) yaitu masing-masing 29.71% dan 23.73%, tetapi berbeda secara signifikan pada pengamatan tujuh hari setelah inokulasi (P = 0.03) yaitu masing-masing 74.42% dan 64.94%. Hasil pengamatan penghambatan pertumbuhan koloni Ganoderma oleh Trichoderma pada media serasah secara visual terlihat bahwa dua bulan setelah inokulasi, koloni Ganoderma masih tersisa + 50% dan setelah lima bulan masih tersisa + 10% dari luas permukaan media serasah yang terdapat dalam kantong plastik.
g di dalam kantong plastik, menunjukkan bahwa Ganoderma dan Trichoderma mampu tumbuh pada serasah A. mangium dan menyebabkan kehilangan berat serasah, kandungan lignin dan selulosa. Persentase berat serasah L yang hilang didekomposisi oleh Ganoderma sebesar 3.99% dan serasah F 4.57%, sedangkan persentase berat lignin yang hilang dari serasah L 8.17% dan serasah F 7.11%, persentase berat selulosa yang hilang dari serasah L 3.63% dan serasah F 2.59%. Persentase berat serasah L yang hilang didekomposisi oleh Trichoderma hanya sebesar 3.20% dan serasah F 3.10%, sedangkan persentase berat lignin yang hilang dari serasah L 3.83% dan serasah lapisan F 3.85%, persentase berat selulosa yang hilang dari serasah L 2.43% dan serasah lapisan F 3.17%.
Pengujian lama kolonisasi Ganoderma sp GBR pada 100 gram substrat dilakukan pada media serasah dari lapisan L, F dan serbuk gergajian kayu sengon. Selain itu juga dilakukan pengujian pertumbuhan koloni Ganoderma pada media PDA dan PDAS. Hasil pengujian lama kolonisasi Ganoderma sp GBR pada media serasah lapisan L, F dan serbuk gergajian kayu sengon menunjukkan bahwa Ganoderma dapat tumbuh lebih cepat mengkolonisasi seluruh media serasah daun A mangium lapisan L diikuti F dan serbuk gergajian kayu sengon masing-masing 13.45 hari, 15 hari dan 15.5 hari. Hasil pengujian pertumbuhan koloni Ganoderma di dalam media PDA dan PDAS terlihat bahwa setelah tujuh hari inokulasi diameter koloni pada masing-masing media mencapai 4.55 cm dan 8.70 cm. Dengan demikian serasah lapisan L merupakan media yang cocok untuk pertumbuhan koloni Ganoderma.
© Hak cipta milik IPB, tahun 2009 Hak cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
SUKSESI FUNGI DAN DEKOMPOSISI SERASAH DAUN
Acacia mangium Willd. DALAM KAITAN DENGAN
KEBERADAAN Ganoderma DAN Trichoderma
DI LANTAI HUTAN AKASIA
SAMINGAN
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Suksesi Fungi dan Dekomposisi Serasah Daun Acacia mangium Willd. dalam Kaitan dengan Keberadaan Ganoderma dan Trichoderma di Lantai Hutan Akasia
Nama Mahasiswa : Samingan NRP : G361050011
Disetujui
Komisi Pembimbing
Dr. Ir. Lisdar I. Sudirman Prof. Dr. Ir. Dede Setiadi, M.S. Ketua Anggota
Prof. Dr. Ir. Alex Hartana Dr. Ir. Budi Tjahjono, M.Agr. Anggota Anggota
Mengetahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr. Ir. Dedy Duryadi S., DEA Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
PRAKATA
Segala puji dan syukur hanya penulis panjatkan kehadirat Allah Swt Tuhan semesta alam yang maha pemurah dan maha penyayang, atas karuniaNya penulis dapat menyelesaikan penelitian dan penulisan disertasi ini. Salawat dan salam semoga senantiasa tercurah kepada junjungan kita Nabi Muhammad Saw beserta segenap keluarga dan para sahabatnya. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret hingga November 2007 ini ialah Suksesi Fungi dan Dekomposisi Serasah Daun Acacia mangium Willd. dalam Kaitan dengan Keberadaan Ganoderma dan Trichoderma di Lantai Hutan Akasia. Aspek-aspek yang diteliti meliputi suksesi fungi dan dekomposisi serasah daun A. mangium, komunitas fungi pada lapisan serasah A. mangium, penyebaran Trichoderma pada lapisan serasah A. mangium, kemampuan Ganoderma dan Trichoderma dalam mendekomposisi serasah A. mangium
Selama menjalani studi, penelitian dan penulisan disertasi ini, penulis mendapat banyak bantuan, bimbingan dan saran dari berbagai pihak. Oleh karena itu pada kesempatan ini penulis menyampaikan penghargaan dan terima kasih kepada yang terhormat Dr. Lisdar I. Sudirman, Prof. Dr. Ir. Dede Setiadi, M.S., Prof. Dr. Ir. Alex Hartana, dan Dr. Ir. Budi Tjahjono, M.Agr selaku Komisi Pembimbing. Rektor Universitas Syiah Kuala, Dekan FKIP dan Ketua Jurusan Pendidikan Biologi FKIP Universitas Syiah Kuala yang telah memberi izin dan dukungan selama menjalani studi di IPB. Pimpinan IPB dan Sekolah Pascasarjana IPB Bogor, Pimpinan dan Staf Pengajar Program Studi Biologi Sekolah Pascasarjana IPB Bogor. Direktur R&D dan Staf PT Riau Andalan Pulp and Paper di Riau yang memberi izin dan membantu penelitian di lapangan.
Penelitian ini tidak dapat terlaksana tanpa bantuan dana, oleh karena itu penulis menyampaikan terima kasih kepada Dirjen Dikti Depdiknas yang telah memberikan beasiswa BPPS, Direktorat Penelitian dan Pengabdian kepada Masyarakat, Dirjen Dikti Depdiknas yang membiayai penelitian ini melalui hibah Penelitian Fundamental. Gubernur Nanggroe Aceh Darussalam melalui Beasiswa Bantuan NAD. Yayasan Damandiri yang telah memberikan dana untuk penulisan disertasi. Ucapan terima kasih juga penulis sampaikan kepada pimpinan dan staf Laboratorium Biokimia dan Mikrobiologi PSSHB IPB Bogor dan Laboratorium Balai Penelitian Ternak Departemen Pertanian Ciawi Bogor. Kepada Pak Iwa Sutiwa, Endang Rusmalia, dan Rahmat yang membantu kegiatan di Laboratorium, juga kepada Rianza Asfa, S.P. yang membantu pengambilan sampel di lapangan. Kepada teman-teman dari Forum Keluarga Unsyiah di Bogor dan Ikatan Mahasiswa Pascasarjana Aceh yang selalu memberi dukungan moril dan spirituil.
RIWAYAT HIDUP
Penulis dilahirkan di Suka Damai Kabupaten Bener Meriah Nanggroe
Aceh Darussalam pada tanggal 1 Desember 1964 dari Ibu Poniyem dan Ayah H.
Mahadi. Penulis anak pertama dari enam bersaudara. Pada tanggal 9 Maret 1991
penulis menikah dengan Marlianita, SH. dan saat ini telah dikaruniai dua orang
anak yaitu Fatima Zahra (Rara, 17 tahun) dan Afifah Rahmah (Ifah, 9 tahun).
Pada tahun 1977 penulis lulus Pendidikan Dasar di MIN Sukadamai, tahun
1981 lulus Pendidikan Menengah Pertama di MTsN Lampahan dan pada tahun
1984 lulus Pendidikan Menengah Atas di SMA PGRI I Bireuen. Pada tahun 1989
penulis menyelesaikan S1 pada Program Studi Pendidikan Biologi FKIP
Universitas Syiah Kuala Banda Aceh dan pada tahun 1998 penulis menyelesaikan
S2 di Program Studi Biologi Sekolah Pascasarjana Universitas Gadjah Mada
Yogyakarta. Pada tahun 2005 penulis berkesempatan untuk melanjutkan studi S3
di Program Studi Biologi Sekolah Pascasarjana IPB Bogor dengan biaya
pendidikan dari BPPS Dirjen Dikti Depdiknas.
Penulis bekerja sebagai dosen pada Jurusan Pendidikan Biologi FKIP
Universitas Syiah Kuala Banda Aceh sejak tahun 1990 sampai sekarang. Sebuah
artikel berjudul Komunitas fungi pada lapisan serasah Acacia mangium sudah
diterbitkan dalam jurnal ilmiah terakreditasi yaitu Jurnal Agrista Faperta Unsyiah
Volume 12 Nomor 2, Agustus 2008. Artikel lain berjudul Fungal succession and
decomposition of Acacia mangium leaf litters in health and Ganoderma attacked
standings sedang dalam proses penerbitan pada Hayati Journal of Biosciences.
Dua artikel lagi sedang disusun untuk dipublikasikan. Karya ilmiah tersebut
merupakan bagian dari disertasi program S3 penulis.
DAFTAR ISI
Halaman
DAFTAR ISI... iiiii
DAFTAR TABEL... xiiv
DAFTAR GAMBAR... xiii
DAFTAR LAMPIRAN... xvi I. PENDAHULUAN... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
Alur Pemikiran dan Landasan Penelitian... 4
II. TINJAUAN PUSTAKA... 6
Biologi dan Potensi Acacia mangium... 6
Serasah Acacia mangium... 7
Dekomposisi serasah oleh Fungi... 10
Biodegradasi Selulosa ... 11
Biodegradasi Hemiselulosa... 12
Biodegradasi Lignin ... 13
Ganoderma... 15
Gejala penyakit busuk akar yang disebabkan oleh Ganoderma... 17
Trichoderma sebagai agen biokontrol penyakit busuk akar ... 19
III. SUKSESI FUNGI DAN DEKOMPOSISI SERASAH DAUN Acacia mangium... 21
Abstract ... 21
Pendahuluan ... 21
Bahan dan Metode ... 23
Pengambilan serasah dan uji dekomposisi... 23
Analisis serasah setelah dekomposisi ... 24
Isolasi fungi yang berperan dalam dekomposisi serasah ... 27
Analisis Data ... 28
Hasil dan Pembahasan ... 29
Laju dekomposisi serasah ... 29
Populasi fungi ... 33
Simpulan ... 37
IV. KOMUNITAS FUNGI PADA LAPISAN SERASAH Acacia mangium ... 38
Abstract ... 38
Pendahuluan ... 38
Bahan dan Metode ... 40
Waktu dan tempat penelitian... 40
Pengambilan sampel serasah... 40
Isolasi fungi... 41
Analisis bahan organik serasah ... 42
Analisis data ... 42
Hasil dan Pembahasan ... 43
V. PENYEBARAN Trichoderma (ISOLAT TBPH) PADA LAPISAN SERASAH DAUN Acacia mangium DAN KEMAMPUANNYA
MENGHAMBAT PERTUMBUHAN Ganoderma (ISOLAT GBR)... 50
Abstract ... 50
Pendahuluan ... 50
Bahan dan Metode ... 52
Persiapan inokulum Trichoderma sp. TBPH ... 52
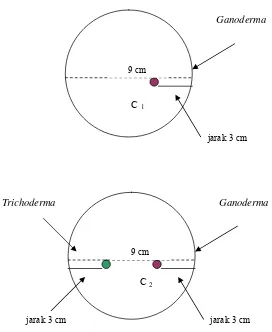
Pengujian penyebaran Trichoderma sp TBPH pada lapisan serasah ... 52
Penentuan populasi Trichoderma sp TBPH... 53
Penumbuhan Trichoderma sp. TBPH pada media serasah secara in vitro54 Pengujian antagonistik Trichoderma sp. TBPH terhadap Ganoderma sp. GBR ... 54
Pengujian antagonistik Trichoderma sp TBPH terhadap Ganoderma sp GBR pada media serasah ... 55
Hasil dan Pembahasan ... 56
Penyebaran Trichoderma spTBPH pada lapisan serasah... 56
Kemampuan antagonistik Trichoderma sp. TBPH terhadap Ganoderma sp. GBR ... 60
Simpulan ... 63
VI. KEMAMPUAN Ganoderma sp. GBR DAN Trichoderma sp. TBPH DALAM MENDEKOMPOSISI SERASAH Acacia mangium... 64
Abstract ... 64
Pendahuluan ... 64
Bahan dan Metode ... 65
Persiapan bibit biakan Ganoderma sp. GBR dan Trichoderma sp. TBPH65 Uji kemampuan Ganoderma sp. GBR dan Trichoderma sp. TBPH dalam mendekomposisi serasah... 66
Hasil dan Pembahasan ... 67
Simpulan ... 73
VII. FUNGI YANG TERDAPAT PADA SERASAH Acacia mangium... 74
Abstract ... 74
Pendahuluan ... 74
Hasil dan Pembahasan ... 76
Simpulan ... 97
VIII. PEMBAHASAN UMUM... 98
IX. SIMPULAN DAN SARAN... 104
Simpulan ... 104
Saran... 105
DAFTAR PUSTAKA... 107
DAFTAR TABEL
Tabel Halaman
Tabel 1 Laju dekomposisi serasah, lignin dan selulosa di bawah tegakan A. mangium umur dua tahun... 30 Tabel 2 Keragaman fungi selama delapan bulan dekomposisi serasah
A. mangium pada tegakan umur dua tahun ... 34 Tabel 3 Populasi fungi pada lapisan serasah A. mangium... 44 Tabel 4 Hasil analisis proksimat serasah A. mangium... 47 Tabel 5 Persentase berat serasah, kandungan lignin dan selulosa yang hilang
DAFTAR GAMBAR
Gambar Halaman
1 Kerangka pemikiran penelitian ... 5 2 Diagram lapisan serasah... 8 3 Struktur umum selulosa ... 11 4 Unit-unit fenilpropan, tiga monomer utama yang merupakan prekusor lignin.13 5 Ganoderma sp ... 16 6 Basidiospora dan basidium Ganoderma lucidum... 17 7 Indikasi serangan Ganoderma dan Phellinus pada A. mangium... 19 8 Persentase berat serasah selama delapan bulan dekomposisi serasah daun A.
mangium pada tegakan umur dua tahun... 29 9 Kandungan lignin dan selulosa selama delapan bulan dekomposisi serasah
daun A. mangium di bawah tegakan umur dua tahun... 30 10 Kandungan air pada serasah selama delapan bulan dekomposisi serasah A.
mangium pada tegakan umur dua tahun... 31 11 Kandungan C dan N selama delapan bulan dekomposisi serasah A.
mangium pada tegakan umur dua tahun... 33 12 Populasi fungi yang ditemukan selama delapan bulan dekomposisi serasah A. mangium pada tegakan umur 2 tahun... 36 13 Frekuensi relatif spesies fungi pada lapisan serasah A. mangium... 45 14 Populasi fungi pada lapisan serasah A. mangium... 46 15 Cara pengujian antagonisme Trichoderma sp TBPH terhadap Ganoderma sp
GBR ... 55 16 Populasi Trichoderma sp. TBPH yang tumbuh pada lapisan serasah A.
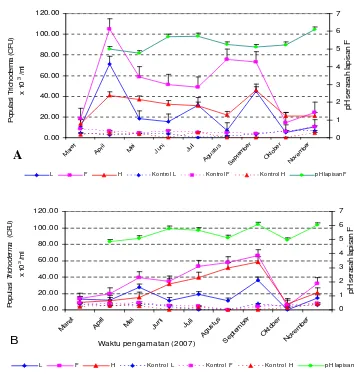
mangium... 57 17 Fluktuasi populasi Trichoderma dan kondisi pH pada lapisan F serasah A.
Mangium... 59 18 Persentase hambatan Trichoderma terhadap Ganoderma pada media PDA
dan media PDAS ... 60 19 Pertumbuhan koloni Ganoderma sp GBR yang dihambat oleh Trichoderma
sp TBPH dalam media serasah A. mangium... 61 20 Interaksi antara Trichoderma dan Ganoderma yang ditumbuhkan pada media
PDA dan PDAS, umur 3 dan 7 hari setelah inokulasi ... 62 21 Tiga mekanisme interaksi antara Trichoderma dan fungi patogen Ganoderma
... 63 22 Persentase berat serasah A. mangium yang didekomposisi oleh Ganoderma sp
GBR dan Trichoderma sp TBPH ... 68 23 Kandungan lignin dan selulosa pada serasah A. mangium yang didekomposisi
oleh Ganoderma sp GBR dan Trichoderma sp TBPH ... 69 24 Keadaan serasah A. mangium setelah didekomposisi oleh Ganoderma sp GBR
dan Trichoderma sp. TBPH ... 71 25 Perbandingan pertumbuhan koloni Ganoderma sp GBR yang ditumbuhkan
dalam media serasah dan serbuk gergajian kayu sengon ... 72 26 Pertumbuhan miselium Ganoderma yang ditumbuhkan pada media PDA dan
27 Pythium intermedium... 77
28 Pythium elongatum... 77
29 Pythium splendens... 78
30 Pythium afertile... 78
31 Pythium salpingophorum... 79
32 Pythium sp 1... 79
33 Pythium sp 2... 80
34 Sp 22 ... 80
35 Penicillium tomii... 81
36 Penicillium canescens... 82
37 Penicillium minioluteum... 82
38 Penicillium sp 4... 83
39 Penicillium sp 6... 83
40 Aspergillus parasiticus... 84
41 Aspergillus flavus... 84
42 Aspergillus fumigatus... 85
43 Aspergillus sp 1 ... 85
44 Aspergillus sp 2 ... 86
45 Aspergillus sp 3 ... 86
46 Aspergillus sp 5 ... 87
47 Aspergillus sp 6 ... 87
48 Aspergillus sp 8 ... 88
49 Aspergillus sp 9 ... 88
50 Trichoderma viride... 89
51 Trichoderma longibrachiatum... 89
52 Trichoderma harzianum... 90
53 Trichoderma piluliferum... 90
54 Trichoderma koningii... 91
55 Fusarium heerosporum... 91
56 Fusarium oxysporum... 92
57 Geotrichum sp ... 92
58 Phialophora richardsiae... 93
59 Sp 5 ... 93
60 Sp 6D... 94
61 Sp 9D... 94
62 Sp 16D... 95
63 Sp 28D... 95
64 Sp 40D... 96
65 Sp 42D... 96
DAFTAR LAMPIRAN
Lampiran Halaman
Lampiran 1 Cara penempatan kantong serasah di bawah tegakan A mangium umur 2 tahun ... 116 Lampiran 2 Diagram cara pelaksanaan pengujian penyebaran Trichoderma pada
Latar Belakang
Serasah daun Acacia mangium Willd. yang berasal dari tegakan
monokultur lebih sukar terdekomposisi, karena keadaan serasahnya yang relatif
seragam dan mengandung lignoselulosa yang tinggi. Akibatnya siklus hara di
lantai hutan menjadi lambat dan pada musim kemarau timbunan serasah tersebut
dapat menjadi salah satu penyebab terjadinya kebakaran hutan. Namun serasah A.
mangium tersebut dapat menjadi substrat yang baik bagi mikrob yang mampu
beradaptasi, karena serasah daunnya mengandung berbagai senyawa seperti
selulosa, hemiselulosa, pati, dan lignin, sebagai sumber energi yang dapat
dimanfaatkan oleh mikrob saprob untuk pertumbuhan dan perkembangannya (Dix
& Webster 1995).
Proses dekomposisi senyawa lignoselulosa pada serasah melibatkan
berbagai mikrob dekomposer, tetapi yang utama adalah fungi (Evan & Hedger
2001). Kelompok fungi yang memiliki kemampuan lignoselulolitik tinggi
umumnya berasal dari fungi pembusuk putih (white rot fungi). Selama proses
dekomposisi, terjadi interaksi antara satu fungi dengan fungi lain. Interaksi
tersebut penting dalam mencapai suatu keseimbangan dinamis dalam suatu
ekosistem, sehingga apabila terjadi ledakan populasi yang berlebihan dari suatu
jenis fungi dapat ditekan oleh jenis fungi lain yang memiliki sifat antagonis.
Sebagai contoh pada lantai hutan A. mangium, Trichoderma bersifat antagonis
terhadap fungi patogen seperti Ganoderma yang merupakan patogen pada hutan
tanaman industri akasia.
Ganoderma selain berperan sebagai dekomposer juga berperan sebagai
patogen terhadap tumbuhan di ekosistem hutan, yaitu penyebab busuk akar pada
A. mangium, baik pada tanaman muda maupun tanaman dewasa. Ganoderma
philippii menyebabkan penyakit busuk akar merah pada A. mangium, sedangkan
Rigidoporus microporus (syn. Fomes lignosus) menyebabkan busuk akar putih
(Nair & Sumardi 2000). Jamur lain seperti Phellinus noxius dapat menyebabkan
Di Indonesia, kerugian yang disebabkan oleh penyakit busuk akar merah
akibat serangan G. philippii pada A. mangium menyebabkan kematian yang tinggi
(sekitar 20%), kematian akan meningkat pada rotasi penanaman kedua dan ketiga
(Old et al. 2000). Pengamatan pada hutan A. mangium, menunjukkan lebih dari
40% kematian pada pohon yang berumur 10 sampai 14 tahun (Lee 2000).
Kerugian akibat serangan busuk akar oleh Ganoderma pada rotasi penanaman
kedua di Sumatera dan Kalimantan mencapai 3% sampai 28% pada pohon yang
berumur tiga sampai lima tahun (Irianto et al. 2006).
Tingginya kerugian tersebut disebabkan karena Ganoderma selain bersifat
saprob juga bersifat parasit fakultatif dengan kisaran inang yang luas (Susanto
2002). Selain itu Ganoderma juga mempunyai kemampuan bertahan di dalam
material berkayu di dalam tanah. Keadaan tersebut membuat fungi ini sukar
dikendalikan terutama pengendalian secara kimia. Pengendalian yang mungkin
dilakukan adalah melakukan pengendalian hayati dengan memanfaatkan
Trichoderma yang mempunyai sifat antagonis terhadap Ganoderma. Pengujian di
laboratorium menunjukkan adanya aktivitas penghambatan yang kuat oleh
Trichoderma terhadap pertumbuhan Ganoderma (Harjono & Widyastuti 2001;
Widyastuti 2006). Namun kenyataan di lapangan, menunjukkan bahwa
pengendalian dengan Trichoderma belum sepenuhnya efektif untuk
menghilangkan atau menekan pertumbuhan Ganoderma pada hutan A. mangium.
PT Riau Andalan Pulp & Paper (RAPP) di Riau sedang menguji coba
pemanfaatan Trichoderma untuk pengendalian Ganoderma. Uji coba yang
dilakukan meliputi seleksi jenis yang efektif serta ketepatan waktu dan frekuensi
aplikasinya. Pengujian tersebut akan efektif jika didukung oleh data ekologi yang
lengkap di lantai hutan A. mangium yaitu dengan mempelajari keanekaragaman
fungi yang tumbuh pada lapisan serasah pada umur yang berbeda baik pada
tegakan yang sehat maupun terserang Ganoderma dan juga pada areal bekas
tebangan. Selain itu proses dekomposisi serasah pada tegakan sehat dan terserang
Ganoderma serta suksesi funginya juga perlu dipelajari untuk melihat
kemungkinan serasah A. mangium sebagai sumber inokulum bagi Trichoderma
dan Ganoderma. Oleh karena itu penelitian tentang suksesi fungi dan dekomposisi
Trichoderma di lantai hutan akasia perlu dilakukan. Penelitian ini penting
dilakukan karena proses dekomposisi serasah A. mangium berjalan sangat lambat
sehingga pada tumpukan serasahnya terbentuk lapisan serasah. Pada setiap lapisan
serasahnya dapat mempunyai iklim mikro yang berbeda sehingga memungkinkan
dihuni oleh jenis fungi yang berbeda pula. Jenis fungi apa saja yang terlibat
selama proses dekomposisi serasah A. mangium dan bagaimana laju
dekomposisinya belum diteliti terutama di RAPP Riau. Informasi yang diperoleh
dari penelitian ini diharapkan dapat mendukung penerapan pengendalian hayati
untuk menanggulangi atau menghindari penyakit yang disebabkan oleh
Ganoderma pada tegakan A. mangium.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui:
1. Besarnya laju dekomposisi serasah A. mangium dan suksesi fungi selama
proses dekomposisi pada tegakan dua tahun sehat dan terserang Ganoderma.
2. Komunitas fungi (termasuk Trichoderma dan Ganoderma) yang tumbuh pada
tiga lapisan serasah A. mangium pada umur tegakan dua dan lima tahun (baik
yang sehat maupun yang terserang Ganoderma) dan pada areal bekas
tebangan.
3. Penyebaran Trichoderma pada tiga lapisan serasah A. mangium.
4. Kemampuan penghambatannya Trichoderma terhadap Ganoderma dalam
media serasah.
5. Kemampuan Ganoderma dan Trichoderma dalam mendekomposisi serasah
A. mangium.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat mengungkapkan secara rinci dan
mendalam tentang suksesi fungi dan perannya dalam proses dekomposisi serasah
A. mangium. Selain itu diharapkan dapat dijadikan sebagai dasar dalam
pengelolaan serasah A. mangium dalam usaha pengendalian Ganoderma dan
sangat besar akibat serangan Ganoderma dapat dikurangi, mengingat A. mangium
merupakan komoditi penting dalam industri kehutanan dan industri kertas.
Alur Pemikiran dan Landasan Penelitian
Penelitian suksesi fungi dan dekomposisi serasah daun A. mangium dalam
kaitan dengan keberadaan Ganoderma dan Trichoderma di lantai hutan akasia
dilakukan dalam empat topik penelitian yaitu:
Penelitian 1:Suksesi fungi dan dekomposisi serasah daun A. mangium, penelitian
ini untuk menjawab permasalahan 1 (Gambar 1)
Penelitian 2: Komunitas fungi pada lapisan serasah A. mangium, penelitian ini
untuk menjawab permasalahan 2 (Gambar 1). Penelitian 1 dan 2 juga
untuk menjawab permasalahan 3.
Penelitian 3: Penyebaran Trichoderma pada lapisan serasah A. mangium dan
kemampuan penghambatannya terhadap Ganoderma, penelitian ini
untuk menjawab permasalahan 4 (Gambar 1)
Penelitian 4: Kemampuan Ganoderma dan Trichoderma dalam mendekomposisi
serasah A. mangium, penelitian ini untuk menjawab permasalahan 5
(Gambar 1)
Penelitian 1 memberikan informasi tentang laju dekomposisi serasah A.
mangium dan jenis fungi yang terlibat serta suksesinya. Penelitian 2 memberikan
informasi tentang keanekaragaman fungi yang tumbuh pada lapisan serasah baik
pada tegakan sehat, terserang Ganoderma, dan areal bekas tebangan. Penelitian 1
dan 2 juga memberikan informasi tentang keberadaan Trichoderma dan
Ganoderma pada serasah A. mangium. Penelitian 3 memberikan informasi tentang
penyebaran Trichoderma pada lapisan serasah di tegakan sehat dan terserang
Ganoderma, juga memberikan informasi tentang kemampuan antagonistik
Trichoderma terhadap Ganoderma pada media yang mengandung serasah A.
mangium. Selanjutnya penelitian 4 memberikan informasi tentang kemampuan
Ganoderma dan Trichoderma dalam mendekomposisi serasah A. mangium.
Berdasarkan informasi yang diperoleh tersebut diharapkan dapat
memformulasikan strategi pengelolaan serasah sebagai alternatif untuk
Keterangan: : faktor-faktor yang diamati dalam penelitian
Gambar 1 Kerangka pemikiran penelitian
Acacia mangium Lantai hutan Serasah daun Dekomposisi Ketersediaan unsur hara Kesuburan tanah Produktivitas meningkat Fungi Dekomposer Patogen Ganoderma Sifat:
- Bertahan pada material berkayu
- Sebaran inang luas Sukar dikendalikan Kerugian:
kematian 3-28% (3-5 th) (Irianto et al. 2006).
Produktivitas menurun
Permasalahan
1. Bagaimana suksesi fungi dan laju dekomposisi serasah
A. mangium di lantai hutan ?
2. Jenis fungi apa saja yang tumbuh pada lapisan serasah A. mangium ?
3. Apakah Trichoderma dan Ganoderma dapat tumbuh pada serasah A. mangium?
4. Bagaimana penyebaran Trichoderma di lapisan serasah A.
mangium dan kemampuan penghambatannya terhadap
Ganoderma?
5. Bagaimana kemampuan Ganoderma dan Trichoderma dalam mendekomposisi serasah? Substrat pertumbuhan fungi Dasar penanganan alternatif ( - ) ( + ) Busuk akar Antagonis Trichoderma Dasar pemanfaatan Data hasil penelitian
Penelitian yang dilakukan
1. Suksesi fungi dan dekomposisi serasah daun A. mangium 2. Mengamati komunitas fungi pada lapisan serasah
3. Penyebaran Trichoderma pada lapisan serasah 4. Kemampuan Ganoderma dan Trichoderma dalam
II. TINJAUAN PUSTAKA
Biologi dan Potensi Acacia mangium
Acacia mangium merupakan spesies tanaman berkayu yang cepat tumbuh,
banyak digunakan untuk program penanaman hutan di wilayah Asia dan Asia
Pasifik. Tanaman ini dapat tumbuh pada daerah yang sangat kering sampai daerah
hutan basah. Acacia mangium dapat tumbuh pada kisaran 0 - 800 meter dpl,
dengan rata-rata curah hujan tahunan 1000-4000 mm, rata-rata temperatur tahunan
18-28o C dengan rata-rata pada musim panas 30-40o C dan pada musim dingin
10-24o C (USDA 2005).
Acacia mangium mempunyai nama lain Racosperma mangium (Willd.)
Pedley. Sedangkan nama dagangnya adalah brown salwood. Klasifikasi tanaman
ini adalah sebagai berikut:
kingdom : Plantae subkingdom : Tracheobionta superdivisi : Spermatophita divisi : Magnoliophita
klas : Magnoliopsida
subklas : Rosidae
ordo : Fabales
famili : Fabaceae
genus : Acacia
species : Acacia mangium Willd. (USDA 2005)
Pohon A. mangium dapat mencapai tinggi 30 meter, batang lurus tidak
bercabang sampai setengah tinggi seluruh batang. Ranting, phillodia dan tangkai
bersifat glabrous atau agak terkelupas. Phillodia lebarnya 5-10 cm, panjang 2-4
kali lebar, berwarna hijau gelap kaku seperti kulit waktu kering. Phillodia
memiliki (3-)4 pertulangan daun utama yang memanjang yang bertemu pada tepi
punggung dari pangkal phillodia, pertulangan sekunder halus dan tidak begitu
terlihat. Bunga berupa bulir yang longgar mencapai panjang 10 cm, soliter atau
berpasangan pada ketiak bagian atas. Bunga pentamer, kelopak mempunyai
panjang 0.6-0.8 mm dengan cuping tumpul pendek, mahkota dua kali panjang
kelopak. Polong lurus, gundul, lebar 3-5 mm, dengan panjang kira-kira 7.5 cm
masak, memipih antar biji-bijinya. Biji berambut halus, hitam, elipsoid, bulat telur
atau memanjang, 3,5 x 2,5 mm, tali pusar berwarna agak oranye, membentuk
arilus berdaging di bagian bawah biji (Starr et al. 2003).
Menurut Duke (1983), akasia menghasilkan eksudat gum pada batangnya.
Gum pada A. mangium mengandung 5.4% abu, 0.98% N, 1,49% metoksil, 32.2%
asam uronat, 9.0% asam 4-0-metilglukouronat, 23.2% asam glukouronat, 56%
galaktosa, 10% arabinosa, dan 2% ramnosa. Sedangkan gum pada A.
auriculiformis mengandung 5.3% abu, 0.92% N, 1.68% metoksil, 27.7% asam
uronat, 10.1% asam 4-0-metilglukouronat, 17.6% asam glukouronat, 59%
galaktosa, 8% arabinosa, dan 5% ramnosa. Acacia mangium dan A. auriculiformis
juga menghasilkan senyawa yang mempunyai aktivitas anti fungi yaitu
3,4’,7,8-tetrahydroxyflavanone dan teracacidin (Mihara et al. 2005).
Produksi kayu A. mangium di Indonesia untuk pulp dan MDF
(medium-density fiberboard) dari hutan tanaman industri adalah: Riau dan Jambi dengan
produksi 5.860.000 m3/tahun, Sumatra Selatan dan Lampung 2.500.000 m3/tahun,
Kalimantan Timur dan Kalimantan Selatan 750.000 m3/tahun, dan Kalimantan
Barat 200.000 m3/tahun. Sedangkan produksi untuk solid wood diperkirakan
mencapai 165.000 m3/tahun. Kegunaan kayu ini utamanya untuk pembuatan pulp
dan paper. Kegunaan lain diantaranya untuk MDF, furniture, fuelwood dan bahan
konstruksi bangunan (Arisman & Hardiyanto 2006). Selain itu serasahnya dapat
digunakan sebagai mulsa tanah, dan juga dapat digunakan sebagai tambahan
makanan ternak sapi. Bunganya dapat sebagai makanan lebah, sehingga dapat
meningkatkan produksi madu (Bui et al. 1992).
Serasah Acacia mangium
Serasah pada lantai hutan umumnya terdiri dari bermacam-macam bagian
tumbuhan yang jatuh ke tanah, yaitu berupa daun, bunga, buah, ranting, dan
cabang. Produktivitas serasah pada suatu ekosistem hutan tergantung pada kondisi
lingkungan, jenis pohon dan umur tegakan. Di hutan tanaman Ubrug, Jatiluhur,
tegakan A. auriculiformis yang berumur lima tahun menghasilkan serasah 10.9
ton/ha. Sedangkan pada umur enam tahun pada tegakan yang sama menghasilkan
Bagian tanaman yang jatuh terlebih dahulu akan berada di bagian paling
bawah atau berada paling dekat dengan permukaan tanah, sedang yang jatuh
kemudian akan berada di atasnya, sehingga terjadi tumpukan serasah dengan
ketebalan tertentu. Ketebalan serasah ini sangat ditentukan oleh keadaan
lingkungan hutan misalnya kerapatan vegetasi, luas kanopi dan kerimbunan
tegakan penyusun hutan tersebut. Seiring dengan perjalanan waktu, pada
tumpukan serasah tersebut terbentuk lapisan-lapisan yang terjadi karena adanya
proses dekomposisi (Gambar 2). Lapisan-lapisan tersebut adalah lapisan L yaitu lapisan serasah bagian atas (yang masih utuh), lapisan F yaitu lapisan serasah bagian tengah yang sebagian sudah terdekomposisi, dan lapisan H yaitu lapisan bagian bawah yang sudah terdekomposisi atau lapisan yang berada pada lapisan
permukaan tanah (Danoff-Burg 2006). Hasil pengukuran tebal lapisan serasah
Acacia mangium di lapangan menunjukkan bahwa pada tegakan umur dua dan
lima tahun ketebalan lapisannya tidak berbeda nyata. Pada tegakan sehat rata-rata
lapisan serasah L, F, dan H masing-masing 3.17 cm, 3.0 cm, dan 2.2 cm,
sedangkan pada tegakan terserang Ganoderma masing-masing 2.5 cm, 2.83 cm,
dan 2 cm.
Gambar 2 Diagram lapisan serasah
Serasah adalah bahan organik yang belum terurai, tetapi yang telah berupa
benda mati, dan terdapat di permukaan tanah (Joetono 1995). Serasah terdiri dari
semua bagian tumbuhan yang mati dan terakumulasi di atas permukaan tanah dan
akan mengalami dekomposisi dengan kecepatan yang berbeda, tergantung dari Lapisan L
Lapisan F
Lapisan H
jenis bagian tumbuhan yang terakumulasi tersebut. Serasah terdekomposisi oleh
aktivitas mikrob dan fauna tanah, sehingga senyawa-senyawa yang kompleks
akan diubah menjadi senyawa-senyawa yang lebih sederhana (Dickinson & Pugh
1974).
Dekomposisi serasah secara biologi akan menghasilkan senyawa-senyawa
yang dapat larut seperti karbohidrat, tanin, peptida, dan asam amino yang
dihasilkan melalui proses hidrolisis pada protein protoplasmik. Selain itu
dihasilkan gas seperti NH3, CO2, juga senyawa lain seperti nitrat, sulfat, pospat
dan air. Sedangkan senyawa-senyawa yang tidak larut yang tersusun dari lignin,
selulosa, hemiselulosa akan berangsur-angsur mengalami dekomposisi menjadi
bentuk-bentuk senyawa baru yang dapat larut. Pada dasarnya semua sisa tanaman
menghasilkan bahan organik yang sama, tetapi berbeda pada kandungan senyawa
yang mudah dan yang sukar terdekomposisi (Allen & Unwin 1982).
Mudah atau sukarnya dekomposisi suatu serasah, tergantung dari zat-zat
yang terkandung di dalam jaringannya. Gula, zat pati, dan protein sederhana akan
lebih mudah terdekomposisi dibandingkan dengan protein kompleks, peptin, dan
hemiselulosa. Sedang selulosa lebih mudah dibanding lignin, resin, tannin, dan
lilin. Organ bagian atas tanaman akan lebih mudah terdekomposisi dibandingkan
dengan bagian akar, dan tanaman yang muda akan lebih mudah terdekomposisi
dari pada tanaman yang lebih tua. Demikian juga serasah hutan campuran akan
lebih mudah terdekomposisi dari pada hutan monokultur (Dickinson & Pugh
1974).
Kecepatan dekomposisi dan aktivitas biologi dari suatu bahan organik juga
ditentukan oleh rasio C:Nnya. Jaringan tumbuhan dengan rasio C:N yang rendah
akan terdekomposisi secara cepat, sedangkan yang memiliki rasio C:N yang
tinggi dekomposisinya lebih lambat. Jika rasio C:N bahan organik lebih besar dari
30, akan terjadi immobilisasi lebih besar dari pada mineralisasi. Jika rasio C:N
bahan organik 15 - 30, immobilisasi sama dengan mineralisasi dan jika rasio C:N
bahan organik lebih kecil dari 15, maka mineralisasi lebih besar dari pada
Dekomposisi serasah oleh Fungi
Keberadaan senyawa penyusun dinding sel tumbuhan seperti selulosa,
hemiselulosa, dan lignin tidaklah terpisah secara sendiri-sendiri, namun satu sama
lain saling terikat membentuk suatu kesatuan yang disebut lignoselulosa (Beguin
& Aubert 1992). Keberadaan senyawa kompleks tersebut di dalam serasah lantai
hutan dapat didegradasi oleh mikrob tanah yang dapat menghasilkan enzim
lignoselulolitik, sehingga dihasilkan senyawa yang lebih sederhana. Di dalam
ekosistem lantai hutan fungi mempunyai peran penting sebagai dekomposer
(Dreisbach 2002).
Selama proses dekomposisi serasah di lantai hutan terjadi pergantian
struktur komunitas (suksesi) fungi dekomposer. Pada tahap awal substrat
ditumbuhi oleh fungi pengkoloni awal (pioneer colonizers) yang umumnya
merupakan fungi ruderal yang mampu beradaptasi dan berkompetisi dalam
memanfaatkan sumberdaya baru terhadap kompetitor lain (Atlas dan Bartha
1993). Pada saat serasah daun jatuh ke tanah, fungi pengkoloni awal merupakan
fungi yang mampu memanfaatkan gula sederhana saja misalnya Cladosporium
herbarum dan Aureobasidium pullulans, bahkan fungi tersebut sering ditemukan
pada daun yang masih segar. Setelah itu akan terjadi kolonisasi secara cepat oleh
fungi tanah yang tergolong genus Penicillium, Humicola, Trichoderma, Fusarium,
Gliocladium, Doratomyces dan dari genus lainnya. Fungi tanah yang mengkoloni
serasah tersebut disebut autochton species. Kebanyakan fungi autochton tersebut
mampu menghidrolisis polisakarida, bahkan spesies tertentu seperti Penicillium
mampu menggunakan tanin sebagai sumber karbon, tetapi fungi lain yang tidak
menghasilkan enzim penghidolisis substrat yang lebih kompleks akan tereduksi.
Selanjutnya kolonisasi akan dilakukan oleh pengkoloni akhir (survivor) yaitu
fungi yang mampu menghidrolisis senyawa kompleks seperti selulosa bahkan
lignin dari substrat serasah sebagai sumber energi utamanya, yaitu
Basidiomycetes dan Ascomycetes (Dix & Webster 1995). Aktivitas dari berbagai
macam fungi terhadap serasah yang ada di lantai hutan akan menghasilkan
senyawa-senyawa yang lebih sederhana dan akhirnya terjadi mineralisasi yang
berhasil mengukur penurunan berat kering serasah A. mangium sebesar 56 %
setelah didekomposisikan selama 18 minggu.
Biodegradasi Selulosa
Selulosa merupakan polimer glukosa dengan ikatan glikosidik β-(1,4)
yang bersifat tidak larut dalam air (Gambar 3). Molekul selulosa membentuk
rantai panjang yang lurus yang diperkuat oleh ikatan hidrogen yang berikatan
silang. Secara alami selulosa tersusun dari bentuk fibril yang terdiri dari beberapa
molekul selulosa paralel dan dihubungkan oleh ikatan hidrogen (Beguin & Aubert
1994). Mikrofibril selulosa terdiri dari dua tipe yaitu kristalin dan amorf. Bagian
kristalin selulosa merupakan mikrofibril yang banyak memiliki jembatan hidrogen
antar molekul dengan orientasi antar mikrofibril yang sangat teratur. Mikrofibril
yang sedikit memiliki jembatan hidrogen dengan orientasi antar mikrofibril yang
tidak teratur merupakan bagian amorf selulosa (Marsden & Gray 1986).
Gambar 3 Struktur umum selulosa (Zabel & Morrell 1992)
Analisis difraksi sinar-X menunjukkan bahwa selulosa alami umumnya
berstruktur kristalin, sedang analisis dengan spektroskopi inframerah
menunjukkan bahwa beberapa gugus hidroksil bebas yang saling berikatan dengan
lignin melalui ikatan kovalen membentuk lignoselulosa yang kuat sehingga sulit
dihidrolisis oleh enzim (Fengel & Wegener 1995).
Enzim yang mendegradasi selulosa adalah selulase, merupakan enzim
kompleks yang terdiri dari tiga komponen yaitu: (1) ekso β (1-4)-glukanase,
dikenal sebagai enzim C1 berperan dalam hidrolisis selulosa kristalin menjadi
selulosa amorf; (2) endo β (1-4)-glukanase, dikenal sebagai enzim Cx berperan
dalam hidrolisis ikatan β-(1-4)-glikosida selulosa amorf menjadi selobiosa; dan
(3) β (1-4)-glukosidase, berperan dalam hidrolisis selobiosa menjadi glukosa
(Wirahadikusumah et al. 1995; Smith et al. 1983). Urutan reaksinya adalah
C1 Cx β (1-4)-glukosidase selulosa kristalin selulosa amorf selobiosa terlarut glukosa
Fungi Phanerochaete chrysosporium mampu menghasilkan lima β 1-4 glukanase yang memiliki berat molekul berbeda dan masing-masing bekerja aktif
pada suhu optimumnya. Penicillium pinophilum mampu menghasilkan
endoglukanase jika diinkubasikan dalam media yang mengandung selulosa.
Trichoderma viride paling sedikit dapat menghasilkan empat β 1-4 selobiohidrolase. Sedangkan T. reesei menghasilkan lima endoglukanase, satu
eksoglukanase dan dua β 1-4 glukosidase (Dix & Webster 1995; Evans & Hedger
2001).
Biodegradasi Hemiselulosa
Hemiselulosa merupakan polimer yang sangat heterogen, yaitu
polimer-polimer heksosa, pentosa dan asam-asam uronat. Silosa dan manosa merupakan
unit yang sering ditemukan. Molekul hemiselulosa umumnya mempunyai rantai
yang relatif lebih pendek dari selulosa, berbentuk non kristalin dan dapat
dihidrolisis menjadi silosa dan pentosa lainnya. Selain itu hemiselulosa mudah
larut dalam larutan alkali dan pada air mendidih. Senyawa ini juga larut dalam
asam yang panas, dihidrolisis menjadi pentosa dan heksosa. Hemiselulosa
berikatan dengan selulosa dan lignin melalui jembatan hidrogen dan gaya van der
Waals (Marsden & Gray 1986).
Enzim yang mendegradasi hemiselulosa analog dengan enzim yang
mendegradasi selulosa tetapi enzim eksonya tidak ada. Silan didegradasi oleh
enzim silanase, sedang mannan didegradasi oleh enzim mannase (Zabel &
Morrell 1992). Silanase merupakan enzim kompleks yang terdiri dari: (1)
endo-1,4-β-silanase yang memisahkan polimer menjadi silosa dan oligomer; (2) 1,4-β
silosidase yang menghidrolisis silo-oligoskarida atau fragmen silan menjadi
silosa; (3) α-glukuronidase, memisahkan rantai samping 4-O-metilglukuron dari
kerangka silan dan melepaskan unit asam glukoronat; (4) α-arabinosidase,
memindahkan rantai samping L-arabinosa; dan (5) asetil esterase, memindahkan
kelompok substituen asetil dari silosa. Sedangkan enzim mannase terdiri dari:
esterase. Namun demikian aksi enzim tersebut sama dengan enzim silanase (Zabel
& Morrell 1992).
Fungi yang telah diidentifikasi mempunyai aktivitas silanase diantaranya
Mucor, Mortierella dan Rhizopus (Dix & Webster 1995). Fungi lain yang
menghasilkan silanase adalah Phytophthora, Glomerella cingulata, sedangkan
Aspergillus oryzae selain menghasilakan silanase juga menghasilkan arabanase.
Chaetomium globosum menghasilkan mannase (Bilgrami & Verma 1978).
Biodegradasi Lignin
Lignin merupakan polimer yang amorf dengan berat molekul tinggi.
Lignin terbuat dari unit-unit fenilpropan yaitu: ρ-koumaril alkohol, koniferil
alkohol, dan sinafil alkohol (Gambar 4). Keberadaan masing-masing unit
fenilpropan tergantung dari sifat dan jenis tanaman (Stevensen 1982). Umumnya
monomer-monomer lignin tersebut memiliki substituen-substituen hidroksi dan
metoksi yang tidak diikat dengan cara yang sama, baik inter maupun intra
monomer (Knapp 1985).
C H C H C H2O H
O H
C H C H C H2O H
O H
O C H3
C H C H C H2O H
O H
O C H3
C H3O
ρ-koumaril alkohol koniferil alkohol sinafil alkohol
Gambar 4 Unit-unit fenilpropan, tiga monomer utama yang merupakan prekusor lignin (Crawford 1981)
Lignin terbentuk secara polikondensasi. Pembentukannya tidak melibatkan
enzim-enzim khusus, tetapi merupakan reaksi-reaksi kimia yang melibatkan fenol
dan radikal bebas, sehingga bahan yang terbentuk tidak menunjukkan adanya
menyebabkan lignin lebih sukar terdegradasi dibandingkan dengan selulosa dan
hemiselulosa (Joetono 1995).
Enzim yang mendegradasi lignin juga merupakan enzim kompleks, yang
terdiri dari lignin peroxidase (LiP), manganese peroxidase (MnP), dan lakase.
Enzim-enzim tersebut diproduksi aktif pada keadaan oksigen yang cukup
(Rothschild et al. 1995; Fukushima & Kirk 1995). Lignin peroxidase (LiP)
merupakan enzim kunci dalam mendegradasi lignin pada Phanerochaete
chrysosporium. Enzim ini memecah atau memutuskan ikatan kimia Cα-Cβ antar
karbon pada unit fenilpropan. Manganese peroxidase (MnP) merupakan enzim
utama yang terlibat dalam degradasi lignin oleh Polyporus anceps. Enzim ini
diduga mengoksidasi Mn2+ menjadi Mn3+ yang kemudian mengoksidasi beberapa
struktur fenolik pada lignin. Sedangkan lakase merupakan enzim yang
menyebabkan terjadinya oksidasi Cα, dimetilisasi, pemecahan kelompok fenil, dan
pemecahan ikatan Cα-Cβ pada struktur siringil (Zabel & Morrell 1992).
Hasil pemecahan lignin tersebut berupa senyawa aromatik yang memiliki
berat molekul rendah seperti: vanilin, siringaldehid, koniferil aldehid, asam
vanilat, asam siringat, dan asam aromatik atau fenol lainnya. Senyawa-senyawa
tersebut akan diubah menjadi senyawa aromatik lain berupa katekol, asam
protokatekoat dan asam gentisat, merupakan senyawa dengan struktur aromatik
yang mudah diputus menjadi senyawa alifatik. Selanjutnya senyawa-senyawa
alifatik yang dihasilkan tersebut diubah menjadi senyawa-senyawa antara yang
mudah dimetabolismekan seperti asam piruvat, asam fumarat, asam suksinat,
asam asetat, dan asetildehid (Zabel & Morrell 1992, Crawford 1981; Joetono
1995). Di dalam tanah, hasil perombakan lignin tersebut dapat mengalami
kondensasi yang akan menghasilkan humat (humic) di dalam tanah (Stevenson
1982).
Pada umumnya fungi yang mampu mendegradasi lignin berasal dari fungi
pelapuk putih (white rot fungi). Phanerochaete chrysosporium adalah fungi yang
paling banyak dipelajari sebagai penghasil enzim lignin peroksidase dan lakase.
Trametes versicolor dan fungi pembusuk putih lainnya juga dideteksi
menghasilkan lignin peroksidase. Sedangkan Dichomitus squalens (Polyporus
Fungi pelapuk coklat (brown rot fungi) yang mampu tumbuh pada media yang
mengandung lignin antara lain Gloeophyllum trabeum, Neolentinus (Lentinus)
lepideus, dan Pholiota adiposa (Zabel & Morrell 1992). Pleurotus ostreatus dapat
tumbuh baik pada jerami, selain itu Fusarium dan Aspergillus ternyata dapat
tumbuh dengan baik dalam medium sintetik yang mengandung lignin (Dix &
Webster 1995).
Ganoderma
Ganoderma termasuk Basidiomycetes kosmopolit yang menyebabkan
busuk akar pada tumbuhan kayu keras dengan mendekomposisi lignin, selulosa
dan polisakarida lain. Fungi ini akan berkembang dengan cepat pada tanaman
monokultur yang ditanam berturut-turut, karena pada tunggul kayu, akar, dan
material berkayu lainnya dari periode sebelumnya tersimpan inokulum yang
sangat banyak (Old et al. 2000). Selain itu Ganoderma juga mempunyai bentuk
pertahanan seperti klamidospora (Susanto 2002), sehingga menjadi masalah besar
karena serangannya semakin luas pada periode tanam kedua dan ketiga
(Widyastuti 2006). Penanganan terpadu untuk memberantas penyakit tersebut
dengan mempertimbangkan keadaan lingkungan penting untuk dilakukan.
Kerugian akibat serangan penyakit busuk akar dapat mecapai 3%-28% pada
pohon yang berumur 3-5 tahun di Sumatera dan Kalimantan (Irianto et al. 2006).
Spesies Ganoderma yang menyebabkan busuk akar merah pada tanaman akasia
adalah G. philippii (= G. pseudoferreum) (Lee 2000). Spesies lain dari
Ganoderma yang menyebabkan busuk pangkal batang tanaman kelapa sawit
adalah G. boninense (Abadi et al. 1989).
Ganoderma termasuk dalam kelompok fungi pelapuk putih (white rot
fungi) yang mampu mendegradasi lignin dengan sistem enzim pengoksidasi fenol
seperti polifenoloksidase, lakase, dan tirosinase. Peneliti lain menyebutkan enzim
yang berperan dalam perombakan lignin adalah lignin peroxidase (LiP),
manganese peroxidase (MnP) dan lakase (Harvey et al. 1993). Beberapa spesies
Ganoderma, selain menghasilkan enzim-enzim di atas juga menghasilkan enzim
amilase, ektraseluler oksidase, invertase, koagulase, protease, renetase, pektinase,
Oleh karena Ganoderma mampu mendegradasi lignin dan selulosa, maka
fungi ini diduga mampu tumbuh dan berkembang pada serasah A. mangium yang
mempunyai kandungan lignin dan selulosa tinggi. Penelitian tentang keberadaan
Ganoderma pada serasah sangat sedikit dilakukan, sebagian besar peneliti lebih
menekankan pada aspek patologisnya.
Menurut Pegler (1973); Seo dan Kirk (2000) Ganoderma termasuk dalam
famili Ganodermataceae dengan ciri-ciri sebagai berikut: merupakan kelompok
fungi tahunan yang mempunyai basidiokarp bertangkai atau tidak bertangkai, dan
mempunyai kulit luar yang keras. Himenofor selalu berbentuk tabung dan pada
umumnya tersusun dalam beberapa lapisan. Konteks berwarna coklat muda
sampai coklat tua, atau coklat keungu-unguan dengan tekstur bergabus sampai
berkayu. Sistem hifa dimitik atau trimitik dengan hifa skeletal yang sering
bercabang di bagian ujungnya, serta dengan hifa generatif yang mempunyai
sambungan apit (Gambar 5). Basidium memproduksi empat basidiospora dan
tidak ada seta ataupun sistidium. Basidiospora berbentuk bola sampai elips,
berwarna coklat atau coklat muda. Struktur dinding basidiospora sangat kompleks
dengan eksoepisporium berpigmen dan bergerigi serta dilapisi oleh perisporium
[image:33.612.217.424.432.639.2]hialin (Gambar 6).
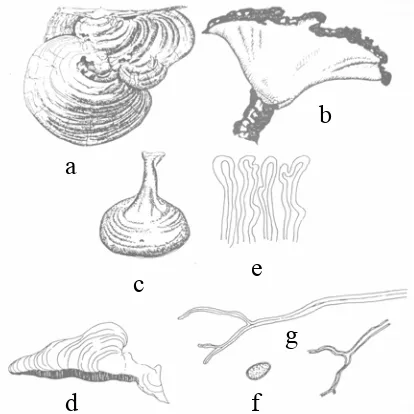
Gambar 5 Ganoderma sp (Hood 2006)
a, b dan c. permukaan bagian atas basidiocarp G. australe, G. steartanum dan
G. cupreum, d. potongan basidiocarp Ganoderma sp, e. sayatan permukaan atas basidiokarp, f. basidiospora dan g. hifa skeletal
a
b
c
d
e
g
Gambar 6 Basidiospora dan basidium Ganoderma lucidum (Seo & Kirk 2000)
a dan b. basidiospora (tanda panah), c dan d. basidium (tanda panah)
Gejala penyakit busuk akar yang disebabkan oleh Ganoderma
Fungi yang termasuk dalam Basidiomycetes biasanya hidup sebagai
saprob endemik yang secara alami menyebabkan sedikit masalah. Pada waktu
lahan dibuka untuk perkebunan, fungi ini dapat hidup pada sisa-sisa akar, tunggul
pohon, dan sampah-sampah berkayu lainnya pada tanah. Fungi ini tergantung
pada sumber makanan yang banyak untuk aktivitas patogeniknya dan bertahan
pada kayu yang mati. Selanjutnya dapat menjadi aktif dan berupa parasit virulen
dengan menginfeksi pohon hidup melalui akarnya. Kemampuan patogen akar ini
untuk menembus dan berkoloni pada sistem akar sangat tergantung pada
kesehatan dari pohon yang diserang (Old et al. 2000). Ganoderma sp. biasanya
menyerang pohon yang kesehatannya kurang baik, sementara Rigidoporus
lignosus menyebar melalui tanah dengan rizomorfnya. Sedangkan Phellinus
noxius tergantung pada kontak antara akar inang yang sehat dengan substrat
tempat fungi itu tumbuh (Nandris et al. 1987).
a
b
Pada areal tegakan akasia yang terserang penyakit busuk akar ditandai
dengan adanya pohon mati dan pohon yang sedang mengalami kematian yang
terlihat dari udara seperti lingkaran. Daun pohon yang terinfeksi biasanya hijau
pucat, ukurannya mengecil karena kekurangan air dan mineral. Kecepatan
tumbuhnya juga menurun. Pucuk muda menjadi layu dan beberapa pohon yang
mengalami cekaman ini dapat menghasilkan buah dan biji di luar musim. Pada
fase selanjutnya dari penyakit busuk akar, pohon akan sangat peka terhadap
hembusan angin. Berdasarkan warna akar yang terinfeksi, penyakit busuk akar
yang menyerang akasia dibedakan menjadi empat macam yaitu busuk akar merah
dan busuk akar coklat, dan yang kurang umum busuk akar putih dan busuk akar
hitam (Old et al. 2000).
Pada penyakit akar merah, akar ditutupi oleh suatu miselium menyerupai
kulit (rizomorf coklat kemerahan yang berkerut), yang tampak pada saat akarnya
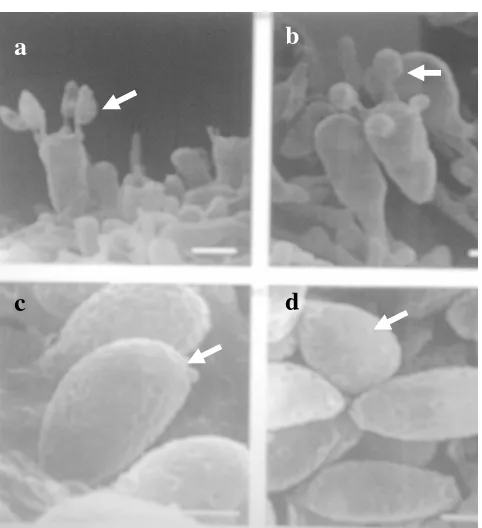
tercuci dari tanah yang menempel (Gambar 7 a). Suatu pola bintik-bintik putih
terjadi pada bagian bawah kulit batang yang terinfeksi. Pada fase awal infeksi
kayunya tetap keras dan tidak ada perubahan warna yang nyata, tetapi pada fase
selanjutnya kayu menjadi pucat dan berkerak atau kering, tergantung kondisi pada
tanah. Keadaan ini merupakan tipe yang umum dari penyakit akar yang diamati
pada perkebunan A. auriculiformis, A. crassicarpa, dan A. mangium yang
berasosiasi dengan Ganoderma spp., terutama G. philippii (Lee & Noraini Sikin
1998).
Berdasarkan observasi di PT RAPP Riau, serangan oleh Ganoderma pada
A. mangium akan lebih mudah diamati apabila tubuh buahnya telah tumbuh pada
batang. Indikasinya adalah di balik kulit batang yang mati warna kayunya putih
atau krem polos (Gambar 7 b). Hal ini penting diketahui untuk membedakan
akibat serangan oleh fungi lain misalnya Phellinus. Indikasi yang khas dari
Phellinus ialah dibalik kulit batang yang mati tampak bentuk pola garis hitam
a
[image:36.612.174.472.80.370.2]b c
Gambar 7 Indikasi serangan Ganoderma dan Phellinus pada A. mangium
Keterangan :
a. Indikasi serangan Ganoderma pada akar, menunjukkan adanya warna merah pada akar (Old et al. 2000).
b. Indikasi serangan Ganoderma pada batang, tidak adanya pola berwarna coklat (polos) sebagai akibat aktivitas fungi
c. Indikasi serangan Phellinus pada batang, adanya pola berwarna coklat sebagai akibat aktivitas fungi (Gambar b dan c hasil observasi di PT RAPP Riau 2006)
Trichoderma sebagai agen biokontrol penyakit busuk akar
Trichoderma merupakan salah satu fungi tanah yang dominan dan
mempunyai variasi habitat yang luas. Sebagai organisme saprob yang memilki
pertumbuhan cepat, Trichoderma dapat berkompetisi secara ekologis dalam waktu
yang lama dan mampu mengkolonisasi berbagai substrat yang ada di lantai hutan.
Interaksi antagonis antara Trichoderma dengan fungi lain, secara
tradisional diklasifikasikan sebagai antibiosis, mikoparasitisme dan kompetisi
(Widyastuti 2006). Antibiosis terjadi ketika antagonisme antara dua fungi, fungi
yang satu menguasai yang lainnya dengan cara menghasilkan antibiotik.
kompetisi terjadi ketika dua atau lebih mikroorganisme membutuhkan lebih
banyak sumberdaya dari pada yang tersedia. Dalam interaksi antagonis tersebut
antibiosis maupun mikoparasitisme mungkin juga melibatkan kompetisi dalam hal
nutrisi (Ghisalberti & Sivasithamparan 1991).
Kemampuan antagonistik Trichoderma telah diujikan terhadap beberapa
patogen tanaman seperti Ganoderma spp., Rigidoporus microporus, Rhizoctonia
spp., Fusarium sp., dan Sclerotium rolfsii. Hasilnya menunjukkan bahwa
Trichoderma secara efektif dapat menekan pertumbuhan fungi patogen secara in
vitro dan di rumah kaca (Widyastuti 2006). Mekanisme pengendaliannya terjadi
dengan cara membelit atau tumbuh di sepanjang hifa inang dan membentuk
struktur semacam kait yang membantu penetrasi ke dalam dinding sel inang (Chet
et al. 2004). Penetrasi dinding sel inang oleh Trichoderma dilakukan dengan
enzim pendegradasi dinding sel fungi yang dimilikinya seperti kitinase,
glukanase, dan protease, selanjutnya menggunakan isi hifa inang sebagai sumber
makanan (Kredics et al. 2003; Harjono & Widyastuti 2001). Tiga spesies
Trichoderma juga telah diuji efektivitasnya terhadap penekanan pertumbuhan
Ganoderma pilippii yang diisolasi dari berbagai macam pohon. Hasilnya
menunjukkan Trichoderma reesei paling efektif sebagai mikoparasit diikuti oleh
T. koningii dan T. harzianum (Widyastuti 2006).
Dalam hal kemampuan Trichoderma mendekomposisikan serasah A.
mangium, pengujian telah dilakukan di lapangan oleh Rohiani (1996), hasilnya
menunjukkan bahwa Trichoderma viride dapat menurunkan rasio C:N antara 20
sampai 30% dalam waktu 8 minggu. Konsentrasi inokulum yang efektif dalam
mendekomposisikan serasah A. mangium adalah 40% dari berat serasah untuk
umur tegakan 2 dan 3 tahun, sedangkan untuk umur 6 tahun cukup dengan 10%
III. SUKSESI FUNGI DAN DEKOMPOSISI SERASAH DAUN
Acacia mangium
Abstract
Leaf litters of Acacia mangium play an important functional role in ecosystem, producing sources of nutrients and giving diversity of microorganisms. Understanding the variation in fungal populations in A. mangium forest is important due to the roles of fungi in regulating populations of other organisms and ecosystem processes. For these purposes, the tests were conducted under two years’ old of health standing (2S) and Ganoderma attacked standing (2G) using litterbag method. Litter weight losses (WL) and lignin, cellulose, C, N contents were measured each month during eight months of decomposition, as well as fungal community involved was observed. After eight months of decomposition, litter WL were low up to 34.61% (k = 0.7 year-1) in 2S and 30.64% (k = 0.51 year-1) in 2G, as well as lignin WL were low up to 20.05% in 2S and 13.87% in 2G and cellulose WL were 16.34% in 2S and 14.71% in 2G. In both standings, the numbers of fungal species were 21 and 20 respectively, while the totals of fungal species were low on March and April dominated by Penicillium, and tends to increase on May to July dominated by Penicillium and Aspergillus, then decrease again on August to November dominated by Trichoderma, Phialophora, and Pythium. The highest diversity indices were found on July in 2S and on November in 2G, while the lowest evenness indices were found on October in 2S and on April in 2G.
Key words: Fungal succession, decomposition, leaf litters, A. mangium
Pendahuluan
Kandungan kimia serasah daun terdiri dari komponen struktural dinding
sel tumbuhan berupa hemiselulosa, selulosa, dan lignin, sehingga konsentrasi
karbonnya lebih besar dari pada nutrient lainnya. Aliran bahan organik tersebut
dalam memasuki subsistem tanah di dalam ekosistem hutan dapat terjadi melalui
proses dekomposisi. Tingkat dekomposisi serasah dapat dipengaruhi oleh tiga
faktor utama, yaitu fisika-kimia lingkungan, populasi decomposer, dan kualitas
bahan organik serasah yang terdekomposisi. Namun jika tidak
mempertimbang-kan kondisi lingkungan, maka kualitas bahan organik serasah sangat menentumempertimbang-kan
tingkat dekomposisinya (Sariyildiz 2003).
Perbedaan iklim dan kualitas bahan organik serasah dapat menyebabkan
komposisi komunitas fungi sebagai decomposer juga akan berbeda. Dekomposisi
di daerah tropis lebih cepat dibandingkan dengan daerah beriklim sedang. Sebagai
contoh di daerah tropis dekomposisi serasah daun Pheonix hanceana berlangsung
selama 12 bulan, Saccarum officinarum 14 bulan dan Ananas comasus dua tahun.
Sedangkan pada daerah beriklim sedang massa daun Fagus crenata
terdekomposisi 50% selama 13 tahun dan daun Pteridium aquilinum akan
terdekomposisi 90% setelah 11 sampai 23 tahun (Tang et al. 2005).
Penelitian Schmit et al. (1999) selama tiga tahun di hutan oak diperoleh
177 spesies fungi yaitu 30 spesies tumbuh pada serasah, 79 tumbuh pada kayu, 36
ektomikoriza dan 29 non mikoriza yang tumbuh di tanah. Sedangkan Osono dan
Takeda (2002) mengungkapkan kemampuan 79 isolat fungi dalam
mendekomposisi serasah pada hutan cool temperate deciduous di Jepang yaitu
enam isolat Basidiomycetes menyebabkan penurunan berat 15.1% sampai
57.67%, 14 spesies Xylaria dan Geniculosporium menyebabkan penurunan antara
4.0% - 14.4%. Isolat lainnya dari Ascomycetes dan Zygomycetes menyebabkan
penurunan berat yang rendah. Dalam penelitian tersebut juga terungkap bahwa
enam spesies dari Basidiomycetes dan semua Xylaria menunjukkan aktivitas
pemutihan (bleaching) pada serasah daun dan meyebabkan dekomposisi lignin
dan karbohidrat.
Serasah daun A. mangium mengandung senyawa lignoselulosa yang tinggi
karena daunnya yang berupa Phyllodium. Selama proses dekomposisi serasah di
lantai hutan terjadi pergantian komunitas fungi dekomposer. Pada tahap awal,
hanya fungi yang mampu memanfaatkan gula sederhana saja yang mampu
mengkoloni serasah, setelah itu akan terjadi kolonisasi secara cepat oleh fungi
tanah yang mampu mendegradasi senyawa lignoselulosa yang dikandung serasah
(Dix & Webster 1995). Penelitian tentang dekomposisi serasah daun A. mangium
sudah pernah dilakukan terutama di hutan tanaman industri (Hardiyanto et al.
2004; Siregar et al. 1999; dan Setiawan 1993), namun penelitian tentang suksesi
fungi selama dekomposisi serasah A. mangium belum pernah dilakukan baik pada
tegakan yang sehat maupun yang terserang Ganoderma. Pada studi pendahuluan
Curvularia sp., Cladosporium sp., Trichoderma sp., Phaecilomyces sp.,
Diamargaris sp., dan Botrytis sp. (Samingan & Sudirman 2008)
Tujuan penelitian ini untuk mengetahui besarnya laju dekomposisi serasah
A. mangium di bawah tegakan umur dua tahun yaitu pada tegakan yang sehat dan
terserang Ganoderma. Selain itu untuk mengetahui jenis fungi yang berperan
dalam dekomposisi dan suksesinya selama proses dekomposisi serasah.
Bahan dan Metode Pengambilan serasah dan uji dekomposisi
Penelitian dilakukan dari bulan Maret sampai dengan November 2007, di
Hutan Tanaman Industri Acacia mangium PT Riau Andalan Pulp & Paper (RAPP)
Riau yaitu di areal Trial Research and Development PT RAPP Sektor Baserah di
Kecamatan Kuantan Hilir Kabupaten Kuantan Singingi. Sebelum dilakukan
pengujian terlebih dahulu dilakukan pengumpulan serasah A. mangium dengan
cara mengumpulkan serasah sebanyak + 10 kg. Serasah yang dikumpulkan adalah
serasah yang baru jatuh di lantai hutan, yang masih segar dan belum kering.
Selanjutnya serasah dikeringkan dengan sinar matahari sampai beratnya tinggal +
50%. Kemudian serasah dipotong-potong dengan ukuran + 3 x 5 cm. Sebanyak
50 gram serasah ditempatkan di dalam kantong jaring nilon ukuran 20 x 20 cm
(ukuran mess 1 mm).
Pengujian laju dekomposisi dilakukan di lantai hutan tegakan umur dua
tahun pada dua tegakan yang berbeda yaitu tegakan yang sehat (2S) dan tegakan
yang terserang oleh Ganoderma (2G) tepatnya di kompartemen J.007 (000
20’48.2” LS dan 1010 47’32.1” BT). Pada setiap lokasi pengujian dibuat tiga
ulangan. Pengujian dilakukan dengan metode kantong serasah (White & Haines
1988; Sariyildiz 2003). Penempatan kantong di setiap lokasi pengulangan
dilakukan pada tempat seluas + 6 x 15 m (3 baris x 7 kolom pohon) (Lampiran 1).
Pada setiap lokasi pengulangan diletakkan 11 kantong yang ditempatkan secara
acak, yaitu untuk delapan bulan pengambilan sampel dan tiga lainnya sebagai
cadangan. Jumlah keseluruhan kantong yang diletakkan berjumlah 66 kantong.
Masing-masing kantong diletakkan di bawah tumpukan serasah, tepatnya di
bawah lapisan F atau di atas permukaan tanah. Agar kantong tetap berada pada
kehilangan berat serasah, kandungan selulosa, lignin, C, dan N serta jenis fungi
yang berperan dalam proses dekomposisi dilakukan setiap bulan selama delapan
bulan. Setiap bulan diambil tiga kantong serasah (berasal dari tiga ulangan) dari
setiap tegakan yang diamati.
Analisis serasah setelah dekomposisi
Analisis kehilangan berat serasah dan analisis kandungan selulosa dan
lignin dilakukan di Laboratorium Balai Penelitian Ternak Departemen Pertanian
di Ciawi Bogor. Sedangkan analisis penentuan kadar C dan N dilakukan di
Laboratorium Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB)
IPB.
a. Analisis kehilangan berat serasah
Kehilangan berat serasah ditentukan berdasarkan metode oven (Andersson
2005). Serasah yang belum terdekomposisi diambil sebanyak 5 g, dikeringkan
dalam oven pada suhu 60o C selama 24 jam kemudian diambil 1 g dan
dikeringkan lebih lanjut pada suhu 105o C sampai beratnya konstan (W0).
Selanjutnya serasah hasil uji dekomposisi (hasil pengambilan pada setiap
pengamatan) juga diambil sebanyak 5 g, dikeringkan dalam oven pada suhu 60o C
selama 24 jam kemudian diambil 1 gram dikeringkan lebih lanjut pada suhu 105o
C sampai beratnya konstan (Wt). Penghitungan persentase berat serasah yang
hilang selama waktu dekomposisi menggunakan rumus:
%
0 t 0
W W W hilang yang serasah
Berat = − x 100
keterangan:
W0 = berat kering serasah sebelum terdekomposisi (berat awal)
Wt = berat kering serasah setelah terdekomposisi (berat pada saat pengamatan)
b. Preparasi serasah
Serasah yang belum terdekomposisi dan serasah hasil dekomposisi
(pengambilan pada setiap pengamatan), masing-masing dikeringkan dalam oven
pada suhu 60o C selama 24 jam, kemudian serasah tersebut dihancurkan dengan
blender. Serbuk serasah yang dihasi