DENGAN MENGGUNAKAN BAKTERI FOTOSINTETIK
Rhodobium marinum
KHAIRUL ANAM
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Studi Pemanfaatan Limbah Cair Industri Makanan Lokal untuk Produksi Hidrogen dengan Menggunakan Bakteri Fotosintetik Rhodobium marinum adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Tesis ini.
Bogor, Agustus 2012
Industry for Hydrogen Production by Using Photosynthetic Bacteria Rhodobium marinum. Under direction of KHASWAR SYAMSU and DWI SUSILANINGSIH
New, clean and renewable energy systems are required to encounter environmental problems caused by the use of fossil energy sources. Hydrogen is energy carrier that fulfills requirement of clean and environmental friendly energy because hydrogen does not produce greenhouse gases in its combustion. Photosynthetic bacteria are one among other bacteria that can produce hydrogen through photo fermentation process. Liquid waste can be utilized as substrate to produce hydrogen by photosynthetic bacteria. In this study, liquid wastes from local food industries are utilized as organic sources for hydrogen production process because of economical and environmental reasons. Photosynthetic bacteria, Rhodobium marinum, were used as the agent for hydrogen production. Milk, soya sauce and tofu liquid wastes were chosen as organic sources. These liquid wastes were treated by centrifugation, neutralization and sterilization. The wastes also have been characterized and it contains sugar, organic acid and protein. Milk liquid waste directly can produce hydrogen about 141±24 ml after been treated, meanwhile soya sauce liquid waste did not produce hydrogen and had to be diluted. Tofu liquid waste also did not produce hydrogen and could not be continued for optimization because of its small content of nutrients. Milk and soya sauce liquid wastes were examined with dilution (1-80 g/l), addition of iron (0-500 µmol/l for milk liquid waste and 0-160 µmol/l for soya sauce), molybdenum (0-12 µmol/l for milk liquid waste and 0-160 µmol/l for soya sauce) and sodium bicarbonate (0-6 g/l) for optimization purposes. The dilution of milk liquid waste that gives 7.58 g/l total sugar concentration had the highest efficiency with 3.22% mol hydrogen/mol hydrogen theoretical and 10.9 g/l for soya sauce with 6.88% mol hydrogen/mol hydrogen theoretical. From these experiments, the addition of iron, molybdenum and sodium bicarbonate does not affect hydrogen production from milk and soya sauce liquid wastes. For kinetics parameters, milk and soya sauce liquid waste which were treated by pretreatment and without addition of iron, molybdenum, sodium bicarbonate, yeast extract and trace element in SL-6 solution were used as hydrogen production medium with 900 ml working volume. From the experiments, the maximum specific growth for R. marinum in milk liquid waste was obtained to be 0.137 hours-1; Yx/s value was 0.45 g biomass/g substrate, Yp/s value was 0.017 g hydrogen/g substrate and Yp/x value was 0.031 g hydrogen/g biomass. The maximum specific growth for R. marinum in soya sauce liquid waste was obtained to be 0.245 hours-1; Yx/s value was 0.475 g biomass/g substrate, Yp/s value was 0.041 g hydrogen/g substrate and Yp/x value was 0.086 g hydrogen/g biomass.
RINGKASAN
KHAIRUL ANAM. Studi Pemanfaatan Limbah Cair Industri Makanan Lokal untuk Produksi Hidrogen dengan Menggunakan Bakteri Fotosintetik Rhodobium marinum. Dibimbing oleh KHASWAR SYAMSU dan DWI SUSILANINGSIH
Energi bersih dan ramah lingkungan merupakan energi alternatif bagi energi berbasis fosil yang saat ini persediaannya semakin menipis dan telah menyebabkan masalah lingkungan. Hidrogen merupakan energi carrier yang ideal untuk dikembangkan sebagai pengganti peran bahan bakar berbasis fosil. Hidrogen tidak menghasilkan gas rumah kaca dalam pembakarannya sehingga aman bagi lingkungan. Ada beberapa cara untuk memproduksi hidrogen, antara lain dengan cara steam reforming, elektrolisis, gasifikasi dan biologi. Dari beberapa cara tersebut di atas, cara biologi merupakan cara yang efisien karena dapat terbarukan.
Produksi hidrogen secara biologi menggunakan mikroorganisme sebagai agen biologi untuk menghasilkan gas hidrogen dari substrat yang dapat terbarukan. Salah satu mikroorganisme yang diketahui sebagai penghasil hidrogen adalah Rhodobium marinum. R. marinum merupakan bakteri fotosintetik dan bagian dari bakteri ungu non sulfur yang dapat memanfaatkan bermacam-macam bahan organik untuk menghasilkan hidrogen. R. marinum juga dapat menghasilkan hidrogen dengan memanfaatkan limbah sebagai substrat. Selanjutnya, limbah dipilih sebagai media produksi karena nilainya yang rendah dan juga banyak dihasilkan. Limbah yang mengandung bahan organik seperti gula dan asam-asam organik merupakan limbah yang sangat cocok untuk produksi gas hidrogen dengan menggunakan bakteri R. marinum. Limbah cair merupakan bentuk limbah yang paling mudah dimanfaatkan sebagai media untuk produksi hidrogen.
Berdasarkan hal tersebut, penelitian ini dilakukan dengan tujuan untuk mencari limbah cair mana yang dapat dimanfaatkan sebagai media produksi hidrogen oleh bakteri R. marinum. Kemudian dilanjutkan dengan penyesuaian terhadap media baik yang ada di dalam limbah maupun yang akan ditambahkan ke dalam limbah dengan tujuan untuk mendapatkan produksi hidrogen yang optimal. Penyesuaian yang dilakukan antara lain adalah efisiensi jumlah kandungan substrat yang ada pada limbah, penambahan besi, molibdenum dan natrium bikarbonat dalam rangka optimasi terhadap proses fotofermentasi yang dilakukan pada botol serum 125 ml dengan volume kerja 80 ml, diinkubasi pada suhu ruang, yaitu sekitar ± 30°C di atas shaker dengan kecepatan 120 rpm, dengan intensitas cahaya 60 watt/m2 dengan nilai OD bakteri 0,1–0,2. Selain itu juga dilakukan pengukuran parameter kinetika produksi hidrogen dari limbah dan pertumbuhan bakteri R. marinum.
kandungan protein, yaitu 0,94%, sebenarnya limbah tahu merupakan penyedia sumber N (nitrogen) yang baik untuk pertumbuhan bakteri.
Limbah susu merupakan limbah yang berbentuk suspensi dimana pada limbah tersebut terdapat gumpalan-gumpalan coklat. Untuk mendapatkan bentuk limbah cair yang optimal, maka limbah susu dipreparasi dengan metode pemanasan untuk melarutkan padatan yang ada lalu dengan penyaringan atau sentrifugasi padatan dan cairan limbah dipisahkan. Cairan limbah yang telah dipisahkan dari padatan, kemudian dinetralisasi dengan larutan basa (NaOH) untuk mendapatkan pH media yang optimal yaitu pada pH 7. Limbah susu yang telah dipreparasi merupakan media yang dapat memproduksi gas hidrogen secara langsung dengan kandungan asam organik dan gula pada MP sebesar 70 mM dan 71 g/l secara berurutan. Setelah dipastikan dapat menghasilkan gas hidrogen, maka pada limbah susu dilakukan efisiensi jumlah kandungan substrat yang ada pada limbah dan penambahan besi, molibdenum serta natrium bikarbonat dalam rangka optimasi. Pada tahap efisiensi substrat dengan konsentrasi 1-80 g/l, diperoleh produksi hidrogen mencapai efisiensi produksi tertinggi dengan nilai 3,22% mol hidrogen/mol hidrogen teoritis pada konsentrasi gula total kurang lebih 7,58 g/l. Optimasi selanjutnya yang dilakukan adalah pemberian unsur besi 0-500 µmol/l, molibdenum 1-12 µmol/l dan natrium bikarbonat 0-6 g/l. Dari hasil uji analisa keragaman (analysis of varian, ANOVA) yang dilakukan, diperoleh bahwa penambahan bahan-bahan tersebut tidak memberikan pengaruh yang nyata terhadap produksi hidrogen. Oleh karena itu, ditambahkannya atau tidak bahan-bahan tersebut, secara statistik tidak memberikan pengaruh bertambahnya produksi hidrogen. Berdasarkan hasil tersebut dilakukan pengukuran parameter kinetika produksi hidrogen dengan tidak dilakukan penambahan bahan dari luar baik besi, molibdenum, natrium bikarbonat, ekstrak khamir dan SL-6. Hasil pengukuran parameter kinetika produksi hidrogen secara fotofermentasi dengan
R. marinum pada volume kerja 900 ml, diperoleh nilai laju pertumbuhan spesifik maksimum sebesar 0,137 jam-1 dan nilai Yx/s yang adalah 0,261 g biomassa/g substrat, nilai Yp/s adalah 0,017 g hidrogen/g substrat dan nilai Yp/x = 0,064 g hidrogen/g biomassa.
adalah pemberian unsur besi 0-160 µmol/l, molibdenum 0-160 µmol/l dan natrium bikarbonat 0-6 g/l. Dari uji ANOVA yang dilakukan, diperoleh hasil bahwa penambahan bahan-bahan tersebut juga tidak memberikan pengaruh yang nyata terhadap produksi hidrogen. Oleh karena itu, sama halnya dengan limbah susu, ditambahkannya atau tidak bahan-bahan tersebut pada media limbah kecap tidak memberikan pengaruh bertambahnya produksi hidrogen. Berdasarkan hasil tersebut dilakukan pengukuran parameter kinetika produksi hidrogen dengan tanpa ada penambahan bahan dari luar baik besi, molibdenum, natrium bikarbonat, ekstrak khamir dan SL-6. Dari hasil pengukuran parameter kinetika produksi hidrogen secara fotofermentasi dengan R. marinum pada volume kerja 900 ml, diperoleh nilai laju pertumbuhan spesifik maksimum sebesar 0,245 jam-1 dan nilai Yx/s adalah 0,475 g biomassa/g substrat, nilai Yp/s adalah 0,041 g hidrogen/g substrat dan nilai Yp/x = 0,086 g hidrogen/g biomassa.
© Hak Cipta milik IPB dan LIPI, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; pengutipan tersebut tidak merugikan kepentingan yang wajar IPBdan LIPI
STUDI PEMANFAATAN LIMBAH CAIR INDUSTRI
MAKANAN LOKAL UNTUK PRODUKSI HIDROGEN
DENGAN MENGGUNAKAN BAKTERI FOTOSINTETIK
Rhodobium marinum
KHAIRUL ANAM
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Penelitian : Studi Pemanfaatan Limbah Cair Industri Makanan Lokal untuk Produksi Hidrogen dengan Menggunakan Bakteri Fotosintetik Rhodobium marinum
Nama : Khairul Anam
NRP : P051090031
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Khaswar Syamsu, M.Sc. Dr. Dwi Susilaningsih, M.Pharm.
Ketua Anggota
Diketahui
Ketua Program Studi Bioteknologi Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Suharsono, DEA. Dr. Ir. Dahrul Syah, M.Sc. Agr.
PRAKATA
Segala puji hanya bagi Allah SWT yang telah melimpahkan rahmah, hidayah dan inayahNya kepada penulis sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2011 ini ialah biohidrogen dengan judul Studi Pemanfaatan Limbah Cair Industri Makanan Lokal untuk Produksi Hidrogen dengan Menggunakan Bakteri Fotosintetik Rhodobium marinum.
Terima kasih penulis ucapkan kepada Bapak Prof. Dr. Ir. Khaswar Syamsu, M.Sc. dan Ibu Dr. Dwi Susilaningsih, M.Pharm. selaku komisi pembimbing yang telah memberikan bimbingan, arahan dan petunjuk selama berlangsungnya penelitian dan penyusunan karya ilmiah ini. Terima kasih kepada Bapak Prof. Dr. Ir. Suharsono, DEA. dan Ibu Dr. Mulyorini Rahayuningsih yang telah memberikan saran dan arahan dalam penyusunan naskah karya ilmiah ini. Semoga amal yang diberikan mendapat balasan yang setimpal dari Allah SWT. Penulis juga mengucapkan terima kasih kepada Lembaga Ilmu Pengetahuan Indonesia (LIPI) atas bantuan dana dan kesempatan yang diberikan kepada penulis, baik melalui karyasiswa LIPI maupun program kompetitif, sehingga penulis dapat menyelesaikan studi yang telah diamanahkan.
Tidak lupa penulis memberikan penghargaan kepada segenap staf pengajar, karyawan dan rekan-rekan angkatan 2009 di program studi Bioteknologi Pascasarjana IPB yang telah berbagi ilmu dan nasehat kepada penulis selama menjalankan studinya. Tidak lupa penulis juga ucapkan terima kasih kepada rekan-rekan di Lab Bioenergi dan Bioproses, Puslit Bioteknologi LIPI, yang sedianya telah membantu kelancaran penelitian ini. Ucapan terima kasih juga penulis sampaikan kepada ibu, istri dan anak-anakku serta seluruh keluarga atas segala doa, kasih sayang dan dukungan yang diberikan.
Penulis menyadari bahwa karya ilmiah ini masih jauh dari sempurna. Untuk itu, penulis dengan segala kerendahan hati, terbuka untuk menerima segala saran dan kritik yang membangun demi kemajuan di masa mendatang. Harapan penulis, semoga dengan segala kekurangannya karya ilmiah ini, dapat diambil manfaatnya.
Bogor, Agustus 2012
DAFTAR ISI
Produksi Hidrogen Secara Biologi ……….. 8
Bakteri Fotosintetik ………. 9
Nitrogenase ………. 13
Hidrogenase ………. 15
Faktor-faktor yang Mempengaruhi Produksi Hidrogen ………….. 15
METODOLOGI ………. 19
Waktu dan Tempat Penelitian ………. 19
Cara Kerja ……… 19
Pengukuran Parameter Kinetika Produksi Hidrogen ..……… 40
Analisa Hasil Produksi Hidrogen ……… 46
SIMPULAN DAN SARAN ………... 49
Simpulan ……….. 49
DAFTAR TABEL
Halaman
1 Karakteristik limbah cair industri makanan setelah dipreparasi. ……….. 31
2 Produksi rata-rata hidrogen secara fotofermentasi dari limbah susu …… 33
3 Produksi rata-rata hidrogen secara fotofermentasi dari limbah kecap ….. 35
4 Perubahan nilai berat biomassa (X), ln berat biomassa (ln X), gula sebagai substrat (S) dan hidrogen sebagai produk (P) pada proses fotofermentasi limbah susu sebagai media produksi hidrogen skala 1
liter ……… 41
5 Perubahan nilai berat biomassa (X), ln berat biomassa (ln X), gula sebagai substrat (S) dan hidrogen sebagai produk (P) pada proses fotofermentasi limbah kecap sebagai media produksi hidrogen skala 1
liter ……… 42
6 Hasil produksi biohidrogen dari limbah cair industri makanan melalui
Halaman
1 Skema sederhana HydrogenFuel Cell……… 6
2 Foto bakteri R. marinum………. 10
3 Proses terjadinya glikolisis dan terbentuknya asam organik melalui jalur Krebs ……… 12
4 Proses terbentuknya hidrogen……….. 13
5 Proses terbentuknya hidrogen di dalam sel……….. 14
6 Sistem fotobioreaktor percobaan………. 20
7 Proses fotofermentasi dengan shaker dan menggunakan penerangan lampu TL……….. 21
8 Sistem fotobioreaktor pada percobaan pengukuran parameter kinetika produksi hidrogen ………. 24
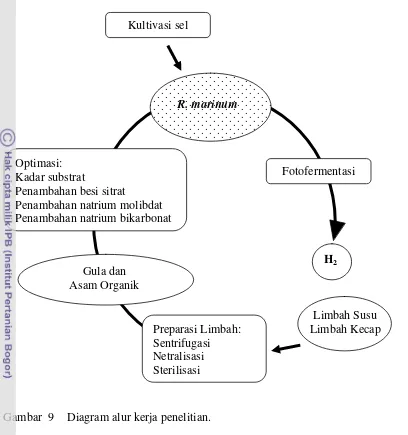
9 Diagram alur kerja penelitian ……….. 27
10 Limbah cair tahu, kecap dan susu ………... 30
11 Volume hidrogen hasil fotofermentasi limbah cair industri susu, tahu dan kecap dengan R. marinum……… 32
12 Hidrogen hasil optimasi jumlah substrat pada proses fotofermentasi limbah cair industri susu dengan R. marinum……….. 34
13 Efisiensi produk hasil optimasi jumlah substrat pada proses fotofermentasi limbah cair industri susu dengan R. marinum………. 34
14 Efisiensi substrat hasil optimasi jumlah substrat pada proses fotofermentasi limbah cair industri susu dengan R. marinum……… 35
15 Hidrogen hasil optimasi jumlah substrat pada proses fotofermentasi limbah cair industri kecap dengan R. marinum………... 36
17 Efisiensi substrat hasil optimasi jumlah substrat pada proses
fotofermentasi limbah cair industri kecap dengan R. marinum……... 37
18 Perbandingan produksi gas hidrogen hasil fotofermentasi limbah susu dengan perbedaan penambahan jumlah Fe, Mo dan NaHCO3
pada media produksi……… 38
19 Perbandingan produksi gas hidrogen hasil fotofermentasi limbah kecap dengan perbedaan penambahan jumlah Fe, Mo dan NaHCO3
pada media produksi……… 39
20 Kurva ln berat biomassa (ln X) dan laju pertumbuhan spesifik bakteri fotosintetik R. marinum pada proses fotofermentasi produksi
hidrogen………... 43
21 Koefisien yield biomassa/substrat (Yx/s), koefisien yield
produk/substrat (Yp/s) dan koefisien Yield produk/biomassa (Yp/x)
Halaman
1 Laporan Hasil Pengujian Kadar N total, Besi (Fe) dan Molibdenum
(Mo)………. 57
2 Kurva standar glukosa ……….. 62
3 Kurva standar berat biomassa………... 63
4 Kurva standar hidrogen……… 64
5 Kromatogram standar hidrogen……… 65
6 Kromatogram sampel hidrogen………. 66
7 Volume hidrogen tiap perlakuan dan analisis statistik ... 68
PENDAHULUAN
Latar Belakang
Pemakaian bahan bakar fosil yang terjadi sejak dahulu hingga saat ini telah mengakibatkan semakin langkanya persediaan bahan bakar tersebut, ditandai melonjaknya harga bahan bakar fosil di pasaran dunia (Kirtay 2011; Mohan et al.
2008). Selain itu, penggunaan bahan bakar fosil yang terus menerus telah menghasilkan gas-gas yang dapat menimbulkan masalah lingkungan dan menyebabkan efek rumah kaca sehingga mengakibatkan pemanasan global yang berujung pada perubahan iklim di bumi (Lin & Lay 2004; Chen et al. 2006).
Dengan adanya krisis energi dan masalah lingkungan yang ditimbulkan, maka perlu dikembangkan suatu energi alternatif yang dapat menggantikan peran bahan bakar berbasis fosil.
Hidrogen merupakan salah satu sumber energi alternatif yang ideal untuk dikembangkan sebagai pengganti peran bahan bakar berbasis fosil. Sebagai bahan bakar, hidrogen dapat menghasilkan energi lebih besar daripada energi yang dihasilkan oleh bensin pada berat yang sama (Kapdan & Kargi 2006). Hidrogen pun lebih ramah lingkungan karena pada proses pembakarannya hanya menghasilkan uap air. Akan tetapi , keberadaan hidrogen dalam bentuk gas relatif jarang ditemukan secara alami di bumi (Lestari 2004). Oleh karena itu, gas hidrogen perlu diproduksi.
Ada beberapa cara untuk memproduksi hidrogen, antara lain dengan cara
steam reforming, elektrolisis, gasifikasi dan biologi (Chen et al 2006, Kapdan & Kargi 2006, Li & Fang 2008, Kirtay 2011). Dari beberapa cara tersebut di atas cara biologi merupakan cara yang efisien dan dapat terbarukan (Li & Fang 2008). Diketahui hidrogen dapat dihasilkan dari beberapa mikroorganisme, seperti mikroorganisme fotosintetik termasuk di dalamnya sianobakter dan bakteri fotosintetik (Miyake 1998, Najafpour et al. 2004, Fang et al. 2006). Selain itu
(1998) dilaporkan bahwa bakteri fotosintetik dapat menghasilkan gas hidrogen lebih banyak dibandingkan dengan bakteri anaerob secara stoikiometri dengan menggunakan glukosa sebagai substrat. Oleh karena itu, dengan produksi hidrogen yang tinggi dibandingkan dengan bakteri lain, maka dalam penelitian ini bakteri fotosintetik digunakan untuk menghasilkan gas hidrogen.
Beberapa penelitian memanfaatkan bakteri fotosintetik sebagai agen biologis penghasil gas hidrogen karena bakteri tersebut dapat memanfaatkan bermacam-macam bahan organik sebagai substrat. Ada penelitian yang
memanfaatkan glukosa sebagai substrat untuk produksi biohidrogen (Redwood & Macaskie 2006). Beberapa penelitian memanfaatkan asam laktat dan asam organik lainnya sebagai substrat (Ike et al. 1999, Barbosa et al. 2001, Kawaguchi
et al. 2002, Li & Fang 2008). Semakin maraknya penggunaan bahan-bahan organik untuk bahan dasar dalam produksi energi alternatif tersebut telah menyebabkan kekhawatiran memicu naiknya harga bahan pangan. Oleh karena itu perlu dikembangkan suatu sistem untuk memproduksi gas hidrogen tanpa harus bersaing dengan bahan-bahan yang berbasis pada kebutuhan pangan.
Limbah organik dengan kandungan nitrogen yang rendah diketahui merupakan substrat yang ideal untuk produksi hidrogen secara fotofermentasi. Beberapa literatur menyatakan bahwa bakteri fotosintetik dapat memanfaatkan jenis limbah organik yang beragam sebagai sumber karbon dalam produksi hidrogen. Limbah-limbah yang dimaksud antara lain, yaitu limbah cair dari industri gula (Yetis et al. 2000), industri susu (Turkarslan et al. 1998), industri tahu (Zhu et al. 1999), industri fermentasi asam laktat (Sasikala & Ramana1991), endapan limbah (Sunita & Mitra, 1993) dan limbah kota (Fascetti et al. 1998). Limbah cair yang mengandung bahan-bahan organik merupakan bentuk limbah yang paling mudah untuk dikonversi menjadi gas hidrogen (Miyake 1998).
Adapun limbah yang akan digunakan dalam studi ini adalah limbah cair yang berasal dari industri makanan lokal yang mengandung bahan organik yang dapat dikonversi menjadi gas hidrogen, seperti limbah cair dari industri kecap, susu dan tahu.
3
berlangsung. Tumpahan ini tidak langsung dibuang ke saluran air akan tetapi ditampung terlebih dahulu di dalam drum bekas. Dari komposisi kecap manis, diketahui limbah ini banyak mengandung gula yang diketahui dapat dikonversi menjadi hidrogen. Limbah industri susu coklat UHT (ultra high temperature) adalah produk retur, kadaluarsa dan produk yang tidak memenuhi syarat untuk dikomersialisasikan. Limbah ini ditampung ke dalam suatu wadah pengolahan limbah dan diambil sebelum proses pengolahan limbah tersebut berlangsung. Dari komposisi produk susu tersebut, diketahui bahwa cairan limbah ini juga
mengandung gula yang dapat diubah menjadi hidrogen. Limbah industri tahu adalah limbah yang diperoleh dari pabrik pengolahan tahu. Limbah ini berasal dari cairan yang digunakan sebagai koagulan dalam pembuatan tahu. Limbah ini diambil sebelum dibuang langsung ke dalam aliran sungai. Dari komposisi cairan yang digunakan, limbah ini mengandung asam yang dapat dikonversi menjadi hidrogen. Oleh karena itu, limbah cair industri makanan merupakan limbah yang sangat cocok untuk digunakan sebagai media produksi gas hidrogen.
Keuntungan dari pemakaian limbah sebagai media produksi, selain merupakan bahan baku murah, pemanfaatan limbah untuk menghasilkan energi dapat mengurangi biaya untuk pengolahan limbah tersebut dan juga dapat mengurangi dampak lingkungan akibat limbah yang secara sengaja dibuang sembarangan. Energi yang dihasilkan pun dapat memberi nilai tambah bagi limbah itu sendiri. Oleh karena itu, dalam penelitian ini, limbah cair industri makanan lokal dicoba dimanfaatkan sebagai media untuk menghasilkan gas hidrogen dengan menggunakan bakteri fotosintetik, Rhodobium marinum, sebagai mikroorganisme penghasil gas hidrogen.
Tujuan Penelitian
TINJAUAN PUSTAKA
Hidrogen
Hidrogen merupakan elemen paling sederhana yang ada di dunia. Satu atom hidrogen memiliki satu proton dan satu elektron. Hidrogen adalah elemen paling ringan dan berbentuk gas pada tekanan dan temperatur normal. Dalam bentuk gas, hidrogen (H2) adalah gas yang tidak berwarna, tidak berbau dan tidak larut di dalam air. Gas hidrogen sangat mudah terbakar yang akan terbakar pada konsentrasi 4% H2 di udara. Entalpi pembakaran hidrogen adalah -286 kJ/mol (Lestari 2004). Hidrogen terbakar menurut persamaan 1
2 H2+ O2 → 2 H2O + 572 kJ ΔG = 286 kJ/mol (1) Hidrogen adalah gas yang paling melimpah di alam semesta dan merupakan sumber dari energi yang kita terima dari matahari. Matahari pada dasarnya adalah bola raksasa yang tersusun oleh gas hidrogen dan helium. Pada proses terjadinya fusi, 4 atom hidrogen bereaksi membentuk 1 atom helium dan melepaskan energi berupa radiasi. Energi dari radiasi tersebut merupakan sumber energi paling melimpah yang kita terima. Radiasi memberi kita cahaya dan panas yang membuat tanaman dapat tumbuh. Adanya panas yang ditimbulkan mengakibatkan angin bertiup dan hujan turun serta tersimpan sebagai energi kimia di dalam bahan bakar fosil. Hampir semua energi yang kita manfaatkan saat ini bersumber pada matahari. Di bumi, hidrogen umumnya ditemukan dalam bentuk komponen dari suatu senyawa. Berkombinasi dengan oksigen, hidrogen membentuk air (H2O). Kombinasi hidrogen dengan karbon dapat membentuk metana (CH4), batu bara dan minyak bumi (www.need.org 2011). Hidrogen juga ditemukan pada mahluk hidup (biomassa).
Manfaat Hidrogen
lebih besar daripada energi yang dihasilkan oleh bensin pada berat yang sama (Kapdan & Kargi 2006, www.need.org 2011). Cairan hidrogen biasa digunakan sebagai bahan bakar roket karena mempunyai kalor pembakaran yang besar, 120 kJ/g. Seiring berjalannya waktu, pemanfaatan hidrogen sebagai bahan bakar dinilai sangat penting untuk menggantikan peran bahan bakar berbasis fosil yang saat ini keberadaannya semakin sedikit akibat pemakaian yang terus menerus. Selain dapat menghasilkan energi yang cukup besar, hidrogen juga ramah lingkungan karena pembakaran hidrogen tidak mengeluarkan gas yang dapat
mengakibatkan polusi dan efek rumah kaca seperti bahan bakar fosil selama ini. Sisa pembakaran hidrogen hanya menghasilkan uap air sehingga ramah bagi lingkungan.
Gas hidrogen dapat diaplikasikan pemanfaatannya sebagai bahan bakar bila disertai dengan sistem fuel cell (hydrogen fuel cell) sebagai sumber (alat) yang dapat menghasilkan listrik. Kinerja hydrogen fuel cell serupa seperti aki (accu), hanya saja reaksi kimia penghasil tenaga listrik ini menggunakan hidrogen dan oksigen yang bereaksi dan mengalir seperti aliran bahan bakar melalui sebuah karburator. Tidak ada pembakaran dalam proses pembangkit listrik ini. Dengan demikian limbah dari proses ini hanyalah air yang aman untuk dibuang.
Gambar 1 Skema sederhana HydrogenFuel Cell (Ming 2010).
7
menyeberang ke katoda. Proton yang tiba di katoda bereaksi dengan oksigen atau udara dan menghasilkan air. Tumpukan elektron di anoda akan menjadi energi listrik searah yang dapat menyalakan lampu. Namun ada hal yang sangat penting yang harus dimengerti mengenai bahan bakar hydrogen fuel cell ini bahwa hidrogen di bumi tidak dapat langsung ditambang atau dipanen karena hidrogen biasa ditemukan dalam bentuk komponen dari suatu senyawa. Oleh karena itu, hidrogen perlu diproduksi (www.need.org 2011).
Metode Produksi Hidrogen
Ada beberapa cara untuk memproduksi hidrogen, antara lain dengan cara
steam reforming, elektrolisis dan gasifikasi biomassa serta secara biologi (Chen et al. 2006, Kapdan & Kargi 2006, Li & Fang 2008, Kirtay 2011). Steam reforming
adalah proses dimana suhu uap air yang tinggi akan memisahkan hidrogen dari
ikatan atom karbon pada metana, dapat dilihat pada persamaan 2. Hidrogen yang diproduksi melalui metode ini tidak digunakan untuk bahan bakar akan tetapi
untuk keperluan proses di dalam industri. Metode ini merupakan metode produksi hidrogen paling efektif saat ini. Tetapi di dalam metode ini baik proses pembuatan dan untuk sumber penghasil panas keduanya menggunakan bahan bakar berbasis fosil sehingga tidak efisien.
CH4 + H2O → CO + 3H2 (2) Elektrolisis, yaitu memisahkan air menjadi hidrogen dan oksigen dengan aliran listrik (persamaan 3). Proses ini akan menghasilkan hidrogen yang memiliki kemurnian yang tinggi. Tetapi, dalam proses elektrolisis dibutuhkan energi listrik yang sangat besar yang berasal dari bahan bakar fosil, sehingga juga dianggap belum efisien. Cara ini bisa lebih efisien apabila dalam prosesnya menggunakan listrik yang berasal dari energi terbarukan.
energi untuk pemanasan akan tetapi menjadi efisien apabila biomassa juga dimanfaatkan untuk menghasilkan panas (Bossel 2006, www.need.org 2011).
Produksi hidrogen secara biologis dapat menjadi alternatif yang digunakan dalam memproduksi gas hidrogen. Dengan memanfaatkan biomassa, produksi hidrogen secara biologis termasuk ke dalam sumber energi terbarukan. Dengan dukungan banyak penelitian dan pengembangan, produksi gas hidrogen melalui proses biologi telah berhasil menyita perhatian beberapa tahun terakhir ini (Kapdan & Kargi 2006).
Produksi Hidrogen Secara Biologi
Ada beberapa mikroorganisme yang dapat menghasilkan gas hidrogen sebagai produk samping pada proses pertumbuhannya dengan menggunakan sumber yang dapat terbarukan seperti air, biomassa dan cahaya matahari.
Beberapa mikroorganisme yang dapat menghasilkan hidrogen, antara lain sianobakteria, bakteri anaerob dan bakteri fotosintetik (Miyake 1998, Koku et al.
2002, Chen et al. 2006). Semua proses yang melibatkan produksi hidrogen tidak lepas dengan adanya pengaruh enzim yang berperan mengkatalisis diproduksinya gas hidrogen (Hallenbeck & Benemann 2002).
Sianobakteria memecah air menjadi hidrogen dan oksigen melalui proses fotosintesis (fotolisis). Mikroorganisme ini bersifat fotoautotrof dan tidak memerlukan bahan organik sebagai substrat untuk menghasilkan hidrogen. Mikroorganisme ini menangkap energi dari cahaya matahari yang memecah air menjadi oksigen dan melepas elektron(persamaan 4). Elektron yang dihasilkan mereduksi feredoxin lalu bergerak ke enzim hidrogenase yang mengubah proton H+ menjadi H2. Keuntungan dari proses ini adalah dapat mengubah air menjadi hidrogen secara langsung. Tetapi, diproduksinya oksigen sebagai hasil samping proses fotosintesis dapat menghambat kerja dari enzim nitrogenase dan hidrogenase (Das & Veziroglu 2008, Hallenbeck et al. 2009).
2 H2O + energi cahaya → O2 + 2 H2 (4)
9
yang lebih kecil melalui proses glikolisis. Enzim yang terlibat dalam produksi hidrogen pada bakteri anaerob adalah enzim hidrogenase. Keuntungan dari proses ini adalah banyak sumber bahan organik yang dapat digunakan sebagai substrat. Fermentasi juga dapat berlangsung terus karena tidak membutuhkan cahaya dan juga dapat menghasilkan beberapa produk samping berharga seperti asam butirat, asam asetat dan asam laktat (Chen et al. 2006, Kapdan & Kargi 2006, Kotay & Das 2008). Akan tetapi, hasil produksi gas hidrogen hanya sedikit, rasio konversi substrat ke produk kecil (Miyake 1998, Hallenbeck et al. 2009).
C6H12O6 (glukosa) + 2H2O → 2CH3COOH (asam asetat) + 2CO2 + 4H2 (5) fotosintetik yang tidak menghasilkan oksigen pada proses fotosintesisnya, tetapi menghasilkan hidrogen sebagai produk samping dengan bantuan cahaya. Produksi hidrogen pada bakteri fotosintetik ini dikatalisis dengan adanya aktivitas enzim nitrogenase dan hidrogenase. Meskipun enzim hidrogenase juga aktif untuk memproduksi hidrogen, akan tetapi enzim ini juga berperan merombak kembali hidrogen yang telah diproduksi (Miyamoto 1997, Koku et al. 2002). Bakteri fotosintetik diketahui dapat menghasilkan gas hidrogen lebih banyak dibandingkan bakteri anaerob secara stoikiometri dengan menggunakan glukosa sebagai substrat (Miyake 1998). Bakteri fotosintetik memiliki kemampuan tinggi dalam mengkonversi substrat secara efisien dan dapat menggunakan bermacam-macam susbtrat untuk produksi hidrogen (Akkerman et al. 2002, Koku et al. 2002, Das & Veziroglu 2008). Hal ini menjadikan bakteri fotosintetik lebih
efisien untuk memproduksi gas hidrogen.
Bakteri Fotosintetik
pertumbuhan metabolisme seperti pertumbuhan fotoheterotrof, fotoautotrof dan pertumbuhan kemoheterotrof. Mode pertumbuhan dari bakteri ini dapat beralih dari satu mode ke mode yang lain tergantung pada ketersediaan sumber karbon (C) dan intensitas cahaya. Jika media mengandung CO2 sebagai sumber C, bakteri ini akan tumbuh secara autotrof. Jika sumber C adalah asam organik, bakteri ini akan tumbuh secara heterotrof. Ketersediaan sumber cahaya diperlukan untuk mode pertumbuhan secara fototrof (Basak & Das 2007).
Gambar 2 Foto bakteri R. marinum.
Bakteri PNS hanya memiliki fotosistem tunggal yang ada di dalam membran intraseluler. Fotosistem ini tidak memiliki daya yang cukup untuk memisahkan air. Karena kurangnya fotosistem II mereka dapat melakukan
fotosintesis anoksigenik. Pertumbuhan fotoheterotrof adalah mode yang disukai untuk produksi hidrogen secara biologis. Mereka dapat hidup baik dalam kondisi gelap ataupun terang. Pertumbuhan ini dapat terjadi pada kisaran pH 6-8,5 dan suhu optimum untuk pertumbuhan antara 30 hingga 35°C (Hiraishi et al. 1995). Istilah "non-sulfur" digunakan karena bakteri ini dianggap tidak menggunakan hidrogen sulfida sebagai donor elektron saat tumbuh secara fotoautotrof. Namun, tidak seperti bakteri sulfur bakteri ini dapat menggunakan sulfida sebagai donor elektron tetapi tidak pada konsentrasi sulfida yang tinggi (Brock et al. 2003). Bakteri PNS berwarna coklat kekuningan sampai kehijauan dan berwarna coklat gelap ketika tumbuh dalam keadaan anaerobik namun berubah menjadi merah
11
dengan adanya oksigen (Basak & Das 2007). Rhodobium marinum adalah bakteri gram negatif PNS dan termasuk bagian dari α Protobacteria. Taksonomi R. marinum ditunjukkan sebagai berikut
dunia : Bacteria
filum : Proteobacteria
kelas : Alpha Proteobacteria
ordo : Rhizobiales
famili : Rhodobiaceae
genus : Rhodobium
species : Rhodobium marinum
Rhodobium marinum merupakan salah satu bakteri fotosintetik yang dapat memproduksi hidrogen (Ike et al. 1999, Kawaguchi et al. 2002). Selnya berbentuk batang, gram negatif, bergerak, memproduksi warna pink sampai merah dan dapat melakukan reproduksi melalui kuncup (Gambar 2). Bakteri ini bersifat
fotoheterotrof fakultatif anaerob dan berhasil diisolasi oleh Hiraishi pada tahun 1995.
C2H4O2 (asam asetat) + 2H2O → 2CO2 + 4H2 (10) C3H6O3 (asam laktat) + 3H2O → 3CO2 + 6H2 (11) C4H6O5 (asam malat) + 3H2O → 4CO2 + 6H2 (12) C6H12O6 (glukosa) + 6H2O → 6CO2 + 12H2 (13)
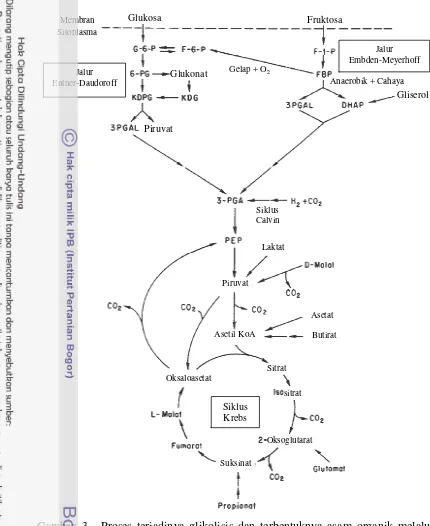
Gambar 3 Proses terjadinya glikolisis dan terbentuknya asam organik melalui jalur Krebs (Koku et al. 2002).
Glukosa Fruktosa
Jalur Entner-Daudoroff
Jalur Embden-Meyerhoff
Anaerobik + Cahaya
Siklus Krebs
Asetat
Butirat
Suksinat
Sitrat
sitrat Oksaloasetat
Oksoglutarat
Gliserol Glukonat
Piruvat
Piruvat
Asetil KoA Laktat Gelap + O2
Siklus Calvin Membran
13
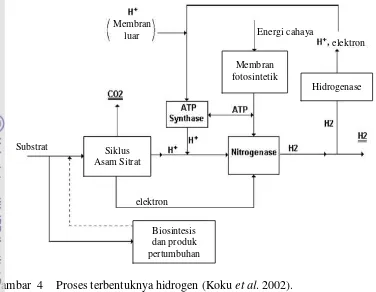
Gambar 4 Proses terbentuknya hidrogen (Koku et al. 2002).
Nitrogenase
Nitrogenase merupakan kompleks enzim yang bertanggung jawab pada proses fiksasi nitrogen. Ketika molekul nitrogen tersedia, enzim nitrogenase bertanggung jawab untuk mengubah nitrogen menjadi amonia. Berikut adalah reaksi fiksasi dari nitrogen
N2 + +8 H+ + 8 e- + 16ATP → 2NH3 + H2 + + 16ADP + 16Pi (14) Kompleks nitrogenase terdiri dari dua komponen yaitu dinitrogenase reduktase (protein Fe) dan dinitrogenase (protein MoFe). Subunit dari nitrogenase dikodekan oleh operon nifHDK. Komponen reduktase dari nitrogenase memiliki dua subunit yang dikodekan oleh gen nifH dan subunit dinitrogenase dikodekan oleh nifD dan gen nifK. nifA adalah aktivator transkripsi dari operon nifHDK (Henson et al. 2004, Kars et al. 2006, Zhu & Li 2010).
Pada kondisi anaerob dan tidak adanya nitrogen, enzim nitrogenase
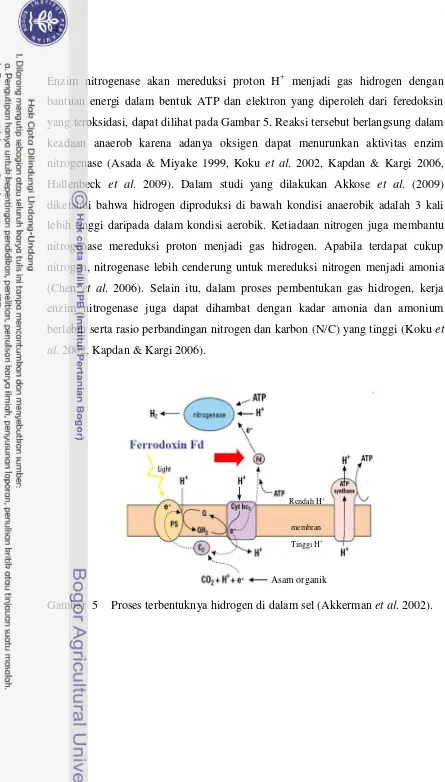
Enzim nitrogenase akan mereduksi proton H+ menjadi gas hidrogen dengan bantuan energi dalam bentuk ATP dan elektron yang diperoleh dari feredoksin yang teroksidasi, dapat dilihat pada Gambar 5. Reaksi tersebut berlangsung dalam keadaan anaerob karena adanya oksigen dapat menurunkan aktivitas enzim nitrogenase (Asada & Miyake 1999, Koku et al. 2002, Kapdan & Kargi 2006, Hallenbeck et al. 2009). Dalam studi yang dilakukan Akkose et al. (2009) diketahui bahwa hidrogen diproduksi di bawah kondisi anaerobik adalah 3 kali lebih tinggi daripada dalam kondisi aerobik. Ketiadaan nitrogen juga membantu
nitrogenase mereduksi proton menjadi gas hidrogen. Apabila terdapat cukup nitrogen, nitrogenase lebih cenderung untuk mereduksi nitrogen menjadi amonia (Chen et al. 2006). Selain itu, dalam proses pembentukan gas hidrogen, kerja enzim nitrogenase juga dapat dihambat dengan kadar amonia dan amonium berlebih serta rasio perbandingan nitrogen dan karbon (N/C) yang tinggi (Koku et al. 2002, Kapdan & Kargi 2006).
Gambar 5 Proses terbentuknya hidrogen di dalam sel (Akkerman et al. 2002).
Asam organik
Rendah H+
15
Hidrogenase
Hidrogenase merupakan enzim yang mengkatalisis oksidasi reversibel dari H2 menjadi proton seperti persamaan 16
H2↔ 2H + + 2e- (16)
Beberapa mikroorganisme menggunakan enzim ini dengan tujuan yang berbeda-beda. Banyak bakteri dan arkea dapat menggunakan hidrogen sebagai sumber elektronnya karena bantuan hidrogenase. Beberapa bakteri fermentatif dan alga hijau menggunakan hidrogenase dengan fungsi yang berlawanan, yaitu melepas
kelebihan kekuatan reduksi dengan mereduksi proton menjadi hidrogen dan bakteri pemfiksasi nitrogen menggunakan hidrogenase untuk menangkap kembali hidrogen yang telah diproduksi oleh nitrogenase (Miyake 1998, Hallenbeck et al. 2009).
Pada mikroorganisme tertentu seperti pada bakteri fotosintetik, kehadiran enzim hidrogenase dapat mengurangi hasil keseluruhan produksi hidrogen karena mengkonsumsi sebagian hidrogen yang telah diproduksi. Untuk mengatasi masalah ini, enzim hidrogenase dapat dinonaktifkan atau dihapus. Kars et al. (2008) mengembangkan strain mutan hup¯ Rb. sphaeroides OU001 untuk meningkatkan kapasitas produksi hidrogen dari sel dengan tidak mengaktifkan enzim hidrogenase akibat mutagenesis situs terarah. Hasil penelitian tersebut menunjukkan bahwa hidrogen yang dihasilkan dengan strain mutan-hup adalah 20% lebih tinggi dibandingkan dengan galur liarnya.
Faktor-Faktor yang Mempengaruhi Produksi Hidrogen
selang waktu optimum pemberian CO2 dalam produksi hidrogen. Penelitian ini dilakukan dengan menggunakan konsorsium bakteri anaerob dan menggunakan glukosa sebagai substrat. Selain itu, ada penelitian yang dilakukan oleh Liu et al. (2009) yang menyatakan adanya pengaruh ion Fe2+ terhadap produksi hidrogen melalui proses fotofermentasi menggunakan asetat sebagai substrat dan
Rhodopseudomonas faecalis RLD-53 sebagai mikroba penghasil hidrogen. Faktor-faktor tersebut juga dapat mempengaruhi kerja enzim nitrogenase. Oleh karena itu, dari informasi di atas, diketahui bahwa baik yang ada di dalam media
(internal) maupun di luar media (eksternal) dapat mempengaruhi tingkat produksi hidrogen.
Pengaruh jumlah substrat terhadap produksi hidrogen
Produksi hidrogen secara optimal oleh bakteri fotosintetik, sangat menarik
secara ekonomi. Akan tetapi tetap harus mempertimbangkan beberapa parameter, seperti efisiensi dan hasil produksi terhadap jumlah sumber karbon.
Antonopoulou et al. (2011) telah melakukan penelitian tentang pengaruh konsentrasi substrat pada produksi hidrogen secara fermentasi dari ekstrak sorgum manis di dalam tangki bioreaktor yang diaduk secara kontinu. Konsentrasi karbohidrat yang diuji berkisar 9,89-20,99 g/l, setara glukosa. Produksi hidrogen tertinggi diperoleh pada konsentrasi 17,50 g karbohidrat/l dan 2,93 l H2/l reaktor/hari dan 0,74 mol H2/mol glukosa yang dikonsumsi, atau sekitar 8,81 l H2/kg sorgum manis. Percobaan tersebut menunjukkan bahwa produksi gas hidrogen tergantung pada konsentrasi karbohidrat awal.
Pengaruh Jumlah ion besi (Fe) dan molibdenum (Mo) terhadap produksi hidrogen
Proses produksi hidrogen secara fotofermentasi juga melibatkan proses enzimatik, maka jumlah ion logam yang dapat mempengaruhi kerja enzim nitrogenase juga dapat mempengaruhi produksi hidrogen. Ada beberapa studi dimana pengaruh jumlah Fe dan Mo pada proses produksi hidrogen secara fotofermentasi oleh bakteri PNS telah diteliti.
17
mempelajari tingkat ekspresi nifD dan nifK, gen yang mengkode subunit besar dinitrogenase dan hupS, gen yang mengkode subunit kecil enzim hidrogenase. Produksi hidrogen di bawah kondisi yang sama dievaluasi. Dari peningkatan konsentrasi produksi hidrogen dengan rangsangan penambahan besi dan molibdenum diperoleh akumulasi hidrogen total tertinggi yang dicapai pada konsentrasi natrium molibdat 16,5 µmol/l (0,84 l H2/l kultur selama 168 jam) dan penambahan besi sitrat 0.1 mM (1,14 l H2/l kultur selama 240 jam) pada media.
Pada penelitian yang dilakukan oleh Eroglu et al. (2011), produksi hidrogen
secara fotofermentasi dengan media produksi limbah cair dari pabrik zaitun oleh
Rhodobacter sphaeroides OU001 diteliti terhadap pengaruh penambahan besi dan
molibdenum. Penambahan kadar Mo sebesar 16,5 µmol/l sedikit meningkatkan total volume produksi gas H2 (62 ml H2), dibandingkan dengan kontrol (40 ml H2). Pada penambahan kadar Fe sebanyak 0,1 mM menunjukkan peningkatan yang signifikan pada produksi H2 (125 ml H2), akan tetapi waktu yang dibutuhkan pada awal produksi lebih lama (24 jam), dibandingkan dengan kontrol (15 jam) dan yang ditambahkan Mo (15 jam).
Pengaruh Jumlah NaHCO3 terhadap produksi hidrogen
Keadaan anaerob sangat dibutuhkan di dalam produksi hidrogen secara fotofermentasi oleh bakteri PNS karena kerja enzim nitrogenase sebagai katalis pada produksi hidrogen dihambat oleh keberadaan oksigen. Oleh karena itu, penghilangan oksigen dari dalam media dibutuhkan untuk menciptakan keadaan anaerob.
METODOLOGI
Waktu dan Tempat Penelitian
Penelitian ini dilakukan dari bulan Januari 2011 sampai dengan bulan Mei 2012 di laboratorium Bioenergi dan Bioproses, Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia di Cibinong, Bogor.
Cara Kerja Kultivasi Sel
R. marinum yang diperoleh dari NBRC (NITE Biological Resource Center) dengan nomor koleksi 100434, ditumbuhkan pada media tumbuh (MT) yang mengandung (dalam g/l) disodium suksinat (Merck) 2,7, ekstrak khamir (Wako) 1, ammonium sulfat (Merck) 1,35 dalam 1 l basal medium yang telah dimodifikasi. Basal medium dalam mg/l: 750 K2HPO4, 850 KH2PO4, 2 EDTA.2Na, 2,8 H3BO3, 0,75 Na2MoO4.2H2O, 0,24 ZnSO4.7H2O, 2,1 MnCl2, 0,04 Cu(NO3)2.3H2O, 10 FeSO4.7H2O, 0,75 CaCl2.2H2O, 200 MgSO4.7H2O. Pada pembuatan MT sebelum dilakukan sterilisasi, media terlebih dahulu dialiri oleh gas nitrogen (teknis) selama 30 menit yang fungsinya untuk membuat keadaan di dalam botol (Schott) menjadi anaerob dengan mengusir oksigen dari dalam media. pH media kemudian disesuaikan pada pH awal 6.8-7 dengan menggunakan larutan NaOH (Merck) 0,1 N dan HCl (Merck) 0,1 N. Setelah dilakukan sterilisasi
menggunakan autoklaf (Tomy), stok kultur dari R. marinum kemudian ditambahkan ke dalam MT sebanyak sepersepuluh bagian (volume/volume) dan
dikultivasi di atas shaker (Certomat) dengan kecepatan 120 rpm yang disertai lampu TL (tubular lamp, Philips) 4 x 15 watt dalam suhu kamar. Kultur sel akan dipanen setelah mencapai OD ± 1 atau lebih dengan ditandai semakin memerahnya warna kultur bakteri (± 2 minggu).
Preparasi Limbah
20
disentrifugasi, dinetralisasi dan disterilisasi. Tiap-tiap limbah memiliki karakteristik yang berbeda-beda, sehingga tahapan preparasi disesuaikan dengan keadaan limbah.
Karakterisasi Limbah
Limbah cair yang diperoleh dari industri kecap, tahu dan susu dipreparasi dan diukur kandungan gula total, asam organik, kadar N total, protein serta data pendukung seperti kandungan besi dan molibdenum. Kadar N total, kandungan besi dan molibdenum diuji di lab PT. Saraswanti Indo Genetech.
Persiapan Bioreaktor
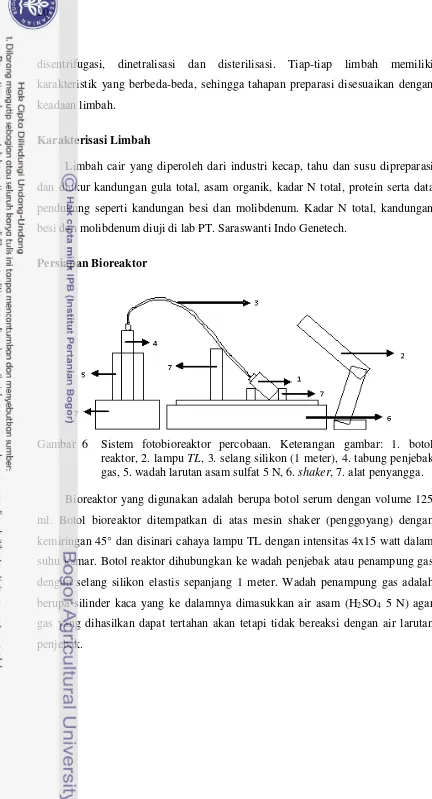
Gambar 6 Sistem fotobioreaktor percobaan. Keterangan gambar: 1. botol reaktor, 2. lampu TL, 3. selang silikon (1 meter), 4. tabung penjebak gas, 5. wadah larutan asam sulfat 5 N, 6. shaker, 7. alat penyangga.
Fotofermentasi
Kultur sel pada MT dibuat menjadi stok dengan menambahkan seperdelapan bagian dari volume MP. OD (optical density) dari stok diperiksa untuk mengetahui berapa ml stok dari kultur yang dibutuhkan untuk mencapai OD 0,1-0,2 pada volume MP. Dengan metode ini diharapkan OD pada kultur awal pada masing-masing ulangan bisa seragam. Kultur sel yang bertindak sebagai agen fermentasi ditambahkan dalam keadaan aseptis. Botol serum ditutup rapat dengan tutup silikon yang telah ditambahkan pipa untuk tempat selang udara dan dilakban
disekitar mulut dan tutup botol. Pipa tersebut akan disambungkan dengan selang silikon yang fungsinya untuk menghubungkan antara botol serum dengan gelas penampung produksi gas yang berisi larutan asam untuk mengurangi adanya kontaminasi. Produksi hidrogen dilakukan pada botol serum 125 ml dengan volume kerja 80 ml MP, diinkubasi pada suhu ruang, yaitu sekitar ± 30°C di atas
shaker dengan kecepatan 120 rpm, dengan intensitas cahaya 60 watt/m2. Fotofermentasi dilakukan dengan sistem curah dimana idealnya di dalam proses ini tidak ada penambahan ataupun pengurangan media.
Gambar 7 Proses fotofermentasi dengan shaker dan menggunakan penerangan lampu TL.
Seleksi Limbah Cair
22
dipreparasi. Kemudian ke dalam MP tersebut ditambahkan sebagian bahan-bahan pendukung seperti ekstrak khamir 1 g/l, natrium bikarbonat (NaHCO3) 1,5 g/l dan 1 ml larutan SL-6 (dalam g/l: 0,1 ZnSO4.7H2O, 0,03MnCl2.4H2O, 0,3 H3BO3, 0,2 CoCl2.6H2O, 0,01 CuCl2.2H2O, 0,02 NiCl2.6H2O, 0,03 Na2MoO4.H2O). Kecuali natrium bikarbonat yang ditambahkan sebelum dilakukan sterilisasi, bahan pendukung lainnya diberikan secara aseptis.
Optimasi
Media limbah yang menghasilkan gas hidrogen akan diberikan perlakuan tambahan sehingga mencapai kondisi optimal untuk produksi hidrogen. Percobaan ini dilakukan berdasarkan rancangan acak lengkap dengan 3 ulangan. Adapun perlakuan yang diujikan pada satuan percobaan antara lain adalah perbedaan kadar substrat yang terkandung di dalam limbah, perbedaan kadar pemberian
natrium bikarbonat, perbedaan kadar pemberian besi dan molibdenum. Satuan percobaan dalam penelitian ini adalah suatu botol reaktor berukuran 125 ml
dengan volume kerja 80 ml yang berisi media produksi dan agen fermentasi berupa bakteri fotosintetik, R. marinum. Adapun respon-respon yang diukur antara lain yaitu volume gas hasil fermentasi dan persentase gas hidrogen. Kadar gula total dan kadar asam organik awal serta akhir juga diukur untuk optimasi kandungan kadar substrat. Faktor-faktor lain yang mempengaruhi fermentasi telah dioptimasi pada penelitian sebelumnya, seperti pH awal adalah 7, kecepatan putaran mesin penggoyang (shaker) pada 120 rpm dan suhu 30°C. Intensitas cahaya sebesar 60 watt/m2 juga dijaga agar nilainya tetap (Habibi et al. 2011).
Perbedaan Kadar Substrat Limbah
Perbedaan Kadar Besi dan Molibdenum
Perbedaan pemberian kadar besi (Fe) dan molibdenum (Mo) dimaksudkan untuk mengetahui pengaruh pemberian besi dan molibdenum terhadap produksi hidrogen melalui proses fotofermentasi. Adapun kadar yang diuji adalah larutan besi sitrat (Fe-sitrat) 0, 20, 100, 500 µmol/l dan larutan natrium molibdat (Na-molibdat) 0, 3, 6, 12 µmol/l untuk limbah susu. Untuk limbah kecap digunakan larutan Fe-sitrat dan Na-molibdat sebesar 0, 20, 40, 80, 160 µmol/l. Perbedaan kadar pemberian Fe dan Mo ini ditambahkan ke dalam limbah cair dengan kadar
substrat yang memiliki efisiensi produk tertinggi. Ditambahkan juga ke dalam media ekstrak khamir sebanyak 1 g/l dan 10 ml kultur R. marinum.
Perbedaan Kadar Natrium Bikarbonat
Perbedaan pemberian jumlah natrium bikarbonat dimaksudkan untuk
mengetahui pengaruh natrium bikarbonat yang melepaskan gas CO2 terhadap fotofermentasi produksi hidrogen. Gas CO2 dilepaskan ketika terjadi pemanasan
terhadap natrium bikarbonat pada saat sterilisasi media. Perbedaan kadar yang diuji adalah 0, 1½, 3, 6 g/l natrium bikarbonat. Natrium bikarbonat dengan berbagai kadar ini kemudian ditambahkan ke dalam limbah dengan kadar substrat yang memiliki efisiensi produksi hidrogen tertinggi. Ke dalam MP juga ditambahkan ekstrak khamir 1 g/l, larutan SL-6 1 ml/l dan 10 ml kultur R. marinum.
Pengukuran Parameter Kinetika Produksi Hidrogen
Pengukuran parameter kinetika produksi hidrogen dilakukan pada botol reaktor 1 liter dengan volume kerja 900 ml. Proses penghomogenan dilakukan dengan bantuan alat magnetic stirrer (Ika) pada kecepatan 1 dengan skala 5. Media yang digunakan adalah limbah dengan kadar substrat yang memiliki efisiensi produk tertinggi tanpa penambahan bahan lainnya. Nilai parameter kinetika dari produksi hidrogen yang diukur antara lain laju pertumbuhan spesifik maksimum (µ max), rendemen (yield) biomassa/substrat (Yx/s), yield
24
produksi juga dilakukan pengambilan sampel berupa cairan media produksi sebanyak 5 ml untuk diukur nilai dari OD bakteri (biomassa), pH media, kadar gula total (substrat) dan total asam organik setiap jam tertentu.
Gambar 8 Sistem fotobioreaktor pada percobaan pengukuran parameter kinetika produksi hidrogen. Keterangan gambar: 1. botol reaktor, 2.
magnetic stirrer, 3. selang untuk pengambilan sampel cair (larutan sampel melalui selang silikon pada gelas penampung dengan syringe khusus (dapat mencegah gas keluar masuk) dan jarum suntik (Terumo) yang telah disemprot alkohol, tiap hari secara rutin hingga MP tidak lagi menghasilkan gas. Sebanyak 5 ml cairan media diambil sebagai sampel dengan cara menghubungkan
syringe steril pada selang silikon khusus untuk pengambilan sampel yang telah disemprot dengan alkohol 70%.
Analisa Sampel
Pemeriksaan Kadar Gas Hidrogen
Volume gas yang terbentuk dicatat pada setiap waktu pengambilan sampel yang diukur oleh skala yang ada pada syringe. Gas hidrogen yang ada pada gas yang diperoleh dari proses fermentasi ditentukan persentasenya dengan menggunakan kromatografi gas (HP 5890) yang dilengkapi dengan thermal
conductivity detector (TCD) dan kolom kromatografi gas (packed column). Suhu oven dijaga disekitar 80°C, sedangkan suhu untuk injector dan detector adalah 150°C dan 250°C secara berurut. Gas yang digunakan sebagai pembawa adalah nitrogen ultra high purity (UHP) dengan kecepatan 8 ml/menit. Volume gas yang diinjeksikan adalah 1 ml. Hidrogen murni digunakan sebagai standar perhitungan kadar hidrogen. Perhitungan kadar gas hidrogen hasil fermentasi adalah dengan membandingkan luas area sampel gas hidrogen hasil fermentasi dengan luas area gas hidrogen murni lalu dikalikan dengan volume produksi gas hasil fermentasi
atau dengan menggunakan persamaan matematis dari kurva baku standar hidrogen. Milimol hidrogen dapat dihitung dengan cara membagi volume hidrogen (dalam ml) dengan volume hidrogen pada keadaan standar yaitu 22,4 liter per mol hidrogen. Adapun berat hidrogen (dalam gram) dapat dihitung dengan mengalikan mol hidrogen dengan berat molekul hidrogen (BM H2 = 2).
Pemeriksaan OD Bakteri
OD Bakteri pada MP diperiksa dengan menggunakan metode spektrofotometri (Shimadzu) pada panjang gelombang 680 nm. Nilai OD bakteri dapat dikonversi menjadi nilai berat biomassa dengan membuat persamaan regresi antara nilai OD bakteri dan nilai berat biomassanya.
Pemeriksaan pH Sampel
pH sampel diperiksa dengan menggunakan indikator pH (Merck) atau pH meter (Jenway 3505).
Pemeriksaan Kadar Gula Total
Kadar gula total pada media diperiksa dengan menggunakan metode (fenol-asam sulfat). Sebanyak 0,5 ml sampel direaksikan di dalam tabung reaksi dengan
26
dengan menggunakan larutan glukosa pada kisaran kadar 10-100 ppm untuk mendapatkan persamaan matematis dengan regresi linier agar nilai absorbansi sampel gula dapat diubah menjadi ppm. Untuk mengubah ppm menjadi g/l, nilai ppm dibagi dengan 1000. Adapun untuk mengubah ppm menjadi mmol maka kadar gula dalam bentuk ppm dibagi 180 (BM glukosa) lalu dikalikan 1000 (mol ke mmol) dan dibagi 80 (volume media produksi).
Pemeriksaan Kadar Asam Organik
Kandungan asam organik diperiksa dengan menggunakan metode asidimetri (total asam) menggunakan NaOH 0,1 atau 0,01 N sebagai larutan titrasi. Sebanyak 1-10 ml sampel ditambahkan 3 tetes indikator PP (Phenolpthalein) yang kemudian dititrasi dengan larutan NaOH hingga warna sampel berubah (merah jambu hingga agak keunguan/warna menjadi lebih gelap). Untuk mengetahui
molaritas dari total asam, volume NaOH yang dibutuhkan kemudian dikalikan dengan normalitasnya (untuk NaOH, normalitas NaOH sama dengan molaritas
NaOH) dan dibagi dengan volume sampel dan dikalikan 1000, maka diperoleh kadar asam organik dalam mmol/l (mM). Untuk mendapatkan nilai kadar asam organik dalam mmol, jumlah kadar dalam mM dibagi dengan volume kerja media produksi (80 ml).
Analisis Data
Analisa data dilakukan dengan cara membandingkan rata-rata atau nilai
Gambar 9 Diagram alur kerja penelitian. Optimasi:
Kadar substrat
Penambahan besi sitrat
Penambahan natrium molibdat Penambahan natrium bikarbonat
Limbah Susu Limbah Kecap Preparasi Limbah:
Sentrifugasi Netralisasi Sterilisasi Kultivasi sel
Fotofermentasi
H2 R. marinum
HASIL DAN PEMBAHASAN
Preparasi Limbah
Preparasi limbah cair industri makanan lokal dilakukan dengan maksud
menyiapkan limbah agar dapat digunakan sebagai media produksi hidrogen untuk bakteri R. marinum. Perbedaan karakter fisik awal dari masing-masing limbah menyebabkan diperlukannya tahap preparasi. Karakter fisik untuk limbah tahu sebelum dipreparasi adalah berupa larutan cair dan bening dan masih terdapat sedikit padatan yang merupakan ampas dari sisa pengolahan tahu. Limbah tahu juga mengeluarkan bau yang tajam akibat telah terjadi fermentasi oleh bakteri yang ada di lingkungan. Pada limbah susu terdapat gumpalan-gumpalan berwarna coklat yang mengendap membentuk suspensi sehingga larutannya berwarna keruh. Penggumpalan diakibatkan karena adanya kegiatan enzim atau penambahan asam oleh bakteri yang ada di lingkungan selama proses penyimpanan. Penambahan asam terjadi akibat proses fermentasi yang dilakukan bakteri dengan mengubah gula (karbohidrat) menjadi asam organik, salah satunya laktosa. Laktosa yang merupakan gula alami yang terkandung di dalam susu diubah menjadi asam laktat, sehingga limbah susu berubah suasananya menjadi asam (pH 4). Selain itu, kerja enzim proteolitik dari bakteri mengakibatkan karbohidrat dan protein yang terkandung di dalam susu terkoagulasi menjadi
gumpalan coklat (repository.upi.edu 2012). Meskipun demikian, limbah susu masih mengeluarkan bau seperti susu. Limbah kecap memiliki karakter larutan
Gambar 10 Limbah cair tahu, kecap dan susu. A. Limbah cair sebelum disterilisasi. B. Limbah cair setelah disterilisasi atau dipanaskan.
Preparasi yang diberikan kepada limbah cair industri tahu, kecap dan susu antara lain sentrifugasi, netralisasi dan sterilisasi. Tiap limbah tidak diberikan urutan proses preparasi yang sama, karena tergantung dari karakter limbah itu sendiri. Pada limbah kecap dan tahu, proses sentrifugasi dilakukan pada tahap awal preparasi dengan tujuan menghilangkan padatan yang terdapat pada limbah. Setelah proses sentrifugasi, larutan yang diperoleh dinetralisasi dengan NaOH 0,1 atau 1 N. Volume NaOH yang ditambahkan disesuaikan dengan limbah, sehingga limbah dapat mencapai pH netral yaitu pH 7. Setelah pH netral, limbah disterilisasi dengan menggunakan otoklaf pada suhu 121°C selama 15 menit. Berbeda dengan limbah yang lain, limbah susu memiliki tahapan preparasi yang lebih panjang. Proses preparasi awal yang dilakukan pada limbah susu adalah pemanasan. Akan tetapi, sebelum dilakukan pemanasan, terlebih dahulu limbah susu dikocok untuk menyeragamkan isi dan kemudian ditimbang. Tujuan
dilakukannya pemanasan pada awal preparasi adalah untuk melarutkan kandungan gula dan protein yang ada pada gumpalan-gumpalan coklat. Pemanasan limbah susu dilakukan dengan menggunakan otoklaf pada suhu 121°C selama 15 menit. Limbah susu yang telah dipanaskan kemudian disaring dengan menggunakan kain. Dari 1 kg limbah susu yang dipanaskan, diperoleh ±750 gram larutan limbah susu. Setelah tahap penyaringan, larutan limbah susu ini kemudian dinetralisasi dengan menggunakan larutan NaOH 0,1 atau 1 N. Pada waktu proses netralisasi, terjadi bentuk suspensi dan mengendap akibat semakin bertambahnya nilai pH. Tahap selanjutnya yang dilakukan adalah proses sentrifugasi larutan limbah susu dengan tujuan untuk memisahkan larutan dengan endapan yang terbentuk selama proses preparasi. Setelah proses sentrifugasi, larutan limbah susu ini kemudian
31
disterilisasi dengan otoklaf pada suhu 121°C selama 15 menit. Setelah dilakukan sterilisasi, ternyata pada larutan limbah susu masih terbentuk padatan atau endapan. Hal ini kemudian diabaikan dan sebisa mungkin ketika larutan ini dituang ke dalam botol reaktor, endapan tersebut tidak ikut masuk. Limbah-limbah cair ini kemudian dikarakterisasi nilai kandungannya.
Karakterisasi Limbah
Hasil karakterisasi kandungan asam organik, gula total dan protein yang
terdapat pada limbah susu, tahu dan kecap yang telah dipreparasi diperoleh bahwa limbah kecap merupakan limbah yang paling banyak mengandung asam organik, gula dan protein dengan nilai 300 mM, 12,5% dan 2,13% secara berurutan. Diikuti oleh limbah susu dan limbah tahu seperti terlihat pada Tabel I. Limbah kecap juga mengandung zat besi sebesar 633,75 ppm dan zat molibdenum sebesar 0,27 ppm.
Tabel 1 Karakteristik limbah cair industri makanan setelah disterilisasi
Limbah Gula Total
menghasilkan gas hidrogen. Kekentalan dari larutan limbah kecap bisa menjadi faktor tidak diproduksinya gas hidrogen dikarenakan bakteri R. marinum tidak dapat tumbuh optimal di dalam media yang kental dan terlalu gelap. Hal ini dapat diatasi dengan cara mengencerkan larutan menjadi tidak terlalu pekat dari sebelumnya.
Untuk limbah tahu, tidak diproduksinya gas hidrogen pada limbah ini bisa dikarenakan minimnya substrat yang ada di dalam media produksi. Oleh karena itu, tidak ada cara untuk mengatasi masalah limbah tahu tersebut agar dapat
menghasilkan gas hidrogen, kecuali dengan menambahkan substrat dari luar. Maka daripada itu, dari hasil seleksi ketiga limbah cair industri makanan, limbah susu dan limbah kecap dipilih untuk selanjutnya dioptimasi, sedangkan untuk limbah tahu tidak lagi diteruskan.
Gambar 11 Volume hidrogen hasil fotofermentasi limbah cair industri susu, tahu dan kecap dengan R. marinum
Optimasi
Tujuan dari optimasi jumlah substrat dimaksudkan untuk mengetahui efisiensi antara produk yang dihasilkan dengan substrat yang tersedia dari proses fotofermentasi yang dilakukan dengan sistem curah. Kriteria yang biasa digunakan dalam mengevaluasi kinerja produksi hidrogen dari suatu substrat
33
dibandingkan secara persentase dengan jumlah hidrogen teoritis yang dihasilkan oleh substrat yang secara stoikiometri diubah menjadi hidrogen. Adapun jumlah substrat yang dikonversi pada proses fotofermentasi dengan menggunakan limbah cair adalah selisih jumlah gula total awal dengan jumlah gula total akhir dan selisih jumlah asam total awal dengan jumlah asam total akhir. Menurut persamaan 11 dan 13, 1 mol asam organik (asam laktat) dapat diubah menjadi 6 mol hidrogen dan 1 mol glukosa dapat diubah menjadi 12 mol hidrogen. Maka, jumlah hidrogen teoritis dapat diperoleh dengan mengkonversi mol dari selisih
jumlah gula total ditambah dengan mol selisih asam total menjadi mol hidrogen. Adapun efisiensi substrat diukur dengan membandingkan antara jumlah kadar gula yang dikonversi baik menjadi produk, biomassa sel atau produk samping dengan jumlah kadar gula awal dalam persentase.
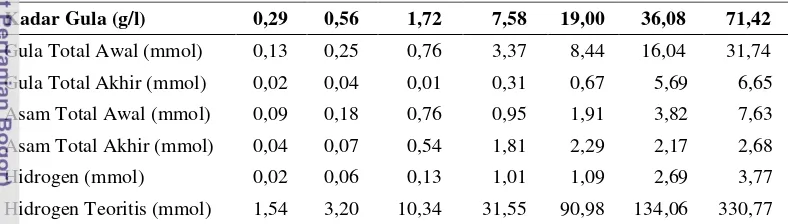
Tabel 2 Produksi rata-rata hidrogen secara fotofermentasi dari limbah susu
Kadar Gula (g/l) 0,29 0,56 1,72 7,58 19,00 36,08 71,42
Gula Total Awal (mmol) 0,13 0,25 0,76 3,37 8,44 16,04 31,74
Gula Total Akhir (mmol) 0,02 0,04 0,01 0,31 0,67 5,69 6,65 Asam Total Awal (mmol) 0,09 0,18 0,76 0,95 1,91 3,82 7,63
Asam Total Akhir (mmol) 0,04 0,07 0,54 1,81 2,29 2,17 2,68
Hidrogen (mmol) 0,02 0,06 0,13 1,01 1,09 2,69 3,77 Hidrogen Teoritis (mmol) 1,54 3,20 10,34 31,55 90,98 134,06 330,77
Gambar 12 Hidrogen hasil optimasi jumlah substrat pada proses fotofermentasi limbah cair industri susu dengan R. marinum
Apabila dihitung berdasarkan perbandingan antara hidrogen yang dihasilkan melalui proses fotofermentasi dengan hidrogen teoritis hasil konversi substrat yang digunakan baik dari gula maupun dari asam organik, maka diperoleh media dengan efisiensi tertinggi adalah media limbah susu dengan kadar gula 7,58 g/l dengan nilai efisiensi 3,22%. Meski menghasilkan hidrogen tertinggi pada proses fotofermentasi, media dengan kadar gula 71,42 g/l hanya memiliki efisiensi sebesar 1,15%. Hasil dapat dilihat pada Gambar 13.
Gambar 13 Efisiensi produk hasil optimasi jumlah substrat pada proses fotofermentasi limbah cair industri susu dengan R. marinum
35
g/l memiliki efisiensi substrat gula kurang dari 80%. Hasil dapat dilihat pada Gambar 14.
Gambar 14 Efisiensi substrat hasil optimasi jumlah substrat pada proses fotofermentasi limbah cair industri susu dengan R. marinum
Tabel 3 Produksi rata-rata hidrogen secara fotofermentasi dari limbah kecap
Kadar Gula (g/l) 5,00 10,94 18,40 30,85 48,50 75,60
Gula Total Awal (mmol) 2,22 4,86 8,18 13,71 21,55 33,60
Gula Total Akhir (mmol) 0,25 0,27 1,33 6,35 10,53 23,59 Asam Total Awal (mmol) 1,79 2,29 1,04 2,82 5,19 10,35
Asam Total Akhir (mmol) 2,35 3,44 2,30 3,80 5,60 4,47
Hidrogen (mmol) 0,50 3,32 2,23 2,49 4,57 0 Hidrogen Teoritis (mmol) 20,25 48,22 74,65 82,39 129,72 155,35
Gambar 15 Hidrogen hasil optimasi jumlah substrat pada proses fotofermentasi limbah cair industri kecap dengan R. marinum
Apabila dihitung berdasarkan perbandingan antara hidrogen yang dihasilkan melalui proses fotofermentasi dengan hidrogen teoritis hasil konversi sumber substrat yang digunakan baik dari gula maupun dari asam organik, maka diperoleh media dengan efisiensi tertinggi adalah media limbah kecap dengan kadar gula
awal 10,94 g/l dengan nilai efisiensi 6,88%. Meski menghasilkan hidrogen tertinggi pada proses fotofermentasi, media dengan kadar gula 48,50 g/l hanya memiliki efisiensi sebesar 3,52%. Hasil dapat dilihat pada Gambar 16.
Gambar 16 Efisiensi produk hasil optimasi jumlah substrat pada proses fotofermentasi limbah cair industri kecap dengan R. marinum
37
Diikuti media limbah kecap dengan kadar gula 5,00 g/l sebesar 88,66%. Pada media limbah kecap dengan kadar gula lebih dari 30,85 g/l memiliki efisiensi substrat gula kurang dari 60%. Hasil dapat dilihat pada Gambar 17.
Gambar 17 Efisiensi substrat hasil optimasi jumlah substrat pada proses fotofermentasi limbah cair industri kecap dengan R. marinum
Kadar gula dengan hasil efisiensi produk tertinggi dari media limbah susu dan kecap dijadikan acuan sebagai kadar gula untuk media produksi hidrogen untuk mengetahui pengaruh perbedaan penambahan besi, molibdenum dan natrium bikarbonat terhadap gas hidrogen yang akan dihasilkan.
Pada taraf nyata = 0,05, dapat diambil kesimpulan bahwa tidak ada perbedaan yang nyata antara besar konsentrasi penambahan besi, molibdenum dan natrium bikarbonat yang diujikan pada media produksi dari limbah susu terhadap gas hidrogen yang dihasilkan karena nilai p-value dari masing- masing penambahan lebih besar daripada 0,05.
Gambar 18 Perbandingan produksi gas hidrogen hasil fotofermentasi limbah susu dengan perbedaan penambahan jumlah Fe ( ), Mo ( ) dan NaHCO3 ( ) pada media produksi. Keterangan: k untuk konsentrasi. Untuk Fe, k1 = 0 µmol/l, k2 = 20 µmol/l, k3 = 100 µmol/l, k4 = 500 µmol/l. untuk Mo, k1 = 0 µmol/l, k2 = 3 µmol/l, k3 = 6 µmol/l, k4 = 12 µmol/l, untuk NaHCO3, k1 = 0 g/l, k2 = 1,5 g/l, k3 = 3 g/l, k4 = 6 g/l.
Pada media produksi limbah kecap, rata-rata gas hidrogen tertinggi untuk
39
molibdenum dan natrium bikarbonat yang diujikan pada media produksi dari limbah kecap terhadap gas hidrogen yang dihasilkan karena nilai p-value dari masing- masing penambahan lebih besar daripada 0,05.
Gambar 19 Perbandingan produksi gas hidrogen hasil fotofermentasi limbah kecap dengan perbedaan penambahan jumlah Fe ( ), Mo ( ) dan NaHCO3 ( ) pada media produksi. keterangan: k untuk konsentrasi. Untuk Fe dan Mo, k1 = 0 µmol/l, k2 = 20 µmol/l, k3 = 40 µmol/l, k4 = 80 µmol/l, k5 = 160 µmol/l, untuk NaHCO3, k1 = 0 g/l, k2 = 1,5 g/l, k3 = 3 g/l, k4 = 6 g/l.