ABSTRACT
YUDI GUNAWAN. Red Blood Cells Profiles of Superovulated Ewes prior to Mating and hCG Injected Ewes on the 6th Day after Mating during Early Pregnancy. Under direction of ANDRIYANTO and WASMEN MANALU.
PMSG and hCG are hormones that are often used for superovulation. Superovulated ewes have different conditions from ewes without superovulation. This research was designed to study red blood cells count, hematocrit values, and hemoglobin levels of the superovulated sheep. Twenty one ewes weighing between 15 up to 25 kg were divided into 4 groups. The first group was control without superovulation and without hCG injection. The second group was superovulated before mating. The third group was given hCG on the 6th day after mating, and the fourth group was superovulated before mating and injected with hCG on the 6th day after mating. Blood samples were drawn from the jugular vein every 3 days during the early pregnancy. The result showed that superovulation prior to mating and hCG injection after mating did not affect red blood cells count, hematocit, and hemoglobin concentrations.
ABSTRAK
YUDI GUNAWAN. Gambaran Darah Merah Domba yang Disuperovulasi Sebelum Kawin dan Disuntik hCG Hari ke-6 Setelah Kawin pada Awal Kebuntingan. Dibimbing oleh ANDRIYANTO dan WASMEN MANALU.
Superovulasi sering dilakukan menggunakan sediaan PMSG dan hCG. Domba yang disuperovulasi memiliki kondisi yang berbeda dengan domba tanpa superovulasi. Penelitian ini dilakukan untuk mengetahui pengaruh superovulasi sebelum kawin dan penyuntikan hCG hari ke-6 setelah kawin terhadap jumlah sel darah merah, nilai hematokrit, dan kadar hemoglobin domba pada awal kebuntingan. Sebanyak 21 ekor domba dengan bobot 15-25 kg dibagi menjadi 4 kelompok perlakuan. Kelompok pertama, tidak disuperovulasi dan tidak disuntik hCG. Kelompok kedua, disuperovulasi sebelum kawin. Kelompok ketiga hanya disuntik hCG hari ke-6 setelah kawin. Kelompok keempat, disuperovulasi sebelum kawin dan disuntik hCG hari ke-6 setelah kawin. Pengambilan sampel darah dilakukan di vena jugularis setiap 3 hari pada awal kebuntingan. Hasil penelitian ini menunjukkan superovulasi sebelum kawin dan penyuntikan hCG hari ke-6 setelah kawin tidak mempengaruhi jumlah sel darah merah, nilai hematokrit, dan kadar hemoglobin.
GAMBARAN DARAH MERAH DOMBA YANG
DISUPEROVULASI SEBELUM KAWIN DAN DISUNTIK hCG
HARI KE-6 SETELAH KAWIN PADA AWAL KEBUNTINGAN
YUDI GUNAWAN
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul Gambaran Darah Merah Domba yang Disuperovulasi Sebelum Kawin dan Disuntik hCG Hari ke-6 Setelah Kawin pada Awal Kebuntingan adalah hasil karya saya sendiri dengan arahan dosen pembimbing skripsi dan belum diajukan dalam bentuk apapun pada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, 27 September 2012
ABSTRACT
YUDI GUNAWAN. Red Blood Cells Profiles of Superovulated Ewes prior to Mating and hCG Injected Ewes on the 6th Day after Mating during Early Pregnancy. Under direction of ANDRIYANTO and WASMEN MANALU.
PMSG and hCG are hormones that are often used for superovulation. Superovulated ewes have different conditions from ewes without superovulation. This research was designed to study red blood cells count, hematocrit values, and hemoglobin levels of the superovulated sheep. Twenty one ewes weighing between 15 up to 25 kg were divided into 4 groups. The first group was control without superovulation and without hCG injection. The second group was superovulated before mating. The third group was given hCG on the 6th day after mating, and the fourth group was superovulated before mating and injected with hCG on the 6th day after mating. Blood samples were drawn from the jugular vein every 3 days during the early pregnancy. The result showed that superovulation prior to mating and hCG injection after mating did not affect red blood cells count, hematocit, and hemoglobin concentrations.
ABSTRAK
YUDI GUNAWAN. Gambaran Darah Merah Domba yang Disuperovulasi Sebelum Kawin dan Disuntik hCG Hari ke-6 Setelah Kawin pada Awal Kebuntingan. Dibimbing oleh ANDRIYANTO dan WASMEN MANALU.
Superovulasi sering dilakukan menggunakan sediaan PMSG dan hCG. Domba yang disuperovulasi memiliki kondisi yang berbeda dengan domba tanpa superovulasi. Penelitian ini dilakukan untuk mengetahui pengaruh superovulasi sebelum kawin dan penyuntikan hCG hari ke-6 setelah kawin terhadap jumlah sel darah merah, nilai hematokrit, dan kadar hemoglobin domba pada awal kebuntingan. Sebanyak 21 ekor domba dengan bobot 15-25 kg dibagi menjadi 4 kelompok perlakuan. Kelompok pertama, tidak disuperovulasi dan tidak disuntik hCG. Kelompok kedua, disuperovulasi sebelum kawin. Kelompok ketiga hanya disuntik hCG hari ke-6 setelah kawin. Kelompok keempat, disuperovulasi sebelum kawin dan disuntik hCG hari ke-6 setelah kawin. Pengambilan sampel darah dilakukan di vena jugularis setiap 3 hari pada awal kebuntingan. Hasil penelitian ini menunjukkan superovulasi sebelum kawin dan penyuntikan hCG hari ke-6 setelah kawin tidak mempengaruhi jumlah sel darah merah, nilai hematokrit, dan kadar hemoglobin.
©
Hak cipta milik Institut Pertanian Bogor, tahun 2012
Hak cipta dilindungi Undang-Undang
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apapun, baik cetak, fotokopi,
GAMBARAN DARAH MERAH DOMBA YANG
DISUPEROVULASI SEBELUM KAWIN DAN DISUNTIK hCG
HARI KE-6 SETELAH KAWIN PADA AWAL KEBUNTINGAN
YUDI GUNAWAN
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan di Fakultas Kedokteran Hewan
Institut Pertanian Bogor
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Gambaran Darah Merah Domba yang Disuperovulasi sebelum Kawin dan Disuntik hCG Hari ke-6 setelah Kawin pada Awal Kebuntingan.
Nama Mahasiswa : Yudi Gunawan
NRP : B04080026
Program Studi : Kedokteran Hewan
Disetujui,
Tanggal lulus:
Pembimbing I
drh. Andriyanto, M.Si NIP. 19820104 2006040 1 006
Pembimbing II
Prof. Dr. Ir. Wasmen Manalu NIP. 19571220 198312 1 001
Diketahui,
Wakil Dekan Fakultas Kedokteran Hewan Institut Pertanian Bogor
KATA PENGANTAR
Puji dan syukur dipanjatkan ke hadapan Allah SWT atas karuniaNya
sehingga skripsi ini berhasil diselesaikan. Penelitian dengan judul “Gambaran Darah Merah Domba yang Disuperovulasi sebelum Kawin dan Disuntik hCG Hari ke-6 setelah Kawin pada Awal Kebuntingan” dilaksanakan di Desa Tegalwaru, Kecamatan Ciampea, Kabupaten Bogor dan Laboratorium Fisiologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor sejak bulan Mei sampai Juli 2011.
Penghargaan dan terima kasih yang sebesar-besarnya penulis sampaikan kepada:
1. Kedua orang tua dan keluarga tercinta atas restu, doa, dan motivasinya
2. drh. Andriyanto, M. Si selaku dosen pembimbing pertama yang telah Maharani, Mitha Tumiati, Andi N. Marijuana, Rika S., Vivien K. Wardhani, serta sahabat-sahabat di Fakultas Kedokteran Hewan khususnya Angkatan 45 (2008) atas motivasi dan sumbangsih tenaga maupun pikiran yang diberikan selama penelitian ini.
6. Rekan seperjuangan: KMS. Ferri Rahman, A. Fadhli, Arif K. W., Eduwin E. F., dan Rofindra R., serta saudara-saudara OMDA IKAMUSI lainnya atas motivasi dan doanya
7. Semua pihak yang telah membantu penelitian dan pembuatan skripsi ini
Akhirnya penulis berharap semoga skripsi ini bermanfaat dan memberikan kontribusi yang nyata terhadap perkembangan ilmu pengetahuan.
Bogor, 27 September 2012
RIWAYAT PENULIS
Yudi Gunawan. Lahir di Lahat, 7 Januari 1990 dari bapak Kurnawi dan mamak Siti Aisyah, sebagai putra keenam dari tujuh bersaudara. Penulis menamatkan SMA pada tahun 2008 dari SMA Santo Yosef, Lahat dan pada tahun yang sama diterima di IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih Program Studi Kedokteran Hewan, Faklutas Kedokteran Hewan. Selama mengikuti perkuliahan, penulis aktif dalam berbagai kegiatan termasuk menjadi pengurus OMDA IKAMUSI Sumatera Selatan, menjadi anggota UKM Taekwondo IPB dan organisasi Himpro Ruminansia FKH IPB, serta beberapa kegiatan bermanfaat lainnya.
Pada tahun 2010 mengikuti kegiatan PKM Penelitian yang lolos seleksi
dan mendapat pendanaan DIKTI dengan judul “Efektivitas Ekstrak Biji Pepaya
sebagai Anthelmintik”. Pada tahun 2011 mengikuti lomba puisi Sepena Pujangga
tingkat nasional dan memperoleh juara II. Penulis mendapatkan beasiswa selama pendidikan SMA yaitu beasiswa khusus Siswa Berprestasi SMA Santo Yosef, beasiswa BUMN PT. Kereta Api, dan beasiswa Siswa Berprestasi Kabupaten Lahat. Penulis juga pernah mendapatkan beasiswa selama 3 tahun berturut-turut di bangku perkuliahan sejak tahun 2010 hingga 2012 yaitu beasiswa Peningkatan Prestasi Akademik (PPA) IPB, beasiswa Bantuan Belajar Mahasiswa (BBM) IPB, dan beasiswa Gerakan Kakak Asuh (GKA) FKH IPB.
Penulis telah melakukan penelitian sebagai bahan dalam penyusunan
DAFTAR ISI
3.4.1. Rancangan Percobaan………. 14
3.4.2. Superovulasi dan Penyuntikan hCG……….. 14
3.4.3. Pengambilan Sampel………... 15
3.4.4. Penghitungan Jumlah Sel Darah Merah, Nilai Hematokrit, dan Kadar Hemoglobin………... 15
3.5. Variabel yang Diamati……… 16
DAFTAR TABEL
Halaman Tabel 1 Parameter hematologi domba normal………..……... 6 Tabel 2 Jumlah sel darah merah (106/ mm3) domba yang disuperovulasi
sebelum kawin dan disuntik hCG hari ke-6 setelah kawin, pada awal kebuntingan... 17 Tabel 3 Nilai hematokrit (%) domba yang disuperovulasi sebelum
kawin dan disuntik hCG hari ke-6 setelah kawin, pada awal kebuntingan... 21 Tabel 4 Kadar hemoglobin (g%) domba yang disuperovulasi sebelum
DAFTAR GAMBAR
Halaman
Gambar 1 Struktur membran eritrosit………... 7
Gambar 2 Domba ekor tipis……….. 11
Gambar 3 Domba ekor gemuk……….. 11
Gambar 4 Domba Priangan………... 12
Gambar 5 Grafik jumlah sel darah merah induk domba kontrol (), disuperovulasi sebelum kawin (■), disuntik hCG hari ke-6 setelah kawin (▲), disuperovulasi sebelum kawin dan disuntik hCG hari ke-6 setelah kawin (●), pada awal kebuntingan….………... 18
Gambar 6 Grafik nilai hematokrit induk domba kontrol (), disuperovulasi sebelum kawin (■), disuntik hCG hari ke-6 setelah kawin (▲), disuperovulasi sebelum kawin dan disuntik hCG hari ke-6 setelah kawin (●), pada awal kebuntingan….………... 22
BAB I
PENDAHULUAN
1.1. Latar Belakang
Indonesia adalah negara tropis dengan nilai sumber daya alam tinggi. Kekayaan sumber daya alam Indonesia berbanding lurus dengan peningkatan kuantitas sumber daya manusia yang dimiliki. Kondisi ini merupakan kondisi alamiah yang menunjukkan ketergantungan manusia pada ketersediaan alam untuk mempertahankan hidupnya. Salah satu kebutuhan manusia yang sangat bergantung pada alam dalam pemenuhannya adalah kebutuhan pangan.
Kualitas sumber daya manusia secara tidak langsung dipengaruhi oleh pangan, dalam hal ini kualitas pangan yang dikonsumsi. Manusia untuk mampu menjadi makhluk yang produktif dalam bidang sosial, pendidikan, maupun ekonomi sehingga menghasilkan kehidupan yang berkualitas membutuhkan kondisi tubuh yang sehat. Kesehatan tubuh sangat ditentukan oleh pangan yang dikonsumsi. Protein hewani adalah jenis pangan yang dipercaya meningkatkan kinerja fisiologis tubuh hingga mencapai optimal.
Sumber protein hewani yang cukup banyak dihasilkan di Indonesia terutama berasal dari ternak ruminansia. Budidaya domba dan kambing sebagai ternak ruminan banyak dilakukan oleh masyarakat baik sebagai mata pencaharian utama maupun sebagai penghasilan tambahan. Permintaan daging ternak ruminansia dalam negeri selalu meningkat setiap tahunnya, namun peningkatan permintaan ini belum seimbang dengan peningkatan populasi ternak yang cenderung lebih lambat. Produksi daging kambing dan domba baru memenuhi 40% kebutuhan dalam negeri, dilain pihak Pemerintah Saudi Arabia membutuhkan pasokan kambing dan domba 1 juta ekor per tahun (Direktorat Jenderal Budidaya Peternakan 2002).
reproduksi yang sedang berkembang dalam beberapa dekade terakhir, salah satunya adalah superovulasi. Superovulasi mampu meningkatkan jumlah korpus luteum yang dihasilkan dan meningkatkan jumlah folikel yang berkembang hingga mengalami ovulasi yang dirangsang melalui penyuntikan pregnant mare serum gonadotropin/human chorionic gonadotrophin (Dziuk 1992; Kleeman et al. 1994; Manalu et al. 2000a). Superovulasi meningkatkan jumlah folikel dan korpus luteum telah terbukti dapat meningkatkan sekresi hormon-hormon kebuntingan, pertumbuhan uterus, jumlah embrio dan fetus, bobot lahir dan bobot sapih, pertumbuhan dan perkembangan kelenjar susu, dan produksi susu pada domba (Manalu et al. 1998; Manalu et al. 1999; Manalu et al. 2000a; Manalu et al. 2000b).
1.2. Tujuan
Penelitian ini bertujuan untuk mengetahui pengaruh superovulasi sebelum kawin dan penyuntikan hCG hari ke-6 setelah kawin terhadap gambaran jumlah sel darah merah, nilai hematokrit, dan kadar hemoglobin domba pada awal kebuntingan yang dibandingkan dengan domba yang tidak disuperovulasi sebagai kontrol.
1.3. Manfaat
BAB II
TINJAUAN PUSTAKA
2.1. Superovulasi
Superovulasi merupakan salah satu cara untuk meningkatkan jumlah korpus luteum yang dihasilkan dan peningkatan jumlah folikel yang berkembang hingga mengalami ovulasi dirangsang melalui penyuntikan pregnant mare serum gonadotropin/human chorionic gonadotrophin (PMSG/hCG). Jumlah korpus luteum dan folikel sangat erat kaitannya dengan tingkat sekresi hormon kebuntingan dan hormon mammogenik seperti estradiol dan progesteron selama kebuntingan (Dziuk 1992; Kleeman et al. 1994; Manalu et al. 2000a). Peningkatan jumlah folikel, korpus luteum, dan plasenta menyebabkan kenaikan sekresi dari kelenjar penghasil hormon kebuntingan dan mammogenik.
Hormon kebuntingan dan mammogenik berperan penting dalam pemeliharaan kebuntingan hingga memasuki periode pasca partus. Penggunaan PMSG/hCG untuk meningkatkan jumlah folikel dan korpus luteum telah terbukti dapat meningkatkan sekresi hormon-hormon kebuntingan, pertumbuhan uterus, embrio dan fetus, bobot lahir dan bobot sapih, pertumbuhan dan perkembangan kelenjar susu, dan produksi susu pada domba (Manalu et al. 1998; Manalu et al. 1999; Manalu et al. 2000a; Manalu et al. 2000b), sapi (Sudjatmogo et al. 2001), dan kambing (Adriani et al. 2004a).
Perlakuan superovulasi dengan level dosis 600 hingga 1200 IU per ekor pada babi meningkatkan sekresi progesteron dan estradiol serta pertumbuhan dan perkembangan uterus dan plasenta pada masa gestasi 15, 35, dan 70 hari. Kondisi ini membuktikan bahwa superovulasi dengan dosis 600 sampai 1200 IU dapat meningkatkan reproduksi babi. Superovulasi pada induk akan meningkatkan hormon kebuntingan progesteron sekaligus juga meningkatkan kapasitas plasenta yang dimanifestasikan melalui peningkatan bobot basah dan kering, massa sel aktif, aktivitas sintetik sel (DNA dan RNA), dan sintesis nutrien plasenta hingga usia 70 hari kebuntingan. Peningkatan kapasitas plasenta juga dipengaruhi oleh pemeliharaan korpus luteum dan produksi progesteron oleh plasenta (Mege et al. 2005).
Peningkatan volume ambing sebagai efek superovulasi sangat nyata meningkatkan produksi susu yang dihasilkan dan bekerja sinergis dengan kombinasi suplementasi seng dalam pakan, terutama pada konsentrasi seng 60 mg/kg bahan kering. Peningkatan volume ambing selama kebuntingan sejalan dengan peningkatan korpus luteum, estrogen, dan progesteron yang dihasilkan serta berhubungan erat dengan naiknya produksi susu. Peningkatan produksi susu akibat superovulasi tidak mempengaruhi kualitas susu dan konsumsi nutrien pakan (Adriani et al. 2004b).
Sediaan yang juga sering dimanfaatkan untuk perlakuan superovulasi adalah controlled internal drug release (CIDR) dan folicle stimulating hormone (FSH). Bentuk CIDR seperti huruf T dengan bahan silikon yang mengandung hormon progesteron. Perlakuan superovulasi dengan kombinasi CIDR dan FSH disertai penyuntikan hCG mampu secara nyata meningkatkan respon superovulasi dan jumlah korpus luteum yang terbentuk pada induk sapi donor Brangus sehingga meningkatkan jumlah embrio terkoleksi dan jumlah embrio layak transfer. Jumlah korpus luteum yang dihasilkan pada perlakuan superovulasi dengan CIDR, FSH, dan hCG meningkat signifikan dibandingkan dengan kelompok hewan coba yang hanya disuperovulasi dengan CIDR dan FSH (Kaiin dan Tappa 2006).
gonadotropin. Terdapat bukti nyata bahwa konsentrasi progesteron pada masa inisiasi superovulasi memegang peranan yang penting dan konsentrasi progesteron yang tinggi menjadi indikasi signifikan dari keberhasilan program untuk mendapatkan embrio berkualitas baik dengan jumlah yang lebih tinggi. Adriani et al. (2007), dalam jurnalnya menyatakan bahwa perlakuan superovulasi dengan dosis 40 mg FSH secara intramuskular pada sapi Simbrah memberikan hasil terbaik dengan jumlah korpus luteum terbanyak.
2.2. Hematologi Darah
Darah merupakan komponen metabolisme makhluk hidup yang berperan sebagai media transportasi oksigen dan sari makanan ke dalam jaringan dan mengangkut sisa metabolisme jaringan dan karbon dioksida untuk selanjutnya diekskresikan. Selain itu, sistem sirkulasi darah dapat juga berperan sebagai sarana penyaluran sekresi kelenjar endokrin menuju organ target. Menurut Dellman dan Brown (1989), volume total darah mamalia berkisar antara 7-8 % dari bobot badan dengan komposisi plasma sebesar 75-85% dan sisanya merupakan benda-benda darah sebanyak 25-35 % yang terdiri atas eritrosit (sel darah merah), leukosit (sel darah putih), dan platelet (keping darah). Sedangkan plasma darah itu sendiri tersusun atas 91-92% cairan dan 8-9% padatan (Swenson 1984).
Perubahan gambaran darah seperti jumlah sel darah merah, nilai hematokrit, dan kadar hemoglobin dapat mencerminkan adanya perubahan status fisiologis. Indeks hematologi domba normal tersaji pada Tabel 1.
Tabel 1 Parameter Hematologi Domba Normal Parameter Nilai kisaran Satuan RBC (eritrosit) 8-16 106/µl
(Sumber: Frandson 1996, Banks 1993, dan Kelly 1984)
2.3. Sel Darah Merah (Eritrosit)
Istilah eritrosit berasal dari bahasa yunani yaitu eritro yang berarti darah dan sit yang berarti sel. Proses pembentukan sel-sel eritrosit berbeda tergantung pada tahap perkembangan hewan. Pada masa fetus, sel eritrosit diproduksi oleh hati dan limpa, sedangkan pada saat hewan dewasa produksi eritrosit diambil alih fungsinya oleh sumsum tulang merah (Frandson 1996). Domba memiliki eritrosit berukuran sekitar 4,8 µ m dengan bentuk cakram bikonkaf dan pinggiran sirkuler (Swenson 1984).
debris (puing-puing) sel rusak untuk selanjutnya dibuang dari sirkulasi (Frandson 1996).
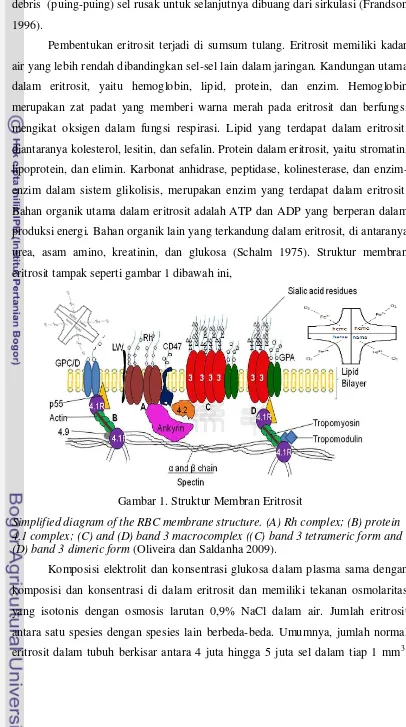
Pembentukan eritrosit terjadi di sumsum tulang. Eritrosit memiliki kadar air yang lebih rendah dibandingkan sel-sel lain dalam jaringan. Kandungan utama dalam eritrosit, yaitu hemoglobin, lipid, protein, dan enzim. Hemoglobin merupakan zat padat yang memberi warna merah pada eritrosit dan berfungsi mengikat oksigen dalam fungsi respirasi. Lipid yang terdapat dalam eritrosit, diantaranya kolesterol, lesitin, dan sefalin. Protein dalam eritrosit, yaitu stromatin, lipoprotein, dan elimin. Karbonat anhidrase, peptidase, kolinesterase, dan enzim-enzim dalam sistem glikolisis, merupakan enzim-enzim yang terdapat dalam eritrosit. Bahan organik utama dalam eritrosit adalah ATP dan ADP yang berperan dalam produksi energi. Bahan organik lain yang terkandung dalam eritrosit, di antaranya urea, asam amino, kreatinin, dan glukosa (Schalm 1975). Struktur membran eritrosit tampak seperti gambar 1 dibawah ini,
Gambar 1. Struktur Membran Eritrosit
Simplified diagram of the RBC membrane structure. (A) Rh complex; (B) protein 4.1 complex; (C) and (D) band 3 macrocomplex ((C) band 3 tetrameric form and (D) band 3 dimeric form (Oliveira dan Saldanha 2009).
Jumlah eritrosit dalam tubuh memiliki nilai yang cenderung tetap. Hal ini menunjukkan adanya kesesuaian kecepatan pembentukan eritrosit baru dengan kecepatan rusaknya eritrosit lama.
Proses pembentukan darah yang terdiri atas eritrosit, leukosit, dan platelet disebut hemopoiesis. Sel darah hewan dewasa berasal dari satu sumber, yaitu sel-sel batang primordial di dalam sumsum tulang. Eritropoiesis adalah proses pembentukan eritrosit yang dipengaruhi oleh respon tubuh terhadap kadar oksigen dalam jaringan. Bila jaringan dan sel mengalami kondisi hipoksia atau kurangnya kadar oksigen yang dibutuhkan untuk metabolisme optimum, maka renal akan melepaskan hormon eritropoietin ke plasma darah untuk merangsang eritropoiesis. Eritropoietin akan berada dalam plasma satu jam setelah mulai terjadinya hipoksia. Hipoksia dapat terjadi karena rendahnya kadar oksigen dalam darah yang dapat disebabkan oleh hipoventilasi, maupun karena afinitas hemoglobin yang rendah terhadap oksigen sehingga suplai oksigen ke jaringan menurun. Sumsum tulang tidak menunjukkan respon langsung terhadap hipoksia dan umumnya produksi eritrosit baru akan terjadi tiga hari kemudian hingga kondisi hipoksia dapat dihilangkan. Setelah kondisi hipoksia berakhir, eritrosit yang berlebih dalam sirkulasi akan dieliminasi melaui mekanisme atrisi (pelemahan) dan degenerasi normal setelah kurang lebih bersirkulasi selama 120 hari tanpa pergantian (Frandson 1996).
Kondisi kelainan klinis berupa menurunnya jumlah eritrosit dibawah batas normal disebut anemia. Anemia dapat terjadi karena infeksi maupun kelainan kongenital. Menurunnya jumlah eritrosit berakibat pada menurunnya suplai oksigen ke jaringan dan terhambatnya penyaluran bahan organik ke sel yang secara tidak langsung menggangu metabolisme tubuh. Jumlah eritrosit yang meningkat hingga diatas ambang normal juga merupakan suatu kondisi kelainan yang disebut polisitemia (Guyton dan Hall 1997).
renal, dan efek samping dari berbagai jenis obat-obatan. Aktivitas neurohormonal dan antiinflamasi seringkali menjadi kunci awal munculnya penyakit yang bersifat progresif hingga akhirnya berujung pada anemia. Menurut Silverberg (2011), penyebab utama anemia pada kondisi gagal jantung kongesti, adalah penyakit ginjal kronis yang mengakibatkan terjadinya depresi produksi eritropoietin di ginjal diikuti produksi sitokin yang berlebihan dan berakhir dengan terjadinya depresi produksi eritropoietin di ginjal maupun di sumsum tulang. Kelebihan produksi sitokin pada gagal jantung kongesti juga menyebabkan defisiensi besi karena sitokin akan meningkatkan produksi hepcidin dari hati yang menyebabkan penurunan absorpsi besi di gastrointestinal dan mengurangi pelepasan besi dari depositnya di makofag dan hepatosit.
Polisitemia didefinisikan sebagai kenaikan hematokrit dan hemoglobin berturut-turut. Penyebab utamanya dapat karena penyakit neoplastik seperti polisitemia vera dengan proliferasi sel klon. Beberapa kondisi polisitemia dapat terjadi sebagai hasil dari hipoksia kronis. Polisitemia fisiologis dapat ditemukan di penduduk dataran tinggi dan atlit yang berlatih di daerah tinggi (Kohler dan Dellweg 2010).
2.4. Hemoglobin
Kerusakan eritrosit menyebabkan keluarnya hemoglobin dari sel, sehingga Fe yang terikat pada gugus heme akan ikut terlepas ke jaringan. Fe yang terlepas akan ditangkap oleh transferin dan kemudian disimpan untuk dapat digunakan lagi. Transferin adalah protein dalam plasma yang mampu mengikat Fe secara reversible. Kadar Fe dalam tubuh dipengaruhi oleh tingkat hemoglobin dan bobot tubuh. Selain dalam hemoglobin, Fe juga terdapat dalam feritin dan hemosiderin. Kandungan Fe yang lebih sedikit terdapat dalam mioglobin, plasma, dan cairan ekstraseluler. Hemoglobin yang rusak menyebabkan terbentuknya bilirubin. Bilirubin adalah zat warna kuning yang mampu berikatan kompleks dengan albumin sebelum ditranspor ke hati (Guyton dan Hall 1997).
2.5. Hematokrit (PCV)
Suatu ukuran yang menunjukkan volume total eritrosit dalam setiap 100 mL darah disebut hematokrit atau Packed Corpuscular Volume (PCV). Nilai hematokrit dinyatakan dalam persentase. Dalam pengukuran nilai hematokrit, darah dibagi menjadi tiga bagian, yaitu eritrosit pada bagian dasar, leukosit dan trombosit yang berupa lapisan berwarna putih sampai abu-abu (buffy coat), dan plasma darah pada bagian paling atas (Schalm 1975). Pada kondisi perdarahan, jumlah eritrosit yang hilang seringkali berbanding lurus dengan plasma darah sehingga nilai hematokrit tetap. Nilai hematokrit yang rendah dapat menyebabkan anemia (Duncan dan Prase 1986).
2.6. Domba
Domba tergolong sebagai hewan ruminansia kecil yang didosmetikasi atau diternakkan sebagai sumber protein hewani dan merupakan kerabat kambing, sapi, dan kerbau (Mulyono 2005). Domba termasuk dalam Famili Bovidae dan Genus Ovis. Domba yang diternakkan saat ini, diperkirakan merupakan hasil domestikasi tiga jenis domba liar, yaitu Mouflon (Ovis musimon) dari Eropa Selatan dan Asia Kecil, Argali (Ovis amon) dari Asia Tenggara, dan Urial (Ovis vignei) dari Asia.
memiliki ukuran tubuh dan ekor yang relatif kecil, bulu cenderung berwarna putih, domba jantan bertanduk kecil dan melingkar, sedangkan domba betina tidak bertanduk, bobot domba jantan berkisar 30-40 kg dan bobot betina berkisar 15-20 kg (Sarwono 2004). Bangsa domba ekor tipis berasal dari India dan Bangladesh dengan penamaan yang berbeda di berbagai wilayah di Indonesia, seperti domba negeri, domba kampung, domba lokal, dan domba kacang. Gambaran domba ekor tipis tampak seperti gambar dibawah ini,
Gambar 2. Domba ekor tipis (Sumber: Anomim1 2012)
Domba ekor gemuk memiliki ukuran badan yang besar, bobot domba jantan mencapai 50 kg dan bertanduk, sedangkan domba betina mencapai 40 kg dan tidak bertanduk. Bangsa domba ekor gemuk cenderung berekor panjang dengan bagian pangkalnya besar dan menimbun banyak lemak. Domba ini banyak tersebar di Madura, Sulawesi, Lombok, dan Jawa Timur. Gambaran domba ekor gemuk tampak seperti gambar dibawah ini,
Gambar 3. Domba ekor gemuk (Sumber: Anomim2 2012)
Gambar 4. Domba Priangan (Sumber: Anomim3 2012)
BAB III
BAHAN DAN METODE
3.1. Waktu dan Tempat
Kegiatan penelitian dilakukan dari bulan Mei hingga bulan Juli 2011. Penelitian dilakukan di dua tempat, yaitu kandang milik MT. Farm di Desa Tegalwaru, Kecamatan Ciampea, Kabupaten Bogor dan laboratorium Fisiologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
3.2. Alat dan Bahan
Alat yang digunakan dalam penelitian ini, yaitu spuit, seperangkat alat USG, tabung reaksi, gelas objek, hemositometer, selotip, lap, marker, kertas label, tabung kapiler, alat penghitung, kamar hitung darah Neubauer, Adam Mikrohematokrit reader, penyumbat tabung kapiler, alat sentrifugasi, tambang, dan mikroskop cahaya.
Bahan yang digunakan dalam penelitian, diantaranya 21 ekor domba betina tidak bunting, hormon Prostaglandin PGF2 alpha (dinoprost dan tromethamin), hormon Pregnant Mare Serum Gonadotropin (PMSG) dan human Chorionic Gonadotropin (hCG), pengencer Turk, NaCl fisiologis 0,9%, antikoagulan Ethilen Diamine Tetraasetate (EDTA), selang penanda terdiri atas empat warna.
3.3. Tahap Persiapan
3.3.1. Hewan Percobaan
Hewan coba yang digunakan dalam penelitian ini ialah 21 ekor domba betina lokal yang telah dewasa kelamin. Domba-domba tersebut memiliki kisaran bobot badan antara 15 hingga 25 kg.
3.3.2. Aklimatisasi Domba
Selama aklimatisasi domba diberikan antibiotik, anthelmintik, dan vitamin B kompleks agar kondisi domba tetap sehat dan kembali prima.
3.3.3. Kandang, Pakan, dan Minum
Kandang yang digunakan dalam penelitian ialah kandang kelompok dengan konstruksi kandang panggaung dengan ketinggian 50 cm dari permukaan tanah. Pakan domba perlakuan yang diberikan terdiri atas hijauan dan ampas tahu. Hijauan diberikan pada pagi dan sore hari, sedangkan pada siang hari diberikan ampas tahu. Pemberian air minum dilakukan secara tidak terbatas atau ad libitum.
3.4. Tahap Pelaksanaan
3.4.1. Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak lengkap dengan 4 perlakuan, yaitu
Kelompok perlakuan pertama yaitu kontrol yang tidak disuperovulasi dan tidak disuntik hCG.
Kelompok perlakuan kedua yang hanya disuperovulasi sebelum kawin dengan kode SO1.
Kelompok perlakuan yang ketiga, hanya disuntik hCG hari ke-6 setelah kawin dengan kode SO2.
Kelompok perlakuan keempat yang disuperovulasi sebelum kawin dan disuntik hCG hari ke-6 setelah kawin dengan kode SO12.
3.4.2. Superovulasi dan Penyuntikan hCG
Kira-kira 24 hingga 36 jam pasca penyuntikan PGF2α kedua, domba berada dalam kondisi estrus, kemudian semua kelompok domba perlakuan dikawinkan dengan domba pejantan yang telah dipilih. Perkawinan dilakukan dengan mencampurkan domba pejantan dan domba betina perlakuan selama 3 hari dengan membagi 21 ekor domba perlakuan menjadi 4 kelompok dengan masing-masing kelompok terdiri atas 5 hingga 6 ekor domba betina perlakuan ditambah 1 ekor domba jantan. Penyuntikan hCG intramuskular dilakukan 6 hari setelah perkawinan. Pemeriksaan kebuntingan menggunakan USG dilakukan 30 hari setelah perkawinan.
3.4.3. Pengambilan Sampel
Pengambilan sampel darah dilakukan setiap 3 hari pada awal kebuntingan. Pengambilan darah dilakukan melalui vena jugularis menggunakan spuit sebanyak kurang lebih 5 mL kemudian langsung dimasukkan ke dalam tabung reaksi yang telah diisi antikoagulan EDTA sebelumnya. Tabung tersebut kemudian langsung ditutup menggunakan sumbat dan diberi label sesuai kode perlakuan. Sampel darah dalam tabung reaksi selanjutnya dimasukkan ke dalam kotak pendingin dan dibawa ke laboratorium fisiologi untuk dilakukan pemeriksaan darah.
3.4.4. Penghitungan Jumlah Sel Darah Merah, Hematokrit, dan Hemoglobin
hitung. Langkah berikutnya, kamar hitung dilihat di bawah mikroskop dengan pembesaran objektif 40 kali. Jumlah sel yang dihitung adalah lima kotak, yaitu pada keempat sudut dan 1 kotak di bagian tengah. Jumlah sel darah merah yang diperoleh dikalikan dengan 10.000 per mm3.
Penghitungan nilai hematokrit dilakukan menggunakan Adam Mikrohematocrit Reader. Tabung mikro yang digunakan adalah tabung mikro dengan panjang 7 cm dan diameter 0,1 mm. Sampel darah diambil dengan menempelkan bagian ujung dari tabung mikro tersebut ke dalam darah. Posisi ujung tabung mikro membentuk sudut kurang lebih 120º dan bagian ujung tabung yang lain dikosongkan kira-kira 1 cm. Bagian ujung tabung disumbat dan tabung mikro tersebut selanjutnya disentrifugasi selama 4-5 menit dengan kecepatan 10.000 rpm. Hasil sentrifugasi dibaca menggunakan Adam Mikrohematocrit Reader untuk mendapatkan nilai hematokrit.
Penghitungan kadar hemoglobin dilakukan dengan menggunakan metode Sahli. Metode ini dilakukan dengan menambahkan HCl ke dalam tabung kemudian ditambahkan dengan sampel darah dan ditambahkan secara perlahan sejumlah akuades hingga warna yang terbentuk sama dengan kontrol. Kadar hemoglobin diperoleh dengan membaca skala yang tertera pada tabung Sahli.
3.5. Variabel yang Diamati
Variabel yang diamati dalam penelitian ini yaitu jumlah sel darah merah, nilai hematokrit, dan kadar hemoglobin.
3.6. Analisis Data
BAB IV
HASIL DAN PEMBAHASAN
4.1. Sel Darah Merah
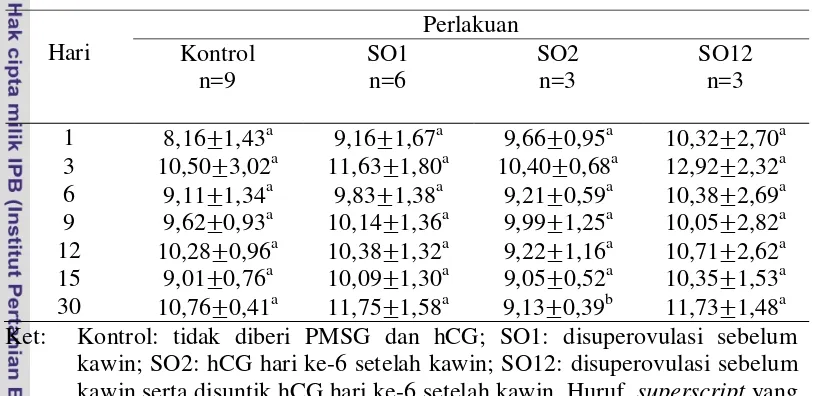
Jumlah sel darah merah yang didapatkan dalam penelitian ini sangat beragam antarkelompok perlakuan meskipun tidak berbeda nyata secara statistik. Pola kenaikan dan penurunan jumlah sel darah merah pada setiap kelompok perlakuan sangat fluktuatif jika dibandingkan dengan hari-hari sebelumnya sehingga sulit untuk menentukan ada tidaknya kenaikan secara pasti setiap harinya. Pengamatan dilakukan dengan membandingkan jumlah sel darah merah pada setiap kelompok perlakuan terhadap kelompok kontrol untuk melihat ada tidaknya kenaikan jumlah sel darah merah secara umum pada awal kebuntingan yang diindikasikan sebagai pengaruh perlakuan berdasarkan nilai sampel yang diambil dan dianalisis setiap 3 hari pada awal kebuntingan seperti yang tersaji pada Tabel 2.
Tabel 2 Jumlah sel darah merah (106/mm3) domba yang disuperovulasi sebelum kawin dan disuntik hCG hari ke-6 setelah kawin, pada awal kebuntingan.
Hari superscript yang berbeda pada baris yang sama menunjukkan nilai berbeda nyata (p<0,05).
yang disuperovulasi sebelum kawin disertai penyuntikan hCG hari ke-6 setelah kawin (SO12) memiliki jumlah sel darah merah yang cenderung lebih tinggi dibandingkan kelompok kontrol yaitu pada hari ke-1, hari ke-3, dan hari ke-9 hingga hari ke-30, sedangkan kelompok perlakuan yang disuntik hCG hari ke-6 setelah kawin (SO2) menunjukkan hasil jumlah sel darah merah yang cenderung lebih rendah dari kelompok kontrol, yaitu pada hari ke-1, hari ke-6, hari ke-9, dan hari ke-30.
Kelompok perlakuan yang disuperovulasi sebelum kawin disertai penyuntikan hCG hari ke-6 setelah kawin (SO12) memiliki jumlah sel darah merah tertinggi yaitu pada hari ke-3 dengan jumlah sel darah lebih tinggi 60,15% dibandingkan kelompok kontrol, lalu diikuti oleh kelompok perlakuan yang hanya disuperovulasi sebelum kawin (SO1) dengan jumlah sel darah merah lebih tinggi 39,30% dibandingkan kelompok kontrol pada hari yang sama. Jumlah sel darah merah terendah terdapat pada hari ke-9 pada kelompok perlakuan yang hanya disuntik hCG hari ke-6 setelah kawin (SO2) dengan jumlah sel darah merah lebih rendah 20,25% dibandingkan kontrol. Pola kenaikan jumlah sel darah merah tersaji pada gambar grafik dibawah ini,
Gambar 5 Grafik jumlah sel darah merah domba kontrol (), disuperovulasi sebelum kawin (∎), disuntik hCG hari ke-6 setelah kawin (▲), dan disuperovulasi sebelum kawin dan disuntik hCG hari ke-6 setelah kawin (●), pada awal kebuntingan.
kelenjar susu, dan produksi susu pada domba (Manalu et al. 1998; Manalu et al. 1999; Manalu et al. 2000a; Manalu et al. 2000b). Hormon tiroid yang merupakan hormon penting yang berperan menstimulasi pertumbuhan dan perkembangan embrio dan fetus juga meningkat lebih pesat pada perlakuan superovulasi. Peningkatan konsentrasi hormon tiroid menggambarkan adanya aktivitas metabolisme yang lebih tinggi sejalan dengan lebih pesatnya pertumbuhan fetus dan terus meningkat dengan bertambahnya umur kebuntingan. Konsentrasi hormon metabolisme menunjukkan pola peningkatan yang sama dengan jumlah dan pertumbuhan dan perkembangan embrio dan fetus yang mengindikasikan hubungan yang kuat antara peningkatan konsentrasi hormon metabolisme dan peningkatan jumlah dan bobot embrio (Mege et al. 2009).
Berdasarkan perbandingan hasil dari kelompok perlakuan SO1, SO2, dan SO12 terhadap kontrol menunjukkan bahwa perlakuan superovulasi sebelum kawin dan penyuntikan hCG hari ke-6 setelah kawin tidak mempengaruhi secara langsung kenaikan jumlah sel darah merah pada awal kebuntingan. Namun, jumlah sel darah merah pada kelompok perlakuan yang didahului superovulasi memiliki nilai persentase yang cenderung lebih tinggi. Hal ini sesuai dengan hasil penelitian Arif (2011) yang menyatakan bahwa kelompok perlakuan superovulasi memiliki jumlah sel darah merah tidak berbeda nyata secara statistik pada bulan pertama kebuntingan. Superovulasi mempengaruhi kenaikan jumlah sel darah merah secara nyata pada bulan kedua dan bulan ketiga kebuntingan. Hormon hCG bekerja seperti luteinizing hormone (LH) yang merangsang perkembangan korpus luteum dan sekresi progesterone untuk memelihara kebuntingan (Andriyanto dan Manalu 2011). Penyuntikan hCG pada hari ke-6 setelah kawin lebih ditujukan untuk meningkatkan kualitas kebuntingan dengan tujuan akhir meningkatkan kualitas bakalan.
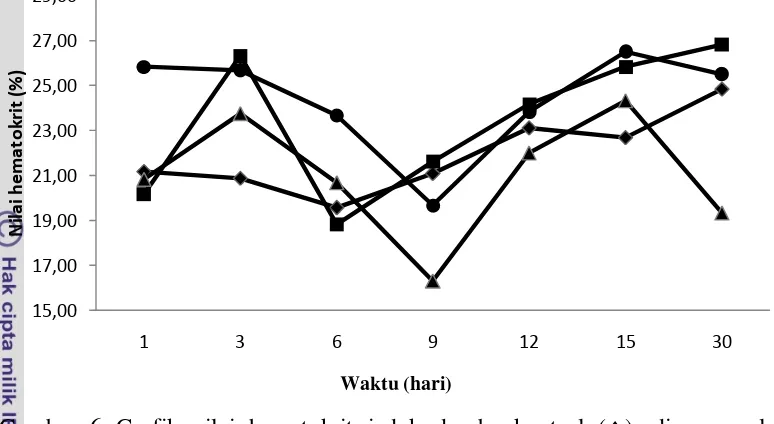
4.2. Hematokrit
Kebuntingan secara umum menyebabkan perubahan dinamis parameter hematologi seperti jumlah sel darah merah, hematokrit, dan hemoglobin pada domba. Peningkatan hematokrit pada hari ke-3, hari ke-7, hari ke-14, hari ke-17, dan hari ke-34 kebuntingan memiliki rentang perubahan antara 32,44±2,18% hingga 39,33±2,73% dengan perubahan signifikan pada hari ke-14, hari ke-17, dan hari ke-34 kebuntingan (Krajnicakova 1995). Hasil penelitian tersebut sejalan dengan hasil penelitian ini meskipun rata-rata nilai hematokrit masih lebih rendah dibandingkan nilai hematokrit yang dilaporkan Krajnicakova (1995).
Tabel 3 Nilai hematokrit (%) domba yang disuperovulasi sebelum kawin dan disuntik hCG pada hari ke-6 setelah kawin, pada awal kebuntingan.
Hari kawin dan disuntik hCG hari ke-6 setelah kawin. Huruf superscript yang berbeda pada baris yang sama menunjukkan nilai berbeda nyata (p<0,05).
Nilai hematokrit memiliki hubungan yang erat dengan jumlah sel darah merah karena nilai hematokrit merupakan suatu ukuran yang menunjukkan volume total sel darah merah dalam setiap 100 ml darah. Kelompok perlakuan yang disuperovulasi sebelum kawin dan disuntik hCG hari ke-6 setelah kawin (SO12) memiliki nilai hematokrit yang cenderung lebih tinggi dibandingkan kontrol pada hari ke-1, hari ke-3, hari ke-6, hari ke-12, hari ke-15, dan hari ke-30. Kelompok perlakuan yang hanya disuperovulasi sebelum kawin (SO1) juga memiliki nilai rata-rata hematokrit cenderung lebih tinggi dibandingkan kontrol pada hari ke-3, hari ke-9, hari ke-12, hari ke-15, dan hari ke-30. Nilai hematokrit tertinggi terdapat pada kelompok SO1 pada hari ke-30 dengan nilai hematokrit 8,05% lebih tinggi daripada kontrol. Kelompok perlakuan yang hanya disuntik hCG hari ke-6 setelah kawin (SO2) memiliki rata-rata nilai hematokrit cenderung lebih rendah dibandingkan kontrol. Nilai hematokrit terendah dari semua kelompok perlakuan terdapat pada hari ke-9 dari kelompok perlakuan SO2 dengan nilai 22,68% lebih rendah dari kontrol.
Gambar 6 Grafik nilai hematokrit induk domba kontrol (), disuperovulasi sebelum kawin (∎), diberi hCG hari ke-6 setelah kawin (▲), dan disuperovulasi sebelum kawin serta disuntik hCG hari ke-6 setelah kawin (●), pada awal kebuntingan.
Semua kelompok perlakuan memiliki nilai hematokrit yang tidak berbeda nyata secara statistik dari hari ke-1 hingga hari ke-30 kecuali untuk kelompok SO2 sehingga dapat ditarik keterangan bahwa secara umum superovulasi sebelum kawin dan penyuntikan hCG hari ke-6 setelah kawin tidak mempengaruhi kenaikan nilai hematokrit pada awal kebuntingan. Hal ini sejalan dengan hasil penelitian Arif (2011), yang menyatakan superovulasi menaikkan nilai hematokrit secara nyata mulai bulan kedua hingga keempat kebuntingan dan penurunan pada akhir masa kebuntingan, sedangkan pada awal kebuntingan tidak mempengaruhi.
Nilai hematokrit semua kelompok perlakuan secara umum lebih rendah dari nilai hematokrit domba tidak bunting menurut Banks (1993) dan Frandson (1996) yang berkisar antara 24-50%. Menurut Podymow et al. (2010), secara fisiologis nilai hematokrit domba bunting akan selalu lebih rendah dibandingkan kondisi tidak bunting dikarenakan adanya retensi cairan yang menyebabkan kenaikan volume plasma darah dan total air tubuh. Pada hari ke-30 nilai hematokrit kelompok SO2 berbeda nyata dari kelompok perlakuan lainnya dengan nilai lebih rendah. Kelompok SO2 memiliki nilai hematokrit yang dibawah normal tetapi jumlah sel darah merah tetap normal sehingga diduga hewan coba
pada kelompok SO2 mengalami retensi cairan yang berlebihan yang dapat disebabkan berbagai faktor.
4.3. Hemoglobin
Kadar hemoglobin yang didapatkan beragam antarkelompok perlakuan meskipun tidak berbeda nyata secara statistik kecuali pada hari ke-30. Pola kenaikan kadar hemoglobin terlihat dalam gambar grafik dibawah ini,
Gambar 7 Grafik kadar hemoglobin induk domba kontrol (), disuperovulasi sebelum kawin (∎), diberi hCG hari ke-6 setelah kawin (▲), dan disuperovulasi sebelum kawin serta disuntik hCG hari ke-6 setelah kawin (●), pada awal kebuntingan
Pola kenaikan hemoglobin berbeda dengan pola kenaikan jumlah sel darah merah. Penghitungan kadar hemoglobin setiap tiga hari sekali pada awal kebuntingan dari setiap kelompok perlakuan menunjukkan hasil yang berbeda seperti terlihat pada Tabel 4.
Tabel 4 Kadar hemoglobin (g%) induk domba yang disuperovulasi sebelum kawin dan disuntik hCG pada hari ke-6 setelah kawin, pada awal kebuntingan.
Hari
kawin; SO2: hCG hari ke-6 setelah kawin; SO12: disuperovulasi sebelum kawin serta disuntik hCG hari ke-6 setelah kawin. Huruf superscript yang berbeda pada baris yang sama menunjukkan nilai berbeda nyata (p<0,05).
Hasil yang didapatkan dalam penelitian ini menunjukkan bahwa kadar hemoglobin antarkelompok perlakuan tidak berbeda nyata secara statistik mulai dari hari ke-1 hingga hari ke-30, kecuali untuk kelompok SO2. Hasil ini menunjukkan bahwa secara umum semua perlakuan baik superovulasi sebelum kawin maupun penyuntikan hCG hari ke-6 setelah kawin tidak mempengaruhi perubahan kadar hemoglobin pada awal kebuntingan. Hal ini sesuai dengan hasil penelitian Arif (2011) yang menyatakan bahwa superovulasi menaikkan kadar hemoglobin secara nyata pada pertengahan dan akhir kebuntingan.
BAB V
PENUTUP
5.1. Simpulan
Semua perlakuan dalam penelitian ini tidak mempengaruhi kenaikan jumlah sel darah merah, nilai hematokrit, dan kadar hemoglobin secara nyata pada awal kebuntingan. Superovulasi sebelum kawin dan penyuntikan hCG hari ke-6 setelah kawin secara umum tidak mempengaruhi perubahan gambaran darah merah domba pada awal kebuntingan.
5.2. Saran
DAFTAR PUSTAKA
Adriani, Sudono A, Sutardi T, Sutama IK, Manalu W. 2004a. Pengaruh Superovulasi dan Suplementasi Seng dalam Ransum pada Induk Kambing terhadap Pertumbuhan Anaknya. Journal of Indonesian Tropic Animal Agric. 29(4).
Adriani, Sutama IK, Sudono A, Sutardi T, Manalu W. 2004b. Pengaruh Superovulasi dan Suplementasi Seng terhadap Produksi Susu Kambing Peranakan Etawah. Journal of Animal Production Vol. 6, No. 2: 86-94. Adriani, Depison, Rosadi B, Supriondo Y, Isroli. 2007. Pengaruh Superovulasi
terhadap Jumlah Corpus Luteum pada Sapi Simbrah. Journal of Indonesian Tropic Animal Agric. 32(3).
Andriyanto, Manalu W. 2011. Potency of ethanol extract Curcuma xanthoriza as natural growth promotor in pregnant ewes with superovulation. Globalization of Jamu Brand Indonesia. The 2nd International symposium on Temulawak. The 40th Meetingof National Working Group on Indonesian Medical Plant. IICC. Bogor. Hlm:134.
Anomim1. 2012. http://files.myopera. com/jualkambing/blog/domba%20ekor%20 tipis-gembel. jpg. [15 Januari 2012].
Anomim2. 2012. http://ternakonline. files.wordpress.com/2009/09/deg-jatim-2a1. jpg?w=239&h=164. [15 Januari 2012].
Anomim3. 2012. http://files.saungdogar.webnode.com/200000021-8de9d8ee3c /dogar%201. jpg. [15 Januari 2012].
Arif R. 2011. Gambaran Jumlah Sel Darah Merah, Nilai Hematokrit, dan Kadar Hemoglobin Induk Domba yang Disuperovulasi Sebelum Kawin dan Dicekok Ekstrak Temulawak Plus Selama Kebuntingan. FKH IPB: Skripsi.
Banks WJ. 1993. Applied Veterinary Histology. Texas: Mosby, Inc. 142-154 Dellmann HD dan Brown EM. 1989. Text Book of Veterinary Histology. 3rd
Direktorat Budidaya Peternakan. 2002. Model Pengembangan Kambing Perah di Indonesia. Direktorat Jenderal Bina Produksi, Departemen Pertanian, Jakarta.
Duncan JR dan Prasse KW. 1986. Veterinary Laboratory Medicine. 2nd Ed. USA: Lowa State University.
Dziuk PJ. 1992. Embryonic development and fetal growth. Anim. Reprod. Sel. 28 : 299-308.
Frandson RD. 1996. Anatomi dan Fisiologi Ternak, edisi keempat. Terjemahan Srigandono dan K. Praseno. Gajah Mada University Press. Yogyakarta. Giersen A, Makikallio K, Hiilesmaa V et al. 2007. The relationship between
human fetal cardiovascular hemodynamics and serum erythropoietin levels in growth-restricted fetuses. [Am. J. ObstetGynecol] 2007 May; Vol. 196 (5), pp. 467.e1-6.
Guyton AC dan Hall JE. 1997. Textbook of Medical Physiology. (Buku Ajar Fisiologi Kedokteran). Ed ke-7. Diterjemahkan oleh Irawati Setiawan, Ken Ariata Tengadi dan Alex Sentoso. Penerbit Buku Kedokteran, EGC. Jakarta.
Kaiin EM dan Tappa B. 2006. Induksi Superovulasi dengan Kombinasi CIDR, Hormon FSH, dan hCG pada Induk Sapi Potong. [Media Peternakan Vol. 29 No. 3: 141-146].
Kelly WR. 1984. Veterinary Clinical Diagnosis. 3rd Ed. London: Baillere Tindall. Kohler D dan Dellweg D. 2010. Polycyhemia. Journal Article: Deutsche
Medizinische Wochenschrift Vol. 135 No. 46.
Kleeman DO, SK. Walker, dan RF. Seamark. 1994. Enhance fetal growth in sheep administered progesterone during the first three days of pregnancy. J. Reprod. Fert. 102:411-417.
Manalu W dan MY. Sumaryadi. 1998. Maternal serum progesterone concentration during pregnancy and lamb birth weight at parturition in Javanese Thin-Tail Ewes with different litter size. Small Rumin. Res. 30:163-169.
Manalu W, MY. Sumaryadi, Sudjatmogo, dan AS. Satyaningtijas. 1999. Mammary gland differential growth during pregnancy in superovulated Javanese Thin-Tail Ewes. Small Rumin. Res. 33:279-284.
Manalu W, MY. Sumaryadi, Sudjatmogo, dan AS. Satyaningtijas. 2000a. Mammary gland indices at the end of lactation in the superovulated Javanese Thin-Tail Ewes. Asian-Aust. J. Anim. Sci. 13:440-445.
Manalu W, MY. Sumaryadi, Sudjatmogo, dan AS. Satyaningtijas. 2000b. The effect of superovulation of Janavese Thin-Tail Ewes prior to mating on lamb birth weight and preweaning growth. Asian-Aust. J. Anim. Sci. 13:292-299.
Mege RA, Nasution SH, Kusumorini N, dan Manalu W. 2005. Pertumbuhan dan Perkembangan Uterus dan Plasenta Babi dengan Superovulasi. [Journal of Biosciences Vol. 14 No. 1]
Mege RA, Manalu W, Kusumorini N, dan Nasution SH. 2009. Konsentrasi Hormon Tiroid dan Metabolit Darah Induk Babi Disuperovulasi Sebelum Perkawinan. [Journal Animal Production 11(2) 88-95].
Mulyono S. 2005. Teknik Pembibitan Kambing dan Domba. Jakarta: Penebar Swadaya.
Oliveira DS dan Saldanha C. 2009. An Overview about Erythrocyte Membrane. Clinical Hemothology and Microcirculation. IOS Press.
Palazzuoli A, Antonelli G, dan Nuti R. 2011. Anemia in Cardio-Renal Syndrome: clinical impact and pathophysiologic mechanism. Journal Article: Heart Failure Rev. Vol. 16 No.6: 603-607.
Podymow T, Phylis A, dan Ayub A. 2010. Management of Renal Disease in Pregnancy. Obster Gynecol Clin N Am 37: 195-210.
Poedjiadi A. 2006. Dasar-dasar Biokimia. Jakarta : UI Press.
Schalm OW. 1975. Veterinary Hematology. 2nd edition. Philadelphia : Lea & Febiger. USA.
Sherif D dan Habel JD. 1976. Sheep Haematology in Diagnosis. Sydney: University of Sydney.
Silverberg DS. 2011. The Role of Erythropoiesis Stimulating Agents and Intravenous (IV) Iron in The Cardio Renal Anemia Syndrome. Journal Article: Heart Failure Review Vol. 16 No. 6: 609-614.
Situmorang P. 2008. A Controlled Intra-Vaginal Device Releasing Hormone for Superovulation Program in Buffalo. Animal Production Vol. 10 No.1: 5-11.
Sudjatmogo B, Utomo, Subiharta, Manalu W, dan Ramelan. 2001. Tampilan produksi susu akibat peningkatan pertumbuhan ambing sapi perah Friesian Holstein yang disuntik PMSG pada program perkawinannya. J Trop Anim Dev 26:8-13.
Sutama IK, M. Budiarsana, H. Setiyanto, dan A. Priyani. 1995. Productive and Reproductive Performances of Young Etawah-cross does. Dalam: Adriani, Sudono A., Sutardi T., Sutama I.K., Manalu W. 2004a. Pengaruh Superovulasi dan Suplementasi Seng dalam Ransum pada Induk Kambing terhadap Pertumbuhan Anaknya. Journal of Indonesian Tropic Animal Agric. 29(4).
Swenson MJ. 1984. Dukes Physiology of Domestic Animals. 10th edition. Itacha and London : Cornell University Press.
BAB I
PENDAHULUAN
1.1. Latar Belakang
Indonesia adalah negara tropis dengan nilai sumber daya alam tinggi. Kekayaan sumber daya alam Indonesia berbanding lurus dengan peningkatan kuantitas sumber daya manusia yang dimiliki. Kondisi ini merupakan kondisi alamiah yang menunjukkan ketergantungan manusia pada ketersediaan alam untuk mempertahankan hidupnya. Salah satu kebutuhan manusia yang sangat bergantung pada alam dalam pemenuhannya adalah kebutuhan pangan.
Kualitas sumber daya manusia secara tidak langsung dipengaruhi oleh pangan, dalam hal ini kualitas pangan yang dikonsumsi. Manusia untuk mampu menjadi makhluk yang produktif dalam bidang sosial, pendidikan, maupun ekonomi sehingga menghasilkan kehidupan yang berkualitas membutuhkan kondisi tubuh yang sehat. Kesehatan tubuh sangat ditentukan oleh pangan yang dikonsumsi. Protein hewani adalah jenis pangan yang dipercaya meningkatkan kinerja fisiologis tubuh hingga mencapai optimal.
Sumber protein hewani yang cukup banyak dihasilkan di Indonesia terutama berasal dari ternak ruminansia. Budidaya domba dan kambing sebagai ternak ruminan banyak dilakukan oleh masyarakat baik sebagai mata pencaharian utama maupun sebagai penghasilan tambahan. Permintaan daging ternak ruminansia dalam negeri selalu meningkat setiap tahunnya, namun peningkatan permintaan ini belum seimbang dengan peningkatan populasi ternak yang cenderung lebih lambat. Produksi daging kambing dan domba baru memenuhi 40% kebutuhan dalam negeri, dilain pihak Pemerintah Saudi Arabia membutuhkan pasokan kambing dan domba 1 juta ekor per tahun (Direktorat Jenderal Budidaya Peternakan 2002).
reproduksi yang sedang berkembang dalam beberapa dekade terakhir, salah satunya adalah superovulasi. Superovulasi mampu meningkatkan jumlah korpus luteum yang dihasilkan dan meningkatkan jumlah folikel yang berkembang hingga mengalami ovulasi yang dirangsang melalui penyuntikan pregnant mare serum gonadotropin/human chorionic gonadotrophin (Dziuk 1992; Kleeman et al. 1994; Manalu et al. 2000a). Superovulasi meningkatkan jumlah folikel dan korpus luteum telah terbukti dapat meningkatkan sekresi hormon-hormon kebuntingan, pertumbuhan uterus, jumlah embrio dan fetus, bobot lahir dan bobot sapih, pertumbuhan dan perkembangan kelenjar susu, dan produksi susu pada domba (Manalu et al. 1998; Manalu et al. 1999; Manalu et al. 2000a; Manalu et al. 2000b).
1.2. Tujuan
Penelitian ini bertujuan untuk mengetahui pengaruh superovulasi sebelum kawin dan penyuntikan hCG hari ke-6 setelah kawin terhadap gambaran jumlah sel darah merah, nilai hematokrit, dan kadar hemoglobin domba pada awal kebuntingan yang dibandingkan dengan domba yang tidak disuperovulasi sebagai kontrol.
1.3. Manfaat
BAB II
TINJAUAN PUSTAKA
2.1. Superovulasi
Superovulasi merupakan salah satu cara untuk meningkatkan jumlah korpus luteum yang dihasilkan dan peningkatan jumlah folikel yang berkembang hingga mengalami ovulasi dirangsang melalui penyuntikan pregnant mare serum gonadotropin/human chorionic gonadotrophin (PMSG/hCG). Jumlah korpus luteum dan folikel sangat erat kaitannya dengan tingkat sekresi hormon kebuntingan dan hormon mammogenik seperti estradiol dan progesteron selama kebuntingan (Dziuk 1992; Kleeman et al. 1994; Manalu et al. 2000a). Peningkatan jumlah folikel, korpus luteum, dan plasenta menyebabkan kenaikan sekresi dari kelenjar penghasil hormon kebuntingan dan mammogenik.
Hormon kebuntingan dan mammogenik berperan penting dalam pemeliharaan kebuntingan hingga memasuki periode pasca partus. Penggunaan PMSG/hCG untuk meningkatkan jumlah folikel dan korpus luteum telah terbukti dapat meningkatkan sekresi hormon-hormon kebuntingan, pertumbuhan uterus, embrio dan fetus, bobot lahir dan bobot sapih, pertumbuhan dan perkembangan kelenjar susu, dan produksi susu pada domba (Manalu et al. 1998; Manalu et al. 1999; Manalu et al. 2000a; Manalu et al. 2000b), sapi (Sudjatmogo et al. 2001), dan kambing (Adriani et al. 2004a).
Perlakuan superovulasi dengan level dosis 600 hingga 1200 IU per ekor pada babi meningkatkan sekresi progesteron dan estradiol serta pertumbuhan dan perkembangan uterus dan plasenta pada masa gestasi 15, 35, dan 70 hari. Kondisi ini membuktikan bahwa superovulasi dengan dosis 600 sampai 1200 IU dapat meningkatkan reproduksi babi. Superovulasi pada induk akan meningkatkan hormon kebuntingan progesteron sekaligus juga meningkatkan kapasitas plasenta yang dimanifestasikan melalui peningkatan bobot basah dan kering, massa sel aktif, aktivitas sintetik sel (DNA dan RNA), dan sintesis nutrien plasenta hingga usia 70 hari kebuntingan. Peningkatan kapasitas plasenta juga dipengaruhi oleh pemeliharaan korpus luteum dan produksi progesteron oleh plasenta (Mege et al. 2005).
Peningkatan volume ambing sebagai efek superovulasi sangat nyata meningkatkan produksi susu yang dihasilkan dan bekerja sinergis dengan kombinasi suplementasi seng dalam pakan, terutama pada konsentrasi seng 60 mg/kg bahan kering. Peningkatan volume ambing selama kebuntingan sejalan dengan peningkatan korpus luteum, estrogen, dan progesteron yang dihasilkan serta berhubungan erat dengan naiknya produksi susu. Peningkatan produksi susu akibat superovulasi tidak mempengaruhi kualitas susu dan konsumsi nutrien pakan (Adriani et al. 2004b).
Sediaan yang juga sering dimanfaatkan untuk perlakuan superovulasi adalah controlled internal drug release (CIDR) dan folicle stimulating hormone (FSH). Bentuk CIDR seperti huruf T dengan bahan silikon yang mengandung hormon progesteron. Perlakuan superovulasi dengan kombinasi CIDR dan FSH disertai penyuntikan hCG mampu secara nyata meningkatkan respon superovulasi dan jumlah korpus luteum yang terbentuk pada induk sapi donor Brangus sehingga meningkatkan jumlah embrio terkoleksi dan jumlah embrio layak transfer. Jumlah korpus luteum yang dihasilkan pada perlakuan superovulasi dengan CIDR, FSH, dan hCG meningkat signifikan dibandingkan dengan kelompok hewan coba yang hanya disuperovulasi dengan CIDR dan FSH (Kaiin dan Tappa 2006).
gonadotropin. Terdapat bukti nyata bahwa konsentrasi progesteron pada masa inisiasi superovulasi memegang peranan yang penting dan konsentrasi progesteron yang tinggi menjadi indikasi signifikan dari keberhasilan program untuk mendapatkan embrio berkualitas baik dengan jumlah yang lebih tinggi. Adriani et al. (2007), dalam jurnalnya menyatakan bahwa perlakuan superovulasi dengan dosis 40 mg FSH secara intramuskular pada sapi Simbrah memberikan hasil terbaik dengan jumlah korpus luteum terbanyak.
2.2. Hematologi Darah
Darah merupakan komponen metabolisme makhluk hidup yang berperan sebagai media transportasi oksigen dan sari makanan ke dalam jaringan dan mengangkut sisa metabolisme jaringan dan karbon dioksida untuk selanjutnya diekskresikan. Selain itu, sistem sirkulasi darah dapat juga berperan sebagai sarana penyaluran sekresi kelenjar endokrin menuju organ target. Menurut Dellman dan Brown (1989), volume total darah mamalia berkisar antara 7-8 % dari bobot badan dengan komposisi plasma sebesar 75-85% dan sisanya merupakan benda-benda darah sebanyak 25-35 % yang terdiri atas eritrosit (sel darah merah), leukosit (sel darah putih), dan platelet (keping darah). Sedangkan plasma darah itu sendiri tersusun atas 91-92% cairan dan 8-9% padatan (Swenson 1984).
Perubahan gambaran darah seperti jumlah sel darah merah, nilai hematokrit, dan kadar hemoglobin dapat mencerminkan adanya perubahan status fisiologis. Indeks hematologi domba normal tersaji pada Tabel 1.
Tabel 1 Parameter Hematologi Domba Normal Parameter Nilai kisaran Satuan RBC (eritrosit) 8-16 106/µl
(Sumber: Frandson 1996, Banks 1993, dan Kelly 1984)
2.3. Sel Darah Merah (Eritrosit)
Istilah eritrosit berasal dari bahasa yunani yaitu eritro yang berarti darah dan sit yang berarti sel. Proses pembentukan sel-sel eritrosit berbeda tergantung pada tahap perkembangan hewan. Pada masa fetus, sel eritrosit diproduksi oleh hati dan limpa, sedangkan pada saat hewan dewasa produksi eritrosit diambil alih fungsinya oleh sumsum tulang merah (Frandson 1996). Domba memiliki eritrosit berukuran sekitar 4,8 µ m dengan bentuk cakram bikonkaf dan pinggiran sirkuler (Swenson 1984).
debris (puing-puing) sel rusak untuk selanjutnya dibuang dari sirkulasi (Frandson 1996).
Pembentukan eritrosit terjadi di sumsum tulang. Eritrosit memiliki kadar air yang lebih rendah dibandingkan sel-sel lain dalam jaringan. Kandungan utama dalam eritrosit, yaitu hemoglobin, lipid, protein, dan enzim. Hemoglobin merupakan zat padat yang memberi warna merah pada eritrosit dan berfungsi mengikat oksigen dalam fungsi respirasi. Lipid yang terdapat dalam eritrosit, diantaranya kolesterol, lesitin, dan sefalin. Protein dalam eritrosit, yaitu stromatin, lipoprotein, dan elimin. Karbonat anhidrase, peptidase, kolinesterase, dan enzim-enzim dalam sistem glikolisis, merupakan enzim-enzim yang terdapat dalam eritrosit. Bahan organik utama dalam eritrosit adalah ATP dan ADP yang berperan dalam produksi energi. Bahan organik lain yang terkandung dalam eritrosit, di antaranya urea, asam amino, kreatinin, dan glukosa (Schalm 1975). Struktur membran eritrosit tampak seperti gambar 1 dibawah ini,
Gambar 1. Struktur Membran Eritrosit
Simplified diagram of the RBC membrane structure. (A) Rh complex; (B) protein 4.1 complex; (C) and (D) band 3 macrocomplex ((C) band 3 tetrameric form and (D) band 3 dimeric form (Oliveira dan Saldanha 2009).
Jumlah eritrosit dalam tubuh memiliki nilai yang cenderung tetap. Hal ini menunjukkan adanya kesesuaian kecepatan pembentukan eritrosit baru dengan kecepatan rusaknya eritrosit lama.
Proses pembentukan darah yang terdiri atas eritrosit, leukosit, dan platelet disebut hemopoiesis. Sel darah hewan dewasa berasal dari satu sumber, yaitu sel-sel batang primordial di dalam sumsum tulang. Eritropoiesis adalah proses pembentukan eritrosit yang dipengaruhi oleh respon tubuh terhadap kadar oksigen dalam jaringan. Bila jaringan dan sel mengalami kondisi hipoksia atau kurangnya kadar oksigen yang dibutuhkan untuk metabolisme optimum, maka renal akan melepaskan hormon eritropoietin ke plasma darah untuk merangsang eritropoiesis. Eritropoietin akan berada dalam plasma satu jam setelah mulai terjadinya hipoksia. Hipoksia dapat terjadi karena rendahnya kadar oksigen dalam darah yang dapat disebabkan oleh hipoventilasi, maupun karena afinitas hemoglobin yang rendah terhadap oksigen sehingga suplai oksigen ke jaringan menurun. Sumsum tulang tidak menunjukkan respon langsung terhadap hipoksia dan umumnya produksi eritrosit baru akan terjadi tiga hari kemudian hingga kondisi hipoksia dapat dihilangkan. Setelah kondisi hipoksia berakhir, eritrosit yang berlebih dalam sirkulasi akan dieliminasi melaui mekanisme atrisi (pelemahan) dan degenerasi normal setelah kurang lebih bersirkulasi selama 120 hari tanpa pergantian (Frandson 1996).
Kondisi kelainan klinis berupa menurunnya jumlah eritrosit dibawah batas normal disebut anemia. Anemia dapat terjadi karena infeksi maupun kelainan kongenital. Menurunnya jumlah eritrosit berakibat pada menurunnya suplai oksigen ke jaringan dan terhambatnya penyaluran bahan organik ke sel yang secara tidak langsung menggangu metabolisme tubuh. Jumlah eritrosit yang meningkat hingga diatas ambang normal juga merupakan suatu kondisi kelainan yang disebut polisitemia (Guyton dan Hall 1997).
renal, dan efek samping dari berbagai jenis obat-obatan. Aktivitas neurohormonal dan antiinflamasi seringkali menjadi kunci awal munculnya penyakit yang bersifat progresif hingga akhirnya berujung pada anemia. Menurut Silverberg (2011), penyebab utama anemia pada kondisi gagal jantung kongesti, adalah penyakit ginjal kronis yang mengakibatkan terjadinya depresi produksi eritropoietin di ginjal diikuti produksi sitokin yang berlebihan dan berakhir dengan terjadinya depresi produksi eritropoietin di ginjal maupun di sumsum tulang. Kelebihan produksi sitokin pada gagal jantung kongesti juga menyebabkan defisiensi besi karena sitokin akan meningkatkan produksi hepcidin dari hati yang menyebabkan penurunan absorpsi besi di gastrointestinal dan mengurangi pelepasan besi dari depositnya di makofag dan hepatosit.
Polisitemia didefinisikan sebagai kenaikan hematokrit dan hemoglobin berturut-turut. Penyebab utamanya dapat karena penyakit neoplastik seperti polisitemia vera dengan proliferasi sel klon. Beberapa kondisi polisitemia dapat terjadi sebagai hasil dari hipoksia kronis. Polisitemia fisiologis dapat ditemukan di penduduk dataran tinggi dan atlit yang berlatih di daerah tinggi (Kohler dan Dellweg 2010).
2.4. Hemoglobin
Kerusakan eritrosit menyebabkan keluarnya hemoglobin dari sel, sehingga Fe yang terikat pada gugus heme akan ikut terlepas ke jaringan. Fe yang terlepas akan ditangkap oleh transferin dan kemudian disimpan untuk dapat digunakan lagi. Transferin adalah protein dalam plasma yang mampu mengikat Fe secara reversible. Kadar Fe dalam tubuh dipengaruhi oleh tingkat hemoglobin dan bobot tubuh. Selain dalam hemoglobin, Fe juga terdapat dalam feritin dan hemosiderin. Kandungan Fe yang lebih sedikit terdapat dalam mioglobin, plasma, dan cairan ekstraseluler. Hemoglobin yang rusak menyebabkan terbentuknya bilirubin. Bilirubin adalah zat warna kuning yang mampu berikatan kompleks dengan albumin sebelum ditranspor ke hati (Guyton dan Hall 1997).
2.5. Hematokrit (PCV)
Suatu ukuran yang menunjukkan volume total eritrosit dalam setiap 100 mL darah disebut hematokrit atau Packed Corpuscular Volume (PCV). Nilai hematokrit dinyatakan dalam persentase. Dalam pengukuran nilai hematokrit, darah dibagi menjadi tiga bagian, yaitu eritrosit pada bagian dasar, leukosit dan trombosit yang berupa lapisan berwarna putih sampai abu-abu (buffy coat), dan plasma darah pada bagian paling atas (Schalm 1975). Pada kondisi perdarahan, jumlah eritrosit yang hilang seringkali berbanding lurus dengan plasma darah sehingga nilai hematokrit tetap. Nilai hematokrit yang rendah dapat menyebabkan anemia (Duncan dan Prase 1986).
2.6. Domba
Domba tergolong sebagai hewan ruminansia kecil yang didosmetikasi atau diternakkan sebagai sumber protein hewani dan merupakan kerabat kambing, sapi, dan kerbau (Mulyono 2005). Domba termasuk dalam Famili Bovidae dan Genus Ovis. Domba yang diternakkan saat ini, diperkirakan merupakan hasil domestikasi tiga jenis domba liar, yaitu Mouflon (Ovis musimon) dari Eropa Selatan dan Asia Kecil, Argali (Ovis amon) dari Asia Tenggara, dan Urial (Ovis vignei) dari Asia.
memiliki ukuran tubuh dan ekor yang relatif kecil, bulu cenderung berwarna putih, domba jantan bertanduk kecil dan melingkar, sedangkan domba betina tidak bertanduk, bobot domba jantan berkisar 30-40 kg dan bobot betina berkisar 15-20 kg (Sarwono 2004). Bangsa domba ekor tipis berasal dari India dan Bangladesh dengan penamaan yang berbeda di berbagai wilayah di Indonesia, seperti domba negeri, domba kampung, domba lokal, dan domba kacang. Gambaran domba ekor tipis tampak seperti gambar dibawah ini,
Gambar 2. Domba ekor tipis (Sumber: Anomim1 2012)
Domba ekor gemuk memiliki ukuran badan yang besar, bobot domba jantan mencapai 50 kg dan bertanduk, sedangkan domba betina mencapai 40 kg dan tidak bertanduk. Bangsa domba ekor gemuk cenderung berekor panjang dengan bagian pangkalnya besar dan menimbun banyak lemak. Domba ini banyak tersebar di Madura, Sulawesi, Lombok, dan Jawa Timur. Gambaran domba ekor gemuk tampak seperti gambar dibawah ini,
Gambar 3. Domba ekor gemuk (Sumber: Anomim2 2012)
Gambar 4. Domba Priangan (Sumber: Anomim3 2012)
BAB III
BAHAN DAN METODE
3.1. Waktu dan Tempat
Kegiatan penelitian dilakukan dari bulan Mei hingga bulan Juli 2011. Penelitian dilakukan di dua tempat, yaitu kandang milik MT. Farm di Desa Tegalwaru, Kecamatan Ciampea, Kabupaten Bogor dan laboratorium Fisiologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
3.2. Alat dan Bahan
Alat yang digunakan dalam penelitian ini, yaitu spuit, seperangkat alat USG, tabung reaksi, gelas objek, hemositometer, selotip, lap, marker, kertas label, tabung kapiler, alat penghitung, kamar hitung darah Neubauer, Adam Mikrohematokrit reader, penyumbat tabung kapiler, alat sentrifugasi, tambang, dan mikroskop cahaya.
Bahan yang digunakan dalam penelitian, diantaranya 21 ekor domba betina tidak bunting, hormon Prostaglandin PGF2 alpha (dinoprost dan tromethamin), hormon Pregnant Mare Serum Gonadotropin (PMSG) dan human Chorionic Gonadotropin (hCG), pengencer Turk, NaCl fisiologis 0,9%, antikoagulan Ethilen Diamine Tetraasetate (EDTA), selang penanda terdiri atas empat warna.
3.3. Tahap Persiapan
3.3.1. Hewan Percobaan
Hewan coba yang digunakan dalam penelitian ini ialah 21 ekor domba betina lokal yang telah dewasa kelamin. Domba-domba tersebut memiliki kisaran bobot badan antara 15 hingga 25 kg.
3.3.2. Aklimatisasi Domba