POTENSI BEBERAPA BAKTERI PENGHAMBAT
PERTUMBUHAN Xanthomonas oryzae pv. oryzae PENYEBAB
PENYAKIT HAWAR DAUN BAKTERI PADA TANAMAN
PADI
ZURAIDAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Potensi Beberapa Bakteri Penghambat Pertumbuhan Xanthomonas oryzae pv. oryzae Penyebab Penyakit Hawar Daun Bakteri pada Tanaman Padi adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Desember 2011
Zuraidah
NIM G351090141
ABSTRACT
ZURAIDAH. The Potency of Some Bacteria to Inhibit The Growth of
Xanthomonas oryzae pv. oryzae Causing Rice Bacterial Leaf Blight. Under direction of NISA RACHMANIA MUBARIK and YADI SURYADI.
Bacterial leaf blight (BLB) disease caused by plant pathogenic bacteria
Xanthomonas oryzae pv. oryzae (Xoo) could lead to death of rice plants. Control of plant pathogenic bacteria can be performed using biological control agents. The aim of this research was to study the inhibitory ability of eight isolates of biocontrol bacteria against Xanthomonas oryzae pv. oryzae (Xoo) under greenhouse conditions. Isolates of biological agents used in the study were obtained from IPB Culture Collection (IPBCC), Department of Biology, IPB and microbial gene bank collection of Indonesian Center for Agriculture Biotechnology and Genetic Resources (BB Biogen), consisting of Pseudomonas aeruginosa C32a and C32b, P. fluorescens ATCC 13525 Pf , Serratia marcescens
E31, Bacillus sp. I.5, B. cereus I.21 and II.14, and B. firmus E65 isolates. The methods used in the research i.e. hypersensitivity test, antagonistic test of biocontrol bacteria to Xoo, and in vivo application of biological agents in the greenhouse condition. Hypersensitivity test on tobacco plants using C32a and C32b inoculums showed characteristics of slightly leaf yellowing but did not cause necrosis. Injection using Xoo inoculum showed necrosis on tobacco leaves. Antagonist isolates i.e. C32a, C32b, Pf, I.21, and I.5 showed inhibitory activity against Xoo, whereas others isolates did not show inhibitory activity. In greenhouse experiments IR 64 rice plants were sprayed with biological control agents (107cfu/ml) at 7 days, 14 days, 28 days, and 42 days after planting. The results showed that C32a isolate could suppress better the lesion length of BLB than that of chemical control (copper sulphate). Growth measurement of rice plants were assessed on plant height, number of tillers, panicle number and grain weight. Rice plants spraying treatment with isolates E65, E31, C32a, C32b, I.21, Pf, and I.5 showed no difference with control of sterile distilled water. Spraying with each suspension isolate of I.21, E31, C32a, Pf, and C32b indicated no different in the panicle number, in addition rice production was higher in C32a, Pf, C32b, and I.21 treatments. Spraying with C32a isolates produced the highest grain production compared with that of other isolates.
RINGKASAN
ZURAIDAH. Potensi Beberapa Bakteri Penghambat Pertumbuhan Xanthomonas oryzae pv. oryzae Penyebab Penyakit Hawar Daun Bakteri pada Tanaman Padi. Dibimbing oleh NISA RACHMANIA MUBARIK dan YADI SURYADI.
Penyakit hawar daun bakteri (HDB) yang disebabkan oleh bakteri patogen tanaman Xanthomonas oryzae pv. oryzae (Xoo) dapat menyebabkan kematian pada tanaman padi. Serangan penyakit terjadi pada fase bibit, tanaman muda, dan tanaman tua. Kerusakan terberat terjadi apabila penyakit menyerang tanaman muda yang peka sehingga menimbulkan gejala kresek dan hawar daun.
Masyarakat saat ini cenderung lebih memilih pangan yang bebas pestisida dan bahan kimia lainnya. Kesadaran akan lingkungan yang sehat dan perkembangan di bidang bioteknologi telah mendorong berkembangnya penelitian tentang penggunaan mikroorganisme. Pengendalian bakteri patogen pada tanaman dapat dilakukan dengan menggunakan agen biokontrol. Tujuan dari penelitian ini ialah untuk mempelajari kemampuan penghambatan delapan isolat bakteri terhadap bakteri patogen Xanthomonas oryzae pv. oryzae (Xoo) yang merupakan penyebab penyakit HDB pada tanaman padi di rumah kaca.
Isolat yang digunakan dalam penelitian ini berasal dari koleksi IPB Culture Collection (IPBCC), Departemen Biologi, IPB dan bank gen mikrob Pusat Bioteknologi Pertanian dan Sumber Daya Genetik (BB Biogen), terdiri atas:
Pseudomonas aeruginosa C32a dan C32b, P. fluorescens ATCC 13525 Pf,
Serratia marcescens E31, Bacillus sp. I.5, B. cereus I.21 dan II.14, dan B. firmus
E65.
Uji reaksi hipersensitif pada tanaman tembakau menggunakan inokulum C32a dan C32b menunjukkan daun sedikit menguning tetapi tidak menyebabkan nekrosis. Inokulum lainnya tidak menunjukkan perubahan pada daun tembakau dan tidak terjadi nekrosis. Injeksi menggunakan inokulum Xoo menunjukkan nekrosis pada daun tembakau.
Uji antagonis secara in vitro menunjukkan isolat C32a, C32b, Pf, I.21, dan I.5 memiliki aktivitas penghambatan terhadap Xoo, sedangkan isolat lainnya tidak menunjukkan aktivitas penghambatan. Isolat C32a dan C32b dapat menghambat pertumbuhan Xoo lebih baik dari pada perlakuan kontrol pembanding kimia dengan tembaga sulfat.
Aplikasi di rumah kaca pada tanaman padi IR 64 yang telah disemprot dengan agen biokontrol menunjukkan bahwa penggunaan isolat C32a mampu menekan panjang lesio HDB lebih baik dari pada kontrol pembanding kimia dengan tembaga sulfat. Pengukuran intensitas perkembangan penyakit HDB dengan penghitungan AUDPC menunjukkan penyemprotan dengan suspensi C32a dapat menurunkan nilai AUDPC hingga 49,10 cm.hari. Sedangkan isolat E31 menunjukkan intensitas penyakit yang lebih tinggi dari pada kontrol sakit dengan Xoo.
Pengukuran pertumbuhan tanaman padi setelah mendapat perlakuan juga diamati. Tinggi tanaman padi menunjukkan penyemprotan suspensi isolat E65, E31, C32a, C32b, I.21, Pf, dan I.5 tidak berbeda dengan perlakuan akuades steril. Perlakuan dengan isolat E65 menunjukkan kecenderungan tinggi tanaman padi hampir sama dengan tinggi pada perlakuan akuades steril. Jumlah anakan juga tidak berbeda dengan perlakuan akuades steril. Namun hasil pengamatan dari 2 sampai 9 mst perlakuan isolat E31 dan I.21memiliki jumlah anakan yang lebih banyak dari pada perlakuan akuades steril. Jumlah malai padi yang diproduksi pada tanaman yang disemprot dengan isolat I.21, C32a, Pf, C32b, dan E31 memiliki jumlah malai yang tidak berbeda dengan jumlah malai pada perlakuan akuades steril. Produksi padi baik bobot gabah basah dan bobot gabah kering pada perlakuan C32a, Pf, C32b, dan I.21 cenderung lebih tinggi dibandingkan dengan perlakuan akuades steril. Hal ini menunjukkan bahwa penyemprotan dengan bakteri biokontrol tersebut memberikan pengaruh nyata terhadap bobot gabah.
Berdasarkan hasil penelitian ini, mengindikasikan bahwa perlakuan penyemprotan secara preventif pada saat tanaman berumur 7, 14, 28, dan 42 hari setelah tanam lebih efektif karena mikrob yang bersifat antagonis akan lebih efektif menekan pertumbuhan Xoo. Aplikasi dengan isolat-isolat biokontrol tidak mengganggu pertumbuhan tanaman padi, bahkan pengaruh aplikasi tersebut cenderung meningkatkan bobot gabah. Penelitian ini menunjukkan potensi pemanfaatan aplikasi isolat C32a, Pf, C32b, dan I.21 cukup baik dalam menghambat pertumbuhan bakteri patogen Xanthomonas oryzae pv. oryzae secara
in vivo pada tanaman padi.
© Hak Cipta milik IPB, tahun 2011 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk
kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan
laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan
tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh
POTENSI BEBERAPA BAKTERI PENGHAMBAT
PERTUMBUHAN Xanthomonas oryzae pv. oryzae PENYEBAB
PENYAKIT HAWAR DAUN BAKTERI PADA TANAMAN
PADI
ZURAIDAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Potensi Beberapa Bakteri Penghambat Pertumbuhan
Xanthomonas oryzae pv. oryzae Penyebab Penyakit Hawar Daun Bakteri pada Tanaman Padi
Nama : Zuraidah
NIM : G351090141
Disetujui Komisi Pembimbing
Dr. Nisa Rachmania Mubarik, M.Si. Ir. Yadi Suryadi, M.Sc. Ketua Anggota
Diketahui
Ketua Mayor Dekan Sekolah Pascasarjana IPB
Mikrobiologi
Dr. Ir. Gayuh Rahayu Dr. Ir. Dahrul Syah, M.Sc. Agr.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan November 2010 ini ialah berjudul Potensi Beberapa Bakteri Penghambat Pertumbuhan Xanthomonas oryzae pv. oryzae Penyebab Penyakit Hawar Daun Bakteri pada Tanaman Padi.
Terima kasih penulis ucapkan kepada Dr. Nisa Rachmania Mubarik, M.Si dan Ir. Yadi Suryadi, M.Sc selaku pembimbing. Ucapan terima kasih disampaikan kepada Dr. Ir. Abdjad Asih Nawangsih, M.Si sebagai penguji ujian tesis atas saran dan masukan yang diberikan. Serta ucapan terima kasih disampaikan kepada Dr. Ir. Ence Darmo Jaya Supena, M.Si sebagai Ketua Departemen Biologi, FMIPA atas saran dan masukan yang diberikan. Ucapan terima kasih disampaikan kepada Rektor IAIN Ar-Raniry Banda Aceh, serta Direktorat Jenderal Pendidikan Tinggi Agama Republik Indonesia yang telah mengizinkan penulis untuk melanjutkan studi S2 di IPB Bogor. Ucapan terima kasih disampaikan pada Departemen Pendidikan dan Kebudayaan Republik Indonesia yang telah memberikan Beasiswa Pendidikan Pacsasarjana (BPPS). Di samping itu, terima kasih disampaikan kepada pimpinan Balai Besar Bioteknologi dan Sumber daya Genetik Pertanian (BB Biogen) Bogor yang telah memberikan izin menggunakan fasilitas, serta kepada laboran BB Biogen yang telah membantu selama pelaksanaan penelitian. Penghargaan penulis sampaikan kepada staf dan laboran di laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB yang telah membimbing dan membantu selama penelitian. Penelitian ini didanai dari proyek penelitian Kerjasama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) kepada Dr. Nisa Rachmania Mubarik, M.Si tahun 2011. Ucapan terima kasih juga penulis disampaikan kepada Bayo Alhusaeri Siregar, M.Si dan Eka Astuty, serta mikrotropisian 2009 dalam membantu pelaksanaan penelitian. Terima kasih juga penulis sampaikan kepada suami dan anak-anak tercinta Mirza Muhammad, ST, MT, Fawwaz Zakka Mirza, Faizza Zayya Mirza, kepada ayah dan ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2011
RIWAYAT HIDUP
Penulis dilahirkan di Medan pada tanggal 1 April 1977 sebagai anak pertama dari tiga bersaudara dari pasangan Ibrahim Husein dan Zaitun Yusuf. Pendidikan sarjana ditempuh di Program Studi Biologi, Fakultas MIPA UNSYIAH Banda Aceh, lulus tahun 2001. Kesempatan untuk melanjutkan ke program magister pada Program Studi Mikrobiologi IPB diperoleh pada tahun 2009. Beasiswa pendidikan pascasarjana diperoleh dari Beasiswa BPPS Dikti.
Penulis bekerja sebagai staf pengajar di program studi Biologi, Fakultas Tarbiyah IAIN Ar-Raniry Banda Aceh sejak tahun 2006.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xii
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 2
Hipotesis Penelitian ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA Perkembangan Penyakit Hawar Daun Bakteri di Indonesia ... 5
Karakteristik Penyakit Hawar Daun Bakteri ... 5
Mekanisme Xanthomonas oryzae pv. oryzae dalam Menginfeksi Tanaman ... 6
Pergeseran Patotipe Xanthomonas oryzae pv. oryzae ... 7
Pencarian Sumber Ketahanan Tanaman Padi terhadap Penyakit Hawar Daun Bakteri ... 8
Pengendalian Hawar Daun Bakteri secara Kultur Teknis ... 9
Pengendalian Hawar Daun Bakteri secara Hayati ... 10
Senyawa Antimikrob yang Dihasilkan oleh Pseudomonas sp ... 12
Senyawa Antimikrob yang Dihasilkan oleh Bacillus sp. ... 13
Senyawa Antimikrob yang Dihasilkan oleh Serratia marcescens ... 14
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 17
Bahan ... 17
Peremajaan Mikrob ... 17
Uji Reaksi Hipersensitif Isolat Uji serta Isolat Patogen Xanthomonasoryzae pv. oryzae terhadap Tanaman Tembakau ... 18
Seleksi Isolat Uji yang Berpotensi Menghambat Pertumbuhan Xanthomonas oryzae pv. oryzae ... 18
HASIL
Karakteristik Pertumbuhan Mikrob ... 23
Reaksi Hipersensitif Isolat Uji serta Isolat Patogen Xanthomonas oryzae pv. oryzae terhadap Tanaman Tembakau ... 24
Potensi Isolat Uji dalam Menghambat Pertumbuhan Xanthomonas oryzae pv. oryzae ... 24
Aplikasi Isolat Uji terhadap Xanthomonas oryzae pv. oryzae pada Tanaman Padi di Rumah Kaca ... 26
Panjang Lesio Hawar Daun Bakteri ... 26
Tinggi Tanaman ... 29
Jumlah Anakan ... 30
Jumlah Malai ... 33
Produksi Gabah ... 33
PEMBAHASAN ... 37
SIMPULAN ... 49
DAFTAR PUSTAKA ... 51
LAMPIRAN ... 59
DAFTAR GAMBAR
Halaman
1 Isolat Pseudomonas aeruginosa ... 23 2 Pengujian reaksi hipersensitif pada daun tembakau setelah 48 jam
inokulasi bakteri ... 24 3 Pengujian antagonis isolat uji terhadap Xoo dibandingkan dengan
kontrol ... 25 4 Gejala HDB pada ujung daun menguning 3 hari setelah inokulasi
Xoo ... 26 5 Gejala HDB pada ujung daun menguning 18 hari setelah inokulasi
Xoo ... 27 6 Panjang lesio HDB pada daun padi setelah inokulasi Xoo ... 28 7 Intensitas serangan HDB pada tanaman padi dan nilai AUDPC
(cm.hari) ... 29 8 Tinggi tanaman padi yang diberi perlakuan isolat biokontrol ... 31 9 Jumlah anakan padi yang diberi perlakuan dengan isolat
biokontrol ... 32 10 Jumlah malai padi yang terserang Xoo dan diberi perlakuan dengan
isolat biokontrol dan panen 9 minggu setelah tanam ... 33 11 Bobot gabah padi yang terserang Xoo dan diberi perlakuan dengan
isolat biokontrol dan panen 9 minggu setelah tanam ... 33 12 Regresi panjang lesio HDB terhadap produksi padi pada
saat panen ... 34
DAFTAR LAMPIRAN
Halaman
1 Karakteristik isolat-isolat yang digunakan dalam penelitian ini ... 60 2 Komposisi bahan dalam beberapa media ... 61 3 Pengaruh perlakuan isolat-isolat uji terhadap panjang lesio HDB dan
nilai AUDPC ... 63 4 Pengaruh perlakuan isolat-isolat uji terhadap tinggi tanaman
padi ... 64 5 Pengaruh perlakuan isolat-isolat uji terhadap jumlah anakan
Latar Belakang
Penyakit hawar daun bakteri (HDB) disebabkan oleh Xanthomonas oryzae
pv. oryzae (Xoo) merupakan salah satu penyakit yang dapat menurunkan kuantitas
serta kualitas produksi tanaman padi (Goto 1998). HDB dapat mengurangi hasil
panen dengan tingkat bervariasi, tergantung pada stadium pertumbuhan tanaman
yang terinfeksi, tingkat kerentanan kultivar padi, dan kondisi lingkungan (Abdullah
2002). Penyakit ini tersebar hampir di seluruh daerah pertanaman padi di Indonesia
baik di dataran rendah maupun dataran tinggi baik pada musim kemarau maupun
musim hujan. Penyakit ini pada musim hujan biasanya berkembang lebih pesat
dibandingkan musim kemarau. Kerugian hasil yang disebabkan oleh HDB dapat
mencapai 60%. Hasil penelitian menunjukkan bahwa bila tingkat keparahan
sebesar 20% sebulan sebelum panen, penyakit ini sudah mulai menurunkan hasil
(Deptan 2011).
Penyakit HDB berkembang menjadi penyakit serius sejak digunakan
varietas unggul IR64. Kerusakan yang ditimbulkan terus meningkat sebagai akibat
meluasnya pertanaman varietas unggul IR64 yang tahan terhadap wereng batang
coklat tetapi sangat rentan terhadap HDB, sehingga butuh penanganan khusus
terhadap penyakit yang disebabkan oleh bakteri ini (Ratna 2000).
Berbagai usaha penanggulangan penyakit ini telah banyak dilakukan, antara
lain dengan menggunakan bahan kimia sintetik seperti asam benzoat dan nitrit,
ataupun aplikasi pestisida berbahan dasar senyawa antibiotik (Asman 1996).
Penggunaan senyawa kimia sebagai pupuk dan pestisida serta antibiotik dalam
penanganan penyakit tanaman dapat menyebabkan resistensi terhadap bakteri,
menimbulkan residu, dan pencemaran lingkungan.
Alternatif biokontrol seperti aplikasi mikrob pengendali hayati
menghasilkan zat antimikrob tanpa mencemari lingkungan. Bakteri mampu
menghasilkan senyawa metabolit yang memiliki efek bakterisidal atau
bakteriostatik untuk menghambat pertumbuhan bakteri patogen. Genus bakteri
yang umum digunakan dan menghasilkan zat antimikrob berupa bakteriosin ialah
sudah digunakan antara lain Pseudomonas flourescens dan Bacillus subtilis.
Formulasi campuran kedua bakteri tersebut telah diaplikasikan untuk
mengendalikan penyakit pustul bakteri kedelai yang disebabkan oleh
Xanthomonas campestris pv. glycines (Dirmawati 2005).
Sejumlah spesies bakteri dari genus Bacillus dan Pseudomonas yang
tergolong plant growth promoting rhizobacteria (PGPR) selain memacu
pertumbuhan tanaman juga dapat meningkatkan ketahanan terhadap penyakit
karena memproduksi antibiotik (Wahyudi et al. 2009), dapat memproduksi asam
sianida, siderofor (Santhini et al. 2005), enzim ekstraseluler yaitu kitinase,
selulase, dan protease yang melisis sel patogen (Jaiganesh et al. 2007; Mubarik et
al. 2010). Suryadi et al. (2011) melaporkan beberapa isolat bakteri memiliki
potensi menekan penyakit blas atau hawar pelepah (sheath blight) yang
disebabkan oleh cendawan patogen Pyricularia grisea pada aplikasi di rumah
kaca, seperti B. cereus I.21, B. firmus E65, B. cereus II.14, B. cereus C29d,
Bacillus sp. I.5, dan Serratia marcescens E31. Isolat-isolat tersebut menunjukkan
kecenderungan lebih baik menekan blas dari pada fungisida yang mengandung
bahan aktif mancozeb. Berdasarkan hasil penelitian tersebut, penggunaan bakteri
ramah lingkungan yang terdiri atas bakteri yang dapat menghambat penyakit
patogen padi dan menghasilkan hormon pemacu pertumbuhan tanaman padi serta
memproduksi enzim ekstraseluler akan lebih efektif dari pada senyawa kimia
pembasmi patogen yang dapat merusak lingkungan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari kemampuan penghambatan
delapan isolat bakteri terhadap bakteri patogen Xanthomonas oryzae pv. oryzae
yang merupakan penyebab penyakit hawar daun bakteri pada tanaman padi di
Hipotesis Penelitian
Hipotesis dari penelitian ini yaitu:
1. Isolat-isolat uji tidak menunjukkan respon hipersensitif terhadap tanaman
tembakau dibandingkan bakteri Xanthomonas oryzae pv. oryzae yang
bersifat patogen terhadap tanaman.
2. Isolat-isolat uji menunjukkan aktivitas penghambatan terhadap bakteri
patogen Xanthomonas oryzae pv. oryzae.
3. Isolat-isolat uji menunjukkan aktivitas penghambatan terhadap penyakit
hawar daun bakteri ditinjau dari panjang lesio pada daun padi.
Manfaat Penelitian
Informasi yang didapatkan dari penelitian ini diharapkan dapat mendukung
pemanfaatan lebih lanjut bakteri-bakteri uji yang bersifat biokontrol sehingga
efektif untuk mengendalikan pertumbuhan Xanthomonas oryzae pv. oryzae pada
TINJAUAN PUSTAKA
Perkembangan Penyakit Hawar Daun Bakteri di Indonesia
Hawar daun bakteri pertama kali dilaporkan di Jepang tahun 1884, dari
Jepang menyebar secara luas di Asia seperi di Srilangka, Filipina, dan Pakistan
(Yamasaki et al. 2006). Salah satu penyakit padi terpenting di banyak negara
penghasil beras termasuk Indonesia. Di Indonesia, HDB pertama kali disebabkan
oleh organisme Xanthomonas sp. (Zhang 2006). Namun hasil penelitian Goto
(1998) menunjukkan bahwa patogen penyebab HDB di Indonesia sama seperti
yang menyerang tanaman padi di Jepang, sehingga namanya diganti menjadi
Xanthomonas oryzae. Pada tahun 1976, nama patogen ini menjadi Xanthomonas
campestris pv. oryzae dan sejak tahun 1992 diganti menjadi Xanthomonas oryzae
pv. oryzae.
Karakteristik Penyakit Hawar Daun Bakteri
Penyakit hawar daun bakteri disebabkan oleh bakteri Xanthomonas oryzae
pv. oryzae (Xoo). Bakteri ini berbentuk batang dengan koloni berwarna kuning.
Memiliki virulensi yang bervariasi tergantung kemampuannya untuk menginfeksi
varietas padi yang mempunyai gen resistensi berbeda. Penyakit ini tidak hanya
menyerang pada fase bibit, tetapi juga menyerang tanaman dewasa. Gejala yang
ditimbulkan akibat serangan Xoo adalah infeksi sistemik dan nekrosis (Ratna
2000). Yamasaki et al. (2006) menyatakan ada dua tipe gejala, yaitu kresek dan
hawar daun. Hawar daun (blight) ialah gejala yang timbul pada fase generatif,
ditandai dengan munculnya garis pada ujung tepi daun. Garis tersebut semakin
memanjang dan melebar, sehingga menyebabkan warna menjadi kuning sampai
putih dan dapat menutup ujung daun. Akibatnya tanaman yang terinfeksi berat
akan menghasilkan gabah hampa sehingga produksi rendah.
Pengendalian penyakit HDB pada tanaman padi masih sulit dilakukan,
karena Xoo mempunyai daerah pencar yang luas serta mempunyai kemampuan
untuk beradaptasi pada tumbuhan inang alternatif, seperti pada beberapa jenis
tergantung pada kelembaban dan keasaman tanah, serta pada sisa-sisa jerami dan
biji yang terinfeksi (Yamasaki et al. 2006).
Karakter iklim tropis menyebabkan semakin banyak galur patogen yang
ditemukan di wilayah tropis. Di Indonesia hingga saat ini telah ditemukan sekitar
12 galur Xoo dengan tingkat virulensi yang berbeda. Galur IV dan VIII
mendominasi serangan HDB pada tanaman padi di Indonesia (Suparyono et al.
2003). Isolat galur VIII tersebar paling luas dan mendominasi di lapangan,
sedangkan galur IV kurang meluas, tetapi mempunyai virulensi tertinggi dan
umumnya semua varietas padi peka terhadap kelompok isolat ini. Perkembangan
penyakit sangat tergantung pada cuaca dan ketahanan tanaman (Goto 1998).
Keragaman komposisi galur Xoo dipengaruhi oleh stadium tumbuh tanaman
padi. Dominasi kelompok galur yang ditemukan pada stadium anakan, berbunga,
dan pemasakan berbeda. Fenomena ketahanan tanaman dewasa, mutasi, dan
karakter heterogenisitas alamiah populasi mikroorganisme diperkirakan sebagai
faktor yang mempengaruhi komposisi galur dengan stadium tumbuh tanaman padi
(Suparyono et al. 2003).
Mekanisme Xanthomonas oryzae pv. oryzae dalam Menginfeksi Tanaman
Bakteri Xoo menginfeksi tanaman melalui hidatoda atau luka. Penyebaran
penyakit melalui kontak fisik antara daun yang terinfeksi dengan daun yang sehat,
melalui aliran irigasi dari satu lahan ke lahan lainnya. Selain itu lingkungan yang
lembab dan jarak tanam yang terlalu rapat juga mempermudah penularan penyakit
ini (Khaeruni 2001).
Bakteri masuk ke dalam jaringan tanaman, lalu memperbanyak diri di dalam
epidermis yang menghubungkan dengan pembuluh pengangkut, kemudian
tersebar ke jaringan lainnya dan menimbulkan gejala. Infeksi yang terjadi pada
pembibitan menyebabkan bibit menjadi kering. Bakteri menginfeksi masuk
melalui sistem vaskular tanaman padi pada saat pindah tanam atau pada saat
dicabut dari tempat pembibitan sehingga akarnya rusak, atau terjadi infeksi pada
saat daun rusak (Suparyono et al. 2003).
Penyakit dapat terjadi pada semua stadia tanaman. Namun pada umumnya
Gejala penyakit disebut kresek pada stadia bibit, sedang gejala stadia tanaman
yang lebih lanjut disebut hawar. Gejala diawali dengan bercak kelabu umumnya
di bagian pinggir daun. Bercak berkembang terus pada varietas yang rentan dan
akhirnya membentuk hawar. Ketika kondisi menjadi parah, tanaman terlihat
kering seperti terbakar (Suparyono et al. 2003).
Pergeseran Patotipe Xanthomonas oryzae pv. oryzae
Xanthomonas oryzae pv. oryzae (Xoo) membentuk galur-galur baru di
lapangan sejalan dengan perkembangan penggunaan varietas padi. Perbedaan
virulensi antara Xoo yang dikumpulkan dari berbagai daerah merupakan dinamika
interaksi antara inang dan patogen yang dapat dibedakan menjadi varietas
diferensial dan kelompok di pihak patogen (Goto 1998).
Xanthomonas oryzae pv. oryzae dikatakan sebagai spesies kompleks. Hal ini
didasari oleh penyebaran yang luas, keragaman genetik, filogenetik, dan molekuler
dari galur-galur yang menyerang tanaman (Tsuyuma et al. 1996). Galur III
mempunyai daerah sebaran yang paling luas, meliputi Sulawesi Selatan,
Kalimantan Selatan, Jawa, dan Bali. Perbedaan virulensi dari isolat Xoo
dipengaruhi oleh gen virulensi yang dimilikinya. Bila terdapat gen virulensi
patogen Xoo yang kompatibel dengan gen ketahanan inang (padi), maka patogen
tersebut mampu menyerang inang. Berdasarkan pola virulensinya terhadap
varietas uji (galur isogenik), isolat yang termasuk dalam kelompok galur IV
diduga sekurang-kurangnya memiliki 8 gen virulen, yaitu v-1, v-2, v-3, v-8, v-10,
v-11, v-12, dan v-14. Isolat yang termasuk ke dalam kelompok galur III hanya
memiliki 7 gen virulen, yaitu v-1, v-4, v-8, v-10, v-11, v-12, dan v-14 (Yamasaki et
al. 2006).
Tsuyuma et al. (1996) melaporkan bahwa interaksi antagonis antara dua
galur tipe liar bakteri hawar daun yaitu Xoo dari Filipina dan Korea, ternyata
galur liar Filipina dapat menghambat galur liar Korea bila galur ini dicampur
dalam satu inokulasi. Selanjutnya mutan nonpatogenik galur Filipina
mengendalikan antagonistik pada bakteri lain. Ternyata galur tipe liar Filipina dan
mutan nonpatogenik dapat menghambat pertumbuhan galur Korea setelah dua hari
penggabungan dengan mutan nonpatogenik, 10-18 macam Xoo tipe liar tidak
menyebabkan penyakit. Sebaliknya tiga dari galur nonpatogenik dapat
menghambat tipe liar dan mutan galur Filipina.
Pertambahan kelompok galur Xoo maka pengendalian penyakit HDB
menjadi semakin sulit. Oleh karena itu, pergeseran galur Xoo perlu terus dipantau
untuk mengetahui kelompok galur Xoo yang akan digunakan dalam program
pemuliaan padi dan untuk dijadikan acuan dalam menentukan varietas padi yang
akan direkomendasikan untuk suatu wilayah (Suparyono et al. 2003).
Pencarian Sumber Ketahanan Tanaman Padi terhadap Penyakit Hawar Daun Bakteri
Varietas tahan merupakan komponen utama pengendalian HDB secara
terpadu karena sangat ekonomis, efektif, dan tidak merusak lingkungan. Tetapi
keefektifan varietas yang tahan ini dipengaruhi oleh interaksi antara gen pembawa
sifat tahan yang dimilikinya dan gen virulensi pada populasi Xooyang terdapat di
suatu wilayah (Yamasaki et al. 2006).
Galur Xoo berbeda dari suatu daerah dengan daerah lain, dan dari suatu
negara dengan negara lain. Varietas padi yang tahan terhadap galur Xoo asal
Filipina belum dapat dipastikan akan bereaksi tahan terhadap galur asal Indonesia
atau negara lain, sehingga perlu adanya pengujian ulang. Varietas dengan gen
ketahanan xa-5 bereaksi tahan terhadap semua galur asal Filipina, sedangkan
varietas dengan gen ketahanan xa-4 seperti yang dimiliki IR64 hanya tahan
terhadap galur I asal Filipina (Yamasaki et al. 2006). Oleh karena itu gen
ketahanan yang masih efektif di suatu wilayah perlu diidentifikasi dengan
seksama.
Penggunaan bakteri isogenik yang nonpatogen melalui mutagenesis
menggunakan transposon merupakan salah satu cara untuk mendapatkan varietas
yang tahan terhadap HDB. Transposon akan menyisip ke dalam genom dan
terutama sekuen DNA yang berperan dalam regulasi suatu proses fisiologi tertentu
seperti sifat virulen, sehingga menyebabkan perubahan ekspresi gen. Selanjutnya
akan dihasilkan mutan Xoo yang tidak menginduksi reaksi hipersensitif sehingga
berkurang sifat virulennya mampu mengurangi kerugian produksi padi akibat
penyakit HDB. Mutan yang dihasilkan secara genetik sama dengan tipe liarnya
disebut isogenik. Mutan isogenik yang nonpatogenik diharapkan mampu menekan
pertumbuhan tipe liarnya dengan cara kompetisi. Penggunaan mutan isogenik
tersebut lebih menguntungkan karena mutan akan berperilaku sama dengan tipe
liarnya dalam merespon perubahan lingkungan sehingga memiliki kesintasan yang
sama di alam (Nakayachi 1995).
Menurut Sugio et al. (2005) bahwa mutasi gen hrpF pada bakteri Xoo tidak
menghilangkan patogenitasnya tetapi dapat mengurangi kemampuan bakteri untuk
tumbuh pada padi dan juga mengurangi kemampuannya dalam menyebabkan
gejala HDB. Hal ini disebabkan keterlibatan gen-gen lain yang menentukan sifat
virulen Xoo. Beberapa gen yang diketahui berperan dalam menentukan virulensi
Xoo antara lain gumG, xps, aroE, rpfF, pgi, purH, dan eglXoB, sehingga mutasi
pada gen hrp Xoo tidak dapat secara langsung menghilangkan seluruh sifat
patogenitasnya pada tanaman padi (Hu et al. 2007).
Pengendalian Hawar Daun Bakteri secara Kultur Teknis
Intensitas serangan HDB tidak hanya dipengaruhi oleh ketahanan varietas
dan virulensi patogen, tetapi juga dipengaruhi oleh teknik bercocok tanam yang
diterapkan oleh petani. Sama halnya dengan penyakit-penyakit padi lainnya,
penyakit HDB mempunyai hubungan yang jelas dengan pemupukan, khususnya
pemupukan nitrogen. Pemberian pupuk N dengan dosis tertentu untuk
meningkatkan pertumbuhan vegetatif dan produktivitas. Sebaliknya pemupukan N
dengan dosis yang tinggi akan meningkatkan kerusakan pada varietas dengan
ketahanan, walaupun pada varietas yang resisten dampaknya relatif kecil. Oleh
karena itu, pemupukan N yang berlebihan sebaiknya dihindarkan. Selain
pemupukan sesuai dosis anjuran, pergiliran varietas dan tanaman, sanitasi dan
eradikasi pada tanaman yang terserang dapat dilakukan untuk mengendalikan
Pengendalian Hawar Daun Bakteri secara Hayati
Kondisi lingkungan yang cocok untuk perkembangan penyakit dapat mendorong penyakit berkembang lebih pesat. Arwiyanto et al. (2007) melaporkan bahwa petani belum melakukan pengelolaan penyakit secara benar misalnya masih menggunakan bibit padi yang terinfeksi penyakit hawar daun bakteri, membiarkan sisa-sisa tanaman sakit, dan tidak melakukan pemupukan sehingga dapat memacu perkembangan penyakit HDB. Pengendalian penyakit tanaman di Indonesia selama ini lebih banyak mengandalkan penggunaan pestisida, namun akibat efek samping yang ditimbulkan maka penggunaannya mulai dikurangi karena residu yang ditinggalkan dapat bersifat racun dan karsinogenik.
Pengendalian bakteri patogen lebih efektif bila dilakukan secara terpadu dengan mengkombinasikan berbagai teknik pengendalian, meliputi varietas tahan atau toleran, teknik budidaya (pergiliran tanaman, bahan organik, pemupukan), pengendalian menggunakan agen biokontrol, pestisida nabati dan membatasi penyebaran bakteri patogen termasuk pengaturan karantina (Arwiyanto et al.
2007).
Menurut Pal dan Gardener (2006) biokontrol telah digunakan dalam berbagai bidang biologi, terutama entomologi dan patologi tanaman. Bidang entomologi menggunakan predator serangga hidup, nematoda entomopatogen, atau mikrob patogen untuk menekan populasi hama serangga. Dalam patologi tanaman penggunaan berjangka mikrob antagonis untuk menekan penyakit serta penggunaan patogen inang spesifik untuk mengendalikan populasi patogen lainnya. Organisme yang menekan hama atau patogen disebut sebagai agen biokontrol. Agen biokontrol umumnya menghasilkan antibiotik dalam jumlah relatif kecil sehingga kosentrasi di alam relatif rendah, walaupun senyawa tersebut mempunyai spektrum yang luas namun tidak memberikan tekanan yang terlalu kuat terhadap patogen sehingga tidak menimbulkan resistensi (Nawangsih 2006).
aman, tidak terakumulasi dalam rantai makanan, adanya proses reproduksi
sehingga dapat mengurangi pemakaian yang berulang-ulang dan dapat digunakan
secara bersama-sama dengan pengendalian yang telah ada. Penggunaan agen
biokontrol dalam skala luas di lapangan memerlukan beberapa kriteria antara lain
formulasi agen biokontrol mudah diaplikasi di lapangan, pembiakan massal dan
bahan formulasi yang murah dan mudah didapatkan, serta agen biokontrol mampu
bertahan pada waktu yang relatif lama dalam bahan formulasinya di suhu ruang
(Dirmawati 2005).
Sebagian besar pekerjaan di bidang biokontrol masih dalam taraf percobaan
dan kajian kelayakan ekonomi, seperti halnya biokontrol penyakit HDB masih
dalam taraf pengujian di laboratorium dan rumah kaca. Hasil penelitian Khaeruni
(2001) menunjukkan bahwa terdapat sejumlah bakteri filosfer yang diisolasi dari
daun padi berpotensi sebagai agen biokontrol penyakit HDB pada skala rumah
kaca. Demikian pula Machmud dan Farida (1995) melaporkan bahwa bakteri
filosfer Pseudomonas fluorescens dan Bacillus sp. yang diisolasi dari daun dan
batang tanaman padi berpotensi sebagai agen biokontrol penyakit HDB pada padi
secara in vitro.
Kemampuan bakteri tanah bertahan hidup diduga sangat tergantung pada
keberadaan tanaman inang. Bakteri patogen yang spesifik pada tanaman inang
terdapat pada lahan tertentu. Hal tersebut berkaitan dengan faktor lingkungan,
baik faktor abiotik, seperti suhu, tipe tanah, dan curah hujan maupun faktor
biotik, sebagai contoh keberadaan nematoda dapat memperparah serangan
penyakit HDB pada tanaman padi (Agustiansyah 2009). Tanaman merespon
berbagai stimulus lingkungan, termasuk gravitasi, cahaya, suhu, stres fisik, air,
dan ketersediaan hara. Tanaman juga menanggapi berbagai rangsangan kimia
yang diproduksi oleh tanah dan tanaman yang berasosiasi dengan mikrob.
Rangsangan tersebut dapat menginduksi pertahanan tanaman melalui perubahan
biokimia yang meningkatkan perlawanan terhadap infeksi berbagai patogen.
Induksi pertahanan inang dapat bersifat lokal atau sistemik di alam tergantung
pada jenis, sumber, dan jumlah rangsangan. Terdapat beberapa jalur induksi
resistensi yang dirangsang oleh agen biokontrol. Jalur pertama disebut ketahanan
oleh asam salisilat (SA) yaitu senyawa yang sering diproduksi oleh mikrob yang
menginfeksi dan biasanya mengarah ke ekspresi protein terkait patogenesis (PR).
Protein PR ini termasuk beberapa enzim yang beragam yang bertindak secara
langsung untuk melisiskan sel yang menyerang, memperkuat batas-batas dinding
sel untuk melawan infeksi, atau menginduksi kematian sel lokal. Jalur lainnya
ialah resistensi sistemik terinduksi atau induced systemic resistance (ISR),
diperantarai oleh asam jasmonat (JA) atau etilen yang dihasilkan oleh beberapa
rhizobacteria nonpatogen (Pal & Gardener 2006).
Senyawa Antimikrob yang Dihasilkan oleh Pseudomonas sp.
Bakteri Pseudomonas sp. mampu mendegradasi sejumlah besar senyawa
organik, berinteraksi dengan tanaman dan berasosiasi dalam rizosfer yang bersifat
menguntungkan di bidang pertanian dan sebagian lainnya dapat sebagai agen
biokontrol (West 2005). Bakteri ini banyak menguntungkan bagi tanaman secara
langsung, yaitu melalui pemacuan pertumbuhan dan peningkatan kesehatan
tanaman, atau secara tidak langsung melalui penghambatan, kompetisi dengan
patogen atau parasit (Loccoz & Defago 2004).
Bakteri Pseudomonas sp. sebagai agen pemacu pertumbuhan tanaman
menghasilkan fitohormon dalam jumlah besar khususnya indole acetic acid (IAA)
untuk merangsang pertumbuhan yaitu giberelin, sitokinin, dan etilen serta
melarutkan fosfat, kalium atau nutrien lain sehingga tersedia bagi tanaman (Astuti
2008). Pada beberapa galur Pseudomonas sp. dapat membantu tanaman
menghadapi cekaman lingkungan seperti kekurangan air dan nutrien serta
pencemaran senyawa toksin (Shen 1997).
Selain sebagai pemacu pertumbuhan tanaman, Pseudomonas sp. juga
mempunyai kemampuan sebagai agen biokontrol terhadap serangan fungi patogen
tanaman. Mekanisme dalam menekan pertumbuhan fungi patogen tanaman antara
lain karena bakteri ini mampu menghasilkan senyawa siderofor, β-1,3 glukanase,
kitinase, antibiosis, dan sianida (Chermin & Chet 2002).
Senyawa antimikrob juga dapat dihasilkan oleh bakteri Pseudomonas sp.
seperti bakteriosin, fenazin, pioluteorin, pirolniftril, 2,4 diasetil floroglusinol, dan
diproduksi oleh Pseudomonas fluorescens 2-79 mampu menghambat
Gaeumannomyces graminis var. tritici ketika diperlakukan pada benih gandum
(Weller 1988). Velusamy et al. (2006) melaporkan 2,4 diasetil floroglusinol yang
diproduksi oleh Pseudomonas sp. dapat menghambat pertumbuhan Xanthomonas
oryzae pv. oryzae yang menyebabkan penyakit HDB pada tanaman padi. Hasil
penelitian lainnya melaporkan bahwa agen biokontrol seperti Pseudomonas
fluorescens mampu menghasilkan asam sianida (HCN) yang mampu menekan
penyakit Black root pada tembakau (Zhang 2006). Sedangkan menurut Loccoz &
Defago (2004) agen biokontrol mampu bertindak sebagai parasit bagi patogen
secara langsung dengan cara mensekresikan enzim ekstraseluler (kitinase,
protease, selulase) yang dapat melisis atau mendegradasi dinding sel patogen
sehingga perkembangan patogen menjadi terhambat. Pseudomonas fluorescens
memproduksi pigmen fluoresen berwarna kuning hijau berfungsi sebagai
siderofor (Weller 1988), juga menghasilkan 2,4-diasetilfloroglusinol (Raaijmakers
et al. 1999) yang mampu mengendalikan berbagai penyakit tular tanah.
Senyawa Antimikrob yang Dihasilkan oleh Bacillus sp.
Bakteri Bacillus sp. mampu membentuk endospora pada kondisi lingkungan
yang tidak menguntungkan sehingga dapat bertahan hidup. Kemampuannya dalam
membentuk endospora menjadikan Bacillus sp. banyak digunakan dalam industri
secara komersil karena dapat bertahan lama dan beradaptasi dengan formula dan
bahan-bahan kimia yang diaplikasikan dalam tanah pertanian (Bai et al. 2003).
Bakteri ini tergolong dalam bakteri aerob dan anaerob fakultatif (Holt et al.
1994).
Bakteri Bacillus sp. mempunyai kemampuan sebagai biokontrol penyakit
tanaman dengan memproduksi antibiotik yang disekresikan saat kultur memasuki
fase stasioner dan memproduksi antibiotik metabolit sekunder seperti
enzim kitinase, mycobacilin, basitrasin, dan zwittermicin (Madigan et al. 2000).
Bakteriosin merupakan senyawa antimikrob polipeptida yang disintesis di
ribosom dan biasanya hanya menghambat galur-galur bakteri yang berkerabat
dekat dengan bakteri penghasil bakteriosin tersebut (Jack et al. 1995). Isramilda
metabolit aktif yaitu bakteriosin. Secara in vitro bakteriosin dapat diproduksi
kemudian dipekatkan dengan berbagai metode pengendapan sebagaimana metode
pengendapan protein. Berbagai pelarut organik seperti aseton, metanol dan etanol
dapat digunakan untuk mengendapkan bakteriosin. Beberapa jenis bakteriosin
yang dihasilkan oleh Bacillus ialah subtilin (B. subtilis), megacin (B.
megaterium), ericin (B. subtilis), licherin (B. licherniformis), coagulin (B.
coagulans), cerein (B. cereus), dan thuricin (B. thuringiensis) (Jack et al.1995).
Senyawa antibiotik zwittermicin A yang diproduksi oleh B. cereus dilaporkan
oleh Weller (1988) mampu menghambat pertumbuhan koloni Phytophthora
medicaginic.
Bakteri B. subtilis dan B. cereus positif menghasilkan senyawa siderofor,
sehingga bakteri ini mampu berkompetisi dengan bakteri patogen dalam
menggunakan Fe3+ yang kosentrasinya sangat terbatas dalam tanah. Pengambilan
Fe3+ oleh bakteri tidak mengganggu kebutuhan tanaman karena tanaman hanya
membutuhkan dalam jumlah sedikit dibandingkan dengan mikroorganisme
(Nawangsih 2006). B. cereus galur UW85 mampu menghasilkan zwittermicin dan
kanosamine. Kemampuan menghasilkan beberapa antibiotik mampu menekan
beragam mikrob pesaing sebagai patogen tanaman (Pal & Gardener 2006).
Senyawa Antimikrob yang Dihasilkan oleh Serratia marcescens
Beberapa galur S. marcescens dapat menghasilkan pigmen prodigiosin yang
berwarna merah gelap hingga merah muda, tergantung pada usia koloni bakteri
tersebut (Madigan et al. 2000). Bakteri ini termasuk Gram negatif yang dapat
tumbuh pada kondisi nutrisi sederhana dan mudah mengkolonisasi pada filosfer
tanaman (Carbonell et al. 2003). Bakteri ini memproduksi enzim kitinase, lipase,
kloroperoksidase, dan protein ekstraseluler. Antibiotik yang umumnya
digunakan untuk mengobati infeksi Serratia yaitu β-laktam, aminoglikosida, dan
fluoroquinol (Hejazi & Falkiner 1997).
Penggunaan bakteri epifit Serratia marcescens galur Kgh1, Pseudomonas
fluorescens galur E10, dan Pantoea agglomerans galur Abp2 mampu mengurangi
gejala penyakit hawar api atau fire blight yang disebabkan oleh Erwinia
galur Kgh1 di lapangan sangat baik dalam menekan penyakit hawar api tersebut
(Gerami et al. 2011).
Serratia marcescens galur 90-166 sebagai rhizobakteria mampu
menginduksi resistensi sistemik (ISR) terhadap fungi patogen, bakteri, dan virus.
Hal ini disebabkan S. marcescens galur 90-166 dapat memproduksi asam salisilat
(SA) dengan menggunakan plasmid salicylateresponsif pUTK21. Bakteri ini
mampu menekan penyakit yang diakibatkan oleh fungi patogen Colletotrichum
orbiculare pada tanaman mentimun. Selain itu S. marcescens galur 90-166
menghasilkan salisilat hidroksilase yang dapat menekan penyakit yang disebabkan
oleh Pseudomonas syringae pv. tabaci pada tembakau tipe liar Xanthi-nc dan
tembakau transgenik NahG-10. Kenaikan kosentrasi besi secara in vitro ternyata
dapat mengurangi produksi SA, dan meningkatnya kosentrasi besi di dalam
tanaman mentimun yang diserap melalui akar ternyata mengurangi induksi ISR
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan November 2010 sampai dengan Juni
2011 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB dan di
laboratorium serta rumah kaca Balai Besar Bioteknologi dan Sumber daya Genetik
Pertanian (BB Biogen), Bogor.
Bahan
Bahan yang digunakan ialah: padi IR64, tanaman tembakau, isolat bakteri
Pseudomonas aeruginosa C32a dan C32b, Serratia marcescens E31, B. firmus
E65, dan isolat patogen Xanthomonas oryzae pv. oryzae (Xoo) dari koleksi bank
gen mikrob BB Biogen. Isolat bakteri P. fluorescens ATCC13525 Pf, Bacillus sp.
I.5, dan Bacillus cereus I.21 dan II.14 dari koleksi IPB Culture Collection
(IPBCC) Departemen Biologi, FMIPA, IPB, (Lampiran 1). Media yang digunakan
ialah: King’S B agar, nutrientagar (NA), dan wakimoto agar (WA) (Lampiran 2).
Peremajaan Mikrob
Isolat bakteri Pseudomonas aeruginosa C32a dan C32b dan P. fluorescens
Pf diperbanyak dengan memindahkan kultur pada medium agar-agar King’S B
dan diinkubasi pada suhu ruang selama 24-48 jam. Isolat tersebut diremajakan dan
diperiksa kemurniannya dengan menggunakan metode kuadran. Biakan yang telah
murni ditumbuhkan pada medium agar-agar miring King’S B dan disimpan dalam
lemari pendingin pada suhu 200C. Hal yang sama juga dilakukan pada isolat
bakteri Xanthomonas oryzae pv. oryzae Xoo yangdiperbanyak pada medium WA
serta isolat bakteri Serratia marcescens E31, Bacillus sp. I.5, Bacillus cereus I.21
dan II.14, dan B. firmus E65 yang masing-masing diperbanyak dengan
Uji Reaksi Hipersensitif Isolat Uji serta Isolat Patogen Xanthomonas oryzae
pv. oryzae terhadap Tanaman Tembakau
Uji reaksi hipersensitif dilakukan pada daun tembakau (Nicotiana tobacum)
(Zou et al. 2006). Masing-masing isolat C32a, C32b, dan Pf diperbanyak pada
medium King’S B cair. Xoodiperbanyak pada medium WA cair, serta E31, I.5,
I.21, II.14, dan E65 diperbanyak pada medium NA cair diinkubasi selama 24
jam pada rotary shaker hingga populasinya mencapai 107cfu/ml. Masing-masing
inokulum diinjeksi sebanyak 1 ml menggunakan syringe steril berukuran 1 ml
tanpa jarum pada bagian belakang helaian daun tembakau yang sehat. Sebagai
kontrol negatif digunakan akuades steril. Daun tembakau diberi label sesuai isolat
yang diinjeksi. Respon tanaman diamati dalam jangka waktu 24-48 jam.
Pengamatan pada daun tembakau terjadi nekrosis atau tidak. Isolat-isolat yang
tidak menimbulkan reaksi hipersensitif kemudian dipilih untuk diuji daya
hambatnya terhadap Xoo.
Seleksi Isolat Uji yang Berpotensi Menghambat Pertumbuhan Xanthomonas
oryzae pv. oryzae
Uji ini menggunakan metode double layer (Lisboa et al. 2006). Uji daya
hambat bakteri-bakteri uji terhadap Xoo secara in vitro dilakukan untuk
menyeleksi isolat yang berpotensi sebagai agen biokontrol. Sebanyak 800 μL
(107cfu/ml) kultur cair bakteri patogen diinokulasi ke dalam 80 ml WA semipadat
lalu dituang pada permukaan cawan WA padat masing-masing sebanyak 10 ml.
Setelah permukaan media WA double layer memadat, potongan kertas saring
Whatman No.2 (diameter 0,7 cm) yang telah direndam dalam larutan yang
mengandung bakteri yang berumur 24 jam, kertas cakram dikeringanginkan
kemudian diletakkan di tengah cawan petri yang berisi biakan bakteri Xoo.
Biakan diinkubasi selama 24 jam kemudian diamati zona hambat di sekeliling
cakram. Perlakuan kontrol terdiri atas, kontrol negatif dengan akuades steril dan
kontrol pembanding kimia bakterisida yang mengandung bahan aktif tembaga
sulfat (CuSO4) 50% dengan merek dagang Nordox (Norwegia). Setiap perlakuan
setelah inkubasi 24 jam pada suhu ruang. Indeks aktivitas antimikrob dihitung
dengan cara (Patra et al. 2009):
Indeks aktivitas antimikrob = Nilai penghambatan perlakuan X 100%
Nilai penghambatan kontrol
Uji In Vivo Aplikasi Isolat Uji terhadap Xanthomonas oryzae pv. oryzae pada
Tanaman Padi di Rumah Kaca
Bibit padi IR64 yang akan disemai dipersiapkan terlebih dahulu dengan cara
dicuci dengan alkohol 95% selama kurang lebih 1 menit kemudian dicuci dengan
akuades steril selama tiga menit sebanyak tiga kali. Kemudian dipilih benih yang
tenggelam. Setelah dicuci, benih dibungkus dengan kain kasa dan diletakkan di
bawah aliran air kran hingga berkecambah selama lebih kurang empat hari,
kemudian ditanam di bak plastik berukuran 15х30 cm2 berisi tanah steril lembab ±
5 Kg yang telah dicampur pupuk NPK (1:1:1). Benih padi berumur 18 hari
dipindahkan ke dalam pot-pot berdiameter 30 cm, dan setiap pot ditanam 3
rumpun padi.
Koloni Xoo yang telah diperbanyak pada medium agar-agar miring selama
24 jam diambil sebanyak 2 ose kemudian ditumbuhkan dalam medium WA cair
selama 48 jam dan diukur kerapatannya sampai 107 cfu/ml. Hal yang sama juga
dilakukan pada isolat bakteri C32a, C32b, Pf, E31, I.5, I.21, II.14, dan E65 sesuai
medium pertumbuhannya. Penelitian disusun dalam Rancangan Acak Lengkap
(RAL) dengan 11 perlakuan dan 3 ulangan, total unit percobaan adalah 33 satuan
percobaan, yaitu:
1. Kontrol positif dilakukan penyemprotan senyawa kimia tembaga sulfat
2. Kontrol negatif dilakukan penyemprotan air steril
3. Kontrol sakit dilakukan penyemprotan Xoo
4. Perlakuan dengan penyemprotan inokulum II.14
5. Perlakuan dengan penyemprotan inokulum I.5
6. Perlakuan dengan penyemprotan inokulum Pf
7. Perlakuan dengan penyemprotan inokulum C32a
8. Perlakuan dengan penyemprotan inokulum C32b
10. Perlakuan dengan penyemprotan inokulum E.31
11. Perlakuan dengan penyemprotan inokulum E.65
Penyemprotan 30 ml filtrat suspensi bakteri dilakukan sebelum inokulasi
patogen Xoo (preventif), yaitu umur 7 hari, 14 hari, 28 hari, dan 42 hari setelah
tanam. Sebanyak sepuluh daun padi yang telah berkembang penuh atau daun
bendera dalam setiap rumpun padi di setiap pot, masing-masing diinokulasi
patogen Xoo dengan cara pengguntingan daun (leaf clipping method) pada saat
tanaman mencapai 45 hari setelah tanam. Perlakuan kontrol pembanding
menggunakan penyemprotan senyawa kimia atau bakterisida yang mengandung
tembaga sulfat sebanyak 2 g/L dan kontrol negatif disemprot dengan akuades
steril, serta kontrol sakit diinokulasi dengan Xoo. Pengamatan terhadap gejala
penyakit HDB dilakukan pada setiap pot dengan selang waktu tiga hari selama
sebulan setelah inokulasi melalui pengukuran panjang lesio (lesion length) HDB.
Selanjutnya dilakukan penghitungan area under disease progress curve
(AUDPC). Luasan area di bawah kurva perkembangan penyakit ini ditentukan
untuk mengetahui hubungan antara intensitas penyakit terhadap respon waktu
(Shaner & Finney 1977):
n
AUDPC = ∑(yi + yi + 1) (ti + 1 –ti) i=1 2
Keterangan:
n = jumlah pengamatan ti = waktu pengamatan Yi = intensitas penyakit HDB
Pengamatan juga dilakukan terhadap tinggi tanaman, jumlah anakan padi
yang muncul, jumlah malai, bobot basah, dan bobot kering gabah tanaman padi
pada akhir pengamatan. Tinggi tanaman padi ± 17 cm dari permukaan tanah pada
saat pindah tanam ke dalam pot-pot besar. Jumlah anakan padi pada saat pindah
tanam sebanyak 4 anakan pada masing-masing pot. Penelitian disusun dalam
Rancangan Acak Lengkap (RAL) dengan 11 perlakuan dan 3 ulangan. Data hasil
percobaan dianalisis dengan menggunakan analisis ragam pada taraf kepercayaan
95% (ANOVA), jika menunjukkan pengaruh nyata maka selanjutnya dilakukan
(Uji jarak berganda Duncan, DMRT) pada taraf 5% (α=0,05) dengan
HASIL
Karakteristik Pertumbuhan Mikrob
Pertumbuhan P. aeruginosa C32a dan C32b lebih cepat dibandingkan P.
fluorescens Pf. Biakan C32a dan C32b mampu tumbuh dalam waktu 24 jam dan
mengubah warna media King’S B menjadi hijau kekuningan (Gambar 1).
Gambar 1 Isolat Pseudomonas aeruginosa.
Isolat P. fluorescens tumbuh berpendar dalam waktu 48 jam pada medium
agar King’S B. Serratia marcescens E31, Bacillus sp. I.5, Bacillus cereus I.21 dan
II.14, dan B. firmus E65 ditumbuhkan pada media agar-agar miring NA,
pertumbuhannya cepat dalam waktu 24 jam pada suhu ruang. Koloni isolat B.
firmus memiliki bentuk tidak beraturan dan menyebar dengan tepian berombak
serta elevasi timbul. Koloni isolat Bacillus sp., S. marcescens, P. aeruginosa, dan
B. cereus dicirikan dengan bentuk bundar, tepian licin, serta elevasi cembung.
Isolat patogen Xanthomonas oryzae pv. oryzae Xoo menunjukkan pertumbuhan
koloni berwarna kekuningan berlendir dengan bentuk koloni bulat, halus,
mengkilap.
C32b
Reaksi Hipersensitif Isolat Uji serta Isolat Patogen Xanthomonas oryzae pv.
oryzae terhadap Tanaman Tembakau
Pengujian reaksi hipersensitif pada daun tanaman tembakau setelah 48 jam
diinjeksi inokulum C32a dan C32b menunjukkan ciri-ciri daun agak menguning
tetapi tidak menyebabkan nekrosis (Gambar 2a). Hasil injeksi dengan inokulum
dari
isolat yang lainnya tidak menunjukkan perubahan pada daun tembakau dan tidak
terjadi nekrosis (Gambar 2a, 2b, dan 2c), artinya bakteri biokontrol tidak
patogenik terhadap tanaman tembakau sehingga tidak menyebabkan jaringan
kolaps dan mati.
Injeksi dengan menggunakan inokulum Xoo menunjukkan nekrosis
munculnya bercak abu-abu gelap dan berubah menjadi kecoklatan pada daun
tembakau (Gambar 2d). Injeksi perlakuan kontrol dengan akuades steril tidak
terjadi nekrosis (Gambar 2a). Semua bakteri biokontrol tidak menimbulkan reaksi
hipersensitif terhadap tanaman tembakau sehingga dapat dilanjutkan dengan
pengujian daya hambat isolat-isolat tersebut terhadap Xoo, dan aplikasi pada
tanaman padi secara in vivo di rumah kaca.
(a) (b) (c) (d)
Gambar 2 Pengujian reaksi hipersensitif pada daun tembakau setelah 48 jam inokulasi bakteri. Keterangan: (a) dan (b) menggunakan semua isolat uji termasuk kontrol (k), (c) Pf, dan (d) Xoo.
Potensi Isolat Uji dalam Menghambat Pertumbuhan Xanthomonas oryzae pv. oryzae
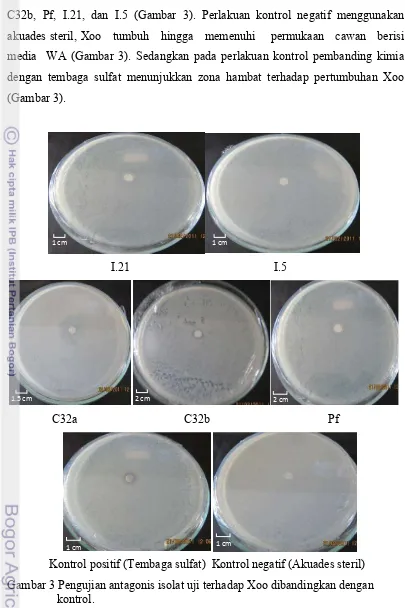
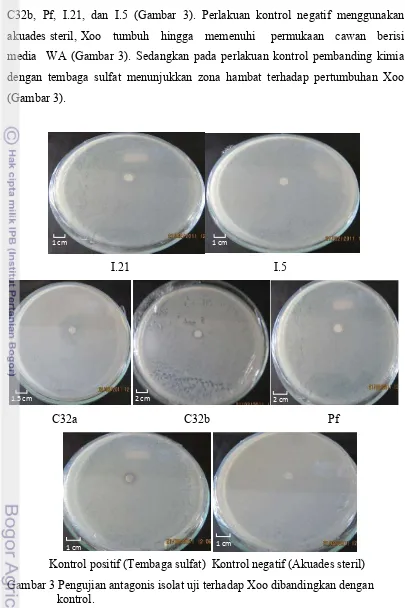
Isolat yang berpotensi menghambat pertumbuhan Xoo ditunjukkan dengan
pembentukan zona hambat. Pertumbuhan Xoo dapat dihambat oleh isolat C32a,
k
C32b, Pf, I.21, dan I.5 (Gambar 3). Perlakuan kontrol negatif menggunakan
akuades steril, Xoo tumbuh hingga memenuhi permukaan cawan berisi
media WA (Gambar 3). Sedangkan pada perlakuan kontrol pembanding kimia
dengan tembaga sulfat menunjukkan zona hambat terhadap pertumbuhan Xoo
(Gambar 3).
I.21 I.5
C32a C32b Pf
Kontrol positif (Tembaga sulfat) Kontrol negatif (Akuades steril)
Gambar 3 Pengujian antagonis isolat uji terhadap Xoo dibandingkan dengan kontrol.
Hasil pengujian efektivitas antagonisme bakteri terhadap bakteri patogen
Xoo secara in vitro memperlihatkan adanya penghambatan pertumbuhan Xoo
dengan terbentuknya zona hambat (Tabel 1). Isolat C32a dan C32b dapat
1 cm 1 cm
1.5 cm 2 cm 2 cm
menghambat pertumbuhan Xoo secara in vitro yang berbeda nyata terhadap
perlakuan kontrol pembanding kimia dengan tembaga sulfat.
Tabel 1 Zona hambat dan indeks aktivitas antimikrob isolat uji terhadap Xoo.
Perlakuan Isolat Nilai rata-rata
zona hambat (cm)
Indeks aktivitas mikrob (%)
C32a Pseudomonas aeruginosa 1,30 a 325
C32b Pseudomonas aeruginosa 1,00 ab 250
Pf Pseudomonas fluorescens 0,80 bc 200
E.31 Serratia marcescens 0,00 e 0
E.65 Bacillus firmus 0,00 e 0
I.21 Bacillus cereus 0,50 bc 125
II.14 Bacillus cereus 0,00 e 0
I.5 Bacillus sp. 0,30 c 75
Tembaga sulfat (+)
- 0,40 c 100
Akuades (-) - 0,00 e 0
Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 5% (DMRT)
Aplikasi Isolat Uji terhadap Xanthomonas oryzae pv. oryzae pada Tanaman Padi di Rumah Kaca
Panjang Lesio Hawar Daun Bakteri. Hasil uji in vivo gejala nekrosis pada daun padi yang telah diinokulasi Xoo mulai terlihat 2 hari setelah inokulasi (hsi)
dengan gejala berupa daun layu seperti tersiram air panas (water soaking) dan
berkembang menjadi gejala hawar sehingga daun berwarna kekuningan mulai 3
hsi (Gambar 4). Gejala penyakit tersebut memanjang di sepanjang tepi daun atau
di seluruh helaian daun. Panjang lesio bertambah sepanjang waktu pengamatan
hingga 18 hsi (Gambar 5).
Panjang lesio HDB yang terbentuk 3 hsi dengan aplikasi bakteri tidak
menunjukkan perbedaan dengan aplikasi menggunakan bakterisida yang
mengandung tembaga sulfat dan Xoo. Penyemprotan dengan suspensi bakteri E31
menunjukkan panjang lesio yang sama dengan perlakuan kontrol sakit yang hanya
diinokulasi dengan Xoo tanpa aplikasi biokontrol (Lampiran 3).
Gambar 5 Gejala HDB pada ujung daun menguning 18 hari setelah inokulasi Xoo. Keterangan perlakuan: (1) Akuades steril, (2) C32a, (3) Pf, (4) C32b, (5) I.21, (6) Tembaga sulfat, (7) I.5, (8) E65, (9) II.14, (10) E31, dan (11) Xoo.
Panjang lesio HDB yang terbentuk 6 hsi dengan aplikasi bakteri C32a mulai
menunjukkan perbedaan dibandingkan aplikasi menggunakan bakterisida yang
mengandung tembaga sulfat dan Xoo (Gambar 6). Aplikasi bakteri C32a
merupakan perlakuan terbaik dengan panjang lesio terendah, sedangkan isolat E31
menunjukkan panjang lesio yang lebih tinggi dibandingkan perlakuan Xoo.
Demikian juga pada 9 hsi dan 12 hsi menunjukkan hal yang sama. Namun pada
15 hsi aplikasi bakteri C32a, Pf, dan C32b menunjukkan tidak berbeda dengan
perlakuan menggunakan tembaga sulfat (Gambar 6).
Pengamatan pada 18 hsi dengan penyemprotan suspensi bakteri C32a
merupakan perlakuan terbaik yang mampu menekan intensitas perkembangan
penyakit HDB dengan panjang lesio terendah (Lampiran 3). Perlakuan
penyemprotan isolat C32a berbeda nyata terhadap perlakuan bakterisida dengan
menggunakan tembaga sulfat. Sedangkan perlakuan dengan isolat E31
menunjukkan panjang lesio tertinggi dibandingkan perlakuan menggunakan Xoo.
5
10 8 11
9 7
6
4
2 1
Gambar 6 Panjang lesio HDB pada daun padi setelah inokulasi Xoo. Keterangan: Sumbu X ialah perlakuan kontrol dan perlakuan isolat bakteri. Sumbu Y ialah panjang lesio HDB (cm).
Pengukuran intensitas perkembangan penyakit HDB ini secara kumulatif
dilakukan dengan penghitungan AUDPC. Penyemprotan dengan suspensi bakteri
C32a menunjukkan nilai AUDPC terendah hingga 49.10 cm.hari (Gambar 7).
Berdasarkan hasil pengukuran intensitas serangan penyakit, perlakuan dengan
isolat C32a membentuk grafik linear serangan HDB dengan nilai terendah
(Gambar 7). Perlakuan dengan isolat Pf dan tembaga sulfat menunjukkan garis
linear yang hampir berhimpit karena memiliki nilai yang hampir sama yang
menunjukkan kedua perlakuan ini tidak berbeda nyata (Lampiran 3). Sedangkan
isolat E31 menunjukkan garis yang tidak linear dan memiliki nilai serangan
penyakit yang lebih tinggi dari pada kontrol sakit dengan Xoo. Hal ini
menunjukkan bahwa aplikasi isolat E31 kurang efektif untuk menekan
perkembangan gejala penyakit HDB.
Gambar 7 Intensitas serangan HDB pada tanaman padi dan nilai AUDPC (cm.hari).
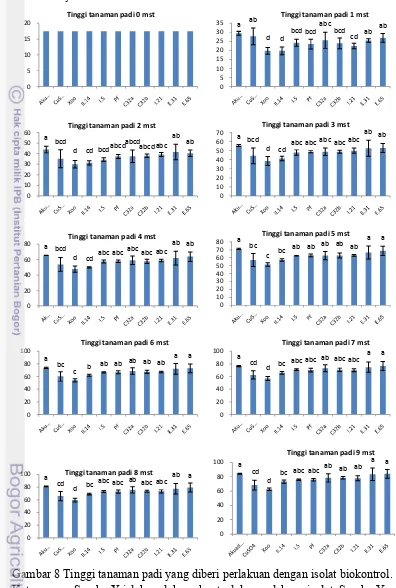
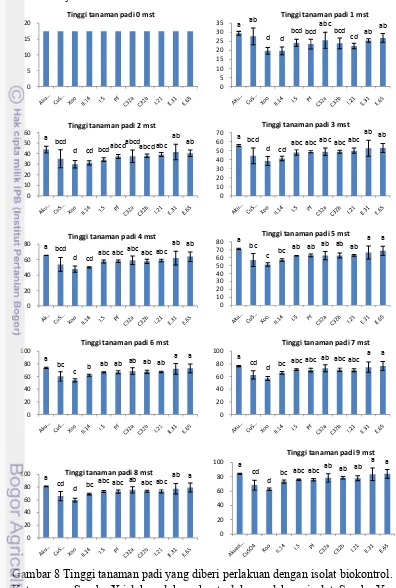
Tinggi Tanaman. Tinggi tanaman padi 1 minggu setelah tanam (mst) menunjukkan perlakuan penyemprotan dengan suspensi tembaga sulfat, E65,
C32a, dan E31 tidak berbeda dengan perlakuan akuades steril (Gambar 8). Namun
perlakuan dengan penyemprotan suspensi I.5, C32b, Pf, I.21 dan II.14
menunjukkan perbedaan dengan perlakuan akuades steril (Lampiran 4).
Pengamatan tinggi tanaman pada 2 dan 3 mst menunjukkan perlakuan
penyemprotan dengan suspensi E65, E31, I.21, C32b, C32a, dan Pf tidak berbeda
dengan perlakuan akuades steril.
Perlakuan E65, E31, C32a, I.21, Pf, C32b, dan I.5 menunjukkan tinggi
tanaman yang cenderung sama dengan perlakuan yang disemprot akuades steril
0
Waktu Pengamatan (Hari)
pada 4 mst hingga 6 mst. Tinggi tanaman padi 7 mst menunjukkan perlakuan
penyemprotan dengan suspensi isolat E65, E31, C32a, I.5, C32b, Pf, dan I.21
tidak berbeda dengan perlakuan akuades steril. Pengamatan tinggi tanaman
padi pada 8 dan 9 mst menunjukkan perlakuan penyemprotan dengan
suspensi E65, E31, C32a, C32b, I.21, Pf, dan I.5 juga tidak berbeda dengan
perlakuan akuades steril. Namun secara keseluruhan pengamatan dari 1 mst
hingga 9 mst menunjukkan bahwa perlakuan dengan E65 memiliki kecenderungan
meningkatkan tinggi tanaman padi hampir sama dengan tinggi tanaman padi pada
perlakuan menggunakan akuades steril. Sedangkan dari pengamatan 3 mst hingga
9 mst menunjukkan bahwa perlakuan dengan penyemprotan tembaga sulfat
(kontrol pembanding kimia) dan suspensi II.14 memiliki kecenderungan tinggi
tanaman yang lebih rendah dibandingkan dengan perlakuan kontrol akuades steril.
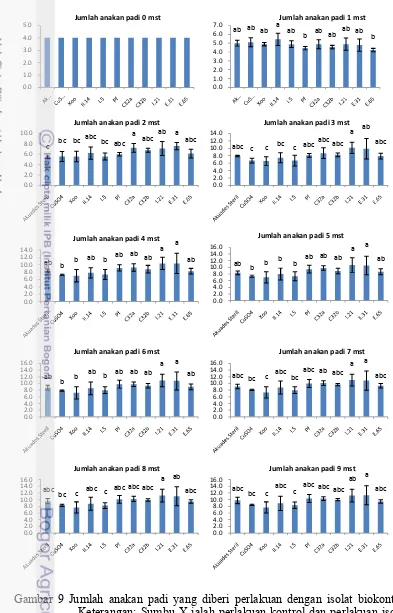
Jumlah Anakan. Saat 1 mst jumlah anakan padi seluruh perlakuan dengan isolat bakteri menunjukkan tidak berbeda dibandingkan perlakuan akuades steril
(Gambar 9). Jumlah anakan yang muncul dengan perlakuan II.14 cenderung lebih
banyak dibandingkan dengan perlakuan isolat-isolat lainnya (Lampiran 5). Jumlah
anakan padi 2 mst pada perlakuan isolat E31, C32a, dan I.21 menunjukkan jumlah
anakan cenderung lebih banyak dari pada perlakuan akuades steril. Penyemprotan
dengan suspensi E31 menunjukkan jumlah anakan cenderung lebih banyak dari
pada perlakuan dengan akuades steril.
Suspensi isolat I.21, E31, C32a, C32b, Pf, E65, II.14, I.5 dan tembaga sulfat
yang disemprotkan pada tanaman padi pada 3 mst menunjukkan jumlah anakan
tidak berbeda dengan perlakuan akuades steril. Namun penyemprotan dengan
suspensi I.21 menunjukkan jumlah anakan sebanyak 10,11 lebih banyak dari pada
jumlah anakan dengan perlakuan akuades steril yaitu 7,89 (Lampiran 5).
Jumlah anakan padi 4, 5, dan 6 mst pada perlakuan isolat I.21, E31, C32a,
Pf, C32b, E65, II.14, I.5 dan tembaga sulfat tidak berbeda dengan perlakuan
akuades steril. Sedangkan pada pengamatan 7,8, dan 9 mst perlakuan I.21, E.31,
C32a, Pf, C32b, E65, II.14, tembaga sulfat, dan I.5 tidak beda dengan perlakuan
akuades steril. Namun dari 7 mst hingga 8 mst hanya perlakuan isolat I.21 yang
menunjukkan jumlah anakan cenderung lebih banyak dari pada perlakuan akuades
menunjukkan jumlah anakan lebih banyak dibandingkan dengan perlakuan
isolat-isolat lainnya.
Gambar 8 Tinggi tanaman padi yang diberi perlakuan dengan isolat biokontrol. Keterangan: Sumbu X ialah perlakuan kontrol dan perlakuan isolat. Sumbu Y ialah tinggi tanaman padi (cm).
Gambar 9 Jumlah anakan padi yang diberi perlakuan dengan isolat biokontrol. Keterangan: Sumbu X ialah perlakuan kontrol dan perlakuan isolat. Sumbu Y ialah jumlah anakan padi.
Jumlah Malai. Pengamatan jumlah malai padi dilakukan saat 9 mst. Perlakuan penyemprotan dengan isolat I.21, C32a, Pf, C32b, dan E31 pada
tanaman padi yang terserang Xoo menunjukkan jumlah malai tidak berbeda
dengan jumlah malai pada perlakuan dengan akuades steril (Gambar 10).
Sedangkan perlakuan dengan isolat II.14, tembaga sulfat, E65, dan I.5
menunjukkan jumlah malai yang cenderung lebih rendah dibandingkan dengan
akuades steril.
Gambar 10 Jumlah malai padi yang terserang Xoo dan diberi perlakuan dengan isolat biokontrol dan panen 9 minggu setelah tanam.
Produksi Gabah. Produksi padi yang terserang Xoo cenderung lebih tinggi pada perlakuan dengan penyemprotan bakteri biokontrol C32a, Pf, C32b, dan I.21
dari pada dengan akuades steril. Penyemprotan dengan isolat C32a menghasilkan
produksi gabah paling tinggi dibandingkan perlakuan yang lain yaitu sebesar
16,44 g untuk bobot basah dan 14,86 g untuk bobot kering gabah (Lampiran 6).
Sedangkan perlakuan dengan isolat I.5, II.14, E31, E65, dan tembaga sulfat
menunjukkan hasil gabah yang lebih rendah dari pada perlakuan dengan akuades
steril.
Gambar 11 Bobot gabah padi yang terserang Xoo dan diberi perlakuan dengan isolat biokontrol panen panen 9 minggu setelah tanam. Keterangan: (■)Bobot Basah, ( ■) Bobot Kering.
Xoo II.14 I.5 Pf C32a C32b I.21 E.31 E.65
Jumlah
Xoo II.14 I.5 Pf C32a C32b I.21 E.31 E.65
Aplikasi dengan isolat-isolat biokontrol tidak mengganggu pertumbuhan
tanaman padi ditinjau dari tinggi tanaman, jumlah anakan, jumlah malai, serta
bobot gabah hingga 9 mst, walaupun tanaman padi sudah terserang Xoo. Namun
demikian untuk mengetahui apakah panjang lesio yang diakibatkan oleh Xoo
berkorelasi terhadap produksi padi pada saat panen maka dilakukan analisis
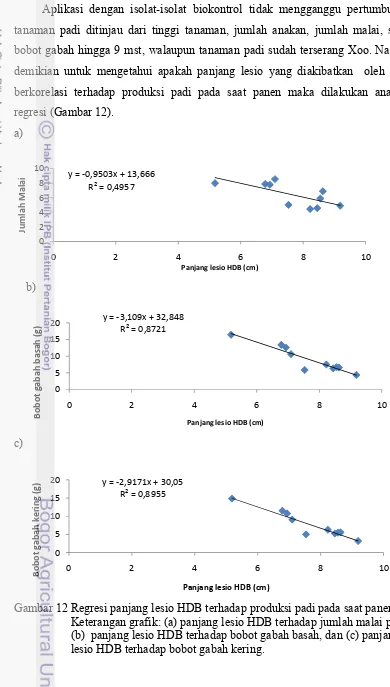
regresi (Gambar 12).
a)
b)
c)
Gambar 12 Regresi panjang lesio HDB terhadap produksi padi pada saat panen. Keterangan grafik: (a) panjang lesio HDB terhadap jumlah malai padi, (b) panjang lesio HDB terhadap bobot gabah basah, dan (c) panjang lesio HDB terhadap bobot gabah kering.
Hasil analisis regresi dengan korelasi sedang memiliki kisaran nilai 0,40 ≤
0,59, korelasi kuat dengan nilai 0,6 ≤ 0,79, dan korelasi sangat kuat dengan nilai
0,80 ≤ 1 (Sugiyono 2006). Hasil analisis korelasi menunjukkan bahwa panjang
lesio HDB pada tanaman padi terhadap jumlah malai berkorelasi sedang dengan
nilai sebesar 0,4957 (Gambar 12a). Namun panjang lesio HDB menunjukkan
korelasi yang kuat terhadap bobot gabah basah yang dihasilkan, hal ini terlihat
pada nilai korelasi yang mencapai 0,8721 (Gambar 12b). Dan panjang lesio HDB
juga menunjukkan korelasi yang kuat terhadap bobot gabah kering yang