HIDROKARBON AROMATIK POLISIKLIK (HAP)
TRI HANDAYANI KURNIATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi berjudul Bakteri Penghasil Biosurfaktan dari Lingkungan Tercemar Limbah Minyak dan Potensinya dalam Mendegradasi Hidrokarbon Aromatik Polisiklik (HAP) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2016
Tri Handayani Kurniati
NIM G361110061
TRI HANDAYANI KURNIATI. Bakteri Penghasil Biosurfaktan dari Lingkungan Tercemar Limbah Minyak dan Potensinya dalam Mendegradasi Hidrokarbon Aromatik Polisiklik (HAP). Dibimbing oleh IMAN RUSMANA, ANI SURYANI, dan NISA RACHMANIA MUBARIK.
Biosurfaktan merupakan senyawa aktif permukaan yang disintesis oleh mikrob. Senyawa ini terdiri dari gugus hidrofilik dan hidrofobik dan memiliki kemampuan untuk menurunkan tegangan permukaan suatu cairan dan tegangan antar muka antara dua fase yang berbeda serta meningkatkan stabilitas emulsi. Biosurfaktan memiliki beberapa keunggulan dibandingkan surfaktan sintetik antara lain, tingkat toksisitas rendah, tidak menimbulkan alergi, kemampuan biodegradasi lebih tinggi, serta memiliki aktivitas yang tinggi pada suhu, pH dan salinitas yang ekstrim. Selain itu biosurfaktan dapat disintesis dari bahan baku terbarukan.
Aplikasi biosurfaktan mencakup banyak bidang termasuk bioremediasi lingkungan yang tercemar minyak, pengeboran minyak mentah, enhanced oil recovery (EOR), produk perawatan kesehatan maupun industri makanan. Peran utama biosurfaktan dalam bioremediasi adalah sebagai pemicu bioavailabilitas polutan sehingga dapat digunakan oleh mikrob yang terlibat dalam proses biodegradasi.
Pencemaran minyak di lingkungan telah menjadi ancaman bagi ekosistem dan manusia melalui masuknya bahan organik beracun termasuk hidrokarbon aromatik polisiklik (HAP) ke lingkungan. HAP adalah molekul organik yang terdiri dari dua atau lebih cincin aromatik yang menyatu dalam berbagai konfigurasi struktural. Kontaminasi HAP di lingkungan menjadi perhatian lebih karena senyawa ini merupakan kontaminan yang dapat tersebar luas dan bersifat sangat beracun, mutagenik dan karsinogenik.
Banyak bakteri dapat menghasilkan biosurfaktan yang memungkinkan mereka untuk mendegradasi atau mengubah senyawa organik yang tidak larut seperti halnya produk minyak bumi. Oleh karena itu, daerah yang tercemar minyak bumi dan limbah industri berpotensi sebagai sumber bakteri penghasil biosurfaktan dan pendegradasi hidrokarbon.
Penelitian ini bertujuan untuk mendapatkan isolat bakteri indigenous penghasil biosurfaktan dan pendegradasi hidrokarbon dari lingkungan tercemar limbah minyak di teluk Jakarta. Selain itu penelitian ini juga bertujuan mendeteksi gen dioksigenase yang bertanggungjawab dalam proses degradasi serta mengkaji aktifitas biosurfaktan yang dihasilkan melalui pengukuran tegangan permukaan dan kemampuan emulsifikasi.
Hasil uji pertumbuhan dan degradasi HAP menunjukkan tiga isolat bakteri yaitu Bacillus pumilus (CHN 27), Ochrobactrum intermedium (AMA 9), dan Gordonia cholesterolivorans (AMP 10) berturut-turut memiliki kemampuan mendegradasi naftalena, antrasena dan pirena. Penelitian ini melaporkan pemanfaatan pirena oleh bakteri G. cholesterolivorans untuk pertama kalinya. Analisis parameter pertumbuhan menunjukkan bahwa G. cholesterolivorans AMP 10 memiliki pertumbuhan terbaik pada konsentrasi pirena 50 mg/L dengan persentase degradasi 96,6% dalam waktu tujuh hari. Hasil analisis nested PCR mengungkapkan bahwa isolat ini memiliki gen nahAc yang mengkode enzim dioksigenase untuk degradasi awal HAP. Hasil pengamatan terhadap tegangan permukaan dan indeks emulsifikasi menunjukkan biosurfaktan yang dihasilkan oleh AMP 10 ketika ditumbuhkan pada substrat glukosa dapat menurunkan tegangan permukaan medium dari 71,3 mN / m menjadi 24,7 mN / m dan mampu membentuk emulsi yang stabil dalam minyak pelumas bekas dengan nilai indeks emulsifikasi sebesar 74%. Berdasarkan hasil penelitian dapat diusulkan bahwa bakteri G. cholesterolivorans AMP10 merupakan kandidat yang baik untuk bioremediasi lingkungan yang terkontaminasi HAP.
TRI HANDAYANI KURNIATI. Biosurfactant Producing Bacteria from Oil Contaminated Environment and Its Potential in Polycyclic Aromatic Hydrocarbons (PAH) Degradation. Supervised by IMAN RUSMANA, ANI SURYANI, dan NISA RACHMANIA MUBARIK.
Biosurfactants are surface active compound made up of a hydrophilic and a hydrophobic moiety synthesized by microorganisms. These compounds have ability to reduce surface and interfacial tension of liquids between two different phases and also to increase emulsion stability. Biosurfactants have several advantages compare with chemically synthesized surfactant such as less toxic, higher biodegradability, high activity at extreme temperature, pH and salinity and the ability to be synthesized from renewable feedstock.
Application of biosurfactants covers many environmental sectors including bioremediation of oil polluted environment, crude oil drilling, enhanced oil recovery (EOR), lubricant, health personal care and food processing. In bioremediation applications biosurfactants play main role in promoting the bioavailability of the pollutants to the microorganisms involved in biodegradation process.
Oil spillage and oil pollution in the environment have been a threat to the ecosystem and human being through the transfer of toxic organic materials including polycyclic aromatic hydrocarbon (PAH). PAH are organic molecules composed of two or more aromatic (benzene) rings which are fused together in various structural configurations. PAHs contamination is a severe environmental concern since this compounds are the ubiquitous persistent contaminant that highly toxic, mutagenic and carcinogenic.
Many bacterial type can produce biosurfactants which allow them to degrade or transform the insoluble organic compounds such as petroleum products. Therefore, petroleum hydrocarbon and industrial oils contaminated area was a potential source to obtain biosurfactant-producing and hydrocarbon degrading bacteria.
The objectives of this research were to obtain indigenous biosurfactant-producing and PAH-degrading bacteria from oil contaminated soil in Jakarta bay. In addition, this study also aimed at detecting dioxygenase genes responsible for the degradation process and review the activities of biosurfactant produced by measuring the surface tension and emulsification ability.
G. cholesterolivorans (AMP 10) have the ability to degrade naphthalene, anthracene and pyrene, respectively. This study reported the utilisation of pyrene by G. cholesterolivorans for the first time. Analysis of microbial growth parameters showed that the novel strain of G. cholesterolivorans AMP 10 grew best at 50 µg mL−1 pyrene concentration, leading to 96.6 % degradation of pyrene within 7 days. The result of nested PCR analysis revealed that this isolate possessed the nahAc gene which encodes dioxygenase enzyme for initial degradation of PAH. Observation of both surface tension and emulsifying activities indicated that biosurfactants which produced by AMP 10 when grown on glucose could reduce the surface tension of medium from 71.3 mN/m to 24.7 mN/m and formed a stable emulsion in used lubricant with an emulsifying index (E24) of 74%. According to the results, it is suggested that the bacterial isolates G. cholesterolivorans AMP10 was a good candidate for bioremediation of PAH-contaminated environment.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Mikrobiologi
TRI HANDAYANI KURNIATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2016
Penguji Luar Komisi pada Ujian Tertutup:
Prof. Dr. Djumali Mangunwidjaja, DEA Dr. Wibowo Mangunwardoyo, MSc.
Penguji Luar Komisi pada Sidang Promosi:
Hidrokarbon Aromatik Polisiklik (HAP) Nama : Tri Handayani Kurniati
NIM : G361110061
Disetujui oleh Komisi Pembimbing
Dr Ir Iman Rusmana, MSi Ketua
Prof Dr Ir Ani Suryani, DEA Anggota
Dr Nisa Rachmania Mubarik, MSi Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi
Prof Dr rer nat Anja Meryandini, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Alhamdulillahhirobbil’alamiin, puji dan syukur penulis panjatkan kepada Allah SWT atas rahmat dan karunia-Nya sehingga disertasi dengan judul Bakteri Penghasil Biosurfaktan dari Lingkungan Tercemar Limbah Minyak dan Potensinya dalam Mendegradasi Hidrokarbon Aromatik Polisiklik (HAP) ini dapat diselesaikan. Disertasi ini disusun berdasarkan hasil penelitian penulis sejak pertengahan tahun 2013 hingga pertengahan tahun 2015 dengan harapan dapat memberikan kontribusi di bidang lingkungan khususnya pemanfaatan bakteri dalam pengelolaan limbah minyak.
Penghargaan yang tinggi dan ucapan terima kasih penulis sampaikan kepada Dr. Ir. Iman Rusmana, MSi. selaku Ketua Komisi Pembimbing beserta Prof. Dr. Ir. Ani Suryani, DEA, dan Dr. Nisa Rachmania Mubarik, MSi. selaku Anggota Komisi Pembimbing, yang telah memberikan bimbingan, arahan dan saran semenjak penyusunan proposal hingga terselesaikannya disertasi ini. Terima kasih pula kepada Prof. Dr. Djumali Mangunwidjaya, DEA dan Dr. Wibowo Mangunwardoyo, MSc. selaku penguji luar komisi pada ujian tertutup dan sidang promosi yang telah memberikan banyak masukan dan saran untuk perbaikan penulisan disertasi ini.
Penulis juga menyampaikan terima kasih kepada Rektor Universitas Negeri Jakarta yang telah memberikan ijin kepada penulis untuk menempuh pendidikan S3, kepada Kementerian Riset Teknologi dan Pendidikan Tinggi yang telah memberikan beasiswa program S3 serta kepada Fakultas MIPA UNJ yang telah memberikan dana penelitian BLU 2013 dan 2015. Terima kasih pula kepada Ketua Program Studi Biologi dan Program Studi Pendidikan Biologi Universitas Negeri Jakarta yang telah memberikan ijin penggunaan Laboratorium Mikrobiologi dan Ekologi.
Terima kasih penulis sampaikan untuk teman-teman MIK 2011, Susan Soka, Marini Wijayanti, Ifah Munifah dan Roni Ridwan, atas persahabatan, bantuan dan dukungan selama studi. Penulis juga menyampaikan terima kasih kepada Dra. Muzajjanah MKes, Dra.Yoswita Rustam, MSi, Dr. Dalia Sukmawati, MSi, Irfan Suwondo, Nurlaila Khairunnisa, Neni Inayah dan tim peneliti di laboratorium Mikrobiologi, serta semua pihak yang tidak dapat disebutkan satu persatu atas bantuan dan kerjasama yang diberikan. Terima kasih juga penulis sampaikan kepada Dr. Mieke Miarsyah, MSi, Dr. Reni Indrayanti, MSi, dan M. Isnin Noer SSi, MSi atas semua bantuan dan dukungan yang diberikan serta kepada laboran Biologi, ibu Deselina yang selalu siap membantu kegiatan penelitian.
Ucapan terima kasih dan penghargaan yang tinggi penulis tujukan kepada suami tercinta Edy Yanto dan kedua putri kami Nisrina Rizka Auliani dan Fakhira Rahmadiani atas doa, cinta, pengertian dan dukungannya sehingga penulis dapat menjalani masa-masa sulit selama studi. Doa dan terima kasih tiada terhingga penulis sampaikan kepada almarhumah ibunda Hj Suwarti dan almarhum ayahanda S. Oemari yang telah membesarkan, membimbing dan meletakkan dasar pemahaman akan pentingnya pendidikan sehingga penulis sampai ke tahap saat ini.
Penulis mengharapkan semoga hasil penelitian dan disertasi ini dapat memberikan kontribusi bagi ilmu pengetahuan dan bermanfaat baik bagi penulis maupun masyarakat pada umumnya.
DAFTAR TABEL xi
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xiii
PENDAHULUAN 1
Latar Belakang 1
Hipotesis Penelitian 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Kebaruan Penelitian 3
TINJAUAN PUSTAKA 4
Biosurfaktan 4
Bakteri Penghasil Biosurfaktan 6
Hidrokarbon aromatik polisiklik (HAP) 7
Bakteri Pendegradasi HAP 8
Biosurfaktan dan Biodegradasi HAP 9
METODE 11
Pengambilan Sampel 12
Kultur Pengayaan dan Isolasi Bakteri 12
Penapisan Bakteri Penghasil Biosurfaktan 13
Uji Kemampuan Tumbuh Bakteri pada Medium Hidrokarbon 13
Pengukuran Aktivitas Emulsifikasi 14
Pengamatan Morfologi Sel dan Tipe Gram 14
Isolasi DNA dan Analisis Gen 16S rRNA 14
Pertumbuhan Bakteri dan Degradasi HAP 15
Deteksi Gen Pengkode Enzim Dioksigenase 15
Pengukuran Tegangan Permukaan 16
HASIL DAN PEMBAHASAN
Hasil 17
Pembahasan 29
SIMPULAN DAN SARAN
Simpulan 45
Saran 45
DAFTAR PUSTAKA 46
LAMPIRAN 54
1 Primer spesifik yang digunakan untuk mendeteksi gen penyandi enzim dioksigenase
15 2 Jumlah isolat bakteri yang diperoleh dari setiap lokasi pengambilan
sampel
17 3 Hasil pengukuran aktivitas hemolitik, drop collapse test dan oil
spreading assay
18 4 Karakteristik degradasi minyak mentah oleh isolat bakteri penghasil
biosurfaktan asal teluk Jakarta
20
5 Hasil uji verifikasi pertumbuhan bakteri dalam MSM+HAP 21 6 Hasil identifikasi bakteri penghasil biosurfaktan berdasarkan sekuen
16 rRNA
22 7 Nilai indeks stabilitas emulsi (E24) yang dihasilkan oleh isolat
bakteri penghasil biosurfaktan
24 8 Laju pertumbuhan spesifik () dan waktu generasi (g) ketiga jenis
bakteri
27 9 Kecepatan degradasi HAP oleh isolat bakteri penghasil biosurfaktan
dan pendegradasi hidrokarbon
27 10 Hasil analisis sekuen gen penyandi enzim dioksigenase dari bakteri
pendegradasi HAP
28 11 Nilai tegangan permukaan dan indeks emulsifikasi (E24) yang
dihasilkan isolat bakteri pada tiga sumber karbon yang berbeda
1 Struktur umum beberapa biosurfaktan glikolipid 4 2 Struktur fisik dan kimia beberapa jenis senyawa HAP 7
3 Diagram alir penelitian 11
4 Peta lokasi pengambilan sampel di kawasan Teluk Jakarta 12 5 Hasil uji penapisan bakteri penghasil biosurfaktan 19 6 Visualisasi produk PCR gen 16S rRNA dari 7 isolat bakteri 22 7 Konstruksi pohon filogenetik berdasarkan sekuen 16 S rRNA dari 10
isolat bakteri menggunakan analisis Neighbor-Joining dengan metode Maximum-Likelihood dan analisis Bootstrap 1000x replikasi.
23 8 Pertumbuhan bakteri Bacillus pumilus CHN27 pada MSM cair dengan
konsentrasi naftalena 50 dan 100 mg/L
25 9 Persentase degradasi naftalena oleh Bacillus pumilus CHN27 pada
konsentrasi 50 dan 100 mg/L
25 10 Pertumbuhan bakteri Ochrobactrum intermedium AMA 9 pada MSM
cair dengan konsentrasi antrasena 50 dan 100 mg/L
26 11 Persentase degradasi antrasena oleh Ochrobactrum intermedium AMA
9 pada konsentrasi 50 dan 100 mg/L
26 12 Pertumbuhan bakteri Gordonia cholesterolivorans AMP 10 pada MSM
cair dengan konsentrasi naftalena 50 dan 100 mg/L
26 13 Pertumbuhan bakteri Gordonia cholesterolivorans AMP 10 pada MSM
cair dengan konsentrasi naftalena 50 dan 100 mg/L
27 14 Hasil elektroforesis produk PCR gen dioksigenase 28 15 Efek ramnolipid yang dihasilkan oleh bakteri Pseudomonas spp
terhadap pembentukan misel dan pengambilan senyawa hidrokarbon pada minyak
32
1 Hasil pengujian degradasi HAP terhadap isolat bakteri penghasil biosurfaktan
53 2 Kromatogram GC-MS dari isolat CHN 27 menunjukkan penurunan peak
area naftalena setelah 5 hari inkubasi.
55 3 Kromatogram GC-MS dari isolat AMA 9 menunjukkan penurunan peak
area antrasena setelah 7 hari inkubasi
56 4 Kromatogram GC-MS dari isolat Gordonia cholesterolvorans AMP 10
menunjukkan penurunan peak area pirena setelah 7 hari inkubasi
58 5 Kromatogram GC-MS dari isolat Gordonia cholesterolvorans AMP 10
menunjukkan penurunan peak area pirena setelah 7 hari inkubasi
PENDAHULUAN
Latar Belakang
Salah satu masalah lingkungan yang utama saat ini adalah kontaminasi hidrokarbon yang dapat berasal dari proses alami dan antropogenik. Meskipun proses alami dapat berkontribusi dalam masuknya hidrokarbon ke lingkungan, aktivitas manusia seperti dalam industri minyak dan produk minyak bumi merupakan penyebab utama pencemaran air dan tanah. Minyak bumi merupakan campuran cairan yang terdiri hidrokarbon kompleks (Das dan Chandran 2011; Jahangeer dan Kumar 2013). Tumpahan dan pencemaran minyak di lingkungan telah menjadi ancaman bagi ekosistem dan manusia melalui paparan bahan organik beracun termasuk hidrokarbon aromatik polisiklik (HAP).
HAP adalah molekul organik yang terdiri atas dua atau lebih cincin aromatik (benzene) yang menyatu bersama-sama dalam berbagai konfigurasi struktural. Kontaminasi HAP merupakan masalah lingkungan yang serius karena senyawa ini bersifat sangat beracun, mutagenik dan karsinogenik. Masuknya senyawa HAP dari berbagai sumber seperti kebakaran hutan, gunung meletus, tumpahan minyak, lalu lintas kapal, pembakaran bahan bakar fosil, limpasan gas dan tar batubara, pengolahan kayu, bahan bakar kendaraan, serta limbah industri telah menyebabkan akumulasi signifikan dari HAP di lingkungan (Luan et al. 2006; Fernandez-Luqueno et al. 2011).
Teluk Jakarta yang terletak di sebelah utara kota Jakarta, merupakan perairan dangkal dengan luas sekitar 514 km2. Di teluk ini bermuara 13 sungai yang melintasi kota Jakarta. Perkembangan kota Jakarta yang pesat menyebabkan teluk Jakarta tercemar berat sebagai akibat dari aktivitas manusia. Menurut data dari Badan Pengendalian Dampak Lingkungan, dalam 10 tahun terakhir Teluk Jakarta telah mengalami pencemaran yang melebihi ambang batas. Setidaknya 83% dari 13 sungai yang bermuara ke Teluk Jakarta telah masuk dalam kategori tercemar berat. Sungai-sungai tersebut membawa berbagai macam jenis limbah yang bersifat toksik ke perairan teluk Jakarta, diantaranya adalah senyawa organik HAP (Ahmad 2012).
Biosurfaktan yang diproduksi oleh mikrob telah menjadi produk bioteknologi penting yang diaplikasikan secara luas di bidang industri dan medis. Senyawa ini digunakan sebagai agen pengemulsi dan agen pembasah dalam industri logam, kertas, tekstil maupun industri pertanian. Biosurfaktan juga berperan sebagai agen pengemulsi dan bahan tambahan dalam industri pangan. Selain itu biosurfaktan diaplikasikan sebagai detergen untuk industri minyak bumi, agen antimikrob untuk industri farmasi dan kesehatan serta sebagai agen pengemulsi yang dapat mempercepat proses degradasi dalam proses bioremediasi senyawa toksik di lingkungan (Singh 2012). Biosurfaktan yang dihasilkan oleh bakteri laut B. circulans merupakan contoh bakteri yang memiliki aktivitas anti mikrob terhadap bakteri pathogen Gram + dan Gram – (Rahman dan Gakpe 2008).
Sejumlah besar mikrob telah dilaporkan dapat menggunakan HAP dengan dua dan tiga cincin seperti naftalena dan antrasena sebagai satu-satunya sumber karbon dan energi (Kumar et al. 2006). Genus Pseudomonas, Mycobacterium, Corynebacterium, Aeromonas, Rhodococcus, dan Bacillus diketahui mampu mendegradasi naftalena yang memiliki dua cincin aromatik, sementara hidrokarbon antrasena dengan tiga cincin dikemukakan dapat didegradasi oleh genus bakteri Pseudomonas, Sphingomonas, Nocardia, Beijerinckia, Rhodococcus dan Mycobacterium (Mrozik et al. 2003).
Penggunaan biosurfaktan untuk meningkatkan kecepatan degradasi HAP telah dilaporkan oleh beberapa peneliti. Rhamnolipid yang dihasilkan oleh bakteri Pseudomonas aeruginosa W3 dapat meningkatkan kelarutan antrasena sehingga mempercepat proses degradasi oleh dua galur bakteri, Sphingomonas sp. 12A dan Pseudomonas sp. 12B. Antrasena merupakan jenis HAP yang tidak mudah di degradasi, selain itu mekanisme degradasi antrasena masih belum diketahui dengan jelas. Biosurfaktan trehalolipid dari bakteri Rhodococcus erythropolis diketahui mampu meningkatkan laju degradasi fenantrena oleh isolat bakteri P5-2, sedangkan biosurfaktan yang dihasilkan Bacillus cereus 28BN mampu meningkatkan kecepatan degradasi naftalena oleh bakteri itu sendiri (Cameotra dan Makkar 2010)
Produksi biosurfaktan secara langsung di lingkungan oleh bakteri pendegradasi hidrokarbon dimungkinkan lebih bermanfaat, lebih menjanjikan dan lebih praktis dibandingkan dengan menambahkan biosurfaktan murni untuk aplikasi bioremediasi berdasarkan bioaugmentasi. Bakteri pendegradasi hidrokarbon yang memiliki kemampuan untuk menghasilkan biosurfaktan ekstraseluler dapat mempercepat proses biodegradasi dengan memfasilitasi kontak antara minyak dengan mikrob (Kumar et al. 2006). Upaya eksplorasi isolat bakteri indigenous dari teluk Jakarta yang mampu menghasilkan biosurfaktan dan juga berperan dalam degradasi hidrokarbon oleh karenanya akan memberikan kontribusi terhadap penanganan pencemaran khususnya yang disebabkan oleh senyawa HAP.
Hipotesis
Bakteri tertentu mampu mendegradasi dan menggunakan senyawa HAP sebagai sumber karbon dan energi, akan tetapi tingkat kelarutan minyak yang rendah menjadi kendala dalam proses degradasi. Produksi biosurfaktan oleh bakteri merupakan upaya bakteri untuk meningkatkan kelarutan dan ketersediaan sumber karbon dari substrat hidrofobik seperti halnya minyak bumi. Bakteri penghasil biosurfaktan yang memiliki kemampuan mendegradasi senyawa HAP oleh karenanya dapat diperoleh dari lingkungan yang tercemar limbah minyak.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan isolat bakteri indigenous yang mampu menghasilkan biosurfaktan dan mendegradasi senyawa HAP (naftalena, antrasena dan pirena). Tujuan lain penelitian ini adalah mendeteksi gen penyandi enzim yang berperan dalam degradasi HAP serta mengkaji aktivitas biosurfaktan yang dihasilkan melalui pengukuran tegangan permukaan dan kemampuan emulsifikasi.
Manfaat Penelitian
Penggunaan bakteri dengan kemampuan menghasilkan biosurfaktan dan mendegradasi hidrokarbon diharapkan dapat lebih mempercepat proses degradasi dan penghilangan polutan hidrokarbon. Isolat bakteri yang diperoleh dalam penelitian ini dapat dimanfaatkan dalam proses bioremediasi khususnya sebagai pendegradasi senyawa HAP sebagai upaya mengatasi pencemaran di lingkungan. Selain itu hasil penelitian diharapkan dapat memperkaya informasi tentang keragaman bakteri indigenous yang diperoleh dari kawasan teluk Jakarta.
Kebaruan Penelitian
TINJAUAN PUSTAKA
Biosurfaktan
Biosurfaktan merupakan molekul aktif permukaan yang dihasilkan oleh banyak galur mikrob baik dari kelompok bakteri maupun cendawan ketika tumbuh dalam medium yang mengandung substrat tak larut air. Adanya gugus hidrofilik dan hidrofobik menyebabkan molekul ini dapat menurunkan tegangan permukaan suatu cairan, tegangan antarmuka dua cairan, atau antara cairan dan padatan. Biosurfaktan memiliki sifat kimia dan ukuran molekul yang bervariasi. Molekul ini dapat berada pada permukaan sel mikrob ataupun disekresikan dalam medium (Desai dan Banat 1997; Mukherjee et al. 2006; Singh 2012). Biosurfaktan dapat menurunkan tegangan permukaan air dari 72mN/m hingga berkisar antara 25 dan 38 mN/m. Surfactin, biosurfaktan yang dihasilkan oleh Bacillus subtilis mampu menurunkan tegangan permukaan air hingga 27mN/m (Desai dan Banat 1997).
Pengelompokan biosurfaktan terutama didasarkan pada komposisi kimia dan mikrob penghasilnya. Secara umum, gugus hidrofilik terdiri atas asam amino atau peptida dan gugus hidrofobik mengandung lemak jenuh, tak jenuh atau asam lemak. Kelompok utama biosurfaktan terdiri atas glikolipid, lipopeptida dan lipoprotein, fosfolipid dan asam lemak, surfaktan polimer, dan surfaktan partikulat (Desai dan Banat 1997; Singh 2012). Rhamnolipid, biosurfaktan dari kelompok glikolipid merupakan jenis yang paling banyak dipelajari dan dikarakterisasi (Desai dan Banat 1997; Muthusamy et al. 2008). Glikolipid mengandung karbohidrat seperti soforosa, trehalosa atau rhamnosa yang tergabung ke asam alifatik rantai panjang atau lipopeptida (Ron dan Rosenberg 2001) (Gambar 1).
Jenis, kualitas dan kuantitas biosurfaktan yang dihasilkan dipengaruhi oleh sifat substrat karbon, konsentrasi nitrogen, fosfor, magnesium, besi, dan ion mangan dalam media dan kondisi kultur, seperti pH, suhu dan agitasi (Guerra-Santos et al. 1986). Arthrobacter paraffineus menghasilkan biosurfaktan ketika ditumbuhkan pada media dengan sumber karbon glukosa, tetapi tidak disintesis ketika digunakan heksadekana sebagai sumber karbon (Reddy et al. 1983). Produksi rhamnolipid dari Pseudomonas aeruginosa PA1 memberikan hasil tertinggi pada substrat gliserol dibandingkan dengan substrat n-heksadekana maupun paraffin (Santa-Anna et al. 2002). Sementara itu, bakteri Aeromonas spp yang diperoleh dari perairan mampu menghasilkan biosurfaktan tertinggi pada media dengan sumber karbon glukosa dan terendah pada media solar asetat. Kedelai diketahui sebagai sumber nitrogen terbaik untuk produksi biosurfaktan (Ilori et al. 2005).
Biosurfaktan merupakan salah satu dari berbagai cara adaptasi mikrob untuk memetabolisme hidrokarbon dan secara umum merupakan respon fisiologis terhadap kebutuhan tertentu yang dihadapi oleh sel pada lingkungan tertentu. Beberapa bakteri mampu mengembangkan pseudosolubilization, yaitu suatu strategi untuk mendapatkan akses ke substrat yang sulit larut dan oleh karenanya menghasilkan biosurfaktan dengan berat molekul rendah. Bakteri lain berinteraksi dengan hidrokarbon secara langsung melalui biosurfaktan yang terikat pada dinding sel sehingga menyebabkan permukaan sel menjadi sesuai dengan substrat hidrofobik (Perfumo et al. 2010). Fungsi utama biosurfaktan dalam sel mikrob adalah mengemulsi substrat tidak larut air seperti hidrokarbon dan memfasilitasi transportasi ke dalam sel agar dapat digunakan sebagai sumber karbon untuk memicu pertumbuhan (Singh 2012). Bagi sebagian bakteri yang lain, biosurfaktan juga dapat memiliki aktivitas antimikrob (Ron and Rosenberg 2001). B. subtilis, B. cereus, B. pumilus, B. brevis, dan B. licheniformis dilaporkan mampu menghasilkan senyawa antimikrob (Rodrigues et al. 2006)
Biosurfaktan lebih menjanjikan dalam aplikasinya dibandingkan surfaktan yang disintesis secara kimiawi. Hal ini disebabkan biosurfaktan memiliki sifat toksisitas yang lebih rendah, biodegradabilitas yang lebih tinggi, lebih kompatibel terhadap lingkungan, serta lebih stabil terhadap perubahan faktor lingkungan seperti pH, salinitas dan suhu. Biosurfaktan juga diketahui memiliki beberapa sifat yang terkait dengan kepentingan terapi dan biomedis seperti sifat antibakteri, antijamur dan antivirus, mampu menghambat pembentukan gumpalan fibrin, serta memiliki sifat anti pelekatan terhadap beberapa mikrob patogen. Selain itu, molekul ini dapat dihasilkan dari bahan baku berbasis pertanian yang lebih murah ataupun menggunakan limbah (Mukherjee et al. 2006; Araji et al. 2007; Fakruddin 2012).
Bakteri Penghasil Biosurfaktan
Pengambilan sampel dan isolasi merupakan dasar untuk seleksi mikrob penghasil biosurfaktan. Lingkungan yang terkontaminasi senyawa organik hidrofobik merupakan lokasi yang paling menjanjikan untuk isolasi mikrob penghasil biosurfaktan (Walter et al. 2010; Jaysree et al. 2011). Mikrob penghasil biosurfaktan telah berhasil diisolasi dari lingkungan yang terkontaminasi minyak (Willumsen dan Karlson 1997; Rahman et al. 2002; Santa-Anna et al. 2005; Nisanthi et al. 2010; Liu et al. 2011), danau buatan yang terkontaminasi limbah minyak (Jaysree et al. 2011) sumur aspal di La Brea, Los Angeles (Belcher et al. 2012), limbah pabrik minyak (Gujar and Hamde 2011), tanah di sekitar bengkel mobil (Shoeb et al. 2012) maupun tangki bahan bakar pesawat (Muriel et al. 1996). Konsorsium bakteri penghasil biosurfaktan juga telah diisolasi dari tanah terkontaminasi hidrokarbon di daerah Cepu, Jawa Tengah, Indonesia (Sumiardi et al. 2012).
Meskipun lebih banyak ditemukan di lingkungan terkontaminasi, bakteri penghasil biosurfaktan juga dilaporkan diperoleh dari lingkungan yang tidak terkontaminasi hidrokarbon. Hasil penelitian memperlihatkan galur bakteri dapat diisolasi dari tanah tidak terkontaminasi yang kaya bahan organik (Jennings dan Tanner 2000), dari perairan (Ilori et al. 2005) serta dari limbah pabrik susu (Gudina et al. 2011).
Biosurfaktan yang diproduksi oleh berbagai mikrob terutama bakteri, jamur dan ragi, beragam dalam komposisi kimia dan sifatnya. Jumlah yang dihasilkan juga bergantung pada jenis mikrob penghasilnya. Banyak mikrob penghasil biosurfaktan yang digunakan dalam pengolahan limbah industri berasal dari tanah yang terkontaminasi limbah dan sumber air limbah. Dengan demikian, mikrob ini memiliki kemampuan untuk tumbuh pada substrat yang dianggap berpotensi bahaya bagi mikrob yang tidak menghasilkan biosurfaktan (Saharan et al. 2011). B. subtilis dan P. aeruginosa diketahui mampu menggunakan minyak mentah dan hidrokarbon sebagai sumber karbon tunggal untuk menghasilkan biosurfaktan dan dapat digunakan untuk membersihkan tumpahan minyak di lingkungan (Das dan Mukherjee 2006).
adalah trehalosa dimikolat yang diproduksi oleh Rhodococcus erythropolis. Trehalolipid yang dihasilkan oleh mikrob berbeda dalam struktur, ukuran dan derajat kejenuhan. Nilai minimal untuk tegangan antar muka air terhadap n-heksadekana yang dicapai oleh trehalolipids berkisar antara 1 dan 17 mN/m, sedangkan penurunan tegangan permukaan oleh lipid trehalosa yang dihasilkan oleh R. erythropolis dan Arthrobacter sp. mencapai 25 dan 40 mN/m. Sementara itu, nilai CMC trehalolipids cukup rendah, sekitar 2 mgL-1 (Desai dan Banat 1997; Rondan Rosenberg 2001).
Bakteri dari genus Lactobacillus juga diketahui mampu menghasilkan biosurfaktan meskipun jumlahnya lebih rendah bila dibandingkan dengan mikrob lainnya, seperti Bacillus subtilis ataupun Pseudomonas aeruginosa. Namun demikian, L. paracasei ssp. paracasei A20 yang diisolasi dari pabrik susu, merupakan penghasil biosurfaktan yang menjanjikan (Gudina et al. 2011).
Meskipun peran biosurfaktan dalam sel mikrob belum sepenuhnya dipahami, akan tetapi telah diketahui bahwa metabolit sekunder ini dapat meningkatkan transportasi nutrisi melintasi membran, berperan dalam berbagai interaksi mikrob dan inang, serta memberikan perlindungan bakterisidal dan fungisidal terhadap organisme penghasil (Jennings dan Tanner 2000).
Hidrokarbon Aromatik Polisiklik (HAP)
Kelompok polutan yang banyak menjadi perhatian para ahli lingkungan adalah HAP. Polutan ini menjadi penting karena terdistribusi secara luas di lingkungan dan menimbulkan efek mengganggu kesehatan (Makkar dan Rockne 2003). HAP merupakan kelompok berbagai senyawa organik yang mengandung dua atau lebih cincin aromatik yang tergabung pada atom karbon dan hidrogen. Senyawa ini kebanyakan sebagai polutan di berbagai lingkungan dan menjadi perhatian lingkungan karena efeknya yang bersifat mutagenik dan atau karsinogenik (Kumar et al. 2006).
HAP banyak terdapat di alam dan berasal dari dua sumber utama, yaitu berasal dari proses alami (biogenik dan geokimia) dan aktivitas manusia. Secara alami HAP terdapat dalam bahan bakar fosil seperti batu bara dan minyak bumi, akan tetapi juga dapat terbentuk selama pembakaran yang tidak sempurna dari bahan organik seperti batu bara, diesel, maupun kayu. Proses alam juga dapat menjadi sumber HAP di lingkungan, seperti letusan gunung berapi dan kebakaran hutan. Aktivitas manusia seperti pembakaran bahan organik, tumHAPan minyak dan solar, pencairan batubara, maupun asap tembakau dan pembakaran bahan makanan menjadi sumber utama polusi HAP (Bamforth dan Singleton, 2005; Kumar et al. 2006)
Gambar 2 Struktur fisik dan kimia beberapa jenis senyawa HAP (Bamforth dan Singleton 2005)
Bakteri Pendegradasi HAP
Lingkungan yang terkontaminasi minyak pada umumnya mengandung campuran hidrokarbon kompleks, termasuk HAP yang mempunyai berat molekul rendah dan HAP yang mempunyai berat molekul tinggi (Guo et al. 2010). Beberapa dekade terakhir, penelitian lebih banyak diarahkan ke proses degradasi HAP dengan berat molekul tinggi yaitu yang memiliki tiga cincin atau lebih (Kanaly dan Harayama 2000).
Bakteri pendegradasi hidrokarbon telah ditemukan di perairan Indonesia, terutama pada lingkungan yang tercemar limbah minyak bumi. Bakteri pendegradasi hidrokarbon yang diperoleh dari laut Dumai diketahui memiliki kesamaan dengan bakteri Providencia vermicola, Burkholderia cepacia, dan Myroides (Nursyirwani dan Amolle 2007). Selain itu, dari rizosfer mangrove yang tumbuh pada tanah terkontaminasi minyak bumi di daerah Sungsang Sumatera Selatan ditemukan 9 isolat bakteri pendegradasi hidrokarbon yang mampu tumbuh pada medium yang mengandung minyak bumi secara in vitro. Dua isolat terbaik dalam mendegradasi senyawa hidrokarbon minyak bumi adalah Pseudomonas alcaligenes dan Alcaligenes facealis (Gofar 2012).
juga telah diketahui mampu mendegradasi senyawa HAP. Sebagian besar isolat tersebut berasal dari genus Sphingomonas, Mycobacterium, Rhodococcus, Paracoccus dan Pseudomonas. Hasil penelitian juga memperlihatkan Semua galur Mycobacterium yang berhasil diisolasi dapat mendegradasi campuran HAP yang terdiri atas fenantrena, fluorantena, dan pirena dalam waktu 14 hari (Guo et al. 2010).
Degradasi HAP sebagian besar dilakukan oleh enzim dioksigenase yang dihasilkan oleh kultur bakteri pendegradasi HAP pada kondisi aerobik. Sejumlah gen penyandi dioxygenase yang berperan dalam degradasi HAP, terutama HAP dengan berat molekul rendah (low molecular weight HAP), telah diketahui. Gen ini tampaknya khas untuk kelompok bakteri dan jenis substrat tertentu, seperti gen nah untuk degradasi naftalena oleh Pseudomonas, gen phn untuk degradasi fenantrena oleh bakteri Burkholderia cepacia RP007, gen nag untuk degradasi naftalen oleh Ralstonia sp. U2 dan Polaromonas naphthalenivorans CJ2, gen bph untuk degradasi naftalena dan fenantrena oleh bakteri Novosphingobium aromaticivoran F199 dan Sphingobium yanoikuyae B1 dan P2, serta gen arh untuk degradasi asenaftena dan asenaftilena oleh Sphingomonas sp. A4. Selain itu, gen nid pada Mycobacterium spp. telah diidentifikasi sebagai penyebab degradasi pirena (Klankeo et al. 2009).
Hasil penelitian Guo et al. (2010) menunjukkan bahwa aktivitas enzim dioksigenase terdeteksi pada tiga belas isolat bakteri Gram positif dan dan empat galur bakteri gram negatif pendegradasi HAP. Namun, gen nahAc dan phnAc tidak terdeteksi di semua galur Sphingomonas yang terisolasi. Hal ini dapat dijelaskan karena kedua gen ini diketahui berasal dari genus Pseudomonas dan Burkholderia, bukan Sphingomonas. Gen nahAc ditemukan pada bakteri Pseudomonas putida yang dapat mendegradasi naftalena dan fenantrena.
Katabolisme aerobik molekul HAP oleh bakteri diawali oleh oksidasi menjadi dihidrodiol oleh sistem enzim multikomponen. Senyawa antara ini kemudian dapat diproses melalui pemecahan tipe orto atau meta, yang mengarah ke senyawa antara utama seperti protokatekuat dan katekol, yang selanjutnya dikonversi ke siklus asam trikarboksilat (Kanaly dan Harayama 2000).
Meskipun mikrob pendegradasi hidrokarbon khususnya HAP telah banyak diketahui, lebih banyak mikrob yang telah dilaporkan dan berhasil diisolasi berasal dari daerah subtropis, yang memiliki suhu dan geografis yang berbeda dengan lingkungan di Indonesia yang beriklim tropis. Literatur mengenai bakteri pendegradasi senyawa hidrokarbon di daerah tropis khususnya Indonesia, masih sangat terbatas (Riffiani dan Sulistinah 2011). Selain itu, jenis HAP yang beragam membutuhkan kondisi degradasi dan jenis bakteri pendegradasi yang beragam pula. Eksplorasi bakteri indigenous dari Indonesia yang mampu mendegradasi hidrokarbon oleh karenanya akan memberikan kontribusi baik dari sisi biodiversitas maupun potensinya sebagai agen bioremediasi.
Biosurfaktan dan Biodegradasi HAP
(Ron dan Rosenberg 2002). Penambahan biosurfaktan atau produksinya secara in situ oleh mikrob diketahui mampu mempersingkat waktu degradasi dan meningkatkan efisiensi biodegradasi hidrokarbon dalam tanah (Kosaric 2001).
Peningkatan efisiensi bioremediasi oleh biosurfaktan ini dapat melalui dua mekanisme, yang pertama meliputi peningkatan bioavailabilitas substrat untuk mikrob, dan kedua melibatkan interaksi dengan permukaan sel yang meningkatkan hidrofobisitas permukaan hidrofobik yang memungkinkan substrat untuk lebih mudah berasosiasi dengan sel bakteri (Pacwa-Płociniczak et al. 2011). Banyak jenis surfaktan telah diteliti utuk mengetahui kemungkinan aplikasinya dalam proses biodegradasi kontaminan organik seperti HAP (Cameotra dan Makkar 2010).
Biosurfaktan mikrob menunjukkan kapasitas menghilangkan hidrokarbon yang lebih baik dibandingkan surfaktan sintetis. Sebagai contoh, biosurfaktan rhamnolipids dan surfactin, telah dievaluasi peranannya dalam membersihkan tanah yang terkontaminasi oleh minyak mentah, HAP dan hidrokarbon terklorinasi. Pada beberapa kasus, efisiensi penghilangan sangat tinggi (hingga 80%). Efisiensi ini tergantung pada waktu kontak dan konsentrasi biosurfaktan. Biosurfaktan tampaknya lebih efektif dalam meningkatkan kelarutan HAP hingga lima kali lipat dibandingkan dengan surfaktan kimia (Franzetti et al. 2010).
METODE
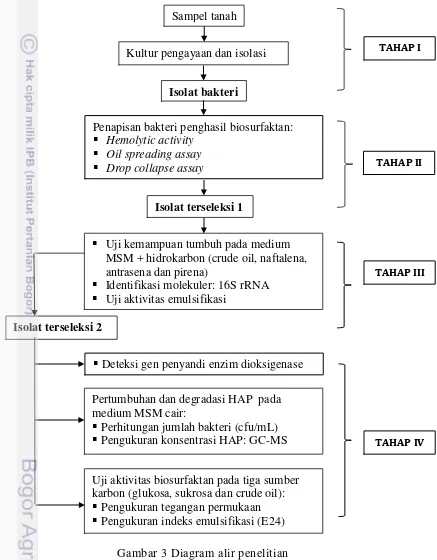
Penelitian dilakukan dalam empat tahap yang diawali dengan pengambilan sampel dan isolasi bakteri hingga analisis gen serta pengujian terhadap degradasi senyawa HAP dan aktivitas biosurfaktan yang dihasilkan oleh isolat bakteri (Gambar 3).
Gambar 3 Diagram alir penelitian Isolat terseleksi 1
Kultur pengayaan dan isolasi
Penapisan bakteri penghasil biosurfaktan: Hemolytic activity
Oil spreading assay Drop collapse assay
Sampel tanah
TAHAP I
TAHAP II
Isolat bakteri
Uji kemampuan tumbuh pada medium MSM + hidrokarbon (crude oil, naftalena, antrasena dan pirena)
Identifikasi molekuler: 16S rRNA Uji aktivitas emulsifikasi
Isolat terseleksi 2
Deteksi gen penyandi enzim dioksigenase
Uji aktivitas biosurfaktan pada tiga sumber karbon (glukosa, sukrosa dan crude oil): Pengukuran tegangan permukaan Pengukuran indeks emulsifikasi (E24) Pertumbuhan dan degradasi HAP pada medium MSM cair:
Perhitungan jumlah bakteri (cfu/mL) Pengukuran konsentrasi HAP: GC-MS
TAHAP III
Pengambilan Sampel
Sampel diambil dari 4 lokasi yang terletak di kawasan Teluk Jakarta yaitu Pulau Rambut, hutan mangrove Muara Angke, pelabuhan kapal nelayan Cilincing dan muara sungai Cilincing (Gambar 4). Pengambilan sampel dilakukan pada bulan Agustus 2014 menggunakan teknik purposive sampling pada lokasi yang tercemar limbah minyak. Setiap lokasi terdiri atas 2 titik pengambilan sampel yang berbeda sehingga terdapat 8 titik pengambilan sampel. Penentuan titik pengambilan sampel didasarkan pada kondisi pencemaran minyak pada tanah di setiap lokasi.
Sampel berupa tanah permukaan diambil pada kedalaman 10-20 cm menggunakan sekop kecil dan sendok steril kemudian dimasukkan ke dalam botol sampel steril untuk selanjutnya dibawa ke laboratorium menggunakan boks pendingin. Penyimpanan sampel sebelum analisis dilakukan pada suhu 4oC. Proses isolasi bakteri dan pengujian dilakukan di laboratorium Mikrobiologi, Fakultas MIPA Universitas Negeri Jakarta.
Gambar 4 Peta lokasi pengambilan sampel di kawasan Teluk Jakarta A. Pulau Rambut (5°58'35.6"S 106°41'28.1"E)
B. Kawasan Mangrove, Muara Angke (6°06'15.0"S 106°45'04.9"E)
C. Pelabuhan Kapal Nelayan, Cilincing (6°06'12.8"S106°55'15.1"E)
D. Sungai Cilincing (6°06'38.5"S 106°56'26.3"E) Kultur Pengayaan dan Isolasi Bakteri
g sampel tanah dimasukkan ke dalam botol selai steril berisi 50 mL MSM + 1% minyak mentah. Masing-masing botol selai yang telah berisi sampel dan medium diinkubasikan dalam shaker pada suhu ruang dengan kecepatan 200 rpm selama 14 hari. Setelah inkubasi, sebanyak 1 ml suspensi diambil dan dilakukan seri pengenceran hingga 10-5 selanjutnya diinokulasikan dengan metode cawan tuang (pour plate method) dalam MSM agar yang ditambahkan dengan 1% minyak mentah. Inkubasi dilakukan pada suhu 30oC selama 2-7 hari. Koloni yang tumbuh kemudian dimurnikan menggunakan metode gores pada medium Nutrient Agar (NA). Koloni yang tumbuh terpisah selanjutnya disimpan dalam medium Nutrient Agar pada suhu 4oC sebagai stock culture. Working culture dibuat dengan menggoreskan isolat dari stock culture ke dalam medium NA yang baru. Penyimpanan kultur cair bakteri dilakukan dalam larutan gliserol steril dengan konsentrasi akhir 10%.
Seleksi Bakteri Penghasil Biosurfaktan
Isolat bakteri yang diperoleh dari proses pengayaan dan isolasi kemudian diseleksi untuk mendapatkan bakteri yang mampu menghasilkan biosurfaktan. Seleksi dilakukan melalui metode sebagai berikut :
a) Hemolytic Activity
Isolat bakteri digoreskan pada permukaan Blood Agar dan diikubasikan pada suhu 20 oC selama 48 jam. Aktivitas hemolitik ditunjukkan dengan adanya zona bening di sekitar koloni (Carrillo et al. 1996).
b) Drop Collapse Test
Uji ini dilakukan dengan meneteskan 2 μL minyak mentah ke dalam sumur mikroplate, kemudian dibiarkan selama 24 jam pada suhu ruang. Supernatan dari kultur bakteri uji (24 jam dalam Nutrient Broth) kemudian ditambahkan sebanyak 5 μL ke permukaan tetesan minyak. Bentuk tetesan pada permukaan minyak diamati setelah 1 menit dengan menggunakan kaca pembesar. Hasil dinyatakan positif apabila tetesan berubah menjadi datar, sedangkan tetesan yang tetap berbentuk bulat dinyatakan negatif tidak terdapat biosurfaktan (Jain et al. 1991).
c) Oil Spreading Assay
Metode ini didasarkan pada Morikawa et al. (1993). Akuades steril dimasukkan ke dalam cawan petri (diameter 15 cm) sebanyak 20 mL diikuti dengan penambahan 15 L minyak mentah sehingga membentuk lapisan tipis pada permukaan akuades. Supernatan dari kultur bakteri kemudian ditambahkan sebanyak 10 μL ke permukaan minyak. Apabila supernatan tersebut mengandung biosurfaktan maka minyak akan terpisah dan membentuk zona jernih. Larutan Tween 20 digunakan sebagai kontrol positif dan akuades digunakan sebagai kontrol negatif.
Uji Kemampuan Tumbuh Bakteri pada Medium Hidrokarbon
Nutrient Broth dimasukkan ke dalam tabung reaksi berisi 5 mL MSM steril dan 100
L minyak mentah kemudian diinkubasikan dalam shaker dengan kecepatan 200 rpm pada suhu ruang selama 5 hari. Medium tanpa inokulum digunakan sebagai kontrol negatif. Pengujian pertumbuhan bakteri pada medium antrasena dan pirena dilakukan dengan menambahkan masing-masing sebanyak 100 μL larutan antrasena dan pirena dalam aseton (50 mg/L) dengan metode sebar (spread plate) ke permukaan MSM agar hingga merata. Kultur cair bakteri berumur 48 jam dalam medium NB diambil sebanyak 0,1 mL dan diinokulasikan dengan metode yang sama. Inkubasi dilakukan pada suhu ruang selama 3-7 hari. Bakteri yang tumbuh pada medium menunjukkan kemampuan dalam mendegradasi senyawa antrasena. Untuk HAP naftalena, medium yang telah diinokulasi diletakkan terbalik pada tutup cawan petri yang telah diberi kristal naftalena (1 g). Celah pada cawan petri dirapatkan dengan plastic wrap. Seluruh cawan petri diinkubasi pada suhu 30oC. Pertumbuhan bakteri diamati setiap hari selama 1 bulan.
Pengukuran Indeks Emulsifikasi (E24)
Indeks emulsifikasi setiap isolat diukur dengan memasukkan 2 mL supernatan bakteri dan 2 mL oli bekas dalam tabung reaksi. Campuran ini diaduk menggunakan vortexmixer selama 1 menit kemudian dibiarkan selama 24 jam pada suhu ruang. Setelah 24 jam tinggi lapisan emulsi yang terbentuk diukur. Nilai indeks emulsifikasi (E24) merupakan persentase dari tinggi lapisan emulsi (cm) dibagi dengan tinggi total larutan (Bodour et al. 2004).
Pengamatan Morfologi Sel dan Tipe Gram
Isolat bakteri ditumbuhkan pada medium NA selama 24 jam. Prosedur pewarnaan Gram dilakukan menurut Benson (2001). Bentuk sel dan tipe Gram dari tiap isolat diamati menggunakan mikroskop pada perbesaran 1000X.
Isolasi DNA dan Analisis Gen 16S rRNA
(BLAST) pada bank gen NCBI. Analisis filogenetik menggunakan software Geneious Basic versi 5.6.5 (Kearse et al. 2012).
Pertumbuhan Bakteri dan Degradasi HAP
Konsentrasi HAP yang digunakan sebesar 50 dan 100 mg/L. Kultur bakteri terseleksi dengan konsentrasi sel 104 cfu/mL diinokulasikan sebanyak 5% ke dalam tabung Erlenmeyer 250 mL yang berisi 100 mL MSM dan HAP sesuai perlakuan (naftalena, antrasena, pirena). Tabung tersebut diinkubasikan dalam rotary shaker dengan kecepatan 100 rpm pada suhu ruang selama 5 hari untuk naftalena dan 7 hari untuk antrasena dan pirena. Pertumbuhan bakteri diamati dengan mengambil 1 mL kultur bakteri setiap 24 jam, kemudian diinokulasikan ke dalam medium Plate Count Agar dengan metode cawan tuang (Pour Plate Method). Konsentrasi HAP dalam supernatan diukur menggunakan GC-MS (Shimadzu QP2010).
Deteksi Gen Pengkode Enzim Dioksigenase
Ekstraksi DNA dilakukan menggunakan DNA extraction kit (Geneaid). Keberadaan gen dioksigenase dideteksi berdasarkan amplifikasi PCR menggunakan PCR kit (KAPA Robust 2G, Kapa Biosystem).
Tabel 1 Primer spesifik yang digunakan untuk mendeteksi gen penyandi enzim dioksigenase
nahAc (nested) Forward TGCMVNTAYCAYGGYTGG
317
Reverse CRGGTGYCTTCCAGTTG
nidA (first) Forward TCCRMTGCCCDTACCACGG 600
Yuliani et al. (2012)
Reverse GAASGAYARRTTSGGGAACA
nidA (nested) Forward TCCRMTGCCCDTACCACGG 300
Reverse GCGSCKRKCTTCCAGTTCG
Pengukuran Tegangan Permukaan
Tiga jenis sumber karbon digunakan untuk pengujian ini yaitu: glukosa, sukrosa dan minyak mentah. Tabung Erlenmeyer berisi 250 mL MSM dan 1% sumber karbon (w/v) diinokulasi dengan 1 mL kultur bakteri berumur 24 jam dalam medium NB. Inkubasi dilakukan dalam rotary shaker dengan kecepatan 100 rpm pada suhu ruang selama 5 hari. Sampel diambil pada hari ke-lima dan dilakukan sentrifugasi pada 10,000 rpm selama 20 menit. Supernatan diambil untuk pengukuran tegangan permukaan dan indeks emulsifikasi (E24).
Tegangan permukaan diukur dengan memasukkan supernatan ke dalam gelas ukur, kemudian pipa kapiler dicelupkan dalam tabung berisi supernatant tersebut. Ketinggian cairan dalam pipa kapiler diukur menggunakan penggaris. Nilai tegangan permukaan diperoleh melalui rumus berikut (Viramontes-Ramos 2010):
= ½ rh
gKeterangan:
= Tegangan permukaan (mN/m);
= Densitas cairan (0.99 g/mL);
g = gravitasi (980 cm/s2);HASIL DAN PEMBAHASAN
Hasil
Isolat Bakteri Pendegradasi Hidrokarbon dari Sampel Tanah
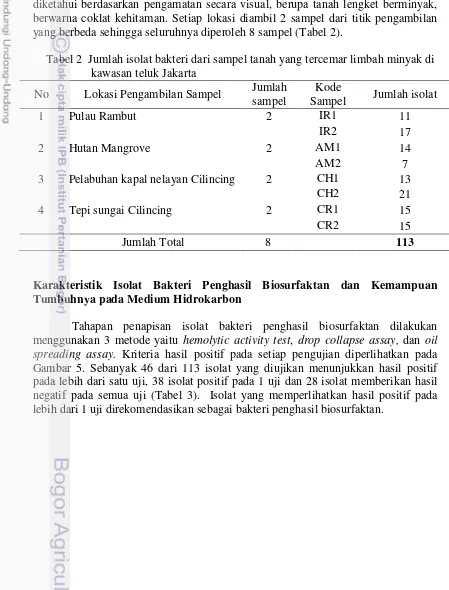
Sampel tanah berasal dari 4 lokasi yang tercemar limbah minyak yang diketahui berdasarkan pengamatan secara visual, berupa tanah lengket berminyak, berwarna coklat kehitaman. Setiap lokasi diambil 2 sampel dari titik pengambilan yang berbeda sehingga seluruhnya diperoleh 8 sampel (Tabel 2).
Tabel 2 Jumlah isolat bakteri dari sampel tanah yang tercemar limbah minyak di kawasan teluk Jakarta
No Lokasi Pengambilan Sampel Jumlah sampel
Kode
Sampel Jumlah isolat
1 Pulau Rambut 2 IR1 11
IR2 17
2 Hutan Mangrove 2 AM1 14
AM2 7
3 Pelabuhan kapal nelayan Cilincing 2 CH1 13
CH2 21
4 Tepi sungai Cilincing 2 CR1 15
CR2 15
Jumlah Total 8 113
Karakteristik Isolat Bakteri Penghasil Biosurfaktan dan Kemampuan Tumbuhnya pada Medium Hidrokarbon
Tabel 3 Jumlah dan kode isolat bakteri asal teluk Jakarta yang memberikan hasil positif pada pengujian hemolytic activity, drops collapse assay, dan oil spreading assay pada tahapan penapisan bakteri penghasil biosurfaktan
Lokasi Hasil positif pada metode uji*
a,b,c a,b a,c b,c a b c Jumlah Isolat Jumlah Isolat Jumlah Isolat Jumlah Isolat Jumlah Isolat Jumlah Isolat Jumlah Isolat
Pulau Rambut
*a: hemolytic activity, b: drops collapse method, c: oil spreading assay
Gambar 5 Hasil pengujian penapisan bakteri penghasil biosurfaktan. A. Isolat bakteri menunjukkan aktivitas hemolitik positif (b) dan negatif (a). B. Hasil positif pada drop collapse (b) menunjukkan bentuk tetesan yang melebar dibandingkan hasil negatif (a). C. Lapisan minyak mentah yang terpisah dan membentuk zona jernih pada pengujian oil spreading assay (a) mengindikasikan adanya biosurfaktan
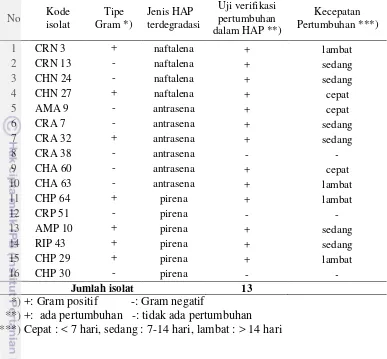
Pengujian pertumbuhan dalam medium yang mengandung hidrokarbon dilakukan sebagai deteksi awal kemampuan degradasi hidrokarbon dari 46 isolat bakteri penghasil biosurfaktan yang diperoleh pada tahap penapisan. Dua jenis pengujian yang dilakukan yaitu uji degradasi minyak mentah dalam Mineral Salt Medium (MSM) cair dan uji kemampuan tumbuh pada medium dengan tiga jenis HAP berbeda yaitu naftalena, antrasena dan pirena. Uji degradasi minyak mentah menghasilkan 41 isolat yang mampu mendegradasi minyak mentah pada medium mineral (Lampiran 1, Tabel 4). Kemampuan degradasi dari isolat bakteri menghasilkan karakteristik degradasi yang berbeda-beda berdasarkan pecahnya lapisan minyak pada permukaan MSM. Pemecahan lapisan minyak ini dikelompokkan menjadi 4 kelompok (Tabel 4). Pengujian pertumbuhan bakteri pada MSM agar yang mengandung HAP sebagai sumber karbon tunggal ditujukan untuk mengetahui kemampuan bakteri dalam mendegradasi HAP naftalena, antrasena dan pirena. Sebanyak 16 isolat mampu tumbuh pada pengujian ini dengan rincian 4 isolat pada medium naftalena (CR 3), CR 13, (CR 38 dan CH 27), 6 isolat pada medium antrasena (AM 9, CR 7, CR 32CH 60, CH 63 dan CH 64) dan 4 isolat lainnya (AM 10, RI 43, CR 51, CH 29, CH 30 dan CH 64) tumbuh pada medium pirena.
Tabel 4 Karakteristik degradasi minyak mentah oleh isolat bakteri penghasil biosurfaktan asal teluk Jakarta
No Ilustrasi degradasi Keterangan Kode isolat
1 Lapisan minyak tampak terpisah,
menghasilkan zona jernih yang lebar di bagian tengah dan membentuk lingkaran seperti cincin. Sel bakteri membentuk endapan yang cukup banyak di dasar
2 Lapisan minyak terpecah sebagian,
membentuk gumpalan. Terjadi sedikit pemisahan membentuk zona yang kecil di
4 Lapisan minyak terpecah sehingga
membentuk struktur yang kasar, tetapi
5 Minyak mentah membentuk lapisan tipis
di permukaan tabung. Tidak terjadi pemecahan dan tidak terbentuk endapan hingga hari ke-7 inkubasi.
Tabel 5 Hasil uji verifikasi pertumbuhan bakteri dalam MSM+HAP
Identifikasi Bakteri Berdasarkan Analisis 16 S rRNA
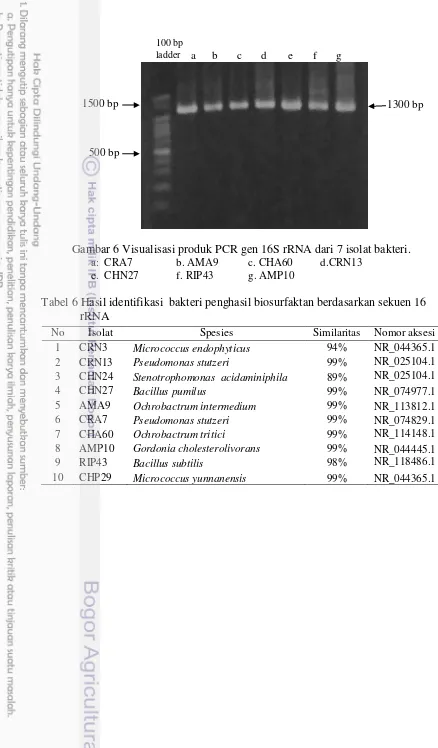
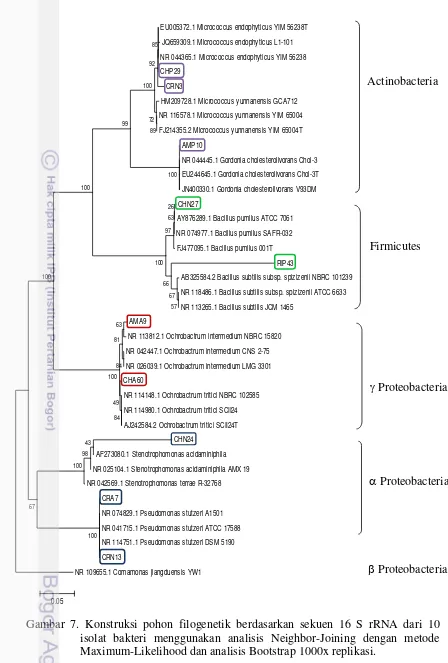
Gambar 6 Visualisasi produk PCR gen 16S rRNA dari 7 isolat bakteri. a: CRA7 b. AMA9 c. CHA60 d.CRN13
e. CHN27 f. RIP43 g. AMP10
Tabel 6 Hasil identifikasi bakteri penghasil biosurfaktan berdasarkan sekuen 16 rRNA
No Isolat Spesies Similaritas
(%)
Nomor aksesi 1 CRN3 Micrococcus endophyticus 94% NR_044365.1
2 CRN13 Pseudomonas stutzeri 99% NR_025104.1
3 CHN24 Stenotrophomonas acidaminiphila 89% NR_025104.1
4 CHN27 Bacillus pumilus 99% NR_074977.1
5 AMA9 Ochrobactrum intermedium 99% NR_113812.1
6 CRA7 Pseudomonas stutzeri 99% NR_074829.1
7 CHA60 Ochrobactrum tritici 99% NR_114148.1
8 AMP10 Gordonia cholesterolivorans 99% NR_044445.1
9 RIP43 Bacillus subtilis 98% NR_118486.1
10 CHP29 Micrococcus yunnanensis 99% NR_044365.1 1300 bp a b c d e f g
100 bp ladder
1500 bp
Gambar 7. Konstruksi pohon filogenetik berdasarkan sekuen 16 S rRNA dari 10 isolat bakteri menggunakan analisis Neighbor-Joining dengan metode Maximum-Likelihood dan analisis Bootstrap 1000x replikasi.
AB325584.2 Bacillus subtilis subsp. spizizenii NBRC 101239
Aktivitas Emulsifikasi Bakteri Penghasil Biosurfaktan
Pengukuran indeks emulsifikasi dilakukan untuk menginvestigasi aktivitas emulsi biosurfaktan yang dihasilkan oleh kesepuluh isolat bakteri. Supernatan yang dihasilkan oleh isolat bakteri menunjukkan nilai indeks emulsifikasi yang berbeda-beda (Tabel 7). Nilai tertinggi dihasilkan oleh bakteri G. cholesterolivorans AMP 10 (79,56) dan nilai terendah oleh bakteri B. subtilis RIP 43 (52,22).
Tabel 7 Nilai indeks emulsifikasi (E24) yang dihasilkan oleh isolat bakteri penghasil biosurfaktan 3 Stenotrophomonas acidaminiphila CHN 24 2,03 3,03 67,03±0,62 4 Bacillus pumilus CHN 27 2,47 3,17 77,89±0,41 5 Ochrobactrum intermedium AMA 9 2,30 3,23 71,15±1,26 6 Pseudomonas stutzeri CRA 7 1,57 2,97 52,76±1,80 7 Ochrobactrum tritici CHA 60 2,10 3,00 69,98±1,00 8 Gordonia cholesterolivorans AMP 10 2,47 3,10 79,56±1,95 9 Bacillus subtilis RIP 43 1,57 3,00 52,22±1.92 10 Micrococcus yunnanensis CHP 29 1,70 2,87 59,29±0,69
Pertumbuhan dan Degradasi HAP oleh Isolat Bakteri Penghasil Biosurfaktan
Sepuluh isolat yang berhasil diperoleh dan diidentifikasi merupakan isolat yang telah diketahui memiliki kemampuan menghasilkan biosurfaktan dan juga mampu tumbuh pada medium HAP. Empat isolat mampu tumbuh pada medium naftalena (Micrococcus endophyticus CRN 3, Pseudomonas stutzeri CRN 13, Stenotrophomonas acidaminiphila CHN 24 dan Bacillus pumilus CHN 27), 3 isolat pada medium antrasena (Ochrobactrum intermedium AMA 9, Pseudomonas stutzeri CRA 7 dan Ochrobactrum tritici CHA 60) serta tiga isolat pada medium pirena (Gordonia cholesterolivorans AMP 10, Bacillus subtilis RIP 43 dan Micrococcus yunnanensis CHP 29). Satu isolat potensial selanjutnya dipilih dari setiap jenis HAP yang mampu didegradasi. Pemilihan ini didasarkan pada kecepatan tumbuh dalam medium HAP (Tabel 5) sebagai parameter kemampuan degradasi hidrokarbon dan nilai E24 (Tabel 6) sebagai parameter aktivitas biosurfaktan. Berdasarkan kedua parameter tersebut maka B. pumilus CHN27, O. intermedium AMA 9 dan G. cholesterolivorans terseleksi untuk diuji lebih lanjut.
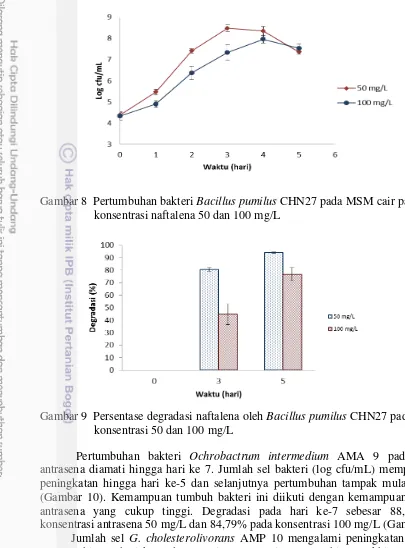
Gambar 8 Pertumbuhan bakteri Bacillus pumilus CHN27 pada MSM cair pada konsentrasi naftalena 50 dan 100 mg/L
Gambar 9 Persentase degradasi naftalena oleh Bacillus pumilus CHN27 pada
konsentrasi 50 dan 100 mg/L
Pertumbuhan bakteri Ochrobactrum intermedium AMA 9 pada medium antrasena diamati hingga hari ke 7. Jumlah sel bakteri (log cfu/mL) memperlihatkan peningkatan hingga hari ke-5 dan selanjutnya pertumbuhan tampak mulai menurun (Gambar 10). Kemampuan tumbuh bakteri ini diikuti dengan kemampuan degradasi antrasena yang cukup tinggi. Degradasi pada hari ke-7 sebesar 88,73% pada konsentrasi antrasena 50 mg/L dan 84,79% pada konsentrasi 100 mg/L (Gambar 11).
Gambar 10 Pertumbuhan bakteri Ochrobactrum intermedium AMA 9 pada MSM cair dengan konsentrasi antrasena 50 dan 100 mg/L
Gambar 11 Persentase degradasi antrasena oleh Ochrobactrum intermedium AMA 9 pada konsentrasi 50 dan 100 mg/L
Gambar 12 Pertumbuhan bakteri Gordonia cholesterolivorans AMP 10
Gambar 13 Pertumbuhan bakteri Gordonia cholesterolivorans AMP 10 pada MSM cair dengan konsentrasi naftalena 50 dan 100 mg/L
Perhitungan laju pertumbuhan spesifik () dan waktu generasi (g) dibuat berdasarkan kurva pertumbuhan yang diperoleh dari ketiga jenis bakteri. Hasil perhitungan menunjukkan laju pertumbuhan tercepat dicapai oleh bakteri B. pumilus CHN 27 pada medium naftalena diikuti pertumbuhan O. intermedium pada medium antrasena dan G. cholesterolivorans pada medium pirena (Tabel 8). Laju pertumbuhan O. intermedium dan G. cholesterolivorans menunjukkan nilai yang sama sebesar 0,378 jam-1 pada konsentrasi antrasena dan pirena 50 mg/L.
Kemampuan degradasi bakteri diketahui berdasarkan data hasil analisis GC-MS terhadap supernatan pada pengamatan yang telah ditentukan (Lampiran 2-4).
Tabel 8. Laju pertumbuhan spesifik () dan waktu generasi (G) ketiga jenis bakteri Isolat/substrat Substrat Konsentrasi
(sel/jam)
G (sel/jam) B. pumilus CHN27 naftalena 50 mg/L 0,0596 11,63
100 mg/L 0,0424 16,34
O. intermedium AMA 9 antrasena 50 mg/L 0,0378 18,33 100 mg/L 0,0353 20,69
G. cholesterolivorans AMP10 pirena 50 mg/L 0,0378 18,33 100 mg/L 0,0328 21,13
Tabel 9. Kecepatan degradasi HAP oleh isolat bakteri penghasil biosurfaktan dan pendegradasi hidrokarbon
Isolat bakteri Jenis HAP Konsentrasi awal (mg/L)
Kecepatan degradasi (mg/jam)
B pumilus CHN 27 Naftalena 50 0,336 ± 0,012 100 0,372 ± 0,069
O. intermedium AMA 9 Antrasena 50 0,343 ± 0,005 100 0,575 ± 0,030
G. cholesterolivorans AMP 10 Pirena 50 0,391 ± 0,008
Deteksi Gen Penyandi Enzim Dioksigenase
Gen nahAc mengkode komponen naftalena dioksigenase dan berperan sebagai biomarker potensial karena sifatnya yang sangat lestari (Park dan Crowley, 2006;
Yuliani et al. 2012). Keberadaan gen ini pada bakteri O. intermedium AMA 9 dan G
cholesterolivorans AMP 10 terdeteksi melalui amplifikasi nested PCR menggunakan dua pasang primer NahAc berdasarkan Zhou et al. (2006). Primer ini mengamplifikasi fragmen DNA berukuran 937 bp (Gambar 14A dan 14C) pada reaksi pertama dan 317
bp pada reaksi kedua. Sementara itu, gen nidA mengamplifikasi fragmen berukuran
sekitar 600 bp pada reaksi pertama dan 400 bp pada reaksi kedua (Yuliani et al. 2012). Hasil amplifikasi gen nidA reaksi pertama terdeteksi dalam penelitian ini pada bakteri O. intermedium AMA 9 (Gambar 14B). Gen dioksigenase ini tidak berhasil teramplifikasi pada bakteri B. pumilus CHN 27.
Tabel 10 Hasil analisis sekuen gen penyandi enzim dioksigenase dari bakteri pendegradasi HAP
No Kode isolat Primer Produk Spesies Similaritas
(%) No aksesi
nidA oksidoreduktase Ochrobactrum intermedium 70% WP 036565147.1
2 AMP10 nahAc hypotetical protein Gordonia
Pengaruh Sumber Karbon terhadap Aktivitas Biosurfaktan
Selain pengujian terhadap kemampuan degradasi hidrokarbon, dalam penelitian ini aktivitas biosurfaktan yang dihasilkan oleh tiga isolat bakteri terpilih juga dikonfirmasi menggunakan tiga sumber karbon berbeda yaitu glukosa, sukrosa dan minyak mentah. Sumber karbon tersebut diberikan dalam konsentrasi 1%. Pengamatan dilakukan terhadap dua parameter uji yaitu tegangan permukaan dan indeks emulsifikasi (E24). Hasil pengukuran terhadap supernatan menunjukkan bahwa semua sumber karbon dapat digunakan untuk memproduksi biosurfaktan oleh ketiga bakteri yang diujikan (Tabel 11).
Tabel 11 Nilai tegangan permukaan dan indeks emulsifikasi (E24) yang dihasilkan isolat bakteri pada tiga sumber karbon yang berbeda
Isolat Sumber Karbon
O. intermedium AMA9 Glukosa 50,9±2,52 69,90±1,16 Sukrosa 64,0±2,52 66,99±0,57 Minyak mentah 42,2±2,52 63,26±0,66
G. cholesterolivorans AMP10 Glukosa 24,7±0,00 78,35±0,38 Sukrosa 26,2±0,00 62,91±2,53 Minyak mentah 36,4±2,52 68,98±2,06
B. pumilus CHN27 Glukosa 27,7±2,52 79,42±3,17
Sukrosa 32,0±2,52 61,84±2,21 Minyak mentah 34,9±0,00 68,63±1,70
Pembahasan
Isolat Bakteri Penghasil Biosurfaktan dan Pendegradasi Hidrokarbon dari Teluk Jakarta
Sampel yang digunakan dalam penelitian ini diambil dari kawasan Teluk Jakarta. Ahmad (2012) menyatakan berdasarkan pemantauan oleh BPLHD DKI Jakarta, 83% sungai yang bermuara ke teluk Jakarta telah masuk dalam kategori tercemar berat. Sungai-sungai ini membawa berbagai jenis limbah yang berasal dari pembuangan samHAP, industri, maupun rumah tangga yang menyebabkan perairan Teluk Jakarta menerima beban pencemaran yang cukup berat. Sebagian limbah tersebut juga bersifat toksik, diantaranya adalah senyawa organik hidrokarbon aromatik polisiklik (HAP). Kondisi tersebut menjadi dasar pemilihan lokasi pengambilan sampel.
dibandingkan tanah yang tidak terkontaminasi. Walter et al. (2010) menyatakan bahwa kebanyakan mikrob penghasil biosurfaktan diisolasi dari sampel tanah atau air yang tercemar senyawa organik hidrofobik. Hal ini dapat dijelaskan karena biosurfaktan dihasilkan sebagai tanggapan fisiologis mikrob termasuk bakteri terhadap adanya substrat tidak larut air seperti minyak bumi. Biosurfaktan berperan untuk meningkatkan kelarutan senyawa hidrofobik tersebut sehingga dapat digunakan sebagai sumber karbon yang dibutuhkan untuk pertumbuhannya.
Tahapan penapisan untuk mendapatkan isolat bakteri penghasil biosurfaktan dilakukan melalui uji blood hemolysis test, drops collapse assay dan oil spreading method. Blood hemolysis test umumnya digunakan sebagai metode awal untuk mendeteksi adanya biosurfaktan. Carillo et al. (1996) menemukan adanya hubungan antara aktivitas hemolitik dengan produksi biosurfaktan, dan merekomendasikan blood hemolysis test sebagai metode primer untuk mengetahui aktivitas biosurfaktan. Hasil uji blood hemolysis terhadap 113 isolat menunjukkan bahwa 44 isolat memiliki kemampuan hemolitik (Tabel 3). Lisis sel darah merah dalam blood agar oleh biosurfaktan menyebabkan timbulnya zona bening di sekeliling koloni bakteri (Gambar 5A). Lebar zona bening yang ditunjukkan oleh isolat dalam penelitian ini berbeda-beda. Perbedaan lebar zona bening kemungkinan disebabkan oleh perbedaan konsentrasi biosurfaktan yang dihasilkan oleh isolat bakteri. Hasil penelitian Youssef et al. (2004) menggunakan bakteri Bacillus mengungkapkan terdapat hubungan linear antara besar diameter zona bening dan konsentrasi biosurfaktan yang dihasilkan. Munculnya zona bening disebabkan karena biosurfaktan merusak membran sel, sehingga sel darah merah menjadi lisis dan hemoglobin keluar dari sel. Zaragoza et al. (2010) menjelaskan bahwa aktivitas hemolitik biosurfaktan dapat terjadi melalui dua mekanisme berbeda. Hemolisis dapat disebabkan oleh larutnya membran yang secara normal terjadi pada konsentrasi biosurfaktan yang tinggi. Hemolisis dapat juga disebabkan oleh meningkatnya permeabilitas membran terhadap zat terlarut berukuran kecil, yang terjadi saat konsentrasi biosurfaktan rendah, sehingga menyebabkan lisis osmotik. Thavasi et al. (2011) menyatakan uji ini bukanlah metode yang sensitif karena senyawa lain selain biosurfaktan juga dapat menyebabkan hemolisis. Oleh karena itu, diperlukan metode lain untuk mendeteksi biosurfaktan yang dihasilkan oleh bakteri.
Metode penapisan kedua yang dilakukan adalah drop collapse (Gambar 5B). Metode ini didasarkan pada kemampuan biosurfaktan untuk mendestabilisasi tetesan cairan. Adanya biosurfaktan diperlihatkan dengan bentuk tetesan minyak yang melebar setelah ditambahkan supernatan kultur bakteri. Apabila tidak terdapat biosurfaktan maka tetesan minyak dalam sumur microplate tetap berbentuk bulat (Walter et al. 2010). Penentuan hasil positif dan negatif dalam penelitian ini mengacu pada Thavasi et al. (2011), yang menyatakan bahwa hasil uji drop collapse dinyatakan positif jika diameter tetesan setidaknya 1 mm lebih besar dari kontrol negatif berupa akuades. Hasil pengujian menunjukkan 45 isolat memberikan hasil positif pada uji ini (Tabel 3). Melebarnya bentuk tetesan disebabkan menurunnya daya tegangan antarmuka antara cairan supernatan dan permukaan hidrofobik dari tetesan minyak (Saravanan dan Vijayakumar, 2012). Metode drop collapse memiliki keuntungan antara lain sensitif, cepat, mudah dilakukan dan membutuhkan jumlah sampel yang kecil (Safary et al. 2010)