OPTIMALISASI SINTESIS DAN KAJIAN ADSORPSI GEL
KITOSAN-ALGINAT TERHADAP ION Cu(II)
DWI WAHYONO
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
DWI WAHYONO. Optimalisasi Sintesis dan Kajian Adsorpsi Gel Kitosan-Alginat Terhadap Ion Cu(II). Dibimbing oleh PURWANTININGSIH SUGITA dan AHMAD SJAHRIZA.
Limbah kulit udang dapat dimanfaatkan untuk membuat kitosan. Sifat reologi kitosan diperbaiki dalam bentuk gel dengan penambahan glutaraldehida dan hidrokoloid alami, seperti alginat. Sifat reologi gel yang diukur adalah kekuatan, titik pecah, ketegaran, pembengkakan, dan pengerutan gel, sedangkan parameter kitosan yang diukur ialah kadar air, kadar abu, derajat deasetilasi (DD), dan bobot molekul (BM). Pembuatan gel dilakukan dengan mencampurkan larutan kitosan 2.50% (b/v), glutaraldehida 4.00, 5.00, dan 6.00% (v/v), serta alginat 0.00, 0.75, dan 1.00% (b/v). Berdasarkan analisis proksimat, kitosan memiliki kadar air 5.89%, kadar abu 0.15%, DD 73.61%, dan BM 4.30 × 105 g mol-1.
Kondisi gel optimum untuk menjerap logam terjadi pada konsentrasi glutaraldehida 4.00% dan alginat 0.83% yang memberikan kekuatan, titik pecah, ketegaran, sifat
pembengkakan, dan pengerutan gel berturut-turut 881.4385 g cm-2, 1.0267 cm, 8.5179 g
cm-1, 4.5313 g, dan 1.6280 g. Spektrum fourier transform infrared gel
kitosan-glutaraldehida, dan gel kitosan-glutaraldehida-alginat menunjukkan puncak serapan
spesifik pada 1563 cm-1 yang diduga sebagai gugus imina yang tidak terdapat pada
spektrum kitosan. Kajian adsorpsi gel kitosan-alginat terhadap ion Cu(II) dengan konsentrasi 500 dan 1000 ppm dilakukan pada kondisi pH 3 dan 6. Kapasitas adsorpsi ion Cu(II) paling besar pada kondisi pH 6 dan konsentrasi logam 1000 ppm. Tetapan persamaan isoterm Langmuir adalah k1 = 6.42 × 10-3 ± 8.87 × 10-4 dan k2 = 1.18 × 10-3 ±
3.88 × 10-4, dengan nilai linearitas 97.57%. Tetapan persamaan isoterm Freundlich adalah
ABSTRACT
DWI WAHYONO. Synthesis Optimization and Adsorption Study of Chitosan-Alginate Gel toward Cu(II) Ion. Supervised by PURWANTININGSIH SUGITA and AHMAD SJAHRIZA.
Shrimp shell can be used to make chitosan. Rheological properties of chitosan were improved by gelation using glutaraldehyde and alginate. Rheological properties of gel measured were strength, break point, rigidity, swelling, and shrinking, while chitosan parameters measured were moisture content, ash content, deacetylation degree (DD), and molecular weight (MW). The gel was made by mixing 2.50% (w/v) chitosan solution, 4.00, 5.00, and 6.00% (v/v) glutaraldehyde, and 0.00, 0.75, and 1.00% (b/v) alginate. Based on proximate analysis, the chitosan had 5.89% of moisture content, 0.15% of ash
content, 73.61% of DD, and 4.30 × 105 g mol-1 of MW.
The optimum gel condition for metal adsorption was at 4.00% of glutaraldehyde and 0.83% of alginate, with gel strength, break point, rigidity, swelling, and shrinking
properties were 881.4385 g cm-2, 1.0267 cm, 8.5179 g cm-1, 4.5313 g, dan 1.6280 g,
respectively. Fourier transform infrared spectrum of chitosan-glutaraldehyde gel and
chitosan-glutaraldehyde-alginate gel showed specific absorption at 1563 cm-1 indicating
imine groups which was not found in chitosan spectrum. Adsorption of chitosan-alginate gel toward Cu(II) ion with concentrations of 500 and 1000 ppm were studied at pH 3 and 6. The best adsorption capacity of Cu(II) was at pH 6 and 1000 ppm of Cu(II). The equation constants of the Langmuir isotherm were k1 = 6.42 × 10-3 ± 8.87 × 10-4 and k2 =
1.18 × 10-3 ± 3.88 × 10-4, with linearity 97.57%. The equation constants of the Freundlich
OPTIMALISASI SINTESIS DAN KAJIAN ADSORPSI GEL
KITOSAN-ALGINAT TERHADAP ION Cu(II)
DWI WAHYONO
Skripsi
Sebagai salah satu syarat memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas rahmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini berjudul Optimalisasi Sintesis dan Kajian Adsorpsi Gel Kitosan-Alginat Terhadap Ion Cu(II).
Penulis mengucapkan terima kasih kepada Dr. Purwantiningsih Sugita, MS dan Drs. Ahmad Sjahriza, selaku pembimbing yang telah memberikan bimbingan dan pengarahan dalam penyusunan karya ilmiah ini. Terima kasih juga penulis ucapkan kepada Prof. Dr. Suminar S. Achmadi dan Budi Arifin S.Si. yang banyak memberi saran dan arahan. Ungkapan terima kasih penulis berikan kepada Mama, Papa, dan keluarga atas dukungan baik moril maupun materil, serta kasih sayang dan doanya. Penghargaan penulis sampaikan kepada seluruh staf dan laboran Kimia Organik, Pak Taufik, Mas Heri, Om Eman atas bantuannya. Selain itu, ucapan terima kasih kepada rekan-rekan sepenelitian (Dwi Wahyu, Rahma, Anti), Riki, Soele, teman-teman kost (Rossi, Om Asep, Mas Waluyo, Satria, Clauduo, Mas Kholil, Hisam), serta teman-teman Kimia 38 yang tidak dapat disebutkan semua atas persahabatan, ilmu, semangat yang diberikan serta kebersamaan yang indah.
Semoga karya ilmiah ini bermanfaat.
Bogor, April 2006
RIWAYAT HIDUP
Penulis dilahirkan di Tangerang pada tanggal 21 Agustus 1983 dari ayah Saino Sudibyo dan ibu Siti Nurjanah. Penulis merupakan anak kedua dari empat bersaudara.
Tahun 2001 penulis lulus dari SMUN 2 Tangerang dan pada tahun yang sama penulis diterima sebagai mahasiswa Departemen Kimia IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum mata kuliah Kimia Dasar II, Kimia Organik, dan Kimia untuk mahasiswa Tingkat Persiapan Bersama (TPB). Pada tahun 2004 penulis melaksanakan
Praktik Kerja Lapangan di Laboratorium Quality Qontrol PT Indocement Tunggal
DAFTAR ISI
Halaman
DAFTAR TABEL... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Kitosan ... 1
Gel Kitosan-Alginat ... 2
Tautan Silang Kitosan ... 3
Sifat Reologi Gel ... 4
Isoterm Adsorpsi ... 4
BAHAN DAN METODE Bahan dan Alat ... 5
Metode Penelitian ... 5
HASIL DAN PEMBAHASAN Pencirian Kitosan ... 8
Optimalisasi dan Analisis Sifat Reologi Gel... 8
Analisis Gugus Fungsi ... 10
Validasi Gel ... 11
Pembuatan Kurva Standar ... 11
Adsorpsi Logam Oleh Gel Kitosan-Alginat ... 11
Isoterm Adsorpsi ... 12
SIMPULAN DAN SARAN ... 13
DAFTAR PUSTAKA ... 13
DAFTAR TABEL
Halaman
1 Parameter mutu kitosan niaga ... 2
2 Parameter kitin, kitosan, dan kitosan niaga ... 8
3 Persamaan alginat, glutaraldehida, dan interaksinya terhadap respons ... 10
4 Hasil validasi gel optimum ... 11
DAFTAR GAMBAR
Halaman 1 Struktur kitosan ... 12 Struktur alginat ... 2
3 Kelat kitosan dengan ion Cu(II) ... 3
4 Struktur glutaraldehida ... 3
5 Struktur tautan silang kitosan dengan glutaraldehida... 3
6 Struktur dari hidrogel kitosan (a) tautan silang antarkitosan, (b) jaringan polimer hibrida, (c) jaringan semi-IPN, (d) tautan silang ionik kitosan ... 4
7 Metode garis-dasar untuk analisis derajat deasetilasi kitosan ... 6
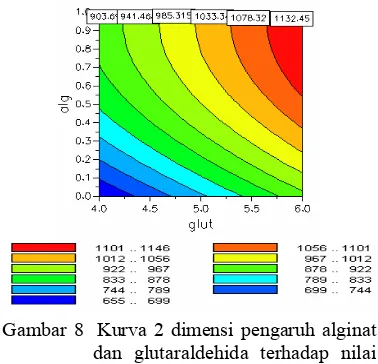
8 Kurva 2 dimensi pengaruh alginat dan glutaraldehida terhadap nilai kekuatan pecah gel ... 8
9 Kurva 2 dimensi pengaruh alginat dan glutaraldehida terhadap titik pecah gel ... 9
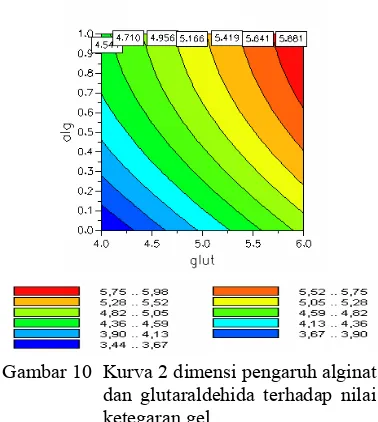
10 Kurva 2 dimensi pengaruh alginat dan glutaraldehida terhadap nilai ketegaran gel ... 9
11 Kurva 2 dimensi pengaruh alginat dan glutaraldehida terhadap nilai pembengkakan gel ... 9
12 Kurva 2 dimensi pengaruh alginat dan glutaraldehida terhadap nilai pengerutan gel ... 10
13 Spektrum FTIR (a) kitosan, (b) gel kitosan-glutaraldehida, dan (c) gel kitosan-glutaraldehida-alginat ... 11
14 Hubungan antara absorbans dan konsentrasi CuSO4.5H2O ... 11
15 Hubungan antara waktu dan kapasitas adsorpsi maksimum pada (a) pH 3 dan (b) pH 6... 12
16 Isoterm adsorpsi Langmuir ion Cu(II)... 12
DAFTAR LAMPIRAN
Halaman
1. Diagram alir sintesis kitin dan kitosan ... 16
2. Diagram alir penelitian ... 17
3. Data hasil pengukuran kadar air dan abu kitin dan kitosan, serta reologi gel
kitosan-alginat ... 18
4. Spektrum FTIR dan derajat deasetilasi kitin dan kitosan ... 20
5. Penentuan bobot molekul kitosan ... 22
6. Grafik tiga dimensi hubungan glutaraldehida dengan alginat terhadap sifat
reologi gel ... 23
7. Data hasil uji ANOVA dan koefisien kuadratik ... 26
8. Kurva adsorpsi pada penentuan panjang gelombang maksimum larutan
CuSO4.5H2O... 29
9. Kapasitas adsorpsi maksimum larutan ion Cu(II) pada pH 3 ... 29
PENDAHULUAN
Udang merupakan salah satu hasil perikanan Indonesia yang banyak dikonsumsi oleh masyarakat. Selain dikonsumsi, udang juga banyak dimanfaatkan dalam dunia industri sebagai salah satu komoditas ekspor non-migas. Udang diekspor dalam bentuk udang beku yang sudah dibuang bagian kepala dan kulitnya. Ekspor udang Indonesia ke Amerika pada triwulan pertama tahun 2005 mencapai 14 ribu ton, sedangkan pada periode yang sama tahun 2004 hanya mencapai 6 ribu ton (Kustiani 2005). Semakin meningkatnya ekspor udang Indonesia dari tahun ke tahun berakibat pada bertambahnya limbah udang.
Selama ini di Indonesia, limbah udang baru dimanfaatkan sebagai campuran ransum pakan ternak atau sebagai bahan campuran dalam pembuatan terasi, petis, dan kerupuk udang. Sementara di negara maju, seperti Amerika dan Jepang, limbah udang telah banyak dimanfaatkan sebagai bahan baku pembuatan kitin, kitosan, atau turunan dari keduanya yang berdaya guna dan bernilai tinggi di berbagai bidang industri modern, seperti farmasi, biokimia, kosmetika, industri kertas, industri pangan, dan industri tekstil.
Salah satu kegunaan kitosan adalah afinitasnya dalam menjerap ion logam berat. Besarnya afinitas kitosan dalam mengikat logam sangat bergantung pada ciri makrostruktur kitosan yang dipengaruhi oleh sumber dan kondisi pada proses isolasi (Schmuhl et al. 2001). Bentuk serpihan kitosan telah diuji coba afinitasnya terhadap ion Pb2+, Ni2+, dan Cr6+ dengan persentase pengikatan berturut-turut (84–98)%, (40– 92)%, dan (17–46)% (Jamaludin 1994). Adsorpsi ion Cu(II) dan Cr(VI) pada kitosan yang berbentuk serpihan dan butiran juga telah dilaporkan mengikuti pola isoterm Langmuir dan Freundlich (Nurdiani 2005).
Modifikasi kimiawi kitosan menjadi gel dapat meningkatkan kemampuan dan kapasitas adsorpsinya terhadap ion logam berat (Guibal 1997). Hal ini disebabkan bentuk gel mempunyai volume pori yang lebih besar dibandingkan dengan bentuk serpihan. Kemampuan adsorpsi gel kitosan sangat dipengaruhi oleh kestabilan sifat gel yang terbentuk. Telah dilaporkan bahwa penambahan polivinil alkohol (PVA) pada pembentukan gel kitosan dapat memperbaiki sifat gel yang terbentuk, yaitu menurunkan waktu gelasi dan meningkatkan kekuatan mekanik gel (Wang et al. 2004 dan Aisyah 2005). Setelah itu, semakin banyak dilakukan
modifikasi kimiawi terhadap kitosan agar kegunaannya semakin luas. Salah satu bentuk modifikasi terhadap kitosan adalah penambahan hidrokoloid alami, misalnya dengan alginat membentuk gel kitosan-alginat. Sejauh ini, kitosan telah dimodifikasi dengan alginat membentuk membran kompleks polielektrolit (PEC) (Cardenas et al. 2003). Alginat dapat memperbaiki struktur dasar makromolekul kitosan dengan membentuk tautan silang pada proses gelasi sehingga dihasilkan sifat gel kitosan yang berbeda.
Modifikasi kimiawi kitosan dengan alginat (PEC) telah dikembangkan dalam bidang pangan, kosmetik, dan industri farmasi. Kompleks polielektrolit dibentuk dengan mencampurkan larutan makromolekul yang berbeda muatan (Cardenas et al. 2003).
Penelitian ini bertujuan mensintesis gel kitosan-alginat, melakukan optimalisasi gel tersebut dilihat dari sifat reologinya, dan menentukan kapasitas adsorpsi gel kitosan-alginat terhadap logam Cu(II) dalam larutan tunggal ion logam. Gel kitosan-alginat yang terbentuk diharapkan dapat digunakan untuk mengadsorpsi logam Cu(II).
TINJAUAN PUSTAKA
Kitosan
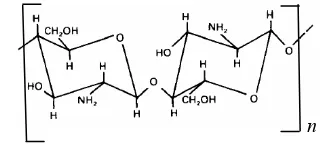
Kitosan merupakan biopolimer poli- kationik linear dengan unit berulang 2-amino-2-deoksi-D-glukopiranosa yang terhubung oleh ikatan β-(1→4) (Thatte 2004). Struktur kimia kitosan disajikan pada Gambar 1.
Gambar 1 Struktur kitosan.
Kitosan memiliki rumus molekul (C6H11NO4)n dan merupakan salah satu dari sedikit polimer alam yang berbentuk polielektrolit kationik dalam larutan asam organik (Hirano 1986 dalam Jamaludin 1994). Berbeda dengan kitin yang tidak larut dalam larutan asam dan basa encer, serta kebanyakan pelarut organik, kitosan larut dalam pelarut organik, HCl encer, HNO3 encer, dan H3PO4 0,5%, tetapi tidak larut dalam basa kuat dan H2SO4. Sifat kelarutan kitosan ini dipengaruhi
2
oleh bobot molekul dan derajat deasetilasi yang beragam bergantung pada sumber dan metode isolasi (Muzi 1990 dalam Jamaludin 1994). Kitosan tidak beracun dan mudah terbiodegradasi. Bobot molekul kitosan beragam, bergantung pada degradasi yang terjadi selama proses deasetilasi (Purwantiningsih 1992).
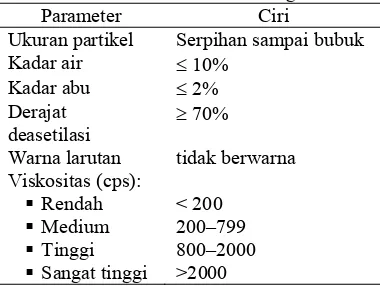
Parameter mutu kitosan biasanya dilihat dari nilai derajat deasetilasi, kadar air, kadar abu, bobot molekul, dan viskositas. Kitosan niaga memiliki bobot molekul sekitar 1 × 105– 1.2 × 106 g/mol. Viskositas kitosan dipenga- ruhi oleh beberapa faktor seperti derajat deasetilasi, bobot molekul, konsentrasi pelarut, dan suhu. Parameter mutu kitosan niaga dapat dilihat pada Tabel 1.
Tabel 1 Parameter mutu kitosan niaga*
Parameter Ciri Ukuran partikel Serpihan sampai bubuk
Kadar air ≤ 10%
Kadar abu ≤ 2%
Derajat deasetilasi
≥ 70%
Warna larutan tidak berwarna
Viskositas (cps):
Rendah < 200
Medium 200–799
Tinggi 800–2000
Sangat tinggi >2000
* Sumber: Anonim (1987) dalam Jamaludin (1994)
Deasetilasi kitosan merupakan proses penghilangan gugus asetil pada kitin menjadi gugus amino bebas menggunakan basa kuat. Kondisi basa dimaksudkan untuk memutuskan ikatan antara amina dan gugus asetil yang terdapat pada kitin. Waktu deasetilasi yang panjang dengan suhu yang tinggi akan menurunkan rendemen, bobot molekul, viskositas, dan kemampuan mekanik lembaran kitosan (Bastaman 1989). Salah satu metode yang dapat digunakan untuk menentukan derajat deasetilasi kitosan ialah spektroskopi inframerah (IR).
Gel Kitosan-Alginat
Hidrokoloid adalah polimer berantai panjang yang larut atau terdispersi di dalam air dan dapat mengental dalam medium tersebut (Fardiaz 1989). Oleh karena itu, hidrokoloid dapat digunakan sebagai komponen pembentuk gel. Berdasarkan sumber asalnya, hidrokoloid dapat dibedakan menjadi tiga jenis, yaitu hidrokoloid alami, hidrokoloid alami termodifikasi, dan hidro-
koloid sintesis. Alginat merupakan salah satu contoh hidrokoloid alami.
Alginat merupakan polimer rantai lurus yang terdiri atas residu-residu asam β-(1→ 4)-D-manuronat (M) dan asam α-(1→ 4)-L-guluronat (G) yang membentuk blok homopolimer M atau G dan blok hetero- polimer MG (Cardenas et al. 2003). Meskipun residu-residu tersebut merupakan epimer (residu asam D-manuronat secara enzimatik diubah menjadi L-guluronat setelah polimerisasi) dan hanya berbeda pada atom C5, keduanya memiliki konformasi yang sangat berbeda. Asam D-manuronat memiliki posisi tautan diekuatorial antarresidu, sedangkan asam L-guluronat memiliki posisi tautan diaksial antarresidu (Chaplin 2005). Alginat dapat dibuat dengan kisaran bobot molekul yang lebar (50–100.000 residu). Rumus struktur alginat ditunjukkkan pada Gambar 2.
Gambar 2 Struktur alginat (Chaplin 2005).
Sifat utama alginat yang diperoleh dari strukturnya adalah kemampuannya untuk membentuk gel dengan adanya kation divalen (Cardenas et al. 2003). Gel didefinisikan sebagai jaringan polimerik yang dapat menampung sejumlah tertentu air di dalam strukturnya dan mengembang tanpa melarut di
dalamnya (Wang et al. 2004). Gel yang
terbentuk dari alginat stabil terhadap panas dan dapat dibentuk pada suhu ruang. Gel tersebut terjadi dengan adanya sedikit ion kalsium atau ion logam divalen atau trivalen lainnya, atau dapat juga terbentuk tanpa adanya ion-ion tersebut pada pH lebih kecil dari 3. Gel alginat dapat terbentuk pada suhu ruang sampai 100 oC dan gel ini tidak dapat mencair dengan pemanasan (McHugh 1987 dalam Rahayu 2000).
3
divalen dikendalikan sehingga menghasilkan gel yang homogen (Chaplin 2005).
Kelarutan dan kapasitas mengikat-air alginat bergantung pada pH (mengendap di bawah pH 3.50), bobot molekul, kekuatan ionik, panjang rantai (semakin panjang rantai akan menurunkan kelarutan), dan sifat alami ion-ion yang ada. Secara umum alginat menunjukkan adsorpsi air yang tinggi (Chaplin 2005).
Alginat dapat digunakan untuk memperbaiki struktur dasar kitosan. Kitosan mudah terputus dalam asam mineral encer, maka perlu modifikasi kimia pada strukturnya, yaitu dengan membuat gel di antaranya dengan penambahan alginat. Interaksi kitosan dengan alginat menghasilkan pembentukan kompleks polielektrolit menurut persamaan reaksi berikut (Cardenas et al. 2003):
~COO-Na++Cl-+NH3~ ~COO-+NH3~+ NaCl Gel kitosan-alginat terjadi karena terbentuknya jaringan tiga dimensi antara molekul kitosan dan alginat yang terentang pada seluruh volume gel yang terbentuk dengan menangkap sejumlah air di dalamnya. Sifat jaringan serta interaksi molekul yang mengikat keseluruhan gel menentukan kekuatan, stabilitas, dan tekstur gel. Untuk memperkuat jaringan di dalam gel biasanya digunakan molekul lain sebagai pembentuk tautan silang.
Kemampuan gel kitosan-alginat dalam mengadsorpsi ion logam disebabkan bentuk butiran gel mempunyai volume pori lebih besar dibandingkan dengan bentuk serpihan. Akan tetapi, daya adsorpsi butiran gel kitosan-alginat dipengaruhi oleh kestabilan sifat gel yang dibentuk. Di bawah kondisi pengukuran yang dinamis, waktu pembentukan gel menurun dengan meningkatnya konsentrasi kitosan dalam campuran reaksi (Thatte 2004).
Pengikatan ion logam oleh kitosan terjadi melalui mekanisme pertukaran ion, adsorpsi, dan pengkelatan, yang mekanismenya beragam pada setiap spesies ion logam. Sebagai contoh adalah pembentukan kelat kitosan dengan ion Cu(II) seperti pada Gambar 3.
Gambar 3 Kelat kitosan dengan ion Cu(II) (Schmuhl et al. 2001).
Tautan Silang Kitosan
Kitosan dicirikan oleh cepat terputusnya rantai struktur dalam kebanyakan asam mineral encer. Dengan demikian untuk menstabilkan kitosan secara kimia untuk keperluan pemulihanion logam dalam larutan asam, diperlukan tautan silang. Adanya tautan silang akan menurunkan kapasitas adsorpsi dari kitosan karena terjadi pembentukan tautan kimia baru pada sisi adsorpsi (Schmuhl
et al. 2001).
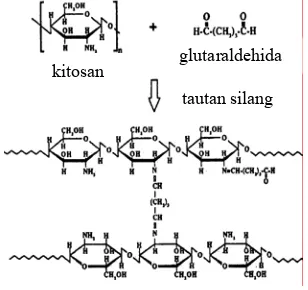
Pembentuk tautan silang merupakan molekul yang memiliki bobot molekul (BM) lebih kecil daripada BM kedua senyawa yang akan diikat (Berger et al. 2004). Senyawa yang lazim digunakan untuk menghasilkan tautan silang pada kitosan adalah glutaraldehida.
Glutaraldehida mempunyai rumus molekul C5H8O2 (Gambar 4) dengan bobot molekul sebesar 100.1 g/mol, titik didih sebesar 100 ºC, titik beku -15 ºC, pH 3.2–4.2, berupa larutan berwarna kuning, dan larut dalam air, alkohol, dan benzena. Glutaraldehida dapat berfungsi sebagai perantara tautan silang untuk PVA dan beberapa polisakarida lain seperti kitosan (Wang et al 2004). Hal ini disebabkan adanya aktivitas gugus aldehida yang tinggi dalam bentuk basa Schiff dengan gugus amina dari protein.
Gambar 4 Struktur glutaraldehida.
Tautan silang glutaraldehida terjadi melalui reaksi pembentukan basa Schiff antara gugus aldehida-ujung pada glutaraldehida dengan gugus amino pada kitosan membentuk imina (Gambar 5).
Gambar 5 Struktur tautan silang kitosan dengan glutaraldehida.
O
C
H (CH2)3 C O
H
o
o
kitosan glutaraldehida
4
Yang dan Zall (1984) dan Masri et al.
(1978) menunjukkan bahwa sifat heterogen tautan silang kitosan dengan glutaraldehida akan menurunkan kapasitas adsorpsi, tetapi mempertahankan kelarutan kitosan. Koyama dan Taniguchi (1986) mencoba memper- lakukan sifat homogen tautan silang kitosan dengan glutaraldehida dalam larutan asam asetat. Dihasilkan pengendapan produk dan ditemukan bahwa tautan silang meningkatkan kapasitas adsorpsi ion Cu(II).
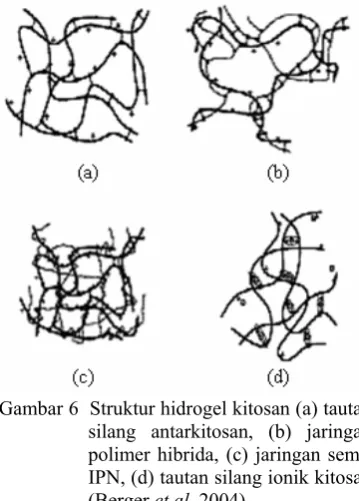
Tautan silang kovalen dalam gel kitosan dapat dibedakan menjadi 3 bagian, yaitu tautan silang antarkitosan, jaringan polimer hibrida atau hybrid polymer network (HPN), dan semi- atau full-interpenetrating network
(IPN) (Gambar 6).
Gambar 6 Struktur hidrogel kitosan (a) tautan silang antarkitosan, (b) jaringan polimer hibrida, (c) jaringan semi-IPN, (d) tautan silang ionik kitosan (Berger et al. 2004).
Tautan silang antarkitosan merupakan tautan silang antara dua unit struktur pada rantai polimer kitosan yang sama. Pada HPN, tautan silang terjadi antara unit dari struktur rantai kitosan dan unit lain dari struktur polimer tambahan. Semi-IPN atau IPN-penuh terjadi jika ada penambahan polimer lain yang tidak bereaksi dengan larutan kitosan sebelum terbentuk tautan silang. Pada semi-IPN, polimer yang ditambahkan hanya melilit, sementara pada IPN-penuh, ada penambahan dua senyawa penaut silang yang terlibat pada jaringan (Berger et al. 2004).
Sifat Reologi Gel
Reologi merupakan ilmu yang mem- pelajari sifat-sifat aliran suatu bahan dan perubahan bentuk suatu fluida (Billmeyer 1984). Sifat fisik dalam reologi meliputi kekentalan (viskositas), kelengketan, elastisitas, plastisitas, kelenturan, dan kekenyalan. Parameter pencirian umum suatu cairan atau larutan adalah viskositas, yaitu indeks hambatan alir suatu cairan. Viskositas dicari dengan cara mengukur laju aliran cairan yang melalui tabung berbentuk silinder (Bird 1993). Faktor-faktor yang memengaruhi viskositas adalah konsentrasi, suhu, dan keberadaan elektrolit dalam larutan.
Sifat fisik utama dari suatu bahan yang dapat membentuk gel adalah kekuatan gel (gel strength). Kekuatan gel merupakan gaya yang diperlukan untuk menghancurkan susunan gel. Selain kekuatan gel, sifat fisik lainnya yang terdapat pada gel adalah pengerutan (shrinking), pembengkakan (swelling), titik pecah, dan ketegaran (rigidity). Pengerutan adalah peristiwa pelepasan medium terdispersi secara spontan pada gel yang disimpan sekalipun pada kelembapan yang tinggi dan suhu yang rendah. Penyebab terjadinya pengerutan adalah kontraksi gel akibat terbentuknya tautan-tautan baru antarpolimer dari struktur gel (Rahayu 2000).
Gel dapat membengkak jika direndam dalam larutan bufer asetat pH 4. Pembengkakan gel terjadi karena masuknya cairan ke dalam struktur gel akibat adanya perbedaan aktivitas pelarut yang ada di dalam dan di luar gel. Pembengkakan merupakan kebalikan dari pengerutan. Kemampuan gel untuk menyimpan air di dalam strukturnya disebut pembengkakan. Menurut Wang et al. (2004), faktor-faktor lingkungan yang memengaruhi terjadinya pembengkakan gel adalah pH, suhu, kekuatan ionik, jenis garam yang digunakan pada saat pembuatan bufer, dan pelarut yang digunakan sebagai medianya. Dalam kondisi asam, gel mampu membengkak 5 kali lebih besar daripada dalam kondisi netral (Cardenas et al. 2003). Titik pecah menunjukkan dalamnya penetrasi pada saat gel pecah, sedangkan ketegaran menunjukkan besarnya beban yang diperlukan untuk memecah matriks gel atau tingkat kekakuan dari gel.
Isoterm Adsorpsi
5
digambarkan dengan isoterm adsorpsi yang merupakan gambaran keadaan setimbang antara konsentrasi zat terlarut yang terjerap pada permukaan padatan dan jumlah penjerap pada suhu tetap (Muhammad et al. 1998). Ada dua jenis persamaan yang sering digunakan untuk menjelaskan proses adsorpsi pada permukaan padatan. Yang pertama adalah persamaan Langmuir yang berlaku untuk
adsorpsi satu-lapisan (monolayer) pada
permukaan padatan yang homogen. Persamaan Langmuir digambarkan sebagai berikut (Ho et al 2005):
Q= (1)
Persamaan Langmuir dapat diturunkan dengan memperkirakan kesetimbangan antarmolekul yang diadsorpsi dan molekul yang masih bebas. Persamaan Langmuir menjadi
C 1 1
Q
dengan
Q = jumlah
adsorbat per unit adsorben
k1, k2 = tetapan isoterm adsorpsi
C =
konsentrasi adsorbat dalam larutan
Isoterm Langmuir biasanya digunakan untuk menggambarkan proses kimisorpsi dan jarang digunakan untuk sistem yang heterogen. Sistem yang menjalani isoterm Langmuir akan terus melakukan adsorpsi sampai tercapai lapisan tunggal.
Persamaan yang kedua ialah persamaan Freundlich yang biasanya berlaku untuk proses adsorpsi dari cairan pada permukaan padatan. Isoterm ini paling umum digunakan karena dapat mencirikan kebanyakan proses adsorpsi dengan baik (Pope 2004). Persamaan untuk isoterm Freundlich adalah
Q = kC1/n (3)
Apabila persamaan tersebut diubah ke dalam bentuk logaritmik akan diperoleh
log Q = log k + 1/n log C (4)
Isoterm Freundlich menganggap bahwa pada sisi permukaan adsorben akan terjadi proses adsorpsi di bawah kondisi yang diberikan. Isoterm Freundlich tidak mampu memperkirakan adanya sisi-sisi permukaan yang mampu mencegah adsorpsi pada saat
kesetimbangan tercapai, dan hanya ada beberapa sisi aktif saja yang mampu mengadsorpsi molekul terlarut (Pope 2004).
BAHAN DAN METODE
Bahan dan Alat
Alat-alat yang digunakan antara lain termometer, viskometer Ostwald 3137R, neraca analitik, fourier transform infrared
(FTIR) Bruker jenis Tentor 37, spektrofotometer Spectronic-20D+, oven, hot plate, cawan porselen, penganalisis tekstur (texture analyzer) Stevens LFRA, pengaduk magnetik, pH-meter, stopwatch, dan alat-alat kaca lainnya.
Bahan-bahan yang digunakan adalah kitosan (hasil isolasi limbah kulit udang pancet dari Muara Angke Jakarta Utara, Lampiran 1), NaOH 3.50% dan 50% (b/v), HCl 1 N, air suling, asam asetat 1%, glutaraldehida, alginat, larutan bufer (asam asetat-natrium asetat) pH 4, larutan bufer (natrium fosfat) pH 7, etilenadiamina, larutan ion logam Cu(II), dan KBr 1%.
Metode Penelitian
Tahapan yang dilakukan dalam penelitian ini adalah isolasi kitosan dan penciriannya, pembuatan gel kitosan-alginat dan pengukuran sifat reologinya, optimalisasi untuk mencari gel optimum, analisis gugus fungsi gel optimum dengan FTIR, serta studi adsorpsi logam Cu(II) oleh gel tersebut dan pembuatan isoterm adsorpsi dengan metode spektrofotometri. Bagan alir penelitian diberikan pada Lampiran 2.
Pencirian Kitin dan Kitosan
Analisis Kadar Air (AOAC 1999)
Penentuan kadar air kitin atau kitosan dilakukan dengan metode gravimetri. Sebanyak kira-kira 1.0000 g contoh dimasukkan ke dalam cawan porselen yang telah diketahui bobotnya, kemudian cawan dan isinya dipanaskan dalam oven bersuhu 105 oC sampai bobotnya konstan. Setelah itu, dimasukkan ke dalam desikator dan ditimbang. Kadar air dihitung dengan cara:
Kadar air =
dengan
= +
k1 k2 k1
C (2)
X – Y
X × 100%
k1k2 C
6
X = bobot contoh mula-mula (g)
Y = bobot contoh kering (g)
Analisis Kadar Abu (AOAC 1999)
Penentuan kadar abu kitin atau kitosan dilakukan dengan metode gravimetri. Cawan porselen dibersihkan dan dimasukkan ke dalam tanur untuk menghilangkan sisa-sisa kotoran yang menempel dalam cawan, kemudian didinginkan dalam desikator dan ditimbang. Sebanyak kira-kira 0.5000 g kitin/kitosan dimasukkan ke dalam cawan tersebut dan dipanaskan sampai tidak berasap, kemudian dibakar dalam tanur pengabuan dengan suhu 600 oC sampai diperoleh abu berwarna putih. Setelah itu, cawan beserta isinya dimasukkan ke dalam desikator dan ditimbang. Kadar abu contoh dihitung dengan persamaan:
Kadar abu =
Penentuan Derajat Deasetilasi
(Khan et al. 2002)
Untuk penentuan derajat deasetilasi digunakan FTIR. Kitin dan kitosan yang diperoleh dibuat pelet dengan KBr 1%, kemudian dilakukan pemayaran pada daerah frekuensi 4000 cm-1 sampai 400 cm-1. Derajat deasetilasi ditentukan dengan metode garis-dasar (Gambar 7).
Gambar 7 Metode garis-dasar untuk analisis derajat deasetilasi kitosan
Nilai absorbans dapat dihitung dengan menggunakan persamaan berikut:
A = log
Po = % transmitans pada garis-dasar
P = % transmitans pada puncak minimum
A = absorbans
Kitin yang terdeasetilasi sempurna (100%) memiliki nilai A1655 = 1.33. Dengan mem- bandingkan nilai absorbans pada bilangan gelombang 1655 cm-1 (serapan pita amida I) dengan absorbans pada bilangan gelombang 3450 cm-1 (serapan gugus hidroksil) (Domszy dan Roberts 1985 dalam Khan et al 2002), %DD dapat dihitung dengan persamaan:
% DD = 1 –
100
%
33
.
1
1
3450 1655×
⎥
⎦
⎤
⎢
⎣
⎡
×
A
A
Penentuan Bobot Molekul Kitosan
(Tarbojevich dan Cosani 1996)
Bobot molekul kitosan ditentukan dengan menggunakan metode viskometer Ostwald. Sekitar 0.10 g kitosan dilarutkan dalam 100 mL asam asetat 0.50 M, kemudian diambil sebanyak 5 mL dan dimasukkan ke dalam viskometer untuk ditentukan waktu alirnya. Pengukuran juga dilakukan untuk beberapa konsentrasi kitosan. Persamaan-persamaan yang digunakan ialah sebagai berikut:
Viskositas relatif ηr = η/ηo≅t/to Viskositas spesifik ηsp =ηr -1 Viskositas intrinsik [η] = (ηsp/c)c=0
ηsp/c = [η] + k’[η]2c, dengan k’ 0.3–0.7 [η] = KMa, dengan K = 3.5 × 10-4 dan a =
0.76
t = waktu alir zat
M = bobot molekul
zat
t0 = waktu alir pelarut
η = viskositas zat
η0 = viskositas pelarut
Pembuatan Gel Kitosan-Alginat
Gel kitosan-alginat dibuat dengan meragamkan konsentrasi alginat dan glutaral- dehida. Konsentrasi alginat yang digunakan adalah 0.00, 0.75, dan 1.00% (b/v), sedangkan konsentrasi glutaraldehida 4.00, 5.00, dan 6.00% (v/v). Konsentrasi kitosan dibuat tetap, yaitu 2.50% (b/v). Sebanyak 2.50 g kitosan dilarutkan dalam 100 mL asam asetat 1.00% (v/v) kemudian 30 mL larutan kitosan tersebut ditambahkan 5.00 mL larutan alginat dengan ragam konsentrasi 0.00, 0.75, dan 1.00% (b/v). Campuran diaduk sampai homogen. Setelah homogen ditambahkan 1 mL glutaraldehida dengan ragam konsentrasi 4.00, 5.00, dan 6.00% (v/v). Larutan yang terbentuk kemudian didiamkan selama semalam.
Gel kitosan-alginat yang terbentuk kemudian dianalisis dengan FTIR dan diukur Bobot abu (g)
Bobot contoh (g) × 100%
Po
P Po
P
Bilangan gelombang (cm-1)
Transmitans (%)
P0
7
sifat reologinya yang meliputi kekuatan gel, titik pecah, ketegaran, pembengkakan, dan pengerutan dengan menggunakan penganalisis tekstur.
Pengukuran Sifat Reologi Gel
Kekuatan pecah gel ditentukan dengan menggunakan alat penganalisis tekstur. Contoh dalam cetakan diletakkan dalam tempat sampel, selanjutnya alat dioperasikan untuk melihat gaya maksimum yang diperlukan untuk memecahkan gel. Nilai kekuatan pecah dihitung dengan persamaan berikut (Angalett 1986):
Kekuatan gel (g/cm2) =
kalibrasi nilai x penekan bidang luas (BC) pecah beban
Nilai kalibrasi =
gel ke penekan jarak penekan beban
Titik pecah (cm) = penetrasi pecah (AC)
Rigiditas (g/cm) =
(AC) pecah penetrasi (BC) pecah beban
Pembengkakan gel dilakukan dengan merendam sekitar 1.0000 g gel dalam 30 mL larutan bufer asetat pH 4 selama 24 jam pada suhu kamar. Selama proses pembengkakan, wadah ditutup untuk mencegah menguapnya larutan bufer. Setelah 24 jam, gel ditimbang kembali untuk mengetahui bobot air yang terserap (Wang et al. 2004).
Pengerutan dilakukan dengan merendam sekitar 2.0000 g gel dalam 30 mL larutan bufer fosfat pH 7 selama 24 jam pada suhu 10 o
C. Setelah itu, gel ditimbang kembali untuk mengetahui bobot air yang dikeluarkan oleh gel (Wang et al. 2004).
Rancangan Percobaan
Hasil penelitian diolah dengan menggunakan perangkat lunak Modde 5.0 untuk mengetahui kombinasi konsentrasi alginat dan glutaraldehida yang terbaik, serta melihat pengaruh dari perubahan konsentrasi alginat dan glutaraldehida terhadap nilai kekuatan pecah, titik pecah, ketegaran, pembengkakan, dan pengerutan gel kitosan-alginat. Nilai konsentrasi alginat dan glutaraldehida yang terbaik digunakan untuk studi adsorpsi.
Pembuatan Kurva Standar Ion Cu(II)
Kurva standar diukur pada panjang gelombang maksimum yang ditentukan terlebih dahulu dengan mengukur absorbans larutan ion Cu(II) 100 ppm pada panjang gelombang antara 400–600 nm.
Larutan logam CuSO4.5H2O dibuat dengan konsentrasi 100, 200, 300, 400, 500, 600, 700, 800, 900, dan 1000 ppm. Sebanyak 7.00 mL dari setiap larutan dipipet ke dalam tabung reaksi kemudian ditambahkan 0.50 mL etilenadiamina sehingga larutan berwarna ungu. Larutan diukur pada panjang gelombang maksimum.
Adsorpsi Logam Oleh Gel Kitosan-Alginat
Ion logam yang digunakan adalah Cu(II) yang berasal dari larutan CuSO4.5H2O. Adsorpsi dilakukan untuk konsentrasi logam 500 dan 1000 ppm pada pH 3 dan 6. Sebanyak kira-kira 1.0000 g gel kitosan-alginat di- masukkan ke dalam 50 ml larutan logam Cu(II) konsentrasi 500 ppm pada kondisi pH 3 dan 6 kemudian campuran diaduk dengan pengaduk magnetik selama 2, 4, 6, 8, 10, dan 12 menit. Setelah itu, larutan disaring dan sebanyak 7.00 mL filtrat dimasukkan ke dalam tabung reaksi, ditambahkan 0.50 mL etilenadiamina, dan diukur absorbansnya dengan spektrofotometer Spectronic-20D+ pada panjang gelombang maksimum. Prosedur yang sama dilakukan untuk konsentrasi ion logam Cu(II) 1000 ppm.
Konsentrasi ion logam dihitung dengan menggunakan kurva standar. Selisih konsentrasi awal dan akhir dari larutan logam merupakan jumlah logam yang dapat diadsorpsi oleh gel. Selanjutnya kapasitas adsorpsi dapat dihitung dengan persamaan: Beban pecah (g)
Penetrasi pecah (mm) B
8
Q =
m
)
C
C
(
V
0−
aKeterangan:
Q = kapasitas adsorpsi per bobot gel
(mg/g)
V = volume larutan (L)
C0 = konsentrasi awal larutan (ppm)
Ca = konsentrasi akhir larutan (ppm)
m = massa gel (g)
Isoterm Adsorpsi
Sebanyak kira-kira 1.0000 g gel kitosan-alginat dimasukkan ke dalam 50 mL larutan ion Cu(II) dengan konsentrasi 100, 250, 350, 500, 650, dan 850 ppm pada kondisi pH 6, kemudian diaduk menggunakan pengaduk magnetik. Reaksi dihentikan pada menit ke-8. Setelah itu, larutan disaring dan sebanyak 7.00 mL filtrat dimasukkan ke dalam tabung reaksi, ditambahkan 0.50 mL etilenadiamina, dan diukur absorbansnya dengan spektrofotometer Spectronic-20D+ pada panjang gelombang
maksimum. Kapasitas adsorpsi (Q) dan
tetapan isoterm adsorpsi (k) dihitung dengan model isoterm adsorpsi Langmuir dan Freundlich.
HASIL DAN PEMBAHASAN
Pencirian Kitosan
Hasil penelitian menunjukkan nilai kadar air dan kadar abu kitosan seperti disajikan pada Tabel 2 (Data lengkap pada Lampiran 3).
Tabel 2. Parameter kitin, kitosan, dan kitosan niaga
Parameter Kitin Kitosan Kitosan
niaga
Kadar air 8.53% 5.89% ≤ 10%
Kadar abu 0.44% 0.15% ≤ 2%
Derajat
deasetilasi 58.27% 73.61% ≥ 70%
Dengan membandingkan parameter kitosan hasil penelitian dengan kitosan niaga (Tabel 2), kitosan yang diperoleh dapat dikategorikan sebagai kitosan niaga. Deasetilasi kitosan ber- tujuan mengubah gugus asetamido yang terdapat pada kitin menjadi gugus amino bebas pada kitosan. Nilai derajat deasetilasi (Tabel 2) menunjukkan bahwa kitin telah mengalami penghilangan gugus asetil selama proses deasetilasi sedangkan pada kitosan tidak seluruhnya terdeasetilasi. Spektrum
FTIR untuk penentuan derajat deasetilasi diberikan pada Lampiran 4.
Bobot molekul kitosan beragam bergantung pada proses isolasinya. Dari percobaan diperoleh bobot molekul kitosan sebesar 4.30 × 105 g mol-1 (Data lengkap pada Lampiran 5). Jadi, kitosan yang diperoleh masih memenuhi syarat sebagai kitosan niaga karena bobot molekulnya di bawah 1 × 106 g mol-1.
Optimalisasi dan Analisis Sifat Reologi Gel
Sifat reologi gel kitosan-alginat yang meliputi kekuatan gel, titik pecah, ketegaran, pembengkakan, dan pengerutan diamati untuk melihat pengaruh konsentrasi alginat (alg) dan glutaraldehida (glut) terhadap sifat reologi tersebut. Gambar 8 menunjukkan kurva 2 dimensi pengaruh alginat dan glutaraldehida terhadap nilai kekuatan pecah gel. (Data langkap disajikan pada Lampiran 3 dan kurva 3 dimensinya pada Lampiran 6). Semakin tinggi konsentrasi glutaraldehida yang ditambahkan, semakin besar kekuatan gel. Hal ini disebabkan fungsi glutaraldehida dalam pembuatan gel adalah sebagai pembentuk tautan silang. Semakin besar jumlah glutaraldehida, semakin banyak tautan silang yang dapat dibentuk dan menyebabkan gel semakin keras. Penguatan gel juga terjadi pada konsentrasi alginat yang semakin tinggi. Penambahan alginat dapat memperbaiki struktur tautan silang kitosan dalam gel sehingga tautan silang menjadi lebih kaku dan gel menjadi lebih kuat. Makin tinggi nilai kekuatan pecah gel, makin kaku dan makin kuat tautan yang terjadi antarpolimer yang membentuk jaringan gel tersebut (Rahayu 2000).
9
Gambar 9 menunjukkan kurva 2 dimensi pengaruh alginat dan glutaraldehida terhadap nilai titik pecah. (Data langkap disajikan pada Lampiran 3 dan kurva 3 dimensinya pada Lampiran 6). Dari Gambar 9 terlihat bahwa nilai titik pecah mengalami penurunan dengan bertambahnya konsentrasi glutaraldehida. Hal ini disebabkan glutaraldehida membentuk tautan silang dengan jumlah yang banyak sehingga gel menjadi rapuh dan gerakan segmen di dalamnya menjadi berkurang akibatnya titik pecah semakin kecil. Adanya penambahan alginat ke dalam struktur gel pada konsentrasi 0.75% sampai 1.00% akan menurunkan titik pecah gel kitosan-alginat. Hal ini disebabkan alginat memiliki sifat menyerap air sehingga sekalipun struktur tautan silang diperbaiki pada saat konsentrasi alginat yang tinggi titik pecah gel mengecil.
Gambar 9 Kurva 2 dimensi pengaruh alginat dan glutaraldehida terhadap titik pecah gel.
Gambar 10 menunjukkan kurva 2 dimensi pengaruh alginat dan glutaraldehida terhadap nilai ketegaran gel. (Data langkap disajikan pada Lampiran 3 dan kurva 3 dimensinya pada Lampiran 6). Dari Gambar 10 dapat dilihat bahwa semakin tinggi konsentrasi alginat dan glutaraldehida, semakin besar nilai ketegaran gel kitosan-alginat. Seperti telah dijelaskan, penambahan glutaraldehida meningkatkan jumlah tautan silang dalam gel sehingga gel menjadi lebih kaku. Akibatnya, nilai ketegarannya meningkat. Demikian juga halnya dengan penambahan alginat yang dapat memperbaiki struktur tautan silang gel sehingga menjadi lebih kaku dan nilai ketegaran gel pun meningkat.
Gambar 10 Kurva 2 dimensi pengaruh alginat dan glutaraldehida terhadap nilai ketegaran gel.
Gambar 11 menunjukkan kurva 2 dimensi pengaruh alginat dan glutaraldehida terhadap nilai pembengkakan gel. (Data langkap disajikan pada Lampiran 3 dan kurva 3 dimensinya pada Lampiran 6). Dari Gambar 11 terlihat bahwa semakin banyak glutaraldehida yang ditambahkan, pembeng- kakan gel semakin kecil. Hal ini disebabkan struktur gel semakin rapat sehingga semakin sulit air berpenetrasi ke dalam struktur gel seiring bertambahnya tautan silang oleh glutaraldehida. Berger et al. (2004) me- nyebutkan bahwa penambahan senyawa pembentuk tautan silang menurunkan nisbah pembengkakan pada gel kitosan. Penambahan alginat akan menurunkan nilai pembengkakan gel karena alginat dapat bereaksi dengan kitosan dan membuat struktur gel menjadi semakin rapat sehingga air sulit masuk.
10
Gambar 12 menunjukkan kurva 2 dimensi pengaruh alginat dan glutaraldehida terhadap nilai pengerutan gel. (Data langkap disajikan pada Lampiran 3 dan kurva 3 dimensinya pada Lampiran 6). Dari Gambar 12 dapat dilihat bahwa semakin tinggi konsentrasi alginat dan glutaraldehida yang digunakan, semakin besar nilai pengerutan gel. Pengerutan yang ini meningkat disebabkan oleh reaksi antara glutaraldehida dan kitosan merupakan reaksi kondensasi yang mengeluarkan air. Selain itu, penggunaan bufer fosfat dalam proses pengerutan juga besar pengaruhnya, yaitu dapat menarik keluar air dari dalam gel karena ukuran molekulnya yang besar. Peningkatan nilai pengerutan juga disebabkan oleh terbentuknya tautan hidrogen antara gugus amino kitosan yang tidak bertautan silang dengan glutaraldehida sehingga struktur gel menjadi lebih rapat dan memeras air keluar.
Gambar 12 Kurva 2 dimensi pengaruh alginat dan glutaraldehida terhadap nilai pengerutan gel.
Hasil analisis keragaman atau ANOVA (Lampiran 7) menghasilkan persamaan glutaraldehida, alginat, dan interaksi keduanya terhadap respons yang diukur, yaitu kekuatan gel, titik pecah, ketegaran, pembengkakan, dan pengerutan gel. Menurut Lindblad (2003), gel yang baik adalah gel yang elastis, lembut, dan mudah membengkak dalam air. Nilai optimum gel kitosan-alginat yang diperoleh menggunakan perangkat lunak Modde 5.0 adalah pada konsentrasi glutaraldehida 4.00 % dan konsentrasi alginat 0.83% yang memenuhi syarat gel untuk aplikasi sebagai penjerap logam, yaitu nilai pembengkakan yang maksimum.
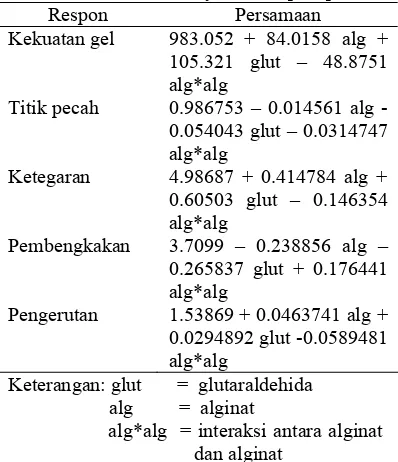
Persamaan alginat dan glutaraldehida terhadap nilai kelima parameter tersebut disajikan pada Tabel 3. Berdasarkan per-
samaan pada Tabel 3, yang memberikan pengaruh nyata terhadap kekuatan gel adalah konsentrasi glutaraldehida (Lampiran 7).
Tabel 3 Persamaan alginat, glutaraldehida, dan interaksinya terhadap respons
Respon Persamaan
Kekuatan gel 983.052 + 84.0158 alg +
105.321 glut – 48.8751 alg*alg
Titik pecah 0.986753 – 0.014561 alg -0.054043 glut – 0.0314747 alg*alg
Ketegaran 4.98687 + 0.414784 alg +
0.60503 glut – 0.146354 alg*alg
Pembengkakan 3.7099 – 0.238856 alg – 0.265837 glut + 0.176441 alg*alg
Pengerutan 1.53869 + 0.0463741 alg + 0.0294892 glut -0.0589481 alg*alg
Keterangan: glut = glutaraldehida alg = alginat
alg*alg = interaksi antara alginat dan alginat
Analisis Gugus Fungsi
11
Gambar 13 Spektrum FTIR (a) kitosan, (b) gel glutaraldehida, dan (c) gel kitosan-glutaraldehida-alginat.
Validasi Gel
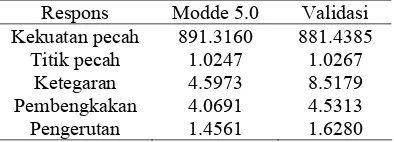
Konsentrasi alginat 0.83% dan glutaraldehida 4.00% hasil optimalisasi dari perangkat lunak Modde 5.0 kemudian diperiksa dengan melakukan validasi terhadap hasil yang diperoleh. Hasil validasi gel dapat dilihat pada Tabel 4. Dari hasil validasi dapat dilihat bahwa nilai seluruh respons sesuai dengan nilai Modde 5.0 kecuali untuk nilai ketegaran gel.
Tabel 4 Hasil validasi gel optimum
Respons Modde 5.0 Validasi
Kekuatan pecah 891.3160 881.4385
Titik pecah 1.0247 1.0267
Ketegaran 4.5973 8.5179
Pembengkakan 4.0691 4.5313 Pengerutan 1.4561 1.6280
Pembuatan Kurva Standar
Kurva standar ion Cu(II) diukur pada panjang gelombang 550 nm (Lampiran 8). Kurva standar untuk larutan Cu(II) memiliki linearitas yang tinggi yang ditunjukkan dengan nilai r2 yang hampir mendekati 1 (Gambar 14). Dari grafik diperoleh persamaan garis y = 0.0003x + 0.0115 dengan r2 = 99.82%.
Gambar 14 Hubungan antara absorbans dan konsentrasi CuSO4.5H2O
Adsorpsi Logam Oleh Gel Kitosan-Alginat
Adsorpsi ion Cu(II) oleh gel kitosan-alginat dilakukan pada kondisi pH 3 dan 6 (Data lengkap pada Lampiran 9 dan 10). Pemilihan nilai pH ini didasarkan pada kisaran nilai pH air limbah yang umum terdapat di perairan. Selain itu, untuk mencegah terbentuknya hidroksida logam yang mungkin terjadi pada pH tinggi. Nilai pH yang terlalu rendah juga dihindari untuk mencegah terjadinya persaingan antara proton dan ion logam. Konsentrasi logam yang digunakan untuk adsorpsi adalah 500 ppm dan 1000 ppm. Gambar 15 menunjukkan kapasitas adsorpsi maksimum (Q) gel kitosan-alginat terhadap ion Cu(II) pada pH 3 dan 6.
(b) (a)
(c)
C=N
0,00 0,05 0,10 0,15 0,20 0,25 0,30
0 200 400 600 800 1000 1200
Konsentrasi Cu (ppm)
Ab
s
o
rb
a
n
s
12
(a) (b)
Gambar 15 Hubungan antara waktu dan kapasitas adsorpsi maksimum pada (a) pH 3 dan (b) pH 6
Gambar 15 memperlihatkan bahwa kapasitas adsorpsi gel kitosan-alginat dipengaruhi oleh konsentrasi logam yang digunakan dengan pola yang relatif sama pada konsentrasi 500 ppm. Diperoleh bahwa kapasitas adsorpsi pada konsentrasi 1000 ppm lebih besar daripada 500 ppm. Dari Gambar 15, juga dapat disimpulkan bahwa jumlah ion Cu(II) yang teradsorpsi pada kondisi pH 3 lebih kecil daripada kondisi pH 6. Penyebabnya, pada kondisi asam (pH 3) jumlah ion H+ lebih besar sehingga persaingan antara ion H+ dan ion Cu(II) untuk berikatan dengan gugus amino kitosan menjadi lebih besar. Apalagi, ukuran ion H+ lebih kecil daripada ion Cu(II) sehingga lebih mudah berikatan dengan gugus amino kitosan.
Isoterm Adsorpsi
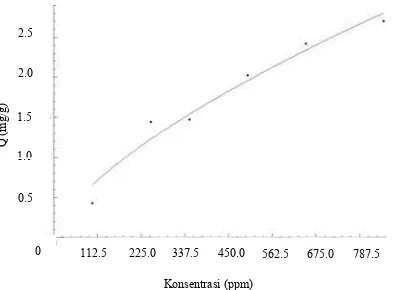
Pembuatan isoterm adsorpsi dilakukan pada pH 6 karena ion Cu(II) lebih banyak teradsorpsi pada kondisi pH tersebut. Gambar 16 dan 17 menunjukkan model isoterm adsorpsi ion Cu(II) pada pH 6.
Gambar 16 Isoterm adsorpsi Langmuir ion Cu(II)
Dari Gambar 16 dapat dilihat bahwa nilai kapasitas adsorpsi semakin bertambah dengan bertambahnya konsentrasi ion Cu(II). Hal ini disebabkan oleh konsentrasi yang tinggi meningkatkan jumlah ion Cu(II) dalam larutan sehingga ion Cu(II) yang teradsorpsi juga semakin besar. Penggunaan isoterm Langmuir, yaitu plot kapasitas adsorpsi terhadap konsentrasi menghasilkan nilai k1 dan k2 dari persamaan (2) berturut-turut sebesar 6.42 × 10-3 ± 8.87 × 10-4 dan 1.18 × 10-3 ± 3.88 × 10-4, dengan nilai linearitas 97.57%. Tetapan k1 dapat digunakan untuk menentukan jumlah yang teradsorpsi yang berhubungan dengan entalpi adsorpsi sedang- kan tetapan k2 dapat menggambarkan mutu adsorpsi yang berhubungan dengan kekuatan adsorben dalam mengikat adsorbat.
Gambar 17 Isoterm adsorpsi Freundlich ion Cu(II)
Dengan menggunakan isoterm Freundlich (Gambar 17), juga dapat dilihat bahwa semakin besar konsentrasi ion Cu(II), jumlah yang diadsorpsi akan semakin banyak. Nilai k
dan 1/n yang diperoleh [Persamaan (4)] berturut-turut adalah 2.94 × 10-2 ± 1.61 × 10-2 dan 1.48 ± 0.19, dengan nilai linearitas 96.18%. Tetapan k pada persamaan isoterm
0,0000 0,5000 1,0000 1,5000 2,0000 2,5000 3,0000 3,5000 4,0000 4,5000 5,0000
0 2 4 6 8 10 12 14 w aktu (menit)
Q ( m g/ g) Cu/1000 Cu/500 0,0000 0,5000 1,0000 1,5000 2,0000 2,5000 3,0000 3,5000 4,0000 4,5000 5,0000
0 2 4 6 8 10 12 14 w aktu (menit)
Q ( m g/ g) Cu/1000 Cu/500
112.5 225.0 337.5 450.0 562.5 675.0 787.5
Konsentrasi (ppm) 0 0.5 1.0 1.5 2.0 2.5 Q (mg/g)
112.5 225.0 337.5 450.0
Konsentrasi (ppm)
13
Freundlich digunakan untuk menentukan kapasitas adsorpsi sedangkan tetapan 1/n
merupakan energi yang dikeluarkan oleh permukaan gel kitosan-alginat saat mengadsorpsi logam. Berdasarkan data linearitas kedua kurva (Gambar 16 dan 17), dapat disimpulkan bahwa adsorpsi gel kitosan-alginat terhadap ion Cu(II) dapat terjadi melalui pola isoterm Langmuir maupun Freundlich.
SIMPULAN DAN SARAN
Simpulan
Sintesis gel kitosan-alginat dengan konsentrasi kitosan 2.50% memberikan nilai konsentrasi alginat dan glutaraldehida optimum berturut-turut sebesar 0.83% dan 4.00%. Gel optimum memberikan kekuatan, titik pecah, ketegaran, pembengkakan, dan pengerutan gel berturut-turut 881.4385 g cm-2, 1.0267 cm, 8.5179 g cm-1, 4.5313 g, dan 1.6280 g. Kondisi optimum diarahkan untuk aplikasi gel sebagai penjerap logam. Kapasitas adsorpsi ion Cu(II) lebih besar pada kondisi larutan logam pH 6 dan konsentrasi logam 1000 ppm dibandingkan dengan kondisi pH 3 dan konsentrasi logam 500 ppm. Isoterm adsorpsi Langmuir dan Freundlich dapat digunakan untuk adsorpsi ion Cu(II) oleh gel kitosan-alginat.
Saran
Perlu meragamkan konsentrasi kitosan yang digunakan sehingga dapat dilihat interaksi antara kitosan dengan alginat dalam penentuan nilai konsentrasi optimum. Selain itu, perlu dilakukan adsorpsi terhadap ion logam yang berbeda valensi sehingga dapat diketahui kemampuan menjerap dari gel
kitosan-alginat.
DAFTAR PUSTAKA
Aisyah IN. 2005. Pembengkakan hidrogel kitosan-polivinil alkohol [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
AOAC, Cunnif P, editor. 1999. Official Methods of Analysis of AOAC
International. 5th Revision. Volume 2.
Maryland: AOAC International.
Angalett SA. 1986. Evaluation of the Voland-Stevens LFRA texture analyzer for measuring the strength of pectin sugar jellies. J Texture Studies 17:87-96.
Bastaman S. 1989. Studies on degradation and extraction of chitin and chitosan from
prawn shell (Nephrops norvegious)
[tesis]. Belfast: The Department of Chemical Engineering, The Faculty of Engineering, The Queen’s University of Belfast.
Berger J et al. 2004. Structure and interactions in covalently and ionically crosslinked chitosan hydrogels for biomedical applications. Eur J of Pharmaceutics and Biopharmaceutics 57: 19-34.
Billmeyer. 1984. Textbook of Polymer
Science. Ed ke-3. New York: A Willey-Interscience Publications.
Bird T. 1993. Kmia Fisika Untuk Universitas.
Jakarta: Gramedia Pustaka Utama.
Cardenas A, Monal WA, Goycoolea FM, Ciapara IH, Peniche C. 2003. Diffusion through membranes of the polyelectrolyte complex of chitosan and alginate. Macromol Biosci 3:535-539.
Chaplin M. 2005. Alginate. London: South Bank University. http://chem.skku.ac. kr/~wkpark/tutor/mirror/www.martin.c haplin.btinternet.co.uk/hygua.html. [1 Desember 2005]
Fardiaz D. 1989. Hidrokoloid. Bogor: Pusat Antar Universitas Pangan dan Gizi, Institut Pertanian Bogor.
Guibal E, Milot C, Roussy J. 1997. Chitosan gel beads for metal ion recovery. European Chitin Society. France.
Ho YS et al. 2005. Regression analysis for the sorption isoterm of basic dyes on sugarcane dust. Taipei. Bioresource Technology 96: 1285-1291.
14
terhadap ion logam Pb2+, Cr6+, dan Ni2+ [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Khan TA, Peh KK, Ch’ng HS. 2002. Reporting degree of deacetylation values of chitosan: the influence of
analytical methods. J Pharm
Pharmaceut Sci 5:205-212.
Kustiani R. 2005. 25 Juni 2005. 11 Eksportir
Udang Diperiksa Amerika. Koran
Tempo: A22 (1-4).
Lindblad MS. 2003. Strategies for building polymers from renewable source: using prepolymers from steam treatment of wood and monomers from fermentation of agricultural products [Tesis]. Swedia: KTH Fibre and Polymer Technology, Royal Institute of Technology Stockholm.
Muhammad N, Parr J, Smith MD, Wheatley AD. 1998. Adsorption of heavy metal in slow sand filters. Proceedings of the 24th WEDC International Conference on Water Supply and Sanitation.
Durban, South Africa. 346-349.
Muzzarelli RAA, Peter MG, editor. 1997.
Chitin Handbook. Grotammare: European Chitin Society.
Nurdiani D. 2005. Adsorpsi logam Cu(II) dan Cr(VI) pada kitosan bentuk serpihan dan butiran [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Pope JP. 2004. Activated carbon and some application for the remediation of soil and groundwater pollution. http//www.cee.vt.edu/program_areas/e nvironmental/teach/gwprimer/group23. webpage.html. [8 Juni 2004].
Purwantiningsih. 1992. Isolasi kitin dan komposisi senyawa kimia limbah
udang windu (Panaeus monodon)
[tesis]. Bandung: Program Pasca- sarjana, Institut Teknologi Bandung.
Rahayu Sri. 2000. Mempelajari pengaruh pH,
penambahan CaCl2, dan alginat
terhadap karakteristik gel cincau hijau (Cyclea barbata L. Miers) [skripsi].
Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Schmuhl R et al. 2001. Adsorption of Cu(II) and Cr(VI) ions by chitosan: kinetics and equilibrium studies. Studies Water SA 27 (1).
Tarbojevich M, Cosani A. 1996. Molecular weight determination of chitin and chitosan. Di dalam Muzarelli RAA &
Peter MG (Editor) 1997. Chitin
Handbook. Grotammare: European Chitin Society 85-108.
Thatte MR. 2004. Synthesis and antibacterial assessment of water-soluble hydrophobic chitosan derivatives bearing quaternary ammonium functionality [disertasi]. India: The Louisiana State University.
11
16
Lampiran 1 Diagram alir sintesis kitin dan kitosan
Kulit udang
Deproteinasi NaOH 3.5% (b/v) dengan nisbah
1:20 (b/v), T = 65 oC, 2 jam.
Penyaringan, pencucian, dan pengeringan
Demineralisasi HCl 1 N dengan nisbah 1:20 (b/v),
suhu kamar, 2 jam.
Kitin
Deasetilasi NaOH 50% (b/v) dengan nisbah 1:20 (b/v), T = 100 o C, 4 jam
Kitosan
Penyaringan, pencucian, dan pengeringan
17
Lampiran 2 Diagram alir penelitian
Isolasi dan pencirian
Kitosan
Ukur: kadar air, kadar abu, derajat deasetilasi, dan bobot molekulnya
Pembuatan Gel
Optimalisasi
Gel Optimum
Pengerutan Pembengkakan
Penganalisis tekstur
FTIR
Studi adsorpsi logam Cu(II)
18
Lampiran 3 Data hasil pengukuran kadar air dan abu kitin dan kitosan, serta reologi gel kitosan-alginat
Kadar air dan abu kitin dan kitosan
Ulangan ke- Sampel Kadar air (%) Kadar abu (%)
1 kitin 9.3747 0.4160
2 kitin 8.1772 0.5349
3 kitin 8.0511 0.3756
Rata-rata 8.5343 0.4422
1 kitosan 4.2599 0.1396
2 kitosan 4.6189 0.2177
3 kitosan 8.7882 0.0999
Rata-rata 5.8890 0.1524
Data tinggi dan lebar kurva (cm) hasil pengukuran dengan penganalisis tekstur [Glutaraldehida]
4% 5% 6%
Ulangan
ke- [Alginat]
T L T L T L
1 2.438 1.213 3.775 1.395 4.175 1.023
2 2.063 1.083 4.813 0.740 4.974 0.865
3
0.00%
3.083 0.830 5.053 0.733 4.555 1.000
1 6.185 1.154 2.967 0.905 4.308 0.839
2 4.642 1.153 4.083 0.995 3.912 0.868
3
0.75%
4.167 1.121 6.515 0.922 6.055 0.936
1 4.770 1.142 4.858 0.872 4.642 0.935
2 3.312 1.035 4.895 0.877 5.523 0.808
3
1.00%
5.678 0.898 6.555 0.938 7.510 0.858
Keterangan: T = Tinggi kurva (cm) L = Lebar kurva (cm)
Data nilai kekuatan pecah (g/cm2) gel kitosan-alginat [Glutaraldehida]
Ulangan ke- [alginat]
4% 5% 6%
1 486.941 739.490 834.042
2 412.027 942.727 994.357
3
0.00%
615.792 989.741 909.954
1 1235.580 592.652 860.511
2 927.434 886.481 781.602
3
0.75%
832.376 1301.504 1209.610
1 952.905 970.385 927.434
2 661.573 977.876 1103.232
3
1.00%
1134.196 1309.495 1681.734
Data nilai titik pecah (cm) gel kitosan-alginat [Glutaraldehida]
Ulangan ke- [alginat]
4% 5% 6% 1.213 0.698 1.023 1.083 0.740 0.865 1
2 3
0.00%
0.830 0.733 1.000 1.154 0.905 0.839 1.153 0.995 0.868 1
2 3
0.75%
1.121 0.922 0.936
1 1.142 0.872 0.935
2 1.035 0.877 0.808
3
1.00%
19
Data nilai ketegaran (g/cm) gel kitosan-alginat [Glutaraldehida]
Ulangan ke- [alginat]
4% 5% 6% 2.010 5.469 4.086 1.906 6.493 5.750 1
2 3
0.00%
3.788 6.913 4.546 5.360 3.284 6.054 4.026 4.095 3.002 1
2 3
0.75%
3.725 7.070 4.306
1 4.175 5.568 4.966
2 3.200 5.588 6.836
3
1.00%
6.324 6.977 10.053
Data nilai pembengkakangel kitosan-alginat [Glutaraldehida]
4% 5% 6% Ulangan
ke- [alginat]
a b c a b c a b c 1.0633 4.1357 3.0724 0.9460 3.8816 2.9356 1.2088 7.9848 6.7760 0.9824 4.2152 3.2328 1.1460 5.1900 4.0440 1.4436 5.9973 4.5537 1
2 3
0.00%
1.1478 4.9845 3.8367 0.9066 3.3568 2.4502 1.1150 4.9019 3.7869 1.3539 6.1206 4.7667 1.2385 4.7335 3.4950 1.4544 4.0757 2.6213 1.8419 7.4919 5.6500 1.0949 3.7478 2.6529 1.4521 4.4463 2.9942 1
2 3
0.75%
1.8301 6.9387 5.1086 1.2389 4.1782 2.9393 1.0277 3.2471 2.2194
1 1.0951 4.7048 3.6097 1.4273 4.5717 3.1444 1.3262 4.4827 3.1565
2 1.5397 7.9143 6.3746 1.5345 4.9466 3.4121 1.3298 3.5818 2.2520
3
1.00%
1.7977 7.3074 5.5097 1.4896 4.7835 3.2939 1.5798 4.0500 2.4702 Keterangan: a = bobot gel awal (g)
b = bobot gel setelah direndam dalam bufer (g) c = selisih b-a
Data nilai pengerutangel kitosan-alginat [Glutaraldehida]
4% 5% 6% Ulangan
ke- [alginat]
a b c a b c a b c
1 0.00% 1.7976 0.5660 1.2316 1.9002 0.6880 1.2122 2.2304 0.4901 1.7403
2 2.2715 0.7398 1.5317 2.2366 0.7448 1.4918 1.7738 0.6569 1.1169
3 1.9403 0.7639 1.1764 1.8903 0.7030 1.1873 1.8608 0.5457 1.3151
1 0.75% 2.5650 0.7501 1.8149 2.4041 0.7195 1.6846 2.5693 0.9411 1.6282
2 2.7333 0.7579 1.9754 2.1144 0.6050 1.5094 2.3792 0.6419 1.7373
3 2.0403 0.5899 1.4504 2.0744 0.5186 1.5558 2.1073 0.8235 1.2838
1 1.00% 2.3036 0.6996 1.6040 2.0152 0.9365 1.0787 1.8648 0.7257 1.1391
2 2.0930 0.6360 1.4570 2.0495 0.8842 1.1653 2.6101 0.7008 1.9093
3 1.9385 0.7256 1.2129 2.2110 1.0044 1.2066 2.6004 0.4921 2.1083
Keterangan: a = bobot gel awal (g)
20
Lampiran 4 Spektrum FTIR dan derajat deasetilasi kitin dan kitosan
Spektrum FTIR kitin
Derajat deasetilasi kitin dihitung dengan persamaan:
A = log
P
P
0dimana: P0 = % transmitans pada garis-dasar
P = % transmitans pada puncak minimum
A = absorbans
% DD = 1 –
x
%
.
x
A
A
100
33
1
1
3450 1655
⎥
⎦
⎤
⎢
⎣
⎡
dimana: A1655 = absorbans pada bilangan gelombang 1655 cm -1 (serapan pita amida) A3450 = absorbans pada bilangan gelombang 3450 cm -1 (serapan gugus hidroksil)
A1655 = log
54
1
64
85
.
.
= 1.7452
A3450 = log
67
6
05
62
.
.
= 0.9686
% DD = 1 –
⎥⎦
⎤
⎢⎣
⎡
33
1
1
7452
1
9686
0
.
x
.
.
× 100 % = 58.27%
P Po
Po
21
Spektrum FTIR kitosan
Derajat deasetilasi kitosan juga dihitung dengan persamaan yang sama
A1655 = log
5
24
0
83
.
.
= 0.5299
A3450 = log
0
3
0
97
.
.
= 1.5096
% DD = 1 –
⎢⎣
⎡
⎥⎦
⎤
33
1
1
5096
1
5299
0
.
x
.
.
× 100 % = 73.61%
Po
P P
22
Lampiran 5 Penentuan bobot molekul kitosan
Waktu alir larutan kitosan
Konsentrasi Waktu alir (detik) Rata-rata
0.00 61 61.67
62 62
0.02 68 68.67
69 69
0.04 82 82.67
83 83
0.06 86 86.67
87 87 0.08 93 93.67 94 94
Bobot molekul kitosan dihitung dengan menggunakan persamaan Mark-Houwink: Viskositas relatif ηr = η/ηo≅t/to
Viskositas spesifik ηsp =ηr -1 Viskositas intrinsik [η] = (ηsp/c)c=0
ηsp/c = [η] + k’[η]2c, dengan k’ 0.3–0.7 [η] = KMa, dengan K = 3.5 x 10-4 dan a = 0.76
t = waktu alir zat
t0 = waktu alir pelarut
η = viskositas zat
η0 = viskositas pelarut
M = bobot molekul zat
c = konsentrasi larutan
Dengan menggunakan mode regresi linear diperoleh persamaan
ηsp/c = [η] + k’[η]2 c sama dengan y = 6.68875 + 3.3625x Jadi [η] = 6.68875
[η] = KMa, maka 6.68875 = 3.5 × 10-4 × M0.76
23
Lampiran 6 Grafik tiga dimensi hubungan glutaraldehida dengan alginat terhadap sifat reologi gel
Hubungan antara glutaraldehida dan alginat dalam gel terhadap kekuatan gel
24
Hubungan antara glutaraldehida dan alginat dalam gel terhadap ketegaran gel
25
26
Lampiran 7 Data hasil uji ANOVA dan koefisien kuadratik
Uji ANOVA untuk kekuatan pecah gel kitosan-alginat
Source DF SS MS F P SD
(variance)
Total 27 2,5589e+007 947742
Constant 1 2,36539e+007 2,36539e+007
Total Corrected 26 1,93512e+006 74427,6 272,814
Regression 3 612470 204157 3,55015 0,030 451,837
Residual 23 1,32265e+006 57506,4 239,805
N = 27 Q2 = 0.143 Cond. no. = 5,0866
DF = 23 R2 = 0.317 Y-miss = 0
R2 Adj. = 0.227 RSD = 239,8050
Uji ANOVA untuk titik pecah gel kitosan-alginat
Source DF SS MS F P SD
(variance)
Total 27 25,2679 0,935849
Constant 1 24,6992 24,6992
Total Corrected 26 0,568699 0,021873 0,147895
Regression 3 0,0815052 0,0271684 1,2826 0,304 0,164828
Residual 23 0,487194 0,0211823 0,145542
N = 27 Q2 = 0.000 Cond. no. = 5,0866
DF = 23 R2 = 0.143 Y-miss = 0
R2 Adj. = 0.032 RSD = 0,1455
Uji ANOVA untuk ketegaran gel kitosan-alginat
Source DF SS MS F P SD
(variance)
Total 27 731,945 27,1091
Constant 1 634,044 634,044
Total Corrected 26 97,9009 3,76542 1,94047
Regression 3 15,8945 5,29816 1,48595 0,245 2,30177
Residual 23 82,0065 3,5655 1,88825
N = 27 Q2 = 0.000 Cond. no. = 5,0866
DF = 23 R2 = 0,162 Y-miss = 0
R2 Adj. = 0.053 RSD = 1,8883
Uji ANOVA untuk pembengkakan gel kitosan-alginat
Source DF SS MS F P SD
(variance)
Total 27 472,845 17,5128
Constant 1 406,428 406,428
Total Corrected 26 66,4174 2,55451 1,59828
Regression 3 4,84596 1,61532 0,603403 0,619 1,27095
Residual 23 61,5714 2,67702 1,63616
N = 27 Q2 = 0.000 Cond. no. = 5,0866
DF = 23 R2 = 0,073 Y-miss = 0
27
Uji ANOVA untuk pengerutan gel kitosan-kitosan
Source DF SS MS F P SD
(variance)
Total 27 61,3705 2,27298
Constant 1 59,2951 59,2951
Total Corrected 26 2,07541 0,0798234 0,28253
Regression 3 0,195679 0,0652264 0,798097 0,508 0,255395
Residual 23 1,87973 0,0817274 0,28588
N = 27 Q2 = 0.070 Cond. no. = 5,0866
DF = 23 R2 = 0.094 Y-miss = 0
R2 Adj. = -0,024 RSD = 0.2859
Uji koefisien kuadratik untuk kekuatan pecah gel kitosan-alginat
Source Coeff. SC. Std. Err. P Conf. int (± )
Constant 983,052 108,435 4,70313e-009 224,312
Alg 84,0158 70,7056 0,246861 146,264
Glut 105,321 47,0296 0,0350886 97,2871
alg*alg -48,8751 101,898 0,636006 210,789
N = 27 Q2 = 0.143 Cond. no. = 5,0866
DF = 23 R2 = 0.317 Y-miss = 0
R2 Adj. = 0.227 RSD = 239,8050
Conf. lev. = 0,95
Uji koefisien kuadratik untuk titik pecah gel kitosan-alginat
Source Coeff. SC. Std. Err. P Conf. int (± )
Constant 0,986753 0,0658108 2,30767e-013 0,136138
Alg -0,014561 0,0429123 0,737448 0,0887699
Glut -0,054043 0,028543 0,0709546 0,0590451
alg*alg -0,0314747 0,0618433 0,615641 0,127931
N = 27 Q2 = 0,000 Cond. no. = 5,0866
DF = 23 R2 = 0,143 Y-miss = 0
R2 Adj. = 0,032 RSD = 0,1455
Conf. lev. = 0,95
Uji koefisien kuadratik untuk ketegaran gel kitosan-alginat
Source Coeff. SC. Std. Err. P Conf. int (± )
Constant 4,98687 0,853828 5,95184e-006 1,76626
Alg 0,414784 0,556744 0,463807 1,1517
Glut 0,60503 0,370317 0,115913 0,76605
alg*alg -0,146354 0,802353 0,856862 1,65978
N = 27 Q2 = 0,000 Cond. no. = 5,0866
DF = 23 R2 = 0,162 Y-miss = 0
R2 Adj. = 0,053 RSD = 1,8883
28
Uji koefisien kuadratik untuk pembengkakan gel kitosan-alginat
Source Coeff. SC. Std. Err. P Conf. int (± )
Constant 3,7099 0,739837 4,49988e-005 1,53045
Alg -0,238856 0,482415 0,625208 0,99794
Glut -0,265837 0,320877 0,415919 0,663778
alg*alg 0,176441 0,695234 0,801917 1,43819
N = 27 Q2 = 0,000 Cond. no. = 5,0866
DF = 23 R2 = 0,073 Y-miss = 0
R2 Adj. = -0,048 RSD = 1,6362
Conf. lev. = 0,95
Uji koefisien kuadratik untuk pengerutan gel kitosan-alginat
Source Coeff. SC. Std. Err. P Conf. int (± )
Constant 1,53869 0,129269 2,59814e-011 0,26741
Alg 0,0463741 0,0842906 0,587507 0,174366
Glut 0,0294892 0,0560657 0,60394 0,115979
alg*alg -0,0589481 0,121476 0,632077 0,251289
N = 27 Q2 = 0,070 Cond. no. = 5,0866
DF = 23 R2 = 0,094 Y-miss = 0
R2 Adj. = -0,024 RSD = 0,2859
29
Lampiran 8 Kurva adsorpsi pada penentuan panjang gelombang maksimum larutan CuSO4.5H2O
Lampiran 9
Kapasitas adsorpsi maksimum larutan ion logam Cu(II) pada pH 3
Q (mg/g)
waktu logam Cu(II)
(menit) 1000 ppm 500 ppm
gel kitosan-alginat gel kitosan-alginat
2 3.0458 1.4277
4 3.5845 2.0570
6 4.1918 2.8984
8 4.2985 3.0529
10 4.7146 3.0688
12 4.4468 3.3334
Lampiran 10 Kapasitas adsorpsi maksimum larutan ion logam Cu(II) pada pH 6
Q (mg/g)
waktu logam Cu(II)
(menit) 1000 ppm 500 ppm
gel kitosan-alginat gel kitosan-alginat
2 1.5016 1.0435
4 1.7293 2.2944
6 2.2000 2.8006
8 4.4765 2.8853
10 4.1107 3.2070
12 4.1796 2.7171
λ
maksimum
0,000 0,005 0,010 0,015 0,020 0,025 0,030 0,035 0,040 0,045 0,050 0,055 0,060 0,065 0,070 0,075 0,080
0 50 100 150 200 250 300 350 400 450 500 550 600
Panjang gelombang (nm)
Ab
so
rb
a
n