AKTIVITAS KITINASE, PEROKSIDASE DAN
ANTICENDAWAN IN VITRO DARI EKSTRAK PROTEIN
TANAMAN TRICHOSANTHES (CUCURBITACEAE)
DEWI SUKMA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SURAT PERNYATAAN
MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa segala pernyataan dalam disertasi
yang berjudul :
AKTIVITAS KITINASE, PEROKSIDASE DAN ANTICENDAWAN IN VITRO DARI EKSTRAK PROTEIN TANAMAN TRICHOSANTHES
(CUCURBITACEAE)
adalah benar-benar karya saya sendiri dengan arahan komisi pembimbing, bukan
hasil jiplakan atau tiruan serta belum pernah diajukan dalam bentuk apapun untuk
memperoleh gelar program sejenis di perguruan tinggi manapun. Sumber
informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak
diterbitkan dari penulis lain
Bogor, Juli 2008
Dewi Sukma
iii ABSTRACT
DEWI SUKMA. Chitinase, Peroxidase and In Vitro Antifungal Activities of Protein Extract of Trichosanthes (Cucurbitaceae). Supervised by : ROEDHY
POERWANTO as the chairman, SUDARSONO, NURUL KHUMAIDA, I MADE ARTIKA and SURYO WIYONO as the member of advisory commitee.
Trichosanthes is a genus of Cucurbitaceae. Some species of this genus were reported containing bioactive protein such as Ribosome Inactivating Protein
and chitinase. Studies on peroxidase were not much reported on these plants. The research was carried out to : 1) study morphology, growth, development, pest and disease of 3 Trichosanthes species 2) analyze chitinase and peroxidase activities from T. tricuspidata dan T. cucumerina var. anguina, 3) analyzed the effect of salicylic acid (SA) and etefon (ETF) on the chitinase and peroxidase activities, 4) evaluate in vitro antifungal activity of crude protein extract of Trichosanthes.
The first part of the research showed the differences of morphological characters and growth habit of T. cucumerina var. anguina, T. tricuspidata and
T. quinquangulata. T. cucumerina live as annual while the two others species lived as perennial plants. T. cucumerina var. anguina had more problem of pest and disease than T. tricuspidata and T. quinquangulata.
The second part of the research described the biochemical characters for
chitinase and peroxidase activities from some tissues of T. tricuspidata and
T. cucumerina var. anguina. T. tricuspidata had the highest chitinase activity in crude protein extract of in vitro shoots, calli and plant roots and peroxidase activity in plant roots grown in field. T. cucumerina var. anguina had the highest chitinase and peroxidase activities in crude protein extract of plant roots grown in field and calli. Roots of T. cucumerina var. anguina showed the highest chitinase activity in seedling, young and mature plants follow by stem and leaves.
The fourth part of the research showed that chitinase and peroxidase activities of calli crude protein extract of T. tricuspidata could be increased by SA. Adversely, ETF decreased the peroxidase activity of calli crude protein exract of T. tricuspidata. In T. cucumerina var. anguina, SA could not increase the chitinase activity but increase the peroxidase activity in crude protein exract of calli and plant roots grown in field.
The fifth part of the research showed that in spore germination assay, the crude protein from in vitro shoots of T. tricuspidata could inhibited the spore germination of Fusarium sp. from T. cucumerina var. anguina, Fusarium
oxysporum from shallot, Puccinia arachidis from peanut and Pseudoperonospora cubensis from cucumber. The protein could not inhibit spore germination of
Curvularia eragrostidis. The leaves and roots crude protein extract of
T. tricuspidata and the leaves, stem and roots protein extract from T. cucumerina
var. anguina inhibited the hypha growth of Helmithosporium tursicum in radial growth inhibition assay. Crude root protein extract of T. tricuspidata showed greater inhibition on hypa growth than leaves. In T. cucumerina var. anguina, crude protein extract from stem resulted greater inhibition on hypha growth of
RINGKASAN
DEWI SUKMA. Aktivitas Kitinase, Peroksidase dan Anticendawan In Vitro dari Ekstrak Protein Tanaman Trichosanthes (Cucurbitaceae). Komisi Pembimbing : ROEDHY POERWANTO (Ketua), SUDARSONO, NURUL KHUMAIDA, I MADE ARTIKA, SURYO WIYONO (Anggota).
Trichosanthes merupakan salah satu genus dari famili Cucurbitaceae. Beberapa spesies dari genus ini menghasilkan protein bioaktif seperti Ribosome Inactivating Protein dan kitinase. Studi tentang peroksidase belum banyak di laporkan pada tanaman ini. Penelitian ini bertujuan untuk : 1) mempelajari morfologi, pertumbuhan, perkembangan, hama dan penyakit dari 3 spesies
Trichosanthes, 2) menganalisis aktivitas enzim kitinase dan peroksidase dalam ekstrak kasar protein dari jaringan tanaman T. tricuspidata dan T. cucumerina var.
anguina, 3) menganalisis pengaruh perlakuan senyawa indusersalicylic acid (SA) dan etefon (ETF) terhadap aktivitas enzim kitinase dan peroksidase dalam ekstrak kasar protein dalam jaringan tanaman T. tricuspidata dan T. cucumerina var.
anguina serta 4) mengevaluasi aktivitas anticendawan secara in vitro dari ekstrak kasar protein dari jaringan tanaman T. tricuspidata dan T. cucumerina var.
anguina.
Bagian pertama dari hasil penelitian menunjukkan perbedaan morfologi dari T.cucumerina var. anguina, T. tricuspidata, dan T. quinquangulata. Perbedaan lain juga terlihat pada kebiasaan hidup (annual/perenial) dan gejala kerusakan karena serangan hama dan penyakit. T. cucumerina var. anguina
menghadapi lebih banyak masalah hama dan penyakit dibanding T. tricuspidata
dan T. quinquangulata.
Bagian kedua dari penelitian menunjukkan karakter biokimia berupa aktivitas kitinase dan peroksidase pada ekstrak kasar protein dari beberapa jaringan tanaman Trichosanthes. Ekstrak kasar protein dari tunas in vitro T. tricuspidata, kalus dan akar tanaman dari lapang memiliki aktivitas kitinase lebih tinggi dibanding daun. Aktivitas peroksidase paling tinggi ditemukan pada ekstrak kasar protein akar tanaman dari lapang. Pada T. cucumerina var. anguina
aktivitas kitinase dan peroksidase paling tinggi ditemukan pada ekstrak kasar protein dari akar tanaman dari lapang dan kalus in vitro. Uji aktivitas kitinase dan peroksidase juga dilakukan pada ekstrak kasar protein dari akar, batang dan daun tanaman T. cucumerina var. anguina dari lapang yang berumur 3 Minggu Setelah Berkecambah (MSB), tanaman berumur 1 bulan setelah penanaman (1 BST) dan tanaman berumur 2 bulan setelah penanaman di polibag (2 BST). Hasil pengujian menunjukkan bahwa aktivitas kitinase dan peroksidase pada T. cucumerina var.
anguina paling tinggi pada ekstrak kasar protein akar, diikuti oleh batang dan daun dan cenderung meningkat dengan bertambahnya umur tanaman. Akar juga menunjukkan aktivitas kitinase dan peroksidase yang tinggi pada bibit, tanaman muda dan tanaman dewasa.
Pada bagian ketiga dari penelitian ditemukan bahwa pada tanaman
v dan peroksidase pada ekstrak kasar protein dari kalus in vitro. Sementara perlakuan ETF dapat meningkatkan aktivitas kitinase dari ekstrak kasar protein kalus T. tricuspidata namun menekan aktivitas peroksidase. Pada T. cucumerina
var. anguina, SA tidak dapat meningkatkan aktivitas kitinase pada tanaman di lapang maupun pada kalus in vitro. Sebaliknya SA dapat meningkatkan aktivitas peroksidase pada akar tanaman T. cucumerina var. anguina di lapangan dan juga pada kalus in vitro.
Pada bagian ke empat dari penelitian ditemukan bahwa pada pengujian aktivitas anticendawan dengan uji perkecambahan spora, ekstrak kasar protein dari tunas in vitro T. tricuspidata dapat menghambat perkecambahan spora beberapa cendawan patogen tanaman yaitu Fusarium sp. dari tanaman T. cucumerina, Fusarium oxysporum dari bawang merah, Puccinia arachidis dari kacang tanah dan Pseudoperonospora cubensis dari ketimun. Namun protein tersebut tidak dapat menghambat perkecambahan spora Curvularia eragrostidis
dari anggrek Dendrobium. Pada uji penghambatan pertumbuhan hifa, esktrak kasar protein dari daun dan akar tanaman T. tricuspidata menunjukkan penghambatan terhadap pertumbuhan hifa cendawan Helminthosporium turcicum.. Ekstrak protein dari akar menunjukkan efek penghambatan yang lebih
besar terhadap pertumbuhan hifa cendawan dibanding protein daun. Pada
T. cucumerina var. anguina, ekstrak protein dari batang menunjukkan penghambatan yang lebih besar terhadap pertumbuhan hifa cendawan
©Hak cipta milik Institut Pertanian Bogor, tahun 2008 Hak cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
vii
AKTIVITAS KITINASE, PEROKSIDASE DAN
ANTICENDAWAN IN VITRO DARI EKSTRAK PROTEIN
TANAMAN TRICHOSANTHES (CUCURBITACEAE)
DEWI SUKMA
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor
pada Program Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Aktivitas Kitinase, Peroksidase dan Anticendawan In Vitro dari Ekstrak Protein Tanaman Trichosanthes (Cucurbitaceae)
Nama : Dewi Sukma
Nomor Pokok : A361030031 Program Studi : Agronomi
Disetujui,
Komisi Pembimbing
Prof. Dr. Ir. H. Roedhy Poerwanto, MSc. Ketua
Prof. Dr. Ir. H.Sudarsono, MSc. Dr. Ir. I Made Artika, MApp.Sc.
Anggota Anggota
Dr. Ir. Nurul Khumaida, MS. Dr. Ir. Suryo Wiyono, MSc.Agr
Anggota Anggota
Diketahui,
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. H. Munif Ghulamahdi, MS. Prof. Dr. Ir. Khairil A.Notodiputro, MS
ix
PRAKATA
Bismillaahirrahmanirrahiim. Puji dan syukur penulis sampaikan ke hadirat ALLAH SWT atas segala karunia dan petunjuk-NYA, sehingga penelitian
dan penulisan disertasi ini dapat diselesaikan. Salawat dan Salam semoga
senantiasa tercurah kepada Nabi Muhammad SAW. pembawa cahaya dan
petunjuk bagi kehidupan umat manusia hingga akhir zaman.
Disertasi dengan judul ”Aktivitas Kitinase, Peroksidase dan Anticendawan In Vitro dari Ekstrak Protein Tanaman Trichosanthes (Cucurbitaceae)” disusun berdasarkan percobaan-percobaan yang dilakukan di lapangan, di laboratorium Bioteknologi Tanaman Departemen Agronomi dan
Hortikultura, dan di Laboratorium Klinik Tanaman Departemen Proteksi
Tanaman, IPB.
Disertasi ini dapat diselesaikan atas kerjasama dan bantuan berbagai pihak.
Oleh karena itu, penghargaan dan ungkapan terimakasih yang sebesar-besarnya
penulis sampaikan kepada ketua komisi pembimbing Prof. Dr. Ir. H. Roedhy
Poerwanto, MSc., yang telah memberikan bimbingan dan arahan dalam
pelaksanaan penelitian dan penulisan disertasi. Ungkapan penghargaan dan
terimakasih juga penulis sampaikan kepada anggota komisi pembimbing : Prof.
Dr. Ir. H. Sudarsono, MSc., Dr. Ir. Nurul Khumaida, MS., Dr. Ir. I Made Artika,
Mapp.Sc., dan Dr. Ir. Suryo Wiyono, MSc.Agr., yang telah banyak membimbing,
mengarahkan dan memberi masukan dalam pelaksanaan penelitian dan penulisan
disertasi ini. Terimakasih yang sebesar-besar-besarnya penulis sampaikan kepada
Dr.Ir. Sandra A. Azis, MS dan Dr.Ir. Rugayah yang telah berkenan menjadi
penguji luar komisi pada sidang terbuka.
Berbagai pihak juga telah banyak berperan sehingga penelitian dan
penulisan disertasi dapat diselesaikan. Karena itu ungkapan terimakasih penulis
sampaikan kepada :
1. Departemen Pendidikan Nasional yang telah memberikan beasiswa BPPS
dan biaya penelitian melalui Program Hibah Bersaing, sehingga penulis
dapat menyelesaikan Program S3 di Institut Pertanian Bogor dan
2. Rektor Institut Pertanian Bogor, Dekan dan Wakil Dekan Fakultas
Pertanian, Ketua Departemen Agronomi dan Hortikultura, IPB, Kepala
Bagian Bioteknologi Tanaman Departemen Agronomi dan Hortikultura
atas ijin dan dukungan yang diberikan sehingga penulis dapat menjalankan
penelitian dan menyelesaikan penulisan disertasi ini dengan baik.
3. Staf Pengajar Program Studi Agronomi, Sekolah Pascasarjana, IPB yang
telah memberikan ilmu selama penulis mengambil kuliah untuk program
S3 di IPB.
4. Dr. Ir. Widodo, MSc. Yang telah mengijinkan penulis melaksanakan
pengujian aktivitas anticendawan di Klinik Tanaman, Departemen Proteksi
Tanaman IPB.
5. Dr. Ir. Agus Purwito, MSc. dan Dr. Ir. Satriyas Ilyas, MSc. yang telah
menguji penulis pada ujian Prakualifikasi Program Doktor.
6. Dr. Ir. Darda Efendi, MS selaku dosen penguji luar komisi pada sidang
ujian tertutup.
7. Staf Pengajar Departemen Agronomi dan Hortikultura yang telah banyak
memberikan bantuan, kerjasama dan dukungan dalam pelaksanaan tugas
penulis sebagai staf pengajar dan juga pengertian selama penulis
menyelesaikan disertasi.
8. Bapak/Ibu dan Rekan-Rekan yang selalu memberikan dukungan, semangat
dan bantuan bagi penulis selama pelaksanaan penelitian dan penulisan
disertasi, yaitu : Prof. Dr. Ir. Sri Setyati Harjadi, Dr. Sandra A. Azis,
Dr. Trikoesoemaningtyas, Dr. Darda Efendi, Dr. Winarso D. Widodo, Dr.
Adiwirman, Dr. Syarifah Iis Aisyah, Dr. M. Syukur, Dr. Rahmi Yunianti,
Dr. Desta Wirnas, Ir. Ketty Suketi, MS., Ir. Supijatno, MS., Ir. Diny
Dinarti, MS., Ir. Ani Kurniawati, MS., Evi T. Tondok, SP, MSc., Juang
Gema Kartika, SP., dan berbagai pihak yang tidak dapat disebutkan satu
per satu dalam tulisan ini.
9. Rekan-rekan di Laboratorium dan pegawai Departemen Agronomi dan
Hortikultura IPB : Mbak Juju, Mbak Iip, Bu Ika, Mbak Pepi, Mbak Emi,
Susi, Mas Agus, Bu Jun, Saiful, Pak Kohar, Pak Khaerudin dan berbagai
xi 10.Terimakasih yang khusus dan mendalam penulis sampaikan kepada kedua
orang tua penulis : Bapak Mukhtar Syarif Dt. Mudo Nan Panjang, Ibu
Rasima Ali atas kasih sayang, perjuangan dan doanya dalam membesarkan
dan mendidik penulis.
11.Terimakasih kepada Bapak dan Ibu Mertua (Bapak Abdul Samad [alm]
dan Ibu Soeparti, yang telah mendidik dan memberikan suami yang baik
bagi penulis.
12.Terimakasih yang sebesar-besarnya kepada suami tercinta Ir. Susilan
Hidayat serta ananda M. Imam Adi Wicaksana dan M. Fajar Ash
Shiddieqy yang telah melengkapi dan memberikan kebahagian bagi
kehidupan penulis dan atas segala pengertian, pengorbanan dan
kesabarannya selama penulis menyelesaikan studi S3 ini.
13.Rasa terimakasih juga penulis sampaikan kepada kakak-kakak Penulis
Deswita dan Holdani, Mas Budi, Mas Damar, Mas Pras, Mas Guntur,
Mbak Sri, adek-adek Elda dan Yat, beserta keluarga, mamanda Sofyan Ali
Dt. Reno Bijayo nan Panjang, serta kepada Umi Sartini dan Mamanda
Ratius, Umi Harnelis dan Pak Etek Unin serta sanak famili lainnya yang
tidak dapat disebutkan satu per satu dalam tulisan ini.
14.Terimakasih kepada berbagai pihak yang telah membantu pelaksanaan dan
penyelesaian disertasi Penulis yang tidak dapat disebutkan satu persatu
dalam tulisan ini.
Semoga bimbingan, bantuan, dukungan dan doa dari berbagai pihak akan
menjadi amal baik dan mendapatkan balasan yang berlipat ganda dari Allah
SWT. Akhir kata, semoga tulisan ini bermanfaat bagi pengembangan dan
kemajuan ilmu pengetahuan dan bagi kehidupan kita bersama. Amin
Bogor, Juli 2008
RIWAYAT HIDUP
Penulis dilahirkan di Payakumbuh, Sumatera Barat pada tanggal 4 April
1970 dari pasangan Mukhtar Syarif Dt. Mudo nan Panjang dan Ibu Rasima Ali,
sebagai anak ketiga dari 5 bersaudara. Pada tahun 1997 penulis menikah dengan
Ir. Susilan Hidayat dan dikaruniai dua orang anak Muhammad Imam Adi
Wicaksana (10 tahun) dan Muhammad Fajar Ash Shiddieqy (5 tahun).
Pendidikan dasar diselesaikan tahun 1983 di SDN 1 Andalas. Pendidikan
menengah pertama diselesaikan pada tahun 1986 di SMPN 2 Payakumbuh dan
menengah atas di SMAN 3 Payakumbuh pada tahun 1989. Pada tahun 1989
penulis diterima di Institut Pertanian Bogor melalui jalur USMI. Pendidikan
Sarjana diselesaikan pada tahun 1994 di Jurusan Budidaya Pertanian, Fakultas
Pertanian IPB. Tahun 2001 penulis menyelesaikan Program S2 di Program Studi
Agronomi, Sekolah Pasca Sarjana IPB. Sejak tahun 1997 sampai sekarang penulis
aktif sebagai Staf Pengajar di Jurusan Budidaya Pertanian (sekarang Departemen
xiii DAFTAR ISI
Hal
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xx
BAB I. PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 4
Kerangka Berpikir dan Garis Besar Disertasi ... 4
BAB II. TINJAUAN PUSTAKA ... 10
Trichosanthes ..... 10
Cendawan ... 11
Protein Anticendawan... 13
Kitinase.... ... 17
Peroksidase ... 20
Asam Salisilat ... 21
Etilen ... ... 23
BAB III. MORFOLOGI, PERTUMBUHAN, PERKEMBA-NGAN, HAMA DAN PENYAKIT 3 SPESIES TRICHOSANTHES ... 26 Abstrak ... 26
Abstract ... 27
Pendahuluan.... ... 28
Bahan dan Metode. ... 29
Hasil ... ... 30
Pembahasan ... 43
Simpulan ... 44
Abstract ... 47
Pendahuluan.... ... 48
Bahan dan Metode. ... 49
Hasil ... ... 52
Pembahasan ... 58
Simpulan ... 60
BAB V. AKTIVITAS KITINASE DAN PEROKSIDASE DARI BERBAGAI JARINGAN DAN TINGKAT PERKEM-BANGAN TANAMAN T. cucumerina var. anguina .... 61 Abstrak ... 61
Abstract ... 62
Pendahuluan.... ... 63
Bahan dan Metode. ... 64
Hasil ... 66
Pembahasan ... 76
Simpulan ... 79
BAB VI. INDUKSI AKTIVITAS KITINASE DAN PEROKSI-DASE PADA 2 SPESIES TRICHOSANTHES ... 81 Abstrak ... 81
Abstract ... 82
Pendahuluan.... ... 83
Bahan dan Metode. ... 84
Hasil ... ... 89
Pembahasan ... 106
Simpulan ... 112
BAB VII. AKTIVITAS ANTICENDAWAN IN VITRO DARI EKSTRAK KASAR PROTEIN TANAMAN TRICHOSANTHES ... 114 Abstrak ... 114
Abstract ... 115
xv
Bahan dan Metode. ... 118
Hasil ... 122
Pembahasan ... 135
Simpulan ... 138
BAB VIII. PEMBAHASAN UMUM... 139
BAB IX. SIMPULAN UMUM DAN SARAN ... 145
Simpulan Umum ... 145
Saran ... 147
BAB X. DAFTAR PUSTAKA ... 148
DAFTAR TABEL
No Judul Halaman
1 Rataan ukuran buah dan benih T. cucumerina var.
anguina, T. tricuspidata dan T. quinquangulata ...
32
2. Ringkasan karakter morfologi buah T. cucumerina var.
anguina, T. quinquangulata, T. tricuspidata ………..
32
3. Pertumbuhan tanaman Trichosanthes hingga 3 minggu setelah tanam di lapang………..
39
4. Keberhasilan menginduksi pembentukan kalus dalam berbagai media MS dengan penambahan berbagai konsentrasi NAA dan BA ...
53
5. Rataan bobot kalus pada 4 MST dari berbagai komposisi media MS dengan penambahan berbagai konsentrasi NAA dan BA ………..
53
6. Nilai total protein terlarut dan kadar protein pada ekstrak kasar protein dari berbagai jaringan tanaman
T. tricuspidata ...
55
7. Aktivitas kitinase pada ekstrak kasar protein dari berbagai jaringan tanaman T. tricuspidata ...
56
8. Aktivitas peroksidase pada ekstrak kasar protein dari berbagai jaringan tanaman T. tricuspidata ...
57
9. Rataan bobot kalus T. cucumerina var. anguina pada 4 MST dari berbagai komposisi media MS dengan penambahan berbagai konsentrasi NAA dan BA ...
66
10. Rataan total protein terlarut dan kadar protein dari kalus in vitro, daun dan akar tanaman dari lapang tanaman
T. cucumerina var. anguina ………...
68
11. Rataan aktivitas kitinase per mg protein dan per gram bobot segar berbagai jaringan tanaman T. cucumerina
var. anguina ...
69
12. Rataan aktivitas peroksidase per mg protein dan per gram bobot segar berbagai jaringan tanaman T. cucumerina
var. anguina ...
xvii
No Judul Halaman
13. Rataan total protein terlarut dan kadar protein jaringan pada daun, akar dan batang tanaman T. cucumerina var.
anguina dari berbagai umur………
72
14. Rataan aktivitas kitinase pada ekstrak protein daun, akar dan batang tanaman T. cucumerina var. anguina dari berbagai umur………..
73
15. Rataan aktivitas enzim peroksidase dari ekstrak kasar protein total dari akar, batang dan daun tanaman T. cucu-merina var. anguina pada berbagai umur tanaman ……….
75
16. Rataan total protein terlarut dan kadar protein jaringan pada ekstrak kasar protein dari akar tanaman T. tricus-pidata yang diberi perlakuan SA...
89
17. Rataan total protein terlarut dan kadar protein jaringan pada ekstrak kasar protein dari akar tanaman
T. tricuspidata yang diberi perlakuan SA...
90
18. Rataan total protein terlarut dan kadar protein jaringan pada ekstrak kasar protein dari akar tanaman T. tricus-pidata pada 2 dan 9 HSP SA ………...
90
19. Rataan aktivitas kitinase dan peroksidase pada ekstrak kasar protein dari akar tanaman T. tricuspidata yang diberi perlakuan SA...
91
20. Rataan aktivitas peroksidase pada ekstrak kasar protein dari akar tanaman T. tricuspidata yang diberi perlakuan SA pada 2 dan 9 HSP...
92
21. Rataan total protein terlarut (TPT) pada ekstrak kasar protein dari tanaman T. cucumerina yang diberi perlakuan SA...
93
22. Rataan kadar protein jaringan (KPJ) pada ekstrak kasar protein dari tanaman T. cucumerina yang diberi perlakuan SA...
94
23. Rataan aktivitas kitinase per mg protein pada ekstrak kasar protein dari tanaman T. cucumerina yang diberi perlakuan SA...
95
24. Rataan aktivitas kitinase per g BS jaringan tanaman
T. cucumerina var. anguina yang diberi perlakuan SA...
No Judul Halaman 25. Rataan aktivitas kitinase per g BS jaringan pada pengaruh
interaksi antara waktu dan jenis jaringan T. cucumerina
var. anguina yang diberi perlakuan SA...
97
26. Rataan aktivitas peroksidase per mg protein pada ekstrak kasar protein dari tanaman T. cucumerina var. anguina
yang diberi perlakuan SA...
98
27. Rataan aktivitas peroksidase per g BS jaringan tanaman dari T. cucumerina var. anguina yang diberi perlakuan SA...
99
28. Rataan TPT dan aktivitas kitinase pada ekstrak kasar protein dari tunas in vitro T. tricuspidata yang diberi perlakuan SA 0.00 dan 0.05 mM ...
100
29. Rataan TPT, aktivitas kitinase dan peroksidase pada ekstrak kasar protein tunas in vitro T. tricuspidata dengan SA 0.00 dan 0.025 mM...
100
30. Rataan TPT, aktivitas kitinase dan peroksidase pada ekstrak kasar protein dari kalus in vitro T. tricuspidata
yang diberi perlakuan SA...
101
30. Rataan TPT, aktivitas kitinase dan peroksidase pada ekstrak kasar protein dari kalus in vitro T. cucumerina
yang diberi perlakuan SA...
102
31. Rataan TPT, aktivitas kitinase dan peroksidase pada ekstrak kasar protein dari kalus in vitro T. tricuspidata
yang diberi perlakuan etefon ...
104
32. Rataan TPT, aktivitas kitinase dan peroksidase pada ekstrak kasar protein dari kalus in vitro T. tricuspidata
yang diberi perlakuan ETF...
105
33. Presentase perkecambahan spora dan pertumbuhan tabung kecambah pada uji perkecambahan spora Fusarium asal
T. cucumerina var. anguina dengan protein asal tunas in vitro T. tricuspidata....
122
34. Presentase perkecambahan spora dan skor panjang tabung kecambah pada uji perkecambahan spora cendawan dengan protein asal tunas in vitro T. tricuspidata...
xix
No Judul Halaman
35. Hasil pengujian kualitatif aktivitas ekstrak kasar protein dari T. tricuspidata dan T. cucumerina var. anguina
terhadap pertumbuhan hifa cendawan Helminthosporium turcicum...
DAFTAR GAMBAR
No Judul Halaman
1. Kerangka Disertasi ... 8
2. Skema dinding sel cendawan struktur kimia kitin ... 12
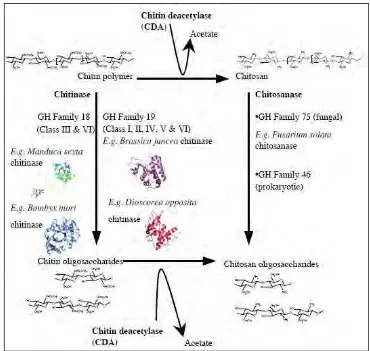
3. Proses dan enzim yang terlibat dalam degradasi senyawa kitin
18
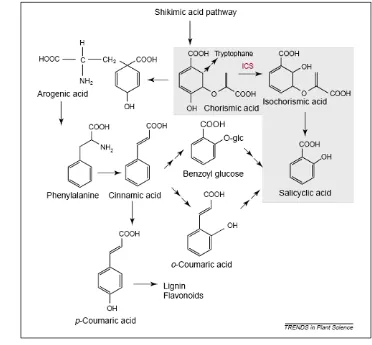
4. Lintasan biosintesis asam salisilat (Metraux 2002) ... 22
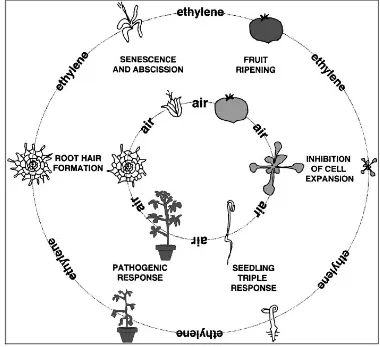
5. Pengaruh etilen terhadap pertumbuhan dan perkembangan tanaman : (searah jarum jam dari atas) mendorong pematangan buah, penghambatan dalam ekspansi sel, menyebabkan triple response(pembelokan ujung apikal, pembengkokan radial dari hipokotil dan pemendekan akar pada perkecambahan benih, mendorong ketahanan terhadap layu dan nekrosis setelah mengalami infeksi patogen, mendorong pembentukan rambut akar, mempercepat senesen bunga dan mendorong absisi petal (Johnson dan Ecker 1998). ……….
24
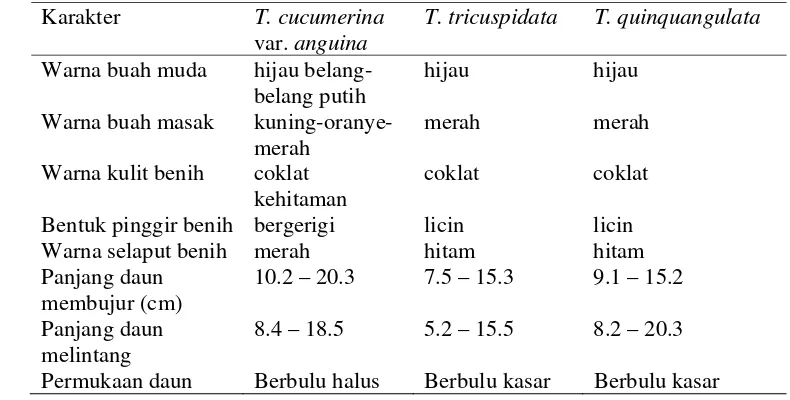
6. Bentuk buah : (a). T. cucumerina var. anguina (buni, silindris panjang), (b). T. tricuspidata (buni silindris, oval). (c). T. quin-quangulata (buni silindris, bulat)………
31
7. Bentuk bagian dalam buah dan biji Trichosanthes : (a). isi buah dan (b) biji T. cucumerina var. anguina, (c) isi buah dan (d) biji T. tricuspi-data, (e) isi buah dan (f) biji
T. quinquangulata………...
33
8. Bentuk permukaan daun Trichosanthes (a) bagian atas daun dan (b) bagian bawah daun T. cucumerina var. anguina, (c) bagian atas daun dan (d) bagian bawah daun T. tricuspidata,
(e) bagian atas daun dan (f) bagian bawah daun
T. quinquangulata………...
34
9. Morfologi bunga Trichosanthes (a) bunga jantan pada tandan bunga, (b) bunga jantan dilihat dari arah atas dan (c) bunga betina dari T. cucumerina var. anguina, (d) tandan bunga jantan, (e) bunga dilihat dari arah atas dan (f) satu bunga jantan
dari T. tricuspidata………..
xxi
No Judul Halaman
10. Morfologi akar tanaman Trichosanthes sp : (a) akar tanaman Morfologi bibit dan tanaman muda Trichosanthes sp. (a) bibit dan (b) tanaman umur 1 bulan setelah tanam (BST) T. cucu-merina var. anguina, (c) bibit dan tanaman umur 1 BST T. tri-cuspidata, (e) bibit dan (f) tanaman muda 1 BST T. quinqu-angulata ………..
38
11. Hama dan gejala kerusakan tanaman Trichosanthes sp : (a) gejala Liriomyza pada bibit T. cucumerina, (b) Liriomyza pada bibit T. tricuspidata, (c) Liriomyza pada T. quinquangulata;
(d) dan (e) ulat yang menyerang daun T. cucumerina var.
anguina, (f) Epilachna pada T. cucumerina var. anguina
(g) telur hama pada tangkai bunga, (h) larva Epilachna dan gejala serangannya pada daun, (i ) hama serangga (Hemiptera, Coreidae, n = nimpa, m = imago) penghisap cairan buah
T. cucumerina var. anguina, (j) gejala keriting pada daun
T. quinquangulatan, (k) bekas tusukan hama pada bagian bawah daun T. quinquangulata, dan (l) hama kumbang daun (spot cucumber beetle) yang menghisap cairan daun
T. quinquangulata………...
41
12. Gejala penyakit dan patogen yang ditemukan pada
Trichosanthes sp. T. cucumerina var. anguina : (a) busuk batang oleh cendawan, (b) cendawan Oidium sp. diatas permukaan daun, (c) gejala embun bulu (Pseudoperonospora cubensis), (d) busuk dari pinggir daun, (e) busuk ujung buah pada T. cucumerina var. anguina, (f) gejala penyakit keriting daun pada T. quinquangulata, (g) spora cendawan Oidium sp. (h) isolat Fusarium sp, dan (i) spora cendawan Fusarium sp. dari T. cucumerina var. anguina…………..
42
13. Morfologi bahan tanaman dalam penelitian : kalus in vitro
pada media : (a) N1B1 (1 µM NAA + 1 µM BA), (b) N2B2 (2 µM NAA + 2 µM BA), (c) N3B3 (3 µM NAA + 3 µM BA), (d) N4B4 (4 µM NAA + 4 µM BA). (e) tunas in vitro
(TIV) dalam media MS + BA 1 mg/l, serta (f) daun tanaman dari lapang (DLP) dan (g) akar tanaman dari lapang (ALP)...
54
14. Representasi jaringan yang dianalisis dalam percobaan 1: (a)eksplan untuk induksi kalus, (b, c, d) kalus pada media N1B1, N3B3 dan N4B4, (e) daun dan (f) akar tanaman dari lapang...
No Judul Halaman
15. Representasi bahan tanaman yang dianalisis dalam percobaan 2 : (a) bibit umur 3 MSB, (b) akar bibit, (c) daun tanaman umur 1 BST, (d) akar tanaman umur 1 BST, (e) daun dan buah tanaman umur 2 BST, (f) akar tanaman umur 2 BST...
71
16. Representasi bahan tanaman T. tricuspidata yang digunakan pada percobaan : (a). Tanaman dilapang umur 9 BST, (b). akar primer, (c). akar sekunder, (d). tunas in vitro (e). kalus in vitro
87
17. Representasi bahan tanaman T. cucumerina var. anguina yang digunakan dalam percobaan : (a) tajuk tanaman dan (b) akar tanaman berumur 2 MST, serta (c) kalus in vitro………
86
18. Penghambatan perkecambahan spora cendawan Fusarium sp. oleh protein asal tunas in vitro pada 24 jam setelah perlakuan : (a) isolat Fusarium sp. sumber spora, (b) spora awal sebelum perlakuan (c) K1 (kontrol bufer, tumbuh), (d) K2 (kontrol benlate, tidak tumbuh), (e) P1 [(protein 0.77 mg/ml), (f) P2 [(protein 0.031 mg/l), (g) P3 [(protein 0.015 mg/ml), dan (d) P4 [(protein 0.0077 mg/ml)……….
123
19. Penghambatan perkecambahan spora cendawan Fusarium oxysporum asal bawang merah oleh protein asal tunas in vitro
pada 24 jam setelah perlakuan : (a) dan (b) K0 (kontrol bufer, tumbuh), (c) E0 (protein asal tunas in vitro), (d) E1 (protein asal tunas yang diberi perlakuan etefon 0.7 mM)………
124
20. Perkecambahan spora (a-f) cendawan (Puccinia arachidis) asal kacang tanah pada 24 jam setelah dikecambahkan dalam kontrol larutan bufer fosfat 50 mM pH 6, (g-i) kontrol benlate 1 mg/ml), (j-l) E0 (protein asal tunas in vitro), (m-o) E1 (protein asal tunas yang diberi perlakuan etefon 0.7 mM)…….
126
21. Peronospora cubensis pada ketimun : a. Gejala bercak pada daun, b. Bercak sumber spora untuk pengujian, c. Spora diujung sporangiofor di atas permukaan daun dilihat dengan mikroskop stereo, d. Bentuk spora cendawan……….
127
22. Penghambatan perkecambahan spora cendawan
Pseudoperonopora cubensis asal ketimun oleh protein asal tunas in vitro pada 24 jam setelah perlakuan : (a) K0 (kontrol bufer, tumbuh), (b) K1 (kontrol benlate 1 mg/ml), (c) E0 (protein asal tunas in Vitro), (d) E1 (protein asal tunas yang diberi perlakuan etefon 0.7 mM)……….
xxiii 23. Cendawan Curvularia eragrostidis : (a) gejala serangan pada
bunga anggrek Dendrobium, (b) kultur cendawan berumur 12 HST, (c). bentuk spora cendawan………
129
24. Perkecambahan spora cendawan Curvularia eragrostidis
tanaman anggrek pada berbagai pada 24 jam setelah perlakuan : (a) K0 (kontrol bufer, tumbuh), (b) K1 (kontrol benlate 1 mg/ml), (c) E0 (protein asal tunas in Vitro), (d) E1 (protein asal tunas yang diberi perlakuan etefon 0.7 mM)………
130
25. Morfologi cendawan Helminthosporium turcicum yang diberi perlakuan ekstrak kasar protein akar dan daun T. tricuspidata
pada 5 hari setelah perlakuan protein : (a) kontrol tampak atas , (b) kontrol tampak bawah, (c) Protein akar tampak atas, (d) protein akar tampak bawah, (e) protein daun tampak atas, (f) protein daun tampak bawah……….
133
26. Morfologi cendawan Helminthosporium turcicum yang diberi Perlakuan ekstrak protein akar, batang dan daun T. cucumerina
5 HSP : (a) kontrol tampak atas , (b) kontrol tampak bawah, (c) Protein akar tampak atas, (d) protein akar tampak bawah, (e) protein batang tampak atas, (f) protein batang tampak bawah, (g) protein daun tampak atas, (h) protein daun tampak bawah
BAB I
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara yang kaya dengan berbagai plasmanutfah
tanaman yang belum banyak diteliti secara ilmiah manfaatnya. Salah satunya
adalah genus Trichosanthes dari famili Cucurbitaceae. Backer dan Van Den Brink
(1963) melaporkan 8 spesies Trichosanthes yang terdapat di Pulau Jawa yaitu
T. coriacea, T. cucumerina, T. anguina, T. globosa, T. ovigera,, T. villosa,
T. trifoliata dan T. bracteata. Rugayah (1999) menambahkan identifikasi
morfologi, anatomi dan isozim dari 39 spesies (termasuk 2 varietas) yang terdapat
di Malesia. Daerah Malesia tersebut meliputi Malesia bagian barat (Malay
Peninsula, Sumatera, Borneo, Palawan dan Jawa), Malesia Tengah (Filipina,
Sulawesi, Moluccas, Kepulauan Sunda Kecil), dan Malesia bagian Timur (Irian).
Sebagian besar spesies Trichosanthes dimanfaatkan sebagai bahan obat kecuali
T. cucumerina var anguina atau dikenal dengan nama lokal paria belut, buah
mudanya dapat dimakan sebagai sayuran.
Berbagai spesies dari famili Cucurbitaceae dilaporkan menghasilkan
protein bioaktif yang disebut Ribosome Inactivating Protein (RIPs). RIPs
merupakan protein yang dapat merusak ribosom dengan aktivitas N-glicosidase
melalui depurinasi rRNA sehingga menghambat proses sintesis protein (Barbieri
et al. 1993). RIP dari tanaman dapat menghambat sintesis protein pada mamalia,
bakteri, cendawan dan tanaman dalam kondisi in vitro dan in vivo (Iglesias et al.
1993).
RIPs yang dijumpai pada jaringan tanaman Cucurbitaceae antara lain
momordin pada paria (Momordica charantia) (Dong et al. 1994), luffin pada
blestru (Luffa cyllindrica L.) (di Toppi et al.1996), trichosanthin pada T. kirilowii
var. japonicum Kitam.(Savary dan Flores 1994), karasurin dari Trichosanthes
kirilowii var. japonica (Kondo et al. 2002), trichoanguina pada T. anguina (Chow
2 berfungsi sebagai salah satu mekanisme defensif bagi tanaman disebabkan RIP
memiliki aktivitas anticendawan, antibakteri bahkan antivirus (Roberts dan
Seletrennikof, 1986). Overekspresi RIPs yang berasal dari biji barley pada
tanaman tembakau meningkatkan ketahanan tanaman terhadap cendawan
(Logeman et al. 1992).
Protein lain yang berhubungan dengan respon ketahanan tanaman terhadap
patogen adalah kitinase dan peroksidase. Kitinase dapat mendegradasi senyawa
kitin yang merupakan komponen utama penyusun dinding sel cendawan. Sebagian
besar cendawan filamentus mengandung senyawa kitin pada dinding sel hifanya.
Kitinase berfungsi menghidrolisis ikatan β-1,4-glycoside pada biopolymer
N-acetylglucosamine dalam senyawa kitin (Kasprzewska 2003). Kitinase juga
termasuk dalam famili protein yang berhubungan dengan proses patogenesis pada
tanaman (pathogenesis related (PR) protein) yaitu termasuk ke dalam PR-3, 4, 8
dan 11 (Lagrimini et al. 1997). Karasuda et al. (2003) melaporkan bahwa kitinase
asal tanaman yam (Dioscorea opposita Thunb) dapat menghambat perkembangan
penyakit embun tepung pada buah dan daun strawberi. Dengan demikian kitinase
mempunyai potensi yang strategis untuk pengembangan metode pengendalian
patogen cendawan pada tanaman. Sekuen asam amino dari enzim kitinase klas III
dari Trichosanthes kirilowii telah dipublikasikan oleh Savary dan Flores (1997).
Peroksidase merupakan enzim yang terlibat dalam respon tanaman
terhadap patogen dan termasuk ke dalam PR-9 (Lagrimini et al. 1997). Oku
(1994) menyatakan bahwa peroksidase berperan dalam proses oksidasi dan
polimerisasi prekursor untuk biosintesis lignin sementara lignin sendiri berfungsi
sebagai barier fisik yang dapat menghambat infeksi patogen pada tanaman.
Peroksidase juga menunjukkan penghambatan terhadap pertumbuhan cendawan
dalam pengujian in vitro (Saikia et al. 2006). Aktivitas peroksidase yang tinggi
pada tanaman terkait dengan ketahanan tanaman yang lebih tinggi terhadap
patogen seperti yang pernah dilaporkan pada kacang tanah (Pujihartati et
al.2006b).
Peroksidase banyak digunakan dalam industri dan aplikasi analitik, antara
lain sebagai reagen dalam diagnosis klinik dan enzim immunoassay (Agostini et
mengandung fenol dan amina aromatik (Klibanov et al. dan Wu et al. dalam
Agostini et al. 2002), dalam proses biobleaching, dalam proses degradasi lignin,
produksi bahan kimia dan bahan bakar dari pulp kayu, produksi alkaloid dimerik,
dan dalam oksidasi dan biotransformasi senyawa organik (Ryan et al. dalam
Agostini et al. 2002). Peroksidase sudah diproduksi secara komersial dari tanaman
horseradish (Armoracia sp.) (Krell et al. dalam Agostini et al. 2002) dan belum
pernah diproduksi dari tanaman Trichosanthes. Melihat luasnya potensi
pemanfaatan peroksidase, maka perlu diteliti potensi tanaman lain termasuk
Trichosanthes dalam menghasilkan peroksidase.
Protein atau enzim-enzim yang ada dalam tanaman dihasilkan dari proses
biosintesis sebagai hasil langsung dari ekspresi gen penyandi protein atau enzim
yang bersangkutan. Ekspresi suatu gen yang menyandi protein/enzim terjadi
melalui serangkaian proses yang dimulai dari transkripsi untuk menghasilkan
mesenger RNA dan translasi untuk menghasilkan protein. Ekspresi gen yang
sifatnya konstitutif berarti proses transkripsi dan translasi terjadi di semua tahapan
pertumbuhan dan perkembangan tanaman, sedangkan ekspresi yang sifatnya
regulated berarti transkripsi dan translasi hanya terjadi pada jaringan tertentu,
pada waktu tertentu, atau pada tingkat perkembangan tanaman tertentu.
Sebagian besar protein atau enzim yang berkaitan dengan respon
ketahanan tanaman terhadap patogen, biosintesisnya terinduksi atau meningkat
ketika tanaman terinfeksi patogen. Sejumlah senyawa tertentu seperti asam
salisilat (SA), metil jasmonat (MJ), dan etephon (ETF) atau etilen (ETL) juga
diketahui dapat meningkatkan ekspresi gen atau biosintesis dari protein atau
enzim yang terkait dengan respon tanaman terhadap patogen. Senyawa-senyawa
tersebut meningkat pada peristiwa Local Acquired Resistance (LAR) pada
tanaman (Dang et al. 2001) dan Systemic Acquired Resistance (SAR) (Sticher et
al. 1997). Asam salisilat merupakan regulator penting dalam induksi ketahanan
tanaman terhadap patogen. Penyemprotan senyawa-senyawa tersebut secara
eksogen dapat meningkatkan ekspresi gen-gen ketahanan pada tanaman Hal
tersebut juga diperkuat dengan kenyataan bahwa tanaman mutan untuk biosintesis
asam salisilat mengalami penurunan ketahanan terhadap penyakit (Sticher et al.
4 Eksplorasi enzim kitinase dan peroksidase dari berbagai spesies tanaman
Trichosanthes ada di Indonesia belum banyak di lakukan. Identifikasi jenis
spesies dan bagian tanaman yang menghasilkan enzim tersebut dalam jumlah
yang besar dapat menjadi dasar untuk eksplorasi gen penyandi kitinase dan
peroksidase maupun untuk produksi peroksidase secara komersial. Faktor-faktor
yang berpengaruh terhadap aktivitas kitinase dan peroksidase pada jaringan
tanaman Trichosanthes masih perlu dipelajari sehingga dapat meningkatkan
biosintesis ataupun aktivitas kedua enzim tersebut.
Tujuan Penelitian:
Penelitian ini bertujuan untuk :
1. Mengetahui performan di lapangan (morfologi, pertumbuhan, perkembangan,
hama dan penyakit) 3 spesies Trichosanthes (T. cucumerina var. anguina,
T. tricuspidata dan T. quinquangulata).
2. Menganalisis aktivitas enzim kitinase dan peroksidase pada ekstrak kasar
protein dari jaringan tanaman T. tricuspidata dan T. cucumerina var. anguina
dari lapangan dan kultur in vitro.
3. Menganalisis pengaruh perlakuan senyawa induser asam salisilat (SA) dan
etefon (ETF) terhadap aktivitas enzim kitinase dan peroksidase pada ekstrak
kasar protein dari jaringan tanaman T. tricuspidata dan T. cucumerina var.
anguina.
4. Menguji aktivitas anticendawan dari ekstrak kasar protein tanaman
T. tricuspidata dan T. cucumerina var. anguina.
Kerangka Berpikir dan Garis Besar Disertasi
Berdasarkan hasil-hasil penelitian yang telah dipublikasikan sebelumnya,
genus Trichosanthes berpotensi sebagai sumber protein bioaktif. Penelitian yang
T. kirilowii ini sudah lama digunakan sebagai bahan obat ataupun sebagai sumber
protein bioaktif yang dapat menghambat pertumbuhan bakteri, cendawan, virus,
bersifat antikanker dan anti-HIV.
Sementara itu, di Indonesia tidak ditemukan spesies T. kirilowii. Akan
tetapi, di Indonesia telah dikarakterisasi sekitar 39 spesies yang tumbuh di
beberapa daerah seperti Jawa, Sumatera, Borneo dan Irian. Khusus di daerah
Bogor, ditemukan spesies T. tricuspidata dan T. quinquangulata. Spesies yang
dibudidayakan untuk dimanfaatkan sebagai sayuran T. cucumerina var. anguina,
ditemukan dibeberapa daerah di Jawa Barat dan Jawa Tengah. Spesies-spesies
yang ada di Indonesia kemungkinan besar juga mengandung potensi sebagai
sumber protein bioaktif seperti yang terdapat pada T. kirilowii. Karena itu
penelitian-penelitian untuk menggali potensi protein bioaktif dari tanaman
Trichosanthes sp. yang ada di Indonesia perlu dilakukan.
Sebelum analisa pada level biokimia dan molekuler dalam studi protein
bioaktif dari tanaman, maka terlebih dahulu perlu dikenali morfologi dan keragaan
tanaman di lapangan. Dalam hal ini, diduga bahwa tanaman-tanaman yang
memiliki potensi sebagai sumber protein bioaktif akan memiliki karakter-karakter
yang diduga berhubungan dengan sifat ketahanan tanaman terhadap patogen.
Untuk itu dalam Bab III dari disertasi dipelajari performan di lapangan
(morfologi, pertumbuhan dan perkembangan) dari 3 spesies Trichosanthes yaitu
T. cucumerina var. anguina, T. tricuspidata, dan T. quinquangulata. Hasil
penelitian pada Bab III menunjukkan bahwa terdapat perbedaan keragaan dari
ketiga spesies yang diteliti. T. cucumerina var. anguina mengalami serangan hama
dan penyakit yang cukup banyak, diikuti oleh T. quinquangulata dan
T. tricuspidata. Berdasarkan keragaan ketiga spesies di lapangan terhadap
kejadian hama dan penyakit, maka diduga T. cucumerina var. anguina dan
T. tricuspidata memiliki sifat yang kontras, dimana T. cucumerina var. anguina
diduga rentan terhadap hama dan penyakit dan T. tricuspidata diduga sebagai
spesies yang tahan terhadap hama dan penyakit.
Berdasarkan hasil penelitian pada Bab III seperti tersebut di atas,
selanjutnya pada Bab IV diteliti 1 spesies yaitu T. tricuspidata dan pada Bab V
6 pada masing-masing spesies untuk mengetahui karakter biokimia berupa aktivitas
kitinase dan peroksidase dari masing-masing spesies. Analisis aktivitas kitinase
dan peroksidase bertujuan untuk mengetahui apakah berbagai bagian tanaman,
tingkat organisasi sel yang berbeda, maupun tingkat perkembangan tanaman
menghasilkan aktivitas kitinase dan peroksidase yang sama besarnya atau
berbeda. Analisis dilakukan pada bagian tanaman seperti akar, batang dan daun
dan juga dari bahan yang dikulturkan secara in vitro seperti tunas dan kalus.
Berdasarkan hasil penelitian pada Bab IV ditemukan bahwa beberapa bagian
tanaman T. tricuspidata menghasilkan aktivitas kitinase yang berbeda, dimana
aktivitas kitinase yang tinggi ditemukan pada ekstrak kasar protein dari tunas in
vitro diikuti kalus dari media N4B4 (MS yang diberi NAA dan BA
masing-masing 4 μM), dan akar tanaman dari lapangan. Sedangkan aktivitas peroksidase
yang paling tinggi ditemukan pada ekstrak kasar protein dari akar tanaman di
lapangan diikuti oleh tunas in vitro dan kalus dari media N4B4. Pada hasil
penelitian Bab V dari T. cucumerina var. anguina, ditemukan bahwa aktivitas
kitinase dan peroksidase yang paling tinggi adalah pada ekstrak kasar protein asal
akar tanaman dari lapangan diikuti oleh kalus dari media N4B4.
Kitinase dan peroksidase termasuk ke dalam PR-protein yang
biosintesisnya pada tanaman meningkat ketika terjadi serangan patogen (seperti
cendawan, bakteri atau virus) maupun kondisi yang menyerupai adanya serangan
patogen. Salah satu kondisi yang menyerupai terjadinya serangan patogen adalah
peningkatan senyawa asam salisilat (SA) atau etilen (ETL). Kondisi tersebut dapat
ditiru dengan memberikan senyawa SA atau ETL secara eksogen pada tanaman.
Pada Bab IV dan V telah ditemukan bagian tanaman yang menunjukkan aktivitas
kitinase dan peroksidase tinggi, karena itu pada Bab VI dilakukan penelitian untuk
mengetahui apakah perlakuan senyawa induser SA dan ETL (diberikan dalam
bentuk etefon [ETF]) dapat meningkatkan aktivitas kitinase dan peroksidase dari
ekstrak kasar protein tanaman. Pada T. tricuspidata, perlakuan senyawa induser
SA diberikan pada akar tanaman di lapangan dan juga pada tunas dan kalus in
vitro dan perlakuan senyawa ETF diberikan pada kalus in vitro. Sementara itu
pada T. cucumerina var. anguina perlakuan senyawa SA diberikan pada akar
tersebut menunjukkan bahwa aktivitas kitinase dari ekstrak kasar protein tanaman
T. tricuspidata dapat ditingkatkan dengan perlakuan SA atau ETF pada kalus in
vitro dan aktivitas peroksidase dapat ditingkatkan dengan perlakuan SA pada akar
tanaman di lapang dan kalus in vitro. Sedangkan pada T. cucumerina var. anguina
perlakuan SA baik pada akar tanaman di lapangan maupun pada kalus in vitro
tidak dapat meningkatkan aktivitas kitinase namun dapat meningkatkan aktivitas
peroksidase dari ekstrak kasar protein.
Potensi kandungan protein bioaktif dari tanaman dapat dievaluasi dari
analisa aktivitas enzim seperti enzim kitinase dan peroksidase yang dilakukan
pada Bab IV, V dan VI ataupun dengan cara menguji langsung aktivitas protein
terhadap patogen tanaman misalnya cendawan. Cendawan merupakan patogen
penyebab penyakit yang banyak menyerang tanaman, hewan maupun manusia.
Pengendalian patogen cendawan pada tanaman dengan fungisida menimbulkan
masalah-masalah baru seperti munculnya resistensi cendawan terhadap
fungidisida, munculnya ras-ras patogen baru dan juga masalah keseimbangan
ekosistem dan masalah kesehatan pada manusia karena adanya residu pestisida
pada produk pangan, buah dan sayuran.
Pencarian sumber-sumber ketahanan dari plasmanutfah tanaman
Cucurbitaceae, termasuk Trichosanthes sp. merupakan alternatif untuk
mengurangi masalah-masalah yang ditimbulkan karena penggunaan fungisida.
Sifat ketahanan yang kemungkinan dimiliki oleh spesies-spesies dalam genus
Trichosanthes berpotensi untuk dipindahkan ke spesies lainnya dalam famili
Cucurbiatceae melalui pendekatan persilangan konvensional maupun
bioteknologi dengan transformasi genetik tanaman.
Dengan landasan pemikiran seperti tersebut di atas maka dilakukan penelitian
pada Bab VII yaitu pengujian bioaktivitas ekstrak kasar protein dari jaringan
tanaman Trichosanthes terhadap cendawan. Pengujian dilakukan pada 5 cendawan
patogen tanaman dari kelas yang berbeda. Ekstrak protein tanaman yang diuji
adalah yang ekstrak kasar protein dari tunas in vitro T. tricuspidata (yang dari
penelitian pada Bab IV menghasilkan aktivitas kitinase cukup tinggi) untuk
pengujian penghambatan perkecambahan spora dan ekstrak kasar protein dari
8 pengujian tersebut menunjukkan bahwa ekstrak kasar protein dari tunas in vitro T.
tricuspidata menghambat perkecambahan spora 4 jenis cendawan patogen
tanaman. Sementara dari uji penghambatan pertumbuhan hifa, ekstrak kasar
protein tanaman T. tricuspidata dan T. cucumerina var. anguina secara kualitatif
terlihat menghambat pertumbuhan koloni hifa cendawan Helminthosporium
tursicum.
Secara garis besarnya kerangka penelitian yang dilakukan seperti terlihat pada
LANDASAN BERPIKIR
Keberagaman spesies Trichosanthes (T. cucumerina var. anguina,
T. tricuspidata T. quinquangulata
BAB III. Studi Morfologi dan Evaluasi Hama dan
Penyakit Tanaman di Lapangan Perbedaan morfologi dan
keragaan ketahanan terhadap hama dan penyakit di
lapangan
PROSES LUARAN
Diketahui karakter morfologi dan spesies yang rentan (T. cucumerina dan dan tahan
(T. tricuspidata)terhadap hama dan penyakit di lapangan
Perbedaan keragaan ketahanan terhadap hama dan
penyakit di lapangan
Perbedaan karakter biokimia yang berhubungan dengan
aktivitas KTN & PRX
BAB IV & V. Studi Aktivitas KTN & PRX
dari T. tricuspidata & T. cucumerina var.
anguina
Diketahui karakter biokimia aktivitas KTN & PRX tinggi yaitu tunas in vitro
(T. tricuspidata) dan akar (T. cucumerina var. anguina)
KTN dan PRX merupakan PR-Protein
Biosintesis Kitinase dan Peroksidase oleh Induser
PR-Protein seperti Salycilyc Acid (SA) dan Etilen (ETL)
BAB VI. Studi Induksi Aktivitas KTN dan PRX dari
Bagian Tanaman T. tricuspidata & T. cucumerina var. anguina
T.tricuspidata : SA dapat meningkatkan aktivitas KTN dan PRX pada kalus. ETF meningkatkan KTN menekan PRX.
T. cucumerina var. anguina : SA tidak meningkatkan aktivitas KTN namun meningkatkan aktivitas PRX.
KTN & PRX terdapat dalam Ekstrak Kasar Protein Tanaman Trichosanthes
Kemungkinan Ekstrak Kasar Protein dapat menghambat
pertumbuhan cendawan yang memiliki kitin pada
dinding selnya
BAB VII. Uji Aktivitas Anticendawan dari Ekstrak
Kasar Protein Tanaman
[image:32.792.40.753.99.559.2]BAB II
TINJAUAN PUSTAKA
Trichosanthes
Trichosanthes merupakan genus terbesar dalam famili Cucurbitaceae yang
terdiri dari sekitar 100 spesies yang tersebar di daerah tropik dan sub tropik Asia
Timur, Malesia, Australia Tropik dan Fiji (Jeffrey, 1990 dalam Rugayah 1999).
Trichosanthes untuk pertama kalinya diterangkan oleh Linnaeus dalam Genera
Plantarum tahun 1737 dengan menyampaikan 4 spesies yaitu T. anguina,
T. nervifolia, T. cucumerina, T. amara. Untuk pulau Jawa, Blume dalam Rugayah
(1999) mengemukakan 13 spesies dari genus Trichosanthes yang terbagi ke dalam
3 genera. Rugayah (1999) mengidentifikasi morfologi dan anatomi 39 spesies
Trichosanthes di Malesia antara lain T. borneesis (Kalimantan), T. cucumerina
var. anguina (Labuan, Jakarta, Bogor, Madiun, Madura), T. globosa (Gunung
Bunder), T. montana (Situ Gunung), T. ovigera (Situ Gunung, Gunung Bunder,
Gunung Halimun), T. pubera (Cianten), T. quinquangulata (Gunung Halimun,
Bengkulu, Irian Jaya), T. tricuspidata (Gunung Bunder, Cibodas, Sukabumi,
Banten, Gunung Salak, Siberut Sumatera), T. villosa (Cianten, Batu Malang), dan
T. wawrae (Gunung Halimun).
Ciri utama dari spesies-spesies Trichosanthes, sebagaimana tanaman
Cucurbitaceae lainnya, yaitu tumbuh merambat atau memanjat. Bentuk buah
bervariasi, ada yang bulat atau bulat lonjong (oblong). T. cucumerina var anguina
buahnya berbentuk silinder bulat dengan warna hijau berbelang-belang putih,
sehingga di beberapa daerah di pulau Jawa dinamakan dengan paria ular atau
paria belut. T. tricuspidata memiliki daun menjari seperti paria (Momordica
charantia) buah berbentuk oval dan berwarna merah menyala ketika matang.
T. quinquangulata memiliki daun yang lebih lebar bersegi lima, bentuk buah
bulat dengan warna merah seperti T. tricuspidata.
Spesies yang sudah dibudidayakan adalah T. cucumerina var. anguina. Buah
T. cucumerina var. anguina mengandung air 94 g, protein 0.6 g, lemak 0.3 g,
karbohidrat 4 g, serat 0.8 g, Ca 26 mg, Fe 0.3 mg, P 20 mg, vitamin A 235 IU,
vitamin B1 0.02 mg, B2 0.03 mg, niacin 0.3 mg dan vitamin C 12 mg).
T. cucumerina var. anguina juga menghasilkan glukosida elaterin, minyak biji
dan pucinic acid (Gildemacher et al. dalam Siemonsma dan Piluek, 1994).
Cendawan
Cendawan merupakan protista eukariotik, heterotrofik yang dapat hidup
sebagai saprofit maupun parasit (Hadioetomo et al. 1986). Selitrennikof (2001)
menyatakan bahwa cendawan merupakan kelompok yang sangat besar karena
terdapat lebih dari 250.000 spesies cendawan di dunia. Cendawan saprofit hidup
dari bahan-bahan organik yang sudah mati sebaliknya parasit hidup pada makhluk
hidup dan mengambil nutrisi dari inangnya. Cendawan yang bersifat parasit
disebut juga sebagai patogen yang dapat menimbulkan gejala penyakit pada
hewan, tumbuhan ataupun manusia yang menjadi inangnya.
Cendawan dikelompokkan ke dalam 4 kelas yaitu Phycomycetes,
Ascomycetes, Basidiomycetes dan Deuteromycetes (fungi imperfecti).
Pengelompokan tersebut terutama didasarkan pada tipe miselium, bentuk spora
aseksual, spora seksual dan habitat alamiahnya. Phycomycetes sering disebut
sebagai cendawan tingkat rendah yang tidak memiliki sekat (aseptat) pada
hifanya, sementara 3 kelas lainnya memiliki hifa yang bersekat (septat).
Phycomycetes menghasilkan spora aseksual berupa sporangiospora atau
kadang-kadang konidia, sementara 3 kelas lainnya menghasilkan konidia. Spora seksual
pada Phycomycetes berupa zigospora atau oospora. Pada Ascomycetes spora
seksualnya berupa ascospora dan pada Basidiomycetes berupa basidiospora,
sementara pada Deuteromycetes belum diketahui bentuk spora seksualnya.
Spora merupakan propagul untuk pembiakan dan penyebaran cendawan.
Spora bervariasi dalam bentuk, warna dan ukurannya, ada yang berupa satu sel
(uniseluler) atau terdiri dari beberapa sel (multiseluler). Spora pada cendawan
12 khusus) seperti uredospora dari cendawan karat (Melampsora epita) dari pohon
Wilow. Sebagian besar spora memiliki dinding sel yang kaku, lebih tebal
dibanding dinding sel pada hifa, karena terdiri dari beberapa lapis sel. Dinding sel
tersebut ada yang mengandung pigmen seperti melanin dan juga mengandung
lemak. Kadar air pada spora relatif rendah dan spora juga menyimpan nutrisi
cadangan berupa lemak, glikogen dan trehalosa (http://www. fungionline.
[image:35.612.184.455.248.657.2]org.uk/2spores/1spore_char.html).
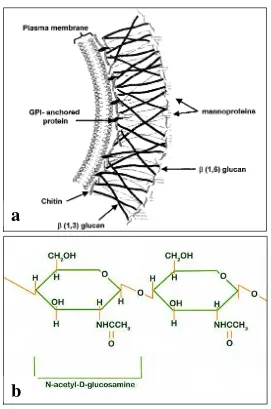
Gambar 2. a. Skema dinding sel cendawan (Selitrennikof, 2001)
b. Struktur kimia kitin http://www.ocean.udel.edu/horseshoecrab/ Research/chitin.html)
a
Spora yang viabel biasanya akan segera berkecambah jika berada pada
kondisi lingkungan yang sesuai untuk perkecambahannya. Proses perkecambahan
diawali oleh proses hidrasi, pembengkakan sel setelah proses hidrasi, peningkatan
metabolisme, lalu pertumbuhan satu atau lebih tabung kecambah. Perkecambahan
spora memerlukan air atau kelembaban yang relatif tinggi serta nutrisi. Untuk
berkecambah, spora membutuhkan suplai nutrisi dari lingkungannya atau dengan
menggunakan cadangan nutrisi yang ada di dalam sel spora tersebut.
Dinding sel cendawan disusun oleh senyawa β-glukan, kitin, lipid dan peptida (Selitrennikof 2001). β-glukan merupakan polimer dari sub unit glucan yang membentuk ikatan β-1,3/1,6-glucan, sedangkan kitin terbentuk dari ikatan
1,4-glicosidic dari sub unit 2-acetamido-2-deoxy-β-D-glucan
(N-acetylgluco-saminide (GlcNac)) (Gooday, 1994, Ubhayasekera, 2005). Senyawa kitin
ditemukan oleh Henry Braconnot tahun 1811 dan dinamakan sebagai “kitin” oleh
A. Odier tahun 1823. Chitosan (hasil deasetilasi senyawa kitin) ditemukan oleh C.
Rouget tahun 1859.
Protein Anticendawan
Selitrennikof (2001) menyatakan ada beberapa kelompok senyawa
anticendawan antara lain PR-Protein, defensin, cyclophilin like-protein,
glycine/histidin rich protein, RIPs, LTPs, killer proteins/killer toxin dan protease
inhibitor. PR-protein merupakan protein yang terinduksi sintesisnya ketika terjadi
proses patogenesis atau serangan patogen pada tanaman (Ubhayasekera, 2005).
Sejumlah PR-protein juga dapat terinduksi sintesisnya oleh berbagai faktor antara
lain stress kekeringan, salinitas, pelukaan, logam berat, oleh perlakuan elisitor
endogen maupun eksogen; dan oleh perlakuan zat pengatur tumbuh tanaman
(Karprezewska, 2003).
PR-protein dikelompokkan ke dalam 5 kelas protein yaitu PR-1, PR-2, PR-3,
PR-4 dan PR-5. PR-1 protein terakumulasi pada tingkat yang tinggi setelah
terjadinya infeksi patogen pada tanaman. PR-1 protein bersifat anticendawan
yang diekspresikan pada tanaman transgenik dan juga pada uji aktivitas
14 Niderman et al. 1995). PR-1 telah ditemukan terekspresi antara lain pada padi,
gandum, jagung, tembakau, Arabidopsis thaliana, dan barley (Agrawal et al.
2000; Bryngelsson et al. 1994; Molina et al. 1999; Muradov et al. 1993; Rauscher
et al.1999). PR-1 protein memiliki aktivitas anticendawan pada konsentrasi
rendah terhadap sejumlah Uromyces fabae, Phytophthora infestans, and Erysiphe
graminis (Niderman et al. 1995).
PR-2 Protein (β-glucanase) memiliki aktivitas β-endoglucanase yang
mampu menghidrolisis ikatan 1,3 β-glucan yang ada pada dinding sel cendawan,
terutama pada ujung hifa cendawan sehingga menyebabkan ujung hifa menjadi
lemah, lisis dan mati. PR-2 protein dikelompokkan ke dalam 3 kelas berdasarkan
runutan residu asam aminonya (Agrawal et al. 2000; Cote et al. 1991; Leah et al.
1991). Glukanase Klas I merupakan protein yang bersifat basic yang ditemukan
pada vakuola tanaman dengan berat molekul sekitar 33 kDa. Sedangkan glukanase
kelas II dan III merupakan protein yang bersifat acidic dan ditemukan
ekstraseluler dengan berat molekul sekitar 36 kDa, serta aktif pada konsentrasi
sekitar 50 µg/ml. PR-2 protein menghambat cendawan Rhizoctonia solani yang
menyerang tanaman dan Candida albicans serta Aspergillus fumigatus yang
menginfeksi manusia. Aktivitas anticendawan PR-2 diketahui berdasarkan hasil
uji in vitro dan hasil uji overekspresi overekspresi pada tanaman transgenik (Jach
et al. 1995).
PR-3 proteins (chitinase) memiliki berat molekul antara 26-43 kDa (Nielsen
et al. 1997). Kitinase dikelompokkan menjadi 5-6 klas (Fukamizo et al. 2003).
Kitinase Klas I memiliki domain N terminal yang kaya residu sistein. Kitinase
klas II memiliki sekuen yang sama dengan klas I tetapi tidak memiliki domain
N-terminal yang kaya residu sistein. Kitinase klas III tidak memiliki kesamaan
runutan asam amino dengan klas lainnya dan mempunyai berat molekul 28-30
kDa. Kitinase klas IV menyerupai kitinase klas I tetapi mempunyai ukuran yang
lebih kecil karena delesi. Kitinase klas V menunjukkan kesamaan sekuen dengan
eksokitinase bakteri dan memiliki berat molekul 41-43 kDa.
Kitinase sudah diisolasi dari bakteri, cendawan, dan tanaman (tembakau,
timun, kacang-kacangan dan biji-bijian) (Selitrennikof 2001). Kitinase
solani, Alternaria radicina, Fusarium oxysporum, Rhizoctonia. solani,
Guignardia bidwellii, Botrytis cinerea, and Coprinus comatus. Cara kerja
kitinase dalam menghambat pertumbuhan cendawan adalah dengan mendegradasi
polimer kitin sehingga melemahkan dinding sel cendawan. Kitinase dan glukanase
dapat bekerja secara sinergis untuk menghambat pertumbuhan cendawan
berdasarkan hasil uji secara in vitro dan uji overekspresi dalam tanaman
transgenik ( Jach et al. 1995).
PR-4 (chitin-binding) protein merupakan protein yang mengikat kitin,
memiliki berat molekul 13-14.5 kDa, dan terdiri atas 2 klas (Friedrich et al. 1991;
Hejgaard et al. 1992; Ponstein et al. 1994; Van Damme et al. 1999). PR-4 protein
klas 1 menyerupai hevein dan termasuk ke dalam superfamili chitin-binding
lectin. Sedangkan 4 protein klas II tidak memiliki domain chitin-binding.
PR-4 protein telah berhasil diisolasi dari tanaman kentang, tembakau, barley dan
tomat. Mekanisme penghambatan pertumbuhan cendawan oleh PR-4 protein
diduga dihasilkan dari proses ikatan PR-4 protein terhadap senyawa β-chitin
melalui mekanisme yang belum sepenuhnya dapat dijelaskan, sehingga
mengakibatkan terganggunya polaritas sel dan terhambatnya pertumbuhan
cendawan (Bormann et al. 1999). Sementara mekanisme penghambatan
pertumbuhan cendawan oleh PR-4 protein klas II belum sepenuhnya dapat
dijelaskan.
PR-5 protein tidak termasuk enzim tetapi merupakan protein yang
bersifat anticendawan dengan merusak membran fungi. PR-5 protein telah
berhasil diisolasi dari jagung dan disebut sebagai zeamatin serta dari tembakau
dan disebut sebagai osmotin. Osmotin mempunyai bobot molekul 24 kD,
terakumulasi dalam vakuola selama adaptasi sel tembakau (Nicotiana tabacum
var. Wisconsin 38) terhadap cekaman osmotik (Singh. et al, dalam Cheong et al,
1997). PR-5 protein juga telah berhasil dimurnikan dan dikarakterisasi dari daun
labu (pumpkin). PR-5 protein dari labu tersebut mempunyai bobot molekul 28 kD
dan dapat menghambat pertumbuhan hifa Fusarium oxysporum dan Neurospora
crassa dalam uji in vitro. (Cheong et al. 1997).
RIPs (Ribosome Inactivating Proteins) merupakan senyawa RNA
16 menghambat sintesis protein karena rusaknya ribosom (Barbieri et al. 1993;
Ferreras et al. 1995; Langer et al. 1996; Pu et al. 1996; Taylor et al. 1990). RIPs
dari tanaman dapat menghambat sintesis protein pada mamalia, bakteri, cendawan
dalam kondisi in vitro dan in vivo. Tanaman penghasil RIP melindungi
ribosomnya sendiri dari kerusakan oleh RIPs yang dihasilkannya dengan
menempatkan RIPs dalam vakuola atau terintegrasi dalam dinding sel (Kataoka et
al. 1991).
RIPs dikelompokkan menjadi 3 tipe. RIP tipe 1 merupakan
N-glicosidase rantai tunggal dengan bobot molekul antara 11-30 kDa. RIP tipe 2
memiliki rantai ganda yaitu N-glycosidase (rantai A) dan rantai B (cell-binding
lectin) dengan bobot molekul hingga 60 kDa (Zhang et al. dalam Selitrennikof,
2001). RIP tipe 2 ada yang toksik seperti ricin and nontoksik seperti ebulin 1 dan
nigrin b. RIP tipe 3 memiliki 4 rantai yang disusun membentuk dua dimmer dari 2
tipe RIP. RIP telah diisolasi dari berbagai jenis tanaman antara lain Mirabilis
expansa, Pisum sativum, Momordica charantia, Ricinus communis, Viscum
album, dan Tricosanthes kirilowii (Selitrennikof, 2001).
RIP berpotensi digunakan dalam bidang pertanian sebagai antivirus,
antibakteri dan anticendawan untuk proteksi tanaman (Vivanco et al. 1997).
Logeman (1993) melaporkan aktivitas anticendawan in vitro dari RIP asal biji
barley dan peningkatan ketahanan terhadap patogen cendawan pada tanaman
tembakau transgenik yang mengekspresikan RIP biji barley (Logeman et al.,
1992).
Banyak peneliti yang telah melaporkan tentang hasil pengujian aktivitas
antimikroba dari protein bioaktif atau peptida antimikroba secara in vitro.
Beberapa metoda yang digunakan untuk pengujian aktivitas anticendawan dari
peptida antimikroba secara in vitro adalah dengan radial growth inhibiton assay
(Schlumbaum et al. 1986), germinated spores antifungal bioassays, microplate
antifungal bioassays, dan spore germination assays (Rajasekaran 2001). Pada
radial growth inhibition assay aktivitas penghambatan pertumbuhan cendawan
dilihat berdasarkan penghambatan pertumbuhan hifa cendawan. Potongan
cendawan ditempatkan ditengah media PDA pada petridish dan senyawa yang
cendawan. Germinated spore antifungal bioassays menggunakan konidia yang
sudah dikecambahkan. Daya penghambatan senyawa bioaktif dilihat berdasarkan
jumlah pembentukan koloni cendawan setelah konidia yang berkecambah
diinkubasi dengan senyawa bioaktif.
Microplate antifungal bioassay dilakukan dengan menggunakan miselia
cendawan yang diblender. Konsentrasi fragmen miselia dihitung dengan
haemacytometer. Pengujian aktivitas protein dilakukan dengan menginkubasi
miselia dengan protein bioaktif dalam sumur-sumur pada plat mikro. Spore
germination assay dilakukan dengan melihat pengaruh senyawa bioaktif terhadap
perkecambahan konidia cendawan. Morfologi tabung perkecambahan dilihat
secara mikroskopik.
Kitinase
Kitinase (E.C. 3.2.1.14) merupakan poly(1,4-(N-acetyl-β-D-glucosamini
de)-glycanohydrolase. Kitinase terdistribusi luas di berbagai organisme yang
memiliki kapasitas kitinolitik di alam meliputi tanaman, mikroorganisme bakteri
dan cendawan, artropoda, dan beberapa hewan tingkat tinggi seperti amfibi, ikan
dan mamalia (Ubhayasekera, 2005). Kitinase termasuk famili 18 dan 19 dari
glycoside hydrolase (GH).
Kitinase bekerja memotong secara acak ikatan glikosida dari GlcNac
untuk menghasilkan oligosakarida terlarut, terutama kitobiosa yang selanjutnya
akan dihidrolisis oleh β-N-acetylglucosaminidase menjadi GlcNac (Orikoshi et al.
2005). Enzim yang terlibat dan produk yang dihasilkan dari degradasi polimer
kitin dapat dilihat pada Gambar 3.
Kitinase pada tanaman tergolong sebagai endokitinase, yang merupakan
protein dengan berat molekul 25 – 40 kDa, isoeletric point (3-10), dan yang
mengalami modifikasi pasca translasi seperti glikosilasi dan prolil-hidroksilasi
(Sticher et al. 1992; Colinge et al. 1993; Nielsen et al. 1994). pH 4-9 merupakan
18 seperti kitinase klas III dari yam memiliki pH optimum yang berbeda tergantung
[image:41.612.133.503.155.506.2]pada substratnya (Tsukamoto et al. 1984).
Gambar 3. Proses dan enzim yang terlibat dalam degradasi senyawa kitin (Sumber : Ubhayasekera, 2005)
Kitinase pada cendawan misalnya kitinase klas 5 yang dikode oleh gen
ChiB dari Aspergilus nidulan (Yamazaki et al. 2006). ChiB yang diekspresikan di
E. coli menunjukkan aktivitas hidrolisis kitin. Delesi pada ChiB tidak
mempengaruhi perkecambahan dan pertumbuhan hifa tapi menurunkan aktivitas
kitinase intraseluler dan ekstraseluler. Ekspresi ChiB meningkat ketika cendawan
sehingga ChiB diduga kuat berperan penting dalam autolisis cendawan
A. nidulans.
Berdasarkan review oleh Kasprezewska (2003) yang dirangkum dari
berbagai penelitian tentang kitinase, ditemukan bahwa pada tanaman sehat,
beberapa bentuk kitinase yang diakumulasikan vakuola dan apoplastik disintesis
secara konstitutif. Kitinase Klas I diekspresikan secara konstitutif dan
terakumulasi dalam jumlah banyak pada bunga dan akar beberapa tanaman.
Kitinase Klas III diekspresikan secara konstitutif pada jaringan vaskular, hidatoda
dan sel penjaga Cucumis sativus dan Arabidopsis thaliana. Ekspresi konstitutif
meningkat dengan bertambahnya umur tanaman dan aktivitas kitinolitik lebih
tinggi pada daun tua dibandingkan daun muda. Pada Cucumis sativus, ekspresi
gen penyandi kitinase Klas III meningkat secara gradual selama pertumbuhan
tanaman dan akumulasi transkrip gen menurun dari bagian jaringan tanaman yang
tua ke bagian tanaman yang muda. Tanaman Arabidopsis thaliana menunjukkan
ekspresi gen penyandi kitinase (gen chi) yang tinggi akibat perlakuan etilen. Pola
ekspresi kitinase ada yang diregulasi mengikuti perkembangan tanaman
(developmentally) dan diregulasi spesifik jaringan atau organ (tissue or
organ-specific regulation).
Stimulasi atau induksi ekspresi gen kitinase karena adanya serangan
patogen sering ditemukan (Collinge et al. 1993; Bishop et al. 2000), dengan
karakter ekspresi sistemik atau lokal (de A Gerhardt et al. 1997; Meier et al.
1993). Pada Arabidopsis thaliana, infeksi dengan patogen yang imkompatibel
menyebabkan akumulasi cepat dari mRNA kitinase Klas IV (Gerhardt et al.
1997). Pada Cucumis sativus, induksi sistemik dari Kitinase Klas III berkorelasi
dengan Systemic Acquired Resistance (SAR). Induksi yang sama terjadi ketika
tanaman diperlakukan dengan salicylic acid (Lawton et al. 1994).
Induksi kitinase pada kondisi in vitro menunjukkan hasil yang sangat
kompleks. Pada kultur in vitro Nicotiana sp., adanya auksin dan sitokinin
menekan ekspresi gen kitinase Klas I. Pada kalus dan suspensi sel Cucurbita sp.,
gen kitinase diekspr