PENAPISAN DAN IDENTIFIKASI DAERAH
DS
PADA PADI MUTAN
PEMBAWA
ACTIVATION-TAG
UNTUK MENGUNGKAP
GEN TOLERAN TERHADAP CEKAMAN SALINITAS
ANKY ZANNATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Penapisan dan Identifikasi Daerah Ds
pada Padi Mutan Pembawa Activation-Tag untuk Mengungkap Gen Toleran Terhadap Cekaman Salinitas adalah benar karya saya bersama komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam
teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor dan Lembaga Ilmu Pengetahuan Indonesia.
Bogor, Agustus 2014
Anky Zannati
RINGKASAN
ANKY ZANNATI. Penapisan dan Identifikasi Daerah Ds pada Padi Mutan Pembawa Activation-Tag untuk Mengungkap Gen Toleran Terhadap Cekaman Salinitas. Dibimbing oleh UTUT WIDYASTUTI dan SATYA NUGROHO.
Peningkatan produksi padi pada masa mendatang, akan banyak menghadapi tantangan yang semakin komplek, berkaitan dengan cekaman abiotik dan biotik akibat dampak perubahan iklim. Pengembangan varietas unggul untuk menghadapi cekaman kini menjadi sangat penting. Mutasi insersi merupakan salah satu metode dalam analisis functional genomics atau analisis fungsi genom. Penggunaan elemen transposon Ac/Ds yang mampu bertransposisi dalam berbagai tanaman termasuk padi, memungkinkan untuk menemukan gen fungsional seperti pengkode toleransi terhadap cekaman abiotik pada padi. Pendekatan ini diharapkan dapat mengungkap potensi sumber gen bermanfaat, atau faktor dan elemen bermanfaat yang mengontrol sifat terkait cekaman abiotik, khususnya cekaman salinitas pada padi. Selanjutnya informasi yang diperoleh dapat dimanfaatkan untuk merakit padi atau bahkan varietas tanaman lainnya yang lebih toleran salinitas. Tujuan dari penelitian ini adalah melakukan penapisan padi mutan pembawa activation-tag untuk toleransi terhadap cekaman salinitas, mengurutkan daerahpengapit Ds, dan mengidentifikasi situs penyisipan gen yang diduga bertanggung jawab atas fenotip.
Sebanyak 75 galur padi mutan dipilih dari 1000 benih hasil penapisan massal digunakan untuk mengidentifikasi mutan yang responsif terhadap cekaman salinitas. Mutan divalidasi toleransi salinitasnya dalam tiga percobaan, dilakukan pada perkecambahan umur 17 hari dalam larutan Yoshida yang mengandung 200 mM NaCl. Pendekatan yang digunakan untuk mengevaluasi toleransi terhadap salinitas, yaitu dengan menghitung nilai Vigour Index dan persentase reduksi. Analisis sekuen pengapit daerah insersi pada genom padi dilakukan menggunakan metoda TAIL-PCR. Sedangkan identifikasi daerah insersi dilakukan melalui analisis bioinformatika. Analisis dilakukan dengan menggunakan beberapa database yang bersifat public open-source.
Sebanyak 10 mutan potensial toleran salinitas diperoleh dari hasil penapisan, dengan nilai indeks vigour tertinggi yaitu 3,54 hingga 7,45. Analisis insersi menggunakan PCR terhadap galur mutan 170-10 menghasilkan pita berukuran 400pb, menunjukkan bahwa elemen Ds telah bertransposisi. Sebuah amplikon dari galur mutan 170-10 berhasil diisolasi dengan teknik TAIL- PCR menggunakan primer random (degenerate primer) AD2 dan primer spesifik Ds3. Analisis bioinformatika menunjukkan insersi terletak di daerah coding sequence
sebagai Os11g0686500 pada kromosom 11.
SUMMARY
ANKY ZANNATI. Screening and Identification of Ds Insertions Sites of Mutant Rice Carrying Activation-tag to Discover Genes Responsive to Salinity Stress. Supervised by UTUT WIDYASTUTI and SATYA NUGROHO.
Increased rice production will face many complex challenges, related to abiotic and biotic stresses due to climate change impacts. Development of improved varieties to cope with stress has become a very important need. Insertion mutation is one method of functional genomics analysis. The use of transposon element Ac / Ds that capable transposed in the genome, allows this method finding functional genes encoding tolerance to abiotic stresses in rice. This approach expected to reveal potential sources of useful genes, or factors and elements that control traits related to abiotic stresses, especially salinity stress in rice. Furthermore, the information obtained can be used to make rice plant or other crop varieties become more tolerant to salinity. The objectives of this research were to screen activation-tag mutant rice for salinity stress tolerance, sequence the Ds flanking regions of a candidate salinity tolerant mutant rice, and identify the insertion site and putative gene responsible for the phenotype.
Seventy-five lines were chosen from a 1000 fast screening experiment to identify mutant responsive to salinity stress. The mutant was validated in three screening batches at germinating stage in Yoshida solution containing 200 mM NaCl. Methods used to evaluate salinity tolerance were calculated from the value of Vigour Index and the percentage reduction. The insertion analysis of flanking sequence region in the rice genome was performed using TAIL-PCR. While the insertion area identification perfomed by bioinformatics analysis using several open-source databases.
Ten potential tolerant mutants, with the highest vigour index from 3,54 to 7,45 were identified. Insertion analysis of the mutant 170-10 showed that the Ds
elements has been transposed, based on 400 bp PCR result. band. A specific amplicon from mutant rice line 170-10 was successfully isolated with TAIL PCR
technique using AD2 degenerate primer and Ds3 specific primers. Bioinformatics based analyses found that the insertion is located in a putative coding sequence designated as Os11g0686500 located in chromosome 11.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB dan LIPI.
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
PENAPISAN DAN IDENTIFIKASI DAERAH
DS
PADA PADI MUTAN
PEMBAWA
ACTIVATION-TAG
UNTUK MENGUNGKAP
GEN TOLERAN TERHADAP CEKAMAN SALINITAS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Penapisan dan Identifikasi Daerah Ds pada Padi Mutan Pembawa Activation-Tag untuk Mengungkap
Gen Toleran Terhadap Cekaman Salinitas Nama : Anky Zannati
NIM : P051100181
Disetujui oleh Komisi Pembimbing
Dr Ir Utut Widyastuti, MSi Ketua
Dr Satya Nugroho Anggota
Diketahui oleh
Ketua Program Studi Bioteknologi
Prof Dr Ir Suharsono, DEA
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 23 Mei 2014
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah yang berjudul Penapisan dan Identifikasi Daerah Ds pada Padi Mutan Pembawa Activation-Tag untuk Mengungkap Gen Toleran terhadap Cekaman Salinitas berhasil diselesaikan.
Ucapan terimakasih penulis sampaikan kepada:
1. Dr Utut Widyastuti sebagai ketua komisi pembimbing dan Dr Satya Nugroho sebagai anggota komisi pembimbing yang telah memberikan bimbingan, arahan dan ilmunya kepada penulis.
2. Dr Ir Aris Tjahjoleksono, DEA selaku dosen penguji luar komisi yang telah memberikan saran dan masukan demi kesempurnaan tesis ini.
3. Kementrian Negara Riset dan Teknologi (KNRT) RI yang telah memberikan beasiswa pendidikan, hingga penulis bisa menyelesaikan studi pada program Pascasarjana Bioteknologi IPB.
4. Dana Penelitian Riset Kompetitif Lembaga Ilmu Pengetahuan Indonesia (LIPI) yang telah mendanai penelitian ini.
5. Keluarga besar laboratorium Genomik dan Perbaikan Mutu Tanaman, yang telah banyak memberikan bantuan atas kelancaran penelitian ini.
6. Kedua orangtua yang telah memberikan begitu banyak perhatian, dukungan dan do’anya kepada penulis.
7. Segenap sahabat mahasiswa S2 Bioteknologi IPB angkatan 2010 yang telah banyak memberikan motivasi dan bantuannya.
8. Segenap karyawan serta staff administrasi Program Studi Bioteknologi IPB, yang telah banyak membantu penulis dalam proses administrasi.
Serta semua pihak yang telah banyak memberikan motivasi, dan dukungannya serta menjadi inspirasi bagi penulis. Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2014
DAFTAR ISI
Sistem Transposon Ac/Ds untuk Analisis Fungsi Genom pada padi (Oryza sativa L) 14
Penapisan Cekaman Salinitas 21
Analisis Insersi 24 Analisis Sekuen Pengapit 28 Prediksi CDS di Daerah Insersi dengan Bioinformatik a 29
Prediksi CDS di Daerah Upstream dan Downstream Insersi 30
Prediksi CDS di Daerah Non-Coding 31
Prediksi Fungsi Gen Teridentifikasi dan Kaitannya dengan Toleransi Cekaman Salinitas: Protein Dinding Sel 32
DAFTAR TABEL
1 Hubungan EC dengan satuan yang lain dan dengan konsentrasi NaCl. Faktor konversi terkait total garam terlarut atau NaCl terhadap electrical
conductivity (EC) 1 dS/m 10
2 Electrical conductivity (EC) dari larutan pada 20oC. 10
3 Kondisi TAIL PCR 19
4 Nilai vigour index 10 mutan terbaik 22
5 Persentasi reduksi pertumbuhan 10 mutan dengan nilai terendah 24
6 Data hasil PCR gen hpt dan bar pada 10 galur mutan 25
DAFTAR GAMBAR
1 Fenomena efek rumah kaca 5
2 Perkiraan penurunan hasil tanaman padi dan jagung di daerah tropis
akibat pemanasan global dan perubahan iklim 6
3 Pengaruh salinitas terhadap hasil tanaman padi 7
4 Ringkasan skematik cekaman yang dapat terjadi dibawah
kondisi salinitas tinggi 9
5 Fenotip perkecambahan pada 17 hari setelah perlakuan salinisasi 21 6 Tingkat toleransi relatif tanaman pangan terhadap kondisi salin 23 7 Skema konstruksi padi mutan pembawa activation-tagging 25
8 Contoh hasil PCR gen hpt dan bar 26
9 Skema dari plasmid pMO mengandung elemen Ds 26
10 Hasil analisis PCR eksisi 27
11 Skema TAIL-PCR 28
12 Hasil TAIL-PCR pada padi mutan potensial galur 170-10 29
13 Skema gen Os11g0686500 30
14 Daerah insersi dan lokasi gen Os11g0686500 kromosom 11 30
DAFTAR LAMPIRAN
1 Hasil Uji Duncan pada Vigour index (Kontrol) 42
2 GrafikVigour index Kontrol 45
3 Hasil Uji Duncan pada Nilai Vigour index Perlakuan 46
4 Grafik Vigour index Perlakuan 49
5 Hasil Uji Duncan pada Nilai Persentase Reduksi Pertumbuhan 50
6 Grafik Nilai Persentase Reduksi Pertumbuhan 52
1
PENDAHULUAN
Latar Belakang
Masalah pangan dan ketahanan pangan di Indonesia tidak dapat dilepaskan dari konteks komoditas beras. Untuk mengamankan ketersediaan pangan dengan pertumbuhan penduduk mencapai 1,3% per tahun (BPS, 2010), maka dibutuhkan pertumbuhan produksi beras yang berkelanjutan, agar dapat memenuhi kebutuhan beras di Indonesia. Kebutuhan beras tahun 2015 akan mencapai lebih dari 37 juta ton dan pada tahun 2025 menjadi 41 juta ton, atau meningkat masing-masing 8% dan 27% dari tahun 2003 yang hanya 32 juta ton (Suryana, 2005). Oleh karena itu produksi padi menjadi faktor penting dalam pertanian di Indonesia.
Salah satu lahan yang dapat dimanfaatkan untuk meningkatkan produksi padi adalah pemanfaatan lahan marginal, seperti lahan pasang surut, yang belum diupayakan secara optimal untuk memenuhi dan mempertahankan kebutuhan pangan nasional. Areal pasang surut di Indonesia diperkirakan mencapai 20.11 juta ha, dengan 0.44 juta ha lahan salin yang merupakan salah satu lahan marginal yang dapat berpotensi menjadi areal persawahan. Pengelolaan yang baik dari potensi produksi padi lahan pasang surut dapat mencapai 5 ton/ha (Sudana, 2005).
Cekaman salinitas merupakan salah satu kendala utama untuk produksi sereal dunia, dimana seluas lebih dari 10% dari lahan di dunia telah rusak oleh salinitas. Di Asia, 12 juta hektar lahan budidaya terkena dampak oleh salinitas yang tinggi, sehingga perlu menjadi perhatian (Lafitte et al. 2004). Lahan marginal di Indonesia selain berupa areal pasang surut, areal persawahan yang terkena intrusi air laut telah menjadi salah satu masalah serius dalam produksi tanaman padi di Indonesia. Lahan persawahan yang mengalami intrusi air laut menyebabkan tanah bersifat salin saat ini semakin meluas. Daerah-daerah tersebut berada di sepanjang pantai utara dan selatan Pulau Jawa (Las et al. 2008). Sulawesi Selatan dan Flores (Nusa Tenggara Timur) juga telah mengalami intrusi air laut ke daratan dan telah masuk ke lahan pertanian (Sembiring et al. 2008).
Selain permasalahan tersebut, peningkatan produksi padi pada masa mendatang, akan banyak menghadapi tantangan yang semakin komplek, berkaitan dengan cekaman abiotik dan biotik akibat dampak perubahan iklim. Permasalahan yang tidak kalah penting lainnya adalah kurangnya varietas toleran cekaman lingkungan, terutama cekaman kadar garam yang tinggi. Pengembangan varietas unggul untuk menghadapi cekaman kini menjadi sangat penting.
Cekaman salinitas mempengaruhi pertumbuhan akar, batang dan luas daun, hal ini akibat ketidakseimbangan metabolik yang disebabkan oleh keracunan ion Na+, cekaman osmotik dan kekurangan hara (Munns, 2002). Tanaman padi sangat peka terhadap cekaman salinitas, khususnya pada fase perkecambahan. Cekaman salinitas pada padi dapat mengarah pada penurunan hasil (Lafitte et al. 2004). Kini melacak gen dengan sifat spesifik untuk fungsi menghadapi cekaman lingkungan, seperti cekaman salinitas, telah difasilitasi dengan tersedianya informasi genom lengkap sehingga memungkinkan adanya eksplorasi sifat-sifat molekul, ekspresi dan regulasi gen.
2
salah satu sistem yang banyak digunakan dalam mutasi insersi pada tanaman, yaitu antara lain pada Arabidobsis, wortel (Van Sluys et al.1987), tomat (Meissner
et al. 2000), lettuce (Yang, et al. 1993), tembakau (Fitzmaurice et al.1999), dan kentang (Knapp. et al. 1988). Studi yang telah dilakukan sebelumnya menunjukkan bahwa transposon Ac/Ds juga dapat digunakan pada padi sebagai mutagen insersional yang potensial (Izawa, et al. 1997). Sistem activation-tagging
dengan elemen Ds yang membawa empat salinan enhancer dapat diterapkan untuk melakukan mutasi overekspresi dan dapat digunakan pada padi untuk memaksimalkan upaya pencarian gen-gen penting (Upadhyaya et al. 2002). Pendekatan ini diharapkan dapat mengungkap potensi sumber gen bermanfaat, atau faktor dan elemen bermanfaat yang mengontrol sifat terkait cekaman abiotik, khususnya cekaman salinitas pada padi. Selanjutnya informasi yang diperoleh dapat dimanfaatkan untuk merakit padi atau bahkan varietas tanaman lainnya yang lebih toleran salinitas.
Pada penelitian sebelumnya, sebanyak 1000 populasi mutan padi pembawa Ac/Ds telah berhasil dikembangkan dan telah melalui fase penapisan massal untuk cekaman salinitas (data belum dipublikasi).
Tujuan Penelitian
Tujuan penelitian ini adalah melakukan penapisan populasi mutasi insersi padi atas respon terhadap cekaman salinitas pada fase perkecambahan, mengidentifikasi daerah insersi pada padi mutan pembawa activation-tag
3
2
TINJAUAN PUSTAKA
Padi Sebagai Tanaman Model
Padi (Oryza sativa L.) adalah salah satu spesies serealia paling penting di dunia, karena merupakan sumber kalori bagi lebih dari 50% penduduk dunia dan nilai ekonominya yang tinggi (David 1991). Padi telah menjadi model untuk tanaman monokotil karena akumulasi informasi molekuler untuk spesies ini (Sakata et al. 2000), efisiensi transformasi (Tyagi dan Mohanty 2000), ukuran genom yang kecil (430 Mb) (Arumuganathan dan Earle 1991).
Gen dari padi dapat menjadi acuan bagi tanaman serealia yang lain, seperti gandum, jagung, barley, dan sorgum (Gale dan Devos 1998). Sehingga analisis fungsional dari gen padi memiliki dampak yang luas untuk tanaman-tanaman ekonomis penting lainnya, karena informasi genom pada padi dapat dimanfaatkan secara luas. Pemanfaatan dapat dilakukan dalam mengembangkan produksi dan teknologi baik pada tanaman padi maupun tanaman pangan lainnya.
Melalui upaya terpadu berbagai lembaga, seluruh genom padi (Oryza sativa ssp. japonica) kultivar Nipponbare dan indica telah berhasil diurutkan (Goff et al, 2005; Yu et al. 2002). Melalui konsorsium internasional, yaitu International Rice Genome Sequencing Project (IRGSP) yang didirikan pada tahun 1997 telah diselesaikan pengurutan genom padi pada bulan Desember 2004. Genom padi yang telah dikenali sekuen genomnya meliputi dua sub-species padi yang berbeda, pada tahun 2002 oleh Syngenta (Torrey Mesa Research Institute, San Diego, Amerika Serikat ) untuk sub-species japonica dan BGI (Beijing Genomics Institute, Beijing, Cina) untuk sub-species indica (Goff et al. 2005; Yu
et al. 2002).
Produksi Padi dan Tantangannya
Perubahan iklim global akan menyebabkan perubahan dalam sistem pertanian. Produktivitas tanaman akan terganggu. Agro-ekosistem dapat berubah karena terjadinya cekaman kekeringan yang berkepanjangan, banjir dan salinisasi, yang selanjutnya akan mengancam ketahanan pangan (Rosenzweig dan Tubiello 2007).
Lahan pertanian, identik dengan wilayah pedesaan yang penduduknya memiliki mata pencaharian bergerak di sektor agraris. Penyempitan lahan pertanian merupakan suatu istilah yang digunakan untuk menggambarkan suatu kondisi dimana lahan pertanian di pedesaan sudah banyak berkurang (Irawan, 2005). Di Indonesia, masalah penyempitan lahan sudah terjadi selama bertahun-tahun. Menurut data dari tahun 1999-2002 penyempitan diperkirakan mencapai 330.000 ha atau setara dengan 110.000 ha/tahun. Hal ini disebabkan oleh munculnya sumber-sumber ekonomi baru di desa seperti industri modern, badan-badan perniagaan, perumahan dan lain-lain (Irawan, 2005).
Pemanasan global diprediksi masih tetap akan terjadi dalam beberapa dekade mendatang, dan akibatnya adalah permukaan air laut meningkat. Rusono
4
kenaikan muka air laut 0.5 m, maka luas lahan pertanian di Pulau Jawa akan hilang sebanyak 313 ribu hektar, dan dari angka ini 113 ribu hektar diantaranya adalah lahan sawah. Lahan yang terkena dampak kenaikan air laut ini, harus bertahan dengan kondisi garam yang tinggi.
Salinitas pada lahan pertanian telah menjadi salah satu masalah serius dalam produksi tanaman padi di Indonesia. Lahan persawahan yang mengalami intrusi air laut menyebabkan tanah bersifat salin saat ini semakin meluas. Daerah-daerah tersebut berada di sepanjang pantai utara dan selatan Pulau Jawa (Las et al.
2008). Selain itu juga di daerah Aceh dan Nias yang beberapa tahun yang lalu mengalami musibah tsunami. Sulawesi Selatan dan Flores (Nusa Tenggara Timur) juga telah mengalami intrusi air laut ke daratan dan telah masuk ke lahan pertanian (Sembiring et al. 2008).
Akibat luas lahan pertanian yang cenderung terus menurun, maka di masa mendatang jumlah beras yang dihasilkan diprediksi tidak mencukupi. Cekaman abiotik, termasuk kekeringan, salinitas, dan suhu rendah akan mempengaruhi pertumbuhan dan produktivitas tanaman. Lebih dari 50% produksi gabah bisa hilang akibat cekaman abiotik tersebut. Oleh karena itu, varietas padi di masa mendatang diharapkan tidak hanya berproduktifitas tinggi pada lingkungan normal, tetapi juga dapat mengurangi kehilangan produksi pada lingkungan dengan cekaman abiotik dan biotik (Ainsworth dan Donald 2010).
Perhitungan dari Badan Pusat Statistik Indonesia menyebutkan bahwa, pertumbuhan maksimal populasi rata-rata pada tahun 2005-2030 yaitu 1,3%. Diprediksikan pada tahun 2015 saja, konsumsi beras per kapita per tahun sudah sebesar 139 kg, maka masyarakat indonesia akan membutuhkan beras sekitar 61.577.000 ton. Oleh karena itu pada 2030 diprediksi, kebutuhan beras untuk makanan akan mencapai lebih dari 75 juta ton (Prabowo, 2007). Di Indonesia pada tahun 2010, luas area tanaman padi sekitar 13.118.120 Ha, dengan jumlah produksi padi (Gabah Kering Sawah) sekitar 65.980.670 ton. Populasi Indonesia pada tahun 2010 sebanyak 237.600.000 orang (BPS, Indonesia, 2011). Oleh karena itu ada sebuah tuntutan yang ditargetkan oleh pemerintah untuk mengupayakan ketersediaan bahan makanan. Hal ini menjadi tantangan tersendiri bagi para pembuat kebijakan, peneliti dan semua pemangku kepentingan lainnya.
Produksi Padi dan Perubahan Iklim
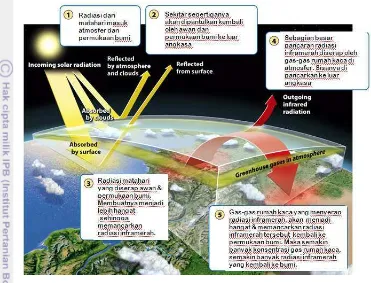
5 pemantulan kembali sebagian udara panas ke ruang angkasa. Akibatnya bumi dan atmosfer perlahan-lahan memanas (Freeman, 2012) (Gambar 1).
Gambar 1Fenomena efek rumah kaca ( Freeman, 2012)
Kenaikan suhu itu mungkin tidak terlalu tinggi, tetapi di negara tertentu seperti Indonesia, hal ini menyebabkan cuaca yang lebih ekstrem. Indonesia akan mengalami badai pesisir yang lebih sering dan lebih dahsyat, serta kemarau panjang dan curah hujan tinggi. Kenaikan muka air laut, akibat dari melelehnya gletser dan lapisan es di kutub, menyebabkan naiknya muka air laut antara 9 hingga 100 cm. Kenaikan ini akan mempercepat erosi di wilayah pesisir, memicu intrusi air laut ke air tanah, merusak lahan rawa di pesisir, dan menenggelamkan pulau-pulau kecil (Moediarta dan Stalker 2007).
6
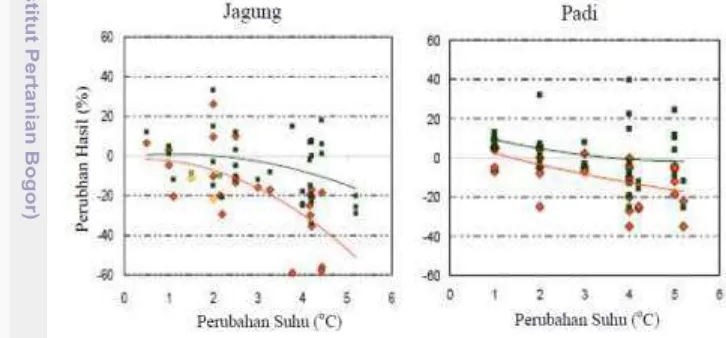
Perubahan iklim diperkirakan akan memberikan dampak yang signifikan terhadap produksi pertanian di Indonesia, khususnya tanaman pangan. Dampaknya dapat bersifat langsung yaitu menurunnya produktivitas karena meningkatnya suhu udara dan pola hujan, serta semakin seringnya gagal panen akibat meningkatnya frekuensi dan kejadian dampak iklim ekstrim seperti banjir, kekeringan dan salinitas (Boer et al. 2009). Secara tidak langsung, perubahan iklim dapat merubah jenis hama dan penyakit dominan pada tanaman pangan (Wiyono, 2008). Apabila teknologi pengendaliannya tidak dikembangkan pada waktu yang tepat, maka hal tersebut akan berakibat pada menurunnya hasil atau seringnya gagal panen akibat serangan hama dan penyakit. Hasil penelitian bahwa pemanasan global dan perubahan iklim pada wilayah tropis diperkirakan akan menurunkan produktivitas tanaman pangan secara signifikan apabila tidak dilakukan langkah-langkah adaptasi. Jagung lebih sensitif dari padi terhadap perubahan iklim. Penurunan hasil pada tanaman jagung dapat mencapai lebih dari 40% dan padi 20% apabila peningkatan suhu akibat pemanasan global meningkat sampai 5OC (Gambar 2).
Gambar 2 Perkiraan penurunan hasil tanaman padi dan jagung di daerah tropis akibat pemanasan global dan perubahan iklim (Tschirley, 2007)
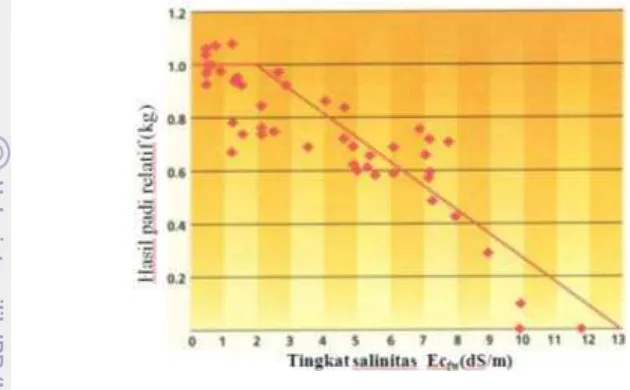
7 penelitian menunjukkan, produktivitas tanaman padi menurun secara linear dengan meningkatnya salinitas air tanah (Gambar 3).
Gambar 3 Pengaruh salinitas terhadap hasil tanaman padi (Grattan et al. 2002)
Cekaman Abiotik Salinitas
Cekaman abiotik menyebabkan masalah dalam pertanian dengan menghambat pertumbuhan dan produktivitas tanaman. Cekaman abiotik juga membatasi penggunaan lahan untuk pertanian, karena umumnya lahan yang tercekam abiotik menjadi lahan yang marjinal dan tidak digunakan (Lexer dan Fay 2005)
Tanaman adalah spesies sesil (tidak bisa berpindah tempat), maka tanaman harus bertahan pada kondisi lingkungan, bahkan pada kondisi yang merugikan. Hal ini menyebabkan tanaman memiliki berbagai respon untuk menyesuaikan diri terhadap perubahan lingkungan. Selama evolusi, tanaman telah mengembangkan mekanisme untuk merasakan perubahan minimal sekalipun dari kondisi pertumbuhan, hal ini memicu jalur sinyal transduksi, yang pada gilirannya mengaktifkan gen responsif terhadap cekaman lalu menyebabkan perubahan pada fisiologis dan tingkat biokimia. Padi adalah tanaman pangan bagi lebih dari setengah populasi dunia, yang peka terhadap berbagai cekaman abiotik, termasuk salinitas, kekeringan, rendaman dan suhu rendah (Lafitte et al. 2004).
gen yang terinduksi oleh cekaman abiotik telah dikarakterisasi. Gen-gen tersebut meliputi Gen-gen-Gen-gen yang menyandikan enzim-enzim yang diperlukan untuk biosintesis berbagai osmoprotektan, enzim-enzim yang menekan reactive oxygen species (ROS), protein-protein late embryogenesis abundant (LEA), enzim-enzim untuk detoksifikasi dan faktor transkripsi untuk cekaman abiotik seperti OsERF1 dan OsDREB1(Shinozaki et al. 2005). Gen ini digunakan para peneliti untuk membuat tanaman transgenik toleran cekaman abiotik.
8
keberlangsungan pertanian, yang dapat meningkat karena aktivitas manusia seperti irigasi pada wilayah arid dan semi-arid. Diperkirakan 20% dari lahan irigasi di dunia tergangganggu akibat salinisasi (Yeo 1999). Cekaman salinitas dapat menurunkan perkembangan dan produktifitas pada spesies glycophyte, yang pada umumnya merupakan produk pertanian.
Salinitas adalah salah satu faktor pembatas utama di lingkungan yang berpengaruh pada pertumbuhan dan produktivitas tanaman. Dampak dari salintas pada tanaman dapat diamati pada fase tanaman dewasa sejalan dengan kematian tanaman atau menurunnya produktivitas. Umumnya terdapat 2 mekanisme toleransi terhadap salinitas, yaitu tanaman mengembangkan mekanisme baik mengeluarkan garam dari sel ataupun untuk bertoleransi atas kehadiran garam dalam sel. Selama tanaman mengalami cekaman, semua proses penting seperti fotosintesis, sintesis protein, pembentukan energi dan metabolism lipid menjadi terganggu. Respon awal adalah reduksi dari luasan daun, selanjutnya terjadi penghentian pertumbuhan. Pertumbuhan dapat berlanjut lagi jika cekaman hilang. Karbohidrat yang dibutuhkan untuk pertumbuhan sel disuplai terutama dari proses fotosintesis, namun umumnya proses fotosintesis menurun pada tanaman yang tercekam salinitas khususnya salinitas karena NaCl (Parida dan Das 2005).
Toleransi terhadap salinitas tinggi adalah kemampuan tanaman untuk berkembang dan menyelesaikan siklus hidupnya pada suatu substrat yang mengandung konsentrasi garam terlarut yang tinggi. Tanaman yang dapat bertahan dalam kondisi konsentrsi garam tinggi di rhizosphere dan dapat tetap tumbuh dengan baik disebut dengan halophyte. Spesies halophyte obligate dapat hidup pada konsentrasi 50% air laut. Sedangkan halophyte fakultatif ditemukan pada area perbatasan salin dan non-salin (Parida dan Das 2005).
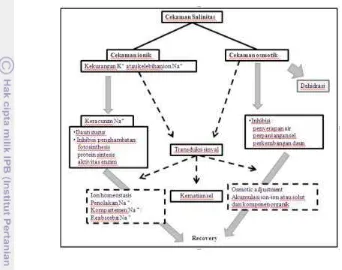
Definisi salinitas merepresentasikan seluruh masalah dari tanah akibat akumulasi berlebih dari garam, yang dapat dikatagorikan ke dalam tanah sodik (alkali) dan salin. Tanah sodik memiliki struktur yang lemah umumnya tersebar di wilayah kering dan agak gersang, mengandung Na+ dalam konsentrasi yang bentuk cekaman osmotik dan cekaman ionik (Gambar 4).
Cekaman osmotik disebabkan karena meningkatnya kadar garam di luar akar, yang akan menghambat penyerapan air oleh akar (Munns dan Tester 2008). Cekaman ionik terjadi akibat akumulasi ion Na+ pada tanaman, umumnya pada daun dengan kadar yang melebihi ambang batas, yang akan memicu pada kematian sel daun dengan terjadinya klorosis dan nekrosis, dan dilanjutkan dengan menurunnya aktivitas metabolism selular termasuk fotosintesis (Glenn et al. 1999) (Gambar 4).
9 antioksidan, dan kedelapan adanya induksi dari hormon-hormon tanaman (Iyengar dan Reddy 1996).
Gambar 4 Ringkasan skematik cekaman yang dapat terjadi dibawah kondisi salinitas tinggi dan respon tanaman untuk menghadapi cekaman tersebut (Horie et al. 2012)
10
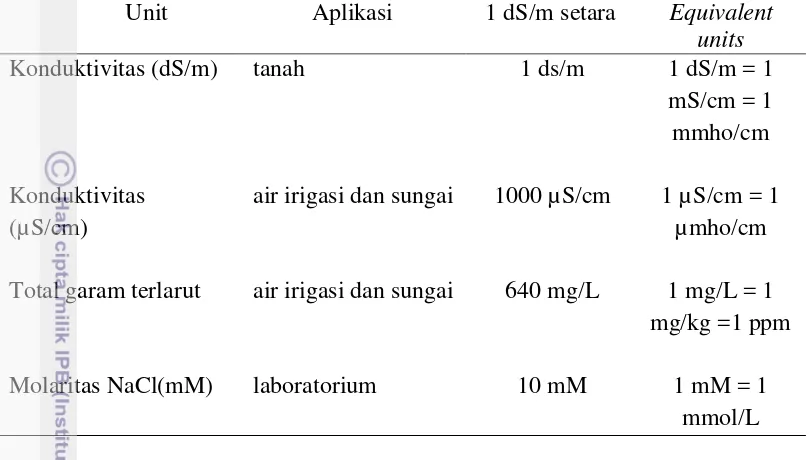
Tabel 1 Hubungan antara satuan konduktivitas listrik (EC) dan konsentrasi garam NaCl.
Unit Aplikasi 1 dS/m setara Equivalent
units
Konduktivitas (dS/m) tanah 1 ds/m 1 dS/m = 1
mS/cm = 1 mmho/cm Konduktivitas
(µS/cm)
air irigasi dan sungai 1000 µS/cm 1 µS/cm = 1 µmho/cm Total garam terlarut air irigasi dan sungai 640 mg/L 1 mg/L = 1
mg/kg =1 ppm
Molaritas NaCl(mM) laboratorium 10 mM 1 mM = 1
mmol/L
Tanaman padi relatif rentan terhadap salinitas tanah, dan NaCl adalah garam utama yang menyebabkan masalah ini (Flowers 2004). Secara umum, konduktivitas listrik atau electrical conductivity (EC) sampel tanah dari 4,0 deciSiemens per meter (dS/m) dianggap sebagai batas minimal untuk mendefinisikan tanah salin. Konsentrasi tinggi dari ion Na+ dalam tanah menyebabkan berbagai efek yang merugikan pada tanaman, seperti gangguan ion intraselular mengakibatkan perubahan homeostasis, disfungsi membran dan terhambatnya metabolisme mengakibatkan terhambatnya pertumbuhan dan akhirnya adalah penurunan hasil (Hasegawa et al. 2000).
Tabel 2 Electrical conductivity (EC) dari larutan pada 20oC .Konsentrasi larutan merupakan gambaran konsentrasi garam yang umumnya ditemukan pada tanah dan air laut.
Larutan EC (dS/m)
10 mM NaCl 1,0
100 mM NaCl 9,8
11 Forward dan Reverse Genetics
Pada tanaman, penyingkapan fungsi gen dengan pendekatan forward genetics yaitu pengungkapan dari fenotipe ke sekuen gen yang bertanggung jawab, diantaranya dapat dilakukan dengan map-based cloning, mutant analysis.
Fenotip akibat mutasi dianalisis, lalu mutasi dipetakan untuk menentukan gen atau aktivitas protein yang terpengaruh. Terdapatnya fenotipe mutan tertentu merupakan dasar awal untuk mengungkap proses biologis (Tierney dan Lamour 2005). Pendekatan genetika dan genomik pada tingkat molekuler telah merevolusi pemahaman tentang proses biologi. Pendekatan reverse genetics menjelaskan proses pengungkapan "dari gen ke fenotipe", dimana fungsi suatu gen dapat diselidiki dengan mengganggu ekspresi fisiologis gen tersebut. Reverse genetics
adalah suatu pendekatan yang dilakukan dengan mengganggu ekspresi gen dengan mutasi, sehingga dampak fenotipik dari gangguan genetik ini dapat lebih lanjut dianalisis. Sebagai contoh suatusekuen gen telah diketahui namun fungsi dari gen tersebut belum diketahui, maka knockout dapat dilakukan untuk mengetahui atau menganalisis fungsinya (Tierney dan Lamour 2005).
Strategi mutagenesis untuk mempelajari fungsi gen
Mutasi berasal dari kata Mutatus (bahasa latin) yang artinya adalah perubahan. Mutasi adalah perubahan susunan atau konstruksi dari gen maupun kromosom suatu individu tanaman, sehingga memperlihatkan penyimpangan (perubahan) dari individu asalnya dan bersifat baka (turun-temurun). Peristiwa terjadinya mutasi disebut mutagenesis. Makhluk hidup yang mengalami mutasi disebut mutan dan faktor penyebab mutasi disebut mutagen (mutagenic agent).
Mutasi dapat terjadi secara alamiah, tetapi frekuensinya sangat rendah, yaitu 10-6 pada setiap generasi. Untuk mempercepat terjadinya mutasi dapat dilakukan secara buatan dengan memberikan perlakuan-perlakuan sehingga terjadi mutasi (induced mutation). Mutasi pada tanaman dapat menyebabkan perubahan-perubahan pada bagian tanaman baik bentuk maupun warnanya juga perubahan-perubahan pada sifat-sifat lainnya (Herawati dan Setiamihardja, 2000).
Mutasi dapat dilakukan dengan beberapa mutagen, yaitu analog basa, mutagen kimia, dan mutagen fisik. Analog basa adalah senyawa dengan struktur kimia mirip dengan salah satu basa nukleotida sehingga dapat digabungkan dengan molekul DNA dalam proses replikasi. Analog basa dapat menginduksi mutasi karena dapat menyebabkan kesalahan dalam penyisipan nukleotida pada untaian DNA pasangannya. Senyawa ini dapat menyebabkan mutasi transisi. Contoh dari senyawa ini adalah 5-bromourasil (5-BU) dan 2-aminopurin (2-AP) (Yuwono, 2008).
12
N-methyl urethane), NMU (N-nitro-N-methyl urea), NEUT (N-nitrose-N-ethyl urethane) dan NEU (N-nitrose-N-ethyl urea) (Aisyah, 2006).Mutagen fisik secara khas dibedakan dari tipe radiasinya. Mutagen fisik yang sering digunakan diantaranya adalah sinar-x, sinar gamma, ultraviolet, dan neutron. Mutagen fisik lainnya adalah partikel alpha dan sinar devteron (Welsh, 1981).
Mutasi dapat terjadi pada setiap tahap perkembangan suatu organisme. Apabila terjadi di dalam jaringan somatik, mutasi mengakibatkan pola mosaik pada satu atau beberapa sel. Apabila di dalam jaringan generatif, mutasi dapat dipindahkan kepada keturunannya, tetapi tidak terlihat untuk beberapa generasi. Jaringan tertentu dari suatu organisme lebih sensitif terhadap mutagen daripada jaringan lain. Embrio lebih sensitif daripada jaringan yang sudah tak berkembang. (Crowder, 2006).
Tujuan mutasi pada tanaman adalah (1) untuk memperbaiki satu atau beberapa karakter khusus dari suatu kultivar/galur, (2) untuk membentuk penanda morfologi (warna) sebagai identitas pada galur-galur harapan, (3) untuk membentuk galur mandul jantan yang berguna bagi pembentukan kultivar hibrida, (4) untuk mendapatkan karakter khusus dalam genotipe (Herawati dan Setiamihardja, 2000).
Analisis fungsional gen bertujuan untuk menemukan korelasi antara fenotipe dan genotip pada mutan tertentu. Ada beberapa metode yang digunakan seperti kimia, fisik dan biologis untuk menciptakan mutan. Metode yang paling banyak digunakan adalah perlakuan ethyl methanesulfonate (EMS), iradiasi neutron, insersi T-DNA dan transposon. Korelasi antara fenotipe dan genotip pada mutan insersi T-DNA dan transposon dapat dengan mudah diidentifikasi (Ennis 2001).
Koleksi mutan dari insersi T-DNA dan transposon telah dilakukan oleh banyak peneliti di seluruh dunia untuk berbagai spesies tumbuhan dan telah digunakan untuk menganalisis fungsi gen dengan pendekatan forward dan
reverse genetics, terutama pada Arabidopsis sebagai tanaman model dikotil (Parinov dan Sundaresan 2000) dan padi sebagai tanaman model monokotil (Hirochika et al. 2004).
Mutasi insersi: transposon tagging
Seluruh genom padi (Oryza sativa ssp. kultivar Nipponbare (japonica) dan 93-11 (indica) telah berhasil diurutkan (Yu et al. 2002; Goff et al, 2002.) akan tetapi belum seluruh gen diketahui fungsinya. Oleh karena itu, salah satu tujuan yang paling menantang di era pasca genomic adalah untuk mengetahui fungsi-fungsi gen. Untuk memudahkan evaluasi tersebut, beberapa pendekatan reverse genetics telah dikembangkan, termasuk rekombinasi homolog, antisense atau RNAi (Chuang dan Meyerowitz, 2000), dan mutasi insersional (Jeon et al. 2000).
Gene trap dan activation tagging adalah dua metode yang sering digunakan dalam mutasi insersi. Gene trap dan activation tag memiliki kelebihan yaitu efisiensi yang tinggi, karena itulah dua metode ini sering digunakan dalam konstruksi insersi multi-fungsional T-DNA populasi mutan (Wan et al.2009)
13 menyebabkan fenotipe yang jelas akibat beragam faktor seperti redudansi fungsi gen. Karena itulah dengan meningkatkan ekspresi dari suatu gen diharapkan dapat menghasilkan fenotipe mutan yang lebih informatif. Strategi untuk menghasilkan mutan dengan ekspresi yang meningkat dikenal dengan metode activation tagging. Prinsip kerjanya adalah dengan penggunaan enhancer pada T-DNA atau transposon yang menghasilkan ekspresi atau overekspresi dari gen-gen sekitarnya akibat aktivasi transkripsi (Ramachandran dan Sundaresan 2001).
Transposon adalah element loncat yang dapat bertransposisi dari suatu lokasi ke lokasi lain dalam suatu genom (Hayes 2003). Terdapat sekuen DNA yang dapat menginsersikan dirinya pada lokasi yang baru dalam genom tanpa ada keterkaitan sebelumnya dengan target lokasi tersebut (Lewin 2004). Mutasi insersi dengan transposon telah banyak berhasil mengindentifikasi gen-gen terkait dengan sifat pathogenitas. Juga telah dikembangkan pada banyak hewan model dan tanaman model (Hayes 2003)
Activation tagging adalah metode untuk menghasilkan mutasi dominan pada tanaman atau sel tanaman dengan insersi random dari T-DNA yang membawa elemen enhancer, yang dapat menyebabkan aktivasi transkripsional dari gen (Memelink, 2003). Sejak pertama kali dilakukan activation tagging pada tanaman (Odell et al., 1985), gen fungsional telah banyak diisolasi (Nakazawa et al. 2003).
Transposon tagging telah menjadi alat yang ampuh untuk mengisolasi gen baru sejak elemen pengendali pertama kali ditemukan oleh McClintock (Fedoroff
et al. 1993). Sejumlah gen telah diisolasi menggunakan transposon sebagai dengan cara tagging seperti pada tembakau(Sundaresan, 1996).). Sistem transposon lainnya, seperti En / Spm (Enhancer / penekan-mutator) dan Mu (mutator), telah digunakan untuk kloning beberapa gen jagung (Walbot, 1992).
Strategi konvensional, seperti mutagenesis T-DNA atau transposons tagging, tidak dapat mengidentifikasi gen berfungsi pada beberapa tahap siklus hidup, misalnya pada pembentukan awal embrio atau pada fase gametofit (Weigel
et al. 2000).
Pada Arabidobsis hanya kurang dari 10% gen yang berhasil di-tagging, yang menunjukkan perubahan fenotipik. Oleh karena itu, untuk melengkapinya dibutuhkan teknologi yang dapat mengetahui fungsi gen yang masih belum terungkap. Salah satu teknik tersebut adalah sistem activation tagging yang telah dikembangkan dalam Arabidopsis (Weigel et al. 2000).
Sistem ini menggunakan vektor T-DNA yang mengandung multimerized transcriptional enhancer CaMV 35S diposisikan dekat T-DNA right border. Sistem transposon activation-tagging juga telah dikembangkan menggunakan elemen Ds yang sekaligus membawa enhancer tetramerized CaMV 35S (Mori et al. 2000). Sistem activation-tagging, T-DNA pool yang digunakan pada Arabidopsis, telah terkarakterisasi lebih dari 30 mutan dominan dengan berbagai fenotipe (Weigel et al. 2000). Analisis dari mutan menunjukkan bahwa vektor
14
Sistem Ac/Ds transposon untuk analisis fungsi genom pada padi
Di antara beberapa pendekatan analisis fungsi genom (Pereira 2000), mutasi insersional menggunakan transposon dianggap sebagai alat yang menjanjikan untuk penemuan fungsi gen padi (Jeon dan An 2001).Elemen Ac/Ds
dari jagung telah terbukti aktif pada kingdom tanaman secara luas. Sejumlah gen penting tanaman telah diklon menggunakan elemen Ac/Ds ( Ramachandran dan Sundaresan 2001). Pustaka insersi Ds telah dihasilkan di Arabidopsis (Ito et al. 2002) dan Padi (Kolesnik et al . 2004).
Sistem Ac/Ds jagung telah diuji untuk gen tagging pada padi. Pertama, elemen Ac telah berhasil dikloning ditempatkan antara promotor dan
phosphotransferase higromisin. Konstruksi tersebut kemudian dimasukkan ke dalam kromosom padi dengan transformasi menggunakan Agrobacterium. Transposisi dari elemen Ac terbukti dengan tanaman yang tahan terhadap antibiotik higromisin (Izawa et al. 1997).
Sistem gen tagging serupa Ac/Ds telah dikembangkan pada padi menggunakan metode introduksi gen dengan bantuan Agrobacterium (Nakagawa
et al. 2000) Metode ini membuat transgen lebih stabil dibandingkan dengan metode transfer gen langsung. Sebanyak 80% dari elemen Ds telah melompat dari situs integrasi asli, hal ini karena adanya aktivitas transposase Ac, yang menunjukkan bahwa sistem Ac/Ds adalah salah satu strategi yang mampu menghasilkan populasi mutan (Chin et al. 1999).
Bioinformatika
Bioinformatika, salah satu faktor pendukung dalam era analisis fungsi genom, didefinisikan sebagai pengembangan dan penerapan alat komputasi untuk penyimpanan, analisis dan interpretasi informasi biologis (Edwards dan Batley 2004). Bioinformatika adalah gabungan disiplin ilmu komputer, statistik dan biologi. Bioinformatika memfasilitasi analisis data genom dan pasca genomic, dan integrasi data terkait bidang trankriptomik, proteomik, metabolomik dan fenomik, dengan menggunakan database dan metode untuk manajemen yang efisien dan berguna untuk interpretasi informasi biologis dalam skala besar. Pada awalnya bioinformatika difokuskan untuk analisis data sekuen DNA, namun kini terlibat lebih dalam untuk merancang desain dan integrasi database sekuen DNA, penyelarasan urutan protein dan DNA, perakitan fragmen DNA ke dalam peta genom, dan prediksi fungsi gen berdasarkan perbandingan urutan dengan gen dengan fungsi yang telah diketahui.
Kemajuan dalam teknologi genomik telah menyebabkan ledakan data dan perkembangan dalam bioinformatika. Hal ini terjadi pada bidang bioteknologi tanaman maupun biomedis. Aplikasi dari bioinformatika telah meluas menjadi yang disebut sebagai teknologi omic, dan disiplin ini sekarang menjadi payung bagi bidang bioteknologi. Tantangan yang dihadapi bidang bioinformatika adalah untuk memberikan, baik berupa data yang terintegrasi bagi seluruh kerangka omic
15 tanaman kini untuk mengatasi isu-isu spesifik, yang bahkan mengantarkan kepada hubungan interdisiplin ilmu. Meskipun aplikasi bioinformatik kini menjadi luas bersama munculnya teknologi omic dan pasca genomic, namun fokus dan kekuatan tetap dalam analisis sekuen DNA dan genom (Edwards dan Batley 2004).
Revolusi dalam era genomik tanaman telah terjadi sejak dirilisnya hasil pengurutan sekuen genom lengkap Arabidopsis thaliana oleh Arabidopsis Genome Initiative pada tahun 2000, empat tahun lebih cepat dari rencana awal (TAGI 2000). Dua tahun kemudian, dilanjutkan dengan keberhasilan penyelesaian pengurutan sekuen genom padi (Oryza sativa L.ssp. Japonica Nipponbare) oleh konsorsium publik. Keberhasilan ini merupakan hasil sekuensing yang dilakukan oleh Syngenta (Goff et al. 2002) dan Monsanto (Barry, 2001) juga proyek penelitian yang terpisah di Beijing Genomics Institute yang bekerja pada subspesies indica (Yu et al. 2002). Adanya kesamaan genomik antara genom padi dan spesies tanaman pangan penting lainnya (Moore et al. 1995), menyebabkan penyelesaian pengurutan genom padi telah memiliki dampak yang signifikan terhadap bioteknologi tanaman dan bioinformatika.
Pertumbuhan pesat dalam informasi sekuen DNA menuntut pengembangan database sekuen DNA yang lebih spesifik. Database sekuen yang terbesar muncul pada tahun 1986, kolaborasi dari GenBank dan EMBL, dan bergabung tahun berikutnya dengan database DNA dari Jepang (Goff et al. 2002).
Database meta-sekuen ini dianggap standar baku untuk acuan sekuen DNA oleh publik di seluruh dunia dan berisi lebih dari 7,4 juta sekuen DNA tanaman.
Ketersediaan urutan genom lengkap, juga banyaknya data sekuen, mengharuskan data tersebut dapat diatur dan diambil manfaatnya. Terjadinya data yang tumpang tindih dalam penemuan gen sudah berkurang dengan adanya referensi atau konsensus database. Jika urutan genom tidak tersedia untuk tanaman tertentu, maka informasi genom sintetik yang terkait dapat digunakan. Terdapatnya database sekuen yang terus meningkat mendorong kemampuan bioinformatik yang lebih baik, terdapat juga kebutuhan untuk mengurangi tumpang tindih data. Pengembangan database telah disertai dengan kemajuan dalam alat untuk analisis data, memungkinkan peneliti untuk memberikan keterangan tentang suatu sekuen dan memungkinkan untuk mengkaji lebih dalam, dengan melihat interaksi antar data sekuen yang didapat sehingga informasi biologi yang diinginkan menjadi lebih lengkap (Edwards dan Batley 2004).
Perangkat pencarian kesamaan sekuen adalah dasar dari banyak aplikasi perangkat lunak untuk menganalisis informasi genomik tanaman. Memiliki kemampuan mengidentifikasi kemiripan dengan sekuen yang telah diketahui sebelumnya, dengan proses anotasi sekuen memungkinkan perbandingan dengan
database sekuen, sehingga mengurangi tingkat pengulangan dalam data dan memungkinkan teridentifikasinya variasi dalam suatu sekuen (Edwards dan Batley 2004).
BLAST menjadi sarana yang tercepat dengan mengidentifikasi sekuen tertentu dalam dataset yang besar dan memungkinkan untuk mengetahui informasi suatu sekuen yang baru (Altschul et al. 1990). Meskipun BLAST adalah alat standar untuk mengidentifikasi kesamaan suatu sekuen dalam dataset, ada beberapa pilihan lain, pilihan yang tergantung pada ketersediaan hardware, ukuran
16
17
3
METODE
Bahan
Benih padi Nipponbare mutan sebanyak 75 galur, yang diperoleh dari koleksi benih padi Pusat Penelitian Bioteknologi LIPI (Nugroho, 2006) yang telah melalui penapisan masal salinitas. Benih padi varietas Pokkali digunakan sebagai kontrol toleran, IR-29 sebagai kontrol peka dan Nipponbare sebagai kontrol isogenik.
Larutan nutrisi (Yoshida Solution) mengandung makronutrien sebagai berikut: NH4NO3, K2SO4, KH2PO4, K2HPO4, CaCl2. 6H20 and MgSO4.7H2O, dan mikronutrient sebagai berikut: MnCl2.4H20, NH4, Mo7O24.4H2O, H3BO3, ZnSO4.7H2O, CuSO4.5H2. Pasangan primer untuk analisis insersi yaitu primer Bar-48-F (5’ ACCATGAGCCCAGAACGACGC-3’) dan Bar-540-R (5’- CAGGCTGAAGTCCAGCTGCCAG-3’), dan juga pasangan primer HPT–F (5’
-GCATCTCCCGCCGTGCAC-3’) dan HPT-R (5’
-GATGCCTCCGCTCGAAGTAGCG 3’). Primer untuk PCR eksisi RB
-pMOG22-F atau disebut dengan primer P1 (5’-GGAAACGACAATCTGATCTCTAGG-3’),
Ac-prom-R atau disebut primer P3 (5’-CTCAGTGGTTATGGATGGGAGTTG-
3’) dan Ac-Lj-R atau disebut dengan primer P2 (5’
-AACGAAACGGGATCATCCCG-3’). Primer untuk analisis sekuen pengapit,
yaitu 3 buah primer spesifik Ds5’-1a (5’
-ACGGTCGGGAAACTAGCTCTAC-3’), Ds5’-2a (5’- TCCGTTCCGTTTTCGTTTTTTAC-3), dan Ds5’-3a (5’-
TATACGATAACGGTCGGTAC-3’). Tiga buah primer spesifik TOS T17TAIL2 (5’- AGT CGC TGA TTT CTT CAC CAA GG -3’), T17TAIL3 (5’- GAG AGC ATC ATC GGT TAC ATC TTC TC-3’), T17TAIL4 (5’- ATC CAC CTT GAG
TTT GAA GGG 3’), dan arbitrary primer AD1 (5’- NTC GA(G/C) T(A/T)T
(G/C)G (A/T) GTT-3’), AD2 (5’- NGT CGA (G/C)(A/T)G ANA (A/T)GA A-3’),
18 toleran, IR-29 sebagai kontrol peka, dan benih Nipponbare non-mutasi. Penapisan dilakukan dengan mengecambahkan benih padi pada larutan Yoshida (Yoshida
Solution) yang mengandung 200 mM NaCl pH 5.5, untuk menciptakan kondisi salin. Galur-galur padi diberi perlakuan selama 17 hari. Sebanyak 75 galur padi mutan tersebut, dibagi dalam tiga kelompok percobaan penapisan yang berbeda, untuk memudahkan pengamatan fenotipe. Tiga kelompok percobaan tersebut adalah kelompok percobaan validasi A, validasi B dan validasi C. Metode validasi galur padi mutan ini merupakan optimasi prosedur dari IRRI (Gregorio 1997).
Evaluasi gejala visual keracunan garam, dilakukan pada hari ke 17 setelah salinisasi. Setiap benih diukur panjang daun dan panjang akar, lalu pada setiap botol dihitung persentasi perkecambahannya. Terdapat 2 pendekatan yang digunakan untuk mengevaluasi toleransi terhadap salinitas, yaitu yang pertama adalah dengan menghitung Vigour index: (Panjang daun (cm) + Panjang Akar (cm) x % Perkecambahan benih), menentukan mutan yang rentan dan toleran, berdasarkan kemampuan benih untuk tumbuh dan berkembang pada larutan nutrisi yang telah disalinisasi (Karnataka 2009). Pendekatan kedua dengan menghitung persentase reduksi dengan rumus Reduksi Pertumbuhan = (1-(pertumbuhan perlakuan/pertumbuhan kontrol))x 100%) dihitung untuk mengetahui persentase reduksi pertumbuhan dalam keadaan salinisasi.
Isolasi DNA Genomik
19
Analisis PCR
Analisis PCR, dilakukan untuk mengetahui pola insersi melalui amplifikasi gen hpt dan bar menggunakan pasangan primer spesifik gen bar (Bar-48-F dan Bar-540-R) dan pasangan primer spesifik gen hpt (HPT-R dan HPT-F). Proses PCR gen bar melalui tahapan denaturasi DNA cetakan pada suhu 95oC selama 1 menit, suhu annealing 67 oC selama 1 menit, suhu elongasi 72oC selama 1 menit dan dilakukan sebanyak 30 siklus. Sedangkan PCR gen hpt melalui tahapan denaturasi DNA cetakan pada suhu 95oC selama 1 menit, suhu annealing
62 oC selama 1 menit, suhu elongasi 72oC selama 1 menit dan sebanyak 30 siklus. Analisis PCR juga dilakukan untuk menetahui aktifitas transposon Ds. PCR dilakukan dengan menggunakan dua pasangan primer yang pertama adalah pasangan primer P1-P3, dan pasangan primer kedua adalah P1-P2 suhu annealing
yang digunakan adalah 60oC. Amplikon hasil PCR tersebut dipisahkan pada gel agarose 0,8% dengan menggunaan larutan penyangga 0,5xTBE. Hasil pemisahan divisualisasi setelah sebelumnya dilakukan pewarnaan dengan larutan ethidium bromide dengan konsentrasi 10 mg/ml.
Analisis Sekuen Pengapit daerah insersi
Analisis sekuen pengapit (flanking sequence) daerah insersi pada genom padi dilakukan menggunakan metoda TAIL-PCR (Thermal Asymmetric Interlaced
PCR) (Liu et al,1995) menggunakan DreamTaq DNA polymerase (Sigma). TAIL-PCR dilakukan dengan menggunakan 3 primer nested spesifik pada transposon Ds yaitu Ds5’-1a, Ds5’-2a, Ds5’-3a dan primer degenerate (random) yaitu AD1, AD2, AD3.
20
Reaksi pertama dilakukan dalam volume total 20 µl, terdiri atas 1 ul DNA konsentrasi 100ng, 0,4 µl primer Ds1 10µM, DreamTaq Green (Thermo-Scientific) 10 µl, AD primer 10µM (4 µl AD1, 6 µl AD2 dan 8 µl AD3). Produk PCR reaksi pertama diambil 1 µl, lalu dibuat konsentrasi 50x pengenceran.
Reaksi kedua dalam volume total 20 µl, terdiri atas 1 µl DNA dari pengenceran 50x, 0,4 µl primer Ds2 10µM, DreamTaq Green (Thermo-Scientific) 10 µl, AD primer 10µM (5,6 µl AD1, 4,6 µl AD2 dan 4,6 µl AD3). Produk PCR reaksi kedua diambil 1 µl, lalu dibuat konsentrasi 20x pengenceran.
Reaksi ketiga dilakukan dalam volume total 100 µl, terdiri atas 0,6 µl DNA dari pengenceran 20x, 0,4 µl primer DS3 10µM, DreamTaq Green ( Thermo-Scientific) 10 µl, AD primer 10µM (3 µl AD1, 4 µl AD2 dan 4 µl AD3). Seluruh produk PCR dianalisis dengan menggunakan elektroforesis gel agarose 0,8%.
Pengurutan DNA
Amplikon dipurifikasi menggunakan DNA Extraction Kit (Fermentas) kemudian dilakukan pengurutan DNA. Pengurutan DNA dilakukan oleh PT. Genetica Science. Untuk proses pengurutan DNA dibutuhkan 35 ng DNA sampel sebanyak minimal 30 µl.
Identifikasi Daerah Insersi dengan Bioinformatik
21
4
HASIL DAN PEMBAHASAN
Penapisan Cekaman Salinitas
Penapisan mutan pada penelitian kali ini merupakan langkah validasi yang dilakukan untuk mengetahui konsistensi toleransi dan kepekaan terhadap perlakuan garam yang sebelumnya telah dilakukan secara masal (data belum dipublikasi). Dari hasil pengamatan pada hari ke-17 setelah perkecambahan pada perlakuan 200mM NaCl, mutan-mutan yang memiliki toleransi, menunjukkan fenotipe perkecambahan yang lebih baik jika dibandingkan dengan varietas kontrol (Gambar 5). Fenotipe perkecambahannya, seperti radikula (bakal akar), dan plumula (bakal daun) tumbuh dengan lebih baik (Karnataka et al. 2009).
Gambar 5 Fenotipe perkecambahan pada 17 hari setelah perlakuan salinitas. A) fenotipe galur mutan potensial 170, 870 dan 654. B) fenotipe varietas kontrol Pokkali, Nipponbare dan IR-29.
Pada penelitian ini persentase perkecambahan, panjang akar, panjang tunas dan vigour index menjadi parameter di dalam mengevaluasi padi mutan toleran salinitas dengan perlakuan 200 mM NaCl. Hal ini dapat dilihat dari hasil analisis dengan rumus vigour index, mutan yang potensial adalah mutan yang memiliki nilai vigour index yang tinggi (Wang et al. 2010).
Analisis varian (ANOVA) dilakukan pada data yang dikumpulkan dengan menggunakan SPSS versi 13 untuk menentukan variasi diantara mutan, pada perlakuan maupun kontrol. Rata-rata vigour index dan persentase reduksi pertumbuhan pada perlakuan dan kontrol dibandingkan dengan menggunakan uji Duncan. Analisis varian nilai vigour index menunjukkan perbedaan yang signifikan antara perlakuan dan kontrol (Lampiran 2).
Dari hasil evaluasi validasi mutan didapatkan 10 mutan potensial toleran salinitas, dengan nilai vigour index tertinggi, yaitu mutan 170 (7,45), 480 (5,65), 870 (5,50), 654 (4,86), 504 (4,54), 994 (4), 788 (3,86), 492 (3,72), 541 (3,62) dan 151 (3,54) (Tabel 4). Nipponbare sebagai varietas kontrol isogenik memiliki nilai
vigour index rata-rata dari 3 ulangan yaitu sekitar 1,01, lebih rendah dibandingkan nilai vigour index 10 mutan tersebut (Lampiran 3). Mutan-mutan dengan nilai
22
toleransi yang lebih baik terhadap perlakuan 200 mM NaCl. Mutan–mutan potensial tersebut menunjukkan perkembangan parameter tumbuh; yaitu panjang daun dan panjang akar, yang lebih baik dibanding dengan Nipponbare sebagai varietas kontrol isogenik. Karnataka (2009) menyatakan bahwa nilai vigour index
dapat dijadikan dasar penentuan suatu tanaman toleran terhadap suatu cekaman abiotik termasuk salinitas.
Tabel 4 Nilai vigour index 10 mutan terbaik dari 3 percobaan validasi
Nomor 1 2 3 4 5 Keterangan: Huruf yang berbeda menunjukkan perbedaan
antar mutan berdasarkan uji Duncan pada p<0.05.
Penurunan pertumbuhan pada penelitian ini menunjukkan bahwa konsentrasi salinitas sebesar 200mM NaCl atau setara dengan 20 dS/m dapat mengurangi perkembangan pada tahap perkecambahan. Pada penelitian ini validasi dilakukan dengan konsentrasi 200mM NaCl, merupakan konsentrasi hasil optimasi penelitian sebelumnya (Nugroho, 2006). Pada cekaman salinitas menurut Maas (1994) terdapat klasifikasi tingkat toleransi relatif tanaman pangan terhadap kondisi salinitas, yaitu sensitif, moderat sensistif, moderat toleran dan toleran. Menurut klasifikasi tersebut, mutan yang dapat bertahan dalam perlakuan 200mM NaCl dianggap sebagai mutan yang moderat toleran. Hal ini juga sesuai dengan tingkat toleransi relatif tanaman pangan terhadap kondisi salinitas (Gambar 6), bahwa kemampuan tumbuh tanaman pada rentang 15 dS/m hingga 20 dS/m atau setara dengan 150 mM NaCl/L hingga 200mM NaCl/L tanaman sudah dapat dikatagorikan sebagai moderat toleran terhadap salinitas (Maas, 1994).
23
Gambar 6 Tingkat toleransi relatif tanaman pangan terhadap kondisi salinitas (Maas, 1994)
24
Tabel 5 Persentasi reduksi pertumbuhan 10 mutan dengan nilai terendah
Nomor 1 2 3 4 5
Galur 170 114 870 151 869
Vigour Index
56,59U 60U 74,02T 77,67TS 77,86TRS
Nomor 6 7 8 9 10
Galur 480 532 654 504 295
Vigour Index
78,63TQRS 79,11TPQRS 79,31QTPQRS 79,87NQTPQRS 80,51MNOTPQRS
Keterangan: Huruf yang berbeda menunjukkan perbedaan antar mutan berdasarkan uji Duncan pada p<0.0.
Pendekatan dengan menghitung persentase reduksi pertumbuhan, dapat digunakan sebagai pendukung untuk menentukan galur mutan potensial. Seperti contohnya pada mutan 170 dengan nilai vigour index yang tertinggi sekaligus memiliki nilai persentasi reduksi yang terendah. Padi mutan yang menunjukkan toleransi yang lebih baik terhadap perlakuan 200mM NaCl pada masa perkecambahan dalam penelitian ini dapat diasumsikan sebagai mutan-mutan potensial toleran salinitas. Asumsi ini diambil melalui analisis data nilai Vigour index dan persentase reduksi.
Analisis Insersi
Analisis insersi dilakukan untuk mengetahui keberadaan dari elemen
Ac/Ds, mengetahui pola insersinya dalam genom padi, dan menentukan strategi isolasi gen. Konstruksi plasmid mutasi insersi activation tagging yang digunakan pada penelitian ini seperti pada Gambar 7. Pada elemen Ds terdapat gen bar
25
Gambar 7 Skema konstruksi plasmid pembawa activation-tag. Pada elemen Ds terdapat gen bar di bawah kendali promotor Ubi
dan mengandung enhancer. Elemen Ac mengandung gen penanda ketahanan terhadap hygromisin (hpt) di bawah kendali promotor 35S.
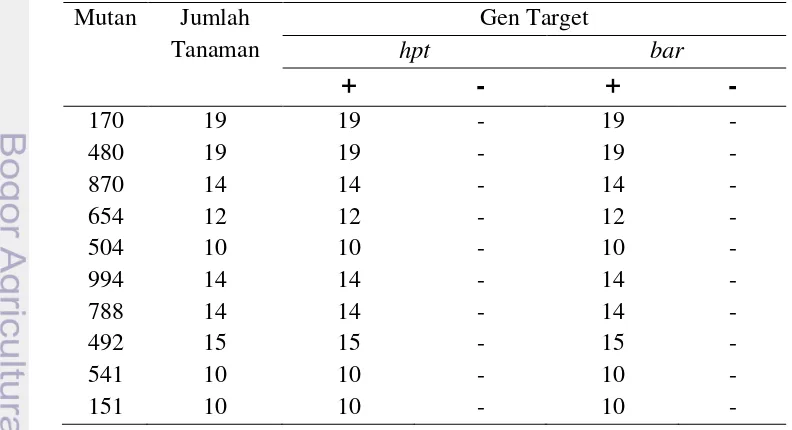
Dalam rangka mengetahui keberadaan elemen Ds dan Ac pada tanaman padi mutan, maka dilakukan analisis PCR. Analisis dilakukan dengan mengamplifikasi gen bar dengan pasangan primer Bar-48-F dan Bar-540-R, dan akan didapatkan pita berukuran 350pb (Gambar 8). Sedangkan untuk mengetahui keberadaan elemen Ac, dilakukan dengan mengamplifikasi gen hpt menggunakan pasangan primer HPT-R dan HPT-F, dan akan didapatkan pita berukuran 500pb (Gambar 8). Dari hasil PCR tersebut diketahui bahwa pada 10 mutan potensial masih memiliki elemen Ac dan Ds (Tabel 6).
Tabel 6 Data hasil PCR gen hpt dan bar pada 10 mutan dengan nilai vigour index tertinggi
Mutan Jumlah Tanaman
Gen Target
hpt bar
+
-
+
-
170 19 19 - 19 -
480 19 19 - 19 -
870 14 14 - 14 -
654 12 12 - 12 -
504 10 10 - 10 -
994 14 14 - 14 -
788 14 14 - 14 -
492 15 15 - 15 -
541 10 10 - 10 -
26
Gambar 8 Contoh hasil analisis PCR gen hpt (A) dan Gen bar
(B). (W) = air, (+) = kontrol galur mutan positif
bar, (-) = kontrol galur mutan negatif bar. 1 – 15 = sampel galur mutan.
Setelah mengetahui keberadaan elemen Ds dan Ac pada tanaman padi mutan, maka pola insersinya di dalam genom padi perlu diketahui. Pola insersi diketahui melalui aktivitas elemen Ds. Untuk mengetahui aktivitas transposisi elemen Ds dilakukan analisis PCR pada 10 galur mutan potensial tersebut. PCR dilakukan dengan pasangan primer P1dan P2 dan pasangan primer P1 dan P3. Transposisi Ds terjadi jika teramplifikasi pita berukuran sekitar 400 pb, yaitu pita yang dihasilkan oleh amplifikasi dari primer P1 dan P3. Pada kondisi Ds tidak bertransposisi, ditandai dengan munculnya pita berukuran sekitar 350 pb yang dihasilkan oleh pasangan primer P1-P2 (Gambar 9).
27 Dari hasil PCR (Gambar 10) didapatkan bahwa pada galur mutan 870-16 (sumur nomor 5-6), 170-10 (sumur nomor 49-50) dan 504-4 (sumur nomor 51-52) elemen Ds bertransposisi, hasil PCR menunjukkan pita berukuran sekitar 400 pb dari pasangan primer P1-P3, sedangkan amplifikasi primer P1-P2 menunujukkan hasil negatif. Hal ini berarti elemen Ds telah bertransposisi. Sedangkan elemen Ds
yang tidak bertransposisi contohnya terjadi pada galur mutan 870-3 (sumur sampel nomor 9-10), 480-12(sumur sampel nomor 37-38), 170-12 (sumur sampel nomor 41-42), dan 654-1(sumur sampel nomor 81-82).
Elemen Ds yang tidak bertransposisi terjadi pada mutan-mutan tersebut, hal ini diketahui dengan teramplifikasinya pita berukuran sekitar 350 pb dari pasangan primer P1-P2 sedangkan amplifikasi dengan pasangan primer P1-P3 tidak menghasilkan amplifikasi. Mutan dengan elemen Ds yang tidak bertransposisi dapat terjadi, disebabkan karena hilangnya mobilitas pada generasi lanjut misalnya pada generasi ke-6, meskipun Ac masih aktif (Izawa et al. 1997). Menurut Greco et al (2003), metilasi dari gen bar diduga juga sebagai sebab terhambatnya aktifitas Ac/Ds pada generasi lanjut. Hal lain juga disebabkan oleh
silencing (pembungkaman) gen akibat meningkatnya metilasi dari residu sitosin pada daerah promoter ubiquitin yang terkait dengan gen bar (Izawa et al. 1997).
Gambar 10 Hasil analisis PCR. Angka ganjil adalah hasil PCR menggunakan Primer P1 dan P3, yaitu pita berukuran ±400 pb menunjukkan elemen Ds
28
Pada hasil PCR eksisi didapatkan amplifikasi dari pasangan primer P1-P3 sekaligus P1-P2, seperti contohnya pada mutan 994-6 (sumur nomor 21-22), 170-13 (sumur nomor 43-44), dan 541-3 (sumur nomor 63-64) (Gambar 10) ((Lampiran 7). Terdapatnya galur mutan yang menunjukkan hasil amplifikasi demikian, diduga adalah mutan multiple-copy atau memiliki salinan ganda, yaitu suatu populasi mutan, pada generasi lanjut terdapat kemungkinan terjadinya multiple transposition. Singh et al. (2006) menyebutkan bahwa mutan dengan
multiple-copy atau salinan ganda pada suatu generasi dapat terjadi sebanyak 20 - 40% populasi.
Setiap mutan tersebut bersifat independen, sehingga insersi yang terjadi akan berbeda satu dengan lainnya, hal inilah yang menyebabkan terjadinya transposisi bervariasi pada setiap galur mutan (Izawa et al. 1997). Keberadaan mutan dengan elemen Ds yang bertransposisi ini juga menandakan bahwa sistem mutasi insersi activation tagging dalam penelitian ini, dapat digunakan dan aktif di dalam padi.
Analisis Sekuen Pengapit
Mutasi insersi dengan pendekatan transposons Ac/Ds yang membawa
activation tagging telah menjadi metode yang penting untuk mempelajari fungsi gen pada tanaman. Analisis insersi dilakukan salah satunya bertujuan untuk mengetahui strategi isolasi gen. Untuk mengidentifikasi insersi gen, maka perlu diketahui sekuen genomiknya. Namun, sekuen gen yang sudah di tagging tidak bisa langsung diisolasi, karena merupakan sekuen yang belum diketahui. Maka dilakukanlah TAIL-PCR untuk mengisolasi flanking region atau daerah pengapit (Gambar 11).
Gambar 11 Skema TAIL PCR. Strategi TAIL PCR dilakukan dengan 3 tahap PCR menggunakan 3 nested primer (SP1,SP2,SP3) dan arbitrary degenerate primer (AD).
Analisis sekuen pengapit daerah insersi transposon Ds dilakukan dengan
Thermal Asymmetric Interlaced PCR (TAIL-PCR) (Liu dan Whitter 1995). Sampel yang dipakai pada TAIL-PCR untuk mengetahui Ds flanking sequences
adalah DNA genomik dari tanaman yang toleran terhadap salinitas, tahan terhadap
29
Gambar 12 Hasil TAIL-PCR pada padi mutan potensial galur 170-10 (kotak merah) sebesar 250 pb. M = marker, Ds1= primer spesifik 1, Ds2 = primer spesifik 2, Ds3 = primer spesifik 3, AD1 = primer
arbitrary degenerate 1, AD2 = primer arbitrary degenerate 2, AD3 = primer arbitrary degenerate 3.
Galur mutan 170 termasuk dalam 10 mutan potensial yang memiliki toleransi paling baik terhadap perlakuan salinitas 200 mM NaCl. Sub-galur mutan 170-10 merupakan mutan dengan Ds yang telah bertransposisi, hal ini dilihat dari data PCR eksisi yang menunjukkan teramplifikasinya pita berukuran 400 pb. Maka untuk elemen Ds telah bertransposisi, salah satu strategi untuk mendapatkan informasi mengenai daerah insersi adalah dengan menggunakan primer spesifik Ds1, Ds2, Ds3 dan arbitrary degenerate primer AD1, AD2 dan AD3. Pada penelitian ini telah berhasil didapatkan produk TAIL-PCR dari mutan 170-10 berupa pita hasil dari amplifikasi primer spesifik Ds3 dan primer AD2 sebesar 250 pb, yang kemudian di purifikasi, untuk analisis sekuensing (Gambar 12).
Prediksi CDS di Daerah Insersi dengan Bioinformatika
Hasil identifikasi gen Os11g0686500 dilakukan melalui analisis in-silico
dengan bioinformatika. Analisis dilakukan dengan menggunakan beberapa
database yang bersifat publik (open-source) yaitu www.ncbi.nlm.nih.gov, www.gramene.org, www.softberry.com, www.geneontology.org dan www.expasy.org. Identifikasi melalui BLAST dari hasil sekuensing galur mutan 170-10 menunjukkan bahwa insersi berada pada exon 2. Gen Os11g0686500
berukuran 4,044 kb pada kromosom 11. Os11g0686500 terdiri atas 2 exon dan 1
intron (Gambar 13). Insersi yang terletak pada exon dari gen Os11g0686500, memungkinkan terjadinya gangguan fungsi gen yang terkait (Ramachandran dan Sundaresan. 2001). Hasil analisis BlastN menunjukkan bahwa gen
Os11g0686500 memiliki kemiripan 90% dengan gen pikm2-TS dan pikm2-TS,
30
Gambar 13 Skema gen Os11g0686500. Meliputi daerah exonintron, untranslated region (UTR), dan daerah lokasi insersi.
Predikasi CDS di daerah upstream dan downstream insersi
Mutasi insersi dengan sistem activation tagging memiliki kelebihan yaitu dengan adanya suatu transkripsi kuat dari enhancer, yang dapat mengaktifkan ekspresi gen pada lokasi sekitar enhancer tersebut dalam genom. Enhancer yang paling umum digunakan adalah kombinasi quadruple dari CaMV 35S enhancer
disebut dengan 4x enhancer, yang dapat memfasilitasi ekspresi gen sekitar dengan orientasi manapun (Weigel et al. 2000) yaitu ke arah upstream maupun
downstream daerah insersi dan berfungsi hingga jarak tertentu (ribuan nukleotida) (Ramachandran dan Sundaresan, 2001). Pada mutasi insersi dengan activation tagging selain fungsi insersi yang dianalisis, fungsi enhancer juga dianalisis. Oleh karena itu, untuk menentukan hubungan antara daerah insersi dengan fenotipe yang muncul diperlukan juga informasi mengenai adanya gen di sekitarnya baik pada daerah upstream maupun downstream yang aktifitasnya mungkin dipengaruhi oleh activation tagging .
Gambar 14 Daerah insersi dan lokasi gen Os11g0686500 di dalam kromosom 11 berserta gen-gen yang terdekat yang ada disekitarnya yaitu