PENGENDALIAN INFEKSI
Aeromonas hydrophila
PADA IKAN
LELE DENGAN MIKROKAPSUL PROBIOTIK PADA DOSIS
DAN FREKUENSI BERBEDA
LILIK SETIYANINGSIH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Pengendalian Infeksi Aeromonas hydrophila pada Ikan Lele dengan Mikrokapsul Probiotik pada Dosis dan Frekuensi Berbeda adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2016
RINGKASAN
LILIK SETIYANINGSIH. Pengendalian Infeksi Aeromonas hydrophila pada Ikan Lele dengan Mikrokapsul Probiotik pada Dosis dan Frekuensi Berbeda. Dibimbing oleh WIDANARNI, ANGELA MARIANA LUSIASTUTI dan MUNTI YUHANA.
Salah satu permasalahan utama pada budidaya ikan lele adalah munculnya penyakit Motile Aeromonad Septicemia (MAS) yang disebabkan oleh bakteri A. hydrophila. A. hydrophila merupakan bakteri yang termasuk ke dalam patogen oportunistik dan dapat menyebabkan kematian tinggi (80-100%) pada ikan budidaya. Salah satu solusi yang diharapkan sebagai upaya penanggulangan infeksi bakteri A. hydrophila adalah pemberian probiotik. Bakteri probiotik dapat bersifat kompetitor terhadap patogen dalam memanfaatkan nutrien dan melindungi ikan dari infeksi melalui peningkatan imunitas. Penggunaan probiotik multispesies diketahui memiliki efektivitas yang lebih tinggi dalam menghambat penyebaran beberapa jenis penyakit bakterial, namun probiotik dalam bentuk kultur sel memiliki keterbatasan dalam masa penyimpanan dan mudah rusak oleh pengaruh lingkungan. Salah satu upaya yang dapat dilakukan untuk mempertahankan viabilitas probiotik adalah melalui penggunaan teknologi mikroenkapsulasi.
Bakteri probiotik yang digunakan adalah B. cereus (P22) (108 CFU ml-1) dan S. lentus (L1k) (108 CFU ml-1) dengan penanda molekuler resisten antibiotik (Rifampisin untuk P22 dan Chloramfenicol untuk L1k) dan dimikroenkapsulasi menggunakan metode spray drying. Uji in vivo menggunakan ikan lele strain mutiara dengan bobot rata-rata 3.72±0.51 g. Ikan uji dipelihara selama 40 hari dan diberi pakan komersial kadar protein 30% secara at satiation tiga kali sehari. Percobaan meliputi K- (kontrol negatif), K+ (kontrol positif), A (pakan+mikrokapsul probiotik (MP) dosis 0.5% frekuensi setiap hari), B (pakan+MP dosis 0.5% frekuensi tiga hari sekali), C (pakan+MP dosis 1% frekuensi setiap hari), D (pakan+MP dosis 1% frekuensi tiga hari sekali), E (pakan+MP dosis 2% frekuensi setiap hari) dan F (pakan+MP dosis 2% frekuensi tiga hari sekali). Uji resistensi ikan lele terhadap A. hydrophila dilakukan pada hari ke-42 melalui injeksi intramuskular dengan kepadatan 108 CFU ml-1 dan pengamatan dilakukan setiap hari selama 14 hari. Parameter yang diamati meliputi kinerja pertumbuhan (tingkat kelangsungan hidup, laju pertumbuhan spesifik dan rasio konversi pakan), respon imun (kadar hematokrit, kadar hemoglobin, aktivitas fagositosis dan respiratory burst), total bakteri di dalam usus, total probiotik P22 dan L1k di dalam usus serta total bakteri A. hydrophila di organ target (ginjal dan hati).
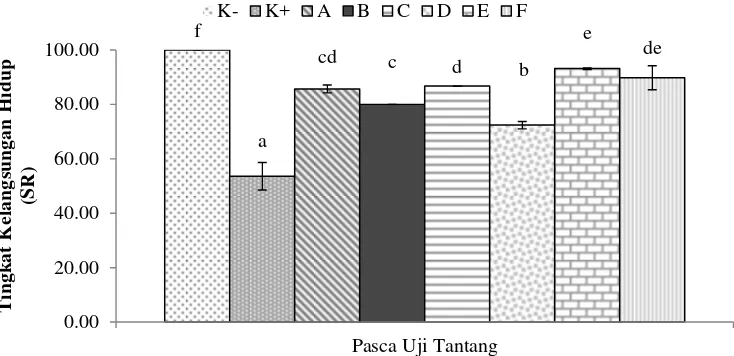
dibandingkan perlakuan kontrol. Perlakuan E diketahui memberikan hasil total bakteri tertinggi (7.49±0.12 log CFU g-1). Total probiotik B. cereus (P22) dan S. lentus (L1k) tertinggi dihasilkan oleh perlakuan E yaitu 4.06±0.09 log CFU g-1; 4.02±0.08 log CFU g-1. Pemberian MP memberikan pengaruh terhadap parameter gambaran darah, terutama pasca uji tantang (terjadi fluktuasi nilai kadar hematokrit (He), hemoglobin (Hb), aktivitas fagositosis (AF) dan respiratory burst (RB)). Kadar He dan Hb menurun pada hari ke 44 dan meningkat kembali pada hari ke 49 dan 56. Kadar Hb tertinggi pada akhir pemeliharaan dan pasca uji tantang ditunjukkan oleh perlakuan E (10.5±0.14) berbeda nyata dengan seluruh perlakuan (P<0.05). Nilai He tertinggi pada hari ke 44 dan 49 dihasilkan oleh perlakuan E (27.70±0.61; 31.83±1.25) namun tidak berbeda nyata dengan perlakuan A dan C (P>0.05) namun berbeda nyata dengan perlakuan lainnya (P<0.05). Nilai He tertinggi pada hari ke 56 ditunjukkan oleh perlakuan C (34.52±1.69) tidak berbeda nyata dengan perlakuan A dan E (P<0.05) namun berbeda nyata dengan perlakuan lainnya (P>0.05). Nilai AF tertinggi pada hari ke 44 ditunjukkan oleh perlakuan E (58.75±1.77) tidak berbeda nyata dengan perlakuan C dan F (P>0.05) namun berbeda nyata dengan perlakuan lainnya (P<0.05). Nilai RB tertinggi pada hari ke 44 dihasilkan oleh perlakuan E (0.076±0.004) berbeda nyata dengan seluruh perlakuan (P<0.05). Total A. hydrophila pada organ target di awal pemeliharaan untuk seluruh perlakuan menujukkan hasil <2.00±0.00 log CFU g-1. Total A. hydrophila di organ ginjal dan hati terendah pada hari ke-49 dihasilkan oleh perlakuan E (3.65±0.49 log CFU g-1; 3.75±0.21 log CFU g-1), sedangkan total A. hydrophila di organ hati dan ginjal terendah pada hari ke-56 dihasilkan oleh seluruh perlakuan probiotik dengan frekuensi pemberian setiap hari yaitu perlakuan A, C, E (<2.00±0.00). Setelah 14 hari pasca uji tantang, seluruh perlakuan probiotik memberikan tingkat kelangsungan hidup yang lebih baik dibandingkan kontrol potitif (P<0.05). Perlakuan E memberikan hasil tingkat kelangsungan hidup yang lebih tinggi (93.10±0.33%), tidak berbeda nyata (P>0.05) dengan perlakuan F (89.77±4.38%) namun berbeda nyata dengan perlakuan lainnya (P<0.05). Suplementasi mikrokapsul probiotik B.cereus P22 dan S. lentus L1k pada pakan dengan dosis 2% yang diberikan setiap hari menunjukkan hasil yang lebih baik dalam mengendalikan infeksi bakteri A. hydrophila pada ikan lele.
SUMMARY
LILIK SETIYANINGSIH. Control of Aeromonas hydrophila Infection on Catfish with Different Doses and Frequancy by Microcapsulated Probiotic. Supervised by WIDANARNI, ANGELA MARIANA LUSIASTUTI dan MUNTI YUHANA.
One of the main problems in aquaculture especially for catfish is the emergence of disease motile Aeromonad Septicemia (MAS), which is caused by bacteria A. hydrophila. A. hydrophila bacteria included in the opportunistic pathogen and it cause high mortality (80-100%) in aquaculture. The solution that expected for the reduction of bacterial infections A. hydrophila is probiotic. Probiotics bacteria may be competitor to pathogens in utilizing nutrients and it can protect fish from infection through increased immunity. Multispecies probiotic have higher efficacy in inhibiting the spread of some types of bacterial diseases, but probiotics in cell culture have a limit on expired date and it easily damaged by environmental conditions. One of solution that can be apply to maintain the viability of probiotics is used of microencapsulation technology.
The probiotics used in this study were B. cereus (P22) (108 CFU ml-1) and S. lentus (L1k) (108 CFU ml-1) with molecular markers of antibiotic resistant (Rifampicin for P22 and Chlorampenicol for L1k) that was encapsulated by spray draying method. The in vivo test used in this study was catfish strain mutiara with an average weight of 3.72 ± 0:51 g. Fish were maintained for 40 days and feeding by 30% protein commercial feed at satiation. Experiments include K- (negative control), K + (positive control), A (feed+0.5% of microcapsule probiotics (MP) with a administration every day), B (feed+0.5% of MP with a administration once every three days), C (feed+1% of MP with a administration every day), D
(feed+1% of MP with a administration once every three days), E (feed+2% of MP with a administration every day) and F (feed+2% of MP with a administration once every three days). On day 42, all of the fish except K- were challenged by injecting of A. hydrophila (108 CFU ml-1) by intramuscular injection and observations carried out for 14 days. Parameter observed were growth performance (survival rate, specific growth rate and feed conversion ratio), immune response (hematocrit, hemoglobin concentration, phagocytosis and respiratory burst activity), total of bacteria in the intestines, total of P22 and L1k probiotics in the intestines and total of bacteria A. hydrophila in the target organ (kidney and liver).
the value of hematocrit (He), hemoglobin (Hb), phagocytic activity (AF) and respiratory burst (RB)). He and Hb levels decreased on day 44 and increased on day 49 and 56. The highest hemoglobin levels at the end of the maintenance and post-challenge test was shown by treatment E (10.5±0.14) it different significant with all treatments (P<0.05). The highest level of He on day 44 and 49 showed by treatment E (27.70±0.61; 31.83±1.25), no different significant with treatment A and C (P>0.05) but it have different significant with another treatment. The highest level of He on day 56 showed by treatment C (34.52±1.69), it was no different significant with treatment A and E (P<0.05) but different significant with another treatment (P>0.05). The highest AF on day 44 showed by treatment E (58.75±1.77) no different significant with treatment C and F (P<0.05) but different significant with another treatments (P<0.05). The highest RB on day 44 showed by treatment E (0.076±0.004) it was different significant with all treatments (P<0.05). Total A. hydrophila in target organ at the beginning of maintenance period for all treatments showed result <2.00±0.00 log CFU g-1. The lowest of total A. hydrophila in kidney and liver on day 49 showed by treatment E (3.65±0.49 log CFU g-1; 3.75±0.21 log CFU g-1), and treatments A, C and E (<2.00±0.00) showed the lowest of total A. hydrophila in kidney and liver on day 56. All of probiotic treatments showed better survival rate compared with positive control (P<0.05). Treatment E showed better survival rate (93.10±0.33%) compared with treatment F (89.77±4.38%) but no different significant (P>0.05). Administration of 2% microencapsulated probiotic every day was the best result to controllig A. hydrophila on Clarias sp.
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PENGENDALIAN INFEKSI
Aeromonas hydrophila
PADA IKAN
LELE DENGAN MIKROKAPSUL PROBIOTIK PADA DOSIS
DAN FREKUENSI BERBEDA
LILIK SETIYANINGSIH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga tesis yang berjudul “Pengendalian Infeksi Aeromonas hydrophila pada Ikan Lele dengan Mikrokapsul Probiotik pada Dosis dan Frekuensi Berbeda” ini berhasil diselesaikan. Tesis ini ditulis berdasarkan hasil penelitian yang dilaksanakan pada bulan September 2015-Januari 2016 bertempat di Instalasi Penelitian dan Pengembangan Pengendalian Penyakit Ikan (IP4I) (Balai Penelitian dan Pengembangan Budidaya Air Tawar Bogor) dan Laboratorium Terpadu SEAFAST, Institut Pertanian Bogor.
Penulis menyadari bahwa terselesaikannya tesis ini tidak lepas dari segala bantuan dan dukungan dari berbagai pihak, baik ide, tenaga, moril maupun materiil. Penulis menyampaikan rasa terima kasih yang mendalam pada Dr. Ir. Widanarni, MSi, Dr. Drh. Angela Mariana Lusiastuti, MSi dan Dr. Munti Yuhana, SPi MSi sebagai komisi pembimbing atas waktu dan bimbingannya mulai dari penyusunan proposal, pelaksanaan penelitian hingga penulisan tesis. Penulis juga menyampaikan rasa terima kasih pada Dr. Ir. Yani Hadiroseyani, MM sebagai penguji luar komisi dan Dr. Ir. Widanarni, MSi sebagai perwakilan dari Program Studi Ilmu Akuakultur yang memberikan saran dan semangat selama ujian tesis
Terima kasih dan penghargaan yang tinggi penulis persembahkan pada Ayah Sujono dan Ibu Siti Ngaisah, Ayah Sugito dan Ibu Sri Purwantiningsih serta suami tercinta Irfan Hanifa atas doa, bantuan, dukungan dan semangatnya.
Terima kasih kepada rekan-rekan S2 Ilmu Akuakultur angkatan 2014 atas kebersamaannya dalam menempuh studi, teknisi lab IP4I BPPBAT Bogor: Bapak Edi, Bapak Setiadi, Bapak Wahyu, Bapak Johan; rekan-rekan di Laboratorium Kesehatan Ikan, Destianingrum, Bapak Ranta dan Bapak Nurwanto atas bantuannya selama penelitian.
Semoga karya ilmiah ini bermanfaat untuk kemajuan ilmu pengetahuan, khususnya perikanan budidaya.
Bogor, Desember 2016
DAFTAR ISI
DAFTAR TABEL
DAFTAR GAMBAR
DAFTAR LAMPIRAN
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 METODE PENELITIAN 3
Waktu dan Tempat Penelitian 3
Persiapan Bakteri Probiotik 3
Mikroenkapsulasi Probiotik 3
Penyiapan Bakteri A. hydrophila 3
Uji In Vivo 4
Parameter Uji 4
Kinerja pertumbuhan 5
Jumlah total bakteri pada usus ikan uji 5
Respon imun 6
Jumlah total bakteri A. hydrophila pada organ target 7
Analisis Data 7
3 HASIL DAN PEMBAHASAN 7
Hasil 7
Kinerja Pertumbuhan 7
Jumlah total bakteri pada usus ikan uji 9
Respon imun 9
Resistensi Ikan Lele terhadap A. hydrophila 12
Jumlah total bakteri A. hydrophila pada organ target 12
Tingkat Kelangsungan Hidup Pasca Uji Tantang 12
Pembahasan 13
4 SIMPULAN DAN SARAN 16
Simpulan 16
Saran 17
DAFTAR PUSTAKA 17
LAMPIRAN 20
DAFTAR TABEL
1. Tingkat kelangsungan hidup (SR), laju pertumbuhan spesifik (SGR), rasio konversi pakan (FCR) ikan lele yang diberi
probiotik dengan dosis dan frekuensi berbeda 7
2. Total bacterial count (TBC) dan total probiotic count (TPC) P22 & L1k pada saluran pencernaan ikan lele yang diberi
probiotik dengan dosis dan frekuensi berbeda 8
3. Total A. hydrophila pada organ target ikan lele pasca uji tantang yang diberi probiotik dengan dosis dan frekuensi
berbeda 12
DAFTAR GAMBAR
1. Kadar hemoglobin ikan lele yang diberi probiotik dengan dosis dan frekuensi yang berbeda pada akhir pemeliharaan
(hari ke-40) dan pasca uji tantang (hari ke- 44, 49 dan 56) 9 2. Kadar hematokrit ikan lele yang diberi probiotik dengan dosis
dan frekuensi yang berbeda pada akhir pemeliharaan (hari
ke-40) dan pasca uji tantang (hari ke- 44, 49 dan 56) 10 3. Aktivitas fagositosis ikan lele yang diberi probiotik dengan
dosis dan frekuensi yang berbeda pada akhir pemeliharaan
(hari ke-40) dan pasca uji tantang (hari ke- 44, 49 dan 56) 10 4. Aktivitas respiratory burst ikan lele yang diberi probiotik
dengan dosis dan frekuensi yang berbeda pada akhir pemeliharaan (hari ke-40) dan pasca uji tantang (hari ke- 44,
49 dan 56) 11
5. Tingkat kelangsungan hidup ikan lele pasca uji tantang A.
hydrophila. 12
DAFTAR LAMPIRAN
1. Analisis statistik terhadap laju pertumbuhan spesifik (A) dan rasio konversi pakan (B) ikan lele yang diberi probiotik dengan dosis dan frekuensi berbeda selama masa
pemeliharaan 20
2. Hasil uji Duncan terhadap kadar hematokrit, hemoglobin, aktivitas fagositosis dan respiratory burst pada akhir pemberian pakan perlakuan dan setelah uji tantang dengan A.
1
1 PENDAHULUAN
Latar Belakang
Salah satu permasalahan utama pada budidaya ikan lele adalah munculnya penyakit Motile Aeromonad Septicemia (MAS) yang disebabkan oleh bakteri A. hydrophila. Menurut Janda dan Abbott (20I0) bakteri A. hydrophila diketahui selektif menyerang ikan lele, carp, tilapia dan salmon. Infeksi bakteri A. hydrophila dapat menyebabkan kerugian yang sangat besar pada budidaya ikan lele karena dapat mengakibatkan mortalitas lebih dari 95%. Ikan yang terinfeksi A. hydrophila dapat mengalami pendarahan pada organ yang terinfeksi sehingga menyebabkan luka. Hardi et al. (2014) menyatakan bahwa secara umum gejala klinis yang ditimbulkan pada ikan yang terinfeksi bakteri tersebut adalah penurunan respons terhadap pakan, berenang abnormal, luka kemerahan, sisik lepas, sirip gripis, kerusakan sel berupa hipertrofi dan hiperplasia, kerusakan organ hati dan ginjal.
Salah satu solusi yang diharapkan sebagai upaya penanggulangan infeksi bakteri A. hydrophila adalah pemberian probiotik. Probiotik mampu memberikan efek antimikrobial berupa produksi antibiotik, bakteriosin, enzim (lisozym dan protease) atau hidrogen peroksida (Cruz et al. 2012). Bakteri probiotik dapat bersifat kompetitor terhadap patogen dalam memanfaatkan nutrien, selain itu penggunaan probiotik dapat melindungi ikan dari infeksi melalui peningkatan imunitas (El-Haroun 2007 dan Tuan et al. 2013). Penggunaan probiotik multispesies diketahui memiliki efektivitas yang lebih tinggi dalam menghambat penyebaran beberapa jenis penyakit bakterial (Thomas dan Chhorn 2011). Pada penelitian ini probiotik multispesies Bacillus cereus dan Staphilococcus lentus digunakan untuk mengendalikan infeksi A.hydrophila pada ikan lele.
Probiotik dalam bentuk kultur sel memiliki keterbatasan dalam masa penyimpanan dan mudah rusak oleh pengaruh lingkungan (Weinbreck et al. 2010). Salah satu upaya yang dapat dilakukan untuk mempertahankan viabilitas probiotik adalah melalui penggunaan teknologi mikroenkapsulasi. Mikroenkapsulasi merupakan teknik pengemasan bahan dalam bentuk partikel mikro dan nano. Mikroenkapsulasi dapat melindungi bahan sensitif dari kelembaban, panas, cahaya atau oksidasi (Jafari et al. 2008). Menurut Jyothi et al. (2010) spray drying merupakan metode mikroenkapsulasi yang tergolong murah dibandingkan dengan metode lainya dan mampu menghasilkan serbuk kualitas tinggi untuk produksi skala besar.
2
sinbiotik Bacillus sp. NP5 RfR dan oligosakarida dengan frekuensi yang berbeda memberikan pengaruh yang nyata terhadap laju pertumbuhan dan respons imun pada udang vaname yang terinfeksi Vibrio harveyi. Beberapa penelitian mengenai dosis dan frekuensi probiotik telah banyak dilakukan, namun penelitian mengenai gabungan dosis dan frekuensi mikrokapsul probiotik multispesies untuk pengendalian A. hydrophila pada ikan lele belum pernah dilakukan.
Perumusan Masalah
Salah satu upaya pencegahan infeksi A. hydrophila adalah pemberian probiotik multispesies. Namun pemberian probiotik dalam bentuk segar memiliki keterbatasan dalam masa penyimpanan, sehingga aplikasi probiotik memerlukan suatu teknologi yang dapat melindungi dan menjaga viabilitas probiotik tersebut dari pengaruh lingkungan. Bakteri probiotik harus mampu bertahan selama proses pencernaan. Teknologi mikroenkapsulasi dengan metode spray drying merupakan salah satu alternatif teknologi yang dapat diterapkan pada pakan yang mengandung probiotik sehingga terjaga viabilitasnya. Pemberian mikrokapsul probiotik multispesies diharapkan mampu memberikan pengaruh positif terhadap sistem imun ikan lele dalam mengendalikan serangan A. hydrophila. Aplikasi dosis dan frekuensi yang tepat diharapkan mampu menekan biaya produksi yang dikeluarkan serta memberikan pengaruh resistensi, respons imun dan kinerja pertumbuhan yang lebih baik terhadap ikan lele yang diinfeksi A. hydrophila. Oleh karena itu perlu adanya kajian mengenai pemberian mikrokapsul probiotik melalui pakan dengan dosis dan frekuensi terhadap resistensi, respons imun dan kinerja pertumbuhanikan lele yang diinfeksi A. hydrophila.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji pemberian mikrokapsul probiotik melalui pakan dengan dosis dan frekuensi berbeda terhadap resistensi ikan lele yang diinfeksi A. hydrophila, respons imun dan kinerja pertumbuhan.
Manfaat Penelitian
3
2 METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan September 2015-Januari 2016 di Instalasi Penelitian dan Pengembangan Pengendalian Penyakit Ikan (IP4I) (Balai Penelitian dan Pengembangan Budidaya Air Tawar Bogor) dan Laboratorium Terpadu SEAFAST, Institut Pertanian Bogor.
Persiapan Bakteri Probiotik
Bakteri probiotik yang digunakan adalah B. cereus P22 (108 CFU ml-1) dan S. lentus L1k (108 CFU ml-1) dengan penanda molekuler resisten antibiotik (Rifampisin untuk P22 dan Chloramfenicol untuk L1k). Stok bakteri diremajakan kembali dengan dikultur pada media Tripticase Soy Agar (TSA-agar miring) dan diinkubasi selama 24 jam di dalam inkubator pada suhu 28oC. Probiotik yang telah ditumbuhkan pada media agar miring TSA dikultur pada 50 ml media cair Tripticase Soy Broth (TSB) selama 24 jam dengan shaker berkecepatan 140 rpm pada suhu 29oC yang selanjutnya digunakan sebagai kultur antara. Selanjutnya bakteri ditumbuhkan pada 500 ml TSB selama 18 jam (Putra dan Widanarni 2015). Hasil kultur probiotik dipisahkan dari medianya dengan cara disentrifuse pada kecepatan 6000 rpm selama 5 menit. Biomassa sel yang diperoleh kemudian dicuci dengan menggunakan Phospat Buffered Saline (PBS) sebanyak dua kali. Hasil yang diperoleh kemudian digunakan sebagai probiotik untuk proses mikroenkapsulasi dengan perbandingan B. cereus P22 dan S. lentus L1k 1:1 . Dosis probiotik yang digunakan adalah sebesar 0,5%, 1% dan 2%.
Mikroenkapsulasi Probiotik
Biomassa probiotik multispesies dari B. cereus P22 dan S. lentus L1k (108 CFU ml-1) dicampur dengan bahan penyalut (perbandingan biomassa probiotik B. cereus P22 dan S. lentus L1k dengan bahan penyalut adalah 1:1). Bahan penyalut yang digunakan pada mikroenkapsulasi probiotik adalah gabungan protein whey dan maltodekstrin (perbandingan 1:1) (Rahmawati 2015). Mikroenkapsulasi menggunakan teknik spray drying pada suhu inlet 150oC dan suhu outlet 70oC. Hasil mikroenkapsulasi yang diperoleh berupa serbuk berukuran mikro dan disimpan di lemari pendingin (suhu 4 oC ) hingga akan digunakan. Kepadatan bakteri probiotik B. cereus P22 dan S. lentus L1k dalam bentuk mikrokapsul probiotik masing-masing sebesar 107 CFU ml-1.
Penyiapan Bakteri A. hydrophila
4
(IP4I) Bogor. Bakteri A. hydrophila ditanam pada media TSA dan diinkubasi selama 24 jam pada suhu 28°C, kemudian isolat bakteri dipindahkan pada media TSB dan diinkubasi kembali selama 24 jam pada suhu 28°C. Kepadatan A. hydrophila yang digunakan untuk uji tantang adalah 108 CFU ml-1.
Uji In Vivo
Penelitian ini terdiri dari delapan perlakuan dengan empat ulangan, yaitu K- (kontrol negatif), K+ (kontrol positif), A (pakan+mikrokapsul probiotik (MP) dosis 0.5% frekuensi setiap hari), B (pakan+MP dosis 0.5% frekuensi tiga hari sekali), C (pakan+MP dosis 1% frekuensi setiap hari), D (pakan+MP dosis 1% frekuensi tiga hari sekali), E (pakan+MP dosis 2% frekuensi setiap hari) dan F (pakan+MP dosis 2% frekuensi tiga hari sekali). Pakan yang digunakan merupakan pakan komersil dengan kadar protein sebesar 30%. Mikrokapsul probiotik ditambahkan ke dalam pakan sesuai dosis yang telah ditentukan dan ditambah dengan 2% putih telur sebagai perekat. Pakan dikeringudarakan dan disimpan ke dalam lemari pendingin bersuhu 4oC. Kepadatan bakteri probiotik B. cereus P22 dan S. lentus L1k dalam bentuk pakan yang mengandung mikrokapsul probiotik masing-masing sebesar 105 CFU ml-1 (mengalami penurunan viabilitas selama proses pencampuran pakan).
Ikan lele yang digunakan adalah strain mutiara dengan bobot rata-rata 3.72±0.51 g. Ikan dipelihara pada bak berukuran 60 cm x 70 cm x 40 cm berisi 60 liter air dan kepadatan 15 ekor bak-1. Pemberian pakan dilakukan sebanyak tiga kali sehari, frekuensi pemberian pakan yang mengandung mikrokapsul probiotik sesuai perlakuan dan diberikan secara at satiation selama 40 hari masa pemeliharaan. Hari ke 41 ikan dipuasakan dan diukur kinerja pertumbuhannya. Ikan diuji tantang dengan A. hydrophila pada hari ke 42 dengan kepadatan 108 CFU ml-1 sebanyak 0.2 ml per ekor menggunakan syringe steril secara intramuscular (IM) (kecuali K- diinjeksi dengan PBS. Ikan diberi pakan perlakuan selama 14 hari pasca uji tantang. Pengamatan kelangsungan hidup pasca uji tantang dilakukan dengan menghitung kematian setiap hari selama 14 hari. Kualitas air selama masa pemeliharaan adalah suhu 26-30oC, oksigen terlarut 4-5.93 mg/l, amoniak 0.016-0.673 ppm dan pH 5.5-7.0.
Parameter Uji
5
Kinerja pertumbuhan
Parameter kinerja pertumbuhan yang diamati meliputi tingkat kelangsungan hidup (SR), laju pertumbuhan spesifik (SGR) dan rasio konversi pakan (FCR).
Kelangsungan hidup atau Survival Rate (SR) dihitung menggunakan persamaan menurut Effendie (1997):
Keterangan :
SR = Tingkat kelangsungan hidup (%)
Nt = Jumlah ikan yang hidup pada akhir pengamatan (ekor) No = Jumlah ikan yang hidup pada awal pengamatan (ekor)
Perhitungan laju pertumbuhan spesifik pada masa pemeliharaan sebelum uji tantang menggunakan persamaan Huisman(1987):
Keterangan:
SGR = Laju pertumbuhan spesifik (%)
We = Rata-rata bobot ikan pada akhir penelitian (g) Ws = Rata-rata bobot ikan pada awal penelitian (g) t = Lama pemeliharaan (hari)
Rasio konversi pakan pada masa pemeliharaan sebelum uji tantang dihitung menggunakan rumus Zonneveld et al. (1991):
FCR =
Keterangan:
FCR = Ratio konversi pakan
F = Jumlah pakan yang diberikan (g)
Bt = Biomassa ikan pada akhir pemeliharaan (g) Bo = Biomassa ikan pada awal pemeliharaan (g)
Jumlah total bakteri pada usus ikan uji
Total bakteri serta total probiotik P22 dan L1k di dalam usus diamati pada awal dan akhir pemeliharaan. Usus ikan diambil kemudian dihomogenkan dalam larutan PBS. Parameter yang diamati adalah Total Viable Bacterial Count (TBC) dan total probiotik. Media yang digunakan berupa media TSA untuk TBC dan media TSA+antibiotik (Rifampisin untuk P22 dan Chloramphenicol untuk L1k). Pengamatan dilakukan setelah inkubasi 48 jam. Populasi masing-masing probiotik dihitung dengan cara Total Plate Count (TPC).
100 No
Nt
6
Respons imun
Pengamatan respons imun ikan dilakukan pada hari 40, 44, 49 dan 56. Parameter respons imun ikan yang diamati dalam penelitian ini meliputi kadar hematokrit (He), aktivitas fagositik (AF), hemoglobin (Hb) dan aktivitas respiratory burst (RB).
Kadar He diukur menggunakan tabung mikrohematokrit. Darah dimasukkan ke dalam tabung mikrohematokrit secara kapiler hingga mencapai ¾ bagian tabung. Ujung tabung yang telah berisi darah ditutup menggunakan crytoceal dan disentrifugasi dengan kecepatan 5000 rpm selama lima menit. Panjang darah yang mengendap dan panjang total volume darah pada tabung diukur untuk menunjukkan nilai kadar He. Kadar He dihitung dengan rumus (a/b) x 100% (Anderson dan Siwicki 1995).
Perhitungan kadar AF dilakukan untuk mengetahui persentase aktivitas
sel-sel fagosit. Darah sampel sebanyak 50 μl dimasukkan ke dalam eppendorf.
Patogen sebanyak 50 μl dihomogenkan ke dalam eppendorf dan diinkubasi selama
20 menit dalam suhu ruang. Suspensi darah sebanyak 5 μl diteteskan pada gelas
objek dan dibuat preparat ulas. Preparat ulas dikeringanginkan, lalu difiksasi dengan metanol selama 5-10 menit dan dikeringudarakan. Kemudian dilanjutkan perendaman dengan giemsa selama 10-15 menit. Preparat tersebut dibilas dengan akuades dan dikeringudarakan, kemudian dilakukan pengamatan secara mikroskopis. Perhitungan dilakukan dengan pengamatan terhadap sel-sel yang memfagosit bakteri hingga 100 sel (Anderson dan Siwicki 1995).
Kadar Hb diukur menggunakan metode Sahli. Darah yang telah ditampung dihisap dengan menggunakan pipet sahli sampai skala 20 mm3 atau pada skala 0.2 ml. Ujung pipet kemudian dibersihkan dengan tisu. Darah yang telah dihisap ke dalam pipet dipindahkan ke dalam tabung Hb-meter yang telah diisi HEL 0.1 N sampai skala 10 (merah), larutan tersebut diaduk dan dibiarkan selama 3-5 menit. Akuades ditambahkan sampai warna darah dan HEL tersebut nampak seperti warna larutan standar yang ada di dalam Hb-meter tersebut. Skala yang terbentuk dibaca dengan mencocokkan permukaan cairan dengan skala tabung Sahli pada skala jalur gr % (kuning). Skala tersebut menunjukkan banyaknya hemoglobin dalam gram 100 ml-1 darah (Wedemeyer dan Yasutake 1997).
7
Jumlah total bakteri A. hydrophila pada organ target
Total bakteri A. hydrophila pada organ target (ginjal dan hati) diamati di awal pemeliharaan serta tujuh hari dan 14 hari pasca uji tantang (hari ke-49 dan 56). Penghitungan jumlah bakteri dilakukan dengan mengambil sampel ginjal dan hati ikan masing-masing sebanyak 0.1 g. Sampel dihaluskan menggunakan mortar dan dihomogenkan dalam 0.9 ml larutan PBS. Media yang digunakan berupa media selektif A. hydrophila RS (Rimler-Shotts), kemudian dilakukan pengenceran bertingkat serta penghitungan bakteri dengan metode cawan. Pengamatan dilakukan setelah inkubasi 24 jam. Jumlah total bakteri A. hydrophila dihitung dengan cara Total Plate Count (TPC).
Analisis Data
Data total bakteri pada usus, total probiotik pada usus dan total A. hydrophila pada organ target dianalisis secara deskriptif, sedangkan data lainnya dianalisis menggunakan sidik ragam (ANOVA) pada selang kepercayaan 95%, data yang berbeda nyata diuji menggunakan uji lanjut Duncan.
3 HASIL DAN PEMBAHASAN
Hasil
Kinerja Pertumbuhan
8
Tabel 1 Tingkat kelangsungan hidup (SR), laju pertumbuhan spesifik (SGR), dan rasio konversi pakan (FCR) ikan lele yang diberi probiotik dengan dosis dan frekuensi berbeda selama masa pemeliharaan
Perlakuan SR (%) SGR (%) FCR
K 93.31±6.67a 3.681±0.000a 1.750±0.070d
A 93.33±6.67a 4.143±0.016b 1.340±0.004b
B 97.78±3.85a 4.361±0.077c 1.441±0.036c
C 97.78±3.85a 4.367±0.101c 1.242±0.062ab
D 93.33±6.67a 4.433±0.003cd 1.191±0.013a
E 97.78±3.85a 4.537±0.018d 1.462±0.004c
F 95.55±3.85a 4.195±0.055b 1.244±0.034ab
Keterangan: huruf yang berbeda pada kolom yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (Uji Duncan; p<0.05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku. K (kontrol tanpa pemberian mikrokapsul probiotik (MP)), A (pakan+MP dosis 0.5% frekuensi setiap hari), B (pakan+MP dosis 0.5% frekuensi tiga hari sekali), C (pakan+MP dosis 1% frekuensi setiap hari), D (pakan+MP dosis 1% frekuensi tiga hari sekali), E (pakan+MP dosis 2% frekuensi setiap hari) dan F (pakan+MP dosis 2% frekuensi tiga hari sekali).
9
Jumlah total bakteri pada usus ikan uji
Total bakteri pada saluran pencernaan selama masa pemeliharaan 40 hari pada perlakuan E diketahui memberikan hasil tertinggi (7.49±0.12 log CFU g-1) (Tabel 2). Total probiotik B. cereus (P22) dan S. lentus (L1k) tertinggi dihasilkan oleh perlakuan E (4.06±0.09 log CFU g-1; 4.02±0.08 log CFU g-1) (Tabel 2). Total bakteri di usus pada seluruh perlakuan probiotik diketahui memiliki jumlah yang lebih tinggi dibandingkan perlakuan kontrol (Tabel 2).
Tabel 2 Total bacterial count (TBC) dan total probiotic count (TPC) P22 & L1k pada saluran pencernaan ikan lele yang diberi probiotik dengan dosis dan frekuensi berbeda
Keterangan: K+ (kontrol positif), A (pakan + MP dosis 0.5% frekuensi setiap hari), B (pakan +MP dosis 0.5% frekuensi tiga hari sekali), C (pakan + MP dosis 1% frekuensi setiap hari), D (pakan+MP dosis 1% frekuensi tiga hari sekali), E (pakan+MP dosis 2% frekuensi setiap hari) dan F (pakan+MP dosis 2% frekuensi tiga hari sekali).
Pemberian probiotik pada pakan memberikan pengaruh peningkatan total bakteri (TBC) dan total probiotik pada saluran pencernaan. Berdasarkan hasil pengamatan dapat diketahui bahwa seluruh perlakuan pemberian probiotik menghasilkan TBC dan total bakteri probiotik yang lebih tinggi dibandingkan dengan perlakuan kontrol. Nilai TBC dan total bakteri probiotik pada saluran pencernaan meningkat seiring dengan peningkatan dosis dan frekuensi pemberian probiotik. Pada dosis yang sama, frekuensi pemberian probiotik yang lebih tinggi menunjukkan peningkatan nilai TBC dan total bakteri probiotik.
Respons Imun
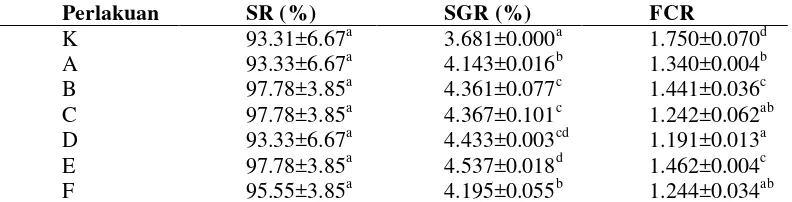
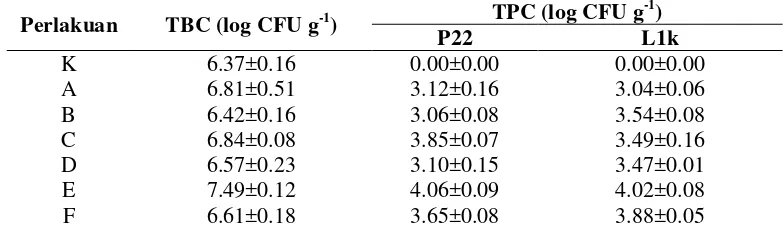
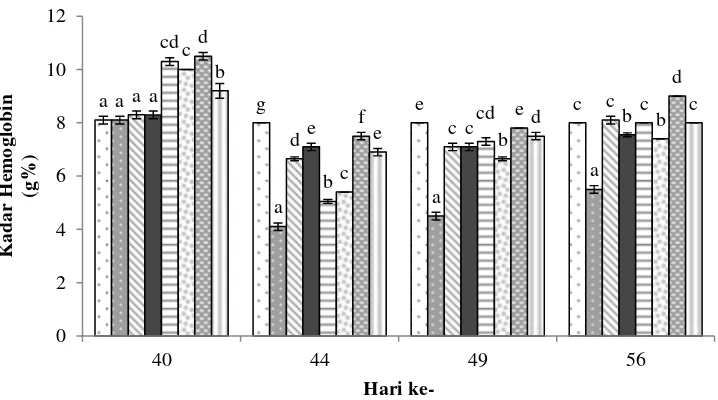
Pemberian probiotik dengan dosis dan frekuensi berbeda diketahui memberikan pengaruh terhadap parameter gambaran darah. Setelah masa pemeliharaan selama 40 hari, kadar hematokrit (He), hemoglobin (Hb), aktivitas fagositosis (AF) dan respiratory burst (RB) pada perlakuan pemberian probiotik menunjukkan hasil yang lebih tinggi dibanding kontrol (P<0.05) (Gambar 1, 2, 3 dan 4) (Lampiran 2). Fluktuasi nilai pada parameter gambaran darah terjadi pasca uji tantang, hal tersebut diduga berkaitan dengan status kesehatan ikan.
10
perlakuan A, dan C (P>0.05) namun berbeda nyata dengan perlakuan lainnya (P<0.05) (Lampiran 2). Nilai He tertinggi pada hari ke 56 ditunjukkan oleh perlakuan C (34.52±1.69) tidak berbeda nyata dengan perlakuan A dan E (P<0.05) namun berbeda nyata dengan perlakuan lainnya (P>0.05) (Lampiran 2).
Gambar 1 Kadar hemoglobin ikan lele yang diberi probiotik dengan dosis dan frekuensi yang berbeda pada akhir pemeliharaan (hari ke-40) dan pasca uji tantang (hari ke- 44, 49 dan 56). Keterangan: Huruf yang berbeda di setiap bar hari yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (Uji Duncan; p<0.05). K+ (kontrol positif), A (pakan+MP dosis 0.5% frekuensi setiap hari), B (pakan + MP dosis 0.5% frekuensi tiga hari sekali), C (pakan+MP dosis 1% frekuensi setiap hari), D (pakan+MP dosis 1% frekuensi tiga hari sekali), E (pakan+MP dosis 2% frekuensi setiap hari) dan F (pakan+MP dosis 2% frekuensi tiga hari sekali), uji tantang dilakukan pada hari ke 42.
Gambar 2 Kadar hematokrit ikan lele yang diberi probiotik dengan dosis dan frekuensi yang berbeda pada akhir pemeliharaan (hari ke-40) dan pasca uji tantang (hari ke- 44, 49 dan 56). Keterangan: Huruf yang berbeda di setiap bar hari yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (Uji Duncan; p<0.05). K+ (kontrol positif), A (pakan+MP dosis 0.5% frekuensi setiap hari), B (pakan+MP dosis 0.5% frekuensi tiga hari sekali), C (pakan+MP dosis 1% frekuensi setiap hari), D (pakan+MP dosis 1% frekuensi tiga hari sekali), E (pakan+MP dosis 2% frekuensi setiap hari) dan F (pakan+MP dosis 2% frekuensi tiga hari sekali), uji tantang dilakukan pada hari ke 42.
11
Pasca uji tantang, nilai AF dan RB meningkat pada hari ke 44 kemudian menurun kembali pada hari ke 49 dan 56. Nilai AF tertinggi pada hari ke 44 ditunjukkan oleh perlakuan E (58.75±1.77) tidak berbeda nyata dengan perlakuan C dan F (P>0.05) namun berbeda nyata dengan perlakuan lainnya (P<0.05) (Lampiran 2). Nilai RB tertinggi pada hari ke 44 dihasilkan oleh perlakuan E (0.076±0.004) berbeda nyata dengan seluruh perlakuan lainnya (P<0.05) (Lampiran 2).
Gambar 3 Aktivitas fagositosis ikan lele yang diberi probiotik dengan dosis dan frekuensi yang berbeda pada akhir pemeliharaan (hari ke-40) dan pasca uji tantang (hari ke- 44, 49 dan 56). Keterangan: Huruf yang berbeda di setiap bar hari yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (Uji Duncan; p<0.05). K+ (kontrol positif), A (pakan+MP dosis 0.5% frekuensi setiap hari), B (pakan+MP dosis 0.5% frekuensi tiga hari sekali), C (pakan+MP dosis 1% frekuensi setiap hari), D (pakan+MP dosis 1% frekuensi tiga hari sekali), E (pakan+MP dosis 2% frekuensi setiap hari) dan F (pakan+MP dosis 2% frekuensi tiga hari sekali), uji tantang dilakukan pada hari ke 42.
12
Resistensi Ikan Lele terhadap A. hydrophila
Jumlah total bakteri A. hydrophila di organ target
Total A. hydrophila di organ target pada awal pemeliharaan untuk seluruh perlakuan menujukkan hasil <2.00±0.00 log CFU g-1. Kemampuan bakteri probiotik dalam menghambat pertumbuhan A. hydrophila dapat diketahui dari total A. hydrophila pada organ target setelah uji tantang. Total A. hydrophila di organ ginjal dan hati terendah pada hari ke-49 dihasilkan oleh perlakuan E (3.65±0.49 log CFU g-1; 3.75±0.21 log CFU g-1), sedangkan total A. hydrophila di organ hati dan ginjal terendah pada hari ke-56 dihasilkan oleh seluruh perlakuan probiotik dengan frekuensi pemberian setiap hari yaitu perlakuan A, C, E (<2.00±0.00) (Tabel 3). Total A. hydrophila di organ ginjal dan hati pada K- (hari ke-49 dan 56) memiliki nilai <2.00±0.00 log CFU g-1.
Tabel 3 Total A. hydrophila pada organ target ikan lele pasca uji tantang yang diberi probiotik dengan dosis dan frekuensi berbeda
Perlakuan H49 (log CFU g
-1
) H56 (log CFU g-1)
Ginjal Hati Ginjal Hati
K- <2.00±0.00 <2.00±0.00 <2.00±0.00 <2.00±0.00
K+ 6.31±1.17 6.87±0.17 4.81±0.29 5.34±0.62
Keterangan: K- (kontrol negatif), K+ (kontrol positif), A (pakan + mp dosis 0.5% frekuensi setiap hari), B (pakan+MP dosis 0.5% frekuensi tiga hari sekali), C (pakan+MP dosis 1% frekuensi setiap hari), D (pakan+MP dosis 1% frekuensi tiga hari sekali), E (pakan+MP dosis 2% frekuensi setiap hari) dan F (pakan+MP dosis 2% frekuensi tiga hari sekali).
Berdasarkan hasil penelitian, dapat diketahui bahwa seluruh perlakuan probiotik menunjukkan nilai total A. hydrophila yang lebih rendah dibandingkan perlakuan kontrol positif. Perlakuan probiotik diketahui dapat menurunkan total bakteri A. hydrophila pada organ target dengan nilai yang lebih besar dibandingkan perlakuan kontrol. Peningkatan dosis probiotik memberikan pengaruh terhadap penurunan total bakteri A. hydrophila pada organ target. Pada dosis yang sama, frekuensi pemberian probiotik yang lebih tinggi menunjukkan penurunan total A. hydrophila yang lebih besar.
Tingkat Kelangsungan Hidup Pasca Uji Tantang
13
Gambar 5 Tingkat kelangsungan hidup ikan lele pasca uji tantang A. hydrophila. Huruf yang berbeda di setiap bar menunjukkan pengaruh perlakuan yang berbeda nyata (Uji Duncan; p<0.05). K- (kontrol negatif), K+ (kontrol positif), A (pakan+MP dosis 0.5% frekuensi setiap hari), B (pakan+MP dosis 0.5% frekuensi tiga hari sekali), C (pakan+MP dosis 1% frekuensi setiap hari), D (pakan+MP dosis 1% frekuensi tiga hari sekali), E (pakan+MP dosis 2% frekuensi setiap hari) dan F (pakan+MP dosis 2% frekuensi tiga hari sekali).
Pembahasan
Penambahan probiotik pada pakan diketahui mampu meningkatkan laju pertumbuhan spesifik (SGR), memberikan hasil FCR yang lebih baik, meningkatkan total bakteri dan total probiotik di saluran pencernaan serta memberikan hasil respons imun yang lebih baik dibandingkan dengan perlakuan kontrol. Bakteri probiotik diketahui dapat memberikan pengaruh positif terhadap ikan uji. Pemberian probiotik dapat membantu meningkatkan penyerapan nutrien sehingga mampu memperbaiki performa pertumbuhan inang (Zhang et al. 2012), meningkatkan keseimbangan mikrobial dan mengurangi keberadaan patogen pada saluran pencernaan (Ilmiah et al. 2013), meningkatkan populasi probiotik di dalam saluran pencernaan ikan (Putra dan Widanarni 2015), mampu berinteraksi dengan sel imun seperti sel fagositosis (monosit dan makrofag), polimorphonuclear leucocytes (neutropil) serta NK sel dalam meningkatkan respons imun (El-Bouhy et al. 2013) serta dapat memodifikasi respons imun dari inang melalui interaksi dengan sel epitel dan memodulasi sekresi dari sitokin anti inflamatori sehingga mampu mengurangi peradangan (Balcazaret al. 2007).
Berdasarkan hasil yang telah diperoleh, dapat diketahui bahwa laju pertumbuhan spesifik (SGR) meningkat seiring dengan peningkatan dosis pemberian probiotik, kecuali pada perlakuan F (4.195±0.055) yang mengalami penurunan. Hal tersebut sesuai dengan pernyataan Zubaidah et al. (2015) bahwa semakin tinggi dosis sinbiotik Bacillus sp. yang diberikan maka laju pertumbuhan semakin meningkat. Peningkatan laju pertumbuhan pada dosis tinggi diduga berkaitan dengan kinerja bakteri probiotik. Semakin tinggi dosis yang diberikan maka akumulasi jumlah probiotik di dalam saluran pencernaan semakin meningkat, sehingga aktivitas bakteri probiotik untuk meningkatkan pertumbuhan dapat lebih optimal. Hal tersebut ditunjukkan oleh adanya peningkatan jumlah
14
TBC dan TPC pada saluran pencernaan sebagai akibat dari peningkatan dosis dan frekuensi pemberian MP (Tabel 2).
Tingginya jumlah probiotik yang masuk di dalam saluran pencernaan memberikan pengaruh yang lebih baik terhadap efisiensi pemanfaatan pakan. Bakteri probiotik pada saluran pencernaan mampu bekerja dalam meningkatkan enzim pencernaan dan penyerapan nutrisi. Kinerja bakteri probiotik dalam menurunkan nilai FCR pada dosis rendah akan lebih optimal apabila diberikan melalui frekuensi tinggi. Sedangkan pada dosis tinggi, kinerja bakteri probiotik dalam menurunkan nilai FCR akan lebih optimal apabila diberikan dengan frekuensi rendah. Hal tersebut diduga berkaitan dengan peningkatan nafsu makan pada ikan uji pasca pemberian MP. Peningkatan dosis dan frekuensi pemberian MP memberikan pengaruh terhadap peningkatan nafsu makan. Pemberian MP dengan dosis dan frekuensi tinggi menunjukkan adanya respons pakan yang sangat baik pada ikan uji. Jumlah pakan yang dikonsumsi ikan uji pada perlakuan dosis dan frekuensi tinggi lebih banyak dibandingkan dengan perlakuan dosis dan frekuensi rendah. Konsumsi pakan yang tinggi mengakibatkan akumulasi sisa pakan pada bak pemeliharaan semakin meningkat. Hal tersebut diduga berpengaruh terhadap tingginya nilai FCR pada perlakuan dosis dan frekuensi tinggi.
Pemberian mikrokapsul probiotik B.cereus P22 dan S. lentus L1k diketahui dapat meningkatkan SGR dan menurunkan FCR dibandingkan perlakuan kontrol. Peningkatan laju pertumbuhan spesifik dan penurunan rasio konversi pakan pada perlakuan mikrokapsul probiotik diduga akibat pengaruh dari meningkatnya probiotik B.cereus P22 dan S. lentus L1k pada saluran pencernaan. Pemberian probiotik yang menghasilkan nilai rasio konversi pakan lebih baik mengindikasikan bahwa probiotik melalui pakan mampu menghasilkan tingkat pemanfaatan pakan yang lebih efisien, dapat berkontribusi dalam meningkatkan aktivitas enzim pencernaan sehingga meningkatkan penyerapan nutrisi serta meningkatkan kinerja pertumbuhan (Tamamdusturi et al. 2016). Bagheri et al. (2008) menyatakan bahwa peningkatan laju pertumbuhan spesifik dan penurunan nilai rasio konversi pakan pada perlakuan pemberian probiotik Bacillus sp. melalui pakan diduga disebabkan oleh peran Bacillus sp. dalam membantu memecah protein dan karbohidrat. Balcazaret al. (2007) menyatakan bahwa probiotik melalui pakan mampu memodifikasi komposisi mikrobiota sehingga memberikan pengaruh yang baik terhadap sistem pencernaan.
15
probiotik Bacillus sp. melalui pakan pada Oreochromis niloticus (Utami et al. 2015) juga pernah dilaporkan sebelumnya.
Suplementasi bakteri probiotik pada pakan tidak hanya berpengaruh positif terhadap kinerja pertumbuhan saja, berdasarkan hasil penelitian dapat diketahui bahwa suplementasi probiotik memberikan hasil respons imun yang lebih baik dibanding perlakuan kontrol. Pemberian MP dengan frekuensi setiap hari pada dosis tinggi memberikan hasil terbaik terhadap parameter respons imun. Hal ini diduga berkaitan dengan efektivitas kinerja bakteri probiotik dalam meningkatkan sistem imun. Tingginya jumlah TBC dan TPC di saluran pencernaan pada perlakuan dengan dosis dan frekuensi tinggi (Tabel 2) mengakibatkan tingginya aktivitas bakteri tersebut dalam memberikan efek imunostimulan. Pada perlakuan tersebut, bakteri probiotik di saluran pencernaan mampu berinteraksi dengan Gut associated Lymphoid Tissue (GALT) secara optimal. Tingginya jumlah TBC dan TPC di saluran pencernaan dapat meningkatkan sensitivitas makrofag dalam mengetahui keberadaan antigen. Hal ini sesuai dengan pernyataan Nayak (2010) bahwa probiotik yang menempel di jaringan limfoid usus dapat mempercepat rangsangan pada makrofag untuk mengetahui keberadaan antigen. Tuan et al. (2013) menyatakan bahwa pemberian probiotik dapat meningkatkan jumlah flora mikroba di dalam saluran pencernaan sehingga meningkatkan fungsi pencernaan dan respons imun. Kadar hemoglobin, hematokrit, aktivitas fagositosis dan aktivitas respiratory burst pada akhir pemeliharaan serta pasca uji tantang menunjukkan bahwa perlakuan probiotik dengan frekuensi pemberian setiap hari menghasilkan nilai yang lebih tinggi dibandingkan frekuensi pemberian tiga hari sekali. Peningkatan dosis probiotik mengakibatkan peningkatan kadar hemoglobin, aktivitas fagositosis dan aktivitas respiratory burst, namun tidak memberikan pengaruh yang nyata terhadap peningkatan kadar hematokrit. Pemberian probiotik selama masa pemeliharaan diduga berpengaruh terhadap peningkatan dari beberapa parameter tersebut. Meningkatnya kadar hematokrit mengindikasikan bahwa probiotik yang digunakan efektif dalam meningkatkan status kesehatan ikan (Aly et al. 2008). Bakteri probiotik dapat memberikan efek imunostimulan melalui interaksi dengan Gut associated Lymphoid Tissue (GALT) sehingga mampu menstimulasi sistem imun (El-Bouhy et al. 2013). Pasca uji tantang terjadi fluktuasi nilai He, Hb, AF dan RB. Penurunan kadar He dan Hb pasca uji tantang diduga berhubungan dengan masa inkubasi A. hydrophila dan terkait adanya infeksi oleh bakteri tersebut. Penurunan parameter hematokrit dan hemoglobin pasca uji tantang menandakan adanya anemia (Tanbiyaskur et al. 2015) dan lisis pada sel darah merah akibat eksotosin maupun endotoksin yang dihasilkan oleh A. hydrophila (Hardi et al. 2014).
Meningkatnya aktivitas fagositosis dan respiratory burst pasca uji tantang mengindikasikan adanya peningkatan respons imun pada ikan uji. Menurut Aly et al. (2008), meningkatnya aktivitas respiratory burst menandakan adanya peningkatan respons imun non spesifik. Balcazar et al. (2007) menyatakan bahwa aktivitas fagositosis merupakan perlawanan awal sebagai respons inflamasi sebelum produksi antibodi, hal tersebut diperantai oleh sel fagosit seperti neutrophil, monosit dan makrofag. Fagosit merupakan mekanisme pertahanan yang paling penting terkait dengan produksi reactive oxygen species (ROS), proses tersebut akan mereduksi O2 menjadi O2- yang akan menghasilkan enzim
16
acid dan peroxynitrite yang berperan sebagai efek antimikroba. Hasil penelitian Biller-Takahasi et al. (2013) menunjukkan bahwa aktivitas respiratory burst meningkat setelah injeksi A. hydrophila pada Piaractus mesopotamicus.
Berdasarkan hasil penelitian dapat diketahui bahwa peningkatan dosis dan frekuensi pemberian probiotik pada pakan memberikan pengaruh terhadap penurunan total A. hydrophila pada organ target. Semakin tinggi frekuensi pemberian probiotik maka semakin cepat penurunan total A. hydrophila pada organ target. Hari ke-56 menunjukkan bahwa seluruh perlakuan probiotik dengan frekuensi pemberian setiap hari dapat menurunkan total A. hydrophila hingga <2.00±0.00 log CFU g-1. Penurunan total A. hydrophila di organ target mengindikasikan adanya upaya perlawanan sistem imun pada ikan terhadap pertumbuhan A. hydrophila oleh B. cereus P22 dan S. lentus L1k. B. cereus diketahui mampu mengurangi patogenitas dan pertumbuhan A. hydrophila (Lalloo et al. 2010). Menurut Tamamdusturi et al. (2016), pemberian probiotik melalui pakan dapat meningkatkan aktivitas fagositosis sehingga mengakibatkan penurunan A. hydrophila di organ target pasca uji tantang. Probiotik diketahui memiliki efek antimikroba dengan memodifikasi mikrobiota usus, mensekresi zat antibakteri (bakteriosin dan asam organik) (Cruz et al. 2012), bersaing dengan patogen untuk mencegah adhesi usus serta untuk memperoleh nutrisi yang dibutuhkan bagi kelangsungan hidup patogen (Tuan et al. 2013).
Pemberian pakan yang mengandung probiotik diketahui mampu meningkatkan jumlah total bakteri serta total P22 dan L1k pada saluran pencernaan sehingga dapat menekan infeksi A. hydrophila dan mampu meningkatkan kelangsungan hidup ikan lele pasca uji tantang. Hal tersebut sesuai dengan peranyataan Nayak (2010) bahwa probiotik mampu menempel di jaringan limfoid usus sehingga mempercepat rangsangan pada makrofag untuk mengetahui keberadaan antigen. Sya’bani et al. (2015) menyatakan bahwa pemberian probiotik Bacillus sp. dan Staphylococcus sp. pada media budidaya diketahui mampu meningkatkan kelangsungan hidup ikan lele (Clarias gariepinus) yang diinfeksi A. hydrophila. Hasil penelitian Khalwan et al. (2012) menunjukkan bahwa suplementasi probiotik Bacillus sp. dapat menurunkan presentase jumlah kematian pada ikan gurami (Osphronemus goramy) yang diinfeksi A. hydrophila. Utami et al. (2015) menyatakan bahwa suplementasi probiotik mikrokapsul diketahui efektif mengendalikan streptococcosis pada ikan nila (Oreochromis niloticus) dengan tingkat kelangsungan hidup yang lebih tinggi setelah uji tantang.
4 SIMPULAN DAN SARAN
Simpulan
17
Saran
Penambahan mikrokapsul probiotik pada pakan dengan dosis 2% yang diberikan setiap hari dapat dijadikan acuan dalam pemeliharaan ikan lele guna meningkatkan respons imun, resistensi dalam pencegahan MAS dan kinerja pertumbuhan.
DAFTAR PUSTAKA
Aly SM, Ahmed YA, Abdel-Aziz A. 2008. Studies on Bacillus subtilis and Lactobacillus acidophilus, as potential probiotics, on the immune response and resistance of Tilapia Nilotica (Oreochromis niloticus) to challenge infections. Fish & Shellfish Immun. 25:128-136.
Anderson DP, Siwicki AK. 1995. Basic hematology and serology for fish health programs. Proceeding of the second symposium on disease in Asian Aquaculture, October 25-29. 1993, Phuket, Thailand. hlm 185-202.
Bagheri T, Hedayati SA, Yavari V, Alizade M, Farzanfar A. 2008. Growth, survival and gut microbial load of Rainbow Trout (Onchorhynchus mykiss) fry given diet supplemented with probiotic during the two months of first feeding. Turkish J. Fish. Aqua. Sci. 8:43-48.
Balcazar JL, Blas ID, Ruiz-Zarzuela I, Vandrell D, Girones O, Muzquiz JL. 2007. Enhancement of the immuneresponse and protection induced by probiotic lactic acid bacteria against Furunculosis in Rainbow Trout (Oncorhynchus mykiss ). FEMS. Immunol. Med. Microbiol. 51:185-193.
Biller-Takahasi JD, Takahashi LS, Saita MV, Gimbo RY, Urbinati EC. 2013. Leukocytes respiratory burst activity as indicator of innate immunity of Pacu Piaractus mesopotamicus. Braz. J. Biol. 73(2):425-429.
Cruz PM, Ibanez L, Hermosillo OAM, Saad HE. 2012. Use of probiotics in aquaculture. ISRN Microbiology. 2012:1-14.
Effendie MI. 1997. Biologi Perikanan. Yogyakarta (ID): Yayasan Pustaka Nusantara.
El-Bouhy ZM, El-Nobi GA, Hassanin ME, El-Hady MA. 2013. Effects of dietary application of two antagonistic gut-isolated Bacillus species on the immune response of Oreochromis niloticus to Aeromonas hydrophila infection. Zag. Vet. J. 41(2):31-39.
El-Haroun ER. 2007. Improved growth rate and feed utilization in farmed African Catfish Clarias gariepinus (Burchell1822) through a growth promoter biogen supplementation. J. Fish. Aquat Sci. 2(5):319-327.
Huisman Ea. 1987. 1987. Principles of Fish Production. Wageningen (ND): Departement of Fish Culture and Fisheries, Wageningen Agricultural University.
18
Ilmiah, Jusoff K, Sukenda, Widanarni, Rustam. 2013. The role of probiotic bacteria on controling vibriosis in Tiger Grouper Fry (Epinephelus fuscoguttatus). J. Fish and Marine Sci., 5(6):622-627.
Jafari SM, Assadpoor E, He Y, Bhandari B. 2008. Encapsulation efficiency of food flavours and oils during spray drying. Dry. Tech. 26(7):816-835.
Janda J M, Abbott SL. 2010. Genus Aeromonas: taxonomy, pathogenicity and infection. Clin. Microbiol. Rev. 23(1):35-73.
Jyothi NVN, Prasanna PM, Suhas NS, Prabha KS, Ramaiah PS, Srawan GY. 2010. Microencapsulation technique, factors influencing encapsulation efficiency. Review. J. Microencapsulation. 27(3): 187-197.
Khalwan, Irianto A, Rachmawati FN. 2012. Pengaruh suplementasi Bacillus sp. melalui perifiton terhadap jumlah total mikroba intestinal dan gambaran darah Ikan Gurami (Osphronemus gouramy). Biotek. 9(2):35-40.
Lalloo R, Moonsamy G, Ramchuran S, Gorgens J, Gardinel N. 2010. Competitive exclusion as a mode of action of a novel Bacillus cereus aquaculture biological agent. J. compilation. 50(2010): 563–570.
Munaeni W, Yuhana M, Widanarni. 2014. Effect of Micro-encapsulated synbiotic at different frequencies for Luminous Vibriosis control in White Shrimp (Litopenaeus vannamei). J. Mikrobiol Indones. 8(2):73-80.
Nayak SK. 2010. Probiotics and Immunity: a fish perspective. Fish & Sellfish Immunology, 29(1): 2-14.
Putra AN, Widanarni. 2015. Screening of amylolytic bacteria as candidates of probiotikcs in Tilapia (Oreochromis sp.). J. Microbiol, 10(1):1-13.
Rahmawati FF. 2015. Suplementasi mikrokapsul probiotik melalui pakan sebagai pencegah infeksi Streptococcosis pada Ikan Nila (Oreochromis niloticus) [Thesis]. Bogor (ID):Institut Pertanian Bogor.
Sya’bani N, Yustiati A, Rustikawati I, Lusiastuti A. 2015. Frekuensi penambahan
probiotik Bacillus sp. dan Staphylococcus sp. pada media pemeliharaan Ikan Lele Dumbo (Clarias gariepinus) untuk ketahanan terhadap Aeromonas hydrophila.J. Perikanan Kelautan, 6(2):130-140.
Tamamdusturi R, Widanarni, Yuhana M. 2016. Administration of microencapsulated probiotic Bacillus sp. NP5 and prebiotic mannan oligosaccharide for prevention of Aeromonas hydrophila infection on Pangasianodon hypophehalmus. J. Fish. Aquat Sci. doi: 10.3923/jfas.2016. Tanbiyaskur, Widanarni, Lusiastuti AM. 2015. Administration of Bacillus NP5
and Oligosaccharide to enhance the immune response in Tilapia Oreochromis niloticus towards Streptococcosis. IJSBAR. 20(2):304-315. Thomas LW, Chhorn L. 2011. Use of probiotics in diets of Tilapia. J. Aquac. Res
Development.31:2-8.
Tuan TN, Duc PM, Hatai K. 2013. Overview of the use of probiotics in aquaculture. Urpjournals. 3(3): 89-97.
Utami DAS, Widanarni, Suprayudi MA. 2015. Administration of microencapsulated probiotic at different doses to control Streptococcosis in Tilapia (Oreochromis niloticus). J. Microbiol. Indones. 9(1):17-24.
19
Weinbreck F, Bodnar I, Marco ML. 2010. Can encapsulation lengthen the shelf-life of probiotic bacteria in dry products?. IJFOODMICRO.136:364-367. Zhang J, Liu Y, Tian L, Yang H, Liang G, Xu, D. 2012. Effects of dietary mannan
oligosakarida on growth performance, gut morphology and stress tolerance of juvenile pacific White Shrimp (Litopenaeus vannamei). Fish & Shellfish Immun. 33: 1027-1032.
Zubaidah A, Yuhana M, Widanarni. 2015. Encapsulated synbiotic dietary supplementation at different dosages to prevent vibriosis in White Shrimp, Litopenaeus vannamei. J. HAYATI Biosci. (22):163-168. doi:10.1016/j.hjb.2015.10.007.
20
Lampiran 1 Analisis statistik terhadap laju pertumbuhan spesifik (A) dan rasio konversi pakan (B) ikan lele yang diberi probiotik dengan dosis dan frekuensi berbeda selama masa pemeliharaan
Means for groups in homogeneous subsets are displayed.
ANOVA
21
Lampiran 2 Hasil uji Duncan terhadap kadar hematokrit, hemoglobin, aktivitas fagositosis dan respiratory burst pada akhir pemberian pakan perlakuan dan setelah uji tantang dengan A. hydrophila.
Hematokrit
Perlakuan Hari ke
40 44 49 56
K- 32.30±0.43a 32.73±0.00f 32.86±0.19c 34.34±1.17cd K+ 32.30±0.43a 15.39±0.74a 18.18±0.00a 19.46±1.05a A 37.62±0.69c 27.04±1.05de 30.59±0.51c 32.90±0.00cd B 36.36±0.00b 23.25±0.00b 26.97±0.43b 29.72±0.00c C 32.41±0.46a 27.53±0.36e 31.10±0.21c 33.02±1.69d D 31,73±0.50a 25.81±0.39cd 27.27±0.00b 28.49±0.00b E 36.36±0.00b 27.70±0.61e 31.84±1.25c 33.28±0.91d F 37.05±0.98bc 25.00±0.00c 27.23±0.79b 30.59±1.77c
Hemoglobin
Perlakuan Hari Ke-
40 44 49 56
K- 8.10±0.14a 8.00±0.00g 8.00±0.00e 8.00±0.00c
K+ 8.10±0.14a 4.10±0.14a 4.50±0.14a 5.50±0.14a
A 8.30±0.14a 6.65±0.07d 7.10±0.14c 8.10±0.14c
B 8.30±0.14a 7.10±0.14e 7.10±0.14c 7.55±0.07b
C 10.30±0.14cd 5.05±0.07b 7.30±0.14cd 8.00±0.00c
D 10.00±0.00c 5.40±0.00c 6.65±0.71b 7.40±0.00b
E 10.50±0.14d 7.50±0.14f 7.80±0.00e 9.00±0.00d
F 9.20±0.28b 6.90±0.14e 7.50±0.14d 8.00±0.00c
Aktivitas fagositosis
Perlakuan Hari ke
40 44 49 56
K- 22.50±0.00a 28.75±1.77a 28.75±1.77a 26.25±1.77a
K+ 22.50±0.00a 36.25±1.77b 36.25±1.77b 31.25±1.77b
A 30.00±0.00b 55.00±0.00d 46.25±1.77cd 46.25±1.77d
B 28.75±1.77b 46.25±1.77c 42.50±0.00c 36.25±1.77c
C 33.75±1.77c 56.25±1.77de 51.25±1.77ef 52.50±0.00e
D 28.75±1.77b 47.50±0.00c 48.75±1.77d 36.25±1.77c
E 31.25±1.77bc 58.75±1.77e 53.75±1.77f 51.67±0.00e
22
Respiratory Burst
Perlakuan Hari Ke-
40 44 49 56
K- 0.044±0.003a 0.045±0.004a 0.046±0.001a 0.045±0.001a
K+ 0.044±0.003a 0.047±0.001ab 0.046±0.001a 0.047±0.000ab
A 0.053±0.002b 0.048±0.001ab 0.052±0.002b 0.049±0.005ab
B 0.048±0.002ab 0.051±0.008ab 0.046±0.000a 0.047±0.001ab
C 0.052±0.005b 0.066±0.005d 0.055±0.003b 0.051±0.003ab
D 0.049±0.000ab 0.058±0.007bcd 0.049±0.002ab 0.048±0.001ab
E 0.054±0.002b 0.076±0.005f 0.069±0.003c 0.051±0.003b
23
RIWAYAT HIDUP
Penulis dilahirkan di Wonosobo pada tanggal 24 Oktober 1992 dari Ibu Siti Ngaisah dan Ayah Sujono. Penulis merupakan bungsu dari 2 bersaudara. Pendidikan formal yang pernah dilalui penulis adalah SDN 01 Rogojati (lulus tahun 2004), SMPN 2 Banjarnegara (lulus tahun 2007) dan SMAN 1 Banjarnegara (lulus tahun 2010). Penulis menempuh pendidikan sarjana pada Program Studi Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Universitas Diponegoro melalui jalur prestasi PMDK tahun 2010 dan lulus tahun 2014. Pada tahun 2014 penulis melanjutkan studinya dengan menempuh Program Magister pada Program Studi Ilmu Akuakultur, Sekolah Pascasarjana, Institut Pertanian Bogor.