PEMBUATAN PROTOTIPE KIT IMUNOKROMATOGRAFI
UNTUK MENDETEKSI ANTIGEN
Edwardsiella Tarda
SAFRULLAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Pembuatan Prototipe Kit Imunokromatografi Untuk Mendeteksi Antigen Edwardsiella Tarda adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2016
Safrullah
RINGKASAN
SAFRULLAH. Pembuatan Prototipe Kit Imunokromatografi untuk mendeteksi antigen Edwardsiella tarda. Dibimbing oleh FACHRIYAN HASMI PASARIBU dan AGUSTIN INDRAWATI.
Edwardsiella tarda adalah salah satu agen penyebab penyakit
Edwardsiellosis yang sering menjadi kendala dalam budidaya ikan. Penyakit ini tak jarang menyebabkan kerugian ekonomi. Untuk penanganan lebih dini serta mencegah tersebar luasnya penyakit ini, diperlukan sebuah metode uji yang cepat dan akurat. Selama ini pengujian terhadap Edwardsiella tarda dilakukan secara konvensional yaitu uji biokimiawi yang memakan waktu dan membutuhkan peralatan banyak atau melalui uji cepat lain seperti Polymerase Chain Reaction
(PCR), ELISA yang mahal dan membutuhkan personel terlatih.
Tujuan penelitian ini adalah untuk mengembangkan Kit Imunokromatografi pendeteksi antigen Edwardsiella tarda. Kit Imunokromatografi adalah strip uji yang berbasis pada imunokromatografi dari hasil ikatan antigen-antibodi yang sudah dilabel dengan pewarna tertentu sehinga dapat dilihat tanpa memerlukan alat khusus dan personel dengan keahlian khusus. Oleh karena itu diharapkan kit imunokromatografi ini dapat menjadi alternatif uji yang cepat, murah, mudah dan akurat.
Antibodi yang digunakan dalam penelitian ini adalah poliklonal antibodi yang diproduksi melalui immunisasi kelinci dengan antigen somatik (O) dari isolat
Edwardsiella tarda yang diperoleh dari Stasiun Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Pontianak. Antibodi tersebut kemudian dikonjugasikan dengan partikel emas dengan pH 8.0 sebanyak 26µg/ml dan
di-block dengan 200 µl 1% BSA yang akan digunakan sebagai konjugat antibodi. Kit ini terdiri dari 4 bagian yaitu : bantalan sampel, bantalan konjugat, membran nitroselulosa dan bantalan penyerap. Membran nitroselulosa merupakan daerah uji yang ditetesi dengan antibodi anti-Etarda pada daerah uji dan IgG kambing anti-kelinci sebagai daerah kontrol.
Sampel yang terdiri dari isolat Edwardsiella tarda dan 6 Isolat lain yang diidentifikasi dengan sekuensing pada gen 16s rRNA dan di-BLAST dengan database yang ada di National Centre of Biotechnology and Information (NCBI) USA. Sampel dipersiapkan dengan proses pemanasan 100ºC selama 30 menit.
Hasil pengujian terhadap 7 sampel tersebut (Edwardsiella tarda, Edwardsiella ictaluri, Aeromonas hydrophilla, Escherichia coli, Salmonella Enterica, Pseudomonas stutzeri dan Plesiomonas shigelloides) tidak menunjukkan reaksi silang dengan Edwardsiella tarda.
Penelitian ini secara umum menginformasikan bahwa kit imunokromatografi dengan memanfaatkan poliklonal antibodi terhadap
SUMMARY
SAFRULLAH. Development Immunochromatographic Kit Prototype for
Edwardsiella tarda Antigen Detection. Under direction of FACHRIYAN HASMI PASARIBU dan AGUSTIN INDRAWATI.
Edwardsiella tarda is one of the causative agents of edwardsiellosis disease which often become obstacles in fish farming. This disease often causing economical losses. For early treatment and prevent the spread of this disease, a fast and accurate detection method is needed. Detection methode against Edwardsiella tarda has been done trough conventional biochemical tests which time consuming and require a lot of equipment or through other rapid tests such as Polymerase Chain Reaction (PCR), Elisa which more expensive and require well trained personnel.
The purpose of this study was to develop Immunochromatographic kit to detect Edwardsiella tarda antigen. Immunochromatographic kit /strip test is test kit that based on a immunochromtography of antigen-antibody binding that have been labeled with a particular dye so that it can be viewed without special tools and well trained personnel needs. Therefore we expect this Immunochromatographic kit can be an alternative detection method that is fast, cheap, easy and accurate.
Antibodies that used in this study are polyclonal antibodies produced by immunization of rabbits with somatic antigen (O) of Edwardsiella tarda obtained from Fish Quarantine and Inspection Agency Class I Pontianak. These antibodies were conjugated with gold particles at pH of 8.0 as 26μg / ml and blocked with 200 mL of 1% BSA to be used as antibody conjugate.
This kit consists of four parts: sample pads, conjugate pads, nitrocellulose membranes and absorbent pads. A nitrocellulose membrane test area drip with
anti-Edwradsiella tarda in the test area and goat anti-rabbit IgG as a control .
A sample of Edwardsiella tarda isolate and 6 other Isolates were identified by sequencing the 16S rRNA gene and BLASTed with existing databases at the
National Centre of Biotechnology and Information (NCBI), USA is prepared by heating 100ºC for 30 minutes.
The test results of 6 samples (Edwardsiella ictaluri, hydrophilla Aeromonas, Escherichia coli, Salmonella enterica, Pseudomonas stutzeri and Plesiomonas shigelloides) shown no cross-reaction with Edwardsiella tarda.
This research generally informs that immunochromatografiphic kit using polyclonal antibodies against Edwardsiella tarda conjugated with gold particles could detect the presence of Edwardsiella tarda antigen and shown no cross-reaction with at least six other isolates. Further research on optimization of sample preparation, the limit of detection, resistance kit in particular storage conditions and cross-reactivity with more antigens are needed to prove this kit as an alternative to rapid test kit and accurate.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PEMBUATAN PROTOTIPE KIT IMUNOKROMATOGRAFI
UNTUK MENDETEKSI ANTIGEN
Edwardsiella Tarda
SAFRULLAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sain
pada
Program Studi Mikrobiologi Medik
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu Wa Ta’alaatas segala karuniadan hidayah-Nya sehingga penulis dapat menyelesaikan penyusunan tesis penelitian yang berjudul “PEMBUATAN PROTOTIPE KIT IMUNOKROMATOGRAFI UNTUK MENDETEKSI ANTIGEN Edwardsiella tarda” , disusun sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada Program Studi Mikrobiologi Medik (MKM), Sekolah Pascasarjana Institut Pertanian Bogor.
Ucapan terima kasih sebesar-besarnya atas doa, bimbingan, dukungan dan bantuan dalam penyelesaian tesis ini penulis sampaikan kepada :
1. Prof. Dr. Drh. Fachriyan Hasmi Pasaribu sebagai ketua komisi pembimbing dan Dr. Drh. Agustin Indrawati, M.Biomed sebagai anggota komisi pembimbing.
2. Prof. Dr. Drh. I Wayan Teguh Wibawan, MS sebagai penguji luar komisi. 3. Prof. Dr. Drh. Retno D. Soejoedono, MS; Dr. Drh. Idwan Sudirman; Dr.
Drh. Eko Sugeng Pribadi, MS; Drh. Surachmi Setiyaningsih, PhD; MSc; Dr. Drh. Sri Murtini, M.Si; Drh. Ni Luh Putu Ika Mayasari, PhD; Dr. Drh. Okti Nadya Poetri, M.Si; Drh. Titiek Sunartatie, MS sebagai dosen di Program Studi Mikrobiologi Medik.
4. Sokhib, S.Pi. MP; Ir. Eka Perdana, MP dan seluruh staf Stasiun Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Pontianak. 5. Adeh Isnawati, SE; Roselyn Syaferina, A.Md; Agus Soemantri, S.Pd; Mas
Wahyu, Pak Nur dan seluruh staf Mikrobiologi Medik.
6. Wiwik Susanti, Dina Kartini, Faidah Rachmawati, Triwardhani C, Ronna CZ, Kusumandari Indah P, Diyantoro, Maiyus Musrianti, Nadhrah Alhan serta seluruh teman-teman MKM 2012, 2014 dan 2015.
Bogor, November 2016
DAFTAR ISI
DAFTAR ISI xiii
DAFTAR GAMBAR xiv
DAFTAR TABEL xiv
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
Hipotesa Penelitian 3
2 TINJAUAN PUSTAKA 3
Edwardsiella tarda 3
Kit Imunokromatografi 5
Partikel Emas 7
Antibodi 9
3 METODE 10
Waktu dan Tempat 10
Bahan dan Alat 10
Metode Penelitian 11
Analisa Data 13
4 HASIL DAN PEMBAHASAN 13
Identifikasi dan Produksi Antigen 13
Produksi Poliklonal Antibodi 15
Konjugasi Antibodi dengan Partikel Emas 20
Konstruksi Kit Imunokromatografi 23
Uji Coba Kit Imunokromatografi 25
KESIMPULAN DAN SARAN 26
DAFTAR PUSTAKA 27
LAMPIRAN 30
DAFTAR GAMBAR
Gambar 1. Struktur Kit Imunokromatografi 5
Gambar 2. Prinsip Uji Kit Imunokromatografi 6
Gambar 3. Diagram Yang Menggambarkan Komposisi Dari Partikel Emas 8 Gambar 4. Gambar TEM dari Partikel Emas yang Dibuat Dengan Metode
Reduksi Sitrat Dengan Diameter Partikel Rata-Rata 15 nm 9
Gambar 5. Immunoglobulin G 10
Gambar 6. Isolat E. tarda dan Uji Biokimiawi 13
Gambar 7. Hasil Identifikasi Edwardsiella tarda Menggunakan Kit API20E
v4.1 14
Gambar 8. Reaksi Aglutinasi dan Agar Gel Presipitation Test (AGPT) 16
Gambar 9. Hasil Pengukuran Titer Antibodi 16
Gambar 10. Hasil Elektroforesis SDS PAGE serum 18
Gambar 11. Hasil Pengukuran Absorbansi Serum dengan Nanodrop™
ND2000 19
Gambar 12.Nilai Absorbansi Koloid Emas Pasca Konjugasi dengan Antibodi
pada berbagai tingkatan Keasaman 21
Gambar 13. Kit Imunokromatografi Hasil Konstruksi 24
Gambar 12. Hasil Uji Reaksi Slang Kit Imunokromatografi 25
DAFTAR TABEL
Tabel 1. Hasil dan Interpretasi Hasil Pengujian API20 E V.4.1 15 Tabel 2. Perubahan Warna pada Titrasi Konsentrasi Antibodi Untuk
Menstabilkan Koloid Emas 22
Tabel 3. Konsentrasi Antibodi Yang Ditambahkan Untuk Menstabilkan
1ml Koloid Emas. 22
Tabel 4. Hasil BLAST Isolat Bakteri dengan Database NCBI 25
1 PENDAHULUAN
Latar Belakang
30
menyebabkan penurunan kualitas lingkungan budidaya sehingga menjadi faktor pemicu bagi munculnya beberapa penyakit.
Dari beberapa penyakit yang ada, Edwardsiellosis/Emphisemathous Putrevactus Disease of Catfish (EPDC) yang disebabkan oleh Edwardsiella tarda, merupakan salah satu penyakit yang sering dihadapi. Gejala penyakit ini meliputi gejala eksternal yaitu adanya lesi kulit kecil sekitar 3-5 mm, yang terletak di wilayah postero-lateral tubuh (Austin dan Austin 2012). Lesi ini disebabkan oleh fistula yang berasal jauh di dalam otot yang muncul sebagai masa subdermal (Noga 2010). Abses akan berkembang menjadi daerah berongga berisi gas. Abses terlihat seperti pigmen, cembung dan bengkak, jika ditusuk mengeluarkan bau busuk, sehingga disebut penyakit yang menyebabkan kebusukan (emphysematous) pada lele (Buller 2014). Pada ikan Turbot di Spanyol menyebabkan adanya tumor mata, pendarahan, peradangan (ginjal, hati dan limpa) dan ascites (Padrós et al. 2006
dalam Austin dan Austin 2012).
Penyakit yang disebabkan oleh E. tarda ini pernah dilaporkan selain menyerang Belut (Anguilla japonica) di Jepang (Miyazaki and Egusa 1976 dalam
Noga 2010), juga menyerang Channel Catfish (Ictalurus punctatus) di Amerika Serikat (Meyer dan Bullock, 1973 dalam Buller 2014) dan beberapa ikan di amerika seperti Striped Bass liar (Moroxone saxatilis) in Chesapeake Bay dan pada Salmon Chinook (Oncorhynchus tshawytscha) di sungai Rogue Oregon, pada Largemouth Bass (Micropterus salmoides) di Florida, USA (White et al. 1973; Amandi et al.
1982; Baya et al. 1997 dalam Buller 2014).
Meskipun data pendukung tentang kerugian yang diakibatkan oleh penyakit ini di Indonesia masih sangat kurang, tetapi penyebaran penyakit ini telah diketahui dan sangat luas. Yaitu meliputi : DI Yogyakarta, Kalimantan Barat, Jawa Barat, Jawa Tengah, Jambi, Bangka Belitung, Kalimantan Tengah, Sulawesi Tengah, DKI Jakarta dan Sumatera Barat (KKP 2013). Untuk itu diperlukan upaya pencegahan agar penyakit ini tidak menyebar ke daerah lain yang lebih luas lagi.
Salah satu faktor keberhasilan dalam upaya penanganan dan mencegah penyebaran yang lebih luas, adalah diperlukannya metode uji cepat, mudah dan akurat yang dapat digunakan sebagai acuan. Hal tersebut akan menjadi pijakan baik dalam tindakan penanganan yang lebih dini untuk menghindari kerugian yang lebih besar maupun tindakan melokalisasi wabah agar tidak berpindah atau menyebar ke daerah lain yang lebih luas.
Penyakit yang disebabkan oleh E. tarda selama ini dideteksi dengan uji konvensional biokimiawi yang tentunya membutuhkan waktu yang tidak singkat (3-5 hari), peralatan yang banyak, tempat khusus (laboratorium) serta kompetensi personel penguji. Sedangkan uji molekuler (Polymerase Chain Reaction (PCR)) dan immunoassay (Elisa, FAT, Aglutinasi dsb) menawarkan keunggulan lebih cepat tetapi memerlukan kompetensi personel yang memadai, bahan dan peralatan yang mahal, tempat khusus (laboratorium) serta tidak bersifat portable (mudah dipindahkan).
31
secara kasat mata. Kit ini juga bisa dipindahkan tanpa perlu mempertahankan kit dalam keadaan dingin yang biasanya menjadi hambatan tersendiri untuk memindahkan bahan-bahan pada metode pengujian yang lain seperti PCR, Elisa dan Immunoassay yang lain. Selain itu bahan-bahan untuk membuat kit ini bisa didapatkan dengan murah. Oleh karena itu diharapkan kit ini mampu menjadi alternatif alat uji yang mudah, cepat, murah dan akurat.
Perumusan Masalah
Penyakit Edwardsiellosis / Emphisemathous Putrevactus Disease of Catfish(EPDC) atau Edwardsielosis septicemia disebabkan oleh E. tarda.
Penyakit ini merupakan salah satu ancaman dalam usaha budidaya ikan yang perlu dilakukan pencegahan dan penanganan secara dini. Salah satu faktor keberhasilan pencegahan dan penanganan dini adalah dibutuhkan uji penapisan yang cepat dan akurat. Oleh karena itu kit imunokromatografi yang dikembangkan ini diharapkan menjadi alternatif alat uji penapisan yang bersifat cepat, murah, mudah dan akurat.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengembangkan Kit Imunokromatografi dalam mendeteksi antigen E. tarda sebagai alternatif uji penapisan yang cepat, murah dan akurat.
Manfaat Penelitian
Memberikan informasi tentang alternatif alat uji penapisan awal yang cepat, murah dan akurat.
Ruang Lingkup Penelitian
Dalam penelitian ini dilakukan serangkaian kegiatan berupa identifikasi ulang bakteri E. tarda, menyiapkan antigen E. tarda, membuat antibodi poliklonal terhadap E. tarda pada kelinci, purifikasi antibodi, konjugasi antibodi dengan partikel emas, konstruksi kit imunokromatografi dan melakukan uji reaksi silang dari kit imunokromatografi terhadap beberapa isolat bakteri.
Hipotesa Penelitian
Hipotesa yang diajukan dalam penelitian ini adalah sebagai berikut : H0 : Kit Imunokromatografi menggunakan poliklonal antibodi anti-E. tarda
terlabel partikel emas dapat mendeteksi antigen E. tarda.
H1: Kit Imunokromatografi menggunakan poliklonal antibodi anti-E. tarda
32
2 TINJAUAN PUSTAKA
Edwardsiella tarda
E. tarda merupakan mikroorganisme penyebab penyakit Edwardsiellosis / Emphisemathous Putrevactus Disease of Catfish(EPDC) atau Edwardsiella Septicemia (ES).
Etiologi
Sejarah edwardsiellosis, dapat ditelusuri dengan dua jenis perkembangan paralel, yaitu dari Wakabayashi dan Egusa (1973) di Jepang, dan Meyer dan Bullock (1973) di Amerika Serikat. Situasi ini semakin rumit oleh laporan
sebelumnya dari Hoshina (1962), yang menggambarkan paracolobactrum
anguillimortiferum sebagai patogen pada budidaya belut. Organisme ini diduga identik dengan E. tarda (Austin dan Austin 2012).
Genus Edwardsiella pertama kali diungkapkan oleh Sakazaki dan Murata pada tahun 1962 dan Sakazaki pada tahun 1967. Kemudian didefinisi ulang oleh King dan Adler pada tahun 1964, dan diangkat sebagai genus oleh Ewing et al. pada tahun 1965 (Barrow dan Feltham, 2003). Genus ini merupakan satu dari 39 anggota dari family Enterobacteriaceae (Buller 2014).
E. tarda tumbuh dalam media Tryptic Soy Agar (TSA) atau Brain Heart Infussion Agar (BHIA) (Amandi et al. 1982 dalam Austin dan Austin 2012). Secara makroskopis koloni Edwardsiela tarda berbentuk bulat, kecil (diameter 0,5 mm), cembung, warna transparan dan berkembang dalam waktu 48 jam pada temperatur 24-26°C (Meyer dan Bullock 1973 dalam Buller 2014). Pada media TSA, koloni
E. tarda berukuran 0.5-1 mm, putih keabu-abuan, transparan, bulat, entire, berkilau, permukaan cembung dan terlihat basah setelah inkubasi 24 jam pada temperatur 25°C sedangkan dalam media Blood Agar, koloni berwarna putih, cembung, berkilau, lembut dan bulat (Wakabayashi dan Egusa 1973 dalam Buller 2014). Secara makroskopis E. tarda berbentuk batang gram negatif, aerobik dan fakultatif aerob, oksidase negatif, memfermentasi gula dan produksi gas, mereduksi nitrat menjadi nitrite, memproduksi gas H2S pada media Triple Sugar Iron (Barrow dan Feltham, 2003). Katalase positif, Motil, batang pendek (2x0.6 µm) positif pada Christensen citrate tetapi negatif pada Simmons Citrate ((Ewing et al. 1965; Alcaida et al. 2006) dalam Buller 2014).
E.tarda hidup secara alamiah di perairan tawar dan laut khususnya perairan yang banyak mengandung bahan organik, tetapi juga ditemukan hidup di tanah berlumpur. Penyakit ini juga dihubungkan dengan kualitas air yang buruk dan tingginya temperatur air diatas 30°C (Meyer dan Bullock 1973 dalam Buller 2014) Namun E.tarda juga ditemukan pada ikan nila terjadi pada musim dingin dan musim semi ketika temperatur berkisar 20º-30ºC (Miyashita 1984 dalam Buller 2014) dan pada temperatur 17ºC untuk kejadian penyakit pada Solea senegalensis
di Spanyol (Castro et al. 2012 dalam Buller 2014).
33
dalam Austin dan Austin 2012). Selain itu keberadaan dari invertebrata air seperti Keong dan Bulu Babi serta vertebrata air seperti ular, katak, kura-kura, burung camar dan manusia dianggap sebagai faktor penting sebagai reservoir dari infeksi ini, meskipun belum ada gambaran jelas apakah E.tarda berperan sebagai patogen primer atau oportunis (Austin dan Austin 2012).
Dua Fenotip dilaporkan di Jepang, strain typical yang dicirikan dengan motil dan strain atypical yang bersifat non motil. Keduanya dilaporkan menyerang pada Belut (A. japonica), Flounder (Paralichtys olivaceous), Red Seabream
(Pagrus major) dan Yellow Tail (seriola quinquer-adiata) (Nakatsugawa 1983; Tomomasa et al. 2005 dalam Buller 2014).
National Institute of Helath (NIH) Jepang dan Centers for Disease Control
(CDC) USA berhasil mengelompokkan 61 antigen group O dan 45 antigen H (Tamura et al. 1988 dalam Buller 2014). Park et al. (1983) dalam Buller (2014) mengelompokkan menjadi 4 serotipe, A,B,C dan D dimana serotipe A adalah yang paling virulen.
Gejala Klinis
Gejala penyakit yang disebabkan E. tarda meliputi gejala eksternal yaitu adanya lesi kulit kecil sekitar 3-5 mm, yang terletak di wilayah postero-lateral tubuh (Austin dan Austin 2012). Lesi ini disebabkan oleh fistula yang berasal jauh di
dalam otot yang muncul sebagai masa subdermal (Noga 2010). Kemudian dengan
berkembangnya penyakit, terjadi abses di otot tubuh dan ekor. Abses ini dapat memperbesar, dan berkembang menjadi rongga yang berisi gas dan terlihat berpigmen, berbentuk cembung yang jika ditusuk akan mengeluarkan bau busuk. Kondisi ini telah menyebabkan penamaan penyakit ini sebagai penyakit yang menyebabkan bau busuk (emphysematous) pada lele (Austin dan austin 2012). Pada Internal organ terjadi petechiae dan berbau busuk (Karena produksi Hidrogen sulfid) necrosis liquefactif dari organ dalam dengan peritonitis fibrinous (Noga 2010).
Gejala Umum penyakit ini adalah berkurangnya pigmen kulit, perut bengkak berisi cairan, hemoragi, anus menonjol dan mata keruh. Gejala internal ditunjukkan dengan adanya nodul pada insang, ginjal dan limfa serta kadang pada usus berisi bakteri (Kubota et al. 1981 dalam Austin dan Austin 2012).
Meskipun kerugian pada lele belum tercatat, penyakit ini menyebabkan efek ekonomi yang parah. Yaitu ketika ikan yang terinfeksi masuk ke industri pengolahan, bau yang busuk efektif akan menghentikan proses produksi karena diperlukan desinfeksi dan deodorisation. Dengan demikian, kerugian keuangan yang lumayan besar pada industri pemroses karena keberadaan sebagian ikan yang terinfeksi penyakit ini (Austin dan austin 2012).
Metode Deteksi
Deteksi E. tarda menggunakan metode Loop-Mediated Isothermal Amplification (LAMP) didasarkan pada amplifikasi gen haemolysin (ethA).
Backward Iinner Primer (BIP) terdiri dari primer B1, linkerdan primer B2 (5’-TTG
GTA CCA TCG GCA AGC CGT TTT GGT ATC GCT GCT GCT CTG C-3’).
Forward Inner Primer (FIP) terdiri dari F1c, linker dan sekuen komplemen dari
34
(5’-AGC CAA CGT ACC CAG GTC-3’). Amplifikasi dilakukan pada 65°C selama 45 menit. Sensitifitas uji berada pada kisaran 10-109 CFU (Buller 2014).
Deteksi E. tarda menggunakan Polymerase Chain Reaction (PCR) dengan
target 450 bp dari fragmen gen 16s rRNA menggunakan primer ETF8 (911) (5’
-CTGTAGAGATATGGGAGTGCCT-3’) dan ETR8 (1360) (5’
-CTCCCGAAGGTTAAGCTAGCTA-3’). Campuran dari 10 ng template DNA, 50 pmol primer, 100 µmol masing dNTP dan 2 mM MgCl2 di amplifikasi pada 35 siklus (94°C 2 menit, 64°C 1 menit dan 72°C 3 menit). Kemudian 10 µl hasil amplifikasi dianalisa pada agarose 1.2%. Metode ini dapat mendeteksi E tarda pada minimum konsentrasi 8 CFU/ml dan maksimal pada 106 CFU/ml (Kumar et al.
2008).
Kit Imunokromatografi
Kit Imunokromatografi / lateral flow immunoassay didasarkan pada prinsip-prinsip Imunokromatografi. Bahan pembuat Kit terdiri dari bahan berpori empat zona yang mengandung reagen yang berbeda, yaitu : bantalan contoh, bantalan konjugat yang mengandung antibodi/antigen konjugat, membran deteksi yang mengandung protein/antibodi yang terserap sebagai garis uji dan kontrol garis, dan bantalan penyerap (Gambar 1).
Gambar 1 Struktur Kit Imunokromatografi (O’farrel 2009)
35
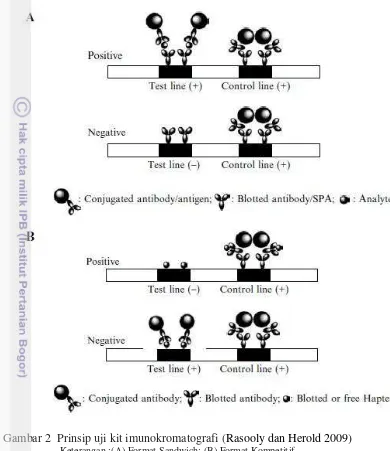
Dua macam format yang dominan digunakan dalam Kit Imunokromatografi adalah sandwich dan kompetitif. Ini dapat dijelaskan secara grafis seperti ditunjukkan pada Gambar 2.
Gambar 2 Prinsip uji kit imunokromatografi (Rasooly dan Herold 2009) Keterangan :(A) Format Sandwich: (B) Format Kompetitif.
36
positif (Gambar 2A). Sedangkan format kompetitif paling sering digunakan saat pengujian untuk molekul kecil dengan determinan antigen tunggal. Analit bebas dalam larutan sampel akan bersaing dengan analit bergerak di jalur tes untuk mengikat antibodi terkonjugasi emas koloid pada konsentrasi yang ditetapkan. ketegasan garis uji tergantung pada konsentrasi analit bebas yang ada dalam sampel
uji (Gambar 2B) (Rasooly dan Herold 2009). Contoh format sandwich adalah tes
strip untuk uji human chorionic gonadotropin (HCG), sedangkan test untuk penyalah gunaan obat dan narkotika adalah contoh untuk yang format kompetitif .
Selain penggunaan label partikel emas, beberapa label juga telah berhasil dikomersialisasikan dan dilakukan penelitian. Diantara label lain tersebut yaitu : liposome, partikel latex, koloid karbon, partikel paramagnetik, enzim, probe fluerescent (Wong dan Tse 2009). Namun partikel emas adalah yang paling populer diabanding dengan yang lainnya. Hal ini dikarenakan partikel emas mempunyai mobilitas yang lebih baik pada membran nitroselulosa dibandingkan latex, tidak mudah mengendap sebelum kit dipakai dan mudahnya menambahkan prosedur untuk meningkatkan sensitifitas uji (Chiao et al. 2004) Sedangkan dilihat dari efek pada protein yang dilabel, penggunaan partikel emas pada ligan tidak menyebabkan perubahan struktur kimia ligan tersebut (Horisberger 1979 dalam Hayat 1989).
Partikel Emas
Koloid emas telah menarik perhatian para ilmuwan selama lebih dari 400 tahun jauh sebelum konsep zat koloid lyophobic dipahami. Daya tarik dengan koloid emas berpusat pada sifat kromatik dan manfaanya sebagai obat. Pada tahun 1600an, Parcelsus menjelaskan preparasi minuman emas (oleum auri, quinta essentia auri) melalui reduksi emas-klorida dengan ekstrak alkohol suatu tanaman (Weiser, 1933 dalam Hayat 1989). Sampai Abad Pertengahan, koloid emas digunakan sebagai obat untuk berbagai penyakit seperti jantung, penyakit kelamin, disentri, epilepsi, dan tumor yang didokumentasikan dalam sebuah buku yang ditulis oleh Francisci antonii tahun 1618 (Vatjai 2013). Koloid emas ini adalah salah satu obat sintetis pertama dan dalam bahasa china disebut dengan nama chin-tau dan dalam pengobatan India disebut makaradhwaja (Mahdihassan 1985 dalam
Hayat 1989). Campuran berwarna merah ini adalah contoh dari koloid emas yang terbentuk oleh kondensasi dan dapat dengan mudah terkonsentrasi menjadi warna merah oker sedikit berminyak tanpa flokulasi. Hal ini mungkin karena kehadiran zat pelindung dalam ekstrak tanaman alkohol yang digunakan dalam persiapannya
37
Gambar 3 Diagaram yang menggambarkan komposisi dari partikel Emas (Weiser
1933 dalam Hayat 1989)
Salah satu sifat unik dari koloid emas adalah bahwa partikel emas dengan berbagai dimensi (2-150 nm diameter) dapat dipreparasi dengan mudah untuk beberapa label. Pelabelan ini memungkinkan visualisasi simultan lebih dari satu
makromolekul pada bagian yang sama. Undecagold Cluster dengan inti atom emas
dari diameter 0,82 nm dapat disintesis untuk pelabelan antibodi. beragamnya Keberagaman ukuran ini memungkinkan untuk kedua studi resolusi rendah dan tinggi (Hayat 1989).
38
Rute sitrat dikenal sebagai metode Turkevich (1951) adalah metode untuk mensintesis partikel emas dengan hasil diameter partikel rata-rata 15 nm. Dalam pendekatan ini, reduktor yang digunakan adalah natrium sitrat dan atau agen pereduksi lainnya seperti asam amino yang telah digunakan dengan sukses. Reduktan ini juga berperan sebagai agen stabilisasi, yaitu mengurangi ion Au3+ untuk membentuk agregasi lagi pada sintesis partikel emas pada suhu tinggi. Partikel emas yang dihasilkan melalui metode ini sebagian besar monodisperse dan berbentuk bulat dengan diameter sekitar 10-20 nm (Vatjai 2013). Modifikasi variasi ukuran partikel emas dapat dilakukan dengan mengatur rasio trisodium sitrat dengan emas (Frens 1973). Pengurangan jumlah sodium sitrat dapat meningkatkan ukuran partikel emas yang dihasilkan. Hasil sintesis partikel emas dengan metode ini bila diamati dengan mikroskop elektron transmisi (TEM) terlihat seperti Gambar 3 (Vatjai 2013).
Gambar 4 Gambar TEM dari Partikel Emas Yang Dibuat Dengan Metode Reduksi Sitrat Dengan Diameter Partikel Rata-Rata 15 Nm.
Keterangan : (A) Gambar pembesaran rendah dan (b) perbesaran yang lebih tinggi, kisi diselesaikan (Vatjai 2013).
Antibodi
Salah satu fungsi utama dari sistem kekebalan tubuh adalah produksi protein larut yang beredar secara bebas yang berkontribusi secara khusus untuk kekebalan dan perlindungan terhadap benda asing. Protein yang larut tersebut adalah antibodi, yang termasuk ke dalam kelas protein yang disebut globulin karena struktur protein tersebut berbentuk globular (Coico dan Sunshine 2015).
39
Gambar 5 Immunoglobulin G.
Keterangan : (A) Struktur Molekul IgG Manusia Rantai berat dengan warna ungu dan rantai ringan berarna coklat - Courtesy of Erica Ollmann Saphire (Delves et al. 2011), (B) Skema yang menggambarkan Molekul IgG memperlihatkan daerah lipatan immunoglobulin yang terbentuk dalam rantai ikatan disulfide (Coico dan Sunshine 2015).
Struktur dasar molekul immunoglobulin tunggal seperti pada Gambar 5B. Immunoglobulin terdiri dari empat rantai protein glycosylated yang ditahan bersama oleh ikatan disulfida dalam konformasi berbentuk Y. Dua dari rantai adalah massa molekul yang lebih tinggi (rantai berat, sekitar 50 kD) dan dua rantai yang ukurannya lebih kecil (rantai ringan, sekitar 25 kD). Dalam hal struktur dan urutan asam amino, dua rantai berat pada satu immunoglobulin adalah identik satu sama lain, hal yang sama juga terjadi pada dua rantai ringan. Ini berarti bahwa dua 'bagian' dari molekul pada dasarnya bayangan cermin satu sama lain (Day dan Schultz 2014).
3 METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan April 2015 sampai dengan Agustus 2016. Penelitian dilakukan di Laboratorium Mikrobiologi, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan IPB.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah isolat E. tarda, Media
40
Borat pH 7.4, Bufer Fosfat pH 7.4, Bovine Serum Albumin (BSA), Tween20, Sukrosa, Kasein, IgG domba anti Kelinci, Membran Nitroselulosa, Bantalan sampel, Bantalan konjugat, Bantalan penyerap, Kit PCR Kappa 2G fast. Sedangkan alat berupa Laminary flow cabinet, Stirrer, Sentrifus, Incubator, Refrigerator,
Shaker dan Thermo Cycler.
Metode Penelitian Preparasi antigen E. tarda
Isolat E. tarda yang digunakan dalam penelitian ini diperoleh dari Stasiun Karantina Ikan dan Pengendalian Mutu Keamanan Hasil Perikanan Kelas I Pontianak. Kemudian dilakukan uji ulang secara biokimiawi menggunakan kit API20E v4.1 untuk memastikan bahwa isolat tersebut adalah E. tarda.
Isolat E. tarda yang telah diuji ulang, dilakukan kultur masal pada media
Triptic Soy Agar (TSA) dan diinkubasi pada temperature 28-30°C selama 18-24 jam (Buller, 2014). Kemudian dilakukan pemanenan dengan cara menambahkan larutan salin steril pada cawan petri yang berisi biakan E. tarda. Suspensi bakteri hasil pemanenan kemudian dilakukan pencucian sebanyak 3x dengan Phosphate Buffer Saline (PBS) dan dilanjutkan pada prosedur penyiapan untuk antigen.
Antigen yang digunakan adalah Antigen Somatic (O) dari E. tarda yang dipersiapkan melalui pemanasan dalam penangas selama 2.5 jam. Kemudian disentrifugasi 1 400 g pada suhu 5°C selama 30 menit. Hasil sentrifugasi diambil peletnya dan ditambahkan 0.3% salin formalin (Justine et al. 1977).
Produksi Antibodi
Sebanyak 0.5 ml Antigen E.tarda 109 sel/ml dalam larutan fisiologis disuntikkan ke kelinci New Zealand White berat ± 2kg melalui vena auricularis. Penyuntikan diulang pada awal minggu ke 2, 3 dan 4 untuk meningkatkan respon antibodi. Pada mingu ke 4 dilakukan pengukuran titer antibodi seperti yang dilakukan Biller-Takahashi et al. (2014). Antibodi diencerkan setengah secara berseri kemudian dititrasi dengan suspensi E. tarda aktif (1 × 109 CFU/ml) dan diinkubasi pada suhu kamar untuk proses aglutinasi selama 16-18 jam. Titik aglutinasi akhir ditetapkan sebagai pengenceran serum terakhir di mana aglutinasi terlihat. Titer aglutinasi antibodi dinyatakan dari kebalikan dilusi serum tertinggi yang menunjukkan aglutinasi.
Purifikasi IgG anti-E.tarda
41
Konsentrasi IgG hasil purifikasi diukur menggunakan Nanodrop™ ND2000
dengan panjang gelombang 280 nm. Extinction coefficient yang digunakan yaitu 1.4 untuk 1mg/ml IgG (Mandy dan Nisonoff 1963 dalam Howard dan Kaser 2013) kemudian dihitung dengan persamaan Beer-Lambert.
A=
ɛ
.b.c
Imunoglobulin G poliklonal anti-E.tarda dikonjugasikan dengan partikel emas sesuai dengan metode Liu et al.(2013) dengan sedikit modifikasi. Koloid emas 1 ml disesuaikan pHnya menjadi 8.0 menggunakan 0.1 M K2CO3 dan kemudian dicampur 26 µg IgG poliklonal. Setelah diinkubasi 1 jam pada suhu ruang dengan adukan pelan, ditambahkan 200 µl 1% BSA dan diinkubasi selama 30 menit. Kemudian disentrifugasi 14 000 rpm selama 30 menit pad 4ºC (Liu et al. 2013) dan dicuci 2 kali menggunakan 2 mM Buffer borate (pH 7.4). Kemudian disimpan dalam 10% volume awal dengan buffer penyimpan Phosphate Buffer pH 7.4 (5% Sukrosa, 1% BSA dan 0.5% Tween 20)(Kolosova et al. 2007).
Kontruksi Kit Immunokromatrografi
Membran nitroselulosa dipotong dengan ukuran 25mm x 3mm. IgG kelinci anti-E.tarda sebanyak 0.5 µl (10µg/ml) diteteskan pada garis test (Test line), dan 0.5 µl (10mg/ml) IgG domba-anti IgG Kelinci diteteskan pada garis kontrol (Control line). Kemudian membran dikeringkan pada suhu 37°C selama 30 menit dan direndam dalam 10 mM Buffer Fosfat (pH 7.4) yang mengandung 2% Casein selama 30 menit dan dicuci 2 kali menggunakan buffer tersebut. Kemudian membran dikeringkan 37°C selama 30 menit (Kolosova et al. 2007).
Bantalan Konjugat (Conjugate pad) ukuran 10 mm x 3 mm) ditetesi dengan konjugat antibodi-partikel emas sebanyak 15µl. Bantalan Sampel (Sample pad) ukuran 15mm x 3mm dan Bantalan Penyerap (Absorbant Pad) ukuran 15mm x 3mm ditempel pada papan penunjang secara menindih 1-2 mm. Kemudian kit Imunokromatografi disimpan dalam kantong plastik dengan desicant pada suhu 4°C hingga akan dipergunakan (Zhang et al. 2006).
Pengujian menggunakan Kit Imunokromatografi
42
Sequencing Kit. Hasil Sekuensing yang telah di-BLAST dengan database yang ada di NCBI digunakan untuk identifikasi isolat-isolat tersebut.
Persiapan Sampel dilakukan dengan cara mendididihkan selama 30 menit untuk mendapatkan antigen terlarut. Kemudian sampel diuji dengan Kit Imunokromatografi untuk menguji reaksi silang dari kit tersebut.
Analisa Data
Seluruh data yang diperoleh dari penelitian ini dianalisa secara deskriptif.
4 HASIL DAN PEMBAHASAN
Identifikasi dan Produksi Antigen
Pada penelitian ini, isolat E. tarda yang digunakan adalah Isolat yang diperoleh dari Stasiun Karantina Ikan dan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Pontianak. Isolat tersebut dikultur pada media Tryptic Soy Agar
(TSA) dan Blood Agar (BA) serta diidentifikasi ulang. Hasil pengamatan morfologi koloni dan uji biokimiawi diperoleh bahwa isolat tersebut benar E. tarda
(Gambar 6 dan 7)
Gambar 6 Isolat E. tarda dan Uji Biokimiawi.
Keterangan :(A) Media Tryptic Soy Agar (TSA); (B) Media Blood Agar (BA); (C) Media OF, bersifat oksidatif fermentatif; (D) H2S pada media Triple Sugar Iron Agar dan (E) Katalase positif.
Hasil pengamatan morfologi koloni pada media TSA terlihat koloni halus kecil/halus berukuran sekitar 0,5-1 mm berwarna putih keabua-abuan (Gambar 6a). sedangkan pada media BA terlihat koloni berwarna putih dengan hemolisis terjadi
43
dibawah koloni. Hal ini sesuai dengan yang diungkapkan oleh Buller (2014) bahwa koloni E tarda pada media TSA berukuran 0,5-1 mm, berwarna putih keabu-abuan, transparan, bundar, entire, cembung, berkilau dan basah (Gambar 6A). Sedangkan pada media BloodAgar (Gambar 6B), koloni berwarna putih, naik keatas, berkilau dan bundar (Hoshina 1962 dalam Buller 2014).
Hasil uji beberapa parameter bikomiawi terlihat bahwa isolat bersifat fakultatif aerob yaitu terlihat mampu men-fermentasi glukosa dalam kondisi beroksigen maupun tidak beroksigen (Gambar 6C), pada media TSI terbentuk H2S berupa warna hitam pada goresan isolat (Gambar 6D), serta adanya aktifitas enzim katalase yaitu terbentuk oksigen berupa gelembung dari H2O2 (Gambar 6E). Hal ini sesuai dengan yang diungkapkan oleh Barrow dan Feltham (1993) dan Buller (2014), bahwa E. tarda bersifat fakultatif aerob, yaitu mampu menfermentasi glukosa pada media OF dalam kondisi aerob (tanpa parafin) maupun anaerob (dengan parafin). Kemampuan menfermentasi ditunjukkan dengan berubahnya warna media menjadi kuning akibat dari produksi asam pada proses fermentasi.
Selainitu E tarda juga menghasilkan Hydrogen Sulfide (H2S) (Buller 2014). Menurut Barrow dan Feltham (1993) E tarda juga memproduksi H2S seperti bakteri lain dalam genus E. yang membedakannya dari bakteri Eschericia coli. Produksi H2S ditandai dengan muculnya warna hitam pada media TSI yang merupakan hasil metabolisme dari ferrous sulfate. E tarda juga mempunyai enzym katalase (Barrow dan Feltham 1993) yang ditunjukkan dengan kemampuan memecah molekul peroksida (H2O2 ) menjadi molekul air dan oksigen(O2).
Selanjutnya isolat E tarda diidentifikasi dengan kit API20E v4.1 seperti terpapar pada Gambar 7 dan Tabel 1.
44
Tabel 1 Hasil dan Interpretasi Hasil Pengujian API20 E V.4.1
No Uji Interpretasi Hasil Hasil Profil
Negatif Positif 5 Citrate Hijau muda/kuning Biru-hijau/biru +
6 H2S Tidak berwarna/ abu-abu Deposit hitam/garis tipis +
7 Urea Kuning Merah/Orange -
4
8 TDA Kuning Coklat merah -
9 Indole Tidak berwarna/ hijau muda/kuning
Merah muda +
10 VP Tidak berwarna Merah muda/merah -
4 11 Gelatin Tidak diffusi Diffusi pigment hitam -
12 Glucose Biru/hijau Kuning/kuning abu +
13 Mannitol Biru/Hijau Kuning - diinterpretasi sesuai petunjuk Kit API20E (Tabel 1). Hasil interpretasi kemudian dicocokkan dengan database APIWeb dan diperoleh nomor profil 6744000 (Kolom terakhir Tabel 1). Nomor profil tersebut dengan taxa E. tarda mempunyai Identic Persentase sebesar 99.4%. Mengacu pada tipikal koloni pada media TSA dan BA, uji oksidatif fermentatif, uji H2S pada media TSI, uji Katalase serta pengujian API20E, maka isolat tersebut diyakini merupakan isolat E. tarda.
Bakteri E. tarda yang telah diidentifikasi selanjutnya dipersiapkan untuk preparasi antigen. Antigen yang dipersiapkan adalah antigen somatik O yang mempunyai sifat tahan panas, asam dan alkohol. Antigen ini merupakan salah satu komponen dari lipopolysakarida (LPS) pada bakteri gram negatif. Unit gula yang diulang pada rantai polisakarida outer (O) diduga paling bertanggungjawab pada spesifitas antigen O. Strain salmonella yang sekuens ulangan unit gula O nya tidak lengkap, diketahui sebagai strain kasar karena berbentuk kasar pada koloni. Strain ini kurang virulen atau tidak virulen dibanding dengan strain halus yang sekuen unit gula O nya lengkap (Parija 2014).
Produksi Poliklonal Antibodi
45
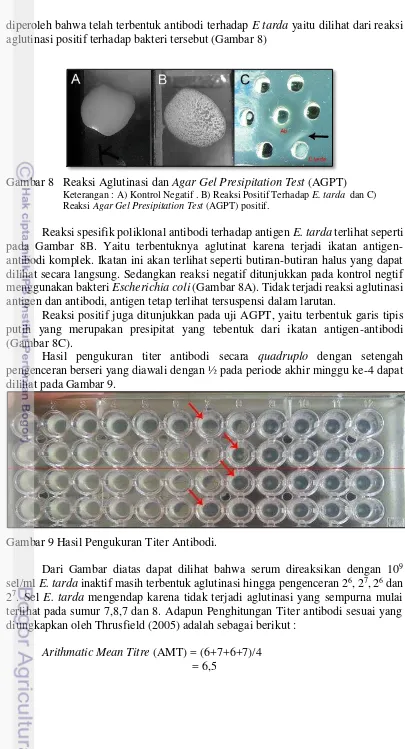
diperoleh bahwa telah terbentuk antibodi terhadap E tarda yaitu dilihat dari reaksi aglutinasi positif terhadap bakteri tersebut (Gambar 8)
Gambar 8 Reaksi Aglutinasi dan Agar Gel Presipitation Test (AGPT)
Keterangan : A) Kontrol Negatif . B) Reaksi Positif Terhadap E. tarda dan C) Reaksi Agar Gel PresipitationTest (AGPT) positif.
Reaksi spesifik poliklonal antibodi terhadap antigen E. tarda terlihat seperti pada Gambar 8B. Yaitu terbentuknya aglutinat karena terjadi ikatan antigen-antibodi komplek. Ikatan ini akan terlihat seperti butiran-butiran halus yang dapat dilihat secara langsung. Sedangkan reaksi negatif ditunjukkan pada kontrol negtif menggunakan bakteri Escherichia coli (Gambar 8A). Tidak terjadi reaksi aglutinasi antigen dan antibodi, antigen tetap terlihat tersuspensi dalam larutan.
Reaksi positif juga ditunjukkan pada uji AGPT, yaitu terbentuk garis tipis putih yang merupakan presipitat yang tebentuk dari ikatan antigen-antibodi (Gambar 8C).
Hasil pengukuran titer antibodi secara quadruplo dengan setengah pengenceran berseri yang diawali dengan ½ pada periode akhir minggu ke-4 dapat dilihat pada Gambar 9.
Gambar 9 Hasil Pengukuran Titer Antibodi.
Dari Gambar diatas dapat dilihat bahwa serum direaksikan dengan 109 sel/ml E. tarda inaktif masih terbentuk aglutinasi hingga pengenceran 26, 27,26 dan 27. Sel E. tarda mengendap karena tidak terjadi aglutinasi yang sempurna mulai terlihat pada sumur 7,8,7 dan 8. Adapun Penghitungan Titer antibodi sesuai yang diungkapkan oleh Thrusfield (2005) adalah sebagai berikut :
Arithmatic Mean Titre (AMT) = (6+7+6+7)/4
46
Ikatan spesifik antibodi terjadi pada Satu sisi Fragment Antigen Binding
(Fab) terhadap satu jenis epitope pada antigen multivalen, sedangkan Fab yang lain berikatan dengan epitope yang lain pada antigen sehingga akan terbentuk ikatan antibodi-antigen yang komplek (Coico dan Sunshine 2015). Ikatan komplek antara banyak molekul antibodi dengan banyak molekul antigen inilah yang menyebabkan ukuran molekulnya menjadi semakin besar sehingga jika dilihat kasat mata akan seperti butiran butiran halus.
Fitur penting dari antibodi (IgG) ini adalah aktifitas biologi dan spesifitas. Spesifitas ini dikaitkan dengan daerah yang mempunyai kecocokan tinggi atau
complementarity- determining region (CDR)(Coico dan Sunshine 2015). Interaksi Antigen-antibodi melibatkan kesesuaian epitop antigen dengan N-terminal variable pada daerah Fab pada molekul antibodi. Beberapa epitope antigen mempunyai kecocokan sempurna dengan daerah perlekatan antigen pada antibodi sehingga
berinteraksi seperti ‘gembok dan anak kunci’ untuk menghasilkan ikatan affinitas
tinggi (Day dan Schultz 2014). Alasan Spesifitas inilah sehingga antibodi dimanfaatkan dalam immunoassay.
Lebih lanjut dijelaskan bahwa Poliklonal antibodi (Immunoglobulin Gamma/IgG) merupakan komponen penting dari respon kekebalan spesifik (Adaptive/Acquired Immunity). Kekebalan ini dimulai dengan paparan antigen ke dalam tubuh. Antigen dapat berupa protein, karbohidrat, lemak, asam nukleat, kelompok kimia kecil seperti hapten atau apa saja. Antigen juga bisa berupa komponen mikroorganisme (Delves et al. 2011).
Antigen tersebut akan ditangkap oleh sel dendrit dan dibawa ke jaringan lymphoid setempat (Lymph node). Sel dendrit berfungsi sebagai Antigen Presenting Cell (APC) yang telah memecah molekul-molekul antigen dan dipresentasikan pada permukaan sel APC. T Cell Receptor (TCR) pada permukaan sel T penolong (T helper cell) akan mengenali molekul-molekul tersebut dengan bantuan CD4+ (pada sisi sel T) dan Major Histocompatibility Complex (MHC) II (pada sisi sel dendrit/APC). Sel T penolong (CD4+ Tcells) tipe 2 akan mensintesis sitokin
(interleukin (IL)-4, IL-5, IL-9 dan IL-13) untuk membantu Sel B berdifferensiasi menjadi sel plasma yang mampu mensekresi antibodi pada sistem kekebalan humoral (Day dan Schultz 2014). Pada saat yang sama, sel B juga berdifferensiasi menjadi sel B memori sehingga sistem kekebalan humoral mempunyai kemampuan untuk mengenang.
Sel plasma merupakan penghasil antibodi diantaranya adalah Immunoglobulin Gamma (IgG) disamping subklas immunoglobulin rantai berat lain (alpha, beta, delta, epsilon dan mu) dan subklas immunoglobulin rantai ringan (kappa dan lambda) (Day dan Schultz 2014).
47
komplemen dan sel-sel darah itu sendiri. Pemisahan dari sel-sel darah dilakukan dengan membiarkan darah membeku (clotting) dan diambil cairan beningnya. Sedangkan pemisahan dari protein-protein lain dan komponen sistem pertahanan yang lain dilakukan dengan purifikasi IgG.
Purifikasi IgG dalam penelitian ini dilakukan dalam dua tahap, yaitu presipitasi Amonium Sulfat (saturasi 50%) dan Melon Gel IgG purification kit. Presipitasi amonium sulfat adalah metode purifikasi IgG yang murah dan sangat populer. Larutan Amonium sulfat yang merupakan garam dengan muatan ion tinggi ditambahkan untuk mempresipitasi antibodi. Kemudian presipitat dipisahkan dari protein yang tidak terpresipitasi dengan cara disentrifugasi, pelet yang terbentuk disuspensikan sehingga diperoleh larutan kaya antibodi (Howard dan Kaser 2013). Hasil uji Sodium Dodecyl Sulfate (SDS) PolyaAcrylamide Gel electrophoresis (PAGE) terhadap Whole serum, Supernatan pada presipitasi ammonium sulfate, Serum hasil purifikasi dan antibodi komersial terpapar pada Gambar 10.
Gambar 10 Hasil Elektroforesis SDS PAGE serum.
Keterangan : Marker Protein (M), Whole Serum(1), Supernatan Presipitasi Ammonium Sulfat (2), Purifikasi dengan Presipitasi Ammonium Sulfat + filtrasi Melon Gel (3) dan Immunoglobulin G Komersial (4).
Hasil SDS PAGE terhadap sampel IgG memperlihatkan adanya dua pita besar yaitu rantai ringan (±23.7 kDa) dan pita rantai berat (±49.7 kDa)(Gambar 10 lajur 3). Menurut Day dan Schultz, Immunoglobulin terdiri dari empat rantai protein glycosylated yang ditahan bersama oleh ikatan disulfida dalam konformasi berbentuk Y. Dua dari rantai adalah massa molekul yang lebih tinggi (rantai berat, sekitar 50 kD) dan dua rantai yang ukurannya lebih kecil (rantai ringan, sekitar 25 kD). Dalam hal struktur dan urutan asam amino, dua rantai berat pada satu immunoglobulin adalah identik satu sama lain, hal yang sama juga terjadi pada dua rantai ringan. Ini berarti bahwa dua 'bagian' dari molekul pada dasarnya bayangan
cermin satu sama lain (Day dan Schultz 2014). Dua Rantai dengan berat molekul
48
Pada Gambar 10 lajur 1 (whole serum) dan lajur 2 (supernatan presipitasi) terlihat terdapat protein molekul besar (diatas 50kDa) yang terbuang. Hal ini menunjukkan bahwa purifikasi yang dilakukan mampu menghilangkan protein selain Immunoglobulin G.
Prinsip dari purifikasi menggunakan presipitasi amonium sulfat adalah, bahwa permukaan protein cenderung memiliki patch hidrofobik yang dikelilingi oleh molekul air ketika dalam kondisi terlarut (Cutler 2004). Protein (IgG) akan membentuk ikatan hydrogen dengan molekul air, melalui kelompok kutub ion yang terekspos. Ketika garam ditambahkan ke dalam larutan protein, molekul air diambil untuk melarutkan ion dari garam yang ditambahkan (Cutler 2004). Kondisi ini akan menghilangkan molekul air dari protein sehingga semakin membuka daerah hidrofobik dari permukaan protein. Di beberapa titik, patch ini akan mulai berinteraksi, menyebabkan agregasi (Cutler 2004) dan kelarutan protein berkurang sehingga menyebabkan presipitasi.
Meskipun Protein secara umum akan mengendap pada konsentrasi garam tinggi, namun ada pengecualian untuk protein tipe globulin. Globulin gamma adalah tipe protein yang tidak larut pada konsentrasi garam rendah yaitu sekitar 1.5 M amonium sulfat, sedangkan globulin alpha dan beta akan mengendap pada konsentrasi 2.5-3.0 M (Scopes 1998). Dengan kata lain, penggunaan konsentrasi amonium sulfate yang tepat akan mengendapkan globulin gamma sedangkan protein-proein lain masih tetap terlarut.
Sedangkan filtrasi dengan Melon Gel pada prinsipnya adalah, menyaring protein-protein lain selain IgG dengan gel. Protein tersebut akan tetap tinggal dengan gel melalui affinitas protein tersebut, sedangkan IgG akan terelusi kebawah sehingga diperoleh IgG yang lebih murni.
Konsentrasi IgG dari hasil proses purifikasi diukur menggunakan Spektrofotometer Nanodrop™ ND2000 pada 280nm. Extinction coefficient yang digunakan yaitu 1.4 untuk 1mg/ml IgG (Mandy dan Nisonoff 1963 dalam Howard dan Kaser 2013). Hasil Pengukuran Konsentrasi IgG tersaji pada Gambar 11.
Gambar 11 Hasil Pengukuran Absorbansi Serum dengan Nanodrop™ ND2000.
23,53
220 230 240 250 260 270 280 290 300 310 320
49
Penghitungan konsentrasi IgG terhadap serum yang telah dipurifikasi menggunakan persamaan Beer-Lambert yaitu sebagai berikut :
A =
ɛ
.b.c
C =
�. �
�
= , . ,
= 16,8 mg/ml
Hasil penghitungan konsentrasi IgG ini yang digunakan dan kemudian disesuaikan untuk tahapan selanjutnya.
Konjugasi Antibodi dengan Partikel Emas
Pembacaan hasil kit imunokromatografi tidak memerlukan alat khusus. Hal ini karena ikatan komplek antigen-antibodi yang terbentuk dalam pengujian telah diberi label sehingga bisa terlihat secara kasat mata. Bahan/label yang sering digunakan dalam imunokromatografi adalah partikel emas (merah) dan lateks (biru). Namun yang lebih populer adalah partikel emas. Menurut Chiao et al.
(2004), partikel emas mempunyai mobilitas yang lebih baik pada membran nitrosellulossa dibandingkan lateks, tidak mudah mengendap sebelum kit dipakai dan mudahnya menambahkan prosedur untuk meningkatkan sensitifitas uji. Sedangkan dilihat dari efek pada protein yang dilabel, penggunaan partikel emas pada ligan tidak menyebabkan perubahan struktur kimia ligan tersebut (Horisberger 1979 dalam Hayat 1989), sehingga antibodi tidak kehilangan kemampuan untuk mengikat antigen. Selain itu partikel emas tidak mudah luntur pada membran setelah pengujian serta sangat mudah dan murah pembuatannya (Chun 2009).
Dalam penelitian ini, koloid emas yang digunakan adalah koloid emas reduksi kimia menggunakan sodium sitrat dengan ukuran partikel sebesar 15-20 nm. Menurut Gui et al. (2008), patikel emas ukuran >75nm bersifat kurang stabil, terjadi agregasi setelah disimpan selama seminggu, sedangkan ukuran <15nm mempunyai warna yang kurang tajam. Hal ini seperti yang diungkapkan oleh Li et al. (2011), bahwa ukuran partikel emas yang dihasilkan dari reduksi sodium sitrat mempunyai sebaran warna dari yang ukuran besar ke kecil adalah, ungu, merah gelap, merah terang dan merah muda-merah.
Uji pendahuluan dalam penentuan nilai pH yang optimal sangat diperlukan dalam proses konjugasi. Hal ini dikarenakan pH optimal sangat berpengaruh pada adsorbsi antibodi pada permukaan partikel emas yang terjadi karena muatan ion pada msing-masing permukaan. Uji Optimasi pH dilakukan seperti yang diungkapkan oleh Wang et al. (2012). Koloid emas diatur pH nya menggunakan 0.02 M K2CO3 secara berseri dari pH 6.0 -9.0 dengan skala 0.5 masing-masing sebanyak 200µl. Kemudian masing-masing ditambahkan antibodi 0.1mg/ml sebanyak 20µl dan digoyang-goyang selama 15 menit. Kemudian ditambahkan NaCl 10% (w/v) sebanyak 20µl dan diukur absorbansi maksimum pada 520nm.
A = Nilai Absorbansi
ɛ = Extinction Coefficient b = Panjang path (cm)
50
Hasil pH yang optimum dalam konjugasi pAb anti-Et yang diperoleh adalah pada pH 8.0 (Gambar 12).
Gambar 12 Nilai Absorbansi Koloid Emas Pasca Konjugasi dengan Antibodi pada berbagai tingkatan Keasaman
Hasil uji optimasi pH menunjukkan bahwa pada pH 8.0 diperoleh hasil yang paling optimal (Gambar 12). Hal ini ditunjukkan dengan nilai absorbansi tertinggi pada panjang gelombang 520nm (0.066) dibandingkan dengan pH lain. Kondisi pH yang optimum akan menghasilkan stabilitas partikel emas setelah konjugasi. Partikel emas yang tidak optimal berikatan dengan antibodi, ketika ditambahkan NaCl 10% akan berubah menjadi keunguan sehingga nilai absorbansi pada 520nm akan lebih rendah.
Partikel emas yang disintesa dari reduksi sitrat akan menghasilkan partikel emas yang mempunyai ion sitrat bermuatan negatif yang teradsorbsi pada permukaan dan akan stabil karena daya tolak elektrostatik (Sperling dan Parak 2010). Penambahan protein pada larutan partikel emas akan menyebabkan protein teradsorbsi secara spontan pada permukaan partikel melalui interaksi elektrostatik dan van deer waals (Hermanson 2013). Muatan ion pada masing-masing permukaan protein dan partikel emas akan berikatan secara kuat. Kondisi pH optimal dari masing-masing protein (immunogobulin) akan berbeda satu dengan lain tergantung dari nilai isoelectric point. Mengatur pH koloid emas sedikit di atas nilai isoelectric point dari protein tersebut akan berpengaruh pada keberhasilan konjugasi (Hermanson 2013). Dalam penelitian ini konjugasi optimal terjadi pada pH 8.0 dengan menunjukkan nilai tertinggi pada absorbansi 520nm.
51
tabung #10 dibiarkan tanpa pAb anti-ET. Kemudian masing-masing tabung ditambahkan Koloid Emas pH 8.0 sebanyak 200µl dan dibiarkan selama 15 menit. Kemudian ditambahkan NaCl 10% masing-masing sebanyak 40µl dan diamati perubahan warna. Perubahan warna dari merah muda ke ungu menunjukkan koloid emas belum stabil dengan konsentrasi antibodi yang ditambahkan.
Tabel 2 Perubahan Warna pada Titrasi Konsentrasi Antibodi Untuk Menstabilkan Koloid Emas
Tabel 3 Konsentrasi Antibodi Yang Ditambahkan Untuk Menstabilkan 1ml Koloid Emas.
Keterangan : *) titik akhir stabilitas koloid emas.
Konsentrasi antibodi yang optimum untuk menstabilkan koloid emas dinyatakan sebagai titik terakhir yang tidak terjadi perubahan warna ke ungu (Tabel 3). Titik akhir diperoleh pada pengenceran ke-5 yaitu diperlukan 6,25 µg untuk menstabilkan 1 ml koloid emas. Wang et al. (2013) menyatakan bahwa jumlah antibodi minimum dikalikan 120% untuk memperoleh konsentrasi optimum konjugasi. Sedangkan Widiyanti et al. (2013) menggunakan empat kali konsentrasi minimum untuk konjugasi. Dalam penelitian ini penggunaan antibodi empat kali konsentrasi minimum menunjukkan hasil yang lebih baik.
52
partikel yang tidak terlapisi dengan IgG akan menyebabkan partikel emas menyerap protein lain yang mengarah pada false positive jika partikel emas melapisi antibodi penangkap pada garis uji. Sedangkan kelebihan IgG akan meyebabkan penurunan sensitifitas karena reaksi antigen-antibodi yang tidak terlabel tidak akan terdeteksi sehingga menyebabkan false negative.
Selain penentuan konsentrasi antibodi yang optimum dalam proses konjugasi antibodi-partikel emas, blocking permukaan partikel emas dengan protein lain yang tidak terkait juga sangat berperan. Blocking pada konjugat dimaksudkan untuk menstabilkan permukaan partikel emas yang tidak terlapis secara sempurna pada proses konjugasi. Permukaan partikel emas yang tidak terlapis sempurna akan memudahkan protein lain untuk menempel sehingga akan mempegaruhi hasil pengujian.
Beberapa penelitian menggunakan blocking antara lain : 1% (b/v) BSA (Shim et al. 2007), 0.1% (b/v) BSA (Wang et al. 2013), 0.1% (b/v)susu skim (Widiyanti et al. 2013). Dalam penelitian ini digunakan 1% (b/v) BSA dan menunjukkan hasil permukaan parikel emas dapat terlapis dengan sempurna yaitu dengan berkurangnya warna merah pada bebarapa tempat yang dilalui konjugat.
Setelah penambahan konjugat pada bantalan konjugat, bantalan akan dilakukan pengeringan untuk memastikan konjugat tidak berpindah dari bantalan sebelum digunakan. Namun konjugat yang kering biasanya akan susah bereaksi kembali serta tidak bisa bergerak ketika sampel ditambahkan. Oleh karena itu diperlukan bahan yang memudahkan pelarutan kembali. Bahan yang biasa digunakan antara lain sukrosa (Shim et al. 2007; Widiyanti et al. 2013; Kolosova
et al. 2007). Sukrosa dan partikel emas kering yang menempel pada permukaan akan membentuk hydrated glaze yang mudah dan cepat terlarut kembali apabila ditambahkan sampel cair.Selain itu sukrosa juga mencegah konjugat melekat pada membran (Chiao et al. 2004).
Selain sukrosa sebagai agen pelarutan kembali, kombinasi penggunaan dengan surfaktan seperti non-ionic detergen (Tween 20, Triton X, dsb) baik sebagai pelarut konjugat maupun pretreatment juga banyak dilakukan. Beberapa penelitian menggunakan kombinasi surfaktan seperti : 0.1 % tetrionic 1307 (Wang et al.
2013), Tween 20 (Kolosova et al. 2007; Widiyanti et al. 2013). Surfaktan berfungsi dalam mengurangi ikatan hidrofobik dan mengurangi tegangan permukaan air (Howard dan Kaser 2013) sehingga mengurangi ikatan non spesifik dan memudahkan konjugat terlarut kembali. Dalam penelitian ini kombinasi sukrosa dan tween 20 digunakan dalam bufer pelarut konjugat sebagai agen pelarutan kembali.
Konstruksi Kit Imunokromatografi
53
sebagai tanda hasil uji positif. Tipe ini digunakan untuk menguji molekul kecil dengan determinan antigen tunggal yang tidak dapat mengikat dua antibodi secara bersamaan (Wild 2013).
Kit imunokromatografi ini dirancang dengan sistem sandwich yang memanfaatkan antibodi terlabel partikel emas yang menangkap antigen sebagai antibodi bergerak, antibodi anti-E. tarda sebagai antibodi penangkap pada garis uji serta antibodi kelinci anti IgG kelinci sebagai garis kontrol. Kit terdiri dari empat bagian; bantalan sampel, bantalan konjugat, bantalan penyerap dan membran nitroselulosa.
Membran nitroselulosa digunakan secara luas dalam immunoblotting karena dapat mengikat antibodi melalui mekanisme elektrostatik. Dwikutub nitrat ester pada nitroselulosa berinteraksi dengan dwikutub ikatan peptida pada antibodi secara kuat (Chiao et al. 2004). Sehingga protein yang sudah dilapiskan/ditempelkan pada membran tidak mudah terlepas dan akan meningkatkan konsistensi pengujian.
Setelah penambahan antibodi pada garis uji dan garis kontrol, dilakukan
blocking menggunakan protein lain yang tidak terkait. Blocking dimaksudkan untuk menghindari ikatan yang tidak diinginkan yang mempengaruhi pada hasil pengujian. Beberapa penelitian melaporkan tidak melakukan blocking (Shim et al.
2009 ; Wang et al. 2013) dan beberapa menggunakan blocking dengan bahan antara lain : 1% Susu Skim selama 15 menit (w/v) dalam penyangga fosfat (Widiyanti et al. 2013), 2% Casein (w/v) dalam penyangga fosfat salin selama 30 menit (Kolosova et al. 2007). Pada penelitian ini, penggunaan 2% casein (Kolosova et al.
2007) memberikan hasil yang lebih baik. Tanpa dilakukan blocking ataupun
blocking tidak maksimal, menyebabkan konjugat sedikit menempel pada membran nitroselulosa yang dilintasi sehingga mengganggu interpretasi hasil pengujian (hasil tidak ditampilkan). Kolosova et al. (2007) menyatakan bahwa jika tidak dilakukan
blocking pada membran akan mempercepat timbulnya warna merah hingga 1-3 menit tetapi sensitifitas dan interpretasi warna akan menurun.
Selain itu, penetapan kadar bahan blocking dan waktu perendaman yang sesuai menjadi faktor kunci dalam proses ini. Kadar bahan yang tinggi akan memastikan kecukupan bahan di satu sisi, tetapi akan meningkatkan kekentalan yang menyebabkan meningkatnya tegangan permukaan sehingga terjadi hambatan penetrasi pada pori membran nitroselulosa di sisi lain.
54
Uji coba Kit Imunokromatografi
Isolat Bakteri sebanyak 6 Isolat dilakukan identifikasi dengan dilakukan PCR gen 16s rRNA dengan primer 27f-1492r (Lane 1991) dan disekuensing menggunakan BigDye® Terminator V3.1 Sequencing Kit. Hasil Sekuensing yang
telah di-BLAST dengan database NCBI tersaji pada Tabel 4.
Tabel 4 Hasil BLAST Isolat Bakteri dengan Database NCBI
No Deskripsi Panjang
Hasil pengujian kit imunokromatografi terhadap isolat E. tarda dan 6 isolat lain : E. ictaluri, Plesiomonas shigelloides, Aeromonas hydrophilla, Pseudomonas stutzeri, Escherichia coli dan Salmonellaenterica tersaji pada Gambar 14.
Gambar 14 Hasil Uji Reaksi Silang Kit Imunokromatografi.
55
Reaksi positif terjadi setelah sebagian epitope pada antigen yang dimaksud berikatan dengan antibodi-partikel emas kemudian bergerak melalui membran nitroselulosa. Sisa epitope pada antigen dari molekul antigen-antibodi komplek tersebut akan tertangkap oleh antibodi anti-E.tarda pada daerah uji sehingga memunculkan warna merah pada daerah uji tersebut. Kemudian sisa antibodi-partikel emas yang tidak terikat pada daerah uji akan bergerak dan berikatan dengan antibodi anti-IgG kelinci sehingga muncul warna merah pada derah kontrol.
Reaksi pengujian dari mulai sampel diteteskan pada bantalan sampel, kemudian sampel bereaksi dengan konjugat dan bergerak menuju membran nitroselulosa hingga terbentuk garis uji dan garis kontrol membutuhkan waktu kurang dari 5 menit. Hal ini menyatakan bahwa kit ini bisa dijadikan alternatif uji yang cepat.
5 KESIMPULAN DAN SARAN
Kesimpulan
Kit imunokromatografi deteksi antigen E. tarda dapat menjadi alternatif pilihan pada uji penapisan awal. Kit tersebut mampu mendeteksi antigen E. tarda
dan tidak menunjukkan reaksi silang setidaknya dengan enam isolat bakteri lain.
Saran
56
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Demak Jawa Tengah pada tanggal 3 Juli 1979 sebagai anak ketujuh dari delapan bersaudara dari bapak Ahmad Mufid (alm) dan ibu Sri Muniroh (alm). Penulis menamatkan Sekolah Lanjutan Tingkat Atas (SLTA) di Madrasah Aliyah (MA) Futuhiyyah-2 Demak pada Tahun 1997. Pada tahun 2004 penulis berhasil menyelesaikan jenjang Srata Satu (S1) pada Program Studi Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan Universitas Diponegoro Semarang. Pada tahun 2013 penulis berkesempatan melanjutkan pendidikan Pascasarjana di Program Studi Mikrobiologi Medik Sekolah Pascasarjana Institut Pertanian Bogor, melalui beasiswa dari Badan Pengembangan Sumberdaya Manusia (BPSDM) Kementerian Kelautan dan Perikanan RI (KKP RI).