SELEKSI PRIMER RAPD-PCR UNTUK MENAMPILKAN
POLA PITA DNA MENIRAN (
Phyllanthus
sp.) DAN
KAPULAGA LOKAL (
Amomum cardamomum)
AZRA ZAHRAH NADHIRAH IKHWANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Seleksi Primer RAPD-PCR untuk Menampilkan Pola Pita DNA Meniran (Phyllanthus sp.) dan Kapulaga Lokal (Amomum cardamomum) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
Azra Zahrah Nadhirah Ikhwani
ABSTRAK
AZRA ZAHRAH NADHIRAH IKHWANI. Seleksi Primer RAPD-PCR untuk Menampilkan Pola Pita DNA Meniran (Phyllanthus sp.) dan Kapulaga Lokal
(Amomum cardamomum). Dibimbing oleh EDY DJAUHARI
PURWAKUSUMAH dan LAKSMI AMBARSARI.
Meniran (Phyllanthus sp.) dan kapulaga lokal (Amomum cardamomum) merupakan tanaman berkhasiat obat yang harus terus digali agar berpotensi dibudidayakan di Indonesia. Informasi genetik kedua tanaman ini dapat dikembangkan untuk mendapatkan bibit unggul sebagai obat. Tujuan penelitian adalah memperoleh beberapa primer acak dengan teknik RAPD-PCR yang mampu menghasilkan amplikon sehingga dapat menunjukkan pola pita pada beberapa contoh meniran dan kapulaga lokal. Optimasi RAPD-PCR telah dilakukan pada contoh kedua jenis meniran yang menunjukkan tidak adanya DNA yang teramplifikasi menggunakan primer universal OPE-19 dan OPH-5, sedangkan untuk contoh kapulaga lokal yang dioptimasi (kapulaga merah) menunjukkan adanya DNA yang teramplifikasi. Primer RAPD yang digunakan berjumlah 20 dari seri OPA-OPD 11-15. Hasil PCR yang dielektroforesis dengan gel agarosa 1.5% pada kapulaga lokal berhasil mengamplifikasi DNA oleh 15 primer dengan pola pita berbeda pada setiap primer di antara dua contoh.
Kata kunci: kapulaga lokal, meniran, RAPD-PCR
ABSTRACT
AZRA ZAHRAH NADHIRAH IKHWANI. RAPD-PCR Primer Selection for Displays Meniran (Phyllanthus sp.) and Local Cardamom (Amomum
cardamomum) Pattern of DNA Bands. Supervised by EDY DJAUHARI
PURWAKUSUMAH and LAKSMI AMBARSARI.
Phyllanthus sp. (meniran) and Amomum cardamomum (local cardamom) are widely used as herbal medicinal plant in Indonesia. Exploration of genetic information of these plants is needed for developing prime seeds for herbal medicinal plant. The objective of this research was selecting some RAPD random primers to generate amplicons that can show DNA bands pattern of some
meniran and local cardamom samples. Optimization of RAPD-PCR was performed on samples of meniran indicating the absence of DNA amplified using universal primers OPE-19 and OPH-5, while for the optimized sample cardamom (cardamom red) showed the amplified DNA. RAPD primer used about 20 of OPA-OPD series 11-15. Results showed that 15 primers were successful in amplifying the local cardamom DNA detected by agarose gel 1.5%.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
SELEKSI PRIMER RAPD-PCR UNTUK MENAMPILKAN
POLA PITA DNA MENIRAN (
Phyllanthus
sp.) DAN
KAPULAGA LOKAL (
Amomum cardamomum)
AZRA ZAHRAH NADHIRAH IKHWANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
DAFTAR ISI
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
PENDAHULUAN 1
METODE 2
Bahan 3
Alat 3
Prosedur Analisis Data 3
HASIL DAN PEMBAHASAN 5
Hasil 5
Pembahasan 10
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 17
LAMPIRAN 20
DAFTAR GAMBAR
1 Elektroforegram DNA meniran dan kapulaga lokal 6
2 Elektroforegram hasil optimasi RAPD-PCR 9
3 Elektroforegram hasil RAPD-PCR kapulaga lokal 11
DAFTAR TABEL
1 Data uji kuantitatif DNA hasil isolasi modifikasi metode Doyle dan Doyle
(1990) 7
2 Data uji kuantitatif DNA meniran hasil isolasi modifikasi metode Doyle
dan Doyle (1987) 8
3 Skoring kualitas DNA meniran dan kapulaga lokal 8
4 Hasil optimasi amplifikasi DNA 9
5 Seleksi primer 10
PENDAHULUAN
Indonesia merupakan negara dengan keberagaman hayati tertinggi kedua dengan sekitar 30000 jenis tumbuh-tumbuhan yang 7500 diantaranya berkhasiat obat (Depkes RI 2007). Bahan baku obat alami di Indonesia yang teregistrasi oleh Badan POM (2006) jumlahnya ada 283 dan hanya 103 yang merupakan hasil budidaya. Budidaya bahan baku obat alami menjadi penting dilakukan agar pasokan dapat terpenuhi tanpa merusak ekosistem alam yang dapat berdampak pada kelangkaan. Pembudidayaan tumbuhan berkhasiat obat dapat dioptimalkan dengan menanam kualitas bibit unggul yang diperoleh dengan melakukan analisis genetiknya. Hal ini mendorong mulai banyaknya penelitian genetik terhadap tumbuhan yang diyakini berkhasiat obat, seperti meniran (Phyllanthus sp.) dan kapulaga lokal (Amomum cardamomum).
Meniran (Phyllanthus sp.) tergolong dalam famili Euphorbiaceae.
Phyllanthus merupakan kelompok genus yang luas dengan sekitar 800 spesies tersebar di daerah tropis dan subtropis (Govaerts et al. 2000). Penyebarannya di seluruh Asia termasuk Indonesia dan dapat ditemukan di Benua Afrika, Amerika serta Australia (Taylor 2003). Tumbuhan ini hampir selalu dapat ditemukan di tempat yang hangat (Schmelzer and Gurib-Fakim 2008). Keberadaan tumbuhan ini di alam liar cukup melimpah, sehingga mudah didapatkan dan belum banyak yang membudidayakannya.
Meniran diketahui mengandung beberapa senyawa aktif yang berkhasiat obat, seperti alkaloid, flavonoid, dan lignan (filantin dan hipofilantin). Senyawa aktif alkaloid dan lignan yang terkandung dalam meniran dilaporkan berkhasiat sebagai antimikroba (Mangunwardoyo et al. 2009). Hasil penelitian farmakologi menunjukkan bahwa meniran mempunyai aktivitas hepato-protektif dan antioksidan (Manjrekar et al. 2008), imunomodulator (Ganju et al. 2003), serta antikanker (Jose et al. 2001).
Kapulaga terbagi dalam dua genus besar, yaitu Elettaria sp. dan Amomum
sp. Jenis kapulaga dari kedua genus tersebut sedang dikembangkan di Indonesia, yaitu kapulaga sabrang (Elettaria cardamomum) dan kapulaga lokal (Amomum cardamomum). Kapulaga sabrang berasal dari India dan tersebar di Sri Lanka, Malaysia serta Indonesia (Babu et al. 2012), sedangkan kapulaga lokal berasal dari Indonesia (endemik di pegunungan Jawa bagian barat) dan tersebar di Malaysia serta China bagian selatan (Lim 2013).
Kapulaga termasuk rempah-rempahan dari famili Zingiberaceae, sehingga buah atau bijinya sering dijadikan bumbu masak oleh masyarakat. Buah atau biji kapulaga juga dapat dimanfaatkan untuk obat. Masyarakat di Indonesia juga sudah lama menggunakan kapulaga sebagai obat yang dijadikan jamu bersama rempah-rempah lainnya, salah satunya adalah masyarakat di daerah Sumenep, Madura. Masyarakat tersebut menggunakan buah kapulaga lokal dan beberapa rempah lainnya sebagai jamu pakak, yaitu untuk memperkuat otot organ reproduksi internal (Mangestuti et al. 2007).
2
(Phyllanthus niruri L.) dan meniran merah (Phyllanthus urinaria L.) asal Kabupaten Bangkalan dan Gresik (Oktavidiati 2012), sedangkan penelitian keragaman genetik meniran (Phyllanthus sp.) dari daerah lain di Indonesia belum pernah diteliti. Adapun kapulaga lokal (Amomum cardamomum) asal Indonesia belum pernah diteliti mengenai informasi genetiknya, penelitian genetik kapulaga baru dilakukan pada kapulaga sabrang (Elettaria cardamomum) yang bukan berasal dari Indonesia.
Identifikasi tanaman ekonomis dan tanaman obat berdasarkan teknik biologi molekuler atau berbasis DNA mulai marak digunakan. Teknik ini berguna dan akurat untuk mengetahui variasi genetik pada tanaman. Teknik molekuler yang kini sering digunakan untuk menganalisis pola sidik jari tanaman untuk melihat keragaman genetiknya dalam bentuk pohon filogenetik adalah marka molekuler. Salah satu marka molekuler yang sering digunakan karena tekniknya relatif sederhana adalah Random Amplified Polymorphism DNA (RAPD) (Prana dan Hartati 2003).
RAPD merupakan salah satu marka DNA dengan menggunakan prinsip kerja mesin Polymerase Chain Reaction (PCR) yang mampu mengamplifikasi sekuen DNA tertentu secara in vitro. Teknik ini tergolong sederhana karena relatif mudah dalam preparasi, primer yang digunakan acak tanpa perlu informasi DNA gen atau genom awal, hasil didapat lebih cepat, dan karakter yang dihasilkan relatif tidak terbatas. Hal tersebut sangat membantu untuk keperluan analisis variabilitas genetik tanaman yang tidak diketahui latar belakang genomnya (Prana dan Hartati 2003). Namun, tidak semua primer RAPD dapat digunakan untuk menganalisis polimorfisme yang menunjukkan pola pita berbeda antar beberapa tanaman termasuk dalam satu spesies. Penentuan jenis primer RAPD-PCR ini menjadi perlu diteliti sebelumnya untuk analisis selanjutnya.
Penelitian ini bertujuan menentukan primer RAPD-PCR yang dapat digunakan untuk membedakan aksesi atau varietas meniran serta kapulaga lokal. Pemilihan primer dilakukan untuk dapat menampilkan pola pita DNA di antara contoh yang selanjutnya dapat diketahui informasi polimorfismenya. Primer RAPD terseleksi pada contoh tumbuhan obat ini diharapkan dapat digunakan secara rutin. Penggunaan rutin yang dimaksud adalah dalam teknik RAPD-PCR untuk analisis genetik yang dibutuhkan mengenai meniran (Phyllanthus sp.) dan kapulaga lokal (Amomum cardamomum), khususnya analisis keragaman genetik antar beberapa meniran juga kapulaga lokal dari berbagai daerah di Indonesia.
METODE
Waktu dan Tempat Penelitian
3 Bahan
Bahan atau contoh penelitian yang digunakan adalah tumbuhan meniran hijau (Phyllantus niruri L.) dan meniran merah (Phyllanthus urinaria L.) yang tumbuh liar di daerah Darmaga dan Bantarjati, Bogor. Contoh lainnya adalah tanaman kapulaga lokal merah dan kapulaga lokal putih (Amomum cardamomum) yang berasal dari Desa Pamijahan dan ditanam kembali di Kebun Cikabayan Biofarmaka IPB. Bahan yang digunakan untuk tahap isolasi DNA yaitu nitrogen cair, CTAB, NaCl, EDTA, Tris-HCl, β-merkaptoetanol, kloroform, isoamilalkohol, isopropanol, etanol 70%, etanol absolut, Molecular Water (MW), akuades steril, dan akuabides. Bahan yang digunakan untuk elektroforesis adalah agarosa, bufer TAE 0.5×, EtBr, loading dye 6×, marker1 kb plus DNAladder dan
marker 100 bp plus DNA ladder. Bahan untuk PCR adalah buffer complete 5×, dNTPs 10 mM, Taq DNA polimerase, dan primer OPA-OPD 11-15.
Alat
Peralatan yang digunakan adalah autoklaf, pH meter, waterbath, neraca analitik, hotplate, mikrosentrifus Mikro 200 R Hettich Zentrifugen, spektrofotometer NanoDrop™ 2000/2000c, spektrofotometer UV-Vis, seperangkat alat elektroforesis gel agarosa BioRad, PCR ESCO, dan dokumentasi gel AlphaImager® Mini. Peralatan lainnya adalah mortar, tube Eppendorf 2 mL dan 1.5 mL, tube dome PCR 0.2 mL, kertas saring, mikro pipet, tip mikro pipet, peralatan gelas, pipet volumetrik, termos es, dan cooler box.
Prosedur Analisis Data
Isolasi DNA Meniran dan Kapulaga Lokal (Modifikasi Doyle dan Doyle 1990)
Sebanyak 200 mg contoh berupa daun digerus bersama nitrogen cair hingga terbentuk serbuk yang kering. Serbuk dimasukkan ke dalam tube
Eppendorf 2 mL dan ditambahkan 0.75 mL bufer CTAB (4% b/v CTAB, 1.4 M NaCl, 50 mM EDTA, 100 mM Tris-HCl pH 8.0, 1% v/v β-merkaptoetanol, akuades steril). Tube yang telah berisi contoh dan bufer tersebut diinkubasi pada suhu 60 oC selama 1 jam. Selanjutnya ke dalam tube ditambahkan 0.75 mL kloroform isoamilalkohol (CIA) dengan perbandingan 24:1. Campuran tersebut disentrifus dengan kecepatan 10000 rpm, suhu 4 oC selama 20 menit. Supernatan yang didapatkan ditambah dengan CIA sebanyak 0.75 mL dan disentrifus kembali dengan kondisi sama. Supernatan dipindahkan ke dalam tube Eppendorf 1.5 mL, kemudian ditambah dengan 0.75 mL isopropanol (tube dibolak-balik agar tercampur baik) dan disentrifus pada kecepatan 10000 rpm, suhu 4 oC selama 10 menit. Pelet yang didapatkan dicuci dengan etanol 70%. Etanol 70% dibuang dan pelet dikeringkan yang selanjutnya disuspensikan dengan bufer TE (10 mM Tris-HCl pH 8.0 dan 0.1 mM EDTA). Contoh disimpan pada -20 oC sebagai stok DNA.
Isolasi DNA Meniran (Modifikasi Doyle dan Doyle 1987)
4
akuades steril) hingga terbentuk cairan merata. Hasil gerusan tersebut dimasukkan ke dalam tube Eppendorf 2 mL dan selanjutnya diinkubasi pada suhu 65 oC selama 30 menit. Selanjutnya ke dalam tube ditambahkan 700 µL CIA (24:1). Campuran tersebut disentrifus dengan kecepatan 11000 rpm, suhu 25 oC selama 5 menit. Supernatan yang didapatkan ditambah dengan CIA sebanyak 700 µL dan disentrifus kembali dengan kondisi sama. Supernatan dipindahkan ke dalam tube
Eppendorf 1.5 mL, kemudian ditambah dengan 700 µL etanol absolut (tube
dibolak-balik agar tercampur baik) dan disentrifus pada kecepatan 9500 rpm, suhu 4 oC selama 5 menit. Supernatan dibuang dan pelet dikeringkan yang selanjutnya disuspensikan dengan 50 µL akuabides. Contoh disimpan pada -20 oC sebagai stok DNA.
Uji Kualitatif Hasil Isolasi DNA
Gel agarosa 1.5% untuk elektroforesis dibuat dengan dilarutkannya agarosa 0.3 g dalam 20 mL larutan bufer TAE 0.5× pH 8.0, kemudian didihkankan hingga larut dan selanjutnya didinginkan pada suhu kamar. Larutan agarosa tersebut dituang ke dalam cetakan gel elektroforesis yang telah dipasangi sisir (cetakan sumur) hingga gel memadat. Gel yang sudah padat dipindahkan ke dalam tangki elektroforesis yang berisi bufer TAE 0.5× pH 8.0. Contoh yang akan dielektroforesis dicampur dengan loading dye dengan perbandingan 4:1 (10 µL contoh DNA dan 2.5 µL loading dye). Setelah tercampur, contoh diinjeksi ke dalam sumur gel agarosa. Marker yang digunakan adalah 1 kb plus DNA ladder
sebanyak 3 L yang dicampur dengan 1 L loading dye. Setelah semua contoh selesai diinjeksi, alat elektroforesis dihubungkan pada power supply yang dialiri tegangan listrik 100 volt selama 30 menit. Gel yang telah selesai dielektroforesis direndam dalam EtBr. Hasil elektroforesis diamati dengan dokumentasi gel oleh bantuan sinar UV dan bobot molekul dianalisis dengan program PhotoCaptMw. Uji Kuantitatif DNA
Pengujian dilakukan dengan metode spektrofotometri dengan alat nanodrop untuk hasil isolasi DNA metode Doyle dan Doyle (1990) dan spektrofotometer UV untuk hasil isolasi DNA metode Doyle dan Doyle (1987). Pembacaan blanko dilakukan terlebih dahulu sebelum contoh. Pengujian dengan nanodrop dilakukan dengan 1 µL suspensi DNA hasil isolasi diinjeksi ke dalam alat. Selanjutnya absorban pada panjang gelombang ( ) 260 nm, 280 nm, dan 230 nm akan dibaca langsung oleh nanodrop yang terhubung pada programnya di PC. Pengujian dengan spektrofotometer UV dilakukan dengan mengencerkan suspensi DNA hasil isolasi sebanyak 10 L menjadi 2000 L dengan ditambahkannya akuabides. Selanjutnya dibaca absorban pada panjang gelombang ( ) 260 nm, 280 nm, dan 230 nm. Pengukuran pada panjang gelombang 280 nm dilakukan untuk mengetahui adanya kontaminasi protein, sedangkan pada panjang gelombang 230 nm untuk mengetahui kontaminasi polisakarida dan fenol.
Optimasi RAPD-PCR DNA (Williams et al. 1990; Yu dan Paul 1994)
5 Program optimasi pertama yang digunakan pada PCR terdiri atas dua tahap (Williams et al. 1990). Tahap pertama berlangsung selama satu kali siklus dengan suhu 92 °C selama 2 menit untuk denaturasi awal, 92 °C selama 3 menit 30 detik untuk penyempurnaan proses denaturasi DNA, 35 °C selama 1 menit untuk penempelan primer, dan 72 oC selama 7 menit untuk tahapan perpanjangan rantai. Program suhu yang digunakan pada tahap berikutnya adalah 92 °C selama 1 menit untuk denaturasi DNA, 35 °C selama 1 menit untuk penempelan primer, 72 °C selama 2 menit untuk tahapan perpanjangan rantai hingga sebanyak 44 kali siklus, serta 72 °C selama 7 menit terakhir untuk memastikan DNA teramplifikasi sempurna. Optimasi ini menyertakan kontrol positif berupa contoh tomat.
Program optimasi kedua yang digunakan yaitu berdasarkan metode Yu dan Paul (1994). Program PCR ini diawali dengan denaturasi DNA pada suhu 94 oC selama 5 menit. Berikutnya, program PCR dilakukan sebanyak 45 siklus dengan denaturasi pada suhu yang masih sama selama 5 detik, kemudian penempelan primer pada suhu 35 oC selama 30 detik, dan perpanjangan rantai pada suhu 72 oC selama 60 detik.
Elektroforesis Hasil Amplifikasi
Elektroforesis hasil amplifikasi dilakukan menggunakan gel agarosa 1.5% dalam bufer TAE 0.5×. Sebelum dilakukan elektroforesis, hasil amplifikasi dicampurkan dengan loading dye terlebih dahulu dengan perbandingan 4:1 (2.5 µL loading dye). Contoh yang diinjeksi ke dalam sumur elektroforesis adalah 3
DNA genom meniran dan kapulaga lokal hasil isolasi dilihat kualitasnya dengan dua parameter, yaitu uji kualitatif DNA dengan menggunakan elektroforesis gel agarosa dan uji kuantitatif DNA dengan metode spektrofotometri. DNA yang terisolasi akan terlihat dari hasil elektroforesis gel agarosa berupa pita, sedangkan konsentrasi DNA dan kemurniannya dapat diketahui dengan pembacaan absorbansnya oleh spektrofotometer.
6
Seluruh contoh meniran dan kapulaga lokal dari isolasi DNA yang dilakukan menunjukkan adanya pita DNA pada gel agarosa. Ketiga contoh meniran hijau hasil isolasi DNA modifikasi metode Doyle dan Doyle (1990) terlihat memiliki intensitas pita yang lebih tinggi dibandingkan kedua contoh meniran merah. Contoh meniran hijau yang menunjukkan pita dengan intensitas tertinggi adalah contoh asal Darmaga ulangan 1 (DH1), sedangkan contoh meniran merah dengan intensitas pita yang lebih baik adalah contoh asal Darmaga (DM). Adapun pita DNA meniran merah hasil isolasi modifikasi metode Doyle dan Doyle (1987) terlihat memiliki intensitas lebih tinggi dibandingkan meniran hijau. Contoh kapulaga lokal secara umum memiliki intensitas pita DNA yang lebih tinggi dibandingkan contoh meniran. Kapulaga lokal putih dan merah yang menunjukkan pita dengan intensitas tertinggi adalah contoh ulangan 2, yaitu KP2 dan KM2 (Gambar 1).
Pita DNA yang dihasilkan dari seluruh contoh juga masih terlihat adanya
smear yang menunjukkan keberadaan kontaminan. Smear pada contoh meniran maupun kapulaga lokal tampak memiliki intensitas yang serupa bila dikaitkan dengan intensitas pita DNA dari tiap-tiap contoh. Ukuran DNA meniran yang dihasilkan dari kedua metode isolasi DNA yang digunakan berkisar antara 10154
base pair (bp) hingga 11000 bp, sedangkan ukuran DNA kapulaga lokal yang dihasilkan berkisar antara 10200 bp hingga 10800 bp. Marker DNA yang digunakan berasal dari Thermo Scientific berukuran 1 kb dengan 14 fragmen DNA. Fragmen DNA marker berukuran 10000 bp, 8000 bp, 6000 bp, 5000 bp, 4000 bp, 3500 bp, 3000 bp, 2500 bp, 2000 bp, 1500 bp, 1000 bp, 750 bp, 500 bp dan 250 bp.
(a) (b)
Gambar 1 Elektroforegram DNA meniran dan kapulaga lokal
(a) Contoh meniran hasil isolasi DNA metode modifikasi Doyle dan Doyle (1987): Lajur 1 = DH; L2 = BtM1; L3 = BtM2
7 Parameter berikutnya dalam melihat kualitas DNA yang telah diisolasi yaitu uji kuantitatif DNA dengan spektrofotometri. Informasi mengenai konsentrasi dan kemurnian DNA akan didapat dari uji ini. Konsentrasi DNA diketahui dari absorban DNA pada panjang gelombang 260 nm. Nilai absorban 1.0 pada panjang gelombang 260 nm ini setara dengan 50 ng µL-1 utas ganda DNA. Nilai kemurnian DNA terhadap kontaminasi protein termasuk RNA diketahui dari rasio A260 dengan A280, sedangkan nilai kemurnian DNA terhadap kontaminasi polisakarida dan fenol diketahui dari rasio A260 dengan A230. Nilai rasio yang baik untuk kemurnian DNA terhadap protein adalah 1.8-2.0 (Kundu et al. 2011), sedangkan nilai rasio yang baik untuk kemurnian DNA terhadap polisakarida dan fenol adalah 1.5-2.1 (Kheyrodin and Ghazyinian 2012).
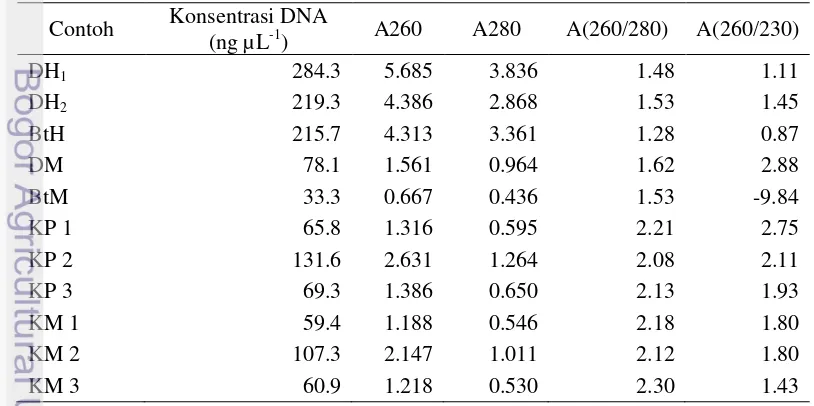
Contoh meniran dari isolasi DNA metode Doyle dan Doyle (1990) menunjukkan nilai konsentrasi yang berkisar antara 33.3 ng µL-1 hingga 284.3 ng µL-1. Konsentrasi DNA tertinggi tersebut adalah contoh meniran hijau asal Darmaga ulangan 1 (DH1) dan yang terendah adalah contoh meniran merah asal Bantarjati (BtM). Kemurnian DNA terhadap protein dari contoh meniran ini berkisar antara 1.28 hingga 1.62, sedangkan kemurnian DNA terhadap polisakarida dan fenol berkisar antara -9.84 hingga 2.88. Nilai kemurnian terhadap protein dan polisakarida juga fenol ini semuanya masih di luar rentang yang baik. Kemurnian meniran hijau dan meniran merah yang cukup baik di antara contoh lainnya pada metode ini adalah contoh asal Darmaga, yaitu DH2 dan DM (Tabel 1).
8
Contoh meniran hasil isolasi DNA metode Doyle dan Doyle (1987) menunjukkan nilai konsentrasi 210 ng µL-1-470 ng µL-1. Kemurnian DNA terhadap protein dari contoh meniran ini berkisar antara 1.00 hingga 1.62, sedangkan kemurnian DNA terhadap polisakarida dan fenol berkisar antara 0.47 hingga 1.15. Nilai kemurnian ini masih di bawah rentang yang baik (Tabel 2).
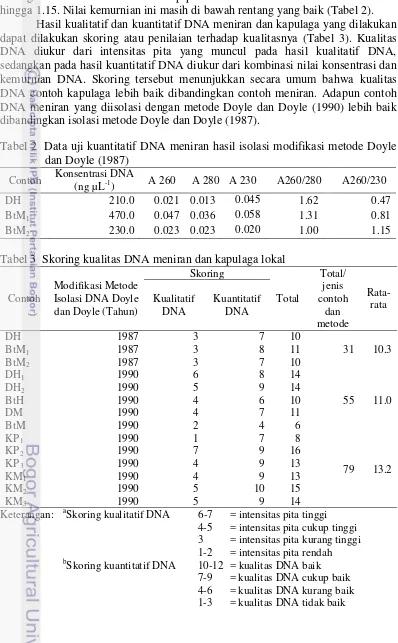
Hasil kualitatif dan kuantitatif DNA meniran dan kapulaga yang dilakukan dapat dilakukan skoring atau penilaian terhadap kualitasnya (Tabel 3). Kualitas DNA diukur dari intensitas pita yang muncul pada hasil kualitatif DNA, sedangkan pada hasil kuantitatif DNA diukur dari kombinasi nilai konsentrasi dan kemurnian DNA. Skoring tersebut menunjukkan secara umum bahwa kualitas DNA contoh kapulaga lebih baik dibandingkan contoh meniran. Adapun contoh DNA meniran yang diisolasi dengan metode Doyle dan Doyle (1990) lebih baik dibandingkan isolasi metode Doyle dan Doyle (1987).
Tabel 2 Data uji kuantitatif DNA meniran hasil isolasi modifikasi metode Doyle dan Doyle (1987)
Tabel 3 Skoring kualitas DNA meniran dan kapulaga lokal
Contoh
Keterangan: aSkoring kualitatif DNA 6-7 = intensitas pita tinggi
4-5 = intensitas pita cukup tinggi
3 = intensitas pita kurang tinggi
1-2 = intensitas pita rendah
b
Skoring kuantitatif DNA 10-12 = kualitas DNA baik
7-9 = kualitas DNA cukup baik
4-6 = kualitas DNA kurang baik
9 Kondisi Optimum RAPD-PCR
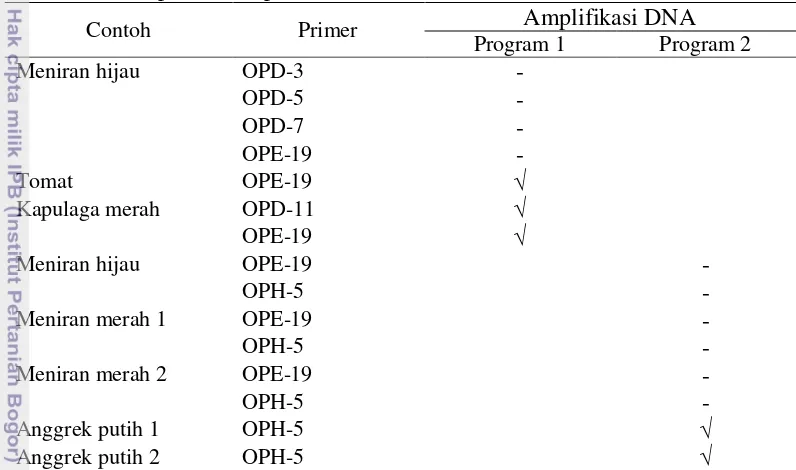
Contoh meniran dari kedua isolasi DNA yang digunakan tidak dilanjutkan untuk dilakukan PCR. Hal tersebut dikarenakan dari hasil optimasi kedua program PCR yang dilakukan tidak ada DNA meniran yang teramplifikasi. Contoh kapulaga dapat dilanjutkan untuk PCR karena dari optimasi program pertama berhasil teramplifikasi (Tabel 4). Adapun kondisi optimum program PCR untuk seleksi primer adalah program kedua, hal ini dilihat dari pita-pita DNA yang terpisah lebih baik dibandingkan program PCR pertama (Gambar 2).
Tabel 4 Hasil optimasi amplifikasi DNA
Contoh Primer Amplifikasi DNA
Program 1 Program 2
Meniran hijau OPD-3
-OPD-5
-OPD-7
-OPE-19
-Tomat OPE-19 √
Kapulaga merah OPD-11 √
OPE-19 √
Meniran hijau OPE-19
-OPH-5
-Meniran merah 1 OPE-19
-OPH-5
-Meniran merah 2 OPE-19
-OPH-5
-Anggrek putih 1 OPH-5 √
Anggrek putih 2 OPH-5 √
Keterangan : √ = DNA teramplifikasi; - = DNA tidak teramplifikasi
(a) (b)
Gambar 2 Elektroforegram hasil optimasi RAPD-PCR
(a) Optimasi pertama: L1 = DH1, primer OPD-3; L2 = DH1, primer OPD-7; L3 = DH1, primer OPD-5; L4 = DH1, primer OPE-19; K+ = Kontrol positif (tomat); L5 = KM2, primer OPD-11; L6 = KM2, primer OPE-19; M1 = Marker 1 kb
10
Primer RAPD-PCR
Contoh DNA meniran tidak dilanjutkan untuk diamplifikasi dengan RAPD-PCR, hanya contoh kapulaga lokal yang diamplifikasi. Kapulaga lokal yang diamplifikasi adalah contoh KM2 dan KP2. Program PCR yang digunakan dalam teknik RAPD ini berdasarkan metode Yu dan Paul (1994). Primer RAPD yang diseleksi pada kedua contoh adalah OPA-OPD 11-15 dari Operon Technologies.
Jumlah primer yang dapat mengamplifikasi DNA di antara kedua contoh ini adalah 15 dari 20. Kelimabelas primer yang berhasil mengamplifikasi DNA ini juga menunjukkan adanya polimorfisme di antara kedua contoh (Tabel 5). Jumlah pita DNA yang muncul pada keseluruhan contoh adalah 182 dengan jumlah lokus polimorfik adalah 164 dan jumlah lokus monomorfik adalah 18. Jumlah pita yang muncul pada KM2 adalah 105, sedangkan pada KP2 adalah 95 (Tabel 6). Pita-pita DNA yang muncul ini menunjukkan pola pita berbeda pada tiap primer di antara kedua contoh (Gambar 3).
Tabel 6 Data jumlah amplikon kapulaga lokal
No. Primer Urutan basa
11
Gambar 3 Elektroforegram hasil RAPD-PCR kapulaga lokal a)
Lajur 1, 3, 5, 7, 9, 11= contoh KM2; Lajur 2, 4, 6, 8, 10, 12= contoh KP2
b)
L1-2 = primer OPB-15; L3-4 = OPA-11; L5-6 = OPA-12; L7-8 = OPA-13; L9-10 = OPA-14; L11-12 = OPA-15; M = Marker 100 bp
Pembahasan
Isolasi DNA genom telah dilakukan terhadap contoh meniran dengan menggunakan metode Doyle dan Doyle (1990) dan Doyle dan Doyle (1987) termodifikasi, sedangkan DNA contoh kapulaga lokal hanya diisolasi dengan menggunakan metode Doyle dan Doyle (1990) termodifikasi. Isolasi DNA menggunakan metode Doyle dan Doyle (1990) ini diacu pada penelitian Rout dan Aparajita (2010) terhadap beberapa contoh Phyllanthus sp. asal India. Modifikasi yang dilakukan pada penelitian ini adalah dalam bentuk preparasi yang kecil (miniprep) dan jumlah contoh yang digunakan menjadi 10× lipatnya. Adapun metode isolasi DNA meniran dengan metode Doyle dan Doyle (1987) yang digunakan dalam penelitian ini mengacu pada penelitian Porebski et al. (1997) terhadap stroberi. Modifikasi yang dilakukan terhadap metode ini adalah tidak digunakannya β-merkaptoetanol dalam bufer ekstraksinya dan jumlah contoh yang lebih sedikit.
Keberhasilan isolasi DNA yang dilakukan dilihat melalui dua parameter, yaitu uji kualitatif DNA dan uji kuantitatif DNA. Uji kualitatif DNA menggunakan elektroforesis gel agarosa 1.5%, sedangkan uji kuantitatif DNA menggunakan metode spektrofotometri. DNA genom contoh yang berhasil diisolasi selanjutnya akan diamplifikasi menggunakan teknik RAPD-PCR. Hasil PCR dilihat menggunakan elektroforesis gel agarosa 1.5%. DNA yang berhasil teramplifikasi akan memunculkan pita pada gel agarosa yang telah mengandung EtBr dengan adanya visualisasi dari sinar UV.
Kualitas DNA Genom Meniran dan Kapulaga Lokal
Kualitas DNA genom meniran dan kapulaga lokal hasil isolasi dilihat dengan dua parameter, yaitu uji kualitatif menggunakan gel elektroforesis dan uji
1500 bp 2000 bp
1200 bp 3000 bp
12
kuantitatif dengan metode spektrofotometri. Kualitas DNA yang terlihat dari dua parameter uji tersebut tentu berkaitan erat dengan proses isolasi DNA yang dilakukan. Pita DNA yang terlihat pada gel agarosa menunjukkan intensitas yang berbeda tiap contohnya dan konsentrasi DNA yang diperoleh juga berbeda-beda. Umumnya, konsentrasi DNA genom yang tinggi akan menghasilkan intensitas pita yang tinggi. Hal yang mempengaruhi tinggi dan rendahnya konsentrasi DNA ini yaitu kandungan senyawa yang terdapat pada contoh, prosedur ekstraksi, dan metode pengendapan atau presipitasi DNA (Chen et al. 2010).
DNA genom meniran hasil isolasi modifikasi metode Doyle dan Doyle (1990) umumnya menunjukkan pita pada gel elektroforesis lebih baik dibandingkan metode modifikasi Doyle dan Doyle (1987). Hal ini dapat disebabkan oleh jumlah contoh yang digunakan pada modifikasi metode Doyle dan Doyle (1990) lebih banyak dibandingkan modifikasi metode Doyle dan Doyle (1987). Namun, kapulaga lokal terlihat masih lebih baik intensitas pitanya dibandingkan contoh meniran (Gambar 1; Tabel 3). Hal ini dapat disebabkan contoh meniran yang diambil langsung di alamnya sudah memasuki fase generatif (tumbuhan dewasa), sehingga tinggi kandungan metabolit sekunder seperti polifenol yang mencakup lignan dan flavonoid. Polifenol ini terutama berasal dari filantin dan hipofilantin yang termasuk senyawa lignan (Oktavidiati 2012).
Pita DNA seluruh contoh yang dihasilkan masih memiliki smear pada bagian bawah. Bentuk pita DNA yang dihasilkan berupa “fire type”. Hal ini menunjukkan adanya kontaminan polisakarida serta fenolik yang terbawa saat isolasi (Pharmawati 2009). Namun, pita yang dihasilkan berjumlah 1 buah. Hal ini menandakan DNA yang dihasilkan cukup baik.
Kualitas DNA meniran hasil isolasi modifikasi metode Doyle dan Doyle (1990) dilihat dari nilai konsentrasi dan kemurniannya menunjukkan nilai yang lebih baik dibandingkan hasil isolasi modifikasi metode Doyle dan Doyle (1987). Namun, kualitas DNA meniran dari kedua metode tersebut tidak berbeda jauh. Nilai konsentrasi DNA pada kedua metode ini menunjukkan angka yang termasuk tinggi, tetapi kemurniannya masih di luar rentang yang baik. Namun untuk analisis molekuler selanjutnya dengan RAPD, kemurnian DNA yang tinggi tidak begitu mempengaruhi. Hal ini disebabkan RAPD toleran terhadap tingkat kemurnian DNA (Prana dan Hartati 2003). Oleh karena itu, DNA meniran yang berhasil diisolasi tersebut diharapkan dapat teramplifikasi pada teknik RAPD.
Konsentrasi DNA kapulaga putih memiliki nilai yang lebih tinggi dibandingkan kapulaga merah. Kemurnian DNA kedua jenis kapulaga lokal ini terhadap protein masih di atas rentang yang baik, tetapi tidak jauh. Kemurniannya terhadap polisakarida dan fenol sebagian besar masuk dalam rentang yang baik (Tabel 1). Kualitas DNA kapulaga lokal ini lebih lebih baik dibandingkan meniran secara umum (Tabel 3). Hal ini menunjukkan bahwa kualitas DNA hasil isolasi dipengaruhi oleh jenis tanaman dan kandungan senyawa dalam tanaman tersebut (Pharmawati 2009).
13 Penggerusan dengan nitrogen cair dimaksudkan untuk memudahkan lisis sel dan menghasilkan gerusan yang halus, sehingga diharapkan akan diperoleh konsentrasi DNA yang lebih tinggi. Nitrogen cair yang bersuhu sekitar -196 oC ini juga berfungsi mengurangi kerusakan DNA dengan menginaktifkan enzim seluler dan bahan kimia berbahaya (Arif et al. 2010). Nitrogen cair yang diganti dengan PVP pada modifikasi metode Doyle dan Doyle (1987) berdasarkan penelitian Porebski et al. (1997) ini berfungsi untuk mencegah kerusakan DNA akibat oksidasi dan menarik senyawa fenolik pada daun (Padmalatha dan Prasad 2006).
Penggunaan PVP diharapkan dapat memperoleh DNA yang lebih tinggi pada contoh meniran yang diketahui mengandung senyawa fenolik tinggi. Namun, konsentrasi dan kemurnian DNA pada metode ini tidak memiliki perbedaan berarti dengan metode penggerusan menggunakan nitrogen cair. Hal ini dapat disebabkan oleh adanya β-merkaptoetanol dalam bufer ekstraksi metode Doyle dan Doyle (1990) yang fungsinya selaras dengan PVP (Prana dan Hartati 2003).
Presipitasi DNA dilakukan dengan menambahkan isopropanol atau etanol absolut. Presipitasi dengan isopropanol dilakukan pada metode isolasi DNA Doyle dan Doyle (1990) dan etanol absolut dilakukan pada isolasi DNA meniran dengan metode Doyle dan Doyle (1987). Isopropanol lebih sulit menguap dibanding etanol absolut, sehingga lebih sulit juga untuk dihilangkan. Pencuciannya dengan etanol 70% menjadi penting untuk dilakukan. Adapun etanol absolut dibutuhkan dalam volume yang lebih banyak untuk presipitasi DNA dibandingkan dengan isopropanol (Green and Sambrook 2012). Presipitasi DNA dengan kedua larutan ini menghasilkan konsentrasi dan kemurnian DNA yang tidak berarti perbedaannya, sehingga keduanya baik digunakan. Hal yang harus diperhatikan hanya jumlah yang ditambahkan dan pencuciannya dengan etanol 70%.
Pelet DNA dari isolasi metode Doyle dan Doyle (1990) yang diperoleh kemudian langsung dilarutkan dengan bufer TE pH 8.0, sedangkan pelet DNA dari isolasi metode Doyle dan Doyle (1987) dilarutkan dengan akuabides. Resuspensi dengan bufer TE tersebut diharapkan dapat menjaga kualitas DNA tetap baik karena kondisi pH yang terjaga konstan. Namun, resuspensi dengan bufer TE dapat menyebabkan masalah saat proses PCR karena EDTA yang terkandung dapat mengkelat MgCl2 yang merupakan kofaktor Taq DNA polimerase untuk memulai perpanjangan rantai. Hal tersebut bisa dihindari dengan konsentrasi EDTA yang kecil pada bufer (dalam penelitian ini adalah 0.1 mM). Contoh DNA teresuspensi tersebut kemudian disimpan pada -20 oC sebagai stok DNA. Kedua metode isolasi DNA ini menunjukkan hasil kualitas DNA yang tidak berbeda jauh dilihat dari elektroforesis gel agarosa dan konsentrasi serta kemurnian DNA-nya (Tabel 3), sehingga keduanya baik digunakan untuk analisis menggunakan RAPD-PCR.
Kondisi Optimum RAPD-PCR
14
penelitiannya (2011) bahwa konsentrasi DNA 50 ng L-1 sudah dapat dilakukan untuk analisis dalam RAPD-PCR.
Kelebihan teknik RAPD salah satunya adalah tingkat kemurnian DNA yang dibutuhkan tidak perlu terlalu tinggi atau dengan kata lain teknik RAPD toleran terhadap tingkat kemurnian DNA (Prana dan Hartati 2003). Kemurnian DNA (A260/A280) hasil isolasi metode Doyle dan Doyle (1990) contoh meniran dan kapulaga lokal yang berada pada rentang nilai 1.28-1.62 dan 2.30-2.08 sudah cukup untuk proses amplifikasi. Hal yang sama juga menunjukkan bahwa kemurnian DNA meniran (A260/A280) hasil isolasi metode Doyle dan Doyle (1987) yang berada pada rentang 1.00-1.62 sudah cukup untuk dilakukan amplifikasi. DNA yang digunakan dalam penelitian ini untuk tiap jenis contohnya diambil satu untuk proses amplifikasi yang mengacu pada beberapa hal tersebut, yaitu DH1 dan DM serta KP2 dan KM2 (Doyle dan Doyle 1990). Namun, contoh meniran yang digunakan dalam tahap optimasi RAPD-PCR hanya DH1 (Gambar 2). Adapun untuk contoh meniran hasil isolasi DNA metode Doyle dan Doyle (1987) yang berjumlah tiga semuanya diamplifikasi dalam tahap optimasi RAPD-PCR dengan primer universal (Gambar 2).
Teknik RAPD-PCR menggunakan primer acak dari Operon Technologies
yang terdiri atas 10 nukleotida dengan urutan basa (sekuens) tertentu (Tabel 6). Primer yang menempel pada lokus berbeda akan mengamplifikasi sekuens secara acak dari cetakan DNA yang komplementer atau dapat terjadi dengan jumlah ketidaksesuaian yang kecil. DNA genom (contoh) akan menjadi cetakan DNA untuk penempelan primer. Primer secara acak akan menempel pada sekuen DNA genom yang komplementer sehingga akan diperpanjang oleh Taq polimerase dan teramplifikasi membentuk suatu pola (Xu 2010).
Produk RAPD salah satunya dipengaruhi oleh kondisi siklus termal yang digunakan. Perbedaan optimasi pertama (Williams et al. 1990) dan kedua (Yu dan Paul 1994) terletak pada suhu denaturasi DNA, waktu tiap proses PCR (denaturasi, penempelan primer, perpanjangan rantai), dan jumlah siklus termal. Optimasi pertama menggunakan suhu denaturasi DNA sebesar 92 oC, sedangkan optimasi kedua menggunakan suhu 94 oC. Kedua suhu denaturasi tersebut umum dipakai pada PCR untuk mendapatkan pita-pita DNA yang terpisah baik (Bartlett and Stirling 2003). Waktu tiap proses PCR pada optimasi pertama lebih panjang dibandingkan optimasi kedua. Jumlah siklus termal optimasi pertama adalah 44 dan ada 1 siklus adaptasi terlebih dahulu, sedangkan jumlah siklus termal optimasi kedua adalah 45.
15 Faktor penting dari siklus termal PCR adalah suhu penempelalan primer. Kedua optimasi PCR yang dilakukan dalam penelitian ini menggunakan suhu penempelan primer sebesar 35 oC dengan %GC primer 60-70. Suhu tersebut direkomendasikan oleh Operon Technologies selaku produsen primer yang digunakan.
Optimasi program PCR pertama diperoleh bahwa contoh meniran hijau (DH1) dari isolasi modifikasi metode Doyle dan Doyle (1990) menggunakan tiga primer acak (OPD-3, OPD-5, OPD-7) dan satu primer universal (OPE-19) tidak menunjukkan adanya DNA yang teramplifikasi. Contoh DNA kapulaga yang digunakan dalam optimasi ini adalah kapulaga merah (KM2) dengan primer OPD-11 dan OPE-19. Hasilnya menunjukkan DNA teramplifikasi pada kedua primer yang digunakan, walaupun pita-pita yang muncul tidak terpisah dengan baik. Kontrol positif berupa DNA tomat juga teramplifikasi dengan pita-pita DNA yang tidak terpisah cukup baik (Gambar 2; Tabel 4).
Optimasi program PCR kedua yang digunakan hanya diuji terhadap contoh meniran dari isolasi DNA modifikasi metode Doyle dan Doyle (1987). Hasilnya menunjukkan dari keseluruhan contoh (meniran hijau dan meniran merah) masih tidak ada DNA yang teramplifikasi menggunakan dua primer universal (OPE-19 dan OPH-5). Pembanding untuk optimasi kedua ini adalah anggrek putih hasil kultur jaringan menggunakan metode isolasi DNA yang sama. DNA anggrek tersebut berhasil teramplifikasi semua dengan penggunaan primer OPH-5 dengan pita-pita DNA yang terpisah cukup baik (Gambar 2; Tabel 4). Contoh DNA meniran yang belum berhasil teramplifikasi pada teknik RAPD-PCR yang digunakan diduga karena contoh sudah memasuki fase generatif.
Isolasi DNA meniran baiknya dicoba dengan usia tanaman yang masih sangat muda, yaitu sekitar dua hari atau muncul dua daun pertama. Hal ini dikarenakan fase generatif meniran yang cepat (diperkirakan sekitar seminggu) membuatnya telah banyak mengandung metabolit sekunder pada contoh. Metabolit sekunder pada meniran umumnya tinggi fenolik, sehingga dapat menghambat proses PCR (Yudiansyah Desember 2013, komunikasi pribadi). Primer RAPD-PCR
Contoh DNA kapulaga lokal dengan rata-rata skoring kualitas 13.2 dapat dianalisis dengan RAPD-PCR, sedangkan kualitas DNA meniran yang didapat dengan rata-rata skoring 10.3 (Doyle dan Doyle 1987) dan 11.0 (Doyle dan Doyle 1990) tidak dapat dilanjutkan untuk analisis RAPD-PCR. Contoh meniran ini tidak berhasil teramplifikasi dengan kedua program PCR yang digunakan pada optimasi. Seleksi primer RAPD-PCR oleh sebab itu hanya dilakukan pada contoh kapulaga lokal.
16
Hasil seleksi primer RAPD-PCR dari 20 primer yang digunakan (OPA-OPD 11-15) terhadap contoh kapulaga lokal menunjukkan DNA contoh teramplifikasi pada 15 primer (Tabel 6). Polimorfisme ditunjukkan juga oleh kelimabelas primer tersebut. Polimorfisme merupakan adanya lokus atau amplikon (pita yang muncul) berukuran tidak sama antar contoh pada satu primer. Pita yang muncul ini selain bersifat polimorfik ada yang bersifat monomorfik, yaitu adanya lokus dengan ukuran sama pada seluruh contoh yang dianalisis (Berdakci 2001).
Lokus merupakan lokasi spesifik suatu gen yang berada di sepanjang kromosom. Jumlah lokus yang muncul pada semua contoh adalah 182 dengan lokus polimorfik sebanyak 164 dan lokus monomorfik sebanyak 18. Kapulaga merah menunjukkan jumlah lokus yang lebih banyak dibandingkan kapulaga putih, yaitu sebanyak 105 lokus dibandingkan kapulaga putih yang jumlah lokusnya 95. Lokus terbanyak muncul di primer OPC-15, yaitu sebanyak 17 dengan lokus polimorfik sebanyak 12 (Lampiran 1). Perbedaan jumlah lokus yang dihasilkan dipengaruhi oleh sekuen primer yang digunakan. Suatu primer dapat mengamplifikasi DNA cetakan bila terdapat ruas yang komplemen. Semakin banyak ruas DNA cetakan yang bersifat komplemen dengan sekuen primer, maka hasil amplifikasi akan menunjukkan jumlah pita yang semakin banyak (Semagn et al. 2006).
Seluruh primer yang berhasil mengamplifikasi DNA umumnya menunjukkan pola amplikon berbeda (Gambar 3; Lampiran 2). Namun, pola amplikon berbeda yang cukup tinggi dan pita-pita yang dihasilkan tegas dibanding lainnya terdapat pada primer seri OPA 11-15. Selain itu, primer yang banyak menghasilkan amplikon dan menunjukkan pola pita berbeda yang cukup tinggi adalah OPC-17 dan OPB-14. Primer-primer tersebut dapat digunakan untuk analisis lebih lanjutnya, yaitu keragaman genetik terhadap beberapa aksesi contoh kapulaga lokal. Informasi keragaman genetik dari dua macam kapulaga lokal ini dapat dijadikan acuan untuk mengembangkan bibit unggul, khususnya pada pemanfaatannya sebagai obat.
SIMPULAN DAN SARAN
Simpulan
17 Saran
Contoh DNA meniran yang belum dapat teramplifikasi pada RAPD-PCR disarankan isolasinya dioptimasi kembali untuk mendapatkan kualitas yang lebih baik. Contoh meniran ini sebaiknya diambil dari daun muda, yaitu pada tahap pembelahan yang belum sampai fase generatif. Penanamannya disarankan pada
petri dish dengan media kertas saring yang dibuat cukup basah atau lembab. Isolasi DNA meniran ini disarankan juga untuk dicoba pada bagian tanaman lainnya, seperti akar. Seleksi primer acak RAPD lainnya untuk contoh kapulaga lokal juga dapat dilakukan untuk menampilkan perbedaan pola pita DNA dan polimorfisme yang lebih beragam lagi. Adapun primer OPA 11-15, OPC-7, dan OPB-14 dapat digunakan untuk analisis lebih lanjutnya, yaitu keragaman genetik terhadap beberapa aksesi contoh kapulaga lokal dan dilengkapi dengan analisis kandungan senyawa kimianya.
DAFTAR PUSTAKA
Arif IA, Bakir MA, Khan HA, Ahamea A, Al Farhan AH, Al Homaidan AA, Al Sadoon M, Bahkali AH, Shobrak M. 2010. A simple method for DNA extraction from mature date palm leaves: impact of sand grinding and composition of lysis buffer. Int J Mol Sci. 11 (9): 3149-3157.
Babu KN, Jayakumar VN, Divakaran M, Venugopal MN, Sudarsh MR, Radhakrishnan VV, Backiyarani S, Narayanaswami M, Peter KV, Parthasarathy VA. 2012. Genetic diversity and phylogenetic relationship among small cardamom (Elettaria cardamomum Maton.) cultivars and related genera using DNA markers. IJIH. 1 (1): 47-56.
Bartlett JMS, Stirling D. 2003. PCR Protocols. 2nd Ed. New York (US): Humana Press.
[BPOM RI] Badan Pengawasan Obat dan Makanan Republik Indonesia. 2006.
Monografi Ekstrak Tumbuhan Obat Indonesia Volume II. Jakarta: BPOM RI.
Berdakci F. 2001. Random amplified polymorphic DNA (RAPD) markers [review]. Turk J Biol.25: 185-196.
Campbell NA, Reece JB, Mitchell LG. 2002. Biologi. Ed ke-5. Manalu W, penerjemah; Safitri A, editor. Jakarta: Erlangga. Terjemahan dari: Biology. 5th Ed.
Chen H, Rangasamy M, Tan SY, Wang H, Siegfried BD. 2010. Evaluation of five methods for total DNA extraction from western corn rootworm beetles. Plos ONE. 5: 1-6.
Doyle JJ, Doyle JL. 1987. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochem Bull. 19: 11-15.
18
Ganju L, Karan D, Chandra S, Srivastava KK, Sawhey RC, Selvamurthy W. 2003. Immunomodulatory effects of agents of plant origin. Biomed Pharmacother. 57: 296-300.
Green MR, Sambrook J. 2012. Molecular Cloning: A Laboratory Manual. 4th Ed. New York (US): Cold Spring Harbor Laboratory Press.
Govaerts R, Frodin DG, Radcliffe-Smith A. 2000. World Checklist and Bibliography of Euphorbiaceae (and Pandaceae) 4. London (GB): Royal Botanic Gardens Kew.
Jose JK, Kuttan G, Kuttan R. 2001. Antitumour activity of Emblica officinalis. J Ethnopharmacol. 75: 65-69.
Kheyrodin H, Ghazvinian K. 2011. DNA purification and isolation of genomic DNA from bacterial species by plasmid purification system. Afr J Agricul Res. 7: 433-442.
Kim J, Johnson M, Hill P, Gill BK. 2009. Microfluidic sample preparation: cell lysis and nucleic acid purification. Integrative Biology. 1: 574-586.
[Depkes RI] Departemen Kesehatan Republik Indonesia. 2007. Kebijakan Obat Tradisonal Nasional. Jakarta: Depkes RI.
Kumar NS, Gurusubramanian G. 2011. Random amplified polymorphic DNA (RAPD) markers and its applications. Sci Vis. 11 (3): 116-124.
Kundu et al. 2011. A simple ethanol wash of the tissue homogenates recovers high-quality genomic DNA from Corchorus species characterized by highly acidic and proteinaceous mucilages. Electron J Biotechnol. 14: 1-7.
Lim TK. 2013. Edible Medicinal and Non-Medicinal Plants: Volume 5, Fruits. Dordrecht (NL): Springer.
Mangestuti, Subehan, Widyawaruyanti A, Zaidi SFH, Awale S, Kadota S. 2007. Traditional medicine of Madura Island in Indonesia. J Trad Med. 20: 90-103. Mangunwardoyo W, Cahyaningsih E, Usia T. 2009. Ekstraksi dan identifikasi
senyawa antimikroba herba meniran (Phyllanthus niruri L.). J Ilmu Kefarmas Indones. 7 (2): 57-63.
Manjrekar AP, Jisha V, Bag PP, Adhikary B, Pai MM, Hegde A, Nandini M. 2008. Effect of Phyllanthus niruri Linn. treatment on liver, kidney and testes in CCl4 induced hepatoxic rats. Ind J Experiment Biol. 46: 514-520. Oktavidiati E. 2012. Kajian beberapa aspek agronomi tanaman obat meniran hijau
(Phyllanthus niruri L.) dan meniran merah (Phyllanthus urinaria L.) [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Padmalatha K, Prasad MNV. 2006. Optimazion of DNA isolation and PCR protocol for RAPD analysis of selected medicinal and aromatic plants of conservation concern from Peninsular India. Afr J Biotechnol.5: 230-234. Porebski S, Baley LG, Baum BR. 1997. Modification of a CTAB DNA extraction
19 Prana TK, Hartati NS. 2003. Identifikasi sidik jari DNA talas (Colocasia esculenta L. Schott) Indonesia dengan teknik RAPD (Random Amplified Polymorphic DNA): skrining primer dan optimalisasi kondisi PCR. J Natur Indones. 5 (2): 107-112.
Rout GR, Aparajita S. 2010. Phylogenic study of twelve species of Phyllanthus
originated from India through molecular markers for conservation. AJPS. 1: 32-37.
Schmelzer GH, Gurib-Fakim A. 2008. Plant Resources of Tropical Africa 11 (1): Medicinal Plants 1. Wageningen (NL): Backhuys Pub.
Semagn K, Bjornstad A, Ndjiondjop MN. 2006. An overview of molecular marker methods for plants [review]. Afr J Biotechnol.5(25): 2540-2568. Taylor L. 2003. Technical Data Report for Chanca Piedra
“StoneBreaker”(Phyllantus niruri). California (US): Sage Pr.
Williams JGK, Kubelik AR, Livak KJ, Rafalski JA, Tingey SV. 1990. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers.
Nucleic Acids Res. 18: 6531-6535.
Xu Y. 2010. Molecular Plant Breeding. London (GB): CABI.
20
LAMPIRAN
Lampiran 1 Jumlah pita contoh kapulaga lokal hasil RAPD-PCR
21 Lampiran 2 Elektroforegram hasil RAPD-PCR kapulaga lokal
Keterangan: a)Lajur 1, 3, 5, 7, 9, 11, 13 = contoh KM2; Lajur 2, 4, 6, 8, 10, 12, 14 = contoh KP2
b)
L1-2 = primer OPD-11; L3-4 = OPD-12; L5-6 = OPD-13; L7-8 = OPD-14; L9-10 = OPD-15; L11-12 = OPC-11; L13-14 = OPC-12; M = Marker 100 bp
Keterangan: a)Lajur 1, 3, 5, 7, 9, 11, 13 = contoh KM2; Lajur 2, 4, 6, 8, 10, 12, 14 = contoh KP2;
b)
L1-2 = primer OPC-13; L3-4 = OPC-14; L5-6 = OPC-15; L7-8 = OPB-11; L9-10 = OPB-12; L11-12 = OPB-13; L13-14 = OPB-14; M = Marker 100 bp
100 bp 500 bp 1000 bp
22
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 22 Agustus 1991 dari pasangan Tutut Sunarminto dan Chairu Fariandini. Penulis merupakan anak kedua dari enam bersaudara. Riwayat pendidikan penulis dimulai dari SDN Gunung Gede Bogor tahun 1997-2003, melanjutkan pendidikan ke SMP Negeri 1 Bogor tahun 2003-2006, dan menyelesaikan pendidikan menengah atas di SMA Negeri 3 Bogor tahun 2009. Pada tahun yang sama, penulis meneruskan pendidikan di Departemen Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam IPB melalui jalur SNMPTN.