Lampiran 1. Proses Pencucian Rambut Dengan Metanol Setelah Rambut Digiling Hingga Halus
Lampiran 2. Proses Penyaringan Dengan Kertas Saring Setelah Proses Pencucian Dengan Metanol
Lampiran 3. Proses Sonikasi Dengan Alat Ultrasonicbath
Lampiran 5 Warna Kesepuluh Sampel Dengan Sistem Pelarut Metanol:Aseton:Amonia (5:1,2:0,08) Dengan Pereaksi Marquis
a. Sampel 1 Dengan Sistem Pelarut Metanol:Aseton:Amonia (5:1,2:0,08)
c. Sampel 3 Dengan Sistem Pelarut Metanol:Aseton:Amonia (5:1,2:0,08)
e. Sampel 5 Dengan Sistem Pelarut Metanol:Aseton:Amonia (5:1,2:0,08)
g. Sampel 7 Dengan Sistem Pelarut Metanol:Aseton:Amonia (5:1,2:0,08)
i. Sampel 9 Dengan Sistem Pelarut Metanol:Aseton:Amonia (5:1,2:0,08)
Lampiran 6 Warna Kesepuluh Sampel Dengan Sistem Pelarut Etilasetat:Metanol:Amonia (8,5:1:0,5) Dengan Pereaksi Marquis
a. Sampel 1 Dengan Sistem Pelarut Etilasetat:Metanol:Amonia (5:1:0,5)
c. Sampel 3 Dengan Sistem Pelarut Etilasetat:Metanol:Amonia (5:1:0,5)
e. Sampel 5 Dengan Sistem Pelarut Etilasetat:Metanol:Amonia (5:1:0,5)
g. Sampel 7 Dengan Sistem Pelarut Etilasetat:Metanol:Amonia (5:1:0,5)
i. Sampel 9 Dengan Sistem Pelarut Etilasetat:Metanol:Amonia (5:1:0,5)
Lampiran 7 Warna Kesepuluh Sampel Dengan Sistem Pelarut Kloroform:Metanol:Asam asetat (7,5:2:0,5) Dengan Pereaksi Marquis
a. Sampel 1 Dengan Sistem Pelarut Kloroform:Metanol:Asam asetat(7,5:2:0,5)
c. Sampel 3 Dengan Sistem Pelarut Kloroform:Metanol:Asam asetat(7,5:2:0,5)
e. Sampel 5 Dengan Sistem Pelarut Kloroform:Metanol:Asam asetat(7,5:2:0,5)
g. Sampel 7 Dengan Sistem Pelarut Kloroform:Metanol:Asam asetat(7,5:2:0,5)
i. Sampel 9 Dengan Sistem Pelarut Kloroform:Metanol:Asam asetat(7,5:2:0,5)
Lampiran 8 Standar Metamfetamin yang Dibuat di Laboratorium Forensik Polda Sumatera Utara Tahun 2016
DAFTAR PUSTAKA
Abdi, K.,2004. Detection Of Morphine in Opioid Abusers Hair By GC-MS. Volume
12
Ashley , K. 2001. Ultrasonic Extraction As a Sample Preparation Technique For
Elemental Analysis By Atomic Spectrometry. America.John Wiley
Badan Narkotika Nasional Indonesia, 2011, Data tindak pidana Narkoba tahun 2007- 2011
Badan Narkotika Nasional, 2010, Jurnal Data Pencegahan Penyalahgunaan Pemberantasan Peredaran Gelap Narkoba (P4GN)
Baumgartner A., 1979, Radioimmunoassay of Hair for Determining Opiate – Abuse
Histories, The Journal of Nuclear Medicine, Hal. 748 – 752
Darmono, 2008. Farmasi Forensik Dan Toksikologi.UI-Press.Jakarta
Clarke, 2004. Pharmaceutical.Third Edition.USA.Great Britain by The Bath Press
Harborne, J.B.1987. Metode Fitokimia.Bandung.Penerbit ITB
Hidayat, N. 2008. Pengembangan Produk dan Teknologi Poses Diunduh dari http://ptp2--7.wordpress.com
Hegstd, S. 2008. Drug Screening of Hair br Liquid Chromatography- Tandem Mass
Spectrometry, Journal of Analytical Toxicology, Vol. 32 Hal. 364 – 372.
Ikin A. Ghani dan Abu Chontraruf, 1993.Bahaya Penyalahgunaan Narkotika dan Penanggulangannya
Ikrar, 2014, Bahaya Narkotika dan Penanggulangannya, University of California,
School of Medicine, Irvine, USA, website : http://www.kabarinews. com.
Jose-Luis Capelo-Martinez, 2009. Ultrasound in Chemistry.Weinheim.Wiley-VCH
Verlag GmbH&Co
John,K. 2002. Analytical Chemistry for Technicians. Third Edition. America. CRC
Press LLC
Kenkel, J. 2003. Analytical Chemistry For Technicians. America.CRC Press LLC
Kolodziejska,I.2007.Effect of Extracting Time and Temperature On Yield Of Gelatin
From Different Fish Offal.Food Chem
Maryadele, J.O.N., 2006. The Merck Index, An Encyclopedia of Chemicals, Drugs,
Melecchi, 2006. Optimization of The Sonication Extraction Method Of Hibiscus
tiliaceus L.Flowers.Ultrasonic Sonochemistry
Moffat, A.C., Oselton, M.D., and Widdop,B. 2004. Clark’s Analysis of Drugs and
Poison.Third Edition. London.Pharmaceutical Press
Remberg,B.,Stead, A.H. 1999. Drugs Characterization/impurity profiling, with
special focus on metamphetamine: recent work of united Nations International Drugs Control Programme, Scientifics Section, UNDCP, Bulletin on Narcotics, Vol LI, Nos I and 2.Vienna
Republik Indonesia, 149 (2) Hal. 199 – 207, Dalam dasar menimbang Undang- Undang Republik Indonesia Nomor 35 Tahun 2009 Tentang Narkotika, poin c
Rosani, S, 2003, Standar Pelayanan Minimal Terapi Medik Ketergantungan Narkotika, Psikotropika dan Bahan Aktif Lainnya (Narkoba), BNN, Jakarta.
Syamsudin, A., 2015, Pengguna narkoba di Indonesia pada 2015 mencapai 5,8 Juta
Jiwa. website : http. :// www/merdeka.com/peritiwa/?.
Ulialbab, A. 2012. Metode Ekstraksi Vanili yang Baik. Diunduh dari website http://aryaulialbab-fkm12.web.unair.ac.id/artikel_detail-61638
Undang - Undang RI No 35 Tahun 2009, Narkotika, diunduh dari website
http://www.bnn. go.id/portal/_uploads/perundangan/2009/10/27/uunomor- 35-tahun-2009-tentang-narkotika-ok.pdf.
United Nations International Drug Control Programme. 2001. Drug characterization/impurity profiling, Background and concepts, Manual for use by national law enforcement authorithies and drug testing laboratories, Scientific Section, New York
Widayati, D. T., 2008, Analisis Forensik, Departemen Narkoba, BNN, Jakarta.
BAB 3 METODE PENELITIAN
3.1. Alat-alat Penelitian
- Ultrasonicbath
- Beaker glass (Pyrex)
- Pipet tetes
- Tabung Reaksi (Pyrex)
- Rak tabung reaksi
- Maat Pipet (Pyrex)
- Pipet Volume (Pyrex)
- Statif dan klem
- Corong pisah (Pyrex)
3.2. Bahan-bahan Penelitian
-Kloroform p.a (E.Merck)
-Etil Asetat p.a (E.Merck)
-Metanol p.a (E.Merck)
-Asam Asetat Glasial p.a (E.Merck)
-Aseton p.a (E.Merck)
-Amonia p.a (E.Merck)
-Formaldehida 37% p.a (E.Merck)
-Asam Sulfat Pekat p.a (E.Merck)
3.3 Prosedur Penelitian
3.3.1 Pembuatan Pereaksi Marquis
Pereaksi Marquist terdiri dari dua pereaksi, pereaksi pertama dibuat dengan
mencampurkan sebanyak 8-10 tetes formaldehida 37% kedalam asam asetat glasial
dan pereaksi kedua adalah asam sulfat pekat.
3.3.2 Preparasi Rambut
Sebanyak 30-40mg rambut pengguna methamphetamine dihaluskan dengan
menggunakan alu dan lumpang. Kemudian dicuci dengan menggunakan metanol
sebanyak 3 kali masing-masing selama 5 menit. Selanjutnya disonikasi dengan
menggunakan sistem pelarut yaitu metanol:aseton:amonia, etiasetat:metanol:amonia
dan kloroform:metanol:asam asetat dengan perbandingan berturut-turut 5 : 1.2 : 0.08 ,
8.5 : 1 : 0.5 dan 7.5 : 2 : 0.5 pada suhu kamar selama 30 menit. Selanjutnya disonikasi
kembali dengan kloroform selama 5 menit. Diekstraksi cair-cair dengan menggunakan
metanol. Didinginkan pada suhu ruangan. Disaring dengan menggunakan kertas
saring. Diidentifikasi filtrat dengan menggunakan pereaksi Marquist. Diamati
3.4 Bagan Penelitian
3.4.1 Preparasi Sampel Rambut Pengguna Metamfetamin
Rambut Pengguna Metamf etamin
Ditimbang sebanyak 30-40 mg
Dihaluskan dengan menggunakan alu dan lumpang
Dicuci dengan menggunakan metanol sebanyak 3 kali masing-masing selama 5 menit
Disaring dengan menggunakan kertas saring
Disonikasi rambut pengguna yang telah dicuci dengan menggunakan perbandingan sistem pelarut yaitu metanol:aseton:amonia , etilasetat:metanol:amonia dan
klorof orm:metanol:asam asetat dengan
perbandingan secara berturut-turut 5 : 1.2 : 0.08 , 8.5 : 1 : 0.5 dan 7.5 : 2 : 0.5 selama 30 menit pada suhu kamar
Diekstraksi cair-cair dengan menggunakan metanol
Didinginkan pada suhu kamar
Disaring menggunakan kertas saring
Ditampung f iltrat dalam botol vial
3.4.2 Uji Kualitatif Filtrat Hasil Sonikasi
Filtrat Hasil Sonikasi
Diambil sekitar 4-6 tetes f iltrat dengan pipet tetes
Dimasukkan kedalam tabung reaksi
Ditambahkan 3-4 tetes f ormaldehid yang telah dicampur dengan asam asetat glasial kedalam masing-masing f iltrat hasil sonikasi
Ditambahkan H2SO4(p) secukupnya
Diamati perubahan warna yang terjadi
Nama Sampel Marquis Test
Rambut Pengguna 1 Kuning Kecoklatan
Rambut Pengguna 2 Kuning Kecoklatan
Rambut Pengguna 3 Kuning Kecoklatan
Rambut Pengguna 4 Kuning Kecoklatan
Rambut Pengguna 5 Kuning Kecoklatan
Rambut Pengguna 6 Kuning Kecoklatan
Rambut Pengguna 7 Kuning Kecoklatan
Rambut Pengguna 8 Kuning Kecoklatan
Rambut Pengguna 9 Kuning Kecoklatan
Rambut Pengguna 10 Kuning Kecoklatan
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Uji Kualitatif Filtrat Hasil Sonikasi dengan Perbandingan Sistem Pelarut
Metanol:Aseton:Amonia menggunakan Pereaksi Marquis
Melalui serangkaian proses pencucian, sonikasi dan ekstraksi maka diperoleh hasil
positif methamphetamine pada rambut pengguna narkotika. Pada tahap sonikasi
digunakan perbandingan sistem pelarut Metanol:Aseton:Amonia dengan perbandingan
5 : 1.2 : 0.08 dan pada akhir proses dihasilkan filtrat berwarna kuning kecoklatan
setelah diidentifikasi menggunakan pereaksi Marquist. Hasil positif methamphetamine
yang diperoleh dari penelitian dapat dilihat pada Tabel 4.1 dibawah ini :
Tabel 4.1. Hasil Positif Methamphetamine dengan sistem pelarut
Warna yang dihasilkan dari pereaksi Marquis dengan sistem pelarut
metanol:aseton:amonia terhadap kesepuluh sampel adalah kuning kecoklatan yang
dapat dilihat dari Gambar 4.1 dibawah ini :
Gambar 4.1 Warna Positif Metamfetamin dengan sistem pelarut
metanol:aseton:amonia
4.1.2. Uji Kualitatif Filtrat Hasil Sonikasi dengan Perbandingan Sistem Pelarut
Metanol:Aseton:Amonia menggunakan Pereaksi Marquis
Melalui serangkaian proses pencucian, sonikasi dan ekstraksi maka diperoleh hasil
positif metamfetamin pada rambut pengguna narkotika. Pada tahap sonikasi
digunakan perbandingan sistem pelarut Etilasetat:Metanol:Amonia dengan
perbandingan 8.5 : 1 : 0.5 dan pada akhir proses dihasilkan filtrat berwarna kuning
kecoklatan setelah diidentifikasi menggunakan pereaksi Marquis. Hasil positif
metamfetamin yang diperoleh dari penelitian dapat dilihat pada Tabel 4.2 dibawah ini
Tabel 4.2. Hasil Positif Metamfetamin dengan sistem pelarut
etilasetat:metanol:amonia
Nama Sampel Marquist Test
Rambut Pengguna 1 Kuning Kecoklatan (+)
Rambut Pengguna 2 Kuning Kecoklatan (+)
Rambut Pengguna 3 Kuning Kecoklatan (+)
Rambut Pengguna 4 Kuning Kecoklatan (+)
Rambut Pengguna 5 Kuning Kecoklatan (+)
Rambut Pengguna 6 Kuning Kecoklatan (+)
Rambut Pengguna 7 Kuning Kecoklatan (+)
Rambut Pengguna 8 Kuning Kecoklatan (+)
Rambut Pengguna 9 Kuning Kecoklatan (+)
Rambut Pengguna 10 Kuning Kecoklatan (+)
Warna yang dihasilkan dari pereaksi Marquis dengan sistem pelarut
etilasetat:metanol:amonia terhadap kesepuluh sampel adalah kuning kecoklatan yang
lemah yang dapat dilihat dari Gambar 4.2 dibawah ini :
Gambar 4.2 Warna Positif Metamfetamin dengan sistem pelarut
etilasetat:metanol:amonia
Nama Sampel Marquist Test
Rambut Pengguna 1 Kuning Kecoklatan
Rambut Pengguna 2 Kuning Kecoklatan
Rambut Pengguna 3 Kuning Kecoklatan
Rambut Pengguna 4 Kuning Kecoklatan
Rambut Pengguna 5 Kuning Kecoklatan
Rambut Pengguna 6 Kuning Kecoklatan
Rambut Pengguna 7 Kuning Kecoklatan
Rambut Pengguna 8 Kuning Kecoklatan
Rambut Pengguna 9 Kuning Kecoklatan
Rambut Pengguna 10 Kuning Kecoklatan
4.1.3. Uji Kualitatif Filtrat Hasil Sonikasi dengan Perbandingan Sistem Pelarut
Metanol:Aseton:Amonia menggunakan Pereaksi Marquis
Melalui serangkaian proses pencucian, sonikasi dan ekstraksi maka diperoleh hasil
positif methamphetamine pada rambut pengguna narkotika. Pada tahap sonikasi
digunakan perbandingan sistem pelarut Kloroform : Metanol: Asam asetat dengan
perbandingan 7.5 : 2 : 0.5 dan pada akhir proses dihasilkan filtrat berwarna kuning
kecoklatan yang lemah setelah diidentifikasi menggunakan pereaksi Marquis. Hasil
positif methamphetamine yang diperoleh dari penelitian dapat dilihat pada Tabel 4.3
dibawah ini :
Tabel 4.3. Hasil Positif Metamfetamin dengan sistem pelarut kloroform:metanol:asam
asetat
(+)
(+)
(+)
(+)
(+)
(+)
(+)
(+)
(+)
Warna yang dihasilkan dari pereaksi Marquis dengan sistem pelarut
kloroform:metanol:asam asetat terhadap kesepuluh sampel adalah kuning kecoklatan
yang lemah yang dapat dilihat dari Gambar 4.3 dibawah ini :
Gambar 4.3 Warna Positif Metamfetamin dengan sistem pelarut
kloroform:metanol:asamasetat
4.3. Pembahasan
Analisis dari senyawaan narkotika menggunakan sampel rambut memiliki peranan
yang sangat penting dalam bidang toksikologi forensik terhadap riwayat
penyalahgunaan narkotika. Sampel rambut yang diambil adalah rambut yang terdapat
pada bagian belakang kepala dan yang dekat dengan kulit kepala.Alasan utama
pemilihan rambut sebagai sampel adalah karena rambut memiliki kemampuan untuk
menyerap zat-zat eksogen dan zat-zat tersebut akan tetap tidak berubah selama
beberapa tahun serta penarikan sampel dan pengangkutannya yang mudah. Obat-
obatan, dalam hal ini metamfetamin, dapat terdeteksi beberapa bulan setelah konsumsi
terakhir, karena obat-obatan tersebut memasuki akar rambut melalui kapiler dan akan
tertanam di batang rambut. Karena tertanam di batang rambut, diperlukan perlakuan
khusus untuk.dapat mengeluarkannya. Metode yang digunakan dalam penelitian ini
adalah sonikasi. Sonikasi adalah suatu metode yang memanfaatkan energi gelombang
suara untuk mengganggu partikel dalam sampel rambut. Getaran yang dihasilkan
dapat mempercepat waktu kontak antara sampel dengan pelarut meskipun pada suhu
ruang. Hal ini menyebabkan proses perpindahan senyawa metamfetamin dari dalam
rambut ke pelarut menjadi lebih cepat. Pelarut yang digunakan dalam tahap sonikasi
adalah metanol:aseton:amonia, etilasetat:metanol:amonia dan
kloroform:metanol:asam asetat. Pemilihan pelarut didasari oleh prinsip like dissolve
like dimana senyawa yang bersifat polar akan larut pada pelarut polar dan senyawa yang bersifat non polar akan larut pada pelarut non polar. Metamfetamin merupakan
senyawa yang bersifat polar maka metamfetamin akan larut pada pelarut polar.
Setelah disonikasi maka filtrat hasil sonikasi di ekstraksi dengan menggunakan
metanol. Tujuannya adalah untuk menarik senyawa metamfetamin yang sudah keluar
dari rambut. Setelah didapat ekstrak pekat yang mengandung metamfetamin, maka
dilakukan uji kualitatif dengan menggunakan pereaksi marquis yang akan
menghasilkan warna orange kecoklatan. Dari hasil uji kualitatif dengan 3(tiga)
perbandingan sistem pelarut, maka warna yang dihasilkan memiliki intensitas yang
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian yang telah dilakukan dapat diambil kesimpulan bahwa sistem
pelarut yang baik digunakan menarik senyawa metamfetamin ketika proses sonikasi
adalah aseton:metanol:amonia.
5.2 Saran
Disarankan untuk penelitian selanjutnya agar dapat melanjutkan penelitian ini secara
kuantitatif dengan menggunakan instrumen GC-MS agar dapat ditentukan kadar
BAB 2
TINJAUAN PUSTAKA
2.1. Narkotika dan Obat Berbahaya (Narkoba)
Narkotika dan obat-obat berbahaya (Narkoba) dan alkohol adalah obat yang termasuk
berefek adiksi bila dikonsumsi. Dewasa ini bahan kimia tersebut beredar secara luas
dan dikonsumsi oleh banyak orang, terutama dalam dunia orang yang melawan
hukum. Bahan kimia tersebut banyak disalahgunakan (drug abuse), sehingga
seseorang yang mengonsuksi obat tersebut banyak melanggar aturan masyarakat yang
ada.
Yang termasuk dalam golongan narkotika dan obat-obat berbahaya adalah obat-
obat yang berefek pada sistem saraf pusat. Ada yang bersifat depresan atau
menghambat kerja sistem saraf pusat, misalnya golongan mariyuana dan golongan
morfin. Ada yang bersifat stimulansia seperti kokain. Sedangkan obat yang termasuk
psikotropika yang disintesis dari bahan kimia/obat adalah ekstasi yang zat aktifnya
adalah metampetamin, disamping itu zat lain yang bukan termasuk narkoba tetapi juga
bersifat adiktif adalah alkohol (etanol). Obat tersebut dapat menyebabkan pengguna
menjadi bertindak berlebihan serta meningkatkan keberanian dan menimbulkan hal-
hal yang negatif dalam bertindak dan berpikir yang kadang merugikan orang lain dan
masyarakat sekitarnya. Di samping itu obat yang disintesis kimiawi maupun biologik
yang digunakan untuk menstimulir secara fisiologik untuk meningkatkan stamina
dalam peningkatan prestasi olahraga disebut doping. Karena efeknya yang dapat
mengakibatkan toksisitas bagi penggunanya maka obat ini termasuk obat terlarang
(Darmono, 2009).
Dari hal tersebut maka narkoba dan zat adiktif lain dikelompokkan berdasarkan
asalnya atau jenisnya, yaitu berasal dari ekstraksi tanaman, berasal dari sintesis dan
1. Yang berasal dari tanaman dan produknya ialah (kelompok narkotika) :
a) Cannabis sativa: mariyuana, hashis, kanabis, ganja
b) Papaver somniverum: morfin, heroin
c) Erythroxylum coca: kokain
2. Yang disintesis (kelompok psikotropika): ekstasi zat aktifnya adalah Metylen
dioksi metyl amphetamine (MDMA), beserta jenis produk yang dihasilkan
3. Hasil fermentasi bijian (zat adiktif lainnya): alkohol (etanol) dan produknya
4. Obat yang diberikan atau digunakan untuk para olahragawan yang dapat
memacu/menstimulir stamina supaya dapat mencapai prestasi tinggi dalam
suatu pertandingan olahraga (doping). Misalnya obat sitesis untuk menstimulir
saraf pusat, obat hormonal yang dapat memacu peningkatan pembentukan sel
darah merah dan sebagainya.
Dari beberapa jenis obat tersebut diatas, kelompok 1 dan 2 adalah kelompok
narkoba, dimana jenis obat tersebut disintesis secara ilegal dan diedarkan
sebagai obat terlarang. Efek farmakologik dari obat tersebut sangat
membahayakan karena dapat mempengaruhi pikiran yang menyebabkan
korban tidak sadar apa yang sedang dilakukannya. Karena efeknya yang
menyebabkan adiksi maka obat tersebut akan dikonsumsi terus-menerus oleh
penderita kecanduan, semakin lama semakin meningkat dosisnya, apabila hal
tersebut tidak segera diobati akan menyebabkan overdosis yang berakhir
dengan kematian si penderita. (Darmono, 2009)
2.1.1. Jenis-Jenis Narkoba
2.1.1.1.Narkotika
Merujuk pada Undang – Undang RI No. 35 Tahun 2009 tentang narkotika,
pengertian Narkotika adalah zat atau obat yang berasal dari tanaman atau bukan
tanaman, baik sintetis maupun semisintetis, yang dapat menyebabkan penurunan atau
perubahan kesadaran, hilangnya rasa, mengurangi sampai menghilangkan rasa nyeri,
dan dapat menimbulkan ketergantungan. Dari aturan tersebut maka narkotika dibagi
a. Narkotika golongan I: dilarang digunakan untuk kepentingan pelayanan kesehatan,
dilarang diproduksi dan/atau digunakan dalam proses produksi, kecuali dalam
jumlah yang sangat terbatas untuk kepentingan pengembangan ilmu pengetahuan
dan teknologi. Contoh: ganja, morphine, putauw adalah heroin tidak murni berupa
bubuk.
b. Narkotika golongan II : adalah narkotika yang memilki daya adiktif kuat, tetapi
bermanfaat untuk pengobatan dan penelitian. Contoh : petidin dan turunannya,
benzetidin, betametadol.
c. Narkotika golongan III : adalah narkotika yang memiliki daya adiktif ringan, tetapi
dapat bermanfaat untuk pengobatan dan penelitian. Contoh : codein dan turunannya.
2.1.1.2. Psikotropika
Menurut Pasal 1 angka 1 Undang – Undang RI No. 5 Tahun 1997 tentang
Psikotropika, pengertian psikotropika adalah zat atau obat, baik alamiah maupun
sintetis bukan narkotika, yang berkhasiat psikoaktif melalui pengaruh selektif pada
susunan saraf pusat yang menyebabkan perubahan khas pada aktivitas mental dan
perilaku, digunakan untuk mengobati gangguan jiwa.
Menurut Undang-Undang No.5 tahun 1997, psikotropika digolongkan lagi
menjadi 4 kelompok, yaitu:
a. Golongan I adalah dengan daya adiktif yang sangat kuat, belum diketahui
manfaatnya untuk pengobatan dan sedang diteliti khasiatnya. Contoh: MDMA,
LSD, STP, dan ekstasi.
b. Golongan II adalah psikotropika dengan daya adiktif kuat serta berguna untuk
pengobatan dan penelitian. Contoh: amfetamin, metamfetamin, dan metakualon.
c. Golongan III adalah psikotropika dengan daya adiksi sedang serta berguna untuk
pengobatan dan penelitian. Contoh: lumibal, buprenorsina, dan fleenitrazepam.
d. Golongan IV adalah psikotropika yang memiliki daya adiktif ringan serta berguna
untuk pengobatan dan penelitian. Contoh: nitrazepam ( BK, mogadon, dumolid )
2.1.1.3 Zat adiktif lain
Selain norkotika dan psikotropika, kita juga mengenal zat adiktif lainnya. Zat adiktif
adalah obat serta bahan – bahan aktif yang jika dikonsumsi oleh organisme hidup
dapat menyebabkan kerja biologi serta menimbulkan ketergantungan atau adiksi yang
sulit untuk dihentikan. Dan sesuai dengan Undang-Undang RI No.5 Tahun 1997
tentang Psikotropika menyebutkan beberapa obat yang mengandung zat adiktif di
antaranya adalah amfetamin, metamfetamin, amobarbital, flunitrazepam, diahepam,
bromazepam, fenobarbital, minuman beralkohol atau miras, tembakau atau rokok,
halusinogen, bahan pelarut seperti bensin, tiner, lem, cat, solvent (Undang-Undang RI
No. 35 Tahun 2009) dan (Undang - Undang RI No.5 Tahun 1997). Contoh-contoh
yang senada juga diungkapkan oleh Alifa, bahwa rokok, kelompok alkohol dan
minuman lain yang memabukkan dan menimbulkan ketagihan serta thiner dan zat
lainnya, seperti lem kayu, penghapus cair dan aseton, cat, bensin yang bila dihirup
akan dapat memabukkan (Alifa U, 2008).
2.2 Sabu-sabu
2.2.1 Sejarah Metamfetamin
Metamfetamin disintesis pertama kali pada tahun 1919 oleh seorang kimiawan dari
Jepang. Metamfetamin merupakan suatu stimulan dengan efek stimulan yang lebih
kuat dibandingkan kokain atau stimulan alam lainnya. Penggunaan dalam jumlah
besar dapat menyebabkan “violence” , halusinasi dan psikosis. Umumnya
metamfetamin diproduksi sebagai kristal menyerupai serbuk, gumpalan besar kristal
atau dalam bentuk tablet. Penggunaannya dapat dihisap dengan hidung, diminum,
dihisap seperti rokok atau diinjeksikan.
Pada 1950-an dan 1960-an, metamfetamin diproduksi secara legal dan dijual
sebagai obat OTC (over the counter) dengan nama Methedrine dan dipasarkan secara
rumahan sebagai antidot depresi dan untuk penurun berat badan di Amerika. Saat ini,
metamfetamin masih diproduksi secara legal, meskipun jarang diresepkan, untuk
terapi gangguan konsentrasi dengan hiperaktifitas (ADHD-attention deficit
Adanya penyalahgunaan yang meluas dan menyebabkan paranoid serta
psikotik pada para penyalahguna metamfetamin tersebut, menyebabkan keberadaan
metamfetamin sangan dibatasi oleh suatu badan “Federal Controlled Substances Act”
di Amerika pada tahun 1970. Pembatasan tersebut ternyata menimbulkan
permasalahan berupa tidak terpenuhinya kebutuhan para penyalahguna sehingga
timbul produksi metamfetamin secara ilegal dan disebut sebagai clandestine industry
atau clandestine laboratory.
Efek metamfetamin dalam jangka pendek antara lain meningkatkan
konsentrasi, meningkatkan aktifitas, menurunkan kelelahan, menahan rasa lapar, rasa
gembira berlebihan (euphoria), peningkatan respirasi dan peningkatan suhu badan
(hipertemia). Sedangkan efek dalam jangka panjang adalah terjadinya ketergantungan,
paranoid, halusinasi dan psikosis, gangguan mood, gangguan aktifitas motorik, stroke
dan penurunan berat badan (Mehling, 2007)
2.2.2 Tinjauan Kimia Metamfetamin
Metamfetamin dikenali dengan beberapa nama kimia sebagai (αS)-N, α-Dimethyl-
benzene ethanamine, (S)-(+)-N, α-dimethylphenethyl amine, d-N-
methylamphetamine, d-deoxyephedrine, l-phenyl-2-methylaminopropane, d-
phenylisopropylmethylamine, methyl-β-phenylisopropylamine, Norodin (Maryadele,
2006). Rumus bangun metamfetamin dapat dilihat dari Gambar 2.1 dibawah ini :
Gambar 2.1. Rumus Bangun Metamfetamin (Kovar, 1989)
Metamfetamin, C10 H15 N, memiliki berat molekul 149,23, merupakan suatu
stimulan saraf pusat. Metamfetmin umumnya tersedia dalam bentuk garam HCl dan
disebut speed, meth, ice. Dikenal pula dengan nama “crank dan crystal”(Mehling,
Pada penggunaan oral, metamfetamin diekskresikan sebagai obat tidak berubah 44%
dan segaia metabolit utamanya adalah amfetamin (6-20%) dan 4-
hidroksimetamfetamin (10%). Urin sam akan meningkatkan kecepatan ekskresi dan
persen ekskresi obat yang tidak berubah (United Nation Office on Drugs and Crime,
1995; Moffat, Osselton & Widdop, 2004).
2.2.3 Rute Sintesis Metamfetamin
Metamfetamin dapat disintesis atau diproduksi melalui beberapa rute. Sedikitnya ada
6 (enam) rute sintesis metamfetamin yang seringkali digunakan dan ditemukan dalam
produksi ilegalnya.
Berdasarkan bahan baku dasarnya, terdapat 2 (dua) grup rute sintesis
metamfetamin yaitu (a) sintesis dimulai dengan fenil-2-propanon, menghasilkan
metamfetamin rasemat, seperti rute leuckart dan reductive amination dan (b) rute
sintesis menggunakan bahan murni bersifat optis l-efedrin atau d-pseudoefedrin
sebagai bahan baku awal menghasilkan d-metamfetamin yang efek stimulannya lebih
baik. Rute yang digunakan adalah Nagai route, Birch reduction, Rosenmund
hydrogenation dan Emde route dengan kloro efedrin sebagai produk intermediet
(Remberg&Stead, 1999).
Salah satu senyawa kimia yang sangat popular digunakan pada sintesis
metamfetamin adalah fenil-2-propanon. Rute sintesis metamfetamin dengan senyawa
ini sangat mudah yang disebabkan oleh struktur senyawa yang relatif sederhana dan
juga sudah popular penggunaannya. Senyawa fenil-2-propanon ini sangat mudah
disintesis dari benzil sianida, asam fenil asetat, kloroaseton ataupun benzil klorida dan
asetonitril ( United Nations on Drug and Crime, Characterization/Impurity Profiling of
Methamfetamine Tablets In South-East Asia).
Senyawa/bahan kimia lain yang digunakan sebagai bahan awal sintesis
metamfetamin adalah efedrin serta pseudoefedrin. Senyawa ini secara ilegal telah
lama digunakan dalam produksi metamfetamin. Namun larutan efedrintidak stabil
terhadap sinar matahari langsungdan oksigen. Oksidasi efedrin atau pseudoefedrin
United Nations on Drug and Crime, Characterization/Impurity Profiling of
Methamfetamine Tablets In South-East Asia).
Pengalaman menunjukkan bahwa perubahan kecil dalam sintesis dapat
berpengaruh pada formasi yang dihasilkan dan tentunya mempengaruhi kompleksitas
pengotornya. Hal-hal yang mempengaruhi profil pengotor dalam metamfetamin hasil
akhir dari sintesis antara lain : a) temperatur reaksi, b) waktu reaksi, c)skala reaksi dan
proporsi bahan kimia awal yang digunakan dan d)tingkatan dan cara pemurnian
produk intermediet dan produk akhir (Remberg&Stead, 1999) .
2.2.4. Mekanisme Kerja
Metamfetamin adalah senyawa yang mempunyai efek simpatomimetik tak langsung
dengan aktivitas sentral maupun perifer. Strukturnya sangat mirip dengan katekolamin
endogen seperti epinefrin, norepinefrin dan dopamin. Efek alfa dan beta adrenergik
disebabkan oleh keluarnya neurotransmiter dari daerah presinap. Metampetamin juga
mempunyai efek menghalangi re-uptake dari katekolamin oleh neuron presinap dan
menginhibisi aktivitas monoamin aksidase, sehingga konsentrasi dari neurotransmitter
cenderung meningkat dalam sinapsis. Mekanisme kerja metampetamin pada susunan
saraf pusat dipengaruhi oleh pelepasan biogenik amine yaitu dopamin, norepinefrin
dan serotonis atau ketiganya dari tempat penyimpanan pada presinap yang terletak
pada akhiran saraf. Efek yang dihasilkan dapat melibatkan neurotransmitter atau
sistim monoamine oxidase (MAO) pada ujung presinaps saraf.
2.2.5 PATOFISIOLOGI
Penggunaan metampetamin kronis dan dosis tinggi menimbulkan perubahan toksik
secara patofisiologi. Efek toksik penggunaan metampetamin kronis dengan dosis
tinggi terhadap:
a. Otak
Penggunaan metampetamin secara kronis dengan dosis tinggi akan
kawan melakukan penelitian pada kera dengan menyuntikkan sebanyak 8kali/hari
(dosis 3-6,5 mg/kg) selama 3-6 bulan. Setelah 24 jam pemberian dosis terakhir
memperlihatkan kekosongan norepinefrin pada semua bagian otak (pons, medula, otak
tengah, hipothalamus dan korteks frontal). Setelah 3-6 bulan suntikan terakhir,
norepinefrin masih tetap rendah di otak tengah dan korteks frontal. Sedangkan pada
hipothalamus dan pons kadar norepinefrin sudah meningkat. Kadar dopamin
terdepresi hanya pada darah, bagian otak lain tidak terpengaruh. Kondisi toksik
metampetamin ini juga mempengaruhi sistim serotoninergik, hal ini diperlihatkan
dengan perubahan aktivitas triptophan hidroksilase terutama pada penggunaan
fenfluramin. Rumbaugh melaporkan pada pemakaian amfetamine kronis dengan dosis
tinggi mempengaruhi vaskularisasi otak. Penelitian pada kera yang diberi injeksi
metamfetamin selama 1 tahun menunjukkan perubahan yang luas dari arteriola kecill
dan pembuluh kapiler.
b. Perifer
Efek yang menonjol adalah terhadap kerja jantung. Katekolamin
mempengaruhi sensitivitas miokardium pada stimulus ektopik, karena itu akan
menambah resiko dari aritmia jantung yang fatal. Efek perifer yang lain adalah
terhadap pengaruh suhu (thermo-regulation). Amfetamine mempengaruhi pengaturan
suhu secara sentral di otak oleh peningkatan aktivitas hipothalamus anterior. Penyebab
kematian yang besar pada toksisitas amfetamine disebabkan oleh hiperpireksia.
Mekanisme toksisitas dari amfetamine terutama melalui aktivitas sistim saraf simpatis
melalui situmulasi susunan saraf pusat, pengeluaran ketekholamin perifer, inhibisi re
uptake katekholamine atau inhibisi dari monoamin aksidase. Dosis toksik biasanya
hanya sedikit diatas dosis biasa. Amfetamine juga merupakan obat/zat yang sering
disalahgunakan.
Efek amfetamine yang berhubungan dengan penyalahguaan dapat dibedakan
dalam 2 fase:
1. Fase awal Selama fase ini efek akut dari amfetamine ditentukan oleh
efek farmakologinya (pelepasan dopamin) dan akan menimbulkan:
a) Euforia
b) Energi yang meningkat
Efek ini timbul sesaat setelah mengkonsumsi
2. Fase konsilidasi Konsumsi yang lama dan intermiten, membuat
individu akan meningkatkan dosis untuk mendapatkan efek yang lebih
besar. Pada pemakaian yang terus-menerus individu akan meningkatkan
frekuensi dan dosis zat untuk merasakan flash atau rush dari penggunaan
amphetamine. Selama masa transisi penggunaan dosis tinggi, individu
menggunakan amfetamine yang bereaksi cepat, yaitu secara intravena atau
dihisap.
2.3.Sonikasi
Sonikasi termasuk kedalam ekstraksi cair-cair. Pada ektraksi cair-cair, satu komponen
bahan atau lebih dari suatu campuran dipisahkan dengan bantuan pelarut. Ekstraksi
cair-cair terutama digunakan bila pemisahan campuran dengan cara destilasi tidak
mungkin dilakukan misalnya karena pembentukan azeotrop atau karena kepekaannya
terhadap panas atau tidak ekonomis. Seperti ekstraksi padat-cair, ekstraksi cair-cair
selalu terdiri dari sedikitnya dua tahap, yaitu pencampuran secara intensif bahan
ekstraksi dengan pelarut dan pemisahan kedua fase cair itu sesempurna mungkin.
Sonikasi memanfaatkan gelombang ultrasonik dengan frekuensi 42kHz yang dapat
mempercepat waktu kontak antara sampel dan pelarut meskupun pada suhu ruang. Hal
ini menyebabkan proses perpindahan massa senyawa bioaktif dari dalam sel tanaman
ke pelarut menjadi lebih cepat. Sonikasi mengandalkan energi gelombang yang
menyebabkan proses kavitasi, yaitu proses pembentukan gelembung-gelembung kecil
akibat adanya transmisi gelombang ultrasonik untuk membantu difusi pelarut kedalam
dinding sel tanaman .(Ashley, et.al ,2001). Metode ekstraksi sonikasi juga efisien dan
mempersingkat waktu ekstraksi (Melecchi et al.2006)
Energi dalam ultrasonik merupakan intensitas gelombang ultrasonik yang
merambat dan membawa energi pada suatu luas permukaan per satuan waktu. Jika
energi gelombang ultrasonik tersebut melalui jaringan, maka akan melepaskan energi
kalor sehingga terjadi pemanasan yang mengakibatkan suhu jaringan meningkat dan
kemudian menimbulkan efek kavitasi, yaitu pembentukan, pertumbuhan dan pecahnya
mendekati atau pada permukaan solid, maka permukaan solid tersebut memberikan
resistensi terhadap aliran cairan. (Bendicho, 2000)
Sedangkan kelemahan metode sonikasi yaitu harganya yang mahal dan
membutuhkan proses curing (Ulilalbab, 2012). Proses curing pada prinsipnya
merupakan suatu proses terjadinya reaksi kimia awal jaringan ikat kolagen kulit
dengan bahan curing baik dengan menggunakan bahan curing asam, basa ataupun
enzim. Proses curing menyebabkan struktur ikatan intermolekuler dan intramolekuler
pada protein kolagen kulit melemah ataupun terjadi proses pemutusan rantai ikatan
asam amino secara parsial (Kolodziejska,2007;Hidayat,2008)
Gambar 2.2 menunjukkan perangkat ultrasonik yang paling umum digunakan
saat ini dalam aplikasi analitis. Tidak semua perangkat berkinerja sama dan tidak
semua ditujukan untuk aplikasi yang sama. Oleh karena itu, hal pertama yang perlu
ketika mengembangkan kimia analitik dengan bantuan ultrasonikasi adalah
pengetahuan tentang perbedaan antara peralatan ultrasonik yang tersedia, terutama
dari keuntungan dan kerugian yang telah diperkirakan untuk masing-masing.
[image:41.595.159.474.438.579.2]2009) (Luis,
Gambar 2.2 Teknologi ultrasonik : (a) probe kaca silika; (b) probe spiral; (c) probe ganda; (d) sonoreaktor; (e) dan (f) prob multi; (g) horn microplate; (h) horn cup
2.3.1. Kavitasi
Suara, termasuk ultrasonik, yang diteruskan melalui media fisik oleh gelombang yang
mengkompresi dan meregangkan jarak molekul dari medium yang dilalui hilang.
Karena ultrasound yang melalui medium pada Gambar 2.2 dimana jarak rata-rata
rata mereka. Bila tekanan negatif yang ditimbulkan karena gelombang ultrasonik
melintasi cairan cukup besar, maka jarak antara molekul cairan melebihi molekul
minimum jarak yang dibutuhkan untuk menahan cairan tetap utuh, dan kemudian
cairan akan pecah dan turun ke bawah dan ruang kosong dibuat. Ruang kosong itu
yang disebut gelembung kavitasi. Karna cairan mengalami kompresi dan peregangan,
maka gelembung kavitasi dapat berperilaku dalam dua cara. Pada bagian pertama,
yang disebut kavitasi stabil, gelembung terbentuk pada ultrasonik yang cukup rendah
dengan intensitas osilasi (10–3 W cm-2 ) mengenai beberapa ukuran keseimbangan
bagi banyak siklus akustik. Pada bagian kedua, yang disebut kavitasi sementara,
gelembung terbentuk menggunakan suara intensitas lebih dari 10 W cm-2 .
(Luis, 2009)
Gambar 2.2 (a) Pergeseran grafik (x); (b) Kavitasi Sementara; (c) Kavitasi Sementara; (d) Kavitasi Stabil; (d) Tekanan grafik (P)
Dari sudut pandang kimia analitik, efek yang paling menarik mengenai
ultrasonikasi berhubungan erat dengan kavitasi. Kavitasi menyebabkan zat terlarut
termolisis bersamaan dengan pembentukan radikal yang sangat reaktif dan reagen,
seperti radikal hidroksil dan hidrogen peroksida, yang menginduksi kondisi reaktif
drastis dalam media cairan.
Secara umum, ultrasonikasi membantu analisis kimia dengan:
1.meningkatkan ekstraksi padat-cair suatu unsur;
2. memperpendek skema ekstraksi sekuensial untuk penentuan unsur
[image:42.595.130.499.290.515.2]
4. mempercepat ekstraksi padat-cair spesies organik
5. mempercepat pengukuran elektroanalitik dengan meningkatkan transportasi
efesiensi massa
6. mempercepat reaksi enzimatik
7. mempercepat teknik ekstraksi cair-cair
8. meningkatkan kinerja dalam ekstraksi fase padat dan microekstraksi
9. meningkatkan akurasi dalam teknik dispersi matrix padat.
2.3.2. Faktor-faktor yang mempengaruhi kavitasi ultrasonik
Adapun faktor-faktor yang mempengarui kavitasi ultrasonik adalah sebagai berikut :
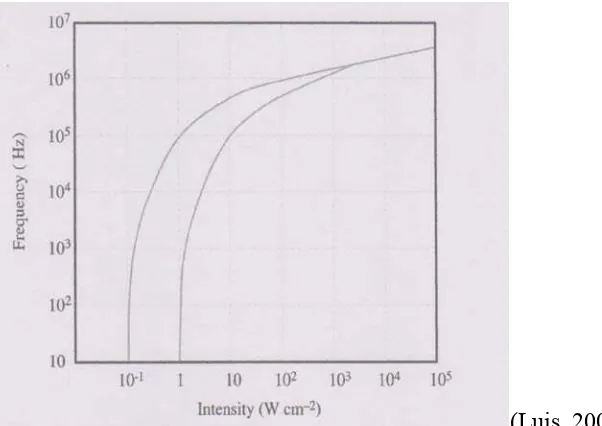
1. Frekuensi
Pada frekuensi sonik yang tinggi, pada urutan MHz, produksi kavitasi
gelembung menjadi lebih sulit dari pada frekuensi sonik yang rendah, dari urutan kHz
.
Untuk mencapai kavitasi, dengan meningkatnya frekuensi sonik, maka intensitas suara
yang dipakai harus ditingkatkan, untuk memastikan bahwa kekuatan kohesif dari
media cair dapat diatasi dan ruang kosong dapat diciptakan. Fenomena ini dapat
dengan mudah dipahami dengan melihat Gambar 2.3, yang menunjukkan variasi
frekuensi ambang terhadap intensitas aerasi air dan udara bebas air. Seperti yang bisa
dilihat, kekuatan yang
diperlukan sepuluh kali untuk menginduksi kavitasi dalam air pada 400 kHz daripada
10 kHz. Penjelasan fisik untuk ini terletak pada kenyataan bahwa, pada frekuensi yang
sangat tinggi, siklus kompresi dan dekompresi disebabkan oleh gelombang ultrasonik
menjadi begitu pendek sehingga molekul cairan tidak dapat dipisahkan untuk
[image:44.595.196.497.84.297.2]
. (Luis, 2009)
Gambar 2.3 Variasi intensitas sonikasi terhadap frekuensi ambang
2. Intensitas
Intensitas sonikasi berbanding lurus dengan amplitudo getaran ultrasonik dan dengan
demikian, kenaikan dalam amplitudo getaran akan menyebabkan peningkatan
intensitas getaran dan peningkatan efek sonokimia . Untuk mencapai ambang kavitasi,
intensitas minimum diperlukan. Ini berarti bahwa amplitudo yang lebih tinggi tidak
selalu diperlukan untuk mendapatkan hasil yang diinginkan. Di samping itu,
amplitudo tinggi sonikasi dapat menyebabkan kerusakan yang cepat dari transduser
ultrasonik, mengakibatkan agitasi cairan daripada kavitasi dan transmisi yang lemah
dalam ultrasonik melalui media cairan. Akan tetapi, amplitudo harus meningkat
ketika bekerja dengan sampel yang memiliki viskositas tinggi, seperti darah. Hal ini
karena saat viskositas sampel meningkat demikian juga hambatan dari sampel ke
perpindahan perangkat ultrasonik, misalnya ujung probe ultrasonik. Oleh karena itu,
intensitas tinggi (yaitu, amplitudo tinggi) diperlukan untuk mengatur perangkat
ultrasonik untuk mendapatkan getaran mekanik yang diperlukan sehingga dapat
mendorong kavitasi dalam sampel.
3. Pelarut
Pelarut yang digunakan untuk melakukan penanganan sampel dengan ultrasonikasi
harus hati-hati dipilih . Sebagai aturan umum, sebagian besar aplikasi dilakukan di
organik, dapat juga digunakan, tergantung pada tujuan yang diinginkan. Kedua
viskositas pelarut dan tegangan permukaan diharapkan untuk menghambat kavitasi.
Semakin tinggi kekuatan kohesif alami yang bertindak dalam cairan (misalnya, tinggi
viskositas dan tegangan permukaan tinggi), semakin sulit adalah untuk mencapai
kavitasi.
4. Temperatur
Suhu pelarut memainkan dua peran dalam ultrasonikasi. Di satu sisi, suhu yang tinggi
membantu untuk mengganggu interaksi zat terlarut-matrix yang kuat, yang melibatkan
gaya Van der Waals, ikatan hidrogen dan atraksi dipol antara molekul zat terlarut dan
situs aktif pada matriks. Selain itu, tingkat difusi lebih cepat terjadi pada suhu yang
lebih tinggi. Di sisi lain, kavitasi lebih baik dicapai pada suhu yang lebih rendah
ketika kekuatan ultrasonik dari generatoris adalah konstan. Hal ini karena suhu pelarut
naik sehingga untuk melakukan tekanan uap dan begitu banyak uap pelarut mengisi
gelembung kavitasi, yang kemudian cenderung jatuh kurang keras, yaitu, efek
sonikasi kurang intens dari yang diharapkan. Oleh karena itu kompromi antara suhu
dan kavitasi harus dicapai. Misalnya, rasio ekstraksi hidrokarbon aromatik polisiklik
dari sedimen yang meningkat antara 6% dan 14% saat ekstraksi ultrasonik dengan
probe dilakukan di bawah kondisi non-pendinginan.
2.4 Ekstraksi cair-cair (Liqud-liquid Extraction)
Salah satu metode populer dari pemisahan suatu analit dalam sampel cairan yang
kompleks adalah teknik yang dikenal dengan ekstraksi cair-cair atau ekstraksi cair-
padat. Dalam ekstraksi cair-cair, cairan yang mengandung analit (biasanya air) dibawa
dalam kontak dengan pelarut cair (biasanya pelarut organik nonpolar) yang tidak larut
dengan pelarut pertama. Wadah yang digunakan adalah biasanya corong pisah. Karena
dua pelarut tidak bercampur, ada dua lapisan cairan dalam corong pisah.
Menggoncang corong pisah menyebabkan dua pelarut kedalak kontak yang menyatu
sehingga analit kemudian berpindah dari pelarut pertama menuju pelarut
kedua.Karena tidak saling bercampur, dua lapisan dapat kemudian dipisahkan dari
satu sama lain dengan membiarkan kedua lapisan untuk mengeluarkan satu lapisan
melalui stopcock pada bagian bawah corong. Larutan yang diinginkan selanjutnya
2.4.1 Kestabilan Sampel
Apabila sampel tidak dibawa selanjutnya melalui prosedur metode analitik karena
analit yang tidak stabil, menjadi penting untuk melindungi sampel dari dekomposisi
dalam beberapa bagian atau membuat derivat analit. Perlindungan dari dekomposisi
dapat berarti menyimpan sampel seperti sampel biologik kedalam kulkas, menghindari
dari cahaya , menghindari dari paparan terhadap udara atau kelembaban. Derivatisasi
analit adalah secara kimia mengubah analit kedalam bentuk yang stabil sehingga
kuantitas analit dapat ditentukan secara tidak langsung melalui analisis derivat
(Kenkel,J.2003)
2.5 Analisis Narkotika dari sampel Rambut
Analisis dari senyawaan narkotika menggunakan sampel rambut memiliki peranan
yang sangat penting dalam bidang toksikologi forensik terhadap riwayat
penyalahgunaan narkotika. Obat-obatan dapat terdeteksi beberapa bulan setelah
konsumsi terakhir, karena obat-obatan tersebut memasuki akar rambut melalui kapiler
dan akan tertanam di batang rambut, dimana rata-rata pertumbuhannya 0.9-1.2 cm per
bulan. Oleh karena itu, rambut dapat digunakan sebagai “kalender” dari kegiatan masa
lalu dalam obat-obatan.
Kelebihan dari analisis rambut dibandingkan dengan uji darah, urin, dan saliva
adalah sebagai berikut :
1. Rambut memiliki kemampuan untuk menyerap zat-zat eksogen menuju batang
rambut dimana zat-zat eksogen tersebut tetap tidak berubah selama beberapa
tahun berlawanan dengan matriks tradisional dimana materi dalam 24 jam
akan terjadi tanda eliminasi atau dekomposisi analit.
2. Uji dengan menggunakan rambut, penarikan sampel dan pengangkutan mudah.
Penarikan sampel tidak bersifat invasive, tanpa ketidaksesuaian terhadap
subjek, dan dilakukan dengan peralatan sederhana. Transportasi tidak
membutuhkan kondisi khusus, hanya dengan nenggunakan aluminium foil dan
3. Sampel rambut sangat sulit untuk dipalsukan sehingga sangat bermanfaat
dalam kasus-kasus forensik.
Dengan fasilitas laboratorium yang maju, sedikit dan sedikit jumlah sampel akan
terdeteksi dalam rambut dan demikian beberapa senyawa-senyawa lain yang
berbahaya akan menarik perhatian analis. Kelemahan dalam analisis rambut yang
diketahui dan harus dipertimbangkan :
1. Sulit untuk mempersiapkan standar rambut referensi yang mengandung
konsentrasi akurat obat yang diperlukan untuk kalibrasi.
2. Efisiensi ekstraksi obat dari matriks padat adalah sangat penting dan parameter
ini perlu dievaluasi untuk setiap jenis obat dalam setiap laboiratorium.
Standarisasi dekontaminasi dan prosedur ekstraksi juga diperlukan.
3. Standar kerja minimum harus ada dalam berbagai laboratorium
(Abdi,dkk.,2004)
2.6. Rambut
2.6.1. Struktur Rambut
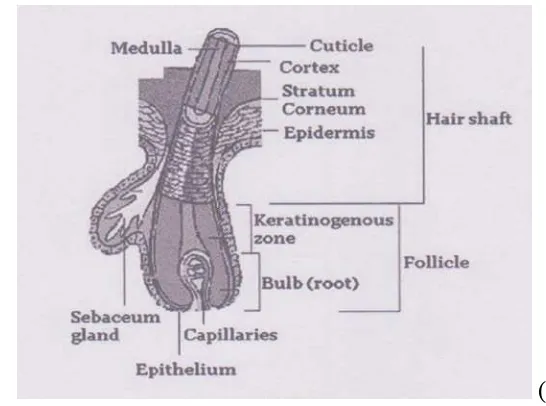
Analisis rambut merupakan masalah yang lebih rumit. Rambut dapat
dibedakan menjadi bagian-bagian sebagai berikut yang dapat dilihat pada Gambar 2.4
dibawah ini :
a. Folikel Rambut, yaitu suatu tonjolan epidermis kedalam berupa tabung yang
meliputi :
1. Akar rambut (folicullus pili), yaitu bagian rambut yang tertanam secara
miring di dalam kulit dan terselubung oleh folikel rambut.
2. Umbi rambut (bulbus pili), yaitu ujung akar rambut terbawah yang
melebar. Bagian terbawah umbi rambut adalah matriks rambut, yaitu
daerah yang terdiri dari sel-sel yang membelah dengan cepat dan berperan
dalam pembentukan batang rambut.
b. Batang rambut, yaitu bagian rambut yang berada di atas permukaan kulit
berupa benang-benang halus yang terdiri dari zat tanduk atau keratin. Batang
rambut terdiri ata 3 bagian, yaitu kutikula (selaput rambut), korteks(kulit
c. Otot penegak rambut (muskulus arector pili) merupakan otot polos yang berasal
dari batas dermo-epidermis dan melekat di bagian bawah kandung rambut.
[image:48.595.173.446.124.327.2]
Gambar 2.4 Struktur Rambut
(Abdi, 2004)
2.6.2 Pertumbuhan Rambut
Batang rambut diawali dalam sel yang terletak di pusat germinasi yang disebut
matriks, yang terletak di dasar folikel. Rambut tidak tumbuh terus-menerus, tetapi
dalam siklus, bergantian antara periode pertumbuhan dan peristirahatan. Sebuah
folikel yang secara aktif menghasilkan rambut dikatakan berada dalam fase anagen.
Rambut dihasilkan selama 4 hingga 8 tahun untuk rambut kepala (<12 bulan untuk
rambut bukan kepala) dengan laju sekitar 0.22 hingga 0.52 mm/hari atau 0.6 hingga
1.42 cm/bulan (Saitoh, 1969) untuk rambut kepala (laju pertumbuhan bergantung
pada tipe rambut dan lokasi anatomi). Setelah periode ini dikenal sebagai fase
katagen, selama pembelahan sel berhenti dan folikel mulai mengalami degenerasi.
Selanjutnya fase transisi, folikel rambut memasuki periode peristirahatan atau diam,
dikenal sebagai fase telogen (10 minggu), selama batang rambut berhenti tumbuh
sepenuhnya dan pertumbuhan rambut mulai terhenti. Faktor-faktornya adalah ras,
kondisi penyakit, kekurangan nutrisi dan usia dikenal mempengaruhi baik laju
pertumbuhan dan lamanya periode istirahat. Pada kulit kepala orang dewasa, sekitar
85% rambut berada dalam fase pertumbuhan dan 15% sisanya dalam keadaan
2.6.3 Faktor-faktor yang mempengaruhi penggabungan obat-obatan
Ada tiga faktor yang mempengaruhi penggabungan obat-obatan kedalam rambut ,
yaitu :
1. Kandungan melanin dalam rambut .pH melanosit berada diantara 3 dan 5 dan
afinitas melanin yang signifikan untuk obat dasar telah dibuktikan dalam
beberapa penelitian eksperimental baik dengan hewan dan manusia atau in
vitro .
2. Polaritas obat atau metabolitnya .Telah beberapa kali didokumentasikan bahwa
metabolit yang lebih polar seperti benzoylecgonin, morfin, atau amfetamin
memasuki rambut dalam jumlah yang lebih sedikit dibandingkan prekursor
yang lebih lipofilik seperti kokain atau 6-monoasetilmorfin atau
metamfetamin.
3. Keasaman atau kebasaan suatu zat obat adalah faktor penting. Matriks rambut
lebih asam dibandingkan darah pH 7.4. Oleh karena itu gradient pH lebih
sesuai untuk transfer basa dibandingkan molekul netral atau asam. Sebagai
contoh, keasamaan metabolit karboksi dalam delta-9-tetrahidrokanabinol
masuk ke dalam rambut hanya dalam jumlah yang sangat sedikit
(Balikova,M.2005)
Senyawa narkotika yang merupakan hasil metabolit juga akan terdapat dalam
rambut sesuai dengan waktu pemakaiannya. Setelah pemakaian 7 (tujuh) hari
narkotika akan terdeteksi pada dasar rambut dan selanjutnya dengan bertambahnya
waktu akan terus naik ke ujung rambut. Hal inilah yang dapat memberikan informasi
berapa lama seorang pemakai mengkonsumsi narkotika sehingga akan diketahui
dengan mudah riwayat penggunaan narkotikia tersebut. (Romadhon, 2011)
2.6.4. Biologis Rambut
Rambut adalah produk dari organ yang dibedakan dalam kulit mamalia.
Rambut berbeda dalam setiap individu hanya dalam warna, kuantitas dan tekstur.
Rambut memiliki kandungan utama protein (65 hingga 95%, pada dasarnya keratin),
dalam rambut sekitar 0.25 hingga 0.95%. Total jumlah folikel rambut dalam rambut
dewasa diperkirakan sekitar 5 juta, dengan 1 juta ditemukan di kepala (Harvey, 1989).
Folikel rambut tertanam dalam epidermis epitelium kulit, sekitar 3 hingga 4mm
dibawah permukaan kulit (Clarke, 2004).
2.7. Mekanisme Penggabungan Obat Menuju Rambut
Mekanisme penggabungan obat-obatan secara umum, diakui bahwa obat-
obatan dapat masuk kedalam rambut melalui dua proses yaitu adsorpsi dari
lingkungan luar dan penggabungan menjadi pertumbuhan batang rambut dari darah
yang menghasilkan folikel rambut. Obat-obatan dapat masuk ke rambut dari paparan
aerosol kimia. Sekresi dari keringat dan kelenjar minyak. Rambut sangat berpori dan
dapat meningkat massanya hingga 18% dengan mengabsorpsi cairan, obat-obatan
dapat ditransfer dengan mudah kedalam rambut melalui keringat. Zat kimia yang ada
dalam udara (asap,uap,dll) dapat didepositkan keatas rambut. Obat tampaknya
dimasukkan kedalam rambut melalui 3 mekanisme :
1. Dari darah selama pembentukan rambut
2. Dari keringat dan sebum
3. Dari lingkungan luar
Petunjuk transfer obat-obatan melalui keringat dan sebum adalah bahwa obat-
obatan dan metabolit hadir dalam keringat dan sebum pada konsentrasi yang tinggi
dan tetap dalam sekresi lebih lama dibandingkan didalam darah.
Mekanisme yang tepat melalui bahan-bahan kimia menuju rambut tidak diketahui. Hal
tersebut telah disarankan bahwa difusi pasif dapat diperbesar melalui ikatan obat-
obatan menuju menuju komponen intraseluler sel rambut, seperti pigmen rambut
melanin. Kandungan melanin (Kronstrand, 1999). Bagaimanapun, tidak mungkin
hanya mekanisme ini, karena obat-obatan tertahan didalam rambut hewan albino yang
kekurangan melanin.Mekanisme lain yang ditujukan adalah ikatan obat-obatan dengan
sulfidril,kandungan asam amino yang ada dalam rambut. Banyak sekali asam amino,
seperti sistin, dalam rambut bentuk ikatan silang ini S-S untuk menstabilkan jaringan
fiber protein. Obat-obatan yang menyebar kedalam sel rambut dapat membatasi cara
2.8 Pengumpulan Spesimen
Prosedur pengumpulan untuk analisa rambut untuk obat-obatan belum dibakukan.
Dalam banyak penyelidikan yang dipublikasikan, sampel didapat kan dari lokasi yang
acak pada kulit kepala. Rambut yang baik dikumpulkan dari area belakang kepala,
yang disebut dengan posterior vertex. Dibandingkan dengan area lain pada kepala,
area ini memiliki keadaan yang sedikit berubah-ubah dalam laju pertumbuhan rambut,
jumlah rambut dalam fase pertumbuhan lebih konstan dan rambut kurang tunduk
terhadap usia dan pengaruh seks terkait. Helaian rambut dipotong sedekat mungkin
dari kulit kepala, dan lokasinya pada kulit kepala dicatat. Pengumpulan pertama,
sampel rambut disimpan pada temperatur ambient dalam aluminium foil, amplop atau
tabung plastik. Ukuran sampel diambil bermacam-macam jauh lebih antara
laboratorium dan bergantung pada obat-obatan yang akan dianalisis dan metodologi
tesnya. Sebagai contoh, ketika fentanil atau buprenorpin diselidiki, 100mg sampel
disarankan. Ukuran sampel dilaporkan dalam beberapa literatur dari satu rambut
hingga 200mg, dipotong sedekat mungkin dengan kulit kepala. Ketika menurut bagian
analisis dilakukan, rambut dipotong menjadi bagian-bagian sekitar 1,2 atau 3 cm, yang
mirip dengan sekitar 1,2 atau 3 bulan pertumbuhan (Clarke, 2004)
2.9. Identifikasi ATS Secara Kualitatif
Upaya untuk menentukan identitas obat, pendekatan analitis harus memerlukan
penentuan setidaknya menggunakan dua parameter. Hal ini diakui bahwa pemilihan
parameter dalam kasus tertentu akan mempertimbangkan obat yang terlibat dan
sumber daya laboratorium yang tersedia untuk analis.
2.9.1. Test Presumtif
Test presumtif merupakan prosedur skrining yang cepat terdiri dari dua atau tiga test
independen yang memberikan indikasi ada atau tidak adanya obat dalam sampel uji.
Test presumtif ini baik, karena semua teknik analisis ,memaksimalkan kemungkinan
presumtif tidak dianggap cukup untuk identifikasi obat dan hasil harus dikonfirmasi
dengan test laboratorium tambahan.
Test presumtif yang lebih sering digunakan sebagai uji lapangan adalah test
warna, meskipun juga dilakukan di laboratorium sebagai prosedur skrining .Untuk
ATS test skrining, test warna, atau test spot, biasanya dilakukan, meskipun test
immunoassay dan sejumlah teknik instrumental cepat dan portable juga tersedia. Test
warna merupakan test kimia sederhana dan tercepat yang dapat diterapkan pada
sampel. Kebanyakan test warna sangat sensitive, hanya beberapa menit yang
diperlukan untuk menyelesaikan test yang sukses, dan sering hasil terbaik diperoleh
dengan jumlah sampel terkecil, sering kurang dari satu mg.
Karena sampel dapat bervariasi dalam kemurnian (konsentrasi ATS), dan zat-
zat yang tidak terkait mungkin ada, warna yang ditunjukkan oleh test ini harus
ditafsirkan dengan hati-hati. Uji Marquis memungkinkan perbedaan antara
amphetamine dan cincin analog tersubstitusi.Tes Simon umumnya digunakan sebagai
tes untuk amina sekunder, seperti cincin methamphetamine dan amfetamin
tersubstitusi sekunder, termasuk MDMA dan MDE. Namun, amina sekunder lainnya,
misalnya, dietilamina dan piperidin, dapat memberikan warna yang sama. Secara
umum, warna yang intens namun mungkin memudar di hadapan beberapa
kotoran.Penting untuk analis mengkonfirmasi hasil tes Simon dengan melakukan tes
tambahan, misalnya tes Marquis.
Uji Marquis
i. Tempatkan sejumlah kecil (1-2mg bubuk atau 1-2 tetes cairan) di piring spot.
ii. Tambahkan satu tetes reagen Marquis 1 yaitu 8-10 tetes (sekitar 0.25 ml)
formaldehid 37% kedalam 10 ml asam asetat glasial, satu tetes reagen 2 yaitu
asam sulfat pekat dan aduk.
iii. Amati warna.
Uji Simon
i. Tempatkan sejumlah kecil (1-2mg bubuk atau 1-2 tetes cairan) dari bahan
ii. Tambahkan satu tetes reagen Simon 1 dan aduk
iii. Tambahkan satu tetes reagen Simon 2 dan kemudian satu tetes reagen 3
iv. Amati warna
2.9.2. Pereaksi Marquis dengan Metamfetamin
Pereaksi Marquis digunakan untuk penentuan secara kualitatif senyawa aromatik
seperti metamfetamin (8). Ion karbonium (9), yang dibentuk dari formaldehid,
bereaksi dengan struktur aromatik dari senyawa. Dibawah pengaruh asam sulfat, ion
karbenium (11) dihasilkan dan distabilkan melalui reaksi dengan molekul kedua dari
komponen aromatik. Kehadiran logam berat dalam asam sulfat, seperti besi,
menyebabkan oksidasi (12) ke (13). Karena media (13) asam, maka dihasilkan ion
karbenium berwarna hijau kekuningan (14) yang dapat dilihat pada Gambar 2.5
dibawah ini :
[image:53.595.110.481.394.685.2]8 ,1989)
Gambar 2.5 Tahapan Pembentukan Ion Karbenium
BAB 1
PENDAHULUAN
I.1. Latar Belakang
Istilah narkoba sudah tidak asing lagi dalam keseharian masyarakat kita. Menurut UU
RI No. 35 tahun 2009 narkotika adalah zat atau obat yang berasal dari tanaman atau
bukan tanaman, baik sintesis maupun semisintesis yang dapat menyebabkan
penurunan atau perubahan kesadaran,hilangnya rasa, mengurangi sampai
menghilangkan rasa nyeri dan dapat menimbulkan ketergantungan yang dibedakan
kedalam golongan-golongan sebagaimana yang terlampir dalam undang-undang.
Metamfetamin merupakan psikotropika golongan 2 yang merupakan obat
stimulan yang dapat mempengaruhi dengan kuat sistem saraf pusat yang menimbulkan
efek adiksi bila dikonsumsi. Menurut data terakhir dari Badan Narkotika Nasional
(BNN) Tahun 2012, jenis narkoba yang paling banyak digunakan oleh pecandu yang
mendapatkan pelayanan terapi dan rehabilitasi adalah sabu – sabu / metamfetamin
(4.697 orang), selanjutnya secara berurutan adalah jenis ganja (4.175 orang), heroin
(3. 455 orang), ekstasi (1.536 orang) dan opiat (736 orang). Berdasarkan data dari
Badan Narkotika Nasional (BNN) tahun 2015 diperoleh bahwa sampai dengan Januari
2015 pengguna narkotika mencapai 5.800.000 jiwa dengan 2.320.000 jiwa pengguna
sabu – sabu. Di Sumatera Utara tercatat 288.226 Jiwa pengguna dengan 115.290
pengguna sabu – sabu. Di kalangan pelajar sendiri tercatat 104.269 jiwa dengan
87.800 adalah pengguna sabu – sabu (Syamsudin, 2015).
Jumlah kasus penyalah gunaan obat terlarang di Indonesia dalam lima tahun
terakhir paling didominasi oleh metamfetamin, dimana jumlah kasusnya meningkat
lebih dari 1000 kasus per tahun. Pemeriksaan narkotika di laboratorium sangat
memerlukan metode – metode yang cukup teruji dengan hasil yang optimal (Hegstd,
2008). Sampel yang digunakan saat analisa dapat meliputi tanaman yang
pemakai.Sampel hasil metabolit yang digunakan juga bervariasi tergantung dari
kebutuhan pemeriksaan.Untuk senyawa hasil metabolit ini memerlukan perlakuan
khusus untuk mendapatkan hasil analisis yang optimal. Dalam hal ini, metode
standard dalam analisis narkotika jenis sabu-sabu sangat diperlukan untuk
memastikan apakah seseorang itu pernah menggunakan narkotika ataupun tidak.
(Rosani, 2003).
Ekstraksi merupakan metode pemisahan suatu zat terlarut secara selektif dari
suatu bahan dengan pelarut tertentu. Pemilihan metode yang tepat tergantung pada
tekstur, kandungan air tanaman yang diekstraksi dan jenis senyawa yang akan
diisolasi.( Harborne, 1987). Ekstraksi dapat dibagi menjadi 2 (dua), yaitu ekstraksi
padat-cair dan ekstraksi cair-cair. Pada ekstraksi padat-cair, satu atau beberapa
komponen yang dapat larut dipisahkan dari bahan padat dengan bantuan pelarut
sedangkan pada ekstraksi cair-cair, zat terlarut atau solut dipisahkan dari cairan
pembawa(diluen) menggunakan pelarut(solven) cair. Campuran diluen dan solven ini
merupakan campuran yang heterogen yang jika dipisahkan akan menghasilkan dua
fase yaitu fase diluen (rafinat) dan fase solven ( ekstrak). Seperti halnya pada proses
ekstraski padat-cair, ekstraksi cair-cair selalu terdiri atas sedikitnnya dua tahap yaitu
pencampuran bahan ekstraksi dengan pelarut dan pemisahan kedua fasa cair itu
sesempurna mungkin.
Pada saat pencampuran terjadi perpindahan massa yaitu ekstrak
meninggalkan pelarut yang pertama (media pembawa) kemudian masuk kedalam
pelarut kedua (media ekstraksi). Bahan ekstraksi dan pelarut tidak boleh saling
melarutkan atau ketika pun terjadi proses pelarutan hanya dalam jumlah yang sangat
kecil. Agar terjadi perpindahan massa yang baik maka haruslah diusahakan agar luas
kontak yang besar di antara kedua cairan tersebut.
Sonikasi merupakan salah satu metode ekstraksi cair-cair yang
memanfaatkan gelombang ultrasonik dengan frekuensi 42 kHz yang dapat
mempercepat waktu kontakantara sampel dan pelarut meskipun pada suhu ruang. Hal
ini menyebabkan proses perpindahan massa senyawa bioaktif dari dalam sampel
yang menyebabkan proses kavitasi, yaitu proses pembentukan gelumbung-gelembung
kecil akibat adanya transmisi gelombang ultrasonik untuk membantu difusi pelarut
kedalam dinding sel tanaman. (Ashley, 2001).Metode ekstraksi sonikasi juga efisien
dan mempersingkat waktu ekstraksi.(Melecchi, 2006).
Pelarut yang digunakan pada tahap sonikasi menentukan jumlah
metamfetamin yang terkandung. Dalam penelitian ini digunakan perbandingan sistem
pelarut pada tahap sonikasi. Pengaruh pelarut dipilih untuk mendapatkan hasil yang
terbaik. Pelarut polar dipakai untuk ekstraksi senyawa polar. Metamfetamin
merupakan senyawa polar sehingga dipakai pelarut polar dalam penelitian.
Berdasarkan latar belakang diatas,timbul keinginan penulis melakukan penelitian
dengan judul “Studi Awal Analisa Kualitatif Metamfetamin Dalam Rambut Pengguna
Sabu-Sabu Dengan Metode Ekstraksi Cair-Cair Dengan Sonikasi ”
I.2. Permasalahan
1. Bagaimana pengaruh perbedaan sistem pelarut terhadap sonikasi dalam analisa
kualitatif methamfetamin dalam rambut pengguna sabu-sabu?
I.3. Pembatasan Masalah
1. Sabu-sabu sebagai pembanding diambil dari Barang Bukti yang dikumpulkan di
Laboratorium Forensik Cabang Medan.
2. Sampel rambut diambil dan dikumpulkan secara acak dari rambut pengguna sabu-
sabu.
1.4. Tujuan Penelitian
-Untuk mengetahui pengaruh sistem pelarut yang optimum digunakan pada ekstraksi
metode sonikasi dalam analisis kualitatif methamphetamine dalam rambut pengguna
1.5. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan tambahan informasi mengenai
standarisasi metode preparasi sonikasi dan ekstraksi, analisis dan identifikasi senyawa
hasil metabolit pengguna narkotika jenis sabu – sabu (metamfetamin) dalam rambut .
1.6. Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Forensik Polda Sumatera Utara dan
Laboratorium Kimia Analitik Universitas Sumatera Utara dengan menggunakan
rambut pengguna narkotika jenis sabu – sabu sebagai sampel.
1.7. Metodologi Percobaan
1. Penelitian ini dilakukan secara eksperimen laboratorium.
2. Preparasi rambut pengguna sabu-sabu dilakukan dengan mencuci rambut
menggunakan metanol sebanyak tiga kali. Kemudian dilakukan sonikasi
dengan perbandingan sistem pelarut metanol:aseton:amonia ,
etilasetat:metanol:amonia dan kloroform:metanol:asam asetat dengan
perbandingan secara berturut-turut 5:1,2:0,08 , 8,5:1:0,5 dan 7,5:2:0,5. Setelah
disonikasi, dilakukan ekstraksi cair-cair dengan metanol. Ekstrak yang didapat
diuji secara kualitatif menggunakan pereaksi Marquis yang akan menghasilkan