ANALISIS SIKAP KONSUMEN DAN STRATEGI PEMASARAN
MADU PADA PERUSAHAAN MUTIARA TUGU IBU
CIMANGGIS DAN CIBUBUR
SKRIPSI
FIJRIA RAHMAWATI
PROGRAM STUDI SOSIAL EKONOMI PETERNAKAN FAKULTAS PETERNAKAN
RINGKASAN
FIJRIA RAHMAWATI. D34104046. 2008. Analisis Sikap Konsumen Rumah Tangga dan Strategi Pemasaran Madu pada Perusahaan Mutiara Tugu Ibu
Cimanggis dan Cibubur. Skripsi. Program Studi Sosial Ekonomi Peternakan,
Fakultas Peternakan, Institut Pertanian Bogor. Pembimbing Utama : Ir. Asi H. Napitupulu, MSc. Pembimbing Anggota : Ir. Juniar Atmakusuma, MS.
Indonesia merupakan salah satu negara tropis yang memiliki kekayaan alam yang melimpah baik flora maupun fauna, selain itu memiliki jumlah penduduk yang besar. Hal tersebut merupakan peluang pasar untuk meningkatkan usaha bidang perlebahan. Perusahaan Mutiara Tugu Ibu (MTI) merupakan salah satu perusahaan perlebahan yang merupakan hasil pelatihan pemuda mandiri yang diselenggarakan oleh Departemen Tenaga Kerja dan Transmigrasi bekerjasama dengan Lembaga Penelitian dan Pemberdayaan Masyarakat IPB (LPPM IPB).
Perusahaan MTI menghadapi beberapa tantangan dalam pemasaran produk madunya yaitu produk-produk madu dalam negeri dan madu impor yang kualitas keasliannya lebih terjamin serta kemasan yang lebih menarik. Dalam menghadapi tantangan ini perusahaan MTI harus melakukan pemasaran yang tepat agar produk yang dipasarkan bisa diterima, disenangi, kemudian dikonsumsi dan akhirnya konsumen puas terhadap produk yang dipasarkan. Analisis riset konsumen diperlukan untuk mengetahui sikap konsumen terhadap atribut produk madu MTI. Sikap konsumen ini selanjutnya digunakan oleh pemasar untuk mengetahui atribut apa yang menyebabkan konsumen bersikap positif maupun negatif terhadap suatu produk. Analisis sikap konsumen ini dapat digunakan dalam pertimbangan penyusunan strategi pemasaran yang tepat.
Tujuan penelitian ini adalah: (1) mengetahui karakteristik umum konsumen madu MTI dan pengukuran sikap konsumen terhadap atribut-atribut produk madu MTI, (2) mengidentifikasi lingkungan internal dan eksternal yang dihadapi perusahaan dalam pemasaran produknya, dan (3) merumuskan alternatif strategi pemasaran bagi perusahaan MTI. Penelitian dilaksanakan di kantor dan dua toko milik perusahaan Mutiara Tugu Ibu (MTI). Lokasi kantor milik MTI berada di Jalan Gatotkaca N0.28, RT 004/03, Harjamukti Depok, sedangkan kedua lokasi toko MTI berada di Jalan Raya Bogor KM 29 Cimanggis Depok, dan Jalan Alternatif Cibubur KM1.
Penelitian dilaksanakan tanggal 1 November – 31 Desember 2007 yang didesain sebagai penelitian yang bersifat survei. Analisis data yang digunakan dalam penelitian ini menggunakan analisis proses keputusan pembelian konsumen, analisis sikap konsumen menggunakan model Fishbein, analisis perumusan strategi yang terdiri dari matriks IFE (Internal Factor Evaluation) dan EFE (External Factor Evaluation), matriks SWOT, dan matriks QSP (Quantitative Strategic Planning). Konsumen yang diwawancarai mayoritas adalah laki-laki, kisaran umur konsumen 17-34 tahun, pegawai swasta dan bertempat tinggal di wilayah Depok dengan latar belakang kelas sosial menengah.
sudah baik. Berdasarkan analisis Internal Factor Evaluation (IFE), kekuatan utama yang dimiliki perusahaan adalah keberagaman produk dengan skor 0,416 serta kelemahan utamanya adalah pengorganisasian yang kurang tertata baik dengan skor 0,186. Total matriks IFE sebesar 2,560 hal ini berarti kemampuan perusahaan dalam menggunakan kekuatan untuk mengatasi kelemahan relatif sedang atau rata-rata. Berdasarkan analisis External Factor Evaluation (EFE), peluang yang paling direspons tinggi yaitu perkembangan teknologi dan informasi dengan skor 0,328 serta ancaman yang terbesar adalah jumlah konsumsi madu masyarakat Indonesia rendah dengan skor 0,325. Total matriks EFE sebesar 2,196 hal ini berarti perusahaan dalam memanfaatkan peluang yang ada dalam menghindari ancaman relatif sedang atau rata-rata.
Berdasarkan kekuatan dan kelemahan internal serta peluang dan ancaman eksternal perusahaan, maka dapat disusun suatu strategi berdasarkan matriks SWOT. Pendekatan matriks SWOT memberikan berbagai alternatif strategi, yaitu strategi S-O, strategi S-T, strategi W-S-O, dan strategi W-T. Strategi S-O yang dapat dilakukan perusahaan adalah meningkatkan kualitas dan kuantitas produk. Strategi S-T yang dapat dilakukan adalah aktif melakukan kegiatan pengembangan produk, melakukan kampanye untuk meningkatkan kesadaran masyarakat terhadap konsumsi madu, dan meningkatkan pelayanan kepada pelanggan. Strategi W-O yang dapat dilakukan adalah meningkatkan promosi. Strategi W-T yang dapat dilakukan adalah memperbaiki kualitas manajemen.
ABSTRACT
The Customer Attitude Analysis and Marketing Strategic Honey of Mutiara Tugu Ibu Factory in Cimanggis and Cibubur
Rahmawati, F., A. H. Napitupulu, dan J. Atmakusuma
ANALISIS SIKAP KONSUMEN DAN STRATEGI PEMASARAN
MADU PADA PERUSAHAAN MUTIARA TUGU IBU
CIMANGGIS DAN CIBUBUR
Oleh
FIJRIA RAHMAWATI D34104046
Skripsi ini telah disetujui dan disidangkan di hadapan Komisi Ujian Lisan pada tanggal 10 Juli 2008
Pembimbing Utama Pembimbing Anggota
Ir. Asi H. Napitupulu, MSc. Ir. Juniar Atmakusuma, MS. NIP. 130 256 389 NIP. 130 804 891
Dekan Fakultas Peternakan Institut Pertanian Bogor
ANALISIS SIKAP KONSUMEN DAN STRATEGI PEMASARAN
MADU PADA PERUSAHAAN MUTIARA TUGU IBU
CIMANGGIS DAN CIBUBUR
FIJRIA RAHMAWATI D34104046
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 19 April 1986 di Jakarta. Penulis merupakan anak pertama dari tiga bersaudara dari pasangan Bapak Harman Rahmat Pandipa dan Ibu Sriwinarti. Penulis menyelesaikan pendidikan di Sekolah Dasar di SD Dewi Sartika Bekasi pada tahun 1998. Pendidikan Sekolah Menengah Pertama diselesaikan di SLTP Negeri 7 Bekasi pada tahun 2001. Penulis melanjutkan pendidikan Sekolah Menengah Atas di SMU Negeri 4 Bekasi dan lulus pada tahun 2004. Penulis diterima sebagai mahasiswa pada Program Studi Sosial Ekonomi Peternakan dengan minat studi Agribisnis Peternakan, Fakultas Peternakan, Institut Pertanian Bogor melalui jalur USMI pada tahun 2004.
KATA PENGANTAR
Segala puji dan syukur Penulis panjatkan kehadiran Allah SWT atas segala nikmat, karunia dan rahmat-Nya sehingga Penulis dapat menyelesaikan skripsi yang berjudul “ Analisis Sikap Konsumen dan Strategi Pemasaran Madu pada Perusahaan Mutiara Tugu Ibu Cimanggis dan Cibubur”. Penyusunan skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada Program Studi Sosial Ekonomi Peternakan,Fakultas Peternakan, Institut Pertanian Bogor.
Indonesia merupakan negara tropis yang memiliki kekayaan alam yang melimpah baik flora maupun fauna, selain itu memiliki jumlah penduduk yang besar. Hal tersebut merupakan peluang besar untuk meningkatkan usaha bidang perlebahan. Semakin banyaknya perusahaan perusahaan perlebahan menyebabkan tingkat persaingan semakin tinggi, sehingga setiap perusahaan perlu mengetahui informasi mengenai karakteristik dan sikap konsumen serta mempunyai strategi pemasaran yang tepat untuk dapat memenangkan usaha persaingan.
Perusahaan Mutiara Tugu Ibu (MTI) merupakan salah satu perusahaan perlebahan yang merupakan hasil pelatihan pemuda mandiri yang diselenggarakan oleh Departemen Tenaga Kerja dan Transmigrasi bekerjasama dengan Lembaga Penelitian dan Pemberdayaan Masyarakat IPB (LPPM-IPB). Perusahaan ini menawarkan berbagai macam produk perlebahan yang sangat berguna bagi kesehatan manusia.
Skripsi ini diharapkan dapat memberikan informasi yang berguna khususnya bagi perusahaan Mutiara Tugu dan Ibu untuk dapat memenangkan persaingan, dan bagi para pembaca, akhir kata Penulis mengucapakan terima kasih kepada semua pihak yang telah membantu dalam menyelesaikan skripsi ini.
Bogor, Juli 2008
DAFTAR ISI
Halaman
RINGKASAN……… i
ABSTRACT ………... iii
RIWAYAT HIDUP……….. iv
KATA PENGANTAR………... v
DAFTAR ISI………. vi
DAFTAR TABEL………...……….…………... viii
DAFTAR GAMBAR………...………. x
DAFTAR LAMPIRAN………. xi
PENDAHULUAN………. 1
Latar Belakang……….. 1
Perumusan Masalah……….………. 2
Tujuan Penelitian……….. 3
Kegunaan Penelitian………. 4
KERANGKA PEMIKIRAN………. 5
TINJAUAN PUSTAKA……….... 7
Lebah Madu...……….. 7
Produk-Produk Lebah Madu……… 7
Proses Keputusan Pembelian Konsumen………... 9
Sikap Konsumen………... 10
Atribut Produk……….. 10
Konsep Pemasaran ……...………... 11
Analisis Lingkungan Pemasaran……….. 11
Analisis Lingkungan Internal………... 11
Analisis Lingkungan Eksternal..……… 13
Analisis Perumusan Strategi……… 15
Tahap Input…....………... 15
Tahap Mencocokkan…………...……… 15
Tahap Pengambilan Keputusan………... 16
METODE PENELITIAN……….. 17
Lokasi dan Waktu……… 17
Populasi dan Sampel……… 17
Disain Penelitian……….. 19
Data dan Instrumentasi………. 20
Pengumpulan Data……… 21
Uji Validitas dan Reliabilitas Instrumen……….. 21
Analisis Data……… 22
Analisis Sikap Konsumen Multiatribut Fishbein……… 22
Analisis Perumusan Strategi………... 24
Definisi Istilah……….. 30
GAMBARAN UMUM LOKASI……….. 32
Sejarah dan Perkembangan Perusahaan………... 32
Visi dan Misi………... 33
Lokasi dan Tata Letak Perusahaan………... 33
Struktur Organisasi Perusahaan………... 35
Lingkup Usaha Perusahaan……….. 36
HASIL DAN PEMBAHASAN………. 38
Karakteristik Konsumen…….………. 38
Proses Keputusan Pembelian…………..………. 40
Pengenalan Kebutuhan……… 41
Pencarian Informasi……… 42
Evaluasi Alternatif………. 43
Keputusan Pembelian………. 45
Evaluasi Pasca Pembelian………... 47
Analisis Penilaian Sikap Terhadap Atribut Madu MTI………... 49
Analisis Lingkungan Internal dan Eksternal Perusahaan………. 54
Analisis Lingkungan Internal……….. 54
Visi dan Misi………... 55
Sumberdaya Manusia………. 55
Produksi dan Operasi………. 56
Pemasaran……….. 58
Keuangan……… 61
Analisis Lingkungan Eksternal………... 62
Lingkungan Mikro……… 62
Lingkungan Makro………... 65
Lingkungan Industri………... 69
Analisis Perumusan Strategi……… 72
Analisis Internal Factor Evaluation (IFE) dan External Factor Evaluation (EFE)…………..……….. 72
Analisis Matriks SWOT... 79
Alternatif Strategi Pemasaran Terbaik………. 82
KESIMPULAN DAN SARAN……… 84
Kesimpulan………... 84
Saran………... 84
UCAPAN TERIMA KASIH……… 86
DAFTAR PUSTAKA……… 88
DAFTAR TABEL
Nomor
Halaman
1. Jumlah Sampel Penelitian di Wilayah Cimanggis dan Cibubur... 18
2. Matriks Internal Factor Evaluation (IFE) ... 25
3. Matriks External Factor Evaluation (EFE)... 25
4. Metode Paired Comparation………. 26
5. Matriks SWOT ... 28
6. Quantitative Strategic Planning Matrix (QSPM)... 29
7. Karakteristik Konsumen Toko Madu Cimanggis dan Cibubur, 2007... 40
8. Sebaran Konsumen Berdasarkan Motivasi untuk Tertarik Membeli Madu MTI………... 41
9. Sebaran Konsumen Berdasarkan Manfaat yang Dicari Saat Membeli Produk Madu MTI... 41
10. Sebaran Konsumen Berdasarkan Sumber Informasi Pertama Kali Mengenai Produk Madu MTI... 43
11. Sebaran Konsumen Berdasarkan Sikap Konsumen terhadap Informasi Pertama Kali Mengenai Produk Madu MTI... 43
12. Sebaran Konsumen Berdasarkan Atribut Produk Utama yang Dipertimbangkan pada Saat Pembelian Produk Madu MTI Pertama Kali……….. 44
13. Sebaran Konsumen Berdasarkan Jenis Merek Madu Lain yang Pernah Dikonsumsi... 44
14. Sebaran Konsumen Berdasarkan Cara Memutuskan Pembelian Madu MTI... 45
15. Sebaran Konsumen terhadap Pengaruh Media dalam Menentukan Jenis Madu pada Keputusan Pembelian... 45
16. Sebaran Konsumen terhadap Pengaruh Media dalam Menentukan Ukuran Madu pada Keputusan Pembelian ... 46
18. Sebaran Konsumen Berdasarkan Frekuensi Pembelian Madu MTI Setiap Tahun… ... 47 19. Sebaran Sikap Konsumen Berdasarkan Pengaruh Promosi Merek
Madu Lain terhadap Pembelian Madu MTI……….. 48 20. Sebaran Konsumen terhadap Tingkat Kepuasan Produk Madu MTI… 48 21. Sebaran Sikap Konsumen terhadap Kenaikkan Harga Produk Madu
MTI 20% ……… 49
22. Nilai Evaluasi (ei) Konsumen terhadap Atribut Produk Madu Secara
Umum... 50 23. Nilai Keyakinan (bi) Konsumen terhadap Atribut Produk Madu MTI.. 51 24. Penilaian Sikap Konsumen terhadap Atribut Madu MTI... 52 25. Nilai Maksimum dan Minimum Sikap (AO) terhadap Atribut Produk
Madu MTI………... 53
26. Rentang Skor Nilai Sikap Responden dan Posisi Sikap Konsumen terhadap Atribut-Atribut Madu MTI ………. 54 27. Karakteristik Pegawai - pegawai Perusahaan MTI ……… 55 28. Tingkat Inflasi Indonesia Tahun 2002-2007 ... 65 29. Perkembangan Volume dan Nilai Impor Madu Tahun 2002-2006 …… 66 30. Estimasi Jumlah Penduduk di Wilayah Penjualan Madu Mutiara Tugu
Ibu ………... 67
DAFTAR GAMBAR Nomor Halaman
DAFTAR LAMPIRAN
Nomor Halaman
1. Kuesioner ……….. 90
2. Daftar Harga Madu Perusahaan MTI………. 103
3. Uji Validitas dan Reliabilitas Nilai Evaluasi (ei) ... 105
4. Uji Validitas dan Reliabilitas Nilai Keyakinan (bi) …... 106
5. Pemberian Bobot untuk Matriks IFE ……… 107
6. Pemberian Rating untuk Matriks IFE……… ………... 108
7. Pemberian Bobot untuk Matriks EFE ………... 109
I. PENDAHULUAN
A. LATAR BELAKANG
Perkembangan kesadaran masyarakat atas kebutuhan hidup sehat menimbulkan permintaan pangan yang tidak hanya memberikan citarasa yang enak, namun juga yang dapat meningkatkan kesehatan. Pangan yang memberikan manfaat terhadap kesehatan tubuh dikenal dengan istilah pangan fungsional. Roberfroid (2002) menjelaskan bahwa pangan fungsional merupakan pangan dengan kandungan komponen yang dapat menurunkan resiko penyakit.
Salah satu pangan fungsional adalah prebiotik. Prebiotik adalah pangan dengan kandungan oligosakarida yang berpotensi memberikan nutrisi bagi mikrobiota usus yang menguntungkan. Pertumbuhan mikroba yang menguntungkan akan menghambat pertumbuhan bakteri patogen seperti E. coli dan Clostridia yang dapat menghasilkan toksin (Roberfroid 2002). Gibson (2004) menyebutkan komponen oligosakarida memberikan pengaruh sebagai ’penyubur’ mikrobiota usus manusia, meningkatkan penyerapan mineral, membantu metabolisme lemak dan mencegah kanker usus.
Ubi jalar berpotensi untuk dikembangkan menjadi pangan prebiotik karena mengandung oligosakarida yang dapat digunakan untuk pertumbuhan bakteri asam laktat (BAL). Suryadjaya (2005) melaporkan pemberian ekstrak kasar oligosakarida ubi jalar segar selama 10 hari dapat menurunkan E. coli sebesar 2.35 log CFU/g pada feses tikus dan menyebabkan Salmonella tidak terdeteksi selama percobaaan. Pada penelitian tersebut, ekstraksi oligosakarida dilakukan dengan etanol 70%. Dengan metode ini, selain oligosakarida (rafinosa dan maltotriosa), pada ekstrak juga mengandung gula sederhana (sukrosa dan maltosa). Untuk itu perlu dilakukan pemurnian oligosakarida untuk melihat potensinya sebagai prebiotik.
halnya yang dilakukan oleh Kim et al. (2003) dengan kacang kedelai yang mengekstrak oligosakarida kacang kedelai dengan menggunakan etanol dan air mendidih.
Dalam aplikasinya, tepung ubi jalar akan dikonsumsi setelah melalui proses pengolahan seperti pengukusan, pemanggangan, penyangraian dan pengeringan drum dried. Pengolahan dilaporkan dapat merubah oligosakarida (Mayastuti 2002). Oleh karena itu perlu dilakukan pengujian kandungan oligosakarida dan potensi prebiotik tepung ubi jalar setelah tepung ubi jalar mengalami pengukusan, pemanggangan, penyangraian dan pengeringan drum dried untuk mempelajari perubahan komponen dan potensi prebiotik oligosakarida.
B. HIPOTESA PENELITIAN
Hipotesa dari penelitian ini adalah:
1. Etanol dan air mendidih dapat mengekstrak oligosakarida dari ubi jalar. 2. Metode isolasi dengan kromatografi pertukaran ion akan menghasilkan
oligosakarida murni dari tepung ubi jalar.
3. Tepung ubi jalar setelah mengalami proses pemanggangan, pengukusan, penyangraian dan drum drying mengalami perubahan komponen oligosakarida.
4. Tepung olahan ubi jalar berpotensi sebagai prebiotik.
C. TUJUAN PENELITIAN
Tujuan penelitian ini adalah:
1. Membandingkan efektivitas metode ekstraksi oligosakarida dengan etanol 70% dan air mendidih.
2. Membandingkan pengaruh pengelusi etanol dan air pada isolasi oligosakarida dengan kromatografi kolom pertukaran ion.
4. Menguji kemampuan fraksi oligosakarida dan ekstrak kasar oligosakarida ubi jalar dalam mendukung pertumbuhan BAL secara in vitro.
5. Menguji kemampuan ekstrak kasar oligosakarida tepung olahan ubi jalar dalam mendukung pertumbuhan BAL, baik secara tunggal maupun berkompetisi dengan patogen secara in vitro.
D. MANFAAT PENELITIAN
Manfaat dari penelitian ini adalah untuk mendapat informasi tentang:
1. Potensi ubi jalar sebagai sumber prebiotik baik dalam bentuk segar maupun olahan.
2. Diperoleh metode isolasi oligosakarida untuk ubi jalar.
II. TINJAUAN PUSTAKA
A. PREBIOTIK
1. Definisi Prebiotik
Prebiotik adalah komponen bahan pangan yang non-viable, memiliki pengaruh menguntungkan terhadap inang dan berhubungan dengan modulasi mikrobiota (FAO 2007). FAO (2007) menegaskan komponen prebiotik bukan organisme atau obat, dapat dikarakterisasi secara kimia dan ’food grade’. Prebiotik dapat meningkatkan kesehatan, terukur dan tidak terserap dalam saluran darah. Komponen dan formulasi prebiotik mampu mengubah komposisi atau aktivitas mikrobiota inang target (modulasi mikrobiota), dapat
dengan cara fermentasi atau memblok reseptor.
2. Evaluasi untuk dapat meng-klaim suatu produk sebagai prebiotik
FAO (2007) menyatakan bahwa komponen yang dapat diklaim sebagai prebiotik harus terlebih dahulu dikarakterisasi meliputi sumber asalnya, kemurnian, komposisi dan struktur kimia, konsentrasi dan jumlah yang dibawa ke inang. Panduan evaluasi dan pembuktian suatu produk diklaim sebagai prebiotik dapat dilihat pada Gambar 1.
Gambar 1 Panduan evaluasi dan pembuktian suatu produk diklaim sebagai prebiotik (FAO 2007).
Kualifikasi prebiotik adalah bahwa prebiotik tidak hanya untuk meningkatkan bifidobakteria saja namun juga ditunjukkan dengan pengaruh meningkatkan kesehatan fisiologi. Contoh-contoh pengaruh fisiologi karena konsumsi prebiotik yaitu dapat membantu penyerapan nutrisi seperti Ca, Mg, trace elements dan protein. Prebiotik mampu mengurangi waktu atau lamanya infeksi, menurunkan kolesterol, mengatur buang air besar, menurunkan resiko kanker dan membawa perubahan terhadap imun spesifik dan nonspesifik yang meningkatkan kesehatan.
Parameter keamanan prebiotik ditetapkan oleh peraturan masing-masing negara, seperti halnya komponen makanan lainnya. FAO merekomendasikan bahwa keamanan formulasi produk akhir prebiotik adalah sebagai berikut:
Karakterisasi komponen yang meliputi sumber asal, kemurnian, komposisi dan struktur kimianya
Pengujian secara in vitro dan in vivo untuk karakterisasi kegunaan
Formulasi dalam bentuk produk meliputi konsentrasi dan jumlah
Penilaian keamanan secara in vitro dan in vivo pada hewan dan manusia jika produk tidak GRAS
Uji secara acak pada manusia beserta kontrol untuk mengetahui adanya korelasi antara hasil pengukuran
fisiologis dan modulasi mikrobiota pada sisi spesifik secara independen Uji pada manusia
i) Jika produk mempunyai sejarah yang aman pada inang target (GRAS) maka uji lanjutan kepada hewan atau uji toksik pada manusia tidak diperlukan lagi. ii) Harus ditetapkan jumlah konsumsi aman dengan gejala dan efek samping minimal. iii) Produk tidak boleh terkontaminasi dan tidak murni. iv) Prebiotik tidak boleh mengubah mikrobiota dan menggangu inang dalam jangka waktu yang lama.
3. Manajemen produk prebiotik
Manajemen produk prebiotik meliputi tiga aspek yaitu aspek produksi, aspek formulasi dan penyimpanan serta aspek peraturan. Dalam proses produksi, setiap proses mempunyai jaminan dalam mempertahankan kemurnian oligosakarida dan konsistensi komposisinya dalam tiap produk. Dalam aspek formulasi dan penyimpanan, FAO merekomendasikan evaluasi setiap jenis produk akan stabilitas komposisi prebiotiknya dan aktivitas biologi inang target yang diinginkan akibat pengaruh pengolahan dan teknologi produksi. Dalam peraturan, produsen bertanggung jawab untuk menyediakan peraturan penjualan dimana para penjualan disiapkan dengan dokumentasi yang sesuai untuk mendukung klaim kesehatan. Bila ada produk baru, perlu kesepakatan dan tanggungjawab produsen untuk membuktikan secara ilmiah dengan target inang bahwa produk tersebut dapat meningkatkan kesehatan (FAO 2007).
4. Keuntungan Prebiotik
Manning et al. (2004) menjelaskan keuntungan prebiotik meliputi: (a) Menghambat patogen, (b) Meningkatkan penyerapan kalsium, (c) Melindungi terhadap kanker usus, (d) Menurunkan lemak darah dan (e) Meningkatkan imunitas.
Menghambat patogen. Wang dan Gibson (1994) menyatakan prebiotik (oligofruktosa) dapat meningkatkan pertumbuhan Bifidobacterium infantis. Hasil uji kompetisi antara B. infantis, E.coli dan C. perfringens dengan
jumlah inokulum awal masing-masing sebesar 108, 108 dan 106 CFU/ml dalam satu media dapat menurunkan E.coli satu sikus log dan
mematikan C. perfringens hingga nol masing-masing setelah 52 jam kompetisi dan diikuti turunnya pH media dari 7 menjadi 5.3. Populasi B. infantis tidak terpengaruh selama uji kompetisi. B. infantis mampu menghasilkan senyawa seperti CO2, asam asetat, propionat, butirat, laktat dan suksinat yang dapat menghambat E. coli dan Clostridium perfringens.
Mekanisme penghambatan patogen oleh prebiotik terbagi menjadi dua yaitu secara langsung maupun tidak langsung. Penghambatan patogen oleh prebiotik secara langsung adalah karena prebiotik (oligosakarida) dapat mem’blok’sisi reseptor pelekatan patogen pada mukosa usus, sehingga patogen tidak menempel pada mukosa usus. Penghambatan patogen oleh prebiotik secara tidak langsung adalah karena prebiotik dimanfaatkan dan meningkatkan pertumbuhan probiotik (Rastall et al. 2005)
Meningkatkan penyerapan kalsium. BAL memfermentasi prebiotik seperti inulin dan menghasilkan produk asam lemak rantai pendek (SCFA), menyebabkan penurunan pH dinding mukosa usus. pH rendah meningkatkan kelarutan dan penyerapan kalsium di dalam usus (Ouwenhand et al. 1999).
Mencegah kanker usus. Mekanisme perlindungan dari prebiotik
terhadap perkembangan kanker usus, yaitu: 1) BAL mengurangi populasi patogen yang menghasilkan senyawa-senyawa karsinogen dalam usus. 2) Kemampuan dinding sel BAL terutama peptidoglikan dapat mengikat senyawa mutagen sepeti Tp-P1, Trp-P2, Glu P1 dan senyawa mutagen lainnya (Surono 2004).
Reddy (1999) melaporkan oligofruktosa dan inulin dapat menghambat potensi tumor pada usus besar tikus. Mekanisme yang terjadi adalah: 1) Prebiotik meningkatkan pertumbuhan bifidobakteria. Bifidobakteria berkolonisasi dan menghasilkan asam laktat, menurunkan pH usus sehingga dapat membunuh E. coli dan Clostridium perfringens. Lingkungan usus menjadi nyaman bagi bifidobakteria dan mendukung modulasi enzim β -glukuronidase yang dapat mengubah prokarsinogen menjadi proksimat karsinogen. 2) Butirat yang dihasilkan BAL dapat menghambat proliferasi sejumlah sel secara in vitro dan menginduksi diferensiasi sel tumor.
mekanisme BAL dalam menurunkan kolesterol dapat dilihat pada Gambar 2 (Surono 2004).
Gambar 2 Mekanisme BAL dalam penurunan kadar kolesterol (Surono 2004).
Meningkatkan imunitas. Prebiotik dapat meningkatkan pertumbuhan BAL. BAL mengeluarkan senyawa imunomodulator yaitu suatu komponen yang mampu berinteraksi dengan sistem imun serta menimbulkan efek menstimulasi atau menekan sistem imun spesifik dan sistem imun non spesifik (Tzianabos 2000). Respon imun non spesifik merupakan pertahanan tubuh terdepan dalam menghadapi serangan berbagai mikroorganisme seperti pada keringat, kulit, air mata, selaput lendir, batuk, bersin dan tubuh dapat memberikan respon langsung. Respon imun spesifik mengenali benda asing terlebih dahulu. Bila sistem imun terpapar kembali dengan benda asing yang sama, maka akan dikenal dan dihancurkan oleh respon imun spesifik.
B. OLIGOSAKARIDA
Oligosakarida merupakan gula dengan 3 hingga 20 unit sakarida. Oligosakarida merupakan rantai pendek polisakarida (Manning et al. 2004). Karakteristik senyawa oligosakarida (Manning dan Gibson 2004) adalah a) terdiri dari susunan monosakarida antara lain glukosa, galaktosa, xylosa dan fruktosa. b) Memiliki ikatan glikosidik. (Gambar 3). Ikatan glikosidik terdiri dari ikatan β (1→4), α (1→4), β (1→6) dan α (1→6) (Wilbraham dan Matta 1992). c) Memiliki berat molekul yang rendah dibawah polisakarida. Inulin merupakan oligosakarida dengan berat molekul yang paling tinggi.
Gambar 3 Salah satu contoh ikatan glikosidik (Wilbraham dan Matta 1992)
Oligosakarida tidak dapat dihidrolisa dan diserap usus halus (Weese 2002), karena mukosa mamalia tidak mempunyai enzim pencerna oligosakarida yaitu α-galaktosidase (Muchtadi 1989). Bifidobakteria memiliki enzim β-fruktofuranosidase yang dapat memutus ikatan beta-D-fruktofuranosida dengan beta-D-beta-D-fruktofuranosida sehingga oligosakarida seperti FOS dapat dicerna oleh bifidobakteria. Laktobasili mempunyai α -galaktosidase yang mampu memutus ikatan alfa-galaktosa dan alfa-galaktosa sehingga oligosakarida seperti galaktooligosakarida dapat dicerna oleh laktobasili.
Beberapa oligomer yang memiliki potensi prebiotik seperti laktulosa, fruktooligosakarida (FOS), galaktooligosakarida (TOS), soyoligosakarida (SOS), laktosukrosa, isomaltooligosakarida (IMO), glukooligosakarida (GOS), xylooligosakarida (XOS) dan palatinosa (Manning et al. 2004). Beberapa struktur golongan oligosakarida dapat dilihat pada Gambar 4-8. Jenis senyawa oligosakarida dan senyawa prebiotik lainnya dapat dilihat pada Tabel 1.
Gambar 4 Struktur maltotriosa
Sumber : Girigowda dan Mulimani (2005)
Gambar 5 Struktur oligosakarida (rafinosa dan kerabatnya)
Verbaskosa
Stakiosa
Rafinosa
Fruktooligosakarida Glukooligosakarida
Gambar 6 Struktur fruktooligosakarida (FOS) dan glukooligosakarida (GOS)
Gambar 7 Struktur galaktooligosakarida (TOS)
Tabel 1 Jenis senyawa oligosakarida dan senyawa prebiotik lainnya Kelompok Jenis senyawa prebiotik
Polylols Xylitol
Sorbitol Mannitol Disakarida Laktulosa
Laktitol Oligosakarida Rafinosa
Oligosakarida kedelai (rafinosa+stakiosa)
Fruktooligosakarida (FOS)
Oligofruktosa (campuran oligosakarida)
Galaktooligosakarida (TOS)
Palatinosa
Isomalto-oligosakarida Laktosukrosa
Galaktosil-laktosa Polisakarida Inulin
Pati resisten
Sumber : Suskovic et al. (2001)
Oligosakarida dengan rantai terpanjang adalah inulin. Beberapa literatur menggolongkan inulin kepada polisakarida, namun banyak penelitian menyebutkan bahwa inulin termasuk golongan oligosakarida. Inulin dapat diperoleh dari berbagai tanaman seperti umbi dahlia, jerusalem artichoke, artichoke, chicory dan dandelions. Perbedaan tanaman menghasilkan perbedaan inulin dalam hal derajat polimerisasi (DP). Inulin artichoke menunjukkan nilai DP yang tinggi (DPn=46) dibandingkan inulin dari sumber lain seperti jerusalem artichoke, chicory, dan dahlia yaitu berturut-turut DPn=26, 24 dan 43. Inulin dengan rantai panjang lebih sukar larut dan membentuk mikrokristal pada air dan susu (Molina et al. 2005).
C. MIKROBIOTA USUS
Mikrobiota usus sangat penting untuk kesehatan. Pada usus manusia, terdapat sekitar 500 spesies bakteri dengan populasi sebesar 1014 dengan berat keseluruhannya dapat mencapai 1-2 kg. Mikrobiota yang diisolasi dari feses anak-anak dan dewasa berbeda jenis dan jumlahnya (Tabel 2). Perbedaan jenis dan jumlah bakteri pada saluran pencernaan manusia dipengaruhi oleh faktor fisik, kimia dan mekanisme biologis (Ballongue 2004).
Jumlah mikrobiota pada bagian saluran pencernaan manusia berbeda-beda (Tabel 3). Jumlah mikrobiota pada lambung adalah yang paling kecil dibandingkan pada usus. Bakteri pada ileum terdiri dari E. coli dan bakteri anaerob seperti Clostridium, Fusobacterium dan Bacteroides (106 CFU/ml). Pada usus besar terdapat banyak jenis dan jumlah bakteri, baik positif dan Gram-negatif (Ballongue 2004).
Tabel 2 Mikrobiota pada feses manusia dengan berbagai kelompok usiaa
Grup bakteri Bayi, 1-4 hari
Bayi, 5-90 hari
Anak-anak, 4-6
tahun
Dewasa, 20-64 tahun
Dewasa 65-86 tahun
Total mikroba 10.1 10.5 10.8 10.8 10.5
Bakteri obligat aerob atau anareobik fakultatif
Enterobacteria 9.3 8.8 8.0 8.2 7.8
Streptococcus 8.5 8.1 7.8 7.7 8.2
Staphylococcus 6.2 6.8 4.0 4.4 4.3
Lactobacillus 6.4 7.3 7.0 6.7 8.0
Kamir 3.5 4.0 4.2 3.7 4.6
Bakteri anaerobik
Bacteroides 8.6 8.2 10.4 10.3 10.0
Bifidobacteria 9.3 9.9 10.1 9.8 9.4
Peptococcus 0 9.0 8.2 8.9 7.7
C. perfringens 5.9 6.9 5.7 4.8 6.6
Eubacteria 0 9.7 9.9 9.9 9.5
Veillonellae 5.6 6.3 5.2 4.8 6.1
a
Tabel 3 Mikrobiota pada saluran pencernaan manusia a
Lambung Ileum Jejenum Usus besar
Total mikroba 0-103 0-105 103-107 1011-1012 Bakteri obligat aerob atau anareobik fakultatif
Enterobacteria 0-102 0-103 102-105 104-1010 Streptococcus 0-103 0-104 102-105 105-1010 Staphylococcus 0-102 0-103 102-105 104-107 Lactobacillus 0-103 0-104 102-105 106-1010
Fongy 0-102 0-102 102-105 102-106
Bakteri anaerobik
Bacteroides Jarang 0-102 103-106 1010-1012 Bifidobacteria Jarang 0-103 103-107 108-1012 Peptococcus Jarang 0-103 103-104 108-1012 Clostridium Jarang Jarang 103-104 106-1011 Fusobacterium Jarang Jarang Jarang 109-1010 Eubacteria Jarang Jarang 103-105 109-1012 Veillonellae Jarang 0-102 103-104 103-104 a
CFU per gram saluran pencernaan Sumber : Ballongue (2004)
Peranan mikrobiota usus berdasarkan aktivitasnya dapat dibagi menjadi dua, yaitu aktivitas yang menguntungkan dan aktivitas yang merugikan. Bifidobacteria, Lactobacillus sp., dan Eubacteria memiliki aktivitas yang menguntungkan sedangkan Clostridium perfringens, Veillonellae sp. dan Proteus sp. memiliki aktivitas yang merugikan. Bakteri yang memiliki sifat menguntungkan dan merugikan adalah Bacteroides, Streptococcus sp., Escherichia coli serta Enterococcus (Yuguchi et al. 1992).
Tabel 4 Pengaruh konsumsi sukrosa dan oligofruktosa terhadap mikrobiota feses manusia (log CFU/g)
Pengukuran Sukrosa 21 hari Oligofruktosa 11 hari Oligofruktosa 21 hari Pasca oligofruktosa Total anaerob Total aerob Bifidobakteria Bacteroides Koliform
9.97 ± 0.27 8.3 ± 0.52 8.85 ± 0.45 9.75 ± 0.4 6.72 ± 1.34
10.60 ± 0.22 8.32 ± 0.85
9.8 ± 0.40 10.41 ± 0.29
5.99 ± 1.17
10.55 ± 0.17 8.86 ± 0.8 9.77 ± 0.24 10.15 ± 0.28
6.93 ± 2.21
10.10 ± 0.32 8.33 ± 0.38 9.11 ± 0.35 9.76 ± 0.14 6.53 ± 0.33
Sumber: Rao (2001)
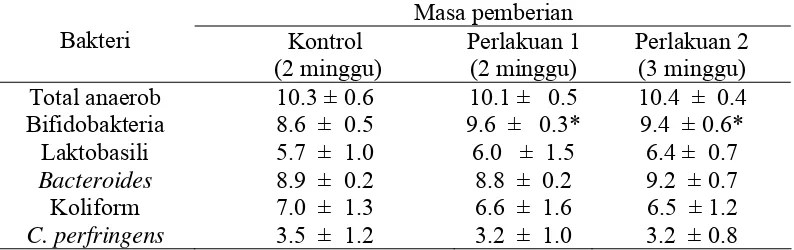
Menne et al. (2000) melaporkan bahwa secara umum pemberian oligofruktosa chicory sebanyak 8 g/hari tidak berpengaruh nyata terhadap total anaerob, laktobasili, Bacteroides, koliform atau C. perfringens, namun berpengaruh nyata dalam meningkatkan bifidobakteria feses manusia. Pengukuran dilakukan selama 7 minggu, dengan kontrol (tanpa penambahan oligofruktosa) selama 2 minggu, perlakuan 1 (pemberian oligofruktosa chicory) selama 2 minggu dan perlakuan 2 (pemberian makanan masakan rumah yang biasa mereka makan dan ditambahkan 8 gram/hari oligofruktosa chicory) selama 3 minggu. Pengukuran terhadap pH feses menunjukkan pada akhir perlakuan 1 dan 2 terjadi penurunan pH hingga 1 unit dibandingkan dengan pH kontrol akhir (Tabel 5).
Tabel 5 Pengaruh konsumsi oligofruktosa chicory 8 g/hari (log CFU/g) terhadap mikrobiota usus manusia.
Masa pemberian
Bakteri Kontrol
(2 minggu)
Perlakuan 1 (2 minggu)
Perlakuan 2 (3 minggu) Total anaerob 10.3 ± 0.6 10.1 ± 0.5 10.4 ± 0.4 Bifidobakteria 8.6 ± 0.5 9.6 ± 0.3* 9.4 ± 0.6* Laktobasili 5.7 ± 1.0 6.0 ± 1.5 6.4 ± 0.7 Bacteroides 8.9 ± 0.2 8.8 ± 0.2 9.2 ± 0.7 Koliform 7.0 ± 1.3 6.6 ± 1.6 6.5 ± 1.2 C. perfringens 3.5 ± 1.2 3.2 ± 1.0 3.2 ± 0.8
*berbeda signifikan sebelum perlakuan
Sumber : Menne et al. (2000)
[image:30.595.120.517.515.640.2]Kelompok sinbiotik paling efektif menurunkan jumlah E. coli di dalam saluran pencernaan tikus percobaan. Pada kelompok prebiotik yang hanya diberi ekstrak oligosakarida juga terjadi penurunan E. coli sebesar 2.35 log CFU/ml pada hari ke-10. Hal ini menunjukkan bahwa ekstrak oligosakarida dari ubi jalar dapat dicerna oleh BAL di usus sehingga populasi BAL meningkat dan dapat bersaing dengan E. coli.
D. PROBIOTIK
Prebiotik tidak dapat dipisahkan dengan probiotik oleh karena target prebiotik adalah memacu pertumbuhan bakteri probiotik (Roberfroid 2000). WHO (2002) menyatakan bahwa probiotik adalah mikroorganisme hidup jika dikonsumsi dalam jumlah yang cukup dapat meningkatkan kesehatan inang. Tannock (1999) menyatakan beberapa manfaat probiotik yang telah diteliti adalah dapat meningkatkan ketahanan terhadap penyakit infeksi pencernaan, mencegah diare, menurunkan tekanan darah, menurunkan kolesterol, mengurangi alergi, merangsang fagositosis sel darah putih, menurunkan potensi karsinogen dan menurunkan tumor. Probiotik dapat meningkatkan kesehatan, namun probiotik bukanlah obat, meskipun probiotik tersedia di supermarket dan toko kesehatan.
Beberapa bakteri probiotik komersial mencakup Lactobacillus casei Shirota (Spanhaak et al. 1998), Lactobacillus casei Rhamnosus, Lactobacillus acidophilus, Bifidobacterium longum dan Bifidobacterium bifidum (Salminen 2004). Beberapa bakteri probiotik lain yang telah diteliti adalah B. animalis (Bielecka et al. 2001), B. infantis (Wang dan Gibson 1993), L. johnsonii LA1 dan L. casei Rhamnosus GG (Salminen 2004).
Spanhaak et al. (1998) melaporkan konsumsi L. casei Shirota dalam susu fermentasi dapat meningkatkan jumlah Lactobacillus difeses laki-laki berumur 40-65 tahun. Setelah perlakuan feses didominasi oleh L. casei Shirota hingga mencapai 107 CFU/g feses. Bakteri lain seperti Bifidobacterium juga meningkat signifikan dan menurunkan Clostridium.
Lactobacillus G1 mampu menempel pada permukaan stainless steel dengan baik (4.9 log sel/cm2), mampu menghambat pertumbuhan E. coli, Salmonella Typhimurium dan Staphylococcus aureus dan meningkatkan jumlah BAL yang ada pada mikroflora normal tikus. Lactobacillus G3 mengalami penurunan kurang dari 1 log (resisten) pada larutan MRSB yang diasamkan dengan HCl hingga pH 3. Hal ini menunjukkan Lactobacillus G3 memiliki ketahanan terhadap asam lambung dan berpotensi sebagai prebiotik.
1. Kriteria Probiotik
2. Metabolit Probiotik
Probiotik menghasilkan senyawa metabolit primer seperti asam organik, hidrogen peroksida dan karbondioksida, juga metabolit sekunder seperti bakteriosin, senyawa flavor (diasetil dan asetaldehid) dan eksopolisakarida (EPS) (Surono 2004).
Asam organik. Fermentasi yang melibatkan BAL menghasilkan asam-asam organik, terutama asam-asam laktat. Asam laktat dihasilkan oleh seluruh Lactobasili dan bifidobakteria. Bifidobakteria memproduksi asam asetat dan asam laktat dengan perbandingan berturut-turut 3:2. Asam laktat dan asam asetat telah diketahui menghambat Staphylococcus aureus (Naidu dan Clemens 2000).
Wong dan Chen (1988) di dalam Naidu dan Clemens (2000) menyebutkan bahwa pertumbuhan B. cereus dihambat dengan adanya BAL yang memproduksi asam asetat pada pH 6 dan menghambat pertumbuhan spora seiring bertambahnya asam format, asam laktat dan asam asetat berturut-turut pada pH 4.4, 4.3 dan 4.2.
Bifidobakteria tidak menghasilkan H2O2, namun memproduksi asam asetat dan asam laktat. Produksi kedua asam ini menurunkan pH saluran pencernaan, yang dapat menghambat pertumbuhan patogen dan bakteri pembusuk. Dengan mengontrol pH saluran pencernaan, memungkinkan membatasi bakteri pembusuk mengeluarkan fenol, ammonia, metabolit steroid, toksin bakteri seperti senyawa amin (histamin, tyramin, cadaverin dan agmatin) (Hidaka dan Eida 1988 di dalam Naidu dan Clemens 2000).
Gambar 9 Mekanisme asam lemah dalam menginaktivasi bakteri (Garbutt 1997).
Hidrogen Peroksida. Hidrogen peroksida (H2O2) dihasilkan oleh BAL yang tidak memiliki enzim katalase. Pada kondisi aerob, BAL mampu memproduksi hidrogen peroksida dimana senyawa ini tidak stabil dan terurai menjadi radikal superoksida (O2- *) dan hidroksil (OH-).
Reaksi : H2O2 +O2 ↔O2−∗+OH−
Mekanisme senyawa H2O2 dalam membunuh bakteri adalah: 1) Terjadinya oksidasi pada sel bakteri. Bakteri memiliki gugus sulfhidril pada protein dinding sel. Gugus sulfhidril akan berinteraksi dengan radikal superoksida oksigen sehingga meningkatkan permeabilitas membran (membran sel terganggu) dan mendenaturasi sejumlah enzim sel, 2) H2O2 dapat bertindak sebagai prekursor (zat yang mengawali suatu reaksi) bagi pembentukan radikal bebas yang dapat merusak DNA, 3) Reaksi pembentukan H2O2 akan mengikat oksigen sehingga membentuk suasana anaerob yang tidak nyaman bagi bakteri aerob (Surono 2004). Contoh probiotik yang menghasilkan H2O2 adalah Lactobacillus acidophilus (Naidu dan Clemens 2000).
Bakteriosin. Bakteriosin adalah suatu peptida yang bersifat antibakteri (toksin). Aktivitas bakterisidal (efek pembunuhan) terhadap bakteri yang sensitif yaitu melalui destabilisasi fungsi permeabilitas membran sel dan terhambatnya produksi energi (Surono 2004) .
R-COOH R-COO-+ H+
Kondisi netral
RCOO-H RCOO- + H+ pH internal berubah
Bakteriosin tidak aktif melawan Gram-negatif namun aktif melawan Gram-positif. Aksi penghambatan bakteriosin adalah bakteriosin merupakan protein yang bersifat hidrofobik, sifat hidrofobik ini mampu berpenetrasi ke dalam membran sel Gram-positif yang bersifat hidrofobik melalui lapisan peptidoglikan (Gambar 10 ) (Parada et al. 2007).
Gambar 10 Dinding sel Gram-negatif dan Gram-positif .
Sifat antimikroba yang dimiliki bakteriosin adalah spesifik (mampu membunuh bakteri tertentu saja). Adsorpsi ini diikuti dengan perubahan metabolik, biologi dan morfologi dan menyebabkan kematian bakteri yang diserang (Nissen-Meyer 1992). Contoh probiotik yang menghasilkan bakteriosin adalah B. bifidum dengan nama bifidin (Salminen 2004) dan L. acidophilus dengan nama lactacin F (Parada et al. 2007).
Karbondioksida. Karbondioksida merupakan produk akhir dari
fermentasi heksosa oleh BAL heterofermentatif. Sifat antimikroba yang dimiliki karbondioksida berupa kemampuan menciptakan kondisi lingkungan yang anaerob dengan cara menggantikan posisi oksigen dan CO2 terakumulasi dalam membran lipid bilayer yang akan mengganggu permeabilitas membran sehingga menyebabkan kerusakan sel membran. Contoh probiotik yang menghasilkan CO2 adalah B. infantis (Wang dan Gibson 1993) .
Diasetil dan asetaldehid. Diasetil merupakan produk akhir pada metabolisme piruvat melalui fermentasi sitrat oleh BAL. Diasetil mempunyai aktivitas antimikroba melawan patogen penyebab keracunan makanan dan
Gram-positif Gram-negatif
Lipopolisakarida Asam teikoat Porin
Membran luar Lipoprotein murein Peptidoglikan Ruang Periplasma
mikroorganisme berbahaya. Diasetil lebih efektif melawan bakteri Gram-negatif, kapang dan kamir dibandingkan melawan Gram-positif.
Diasetil memiliki berat molekul yang rendah dan bersifat hidrofilik. Sifat hidrofilik ini menyebabkan diasetil mampu masuk melalui protein porin ke bagian dalam bakteri Gram-negatif tanpa mengganggu permeabilitas membran luar. Hal inilah yang memberikan nilai tambahan pada diasetil sebagai senyawa antimikroba pada makanan, karena aksinya yang kuat secara alami membunuh bakteri Gram-negatif. Diasetil dengan konsentrasi 100 ppm mampu mematikan E. coli dan Staphylococcus aureus (Lanciotti et al. 2003).
Asetaldehid terbentuk selama metabolisme karbohidrat oleh BAL heterofermentatif seperti L. bulgaricus dan S. thermophilus. Asetaldehid menjadi etanol dengan reoksidasi dari nukleutida piridin, dikatalis oleh NAD dependent alkohol dehidrogenase. Asetaldehid memberikan aroma khas yoghurt. Asetaldehid dengan konsentrasi (10-100 ppm) melawan patogen seperti E. coli, Salmonella Typhimurium dan Staphylococcus aureus.
Eksopolisakarida (EPS). BAL menghasilkan polisakarida sebagai
komponen dinding sel dan juga sebagai kapsul dan lendir (Surono 2004). Roberts et al. (1995) melaporkan beberapa BAL dapat memproduksi EPS. EPS dapat terdiri atas polisakarida dengan satu jenis gula (homopolisakarida) dan campuran beberapa gula (heteropolisakarida). Contoh BAL penghasil homopolisakarida adalah Streptococcus mutans dan Leuconostoc mesenteroides dengan jenis glukan berturut-turut disebut mutan dan dekstran. Contoh BAL yang menghasilkan EPS heteropolisakarida adalah Bifidobacterium longum BB-79 dengan kandungan EPS terdiri dari galaktosa dan gula heksosa (kemungkinan glukosa) dengan campuran asam laktat.
permukaan mukosa, maka semakin memberi kesempatan untuk metabolisme dan menstimulir sistem imun (Surono 2004).
E. UBI JALAR (Ipomoea batatas L)
Ubi jalar termasuk ke dalam famili Convolvulaceae dan mempunyai nama botani Ipomoea batatas (L) Lam. (Rukmana 1997). Pada umumnya ubi jalar dibagi dalam dua golongan yaitu ubi jalar yang berumbi lunak karena banyak mengandung air dan ubi jalar yang berumbi keras karena banyak mengandung pati (Lingga et al. 1986).
Ubi jalar mengandung karbohidrat yang tinggi dan protein serta lemak yang rendah. Kandungan proksimat ubi jalar putih dan ubi jalar merah tidak berbeda. Perbedaan komposisi antara ubi jalar putih dengan ubi jalar merah terletak pada kandungan vitamin A. Ubi jalar putih memiliki kandungan vitamin A yang kecil (60 SI) dibandingkan dengan ubi jalar merah (7700 SI). Komposisi gizi ubi jalar putih per 100 g bahan mentah dapat dilihat pada Tabel 6.
Tabel 6 Komposisi gizi ubi jalar per100 g bahan mentah (86%bdd) Komponen Kandungan
Kalori Protein Lemak Karbohidrat
Kalsium Fosfor
Besi Vitamin A Vitamin B1
Vitamin C Air
123 kal 1.8 g 0.7 g 27.9 g 30 mg 49 mg 0.7 mg
60 SI 0.09 mg
22 mg 68.5 g Sumber: DKBM, Dep Kes Gizi (1992)
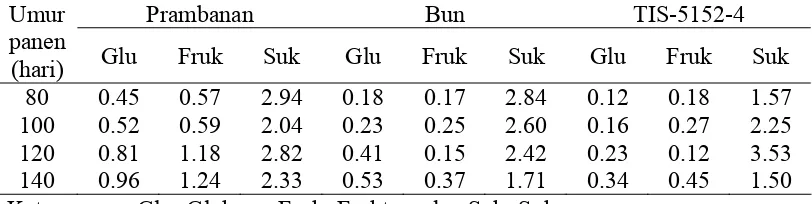
Komposisi karbohidrat dan jenis gula yang terkandung dalam ubi jalar dapat dipengaruhi oleh umur panen, jenis varietas (Marzempi et al. 1988) dan metode pengolahan (Yadav et al. 2006).
pembentukan umbi meningkat. Glukosa yang dibentuk di daun dalam fotosintesis akan dibawa ke dalam umbi untuk pembentukan pati dan senyawa lainnya. Namun terjadi penurunan kandungan sukrosa pada umbi lewat matang (140 hari) (Tabel 7). Hal ini disebabkan menurunnya kegiatan fotosintesis karena tanaman menuju tahap senescene (layu) dan sukrosa yang telah ada dalam umbi berubah menjadi glukosa dan fruktosa (Marzempi 1988).
Tabel 7 Kandungan gula (%) ubi jalar varietas Prambanan, Bun dan TIS-5152-4 dengan waktu panen berbeda.
Prambanan Bun TIS-5152-4 Umur
panen
(hari) Glu Fruk Suk Glu Fruk Suk Glu Fruk Suk
80 0.45 0.57 2.94 0.18 0.17 2.84 0.12 0.18 1.57 100 0.52 0.59 2.04 0.23 0.25 2.60 0.16 0.27 2.25 120 0.81 1.18 2.82 0.41 0.15 2.42 0.23 0.12 3.53 140 0.96 1.24 2.33 0.53 0.37 1.71 0.34 0.45 1.50 Keterangan : Glu=Glukosa, Fruk=Fruktosa dan Suk=Sukrosa
Sumber : Marzempi (1988)
Varietas. Perbedaan varietas ubi jalar memiliki kandungan pati yang
berbeda. Tjintokohadi et al (2001) melaporkan bahwa varietas Sukuh memiliki kandungan pati 27.7% (bk), lebih besar dibandingkan varietas Jago dengan kandungan pati 22.9% (bk). Collins dan Walter melaporkan kandungan pati varietas Garnet memiliki kandungan pati 46.2% (bk).
Marzempi (1988) mengidentifikasi tiga komponen gula (fruktosa, glukosa dan sukrosa) pada ubi jalar varietas Prambanan, Bun dan TIS-5125-4. Konsentrasi total kandungan glukosa, fruktosa dan sukrosa dari yang terbesar hingga yang terkecil adalah varietas Prambanan, varietas Bun dan TIS-5152-4 dengan konsentrasi berturut-turut adalah 3.96%, 3.19% dan 1.87% (Tabel 7). Kandungan gula ubi jalar dari ketiga varietas tersebut secara keseluruhan memiliki urutan konsentrasi dari yang terbesar hingga terkecil adalah sukrosa, fruktosa dan glukosa.
Proses pengolahan. Collins dan Walter (1985) melaporkan bahwa
kandungan gulanya, namun kandungan pati, selulosa, hemiselulosa dan pektin menurun (Tabel 8).
Tabel 8 Komposisi karbohidrat pada ubi jalar mentah dan panggang varietas Garnet
Konsentrasi (% berat kering) Komposisi karbohidrat
mentah panggang Pati 46.2 2.6 Gula 22.4 37.6
Hemiselulosa 3.8 1.0
Selulosa 2.7 2.5
Pektin larut air 0.47 0.31
Sumber : Collins dan Walter (1985)
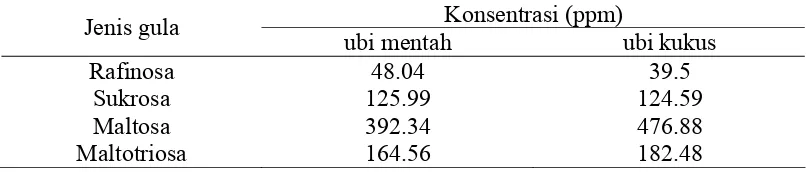
Adijuwana (2005) menyebutkan kandungan gula yang terdapat pada ubi jalar varietas Sukuh adalah rafinosa, maltosa, sukrosa dan maltotriosa (Tabel 9). Konsentrasi gula ubi jalar yang dikukus meningkat dibandingkan dengan ubi mentah. Hal ini menunjukkan pengolahan mengubah konsentrasi gula yang ada dalam ubi jalar.
Tabel 9 Kandungan gula ekstrak tepung ubi jalar varietas Sukuh Konsentrasi (ppm)
Jenis gula
ubi mentah ubi kukus
Rafinosa 48.04 39.5
Sukrosa 125.99 124.59 Maltosa 392.34 476.88
Maltotriosa 164.56 182.48
Sumber : Adijuwana (2005)
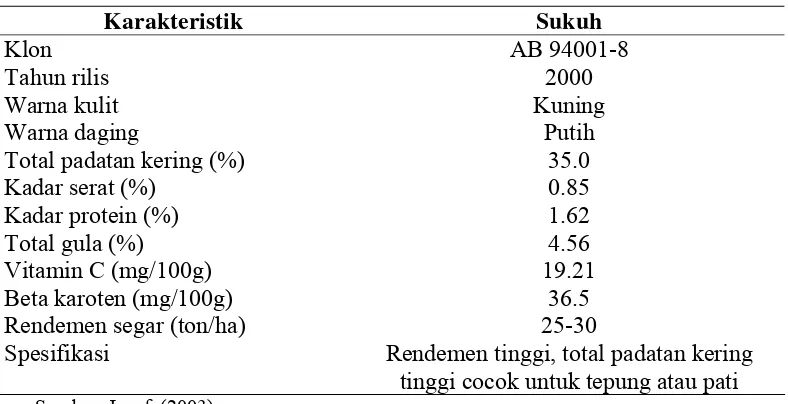
Gambar 11 Ubi jalar varietas Sukuh
Tabel 10 Karakteristik ubi jalar putih varietas Sukuh
Karakteristik Sukuh
Klon Tahun rilis Warna kulit Warna daging
Total padatan kering (%) Kadar serat (%)
Kadar protein (%) Total gula (%) Vitamin C (mg/100g) Beta karoten (mg/100g) Rendemen segar (ton/ha) Spesifikasi
AB 94001-8 2000 Kuning
Putih 35.0 0.85 1.62 4.56 19.21
36.5 25-30
Rendemen tinggi, total padatan kering tinggi cocok untuk tepung atau pati
Sumber: Jusuf (2003)
[image:40.595.117.511.351.553.2]Tabel 11 Komposisi proksimat (g/100g berat kering) tepung ubi jalar dengan teknik pengeringan drum dryer dan udara panas
Teknik pengeringan Parameter
drum dryer udara panas
Protein Lemak
Total serat makanan Abu
Total fosfor Total karbohidrat
6.5 ± 0.1 1.1 ± 0.07 17.5 ± 0.2 1.0 ± 0.06 0.1 ± 0.01 73.0 ± 0.6
6.3 ± 0.1 1.1 ± 0.06 17.2 ± 0.2 1.1 ± 0.07 0.11 ± 0.01
73.6 ± 0.7
Sumber : Yadav et al. (2006)
Mayastuti (2002) melaporkan berdasarkan analisa HPLC, konsentrasi gula ubi jalar varietas Cilembu yang dipanggang meningkat dibandingkan dengan konsentrasi gula ubi jalar Cilembu mentah (Tabel 12). Perubahan terbesar adalah pada glukosa yang meningkat sekitar 6-8% setelah dipanggang (suhu 200oC). Hal ini disebabkan oleh pada suhu pemanggangan terjadi hidrolisis karbohidrat kompleks menjadi karbohidrat yang lebih sederhana.
Tabel 12. Kisaran konsentrasi gula ubi jalar varietas Cilembu Kisaran konsentrasi (%)* Jenis gula
ubi mentah ubi panggang
Fruktosa 0.742-1.793 5.371-10.158
Glukosa 1.603-2.667 7.945-10.852
Sukrosa 0.360-1.466 0.693-1.514
Maltosa 0.386-1.970 0.622-1.872
Rafinosa 0.130-0.430 0.646-1.136
*kisaran konsentrasi dipengaruhi faktor penyimpanan ubi selama 3 bulan Sumber : Mayastuti (2002)
F. METODE ISOLASI OLIGOSAKARIDA
[image:41.595.111.514.433.574.2]1. Ekstraksi
Pemilihan metode ekstraksi bergantung pada senyawa yang ingin diekstrak. Ekstraksi dengan pelarut organik digunakan untuk pemurnian oligosakarida. Pelarut organik yang hidrofilik seperti alkohol dan air (Kim et al. 2003). Pelarut organik yang hidrofobik seperti heksan dan kloroform.
2. Kromatografi
Kromatografi merupakan metode yang sering digunakan untuk pemurnian oligosakarida. Kromatografi kolom digunakan dengan adsorben selektif seperti silika magnesium asam dan karbon aktif. Kromatografi kolom berkembang dengan menggunakan resin pertukaran-ion, selulosa bubuk, dan dekstran ikatan-silang. Resin berguna untuk memisahkan kelompok oligosakarida yang mampu terion.
Isolasi oligosakarida dapat dilakukan dengan kromatografi kertas dan kromatografi lapis tipis. Kromatografi lapis tipis lebih singkat dibandingkan kromatografi kertas atau kolom. Metode ini berguna untuk identifikasi oligosakarida secara kualitatif dan untuk persiapan prosedur analisa.
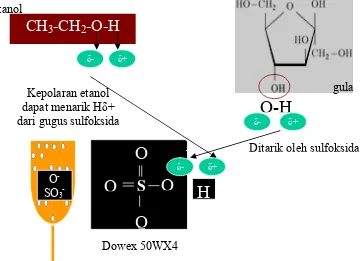
Conkerton (1983) mengisolasi oligosakarida pada kedelai dengan menggunakan etanol 70% untuk mengekstrak karbohidrat. Kemudian menggunakan heksan untuk mengekstrak lemak kedelai yang dilanjutkan dengan pemisahan protein dengan menggunakan alkohol dan sentrifugasi. Protein akan terlarut dalam alkohol. Selanjutnya supernatan diekstraksi dengan tahapan kromatografi kolom pertukaran ion Dowex 50WX4 resin yang dielusikan dengan air. Hasil yang diperoleh dengan analisa HPLC terbaca 90% fraksi-fraksi karbohidrat bebas dan diperoleh stakiosa, rafinosa, glukosa dan fruktosa.
O
-SO3-
H
CH
3-CH
2-O-H
O
O
O
δ
-O-H
Ditarik
O
δ+
δ
-δ+
δ-
δ+
S
Ditarik oleh sulfoksida Kepolaran etanol
dapat menarik Hδ+ dari gugus sulfoksida
Dowex 50WX4
gula etanol
menghilangkan senyawa alkaloid sedangkan fraksi yang terbawa oleh fase air diperoleh ekstrak oligosakarida yang tinggi dengan kisaran 87-90%.
[image:43.595.113.474.297.558.2]Interaksi gula dengan kromatografi pertukaran ion Dowex 50WX4, mempengaruhi pergerakan gula. Suhartono (1989) menjelaskan kromatografi pertukaran ion memanfaatkan perbedaan afinitas molekul bermuatan di dalam larutan dengan senyawa tidak reaktif yang berfungsi sebagai pengisi kolom yang bermuatan berlawanan. Dowex 50WX4 memiliki gugus fungsional O -SO3- sebagai penukar kation. Mekanisme interaksi gula dengan gugus fungsional O-SO3- dapat dilihat pada Gambar 12.
Gambar 12 Mekanisme isolasi oligosakarida dengan kromatografi pertukaran ion Dowex 50WX4
dan parsial negatif. Semakin besar molekul maka semakin banyak atom yang mengganggu terikatnya H+ (dari gula) dengan gugus sulfoksida yang parsial negatif. Hal ini mengakibatkan molekul gula yang besar akan turun terlebih dahulu dari kolom. Pada molekul gula yang kecil, halangan (gangguan atom molekul lain) tidak terlalu banyak sehingga atom H+ gula akan terikat baik pada matriks sulfoksida.
3. Pemekatan
Metode lain untuk mendapatkan oligosakarida adalah dengan pemekatan pada kondisi tertentu seperti dengan penguapan pada kondisi vakum dengan suhu rendah atau kering beku. Teknik ini berguna untuk pemekatan larutan dari senyawa biologi yang sensitif pada suhu tinggi atau mudah terhidrolisis pada larutan air. Tahapan berikutnya adalah dengan pemurnian dan isolasi akhir oligosakarida dengan menggunakan senyawa organik berberat molekul rendah (metanol), etanol dan propil alkohol; keton (aseton dan butanon).
4. Membran Ultrafiltrasi
Kim et al. (2003) melaporkan bahwa oligosakarida dapat dimurnikan dengan membran ultrafiltrasi. Membran ultrafiltrasi digunakan untuk memisahkan oligosakarida dari polisakarida dan protein berdasarkan berat molekul, dengan tekanan rendah pada kisaran 10-100psi.
III. METODOLOGI
A. BAHAN DAN ALAT
Bahan baku yang digunakan adalah ubi jalar varietas Sukuh yang berasal dari the International Center Potato (CIP), Ciapus-Bogor. Kultur BAL yang digunakan adalah Lactobacillus casei Shirota (L. casei Shirota), L. casei Rhamnosus, Lactobacilus galur Fl dan G3, Bifidobacterium longum dan B. bifidum. Bakteri patogen yang digunakan adalah Escherichia coli, Salmonella sp dan Bacillus cereus.
Bahan-bahan untuk ekstraksi adalah air (air demineralisasi) dan etanol 70%. Bahan untuk isolasi oligosakarida adalah kromatografi kolom Dowex 50WX4 (H+, 200-400 mesh) dan etanol 30%. Bahan untuk analisis oligosakarida adalah etil asetat, 2-propanol, etanol, difenilamin, anilin, asam ortofosfat dan Pb-asetat jenuh. Standar yang digunakan adalah fruktosa (SIGMA), glukosa (MERCK), sukrosa (FLUKA), maltosa (MERCK), rafinosa (SIGMA), maltotriosa (FLUKA), stakiosa (SIGMA), oligofruktosa (ORAFTI) dan inulin (MERCK). Bahan-bahan yang digunakan pada analisis mikrobiologi adalah Nutrient Broth (NB)(OXOID), Nutrient Agar (NA) (DIFCO), de Mann Rogosa Broth (MRSB) (OXOID), de Mann Rogosa Agar (MRSA) (OXOID), media berbasis MRS (komposisi pada Lampiran 1), Eosine Methylene Blue Agar (EMBA) (MERCK), gliserol 2%, H2SO4 0.05 M, KOH 0.05 N, NaCl 0.85%, aquades dan spirtus.
B. METODE PENELITIAN
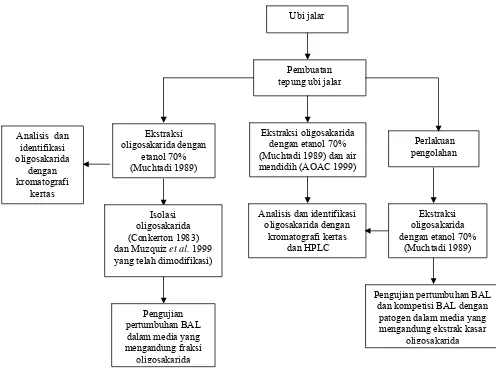
[image:46.595.76.572.286.655.2]Penelitian ini terbagi ke dalam lima tahap penelitian, meliputi (1) Ekstraksi oligosakarida, (2) Isolasi oligosakarida, (3) Pengaruh pengolahan terhadap kandungan oligosakarida tepung olahan ubi jalar, (4) Pengujian fraksi ekstrak oligosakarida dan ekstrak kasar oligosakarida tepung olahan ubi jalar dalam mendukung pertumbuhan BAL secara in vitro dan (5) Kompetisi BAL dan bakteri patogen dalam medium dengan ekstrak kasar oligosakarida tepung olahan ubi jalar sebagai sumber gula secara in vitro. Skema penelitian dapat digambarkan dengan diagram alir pada Gambar 13.
Gambar 13 Diagram alir penelitian
Ubi jalar
Pembuatan tepung ubi jalar
Ekstraksi oligosakarida dengan
etanol 70% (Muchtadi 1989) Analisis dan
identifikasi oligosakarida
dengan kromatografi
kertas
Isolasi oligosakarida (Conkerton 1983)
dan Muzquiz et al. 1999
yang telah dimodifikasi)
Pengujian pertumbuhan BAL
dalam media yang mengandung fraksi
oligosakarida
Analisis dan identifikasi oligosakarida dengan
kromatografi kertas dan HPLC Ekstraksi oligosakarida
dengan etanol 70% (Muchtadi 1989) dan air mendidih (AOAC 1999)
Perlakuan pengolahan
Ekstraksi oligosakarida dengan etanol 70%
(Muchtadi 1989)
Pengujian pertumbuhan BAL dan kompetisi BAL dengan
patogen dalam media yang mengandung ekstrak kasar
1. Ekstraksi Oligosakarida
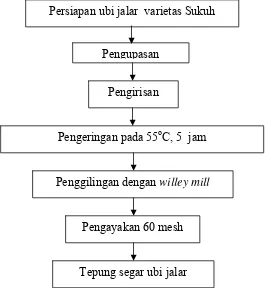
a. Pembuatan tepung ubi jalar.
[image:47.595.196.461.265.553.2]Ubi jalar segar dibersihkan dan dikupas, kemudian diiris dengan menggunakan slicer dengan ketebalan ±1 mm. Selanjutnya irisan ubi jalar dikeringkan dalam oven pengering suhu 55oC selama 5 jam hingga irisan ubi dapat dipatahkan dengan tangan. Irisan ubi kemudian digiling dengan willey mill dan diayak 60 mesh. Tahapan dalam pembuatan tepung segar ubi jalar dapat dilihat pada Gambar 14.
Gambar 14 Tahapan pembuatan tepung ubi jalar
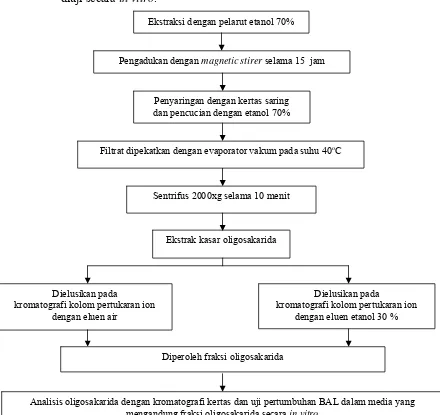
b. Ekstraksi dengan etanol 70% (Muchtadi 1989).
Sebanyak 10 gram tepung ubi jalar disuspensikan ke dalam 100 ml etanol 70% dan diaduk selama 15 jam menggunakan magnetic stirer pada suhu ruang. Setelah itu dilakukan penyaringan menggunakan kertas saring dan residu dicuci dengan etanol 70%. Filtrat yang diperoleh dipekatkan menggunakan evaporator vakum pada suhu 40oC. Hasil pemekatan disentrifus pada 2000xg selama 10 menit untuk mengendapkan kotoran
Persiapan ubi jalar varietas Sukuh
Pengupasan
Pengirisan
Pengeringan pada 55oC, 5 jam
Penggilingan dengan willey mill
dan padatan sehingga ekstrak mudah disterilisasi dengan membran steril 0.2 μm. Jenis oligosakarida yang terdapat dalam ubi jalar dianalisa dengan kromatografi kertas.
c. Ekstraksi dengan air mendidih (AOAC 1999).
Sebanyak 5 gram tepung ubi jalar dicampur dengan 40 ml air mendidih sambil diaduk dan pH diatur pada kisaran 6.5-8 dengan menambahkan 0.05 N KOH atau 0.05 N HCl. Elektroda dibilas dengan air mendidih. Ekstrak yang telah diatur pH-nya kemudian dipindahkan ke dalam labu volumetrik 100 ml dan ditera mencapai 100 ml. Ekstrak dipertahankan pada suhu 85oC±2oC dengan pengadukan terus menerus selama 10 menit. Analisa oligosakarida dilakukan terhadap ekstrak dengan kromatografi kertas.
2. Isolasi Oligosakarida (Conkerton et al. 1983 dan Muzquiz et al. 1999 yang telah dimodifikasi)
Ekstrak kasar oligosakarida yang diperoleh selanjutnya dimurnikan dengan kromatografi kolom pertukaran ion resin Dowex 50WX4 (H+, 200-400 mesh) dengan modifikasi eluen yang digunakan. Untuk mengelusi oligosakarida digunakan dua jenis eluen yaitu air dan etanol 30%. Laju alir eluen adalah 1 ml/menit. Sebanyak 1 ml perfraksi oligosakarida dikumpulkan dan diukur dengan refraktometer. Fraksi dengan kandungan padatan terlarut lebih 0oBrix selanjutnya diidentifikasi jenis oligosakaridanya dengan kromatografi kertas. Diagram alir isolasi oligosakarida tepung ubi jalar dapat dilihat pada Gambar 15. Fraksi yang memiliki komposisi oligosakarida yang sama dikumpulkan dan diuji kemampuannya dalam mendukung pertumbuhan BAL secara in vitro.
3. Pengaruh Pengolahan terhadap Kandungan Oligosakarida Tepung Olahan Ubi Jalar
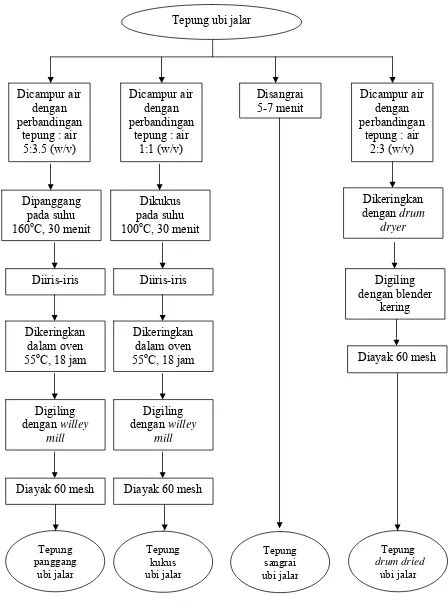
a. Proses pengolahan tepung ubi jalar.
dan dipanggang pada oven 160oC selama 30 menit. Perlakuan kedua, tepung ubi jalar dicampur air dengan perbandingan 1:1 (w/v) dan dikukus selama 30 menit. Perlakuan ketiga adalah tepung ubi jalar disangrai selama 5-7 menit tanpa penambahan air. Perlakuan keempat tepung ubi jalar dicampur air hingga kekentalan menyerupai pasta dengan perbandingan tepung dan air 2:3 (w/v). Seluruh adonan yang diperoleh ditepungkan dan diayak kembali agar ukuran partikel yang diperoleh seragam. Diagram alir tepung olahan ubi jalar dapat dilihat pada Gambar 16. Tepung olahan ubi jalar diekstrak dengan etanol 70%. Ekstrak kasar oligosakarida tepung olahan ubi jalar diidentifikasi oligosakaridanya dan diuji secara in vitro.
Gambar 15 Isolasi oligosakarida dari tepung ubi jalar (Conkerton et al. 1983 dan Muzquiz et al. 1999 yang telah dimodifikasi).
Ekstrak kasar oligosakarida
Dielusikan pada
kromatografi kolom pertukaran ion dengan eluen air
Analisis oligosakarida dengan kromatografi kertas dan uji pertumbuhan BAL dalam media yang
mengandung fraksi oligosakarida secara in vitro
Dielusikan pada
kromatografi kolom pertukaran ion dengan eluen etanol 30 % Ekstraksi dengan pelarut etanol 70%
Pengadukan dengan magnetic stirer selama 15 jam
Penyaringan dengan kertas saring dan pencucian dengan etanol 70%
Sentrifus 2000xg selama 10 menit
Filtrat dipekatkan dengan evaporator vakum pada suhu 40oC
Diayak 60 mesh Dicampur air
dengan perbandingan
tepung : air 5:3.5 (w/v)
Dicampur air dengan perbandingan
tepung : air 1:1 (w/v)
Disangrai 5-7 menit
Dicampur air dengan perbandingan
tepung : air 2:3 (w/v)
Dipanggang pada suhu 160oC, 30 menit
Dikukus pada suhu 100oC, 30 menit
Dikeringkan dengan drum
dryer
Diiris-iris Diiris-iris
Dikeringkan dalam oven 55oC, 18 jam
Dikeringkan dalam oven 55oC, 18 jam
Digiling dengan willey
mill
Digiling dengan willey
mill
Diayak 60 mesh Diayak 60 mesh
Digiling dengan blender
kering
Tepung panggang
ubi jalar
Tepung sangrai ubi jalar Tepung
kukus ubi jalar
Tepung drum dried
ubi jalar
[image:50.595.90.538.81.685.2]Tepung ubi jalar
b. Identifikasi oligosakarida tepung olahan ubi jalar dengan kromatografi kertas dan HPLC.
Kandungan oligosakarida tepung olahan ubi jalar yang telah diekstraksi dengan etanol 70% selanjutnya dianalisis dengan kromatografi kertas dan HPLC. Metode dapat dilihat pada metode analisis kromatografi kertas dan analisis HPLC.
4. Pengaruh Metode Isolasi dan Proses Pengolahan terhadap Kemampuan Ekstrak untuk Mendukung Pertumbuhan BAL
a. Pertumbuhan BAL pada fraksi oligosakarida hasil isolasi.
Fraksi oligosakarida hasil isolasi dengan eluen etanol 30% diuji kemampuannya dalam mendukung pertumbuhan BAL secara in vitro. Fraksi dengan komponen oligosakarida yang sama dikelompokkan masing-masing pertiga fraksi yaitu fraksi A (fraksi 18-20), fraksi B (fraksi 21-23), fraksi C (fraksi 24-26), fraksi D (fraksi 27-29), fraksi E (fraksi 30-32), fraksi F (fraksi 33-35) dan fraksi G (fraksi 36-38). Fraksi yang telah dikelompokkan ini dianalisa Total Padatan Terlarut (TPT) nya. BAL yang digunakan adalah L. casei Rhamnosus. Sebagai media pertumbuhan, sebanyak 0.9 ml fraksi dengan TPT 5% di masukkan ke dalam 9 ml media berbasis MRS (Hidaka 1986). Kemudian 0.1 ml L. casei Rhamnosus diinokulasikan ke dalam media pertumbuhan sehingga jumlah pengujian awal L. casei Rhamnosus adalah 107 CFU/ml. Pertumbuhan L. casei Rhamnosus dihitung secara kuantitatif pada 0 jam, 24 jam dan 48 jam dalam media MRSA dengan metode agar tuang. Sebagai pembanding fraksi oligosakarida diganti dengan glukosa dan oligofruktosa. Sebagai kontrol digunakan etanol 30%, air dan ekstrak kasar oligosakarida dari tepung segar ubi jalar.
b. Pertumbuhan BAL pada ekstrak kasar oligosakarida tepung olahan ubi Jalar.
adalah media berbasis MRS dengan ekstrak kasar oligosakarida tepung olahan ubi jalar sebagai sumber gula. Sebagai pembanding digunakan ekstrak kasar oligosakarida dari tepung segar ubi jalar dan dua standar gula yaitu glukosa dan oligofruktosa.
Ekstrak kasar oligosakarida tepung olahan ubi jalar dipersiapkan dengan TPT 5% dan standar gula dengan konsentrasi 5%. Ekstrak kasar oligosakarida tepung olahan ubi jalar dan standar gula disterilkan dengan membran filter 0.22 μm. Sebanyak 1 ml ekstrak kasar oligosakarida dan standar masing-masing dimasukkan ke dalam dua tabung berisi 9 ml media berbasis MRS sehingga diperoleh kandungan ekstrak kasar oligosakarida 0.5% dan konsentrasi gula standar 0.5% dalam media pengujian.
BAL diinokulasikan masing-masing 0.1 ml ke dalam dua tabung media pengujian. Lactobacillus diinkubasi secara aerob dan Bifidobacterium diinkubasi secara anaerob pada suhu 37oC. Pertumbuhan BAL dihitung dengan mengukur absorbansi pada panjang gelombang (λ) 600 nm pada 0 jam dan 48 jam. BAL dengan pertumbuhan terbaik pada ekstrak ekstrak kasar oligosakarida tepung olahan ubi jalar dipilih untuk pengujian selanjutnya.
5. Kompetisi BAL dan Bakteri Patogen dalam Media yang Mengandung
Ekstrak Kasar Oligosakarida Tepung Olahan Ubi Jalar
a. Persiapan kultur bakteri uji.
Penyegaran BAL dilakukan dengan menginokulasikan BAL ke dalam 10 ml MRSB dan diinkubasi selama 48 jam sebelum uji kompetisi. Penyegaran patogen dilakukan dengan menginokulasikan patogen ke dalam 10 ml NB dan diinkubasi selama 24 jam sebelum uji. Penyegaran hanya dilakukan ketika uji dilakukan
berikut: BAL segar (setelah BAL ditumbuhkan 48 jam) disentrifus 3000 rpm selama 15 menit. Filtrat dibuang dengan cara dipipet sebanyak 9 ml dan di peroleh endapan BAL (pellet). Endapan BAL dimasukkan larutan pengencer 9 ml. Suspensi BAL siap digunakan. Persiapan patogen adalah sebagai berikut: patogen segar (setelah patogen ditumbuhkan 24 jam) diencerkan. Untuk E. coli dan Salmonella diencerkan 1000 kali dan B. cereus diencerkan 100 kali.
b. Uji kompetisi.
Pengujian kompetisi pertumbuhan BAL dan bakteri patogen dilakukan dengan menginokulasikan secara bersama-sama BAL dan bakteri patogen ke dalam satu medium. Sebanyak 8.1 ml media berbasis MRS steril dimasukkan 0.9 ml ekstrak kasar oligosakarida dengan TPT 5% sehingga kandungan ekstrak kasar oligosakarida dalam media menjadi 0.5% TPT. Sebanyak 1 ml BAL dan 0.1 ml patogen (setelah pengenceran) diinokulasikan ke dalam media kompetisi. Untuk menghindari kontaminasi maka uji kompetisi dibagi dalam 3 tabung terpisah yang akan diamati pada 0 jam, 24 jam dan 48 jam. BAL dan patogen dihitung secara kuantitatif dengan metode agar tuang.
D. METODE ANALISIS
1. Kadar Air (AOAC 1999)
% 100 x b
a c
TPT = −
Perhitungan : Berat sampel (gram) = W1
Berat sampel setelah dikeringkan (gram) = W2 Kehilangan berat (gram) = W1-W2 = W3
Persen kadar air (dry basis) 100%
2 3 x
W W =
Persen kadar air (wet basis) 100%
1 3 x
W W =
2. Total Padatan Terlarut (Apriyantono 1989)
Pengukuran total padatan terlarut (TPT) bertujuan untuk melihat kepekatan padatan yang terlarut yang berguna pada pengujian dengan kromatografi kertas dan uji pertumbuhan BAL.
Cawan porselen dikeringkan selama 2 jam dalam oven bersuhu 100oC, kemudian didinginkan dalam desikator hingga diperoleh berat tetap. Cawan tersebut kemudian ditimbang (a gram). Sebanyak 1 ml ekstrak kasar oligosakarida di tempatkan ke dalam cawan porselen tersebut dan ditimbang berat larutan ekstrak kasar oligosakarida (b gram). Cawan yang telah berisi ekstrak kasar oligosakarida kemudian ditempatkan dalam oven selama sehari semalam. Setelah kering, cawan berisi sampel ekstrak kasar oligosakarida didinginkan dalam desikator selama 10 menit atau hingga berat cawan stabil. Berat cawan yang berisi ekstrak kering kemudian diukur (c gram). Total padatan terlarut dihitung dari hasil perbandingan berat ekstrak setelah dikeringkan dengan berat ekstrak sebelum dikeringkan dan dikalikan 100%.
3. Analisa Oligosakarida dengan Kromatografi Kertas (Muchtadi et al.
1989)
pelarut ditempuh
yang jarak
komponen ditempuh
yang jarak Rf =
sebanyak 10 μl membentuk spot lingkaran kecil atau garis tipis. Standar rafinosa 1%, maltosa 1%, glukosa 1%, sukrosa 1%, fruktosa 1%, inulin 1%, stakiosa 1%, fruktooligosakarida 1% dan maltotriosa 1% juga diteteskan masing-masing sebanyak 10 μl ke atas kertas.
Kertas kromatografi yang telah diteteskan sampel dan standar gula, dimasukkan ke dalam chamber. Sisi kertas yang terdapat spot sampel dan standar gula terendam pelarut dengan tinggi pelarut setengah dari tinggi spot. Setelah itu, chamber ditutup rapat dan didiamkan selama 5 jam (Gambar 17).
[image:55.595.165.492.346.545.2]Area-area spot komponen oligosakarida disemprot dengan larutan pewarna berupa campuran difenilamin (4 g), anilin (4 ml) dan asam ortofosfat 80% (20 ml) di dalam 200 ml aseton. Kemudian kertas kromatografi dipanaskan dalam oven 100oC sehingga muncul warna biru kehijauan.
Gambar 17 Skema kromatografi kertas
Perhitungan laju migrasi sampel terhadap pelarut (Rf) adalah sebagai berikut:
chamber
pelarut tutup chamber
kertas kromatografi
Ws V x FP x Cs x As Ap Cp (%)=
4. Analisa Oligosakarida dengan HPLC (AOAC 1999)
Ekstrak oligosakarida diidentifikasi dengan HPLC. Pengujian dilakukan di Sucofindo (Cikarang). Kolom yang digunakan adalah Bondclone 10μ NH2 dengan detektor refractive index, berlaju alir (Flow Rate (FR)) 1-1.2 ml/menit. Fase gerak yang digunakan adalah asetonitril dan air dengan perbandingan asetonitril:air (80:20). Volume sampel yang diinjeksikan adalah 20 μl. Standar gula yang digunakan adalah fruktosa, glukosa, sukrosa, maltosa, rafinosa, maltotriosa, .stakiosa, oligofruktosa dan inulin.
Setiap peak menunjukkan satu jenis komponen gula. Waktu retensi (Retention Time (RT)) dari setiap komponen gula dibandingkan dengan waktu retensi dari standar gula. Waktu retensi yang hampir sama menunjukkan jenis komponen yang diperkirakan sama. Perhitungan konsentrasi komponen gula dilakukan berdasarkan rumus sebagai berikut:
Ket : Cp = Konsentrasi sampel (%) Cs = Konsentrasi standar (%) Ap = Luas area sampel As = Luas area standar FP = Faktor pengenceran V = Volume larutan akhir
Ws = Berat samp