HIDROGENASI GLUKOSA MENJADI SORBITOL DENGAN
MENGGUNAKAN KATALIS Pd/C DALAM
PELARUT N-HEKSAN KERING
SKRIPSI
DERLIANY BELINDA SITOMPUL
080822021
PROGRAM STUDI SARJANA KIMIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
HIDROGENASI GLUKOSA MENJADI SORBITOL DENGAN
MENGGUNAKAN KATALIS Pd/C DALAM
PELARUT N-HEKSAN KERING
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
DERLIANY BELINDA SITOMPUL 080822021
PROGRAM STUDI SARJANA KIMIA DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : HIDROGENASI GLUKOSA MENJADI SORBITOL
DENGAN MENGGUNAKAN KATALIS Pd/C DALAM PELARUT N-HEKSAN KERING
Kategori : SKRIPSI
Nama : DERLIANY BELINDA SITOMPUL
Nomor Induk Mahasiswa : 080822021
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Juni 2010
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Andriayani, MSi. Dra. Saur Lumban Raja, MSi.
NIP 196903051999032001 NIP 195506231986011002
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
HIDROGENASI GLUKOSA MENJADI SORBITOL DENGAN MENGGUNAKAN KATALIS Pd/C DALAM PELARUT N-HEKSAN KERING
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juni 2010
PENGHARGAAN
Puji dan Syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa, atas limpahan kasih dan karunia-Nya sehingga skripsi ini dapat diselesaikan tepat pada waktunya.
Ucapan terima kasih yang sebesar-besarnya kepada kedua orang tua: Drs. D. Sitompul dan Dra. D. Simatupang, Apt. dan keluarga yang telah banyak membantu dan memberi dukungan baik secara moril maupun materil. Dan dengan segala kerendahan hati saya ucapkan terima kasih kepada: Ibu Dra. Saur Lumban Raja, M.Si selaku dosen pembimbing pertama dan Ibu Andriayani, Spd, M.Si selaku dosen pembimbing kedua yang telah banyak memberikan bimbingan dan arahan kepada penulis selama melakukan penelitian hingga selesainya penulisan skripsi ini. Kepada Ibu Dr. Rumondang Bulan, MS dan Bapak Drs. Firman Sebayang, MS selaku Ketua dan Sekretaris Departemen Kimia FMIPA-USU Medan. Bapak Prof. DR. Seri Bima Sembiring, M.Sc selaku Ketua Bidang Kimia Anorganik. Bapak Drs. Nimpan bangun, M.Sc beserta seluruh Asisten Laboratorium Kimia Anorganik FMIPA USU atas bantuan dan fasilitas yang diberikan selama ini. Ucapan Terima kasih juga ditujukan kepada seluruh Bapak dan Ibu dosen departemen Kimia yang telah mendidik penulis selama ini. Dan kepada pihak Bea Cukai–Belawan atas bantuannya menganalisa sampel. Seluruh Staff pegawai FMIPA USU medan yang telah banyak membantu penulis selama masa perkuliahan. Serta kepada rekan-rekan perkuliahan yang telah banyak memberikan dukungan dalam penelitian ini.
ABSTRAK
HYDROGENATION OF GLUCOSE TO SORBITOL WITH USING A CATALYST OF Pd/C IN N-HEXANE SOLVENTS DRY
ABSTRACT
DAFTAR ISI
Daftar Lampiran ix
Bab 1 Pendahuluan 1
1.1 Latar Belakang 1
1.2 Permasalahan 3
1.3 Tujuan Penelitian 4
1.4 Manfaat Penelitian 4
1.5 Lokasi Penelitian 4
1.6 Metodologi Penelitian 4
Bab 2 Tinjauan Pustaka 5
2.1 Karbohidrat 5
2.1.1 Klasifikasi Karbohidrat dan Penamaan 5
2.2 Glukosa 6
2.5.1.1 Katalis Homogen 14
2.5.1.2 Katalis Heterogen 15
2.5.2 Reaksi-Reaksi Yang Dikatalisis Oleh Palladium 16
2.5.3 Reaksi-Reaksi Yang Dikatalisis Oleh Palladium Karbon 17
2.6 Kromatografi Cair Kinerja Tinggi (KCKT) 20
Bab 3 Metodologi Penelitian 23
3.1 Alat dan bahan 23
3.1.1 Alat-alat 23
3.1.2 Bahan-bahan 24
3.2 Prosedur penelitian 24
3.2.1 Hidrogenasi Glukosa 23
3.2.2 Uji Fehling untuk Glukosa 25
3.2.3 Uji Tollens untuk Glukosa 25
3.3.1 Hidrogenasi Glukosa 26
3.3.2 Uji Fehling Untuk Glukosa 27
3.3.3 Uji Tollens Untuk Glukosa 27
Bab 4 Hasil dan Pembahasan 28
4.1 Hasil Penelitian 28
4.2 Pembahasan 28
4.2.1 Spektrum FT-IR Hasil Hidrogenasi (Produk) Fraksi Filtrat 30 4.2.2 Spektrum FT-IR Hasil Hidrogenasi (Produk) Fraksi Residu 31
4.2.3 Kromatogram HPLC Hasil Hidrogenasi (Produk) 32
Bab 5 Kesimpulan dan Saran 35
5.1 Kesimpulan 35
5.2 Saran 35
DAFTAR LAMPIRAN
Halaman Gambar 1 Spektrum FT-IR Glukosa berdasarkan SDBS
Gambar 2 Spektrum FT.IR Sorbitol berdasarkan SDBS Gambar 3 Spektrum FT-IR Glukosa
ABSTRAK
HYDROGENATION OF GLUCOSE TO SORBITOL WITH USING A CATALYST OF Pd/C IN N-HEXANE SOLVENTS DRY
ABSTRACT
BAB 1
PENDAHULUAN
1.1Latar Belakang
Karbohidrat merupakan senyawa karbon, hidrogen dan oksigen yang terdapat dalam alam. Banyak karbohidrat mempunyai rumus empiris CH2O; misalnya, rumus molekul
glukosa ialah C6H12O6 (enam kali CH2O) (Fessenden et al, 1986). Molekul
karbohidrat paling sederhana yang tidak terikat pada karbohidrat lain dinamakan gula sederhana atau monosakarida, kedua nama ini sering dipertukarkan (Wilbraham et al, 1992).
Glukosa adalah monosakarida yang terpenting, kadang-kadang disebut gula darah (karena dijumpai dalam darah), gula anggur (karena dijumpai dalam buah anggur, atau dekstrosa (karena memutar bidang polarisasi ke kanan) (Fessenden et al, 1986). Glukosa dapat mengalami beberapa reaksi, antara lain: reaksi reduksi, oksidasi dan hidrogenasi. Glukosa dapat direduksi olek zat pereduksi, seperti hidrogen dan
katalis atau suatu hidrida logam, menjadi polialkohol yang disebut alditol. Produk reduksi glukosa disebut glusitol (glucitol) atau sorbitol.
Glukosa juga dapat mengalami reaksi hidrogenasi mengha silkan sorbitol.
Beberapa reaksi hidrogenasi yang pernah dilakukan, antara lain: hidrogenasi glukosa dalam pelarut air melalui dua tahap reaksi. Reaksi tahap pertama reduksi air menjadi gas hidrogen dan oksigen oleh katalis bentonit terpilar TiO2. Reaksi tahap kedua,
hidrogen yang dihasilkan digunakan untuk mereduksi glukosa menjadi sorbitol dengan logam nikel sebagai katalis selama 30 hari dibawah sinar UV matahari (Rosida. M., 2009). Hidrogenasi glukosa menggunakan katalis Pd/γ-Al2O3 pada
tekanan 150 Psi (10,20 atm) dalam pelarut air dan dipanaskan pada suhu 1000C menghasilkan sorbitol (Sari, H. P., 2009). Hidrogenasi glukosa menjadi sorbitol menggunakan katalis nikel dalam reaktor berpengaduk dan bertekanan tinggi (Tjatoer, W., 2007). Hidrogenasi glukosa menggunakan katalis Ru/Al2O3 C, Ru/TiO2 dan
Ni/SiO2 pada tekanan 120 bar dan suhu 120 0C (Schimpf, S et al, 1997), hidrogenasi
glukosa menggunakan katalis Ni/SiO2 ditambah etilendiamina pada tekanan 120 bar
dan suhu 120 0C (Claus, P., 2006), serta hidrogenasi glukosa menggunakan katalis RuCl3 dengan kelebihan KBH4 (5:1) dalam pelarut air dengan tekanan 4,0 MPa dan
suhu 800C (Luo. H. S et al, 2002).
Sorbitol alamiah telah diisolasi dari banyak buah (misalnya, buah ceri, priem, apel dan berri abu gunung) dan dari lumut serta rumput laut. Sorbitol sintetik digunakan sebagai pemanis sintetik (Fessenden et al, 1986).
Sorbitol adalah salah satu pemanis alternatif lain yang sering digunakan dalam
gula pengganti pada penderita diabetes melitus. Sorbitol yang dicampur dengan
kalium nitrat dapat digunakan untuk bahan bakar roket amatir. Dengan proses reduksi, sorbitol dapat dijadikan bahan bakar biomass
Katalis Pd/C telah banyak digunakan dalam reaksi kimia, antara lain: reaksi
oksidasi etanol menjadi asam asetat (Gunawan, M. L., 1989), reaksi hidrogenasi fenol secara endotermis membentuk sikloheksanol (Dianita, D., 2009).
Katalis Pd/C mempunyai aktifitas spesifik yang tinggi, namun memiliki tingkat volatilitas besar, mudah teroksidasi dan mudah rusak pada suhu 500-9000C.. Selain itu, logam paladium tersebut mempunyai kelimpahan yang rendah dan harga yang cukup mahal. Katalis Pd/C efektif sebagai katalis oksidasi dan reduksi. (Dianita, D., 2009).
Hidrogenasi glukosa pernah dilakukan dengan menggunakan pelarut polar yaitu air, maka dalam hal ini berdasarkan latar belakang diatas penulis ingin melakukan hidrogenasi glukosa menjadi sorbitol dengan menggunakan pelarut non-polar yaitu pelarut N-heksan kering dengan menggunakan katalis heterogen Pd/C.
1.2Pemasalahan
Dalam reaksi hidrogenasi glukosa menjadi sorbitol yang telah dilakukan dengan pelarut air masih diperoleh hasil yang rendah dan data untuk mendukung perolehan hasil tersebut masih kurang. Hal ini diduga karena gas hidrogen yang bersifat non
1.3Tujuan Penelitian
Untuk menghidrogenasi glukosa menjadi Sorbitol dengan memanfaatkan katalis Pd/C dalam pelarut N-heksan kering.
1.4 Manfaat Penelitian
Hasil penelitian diharapkan dapat memberikan informasi ilmiah terhadap perkembangan ilmu kimia anorganik serta meningkatkan daya guna katalis Pd/C dalam industri kimia pada proses hidrogenasi glukosa menjadi sorbitol.
1.5 Lokasi Penelitian
Penelitian dilakukan di laboratorium Kimia Anorganik FMIPA-USU Medan. Karakterisasi analisa spekstroskopi FT-IR dilakukan di laboratorium Bea Cukai Belawan-Medan dan analisa HPLC dilakukan di laboratorium Bea Cukai Jakarta.
1.6 Metodologi Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1 Karbohidrat
Karbohidrat adalah senyawa yang mengandung unsur-unsur: C, H dan O, terutama terdapat didalam tumbuh-tumbuhan yaitu kira-kira 75%. Dinamakan karbohidrat karena senyawa-senyawa ini sebagai hidrat dari karbon; dalam senyawa tersebut perbandingan antara H dan O sering 2 berbanding 1 seperti air. Jadi C6H12O6 dapat
ditulis C6(H2O)6, C12H22O11 sebagai C12 (H2O)11 dan seterusnya, dan perumusan
empiris ditulis sebagai CnH2nOn atau Cn (H2O)n (Sastrohamidjojo, H., 2005).
2.1.1 Klasifikasi Karbohidrat dan Penamaan
Karbohidrat dibagi menjadi beberapa klas atau golongan sesuai dengan sifat-sifatnya terhadap zat-zat penghidrolisis. Karbohidrat atau gula dibagi menjadi empat klas
pokok:
1. Gula yang sederhana atau monosakarida, kebanyakan adalah
senyawa-senyawa yang mengandung lima dan enam atom karbon. Karbohidrat yang mengandung 6 karbon disebut heksosa. Gula yang mengandung 5 karbon disebut pentosa. Kebanyakan gula sederhana adalah merupakan polihidroksi aldehida yang disebut aldosa dan polihidroksi keton disebut ketosa.
2. Oligosakarida, senyawa berisi dua atau lebih gula sederhana yang
3. Polisakarida, di mana di dalamnya terikat lebih dari satu gula sederhana yang
dihubungkan dalam ikatan glikosida. Polisakarida meliputi pati, sellulosa dan dekstrin.
4. Glikosida, dibedakan dari oligo dan polisakarida yaitu oleh kenyataan bahwa mereka mengandung molekul bukan gula yang dihubungkan dengan gula oleh ikatan glikosida (Sastrohamidjojo, H., 2005).
2.2 Glukosa
Glukosa merupakan salah satu tipe monosakarida dengan rumus molekul C6H12O6;
padatan kristal berwarna putih, berasa manis [75% dari kemanisan gula pasir (sukrosa)
tetapi nilai kalornya sama]. Merupakan gula yang banyak ditemukan di alam terutama
dalam buah anggur (karenanya disebut gula anggur). Glukosa juga disebut dekstrosa karena strukturnya sebagian besar berada dalam bentuk D- yakni D-glukosa. Glukosa merupakan monomer yang ditemukan di alam sebagai dimer sampai polimer. Karbohidrat yang dikonsumsi tubuh umumnya diubah menjadi glukosa dan mengalami sirkulasi dalam tubuh (dalam darah mengandung ± 0,08% sedangkan dalam urine 0,2% glukosa). Dalam perdagangan, glukosa dibuat dari hidrolisa amilum (Mulyono, 2006).
Glukosa biasanya tersedia dalam bentuk zat berwarna putih atau kristal padat. Glukosa diproduksi secara komersil melalui hidrolisis pati dengan bantuan enzim. Glukosa dapat di reduksi menjadi sorbitol, yang biasanya dikenal sebagai glusitol. Dimana gugus aldehida pada glukosa diganti menjadi gugus alkohol dengan adanya penambahan gas hidrogen
Glukosa mudah teroksidasi oleh perak atau ion tembaga. Bila ditambahkan dengan larutan perak nitrat amoniak akan terjadi cermin perak. Mereduksi larutan-larutan Fehling yaitu dengan timbulnya endapan kupro oksida. Larutan Fehling terdiri atas larutan Fehling A: larutan CuSO4, dan larutan Fehling B: larutan dari Na-K-tartrat
2.3 Reaksi-Reaksi Glukosa
2.3.1 Oksidasi Glukosa
Suatu gugus aldehida sangat mudah dioksidasi menjadi suatu gugus karboksil. Uji kimiawi untuk aldehida tergantung pada mudahnya oksidasi ini. Gula yang dapat dioksidasi oleh zat pengoksidasi lembut seperti reagensia Tollens, suatu larutan basa dan Ag(NH3)2+, disebut gula pereduksi (karena zat pengoksidasi anorganik direduksi
dalam reaksi itu) (Fessenden et al, 1986).
a. Asam Aldonat
Produk oksidasi dari gugus aldehida suatu aldosa adalah suatu asam polihidroksi karboksilat, yang disebut asam aldonat (aldonic acid). Meskipun reagensia Tollens dapat mengakibatkan perubahan ini, suatu reagensia yang lebih mudah dan murah
untuk reaksi sintetik ialah larutan brom yang dibuffer (disangga).
CHO CO2H
(Fessenden et al, 1986).
b Asam Aldarat
CHO CO2H
(Fessenden et al, 1986).
c Asam Uronat
Meskipun tidak mudah dilakukan dilaboratorium, dalam sistem biologis gugus CH2OH ujung dapat dioksidasi dengan enzime tanpa teroksidasinya gugus aldehida.
Produknya disebut asam uronat (uronic acid).
[O] enzime
D-glukosa asam D-glukuronat(suatu asam uronat)
(Fessenden et al, 1986).
d Oksidasi Asam Periodat
Oksidasi asam periodat merupakan uji untuk 1,2-diol dan untuk 1,2- atau α- hidroksi
dari aldehida maupun keton. Suatu senyawa yang mengandung gugusan semacam itu dioksidasi dan dipaksapisah oleh asam periodat (HIO4). Dalam hal ini 1,2-diol
2.3.2 Reduksi Monosakarida
Baik aldosa maupun ketosa dapat direduksi oleh zat pereduksi karbonil, seperti hidrogen dan katalis atau suatu hidrida logam, menjadi polialkohol yang disebut alditol. Akhiran untuk nama dari salah satu polialkohol ini ialah –itol. Produk reduksi D-glukosa disebut D-glusitol (D-glucitol) atau sarbitol.
O
(Fessenden et al, 1986).
Beberapa reaksi hidrogenasi yang pernah dilakukan antara lain:
1. Hidrogenasi glukosa dalam pelarut air melalui dua tahap reaksi. Reaksi tahap
pertama reduksi air menjadi gas hidrogen dan oksigen oleh katalis bentonit terpilar TiO2. Reaksi tahap kedua, hidrogen yang dihasilkan digunakan untuk
2. Hidrogenasi glukosa menggunakan katalis Pd/γ-Al2O3 pada tekanan 150 Psi
(10,20 atm) dalam pelarut air dan dipanaskan pada suhu 1000C menghasilkan sorbitol 65.09% (Sari, H. P., 2009).
C H
3. Hidrogenasi glukosa menjadi sorbitol menggunakan katalis nikel dalam
reaktor berpengaduk dan bertekanan tinggi, mengasilkan sorbitol sebasar
Katalis
Katalis Persiapan Pendukung Kandungan logam
Ru3Ap Mempercepat Al2O3 C 2,75
5. Hidrogenasi glukosa menggunakan katalis Ni/SiO2 ditambah etilendiamina
pada tekanan 120 bar dan suhu 120 0C (Claus, P., 2006).
6. Hidrogenasi glukosa menggunakan katalis RuCl3 dengan kelebihan KBH4
2.4 Sorbitol
Bahan pemanis ini dikenal sebagai D-sorbitol, D-glucitol, L-gulitol, sorbit atau sorbol adalah monosakarida poliol mempunyai berat molekul 182,17 dengan rumus kimia C6H14O6. Kemanisannya hanya 0,5 kali gula tebu. Sorbitol larut dalam pelarut polar
seperti air dan alkohol. Sorbitol secara komersial dibuat dari glukosa dengan hidrogenasi dalam tekanan tinggi maupun reduksi elektrolit.
Sorbitol berupa senyawa yang berbentuk granul atau kristal dan berwarna putih dengan titik leleh berkisar antara 89-101°C, higroskopis dan berasa manis. Penggunaannya pada suhu tinggi tidak ikut berperan dalam reaksi pencoklatan (Maillard).
Kristal sorbitol mengandung 0,5 atau 1 molekul H2O. Kandungan kalorinya
3,994 K. Kalori setiap gram sama dengan kalori gula tebu, yaitu 3,940 K. Tujuh puluh
persen dari jumlah sorbitol yang masuk kedalam tubuh akan diubah menjadi CO2
tanpa menunjukan adanya kenaikan glukosa dalam darah sehingga sangat baik untuk penderita diabetes (Cahyadi. W., 2006).
2.4.1 Penggunaan Sorbitol
Sorbitol memiliki beberapa keunggulan dibanding gula lainnya. Rasanya cukup manis namun tidak merusak gigi. Poliol pada umumnya dan sorbitol khususnya, resisten terhadap metabolisme bakteri oral yang melepaskan asam dari reaksi penguraian gula
dan pati. Asam ini dapat mengerosi email / enamel gigi.
adalah sebagai pencegah kristalisasi dalam produk makanan, karena sifatnya yang
mampu mempertahankan kelembaban makanan yang cenderung mengering dan mengeras; agar bahan makanan tersebut tetap segar. Sorbitol juga sering dipakai sebagai bahan tambahan untuk obat kumur, sirup obat batuk dan pasta gigi.
Sorbitol juga cukup aman dipakai sebagai gula pengganti pada penderita diabetes melitus, karena penyerapannya lebih lambat daripada glukosa. Penyerapan yang lambat ini otomatis akan mengurangi derajat drastisnya peningkatan glukosa darah dan respons insulin. Kalori yang rendah juga sesuai dengan target pengendalian berat badan pada pasien diabetes melitus. Untuk tujuan ini sorbitol banyak digunakan untuk membuat produk makanan rendah kalori.
Di luar urusan makanan, sorbitol yang dicampur dengan kalium nitrat dapat digunakan untuk bahan bakar roket amatir. Dengan proses reduksi, sorbitol dapat dijadikan bahan bakar biomassa
2.4.2 Efek Samping Penggunaan Sorbitol
Sorbitol cukup aman dan jarang menimbulkan efek samping. Walaupun demikian ADI (acceptable daily intake) untuk sorbitol belum ditentukan sampai sekarang. Kelebihan konsumsi sorbitol dapat menimbulkan diare osmotik. Hal ini terjadi apabila sorbitol terdapat dalam saluran pencernaan dalam jumlah besar (lebih dari 50 gram per hari), sehingga tekanan osmosis dalam lumen usus lebih tinggi daripada sekitarnya. Hal ini menyebabkan sejumlah besar cairan yang ada di interstisial terdorong ke lumen usus, dan terjadilah diare. Efek samping lainnya adalah sakit perut dan kembung
2.5 Katalis
kemudian terbentuk kembali sebagai zat bebas. Selanjutnya bereaksi lagi dengan
pereaksi mempercepat reaksi dan bebas kembali. Demikian seterusnya berulang kali sehingga reaksi selesai.
Suatu reaksi yang menggunakan katalis disebut reaksi katalis dan prosesnya disebut katalisme (Syukri, 1999).
2.5.1 Pembagian Katalis
2.5.1.1 Katalis Homogen
Katalis homogen adalah katalis yang mempunyai fase sama dengan pereaksi (Hiskia, 2001). Katalis homogen umumnya bereaksi dengan satu atau lebih pereaksi untuk membentuk suatu zat antara yang selanjutnya bereaksi membentuk produk akhir reaksi. Contoh reaksi yang menggunakan katalis homogen adalah hidrolisis ester dengan katalis asam (Parker, 1982).
CH3COOC2H5(aq) + H2O(l) CH3COOH(aq) + C2H5OH(aq)
H+
Cara kerja katalis homogen umumnya melibatkan pembentukan senyawa-senyawa kompleks antara yang bersifat tidak stabil dalam tahap-tahap reaksi. Katalis dengan reaktan membentuk kompleks antara yang mengakibatkan reaktan dalam kompleks menjadi aktif membentuk produk baru dengan disertai pelepasan kembali
katalisatornya. Oleh karena itu, unsur-unsur transisi sangat berperan dalam reaksi katalitik karena sifatnya mudah membentuk senyawa kompleks.
Berikut ini dikemukakan beberapa contoh reaksi organik katalitik:
1. Pada reaksi hidrokarbonilasi alkena menjadi aldehida (artinya pengikatan
hidrogen dan karbonil, CO) dipakai katalisator Co(I) atau Rh(I):
Co(I) atau O
RHC = CH2 + H2 + CO RH2C – CH2 – C
Rh(I) H
Katalisator Co(I) dalam bentuk konpleks hidrokarbonil diduga mengalami
perubahan sebagai berikut:
HCo(CO)4 HCo(CO)3 + CO
2. Pada reaksi oksidasi etena menjadi metanal (proses Wacker) dipakai
katalisator Pd(II) dan Cu(II):
Pd(II) + Cu(II) O
H2C = CH2 + O2 CH3 – C
H
Pada proses ini dipakai katalisator PdCl2 yang pada awalnya diduga terjadi
reaksi dengan etena:
C2H4 + PdCl2 + H2O → CH3CHO + Pd + 2HCl
Oksidasi Pd kembali menjadi Pd(II) dipercepat dengan penambahan katalisator Cu(II):
Pd + 2Cu2+ → Pd2+ + 2Cu+,
Dan Cu+ mudah teroksidasi oleh udara kembali menjadi Cu2+:
4Cu+ + O2 + 4H+ → 4Cu2+ + 2H2O (Kristian et al, 2010).
Keuntungan dari katalisis homogen adalah kespesifikannya dan tidak membutuhkan suhu dan tekanan yang tinggi dalam reaksi. Kerugiannya dari katalisis homogen adalah kesulitan dalam pemisahan katalis dari produk, degradasi dari katalis dan harganya yang mahal (Leach. B, 1983).
2.5.1.2 Katalis Heterogen
Katalis heterogen adalah katalis yang mempunyai fasa yang tidak sama dengan fasa pereaksi. Pada umumnya katalis adalah padatan sedangkan pereaksi terbanyak adalah gas dan adakalanya cairan.
Contoh:
1. Proses Haber dalam pembuatan amoniak Fe
N2 + 3H2 2NH3
2. Proses kontak pada pembuatan H2SO4
Pt
2SO2 + O2 2SO3
3. Oksidasi amoniak pada pembuatan asam nitrat Fe2O3
Minyak tak jenuh lemak jenuh
5. Pembuatan asam klorida arang
H2 + Cl2 2HCl
(Hiskia, 2001).
2.5.2 Reaksi-reaksi yang Dikatalisis oleh Palladium
Telah lama diketahui bahwa senyawaan etilena dari palladium, misalnya, [C2H4PdCl2]2 cepat terdekomposisi dalam larutan air membentuk asetal dehida dan
logam Pd. Konversi reaksi stoikiometri ini kedalam suatu siklus (proses Wacker) membutuhkan kaitan bersama dari masing-masing reaksi yang diketahui:
C2H4 + PdCl2 + H2O → CH3CHO + Pd + 2HCl
Pd + 2CuCl2 → PdCl2 + 2CuCl
2CuCl + 2HCl + ½O2 → 2CuCl2 + H2O
C2H4 + ½O2 → CH3CHO
Karena reaksi berlangsung dalam larutan PdII dengan konsentrasi ion klorida >
0,2M, logamnya paling mungkin ada sebagai [PdCl4]2-. Reaksi berikut kemudian
terjadi:
[PdCl4]2- + C2H4 [PdCl3(C2H4)]- + Cl
[PdCl3(C2H4)]- + H2O [PdCl2(H2O)(C2H4)] + Cl
-[PdCl2(H2O)C2H4] + H2O [PdCl2(OH)(C2H4)]- + H3O+
Mekanisme bagi oksidasi logam Pd oleh kompleks kloro CuII tidak diketahui dengan baik, namun pemindahan elektron melalui jembatan halida mungkin terlibat. Oksidasi di udara yang sangat cepat dari kompleks kloro CuI diketahui lebih baik dan mungkin berlangsung melalui suatu kompleks awal oksigen:
CuCl2- + O2 ClCuO2 + Cl
-Diikuti oleh pembentukkan radikal seperti O2-, OH, atau H2O
Kereaktifan kompleks palladium dalam sistem lain telah dikaji secara luas, dan sekarang terdapat banyak reaksi katalitik yang menyangkut alkena, arena, CO, asetilena, dan sejenisnya. Perluasan proses Wacker menggunakan media selain air, dikenal; jadi dalam asam asetat, diperoleh vinil asetat sedangkan dalam alkohol, diperoleh vinil eter. Juga dengan alkena selain etilena, dapat diperoleh keton. Sebagai contoh, propene menghasilkan aseton. (Cotton et al, 1989)
2.5.3 Reaksi-reaksi yang Dikatalisis oleh Palladium Karbon
Katalis palladium karbon terdiri dari 3 komposisi palladium. Dimana tiap-tiap komposisi mempunyai aplikasi fungsi yang berbeda dalam reaksi kimia.
Komposisi dari katalis palladium karbon antara lain:
1. Sebanyak 5% palladium didalam katalis palladium karbon
Mempunyai aplikasi penggunaan dalam reaksi kimia antara lain sebagai berikut:
a. Hidrogenasi alkena dan alkuna
b. Hidrogenasi aromatik aldehid menjadi alkohol
c. Hidrogenasi untuk Aldehida Aromatik Hidrokarbon
d. Hidrogenasi Senyawa Anilin
e. Reduksi untuk Senyawa Alkil dari Haloanilines
2. Sebanyak 10% palladium didalam katalis palladium karbon
a. Pengurangan Alkilasi
b. Dehidrohalogenasi dari Alifatik dan Campuran Aromatik
c. Hidrogenasi Piridin menjadi Pipiridin
d. Sintesis Hidrosilamin
3. Sebanyak 0,5% palladium didalam katalis palladium karbon
Digunakan untuk hidrogenasi hydroxybenzaldehyde β-(4-CBA) untuk asam β -toluen dalam menghasilkan Terephthalic Acid (PTA). Yang pengotor dipisahkan oleh kristal.
2.6 Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi Cair Kinerja Tinggi atau KCKT atau biasa juga disebut dengan HPLC (High Performance Liquid Chromatography) dikembangkan pada akhir tahun 1960-an dan awal tahun 1970-an. Saat ini, KCKT merupakan teknik pemisahan yang diterima secara luas untuk analisis dan pemurnian senyawa tertentu dalam suatu sampel pada sejumlah bidang, antara lain: farmasi, lingkungan, bioteknologi, polimer, dan industri-industri makanan. Beberapa perkembangan KCKT terbaru antara lain: miniaturisasi sistem KCKT, penggunaan KCKT untuk analisis asam-asam nukleat, analisis protein, analisis karbohidrat, dan analisis senyawa-senyawa kiral.
Kegunaan umum KCKT adalah untuk: pemisahan sejumlah senyawa organik, anorganik, maupun senyawa biologis; analisis ketidakmurnian (impurities); analisis senyawa-senyawa tidak mudah menguap (non-volatil); penentuan molekul-molekul total, ionik, maupun zwitter ion; isolasi dan pemurnian senyawa; pemisahan senyawa-senyawa yang strukturnya hampir sama;pemisahan senyawa-senyawa-senyawa-senyawa dalam jumlah sekelumit (trace elements), dalam jumlah banyak, dan dalam skala proses industri. KCKT merupakan metode yang tidak destruktif dan dapat digunakan baik untuk analisis kualitatif maupun kuantitatif.
KCKT paling sering digunakan untuk: menetapkan kadar senyawa-senyawa tertentu seperti asam-asam amino, asam-asam nukleat, dan protein-protein dalam
cairan fisiologis; menentukan kadar senyawa-senyawa aktif obat, produk hasil sampingan proses sintetis, atau produk-produk degradasi dalam sedian farmasi; memonitor sampel-sampel yang berasal dari lingkungan; memurnikan senyawa dalam suatu campuran; memisahkan polimer dan menentukan distribusi berat molekulnya dalam suatu campuran; kontrol kualitas; dan mengikuti jalannya reaksi sintetis.
Kromatografi merupakan teknik yang mana solut atau zat-zat terlarut terpisah
oleh perbedaan kecepatan elusi, dikarenakan solut-solut ini melewati suatu kolom kromatografi. Pemisahan solut-solut ini diatur oleh distribusi solut dalam fase gerak dan fase diam. Penggunaan kromatografi cair secara sukses terhadap suatu masalah yang dihadapi membutuhkan penggabungan secara tepat dari berbagai macam kondisi operasional seperti jenis kolom, fase gerak, panjang dan diameter kolom, kecepatan alir fase gerak, suhu kolom, dan ukuran sampel. Untuk tujuan memilih kombinasi kondisi kromatografi yang baik, maka dibutuhkan pemahaman yang mendasar tentang berbagai macam faktor yang mempengaruhi pemisahan pada kromatografi cair.
Instrumentasi KCKT pada dasarnya terdiri atas delapan komponen pokok yaitu (1) wadah fase gerak, (2) sistem penghantaran fase gerak, alat untuk memasukkan sampel, (4) kolom, (5) detektor, (6) wadah penampungan buangan fase gerak, (7) tabung penghubung dan (8) suatu komputer atau integrator atau perekam. Diagram blok untuk sistem KCKT ditunjukkan oleh gambar. (Ibnu Golib et al, 2007).
Pada beberapa tulisan, ”HP” pada HPLC diartikan ”tekanan tinggi” (high pressure) dan beberapa yang lainnya menghubungkan dengan masalah biaya bisa berpikir bahwa ”HP” adalah singkatan dari ”biaya yang tinggi” (high price) tetapi kebanyakan ”HP” itu berarti ”penampilan yang tinggi” (high performance) (Day et al, 2002).
Kromatografi Cair Kinerja Tinggi dapat memisahkan makromolekul, ion,
bahan alam yang tidak stabil, polimer dan berbagai gugus polifungsi dengan berat molekul tinggi. Berbeda dengan kromatografi gas, pemisahan pada KCKT adalah hasil antaraksi spesifik antaramolekul senyawa dengan fase diam dan fase gerak.
Kinerja kolom. Beberapa perangkat kondisi eksperimen dapat digunakan untuk mendapatkan pemisahan yang diinginkan dari komponen sampel dan ada perangkat yang lebih praktis daripada yang lainnya, sehingga perlu mencari optimasi.
Pertama-tama harus dipilih sistem KCKT yang tepat, karena itu semua parameter dalam persamaan yang tergantung kepada sistem atau kepada sifat fase diam dan fase gerak ditentukan dan tidak dapat dirubah.
Parameter tersebut adalah retensi relatif α, koefisian partisi dari senyawa yang
paling lama ditahan k’ (rasio partisi), dan bilangan pelat. Senyawa yang dianalisis biasanya memerlukan waktu dua sampai sepuluh kali lebih lama untuk melewati kolom, dibandingkan dengan senyawa yang tidak diretensi tM. Perlu diperhatikan juga
viskositas fase gerak dan koefisien difusi senyawa dalam fase gerak. Selain itu tipe dan karakteristik pengisi kolom (terutama porositas, rentang sempit ukuran partikel,
prosedur pengisian kolom yang baik dan pengisi kolom berkualitas tinggi), mempengaruhi panjang kolom dan ukuran partikelnya.
Karena proses pemisahan dalam kolom kromatografi dan identifikasinya
BAB 3
METODOLOGI PENELITIAN
3.1 Alat dan Bahan
3.1.1 Alat-alat
Nama Alat Spesifikasi Merek
1. Neraca Analitik Digital Mettler PM 2000
2. Hot plate stirrer Bibby
3. Gelas Erlenmeyer 100 ml Pyrex
4. Gelas Beaker 250 ml Pyrex
5. Termosetting 6. Magnetik bar
7. Autoclave 100 ml Duragauge
8. Termometer 200 0C Fisher
9. Labu alas 50 ml Pyrex
10.Pompa Vakum Welch Pou-Seal
11.Statif dan Klem
12.Corong saring Pyrex
13.Pipa kapiler
14.Buret 50 ml Pyrex
15.Perkin Elmer FT-IR
3.1.2 Bahan- bahan
10.Larutan Fehling A 11.Larutan Fehling B
3.2 Prosedur Penelitian
3.2.1 Hidrogenasi Glukosa
Sebanyak 9,0019 gram glukosa dimasukkan ke dalam tabung autoclave yang dilengkapi dengan pengaduk magnet. Dimasukkan kedalamnya N-Heksan kering sebanyak 40 ml. Dimasukkan katalis Pd/C sebanyak 0,0609 gram. Tabung autoclave di tutup rapat, kemudian dialirkan gas hidrogen sampai tekanan 200 psi (13,52 atm)
3.2.2 Uji Fehling untuk Glukosa
Sebanyak 2 ml filtrat dimasukkan kedalam tabung reaksi, ditambahkan larutan Fehling A dan Fehling B kemudian dipanaskan akan terbentuk endapan merah bata. Fehling A: larutan CuSO4 dan larutan Fehling B: larutan dari Na-K-tartrat.
3.2.3 Uji Tollens untuk Glukosa
Kedalam tabung reaksi dimasukkan 2 ml AgNO3 dan ditambahkan 2 ml NaOH 0,1 N
selanjutnya ditambahkan sebanyak 2 ml NH4OH sampai tidak terdapat endapan putih.
Glukosa 9,0019 g
Larutan Kuning
Filtrat Residu
Larutan Kental berwarna coklat tua
Analisa secara FT-IR dan HPLC
Filtrat Residu
Larutan Kental Berwarna Coklat Tua
Analisa secara FT-IR 3.3 Bagan Penelitian
3.3.1 Hidrogenasi Glukosa
Dimasukkan kedalam Autoclave
Ditambahkan N-hexan kering sebanyak 40 ml Ditambahkan katalis Pd/Csebanyak 0,0609 g Dialirkan gas H2 sebesar 200 psi (13,52 atm)
Diaduk dan dipanaskan pada suhu 1600C
Disaring
Ditambahkan etanol Ditambahkan air
Diupkan pelarutnya dengan cara Disaring
divakum sampai terbentuk larutan kental
Direaksikan dengan Direaksikan dengan
pereaksi Tollens pereaksi Tollens
Direaksikan dengan Direaksikan dengan
pereaksi Fehling pereaksi Fehling
Diuapkan pelarutnya dengan cara divakum sampai terbentuk larutan kental
Filtrat
Hasil
Ditambahkan AgNO3
Ditambahkan NaOH 0,1 N
Ditambahkan NH4OH
Filtrat
Hasil 3.3.2 Uji Fehling untuk Glukosa
Ditambahkan larutan Fehling A Ditambahkan larutan Fehling B Dipanaskan
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
Reaksi hidrogenasi antara glukosa (9,0019 gram; 0,05 mol) dengan hidrogen bertekanan 200 psi (13,52 atm) yang berlangsung pada suhu 1600C selama 3 jam, dengan adanya Katalis Pd/C menghasilkan % yield sebanyak 57,14 %.
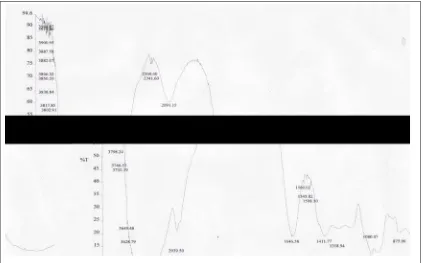
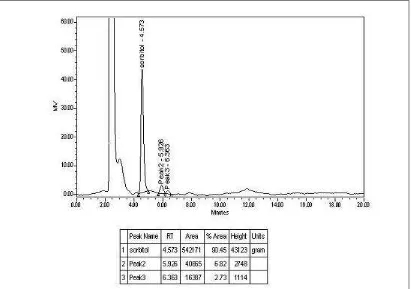
Dari hasil penelitian diperoleh data analisa FT-IR (Gambar 4.2.1) yang menunjukkan adanya pita serapan pada bilangan gelombang: 3628,79 cm-1; 2939,50 cm-1; 2091,15 cm-1; 1411,77 cm-1 dan 1040,18 cm-1. Sedangkan dari data analisa HPLC sebagai pengujian kuantitatif (Gambar 4.2.2) diperoleh puncak kromatogram untuk sorbitol pada waktu retensi 4,573 menit sebesar 90,45%.
Pengujian kualitatif yang dilakukan dengan menggunakan pereaksi Fehling masih menunjukkan adanya endapan merah bata sedangkan dengan pereaksi Tollens
tidak lagi menunjukkan adanya cermin perak.
4.2 Pembahasan
O
Reaksi hidrogenasi glukosa menjadi sorbitol telah banyak dilakukan dengan pelarut air tetapi hasil yang diperoleh masih rendah. Hal ini diduga karena gas hidrogen yang bersifat non polar tidak dapat masuk kedalam pelarut air yang bersifat
polar. Oleh karena itu perlu dilakukan perubahan terhadap pelarut yang digunakan. Pelarut n-heksan merupakan pelarut non polar sehingga cenderung melarutkan komponen yang bersifat non polar.
Interaksi dan absorbsi antara permukaan logam Palladium dan hidrogen terjadi pada suhu kamar. Pada suhu tersebut palladium mampu menyerap molekul hidrogen dalam jumlah besar, karena atom hidrogen mampu menempati sisi stabil di bawah permukaan lapisan palladium (Evans. J, 2005). Pertama-tama hidrogen mengalami absorbsi secara kimia. Seiring dengan pertambahan tekanan, hidrogen akan masuk ke dalam kisi-kisi atom logam Palladium yang disebut sebagai pembentukan fase α dan β hidrida. Dan hidrogen yang terserap akan dilepaskan kembali dengan adanya pemanasan (Greenwood, N.N dan Earnshaw. A, 1984).
yaitu molekul produk akan terlepas kembali dari sisi aktif katalis untuk bereaksi dan
membentuk produk baru
Pendukung katalis karbon dapat mempengaruhi struktur permukaan dari fase aktif katalis yang berperan dalam proses katalitik (ITS-Master-7346-1407201744-bab1). Selain itu dapat memperpanjang umur katalis, karena tidak dapat terjadi penggumpalan logam aktif, luas permukaan katalis juga dapat bertambah sehingga reaksi lebih efekti
4.2.1 Spektrum FT-IR Hasil Hidrogenasi (Produk) Fraksi Filtrat.
Spektrum FT-IR dari produk (Gambar 4.2.1) menunjukkan adanya pita serapan pada
bilangan gelombang 3418,45 cm-1 yang menunjukkan adanya vibrasi uluran O–H
yang melebar. Pita serapan pada bilangan gelombang 2981,22 cm-1 menunjukkan adanya gugus serapan C–H aldehida. Pita serapan pada bilangan gelombang 1644,96 cm-1 menunjukkan adanya gugus serapan aldehida tidak jenuh. Pita serapan pada
bilangan gelombang 1411,77 cm-1 menunjukkan adanya tekukan C–O–H didalam
bidang. Pita serapan pada bilangan gelombang 1040,18 cm-1 menunjukkan adanya rentangan C–O alkohol primer (Sylverstain, 1981).
4.2.2 Spektrum FT-IR Hasil Hidrogenasi (Produk) Fraksi Residu.
Spektrum FT-IR dari produk (Gambar 4.2.2) menunjukkan adanya pita serapan pada
bilangan gelombang 3628,79 cm-1 yang menunjukkan adanya vibrasi uluran O–H
yang bebas. Pita serapan pada bilangan gelombang 2939,50 cm-1 yang menunjukkan adanya uluran taksimetrik CH2. Pita serapan pada bilangan gelombang 2091,15 cm-1
menunjukkan adanya pita kombinasi. Pita serapan pada bilangan gelombang 1411.77
cm-1 menunjukkan adanya tekukan C–O–H didalam bidang. Pita serapan pada
bilangan gelombang 1040,18 cm-1 menunjukkan adanya rentangan C–O alkohol
primer (Sylverstain, 1981).
Gambar 4.2.2 Spektrum FT-IR Hasil Hidrogenasi (Produk) Fraksi Residu.
Sedangkan pada spektrum FT-IR glukosa (lampiran 1) menunjukkan adanya pita serapan pada bilangan gelombang : 3294,69 cm-1 yang menunjukkan vibrasi O–H
yang melebar, bilangan gelombang 3100.97 cm-1 yang menunjukkan serapan C-H
aldehida aromatik, bilangan gelombang 2943,94cm-1 yang menunjukkan uluran
asimetrik vibrasi CH2, bilangan gelombang 1422,59 cm-1 yang menunjukkan adanya
tekukan C–H pada bidang, bilangan gelombang 1034,16 cm-1 yang menunjukkan
Jika data spektrum FT-IR glukosa (Lampiran 1) dibandingkan dengan
Spektrum FT-IR produk, sudah dapat dilihat perbedaan yang nyata. Dimana tidak terdapat lagi gugus serapan C-H aldehida aromatik pada bilangan gelombang 3100.97 cm-1.
Dari data spektrum FT-IR produk jika dibandingkan dengan data FT-IR berdasarkan SDBS (Spectral Data Base System for organic compounds) maka yang lebih mendekati spektrum sorbitol adalah data dari spektrum hasil hidrogenasi (produk) fraksi residu maka produk dari fraksi residu di HPLC untuk melihat berapa banyak produk yang berupa sorbitol didapat.
4.2.3 Kromatogram HPLC Hasil Hidrogenasi (Produk)
Produk hasil hidrogenasi berupa larutan yang diperkirakan masih terdiri dari campuran: glukosa yang belum terhidrogenasi, produk yang berupa sorbitol dan karamel yang sulit untuk dipisahkan. Oleh karena itu diperlukan adanya analisa HPLC untuk memisahkan dan melihat kadar dari masing-masing zat.
Gambar dibawah ini menunjukkan adanya sorbitol pada kromatogram HPLC yang mempunyai % area sekitar 90,45%. Luas dan tinggi puncak berbanding lurus dengan konsentrasi dan dapat dipakai untuk memperoleh hasil kualitatif (Johnson,
Gambar 4.2.3 Kromatogram HPLC Hasil Hidrogenasi.
Keterangan puncak:
1. Puncak 1 adalah sorbitol 2. Puncak 2 adalah glukosa 3. Puncak 3 adalah karamel
Untuk menentukan massa produk akhir digunakan rumus persen yield. Persen yield adalah perbandingan massa zat terlarut dalam massa sampel awal dikalikan 100%. Satuan ini biasa dipakai untuk larutan padat dalam cair atau padat dalam padat.
Sampel yang digunakan untuk HPLC = 2ml (campuran). Didalam 2ml sampel terdapat sorbitol dengan kadar 90,45%. Maka Vsorbitol = 90,45% x 2ml
= 0,9045 x 5ml = 1,809ml
Berat sorbitol = ρ x Vsorbitol
Jadi, berat sorbitol dalam 4ml (hasil keseluruhan dari penelitian) adalah:
g 35 , 2 2 4 Sorbitol
Berat = x
= 4,7 g
Sehingga % yield adalah:
x 100%
g 9,0019
g 4,7 %yield =
%yield =52,21%
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian ini dapat disimpulkan bahwa hidrogenasi glukosa dengan
molekul hidrogen yang berlangsung selama 3 jam pada suhu 1600C dan tekanan
hidrogen 200 psi (13,52 atm) dalam pelarut N-heksan kering, dengan adanya katalis Pd/C dapat menghasilkan % yield sebanyak 52,21% dengan puncak yang dihasilkan pada kromatogram HPLC sebesar 90,45%.
5.2 Saran
DAFTAR PUSTAKA
Albert Cotton; Geoffrey Wilkinson. 1989. Kimia Anorganik Dasar. Penerjemah: Suhati Suharto. Pedamping: Yanti R. A. Koestoer. Cetakan Pertama. Jakarta. Penerbit Universitas Indonesia (UI-Press).Hal: 61;628-630.
Antony C. Wilbraham dan Michael S. Matta.1992. Pengantar Kimia Organik Dan
Hayati. Penerjemah: Dr. Suminar Achmadi. Bandung. Penerbit ITB.Hal: 103.
Dita Dianita. 2009. Laporan Tugas Prarancangan Pabrik; Prarancangan Pabrik
Kaprolaktam Dari Sikloheksanon Dan Hidroksilamin Sulfat Kapasitas 40.000 Ton Per Tahun. Surakarta. Skripsi Jurusan Teknik Kimia. FT Universitas
Muhammadiyah Surakarta.
Edward L. Johnson. 1991. Dasar Kromatografi Cair. Penerjemah: Prof. Dr. Kosasih Padmawinata. Bandung. Penerbit ITB. Hal 7.
Evans, J. 2005. Focus On Palladium Hydrogen Storage Potential. E C H Sykes et
al, Proc. Natl. Acad. Sci. USA (DOI: 10.1073/pnas.0506657102).
Greenwood, N.N dan Earnshaw, A, 1984. Chemistry Of the Element. New York : Pergamon-press.
Happy Puspita sari. 2009. Hidrogenasi Glukosa Menjadi Sorbitol Menggunakan
Katalis Pd/γ-Al2O3 Dalam Pelarut Air. Medan. Skripsi Jurusan Kimia FMIPA USU.
Hardjono Sastrohamidjojo. 2005. Kimia Organik; Stereokimia, Karbohidrat, Lemak
Dan Protein. Yogyakarta. Penerbit Gadjah Mada University Press. Hal:42-44,
47.
Hiskia Ahmad. 2001. Penuntun Belajar Kimia Dasar Elektrokimia Dan Kinetika
Kimia. Bandung. Penerbit PT. Citra Aditya Bakti. Hal: 214-216.
http://sorbitol suara merdeka - ragam.htm. Diakses tanggal 3 September, 2009.
http://sorbitol News1.htm. Diakses tanggal 8 September, 2009.
juni 2009.
Hong Shan LUO, Hai Bing GUO, He Xing LI, Ming Hui WANG, Ye Ping XU. 2002. A novel Ultrafine Ru-B Amorphous Alloy Catalyst for Glucose
Hydrogenation to Sorbitol. Chinese chemical letters vol.13, no.12, pp
1221-1224.
Holum, R. J. 1987. Elements of General and Biological Chemistry. Seventh Edition. USA: John Willey and Sons, Inc.
Ibnu Ghilib Gandjar dan Abdul Rohman. 2007.Kimia Farmasi Analisis. Cetakan II. Yogyakarta. Penerbit Pustaka Pelajar. Hal: 378-380.
KaiDa Technology Ltd All Rights Reserved. 2006. Grup Pemasok
terkemuka senyawa kata lis loga m dan an od a Titanium. (http://www.kaida.co.uk/palladium-1-3.html)
Kemp, W. 1987. Organic Spectroscopy. Second Edition.London : Macmilan Publishers Ltd.
Kosasih Satiadarma, dkk. 2004. Asas Pengembangan Prosedur Analisis. Cetakan I. Surabaya. Airlangga University Press. Hal: 201-202;211.
Kristian H. Sugiarto dan Retno D. Suyanti. 2010. Kimia Anorganik Logam. Edisi Pertama. Yogyakarta. Graha Ilmu. Hal: 201-202.
Leach, B. E. 1983. Applied Industrial Catalysis. Volume 2. New York : Academic Press.
Melia Laniwati Gunawan. 1989. Oksidasi Etanol Menjadi Asam Asetat Dengan
Katalis Palladium/Karbon. Bandung. Tesis Program Studi Teknik Kimia.
Program Pasca Sarjana ITB.
Mulyono Ham. 2006. Kamus Kimia. Bumi Aksara. Jakarta. Hal:151.
Parker, S. P. 1982. McGraw Hill Encyclopedia of Chemistry. Second Edition. New York : Mc Graw Hill,Inc.
Ralp J. Fessenden dan Joan S. Fessenden. 1986. Kimia Organik. Edisi ke-3. Jilid 2. Alih bahasa Aloysius Hadyana Pudjaatmaka, Ph. D. Jakarta. Penerbit Erlangga. Hal: 318; 319;337.
Rosida Marhusari. 2009. Bentonit Terpilar TiO2 sebagai katalis dalam pelarut air
pada hidrogenasi glukosa menjadi Sorbitol dengan katalis Nikel. Medan.
Skripsi Jurusan Kimia FMIPA USU.
Sabine Schimpf, Catherine Louis dan Peter Claus. 2006. Ni/SiO2 catalyst prepared
with ethylenediamine nickel precursors: influence of pretreatment on the catalytic properties in glucose hydrogenation. Applied Catalyst A:General 318
(2007)45-53.
S. Schimpf, B. Kusserow, C. Mohr, P. Claus. 1997. Deactivation Phenomena of
Catalyst used for the Hydrogenation of Glucose.Fachbereich chemie, Institut
for Chemistry Technologie II. Petersenstr.20, D- 64287 Damstadt.
Stanley H. Pine; James B. Hendrickson; Donald J. Cram; George S. Hammond.1988.
Kimia Organik 2. , diterjemahkan oleh Roehyati Joedodibroto dan Sasanti W.
Purbo Hadiwidjoyo. Terbitan Ke-4. Bandung. Penerbit ITB. Hal: 815-816.
Sylverstein, R. M; Bassler, G. C; Morrill, C. T. 1986. Penyidikan spektrometrik
senyawa organik. Alih Bahasa Drs. A.J. Hartomo dkk; Dra. Ani Victor Purba,
M. Sc. Edisi Keempat. Jakarta. Penerbit Erlangga.
Syukri. S. 1999. Kimia Dasar. Jilid 2. Bandung. Penerbit ITB. Hal: 502.
Tony Luqman Lutony. 1993. Tanaman Sumber Pemanis. Jakarta. Penebar swadaya. Hal: 4;11-13.
Welasih, T. 2007. Hidrogenasi glukosa menjadi sorbitol menggunakan katalis nikel
dalam reaktor berpengaduk dan bertekanan tinggi. Surabaya: ITS- digital
library.
1. Rangkaian alat Autoclave
2. Rangkaian alat FT-IR