PADA CABAI (Capsicum annuum L.)
YUNIK ISTIKORINI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi Potensi Cendawan Endofit untuk mengendalikan Penyakit Antraknosa pada Cabai (Capsicum annuum L.) adalah karya saya dengan arahan dari komisi pembimbing dan belum pernah diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Agustus 2008
YUNIK ISTIKORINI. Potential of Endophytic Fungi in Controlling Anthracnose on Chili (Capsicum annuum L.). Under direction of SIENTJE MANDANG, WIDODO, SRI HENDRASTUTI, and SRIANI SUJIPRIHATI.
Anthracnose is still to be key factor threatening in chili production. Three Colletotrichum spesies, C. capsici, C. gloeosporioides and C. acutatum, have been associated with anthracnose disease on chili in Indonesia. The disease occurs mainly in rainy season. Since utilization of chemical fungicides has impact to the environment, naturally available biological control microorganism have been proposed to control fungi pathogens. Endophytic fungi has been used for disease control and plant growth enhancement..
This research consisted of four step: (1) Exploration in endophytic fungi from chili (Capsicum annuum L.) and sedge (Cyperus rotundus). (2) Effectiveness of endophytic fungi in controlling anthracnose disease, and improving growth and yield of chili. (3) Role of elisitor from endophytic fungi to inhibit growth of C. acutatum CA4. (4) Biochemical analysis of induced resistance in chili against anthracnose disease by endophytic fungi.
Endophytic fungi isolates were isolated from roots and stems in the chili and sedge. Thirteen selected isolates had ability to improve growth of chili and controlling anthracnose disease. Isolates of Acremonium sp. RJ3, Fusarium oxysporum CB5and F. solani CJ1 which produced better plant growth, plant fresh weight and roots growth. The treatment also reduced anthracnose incidence on chili cv. Tit Super. Elicitor endophytes fungi (Acremonium sp. RJ3, Fusarium oxysporum CB5 and F. solani CJ1) was divided into crude filtrate elicitor (CFC), cell wall elicitor (CWE), and cytoplasm elicitor (CE). The result showed that elicitors were able to suppress germination conidia and mycelial growth of C. acutatum CA4 indirectly, and elicitors were non antibiosis to C. acutatum CA4 directly. The research was showed the highest content of peroxidase compounds is detected on treatment with cell wall elicitor of endophytes fungi. Cell wall elicitor of F. oxysporum CB5 was more effective to reduce anthracnose incidence on chili cv. Tit Super. One mechanisms of endophytic fungi for protection of plant is systemic aquired resistance (SAR). In chili cv. Tit Super, SAR activation results in reduction of disease incidence caused by the fungi C. acutatum CA4. Associated with SAR is the expression of Protein Related (PR). In chili, peroxidase (PR-9) is expressed. FoCB5 conidia treatment was more effective in inhibiting disease incidence compared to the cell wall elicitors of FoCB5. Induction of defense response, particularly phenolic and salicylic acid synthesis in chili fruits may be important mechanism in the biological control by this fungus of C. acutatum CA4 – incited chili antrachnose disease. Based on this experiment, endophytic fungi FoCB5 can be recommended as biocontrol agents in controlling anthracnose disease of chili.
MANDANG, WIDODO, SRI HENDRASTUTI DAN SRIANI SUJIPRIHATI. Cabai (Capsicum annuum L.) merupakan salah satu komoditas hortikultura penting di Indonesia. Di Indonesia, produktivitas cabai masih di bawah potensi produksi yang semestinya. Salah satu faktor yang menyebabkan rendahnya produktivitas cabai di Indonesia adalah penyakit antraknosa yang disebabkan oleh tiga spesies cendawan, yaitu Colletotrichum capsici, C. gloeosporioides dan C. acutatum. Pengendalian penyakit antraknosa yang banyak diterapkan oleh petani di Indonesia adalah dengan fungisida. Penggunaan fungisida yang kurang bijaksana diketahui dapat berdampak negatif terhadap lingkungan.
Pengendalian hayati merupakan salah alternatif pengendalian yang ramah lingkungan. Pengendalian hayati terhadap penyakit antraknosa pada cabai dengan cendawan endofit belum pernah dilaporkan di Indonesia. Oleh karena itu perlu dilakukan penelitian mengenai potensi cendawan endofit untuk mengendalikan penyakit antraknosa pada cabai. Penelitian ini terbagi atas empat percobaan yang saling berkaitan antara satu dengan lainnya : (1) Eksplorasi cendawan endofit dari tanaman cabai (Capsicum annuum L.) dan teki (Cyperus rotundus). (2) Efektivitas cendawan endofit untuk mengendalikan penyakit antraknosa, meningkatkan pertumbuhan dan hasil cabai. (3) Peranan elisitor cendawan endofit dalam menghambat pertumbuhan cendawan patogen. (4) Analisis biokimia ketahanan terinduksi tanaman cabai terhadap penyakit antraknosa dengan cendawan endofit.
Pada uji pendahuluan juga dilakukan uji virulensi untuk mendapatkan cendawan patogen C. acutatum yang virulen. Isolat C. acutatum CA4 (Temanggung) dipilih sebagai isolat patogen potensial karena lebih virulen dibanding isolat CA1 (Bogor), CA2 (Jember) dan CA3 (Sukabumi) berdasarkan masa inkubasi, diameter bercak dan kejadian penyakit.
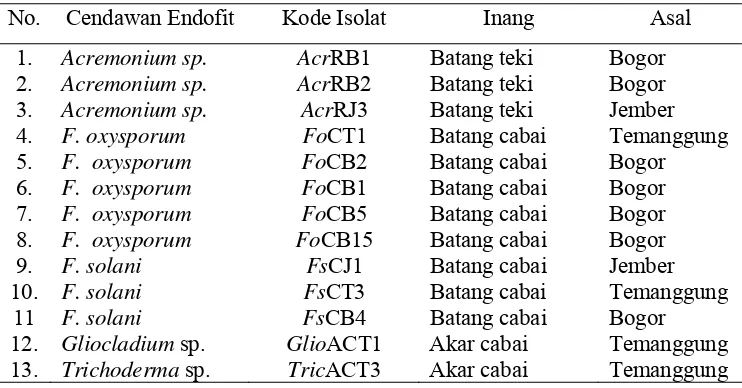
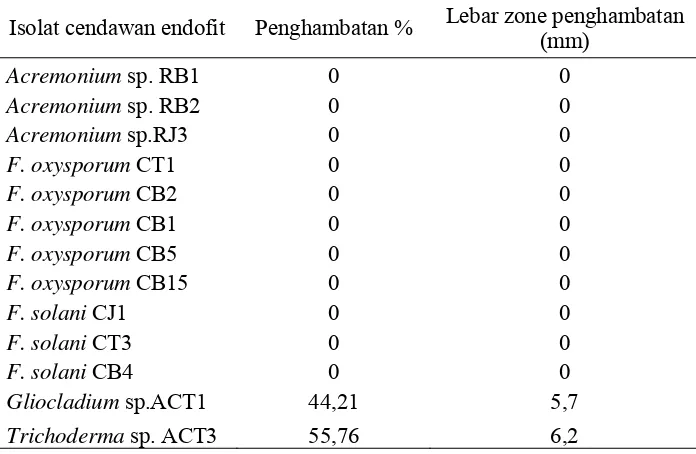
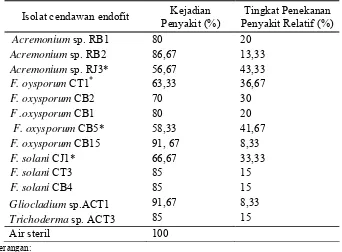
Penelitian mengenai pengendalian hayati penyakit antraknosa masih terus diupayakan, di antaranya dengan menggunakan cendawan endofit. Penelitian ini diawali dengan eksplorasi cendawan endofit dari tanaman cabai dan rumput teki yang sehat atau tidak menunjukkan gejala penyakit. Dari hasil eksplorasi diperoleh 111 cendawan endofit meliputi 7 genus cendawan yaitu Acremonium sp., Fusarium oxysporum, F. solani, Trichoderma sp., Gliocladium sp., Penicillium sp., Aspergillus sp. dan Colletotrichum sp. Selanjutnya, cendawan endofit tersebut diseleksi berdasarkan uji pertumbuhan pada tanaman ketimun dan didapatkan 13 isolat cendawan endofit potensial. Dari tiga belas cendawan endofit tersebut terdapat empat isolat yaitu Acremonium sp. RJ3, F. oxysporum CB5, F. oxysporum CT1 dan F. solani CJ1 yang berpotensi menekan kejadian penyakit antraknosa (33,33 sampai 43,33%) pada cabai kultivar Tit Super.
kejadian penyakit antraknosa dibanding elisitor cendawan endofit lainnya. Penekanan penyakit oleh F. oxysporum CB5 berupa konidia mencapai 38,33% lebih besar dibanding berupa elisitor dinding sel yaitu sebesar 23,33%. Hal ini diduga konidia cendawan mengandung senyawa aktif lebih banyak dibanding elisitor dinding sel cendawan sehingga lebih mampu mengaktifkan gen-gen ketahanan tanaman. Oleh karena itu perlindungan yang diberikan pada tanaman lebih efektif. Potensi konidia F. oxysporum CB5 menekan kejadian penyakit antraknosa lebih rendah dibanding potensi elisitor abiotik asam salisilat (Sigma). Namun, perlakuan dengan konidia F. oxysporum CB5 lebih bersifat natural dibanding elisitor abiotik asam salisilat sehingga lebih aman digunakan.
Mekanisme cendawan Acremonium sp RJ3, F. solani CJ1 dan F. oxysporum CB5 dan elisitornya dalam menekan kejadian penyakit antraknosa tidak melalui mekanisme antibiosis karena secara in vitro cendawan endofit dan elisitornya tersebut tidak mampu menghambat pertumbuhan cendawan patogen C. acutatum CA4. Berkurangnya kejadian penyakit tersebut disebabkan oleh adanya mekanisme ketahanan terinduksi, yaitu dengan meningkatkan aktivitas enzim pertahanan, mengaktifkan pembentukan metabolit tranduksi signal sehingga mampu mengaktifkan gen-gen ketahanan untuk membentuk metabolit sekunder yang bersifat anticendawan.
Potensi elisitor cendawan endofit dalam mengendalikan penyakit antraknosa diduga melalui systemic aquired resistance (SAR). Respon SAR berhubungan dengan aktivasi satu set gen-gen inang yang berperan dalam mekanisme ketahanan yaitu gen-gen Pathogenesis Related-(PR) protein. Peroksidase (PR-9) merupakan salah satu protein yang diinduksi oleh gen-gen PR-9. Dengan adanya hidrogen peroksida (H2O2), peroksidase mengkatalisis oksidasi senyawa fenil propanoid menghasilkan lignin sehingga dinding sel tanaman lebih tahan terhadap degradasi enzim patogen. Peningkatan aktivitas peroksidase juga dipengaruhi oleh jenis elisitor yang digunakan. Aktivitas enzim peroksidase dengan perlakuan elisitor dinding sel Acremonium sp RJ3, F. solani CJ1 dan F. oxysporum CB5 lebih tinggi dibanding perlakuan dengan elisitor filtrat kasar dan elisitor sitoplasma dari cendawan endofit tersebut. Aktivitas peroksidase menyebabkan peningkatan oksidasi senyawa-senyawa fenolik. Perlakuan induksi dengan menggunakan konidia F. oxysporum CB5 menunjukkan aktivitas total fenol tertinggi (26,10 ppm) dibanding perlakuan menggunakan EDS F. oxysporum CB5, dan EDS cendawan patogen C. acutatum CA4. Senyawa fenol diketahui berperan dalam pertahanan tanaman terhadap patogen.
© Hak cipta milik
Institut Pertanian Bogor
, tahun 2008
Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
PADA CABAI (Capsicum annuum L.)
YUNIK ISTIKORINI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Departemen Hama dan Penyakit Tumbuhan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Disetujui, Komisi Pembimbing
Prof. Dr. Ir. Sientje Mandang S, MS. Dr. Ir. Widodo, MS. Ketua Anggota
Dr. Ir. Sri Hendrastuti Hidayat, MSc. Prof. Dr. Ir. Sriani Sujiprihati, MS. Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Entomologi dan Fitopatologi
Dr. Ir. Sri Hendrastuti Hidayat, MSc. Prof. Dr. Ir. Khairil A. Notodiputro, MS.
Penguji Ujian Tertutup : Dr. Ir. Suryo Wiyono, M.Sc.
karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak November 2004 ini ialah Potensi Cendawan Endofit untuk Mengendalikan Penyakit Antraknosa pada Cabai (Capsicum annuum L.).
Terima kasih penulis ucapkan kepada Prof. Dr. Ir. Sientje Mandang S, MS., Dr. Ir. Widodo, MS., Dr. Ir. Sri Hendrastuti Hidayat, MSc. dan Prof. Dr. Ir. Sriani Sujiprihati, MS. atas segala bimbingan, kritik, saran, serta dukungan moril yang sangat besar peranannya dalam terselesaikannya penulisan disertasi ini.
Pada kesempatan ini, penulis dengan tulus menyampaikan terima kasih yang tiada terhingga dan penghargaan setinggi-tingginya kepada:
1. Dr. Ir. Lisdar I. Sudirman, MSc. (Departemen Biologi, IPB) selaku penguji luar komisi pada ujian prakualifikasi program doktor dan Dr. Ir. Suryo Wiyono, MSc. (Departemen Hama dan Penyakit Tanaman, IPB) selaku penguji luar komisi pada ujian tertutup program doktor yang telah banyak memberikan saran dan arahan yang sangat bermanfaat untuk perbaikan disertasi ini.
2. Rektor dan Direktur Program Pascasarjana IPB atas kesempatan yang diberikan kepada penulis untuk mengikuti program doktor di IPB
3. Rektor Universitas Jember dan Dekan Fakultas Pertanian Universitas Jember yang telah memberi ijin untuk mengikuti program doktor di IPB. 4. Dirjen DIKTI yang telah memberikan dukungan dana melalui BPPS. 5. Staf pengajar dan pegawai yang ada di lingkup Sekolah Pascasarjana
Institut Pertanian Bogor, atas segala curahan waktu, ilmu pengetahuan, pengalaman berharga, layanan administrasi dan bantuan yang telah diberikan selama penulis menempuh pendidikan di IPB.
asuhan, didikan dan kasih sayang, doa restu yang tulus, dorongan semangat dan motivasi agar ananda selalu tabah dan tegar menghadapi segala kesulitan.
8. Ayah dan ibu mertua Prof. Ir. Rijanto dan ibu Sosetijati penulis ucapkan terima kasih atas kasih sayang dan doa restu yang diberikan.
9. Kakanda Arief Budi Santoso alm. yang terus berdoa dan memberi semangat sampai hembusan nafasnya yang terakhir. Kakanda drs. Hery Purwanto, adinda Yunior Joko Sutopo, ST., adinda Ani Pudjiwati dan adinda Novitasari, atas segala dukungan yang diberikan kepada penulis sejak awal hingga selesainya penulisan disertasi ini.
10.Suami tercinta Yudhie Setyanto, ST., atas doa tulus, pengorbanan, pengertian, ketabahan dan dorongan semangat yang selalu diberikan, terima kasih telah membantu dalam menjaga dan mendidik anak-anak sehingga menjadi lebih mandiri dan lebih bertanggung jawab dalam segala hal. Ananda tersayang Aggie Farkhantiansyah, Reihan Augeetiansyah, Rafli Ramadhan Febytiansyah dan Fardhan Deantiansyah, terima kasih telah menjadi penyejuk hati dan pendorong semangat Mama. Smoga apa yang Mama lakukan bisa menjadi teladan bagi kalian di masa depan nanti. Semoga karya ini bermanfaat bagi pengembangan ilmu pengetahuan, khususnya di bidang pertanian. Amin.
Bogor, Agustus 2008
Hadisasmito alm. dan Ibu Sulusijah alm. Penulis merupakan putri ketiga dari enam bersaudara. Pendidikan sarjana di tempuh di Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian Universitas Jember, lulus tahun 1993. Pada tahun 1997, penulis diterima di Program Studi Hama dan Penyakit Tumbuhan Program Pascasarjana UGM jenjang Magister Pertanian (S2) dan menamatkannya pada tahun 2000. Tahun 2002 penulis mendapatkan kesempatan ke Program Doktor (S3) pada Program Studi Entomologi Fitopatologi, Fakultas Pertanian IPB. Selama menempuh studi S2 dan S3, penulis mendapat Beasiswa Pendidikan Pascasarjana (BPPS) dari Ditjen DIKTI.
Penulis bekerja sebagai staf pengajar di Fakultas Pertanian, Universitas Jember. Penulis bergabung pada Jurusan Hama dan Penyakit Tumbuhan.
DAFTAR TABEL ... xvii
DAFTAR GAMBAR ... xix
DAFTAR LAMPIRAN ... xxi
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 5
Kerangka Penelitian ... 5
TINJAUAN PUSTAKA ... 7
Penyebab Penyakit Antraknosa ... 7
Gejala Penyakit Antraknosa ... 8
Faktor-faktor yang Mempengaruhi Perkembangan Penyakit Antraknosa ... 9
Patogenesis dan Daur Penyakit Antraknosa ... 10
Cendawan Endofit sebagai Agen Pengendali Hayati ... 12
Mekanisme Ketahanan Terinduksi ... 14
Asam Salisilat sebagai Signal Translokasi ... 16
DAFTAR PUSTAKA ... 18
EKSPLORASI CENDAWAN ENDOFIT DARI TANAMAN CABAI (Capsicum annuum L.) dan TEKI (Cyperus rotundus) ... 25
ABSTRAK ... 25
ABSTRACT ... 26
PENDAHULUAN ... 27
BAHAN DAN METODE ... 28
Tempat dan Waktu Penelitian ... 28
Isolasi dan Identifikasi Cendawan Endofit ... 28
Pengujian Cendawan Endofit yang dapat Memacu Pertumbuhan Tanaman ... 29
Penyediaan Isolat Cendawan Endofit ... 30
Uji Patogenisitas ... 30
Reisolasi Cendawan Endofit dalam Jaringan Tanaman ... 31
Analisis Histologis Batang ... 32
HASIL ... 32
Identifikasi Cendawan Endofit ... 32
Uji Patogenisitas Cendawan Endofit ... 34
Reisolasi Cendawan Endofit dalam Jaringan Tanaman ... 35
EFEKTIVITAS CENDAWAN ENDOFIT UNTUK MENGENDALIKAN PENYAKIT ANTRAKNOSA, MENINGKATKAN PERTUMBUHAN
DAN HASIL CABAI (Capsicum annuum L.) ... 44
ABSTRAK ... 44
ABSTRACT ... 45
PENDAHULUAN ... 46
BAHAN DAN METODE ... 48
Tempat dan Waktu Penelitian ... 48
Penyediaan Isolat Cendawan Endofit ... 48
Penyediaan Isolat Cendawan Patogen ... 49
Penyediaan Bahan Tanaman ... 50
Uji Penghambatan in vitro terhadap Cendawan Patogen ... 51
Uji Pertumbuhan pada Tanaman Cabai ... 51
Uji Induksi Ketahanan ... 51
HASIL ... 52
Uji Penghambatan secara Langsung terhadap Cendawan Patogen 52
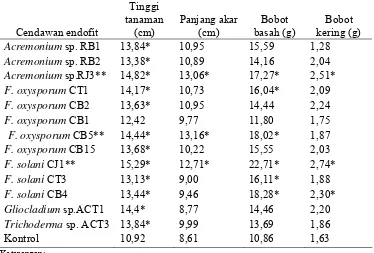
Uji Pertumbuhan pada Tanaman Cabai ... 53
Uji Induksi Ketahanan ... 54
Pengaruh Cendawan Endofit terhadap Produksi Cabai ... 55
PEMBAHASAN ... 56
KESIMPULAN ... 59
DAFTAR PUSTAKA ... 60
PERANAN ELISITOR CENDAWAN ENDOFIT DALAM MENGHAMBAT PERTUMBUHAN CENDAWAN PATOGEN (Colletotrichum acutatum) ... 63
ABSTRAK ... 63
ABSTRACT ... 64
PENDAHULUAN ... 65
BAHAN DAN METODE ... 67
Tempat dan Waktu Penelitian ... 67
Produksi Elisitor dari Filtrat Kultur Cendawan ... 67
Daya Hambat Elisitor Cendawan Endofit terhadap Cendawan Patogen ... 68
Daya Hambat Filtrat Tanaman Cabai terhadap Cendawan Patogen ... 69
Aktivitas Peroksidase ... 70
Induksi Ketahanan ... 76
PEMBAHASAN ... 77
KESIMPULAN ... 79
DAFTAR PUSTAKA ... 79
ANALISIS BIOKIMIA KETAHANAN TERINDUKSI TANAMAN CABAI (Capsicum annuum L.) TERHADAP PENYAKIT ANTRAKNOSA DENGAN CENDAWAN ENDOFIT ... 82
ABSTRAK ... 82
ABSTRACT ... 83
PENDAHULUAN ... 84
BAHAN DAN METODE ... 86
Tempat dan Waktu Penelitian ... 86
Uji Induksi Ketahanan ... 86
Uji in vitro Penghambatan Cendawan Patogen ... 88
Analisis Biokimia ... 88
HASIL ... 89
Pengaruh Tidak Langsung Elisitor terhadap Patogen ... 89
Analisis Biokimia ... 90
Induksi Ketahanan ... 91
PEMBAHASAN ... 92
KESIMPULAN ... 95
DAFTAR PUSTAKA ... 96
PEMBAHASAN UMUM ... 99
KESIMPULAN UMUM ... 106
SARAN ... 107
Judul Halaman 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13.
Cendawan endofit dari akar dan batang tanaman cabai (Capsicum annuum L.)dan teki (Cyperus rotundus)...
Persentase akar, batang, dan daun tanaman cabai Kultivar Tit yang dikolonisasi cendawan endofit (30 HSI)... Cendawan endofit, inang, dan asal isolat ... Uji penghambatan isolat cendawan endofit terhadap C. acutatum. Rata-rata tinggi, panjang akar, bobot basah dan bobot kering brangkasan cabai (Capsicum annuum L.)... Kejadian penyakit antraknosa dan tingkat penekanan penyakit relatif pada cabai setelah perlakuan dengan cendawan endofit... Pengaruh penggunaan elisitor dari cendawan endofit terhadap perkecambahan konidia C. acutatum CA4... Pengaruh penggunaan filtrat bibit cabai kultivar Tit Super yang telah diinokulasi dengan elisitor dari cendawan endofit terhadap perkecambahan konidia C. acutatum CA4... Persentase penghambatan perkecambahan konidia C. acutatum CA4... Kejadian penyakit dan penekanan penyakit antraknosa relatif pada cabai kultivar Tit Super setelah diinduksi elisitor cendawan endofit... Rata-rata diameter koloni C. acutatum CA4 pada medium PDA yang ditambah filtrat bibit cabai kultivar Tit Super yang telah diinduksi elisitor biotik dan abiotik... Persentase penghambatan pertumbuhan koloni C. acutatum CA4 pada medium PDA yang ditambah filtrat bibit cabai kultivar Tit Super yang telah diinduksi elisitor biotik dan abiotik... Konsentrasi total fenol dan asam salisilat (ppm) pada buah cabai kultivar Tit Super...
No. Judul Halaman 1. 2. 3. 4. 5. 6. 7.
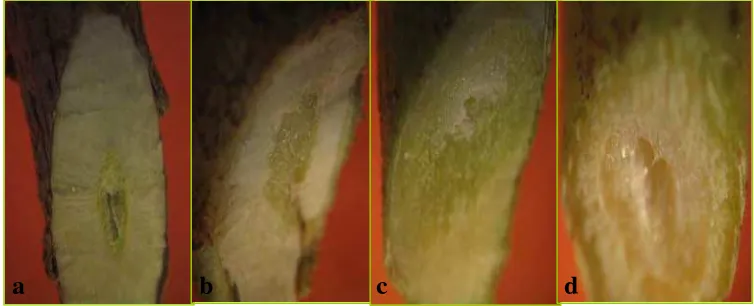
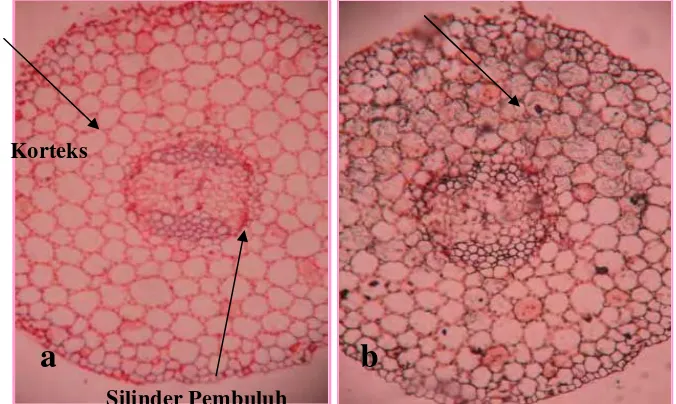
Diagram alir tahap-tahap kegiatan penelitian... Respon tanaman uji setelah inokulasi cendawan endofit. Semua tanaman tidak menunjukkan gejala penyakit (rebah semai, busuk akar dan pangkal batang, layu Fusarium). Tanaman uji terdiri dari (a) cabai (70 HSI), (b) tomat (40 HSI), (c) ketimun (40 HSI), dan (d) kacang panjang (40 HSI)... Irisan pangkal batang tanaman uji setelah inokulasi cendawan endofit tidak menunjukkan gejala penyakit internal (nekrosis). Tanaman uji terdiri dari (a) cabai (70 HSI), (b) tomat (40 HSI), (c) ketimun (40 HSI), dan (d) kacang panjang (40 HSI)... Anatomi batang bibit cabai (400X). a: tidak terinfeksi cendawan endofit F. oxysporum, b. terinfeksi cendawan endofit F. oxysporum memperlihatkan kolonisasi miselium (tanda anak panah)... Silinder pembuluh pada batang bibit cabai kultivar Tit Super tidak menunjukkan adanya kolonisasi miselium cendawan endofit F. oxysporum.... Bobot dan jumlah buah cabai total per tanaman setelah perlakuan induksi dengan cendawan endofit. Acr= Acremonium sp., Fo=F. oxysporum, Fs=F. solani, Gli= Gliocladium sp., Tric= Trichoderma sp. ... Aktivitas peroksidase pada bibit cabai kultivar Tit Super yang mendapat perlakuan elisitor cendawan patogen C. acutatum CA4 dan cendawan endofit. Ca=C. acutatum CA4, Fo=F.oxysporum, Fs=F. solani, EDS=elisitor dinding sel, ES= elisitor sitoplasma EFK=elisitor filtrat kasar ...
No. Judul Halaman 1 2. 3 4. 5 6. 7. 8. 9. 10. 11. 12.
Seleksi Tahap 1: Rata-rata tinggi tanaman, panjang akar, bobot basah dan bobot kering brangkasan ketimun setelah diinduksi oleh cendawan endofit...
Seleksi Tahap 2: Rata-rata tinggi tanaman, panjang akar, bobot basah dan bobot kering brangkasan ketimun setelah diinduksi oleh cendawan endofit...
Seleksi Tahap 3: Rata-rata tinggi tanaman, panjang akar, bobot basah dan bobot kering brangkasan ketimun setelah diinduksi oleh cendawan endofit...
14
(Temanggung)... Prosedur Uji Aktivitas Peroksidase...
Ditinjau dari aspek pertanaman maupun nilai produksi, cabai (Capsicum annuum L. ) merupakan salah satu komoditas hortikultura andalan di Indonesia. Tanaman cabai mempunyai luas panen terluas di antara tanaman hortikultura lainnya yaitu 187,236 ribu ha dan 202,079 ribu ha untuk tahun 2005 dan 2006 (BPS 2007). Rata-rata produksi cabai di Indonesia pada tahun 2004 sebesar 5,67 ton/ha dan pada tahun 2005 sebesar 5,84 ton/ha (DBPH 2007). Hasil produksi tersebut masih lebih rendah bila dibandingkan dengan potensi produksinya yang dapat mencapai 20 ton/ha (Duriat et al. 1999).
Rendahnya produksi cabai antara lain disebabkan oleh adanya hama dan penyakit. Hama dan penyakit pada tanaman cabai merupakan pembatas utama produksi cabai (Suryaningsih et al. 1996). Menurut Widodo (2007), terdapat 11 hama dan penyakit yang menyerang pertanaman cabai di Indonesia. Diketahui bahwa serangan penyakit antraknosa di Indonesia menempati urutan kedua setelah serangan tungau.
Penyakit antraknosa pada cabai disebabkan oleh enam spesies Colletotrichum, yaitu C. gloeosporioides, C. capsici, C. dematium, C. coccodes, C. acutatum dan Glomerella cingulata (Kim et al. 1989). Cendawan Colletotrichum yang menyerang pertanaman cabai di Indonesia adalah C. capsici dan C. gloeosporioides (Suryaningsih et al. 1996). Namun pada tahun 2007, diketahui bahwa C. acutatum banyak ditemukan menyerang pertanaman cabai di Indonesia (Widodo 2007).
membentuk aservulus, membentuk massa konidia berwarna merah jambu (Semangun 1994, Holliday 1980).
Penyakit antraknosa merupakan salah satu penyakit yang sangat merugikan terutama pada musim hujan. Hal ini terutama disebabkan perkecambahan konidia Colletotrichum dan keparahan penyakit antraknosa sangat dipengaruhi oleh kelembaban udara yang tinggi (Hong & Hwang 1998). Penyakit antraknosa ini kurang dijumpai pada musim kemarau atau di lahan yang mempunyai drainase dan gulma yang terkendali dengan baik (Semangun 1994). Kehilangan hasil di lapangan akibat penyakit antraknosa pada musim hujan mencapai 80%, sedangkan pada musim kemarau berkisar 20 sampai 35% (Widodo 2007). Namun demikian, petani tetap menanam cabai pada musim penghujan, karena harga cabai sangat tinggi (Setiadi 1992). Lingkungan yang kondusif ini menyebabkan penyakit antraknosa berkembang sampai tingkat yang merugikan.
Kultivar cabai komersial yang dianggap tahan terhadap penyakit antraknosa sampai saat ini masih belum ada. Hasil pengujian Setiamiharja dan Qosim (1991) di Lembang dengan menggunakan 36 kultivar yang beredar di Jawa Barat menunjukkan bahwa belum ditemukan kultivar yang benar-benar tahan terhadap penyakit antraknosa. Dalam kondisi seperti ini, fungisida dapat berfungsi sebagai penyelamat yang diperlukan untuk menekan kerugian akibat kejadian penyakit antraknosa.
Fungisida yang banyak digunakan oleh petani di Indonesia adalah propineb, acylbenzolar e-methyl+mancozeb, dan mancozeb. Beberapa petani juga menggunakan fungsida chlorotolanil dan azoxistrobin + difenoconazole. Pada musim hujan, penggunaan fungisida lebih intensif yaitu sedikitnya sekali dalam waktu kurang dari 7 hari. Oleh karena itu, pada musim hujan petani harus menyediakan dana untuk fungsida lebih tinggi dibandingkan pada musim kemarau yaitu mencapai 10 sampai 40% dari biaya total penanaman cabai (Widodo 2007).
dengan menggunakan satu atau lebih organisme. Hal tersebut dapat terjadi secara alami atau melalui manipulasi lingkungan, inang, atau antagonis, atau melalui introduksi massa satu jenis antagonisme atau lebih (Baker & Cook 1974).
Pengendalian hayati terhadap penyakit antraknosa pada cabai telah dilaporkan dengan menggunakan C. gloeosporioides avirulen. Induksi cendawan ini dapat meningkatkan ketahanan tanaman cabai kultivar Teropong yang rentan menjadi agak tahan (Istikorini 2000). Perlakuan benih dengan campuran Plant Growth Promoting Rhizobacteria (PGPR) yaitu Pseudomonas fluorescens PG 01 dan Bacillus polymixa BG 25 mampu menekan kejadian penyakit antraknosa pada cabai kultivar Lokal Brebes dan kultivar Tit Super (Sutariati 2006). Pengendalian penyakit antraknosa pada cabai dengan agens hayati berupa cendawan endofit belum pernah dilaporkan.
Cendawan endofit adalah cendawan yang hidup pada bagian dalam jaringan tanaman sehat tanpa menimbulkan gejala penyakit pada tanaman inang. (Carroll 1990). Potensi cendawan endofit sebagai agen pengendali hayati, antara lain karena endofit hidup dalam jaringan tanaman sehingga dapat berperan langsung dalam menghambat perkembangan patogen dalam tanaman (Niere 2002).
Peranan penting endofit dalam perlindungan tanaman telah dibuktikan oleh beberapa peneliti. Cendawan endofit diketahui bersifat toksik terhadap herbivora, misalnya insekta, mamalia dan kutu daun (Clay 1988; Johnson et al. 1985). Cendawan endofit juga bersifat toksik terhadap nematoda patogen (Nordmeyer & Sikora 1983; Kimmons et al., 1990; Sinclair & Cerkauskas 1996) dan cendawan patogen (Amin et al. 1997; Bragmann & Schonbech 1992; Sinclair & Cerkauskas 1996; White & Cole 1985). Pada rumput-rumputan, cendawan endofit dapat memperbaiki respon tanaman terhadap kekeringan (Sinclair & Cerkauskas 1996). Cendawan endofit Trichoderma sp. dan Fusarium sp. berpotensi dapat meningkatkan pertumbuhan tanaman tomat (Amin et al. 1997).
ditemukan baik pada tanaman pertanian maupun pada rumput-rumputan (Faeth 2002). Cendawan endofit dalam tanaman diketahui dapat menyebabkan berkurangnya kerusakan pada sel atau jaringan tanaman, meningkatkan kemampuan bertahan hidup dan fotosintesis sel jaringan tanaman yang terinfeksi patogen tular tanah (Sinclair & Cerkauskas 1996). Kolonisasi cendawan endofit pada rumput menyebabkan terinduksinya metabolit sekunder yang bersifat antagonis terhadap herbivora insekta (Carroll 1995). Selain itu, kolonisasi dari cendawan endofit juga dapat meningkatkan senyawa fenol dan mungkin senyawa lain seperti pathogenesis-related protein (PR-Protein) dalam inang. Senyawa fenol dapat menghambat patogen secara langsung atau dengan produk oksidasinya dan juga dengan meningkatkan perubahan metabolik kompleks seperti senyawa yang dapat membentuk barrier pertahanan (Agrios 1997; Gazoni & Stegman 1997).
Mekanisme penghambatan cendawan endofit terhadap patogen dapat secara langsung dengan mekanisme antagonis dan secara tidak langsung dengan mekanisme ketahanan terinduksi. Perlindungan tanaman dengan ketahanan terinduksi didasarkan pada rangsangan mekanisme ketahanan oleh adanya perubahan metabolik yang memungkinkan tanaman untuk lebih mengefektifkan ketahanannya. Diperkirakan ketahanan terinduksi dapat berkembang apabila sel-sel tanaman mampu menghasilkan enzim-enzim baru yang mengaktifkan gen tanaman yang bertanggung jawab dalam mekanisme ketahanan tanaman tersebut (Agrios 1997). Ketahanan terinduksi biasanya memerlukan periode waktu untuk mengembangkan ketahanan. Induksi ketahanan pada tembakau dengan Pseudomonas tabaci avirulen dilakukan 24 jam sebelum inokulasi dengan P. tabaci virulen (Goodman et al. 1967).
ketahanan yaitu gen-gen PR-protein. Respon SAR memerlukan keterlibatan molekul signal asam salisilat (SA) (Chasan 1995; van Loon 1997).
Di Indonesia penelitian tentang cendawan endofit serta potensinya sebagai agen pengendali hayati masih sedikit dilakukan, bahkan belum pernah dilaporkan adanya penelitian tentang cendawan endofit pada cabai dan potensinya sebagai agen pengendali hayati penyakit antraknosa. Oleh karena itu perlu dilakukan pengkajian potensi cendawan endofit untuk mengendalikan penyakit antraknosa pada cabai. Selanjutnya, juga dikaji komponen struktural cendawan endofit yang diduga juga dapat menginduksi ketahanan tanaman.
Tujuan Penelitian
Mengingat pentingnya pengendalian penyakit antraknosa yang berbasis mempertahankan keseimbangan biologi maka pemanfaatan cendawan endofit sebagai agen pengendali hayati perlu dikembangkan. Adapun tujuan penelitian ini adalah untuk:
1. Mendapatkan cendawan endofit dari tanaman cabai dan teki (Cyperus rotundus) sebagai agen pemacu pertumbuhan (biofertilizer) dan sebagai agen hayati potensial dalam mengendalikan penyakit antraknosa pada tanaman cabai.
2. Mengevaluasi komponen struktural cendawan endofit yang berperan sebagai elisitor ketahanan tanaman cabai terhadap penyakit antraknosa, dan pengaruh anticendawan dari elisitor tersebut secara in vitro dan in vivo terhadap spesies Colletotrichum penyebab penyakit antraknosa pada cabai.
3. Mengevaluasi mekanisme cendawan endofit dalam meningkatkan ketahanan cabai terhadap penyakit antraknosa melalui peningkatan enzim peroksidase, senyawa fenol dan asam salisilat.
Kerangka Penelitian
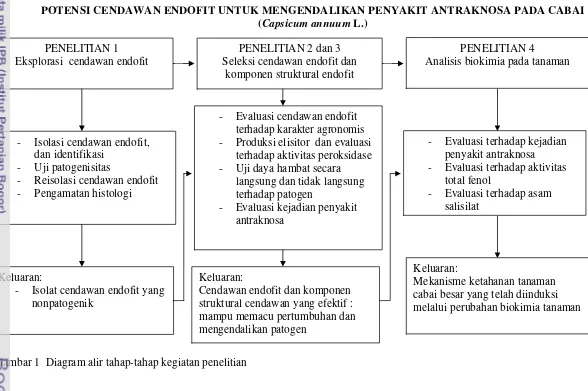
Eksplorasi cendawan endofit Seleksi cendawan endofit dan komponen struktural endofit
- Isolasi cendawan endofit, dan identifikasi
- Uji patogenisitas
- Reisolasi cendawan endofit - Pengamatan histologi
- Evaluasi cendawan endofit terhadap karakter agronomis - Produksi elisitor dan evaluasi
terhadap aktivitas peroksidase - Uji daya hambat secara
langsung dan tidak langsung terhadap patogen
- Evaluasi kejadian penyakit antraknosa
Keluaran:
- Isolat cendawan endofit yang nonpatogenik
Keluaran:
Cendawan endofit dan komponen struktural cendawan yang efektif : mampu memacu pertumbuhan dan mengendalikan patogen
Analisis biokimia pada tanaman
- Evaluasi terhadap kejadian penyakit antraknosa - Evaluasi terhadap aktivitas
total fenol
- Evaluasi terhadap asam salisilat
Keluaran:
Mekanisme ketahanan tanaman cabai besar yang telah diinduksi melalui perubahan biokimia tanaman
Gambar 1 Diagram alir tahap-tahap kegiatan penelitian
Penyebab Penyakit Antraknosa
Beberapa spesies
Colletotrichum
yang dilaporkan dapat menyebabkan
penyakit antraknosa pada cabai adalah
C. gloeosporioides, C. capsici, C. dematium,
C. coccodes, C. acutatum
dan
Glomerella cingulata
(Kim
et al.
1989).
Colletotrichum
merupakan cendawan anamorfik,
termasuk dalam subdivisi
Deuteromycotina, kelas Deuteromycetes, subkelas Coelomycetidae, ordo
Melanconiales, famili Melanconiaceae, dan genus
Colletotrichum
(Alexopoulos &
Mims 1996; Sutton 1992).
Di Indonesia, spesies
Colletotrichum
yang banyak menyerang cabai adalah
C.
capsici
dan
C. gloeosporioides
(Suryaningsih
et al.
1996). Namun demikian, hasil
penelitian Widodo (2007) menunjukkan bahwa penyebab penyakit antraknosa pada
cabai dari Bogor, Brebes, Bandung, Pasir Sarongge, Payakumbuh dan Mojokerto
yang secara morfologi mirip dengan
C. gloeosporioides
setelah diidentifikasi secara
molekuler adalah
C. acutatum.
Pada umumnya, metode konvensional untuk membedakan spesies
Colletotrichum
terutama berdasarkan morfologi, seperti karakteristik koloni, bentuk
dan ukuran konidia, kecepatan pertumbuhan, ada dan tidaknya seta, spesifitas inang
dan keberadaan teleomorf
Glomerella
(Denoyes & Baudry 1995; Gunnell & Gubler
1992; Sutton 1992).
Karakteristik morfologi
C. gloeosporioides
adalah koloni
berwarna putih
keabuan sampai abu-abu tua, sedangkan koloni
C. acutatum
berwarna oranye muda
sampai abu-abu. Secara individual konidia
Colletotrichum
hialin, bersel satu,
15,5-18,6 x 5,4 – 6,2 µm. Konidia dalam bentuk massa kelihatan berwarna agak
terdapat pada sel-sel epidermal atau subepidermal. Aservulus ini berbentuk seperti
cawan, berwarna kuning jingga atau merah jambu (Holliday 1980; Mehrota 1980;
Semangun 1994).
Karakteristik utama yang digunakan untuk mengidentifikasi
C. acutatum
dan
C. gloeosporioides
adalah bentuk konidia dan laju pertumbuhan.
Konidia
C.
acutatum
berbentuk silindrik dengan ujung meruncing dan pertumbuhannya lambat,
sedangkan konidia
C. gloeosporioides
berbentuk silindrik ujung membulat dan
pertumbuhannya cepat (Denoyes & Baudry 1995; Sutton 1992). Namun demikian,
Nirenberg
et al.
(2002) menemukan bahwa bentuk dan ukuran konidia bervariasi
ketika beberapa spesies
Colletotrichum
ditumbuhkan. Oleh karena itu, identifikasi
berdasarkan metode konvensional tersebut sulit untuk membedakan antara
C.
gloeosporioides
dengan
C. acutatum
(Freeman
et al.
1998; Freeman
et al.
2000;
Talhinhas
et al.
2002).
Identifikasi untuk membedakan antara
C. gloeosporioides
dengan
C. acutatum
selanjutnya diklarifikasi menggunakan teknik molekuler. Sequen nukleotida dari
Internal Transcribed Spacer
(ITS1) dari gen ribosomal RNA (rDNA) telah digunakan
untuk membedakan
C. acutatum
dari
C. gloeosporioides
. Didasarkan pada sequen
ITS1, primer spesifik PCR dari dua spesies cendawan ini dikembangkan (Freeman
et
al.
2001; Sreenivasaprasad
et al.
1996; Talhinhas
et al.
2002). Pasangan primer
CgInt/ITS4 dan CaInt2/ITS4 dapat digunakan untuk mengamplifikasi berturut-turut
C. gloeosporioides
dan
C. acutatum
(Brown
et al.
1996).
Gejala Penyakit Antraknosa
Penyakit antraknosa yang disebabkan oleh cendawan
Colletotrichum
merupakan penyakit penting pada tanaman cabai terutama pada musim hujan (Bailey
et al.
1992; Suryaningsih
et al.
1996; Goldberg 2003). Cendawan ini dapat
menginfeksi cabang, ranting, daun dan buah cabai (Holliday 1980; Mehrota 1980).
Gejala pada buah diawali dengan terbentuknya bercak kecil berwarna kehitaman dan
membesar dan memanjang. Pada tengah bercak terdapat kumpulan titik-titik hitam
yang terdiri dari kelompok seta dan konidia cendawan.
Dalam cuaca yang lembab, cendawan membentuk aservulus dalam
lingkaran-lingkaran sepusat, membentuk massa konidia berwarna merah jambu. Serangan yang
berat dapat menyebabkan seluruh buah cabai mengering dan keriput. Buah yang
seharusnya berwarna merah berubah menjadi seperti jerami (Holliday 1980;
Semangun 1994). Serangan yang terjadi pada biji akan menyebabkan kegagalan biji
untuk berkecambah, pada kecambah dapat menyebabkan rebah kecambah serta pada
tanaman dewasa dapat menimbulkan mati pucuk dan infeksi lebih lanjut dapat
menyebabkan busuk kering pada batang (Suryaningsih
et al.
1996). Cendawan ini
dapat menyebabkan infeksi ringan pada daun dan batang muda yang mungkin tidak
terdeteksi. Cendawan ini mampu bertahan dan berkembang biak sampai tahap
tertentu hingga buah mulai masak dan rentan terhadap infeksi cendawan (Holliday
1980; Agrios 1997).
Faktor-faktor yang Mempengaruhi Perkembangan Penyakit Antraknosa
Temperatur dan kelembaban udara merupakan faktor lingkungan yang penting
untuk pertumbuhan, reproduksi dan patogenesis cendawan patogen. Perkecambahan
konidia
Colletotrichum
dan keparahan penyakit didukung oleh kelembaban udara
yang tinggi (Hong & Hwang 1998). Kelembaban udara yang rendah di sekitar kanopi
dapat mengurangi keparahan penyakit. Kelembaban relatif udara 95 persen yaitu pada
saat cuaca berkabut dan berembun dengan temperatur udara rata-rata 32
oC akan
sangat membantu infeksi dan perkembangan penyakit antraknosa selanjutnya
(Bergstrom & Nicholson 1999; Suryaningsih
et al.
1996). Kelembaban juga sangat
berpengaruh terhadap ketahanan
C. coccodes
di dalam tanah (Farley 1976).
Ketahanan
C. acutatum
meningkat pada temperatur rendah (Eastburn & Gubler
1990).
(Manandhar
et al.
1995). Tipe konidia berlendir seperti
Colletotrichum
spp. tidak
mungkin dipencarkan oleh angin saja. Untuk pemencarannya konidia harus lepas dari
aservulus dan terdispersi dalam air (Bailey
et al.
1992). Hujan lebat disertai angin
kencang sangat efektif untuk pemencaran penyakit semacam itu. Menurut Manandhar
et al.
(1995), konidia
C. gloeosporioides
akan terlepas dari aservulus apabila terkena
percikan air hujan. Percikan air hujan ini dapat menyebarkan konidia dan
menularkannya pada tanaman sehat. Di India dilaporkan bahwa kerugian hasil cabai
terjadi pada tahun yang relatif lebih basah. Penyakit jarang dijumpai pada musim
kemarau atau di lahan yang mempunyai drainase dan gulma yang terkendali dengan
baik (Semangun 1994; Urena-Padilla
et al.
2001).
Patogenesis dan Daur Penyakit Antraknosa
Cendawan
Colletotrichum
sp. dapat bertahan pada biji sebagai patogen tular
biji, pada sisa-sisa tanaman terinfeksi maupun pada inang yang lain, juga dapat
bertahan di dalam tanah. Pada cuaca yang lembab cendawan membentuk banyak
konidia. Konidia dihasilkan dalam aservulus pada jaringan tanaman, dilapisi oleh
matrix
mucilaginous
ekstraseluler yang berperan dalam daya tahan hidup dan
penyebaran konidia. Konidia hanya akan berkecambah dan membentuk apresorium
apabila terpencar dari aservulus dan menempel pada permukaan inang yang sesuai
(Bergstrom & Nicholson 1999).
Tahap awal infeksi
Colletotrichum
sp. diawali dengan menempelnya konidia
dan perkecambahan konidia pada permukaan tanaman. Perkecambahan konidia
menghasilkan tabung kecambah yang kemudian berdiferensiasi membentuk apresoria
bermelanin yang diperlukan untuk menembus
barrier
kutikula. Setelah penetrasi, hifa
tumbuh secara interseluler dan intraseluler pada jaringan (Bailey
et al.
1992; Henson
et al.
1999).
Selama bertahan dan mengkolonisasi tanaman inang, sebagian besar genus
dari sel yang mati. Cendawan berkembang dengan membentuk struktur infeksi
termasuk tabung kecambah, apresorium, hifa intraseluler primer dan hifa nekrotropik
sekunder (Bailey
et al.
1992; Dickman 2000).
Pada umumnya
Colletotrichum
sp. bertahan dengan mengkolonisasi jaringan
secara intraseluler. Miselia tumbuh dalam lumen sel tanpa merusak membran inang,
yaitu tumbuh di antara membran plasma dan dinding sel tanaman. Hifa intraseluler
biotropik kemudian menghasilkan hifa nekrotropik sekunder (Bailey
et al.
1992).
Colletotrichum
sp.
cenderung menghasilkan infeksi laten subkutikular pada
buah yang mentah. Hal ini dikarenakan pada buah yang mentah kaya akan asam-asam
organik dan senyawa fenol tetapi miskin karbohidrat. Sebaliknya buah yang masak
kaya karbohidrat namun miskin asam-asam organik dan senyawa fenol. Oleh karena
itu, selama pematangan (
softening
) buah, tabung kecambah mulai berkembang dari
apresoria dan mempenetrasi kutikula dan epidermis. Hifa menginvasi jaringan buah
lebih lanjut dan menimbulkan bercak nekrotik. Infeksi cendawan ini bersifat laten
dalam bentuk apresorium sampai pelunakan atau pemasakan buah (Agrios 1997;
Binyamini & Nadel 1972; Brown 1975).
Proses infeksi juga dibantu oleh bermacam-macam enzim yang dihasilkan
oleh cendawan, seperti kutinase, selulase, pektinase, dan poligalakturonase. Beberapa
Colletotrichum
sp. menghasilkan kutinase untuk mendegradasi kutin.
C.
gloeosporioides
yang kurang mengandung kutinase biasanya kurang patogenik.
Aktivitas kutinase telah dideteksi dalam filtrat kultur lebih dari 20 spesies cendawan
patogenik. Adanya kutinase pada tempat penetrasi menunjukkan keterlibatan kutinase
dalam penetrasi (Bailey
et al.
1992; Huang 2001; Podila
et al.
1995). Setelah berhasil
menembus kutikula, hifa infeksi dari
Colletotrichum
sp. menghancurkan dinding sel
epidermis dengan enzim pendegradasi dinding sel seperti enzim poligalakturonase,
pektinase dan protease. Dengan terurainya dinding luar sel epidermis, keseimbangan
sel terganggu.
Selama proses infeksi, cendawan juga menghasilkan toksin. Beberapa toksin
nicotianae
dan
C. capsici, colletopyron
dari
C. nicotianae
dan
aspergillo-marasmin
dari
C. gloeosporioides
(Bailey
et al.
1992). Toksin mampu menghasilkan gejala
penyakit karena secara langsung mempengaruhi protoplasma tumbuhan inang dan
menyebabkan kematian sel. Toksin merusak sel tanaman dengan mempengaruhi
permeabilitas membran sel dan dengan menginaktifkan atau menghambat enzim
sehingga mengganggu reaksi enzimatik dalam tanaman. Sel-sel tanaman yang telah
dirusak oleh cendawan tersebut menghasilkan bercak nekrotik (Holliday 1980; Agrios
1997). Pada waktu jaringan tanaman mati, cendawan ini secara cepat mengkolonisasi
jaringan dan selanjutnya aservulus terbentuk melengkapi siklus hidupnya (Brown
1975; Bailey
et al.
1992).
Cendawan Endofit sebagai Agen Pengendali Hayati
De Bary (1866)
dalam
Dayle
et al.
(2001) pertama kali mendefinisikan bahwa
seluruh organisme yang mengkolonisasi jaringan internal tanaman adalah endofit.
Namun definisi ini terlalu luas karena termasuk patogen daun yang virulen dan
mikorisa simbion akar. Kemudian Carroll (1990) memberi batasan bahwa cendawan
endofit adalah cendawan yang hidup pada bagian dalam jaringan tanaman sehat tanpa
menimbulkan gejala penyakit pada tanaman inang.
Cendawan endofit yang tidak menyebabkan gejala penyakit diteliti lebih dari
300 spesies tanaman, sebagian besar adalah dari kelas ascomycetes (Carroll 1988).
Beberapa cendawan yang tergolong endofit adalah
Acremonium, Fusarium,
Trichoderma, Colletotrichum, Gliocladium, Alternaria, Beauveria, Penicillium,
Mucor,
dan
Phyllosticta
(Amin
et al.
1997). Pada akar
Lepanthes
(Orchidaceae)
ditemukan cendawan endofit
Colletotrichum, Aspergillus, Penicillium, Pestalosia
dan
Phoma
(Bayman
et al.
1997).
Cendawan endofit dibagi dalam dua kelompok yaitu cendawan endofit yang
terdapat di tanaman tidak berkayu (rumput) dan cendawan endofit yang hidup pada
tanaman berkayu. Cendawan yang terdapat di rumput terbawa biji, termasuk ordo
rumput-rumputan terinfeksi cendawan endofit (Clay 1990). Diketahui bahwa pada
perakaran rumput-rumputan mengandung banyak mikroorganisme yang bersifat
antagonis.
Penyebaran cendawan endofit ini dapat secara vertikal melalui biji. Dalam hal
ini cendawan endofit ditransmisi secara maternal melalui biji tanaman inang,
kemudian hifa cendawan tumbuh berkembang dalam ovul dan biji. Penyebaran
cendawan endofit secara horisontal melalui spora secara eksternal (Clay
et al.
1993;
Clay & Schardl 2002; Saikonen
et al.
1998).
Penelitian pada beberapa rumput-rumputan menunjukkan bahwa tanaman
yang terinfeksi lebih vigor dan toksik terhadap herbivora (termasuk serangga dan
mamalia) dan lebih tahan daripada tanaman yang tidak terinfeksi. Endofit ini sangat
penting untuk meningkatkan ketahanan tanaman dengan mempengaruhi
fitness
secara
keseluruhan inang (Clay 1988; Clay
et al.
1993).
Cendawan endofit mengkolonisasi bagian jaringan tanaman hidup dan tidak
menyebabkan gejala penyakit (Caroll 1990). Cendawan endofit bersifat
menguntungkan tanaman inang (mutualisme) jika mempunyai mekanisme antagonis
terhadap patogen atau menstimulasi pertumbuhan inang dan mempunyai kemampuan
kompetisi. Simbiosis mutualistik tersebut juga dapat menyebabkan berkurangnya
kerusakan pada sel atau jaringan tanaman, meningkatkan kemampuan bertahan hidup
dan fotosintesis sel jaringan tanaman yang terinfeksi patogen tular tanah (Sinclair &
Cerkauskas 1996).
Penggunaan cendawan endofit dalam meningkatkan pertumbuhan dan
mengendalikan penyakit sudah banyak diteliti. Cendawan endofit
Trichoderma
dan
Fusarium
dapat meningkatkan pertumbuhan tanaman tomat. Diketahui juga bahwa
cendawan endofit ini mampu menghambat patogen
F. oxysporum
secara
in vitro
(Amin
et al.
1997). Cendawan
Trichoderma, Fusarium, Penicillium,
dan
Phoma
dapat meningkatkan pertumbuhan dan menginduksi ketahanan pada tanaman ketimun
ketahanan terhadap penyakit yang disebabkan cendawan, serangga, dan nematoda
yang merugikan (Sinclair & Cercauskas 1996). Johnson
et al
. (1985) membuktikan
bahwa cendawan endofit mampu menekan kutu daun pada tanaman padi. Cendawan
endofit
Acremonium coenophialium
secara
in vitro
menghambat pertumbuhan
cendawan patogen
Rhizoctania cerealis
dan
Alternaria alternate
(White & Cole
1985). Terjadinya suatu induksi resistensi lewat perlakuan cendawan endofit
A.
kliense
terhadap penyakit layu pada tanaman tomat (Bragmann & Schonbech 1992).
Pengaruh endofit terhadap nematoda parasit tanaman telah dilaporkan oleh berbagai
ahli peneliti (Nordmeyer & Sikora 1983; Kimmons
et al
. 1990).
Mekanisme Ketahanan Terinduksi
Ketahanan terinduksi adalah ketahanan yang berkembang setelah inokulasi
awal tumbuhan dengan senyawa penginduksi atau elisitor. Respon ketahanan
terinduksi telah diketahui beberapa tahun ini dengan nama yang berbeda-beda, seperti
acquired resistance, acquired immunity,
dan
immunization
(van Loon 1997).
Elisitor berdasarkan tipe atau asalnya terbagi dua, yaitu elisitor biotik dan
elisitor abiotik (Huang 2001). Beberapa contoh elisitor biotik adalah glukan dari
dinding miselia
Phytophthora megasperma
f.sp.
glicinea
mampu menginduksi
fitoaleksin dan reaksi hipersensitif dalam beberapa tanaman (Ayers
et al.
1976).
Phytophthora
menghasilkan protein dengan berat molekul rendah dalam kultur media
yang mampu menginduksi respon ketahanan yang disebut elicitin
.
Ketika
diaplikasikan pada batang dan akar tanaman tembakau, elicitin menyebar cepat pada
lamina daun dan induksi nekrosis tidak hanya pada tempat infeksi tapi pada daerah
yang jauh dari aplikasi. Elicitin yang dihasilkan
P. cryptogea
mampu menginduksi
pembentukan capsidiol (Kamoun
et al.
1994). Glikoprotein yang diisolasi dari
dinding sel
Puccinia graminis
f.sp.
tritici
juga dapat mengaktifkan aktivitas
phenylalanin ammonia lyase
(PAL) dan menginduksi lignifikasi pada gandum (Kogel
(Koga
et al.
1998). Elisitor abiotik yang telah dilaporkan efektif sebagai penginduksi
ketahanan terutama untuk mengatasi masalah
Tobacco Mosaic Virus
adalah asam
salisilat (aspirin) dan asam 2-kloroetilposfonik (Lyon & Newton 1999).
Menurut Steiner dan Schonbeck (1995, diacu dalam Slusarenko
et al.
2000),
karakteristik ketahanan terinduksi
antara lain adalah (1) tidak adanya pengaruh toksin
dari mikroorganisme penginduksi terhadap patogen, (2) penghambat ketahanan
terinduksi yang diaplikasikan akan mempengaruhi ekspresi gen, (3) perlu interval
waktu antara aplikasi
inducer
dengan perlindungan tanaman, (4) perlindungan tidak
spesifik, (5) perlindungan secara lokal dan sistemik, dan (6) tergantung pada peranan
genotipe tanaman untuk tingkat dan tipe perlindungan pada kultivar yang berbeda.
Ketahanan terinduksi biasanya memerlukan periode waktu untuk
mengembangkan resistensi dan tidak spesifik dengan agen penginduksi atau hasil
aktivitas spektrum biologi. Induksi ketahanan pada tembakau dengan
Pseudomonas
tabaci
avirulen dilakukan 24 jam sebelum inokulasi dengan
P.
tabaci
virulen
(Goodman
et al.
1967). Diperkirakan ketahanan terinduksi dapat berkembang apabila
sel-sel inang mampu menghasilkan enzim-enzim baru, yaitu penginduksi ketahanan
yang mengaktifkan gen tumbuhan yang bertanggung jawab dalam mekanisme
pertahanan pertumbuhan tersebut. Pada umumnya agen penginduksi bersifat tidak
spesifik, di mana satu penginduksi dapat membuat tanaman menjadi tahan terhadap
bermacam-macam patogen (Huang 2001).
Adanya ketahanan terinduksi dapat diketahui dari pengurangan gejala
penyakit, perubahan faktor-faktor biokimia dalam tanaman yang menyebabkan
tanaman tahan terhadap penyakit (van Loon 1997). Adapun mekanisme tanggapan
tanaman yang terkait ketahanan terinduksi adalah perubahan struktural tanaman
inang, pembentukan protein pertahanan, pembentukan ensim kitinase, lignifikasi dan
reaksi hipersensitif. Ketahanan terinduksi terjadi sebagai hasil dari beberapa
mekanisme ketahananan (Kessman
et al.
1994).
Pertahanan melalui ketahanan terinduksi nampaknya mengikuti
kematian sel tanaman sangat cepat sehingga sel-sel yang dipenetrasi cepat
bergranulasi, berwarna coklat dan cendawan menjadi terisolir (Elliston
et al
. 1971;
Perez
et al.
1996). Dalam reaksi hipersensitif terjadi dua hal penting, yaitu kematian
sel secara cepat dan inaktivasi patogen. Perubahan yang terjadi pada reaksi
hipersensitif antara lain meliputi akumulasi enzim peroksidase, akumulasi dan
oksidasi senyawa fenolik dan produksi fitoaleksin (Agrios 1997).
Enzim
peroksidase
diketahui berperan dalam ketahanan tanaman terhadap
penyakit. Enzim peroksidase dihasilkan dalam interaksi inkompatibel (Chibbar & van
Huystee 1984; Reimers
et al.
1992; Hammond-Kosack & Jones 1996). Beberapa
tanaman yang menunjukkan reaksi hipersensitif, menyebabkan pembentukan enzim
peroksidase. Reimers
et al.
(1992), menunjukkan bahwa aktivitas peroksidase pada
semai padi yang diinokulasi dengan
Xanthomonas oryzae
pv.
oryzae
setelah 16-24
jam meningkat.
Peningkatan aktivitas peroksidase menyebabkan peningkatan oksidasi
senyawa fenolik, dan di antara pemecahannya ada yang bersifat meracun terhadap
patogen (Fric 1976). Peroksidase menghasilkan quinon melalui oksidasi fenol.
Quinon terakumulasi dengan cepat melalui perantaraan peroksidase (van Lelyveld &
van Vuuren 1988).
Dengan adanya hidrogen peroksida (H
2O
2), peroksidase
mengkatalisis oksidasi senyawa fenil propanoid menghasilkan lignin. Dengan
demikian, peroksidase terlibat dalam biosintesis lignin yang berperan sebagai
barrier
fisik terhadap penetrasi patogen (Vegetti
et al.
1975; Whetten & Sederoff 1995).
Hammerschmidt
et al.
(1982) menyebutkan bahwa prekusor pembentukan lignin
yaitu koniferil alkohol bersifat toksik terhadap
Colletotrichum lagenarium
dan
Cladosporium cucumerinum
.
Asam Salisilat sebagai Signal Translokasi
Asam salisilat (SA) atau 2-hydroxybenzoic merupakan salah satu senyawa
fenol. Asam salisilat telah diketahui berperan penting sebagai molekul signal dari
dengan menginduksi tanaman dengan cara transfer gen bakteri (gen
nahG
) yang
mengkode enzim salisilat hidroksilase, yang diketahui sebagai katalisator perubahan
SA menjadi komponen inaktif catechol. Dari percobaan tersebut ternyata selain
tanaman tidak mengalami akumulasi SA, tanaman juga tidak mampu meningkatkan
respon
Systemic Acquired Resistance
(SAR) terhadap patogen (Lawton
et al.
1995).
Hal ini menunjukkan bahwa induksi SAR diperlukan akumulasi SA.
Infeksi patogen menyebabkan peningkatan SA pada floem ketimun dan
tembakau (Yalpani
et al.
1991). Asam salisilat yang dihasilkan pada daun tembakau
yang terinfeksi TMV dan ketimun yang terinfeksi TNV, ditransportasi ke tanaman
dan terakumulasi pada jaringan yang tidak terinfeksi (Shulaev
et al.
1995; Molders
et
al.
1996). Hal ini menunjukkan bahwa SA diduga sebagai signal yang
ditranslokasikan dari tempat infeksi untuk mengaktifkan SAR. Asam salisilat bukan
merupakan signal yang panjang (
long distance
)
.
Daun ketimun yang diinokulasi
dengan
Pseudomonas syringae
dapat ditranslokasi 6 jam setelah inokulasi
(Rasmussen
et al.
1991).
Asam salisilat sangat berperan dalam ketahanan tanaman terhadap penyakit,
oleh karena itu biosintesis SA merupakan faktor yang sangat menentukan dalam
respon ketahanan tanaman. Asam salisilat ini dibiosintesis dari fenilalanin yang
merupakan suatu perubahan biokimia yang hampir selalu terjadi pada tanaman yang
terinfeksi. Oleh karena itu distribusi yang luas dari SA dalam kingdom tanaman,
memungkinkan tanaman yang terinfeksi untuk mensintesis SA (Yalpani
et al.
1993).
Mekanisme SA dalam menginduksi SAR belum diketahui. Diketahui bahwa
enzim peroksidase berperan sebagai
second messenger
SA dalam
signalling
SAR.
Protein
binding
SA adalah katalase. Asam salisilat diketahui dapat menghambat
aktivitas katalase dan meningkatkan pembentukan enzim peroksidase. Lebih lanjut,
diketahui bahwa enzim peroksidase menyebabkan ekspresi gen PR-1 dan mampu
DAFTAR PUSTAKA
Agrios GN. 1997.
Plant Pathology
. Tokyo. Acad. Pres Tokyo. 635 p.
Alexopoulos CJ, CW Mims. 1996.
Introductory Mycology
. Fourth Edition. John
Wiley & Son. Inc. New York. 632 p.
Amin, N, Malik W, Sarbini G. 1997. Penggunaan cendawan endofit sebagai
biofertilizer dan biopestisida dalam sistem pertanaman tomat.
Pros. Sem.
Perhimpunan Bioteknologi Pertanian Indonesia
. 360-366.
Ayers AR, Ebel J, Valent B, Albersheim P. 1976. Host-pathogen interaction X.
Fractionation and biological activity of an elicitor isolated from the mycelial
walls of
Phytophthora megasperma
var.
sojae.
Plant Physiol.
57. 760-765.
Bailey JA, O’Connell RJ, Pring RJ, Nash C. Infection strategis of
Colletotrichum
Spesies. Di Dalam: Bailey JA, Jeger MJ. 1992.
Colletotrichum
: Biology,
Pathology and Control. CAB. International. 88-120p.
Baker KF, Cook RJ. 1974.
Biological Control of Plant Pathogens.
W.H. Freeman &
Co. San Fransisco. 433p.
Bayman P, Lebron LL, Tremblay RL, Lodge DJ. 1997. Variation in endophytic fungi
from roots and leaves of
Lepanthes
(Orchidaceae).
New Phytol
. 135: 143-149.
Bergstrom GC, Nicholson RL. 1999. The biology of corn anthracnose.
Plant Dis.
83
(7): 596-608.
Binyamini N, Nadel MS. 1972. Latent Infection in Avocado Fruit Due to
Colletotrichum gloeosporioides
.
Phytopathology
62: 592-594.
[BPS] Badan Pusat Statistik.2007. Survey Pertanian: Produksi Tanaman Sayuran dan
Buah-buahan Indonesia. Jakarta.
Bragmann C, Schonbeck F. 1992.
Acremonium kliense
as inducer of resistance to wilt
disease on tomatoes.
J of Plant Disease and Protection
99 (3): 266-272.
Brown GE. 1975. Factor affecting postharvest development of
Colletotrichum
gloeosporioides
in citrus fruits.
Phytopathology
65: 404-409.
Brown AE, Sreenivasaprasad S, Timmer L. 1996. Molecular characterization of slow
growing orange key lime anthracnose strain of
Colletotrichum
from citrus as
Colletotrichum acutatum. Phytopathology
86: 523-527.
Carroll GC. 1988. Fungal endophytes in stem and leaves: from latent pathogen to
mutualistic symbiont.
Ecology
69: 2-9.
Carroll GC. 1990. Fungal endophytes in vascular plants.
Trans. Mycol. Soc. Japan.
Carroll GC.1995. Forest endophytes of grasses: a defensive mutualism between
plants and fungi.
Ecology
69: 0-16.
Chasan R. 1995. SA: Source or signal for SAR? Plant Cell 7 : 1519-1521.
Chen Z, Silva H, Klessig DF. 1993. Involvement of reactive oxygen spesies in the
induction of systemic acquired resistance by salicylic acid in plants.
Science
242: 883-886.
Clay K. 1988. Fungal endophytes of grasses: a defensive mutualism between plants
and fungi.
Ecology
69: 1-16.
Clay K. 1990. Fungal endophytes of grasses.
Ann. Rev. Ecol. Syst
. 21: 275-297.
Clay K, Marks S, Cheplink GP. 1993. Effect of insect herbivory and fungal
endophyte infection on competitive interaction among grasses.
Ecology
74.
1767-1777.
Clay K, Schardl C. 2002. Evolutionary origins and ecological consequences of
endophyte symbiosis with grasses.
American Naturalist
160: 99-127.
www.journals.uchicago.edu/cgi-bin
.
Chibbar RN, van Huystee RB. 1984. Characterization of peroxidase in plant cells.
Plant Physiol.
75: 956-958.
Dayle SA, Neil OP, Paul DS, Melvin RD. 2001. Angiospermae DNA Contamination
by Endophytic Fungi: Detection and Methods of Avoidance.
Plant Molecular
Biologi Reporter
19: 249-260.
[DBPH] Dirjen Bina Produksi Hortikultura. 2007. Perkembangan produktivitas
sayuran tahun 1996-2005.
http://www.deptan.go.id.html
Denoyes B, Baudry A. 1995. Spesies identification and pathogenicity study of French
Colletotrichum strains isolated from strawberry using morphological and
cultural characteritics. Phytopathology 85: 53-57.
Dickman MB. 2000.
Colletotrichum.
Di Dalam Kronstrad JW.
Fungal Pathology
:
Kluwers Academic Publishers: 127-248.
Duriat AS, Widjaya A, Hadisoeganda W, Soetiarso TA, Prabaningrum L. 1999.
Teknologi Produksi Benih Cabai Merah. Balai Penelitian Tanaman Sayuran.
Pusat Penelitian dan Pengembangan Pertanian. Lembang Bandung.
Eastburn DM, Gubler WD. 1990. Strawberry anthracnose: Detection and survival of
Colletotrichum acutatum
in soil.
Plant Dis.
74: 161-163.
Elliston JE, Kuc J, EB Williams. 1971. Induced resistance to bean anhracnose at a
distance from the site of the inducing interaction.
Phytopathology
61:
1110-1112.
Farley JD. 1976. Survival of
Colletotrichum coccodes
in soil.
Phytopathology
66:
640-641.
Fric F. 1976. Oxidative enzymes. Di Dalam : Heitefuss R, Williams PH.
Physiological Plant Pathology
Vol 4.). Springer-Verlag. Berlin Heidelberg New
York: 617-631.
Freeman S, Katan T, Shabi E. 1998. Characterization of
Colletotrichum
spesies
responsible for anthracnose disease of various fruits.
Plant Dis.
82: 596-605.
Freeman S, Minz D, Jurkevitch E, Maymon M, Shabi E. 2000. Molecular analyses of
Colletotrichum
spesies from almond and other fruits.
Phytopathol.
90: 608-614.
Freeman S, Minz D. Maymon M, Zveibil A. 2001. Genetic diversity within
Colletotrichum acutatum sensu
Simmonds.
Phytopathol.
91: 586-592.
Gazoni L, Stegman B. 1997. Supression of
Rhizoctonia solani
by
Cladosporium
foecundissimum
in cotton roots. Di Dalam : Ogoshi A, Homma Y, Kodama F,
Kondo N, Akino.
A Plant Growth-Promoting Rhizobacteria
. Proceeding of the
fourth International Workshop on Plant Growth Promoting Rhizobacteria.
Japan. 224-227.
Goldberg NP. 2003. Chile Pepper Disease. New Mexico State University. 1-19p.
http://www.cahe.nmsu.edu/pubs/circulars/circ549.html
Goodman RN, Kiraly Z, Zaitlin M. 1967.
The Biochemistry and Physiology of
Infectious Plant Disease
. D. van Nostrand Company. Canada. 354 p.
Gunnell PS, Gubler WD. 1992. Taxonomy and morphology of
Colletotrichum
spesies
pathogenic to strawberry.
Mycologia
84: 157-165.
Hammond-Kosack KEH, Jones JDG. 1996. Resistance gene-dependent Plant Defense
Response.
The Plant Cell
8: 1773-1791.
Hammerschmidt R, Nuckles EM, Kuc J. 1982. Association of enhanced peroxidase
activity with induced systemic resistance of cucumber to
Colletotrichum
lagenarium
.
Physiol Plant pathol
20: 73-82.
Henson JM, Michael JB. Day AW. 1999. The dark side of the mycelium: Melanins of
phytopathogenic fungi.
Ann. Rev. Phytopathol.
37: 447-471.
Holliday P. 1980.
Fungus Disease of Tropical Crops.
Cambridge University Press.
Melbourne-Sidney. 605p.
Hong JK, Hwang BK. 1998. Influence of inoculum density, wetness duration, plant
age, inoculation method, and cultivar resistance on infection of pepper plants by
Colletotrichum coccodes. Plant Dis.
82: 1079-1083.
Istikorini Y. 2000. Pengimbasan ketahanan terhadap penyakit antraknosa pada cabai
dengan
Colletotrichum gloeosporioides
avirulen.
Agrosains
14 (3): 313-320.
Johnson M, Dahlan DL, Siegel MR, Bush LP, Latch GCM, Potter DA, Varney DR.
1985. Insect feeding deterrent in endophyte-infected tallfescue.
Appl. Envir.
Microbiol
. 49: 568-571.
Kamoun S, Young M, Forster H, Coffey MD, Tyler BM. 1994. Potential role of
elicitins in the interaction between
Phytophthora
spesies and tobacco.
Appl.
Environ. Microbiol.
60: 1593-1598.
Kessmann H, Staub T, Ligon J, Oostendorp M, Ryals J. 1994. Activation of systemic
acquired disease resistance in plants.
Eur. J. Plant Pathol
100:359-369.
Koga J, Yamauchi T, Shimura M, Ogawa N, Oshima K, Umemura K, Kikuchi M,
Ogasawara N
.
1998. Cerebroside A and C, sphingolipid elicitors of
hypersensitive cell death and phytoalexin accumulation in rice plants.
J. Biol.
Chem.
273:31985-31991.
Kogel G. Beissmann B, Reisener HJ, Kogel K. 1988. A single glycoprotein from
Puccinia graminis
f. Sp.
Tritici
cell walls elicits the hypersensitive lignification
response in wheat.
Physiol. Mol. Plant. Pathol.
33: 173-185
Koike N, Kageyama K, Hyakumachi M. 1997. Induction of systemic resistance in
cucumber against anthracnose, bacterial angular leaf spot, and Fusarium wilt by
selected strains of plant growth promoting fungi (PGPF). Di dalam : Ogoshi A,
Homma Y, Kodama F, Kondo N, Akino.
A Plant Growth-Promoting
Rhizobacteria
. Proceeding of fourth International Workshop on Plant Growth
Promoting Rhizobacteria. Japan: 262-272.
Kim BS, Park HK, Lee WS. 1989. Resistance to anthracnose (
Colletotrichum
spp) in
pepper. P. 184-188. Di Dalam : Tomato and Pepper Production in the Tropic.
AVRDC. Shanhua. Taiwan. China.
Kimmons CA, Gwinn KD, Bernard EC. 1990. Nematode reproduction on
endophyte-infected and endophyte-free tell fescue.
Plant Dis.
74: 757-761.
Lawton K, Weymann K, Friedrich L, Vernooij B, Uknes S, Ryals J. 1995. Systemic
acquired resistance in
Arabidopsis
requires salicylic acid but not ethylene.
Mol.
Plant-Microb Interac.
8: 863-870.
Lyon GD, Newton AC 1999. Immunizing plants against pathogens: Implementing
induction in Agriculture. Di Dalam : Induced plant defenses against pathogens
and herbivores. APS Press. American Phytopathological Society. Minnesota:
299-318
Mehrota RS. 1980. Plant Pathology. Tata Mc. Graw-Hill. New Delhi. 771p.
Molders W, Buchala A, Metraux JP. 1996. Transport of salicylic acid in tobacco
necrosis virus-infected cucumber plants.
Plant Physiol.
112: 787-792.
Niere B. 2002. Banana Endophyte: Potential for Pest Biocontrol. IITA-ESARC.
Kampala, Uganda.
Nirenberg HI, Feiler U, Hagedorn G. 2002. Description of
Colletotrichum lupine
comb. nov. in modern terms.
Mycologia
94: 307-320.
Nordmeyer D, Sikora RA. 1983. Studies on interaction between
Heterodera daverti,
Fusarium avenacum,
and
F. oxysporum
on
Trifolium subterranum
.
Rev.
Nematol
. 6 (2): 193-198.
Perez MDG, Egea C, Candela ME. 1996. Hypersensitive-like response of pepper
(
Capsicum annuum
L.) cells to
Phytophthora capsici. Physiologia Plantarum
98: 737-742.
http://www.edu/orgs/pnas/abs97/posters/perez.html
Podila GK, Roosen E, San Fransisco MJD, Kolattukudy PE. 1995. Targeted Secretion
of Cutinase in
Fusarium solani
f.sp.
pisi
and
Colletotrichum gloeosporioides
.
Phytopathology
85: 238-242
Rasmussen JB, Hammerschmidt R, Zook MN. 1991. Systemic induction of salycilic
acid accumulation in cucumber after inoculation with
Pseudomonas syringae
pv.
Syringae. Plant Physiol.
97: 1342-1347.
Reimers PJ, Guo A, Leach JE. 1992. Increased activity of a cationic peroxidase
associated with an incompatible interaction between
Xanthomonas oryzae
pv.
Oryzae
and rice (
Oryza sativa
).
Plant Physiol.
99: 1044-1050.
Saikkonen K, Faeth SH, Helander M, Sullivan TJ.1998. Fungal endophytes: a
continuum of interaction with host plant.
Ann. Rev. Ecol. System
29: 319-343.
Semangun H. 1994. Penyakit-Penyakit Tanaman Hortikultura di Indonesia. Gadjah
Mada University Press. 850p.
Setiadi. 1992. Bertanam Cabai. Penebar Swadaya. Jakarta 188 p.
Setiamihardja R, WA Qosim. 1991. Uji Ketahanan terhadap penyakit antraknosa pada
tanaman cabai merah untuk seleksi tetua. Zuriat 2: 37-42.
Slusarenko AJ, Fraser RSS, van Loon LC. 2000.
Mechanisms of Resistance to Plant
Disease.
Kluwer Academic Publisher. Netherlands. 620p.
Shulaev V, Leon J, Raskin I. 1995. Is salicilic acid translocated signal of acguired
resistance in tobacco?
Plant Cell
7 : 1691-1701.
Sreenivasaprasad S, Sharada K, Brown AE, Mills PR. 1996. PCR-based detection of
Colletotrichum acutatum
on strawberry.
Plant Pathol
45: 650-655.
Suryaningsih ER, Sutarya R, Duriat AS.
1996. Penyakit Tanaman Cabai Merah dan
Pengendaliannya. Di Dalam : Teknologi Produksi Cabai Merah. Balai
Penelitian Tanaman Sayuran Lembang. Bandung. Pp 64-84.
Sutariati GAK. 2006. Perlakuan benih dengan agens biokontrol untuk pengendalian
penyakit antraknosa, peningkatan hasil dan mutu benih cabai [disertasi].
Bogor: Institut Pertanian Bogor, Fakultas Pertanian. 163p.
Sutton BC. 1992. The genus
Glomerella
and its anamorph
Colletotrichum.
Di Dalam
: Bailey JA, Jeger MJ. 1992.
Colletotrichum
: Biology, Pathology and Control.
CAB. International. 388 p.
Talhinhas P, Sreenivasaprasad S, Neves-Martins J, Oliveira H. 2002. Genetic and
morphological characterization of
Colletotrichum acutatum
causing anthracnose
of lupins.
Phytopathology
92: 986-996.
Urena-Padilla AR, Mitchell DJ, Legard DE. 2001. Oversummer survival of inoculum
for Colletotrichum crown rot in buried strawberry crown tissue.
Plant Dis.
85:
750-754.
van Lelyveld LJ, van Vuuren SP. 1988. Peroxidase activity as a marker in greening
disease of citrus for assesment of tolerance and susceptibility.
Phytopathology
121: 357-362.
Van Loon LC. 1997. Induced resistance in plants and the role of pathogenesis-related
proteins.
European J. of Plant Pathol.
103: 753-765.