GENE FLOW DARI GEN ICETAHANAN ANTIBIOTIKA
(nptII)
DAN PROMOTOR CaMV 35s PADA TANAMAN
KAPAS TRANSGENIK BOLLGARD NuCOTN
35B
K E
IOiPAS
BUKAN TRANSGENIK
OLEH
:
REZA INDR.IAD1
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOH;
ABSTRAK
REZA INDRIADL. Gene Flow dari Gen Ketahanan Antibiotika (nptII) dan Promotor CaMV 3 5 s pada Tanaman Kapas Transgenik Bollgard NuCOTN 3SB ke Kapas Bukan 'Transgenik. Dibawah Bimbingan DWI ANDREAS SANTOSA dan MUHAMMAD I-IERMAN.
Penelitian tentang gene flow dari gen ketahanan antibiotika (nprII) dan promotor CaMV 3 5 s pada tanaman kapas transgenik Bollgard NuCOTN 35B l<e kapas bukan transgenik dilaksanakan dari bulan November 2001 sampai dengan Agustus 2002. I'enelitian ini bertujuan untuk memperoleh metoda untuk melakukan isolasi DNA genom total dari biji kapas yang sesuai untuk keperluan PCR dan molekular kloning, mendeteksi terjadinya gene $ow dari gen ketahanan antibiotika (nptII) dan pr~motor 35s CaMV pada kapas transgenik Bollgard ke kapas bukan transgenik, mendeteksi terjadinya multiplikasi kedua gen tersebut pada kapas bukan transgenik. Metodologi yang digunakan dalam penelitian ini adalah ekstrdksi dan isolasi DNA genom total dari biji, pelacakan sekuen DNA transgenik melalui lvebsite GenBank dan disain primer dengan meilggunakan software Primer3, pendeteksian gen nptII dan promotor 35s CaMV dengan proses polymerase chain reaction (PCR) dan pendeteksian multiplikasi sekuen rr~elalui
densitometer.
Hasil !rang diperoleh menunjukkan bahwa berhasil diperolehnya rrletoda isolasi DNA genom total dari biji kapas dengan berat molekul lebih dari 24 kb, dengan hasil 1.58
+
0.63 pg DNA per biji, dan tingkat kemurnian DNA 1.82+
0.36. Terjadinya gene flow dari gen nptII dan promotor 35s CaMV pada tanarnan kapas transgenik Bollgard ke tanaman kapas jenis Kanesia-7. Sebaliknya tidak ditemukiin terjadinya multiplikasi kedua gen tersebut pada tanaman kapas Kanesia-7.Saya ~nenyataknn dengan sebenar-benamya bahbva segala pernyataan
dala~n
tesis say;[y a n g be~:judrll
:GENE
FIdOFV
1)AIIl C1CN l<ICrI'A1lANAN AN'I1II~lO'l'Il<A (t ~ p t l l )
DAN I'ROMO'I'OIt
CirMV 3SSA
' I ' A N A M A N ICAI'AS
T M N S G E N I l t BOLLGARD NuCOrl'N
3513
ICE
IOIl'AS
BUI<AN TRANSGENII<
Merupakan gagasan atau hasil penelitian tesis saya sendiri dengan
pernbimbingan ltolnisi pembimbing, kecuali yang dengall secara jelas
ditunjukkan ri~,jukkannya. Tesis ini belunl pernah diajukan untuk
memperoleh gelar pada program sejenis di Perguruan Tinggi lain.
,Semua data dall inforrllasi yang digunaltan telah dinyatakan secara
jelas dan dapat diperiksa kebenarannya.
Reza Indriadi
GENE FLOW
D A N GEN KETAHANAN ANTIBIOTIIKA
(nptII)
DAN PROMOTOR CaMV
35s
PADA TANAMAN
KAPAS TRANSGENIK BOLLGARD NuCOTN 35B
K E KAPAS BUKAN TRANSGENIIC
OLEH
:
REZA INDRIADI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar
Magister Sains Pada
Program Studi Bioteknologi
PROGRAM PASCASA,RJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : GENE FLOW DARI GEN KETAHANAN ANTIBIOTIKA (nptII) DAN PROMOTOR CaMV 35s PADA TANAMAN KAPAS TRANSGENIK BOLLGARD NuCOTN 35B KE KAPAS BUKAN TRANSGENIK
Nama Mahasiswa : Reza Indriadi
NRP : 99643
Program Studi : Bioteknologi
\ Menyetujui,
1. Komisi Pembimbing
*Q*-
Dr. Ir. Muhammad Herman
Ketua Anggota
Mengetahui,
2. Ketua Program Studi rogram Pascasarjana
Bioteknologi
fP1
C
-
Alhamdulillah..
. .
ku syukuri atas segala rahmat. MU
mungkin kecil bagi MU tapi sangat berarti bagi ku sepenggal asa, telnh kuraih dalam panjangnya perjalanan hidup ini
Penulis dilahirkan di Padang pada tanggal 23 Januari 1976 sebagai analc
kedua dari tiga bcrseudara dari keluarga Nasri Taharudin dan Indrawati. Jenjang
pendidikan SD di S11 Negeri 2 Nanggalo Padang, SMP Negeri 12 Padang d m
SMA PGRI 1 Paditng. I
Pendidikall sarjana ditempuh pada tahun 1994 di Program Studi Agronomi
Junlsan Budidaya Pcrtanian, Fakultas Pertaniaii. Universitas Andalas, lulus pada
tahun 1999. Patla tahun yang sarna, penulis diterima di Program Studli
PRAKATA
Puji dan s ~ u k u r penulis haturkan kehadirat Allah SWT atas segala Rahmat
dan Karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan
Tesis ini dengan baik. Tesis yang berjudul "Gene flow dari Gen Ketahanan Antibiotika (nprJI) dan Promotor CaMV 35s pada Tanaman Kapas Transgenik Bollgard NuCOTN 35B ke Kapas Bukan Transgenik" irii merupakan salah sat11 syarat untuk memperoleh gelas Magister Sains (MSi) pada
Program Studi 13ioieknologi Institut Pertanian Uogor. Pada Kesempatan i r ~ i
penulis bermaksutl mengucapkan terima kasih yang sebesar-besarnya pada :
1. Dr. Ir. DM i Andreas Santosa dan Dr. Ir. Muhammad Herman selaku ketua
dan anggota komisi pembimbing yang memberikan arahan clan bimbingan
dalam pe1itks;lnaan penelitian ini.
2. Kedua ormg tua penulis, Nasri Taharudin (Alm) dan Indrawati beserta
kedua sattdara, Ivan Indriawan dan Yohall Indriansyah yang telah
8
memlerikiin doa, kepercayaan dan sernangat yang tak ternilai bagi
penulis.
3." Jajaran direksi dan staff Indonesia Center for Biodiveisity ant1
Biotechnology (ICBB) yang memberikan bantuan dana sehingga
penelitian ini dapat terlaksana dengan baik.
4. Ir. FX. I<~.istiyono selaku direktur PT. Saraswanti Endogenetech beserta
staff yarg telah memberikan bantuan fasilitas dalarn pelaksanaail
penelitian ini
5. Adinugrollo Setiawan, ST dan staff laboratorium PT. Saraswanti
Indogenetch atas kerjasama yang diberikan selama penelitian.
6. Rekan-rekan di laboratorium, Heru Kusdianto, SPi., Neni Yuliawati, SI' dm Marhirmrrh Nadir, SP dan rekan-rekan mahasiswa PPs Bioteknologi
7. Bapak, Ibu dan r ~ k a n di Ikatan Keluarga Besar Universitas Andalas
Bogor, rehan-rekan alumni jurusan Budidaya Pertanian Fal;ultas Pertanian
Universitas Andalas angkatan 1994 atas keakraban selama ini.
8. Keluarga I~esar Taharudin, Yazid dan Hasmanan yang telah memberikan.
dorongan selnangat kepada penulis untuk dapat menyelesaikan studi
dengan b a ~ k.
9. Guru-guru yang telah mendidik dan mengajariku.
Akhir kata penulis berharap tesis ini dapat memberikan manfaat bagi
yang membaca dan nlenjadi pertimbangan dan masukan untuk pelepasarl tanaman
kapas transgenik.
Bogor, September 2002
DAFTAR IS1
.
.
DAFTARTABEL
...
11...
...
DAFTAR GAMBAR 111
...
DAFTAR
LAMPI
RAN ivPENDAHU1,UAN
...
Latar Belakang 1
Tujuan
...
5 Manfaat Perleli tian...
5TIN JAUAN PUSTAKA
...
Tanaman Hasil Modifikasi Genetik 6...
Analisis Resiko Lingkungan 9
BAHAN DAN METODE
...
Tempat dan Waktu
...
Bahan Tanaman...
Sekuen DNA Kapas Transgenik dan Disain Primer
Ekstraksi dan Isolasi DNA Genom Total dari Biji Kapas ... Pendeteksiail Gene I~lovv dari Gen nptII dan
...
...
Promotor CaMV 35s Melalui PCR
.
.
Pendeteksian Multiplikasi Melalui Densitomerer
...
HASIL DAN PEMBAHASAN
Sekuen DNA Kapas Transgenik dan Disain Primer
...
28 Ekstraksi dan Isolasi DNA Genom Total dari Biji Kapas...
33 Pendeteksian Gene Flow dari Gen nptII dan...
Promotor CaMV 35s Melalui PCR 36
...
Pendeteksian Multiplikasi Melalui Densitometer 43
...
KESIMPULAN 45
...
DAFTARPUSTAKA 45
DAFTAR TABEL
Halaman
1
. Hibridisasi Tailaman dengan Spesies Liarnya
(Wild Relatives)...
152
. Sekuen dan Ciri Primer- primer CaMV 35s dan
nptII...
283
. Kapas Bollgard dan Karakteristiknya Berdasarkail USFDA ...
294
.
Kapas Bollgard dan Karakteristiknya Berdasarkan BLAST...
305
.
Karakteristik Sekuen DNA Transgenik dan KomplemensitasDAFTAR GAMBAR
Halaman
1
.
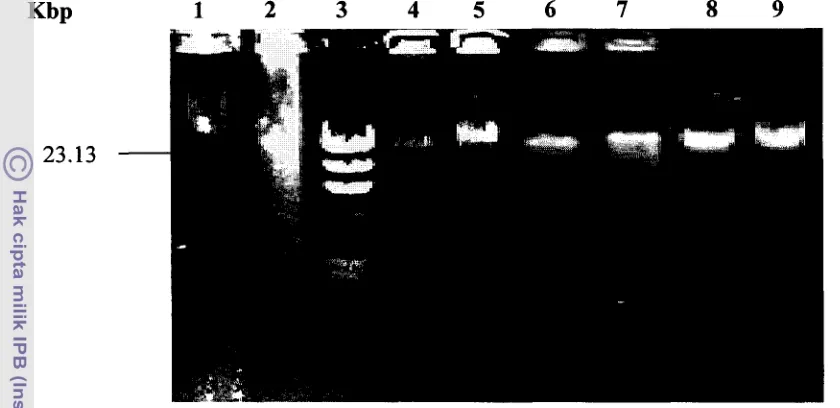
Hasil E. kstraksi dan Isolasi DNA Genom Total biji Kapas...
34...
2
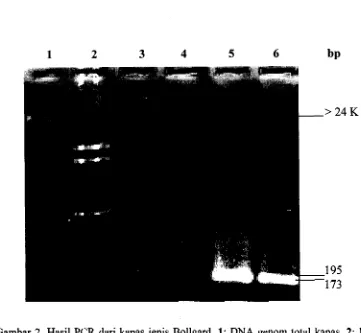
.
Hasil PCR dari Biji Kapas Jenis Bollgard 383
.
Hasil Amplifikasi dengan Menggunakan Primer TN5...
Untuk mendeteksi Fragmen nptII 39
4
.
Hasil Amplifikasi dengan Menggunakan Primer 35s-B...
Untuk mendeteks; Fragmen CaMV 3 5 S 39
5
.
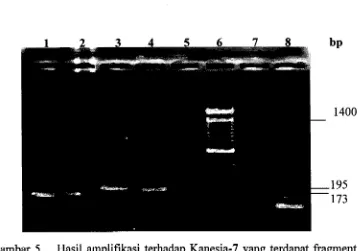
Hasil Amplifikasi Terhadap Kanesia-7 yang...
DAFTAR LAMPIRAN
Halaman
1
.
Denah Pengambilail Sampel Biji Kapas...
51...
.
2 Deskripsi Kapas Varietas NuCOTN 35B (Bollgard) 52
.
...
3 Sekuen Lengkap dari PBI 1012T 53
.
...
4 Sekuen Legkap dari Promotor CaMV 35s 57PENDAHULIJAN
Teknologi rekayasa genetik tanaman telah mengalami perkembangan yanlg
sangat pesat pada dekade belakangan ini. Teknologi ini memberikan pengertis~n
dalam transfer DNA dari berbagai organisme kedalam tanaman dengan harapan
bahan genetik yang ditransfer tersebut dapat meinberikan keuntungan terhada.~
industri pertanian, makanan dan konsumen.
Tanarnan transgenik mengandung bahan genetik yang secara artifisial
dimasukkan kedalanl susunan genoln tanaman. Susunan dari baharl genetik
tersebut murlgkin dapat berasal dari tanaman dari spesies lain, atari bahkan dari
organisme lainnya. Seperti halnya yang terdapat pada kapas Bt. dimana tanarnan
pada kapas Bt mengandung bahan genetik dari bakteri Bacilius thuringiezzsis
(crylAc) d m protein dihasilkan efektif terha'dap serangan harna Lepidoptera
(Monsanto, 2001). Tananlan transgenik dikenal dengan istilah tanarnan hasil
rekayasa genetik atau hasil modifikasi genetik (genetically moJiJiec(' crops),
walaupun sebenarnya tanaman itu sendiri telah mengalarni modifikasi genetik
dalam jangka waktu yang cukup lama dengan jalan membudidayakan spesies liar,
adanya seleksi serta kontrol terhadap pemakaian bmih yang baik untuk musinn
tanam berikutnya, kesemuarlya ini dilakukan secara konkensional oleh petani
sejak lama tanpa lnengetahui proses pemodifilcasian / perekayasaan genetik yang
Data yang diperoleh International Service for Acquisition of Agri-biotech
Applications (ISAAA) oleh James pada tahun 2001 mznyatakan bahwa secara
global terjadi peningkatan penanaman tanaman transgenik yaitu sekitar 1,7 juta
hektar pada t'hun 1996 menjadi 52,6 juta hektai pada tahun 2001. Tanaman kapas
transgenik sendiri menyumbang sekitar 13 % dari total area penanaman tanamal;
transgenik pada tahun 2001 dan mengalami peningkatan sekitar 28 % dari tahutl
sebelurnnya. Penanaman tanaman transgenik di Indonesia hanya sekitar 4.000
hektar (James, 21301).
Penggunaan tanaman transgenik secara komersial telah menjadi perhatiark
hampir di seluruh negara di dunia, termasuk di lndonesie. Sr;:jak tahun 1997
prinsip kehati-hatian merupakan pendekatan yang dilakukan olzh pemerintal-1
.
Indonesia terhadap pengaturan keamanan hayati Produk Bioteknologi Hasil Rekayasa Genetik (PBPHRG) dengan keluarnya keputusan Menteri PertanianNo. 856/Kpts/HW.330/9/1997. Karena keputusan Menteri Pertanian tersebut
belum mencakup aspek keamanan pangan produk PBPMRG, maka pada tahun
1999 dikeluarkan Surat Keputusan Bersama Empat Menteri, Menteri Pertanian,
Menteri Kehutanan dan Perkebunan, Menteri Kesehatan dan Menteri Negara
Pangan dan Hortikultura tentang Keamanan Hayati dan Keamanan Pangan Produk
Pertanian Hasil Rekayasa'Genetik (PPHRG) (Herman, 2002. komunikasi pribadi)
Sehubungan dengan itu telah dikeluarkan beberapa peraturan dan pedoman
serta dibangunnya Fasilitas Unit Terbatas (FUT) yang bertujuan pengujian
keamanan hayati tanaman transgenik. Disamping itu telah dibentuk suatu
s
yaitu Komisi Kearnanan Hayati dan Keamanan Pangan (KKHKP) yang dalanl
tugasnya dibantu oleh Tim Teknis Keamanan Hayati dan Keamanan pan gar^
(TTKHKP).
Menurut surat Keputusan Bersama Empat Menteri, Menteri Pertanian,
Menteri Kehutar~an dan Perkebunan, Menteri Kesehatan dan Menteri Negara
Pangan dan Hortikultura No. 998.l/Kpts/OT.210/9/99; 790.a/Kpts-IXf1399;
1 145A/MENKES/SKB/IX/l99; 01 SA/Nmeneg PH01U09/1999, tentang
Keamanan Hayati dan Keamanan Pangan Produk Pertanian I-Jasil Rekayasa
Genetik, setiap tanaman transgenik termasuk kapas Bt, yang akan dimarifaatkart di
Indonesia harus melalui suatu evaluasi, pengkajian, dan pengujian keamanari
hayati tanaman transgenik. Evaluasi dan kajian dokumen dan pustaka ilmidi
tentang keamanan hayati tanaman transgenik yang diuji dilakukan oleh TTKHKF'
Kelompok Tanaman. Pengujian tanaman transgenik dilakukan secara bertahap
yaitu di Fasilitas Uji Terbatas (FUT) dan Lapangan Uji Terbatas (LUT).
Persetujuan pengujian keamanan hayati di FUT diberikan oleh TTKHKP.
TTKHKP menetapkan pengujian keamanan hayati tanaman transgenik untuk.
dapat dilanjutkan di LUT. Pelaporan hasil evaluasi, pengkajian dan pengujian~
keamanan hayati oleh TTKHKP kepada KKHKP. Atas saran TTECHKP, KKHKP'
merekomendasikan arnan hayati terhadap tanaman transgenik yang dijui dalam ha1
ini kapas Bt kepada Direktur Jenderal terkait. Tanaman transgenik yang sudah,
mendapatkan ketetapan keamanan hayati dadatau keaimanan pangan dapal
Kapas Bt y ang dikpas oleh pemerintah telah m6ndapatkan status aman liayati dan
melalui prosedur pelepasan varietas tanaman.
Secara global Perkembangan dari penggunaan tanaman transgenik teial-1
menimbulkan menimbulkan perdebatan pro dan kontra pada masyarakat
(Johnson and Riordan, 1998; Ho, 2000; Herman, 2000) serta menjadi isu yang
penting di Indonesia (Amsar, 2001; Syamsari, 2001; YLK Sulsel, 2001).
Di Indonesia, kapas Bollgard adalah tanaman transgenik yang pertama kalii
ditanam pada skala komersial tahun 2001. Kapas transgenik yang cliintroduksikar~
tersebut dikenal dengan nama NuCOTN 35B (Bollgard), dengan karakteristik;
tahan terhadap serangan hama Helicoverpa armigera. Uji coba tanaman in^
dilakukan di Kabupaten Takalar, Bantaeng, Gowa dan Bulukumba Provinsi~
Sulawesi Selatan dengsrn jumlah keseluruhan 465 ha. Dengan keluarnya~
SK Mentan No. 107/KPTS/KB 430/2/200 1, maka penananan kapas Bollgardl
dilakukan secara komersial pada tujuh kabupaten di Sulawesi Selatan yaitu~
Gowa, Takalar, Bantaeng, Bulukumba, Bone, Soppeng yang bxlsku selama satul
tahun dan terbatas pada lahan seluas 8.000 ha.
Analisis risiko lingkungan (ARL) pada lahan penariaman tanaman
transgenik merupakan ha1 yang mendasar dan harus dilakukan. ARL ini
bertujuan menetaplcan risiko lingkungan yang mungkin muncul akibat dari
pelepasan secars kolnersial tanaman kapas transgenik serta kemungkiilan tindak
lanjutnya dan dik~arapkan untuk menjadi suatu kajian komprehensif'
(Santosa, 2001a; Santosa, 2001b komunikasi pribadi). Hasil evaluasi kapas
bahwa kapas transgenik Bollgrad aman terhadap lingkungan (Herman, 2002
komunikasi pribadi).
Penelitian yang telah dilakukan adalah kajian mengenai gene flow dari gen
ketahanan antibiotika (nptII) dan promotor CaMV 35s pada tanaman kapas
transgenik Bollgald NuCOTIq 35B ke kapas bukan transgenik. Hipotesis yang
diperoleh dimungkinkan terjadinya gene flow dari gen ltetahanan antibiotika
(nptII) dan promotor CaMV 35s pada kapas transgenik Bollgard ke kapas bukarl
transgenik.
Tujuan
1. Memperoleh metoda yang sesuai untuk mengisolasi DNA genom total darii
biji kapas.
2. Mendeteksi kemungkinan terjadinya gene flow darl gen ketahanani
antibiotikz (nptII) dan promotor CaMV 35s pada kapas transgenik. Bollgard
NuCOTN 35B ke kapas bukan transgenik.
3. Mendeteksi kemungkinan terjadinya multiplikasi atau peningkatan kopi gen
nptII dan pronlotor CaMV 35s pada kapas bukan transgenik.
6
Manfaat Penelitian
Wasi'l dari penelitian ini diharapkan dapat menjadi pertimbangan masukan
TINJAUAN PUSTAKA
Tanaman Hasil Modifikasi Genetik.
Rendahnya kualitas dan kuantitas merupakan masalah utama yang ditemui
dalarn usaha pertanian yang disebabkan oleh cekaman bio~ik, seperti serangaii
hama dan penyakit tanaman serta oleh cekaman abiotik, seperti masalah tanah
masam yang banyak dijumpai terutama di Indonesia. Pemu!iaan tanarnan secara
konvensional dapat mengatasi masalah ini bila dapat diketahui plasma nutfahnya
(germpla3m). Teknologi rekayasa genetik melalui teknik DNA rekombinar~
(rDNA) membuka peluang untuk mernodifikasi bahan genetik ketahanan terhadap
cekarnan biotik dan abiotik dari organisme lain selain tanmarl. Langkah-langkah
essensial dari rekayasa genetik pada tanarnan adalah identifikasi gen yang;
diinginkan, kloning, studi fungsi dan regulasinya, introduksi gen sel-ta studj,
ekspresi kedalsm sel dan akhimya evaluasi genotipe yang dimaksud di lapangan
(Johnson and Riordan, 1998).
Metoda pemuliaan pada tanaman kapas (Gossypium hirsutum) yang
disarankan untuk lnernperoleh tanaman kapas yang tahan terhadap serangan harna
selain dengan n~elakukan penyilangan dengan spesies liar yang diketahui
mempunyai sifat ketahanan terhadap hama, adalah dengan mengintroduksikari gen
ketahanan ke dala~n tanaman kapas yang berasal dari organisme lain dengan cara
rekayasa genetik (Watson, 1989). Salah satu haina yang menyerang tanaman
dikenal dengan cotlon bollworm. Pada tanaman kapas, larva dari hama irli
menyerang bagjan pangkal dari pucuk bunga, bunga deavasa dan buah
(Menn, King and Coleman, 1989) dan pengendalian hama Heliothis sea secara
biologis adalah menggunakan bakteri Bacillus thuringien.sis. Menn et a1 (1989)
menyatakan bahwa lnetoda pengendalian hama Heliothis dengan menggunakan
bakteri Bacillus lhuringicnsis telah digunakan lebih dari dua puluh tahun ymg
lalu dan dianggap sebagai elemen pokok dari program manajemen pengendalian
yang terintegritas. Bakteri yang digunakan adalah Bacillus thurigl:ensis var.
kurstaki strain HD- 1
.
Pemanfaatan suatu bahan genetik yang menyandikan sifat ketahanan bag,i
tanarnan yang telah dikembangkan dan dikomersialkan dalam bentuk tanaman
transgenik adalah yang bersumber dari gen phosphinotricin acetil transferase
(pat) yang diisolasi dari' Streptomyces, gen 5-enolpyruvylshiki~mase-3-phospt
Synthase (epsps) yang digunakan untuk mentransfonnasi sifat tanaman toleran
bagi herbisida serta pemanfaatan protein kristal dari Bacillus thuringiensis untuk
gen ketahanan scrangan serangga hama bagi tanaman (Travers, h4artin and
Reichelderfer, 1987; Feitelson, Payne and Kim, 1942)
Kapas merupakan salah satu tanaman utama penghasil serat dan serangga
lepidoptera adalah masalah hama utarna yang ditemui. Kapas transgenik jenis
Bollgud dihasilkan dengan menyisipkan protein pengendali insekra (CrylAc)
yang diperoleh dari bakteri tanah Bacillus thuringiensis subsp. Kurstalci (B.t.61
yang dipindahkan dengan mediasi Agrobacterium tumefaciens. Laporan safety
produksi protevn CrylAc didalanl genom tanaman kapas &an memberikan
ketahanan alarni terhadap serangan hama serangga lepidoptera, diantaraya
tobacco budworn, pink bollworn, dan cotton bollworn (Monsanto, 2001).
Kapas Bollgard ini mulai dikembangkan, pada akhir tahun 1980 oleh
Monsanto St. Louis, Co dan mulai dikenalkan di Amerika Serikat pada tahun
1996 yang diikuti penanamannya oleh negara-negara Argentina, Australia, China.,
Meksiko dan Afrika Selatan (Edge et al., 2001). Penanaman kapas transgenik Bf
di dunia sekitar 1,9 juta hektar atau 4 % dari total 52,6 juta hektar dari total
tanaman transgenik pada tahun 2001, peningkatan yang peningkatan cukup
signifikan terdapat di China dari 0,5 juta hektar pada tahun 2001 menjadi 1 3 jutii
hektar pada tahun 200 1 (James, 200 1).
Kapas Bollgard ini mengandung dua T-DNA insert dari Agrobacteriurut
tumefaziens. Insert pertama mengandung kopi tunggal dari gen crylAc, nptII[
(neomycin phosphotransferase II yang mengkode ketahanan terhadap antibiotika
kanamisidner~misin), serta gen ketahanan antibiotika' spektinornisin dar.1
streptomysin [nad{3 "(9)-0-aminoglyciside adenyltmnsferase)]. Gen kaset cry1 Ac:
terdapat promotor 35s dan terminator 7S3', gen nptJI dikendali.k.an oleh promotor
caulzjlo~ver mosaic virus 35s dan terminator n o d ' (nophaline syrrthase), gen ini
berfungsi mcngatur polyadenilation dari mRNA. Insert T-DNA kedua terdapat
262 bp yang me~upakan bagian terminator polyadenylafion 7S3' dari gen cry1 Ac
(Monsanto, 2001).
Gen-gen dari organisme donor yang terlibat dalarn pembuatan kapas
nophaline synthase terminator dari bakteri Agrobacterium ~'umefaciens, nptII da~n
aad dari bakteri E. coli, 7S3 ' terminator dari Glycine max (Monsanto, 2001).
Analisis Risiko Lingkungan.
Pelepasan PI-IRG terutama tanaman transgenik ke lingkungan aka1
berpontensi untuk berinteraksi dengan keanekaragaman habitat yang terdapat di
sekitarnya dalam skala waktu dan ruang. Ekosistem bersifat komplek, maka tidalc
setiap pelepasa~l tanaman transgenilc dapat dilakukan kajian risiko lingkungan
secara tepat. Interkasi yang terjadi di alam terutama dalam jangka waktu yang
lama merupakan suatu kendala dalam melakukan prediksi mengenai potensial
risiko yarig terjadi disamping sedikitriya data yang menunjang niengenai dm~palc
lingkungan yang ditimbulkan. Pengelolaan yang tepat merupakm ha1 yang
dibutuhkan dalam nlenetapkan suatu kajian mengenai risiko lingkungan dari
pelepasan tanarnan transgenik (Wolfenbarger and Phifer, 2000).
Setiap tanaman transgenik termasuk kapas Bt, yang akan dimanfaatkan di
Indonesia hams ~nelalui suatu evaluasi, pengkajian, dan pengujian keamanari
hayati tanaman transgenik. Menurut Surat Keputusan Bersama Empat Menteri,
Menteri Pertanian, Menteri Kehutanan dan Perkebunan, Menteri Kesehatan darl
Menteri Negara Pangan dan Hortikultura No. !398.1/Kpts/OT.210/9/99;
790.alKpts-1x11999; 1 145A/MENKES/SKB/IX/l99; 01 5AAVmeneg PHORI 09,'
1999, tentang Keamanan Hayati dan Keamanan Pangan Produk Pertanian Hasil
Rekayasa Genetik bahwa pemanfaatan tanaman transgenik baik produk yang
hayati dan keamanan pangan serta memepertimbangkan kaidah agama, etika,
sosial budaya dan estetika (gen yang ditransformasikan harus tidak bertentangan
dengan kaidah agama atau harus halal).
Evaluasi dan kajian dokumen dan pustaka ilmiah tentang keamanan hayaiti
tanaman transgenik yang diuji dilakukan oleh TTKMKP Kelompob Tanaman.
Evaluasi dan kajian dokumen dan pustaka ilmiah dilakukan terhadap data d m
dokurnen jawaban pertanyaan-pertanyaan inti yang mencakup anatara lain spesies
yang akan diuji, tujuan khusus pengujian, lokasi, habitat dan ekologi, genetika
tanaman transgenik, prosedur percobaan, dan pemantaua~~, serta dok.ume~n
pernyataan aman yang disetujui untuk dikomersialkan diberbagai negara.
Pengujian keamanan hayati tanaman transgenik dilaltukan secara bertdiaj~
yaitu di Fasilitas Uji Terbats (FUT) dan Lapangari Llji 'T'erbatas (LUT).
Persetujuan pengu-jian keamanan hayati di FUT diberikan oleh T?'HE;IP. Pengujian
tanaman transgenik di FUT dilaksanakan sesuai dengan Pedoman Pengujian
Keamanan Hayati PI3HRG Seri Tanaman tahun 1998. 'TTKHKP melakukari
monitoring terhadap pelaksanaan pengujian tanaman transgenik di FUT. Evaluasi
dan pengkajian data hasil pengujian FUT dilakuarl oleh 'T'TKNKP Kelompok
Tanaman. Dari hasil review pengujian keamanan hayati di FUT dan kajian ilmiah
data-data dan dokumen keamanan hayati di luar negeri, diketahui tidak adanya
darnpak negatif dan efikasi positif dari sifat utama yang di klaim dari tanarnar~
transgenik.
TTKHKP nienetapkan pengujian keamanan hayati tanaman transgenik.
dilaksanakan di tiga lokasi. Pengujian tanaman transgenik di LUT dilaksanakan
sesuai dengan Pedoman Pengujian Keamanan Hayati PBHKG Seri Tanaman
tahun 1998. TTKHKP melakukan monitoring terhadap pelal~sanaan pengujian
keamanan hayati di LUT. Pelaporan hasil evaluasi, pengltajian dan pengujian
keamanan hayati oleh TTKHKP tentang rekomendasi aman hayati tanaman
transgenik kepada KKHKP. Atas saran TTKHKP, KKHKP merekomendasikan
arnan hayati terhadap taimnan transgenik yang diuji dalam ha1 ini kapas Bt
kepada Direktur Jendesal terkait.
Tanaman transgenik yang akan dilepas dan diedarkan di Indonesia harus
mendapatkan dua tipe surat keterangan aman, yaitu Iceamanan Hayati dain
Kearnanan Pangan uu~tuk tanaman transgenik yang ditumbuhkan di Indonesia d a i ~
digunakan sebagai bahan pangan dan pakan seperti jagung, kacang tanah, kedelai,
kentang, padi. Keamanan Hayati untuk tanaman transgenik yang ditumbuhkan,
tetapi bukan untuk bahar, pangan dan pakan seperti kapas. Tanaman transgenik
yang sudah mendap2tkan ketetapan keamanan hayati dantatau keamanan pangari
dapat dilakukan uji adaptasi di berbagai lokasi sebagai persyaratan pelepasarl
varietas. Kapas BI yang dilepas oleh pemerintah telah mendapatkan st- a t ~ ~ amarl
hayati dan melalui prosedur pelepasan varietas tanarnan.
Keluarnya SK Mentan No. 107lKPTSlKB 43 0121200 1 menandakan adanya
pelepasan terbatas tanaman kapas transgenik dalam usaha skala kornersial dii
Indonesia. Kerjasama bagi penelitian, monitoring dan pengujian pada tanaman,
kapas ini dari berbagai pihak hendaknya dikembangksm, sehingga apa dan
perusahaan sebazai produsen, akademisi, pemerintah akan tetapi dapat dipahmli
dan diterima oleh masyarakat sebagai konsumen.
Sehubungan dengan keperluan pemantauan dan pemanfaatan kapas Bt cli
Sulawesi Selatan, maka dalam rangka pendekatan kehati-hatian telah dikeluarkan
Keputusan Menteri Pertanian No: 3051KptslKp. 1 50151200 1 tentang pernbentukan
Tim Pengendalian Kapas Transgenik, tim ini terdiri dari unsur Menteri Negara
Lingkungan Hidup I Badan Pengendalian Dampak Lingkungan Pusait,
Departemen Pertanian, Pemerintah Daerah Propinsi Sulawesi Selatan, Tim Penila~i
dan Pelepas Varietas, Komisi Keamanan Mayati dan Keamanan Pangan.,
Kelompok Pakar 13ioteknologi, Lingkungan, Sosial Ekonomi dan Pemuliaan. Tim
ini bekerja dalam berbagai bidang, antara iain: Bidang Produksi dan
Pengembangan, Bidang Pengkajian yang terbagi menjadi 3 sub bidang yaitu Sub
Bidang Daya Hasil, Sub Bidang Analisis Risiko Lingkungan, Sub Bidang Sosial
Ekonomi dan Ridang Pemantauan clan Pengawasan (Herman, 2002 koniunikasi
pribadi).
Kajian analisis risiko lingkungan (ARL) bermanfaat untuk menetapkan
kemungkinan dan akibat yang sebenarnya terjadi dari pcnggunaavl tanaman
transgenik (Ammann, Jaot and A1 Mazyad, 2001). Regal (1994) mengajukan tiga~
kategori yang harus diuji dalam suatu kajian ARL pada tanarnan transgenik, yaitu.
1) kemungkinan dari tanaman transgenik bersifat invasive di lingkungan pertanian
(bersifat sebasai gulma), 2) kemungkinan terjadinya perpindahan gen secara
vertikal (vertical gene flow) melalui hibridisasi dengan tanaman sejenis atau
Pendapat Santosa (2001 b, komunikasi pribadi) mengenai kajian ARL yang
hendaknya dilakukan pada tanaman kapas transgenik Bt adalall 1) pengaruh kapa~s
transgenik terhadap ekologi tanah, 2) dampak perubahan fungsi metabolisme pada
komunitas mikroba, dan pengaruh yang mungkin terjadi pada hama sekunder,
3) persistensi rekoinbinan DbJA Bt dan degradasi protein Cry didalarn tanah,
4) kemungkinan tcrjadinya transfer gen horizontal gen ketahanan antibitotika ke
mikroba tanah, 5) kemungkinan terjadinya transfer gen cry dan ketahanarn
antibiotika ke tanaman bukan transgenik.
Sebagian lnasyarakat mengkhawatirkan adanya risiko keamanan hayati
dari penggunaan tanaman transgenik. Herman (2002, komunikasi pribadi)
mengelompokkan r i ~ i k o tersebut atas: 1) terjudinya pengaruh negatif terhadap
organisme bukan sasaran dan hewan ternak, 2) timbulnya gulma super, 3) tidak
stabilnya gen ketahanan dan terjadinya kepatahan ketahanan tanaman transgenik
terhadap hama sasaran sehingga timbul hama super yang kebal terhadap tanamarl
tersebut, 4) pembcntukan senyawa yang menimbulkan alergi atau keracunan bagl
manusia.
Gene fk)w dari tanaman transgenik merupakan perhatian utama dalam~
s
pengujian risiko I ingkungan (Ammann, Jaot, and A1 Mazyad, 200 1). Gene flow!
diartik,p sebagai pergerakan atau penyebaran dari gen (movement of genes)
(Mallet, 2001), penggabungan suatu gen ke dalam suaru gene pool dari sati~
populasi atau lebih (Eastham and Sweet, 2002). Terjadinya geneflow dipengaruhi
oleh keberhasilnn hibridisasi dan penyerbukan (pollination). sementara
seperti: jumlah serbuk sari yang dihasilkan oleh tanaman (transgenik), sebertpa
besar persentase tingkat penyerbukan yang dirniliki oleh suatu tanaman (apakah
bersifat menyerbuk sendiri atau menyerbuk silang), persentase dari tingkat
penyebaran serbuk sari (pollen dispersal), serangga yang melakukan penyerbukan
(insect pollinator), keadaan lingkungan (seperti: cuaca, lingkungan lokal,
halangan yang bersifat fisik), daya viabilitas dan sifat kompetitif dari serbuk sari,
serta sinkronisasi waktu penyerbukan antara matangnya serbuk sari dan stigma
yang bersamaan (Ammann, Jaot and A1 Mazyat, 2001; Eastham and Sweeit,
2002).
Secara alalni tanaman kapas bersifat seifpolination (menyerbuk sendiri)
dan hanya sekitar 2 % yang cross pollination (menyerbuk silang) dengan
perantara angin dan serangga, antara lain bumble hces dan honey bees (Canadian
Food Inspection LJecision Document, Decision Document No.96- 14, 1999). Gcnt?
flow melalui penyerbukan (pollination) merupakan peristiwa yang sangat alami
(CBI, 2001). Serbuk sari pada tanaman kapas berkarakteristik heavy and sticky
(sangat bany& dan lengket) dan penyerbukan silang terjadi pada batasan jarak:
yang terbatas pada sesama tanaman kapas (Canadian Food Inspection Decisior;,
Document, Decision Document No.96- 14, 1996). Faktor lain yang memungkinkan
perpindahan gen dapat terjadi selain hibridisasi dan penyerbukan adalah aclanya
kompabilitas seksi~al (sexual compability) antar tanaman (CBI, 2001).
Ammann, Jaot and A1 Mazyat (2001) melaporkan bahwa 12 dari 13
tanaman terpenting di dunia dapat berhibridisasi dengan spesies liarnya., seperti
Tabel 1. Hibridisasi tanaman dengan spesies liarnya (wild selativesj
(
Zea mays subsp liarI
Glycine gracilis TanamanGandurn Padi
I
BarlevI
Hordeum suontaneumI
Spesies Liar (wild relatives) ~riiicum turgidum subsp liar, beberapa~egiloPs sp Orvza s ~ e s i e s liar
Beberapa Brassicaea spesies liar Tidak ada l a ~ o r a n
Kapas Sorghum Millets Beans
Gossypium spesies liar ----
Sorghum spesies liar
Eleusine coracana subsp Africans, Pennisetum - spesies liar Phaseolus spesies liar
Kemungkinan terjadinya penyerbukan silang antara kal~as transgenilc
Bollgard dengan spesies liarnya khusus di Indonesia tidak nlungkin terjadi,
beberapa alasan antara lain, berbedanya jumlah ploidi dari kapas yang
dibudidayakan dengan spesies liar dan tidak samanya letak secara geografis dari
spesies kapas liar Gossypium tomentosum yang terdapat di Hawaii (lvfonsai~to,
2001). Kemungkinan terjadinya perpindahan gen ke tanarnan kapas budidaya
lainnya dalam lingkungan yang terdekat dapat terjadi dengan bantuan serangga Sunflower
Sugarcme
terutama lebah (Allis mellgera L) (Canadian Food Inspection Decision Document,
Decision Documetzt No.96- 14, 1 996; Monsanto, 200 1).
Terjadinya gcneflow dari kapas transgenik (cotton-Bt) telah teridentifikasi.,
di Australia didapatkan terjadinya tingkat gene flow pada t ~ h u n pertama sebesar
0,15 % pada plot ujl 1 meter dan 0,08 % pada plot uji 4 meter, sedangkan.
pengamatan pada tahun kedua ditemukan sebesar 0,4 % dan 0,03 Oh8 Helianthus annuus liar
Saccharum spesies liar -
[image:109.551.80.490.81.339.2]pengujian penyebaran serbuk sari kapas transgenik adalah dengan mengukur
besaran frekuensi yang terjadi dari gen marker nprII pada turunan pertama dan
kedua dari daerah penyangga (buffer rows zone) (Liewellyn ,and Fitt, 1996).
Hasil penclitian lainnya adalah ditemukipya gene $ow dari kapas
transgenik sampai 6 meter ke arez penyangga bahkan perpindahan gen jug,a
teridentifikasi salnpai pada jarak 36 meter dari plot kapas transgenik
4
(Shen er al., 2001). Jenis kapas transgenik yang digunakan dalanl penelitian ini
adalah kapas transgenik GK-12 yang mengandung gen cry dan gen marker nptl[I
serta kapas bukan transgenik CCRC 12 dan Xinmian 13 yang ditanarn
disekelilingnya dengan ukuran plot 6 x 6 meter. Pengujian plot pada skala kecil.
yang dilakukan oleh Liewellyn and Fitt, (1996); Shen et al (2001) menyar,znkan
perlunya terdapat zona penyangga (buffer rows zone) sejauh 20 meter dan
70 meter dari tana~nan kapas transgenik yang disesuaikan dengan keadaan
lingkungan masing-masing.
Keberadaan gen ketahanan antibiotika spektinomisin dan streptomysi:n
(aad) pada tanalnan kapas transgenik adalah sebagai hasil dari penggunaaniiya
sebagai gen marker (penanda) untuk menyeleksi bakteri Agrobacteriufiv2
tumefaciens transl'orman yang membawa plasmid gen fungsional dan gen ini
berada dibiiwah kontroi promotor prokariot Agrobacterium tumefaciens dan tidal<
diekspresikan pada tanaman kapas transgenik. Kapas transgenik juga mengandung *
gen penyandi antibiotika yang lain yaitu nptII (neomycin phospotransferase 11)
menyjandikan ketahanan terhadap neomisinlkanamisin dan berada dibawah kontrol
mengidentifikasi sel kapas yang mengandung gerl crylAc (Monsanto, 2001;
Robinson, 1949; IJSFDA, 1998).
Sekitar 90 % dari total 5.769 tanaman transgenik yang telah dilakukan
pengujian di Amcrika Serikat sejak tahun 1998 mengandung gen npt1I sebaga.i
penanda seleksi (Gay, 2001). Antibiotika yang terekspresikan pada kapas
transgenik Bollgard adal3h dari jenis neomisin dan kanamisin yang dikode ole'n
gen npfII (Monsanto, 2001).
Gen ketahanan antibiotika ini diisolasi dari bagian Tn5 bakteri Escherichia
coli yang menyandi kan aminoglycoside 3 '-phosphotransferase II (-4 PH(3 YII)
(O'Sullivan, 1990). APH(3')II mempunyai berat molekul 25.000 yang
mengkatalisis perpindahan grup fosfat dari adenosine 5'-fosfat (ATP) menj3d.i
grup hidroksil pada antibiotika golongan aminoglikosida, dimtaranya adalal~
neomisin, kanamisin, paromomisin, ribostamisin, gentamisin A and B, serta
butirosin (USFDA, 1998; O'Sullivan, 1990) dan diantara antibiotika tersebut yang
digunakan secara inedis bagi manusia dan hewan adalah neomisin dan kanamiscin
(U.S. Pharrnacopeia, 1990).
Proses Polvmerase Chain Reaction (PCR) merupakan elemen pokok dari
0
kajian gene flow dari gen ketahanan antibiotika (nptII) dan promotor CaMV 35s
pada tanaman kapns transgenik Bollgard ke kapas bukan transgenik. Metoda PCR
juga digunakan dalam analisa GMO (genetically modiJied organism) ole11
European Commission, Joint Research Centre, Institufe for Helrlth and Consumer
PCR merupakan tcknik amplifikasi DNA yang spesifik, proses ini dikembangkan
oleh Kary Mullis tahun 1985 (Glick and Pasternack, 1994).
Teknik amplifikasi DNA dilakukan dengan cara melakukan prose:s
pemanjangan nukleotida dari primer yang merupakan pasangan komplemeri da:ri
utas DNA tersebut dengan cara simultan. Proses pemanjangarl nukleotida
merupakan proses polimerasi yang dilakukan oleh DNA polimerase berdasarkan
utas cetakan, proscs ini terjadi akibat adanya primer (Glick and Pasternack, 1994;
Komponen-komponen yang dibutuhkan da.lam suatu proses PCR ada1a.h
1) DNA cetakan (template), sebagai bahan cetakan DNA, 2) Deoksinukleotida
(dNTP), sebagai bahan untuk penyusun polimer DNA, 3) Primer untuk memulsd
I
sintesis bag& yang spesifik, yang merupakan pasangan komplemen dari DNA
cetakan, 4) Dl\JA polimerase, sebagai sintesa DNA dengan adanya primer, *
5) Buffer (larutan penyangga), berguna untuk menyangga berlangsungnya proses
polimerase DNA (Glick and Pasternack, 1994).
Secara umum keefektifan amplifikasi dalam proses PCR tergar~tung pada
kualitas d m kemurniaan DNA. Kualitas DNA dipengaruhi oleh panjang
fragement DNA yang dihasilkan dan tingkat kerusakan DNA dari proses
ekstraksi, sementnra kemurniaan DNA dipengaruhi oleh terdapatnya berbagai
residu senyawa ki~nia hasil proses ekstraksi DNA yang dapat men.ghambat proses
DNA poliml;rase (Laura et al., 2001). Tingkat kualitas dan kemurniaan DNA yang
baik diperlukan sebelum melakukan proses arnplifikasi PCK untuk rnendeteksi
"Biomultiplikasi diartikan sebagai bioakumulasi atau tingkat ekpresi yang
tidak diharapkan dari protein tertentu (greater-than-expected expression of the
protein) yang yang terjadi secara alarni di lingkungan (SAP Report No. 99-06Pi,
2000): Federal Insecticide, Fungicide, and Rodenticide Act (F'IFRA) juga
. ,
meniandang perlu dilakukan kajian lingkungan mengenai kemungkinan terjadinya
biomultiplikasi ke lingkungan (SAP Report No. 99..06A,2000).
Kajian biomultiplikasi yang dilakukan pada penelitian ini adalah
mendeteksi multiplikasi sekuen gen target (Promotor CaMV 35s dan nptII)
dengap menggunakan metoda quuntitative competitive YCR (QC-PCR),
penggunaan metoda ini berdasarkan adanya hubungan antara jumlah kopi gein
dengan tingkat ekspresinya pada transforman (Gendloff, Bowen and Buchholz:,
1990). Metoda QC-PCR dapat menentukan korelasi antara konsentrasi DNA
target dengan jumlah PCR produk yang dihasilkan melalui anlpllifikasi (Laura
BAHAN DAN METODE
Tempat dan Waktu
Percobaan ini dilakukan di laboratorium molekular PT. Saraswanti
IndoGenetch, Bogor. Dimulai dari bulan November 2001 s m p a i dengan bu1a.n
Agustus 2,002.
Bahan Tanaman
Bahan percobaan yang digunakan adalah biji turunan pertama dari
tanaman kapas transgenik varietas Bollgard NuCOTN 35B dan bukan transgenik
(varietas Kanesia-7 dan Delta Paint). Biji tanaman kapas ini diperoleh dari lahan
pertanaman kapas bji multilokasi pengujian daya hasil di Kecamatan Bajeng
Kabupaten Gowa, Sulawesi Selatan. Sarnpel diambil pada panen pertama kapas
pada bulan Oktobcr 200 1.
Sarnpel biji tanaman kapas yang dianalisis adalah dari varietas Delta Paint
dan Kanesia-7, scmcntara varietas Bollgard NuCOTN 35B digunakan sebagai
kontrol yositif. Pengambilan biji dilakukan pada tanaman ketiga dari pinggir plot
dan kemudian dikomposit. Sebanyak 20 buah biji dari tiap-tiap plot dianalisis
dengan prioritas iitama terletak pada sampel biji kapas Dp 2.11 (Delta Paint),
pemilihan ini berdasarkan letak dari plot tersebut dikelilingi oleh plot pertanaman
kapas Bollgard dengan jarak satu meter, pengambilan sampel juga dilakukan pada
persiapan, penanaman dan pemeliharaan dari tanaman yang dianalisa dam
dilaporkan dalam penelitian ini tidak didisain khusus untuk penelitian ini. Densth
pengarnbilan sampel dapat dilihat pada Lampiran 1.
Sekuen DNA Kapas Transgenik dan Disain Primer.
Sebelurn nlenentukan disain primer yang akan digunakan, terlebih dahulu
harus mendapatkan sekuen dari fragmen DNA yang akan dianalisis. lClasifikasi
fragment DNA yang umum terdapat dalam setiap tanaman transgenik adalah
prornotor, terminator, gen reporter, gen seleksi, dan gen fungsional. Untuk
fragment DNA dari promotor, terminator, gen reporter dan gen seleksi, sekuennya
dapat diakses rnelalui website dari GenBank.
Untuk mendapatkan sekuen dari gen fungsional dari tanaman transgenik,
ada beberapa ha1 yang harus diketahui yaitu : 1) jenis tanman transgenik yang
telah disetujui untuh. dikomersialisasikan, 2) perusahaan yang memproduksi,
3) gen fungsional yang digunakan dan 4) sumber dari gel1 fungsional tersebut
(Tao et al., 2001). Semua data diatas dapat diakses website dari IJnited States qf
Food bnd Drug A~lrninistrasion (USFDA) (htt~://cfsan.fda.eov/-Ird/~con.htmli)
dan yang berhubungan dengan paten dapat diakses website United States Patent
and Trademark Office (USPTO) pada (htt~://www.uspto.gov/patft/), pada situs ini
didapatkan sekuen dari gen-gen yang dimaksud.
Untuk ine~ldisain primer, digunakan software Primer3 dari Whitehead
Institute for Biomcdical Kesearch (Nielsen, 2002 komunikasi pribadi) pada situ!:
beberapa persyaratan yang harus diikutsertakan dalam penibuatan primer iai,
antara lain adalah : 1 ) ukuran produk yang akan diharapkan, 2) CG clamp, 3)
ukuran maksimu~n, minimum dan optimum dari primer, 4) suhu melting,
5) persei~tase kandungan baca G dan C, 6) batasan dari konsentrasi garam
terhadap primer serta 7) maksimum komplemensitas antara primer dengan
template.
Ekstraksi clan Isolasi DNA Genom Total dari Biji Kapas
Kegiatan ekstraksi dan isolasi DNA total tanaman dilakukan mengisolasi
DNA dari biji kapas, beberapa modifikasi metoda yang digunakan antara lain:
1. Metoda JAodifikasi CTAB.
Metoda C1'AB (Marcus et al., 1999) yang telah dimodifikasi untuk sampe:l
berukuran kEcil, sebagai berikut: biji digerus hingga berbentuk tepung dan
diletakkan ke tabung eppendorf 1,5 ml. Larutan ekstraksi CTAR 2X {CTAB ( w ~ v )
2%, 100 mM Tris-HC1 (pH 8,0), 20 mM EDTA, 1,4 M hTaCl, 2-mercaptoethanol
2 %) sebariyak 400 pl ditambahkan ke dalam tabung tersebut. Teyung da11
carnpuran larutan diinkubasikan selama 30 menit pada suhu 65' C dan
ditarnbahkan 500 p1 chloroform. Tahap selanjutnya adalah sentrifugasi campuraii
tersebut selama 10 menit dengan kecepatan 13.000 g. Lapisan teratas kemudian
dipindahkan ketabung baru. Larutan CTAB 1X f CTAB (wfv) 196, 50 mM Tris-
HCI (pH 8,0), 10 mM EDTA, 2-mercaptoethanol 2 %) sebanyak 300 pl
saat. Larutan diinkubasikan antara 40-60 menit, disentrifus 13.000 g selama 15
menit, kemudian supernatan dibuang.
Proses presipitasi dilakukan dengan ditarnbahkannya 1,25 M NaCl
sebanyak 120 pi clan dibiarkan sekitar 1 menit, lanitan chloroform ditambahkan
untuk kemudian disentrifius selama 10 menit, 13.000 g, supernatan dipindahkan
ke tabung ban1 dan 0.6 volume isopropanol ditambahkan, larutan diinkubasikan
selama 30 menit, dan setelah itu disentrifius selama 10 menit dengan kecepatan
13.000 g, pelet yang diperoleh kemudian dicuci dengan ethanol 70 % dan
dikeringkan; DNA dilarutkan dalam 40 pl TE.
2. Metoda biii kering
Metoda isolasi DNA genom total dari biji kering ini diperoleh dari Kang
et al., 1998). Yrosedur tersebut adalah sebagai berikut: kulit biji dibuang dan biji
dimasukkan ke'dalam tabung eppendorf 1,5 mL. Bufer ekstraksi (200 mM Tris-
HCI, pH 8,0,200 1nM NaC1, 25 mM EDTA dan 0,5 % SDS) yang mengandung
proteinase K (50 pg) sebanyak 400 p1 ditambahkan ke dalam tabung tersebui.
Larutan diinkubasi selama 1 jam pada suhu 37
'c.
Larutan CTAB {2 % CTAB(wlv), 100 mM 'I'ris-HC1 pH 8,0, 20 mM EDTA pH 8,0, 1.4 b4 NaC1, 1 %
Polyvinilpyrolidone) sebanyak 400 p1 ditambahkan ke dadam tabung tersebut.
Tahap selanjutnya, 300 pl kloroform: Isoamilalkohol (24:l) dengan 5 % phenol1
ditambahkan ke dalarn tabung yang selanjutnya disentrifugasi pada kecepatan
1 1.700 g pada suhu 4' C, 10 menit. Supernatan kemudian dipindahkan ke tabung *
selanjutnya disentrifus de'ngan kecepatan 11.700 g selama 5 menit. Supernatan
kemudian dibuang dan pelet yang terbentuk dicuci dengan ethanol 70 %. Pelet
DNA dikeringanginkan beberapa saat dan diresuspensi pada buffer TE sebanyak
3. Protokol C Gerus
Metoda ini nlerupakan modifikasi dari metoda Karig ('1 a1.,(1998) dan
Santosa (2001~). I'rosedur tersebut adalah sebagai berikut: kulit biji dibuang dan
biji digerus, selanjutnya tepung biji dimasukkan ke dalam tabung eppendorf
1,5 ml. 400 pZ buler skstraksi (200 mM Tris-HC1, pH 8.0,200 mM NaC1,25 mbA
EDTA dan 0.5 % SDS) yang mengandung proteinase K (50 pg) dan diirlkubasi
selama 1 jam pada suhu 37 OC dan untuk prosedur berikutnya sama dengan
aktifitas nomor 2 metoda biji kering diatas sampai diperoleh crude DNA, cnrd'e
DNA ditambahkan dengan 300 p1 larutan DAS-TIZ dan diinkubasikan pada suhu
ruang selama 5 nlenit. Larutan disentrifugasi pada kecepatan 15.000 g selama
10 menit pada suhu 4' C. Tahap selanjutnya sebanyak 500 p1 phenol dan 500 pll
chloroform: isoam ylalkohol (24: 1) ditambahkan ke dalanl tabung untuk ekstraksi
DNA, selanjutnya larutan disentrifugasi. Supernatan (+ 250 p1) dipindahkan dan d
400 pl isopropanol ditambalzkan ke dalanl tabung baru. Tahap selanjutnya adalalh
sentrifugasi selama 10 menit dengan kecepatan 1 1.700 g. DNA murni kemudian
4. Pratokol C Tanpa Gerus
Metoda ini merupakan pengembangan dari ke-3 nietoda yang aipaparksn
diatas. Prosedur tersebut adalah sebagai berikut: kulit bi.ji dibuang dan biji
dimasukkan kedclam tabung eppendorf 1,5 ml dan ditambahkan 400 pl bufer
eksttaksi (200 mM l'ris-HCl, pH 8,0, 200 mM NaC1, 25 mM EDTA dan 0.5 96
SDS) yang rnengandung proteinase-K (50 pg) dan diinkubasi selama 1 jam yada
suhu 37 OC, untuk aktifitas berikutnya sama dengan prosedur nomor 3 prosedur C
gems.
Larutan DNA hasil isolasi diukur dengan spektofc~tometer pada panjang
1
gelombang 260 nnl dan 280 m. untuk mengetahui kualitas DNA hasil isolasi yang
diperoleh. Proses PCR ini dilakukan dengan menggunakan beberapa set primer
spesifik yang mengenali fragmen-fragmen dari konstruksi DNA kapas transgenik.
Hal ini dilakukan karena pada awalnya tidak diperolehnya informasi mengenai
konstruksi rDNA Bt yang terdapat pada kapas transgenik varietas Bollgard yang
ditanam di Sulawesi &latan, sehingga diperlukan beberapa primer untuk
melacaknya.
l'endeteksian Gene FIow dari Gen nptII clan
Promotor CaMV 35s Melalui PCR
Dua pasang primer digwakan untuk mendeteksi fragmen dari genl
ptnyandi penanda antibiotika (nptII) dan promotor CaMV
35s
yang terdapat:dalam DNA kapas transgenik. Primer-primer ini didisain oleh Invitrogen dengan
,
26
diperoleh selariiutnya diamplifikasi dengan primer-primer dari konstruksi geri
chimera kapas Bollgard dengan prosedur: 100 ng DNA template, primer:
0.12 pM (fctrwarci dan reverse), campuran PCR-kit (Master Rache) (25 U Taq
DNA Pbl, 100
mM
KC1, 3 mM MgC12, dNTP (0.4 mhl)}, dHzO. Proseduramplifikasi dua primer tersebut adalah sebagai berikut:
1 . Primer CaMV 3 5 S
Primer CaMV 355: digunakan untuk mendeteksi fragmen promotor CaMV
35s. Prosedur yang dilakukan adalah sebagai berikut: 3 menit denaturasi pada
suhu 95' C dan 35 kali siklus yang terdiri dari 1 menit denatrlrasi pada suhlu
95' C, annealing selama*30 detik pada suhu 57' C untuk primer 35s-A dan 30
detik pada suhu 55' C untuk primer 35s-B, 45 detik extension pada suhu 72' C
dan 3 menit pada suhu 72' C untuk last extension.
2) Primer CRY.
Primer CRY digunakan untuk mendeteksi fragmen gen fungsional dari cry
1Ac. Prosedur yang dilakukan adalah sebagai berikut: 5 rnenit deniiturasi pada
suhu 95' C dan 42 kali siklus yang terdiri dari 40 detik denaturasi pada suhu
95' C, 45 detik a,znraling pada suhu 55' C, 30 detik extension pada suhu 72' C
dan 3 menit pada suhu 72' C untuk last extension.
3. Primer NPT
Primer ini digunakan untuk mendeteksi keberadaan dari gen nptII.
95' C dan 37 kali siklus yang terdiri dari 1 menit denaturasi pada suhu 95' C:,
annealing pada suhu 55' C selama 30 detik pada suhu 50' C selama 40 detik
untuk primer TN 5, dan suhu 60' C untuk primer NPT, selardutnya 30 detik
extention pada suhu 72' C dan 3 menit untuk last extension pada suhu 72' C.
Petideteksian Multiplikasi Melalui Densitometer
Pendeteksian terjadinya multiplikasi atau peningkatan jumlah kopi dari
gen nptII dan prolnotor CaMV 35s dilakukan dengan metoda quantitive
competitive (Alkami, 1999) yang telah dimodifikasi sesuai dengan percobaan in^^.
Prosedur yang dilakukan adalah sebagai berikut: dilakukan pengukurmn
konsentrasi (pglpl) DNA marker yang terdapat di gel agarose dan konsentrasi inli
digunakan sebagai standar pengukuran dilakukan dengan meinyergunakain
densitometer. Kegiatan dilanjutkan dengan mengukur konsentrasi produk F'CR
(pglpl) dari fragmen nptII, CaMV 35s dan crylAc. Hasil yang diperolell
kemudian dikonversikan dengan standar dari inarker tadi. Hasil konversi
merupakan nilai estimasi dari produk PCR. Keselunlhan prosedur ini
HASIL DAN PEMBAHASAN
Sekuen DNA Kapas Transgenik dan Disain Prinaer
Secara umum sekuen-sekuen DNA yang terdapat didalam suatu genoin
tanarnan transgenik dikelompokkan atas promotor, terminator, penanda seleksi
dan fragment gen fungsional itu sendiri. Spkuen-sekuen yang digunakan dalain
percobaan in ditampilkan pada tabel berikut ini :
Tabel 2. ~ e k l e n d m ciri dari primer-primer CaMV 3 5 s d m nptII
Fragmen DNA " Sekuen (5-3) Ukuran produk (bp) Tm
('c)
Asal sekueri Kode akses Acuan Promotor CaMV 35s (35s-B) gctcctacaaatgcca tca 195 60 Promotor CaMV35 S (3 5s-A)
gccatcattgcgataaag gaaaggc -
212
62 ,
Cauliflower mosaic virus
PROTEC'I'ION OF PLANT FROM VIRUS
INFECTION Patent: JP 1987201 527-A 3 05-SEP- 1987 ;
MONSANTO C0,WASI IINGTO N UNIV E01311 (GenBank) --
Gen Marker Gen Marker nptII (NPT) n tI1 (TN 5)
atgactgggcacaa gcatc:tcctgtcatlir cagacaatcgg 289 70.25 Cloning vector pBI101.2. GUS gene fusion vector pBI 10 1.2 T-DNA region
-- 5 9
--- -
--
-- European
Commision GMOs in Food and Environment (2002), Hemmer, (1 997)
- -
European Commision GMOs in Food and En~~ironment (2002), Hemmer, (1 997)
Pendeteksian sekuen DNA transgenik yang terdapat pada kapas Bollgard
NuCOTN 35 B yang ditanam di Sulawesi Selatan dimulai dengan mengakses situs
publik dari United States Food and Drug Administration (USFDA.)
(http://vni.cfsan.ft'a.~~ov/-lrd/biocon.html/), pada situs tersehut ditemukan bahwa
tanaman kapas jenis Bollgard terdaftar dengan nomor registrasi BNF No. 13,
Submitted November, 21, 1994 oleh perusahaan Monsanto, Co.
Tabel 3. Kapas Bollgard dan karakteristiknya berdasarkan USFDA
1
Daftar Lengkap Berdasarkan Nomor Pencatatan1
(Environmental Protection Agency).
(BNF / Biotechnology NotiJication File No.)
Nomor paten dari kapas Bollgard dapat diperoleh dari dari situs publik;
dari badan paten Anlerika Serikat (United States Patent and Trademark Ofice
pada ( & : / / w w w . u s ~ ~ t o . ~ v / s a f t ~ , pada situs ini didapatkan bahwa namor paten
dari kapas jenis Bollgard adalah 5.322.938 dan juga diperoleh sekuen dari gen
cry1 Ac.
Jenis Gen, Gel1 Tujuan Produk,
atau Fraemen Gen
makart'an ternak dan manusia
-
~ a ~ a s - Protein Bacillus Ketahanan 531FDI:
BNF No. 13, disampaikan 21 November 1994 oleh Monsanro, penggunaan untuk Sumber Gen Jenis
Cry 1 Ac
Surat Persetujuan
--
[image:123.551.73.491.203.755.2]Informasi ~nengenai kapas Bollgard juga diperoleh dari laporan BLAS'T
(Biosicherheitsfor.schur2g und Abschatzung son Technologen des Scwerpunkt
Programmes Biotechnologie), Hemmer (1 997) melalui situs www.bats.ch, sepenti *
yang tercantum pada tabel berikut ini.
Tabel 4.' Kapas Bollgard dan karakteristiknya berdasarkan RLAST
L = lepidoptera
Untuk pelacakm sekuen dari promotor CaMV 35Sdan gen penanda
(nptII) yang terdapat pada tanaman kapas jenis Bollgard, sekuennya dapat diakses Keterangan : IR = Insectisidal resistance
Gen Introduksi
l)altered, sy~thetic 1Ac delta- cty
endotoxin
2) nptIl
3) aad
Produk
Kapas
melalui website dari GenBank-NCBI (Nutional Center for Biotechnol~gy Tujuan
I R ( L ) Produsen
BollgardB Monsanto
Information). Ditemukan sekitar 7 (tujuh) buah sekuen, ha1 ini disebabkan karena Prornotor
1)e-P-35s
2 ) P-35s
3) bacterial Sumber 1)Btssp. (HD-73)) kurstaki 2) Tn5
3) Tn7
sekuen (promotor 35s dan nptII) telah digunakan secara urnum pada tsnamari Terminator Tanggal
Pellgesahan
1 ) 7 S 3 '
r.
USDA: 3/95EPA:
FDA:
-7
51/95 11 01942) nos 3'
3)bacterial
transgenik, ha1 yang sama diungkapkan oleh Tao et al., (2001).
Dari tujuh buah sekuen yang diperoleh, sekuen promotor CaM'V
35 Sdiperoleh dari c~~ulijlower mosaic virus, strain CM4- 184, clone pOS- 1 clone
dengan nomor akses GenBank: E0 13 1 1, pemilihan ini didasarkan atas perusahaar~
yang menghasilknn tanaman kapas jenis Bollgard tersebut. Sekuon dari nptIl
dipilih karena dari beberapa sekuen untuk gen nptII yang diperoleh dari GenBanl,,
kesemuanya menunjukkan urutan sekuen DNA yang sama, wi~lau terletak pada
vektor kloning yang berbeda dan juga ditunjukkar~ oleh asal dari gen nptIl itu
sendiri yang berasal dari gen tn 5.
Untuk mendisain primer, digunakan software Primer3 dari Whitehead
Institute for Biomedical Research (Nielsen, 2002, komunikasi pribadi) pada siti1.s
http:/lwww-genonle.\vi.mit.edul~enome software/otherl~ri111er3. htn.11. Terdapsit
-
beberapa persyaratan yang hams diikutsertakan dalam pembuatan primer ini,
antara lain adalah : 1 ) ukuran produk yang akan diharapkan: 100- 300 bp, 2) C(3
clamp adalah: 2 bp, 3) ukuran maksimum, minimum dan optimum dari primer
adalah: 25 I 18 120 bp, 4) suhu melting ( ~ m ' C) adalah: 60
-
70, 5) persentasekandungan baca G dan C : 55 %
,
6) batasan dari konsentrasi gafim terhadalpprimer adalah: 50 %. Hasil pembuatan primer terhadap sekuen dapat dilihat pad,a
tabel berikut ini.
Tabel 5. Karakteristi k sekuen DNA transgenik dan komplemensitas dengan primer
A. Sekuen not-II.
I
Organisme
I
CJonine vector oBIl 01.2I
LocusSumber
I
phosphotransferase; beta-glucuronidase-
J
PBIlOl2T 5351 bp DNA linear, 1 6 - ~ ~ ~ - 1 9 9 7--
Karakteristik : Location / Qualifiers
Surnber : 1 ..5351 lorganism="Cloning vector pBI101.2" /plasmid="pBI101.2"
/db_xref="taxon:36567"
/note="sequence from the right border to the left border"
1 ..2498 /note="pBinl9 sequence, containing a neomycin phosphotransferase gene driven by nos promoter" 1 ..25 /note="the right border repeat"
386.. 1 180 /codon-start=l /trans1
-
table=u/product="neomycin phosphotransferase" 2498..2538 /note="polylinker"
255 3. .436 1 /note="modified beta-glucuronidase gene coding region fiom pRAJ260"
/codon-start= 1 /trans1 table=u
/produ~t="beta-glucuronidase"
I 4432..4684 /note="3'UTR of the nopaline synthase gene" 4688..5351 /note="pBinl9sequence"
5327..5351 /note="the left border repeat"
atgattgaacaagatggattgcacgcaggttctccggccgcttgggtggagaggctattcggc~t~~~
~~cacaaca~acacxtc~~ctgctctgatgccgccgtgttccggctgtcagcgcaggggcgcccggttctttttgtcaagaccgacctgtccggtgccctgaatgaactgcaggacgaggc,zgcgcggcta
tcgtggctggccac~:acgggcgttccttgcgcagctgtgctcgacgttgtcactgaagcgggaaggg
actggctgctattgggcgaagtgccggggcaggatctcct~tcatctcaccttgctcct~cc~agu~~
a~atccatcat~ctgatgcaatgcggcggctgcatacgcttgatccggctacctgcccattcgacc
accaagcgaaacatcgcatcgagcgagcacgtactcggatggaagccggtcttgtc~atcae~a~
a
tctggacgaagagcatcaggggctcgcgccagccgaactgttcgccaggctcaaggcgcgc:at@;
-
cccgacggcgaggatctcgtcgtgacccatggcgatgcctgcttgccgaatatcatggtggaaaatg
gccgcttttctggattcatcgactgtggccggctgggtgtggcggaccgctatcaggacatagcgttg
gctacccgtgatattgctgaagrgcttggcggcgaatgggnnnnctgaccgcttcctcgtgc~ac@,
Keterangan :
Cetak tebal : komplemen primer dengan sekuen dari primer TN 5 , 173 bp Cetak miring : komplemen primer dengan sekuen dari primer NP'I', 289 bp
332 bp DNA linear PAT 29-SEP- 1997 Sumber clruliflower mosaic virus.
Nomor Akses
I
E0 1 3 1 1 ---A- ---3
Karakteristik : Loccition/Qualij?ers
Sumber : 1 ..332 /organism="Cauliflower mosaic virus"
/db
-
xref="taxon: 1064 1 " --1
Versi Keterangan Kata Kunci .
Keterangan :
Cetak tebal : kompleinen primer dengan sekuen dari primer 35s-By ukuran produk 195 pasang basa
Cetak miring : komplemen primer dengan sekuen dari primer 35s-A, ukuran produk 2 12 pasang basa
E01311.1 GI:2169570
~ruliflower mosaic virus promoter (Promotor ---- C ~ % V 35s ).
JP 198720 1527-A/3.
---
, Ekstralcsi