GAMBARAN DARAH MERAH DOMBA BUNTING YANG
DIBERIKAN SUPEROVULASI DAN PENYUNTIKAN HUMAN
CHORIONIC GONADOTROPIN
(hCG) PADA HARI KE-6
SETELAH PERKAWINAN
MITA TUMIATI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Gambaran Darah Merah Domba Bunting yang Diberikan Superovulasi dan Penyuntikan Human Chorionic Gonadotropin (hCG) pada Hari ke-6 setelah Perkawinan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2013
Mita Tumiati
ABSTRAK
MITA TUMIATI. Gambaran Darah Merah Domba Bunting yang Diberikan Superovulasi dan Penyuntikan Human Chorionic Gonadotropin (hCG) pada Hari ke-6 setelah Perkawinan. Dibimbing oleh ANDRIYANTO dan WASMEN MANALU.
Superovulasi merupakan salah satu teknologi reproduksi yang digunakan untuk meningkatkan produktivitas domba. Domba yang disuperovulasi memiliki kondisi yang berbeda dari domba yang tidak disuperovulasi. Penelitian ini dilakukan untuk melihat gambaran darah merah domba bunting yang diberikan superovulasi dan penyuntikan human chorionic gonadotropin (hCG) pada hari ke-6 setelah perkawinan. Sebanyak dua belas ekor domba yang sudah dewasa kelamin, dengan bobot badan sekitar 18-25 kg yang dibagi ke dalam 4 kelompok perlakuan. Kelompok perlakuan pertama tidak disuperovulasi (kontrol), kelompok kedua disuperovulasi dengan penyuntikan PMSG dan hCG (SO1), yang ketiga disuntik dengan hCG sebelum kawin (SO2), dan keempat disuntik dengan PMSG dan hCG sebelum kawin diikuti dengan penyuntikan hCG 6 hari pascakawin (S012). Sinkronisasi estrus dilakukan dengan menyuntikkan 5-15 mg PGF2α pada masing-masing domba betina. Parameter yang diamati dalam penelitian ini adalah jumlah total sel darah merah, nilai hematokrit (PCV), dan kadar hemoglobin. Hasil penelitian yang diperoleh menunjukan bahwa kelompok perlakuan SO12 memiliki nilai rata-rata sel darah merah, hemoglobin, dan hematokrit lebih tinggi daripada kontrol. Berdasarkan hasil tersebut dapat disimpulkan bahwa superovulasi dan ditambahkan penyuntikan hCG pada hari ke-6 setelah perkawinan (S012) menyebabkan peningkatan metabolisme tubuh induk domba yang digambarkan dari peningkatan jumlah sel darah merah, kadar hemoglobin, dan nilai hematokrit (SO12).
ABSTRACT
MITA TUMIATI. Erythrocyte Parameters of Pregnant Ewes that had a Superovulated and Injected Human Chorionic Gonadotrophin on Day-6 after Mating. Supervised by ANDRIYANTO and WASMEN MANALU.
Superovulation is one of the reproduction technology used to increase the productivity of ewes. Physiological conditions of superovulated ewes are different from those of nonsuperovulated ewes. This research was conducted to observe the red blood cell (RBC) profiles of pregnant ewes superovulated and injected with hCG on the 6th day after mating. Twelf matures ewes weighing from 18-25 kg were dividied into 4 groups. The first group was not superovulated (control), the second group was superovulated before mating (SO1), the third group was
injected with hCG 6 days after mating (SO2), and the fourth group was injected
with PMSG and hCG before mating followed by injection of hCG 6 days post mating (S012). Estrus synchronization was done by injecting 5-15 mg of PGF2α
with 11 days interval. The parameters measured were the total number of red blood cell, hematocrit value, and the hemoglobin concentration. The results obtained showed that the SO12 treatment group had higher red blood cells,
hemoglobin, and hematocrit as compared to control. Based on these results it can be concluded that superovulation and added injected hCG on day-6 after mating (S012)increased red blood cell count, hemoglobin level, and hematocrit values to
support maternal metabolism due to the increased fetal number and growth.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
GAMBARAN DARAH MERAH DOMBA BUNTING YANG
DIBERIKAN SUPEROVULASI DAN PENYUNTIKAN HUMAN
CHORIONIC GONADOTROPIN
(hCG) PADA HARI KE-6
SETELAH PERKAWINAN
MITA TUMIATI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Gambaran Darah Merah Domba Bunting yang Diberikan Superovulasi dan Penyuntikan Human Chorionic Gonadotropin
(hCG) pada Hari ke-6 setelah Perkawinan. Nama : Mita Tumiati
NIM : B04080202
Disetujui oleh
drh Andriyanto, MSi Pembimbing I
Prof Dr Ir Wasmen Manalu Pembimbing II
Diketahui oleh
drh Agus Setiyono, MS, Ph.D, APVet Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji syukur penulis panjatkan kehadirat Tuhan yang Maha Esa, atas rahmat dan karunia-Nya sehingga skripsi ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Mei sampai Oktober 2011 ini ialah Gambaran Darah Merah Domba Bunting yang Diberikan Superovulasi dan Penyuntikan Human Chorionic Gonadotropin (hCG) pada Hari ke-6 setelah Perkawinan.
Terima kasih penulis ucapkan kepada Bapak drh Andriyanto, MSi dan Bapak Prof Dr Ir Wasmen Manalu selaku pembimbing. Di samping itu, penghargaan penulis sampaikan kepada semua dosen dan staf Laboratorium Fisiologi, Departemen Anatomi, Fisiologi, dan Farmakologi (AFF) FKH IPB yang telah membantu selama pelaksanaan penelitian ini. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas doa dan dukungannya.
Semoga skripsi ini bermanfaat bagi penulis, pembaca, dan semua pihak yang berkepentingan.
Bogor, Juli 2013
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN ix
PENDAHULUAN 1
TINJAUAN PUSTAKA 2
Domba 2
Superovulasi 2
Darah 3
Sel Darah Merah 4
Hemoglobin 4
Hematokrit 5
METODE 6
Waktu dan Tempat Penelitian 6
Alat 6
Bahan 6
Tahap Persiapan 6
Hewan Percobaan 6
Aklimatisasi Domba 6
Kandang, Pakan, dan Minum 6
Tahap Pelaksanaan 7
Rancangan Percobaan 7
Superovulasi 7
Pengambilan Sampel 7
Pemeriksaan Sampel 8
Variabel yang Diamati 8
Analisi Data 8
HASIL DAN PEMBAHASAN 9
Sel Darah Merah 9
Hemoglobin 10
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 13
DAFTAR PUSTAKA 13
LAMPIRAN 16
DAFTAR TABEL
1 Rancangan kelompok perlakuan 7
2 Rata-rata dan standar deviasi jumlah sel darah merah (106/mm3) 9 3 Rata-rata dan standar deviasi hemoglobin (gram %) 10 4 Rata-rata dan standar deviasi nilai hematokrit (%) 12
DAFTAR GAMBAR
1 Domba lokal atau Ovis aries (Anonim 2013) 2
2 Bentuk sel darah merah (Mahmood dan Mansor 2012) 4
DAFTAR LAMPIRAN
PENDAHULUAN
Daging merupakan sumber protein hewani yang dibutuhkan tubuh untuk memenuhi kebutuhan gizi. Permintaan daging akan terus meningkat seiring dengan peningkatan jumlah penduduk dan pertumbuhan ekonomi masyarakat. Daging ternak yang cukup diminati masyarakat salah satunya adalah daging domba. Daging domba memiliki jumlah permintaan yang cukup tinggi namun masih mengalami keterbatasan pada tingkat produksinya. Hal ini disebabkan karena tingkat populasi ternak yang tidak menentu setiap tahun. Menurut Direktorat Jenderal Peternakan (2013), populasi ternak domba di Indonesia tahun 2012 mencapai 11790.61 ribu ekor, produksi dagingnya sebesar 46.79 ribu ton, sampai 2013 mencapai 13420.44 ribu ekor (angka sementara) dan produksi dagingnya sebesar 44.4 ribu ton. Pertumbuhan populasi ternak tahun 2013 terhadap 2012 sebesar 12.14% dan produksi dagingnya sebesar 5.49%. Angka tersebut masih dikhawatirkan apabila tidak mengalami peningkatan yang sebanding dengan peningkatan jumlah penduduk di Indonesia setiap tahunnya.
Ternak domba merupakan salah satu sumber protein hewani yang tidak kalah saingnya dengan ternak ruminansia lain. Domba, baik jenis lokal maupun bukan lokal merupakan sumber plasma nutfah yang memiliki potensi untuk dikembangkan. Domba memiliki kemampuan melahirkan anak kembar tiga atau lebih. (Sumaryadi 1997; Sutama et al. 1999; Andriyanto dan Manalu 2011). Anak yang dilahirkan kembar memiliki peluang mortalitas tinggi dan bobot badan kecil. Hal ini disebabkan karena tingginya persaingan dalam memperoleh nutrisi dari tubuh induk (Subandrio et al. 1998).
Salah satu metode yang dilakukan untuk meningkatkan angka kelahiran dan menekan angka kematian adalah dengan teknik superovulasi. Superovulasi merupakan metode dengan penyuntikan hormon pregnant mare serum gonadotropin (PMSG) dan human chorionic gonadotropin (hCG) yang berpotensi dalam menstimulasi fungsi ovarium untuk meransang pertumbuhan folikel dan meningkatkan jumlah korpus luteum. Metode superovulasi ini meransang sekresi hormon kebuntingan (estradiol dan progesteron) yang berperan penting dalam proses reproduksi (Adriani et al. 2009).
Penelitian ini dirancang untuk meningkatkan kualitas kebuntingan pada induk domba melalui metode superovulasi yang pengaruhnya dapat dilihat pada gambaran butir darah merah, hemoglobin, dan hematokrit.
2
TINJAUAN PUSTAKA
Domba
Domba merupakan hewan ruminansia kecil yang telah didomestikasi sebagai ternak. Sejarah domba diturunkan dari 3 jenis domba liar, yaitu Mouflon
(Ovis musimon) yang berasal dari Eropa Selatan dan Asia Kecil, Argali (Ovis amon) berasal dari Asia Tenggara, dan Urial (Ovis vignei) yang berasal dari Asia. Domba memiliki nama ilmiah ovis aries. Domba diklasifikasikan ke dalam kingdom animalia, filum chordata, kelas mamalia, ordo artiodactyla, dan masuk ke dalam famili bovidae, genus ovis, serta spesiesnya aries. Di Indonesia, khususnya di Jawa, ada 2 bangsa domba yang terkenal, yakni domba ekor gemuk yang banyak terdapat di daerah Jawa Tengah dan Jawa Timur dan domba ekor tipis yang banyak terdapat di Jawa Barat. Gambar domba dapat dilihat pada gambar 1.
Gambar 1 Domba lokal atau Ovis aries (sumber: Anonim 2013)
Domba memiliki rambut tebal dan dipelihara untuk dimanfaatkan rambut (wol), daging, dan susunya (Hafes 2000). Menurut Smith dan Mangkoewidjojo (1988), dalam aplikasi penelitian, domba biasanya digunakan sebagai sumber sel darah merah untuk memproduksi antibodi dan dapat diperoleh serum dalam jumlah yang besar. Domba dapat pula digunakan dalam percobaan dasar, seperti percobaan fisiologi, farmakologi, percobaan bedah eksperimental, dan penelitian anestesi.
Superovulasi
Superovulasi merupakan salah satu metode pengembangan ternak dengan memanfaatkan preparat hormon gonadotropin. Hormon ini akan meransang pertumbuhan folikel yang lebih banyak dan meningkatkan jumlah korpus luteum. Keberhasilan teknik superovulasi bergantung pada beberapa faktor, seperti kondisi hewan betina yang digunakan, preparat hormon yang dipakai, prosedur pelaksanaan, serta dosis pemberian hormon. Kondisi hewan betina yang dipilih haruslah sehat secara fisik dan sudah dewasa kelamin sehingga setelah disuperovulasi dengan preparat hormon dapat memberi respons yang diharapkan. Hormon gonadotropin yang sering digunakan pada teknik superovulasi adalah
3
(PMSG). Kedua hormon ini sama-sama memiliki respons yang sangat baik, namun memiliki waktu paruh yang berbeda. Superovulasi dengan FSH dapat meransang jumlah folikel yang berkembang hingga fase folikel de graaf. Hormon FSH memiliki waktu paruh (half life) yang pendek, yaitu sekitar 2 jam - 5 jam sehingga perlu pemberian dosis berulang untuk merangsang aktivitas folikel secara efisien (Kaiin dan Tappa 2006).
PMSG merupakan hormon gonadotropin eksogen yang memiliki potensi biologik tinggi dalam merangsang fungsi ovarium untuk menghasilkan folikel dan
corpus luteum (CL). Pemberian PMSG untuk superovulasi akan memberikan respons yang bervariasi pada ternak. Superovulasi dengan PMSG dapat diberikan pada akhir fase luteal siklus berahi (hari ke-12 atau ke-13). Selain itu, hormon ini dapat juga diberikan setelah pemberian progesteron yang digunakan untuk sinkronisasi estrus. Dalam molekul PMSG terdapat kandungan asam salisilat yang tinggi menyebabkan waktu paruh (half life) hormon PMSG lebih panjang sehingga dapat menimbulkan beberapa efek negatif, seperti gangguan keseimbangan hormonal, gangguan fertilisasi, dan gangguan transportasi embrio dari tuba fallopii menuju uterus (Siregar et al. 2012). Efek negatif hormon PMSG dapat diatasi dengan pemberian antibodi monoklonal (MoAb) antiPMSG yang bekerja menghilangkan residu PMSG yang masih berfungsi sehingga angka ovulasi dan hasil panen embrio dapat ditingkatkan (Supriatna et al. 1998).
Hormon lain yang dapat digunakan untuk memicu terjadinya ovulasi folikel hasil superovulasi adalah dengan penyuntikan human chronionic gonadotropin
(hCG). Hormon ini berpotensi untuk perkembangan dan pemasakan folikel sampai terjadinya ovulasi. Pemberian PMSG yang dikombinasi dengan hCG dapat menghasilkan corpus luteum (CL) yang lebih banyak dibandingkan dengan pemberian PMSG atau FSH saja (Supriatna et al. 1998). Pengaruh pemberian hormon-hormon gonadotropin terhadap induk yang disuperovulasi dapat dilihat dari pemeriksaan gambaran darah merah dan darah putihnya. Berbagai parameter penghitungan darah lengkap dapat memberikan informasi mengenai status kesehatan induk (Maheshwari et al. 2001).
Darah
4
Sel Darah Merah
Sel darah merah atau eritrosit merupakan bagian utama dari darah. Sel darah merah berbentuk lempeng bikonkaf dengan diameter rata-rata 7,8 mikromete dan ketebalan 2.5 mikrometer dari bagian yang paling tebal, serta 1 mikrometer di bagian tengahnya (Guyton dan Hall 2007). Sel darah merah berwarna merah yang disebabkan oleh hemoglobin. Warna merah itu sangat dipengaruhi oleh hemoglobin saat mengikat oksigen dan disebut sebagai oksihemoglobin (HbO2). Gambar sel darah merah disajikan pada gambar 2.
Gambar 2 Sel darah merah (Mahmood dan Mansor 2012)
Sel darah merah dibentuk dalam sumsum tulang yang kemudian dilepaskan ke dalam sistem sirkulasi dan beredar ke seluruh tubuh melalui pembuluh darah. Jumlah sel darah merah dalam pembuluh darah relatif konstan yang artinya pembentukan sel darah merah yang baru memiliki kecepatan yang sama dengan kecepatan rusaknya sel darah merah yang lama. Sel darah merah dapat bertahan dalam jangka waktu 120 hari sampai dengan 125 hari dalam sistem sirkulasi dan kemudian mengalami kerusakan. Peran penting sel darah merah adalah sebagai pembawa hemoglobin yang mengandung oksigen dan dibawa dari paru-paru ke semua jaringan tubuh (Guyton dan Hall 2007). Pemeriksaan sel darah merah dalam sampel darah dapat memberikan beberapa informasi tentang kondisi abnormal dalam tubuh (Mahmood dan Mansor 2012).
Faktor-faktor yang mempengaruhi jumlah dan kualitas sel darah merah diantaranya adalah Hb, PCV, umur, sex, gizi, iklim, kehamilan, laktasi, dan ketinggian lokasi. Jumlah sel-sel darah merah yang berkurang dapat disebabkan oleh kasus perdarahan akibat infeksi parasit dan penyakit anemia. Penyakit anemia terjadi karena kekurangan asupan gizi terutama zat besi dan vitamin dalam makanan. Peningkatan sel darah merah disebabkan oleh keadaan hipoksia jaringan dan gangguan dalam transportasi oksigen dari paru-paru ke jaringan tubuh (Suwandi 2002).
Hemoglobin
5
disusun oleh inkorporasi besi ke dalam keempat heme. Sintesis rantai globin terjadi di dalam ribosom sitoplasma (Ganong 1995).
Jumlah hemoglobin dalam darah berhubungan dengan kebutuhan oksigen (O2) tubuh. Pada saat darah merah melalui kapiler paru-paru, hemoglobin akan mengikat oksigen (O2) membentuk oksi-hemoglobin. Sebaliknya, pada saat melewati kapiler sistemik, hemoglobin akan melepaskan oksigen (O2) ke dalam jaringan dan menjadi hemoglobin kembali. Intensitas warna merah hemoglobin dipengarihi oleh banyaknya kandungan oksigen. Tingkat hemoglobin dalam darah akan mempengaruhi kesehatan karena ketika tingkat hemoglobin terlalu rendah maka akan memicu kelelahan dan sesak napas akibat kekurangan oksigen yang masuk ke jaringan tubuh ( Mahmood dan Mansor 2012).
Kadar hemoglobin dalam darah dapat dipengaruhi oleh berbagai faktor di antaranya adalah umur, jenis kelamin, kehamilan, menstruasi, asupan makanan, kebiasaan minum teh atau kopi (dapat menurunkan penyerapan besi), dan penyakit-penyakit infeksi. Anemia adalah suatu keadaan yang kadar hemoglobin (Hb) dalam darah kurang dari normal. Keadaan tersebut disebabkan oleh salah satu dari faktor-faktor di atas. Kekurangan kadar hemoglobin dalam darah dapat menimbulkan gejala lesu, lemah, letih, lelah, dan cepat lupa. Akibatnya, daya tahan tubuh menurun dan mengakibatkan mudah terkena infeksi (Khaidir 2007). Peningkatan kadar hemoglobin dalam sel darah merah dapat menyebabkan kemampuan membawa oksigen dalam jaringan lebih baik dan ekskresi CO2 lebih efisien sehingga kondisi dan fungsi sel akan berjalan dengan normal (Cunningham 2002).
Hematokrit
Hematokrit atau packet cell volume (PCV) adalah angka yang menunjukkan perbandingan volume eritrosit dengan volume plasma darah yang dinyatakan dalam persen volume (Shadly dan Pringgodigjo 1977). Nilai hematokrit dipengaruhi oleh pergantian cairan atau perdarahan. Kadar hematokrit akan meningkat dengan meningkatnya jumlah sel darah merah dan pada kasus hemokonsentrasi yang terjadi karena kebocoran plasma yang mengakibatkan berkurangnya cairan plasma. Selain itu, dapat juga disebabkan oleh keadaan diare dan dehidrasi (Pusparini 2004). Sebaliknya, berkurangnya pembentukan sel darah merah akibat gizi yang tidak baik, pada keadaan bunting, kelebihan cairan, anemia, dan pada kasus-kasus berat yang disertai perdarahan pada umumnya dapat menyebabkan penurunan nilai hematokrit (Suwandi 2002).
6
METODE PENELITIAN
Bahan
Bahan yang digunakan dalam penelitian ini di antaranya 12 domba betina, sediaan hormon prostaglandin F2α (PGF2α), pregnant mare serum gonadotropin
(PMSG) dan human chorionic gondadotropin (hCG), pengencer NaCl 0.9%, alkohol 70%, antikoagulan ethilen diamine tetra-asetate (EDTA), vitamin B kompleks, dan anthelmintik (Albendazole).
Alat
Alat yang digunakan dalam penelitian ini antara lain spuid 3 mL, seperangkat alat ultrasonography (USG), tabung reaksi, gelas objek, hemositometer, selotip, marker, kertas label, kertas saring atau tisu, kapas, tabung kapiler, alat penghitung,
adam micro-hematocrit reader, penyumbat tabung kapiler, alat sentrifugasi, tambang,
selang penanda berwarna, mikroskop cahaya, oven, dan kotak pendingin.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan selama enam bulan yang dimulai pada bulan Mei sampai dengan Oktober 2011. Penelitian dilakukan di kandang Mitra Tani Farm yang beralamat di Jalan Manunggal Baru No 1, Desa Tegalwaru, Kecamatan Ciampea, Kabupaten Bogor, sementara itu analisis sampel darah dilakukan di Laboratorium Fisiologi, Departemen Anatomi, Fisiologi, dan Farmakologi (AFF), Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Tahap persiapan Hewan percobaan
Hewan coba yang digunakan dalam penelitian ini adalah 12 domba betina lokal yang telah dewasa kelamin. Domba- domba memiliki kisaran bobot badan antara 18 kg - 25 kg yang diperoleh dari peternakan Mitra Tani Farm.
Aklimatisasi domba
Domba penelitian diaklimatisasikan selama dua minggu sebelum diberikan perlakuan. Pada tahap ini, domba penelitian diberikan obat cacing (albendazol), vitamin B kompleks, dan antibiotik. Pemberian obat cacing dan antibiotik bertujuan supaya domba penelitian terbebas dari infeksi cacing dan bakteri. Vitamin B kompleks diberikan untuk meningkatkan daya tahan tubuh. Proses aklimatisasi ini penting dilakukan supaya domba-domba tersebut dapat menyesuikan diri dengan lingkungan kandang dan sekitarnya sehingga kondisi kesehatan tetap terjaga.
Kandang, pakan, dan minum
7
hijauan yang diberikan pada pagi dan sore hari serta ampas tahu yang diberikan pada siang hari. Air minum tersedia secara ad libitum.
Tahap Pelaksanaan
Rancangan percobaan
Rancangan percobaan yang digunakan dalam penelitian ini ialah rancangan acak lengkap (RAL).
Tabel 1 Pembagian kelompok domba perlakuan Kelompok Perlakuan Keterangan
I Domba yang tidak diberi perlakuan (kontrol)
II Domba diberi penyuntikan PMSG + hCG (SO1) sebelum
Sebelum perlakuan superovulasi, dilakukan ultrasonography (USG) terlebih dahulu terhadap hewan perlakuan untuk memastikan hewan tidak bunting. Kemudian dilakukan sinkronisasi estrus dengan menyuntikkan hormon PGF2α (Lutalyse TM) secara intramuskuler sebanyak dua kali pada semua kelompok perlakuan. Dosis PGF2α yang diberikan 0.5 mg kg-1 bobot badan. Penyuntikan PGF2α kedua dilakukan dengan selang waktu 11 hari dari penyuntikan pertama. Selain itu, kelompok domba superovulasi (SO1) dan kelompok domba yang
double superovulasi (SO12) dilakukan penyuntikan secara intramuskuler menggunakan hormon PMSG dan hCG yang disuntikkan sesaat setelah penyuntikan PGF2α yang kedua.
Dua sampai tiga hari setelah penyuntikan PGF2α yang kedua, semua domba percobaan berada dalam kondisi estrus. Setelah itu, semua domba percobaan dicampur dengan domba pejantan yang telah dipilih. Pencampuran domba jantan dengan domba betina dilakukan selama dua hari. Pencampuran dengan pejantan dilakukan dengan membagi 12 domba betina menjadi 4 kelompok dengan masing-masing kelompok terdiri atas 3 betina dan 1 jantan. Tiga puluh hari setelah pencampuran dengan pejantan, dilakukan pemeriksaan kebuntingan menggunakan USG.
Pengambilan sampel
8
Pemeriksaan sampel
Parameter yang diamati dalam pemeriksaan sampel terdiri atas jumlah sel darah merah, nilai hematokrit (PCV), dan kadar hemoglobin. Penghitungan jumlah sel darah merah dilakukan secara manual dengan metode hemositometer. Metode ini diawali dengan menghisap darah dengan menggunakan pipet eritrosit sampai skala 0.5. Kemudian, pipet darah yang menempel pada bagian luar pipet dibersihkan menggunakan tissu. Setelah itu, ujung pipet dimasukkan ke dalam cairan pengencer hayem yang sebelumnya telah disediakan di dalam cawan porselin, kemudian larutan hayem tersebut dihisap sampai batas tera 101. Kemudian aspirator dilepas dan pipet diangkat sambil ujungnya ditutup dengan jempol serta pangkalnya ditutup dengan jari tengah. Pipet diposisikan mendatar dan dihomogenkan dengan membuat gerakan memutar angka 8. Setelah homogen, cairan tetesan pertama dan kedua dari dalam pipet dibuang, setelah itu, ujung pipet disentuhkan pada bagian pinggir kamar hitung yang telah ditutup dengan kaca penutup, setelah cairan dari pipet menyebar pada bagian dasar kamar hitung, kamar hitung diletakkan di bawah mikroskop kemudian difokuskan dan dilakukan perhitungan darah pada lima kotak kamar hitung mulai dari kotak bagian kiri atas, kanan atas, kanan bawah, kiri bawah, dan kotak tengah.
Penghitungan nilai hematokrit dilakukan dengan menggunakan Adam Mikrohematokrit Reader. Tabung mikro yang digunakan adalah tabung mikro dengan panjang 7 cm dan diameter 1 mm. Sampel darah diambil dengan menempelkan bagian ujung dari tabung mikro tersebut ke dalam darah. Posisi ujung tabung mikro hampir mendatar dan bagian ujung tabung yang lain dikosongkan kira-kira 1 cm. Kemudian, bagian ujung tabung disumbat dan tabung mikro yang berisi sampel darah tersebut disentrifuse selama 4 menit - 5 menit dengan kecepatan 10.000 rpm. Hasil sentrifuse dibaca menggunakan Adam mikrohematocrit Reader.
Pengukuran nilai hemoglobin dilakukan dengan menggunakan metode Sahli. Metode ini dilakukan dengan cara menambahkan HCL ke dalam tabung kemudian ditambahkan dengan sampel darah dan ditambahkan secara perlahan sejumlah aquades hingga warna yang terbentuk sama dengan kontrol. Kadar hemoglobin diperoleh dengan membaca skala yang tertera pada tabung Sahli.
Variabel yang Diamati
Variabel yang diamati pada penelitian ini terdiri atas jumlah sel darah merah, kadar hemoglobin, dan nilai hematokrit (PCV).
Analisis Data
9 perkawinan (SO12) memperlihatkan hasil yang bervariasi. Jumlah rata-rata sel darah merah pada ketiga perlakuan dengan perlakuan kontrol sebagai pembanding disajikan pada Tabel 2.
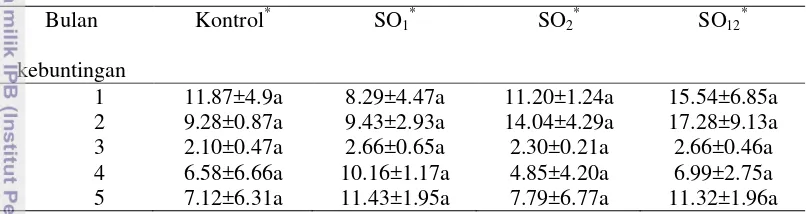
Tabel 2 Rataan jumlah sel darah merah (106 mm-3) pada induk domba Bulan
kebuntingan
Kontrol* SO1* SO2* SO12*
1 11.87±4.9a 8.29±4.47a 11.20±1.24a 15.54±6.85a
2 9.28±0.87a 9.43±2.93a 14.04±4.29a 17.28±9.13a
3 2.10±0.47a 2.66±0.65a 2.30±0.21a 2.66±0.46a
4 6.58±6.66a 10.16±1.17a 4.85±4.20a 6.99±2.75a
5 7.12±6.31a 11.43±1.95a 7.79±6.77a 11.32±1.96a
Kontrol: Tidak diberi perlakuan apa-apa, SO1: penyuntikan PMSG dan hCG sebelum kawin, SO2 :
hCG hari ke-6 setelah kawin, SO12: penyuntikan PMSG dan hCG sebelum kawin serta hCG hari
ke-6 setelah kawin; *Angka-angka pada kolom yang sama yang diikuti oleh huruf kecil yang sama menunjukkan tidak berbeda nyata pada taraf uji 5%.
Hasil penelitian ini menunjukkan efektivitas kerja hormon tambahan yang diberikan untuk meningkatkan kualitas kebuntingan pada induk domba. Hormon PMSG dan hCG yang digunakan dalam superovulasi memiliki kerja yang mirip dengan hormon FSH dan LH, yaitu merangsang pembentukan folikel ovarium yang selanjutnya dapat meproduksi hormon estrogen (Mege et al. 2007). Penyuntikan hormon PMSG dan hCG diharapkan dapat memaksimalkan fungsi organ reproduksi pada masa kebuntingan.
Pada penelitian ini diperoleh jumlah rata-rata sel darah merah secara keseluruhan pada kelompok perlakuan SO1 (8.39±2.23), SO2 (8.04±3.34), dan SO12 (10.76±4.23) selama lima bulan kebuntingan menunjukkan hasil yang cenderung lebih tinggi dari perlakuan kontrol (7.39±3.84). Apabila dilihat dari ketiga kelompok perlakuan superovulasi, kelompok perlakuan SO12 memiliki
rata-rata keseluruhan jumlah sel darah merahlebih tinggi dari kelompok SO1 dan SO2.
Hasil ini memberi gambaran adanya peningkatan laju metabolisme tubuh pada kelompok tersebut. Penggunaan hormon PMSG pada superovulasi memicu pembentukan folikel, korpus luteum, dan plasenta yang merupakan kelenjar penghasil hormon-hormon kebuntingan (Mege et al. 2007). Selain menghasilkan kelenjar-kelenjar di atas, penyuntikan hormon PMSG sebelum prkawinan juga mampu meningkatkan hormon tiroid (T3 dan T4), glukosa, dan trigliserida darah yang merupakan faktor pendukung meningkatnya laju metabolisme tubuh (Mege
10
ovulasi (Situmorang 2005). Pada penelitian ini ditemukan bahwa dengan pemberian hormon PMSG dan penambahan hCG memberikan respons positif pada organ reproduksi seperti yang ditunjukan oleh kelompok perlakuan SO12. Hal ini disebabkan karena hCG bersifat luteotropik, bekerja mengoptimalkan fungsi korpus luteum, mencegah regresi luteal, dan meningkatkan konsentrasi hormon progesteron (Siregar et al. 2010). Peningkatan angka kebuntingan akan berbanding lurus dengan kebutuhan metabolisme tubuh induk. Peningkatan jumlah sel darah merah pada kelompok domba perlakuan SO12 merupakan respons homeostasis dalam menyeimbangkan peningkatan laju metabolisme tubuh (Andriyanto et al. 2013).
Pada bulan ke-3, semua kelompok perlakuan mengalami penurunan jumlah sel darah merah secara drastis. Hal ini diduga karena terjadinya tingkat stres akibat cekaman metabolik yang semakin tinggi (Maheshwari et al. 2001). Pada bulan ke-4 dan ke-5 terjadi peningkatan kembali karena respons induk mulai stabil dalam mempersiapkan kebutuhan metabolik seiring dengan meningkatnya pertumbuhan, bobot, dan ukuran fetus selama trimester terakhir kebuntingan. Selain pada fetus, ukuran tubuh induk juga ikut meningkat. Kedua hal ini mengakibatkan peningkatan pada metabolisme tubuh sehingga merangsang sumsum tulang untuk menghasilkan sel-sel darah merah dalam jumlah banyak. Jumlah sel darah merah yang tinggi menjelang proses kelahiran diperlukan untuk mengantisipasi kondisi tubuh induk setelah melahirkan (Guyton dan Hall 2007).
Hemoglobin
Pada keadaan bunting, kadar hemoglobin yang tinggi sangat dibutuhkan tubuh untuk mengangkut oksigen dan nutrisi yang terkandung dalam sel darah merah. Peningkatan kadar hemoglobin pada hewan yang sedang bunting sangat bergantung pada kebutuhan metabolisme tubuh. Menurut Kozat et al (2006) kadar hemoglobin domba bunting sekitar 12.3±0.58 gram%. Pada penelitian ini, hasil perhitungan rata-rata kadar hemoglobin darah selama lima bulan periode kebuntingan disajikan pada Tabel 3.
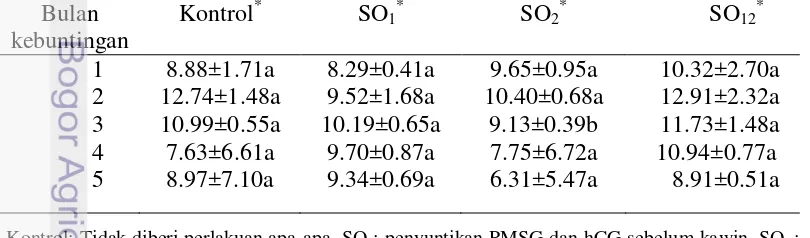
Tabel 3 Rataan kadar hemoglobin (g dL-1) pada induk domba Bulan Kontrol: Tidak diberi perlakuan apa-apa, SO1: penyuntikan PMSG dan hCG sebelum kawin, SO2 :
hCG hari ke-6 setelah kawin, SO12: penyuntikan PMSG dan hCG sebelum kawin serta hCG hari
11
Hasil pada Tabel 3 menunjukkan kadar rata-rata hemoglobin darah pada setiap kelompok perlakuan dan kelompok kontrol sebagai pembanding. kadar hemoglobin secara keseluruhan pada kelompok perlakuan SO1 (9.41±0.86) dan SO2 (8.65±2.84) lebih rendah dari kontrol (9.84±3.49) walaupun tidak berbeda signifikan. Akan tetapi, pada kelompok perlakuan SO12 (10.96±1.56) menunjukkan hasil hemoglobin yang sedikit lebih tinggi dari perlakuan kontrol (9.84±3.49). Hasil tersebut menggambarkan kebutuhan metabolisme yang berbeda-beda pada setiap kelompok perlakuan. Tinggi rendahnya kadar hemoglobin dipengaruhi oleh besar kecilnya beban metabolisme yang ditanggung. Kadar hemoglobin yang cenderung lebih tinggi pada kelompok perlakuan SO12 menandakan bahwa laju metabolisme pada kelompok tersebut lebih besar akibat meningkatnya angka kebuntingan yang dikandung. Kadar hemoglobin yang tinggi pada masa kebuntingan berfungsi melancarkan masuknya oksigen ke dalam jaringan dan keluarnya CO2 dari jaringan ke paru-paru sehingga sel-sel jaringan dapat berfungsi dengan baik (Cunningham 2002). Kadar hemoglobin pada kebuntingan kembar lebih tinggi dibandingkan pada kebuntingan tunggal. (Andriyanto et al. 2011).
Kelompok domba perlakuan SO2 bulan ke-3 secara statistik menunjukkan perbedaan nyata (P<0,05) dari kelompok kontrol, SO1, dan SO12. Kelompok domba yang hanya diberi penyuntikan hCG hari ke-6 setelah perkawinan ini cenderung memiliki kadar hemoglobin darah yang lebih rendah. Penyuntikan hCG secara tunggal pada kelompok perlakuan SO2 tidak memberi respon yang efektif dari organ reproduksi. Hal ini ditandai dengan rendahnya kadar hemoglobin pada kelompok tersebut yang artinya tidak terjadi peningkatan pada beban metabolisme tubuh. Pemberian hCG dilaporkan mampu meningkatkan kualitas fungsi organ reproduksi apabila terlebih dahulu disuperovulasi menggunakan PMSG (Situmorang 2005).
Hematokrit
Hematokrit adalah angka yang menunjukkan persentase sel darah dalam darah. Tinggi rendahnya nilai hematokrit erat kaitannya dengan pergantian cairan dan perdarahan. Pengamatan nilai hematokrit sangat penting dalam menentukan status kesehatan hewan (Suwandi 2002). Nilai hematokrit pada setiap ternak berbeda-beda. Menurut Bank (1993) dan Frandson (1996), nilai hematokrit domba sekitar 24-50% dengan rata-rata sekitar 36%, sedangkan menurut Kozat et al.
(2006), nilai hematokrit domba bunting sekitar 28.60%. Kadar rata-rata hematokrit pada setiap kelompok perlakuan selama lima bulan periode kebuntingan dalam penelitian ini dapat dilihat pada Tabel 4.
12
memiliki nilai yang jauh lebih kecil dari nilai hematokrit yang dilaporkan Kozat et al. (2006), yaitu nilai hematokrit pada domba bunting adalah 28.60±1,4%. Akan tetapi, apabila kelompok kontrol yang digunakan sebagai pembanding pada peneitian ini maka kelompok perlakuan SO12 memilki nilai hematokrit yang lebih tinggi.
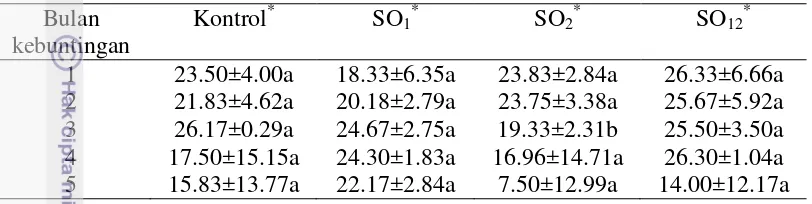
Tabel 4. Rataan Nilai Hematokrit (%) pada Induk Domba Bulan
kebuntingan
Kontrol* SO1* SO2* SO12*
1 23.50±4.00a 18.33±6.35a 23.83±2.84a 26.33±6.66a 2 21.83±4.62a 20.18±2.79a 23.75±3.38a 25.67±5.92a 3 26.17±0.29a 24.67±2.75a 19.33±2.31b 25.50±3.50a 4 17.50±15.15a 24.30±1.83a 16.96±14.71a 26.30±1.04a 5 15.83±13.77a 22.17±2.84a 7.50±12.99a 14.00±12.17a Kontrol: Tidak diberi perlakuan apa-apa, SO1: penyuntikan PMSG dan hCG sebelum kawin, SO2 :
hCG hari ke-6 setelah kawin, SO12: penyuntikan PMSG dan hCG sebelum kawin serta hCG hari
ke-6 setelah kawin; *Angka-angka pada kolom yang sama yang diikuti oleh huruf kecil yang sama menunjukkan tidak berbeda nyata pada taraf uji 5%.
Pemberian hormon PMSG dan hCG pada perlakuan superovulasi bekerja efektif dalam merangsang pertumbuhan dan perkembangan folikel ovarium (Mege
et al. 2007). Hormon hCG yang diberikan setelah superovulasi menggunakan PMSG memberi respon yang positif dari organ reproduksi dalam meningkatkan jumlah korpus luteum dan embrio. Korpus luteum yang dihasilkan berpotensi meningkatkan produksi hormon-hormon kebuntingan seperti progesteron yang mendukung tumbuh kembang fetus selama kebuntingan (Adriani et al. 2007).
Nilai hematokrit yang meningkat berkaitan erat dengan laju metabolisme tubuh. Ovarium yang menghasilkan folikel dalam jumlah banyak dapat menyebabkan peningkatan metabolisme tubuh, yang selanjutnya meningkatkan volume sel darah merah. Pada penelitian ini, nilai hematokrit yang relatif lebih tinggi pada kelompok SO12 (23.56±5.86%) dapat disebabkan karena viskositas (kekentalan) darah yang meningkat akibat peningkatan laju metabolisme tubuh. Tinggi rendahnya nilai hematokrit memiliki pengaruh penting terhadap fungsi darah untuk membawa oksigen dan nutrisi (Cunningham 2002).
13
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil yang diperoleh dalam penelitian ini, dapat disimpulkan bahwa perlakuan superovulasi dapat meningkatkan metabolisme tubuh induk domba. Penyuntikan hCG yang didahului superovulasi dengan PMSG dan hCG dapat meningkatkan produktivitas fungsi ovarium.
Saran
Penelitian lebih lanjut diperlukan untuk mengkaji efektivitas hormon PMSG dan hCG dengan dosis yang berbeda pada organ reproduksi induk domba dalam memperbaiki kualitas kebuntingan.
DAFTAR PUSTAKA
Andriyanto, Manalu W. 2011. Potency of ethanol extract Curcuma xanthoriza as natural growth promotor in pregnant ewes with superovulation. Globalization of Jamu Brand Indonesia. The 2nd International Symposium on Temulawak. The 40th Meeting of National Working Group on Indonesian Medical Plant. IICC, Bogor. hlm 134-136.
Andriyanto, Ridi Arif, Muhammad Darjat Darulfalah, Ganjar Maulana Nugraha, Nastiti Kusomorini, Hera Maheshwari, dan Wasmen Manalu. 2013. Efek pemberian hormon pregnan mare’s serum gonadotropin (PMSG) sebelum kawin terhadap gambaran darah merah induk domba selama periode kebuntingan. J Kedokter Hewan. 7(1):1-4.
Adriani, Rosadi B, Deprison. 2009. Penggunaan follicle stimulating hormone dan pregnant mare serum gonadotrophin untuk superovulasi pada sapi persilangan brahman. Media Petern. 32(3):163-170.
Adriani, Sudono A, Sutardi T, Manalu W, Sutama I K. 2007. Pertumbuhan prenatal dalam kandungan kambing melalui superovulasi. Hayati J Biosci. 14(2):44-48. Ashworth CJ. 1991. Effect of pre-mating nutritional status and post- mating
progesterone suplementation on embryo survival and conceptus growth in gilts. Anim. Reprod. Sci. 26:311-321
Anonim. 2013. http://hewankurban.jaringan-online.com/domba.html [19 agustus 2013].
Bank WJ. 1993. Applied Veterinary Histology. Texas (USA): Mosby Inc. 142-154. Cunningham JG. 2002. Text Book of Veterinary Physiology. Philadelphia (USA):
WB Saunders Company. Ed ke-3.
14
Dziuk PJ. 1992. Embriyonic developmant and fetal growth. Anim. Reprod. Sci. 28:299-308.
Eppleston J. 1982. Embryo transfer procedures in the goat: Physiological and procedural differences in superovulation and tranfer between sheep and goats. Dalam: Embryo Transfer in Cattle, Sheep and Goats. Adst. Soc. Reprod. Biol. hlm:41-43.
Frandson RD. 1996. Anatomi dan Fisiologi Ternak. Srigandono, Praseno K, penerjemah. Yogyakarta (ID): Gajah Mada University Pr. Edisi ke-4.
Guyton, Hall. 2007. Buku Ajar Fisiologi Kedokteran. Irawati Setiawan, penerjemah. Jakarta (ID): EGC. Ed ke-11.
Ganong WF. 1995. Buku Ajar Fisiologi Kedokteran. Petrus Andrianto, penerjemah. Jakarta (ID): ECG.
Hafez ESE. 2000. Reproduction in Farm Animals. Philadelpia. Herren R. 2000. The Science of Animal Agriculture Ed-2. Delmar
Kaiin EM, Tappa B. 2006. Induksi superovulasi dengan kombinasi CIDR, hormon FSH dan hCG pada induk sapi potong. Media Petern. 29:141-146.
Khaidir M. 2007. Anemia defisiensi besi. J Kesehat Masyar. 1:2.
Kleeman DO, Walker SK, Seamark RF. 1994. Enhance fetal growth in sheep administered progesterone during the first three days of pregnancy. J Reprod Fert. 102:411-417.
Maheshwari H, Isdoni B, Satyaningtijas AS, Ekastuti DR, Kusumorini N. 2001. Gambaran darah kambing yang bunting tunggal dan kembar. Media Petern
24(3):77-82.
Mahmood NH, Mansor MA. 2012. Red blood cells estimation using hough transform technique. SIPIJ. 3(2):53-64.
Manalu W, Sumaryadi MY, Sudjatmogo, Satyaningtijas AS. 1999. Mammary gland differential growth during pregnancy in superovulated Javanese Thin-Tail ewes. Small Rumin Res. 33:279-284.
Manalu W, Sumaryadi MY. 1998. Maternal serum progesterone concentration during pregnancy and lamb birth weight at parturition in javanese thin-tail ewes with different litter size. Small Rumin Res. 30:163-169.
Mege RA, Nasution SH, Kusumorini N, Manalu W. 2007. Pertumbuhan dan perkembangan uterus dan plasenta babi dengan superovulasi. Hayati J Biosci. 14(1):1-6
Shadly H, Pringodidjo AG. 1977. Ensksiklopedia Umum. Yogyakarta (ID): Kanisius.
Seymour IS, Shires GT, Spenser FC, Husser WC. 2000. Principlles os Surgery Companion Handbook. New York (USA): McGriw-Hill Inc.
Schalm OW, Jain NC, Carrol EJ. 1986. Veterinary Hematology. Philadelpia: Lea & Febiger. Ed ke-3.
Siregar TN, Eldora MG, Melia J, Panjaitan B, Yusmadi, Barus RA. 2012. Kehadiran folikel dominan pada saat inisiasi superovulasi menurunkan respons superovulasi sapi aceh. J Kedokter. 6:2.
15
Situmorang P. 2005. Pengaruh pemberian hormon human chorionic gonadotrophin (hCG) pada perlakuan superovulasi ternak kerbau. JITV. 10 (4):286-292.
Smith JB, Mangkoewidjojo S. 1988. Pemeliharaan, Pembiakan, dan Penggunaan Hewan Percobaan di Daerah Tropis. Jakarta (ID): UI Pr.
Subandrio, Setiadi B, Rangkuti M, Diwyanto K, Doloksaribu M, Batubara LP, Romjali E, Eliaser S, Handiwirawan E. 1998. Performa domba komposit hasil persilangan antara domba lokal sumatera dengan domba rambut generasi pertama dan kedua. JITV. 3:2.
Supriatna I, Yusuf TL, Purwantara B, Moekti G, Hernomoadi LP. 1998. Kajian pemberian human chorionic gonadotropin (hCG) pada sapi perah yang telah disuperovulasi dengan pregnant mare serum gonadotropin- monoklonal antibody (PMSG-MoAb) Anti- PMSG. Media Veterin. 5(2):15-20.
Sutama IK, Budiarsanaa IGM, Setijanto H, Priyanto A. 1999. Productive and reproductive performance of young Etawah-cross does. JITV. 1(2):81-85. Sumaryadi MY. 1997. Prediksi banyaknya anak, bobot lahir, komponen kimia
kelenjar susu, dan produksi susu kaitannya dengan bobot sapih berdasarkan profil hormon dan metabolit darah selama kebuntingan pada domba (Ovis aries) [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Suwandi. 2002. Manfaat Pemeriksaan Gambaran Darah Umum pada Ternak Ruminansia. Temu Teknis Fungsional Non Peneliti 2002. Bogor, Indonesia. Bogor (ID): Balai Penelitian Ternak. hlm 133-139.
16
Lampiran 1 Hasil Analisis Perhitungan Jumlah Sel Darah Merah /POSTHOC=DUNCAN ALPHA(0.05).
Oneway
Anova
Sumof Squares df Mean Square F Sig. Mei Between Groups 7.988E13 3 2.663E13 1.154 .385
Within Groups 1.845E14 8 2.306E13
Total 2.644E14 11
Juni Between Groups 1.348E14 3 4.493E13 1.618 .260 Within Groups 2.222E14 8 2.777E13
Total 3.569E14 11
Juli Between Groups 7.014E11 3 2.338E11 1.032 .429 Within Groups 1.812E12 8 2.266E11
Total 2.514E12 11
Agustus Between Groups 4.416E13 3 1.472E13 .831 .513 Within Groups 1.417E14 8 1.771E13
Total 1.859E14 11
September Between Groups 4.692E13 3 1.564E13 .670 .594 Within Groups 1.869E14 8 2.336E13
Total 2.338E14 11
Post Hoc Tests
Homogeneous Subsets
Mei
Perlakuan N Subset for alpha = 0.05 1
Duncana SO1 3 8.2900E6
SO2 3 1.1200E7
kontrol 3 1.1877E7
SO12 3 1.5537E7
Sig. .121
17
Juli
Perlakuan N
Subset for alpha = 0.05 1
Duncana kontrol 3 2.0967E6
SO2 3 2.3000E6
SO1 3 2.6600E6
SO12 3 2.6600E6
Sig. .210
Meansforgroups inhomogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 3,000.
Agustus
Perlakuan N Subset for alpha = 0.05 1
Duncana SO2 3 4.8467E6
kontrol 3 6.5767E6
SO12 3 6.9933E6
SO1 3 1.0160E7
Sig. .184
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 3,000.
Juni
Perlakuan N
Subset for alpha = 0.05 1
Duncana control 3 9.2833E6
SO1 3 9.4333E6
SO2 3 1.4037E7
SO12 3 1.7277E7
Sig. .119
18
September
Perlakuan N
Subset for alpha = 0.05 1
Duncana kontrol 3 7.1167E6
SO2 3 7.7900E6
SO12 3 1.1323E7
SO1 3 1.1433E7
Sig. .333
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 3,000.
Lampiran 2 Hasil Analisis Perhitungan Nilai Hemoglobin /POSTHOC=DUNCAN ALPHA(0.05).
Oneway
Anova
Sum of Squares df Mean Square F Sig.
Mei Between Groups 7.055 3 2.352 .835 .511
Within Groups 22.527 8 2.816
Total 29.582 11
Juni Between Groups 25.935 3 8.645 3.183 .085
Within Groups 21.731 8 2.716
Total 47.666 11
Juli Between Groups 11.196 3 3.732 4.876 .033
Within Groups 6.123 8 .765
Total 17.319 11
Agustus Between Groups 23.131 3 7.710 .342 .796 Within Groups 180.453 8 22.557
Total 203.584 11
September Between Groups 17.518 3 5.839 .247 .861 Within Groups 189.230 8 23.654
19
Post Hoc Tests
Homogeneous Subsets Mei
Perlakuan N Subset for alpha = 0.05 1
Duncana SO1 3 8.2900
kontrol 3 8.8800
SO2 3 9.6500
SO12 3 10.3167
Sig. .201
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3,000. Juni
Perlakuan N Subset for alpha = 0.05
1 2
Duncana SO1 3 9.5167
SO2 3 10.4033 10.4033
kontrol 3 12.7433 12.7433
SO12 3 12.9167
Sig. .050 .111
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 3,000.
Juli
Perlakuan N Subset for alpha = 0.05
1 2
Duncana SO2 3 9.1267
SO1 3 10.1867 10.1867
kontrol 3 10.9933
SO12 3 11.7267
Sig. .176 .072
20
Agustus
Perlakuan N Subset for alpha = 0.05 1
Duncana kontrol 3 7.6300
SO2 3 7.7500
SO1 3 9.7033
SO12 3 10.9433
Sig. .443
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 3,000. September
Perlakuan N Subset for alpha = 0.05 1
Duncana SO2 3 6.3067
SO12 3 8.9067
kontrol 3 8.9700
SO1 3 9.3367
Sig. .492
21
Lampiran 3 HasilAnalisisPerhitungan Kadar Hematokrit /POSTHOC=DUNCAN ALPHA(0.05).
Oneway
Anova
Sum of Squares df Mean Square F Sig. Mei Between Groups
101.500 3 33.833
.244 .356
Within Groups 217.500 8 27.188
Total 319.000 11
Juni Between Grous
50.664 3 16.888
893 .485
Within Groups 151.210 8 18.901
Total 201.874 11
Juli Between Groups
87.417 3 29.139
.616 .037
Within Groups 50.500 8 6.312
Total 137.917 11
Agustus Between Groups
201.640 3 67.213
596 .635
Within Groups 901.447 8 112.681
Total 1103.087 11
September Between Groups
327.729 3 109.243
849 .505 Within Groups 1028.833 8 128.604
22
Post Hoc Tests
Homogeneous Subsets Mei
Perlakuan N Subset for alpha = 0.05 1
Duncana SO1 3 18.3333
kontrol 3 23.5000
SO2 3 23.8333
SO12 3 26.3333
Sig. .115
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 3,000.
Juni
Perlakuan N Subset for alpha = 0.05 1
Duncana SO1 3 20.1833
kontrol 3 21.8333
SO2 3 23.7500
SO12 3 25.6667
Sig. .184
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 3,000.
Juli
Perlakuan Subset for alpha = 0.05
1 2
Duncana SO2 19.3333
SO1 24.6667
SO12 25.5000
kontrol 26.1667
Sig. 1.000 .503
23
Agustus
Perlakuan Subset for alpha = 0.05 1
Duncana SO2 16.9667
kontrol 17.5000
SO1 24.3000
SO12 26.3000
Sig. .340
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 3,000.
September
Perlakuan Subset for alpha = 0.05 1
Duncana SO2 7.5000
SO12 14.0000
kontrol 15.8333
SO1 22.1667
Sig. .175
24
RIWAYAT HIDUP
Penulis dilahirkan di Segorong Kalimantan Barat pada tanggal 28 juni 1988. Penulis adalah putri kedua dari pasangan Bapak Lokay dan Ibu Minah. Tahun 2007 penulis lulus dari SMA Borneo Bengkayang dan pada tahun yang sama penulis lulus seleksi masuk masuk Institut Pertanian Bogor (IPB) melalui jalur Beasiswa Utusan Daerah (BUD) dan menjalani matrikulasi Pra-Universitas selama satu tahun.