ISOLASI, PEMURNIAN PARSIAL, DAN KARAKTERISASI
ENZIM KITINASE DARI Bacillus sp. BPPT CC 2
OKI KURNIA SUGIARTO
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Isolasi, Pemurnian Parsial, dan Karakterisasi Enzim Kitinase dari Bacillus sp. BPPT CC 2 adalah benar karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada Perguruan Tinggi manapun. Penelitian ini merupakan bagian dari proyek penelitian atas nama Dr. Ir. Siswa Setyahadi, M. Sc. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini. Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Laboratorium Teknologi Bioindustri, LAPTIAB, Puspiptek Serpong.
Bogor, Agustus 2013
Oki Kurnia Sugiarto
ABSTRAK
OKI KURNIA SUGIARTO. Isolasi, Pemurnian Parsial, dan Karakterisasi Enzim Kitinase dari Bacillus sp. BPPT CC 2. Dibimbing oleh DJAROT SASONGKO HAMI SENO dan SISWA SETYAHADI.
Kitinase merupakan enzim yang potensial karena kemampuannya untuk menghidrolisis kitin menjadi turunannya yang dapat dimanfaatkan secara komersial dalam berbagai bidang, misalnya pertanian, mikrobiologi, dan kosmetik. Penelitian ini bertujuan mengisolasi, memurnikan, dan mengkarakterisasi (pH, suhu, pengaruh ion logam, bobot molekul, dan parameter kinetika) kitinase dari
Bacillus sp. BPPT CC2. Pemurnian enzim dilakukan dengan pengendapan ammonium sulfat dan dialisis. Setelah dialisis, enzim dikarakterisasi dengan beberapa parameter seperti pH, suhu, ion logam, bobot molekul, dan parameter kinetika. Enzim kitinase terendapkan dengan baik menggunakan ammonium sulfat 80%. Kemurnian enzim yang telah didialisis meningkat 6.58 kali dengan aktivitas spesifik sebesar 0.0924 U/mg. Suhu dan pH optimum untuk kitinase yaitu 55ºC dan pH 5. Nilai Km dan Vmaks yang diperoleh yaitu 2.705x10-4 mg/L detik dan
0.6959 mg/L. Bobot molekul kitinase diprediksi sebesar 103 kDa. Penambahan ion logam Mn2+ dan EDTA (5 mM dan 10 mM) berperan sebagai aktivator.
Kata kunci: Bacillus sp. BPPT CC 2, karakterisasi, kitinase, parameter kinetika, pemurnian
ABSTRACT
OKI KURNIA SUGIARTO. Isolation, Parsial Purification, and Characterization of Chitinase Enzyme from Bacillus sp. BPPT CC 2. Supervised by DJAROT SASONGKO HAMI SENO and SISWA SETYAHADI.
Chitinase is a potential enzyme due to its acitvity hydrolyting chitin to its derivates. Therefore, it can be used for various applications, such as agriculture, microbiology, and cosmetic. This study aimed to isolate, purify, and characterize (pH, temperature, metal ion effect, molecular weight, and kinetic parameters) chitinase of Bacillus sp. BPPT CC 2. Ammonium sulphate precipitation and dialysis were used for enzyme purification. Enzyme was characaterized its optimum pH and temperature, metal ions, molecular weight, as well as kinetic parameters. The results showed that enzyme was well precipitated using 80% ammonium sulphate. After dialyzed, level of enzyme purity increased 6.58 fold with specific activity of 0.0924 U/mg. Results showed that the optimum temperature and pH of chitinase were found at 55ºC and pH 5. Value of Km and
Vmaks values were 2.705x10-4mg/L second and 0.6959 mg/L. Predicted molecular
weight of chitinase was 103 kDa. Addition of metal ions Mn2+and EDTA (5 mM and 10 mM) act as activators of chitinase.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
ISOLASI, PEMURNIAN PARSIAL, DAN KARAKTERISASI
ENZIM KITINASE DARI Bacillus sp. BPPT CC 2
OKI KURNIA SUGIARTO
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Isolasi, Pemurnian Parsial, dan Karakterisasi Enzim Kitinase dari
Bacillus sp. BPPT CC 2 Nama : Oki Kurnia Sugiarto NIM : G84090033
Disetujui oleh
Dr. Djarot Sasongko Hami Seno, MS Pembimbing I
Dr. Ir. Siswa Setyahadi, M.Sc Pembimbing II
Diketahui oleh
Dr.Ir. I Made Artika, M.App.Sc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT, yang senantiasa memberikan rahmat serta hidayah-Nya sehingga penyusunan skripsi yang berjudul “Isolasi, Pemurnian Parsial, dan Karakterisasi Enzim Kitinase dari Bacillus sp. BPPT CC 2” ini dapat diselesaikan. Penelitian ini berlangsung selama 4 bulan dari Januari hingga April 2013 dan dilaksanakan di Laboratorium Teknologi Bioindustri, LAPTIAB, Puspiptek. Penelitian ini bagian dari proyek atas nama Dr. Ir. Siswa Setyahadi, M. Sc.
Terima kasih disampaikan kepada Bapak Dr. Djarot Sasongko Hami Seno, MS dan Bapak Dr. Ir. Siswa Setyahadi, M.Sc, selaku pembimbing dalam skripsi ini. Penulis mengucapkan terima kasih kepada kak Ruby Setyawan dan staf Divisi Biokatalis yang telah membantu selama penelitian ini. Ucapan terima kasih juga penulis sampaikan kepada orang tua, keluarga, dan teman-teman atas doa dan segala dukungan. Demikianlah skripsi ini disusun, semoga dapat bermanfaat baik bagi penulis maupun para pembaca.
Bogor, Agustus 2013
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
HASIL 4
PEMBAHASAN 7
Produksi dan Purifikasi Enzim Kitinase 7
Suhu dan pH Optimum Enzim Kitinase 8
Identifikasi Bobot Molekul Enzim berdasarkan SDS PAGE dan Zimogram 9 Pengaruh Ion Logam terhadap Aktivitas Enzim Kitinase 9
Parameter Kinetika Enzim Kitinase 10
SIMPULAN 11
DAFTAR PUSTAKA 11
LAMPIRAN 14
DAFTAR GAMBAR
1 Suhu dan pH optimum enzim kitinase 5
2 Elektroforegram SDS PAGE dan zimogram 5
3 Pengaruh ion logam terhadap aktivitas kitinase 6
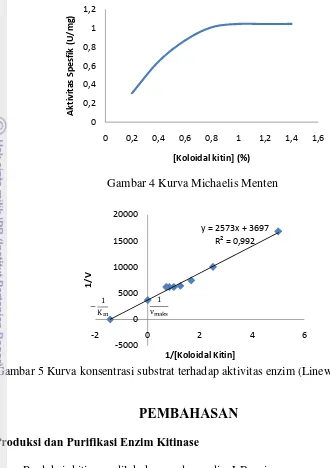
4 Kurva Michaelis Menten 7
5 Kurva konsentrasi substrat terhadap aktivitas enzim 7
DAFTAR LAMPIRAN
1 Diagram alir penelitian 14
2 Kurva standar BSA 15
3 Kurva standar N-asetilglukosamin 17
4 Data hasil penentuan aktivitas kitinase berbagai fraksi 19
5 Data hasil suhu optimum 19
6 Data hasil pH optimum 19
7 Pengaruh ion logam 20
1
PENDAHULUAN
Enzim merupakan katalis biologis yang berperan dalam reaksi metabolisme pada makhluk hidup. Enzim masih memiliki aktivitas katalis meskipun di luar sel. Oleh karena itu, para peneliti telah mempelajari studi tentang karakteristik enzim secara in vitro. Meskipun hampir semua enzim ditemukan di dalam sel, beberapa enzim yang dihasilkan mikroba disekresikan ke media produksi yang disebut sebagai enzim ekstraseluler. Enzim ekstraseluler tersebut perlu diisolasi untuk dipelajari karakteristiknya secara in vitro. Selain diisolasi, enzim tersebut juga perlu dimurnikan sebelum diketahui karakteristiknyas (Nelson and Cox 2008).
Kitinase merupakan salah satu enzim yang sangat berpotensi di dunia industri. Enzim kitinolitik dapat dimanfaatkan di berbagai aplikasi, seperti produksi kitooligosakarida dan N-asetilglukosamin, persiapan protein sel tunggal, isolasi protoplas dari jamur, biokontrol jamur patogen, dan berpotensi untuk mengendalikan larva nyamuk Aedes aegypti (Dahiya et al. 2006). Enzim kitinase termasuk ke dalam enzim kelas hidrolase karena saat terjadinya reaksi enzimatis akan diperoleh hasil samping berupa air. Berbagai organisme menghasilkan aneka jenis kitinase dengan spesifitas substrat dan karakteristik yang bervariasi. Bakteri menghasilkan kitinase sebagai sarana memperoleh nutrisi dan agen parasitisme, sedangkan fungi, protozoa, dan invertebrata menghasilkan enzim untuk proses morfogenesis. Tanaman menghasilkan kitinase untuk mempertahankan diri dari serangan patogen. Kitinase dari organisme laut berperan dalam proses daur ulang kitin (Zeki dan Muslim 2010; Dahiya et al. 2006; Thiagarajan et al. 2011).
Enzim kitinase dikelompokkan menjadi dua berdasarkan tempat dihasilkannya, yaitu endokitinase dan eksokitinase. Endokitinase dapat menghidrolisis kitin secara acak dari bagian dalam dan menghasilkan kitooligomer. Eksokitinase terdiri atas β-N-asetilheksoaminidase dan kitobiohidrolase. Enzim β-N-asetilheksoaminidase dapat menghidrolisis kitin secara berurutan dari ujung non reduksi menghasilkan N-asetilglukosamin sedangkan kitobiohidrolase dapat menghidrolisis kitin secara berurutan dari ujung non reduksi menghasilkan kitobiosa sebagai produk akhir (Patil et al. 2000).
Isolat Bacillus sp. BPPT CC 2 merupakan isolat yang diperoleh dari hasil penapisan dari air di Sumatera Utara. Isolat ini berbentuk batang dan berpotensi sebagai penghasil enzim kitinase. Optimasi telah dilakukan untuk produksi N-asetilglukosamin menggunakan enzim kitinase yang berasal dari Bacillus sp. BPPT CC 2. Rendemen tertinggi sebanyak 99.41% dari hasil hidrolisis 3% substrat koloidal kitin dengan 0.2 U enzim pada kondisi pH 7.0 dan suhu 37°C selama 5 hari (Maggadani 2012). Hasil tersebut mengindikasikan bahwa enzim kitinase dari Bacillus sp. BPPT CC 2 dapat digunakan untuk biokonversi kitin menjadi N-asetilglukosamin dengan rendemen yang tinggi untuk kepentingan industri. Pemanfaatan dan potensi isolat Bacillus sp. BPPT CC 2 sebagai penghasil enzim kitinase sampai saat ini masih terus dilakukan.
2
memberikan informasi mengenai kondisi optimum enzim kitinase sehingga dapat dimanfaatkan lebih lanjut dalam skala laboratorium maupun skala industri.
METODE
Bahan dan Alat
Penelitian ini menggunakan isolat Bacillus sp. BPPT CC 2 yang berasal dari Laboratorium Teknologi Bioindustri LAPTIAB Puspiptek. Bahan yang digunakan untuk produksi enzim adalah media Luria Bertani (pepton 1%, yeast esxtract 0.5%, dan NaCl 0.5%) dan substrat koloidal kitin 5%. Bahan yang digunakan untuk uji aktivitas adalah reagen DNS (asam dinitrosalisilat), standar N-asetilglukosamin, buffer fosfat 0.05 M, dan koloidal kitin 1%. Bahan yang digunakan untuk purifikasi dan karakterisasi adalah ammonium sulfat, membran tubing selulosa D9777, bovine serum albumin (BSA), phosphate buffer saline (PBS), buffer (sitrat, fosfat, dan Tris-Cl), beberapa ion logam (Ca2+, Mg2+, Mn2+, Zn2+), EDTA (Ethylene Diamine Tetraacetic Acid), air reverse osmosis (RO), dan marker SDS PAGE.
Peralatan yang digunakan dalam penelitian ini antara lain erlenmeyer, gelas piala, labu ukur, hot plate, sentrifuse, pH meter, vortex, thermomixer, spektrofotometer UV-Vis, rotary shaker inkubator, lemari pendingin, perangkat elektroforesis, autoklaf, laminar air flow, penangas air, mikropipet, tabung vial (Eppendorf), dan magnetic stirer.
Metode
Pembuatan Substrat Koloidal Kitin
Serbuk kitin sebanyak 5 gram ditambahkan ke dalam 60 mL HCl pekat dan diaduk selama 16 jam pada suhu 4ºC. Campuran tersebut dimasukkan ke dalam 2 L etanol 95% dan diaduk selama semalam pada suhu 4ºC. Campuran tersebut dipisahkan dengan vakum. Endapan yang diperoleh dicuci dengan RO hingga netral (pH 7). Kemudian larutan koloidal kitin (5%) disimpan pada suhu 4ºC (Wen et al. 2002).
Produksi Enzim
Sebanyak 2-3 ose kultur Bacillus sp. BPPT CC 2 dari agar miring diinokulasikan pada media 5 mL LB cair dan diinkubasi pada suhu 37ºC selama semalam. Hasil inkubasi tersebut diinokulasi sebanyak 1 mL ke dalam 9 mL media starter LB dan diinkubasi selama 6 jam pada suhu 37ºC. Media starter
3
Analisis Kadar Protein
Pengujian kadar protein dilakukan setelah pembuatan kurva standar. Kurva standar dibuat dari standar BSA dengan konsentrasi 0-8 mg/mL. Sampel sebanyak 20 µL direaksikan dengan 180 µL larutan PBS dan 2 mL reagen Lowry lalu divorteks dan diinkubasi selama 10 menit pada 37ºC. Kemudian pereaksi ditambahkan Follin Ciocalteu 200 µL dan diinkubasi 30 menit hingga terjadi perubahan warna dari bening menjadi biru. Absorbansi diukur pada panjang gelombang 750 nm (Lowry 1951).
Pengendapan Ammonium Sulfat
Esktrak enzim kasar yang telah diperoleh diendapkan dengan variasi konsentrasi dari ammonium sulfat (20%, 40%, 60%, dan 80%). Penambahan ammonium sulfat dilakukan pada suhu 4ºC dan diaduk selama 1 jam dan disentrifuse dengan kecepatan 3000 rpm selama 10 menit pada suhu 4ºC. Pelet yang diperoleh diresuspensi dengan buffer fosfat 0,05 M pH 7 dengan perbandingan 1:2 (b/v) (Baehaki et al. 2012).
Dialisis
Enzim yang telah diendapkan dengan ammonium sulfat kemudian dimurnikan lebih lanjut dengan dialisis. Membran tubing selulosa yang digunakan untuk dialisis sebelumnya dicuci dengan air RO untuk menghilangkan kontaminan seperti gliserol. Enzim yang telah diresuspensi kemudian dimasukkan ke dalam membran dialisis dengan ukuran 12,4 kDa dan diinkubasi dalam buffer fosfat 0,05 M pH 7 selama 12-16 jam pada suhu 4ºC (Baehaki et al. 2012).
Uji Aktivitas Enzim
Aktivitas kitinase dianalisis dengan penentuan gula pereduksi. Uji aktivitas dilakukan dengan mencampurkan 0.3 mL koloidal kitin 1% pH 7 dan 0.3 mL enzim dan diinkubasi selama 30 menit pada suhu 37ºC. Reaksi hidrolisis dihentikan dan dianalisis dengan penambahan 0.6 mL reagen DNS. Campuran tersebut kemudian disentrifuse pada kecepatan 14.000 rpm selama 5 menit. Supernatan kemudian diambil dan diinkubasi pada air mendidih selama 15 menit. Aktivitas enzim diukur pada panjang gelombang 540 nm. Satu unit aktivitas kitinase didefinsikan sebagai jumlah enzim yang dibutuhkan untuk menghasilkan 1 µmol gula pereduksi N-asetilglukosamin yang terdeteksi dalam 1 menit (Miller 1959)
Penentuan Suhu dan pH Optimum
Penentuan suhu dan pH optimum dilakukan dengan metode Miller termodifikasi. Suhu yang digunakan pada penelitian ini yaitu suhu 30-60ºC dengan interval 5ºC, sedangkan pH yang digunakan yaitu pH 3-9 dengan interval 1 unit (Baehaki et al. 2012).
SDS PAGE dan Zimogram untuk Identifikasi dan Penentuan Bobot Molekul
SDS PAGE dilakukan sesuai dengan metode Laemmli. Standar protein yang digunakan yaitu standar low molecular weight (LMW) yang terdiri atas fosforilase b (97 kDa), BSA (66 kDa), ovalbumin (45 kDa), carbonic anhydrous
4
atas stacking gel (5%) dan separating gel (12%). Gel dielektroforesis dengan tegangan 150 V dan 100 A selama 90 menit. Setelah itu, gel diwarnai dengan
Page Blue selama 30 menit dan dicuci dengan air RO sampai pita protein terlihat (Laemmli et al. 1970).
Zimogram dilakukan sebagai berikut: sampel enzim ditambahkan ke dalam SDS PAGE sampel buffer dan diinkubasi pada suhu optimum selama 1 menit. Gel terdiri atas stacking gel (5%) dan separating gel (12%). Enzim dipisahkan dengan separating gel yang mengandung 0,1% glikol kitin. Setelah dielektroforesis, gel direndam dengan 2,5% Triton X-100 selama 1 jam. Kemudian gel direndam pada buffer dengan suhu dan pH optimum selama 30 menit dan diinkubasi selama 15 menit pada suhu 40C. Pewarnaan gel dilakukan dengan perendaman menggunakan 0,1% congo red selama 30 menit dan dicuci dengan NaCl 1 M hingga zona bening terlihat. Setelah itu ditambahkan HCl 1M (Laemmli et al. 1970; Flint et al. 1994).
Pengaruh Ion Logam dan Penentuan Parameter Kinetika
Ion logam yang digunakan adalah Ca2+, Mg2+, Mn2+, Zn2+, dan EDTA dengan konsentrasi 5 mM dan 10 mM. Kompleks enzim dan ion logam diinkubasi pada suhu ruang selama 1 jam dan diuji aktivitasnya dengan metode Miller termodifikasi. Konsentrasi substrat koloidal kitin yang digunakan untuk penentuan parameter kinetika divariasikan mulai dari 0.2%; 0.4%; 0.6%; 0.8%; 1%; 1.2%; dan 1.4%. Aktivitas enzim diuji dengan metode Miller termodifikasi (Baehaki et al. 2012).
HASIL
Isolasi dan Pemurnian Parsial Kitinase
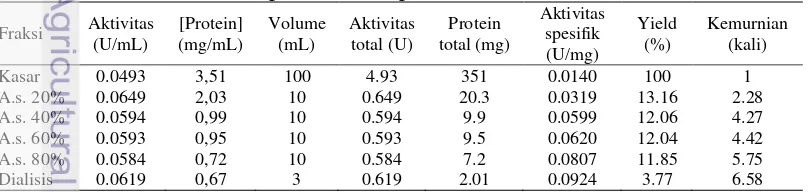
Ekstrak kasar enzim kitinase diperoleh dari isolat Bacillus sp. BPPT CC 2 setelah difermentasi selama 5 hari dalam media LB yang mengandung koloidal kitin 1% (Sugiarto 2012). Berdasarkan hasil penelitian, aktivitas sepsifik enzim kasar kitinase yang diperoleh sebesar 0.0140 U/mg. Setelah enzim diisolasi, kemudian diendapkan menggunakan ammonium sulfat dengan konsentrasi 20%; 40%; 60%; dan 80%. Tabel 1 menunjukkan aktivitas spesifik dan tingkat kemurnian tertinggi terdapat pada fraksi ammonium sulfat dengan kejenuhan 80%, masing-masing sebesar 0.0807 U/mg dan 5.75 kali. Langkah selanjutnya yaitu memurnikan enzim dari fraksi ammonium sulfat 80% dengan dialisis menggunakan membran tubing selulosa. Aktivitas spesifik dan kemurnian enzim kitinase meningkat sebesar 0.0924 U/mg dan 6.58 kali setelah dialisis.
Tabel 1Aktivitas kitinase tiap fraksi hasil pemurnian
Suhu dan pH Optim isolat Bacillus sp. BPP
Gambar untuk enzim kitinase berfungsi secara optima g digunakan dalam penelitian ini yaitu suhu ondisi optimum yang diperoleh dari isolat Bacillus
55ºC (Gambar 1a). Nilai pH yang digunakan pada an interval 1 unit. Kondisi pH optimum yang
PPT CC 2 yaitu pada pH 5 (Gambar 1b).
bar 1 Suhu (a) dan pH (b) optimum enzim kitina
Molekul Enzim berdasarkan SDS PAGE dan
r dan semi murni ditentukan bobot molekulnya rnaan Page Blue digunakan untuk pewarnaa m menggunakan pewarnaan Congo Red. Enzi lkan oleh Bacillus sp. BPPT CC 2 memiliki etelah dikonfirmasi dengan menggunakan me
oregram sumur (1) marker low molecular weight
6
Pengaruh Ion Logam
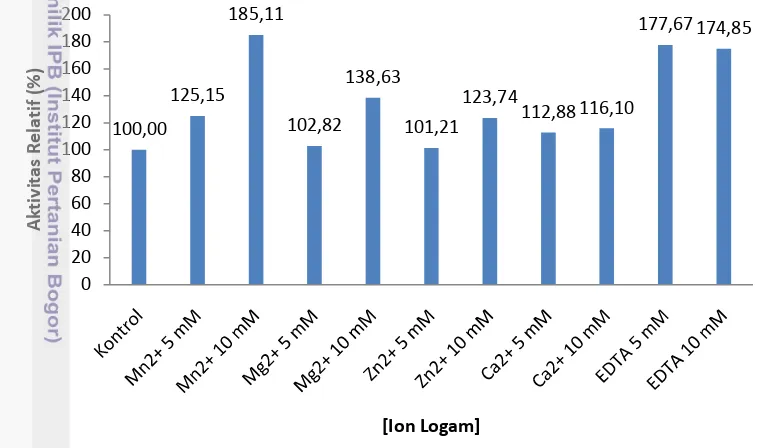
Hasil uji pengaruh penambahan ion logam dan EDTA terhadap aktivitas enzim kitinase Bacillus sp. BPPT CC 2 disajikan pada Gambar 3. Ion logam yang digunakan yaitu Mn2+, Mg2+, Zn2+, Ca2+, dan EDTA dengan konsentrasi 5 mM dan 10 mM. Berdasarkan uji statistik (Lampiran 6) dan Gambar 3, penambahan ion logam Mg2+ dan Zn2+ dengan konsentrasi 5 mM tidak berpengaruh terhadap peningkatan aktivitas enzim kitinase. Penambahan ion logam Ca2+ dengan konsentrasi 5 mM dan 10 mM juga tidak berpengaruh terhadap aktivitas enzim kitinase. Ion logam Mg2+ (10 mM), Mn2+, Zn2+ (10 mM), dan EDTA dapat meningkatkan aktivitas enzim kitinase. Peningkatan aktivitas enzim kitinase tertinggi yaitu dengan penambahan ion logam Mn2+ dengan konsentrasi 10 mM.
Gambar 3 Pengaruh ion logam terhadap aktivitas kitinase
Parameter Kinetika Enzim Kitinase
7
Gambar 4 Kurva Michaelis Menten
Gambar 5 Kurva konsentrasi substrat terhadap aktivitas enzim (Lineweaver Burk)
PEMBAHASAN
Produksi dan Purifikasi Enzim Kitinase
Produksi kitinase dilakukan pada media LB cair yang mengandung 1% koloidal kitin (Sugiarto 2012). Pemanenan dilakukan dengan cara sentrifugasi dengan kecepatan 13000 rpm selama 5 menit pada suhu 4ºC. Metode analisis aktivitas kitinase menggunakan metode DNS (3,5-Dinitrosalicylic acid). Enzim kitinase akan menghidrolisis koloidal kitin dan menghasilkan gula pereduksi berupa N-asetilglukosamin. Reaksi ini dihentikan dengan penambahan DNS. Gula pereduksi (N-asetilglukosamin) akan bereaksi dengan DNS dan menghasilkan warna kuning kecoklatan.
Setelah enzim kasar diperoleh, proses purifikasi selanjutnya adalah dengan pengendapan ammonium sulfat. Tahap ini berfungsi untuk meningkatkan konsentrasi protein enzim, mereduksi volume larutan enzim, dan memisahkan protein target dari sebagian kontaminan. Kitinase diperoleh dengan cara sentrifugasi karena enzim akan mengendap. Pelet yang diperoleh dilarutkan dengan buffer fosfat 0.05 M pH 7 untuk menjaga kestabilan enzim. Tabel 1 menunjukkan bahwa pengendapan enzim yang menghasilkan aktivitas spesifik
8
tertinggi pada fraksi 80%. Hal tersebut dikarenakan pada fraksi 60-80% kontaminan yang terdapat pada enzim semakin berkurang. Aktivitas spesifik pada fraksi 60-80% sebesar 0.0807 U/mg dengan tingkat kemurnian 5.75 kali.
Tahap pemurnian selanjutnya adalah dialisis yang memiliki prinsip untuk memisahkan molekul berdasarkan ukuran molekul melalui membran semi permeabel. Membran dialisis yang digunakan adalah membran tubing selulosa dengan MWCO (molecular weight cut off) 12,4 kDa. Penggunaan membran
tubing selulosa ini diharapkan molekul yang berukuran di atas 12,4 kDa tetap berada dalam membran dialisis sedangkan kontaminan yang berukuran di bawah 12,4 kDa akan keluar dari membran dialisis. Enzim kitinase memiliki bobot molekul berkisar antara 60 – 168 kDa (Anindyaputri 2010; Songsiriritthigul et al.2010; Stefanidi dan Vorgias 2008). Pada tahap dialisis ini aktivitas spesifik yang diperoleh meningkat hingga 0.0924 U/mg. Rendemen yang dihasilkan sekitar 3.77% dengan tingkat kemurnian 6.58 kali (Tabel 1). Beberapa kitinase juga mengendap dengan baik menggunakan ammonium sulfat pada konsentrasi 80%, misalnya pada kitinase yang dihasilkan oleh Diospyros kaki dan bakteri termofilik Ralstonia sp. A-471 (Zhang et al. 2013; Ueda et al. 2005).
Suhu dan pH Optimum Enzim Kitinase
Suhu merupakan salah satu faktor yang mempengaruhi kinerja enzim. Kebanyakan enzim mengalami denaturasi pada suhu antara 40-70ºC. Gambar 1a menunjukkan pengaruh suhu terhadap aktivitas kitinase. Kitinase yang dihasilkan memiliki aktivitas optimum pada suhu 55ºC dengan aktivitas spesifik sebesar 0.2193 U/mg. Aktivitas enzim meningkat pada suhu optimum karena terjadi peningkatan energi kinetik yang mempercepat gerak rotasi substrat dan enzim sehingga memperbesar peluang keduanya untuk saling bertumbukan. Suhu yang lebih besar dari suhu optimum menyebabkan protein enzim mengalami perubahan konformasi yang menyebabkan aktivitasnya berkurang. Menurut Yurnaliza (2008) kitinase yang dihasilkan Streptomyces RKt-5 memiliki aktivitas optimum pada 50ºC, Beavuveria bassiana pada suhu 50ºC (Lawati 2013), dan Bacillus sp. NCTU2 pada suhu 50-60ºC (Wen et al. 2002).
Aktivitas enzim juga sangat bergantung pada pH karena adanya hubungan antara keadaan ionisasi dari asam amino penyusun enzim dengan sisi aktifnya. Gambar 1b menunjukkan pengaruh pH terhadap aktivitas kitinase. Kitinase yang dihasilkan memiliki aktivitas optimum pada pH 5 dengan aktivitas spesifik sebesar 0.2818 U/mg dan terjadi penurunan aktivitas saat pH 6. Menurut Yurnaliza (2008) kitinase yang dihasilkan Streptomyces RKt-5 memiliki aktivitas optimum pada pH 5.5, Beavuveria bassiana pada pH 4 (Lawati 2013), Bacillus sp. NCTU2 pada pH 7 (Wen et al. 2002), dan Enterobacter sp. NRG4 pada pH 5,5 (Dahiya et al. 2005)
9
Identifikasi Bobot Molekul Enzim berdasarkan SDS PAGE dan Zimogram
Sampel enzim fraksi dialisis dan ekstrak kasar dianalisis dengan teknik SDS PAGE. Konsentrasi stacking gel yang digunakan yaitu 5% sedangkan konsentrasi
separating gel yang digunakan sebesar 12%. Gel akrilamid terbentuk akibat terjadinya proses polimerisasi akrilamida dengan metilenbisakrilamida dan amonium persulfat sebagai katalisator (Janson dan Ryden 1998). Fungsi penambahan SDS pada pembuatan gel yaitu untuk mengikat bagian hidrofobik pada protein, sehingga molekul terurai dari lipatannya dan muatan protein tersebut sama. Muatan yang sama bertujuan agar protein terpisah berdasarkan perbedaan bobot molekul (Lawati 2013). Bobot molekul pita protein yang dihasilkan pada enzim kasar masih banyak karena terdapat kontaminan. Namun setelah proses dialisis, diperoleh sebanyak 7 pita dengan bobot molekul 103 kDa, 43 kDa, 40.2 kDa, 37.8 kDa, 30.3 kDa, 25.4 kDa, dan 23.6 kDa. Enzim kitinase yang diperoleh diprediksi memiliki bobot molekul sebesar 103 kDa. Hal ini dapat dibuktikan dengan hasil zimogram pada Gambar 2. Beberapa penelitian menunjukkan enzim kitinase memiliki bobot molekul berkisar antara 60 – 168 kDa (Anindyaputri 2010; Songsiriritthigul et al.2010; Stefanidi dan Vorgias 2008).
Zimogram merupakan salah satu teknik elektroforesis yang digunakan untuk mengidentifikasi aktivitas enzim yang dipisahkan dalam gel poliakrilamida. Prinsip zimogram hampir sama dengan teknik elektroforesis, namun yang membedakannya yaitu penggunaan substrat yang disertakan dalam separating gel, penggunaan buffer renaturasi agar protein sisi katalitik enzim aktif, dan waktu inkubasi untuk enzim menghidrolisis substrat pada suhu dan pH optimum. Visualisasi gel umumnya diwarnai dengan congo red dan aktivitas enzim ditunjukkan dengan adanya zona bening dimana substrat telah didegradasi oleh enzim (Kleiner dan Stevenson 1997). Substrat yang sering digunakan pada zimogram kitinase yaitu glikol kitin. Keuntungan penggunaan zimogram yaitu dapat menganalisa aktivitas enzim secara sederhana, sensitif, dan dapat dikuantitasi (Leber dan Balkwil 1997).
Pengaruh Ion Logam terhadap Aktivitas Enzim Kitinase
10
Peningkatan aktivitas tertinggi yaitu pada penambahan ion logam Mn2+ dengan konsentrasi 10 mM dan EDTA dengan konsentrasi 5 mM dan 10 mM. Ion logam Mn2+ dapat berperan sebagai kofaktor yang efektif untuk meningkatkan aktivitas enzim kitinase dengan aktivitas spesifik sebesar 0.1723 U/mg. Lawati (2004) juga melaporkan aktivitas enzim kitinase yang dihasilkan oleh Beauveria bassiana meningkat setelah penambahan ion logam Mn2+ dengan konsentrasi 10 mM. Beberapa bakteri penghasil kitinase seperti isolat bakteri C4 dan Bacillus
MH-1 juga mengalami peningkatan aktivitas setelah penambahan ion logam Mn2+ (Yong et al. 2005; Sakai et al. 1998).
Penambahan EDTA dapat meningkatkan aktivitas kitinase sebesar 0.1131 U/mg. EDTA dapat meningkatkan aktivitas kitinase karena EDTA dapat bersifat sebagai pengkelat ion logam bivalen yang berikatan pada enzim (metaloenzim), seperti Hg2+, Cu2+, dan Co2+ sehingga dapat mengaktifkan sisi katalitik enzim kitinase. Hal ini sesuai dengan beberapa penelitian yang menunjukkan adanya daya inhibisi dari ion logam Hg2+ terhadap aktivitas kitinase yang dihasilkan oleh
Diospyros kaki, Bacillus sp. DAU101, dan Streptomyces sp. M-20 (Zhang et al.
2013; Lee et al. 2006; Kim et al. 2002). Aktivitas kitinase dari Bacillus sp. Hu1 menurun setelah penambahan ion logam Cu2+ dengan konsentrasi 4 mM, sedangkan bakteri T5a1 asal terasi menurun setelah penambahan ion logam Cu2+ dan Co2+ dengan konsentrasi 1 mM (Dai et al. 2011; Noviendri et al. 2008). Purwani (2004) melaporkan bahwa bakteri termostabil Bacillus sp. 13.26 yang berasal dari Indonesia, memiliki jenis kitinase yang berbeda, karena dapat diaktivasi dengan kation Mg2+, dihambat dengan Ca2+, dan sangat sensitif dengan adanya Mn2+ dan Co2+ yang dapat menginaktivasi enzim kitinase dengan konsentrasi 2 mM.
Parameter Kinetika Enzim Kitinase
Persamaan linier Lineweaver-Burk digunakan untuk menentukan konstanta kinetika kitinase dari Bacillus sp. BPPT CC 2. Gambar 4 menunjukkan pengaruh konsentrasi koloidal kitin terhadap aktivitas spesifik kitinase. Aktivitas enzim pada konsentrasi koloidal kitin rendah meningkat secara liniear terhadap konsentrasi namun pada konsentrasi melebihi 1.0%, laju peningkatan aktivitas enzim mengalami penurunan secara progresif terhadap konsentrasi. Konsentrasi substrat yang amat rendah menyebabkan reaksi amat rendah tetapi kecepatan akan meningkat dengan meningkatnya konsentrasi substrat. Pada akhirnya akan tercapai titik batas dan setelah titik ini dilampaui, kecepatan reaksi hanya akan meningkat sedemikian kecil dengan bertambahnya konsentrasi substrat. Pada batas inim enzim menjadi jenuh oleh substratnya dan tidak dapat berfungsi lebih cepat (Nelson and Cox 2008).
Penentuan nilai Km dan Vmaks secara lebih tepat dan mudah dilakukan
dengan memanfaatkan persamaan Lineweaver-Burk (Gambar 5). Persamaan yang diperoleh adalah y = 2573x + 3697 dengan nilai r2 sebesar 0.987 sehingga kecepatan maksimum aktivitas kitinase sebesar 2.705x10-4 mg/L detik dan Km
sebesar 0.6959 mg/L. Semakin rendah nilai Km maka semakin kuat ikatan antara
enzim dan substrat. Kecepatan reaksi suatu enzim pada setiap konsentrasi dapat dihitung dengan mengetahui nilai Km dan Vmaks. Selain itu nilai Km dapat
11 yang berarti dapat diketahui kesesuaian enzim dengan substrat yang diberikan (Winarno 1999). Nilai Km yang diperoleh dari enzim Bacillus sp. BPPT CC 2
menunjukkan nilai yang lebih besar jika dibandingkan Km enzim kitinase
Beauveria bassiana sebesar 0.225 mg/L yang telah dilakukan Lawati (2013). Nilai kitinase dari isolat Bacillus sp. BPPT CC 2 yang lebih besar menunjukkan bahwa enzim kitinase kurang kompleks terhadap substrat dan afinitas enzim terhadap substrat lebih kecil.
SIMPULAN
Enzim kitinase yang dihasilkan oleh isolat Bacillus sp. BPPT CC 2 terendapkan dengan baik pada pengendapan 80% amonium sulfat dengan aktivitas spesifik sebesar 0.0807 U/mg dengan kemurnian 5.75 kali. Suhu dan pH optimum untuk kitinase yaitu 55ºC dan pH 5. Nilai Km dan Vmaks yang diperoleh yaitu
2.705x10-4 mg/L detik dan 0.6959 mg/L. Bobot molekul kitinase diprediksi sebesar 103 kDa. Penambahan ion logam Mn2+ dengan konsentrasi 10 mM dapat meningkatkan aktivitas spesifik kitinase secara optimal.
DAFTAR PUSTAKA
Anindyaputri A. 2010. Identifikasi Molekuler Bakteri Pengurai Kitin Serangga dan Karakterisasi Enzim Kitinasenya [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Baehaki A, Suhartono MT, Sukarno, Syah D, Sitanggang AB. 2012. Purifikasi dan Karakterisasi Kolagenase dari Bacillus licheniformis F11.4 [tesis]. Bogor (ID): Institut Pertanian Bogor.
Dai DH, Hu WL, Huang GR, Li W. 2011. Purification and charazterization of a novel extracellular chitinase from thermophilic Bacillus sp. Hu1. African Journal of Biotechnology 10 (13): 2476-2465.
Dahiya N, Tewari R, Hoondal GS. 2005. Chitinase from Enterobacter sp NRG4: its purification, characterization, and reaction pattern. Electronic Journal of Biotechnology 8 (2): 134-145.
Dahiya N, Tewari R, Hoondal GS. 2006. Biotechnological and aspects of chitinolytic enzymes: a review. Applied Microbiology and Biotechnology 71 (6): 773-782.
Dutta PK, Dutta J, Tripathi VS. 2004. Chitin and chitosan: chemistry, properties, and application. Journal of Scientific and Industrial Research 63: 20-31. Flint HJ, Zhang JX, Martin J. 1994. Multiplicity and expression of xylanases in
the rumen cellulolytic bacterium Ruminococcus flavefaciens Curr.
Microbial J. 9: 139-143.
Gohel V, Singh A, Vimal M, Ashwini P, Chhatpar HS. 2006. Bioprospecting and anti fungal of chitinolytic microorganism. African Journal of Biotechnology
5 (2): 54-72.
12
Kleiner DE, Stevenson WG. 1997. Quantitative zymography: detetction of picogram quantitive of gelatinases. Anal Biochem 228: 325-329.
Laemmli UK. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227 (5259): 680–685.
Lawati N. 2012. Pemurnian parsial dan karakterisasi enzim kitinase dari
Beauveria bassiana [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Leber TM, Balwil FR. 1997. Zimography: a single step staining method for quantitative of proteloytic activity on substrats gel. Biochem 249: 24-28. Lee YS, Park IH, Yoo JS, Chung SY, Lee YC, Cho YS, Ahn SC, Kim CM, Choi
YL. 2006. Cloning, purification, and characterization of chitinase from
Bacillus sp. DAU101. Biosource Technology 98: 2734-2741.
Lowry OH, Roserbrough NJ, Farr AL, Randall RJ. 1951. Protein measurement with the folin phenol reagen. J Biol Chem. 5: 265-275.
Maggadani, BP. 2012. Optimasi Produksi N-asetilglukosamin dari Kitin Menggunakan Kitinase Hasil Isolasi Bakteri [tesis]. Depok (ID): Universitas Indonesia.
Miller GL. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal Chem. 31 (2): 426-428.
Nelson LD, Cox MM. 2008. Lehninger: Principles of Biochemistry, 5th Ed. New York (US): W. H. Freeman and Co.
Noviendri D, Fawzya YN, Chasanah E. 2008. Karakteristik dan sifat kinetika enzim kitinase dari isolat bakteri T5a1 asal terasi. Jurnal Pascapanen dan Bioteknologi Kelautan dan Perikanan 3 (2): 123-129.
Patil RS, Ghormade V, DeshpandeMV. 2000. Chitinolytic enzymes: an exploration. Enzyme and Microbial Technology 26: 473-483.
Puwarni EY, Suhartono MT, Rukayadi Y, Jae KH, Yu RP. 2004. Characteristics of thermostable chitinase enzymes from the indonesian Bacillus sp. 13.26.
Elsevier
Sakai K, Yakota A, Kuwokawa H, Mamoru W, Mitsuaki M, Moriguchi M. 1998. Purification and characterization of three thermostable endochitinase of
Bacillus noble strain MH-1 isolated from chitin containing compost. J Appl Environ Microbiol. 64: 3340-3391.
Songsiriritthigul C, Lapboonrueng S, Pechsrichuang P. 2010. Expression and characterization of Bacillus licheniformis chitinase (ChiA), suitable for bioconversion of chitin waste. Bioresource Technology 101: 4096-4103. Stefanidi E, Vorgias CE. 2008. Molecular analysis of gene encoding a new
chitinase from marine psychrophilic bacterium Moritella marina and bichemical characterization of recombinant enzyme. Springer 56 (2): 234-244.
Sugiarto, OK. 2012. Variasi Media Produksi untuk Optimasi Enzim Kitinase dari
Bacillus sp. BPPT CC 2 [laporan praktik lapang]. Bogor (ID): Institut Pertaninan Bogor.
Thiagarajan V, Revathi R, Aparajini K, Sivamani P, Girilai M, Priya CS, Kalaichelven T. 2011. Extra cellular chitinase production by Streptomyces
13 Triana R. 2013. Pemurnian dan karakterisasi enzim glukosa oksidase dari isolat
lokal Aspergillus niger (IPBCC.08.610) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Trudel J, Asselin A. 1990. Detection of chitin deacetylase activity after polyacrilamide gel electrophoresis. Anal Biochem. 189 (2) : 249-253. Ueda M, Kotani Y, Sutrisno A, Nakazawa M, Miyatake K. 2005. Purification and
characterization of chitinase b from moderately thermophilic bacterium
Ralstonia sp. A-471. Biosci Biotechnol Biochem. 69 (4): 842-844.
Wen CM, Tseng CS, Li YK. 2002. Purification, characterization, and clonning of a chitinase from Bacillus sp. NCTU2. Biotechnol Appl Bichem. 35: 213-219. Winarno FG. 1999. Enzim Pangan. Jakarta (ID): Gramedia Pustaka Utama.
Yong T, Hong J, Zhangfu L, Li Z, Xiuqiong D, Shaorong G, Shigui L. 2005. Purification and characterization of an extracellular chitinase produced by bacterium C4. Annals of Microbiology 55 (3): 213-218.
Yurnaliza, Margino S, Sembiring L. 2008. Kondisi optimum untuk produksi kitinase dari Streptomyces Rkt5 dan karakterisasi pH dan suhu enzim. Biota
13 (3): 169-174.
Zeki NH, Muslim SN. 2010. Purification, characterization and antifungal activity of chitinase from Serratia marcescens isolated from fresh vegetables.Ibn Al-Haitham Journal for Pure and Appl Sci. 23(1): 23-30.
14
Lampiran 1 Diagram alir penelitian
Inokulasi bakteri dari agar miring ke media starter
Inokulasi bakteri dari media starter
ke media produksi
Isolasi enzim
Presipitasi ammonium sulfat dan dialisis
Enzim kitinase semi murni
Karakterisasi suhu, pH, dan pengaruh ion logam
Identifikasi dan penentuan bobot molekul enzim berdasarkan SDS
PAGE dan zimogram
15
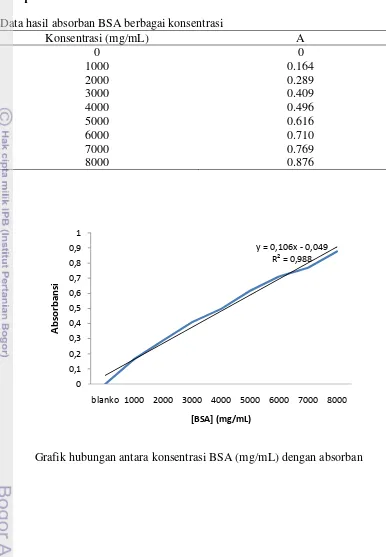
Lampiran 2 Kurva standar BSA
Data hasil absorban BSA berbagai konsentrasi
Konsentrasi (mg/mL) A
0 0
1000 0.164
2000 0.289
3000 0.409
4000 0.496
5000 0.616
6000 0.710
7000 0.769
8000 0.876
Grafik hubungan antara konsentrasi BSA (mg/mL) dengan absorban y = 0,106x - 0,049
R² = 0,988
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1
blanko 1000 2000 3000 4000 5000 6000 7000 8000
A
b
so
rb
a
n
si
16
Data hasil perhitungan konsentrasi protein berbagai fraksi
Fraksi enzim Absorban
kontrol
Absorban rata-rata
Absorban
terkoreksi [protein] (mg/mL)
Enzim kasar 0.0373 0.3603 0.323 3.51
Ammonium Sulfat 20% 0.0373 0.203 0.166 2.03
Ammonium Sulfat 40% 0.0373 0.093 0.056 0.99
Ammonium Sulfat 60% 0.0373 0.089 0.052 0.95
Ammonium Sulfat 80% 0.0373 0.065 0.027 0.72
Dialisis 0.0373 0.059 0.022 0.67
Persamaan kurva standar: у = 0.106 x – 0,049 keterangan: y = absorbansi
x = konsentrasi protein (mg/mL) Contoh absorbansi = 0.3603
Absorban kontrol = 0.0373
Absorban terkoreksi = 0.3603 – 0.0373 = 0.323
Contoh Perhitungan:
y = 0.106 x – 0.049 0.323 = 0.106 x – 0.049 0.106 x = 0.372
17
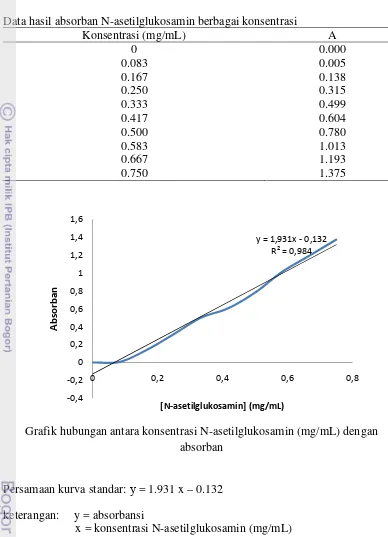
Lampiran 3 Kurva standar N-asetilglukosamin
Data hasil absorban N-asetilglukosamin berbagai konsentrasi
Konsentrasi (mg/mL) A
Grafik hubungan antara konsentrasi N-asetilglukosamin (mg/mL) dengan absorban
Persamaan kurva standar: у = 1.931 x – 0.132 keterangan: y = absorbansi
18
Contoh Perhitungan:
y = 1.931 x – 0.132 0.122 = 1.931 x – 0.132 x = 0.1315 mg/mL • Aktivitas enzim
Aktivitas U/mL = [Gula pereduksi]
!
"# x 1000 μg/mg x Faktor Pengencer
BM GlcNAc μg/μmol x Waktu inkubasi x Volume enzim
Aktivitas U/mL = 0.1315 x 1000 x 1221.2 x 30 x 0.3 = 0,0660
Aktivitas total (U) = Aktivitas x volume total fraksi = 0.0660 U/mL x 3 mL
= 0.1981
Protein total (mg) = Protein x volume total fraksi = 0.67 mg/mL x 3 mL
= 2.01 mg
Aktivitas spesi:ik ;mg< =U Aktivitas totalProtein total = 0.1981 U2.01 mg = 0.09858
• Yield
Yield % =Aktivitas total ekstrak kasar x 100%Aktivitas total
= 0.19814.9294 x 100% = 4.018%
• Kemurnian
19
Lampiran 4 Data hasil penentuan aktivitas kitinase berbagai fraksi
Fraksi Gula Keterangan: contoh perhitungan pada lampiran 3
Lampiran 5 Data hasil penentuan suhu optimum
Suhu (°C) Gula terbentuk Aktivitas spesifik (U/mg) Aktivitas rerata
Keterangan: contoh perhitungan pada lampiran 3
Berdasarkan data yang diperoleh, kitinase yang dihasilkan oleh Bacillus sp. BPPT CC 2 mencapai aktivitas optimum pada suhu 55°C dengan aktivitas spesifik sebesar 0.2193 U/mg.
Lampiran 6 Data hasil penentuan pH optimum
pH Gula terbentuk Aktivitas spesifik (U/mg) Aktivitas rerata
Keterangan: contoh perhitungan pada lampiran 3
20
Lampiran 7 Pengaruh ion logam
Ion logam Gula terbentuk Aktivitas spesifik (U/mg) Aktivitas rerata
1 2 1 2
Kontrol 0.0621 0.0588 0.0927 0.0877 0.0905
5 mM Mn2+ 0.0811 0.0723 0.1211 0.1079 0.1145
10 mM Mn2+ 0.1202 0.1108 0.1793 0.1653 0.1723
5 mM Mg2+ 0.0603 0.0642 0.0900 0.0958 0.0929
10 mM Mg2+ 0.0892 0.0816 0.1331 0.1218 0.1275
5 mM Zn2+ 0.0598 0.0626 0.0892 0.0935 0.0914
10 mM Zn2+ 0.0769 0.0746 0.1149 0.1114 0.1132
5 mM Ca2+ 0.0655 0.0720 0.0978 0.1075 0.1026
10 mM Ca2+ 0.0697 0.0720 0.1040 0.1075 0.1057
5 mM EDTA 0.1095 0.1118 0.1634 0.1669 0.1651
10 mM EDTA 0.1084 0.1092 0.1618 0.1630 0.1624 Keterangan: contoh perhitungan pada lampiran 3
ANOVA
Sum of Squares Df Mean Square F Sig.
Between Groups .084 10 .008 59.898 .000
Within Groups .002 11 .000
Total .085 21
Perlakuan N
Subset for alpha = 0.05
1 2 3 4 5
Tukey HSDa Kontrol 2 .188050
5 Zn2+ 2 .190450 .190450
5 Mg2+ 2 .193650 .193650 .193650
5 Ca2+ 2 .213900 .213900 .213900
10 Ca2+ 2 .220350 .220350 .220350 .220350
10 Zn2+ 2 .235750 .235750 .235750
5 Mn2+ 2 .238600 .238600
10 Mg2+ 2 .265650
10 EDTA 2 .338500
5 EDTA 2 .344150
10 Mn2+ 2 .359150
21
Lampiran 8 Parameter kinetika enzim kitinase
[koloidal
Contoh perhitungan pada koloidal kitin 0.2%
D EFGFHIJIK JFLMFKJNEKOI P − IQFJRSTSNEUQIVRK =[PWX]1800
22
Persamaan Line Weaverburk:
y = 2573 x + 3697 1
V\ =
K
V [s] +1 V1
1
v = 3697
V = 2.705 x 10Z^mg/L detik
K
V = 2573
Km = 0.6959 mg/L
Kemiringan:
K
V = 2.705 x 100.6959Z^= 2572.99
Intersep:
;[s] = 0,1 1v< = 0, 3697
21
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 15 Oktober 1991 di Jakarta dari ayahanda Tarto Saputro dan ibunda Tati Suprapti, sebagai anak keempat dari empat bersaudara. Penulis menempuh pendidikan di Tangerang, pada tahun 2009 penulis lulus dari SMA Negeri 1 Pamulang dan diterima sebagai mahasiswa di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) di Mayor Biokimia, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Selama menempuh pendidikan, penulis ditunjang oleh Beasiswa Bantuan Mahasiswa DIKTI.