MODIFIKASI SILIKA ASAL SEKAM PADI DENGAN
L-HISTIDINA SEBAGAI MEDIA PENGEKSTRAK ION
LOGAM TIMBAL(II) PADA EKSTRAKSI CAIR-PADAT
NURHAJAWARSI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Modifikasi Silika Asal Sekam Padi dengan L-Histidina sebagai Media Pengekstrak Ion Logam Timbal(II) pada Ekstraksi Cair-Padat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2016
Nurhajawarsi
RINGKASAN
NURHAJAWARSI. Modifikasi Silika Asal Sekam Padi dengan L-Histidina sebagai Media Pengekstrak Ion Logam Timbal(II) pada Ekstraksi Cair-Padat. Dibimbing oleh ETI ROHAETI dan MOHAMAD RAFI.
Timbal (Pb) merupakan salah satu logam berat yang berbahaya untuk kesehatan manusia, karena Pb tidak terdegradasi secara alami, dapat terakumulasi dalam sistem biologi dan toksik meskipun dalam konsentrasi yang rendah. Kadar Pb yang diperbolehkan dalam air minum oleh Kementerian Kesehatan Republik Indonesia adalah 0.01 ppm (Kemenkes RI 2010). Konsentrasi yang rendah ini menyebabkan penentuan Pb memerlukan metode yang sensitif atau harus melalui tahapan prakonsentrasi. Metode prakonsentrasi konvensional seperti ekstraksi cair-cair, kopresipitasi, penukar ion, dan filtrasi membran merupakan metode-metode yang tidak ekonomis karena membutuhkan banyak pelarut organik sehingga dapat menyebabkan polusi pada lingkungan. Metode prakonsentrasi yang sekarang banyak digunakan adalah ekstraksi fase padat (SPE) karena metode tersebut memiliki banyak kelebihan seperti: mudah digunakan, memiliki selektivitas tinggi, ekonomis (butuh sedikit pelarut), dan tidak membutuhkan waktu lama. Salah satu media pengekstrak yang digunakan dalam SPE adalah silika gel. Silika gel memiliki kelemahan yaitu rendahnya selektivitas dan efektivitas permukaan dalam berinteraksi dengan logam berat. Untuk mengatasi masalah ini, dibutuhkan penambahan gugus aktif untuk memodifikasi permukaan silika agar silika menjadi lebih selektif dalam mengikat ion Pb. Dalam penelitian ini L-histidina digunakan untuk memodifikasi silika.
Tujuan dari penelitian ini adalah untuk membuat media pengekstrak dari silika sekam padi yang termodifikasi L-histidina (SSLH) dan menentukan kapasitas adsorpsi dan selektivitas SSLH terhadap ion Pb(II). Pada penelitian ini
silika gel disintesis melalui proses sol-gel dengan penambahan larutan HCl 3M ke dalam larutan natrium silikat (Na2SiO3) setetes demi setetes. Na2SiO3 dihasilkan
dari destruksi abu sekam padi oleh larutan NaOH, pemanasan pada 500 ºC selama 30 menit. Silika sekam (SS) selanjutnya dimodifikasi dengan L-histidina dengan terlebih dahulu direaksikan dengan 3-aminopropiltrimetoksisilan (APTMS) untuk menghasilkan SSLH. SSLH selanjunya dikarakterisasi menggunakan FTIR dan digunakan untuk mengadsorpsi ion logam Pb(II). Rentang pH, massa adsorben, dan waktu kontak dioptimisasi menggunakan Metode Permukaan Respon (RSM).
Hasil penelitian menunjukkan bahwa kondisi optimum untuk adsorpsi Pb(II) oleh SSLH yaitu pada pH 5; massa adsorben 0.1 g; dan waktu kontak 15 menit. Kapasitas adsorpsi tertinggi untuk ion Pb(II) oleh SSLH adalah 62.5 mg/g. Pola adsorpsi matriks diketahui mengikuti persamaan Langmuir. Berdasarkan hasil uji selektivitas, penjerapan Pb(II) tidak dipengaruhi oleh adanya dua logam lain yaitu Cd(II) dan Zn(II). Persen adsorpsi Pb(II) oleh penjerapan SSLH lebih tinggi dibandingkan dengan penjerapan Cd(II) dan Zn(II)
SUMMARY
NURHAJAWARSI. Modification of Silica from Rice Husk with L-Histidina as Lead(II) Extractant in Liquid-Solid Extraction. Supervised by ETI ROHAETI and MOHAMAD RAFI.
Lead (Pb) is one of the most hazardous heavy metals for human health because it is non-biodegradable, could accumulate within biological systems, and toxic even at low concentration. A guideline for drinking water issued by the Ministry of Health of The Republic of Indonesia (2010) determines that the maximum Pb level is 0.01 ppm. This low permissible concentration makes direct determination of Pb difficult and requires a sensitive method or a preconcentration step. Conventional preconcentration methods include liquid-liquid extraction, co-precipitation, ion exchange, filtration membrane, etc. are considered uneconomical because they require a large amount of organic solvent causing environmental problems. Nowadays, solid phase extraction (SPE) has commonly been used as a preconcentration technique due to the advantages, such as ease of use, high selectivity, lower cost (requires less solvent), and less time. One of the most common extractant used in SPE is silica gel. Silica gel has some disadvantages, for example, low surface selectivity and effectiveness that will result in weak interaction with heavy metal ions. To solve this problem, it is needed an addition of active groups to modify the silica surfaces in order to make silica more selective in binding the Pb ions. In this research L-histidine was used to modify rice husk silica.
The aims of this research were to make extractant, L-Histidine-modified Rice Husk Silica (LHRHS), determine adsorption capacity and selectivity of LHRHS for Pb(II) ion. In this research, silica gel. Rice husk silica (RHS) was synthesized via sol-gel process by adding 3M hydrochloric acid solution to sodium silicate (Na2SiO3) drop by drop. The Na2SiO3 was generated from destructing rice husk
ash (RHA) with sodium hydroxide, heated at 500 ºC for 30 minutes. RHS was then modified with L-histidine by reacting it with 3-aminopropyltrimetoxysilane (APTMS) previously to procure LHRHS. The LHRHS was characterized by fourier transform infrared spectroscopy (FTIR) and used further to adsorp Pb(II) metal ion. The pH range, amount of adsorbent, and adsorption time were optimized by response surface method (RSM).
The results showed that the optimum condition for the adsorption of Pb(II) were pH 5; amount of adsorbent 0.1 g; and adsorption time 15 minutes. The adsorption capacity for Pb(II) ion was found to be 62.5 mg/g. The adsorption behavior of the matrix followed the Langmuir’s model. Based on the result of selectivity determination, Pb(II) adsorption was not influenced by the existence of two other metals, namely Cd(II) and Zn(II). Adsorption percentage of Pb(II) by SSLH were higher than Cd(II) and Zn(II) adsorption.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kimia
MODIFIKASI SILIKA ASAL SEKAM PADI DENGAN
L-HISTIDINA SEBAGAI MEDIA PENGEKSTRAK ION
LOGAM TIMBAL(II) PADA EKSTRAKSI CAIR-PADAT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2015 hingga Februari 2016 ini ialah media pengekstrak logam berat, dengan judul Modifikasi Silika Asal Sekam Padi dengan L-Histidina sebagai Media Pengekstrak Ion Logam Timbal (II) pada Ekstraksi Cair-Padat.
Terima kasih penulis ucapkan kepada Ibu Dr Eti Rohaeti, MS dan Bapak Dr Mohamad Rafi, MSi selaku pembimbing yang telah banyak meluangkan waktu dan pikiran hingga terselesaikannya tulisan ini. Terima kasih juga penulis sampaikan kepada Ibu Dr Henny Purwaningsih Suyuti, MSi selaku penguji luar komisi yang telah memberikan banyak saran yang membangun, kepada Ibu Prof Dr Dyah Iswantini, MScAgr selaku ketua Program Studi Magister Kimia, kepada Ibu Dr Gustini Sabirin MS selaku sekretaris Program Studi Magister Kimia serta seluruh dosen Pascasarjana Kimia atas segala bimbingan dan ilmu yang diberikan. Terima kasih penulis sampaikan kepada Direktorat Jenderal Pendidikan Tinggi (Dikti) Kementerian Pendidikan dan Kebudayaan yang telah memberikan bantuan dana berupa beasiswa BPPDN. Di samping itu, penghargaan penulis sampaikan kepada seluruh staf Laboratorium Kimia Analitik IPB (Bu Nunung, Om Eman, Pak Kosasih, dan Pak Dede), Laboratorium Bersama Kimia IPB (Pak Wawan, Mas Eko) yang telah membantu penulis selama penelitian. Tak lupa pula penulis ucapkan terima kasih kepada Bapak Dr Ir Irzaman Husein, MSi dari Departemen Fisika yang telah membantu penulis dalam penyediaan bahan penelitian berupa arang sekam padi. Terimakasih juga untuk sahabat-sahabatku, para pejuang (Dewi Pratiwi, Gustria Ernis, Ida Ayu Suci, Ina Ristian, dan Romi Seroja), seperjuangan dari tanah para Daeng (Nurul Ichsania, Stefani Bija, Kak Maryati, Engka Rukmana), teman-teman International Class Program of Chemistry angkatan 2008 UNM, teman-teman kos Karona Cantik dan para jelita Wisma Melati, serta teman-teman-teman-teman Pascasarjana Kimia angkatan 2013 atas motivasi dalam penyelesaian tesis ini.
Ungkapan terima kasih untuk yang teristimewa kepada Ayahanda Jamaludin R, Ibunda Nurhabibah S, Adinda Azharuni, keluarga besar, dan Dede Nurdiansah atas segala doa, bantuan baik moril atau materil serta kasih sayang yang diberikan kepada penulis. Ucapan terima kasih juga disampaikan kepada seluruh keluarga, rekan, dan sahabat yang tidak dapat penulis sebutkan satu persatu dan telah membantu dalam penyelesaian tesis ini. Penulis juga menyampaikan permohonan maaf apabila selama studi, selama pelaksanaan penelitian maupun penulisan tesis ini terdapat tutur kata, sikap maupun perbuatan yang kurang berkenan. Semoga hasil penelitian dan tulisan ini dapat bermanfaat sebagai bahan informasi dalam kemajuan ilmu pengetahuan alam dan teknologi.
Bogor, Oktober 2016
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
1 PENDAHULUAN
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 3
2 TINJAUAN PUSTAKA
Sekam Padi 3
Silika Gel 4
Modifikasi Permukaan Silika Gel 4
Isoterm Adsorpsi 6
Pencirian silika dengan FTIR dan XRD 7
Timbal(Pb) 8
3 METODE
Bahan 8
Alat 9
Waktu dan Tempat Penelitian 9
Prosedur Penelitian 9
4 HASIL DAN PEMBAHASAN
Hasil Sintesis Silika Sekam (SS), Aminopropilsilika (APS),
dan Silika termodifikasi L-Histidina (SSLH) 11
Analisis Difraksi Sinar-X 13
Analisis Gugus Fungsi 14
Kondisi Optimum Adsorpsi Pb(II) oleh SSLH 16
Kapasitas dan Isoterm Adsorpsi 18
Selektivitas SSLH dalam Penjerapan Pb(II) 21 5 SIMPULAN DAN SARAN
Simpulan 23
Saran 23
DAFTAR PUSTAKA 23
LAMPIRAN 27
DAFTAR TABEL
1 Kandungan kimia abu sekam padi 3
2 Karakteristik spektrum IR silika gel 7
3 Konsentrasi awal Pb(II), kapasitas adsorpsi, dan % adsorpsi SSLH 18 4 Perbandingan hasil kapasitas adsorpsi Pb(II) oleh adsorben berbasis
silika 19
5 Parameter-parameter adsorpsi SSLH terhadap Pb(II) 21 6 Perbandingan logam, konsentrasi terjerap, % adsorpsi 22
DAFTAR GAMBAR
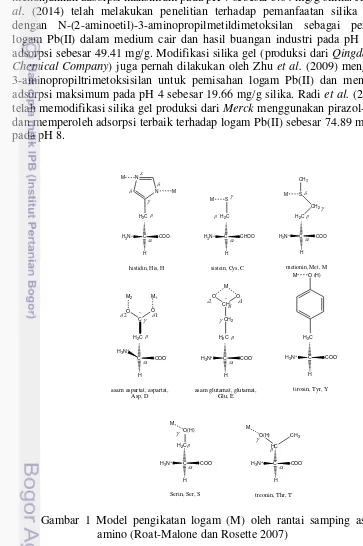
1 Model pengikatan logam oleh rantai samping asam-asam amino 5
2 Difraksi sinar-X silika sekam 14
3 Spektrum FTIR dari silika sekam (SS), aminopropilsilika (APS), dan
silika termodifikasi L-histidina (SSLH) 15
4 Kontur plot % adsorpsi Pb(II) oleh SSLH pada ragam pH, bobot
adsorben, dan waktu kontak 17
5 Isoterm adsorpsi pada asorpsi Pb(II) oleh SSLH model (a) Langmuir,
(b) Freundlich 20
DAFTAR LAMPIRAN
1 Diagram Alir Penelitian 28
2 Rancangan percobaan pengoptimuman CCD untuk adsorpsi Pb oleh
SSLH 29
3 Kurva kalibrasi larutan logam Pb, Cd, dan Zn 29
4 Data hasil estimasi koefisien regresi CCD mmenggunakan Minitab 16 31 5 Plot Pengoptimuman hasil pengolahan CCD menggunakan Minitab 16 32 6 Data hasil analisis isoterm Langmuir dan Freundlich adsorpsi Pb(II)
1
PENDAHULUAN
Latar Belakang
Timbal (Pb) merupakan salah satu logam berat yang dapat terakumulasi dalam tubuh manusia dan menimbulkan berbagai masalah kesehatan meskipun dalam kadar yang rendah. Penyakit yang bisa disebabkan oleh keracunan Pb antara lain ensefalopati, penurunan IQ, malfungsi ginjal, sistem reproduksi, hati, sistem saraf pusat, dan bahkan menyebabkan kematian (Manahan 2001; Sudarmadji et al. 2005; EPA 2015). Timbal merupakan logam yang paling banyak mengkontaminasi lingkungan karena penggunaan Pb dalam jumlah yang besar, yaitu dari limbah industri dan bahan bakar kendaraan. Menyadari bahaya dari kontaminasi logam Pb ini, Kementerian Kesehatan Republik Indonesia mengeluarkan peraturan kadar Pb yang diperbolehkan dalam air minum, yaitu 0.01 mg/L (Kemenkes RI 2010). Konsentrasi yang rendah ini menyebabkan penentuan Pb memerlukan metode yang sensitif atau harus melalui tahapan prakonsentrasi.
Penentuan kadar Pb yang dijadikan standar oleh Badan Standardisasi Nasional (BSN) pada air dan air limbah menggunakan spektrofotometer serapan atom nyala (FAAS) dengan asam nitrat sebagai pelarut. Penambahan asam nitrat tidak hanya melarutkan Pb saja akan tetapi juga logam-logam lainnya seperti tembaga, kobalt, seng, dan juga besi sehingga dapat mengganggu pengukuran sinyal untuk Pb. Mengingat dimungkinkannya konsentrasi Pb yang rendah dalam suatu sampel dan matriks dari sampel tersebut yang kompleks, maka perlu adanya tahapan prakonsentrasi ion Pb2+ sebelum pengukuran pada FAAS agar meningkatkan sensitivitas pengukuran.
2
Sebagai media pengekstrak, silika gel memiliki banyak kelebihan antara lain luas permukaan yang besar, stabilitas tinggi (dalam panas dan asam), dan tidak mengembang, silika gel juga mudah dimodifikasi (Jiang et al. 2006; Zhu et al.
2009; Ghaedi dan Sharifpour 2012; Radi et al. 2014). Silika gel juga memiliki kelemahan, yaitu rendahnya selektivitas dan efektivitas permukaan dalam berinteraksi dengan logam berat. Akan tetapi kekurangan ini dapat diatasi dengan menambahkan gugus-gugus aktif pada silika (Sulastri dan Kristianingrum 2010). Beragam modifikasi telah dilakukan untuk meningkatkan kemampuan adsorpsi dan selektivitas silika gel misalnya modifikasi ligan organik (organofungsionalisasi) yang memiliki atom-atom donor (O, N, S, dan P) seperti asam amino (Yu et al. 2014). Keberadaan atom-atom donor gugus samping asam amino antara lain: gugus imidazol pada histidina, gugus tiol pada sisteina dan gugus indolil pada triptofan mampu mengikat logam yang telah dibuktikan dalam tubuh. Sebagai contoh histidina pada superoksida dismutase, di mana dua logam yaitu Zn(II) dan Cu(II) masing masing terikat pada atom nitrogen dan nitrogen pada gugus imidazol (Roat-Malone dan Rosette 2007). Pengikatan logam oleh asam amino dalam tubuh sangat menarik mengingat logam-logam berada dalam konsentrasi rendah (trace element), namun asam amino mampu mengikat logam tersebut.
Perumusan Masalah
Permasalahan dalam penelitian ini adalah apakah silika yang disintesis dari sekam padi dan dimodifikasi dengan L-histidina dapat menjadi media pengekstrak untuk memisahkan ion logam Pb(II) secara selektif
Tujuan Penelitian
Penelitian ini bertujuan membuat media pengekstrak dari silika sekam padi yang termodifikasi L-histidina (SSLH) dan menentukan kapasitas adsorpsi serta selektivitas SSLH terhadap ion Pb(II).
Manfaat Penelitian
3
Ruang Lingkup Penelitian
Penelitian ini meliputi 7 tahapan percobaan, yaitu (1) penyiapan abu sekam padi sebagai bahan dasar pembuatan silika, (2) pembuatan natrium silikat, (3) sintesis silika gel asal sekam padi (SS) dan penciriannya dengan spektroskopi FTIR dan XRD, (4) reaksi SS dengan 3-aminopropiltrimetoksisilan (APTMS) dan modifikasi L-histidina (SSLH) serta pencirian dengan spektroskopi FTIR, (5) pengoptimuman pH, bobot adsorben dan waktu kontak menggunakan metode respons permukaan (RSM), (6) uji kapasitas adsorpsi dan isoterm adsorpsi dari SSLH dalam menjerap ion Pb dengan metode lompok/tumpak (batch), dan (7) uji selektivitas SSLH yang dihasilkan terhadap logam lainnya. Tahapan penelitian ditunjukkan pada diagram alir penelitian di Lampiran 1.
2
TINJAUAN PUSTAKA
Sekam Padi
Sekam padi merupakan limbah hasil penanaman padi yang bersifat keras, kasar, tahan cuaca serta berkadar gizi rendah, dan tidak bernilai secara ekonomis (Rohaeti 1992). Struktur utama dari sekam padi adalah lemma dan palea yang saling bertautan dan berbeda dari segi ukuran, bentuk, dan jumlah vaskular.
Lemma dan palea saling tumpang tindih untuk melindungi kariopsis. Kekakuan sel epidermal terluar disebabkan oleh tebalnya dinding sel yang mengandung asam silikat dan silika (Champagne 2004).
Menurut Zakharov et al. (2003) sekam padi memiliki struktur yang berpori, sehingga mempercepat masuknya oksigen selama pembakaran. Semakin tinggi suhu pada proses pembakaran, maka akan menghasilkan fasa kristal. Sekam padi terdiri atas 40% selulosa, 30% lignin dan 20% silikon dioksida. Kandungan kimia dari abu sekam padi yang terbanyak adalah silika. Tabel 1 menunjukkan komposisi kimia dari abu sekam padi.
Tabel 1 Kandungan kimia abu sekam padi (Ghosh dan Bhattacherjee 2013)
Kandungan Massa (%)
Silika (SiO2) 94.50
Kalsium oksida (CaO) 0.48 Mangan (II) oksida (MnO) 1.09 Magnesium oksida (MgO) 0.23 Besi (III) oksida (Fe2O3) 0.54
Aluminium Oksida (Al2O3) 0.21
4
Silika Gel
Silika merupakan hasil polimerisasi dari monomer asam silikat. Silika gel sebagai salah satu senyawa silika sintetis yang berstruktur amorf. Silika gel merupakan salah satu bahan kimia berbentuk padatan yang banyak dimanfaatkan sebagai adsorben. Hal ini disebabkan oleh mudahnya produksi dan juga beberapa kelebihan yang lain, yaitu: sangat inert, hidrofilik, mempunyai kestabilan termal dan mekanik yang tinggi serta relatif tidak mengembang dalam pelarut organik jika dibandingkan dengan padatan resin polimer organik. Sifat sebagai penjerap yang disebut juga sifat adsorptif adalah karena adanya tapak aktif pada permukaan. Kegunaan silika gel yang lazim adalah sebagai penjerap uap air pada penyimpanan bahan-bahan yang bersifat higroskopis, atau mudah menjerap uap air seperti berbagai produk makanan dan juga obat-obatan. Pada silika gel yang digunakan sebagai penjerap uap air biasanya ditambahkan senyawa kobalt sebagai indikator untuk mengetahui kapasitas uap air yang terjerap (Sulastri dan Kristianingrum 2010).
Terdapat dua jenis gugus pada permukaan silika gel, yaitu gugus silanol (Si-OH) dan gugus siloksan (Si-O-Si) (Sulastri dan Kristianingrum 2010). Silika gel adalah salah satu media pengekstrak yang digunakan dalam ekstraksi fase padat. Selain karena memiliki luas permukaan yang besar, stabilitas tinggi (dalam panas dan asam), dan tidak mengembang, silika gel juga mudah untuk dimodifikasi (Jiang et al. 2006; Zhu et al. 2009; Ghaedi dan Sharifpour 2012; Radi et al. 2014).
Modifikasi Permukaan Silika Gel
Modifikasi permukaan silika gel berhubungan dengan keseluruhan proses yang bertujuan mengubah komposisi kimia pada permukaan. Modifikasi akan mempengaruhi secara signifikan proses adsorpsi. Silika gel dapat digunakan langsung sebagai adsorben, akan tetapi interaksi ion logam dengan permukaan silika gel lemah. Hal ini dikarenakan keasaman gugus silanol dan sifat donor dari permukaan atom oksigen yang lemah. Berdasarkan jenis senyawa yang digunakan, modifikasi permukaan silika gel dapat dibedakan menjadi 2 jenis yaitu fungsionalisasi organik yang agen pemodifikasinya berupa gugus organik dan fungsionalisasi anorganik yang gugus pemodifikasinya dapat berupa senyawa organometalik atau oksida logam (Jal et al. 2003).
5
biasanya terikat pada permukaan silika melalui proses silanisasi yang melibatkan pembentukan ikatan kovalen. Proses silanisasi ini dilakukan biasanya dalam suasana non air (Jal et al. 2003; Sulastri dan Kristianingrum 2010).
6
Penggunaan asam amino termasuk L-histidina sebagai pemodifikasi telah banyak dilakukan dalam penelitian-penelitian. Malachowski et al. (2003) telah mengimobilisasi poli(L-histidina) pada controlled pore glass (CPG) sebagai pengkelat kation logam dan oksianion logam. Modifikasi silika dengan asam amino dengan pendekatan biomimetik pernah dilakukan oleh Luechinger et al.
2005. Asam amino yang digunakan adalah histidina dan asam glutamat sebagai model dalam pengikatan Fe(II) oleh hemoglobin. Roat-Malone dan Rosette (2007) mengungkapkan bahwa asam-asam amino dalam tubuh bertindak sebagai ligan yang dapat mengikat logam-logam (Gambar 1). Asam amino memiliki gugus samping seperti gugus imidazol pada histidina, gugus tiol pada sistein dan gugus indolil pada triptofan. Misalnya histidina pada superoksida dismutase, di mana dua logam, yaitu Zn(II) dan Cu(II) yang masing masing terikat pada atom nitrogen
dan nitrogen .
Isoterm Adsorpsi
Isoterm adsorpsi menunjukkan hubungan kesetimbangan antara konsentrasi adsorbat yang teradsorpsi pada permukaan padatan dengan konsentrasi adsorbat yang tetap berada dalam larutan. Kesetimbangan terjadi saat laju pengikatan adsorben terhadap adsorbat sama dengan laju pelepasannya. Terdapat beberapa isoterm yang dikembangkan untuk menggambarkan interaksi antara adsorben dengan adsorbat. Tipe isoterm yang biasa digunakan untuk menggambarkan fenomena adsorpsi padat-cair adalah tipe isoterm Langmuir dan Freundlich.
Menurut Subramanyam dan Das (2009), isoterm adsorpsi Langmuir mengasumsikan sebagai berikut :
1. Adsorpsi hanya terjadi pada lapisan tunggal (monolayer) 2. Panas adsorpsi tidak tergantung pada penutupan permukaan 3. Semua bagian dan permukaannya bersifat homogen
4. Sejumlah tertentu tapak aktif adsorben yang membentuk ikatan kovalen atau ion.
Persamaan isoterm adsorpsi Langmuir dapat diturunkan secara teoritis dengan mengganggap terjadinya kesetimbangan antara molekul-molekul yang diadsorpsi pada permukaan adsorben dengan molekul-molekul yang tidak teradsorpsi. Persamaan isoterm adsorpsi Langmuir dapat dituliskan sebagai berikut:
keterangan :
Ce = konsentrasi kesetimbangan adsorbat dalam larutan (mg/L)
qe = jumlah adsorbat yang teradsorpsi per unit bobot adsorben pada
kesetimbangan (mg/g)
qm = kapasitas adsorpsi maksimum (mg/g)
7
Isoterm Freundlich mengasumsikan suatu permukaan adsorpsi yang heterogen dan perbedaan energi pada tapak aktif (Koumanova dan Peeva-Antova 2002). Model isoterm ini menganggap bahwa pada semua tapak aktif permukaan adsorben akan terjadi proses adsorpsi di bawah kondisi yang diberikan. Isoterm Freundlich tidak mampu memperkirakan adanya tapak-tapak pada permukaan yang mampu mencegah tercapainya adsorpsi pada kesetimbangan. Hanya ada beberapa tapak aktif saja yang mampu mengadsorpsi molekul terlarut. Persamaan isoterm adsorpsi Freundlich didasarkan pada asumsi sebagai berikut :
1. Terbentuknya adsorpsi beberapa lapisan (multilayer) dari molekul-molekul adsorbat pada adsorben
2. Bagian tapak aktif pada permukaan adsorben bersifat heterogen
3. Hanya melibatkan gaya van der Waals sehingga adsorbat dapat bergerak dari satu bagian permukaan ke bagian permukaan lain dari adsorben
Persamaan isoterm adsorpsi Freundlich dapat dituliskan sebagai berikut:
keterangan:
Kf = konstanta kapasitas adsorpsi
n = konstanta intensitas adsorpsi
Pencirian Silika dengan FTIR dan XRD
Spektroskopi inframerah transformasi fourier (FTIR) merupakan suatu teknik spektroskopi yang digunakan untuk mengidentifikasi gugus fungsi dalam suatu senyawa. Pada silika gel, diketahui silanol dan siloksan merupakan gugus-gugus penciri silika. Penambahan agen silanasi seperti APTMS serta proses modifikasi akan memunculkan puncak baru, maka pola spektrum akan mengalami beberapa perubahan (Sulastri dan Kristianingrum 2010; Radi et al. 2014). Tabel 2 menunjukkan karakteristik dari pola spektrum absorpsi dari gugus fungsi utama silika gel.
Tabel 2 Karakteristik spektrum IR silika gel (Silverstein et al. 2005; Jiang et al. 2006; Vejayakumaran et al. 2008)
Gugus Fungsi Bilangan Gelombang (cm-1) Tipe Vibrasi
O-H (silanol dan air)
3200–3700 Ulur
O-H (silanol dan air)
~ 1638 Tekuk
Si-O (siloksan) 1030–1200 Ulur
asimetris
Si-O (silanol) 950–970 Ulur simetris
8
Struktur dan permukaan silika sekam padi dapat dianalisis dengan menggunakan difraktometer sinar-X (XRD). XRD merupakan salah satu metode karakterisasi material yang digunakan untuk mengidentifikasi struktur atom dalam material tanpa menghancurkan material tersebut. Sudut untuk penembakan silika adalah antara 10°–90° dan tiap puncak yang muncul pada pola XRD mewakili satu bidang kristal yang memiliki orientasi tertentu dalam sumbu tiga dimensi (hkl). Puncak-puncak yang didapatkan dari data pengukuran ini kemudian dicocokkan dengan data standar difraksi sinar-X yang telah tersedia hampir untuk semua jenis material.
Timbal (Pb)
Timbal adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Pb dan nomor atom 82. Lambangnya diambil dari bahasa Latin
Plumbum. Pb adalah logam berat yang terdapat secara alami di dalam kerak bumi. Titik leleh timbal murni sebesar 327 ºC, sedikit rendah untuk ukuran logam sehingga mudah dibentuk menjadi pipa, dan lain-lain. Unsur Pb digunakan dalam bidang industri modern sebagai bahan pembuatan pipa air yang tahan korosi, bahan pembuat cat, baterai, dan campuran bahan bakar bensin tetraethyl lead
(TEL). Pb termasuk logam yang mendapat perhatian khusus karena sifatnya yang toksik terhadap manusia. Pb dapat masuk ke dalam tubuh melalui konsumsi makanan, minuman, udara, air, serta debu yang tercemar Pb. Keracunan logam timbal pada manusia dapat menyebabkan malfungsi ginjal, sistem reproduksi, hati, otak, sistem saraf pusat, dan bahkan menyebabkan kematian. Keracunan logam ini juga dapat menyebabkan keterbelakangan mental pada anak. Timbal juga dapat menyebabkan anemia (Manahan 2001; Sudarmadji et al. 2005; EPA 2015).
Keracunan timbal atau dikenal juga sebagai plumbism, colica pictorum, saturnism, decon colic, atau painter’s colic adalah kelainan kondisi kesehatan pada manusia dan hewan vertebrata yang disebabkan oleh meningkatnya kadar logam berat Pb dalam tubuh. Keracunan timbal bisa menyerang manusia dari berbagai usia. Akan tetapi, anak-anak lebih sensitif dibandingkan dengan orang dewasa karena pusat perkembangan saraf mereka masih berkembang. Pengaruh timbal pada kesehatan anak sangat banyak termasuk di antaranya mengurangi perkembangan IQ, hiperaktif, susah dalam belajar, masalah dalam bersikap seperti kurang peduli dan agresif (Suherni 2010).
3
METODE
Bahan
9
glutaraldehida (Sigma Aldrich, St Louise, Amerika Serikat), L-Histidina (Merck, New Jersey, Amerika Serikat), asam klorida 3M dan 6M, natrium hidroksida 2M dan 4M, toluena, gas nitrogen, larutan standar (1000 mg/L) Pb, Cd, dan Zn dari kawat dan dilarutkan dengan menggunakan asam nitrat.
Alat
Alat-alat yang digunakan dalam penelitian ini adalah Unitronic OR P shaker water batch (J. P. Selecta, Barcelona, Spanyol), spektrofotometer serapan atom nyala (FAAS) AA-6800 (Shimadzu, Kyoto, Jepang), FTIR 8400S (Shimadzu, Kyoto, Jepang), XRD 7000 (Shimadzu, Kyoto, Jepang), pH meter HM-20S (TOA, Tokyo, Jepang), pengaduk magnet, tanur (Nabertherm, Lilienthal, Jerman), oven (Memmert, Schwabach, Jerman), cawan porselein, ayakan 200 mesh, alu dan lumpang, peralatan refluks, desikator, serta peralatan-peralatan kaca yang umum terdapat di laboratorium kimia.
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret 2015 sampai Februari 2016 di Laboratorium Kimia Analitik IPB, Laboratorium Bersama Kimia IPB dan Q-Lab
Fakultas Farmasi Universitas Pancasila.
Prosedur Penelitian
Pengabuan Arang Sekam Padi
Arang sekam padi dibersihkan dari kotoran kemudian direndam dengan air panas selama 2 jam dan dikeringkan di dalam oven. Setelah itu arang sekam padi dihaluskan dan diayak dengan ayakan 200 mesh, selanjutnya arang sekam padi yang sudah bersih dan kering dimasukkan ke dalam cawan porselein dan diabukan dalam tungku pengabuan (tanur) pada suhu 400 ºC selama 2 jam dan diteruskan pada suhu 750 ºC selama 4 jam (modifikasi dari metode Djatmiko dan Amaria 2008; Hikmawati 2010).
Pembuatan Natrium Silikat
10
menjadi setengah volume, selanjtnya larutan dituangkan ke dalam cawan porselin dan dilebur pada suhu 500 ºC selama 30 menit. Padatan natrium silikat (Na2SiO3)
yang sudah dingin ditambahkan 200 mL akuades, diaduk dengan pengaduk magnet dan dibiarkan semalam. Selanjutnya disaring dengan kertas saring Whatman 42. Filtrat yang diperoleh adalah larutan Na2SiO3 (Mujiyanti et al.
2010; Hikmawati 2010).
Pembuatan Silika Sekam Padi (SS)
Larutan Na2SiO3 sebanyak 20 mL ditempatkan dalam gelas kimia dan
diaduk dengan pengaduk magnet sambil ditambahkan larutan HCl 3 M setetes demi setetes sampai terbentuk gel yang selanjutnya disimpan selama 24 jam. Kemudian dicuci dengan akuades panas hingga netral dan dikeringkan dalam oven pada suhu 120 ºC selama 48 jam. Selanjutnya dilakukan karakterisasi dengan FTIR dan XRD (Mujiyanti et al. 2010).
Pembuatan 3-Aminopropilsilika (APS)
Sebanyak 2 g SS yang teraktivasi (dipanaskan pada suhu 160 ºC selama 24 jam) dicampurkan dengan 65 mL APTMS (1% v/v dalam toluena). Campuran diagitasi selama 24 jam dengan refluks pada suhu 110 ºC. Selanjutnya dipisahkan dengan sentrifus pada 3000 rpm dan dicuci dengan toluena sebanyak 3 kali. Hasil yang diperoleh merupakan aminopropilsilika (APS) yang kemudian dikeringkan dalam oven pada suhu 110 ºC selama 12 jam. Selanjutnya dilakukan karakterisasi dengan FTIR (Vejayakumaran dan Ismail 2008).
Modifikasi L-Histidina pada APS
APS direaksikan dengan 50 mL glutaraldehida (5% v/v dalam larutan penyangga fosfat 0.1 M pH 8) di bawah kondisi nitrogen selama 90 menit pada suhu ruang. Selanjutnya campuran disaring, dicuci dengan aquades dan dikeringkan dalam desikator. Sebanyak 1 gram campuran direaksikan dengan 25 mg L-histidina yang dilarutkan dalam 20 mL larutan penyangga fosfat 0.1 M (pH 5.3). Selanjutnya dibiarkan selama 48 jam pada suhu ruang di bawah kondisi nitrogen. L-histidina yang telah termodifikasi pada silika (SSLH) dicuci dan dikeringkan, serta dilakukan karakterisasi dengan FTIR (Malachowski dan Holcombe 2003).
Penentuan pH, Bobot Adsorben, dan Waktu Kontak Optimum dalam Penjerapan Ion Logam Pb(II) dengan Menggunakan Metode Permukaan Respons (RSM)
11
Kondisi optimum ditentukan dengan melihat besarnya nilai % adsorpsi pada masing-masing kondisi percobaan yang dihitung dengan rumus sebagai berikut:
Percobaan dilakukan secara metode lompok dengan mencampurkan 25 ml larutan ion Pb(II) 100 mg/L dengan sejumlah tertentu adsorben SSLH dalam erlenmeyer. Campuran ini dikocok pada suhu ruang dengan ragam waktu yang ditentukan menggunakan shaker otomatis. Ion Pb(II) yang tidak terekstrak dianalisis dengan FAAS.
Penentuan Kapasitas Adsorpsi dan Isoterm Adsorpsi Ion Logam Pb(II)
Sebanyak 25 mL larutan ion logam Pb(II) dengan ragam konsentrasi (50; 100; 200; 300; dan 400 mg/L) dikontakkan dengan 0.1 g SSLH pada shakerbatch
menggunakan kondisi optimum. Campuran selanjutnya dipisahkan dengan senrtifus dan jumlah ion logam dalam filtrat ditentukan dengan FAAS (Modifikasi metode Djatmiko dan Amaria 2012; Javadian et al. 2014).
Penentuan Selektivitas SSLH
Sebanyak 0.5 g SSLH dalam campuran larutan logam yang mengandung ion-ion logam Pb, Cd. dan Zn dengan beragam konsentrasi (1:1:1; 2:1:1; 1:2:2) dikontakkan dengan adsorben pada shaker batch menggunakan kondisi optimum. Campuran selanjutnya dipisahkan dengan sentrifus dan jumlah ion logam dalam filtrat ditentukan dengan FAAS. Konsentrasi ion logam dihitung menggunakan persamaan kurva kalibrasi dari masing-masing logam (Lampiran 3).
4
HASIL DAN PEMBAHASAN
Hasil Sintesis Silika Sekam (SS), Aminopropilsilika (APS), dan Silika termodifikasi L-Histidina (SSLH)
Silika sekam padi disintesis dengan metode sol-gel dari prekursor Na2SiO3.
Proses pengabuan dengan peningkatan suhu yang bertahap pada suhu 400 ºC selama 2 jam dan diteruskan pada suhu 750 ºC selama 4 jam bertujuan untuk memperoleh silika yang lebih murni (Hikmawati 2010). Pelarutan material-material organik dan pengurangan bahan asing berupa oksida-oksida logam seperti Fe2O, MgO, Na2O, K2O, dan CaO dilakukan dengan mencuci abu sekam
12
Peleburan pada suhu 500 ºC selama 30 menit menghasilkan Na2SiO3 berupa
padatan putih kehijauan. Hasil tersebut sesuai dengan hasil penelitian Mujiyanti et al. (2010) dan Putra (2013). Reaksi pembentukan Na2SiO3 dapat dilihat pada
Persamaan 3. Pada suhu yang tinggi, NaOH meleleh dan terdisosiasi sempurna membentuk Na+ dan OH-.Atom O pada SiO2 memiliki keelektronegatifan yang
lebih tinggi sehingga Si lebih elektropositif dan terbentuk intermediet [SiO2OH]
-yang tidak stabil. Dalam hal ini terjadi dehidrogenasi dan OH- yang kedua akan berikatan dengan hydrogen membentuk air. Dua ion Na+ akan menyeimbangkan muatan negatif yang terbentuk dan berinteraksi dengan ion SiO32- sehingga
terbentuk Na2SiO3(Mujiyanti et al. 2010).
SiO2 + 2NaOH → Na2SiO3 + H2O
Sintesis silika gel dilakukan dengan menambahkan HCl 3M setetes demi setetes ke dalam larutan Na2SiO3. Hasil reaksi larutan Na2SiO3 (400 mL) dengan
HCl 3M menghasilkan alkogel yang akan mengalami sinerisis bila didiamkan dan menjadi hidrogel. Hidrogel yang dicuci dan dipanaskan pada akhirnya akan membentuk xerogel berupa padatan putih sebanyak ±25 gram. Penambahan HCl menyebabkan terjadinya protonasi gugus Si-O- menjadi Si-OH. Gugus silanol diserang oleh gugus siloksi dengan bantuan katalis asam untuk membentuk ikatan siloksan (Si-O-Si). Proses ini terjadi cepat dan terus menerus membentuk jaringan silika amorf (Sriyanti dan Kristianingrum 2005).
Na2SiO3 + 2HCl + H2O → 2NaCl + Si(OH)4
Tahap ini menjadi sangat penting sebelum memodifikasi silika dengan L-histidina. Aktivasi silika gel perlu dilakukan untuk menghilangkan kandungan air yang dijerap oleh silika selama penyimpanan. Proses silanasi dengan pereaksi silan menggunakan APTMS dan dilakukan dalam suasana non-air menggunakan pelarut toluena. Campuran diagitasi selama 24 jam dengan refluks dan hasil yang diperoleh kemudian dicuci dengan toluena untuk melarutkan sisa APTMS yang tidak bereaksi dengan silika. APS yang telah dihasilkan selanjutnya direaksikan dengan glutaraldehida dalam larutan penyangga fosfat (pH 8) di bawah kondisi nitrogen. Glutaraldehida yang akan menjadi penghubung gugus -NH2 pada APS
dan pada L-histidina.
OH O O
Si NH
2
3-Aminopropilsilika
O O
13
APS-glutaraldehida direaksikan di bawah kondisi nitrogen dengan L-histidina yang dilarutkan dalam larutan penyangga fosfat (pH 5.3). Gas nitrogen digunakan untuk membuat kondisi reaksi dalam keadaan inert sehingga menghindari terjadinya oksidasi oleh oksigen. Dugaan reaksi yang terjadi seperti reaksi di bawah ini.
APS-Glutaraldehida L-Histidina
OH
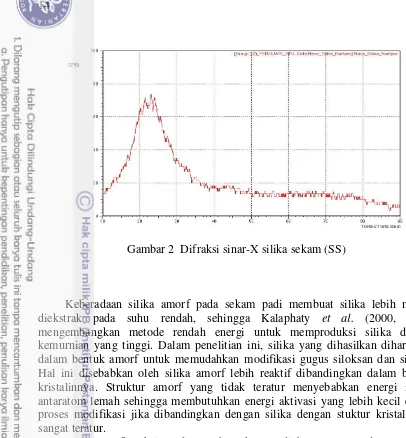
Difraksi sinar-X merupakan teknik yang digunakan untuk menganalisis padatan kristalin. Pola difraksi yang dianalisis dalam penelitian ini adalah silika asal sekam padi (SS). Silika yang diperoleh merupakan serbuk berwarna putih menunjukkan struktur amorf yang dibuktikan dengan difraktogram XRD pada Gambar 2. Pola difraksi dari SS pada Gambar 2 menunjukkan pola yang melebar
di sekitar 2θ = 20.15º–22.99º. Difraktogram XRD dengan puncak melebar sekitar
14
Gambar 2 Difraksi sinar-X silika sekam (SS)
Keberadaan silika amorf pada sekam padi membuat silika lebih mudah diekstrak pada suhu rendah, sehingga Kalaphaty et al. (2000, 2002) mengembangkan metode rendah energi untuk memproduksi silika dengan kemurnian yang tinggi. Dalam penelitian ini, silika yang dihasilkan diharapkan dalam bentuk amorf untuk memudahkan modifikasi gugus siloksan dan silanol. Hal ini disebabkan oleh silika amorf lebih reaktif dibandingkan dalam bentuk kristalinnya. Struktur amorf yang tidak teratur menyebabkan energi ikatan antaratom lemah sehingga membutuhkan energi aktivasi yang lebih kecil dalam proses modifikasi jika dibandingkan dengan silika dengan stuktur kristal yang sangat teratur.
Umumnya fasa kristal dalam abu sekam padi bergantung pada temperatur pengabuan, silika dalam sekam terdapat dalam bentuk amorf dan akan tetap dalam keadaan tersebut apabila dibakar pada temperatur di bawah 800 ºC (Kalaphaty et al. 2000; Mujiyanti et al. 2010; Rohaeti et al. 2010; Gu et al. 2015). Sedangkan apabila pengabuan sekam padi dilakukan pada suhu 800 ºC akan menghasilkan kristal kristobalit (Nuryono et al. 2004).
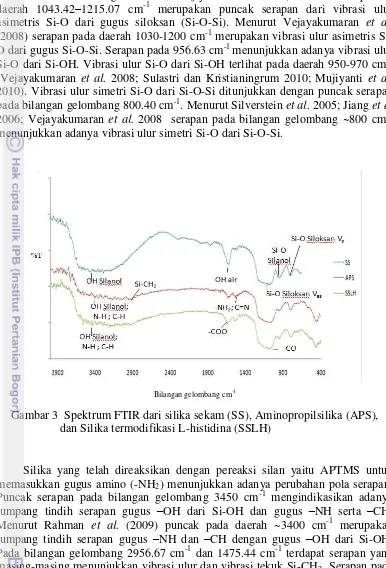
Analisis Gugus Fungsi
Karakterisasi FTIR dilakukan untuk mengidentifikasi gugus fungsi penciri SS, APS, maupun SSLH. Berdasarkan pola serapan yang ditunjukkan pada Gambar 3 menunjukkan adanya serapan pada bilangan gelombang 3448.49 cm-1 dan 1627.81 cm-1 masing-masing merupakan vibrasi ulur dan vibrasi tekuk gugus hidroksil (–OH) pada gugus silanol (Si-OH) dan –OH pada molekul air. Vibrasi ulur silanol dan air ditunjukkan pada daerah 3200–3700 cm-1 (Silverstein et al.
15
Sulastri dan Kristianingrum 2010; Mujiyanti et al. 2010). Puncak serapan di daerah 1043.42–1215.07 cm-1 merupakan puncak serapan dari vibrasi ulur asimetris Si-O dari gugus siloksan (Si-O-Si). Menurut Vejayakumaran et al.
(2008) serapan pada daerah 1030-1200 cm-1 merupakan vibrasi ulur asimetris Si-O dari gugus Si-Si-O-Si. Serapan pada 956.63 cm-1 menunjukkan adanya vibrasi ulur Si-O dari Si-OH. Vibrasi ulur Si-O dari Si-OH terlihat pada daerah 950-970 cm-1 (Vejayakumaran et al. 2008; Sulastri dan Kristianingrum 2010; Mujiyanti et al.
2010). Vibrasi ulur simetri Si-O dari Si-O-Si ditunjukkan dengan puncak serapan pada bilangan gelombang 800.40 cm-1. Menurut Silverstein et al. 2005; Jiang et al. 2006; Vejayakumaran et al. 2008 serapan pada bilangan gelombang ~800 cm-1 menunjukkan adanya vibrasi ulur simetri Si-O dari Si-O-Si.
Bilangan gelombang cm-1
Gambar 3 Spektrum FTIR dari silika sekam (SS), Aminopropilsilika (APS), dan Silika termodifikasi L-histidina (SSLH)
Silika yang telah direaksikan dengan pereaksi silan yaitu APTMS untuk memasukkan gugus amino (-NH2) menunjukkan adanya perubahan pola serapan.
Puncak serapan pada bilangan gelombang 3450 cm-1 mengindikasikan adanya tumpang tindih serapan gugus –OH dari Si-OH dan gugus –NH serta –CH. Menurut Rahman et al. (2009) puncak pada daerah ~3400 cm-1 merupakan tumpang tindih serapan gugus –NH dan –CH dengan gugus –OH dari Si-OH. Pada bilangan gelombang 2956.67 cm-1 dan 1475.44 cm-1 terdapat serapan yang masing-masing menunjukkan vibrasi ulur dan vibrasi tekuk Si-CH2. Serapan pada
daerah 2840–3000 cm-1 menunjukkan adanya vibrasi ulur Si-CH2, sedangkan
serapan pada daerah 1384–1490 cm-1 menunjukkan adanya vibrasi tekuk Si-CH2
16
serapan pada bilangan gelombang 1541.02 cm-1. Serapan pada daerah ~1560 cm-1 menunjukkan vibrasi tekuk amina primer (-NH2) (Jiang et al. 2006;
Vejayakumaran et al. 2008; Rahman et al. 2009; Buhani dan Suharso 2010; Niu et al. 2013; Radi et al. 2014).
Pada sampel SSLH, modifikasi L-histidina menyebabkan adanya puncak serapan baru serta pergeseran bilangan gelombang dari gugus-gugus APS. Vibrasi ulur –CH ditunjukkan dengan adanya serapan pada daerah 3103.25 cm-1. Menurut Kumar et al. (2010)serapan pada daerah 3090–3109 cm-1 menunjukkan adanya vibrasi ulur dari gugus –CH pada cincin imidazol. Serapan pada bilangan gelombang 1712.67–1745.46 cm-1 menunjukkan gugus karboksilat (-COO). Menurut Luechinger (2005), material yang diimobilisasi dengan asam amino menunjukkan adanya serapan pada sekitar 1700 cm-1 yang merupakan serapan gugus karboksilat. Gugus C=C siklik pada gugus imidazol muncul pada bilangan gelombang sekitar 1610.45 cm-1. Pada daerah sekitar 1600 cm-1 akan muncul serapan dari C=C aromatik (Silverstein et al. 2005; Sitorus M 2009; Djatmiko dan Amaria 2012; Nurmasari et al. 2013). Puncak serapan vibrasi ulur –NH2 pada
bilangan gelombang 1521.73 cm-1 terlihat mengalami pergeseran akibat mengalami tumpang tindih serapan dengan vibrasi –C=N. Pada bilangan gelombang 1070.42–1128.28 cm-1 terdapat serapan yang menunjukkan vibrasi gugus –CO. Menurut Silverstein et al. (2005) vibrasi –C=N ditunjukkan dengan adanya serapan pada daerah 1000–1320 cm-1. Sedangkan gugus penciri silika dan APS masih dapat terlihat pada spektrum FTIR SSLH dan mengalami pergeseran bilangan gelombang .
Kondisi Optimum Adsorpsi Pb(II) oleh SSLH
Penentuan kondisi optimum menggunakan RSM mempertimbangkan hubungan antara peubah-peubah dan respon seperti dicantumkan pada estimasi koefisien regresi hasil analisis dari perantilunakMinitab 16 (Lampiran 4). Persen adsorpsi dan kapasitas adsorpsi merupakan respon yang digunakan untuk melihat pengaruh dari setiap peubah dan interaksinya. Peubah dengan nilai p < 0.05 mengindikasikan pengaruh signifikan terhadap respon. Berdasarkan hasil yang ditunjukkan pada Lampiran 2, pengaruh pH, bobot adsorben, dan waktu kontak dapat dijabarkan melalui persamaan model regresi, yaitu: Y sebagai % adsorpsi dan kapasitas adsorpsi SSLH terhadap Pb(II), x1 sebagai fungsi pH, x2 sebagai
fungsi bobot adsorben, dan x3 sebagai fungsi waktu kontak.
a. Y sebagai % adsorpsi
Persamaan 7 b. Y sebagai kapasitas adsorpsi
Persamaan 8
17
adsorpsi SSLH lebih besar dibandingan dengan SS. Absorbansi dari SSLH dan SS berturut-turut sebesar 0.0006 dan 0.1956. Absorbansi SS jauh lebih besar yang menandakan bahwa konsentrasi yang tak terjerap dalam larutan masih banyak sementara yang terjerap oleh SS sangat sedikit. Akan tetapi perhitungan ke kapasitas adsorpsi tidak dilanjutkan karena absorbansi yang dihasilkan di luar kurva standar. Hal ini membuktikan bahwa modifikasi dengan histidina telah menambah gugus aktif silika yang awalnya hanya siloksan dan silanol. Setelah direaksikan dengan APTMS dan selanjutnya dimodifikasi dengan histidina menambah gugus aktif yaitu gugus imidazol.
pH
Contour Plot of % Adsorpsi vs Bobot, pH
pH
Contour Plot of % Adsorpsi vs Waktu, pH
Bobot
Contour Plot of % Adsorpsi vs Waktu, Bobot
pH
Contour Plot of Kapasitas Adsorpsi vs Bobot, pH
pH
Contour Plot of Kapasitas Adsorpsi vs Waktu, pH
Bobot
Contour Plot of Kapasitas Adsorpsi vs Waktu, Bobot
18
Persen adsorpsi dan kapasitas adsorpsi pada kondisi optimum ditunjukkan dengan warna hijau paling tua pada kontur plot Gambar 4. Hal ini sesuai dengan hasil yang ditunjukkan oleh optimization plot pada Minitab 16 dan diperoleh kondisi optimum pada pH 7.19, bobot adsorben 0.1 g, dan waktu kontak selama 15 menit (Lampiran 5). Namun, dari hasil pengulangan diketahui bahwa pH 7.19 telah mendekati nilai Ksp dari Pb(OH)2 sehingga digunakan pH 5 sebagai pH
kondisi optimum, pH 5 ini sesuai dengan kondisi optimum jika yang digunakan sebagai respon hanya % adsorpsi. Kondisi optimum yang selanjutnya dipakai untuk menentukan kapasitas adsorpsi dan pola isoterm adsorpsi SSLH terhadap ion Pb(II) adalah pH 5, bobot adsorben 0.1 g, serta waktu kontak 15 menit.
Kondisi keasaman larutan logam terlihat memberikan pengaruh terhadap proses adsorpsi SSLH. Pada kondisi yang terlalu asam, penyerapan ion Pb rendah. Hal ini dikarenakan pada pH yang terlalu asam permukaan adsorben dikelilingi oleh ion H+ (karena gugus fungsi yang terdapat pada adsorben terprotonasi) akibatnya ion-ion H+ menghalangi interaksi ion Pb dengan permukaan SSLH. Selain itu, permukaan adsorben bermuatan positif menyebabkan terjadi tolakan antara permukaan adsorben dengan ion Pb, sehingga adsorpsi SSLH pun menjadi rendah. Kondisi pH yang lebih tinggi dari pKa histidina (~6.15), piridin nitrogen pada gugus imidazol terdeprotonasi sehingga tidak ada PEB yang bisa mengikat ion logam (Malachowski dan Holcombe 2003). Sedangkan pada pH yang tinggi (pH=8), ion Pb mulai membentuk endapan Pb(OH)2 sehingga ion Pb yang terjerap
lebih sedikit dan mengakibatkan adsorpsi mulai menurun (Nurhasni et al. 2014).
Kapasitas dan Isoterm Adsorpsi
Penentuan kapasitas adsorpsi dan isoterm adsorpsi dilakukan pada pH 5, bobot 0.1 g, dan waktu kontak 15 menit dengan ragam konsentrasi awal 50–400 mg/L. Percobaan ini dilakukan pada suhu ruang dan diperoleh kapasitas adsorpsi 8.46–67.08 mg/g untuk SSLH dan % adsorpsi sebesar 51.22–98.14%. Tabel 3 menunjukkan penjabaran dari hasil adsorpsi SSLH tiap konsentrasi.
Tabel 3 Konsentrasi awal Pb(II), kapasitas adsorpsi, dan % adsorpsi SSLH
[Pb(II)] (mg/L) Kapasitas
Adsorpsi (mg/g) % Adsorpsi
50 8.46 98.14
100 15.12 63.68
200 48.06 91.91
300 67.08 72.52
400 59.27 51.22
19
yang terjerap. Namun, pada konsentrasi > 300 mg/L kapasitas adsorpsi mengalami penurunan. Hal ini disebabkan oleh ion Pb(II) mulai mengendap karena telah berubah menjadi spesi Pb(OH)+ dan Pb(OH)2. Secara teori, melalui perhitungan
hasil kali kelarutan (KSP), pada pH 5 dan konsentrasi > 300-400 mg/L seharusnya
belum terjadi pengendapan. Namun, hasil pengamatan menunjukkan bahwa telah terjadi pengendapan.
Dari Tabel 3 dapat terlihat bahwa % adsorpsi semakin menurun dengan bertambahnya konsentrasi logam. Penurunan % adsorpsi disebabkan karena pada konsentrasi yang lebih tinggi, jumlah ion Pb dalam larutan tidak sebanding dengan jumlah SSLH yang tersedia sehingga permukaan SSLH akan mencapai titik jenuh dan menyebabkan % adsorpsi menurun.
Data yang diperoleh tersebut sesuai dengan teori Langmuir yang menjelaskan bahwa pada permukaan adsorben terdapat situs aktif yang jumlahnya sebanding terhadap luas permukaan adsorben, sehingga bila situs aktif pada permukaan adsorben telah jenuh oleh ion logam, maka penambahan konsentrasi tidak lagi dapat meningkatkan kemampuan adsorpsi dari adsorben tersebut (Sembiring et al. 2008). Oleh sebab itu, pada konsentrasi lebih dari 300 mg/L, adsorpsi ion logam mengalami penurunan.
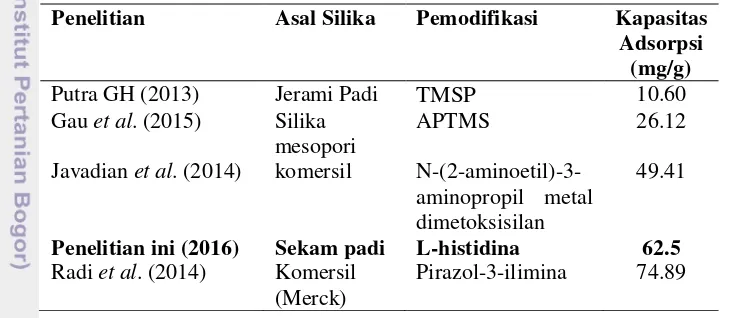
Tabel 4 Perbandingan hasil kapasitas adsorpsi Pb(II) oleh adsorben berbasis silika
Penelitian Asal Silika Pemodifikasi Kapasitas
Adsorpsi
Javadian et al. (2014) komersil N-(2-aminoetil)-3-aminopropil metal dimetoksisilan
49.41
Penelitian ini (2016) Sekam padi L-histidina 62.5
Radi et al. (2014) Komersil (Merck)
Pirazol-3-ilimina 74.89
Perbedaan kapasitas adsorpsi ion logam Pb(II) pada penelitian ini dengan penelitian sebelumnya ditunjukkan pada Tabel 4. Putra (2013) memodifikasi silika asal jerami padi dengan 3-(trimetoksilil)-1-propanatiol (TMSP) dan memperoleh kapasitas adsorpsi maksimum sebesar 10.60 mg/g dengan menggunakan 0.1 gram bobot adsorben. APTMS juga digunakan sebagai pemodifikasi silika mesopori oleh Gau et al. (2015) dan memperoleh kapasitas adsorpsi sebesar 26.12 mg/g. Pada penelitian ini, kapasitas adsorpsi SSLH yang diperoleh lebih besar dibandingkan dengan penelitian Putra (2013) dan Gau et al.
20
permukaan silika yang termodifikasi serta penggunaan silika komersil dengan kemurnian yang tinggi.
(a)
(b)
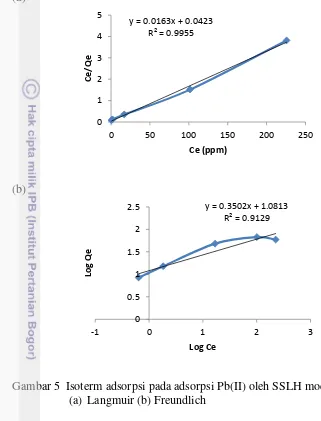
Gambar 5 Isoterm adsorpsi pada adsorpsi Pb(II) oleh SSLH model (a) Langmuir (b) Freundlich
Isoterm adsorpsi oleh adsorben SSLH dianalisis menggunakan dua model persamaan isotermal, yaitu model Langmuir dan Freundlich yang ditunjukkan pada Gambar 5a dan 5b. Pola adsorpsi ditentukan dengan cara membandingkan linearitas kurva yang ditunjukkan oleh harga R2 (Suardana 2008). Berdasarkan nilai linearitasnya, adsorpsi ion logam Pb(II) oleh SSLH mengikuti persamaan Langmuir. Hasil yang diperoleh menunjukkan bahwa isoterm adsorpsi SSLH mengikuti persamaan Langmuir karena nilai R2 yang lebih besar (R2= 0.995) dibandingkan dengan persamaan Freundlich (R2= 0.912). Dengan demikian, dapat diasumsikan bahwa proses adsorpsi terjadi melalui mekanisme yang sama dan membentuk satu lapisan tunggal saat adsorpsi maksimum. Menurut Wijayanti (2009) bila permukaan sudah jenuh atau mendekati jenuh terhadap adsorbat, dapat terjadi dua hal:
y = 0.0163x + 0.0423 R² = 0.9955
0 1 2 3 4 5
0 50 100 150 200 250
Ce
/Qe
Ce (ppm)
y = 0.3502x + 1.0813 R² = 0.9129
0 0.5 1 1.5 2 2.5
-1 0 1 2 3
Log Qe
21
1. Terbentuk lapisan tunggal dan seterusnya adsorbat yang belum teradsorpsi berdifusi keluar pori dan kembali ke arus fluida.
2. Terbentuk lapisan adsorpsi kedua dan seterusnya di atas adsorbat yang telah terikat di permukaan, gejala ini disebut adsorpsi multilayer (Freundlich).
Parameter-parameter adsorpsi SSLH terhadap Pb(II) juga dihitung untuk mengetahui besarnya energi adsorpsi seperti tertera dalam Tabel 5. Parameter untuk isoterm Langmuir yaitu kapasitas adsorpsi maksimum (Qm) suatu adsorben, parameter yang berhubungan dengan energi adsorpsi (b) dan faktor pemisahan (RL). Faktor pemisahan (RL) merupakan parameter yang menggambarkan dimensi
adsorpsi. Jika 0 < RL < 1 maka proses adsorpsi bersifat favorable (baik). Nilai RL
yang diperoleh sebesar 0.071 yang menunjukkan bahwa proses adsorpsi SSLH untuk ion logam Pb(II) bersifat baik.
Sedangkan parameter untuk isoterm Freundlich, yaitu konstanta yang menggambarkan kapasitas adosrpsi relatif dari adsorben (Kf) dan konstanta yang menggambarkan intensitas adsorpsi (n). Jika nilai n berada pada rentang 1 – 10, maka proses adsorpsi bersifat baik (Fan et al. 2008). Nilai n yang diperoleh dalam penelitian ini sebesar 2.857 yang menunjukkan bahwa proses adsorpsi SSLH bersifat baik. Dari hasil perhitungan (Lampiran 6) diketahui harga energi adsorpsi SSLH terhadap Pb(II) sebesar -2.206 Kj/mol untuk pola isoterm Langmuir dan 6.208 Kj/mol untuk pola isoterm Freundlich. Berdasarkan harga energi adsorpsi, maka adsorpsi Pb(II) oleh SSLH merupakan adsorpsi fisik. Nilai (-) pada energi isoterm Langmuir menunjukkan bahwa proses adsorpsi berlangsung spontan, sedangkan energi bebas pada model isoterm Freundlich menunjukkan nilai positif yang berarti proses adsorpsinya tidak berlangsug secara spontan (Ghorbani et al. 2016).
Tabel 5 Parameter-parameter Adsorpsi SSLH terhadap Pb(II)
Langmuir Freudlich
Qm (mg/g)
b (L/mg)
RL E
(Kj/mol) R
2 n Kf E
(Kj/mol) R
2
62.5 0.381 0.071 -2.206 0.995 2.857 12.05 6.208 0.912
Selektivitas SSLH dalam Penjerapan Pb(II)
22
Tabel 6 Perbandingan logam, konsentrasi terjerap, % adsorpsi
Perbandingan Logam % Adsorpsi
(1:1:1) Pb 55.413
Cd 16.730
Zn 55.581
(2:1:1) Pb 99.853
Cd 28.394
Zn 57.583
(1:2:2) Pb 99.816
Cd 52.400
Zn 33.619
Hasil pada Tabel 6 menunjukkan bahwa penjerapan ion logam Pb(II) oleh SSLH (kondisi optimum) tidak dipengaruhi oleh adanya logam lain dalam campuran. Persen adsorpsi terhadap Pb(II) terpaut jauh dari dua logam lainnya (Cd dan Zn). Adsorpsi ion logam terjadi melalui pengikatan ion logam dan gugus imidazol pada histidina. Teori asam basa lunak keras (HSAB) menunjukkan bahwa gugus imidazol merupakan borderline basa begitupun dengan Pb dan Zn yang merupakan borderline asam, sedangkan Cd merupakan asam lunak (Roat-Malone dan Rosette 2007), sehingga Pb dan Zn pada perbandingan konsentrasi yang sama (1:1:1) lebih mudah berinteraksi dengan SSLH dibandingkan dengan Cd.
Kecenderungan ion logam untuk berikatan dengan adsorben dalam campuran dipengaruhi oleh elektonegativitas dan jari-jari ionnya (Ghorbani et al.
23
5
SIMPULAN DAN SARAN
Simpulan
Silika asal sekam padi termodifikasi L-histidina (SSLH) telah berhasil disintesis sebagai adsorben ion logam Pb(II). Kapasitas adsorpsi maksimum SSLH diperoleh pada kondisi optimum (pH= 5; bobot adsorben= 0.1 gram; dan waktu kontak= 15 menit) adalah 62.5 mg/g. Dengan keberadaan dua logam lain yaitu Zn dan Cd, SSLH mampu mengadsorpsi logam Pb(II) lebih baik dibandingkan dengan penjerapan dua logam lainnya, meskipun belum cukup selektif. Diharapkan silika sekam termodifikasi L-histidina (SSLH) mampu dikembangkan sebagai media pengekstrak untuk logam Pb(II).
Saran
Untuk pengujian selektivitas dapat diujicobakan ke logam trivalent ataupun monovalent, dapat pula digunakan anion-anion serta mempertimbangkan ion-ion logam yang selalu terdapat bersama timbal. Media pengektrak yang telah dibuat dapat diaplikasikan ke dalam catridge SPE dan mengujikan langsung pada
catridge tersebut untuk menggantikan metode ektraksi lompok yang digunakan dalam penelitian ini.
DAFTAR PUSTAKA
[EPA] Environmental Protection Agency (US). (2015). Lead Renovation, Repair, and Painting Program Rules. Retrieved from http://www.epa.gov > lead > renovation, repair, and painting program rules.
Amelia R, Wonorahardjo S, Joharmawan R. 2013. Preparasi Silika, Alumina untuk Menurunkan Kadar Ion Logam Cd2+ dan Pb2+ sebagai Co-Ion
dalam Campuran [Internet]. Malang (ID): Jurnal online UM. [diunduh 2016 Agustus 17] Tersedia pada: http://jurnal-online.um.ac.id/ .
Champagne ET. 2004. Rice, Chemistry and Technology. Minnesota (US): American Association of Cereal Chemists.
Djatmiko R, Amaria. 2012. Modifikasi silika gel sekam padi dengan 8-hidroksiquinolin sebagai adsorben Ni (II) dalam medium air. UNESA J of Chem. 1(2):58-65.
24
Gau AA, Taba P, Budi P. 2015. Modifikasi silika mesopori MCM-48 dengan 3-aminopropiltrimetoksisilan (3-APTMS) dan uji adsorptivitasnya terhadap ion Pb2+. Jur. Techno. 4(2): 23-29.
Ghaedi M, Sharifpour E. 2012. Chemically modified nano silica gel with 2-((3silylpropylimino)methyl)-2-hydroxy-1-naphtol (SPIMHN) as good and efficient adsorbent for solid phase extraction. Des Water Treat. 41:315-324.doi: 10.1080/19443994.2012.664720.
Ghorbani M, Nowee SM, Ramezanian N, Raji F. 2016. A new nanostuctured material amino functionalized mesoporous silica synthesized via co-condensation method for Pb(II) and Ni(II) ion sorption from aqueous solution. Hydromet.161: 117-126.doi:10.1016/j.hydromet.2016.02.002. Gu S, Zhou J, Yu C, Luo Z, Wang Q, Shi Z. 2015. A novel two-staged thermal
synthesis method of generating nanosilica from rice husk via pre-pyrolysis combined with calcinations. J Ind Crop. 65:1-6.
Hikmawati. 2010. Produksi bahan semikonduktor silikon dari silika limbah arang sekam padi sebagai alternatif sumber silikon [tesis]. Bogor (ID): Institut Pertanian Bogor.
Jal PK, Patel S, Mirsha BK. 2003. Chemical modification of silica surface by immobilization of functional groups for extractive concentration of metal ions. Talanta. 62:1005-1028.doi:10.1016/j.talanta.2003.10.028.
Javadian H, Koutenaei BB, Khatti R, Toosi M. 2014. Application of functionalized nano HMS type mesoporous silica with N-(2-aminoethyl)-3-aminopropyl methyldimethoxysilane as a suitable adsorbent for removal of Pb (II) from aqueous media and industrial wastewater. J Saud Chem Soc. doi: 10.1016/j.jscs.2014.01.007.
Jiang N, Chang X, Zheng H, He Q, Hu Z. 2006. Selective solid-phase extraction of nickel (II) using a surface-imprinted silika sorbent. Anal Chim Acta.
577:225-231.doi: 10.1016/j.aca.2006.06.049.
Kalaphaty U, Proctor A, Schultz J. 2000. A simple method for production of pure silica from rice hull ash. Biores Technol. 73:257-262.
Kalaphaty U, Proctor A, Schultz J. 2002. An Improved method for production of silica from rice hull ash. Biores Technol. 85:285-289.
Kemeskes RI. (2010). Peraturan Menteri Kesehatan Republik Indoenesia Nomor 492 Tahun 2010 tentang Persyaratan Kualitas Air Minum. KEMENKES RI.
Koumanova B, Antova PP. 2002. Adsorptionof p-chlorophenol from aqueoussolution on bentonite and perlite. J Haz Mat.90:229-234.
Larichev YV, Yeletsky PM, Yakovlev VA. 2015. Study of silca in the rice husk and the carbon-silica nanocomposites produced from rice husk. J Phys Chem Solids. 87:58-63.
Luechinger M, Kienhöfer A, Pirngruber GD. 2006. Immobilized complexes of metals with amino acids ligands- a first step forward the development of new biomimetic catalyst. Chem Mat. doi: 10.1021/cm052130i.
Malachowski L, Holcombe JA. 2003. Immobilized poly (L-histidinae) for chelation metal cations and metal oxyanions. Anal Chim Acta. 495:151-163.doi: 10.1016/j.aca.2003.08.039.
25
Mujiyanti DR, Nuryono, Kunarti ES. 2010. Sintesis dan karakterisasi silika gel dari abu sekam padi yang diimobilisasi dengan 3-(trimetoksisilil)-1-propantiol. Sains dan Terapan Kimia. 4(2):150-167.
Nurhasni, Hendrawati, Saniyyah N. 2014. Sekam Padi untuk Menjerap Ion Logam Tembaga dan Timbal dalam Air Limbah. Valensi. 4(1): 36-44.
Nuryono, Narsito, Astuti E. 2004. Pengaruh Temperatur Pengabuan Sekam Padi Terhadap Karakter Abu dan Silika Gel Sintetik. Chem.Rev., 2 (7) 67-80 Putra GH. 2013. Adsorpsi timbal dengan hibrida merkapto-silika dari abu jerami
padi [Skripsi]. Bogor (ID): Fakultas Matematika Dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Radi S, Tighdouini S, Bacquet M, Degoutin S, Cazier F, Zaghrioui M, Mabkhot Y N. 2014. Organically modified silica with Pyrazole-3-carbaldehyde as a new sorbent for solid-liquid extraction of heavy metals. Molecules. 19: 247-262 doi:10.3390/molecules19010247.
Rahman IA, Vejayakumaran P, Sipaut CS, Ismail J, Chee CK. 2008. Effect of drying techniques on the morphology of silica nanoparticles synthesized via sol-gel process. J Ceram Int. 34:2059-2066.doi: 10.1016/j.ceramint.2007.08.014.
Roat-Malone, Rosette M. 2007. Bioinorganic Chemistry (2nd ed.). Chestertown (US): John Wiley & Son.
Rohaeti E. 1992. Pemisahan silikon dioksida (SiO2) dari sekam padi dan
karakterisasinya. [Tesis]. Bandung (ID). Institut Teknologi Bandung. Rohaeti E, Hikmawati, Irzaman. 2010. Production of semiconductor materials
silicon from silica rice husk waste as alternative silicon sources. Mater. sci. technol., 265-272.
Sembiring Z, Buhani, Suharso, Sumadi. 2009. Isoterm Adsorpsi Ion Pb(II), Cu(II), dan Cd(II) pada Biomassa Nannochloropsis, sp yang Dienkapsulasi Akuagel Silika. Indo. J. Chem. 9(1): 1-5.
Silverstein RM, Webster FX, Kiemle DJ. 2005. Spectrometric identification of organic compound (5th ed.). New York (US): John Wiley & Son.
Subramanyam B, Das A. 2009. Linearized and non-linearized isotherm models comparative study on adsorption of aqueous phenol solution in soil. Int. J. Environ Sci Tech. 6(4):633-640.
Sudarmaji, Mukono J, Corie IP. 2005. Toksikologi logam berat B3 dan dampaknya terhadap kesehatan. J Kes Ling. 2(2): 129-142.
Suherni. 2010. Keracunan timbal di Indonesia [Ulasan]. Sydney (US): The Global Lead Advice and Support Service (GLASS) [diunduh 2014 Nov 22] Tersedia pada: http://www.lead.org.au/.
Sulastri S, Kristianingrum S. 2010. Berbagai macam senyawa silika: Sintesis, Karakterisasi, dan Pemanfaatan. Seminar Nasional Penelitian, Pendidikan dan Penerapan MIPA; tahun bulan tanggal; 2010 Mei 15; Yogyakarta, Indonesia.
Thuadaij N, Nuntiya A. 2008. Synthesis and characterization of nanosilica from rice husk ash prepared by precipitation method. J Nat Sci. 7(1):59-65. Vejayakumaran P, Rahman IA, Sipaut CS, IsmailJ, Chee CK. 2008. Structural and
26
Yu W, Xia C, Sheng-Chao Y, Qing-Hui LV, Fang-Gui Y, Shu-Lin Z. 2014. Preparation and characterization of polymer solid-phase extraction monolith immobilized metal affinity ligands. Chinese J Anal Chem.
42(4):495-500.doi: 10.1016/s1872-2040(13)60722-7.
Zakharov AI, Belyakov AV, Tsviguno AN. 2003. Forms of extraction of silicon compound in rice. J Glass Ceram. 50(9): 37-41.
27
LAMPIRAN
28
Lampiran 1 Diagram Alir Penelitian
Penentuan Selektivitas Penentuan Kapasitas Adsorpsi dan Isoterm
Adsorpsi Pengabuan Arang
Sekam Padi
Pembuatan Natrium Silikat
Pembuatan Silika Sekam Padi
Pembuatan 3-aminopropilsilika
Modifikasi L-histidina pada 3-aminopropilsilika FTIR
Pengoptimuman pH, Bobot Adsorben, dan
Waktu kontak FTIR, XRD
29
Lampiran 2 Rancangan percobaan pengoptimuman CCD untuk adsorpsi Pb oleh SSLH
pH Bobot SSLH
Waktu Kontak
% Adsorpsi Kapasitas Adsorpsi (mg/g)
6 0.1 67.5 99.489 26.791
6 0.3 67.5 99.231 8.907
4 0.5 120 98.471 5.784
4 0.1 15 90.758 26.653
6 0.3 67.5 99.627 8.943
8 0.5 120 98.368 5.340
8 0.5 15 97.013 5.266
8 0.1 15 99.993 27.141
6 0.3 15 99.324 35.662
8 0.1 120 99.513 27.011
6 0.3 120 94.894 8.518
6 0.3 67.5 99.637 8.944
6 0.3 67.5 98.873 8.875
4 0.5 15 99.471 5.842
6 0.3 67.5 99.118 8.897
6 0.5 67.5 99.954 5.383
4 0.3 67.5 98.328 9.625
4 0.1 120 87.170 25.600
6 0.3 67.5 99.380 8.920
8 0.3 67.5 97.039 8.780
Lampiran 3 Kurva kalibrasi larutan logam Pb, Cd, dan Zn
Kurva kalibrasi logam Pb(II)
Sampel Konsentrasi
(mg/L) Absorbansi
Standar 1 0.5 0.0074
Standar 2 1 0.0164
Standar 3 2 0.0290
Standar 4 4 0.0575
31
Lanjutan Lampiran 3
Kurva kalibrasi logam Zn(II)
Sampel Konsentrasi
(mg/L) Absorbansi
Standar 1 0 0.0035
Standar 2 0.5 0.2317
Standar 3 1 0.4043
Standar 4 1.5 0.5604
Standar 5 2 0.7719
Lampiran 4 Data hasil estimasi koefisien regresi CCD mmenggunakan Minitab 16
Response Surface Regression: % Adsorpsi versus pH, Bobot, Waktu
The analysis was done using coded units.
Estimated Regression Coefficients for % Adsorpsi
Term Coef SE Coef T P Constant 99.2451 0.5440 182.434 0.000 pH 1.7730 0.5004 3.543 0.005 Bobot 1.6354 0.5004 3.268 0.008 Waktu -0.8142 0.5004 -1.627 0.135 pH*pH -1.4627 0.9543 -1.533 0.156 Bobot*Bobot 0.5752 0.9543 0.603 0.560 Waktu*Waktu -2.0376 0.9543 -2.135 0.059 pH*Bobot -3.0174 0.5595 -5.393 0.000 pH*Waktu 0.6828 0.5595 1.220 0.250 Bobot*Waktu 0.5529 0.5595 0.988 0.346
S = 1.58244 PRESS = 192.273
R-Sq = 87.95% R-Sq(pred) = 7.46% R-Sq(adj) = 77.10% y = 0.3731x + 0.0213
R² = 0.9959
0 0.2 0.4 0.6 0.8 1
0 0.5 1 1.5 2 2.5
Ab
so
rb
an
si
32
Lanjutan Lampiran 4
Response Surface Regression: Kapasitas Adsorpsi versus pH, Bobot, Waktu
The analysis was done using coded units.
Estimated Regression Coefficients for Kapasitas Adsorpsi
Term Coef SE Coef T P Constant 10.8738 2.086 5.213 0.000 pH 0.0034 1.919 0.002 0.999 Bobot -10.5580 1.919 -5.502 0.000 Waktu -2.8313 1.919 -1.476 0.171 pH*pH -4.6104 3.659 -1.260 0.236 Bobot*Bobot 2.2741 3.659 0.622 0.548 Waktu*Waktu 8.2769 3.659 2.262 0.047 pH*Bobot -0.3648 2.145 -0.170 0.868 pH*Waktu 0.1319 2.145 0.062 0.952 Bobot*Waktu 0.1498 2.145 0.070 0.946
S = 6.06783 PRESS = 2575.13
R-Sq = 80.21% R-Sq(pred) = 0.00% R-Sq(adj) = 62.39%
Lampiran 5 Plot Pengoptimuman hasil pengolahan CCD menggunakan Minitab 16
Cur
High
Low 0.94208D Optimal
d = 0.95658 Maximum % Adsorp
y = 99.4429
d = 0.92780 Maximum
Kapasita
y = 33.4673
0.94208 Desirability Composite
15.0 120.0
0.10 0.50
4.0
8.0pH Bobot Waktu
33
Lampiran 6 Data hasil analisis isoterm Langmuir dan Freundlich adsorpsi Pb(II) oleh SSLH
ISOTERM LANGMUIR
Co (mg/L) Ce (mg/L) Qe (mg/g) Ce/Qe
34.5 0.642 8.464 0.076
95 1.833 15.125 0.121
209.166 16.917 48.062 0.352
370 101.667 67.083 1.516
462.916 225.833 59.271 3.810
Keterangan : Ce = konsentrasi adsorbat dalam kesetimbangan (mg/L); Co = konsentrasi awal ion logam dalam larutan (mg/L); Qe = konsentrasi adsorbat didalam adsorben pada kondisi kesetimbangan atau kapasitas adsorpsi (mg/g)
Persamaan isoterm Langmuir:
y = 0.016x + 0.042 R² = 0.995
=
⁄
Slope =
0.016 ⁄
= 0.042
= = 2.625 b = 0.381 L/mg
= 0.071
Perhitungan energi adsorpsi isoterm Langmuir
∆E adsorpsi = -∆G = RT ln b
= 8.314 J K-1 mol-1 x 300 K (ln 0.381) = -2406.793 J mol-1