PENGUJIAN BAKTERI PELARUT FOSFAT ASAL TANAH
PENAMBANGAN BATUAN KAPUR CIREBON PADA BIBIT
TANAMAN LAMTORO (Leucaena leucocephala L.)
SATYA RATNA LESTARI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI DAN PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pengujian Bakteri Pelarut Fosfat Asal Tanah Penambangan Batuan Kapur Cirebon pada Bibit Tanaman Lamtoro (Leucaena leucocephala L.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka pada bagian akhir dari skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Satya Ratna Lestari
ABSTRAK
SATYA RATNA LESTARI. Pengujian Bakteri Pelarut Fosfat Asal Tanah Penambangan Batuan Kapur Cirebon pada Bibit Tanaman Lamtoro (Leucaena
leucocephala L.). Dibimbing oleh NISA RAHMANIA MUBARIK DAN YADI
SURYADI.
Penggunaan pupuk hayati dapat menjadi alternatif untuk meningkatkan produksi tanaman. Bakteri pelarut fosfat merupakan salah satu pupuk hayati yang memiliki kemampuan melarutkan fosfat dalam tanah. Dengan demikian, bakteri ini dapat membantu proses pemulihan lahan pascatambang batuan kapur untuk proses rehabilitasi lahan. Tanaman lamtoro (Leucaena leucocephala L.) dapat digunakan untuk revegetasi pada proses pemulihan lahan pascatambang. Penelitian ini bertujuan mengetahui potensi bakteri pelarut fosfat asal tanah pascatambang batuan kapur Cirebon sebagai pupuk hayati terhadap pertumbuhan bibit tanaman lamtoro. Penambahan pupuk kompos dan isolat QC3A1 pada media tanam menghasilkan nilai P tersedia bagi tanaman paling tinggi. Penambahan pupuk kandang dan isolat QC3A2 memberikan pengaruh yang nyata terhadap jumlah tangkai anak daun lamtoro hingga 83 hari setelah tanam.
Kata kunci: batuan kapur, bakteri pelarut fosfat, lamtoro, pupuk hayati
ABSTRACT
SATYA RATNA LESTARI. The examination of Phosphate Solubilizing Bacteria from Soil of Cirebon Limestone Quarry Used on Leucaena (Leucaena leucocephala
L.) Seedling. Supervised by NISA RACHMANIA MUBARIK and YADI SURYADI
Bio-fertilizer can be used alternatively to enchance crop production. Phosphate solubilizing bacteria is one of the bio-fertilizer that can dissolve mineral of phosphate. Therefore, this bacteria can be used to recover the land of limestone quarry for land rehabilitation. Leucaena (Leucaena leucocephala L.) can be used for revegetation in the land of limestone quarry recovery. The objective of the research was to use the potential of phosphate solubilizing bacteria from Cirebon limestone quarry on leucaena seedlings. The addition of compost and QC3A1 bacterial isolate in the soil of planting media produced highest P solublelized. The addition of manure and QC3A2 bacterial isolate had significant effect for the number of petiololus of leucaena until 83 days after planting.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan IPB
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
PENGUJIAN BAKTERI PELARUT FOSFAT ASAL TANAH
PENAMBANGAN BATUAN KAPUR CIREBON PADA BIBIT
TANAMAN LAMTORO (Leucaena leucocephala L.)
SATYA RATNA LESTARI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT, berkat rahmat dan karunia-NYA sehingga penulis dapat menyelesaikan karya ilmiah ini dengan baik. Shalawat serta salam semoga selalu tercurah kepada Rasulullah SAW. Penelitian ini dilaksanakan bulan Januari hingga Mei 2015 dengan judul “Pengujian Bakteri Pelarut Fosfat Asal Tanah Penambangan Batuan Kapur Cirebon pada Bibit Tanaman Lamtoro (Leucaena leucocephala L.)”. Penelitian ini merupakan salah satu syarat untuk menyelesaikan studi di Departeman Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih banyak kepada semua pihak yang terlibat dalam pembuatan karya ini terutama kepada, Dr Nisa Rachmania Mubarik, MSi, Ir Yadi Suryadi, MSc selaku dosen pembimbing atas segala bimbingan serta pengarahan, dan Ir. Hadisunarso, MSi selaku dosen penguji atas saran dan diskusi yang diberikan kepada penulis, Dr Ir Iman Rusmana, MSi selaku Ketua Departemen Biologi, Prof Ir Alex Hartana selaku pembimbing akademik, Staf pengajar dan administrasi Departemen Biologi, Institut Pertanian Bogor, Kedua orang tua yang selalu mendukung, mendoakan, dan memberi semangat serta motivasi. Kakak (almh. Satya Wirantika) dan Adik tersayang (Sintya Wulandari dan Azril Prambudiawarsa) yang memberi semangat kepada penulis, Reza Febriyansyah, SPi, Ramadhanul Fitra Yandra, Tiara Sayusti, Seftiyana, Wira Agung Pratikto, Nurul Mudjalifah yang selalu mendukung dan menemani setiap langkah penelitian ini serta sahabat-sahabat Biologi 48 yang selalu menghibur dan memberi semangat kepada penulis, Teman-teman dan kakak-kakak mikrobiologi atas segala bantuannya, Pak Jaka, Ibu Heni dan Kak Sari selaku penanggung jawab laboratorium mikrobiologi yang telah membantu dalam penelitian dan semua pihak yang telah membantu penulis yang tidak dapat disebutkan satu-persatu.
Semoga tulisan ini dapat bermanfaat bagi semua pihak yang membutuhkannya.
Bogor, Juli 2015
DAFTAR ISI
DAFTAR GAMBAR xvi
DAFTAR LAMPIRAN xvi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODE PENELITIAN 2
Waktu dan Tempat 2
Bahan 2
Peremajaan Bakteri Pelarut Fosfat (BPF) 2
Penanaman Bibit Tanaman Lamtoro 3
Uji Efektivitas BPF dengan Aplikasi Siram pada Bibit Lamtoro 3
Perkiraan Jumlah Sel Bakteri di dalam Tanah dengan Metode Total Plate Count (TPC) 3
Analisis Data 3
HASIL DAN PEMBAHASAN 4
Peremajaan Bakteri Pelarut Fosfat 4
Bahan Organik Tanah 4
Perkiraan Jumlah Sel Bakteri di dalam Tanah dengan Metode Total Plate Count (TPC) 5
Pengamatan Pengaruh Bakteri pada Pertumbuhan Lamtoro 6
Pembahasan 7
SIMPULAN DAN SARAN 10
Simpulan 10
Saran 10
DAFTAR PUSTAKA 11
LAMPIRAN 14
DAFTAR GAMBAR
1. Isolat QC3A1 dan QC3A2 4
2. Hasil analisis P tersedia pada setiap perlakuan di 65 hari setelah tanam. 5 3. Log sel hasil TPC asal tanah semua perlakuan hari ke-50 setelah tanam 6
DAFTAR LAMPIRAN
1. Komposisi media Pikovskaya 14
2. Hasil metode Total Plate Count tanah dari setiap perlakuan pada
media Nutrient Agar dan media Pikovskaya 14 3. Hasil analisis sidik ragam (Anova) masing-masing parameter saat panen
(83 hari setelah tanam) 16
1
PENDAHULUAN
Latar Belakang
Fosfat merupakan unsur makro yang penting bagi pertumbuhan tanaman setelah unsur Nitrogen. Fungsi yang paling esensial ialah keterlibatannya dalam penyimpanan dan transfer energi di dalam tanaman (Havlin et al. 2005). Fosfat juga berperan pada proses fotosintesis dan metabolisme karbohidrat sebagai fungsi regulator pembagian hasil fotosintesis antara sumber dan organ reproduksi, pembentukan intisel, pembelahan dan perbanyakan sel, dan pengalihan sifat-sifat keturunan (Munawar 2011). Pasokan fosfat yang cukup dapat meningkatkan kualitas buah, pakan ternak, sayuran, dan biji tanaman (Havlin et al. 2005).
Ketersediaan fosfat di tanah biasanya dalam bentuk fosfat organik dan fosfat anorganik. Meskipun kandungan fosfat dalam tanah yang subur melimpah namun hanya sebagian kecil fosfat tersedia yang dapat diserap oleh tanaman. Rata- rata kandungan P organik di dalam tanah berkisar antara 5 sampai 50 % dari total P (Saparatka 2002). Namun P dalam bentuk organik tidak dapat segera digunakan oleh tanaman, tetapi perlu ditransformasi terlebih dahulu menjadi P anorganik melalui proses mineralisasi oleh enzim tanah (Sylvia et al. 2005). Sementara itu, kandungan fosfat pada batuan kapur sangat sedikit yaitu kurang dari 0,5% sedangkan kandungan kalsium yang merupakan pengikat fosfat lebih dari 75% (Lamar 1961). Oleh karena itu penggunaan pupuk fosfat masih banyak dilakukan dan hal tersebut dapat mengakibatkan kerusakan lingkungan jika penggunaan berlebih. Penggunaan pupuk hayati dapat menjadi alternatif untuk produksi tanaman yang baik tanpa harus merusak lingkungan (Zaidi et al. 2009). Pupuk hayati merupakan pupuk yang mengandung mikroorganisme salah satunya bakteri pelarut fosfat (BPF) (Kudashev 1956).
Bakteri pelarut fosfat memiliki kemampuan melarutkan fosfat dalam tanah dengan beberapa mekanisme pelarutan fosfat. BPF dapat menyediakan hara bagi tanaman dengan melarutkan P-terjerap menjadi bentuk P-tersedia sehingga dapat memulihkan kesuburan tanah (Shovitri dan Hefdiyah 2014). IIImer et al. (1995) menyatakan bahwa mekanisme pelarutan fosfat dari bahan yang sukar larut banyak dikaitkan dengan aktivitas mikrob yang mempunyai kemampuan menghasilkan enzim fosfatase, fitase, dan asam organik hasil metabolisme seperti asam asetat, propionat, glikolat, fumarat, oksalat, suksinat, tartrat, sitrat, laktat, dan ketoglutarat. Asam-asam organik tersebut akan bereaksi dengan ion-ion pengikat P (Ca2+, Fe3+,dan Al3+) menjadi bentuk yang stabil (khelat) sehingga unsur P akan dibebaskan dan tersedia bagi tanaman (Premono 1994).
2
di Indonesia, L. leucocephala dapat tumbuh walaupun tidak optimal. Penelitian Mursyida et al. (2015) menunjukkan ada dua isolat BPF hasil isolasi dari tanah pascatambang batuan kapur Cirebon yang memiliki potensi pelarutan fosfat paling tinggi pada media Pikovskaya yaitu Burkholderia cepacia QC3A1 dan Serratia
marcescens QC3A2. Namun belum ada penelitian lebih lanjut mengenai potensi
kedua isolat ini sebagai pupuk hayati pada tanaman lamtoro.
Tujuan Penelitian
Penelitian ini bertujuan mengetahui potensi bakteri pelarut fosfat asal tanah pascatambang batuan kapur Cirebon sebagai pupuk hayati terhadap pertumbuhan bibit tanaman lamtoro.
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari hingga Mei 2015. Peremajaan dan persiapan inokulum bakteri dilakukan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB. Penanaman biji hingga pembibitan tanaman lamtoro dilakukan di Rumah Kaca Mikrobiologi, Departemen Biologi, FMIPA IPB.
Bahan
Bahan yang digunakan dalam penelitian ini ialah dua isolat BPF
Burkholderia cepacia QC3A1 dan Serratia marcescens QC3A2 (Mursyida 2015)
dari koleksi biakan bagian Mikrobiologi, FMIPA IPB, media Pikovskaya dengan komposisi berdasarkan Pikovskaya (1948) (Lampiran 1), media Nutrient Agar
(NA) dengan komposisi Peptic digest of animal tissue 5g/L, Sodium chloride
5g/L, Beef extract 1,5 g/L, Yeast extract 1,5 g/L dan Agar 20g/L, tanah dari kebun percobaan Cikabayan, biji Lamtoro dari Balai Teknologi Perbenihan Ciheuleut, Bogor, pupuk kompos dan pupuk kandang dari toko Darmaga Tani(Lampiran 4)
Peremajaan Bakteri Pelarut Fosfat
3
Penanaman Bibit Tanaman Lamtoro
Biji dari tanaman lamtoro diseleksi untuk mendapatkan kualitas bibit yang baik. Biji direndam air selama 24 jam untuk menyeleksi biji, biji yang rusak akan terapung ke permukaan kemudian dibuang. Biji yang sudah direndam kemudian ditanam pada media tumbuh yang sudah diisi dengan media tanam (tanah). Biji diletakkan pada tempat yang teduh dan sedikit cahaya. Biji disiram setiap hari sampai memunculkan kecambah tanaman dan siap untuk diberi perlakuan.
Uji Efektivitas BPF dengan Aplikasi Siram pada Bibit Lamtoro
Bibit tanaman lamtoro yang berusia 10-14 hari ditumbuhkan di dalam polibag yang berukuran 12 x 20 cm berukuran 2 kg. Perlakuan yang akan digunakan yaitu tanah tanpa perlakuan (sebagai kontrol) dengan kode K, tanah+ BPF dengan kode B1 (isolat QC3A1) dan B2 (isolat QC3A2), tanah + kompos (komposisi 3:1) dengan kode CS, tanah + pupuk kompos (komposisi 3:1) + BPF dengan kode CSB1 dan CSB2, tanah + pupuk kandang (komposisi 3:1) dengan kode MS, tanah + pupuk kandang (komposisi 3:1) + BPF dengan kode MSB1 dan MSB2. Masing-masing perlakuan disusun dengan rancangan acak lengkap dan dilakukan dengan 3 kali ulangan. Pupuk kompos dan pupuk kandang yang digunakan tidak disterilisasi. Bakteri pelarut fosfat yang digunakan ialah sebanyak 7 mL suspensi dengan jumlah sel 1x108 sel/mL kemudian pada 13 HST (hari setelah tanam) BPF disiram pada bagian permukaan tanah polibag yang berisi bibit lamtoro. Penyiraman BPF dilakukan sebanyak 3 kali yaitu pada 13 HST, 27 HST, dan 41 HST. Parameter yang diukur pada saat panen (83 HST) ialah panjang tajuk, panjang akar, jumlah tangkai anak daun, bobot basah, dan bobot kering tanaman.
Perkiraan Jumlah Sel Bakteri di dalam Tanah dengan Metode Total Plate Count (TPC)
Sebanyak 1 gram tanah dari masing-masing perlakuan diencerkan dalam garam fisiologis hingga pengenceran ke-6. Pada hasil pengenceran dilakukan metode cawan sebar pada cawan yang berisi media Nutrient Agar (NA) dan Pikovskaya, lalu diinkubasi selama 24 jam untuk media NA dan 72 jam untuk media Pikovskaya. Metode ini dilakukan pada hari ke-50 dan ke-80 setelah tanam sebanyak 2 kali ulangan.
Analisis Data
Data hasil pengamatan dianalisis menggunakan program SPSS versi 2.1
dan Sirichai Statistics versi 6.00. Hasil analisis lalu dilanjutkan dengan
4
HASIL DAN PEMBAHASAN
Peremajaan Bakteri Pelarut Fosfat
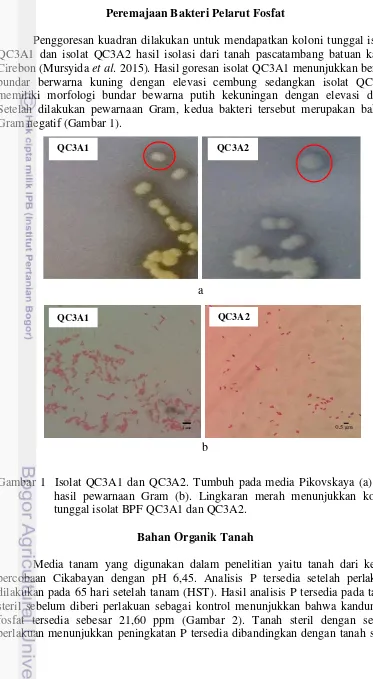
Penggoresan kuadran dilakukan untuk mendapatkan koloni tunggal isolat QC3A1 dan isolat QC3A2 hasil isolasi dari tanah pascatambang batuan kapur Cirebon (Mursyida et al. 2015). Hasil goresan isolat QC3A1 menunjukkan bentuk bundar berwarna kuning dengan elevasi cembung sedangkan isolat QC3A2 memiliki morfologi bundar bewarna putih kekuningan dengan elevasi datar. Setelah dilakukan pewarnaan Gram, kedua bakteri tersebut merupakan bakteri Gram negatif (Gambar 1).
Gambar 1 Isolat QC3A1 dan QC3A2. Tumbuh pada media Pikovskaya (a) dan hasil pewarnaan Gram (b). Lingkaran merah menunjukkan koloni tunggal isolat BPF QC3A1 dan QC3A2.
Bahan Organik Tanah
Media tanam yang digunakan dalam penelitian yaitu tanah dari kebun percobaan Cikabayan dengan pH 6,45. Analisis P tersedia setelah perlakuan dilakukan pada 65 hari setelah tanam (HST). Hasil analisis P tersedia pada tanah steril sebelum diberi perlakuan sebagai kontrol menunjukkan bahwa kandungan fosfat tersedia sebesar 21,60 ppm (Gambar 2). Tanah steril dengan semua perlakuan menunjukkan peningkatan P tersedia dibandingkan dengan tanah steril
b a
QC3A2 QC3A1
5
sebelum diberi perlakuan. Penambahan pupuk kompos dan pupuk kandang tanpa perlakuan bakteri dapat meningkatkan P tersedia pada media tanam. Jumlah P tersedia pada penambahan pupuk kompos 52,60% lebih tinggi dibandingkan dengan kontrol sedangkan penambahan pupuk kandang hanya meningkatkan 1,38% jumlah P tersedia. Penambahan kedua isolat bakteri QC3A1 dan isolat bakteri QCA2 juga dapat meningkatkan jumlah P tersedia dibandingkan dengan kontrol. Penambahan isolat bakteri QC3A1 dapat meningkatkan P tersedia sebesar 54,10% dan penambahan isolat QC3A1 meningkatkan 37,10% dibandingkan dengan kontrol. Jumlah P tersedia dengan penambahan isolat bakteri QC3A1 lebih tinggi dibandingkan dengan penambahan isolat bakteri QC3A2 sebesar 6,64 ppm. Penambahan kedua isolat bakteri BPF pada perlakuan pupuk kompos maupun pupuk kandang juga menunjukkan jumlah P tersedia yang lebih tinggi dibandingkan dengan perlakuan pupuk tanpa isolat bakteri. Penambahan isolat bakteri QC3A1 pada pupuk kompos menunjukkan peningkatan sebesar 47,34 ppm atau 79,20% dibandingkan dengan pupuk kompos tanpa penambahan isolat bakteri. Pupuk kandang dengan penambahan isolat bakteri QC3A1 menunjukkan peningkatan P tersedia paling signifikan yaitu lebih dari dua kali jumlah P tersedia pada perlakuan pupuk kandang tanpa bakteri.
Gambar 2 Hasil analisis P tersedia pada setiap perlakuan di 65 hari setelah tanam. Keterangan; K: Kontrol, CS: Tanah dan Pupuk Kompos, MS: Tanah dan Pupuk Kandang, B1: Pemberian isolat QC3A1, dan B2: Pemberian isolat QC3A2
Perkiraan Jumlah Sel Bakteri di dalam Tanah dengan Metode Total Plate Count (TPC)
6
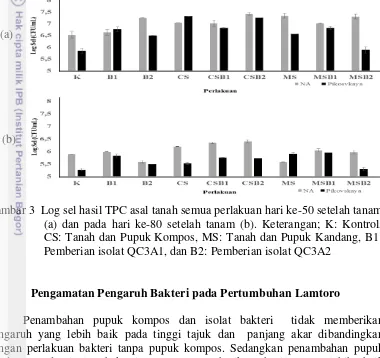
dibandingkan dengan media NA. Perlakuan pupuk kompos mengalami penurunan sebesar 24% jumlah bakteri pada hari ke-80. Jumlah bakteri pada perlakuan B1 dan B2 menunjukkan jumlah BPF yang lebih banyak dibandingkan dengan kontrol pada hari ke-50 dan 80. Penambahan pupuk kompos maupun pupuk kandang tanpa bakteri pada hari ke-50 menunjukkan jumlah bakteri yang lebih tinggi dibandingkan dengan penambahan pupuk dengan bakteri. Perlakuan bakteri dengan ditambahkan pupuk kompos memiliki jumlah bakteri yang paling tinggi dibandingkan dengan perlakuan lain hingga 80 HST (Gambar 3).
Gambar 3 Log sel hasil TPC asal tanah semua perlakuan hari ke-50 setelah tanam (a) dan pada hari ke-80 setelah tanam (b). Keterangan; K: Kontrol, CS: Tanah dan Pupuk Kompos, MS: Tanah dan Pupuk Kandang, B1: Pemberian isolat QC3A1, dan B2: Pemberian isolat QC3A2
Pengamatan Pengaruh Bakteri pada Pertumbuhan Lamtoro
Penambahan pupuk kompos dan isolat bakteri tidak memberikan pengaruh yang lebih baik pada tinggi tajuk dan panjang akar dibandingkan dengan perlakuan bakteri tanpa pupuk kompos. Sedangkan penambahan pupuk kandang pada isolat bakteri QC3A2 memberikan hasil yang lebih baik dibandingkan dengan perlakuan isolat bakteri QC3A2 tanpa pupuk kandang. Penambahan isolat QC3A1 dan pupuk kandang menunjukkan respon yang paling baik untuk tinggi tajuk. Perlakuan isolat QC3A1 memberikan hasil yang paling baik untuk panjang akar dibandingkan dengan perlakuan isolat QC3A1 dan pupuk kompos. Penambahan pupuk kandang pada isolat bakteri memberikan pengaruh yang lebih baik untuk bobot basah tajuk dibandingkan dengan perlakuan isolat bakteri tanpa pupuk kandang. Sedangkan penambahan pupuk kompos pada isolat QC3A1 memberikan pengaruh yang lebih buruk dibandingkan dengan perlakuan isolat tanpa pupuk kompos. Perlakuan isolat QC3A2 tanpa pupuk kandang maupun pupuk kompos memberikan pengaruh yang paling baik pada bobot basah dan bobot kering akar dibandingkan dengan penambahan pupuk kandang maupun pupuk kompos pada kedua isolat bakteri. Namun penambahan
(a)
7
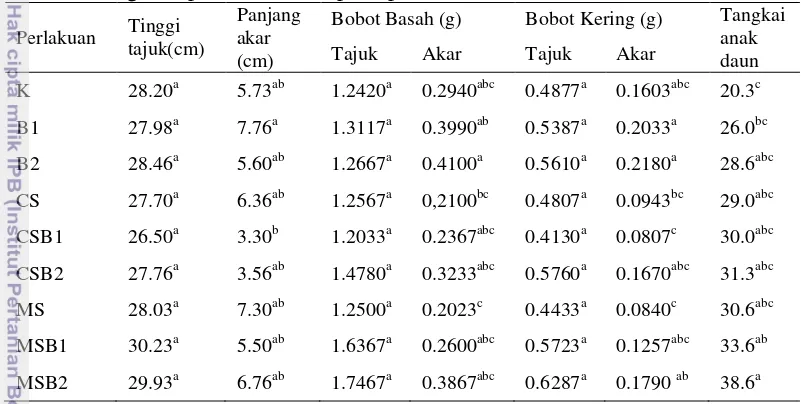
pupuk kandang dan pupuk kompos pada isolat QC3A2 memberikan pengaruh yang baik terhadap bobot kering tajuk dibandingkan dengan perlakuan isolat QC3A2 tanpa penambahan pupuk. Penambahan pupuk kandang dan pupuk kompos pada kedua isolat memberikan pengaruh yang lebih baik terhadap jumlah tangkai anak daun dibandingkan dengan perlakuan isolat bakteri tanpa penambahan pupuk.. Penambahan pupuk kandang dan isolat QC3A2 memberikan pengaruh yang nyata terhadap jumlah tangkai anak daun dibandingkan dengan kontrol (Tabel 1).
Tabel 1 Pengaruh perlakuan BPF pada pertumbuhan bibit lamtoro di 83 HST Perlakuan Tinggi
tajuk(cm)
Panjang akar (cm)
Bobot Basah (g) Bobot Kering (g) Tangkai
anak
CSB2 27.76a 3.56ab 1.4780a 0.3233abc 0.5760a 0.1670abc 31.3abc
MS 28.03a 7.30ab 1.2500a 0.2023c 0.4433a 0.0840c 30.6abc
MSB1 30.23a 5.50ab 1.6367a 0.2600abc 0.5723a 0.1257abc 33.6ab
MSB2 29.93a 6.76ab 1.7467a 0.3867abc 0.6287a 0.1790 ab 38.6a
Keterangan: Angka pada setiap kolom yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf 5% (DMRT). K: Kontrol, CS: Tanah dan Pupuk Kompos, MS: Tanah dan Pupuk Kandang, B1: Pemberian isolat QC3A1, dan B2: Pemberian isolat QC3A2
Pembahasan
Isolat QC3A1 dan QC3A2 merupakan kedua isolat yang memiliki pelarutan fosfat paling tinggi di antara 45 isolat BPF yang disolasi dari tanah pascatambang batuan kapur Cirebon. Identifikasi secara molekular menunjukkan isolat QC3A1 merupakan bakteri Burkholderiacepacia sedangkan isolat QC3A2 adalah bakteri Serratia marcescens (Mursyida et al. 2015). Pewarnaan Gram yang dilakukan menunjukkan kedua isolat tersebut tergolong ke dalam bakteri Gram negatif dengan morfologi batang untuk isolat QC3A1 dan batang pendek untuk isolat QC3A2. Burkholderia cepacia merupakan bakteri pelarut fosfat yang memiliki mekanisme pelarutan fosfat melalui produksi asam organik seperti asam glukonik dan asam ketoglukonik (Bar et al. 1999). Asam glukonik merupakan asam organik utama dalam pelarutan fosfat anorganik yang dihasilkan dalam jumlah yang banyak oleh beberapa BPF salah satunya Burkholderia cepacia
(Goldstein et al. 1999). Bakteri ini juga memiliki potensi sebagai agen penghasil zat pemacu pertumbuhan dan meningkatkan hasil panen sehingga dapat menjadi alternatif untuk berbagai jenis pupuk kimia (Tabacchioni et al. 1993). Serratia
marcescens juga memiliki kemampuan melarutkan fosfat melalui produksi asam
8
dan asam propionat (Chen et al 2006). Bakteri ini dapat melarutkan P-terjerap, ditandai dengan terbentuknya zona bening dengan ukuran yang besar pada media yang mengandung FePO4, AlPO4, atau Ca3(PO)4 (Khalil dan Sohail 2013).
Serratia telah banyak digunakan sebagai pupuk hayati. Hasil penelitian Khalil dan Sohail (2013) menunjukkan penambahan inokulum S. marcescens pada biji sebelum ditanam dapat meningkatkan jumlah perkecambahan biji pada tanaman kacang hijau dan tanaman buncis. Penggunaan bakteri S. marcescens dan
Pseudomonas sp. dalam pupuk kompos dapat meningkatkan produktivitas
tanaman dan dapat menggantikan penggunaan pupuk P kimia (Hameeda et al. 2008)
Pelarutan fosfat dalam tanah dipengaruhi oleh pH dan konsentrasi kation. Pada sebagian besar tanah, maksimum ketersediaan P terjadi antara pH 5,5–7. Pada kisaran pH ini, penggunaan P paling efisien terjadi pada tanah netral dan berkapur dan P diikat oleh Fe, Al, dan Mn. Sementara antara pH 6 - 8,5 P diikat oleh mineral silikat dan Ca (Zaidi et al. 2009). Meskipun tanah steril yang digunakan memiliki pH 6,45 dan jumlah P tersedia sebesar 21,60 ppm dan tergolong tanah agak subur dalam hal ketersediaan fosfat. Namun, jumlah P tersedia di media tanam pada 65 HST dengan penambahan isolat QC3A1 dan isolat QC3A2 lebih tinggi dibandingkan dengan kontrol. Peningkatan yang cukup signifikan ini disebabkan karena kemampuan kedua isolat BPF dalam melarutkan fosfat pada media tanam. Burkholderia QC3A1 memiliki kemampuan melarutkan fosfat tertinggi pada hari ke-5 sebesar 50,83 mg/L dan Serratia QC3A2 melarutkan P tertinggi pada hari ke-7 yaitu 80,61 mg/L (Mursyida et al. 2015). Pelarutan P tersebut diduga disebabkan oleh produksi asam organik oleh kedua isolat tersebut. Pada pH 4 hingga 7 Burkholderia cepacia menggunakan 0-5000 µM asam glukonik untuk melarutkan fosfat (Zaidi et al. 2009). Hasil penelitian Lavania dan Nautiyal (2013) menunjukkan pada pH 7 S. marcescens dapat menghasilkan 65 mM asam salisilat 23 mM asam sitrat, 12,7 mM asam oksalat dan 0,5 mM asam asetat.
9
Hasil metode cawan sebar menunjukkan bahwa masih ada bakteri pada tanah tanpa perlakuan (kontrol). Meskipun tanah yang digunakan merupakan tanah yang sudah disteril namun masih banyak bakteri yang dapat tumbuh. Perlakuan pupuk kompos dan pupuk kandang juga menunjukkan adanya bakteri lain yang berasal dari pupuk tersebut. Namun tidak semua bakteri yang tumbuh pada media tanam memiliki kemampuan melarutkan fosfat. Media Pikovskaya merupakan media selektif untuk BPF yang mengandung tri calsium phosphate
(Pikovskaya 1948), oleh karena itu jumlah bakteri pada media ini lebih sedikit dibandingkan dengan jumlah bakteri pada media NA. Hasil metode cawan sebar juga menunjukkan bahwa Burkhoderia QC3A1 yang disiramkan pada media tanam mendominasi pada jumlah total koloni yang terhitung (Lampiran 3).
Jumlah bakteri pada semua perlakuan media tanam mengalami penurunan. Hasil penelitian Mursyida et al. (2015) menunjukkan bahwa jumlah sel isolat QC3A1 mengalami penurunan hingga hari ke-7 inkubasi pada media cair Pikovskaya sedangkan jumlah sel isolat QC3A2 berada dalam fase stasioner pada hari ke-7 inkubasi. Oleh karena itu, penurunan yang terjadi dapat disebabkan oleh penyiraman isolat BPF yang hanya dilakukan tiga kali. Kompetisi antar mikrob untuk mendapatkan nutrisi di dalam media tanam juga bisa menjadi penyebab berkurangnya jumlah bakteri pada hari ke-80 setelah tanam. Pertumbuhan bakteri di dalam tanah dipengaruhi oleh nutrisi, pH, dan suhu (Pettersson 2004). Kebutuhan nutrisi yang berbeda untuk setiap mikrob membuat keberadaan nutrisi menjadi fluktuasi (Pettersson 2004), sehingga berpengaruh terhadap pertumbuhan dan jumlah mikrob tersebut.
Penelitian untuk menguji potensi kemampuan BPF ini biasanya menggunakan tanah masam atau tanah kapur dengan kandungan fosfat yang rendah. Namun penelitian ini dilakukan pada tanah jumlah P tersedia yang cukup sehingga pemberian inokulum BPF tidak menunjukkan pengaruh yang besar dibandingkan dengan kontrol pada hasil pengukuran tinggi tajuk, panjang akar, bobot basah dan bobot kering tajuk. Penambahan pupuk kompos dan pupuk kandang yang tidak steril dengan isolat bakteri QC3A1 dan isolat QC3A2 pada penelitian ini memberikan pengaruh berbeda terhadap pertumbuhan bibit lamtoro. Penambahan pupuk kompos pada isolat QC3A1 dan isolat QC3A2 menunjukkan hasil yang negatif terhadap bobot kering akar dibandingkan dengan perlakuan isolat bakteri tanpa penambahan pupuk kompos. Hal tersebut dapat disebabkan oleh sifat antagonistik antara BPF yang diberikan dengan bakteri yang berasal dari pupuk kompos. Meskipun kedua isolat BPF memiliki kemampuan melarutkan fosfat, namun dalam kondisi lingkungan yang tidak steril karena penambahan pupuk yang tidak disterilisasikan, bakteri asal tanah maupun pupuk akan mempengaruhi pertumbuhan kedua isolat BPF. Kemampuan beberapa bakteri yang melarutkan fosfat tidak dapat maksimal jika hidup pada kondisi in-situ
10
merupakan organ penting tanaman untuk berlangsungnya fotosintesis. Transpor hasil fotosintesis memerlukan ATP yang merupakan energi yang kaya akan fosfat, sehingga ketersediaan fosfat dalam jumlah yang cukup dapat meningkatkan jumlah dan lebar daun (Sultenfuss dan Doyle 1999). Perlakuan isolat QC3A2 dengan penambahan pupuk kandang menghasilkan jumlah tangkai anak daun yang paling baik dan banyak. Serratia marcescens dan Pseudomonas sp. dapat meningkatkan biomasa tanaman jagung (Hameeda et al. 2008). Daun lamtoro memiliki kandungan N sebesar 2,94%, dan P 0,09% (Pangaribuan et al. 2011). Kandungan N pada daun lamtoro lebih besar dibandingkan dengan kandungan fosfat. Namun, fosfat memiliki peran yang penting dalam fiksasi nitrogen. Translokasi komponen N dari bintil ke bagian lain pada tanaman merupakan sistem simbiosis penting dan fosfat merupakan bagian yang diperlukan dalam sistem pengangkutan (Sultenfuss dan Doyle 1999). Kandungan N tersedia pada pupuk kandang 78% lebih besar dibandingkan dengan kandungan N tersedia pada pupuk kompos (MPS 1985) sehingga penambahan pupuk kandang juga berperan dalam peningkatan jumlah daun lamtoro.
Efektivitas penggunaan bakteri pelarut fosfat tidak hanya disebabkan oleh kemampuannya dalam meningkatkan ketersediaan P tetapi juga kemampuannya dalam menghasilkan zat pengatur tumbuh seperti Indole-3-Acetic Acid (IAA) dan asam giberelin (GA3) (Arshad dan Frankenberger 1993). Penyiraman inokulum BPF pada tanaman lamtoro memberikan pengaruh positif terhadap bobot basah dan bobot kering akar. Perlakuan isolat QC3A2 menunjukkan hasil yang paling baik untuk pengukuran bobot basah akar. Selain memiliki kemampuan melarutkan fosfat, Serratia dapat memproduksi zat pemacu pertumbuhan seperti IAA, Siderofor, dan HCN (Selvakumar et al. 2008). Hasil penelitian Khalil dan Sohail (2013), Serratia marcescens meningkatkan panjang akar pada tanaman buncis. Isolat QC3A1 memberikan pengaruh yang paling baik terhadap bobot kering akar. Kelompok bakteri Burkholderia ini juga menghasilkan Aminocyclopropane carboxylate (ACC) deaminase, IAA, Siderofor dan dapat melarutkan logam berat (Jiang et al. 2008).
SIMPULAN DAN SARAN
Simpulan
Penambahan pupuk kompos dan isolat bakteri pelarut fosfat QC3A1 pada media tanah menghasilkan nilai P tersedia paling tinggi. Pemberian isolat QC3A1 berpengaruh terhadap bobot kering akar. Penambahan pupuk kompos pada isolat QC3A1 dan QC3A2 tidak berpengaruh baik terhadap pertumbuhan akar. Penambahan pupuk kandang pada isolat bakteri pelarut fosfat QC3A2 memberikan pengaruh yang nyata terhadap jumlah tangkai anak daun tanaman lamtoro hingga 83 hari setelah tanam.
Saran
11
nyata dan dapat diaplikasikan pada proses reklamasi tanah pascatambang. Perlu dilakukan analisis kimia tanah dan pupuk secara lengkap. Pupuk yang digunakan seharusnya disterilkan terlebih dahulu.
DAFTAR PUSTAKA
[MPS] Midwest Plant Service. 1985. Livestock Waste Facillities Handbook. 2nd
Edition. Ames (US): Iowa State University.
Arshad M, Frankenberger WT. 1993. Microbial Production of Plant Growth Regulators. Di dalam: Meltind FB, editor. Soil Mirobial Ecology. New York (US): Marcel Dekker, Inc.
Bar YB, Rogers RD, Wolfram JH, Richman E. 1999. Pseudomonas cepacia
mediated rock phosphate solubilization in kaolinite and montmorillonite suspensions. Soil Sci Soc Am J. 63:1703-1708.
Chen YP, Rekha PD, Arun AB, Shen FT, Lai WA, Young CC. 2006. Phosphate solubilizing bacteria from subtropical soal and their tricalcium phosphate solubilizing abilites. Appl Soil Ecol. 34:33-41.
Goldstein AH, Braverman K, Osorio N. 1999. Evidence for mutualism between a plant growingin a phosphate limited desert environment and a mineral phosphate solubilizing (MPS) bacterium. FEMS Microbiol Ecol. 3:295-300. Hameeda B, Harini G, Rupela OP, Wani SP, Reddy G. 2008. Growth promotion
of maize by phosphate solubilizing bacteria isolated from composts and macrofauna. Microbiol Res. 163:234-242.
Havlin JL, Beaton JD, Nelson WL. 2005. Soil fertility and fertilizer. An introduction to nutrient management. Di dalam: Munawar A, editor. Kesuburan
Tanah dan Nutrisi Tanaman. Bogor (ID): IPB Press
Illmer P, Barbato A, Schinner F. 1995. Solubilizing of hardy soluble AlPO4 with P-solubilizing bacteria microorganism. Soil Biol Biochem. (27):265-270.
Jiang C, Sheng X, Qiam M, Wang Q. 2008. Isolation and characterization of a heavy metal resistant Burkholderia sp from heavy metal-contaminated paddy field soil and its potential in promoting plant growth and heavy metal acumulationin metal-polluted soil. Chemosphere. 72:157-164.
Khalil S, Sohail M. 2013. Indigeneously isolated phosphate solubilizing bacteria and their application as biofertilizer. Trends Life Sci. 2(2):10-16.
Kudashev IS. 1956. The effect of phosphobacterin on the yield and protein contentin grains of Auntum wheat, maize and soybean. Doki Akad Skh Nauk. 8:20-23.
Lamar JE. 1961. Uses of Limestone and Dolmite. Urbana (US): State of Illinois Lavania M, Nautiyal CS. 2013. Solubilization of tricalsium phosphate by
temperature and salt tolerant Serratia marcescens NBRI1213 isolated from alkaline soils. Afr J Microbiol Res. 7(34):4403-4413.
Munawar A. 2011. Kesuburan Tanah dan Nutrisi Tanaman. Bogor (ID): IPB Press
12
Pangaribuan DH, Pratiwi OL, Lismawanti. 2011. Pengurangan pemakaian pupuk anorganik dengan penambahan bokhasi serasah tanaman pada budidaya tanaman tomat. J Agron Indones. 39(3):173-179.
Pettersson M. 2004. Factors affecting rates of change in soil bacterial communities [tesis]. Swedia (SWE): Lund University.
Pikovskaya RI. 1948. Mobilization of phosphorus in soil connection with vital capacity of source microbial spesies. Microbiologiya. 17:362-370.
Premono E. 1994. Jasad renik pelarut fosfat pengaruhnya terhadap P-tanah dan efisiensi pemupukan P-tanaman tebu [disertasi]. Bogor (ID): Program Pascasarjana. IPB.
Purwantari, ND, Prawiradiputra BR, Sajimin. 2005. Leucaena: Taxonomi,
Adaptasi, Agronomi dan Pemanfaatan. Prosiding Lokakarya Nasional
Tanaman Pakan Ternak. Bogor 16 September 2005; Bogor, Indonesia. Bogor
(ID): BALITBANG Pertanian
Rodriguez H, Fraga R. 2000. Phosphate solubilizing bacteria and their role in plant growth promotion. Biotechnol Adv.17:319-339.
Sarapatka B. 2002. Phosphatase activity of Eutric cambisols (upland, Sweeden) in realtion to soil properties and farming systems. Original paper publish in Acta
Agricult Bohemica 33 (1):18-24.
Selvakumar G, Mohan M, Kundu S, Gupta AD, Joshi P, Najim S, Gupta HS. 2008. Cold tolerance and plant growth promotion potensial of Serratia
marcescens starian SRM (MTTC 8708) isolated from flowers of summer
squash (Curcubita pepo). Let Appl Microbiol. 46:171-175.
Sharma SB, Sayyed RZ, Trivedi MH, Gobi TA. 2013. Phosphate solubilizing microbes: sustainable approach for managing phosphorus deficiency in agricultural soils. SpringerPlus. 2:587-601.
Shovitri M, Hefdiyah. 2014. Potensi isolat bakteri Edwardsiella dan
Corynebacterium dari Pulau Poteran Sumenep sebagai pelarut fosfat. J Teknik
Pomit. 3(2):75-79.
Sultenfuss JH, Doyle WJ. 1999. Better Crops with Plant Food: Phosphorus for Agriculture. Norcross (US): Potash & Phosphate Institute (PPI).
Suriadikarta DA, Setyorini D. 2005. Baku Mutu Pupuk Organik, dalam Pupuk
Organik dan Pupuk Hayati. Jawa Barat (ID): Balai Besar Litbang Sumberdaya
Lahan Pertanian, Departemen Pertanian.
Surtinah. 2013. Pengujian kandungan unsur hara dalam kompos yang berasal dari serasah tanaman jagung manis (Zea mays saccharata). J Ilm Pertan. 1(11). Sylvia D, Hartel P, Fuhrmann J, Zuberer D. 2005. Principle and Application of
Soil Microbiology. Ed ke-2. New Jersey (US): Pearson Prentice Hall.
Tabacchioni S, Bevivino A, Chiarini L, Visca P, Del Gallo M. 1993. Characteristics of two rhizosphere isolates of Pseudomonas cepacia and their potential plant growth promoting activity. Microb Releases. 2:161-168.
Thaller MC, Berlutti F, Schippa S, Iori P, Passariello C, Rossolini GM. 1995. Heterogeneous patterns of acid phosphatases containing low-molecular-mass Polipeptides in members of the family Enterobacteriaceae. Int J Syst Bacteriol. 4:61-255.
Winarso S, Sulistyanto D, Handayanto E. 2011. Effect of humic compound and phosphate solubilizing bacteria on phosphorus availability in an acid soil. J
13
14
LAMPIRAN
Lampiran 1 Komposisi media Pikovskaya
Komposisi Jumlah (g l-1)
Glukosa 10
Ca3(PO4)2 5
(NH4)2SO4 0.5
NaCl 0.2
MgSO4.7H2O 0.1
KCl 0.2
Ekstrak Khamir 0.5
MnSO4.H2O 0.002
FeSO4.7H2O 0.002
pH 7.0
Lampiran 2 Hasil metode Total Plate Count tanah dari setiap perlakuan pada media Nutrient Agar dan media Pikovskaya
Perlakuan NA Pikovskaya
K -
15
B2
CS
CSB1
16
MS
MSB1
MSB2
Keterangan: K: Kontrol, CS: Tanah dan Pupuk Kompos, MS: Tanah dan Pupuk Kandang, B1: Pemberian isolat QC3A1, dan B2: Pemberian isolat QC3A2. Zona bening menunjukkan kemampuan isolat bakteri dalam melarutkan tri-kalsium fosfat pada media Pikovskaya
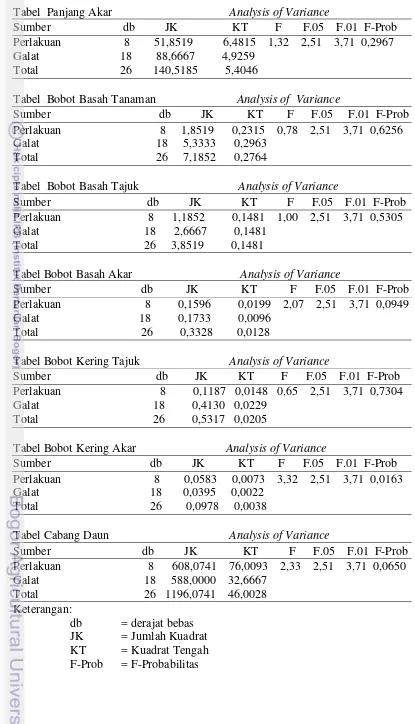
Lampiran 3 Hasil analisis sidik ragam (Anova) masing-masing parameter saat panen (83 hari setelah tanam)
Tabel Tinggi Tanaman Analysis of Variance
Sumber db JK KT F F.05 F.01 F-Prob Perlakuan 8 35,6296 4,4537 0,33 2,51 3,71 0,9444 Galat 18 245,3333 13,6296
18
Lampiran 4 Pupuk kandang dan pupuk kompos
A B
19
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 15 Februari 1994 dari ayah Caca Suwarsa dan Ibu Cicih Mintarsih. Penulis adalah putri kedua dari empat bersaudara. Pada tahun 2011 penulis menyelesaikan pendidikan menengah atas di SMA Rimba Madya Bogor. Pada tahun yang sama penulis diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB.
Penulis memiliki pengalaman sebagai asisten praktikum pada mata kuliah Biologi Dasar pada tahun 2013 hingga 2015 dan Mikrobiologi Dasar pada tahun 2015. Penulis juga aktif dalam Divisi Observasi Wahana Alam (OWA) Himpunan Profesi Mahasiswa Biologi sebagai Sekertaris Umum pada tahun 2013-2014.