KARAKTERISTIK GENETIK
KLON IKAN SUMATRA (
Puntius tetrazona
Bleeker)
HASIL GINOGENESIS
TRI YUSUFI MARDIANA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa segala pernyataan dalam tesis
KARAKTERISTIK GENETIK KLON IKAN SUMATRA (
Puntius tetrazona
Bleeker) HASIL GINOGENESIS)
adalah benar merupakan gagasan dan hasil
penelitian saya sendiri dibawah arahan komisi pembimbing. Semua data dan sumber
informasi yang digunakan dalam tesis ini telah dinyatakan secara jelas dan
dicantumkan dalam Daftar Pustaka di bagian akhir tesis serta dapat diperiksa
kebenarannya. Tesis ini belum pernah diajukan untuk memperoleh gelar pada
program studi sejenis di Perguruan Tinggi lain.
Bogor, Agustus 2007
RINGKASAN
TRI YUSUFI MARDIANA. Karakteristik Genetik Klon Ikan Sumatra (
Puntius
tetrazona
Bleeker) Hasil Ginogenesis. Dibimbing oleh KOMAR
SUMANTADINATA, DINAR TRI SOELISTYOWATI dan UTUT WIDYASTUTI.
Rekayasa set kromosom dengan teknologi ginogenesis 2 tahap telah dilakukan
dalam rangka penyedian populasi klon ikan sumatra sebagai hewan percobaan.
Penelitian ini bertujuan untuk memproduksi klon ikan sumatra dan melakukan
verifikasi genotip klon hasil ginogenesis berdasarkan analisis RAPD, determinasi
kelamin dan ciri meristik. Pada ginogenesis tahap I, kejutan panas diberikan pada fase
mitosis I untuk mendapatkan mitogen sebagai calon induk klon. Pada ginogenesis
tahap II, kejutan panas diberikan pada fase meiosis yang menghasilkan klon.
ABSTRACT
TRI YUSUFI MARDIANA. The Genetic Characteristics of Gynogen Clon in
Sumatra Fish (
Puntius tetrazona
Bleeker). Under supervision of KOMAR
SUMANTADINATA, DINAR TRI SOELISTYOWATI, and UTUT WIDYASTUTI
.© Hak cipta milik IPB, tahun 2007
Hak cipta dilindungi
1.
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan
atau menyebutkan sumber
a.
Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan
karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu
masalah
b.
Pengutipan tidak merugikan kepentingan yang wajar IPB
KARAKTERISTIK GENETIK
KLON IKAN SUMATRA (
Puntius tetrazona
Bleeker)
HASIL GINOGENESIS
TRI YUSUFI MARDIANA
Tesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Ilmu Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul
: Karakteristik Genetik Klon Ikan Sumatra (
Puntius tetrazona
Bleeker)
Hasil Ginogenesis
Nama
: Tri Yusufi Mardiana
NRP
: C 151030181
Program Studi : Ilmu Perairan
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Komar Sumantadinata, MSc
Ketua
Dr. Ir. Dinar Tri Soelistyowati, DEA
Dr. Ir. Utut Widyastuti, MSi
Anggota
Anggota
Diketahui,
Ketua Program Studi
Dekan Sekolah Pascasarjana
Ilmu Perairan
Prof. Dr. Ir. Enang Harris, MS
Prof. Dr.Ir. Khairil A.Notodiputro, MS
PRAKATA
Syukur Alhamdulillah atas segala rahmat dan hidayah Allah SWT, sehingga
penulisan tesis dengan judul
KARAKTERISTIK GENETIK KLON IKAN
SUMATRA (
Puntius tetrazona
Bleeker) HASIL GINOGENESIS
dapat
diselesaikan. Tesis ini
diajukan untuk memperoleh gelar Magister pada Sekolah
Pascasarjana Institut Pertanian Bogor.
Penghargaan dan ucapan terima kasih yang sebesar-besarnya kepada Bapak
Prof. Dr. Ir. Komar Sumantadinata MSc., selaku ketua komisi pembimbing, serta Ibu
Dr. Ir. Dinar Tri Soelistyowati, DEA selaku anggota komisi pembimbing yang telah
memberikan kesempatan untuk ikut dalam kegiatan Hibah Penelitian dari Direktur
Pembinaan Penelitian dan Pengabdian pada Masyarakat DIKTI, serta Ibu Dr. Ir. Utut
Widyastuti, MSi selaku anggota komisi pembimbing. Terimakasih atas keikhlasan
dan kesabaran memberikan bimbingan nasehat, arahan dan dorongan mulai dari
penulisan proposal, selama pelaksanaan penelitian berlangsung sampai selesainya
penulisan tesis ini.
Ucapan terima kasih juga saya sampaikan kepada Rektor Universitas
Pekalongan, Departemen Pendidikan dan Kebudayaan Republik Indonesia melalui
Dana Pendidikan BPPS sehingga studi berjalan dengan lancar. Terima kasih saya
sampaikan kepada Kepala Laboratorium Pengembangbiakan dan Genetika Ikan FPIK
IPB, Pusat Studi Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB, Laboratorium
Ikan di Babakan atas izin lokasi penelitian, serta Pak Mul, Mbak Pepi, Mbak Lina.
Tim ginogenesis (Elis, Siska, Rizal, Andi, Arti) dan tim Biorin (Ibu Ayi, Udin,
Firdaus, Huda, Agustin, Zendi, Wiwid, Didi), Nazli, Hanum atas bantuannya selama
penelitian. Terima kasih kepada orang tua, adik, kakak, suami dan anak tercinta atas
segala dukungan, doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2007
RIWAYAT HIDUP
Penulis bernama Tri Yusufi Mardiana, dilahirkan di Blitar, Jawa Timur pada
tanggal 29 Maret 1975. Penulis merupakan puteri ketiga dari empat bersaudara
pasangan Bapak M. Zen Haryanta dan ibu Harmini. Pendidikan Sekolah Dasar
ditempuh di SD Negeri II Srengat Blitar, lulus tahun 1987. Sekolah Menengah
Pertama diselesaikan pada tahun 1990 di SMP I Srengat Blitar, Sekolah Menengah
Atas ditempuh di SMA I Blitar Jurusan Fisika (A1) lulus tahun 1993.
Pada tahun 1993 penulis melanjutkan di Jurusan Perikanan Fakultas
Perikanan dan Ilmu Kelautan Universitas Diponegoro Semarang melalui jalur PSSB
(Program Seleksi Siswa Berpotensi) dan lulus Strata 1 tahun 1998. Tahun 2000
sampai sekarang, penulis bekerja sebagai staf pengajar di Fakultas Perikanan
Universitas Pekalongan. Pada tahun 2003 penulis melanjutkan pendidikan Strata 2 di
Institut Pertanian Bogor pada Program Studi Ilmu Perairan (AIR). Beasiswa
pendidikan pascasarjana diperoleh dari Departemen Pendidikan dan Kebudayaan
Republik Indonesia melalui Dana Pendidikan BPPS. Penulis telah menikah dengan
Slamet Suharto, SPi dan telah dikaruniai dua anak, Hakimah Nur Yusla dan
DAFTAR ISI
Halaman
DAFTAR TABEL ………
xi
DAFTAR GAMBAR ………...
xii
DAFTAR LAMPIRAN ………
xiii
PENDAHULUAN
Latar Belakang ………...
1
Perumusan dan Pendekatan Masalah ………
2
Tujuan dan Manfaat ………...
3
TINJAUAN PUSTAKA
Ikan Sumatra ……….
4
Penggunaan Sperma dari Spesies yang Berbeda .………
4
Ginogenesis ………
5
Verifikasi Genetik Ikan Klon ……….
9
RAPD …… ………..
9
Determinasi Kelamin ………...
11
Karakter Meristik ………...
11
METODOLOGI
Waktu dan Tempat Penelitian ………
13
Metode Penelitian ………..
13
Ginogenesis ………..
13
Pemeliharaan Induk Ikan Sumatra dan Ikan Tawes ……
13
Pemijahan Ikan Sumatra ……….
13
Produksi Klon dengan Metode Ginogenesis …………...
14
Verifikasi Genetik Ikan Klon ………...
16
RAPD……. ……….
16
Isolasi DNA Genom Ikan ………..
16
Analisis RAPD ………...
17
Identifikasi Jenis Kelamin………...
20
Karakterisasi Meristik ……….
20
Analisis Data ………
20
HASIL DAN PEMBAHASAN
Keberhasilan Klon Melalui Ginogenesis ……….
22
Karakteristik Genetik Ikan Klon ………..
24
RAPD …… ……….
24
Determinasi Kelamin………...
27
Karakter Meristik ………
27
DAFTAR PUSTAKA ………..
31
DAFTAR TABEL
Halaman
1 Spesies donor sperma pada ginogenesis dari beberapa spesies
berbeda ………...
5
2
Primer-primer yang digunakan dalam RAPD-PCR……….
18
3
Campuran komponen PCR ………..
19
4
Siklus, proses, suhu dan waktu dalam amplifikasi genom ikan
sumatra………
19
5
Rerata keberhasilan ginogenesis menggunakan sperma ikan tawes
yang diradiasi dan suhu kejutan 40
oC selama 1.5 menit ………….
23
6 Jumlah pita DNA dan jumlah pita polimorfik hasil amplifikasi
DNA ikan sumatra dengan primer OPA2 dan OPA4………...
25
7
Kisaran dan keragaman ciri meristik pada ikan sumatra K2N,
mitogen dan klon ……….
DAFTAR GAMBAR
Halaman
1 Penampilan morfologis ikan sumatra (
Puntius tetrazona
) betina
dan jantan …………...
4
2 Penampilan morfologis ikan tawes jantan (
Puntius gonionotus
) ….
5
3 Diagram ginogenesis pada ikan ………
8
4 Diagram skematik produksi klon ……….
15
5 Pola-pola pita 13 sampel ikan sumatra hasil RAPD mengunakan
primer OPA 4 ………...
25
6 Dendrogram kesamaan genetik ikan sumatra normal, mitogen dan
klon ………...
DAFTAR LAMPIRAN
Halaman
1 Komposisi
Cell lysis Solution
38
2
Komposisi TE 1x………..
38
3
Komposisi TAE 50x ………...
38
4
Komposisi TBE 10x ………
38
5 Komposisi
Loading dye
6x………..
38
6
Keberhasilan mitogen dengan menggunakan metode ginogenesis
tahap I ………..
39
7
Keberhasilan produksi klon dengan metode ginogenesis tahap II
menggunakan induk mitogen pada percobaan 1 ………..
40
8
Keberhasilan produksi klon dengan metode ginogenesis tahap II
pada percobaan 2 ………
40
9
Keberhasilan produksi klon dengan metode ginogenesis tahap II
pada percobaan 3 ……….
40
10 Keberhasilan produksi klon dengan metode ginogenesis tahap II
menggunakan induk mitogen ………..
41
11 Hasil spektofotometer DNA genom ikan sumatra normal ………..
42
12 Hasil spektrofotometer DNA genom ikan sumatra mitogen ……...
42
13 Hasil spektrofotometerv DNA genom ikan sumatra klon ………...
42
14 Hasil ekstraksi DNA ikan sumatra normal, mitogen, klon ………..
43
15 Pola-pola pita 12 sampel ikan sumatra normal, mitogen dan klon
hasil RAPD mengunakan primer OPA 2 ………
43
16 Pola-pola pita 12 sampel ikan sumatra normal, mitogen dan klon
hasil RAPD mengunakan primer OPA 2 ……….
44
hasil RAPD mengunakan primer OPA 4 ……….
18 Hasil pengukuran meristik ikan sumatra normal ……….
45
19 Hasil pengukuran meristik ikan sumatra mitogen ………...
46
20 Hasil pengukuran meristik ikan sumatra klon ……….
47
PENDAHULUAN
Latar Belakang
Kegiatan penelitian terhadap berbagai aspek akuakultur memerlukan
ikan percobaan yang homogen sehingga pengaruh perlakuan tidak bias
dengan ragam yang tinggi antar individu ikan percobaan. Ikan uji yang
homogen semakin diperlukan untuk kajian respon penyakit ikan, evaluasi
pakan, pengujian obat, evaluasi strain dan sebagainya (Sumantadinata
1997).
Ikan sumatra (Puntius tetrazona Bleeker) atau yang dikenal dengan
nama tiger barb memiliki warna dasar kuning dengan belang hitam. Ikan ini
dipertimbangkan sebagai ikan percobaan karena dapat memenuhi
persyaratan seperti siklus hidupnya yang pendek (5-6 bulan), proses
budidayanya mudah, selain itu juga memiliki ornamen warna yang menarik
dan berukuran relatif kecil (3-6 cm).
Pembuatan individu yang homozigot dengan cara seleksi
konvensional membutuhkan waktu yang lama. Thomson (1983)
menyatakan bahwa satu generasi ginogenesis menghasilkan tingkat
homozigositas yang sama dengan tujuh sampai delapan generasi perkawinan
sekerabat (sib mating). Menurut Allendorf dan Leary (1984) galur murni
dapat dihasilkan dengan 2 generasi ginogenetik, sedangkan dengan
perkawinan sekerabat membutuhkan 20 generasi.
Pembentukan klon ikan dengan teknologi ginogenesis telah berhasil
dilakukan antara lain pada zebra fish (Danio rerio) (Streisinger et al. 1981),
medaka/japanese fish Oryzias latipes (Naruse et al. 1985), common carp
Cyprinus carpio (Komen et al. 1991), ayu fish Plecoglossus altivelis (Han et al. 1991), amago salmon Oncorhynchus rhodurus (Kobayashi et al. 1994) dan tilapia Oreochromis niloticus (Muller-Belecke and Horstgen-Schwark 2000).
Teknologi ginogenesis pada ikan sumatra telah dilakukan oleh
2
2 untuk menghasilkan persentase kelangsungan hidup larva tertinggi adalah
90 detik yaitu sebesar 15%, dengan kelangsungan hidup miogen lebih tinggi
daripada mitogen. Kelangsungan hidup tertinggi dicapai saat kejutan panas
diberikan pada menit ke-1 setelah pembuahan untuk miogen (9.19%) dan
pada menit ke-18 setelah pembuahan untuk mitogen (7.7%).
Verifikasi status genetik ikan klon dapat dilakukan dengan tissue
grafting, DNA fingerprint SSRa-PCR dan RAPD. Verifikasi status klon dengan metode RAPD dipakai pada tilapia (Jenneckens et al. 1999).
Metode tissue grafting telah diteliti pada ayu fish (Han et al. 1991),
Cyprinus carpio (Komen et al. 1991), salmon (Kobayashi et al. 1994). Metode DNA fingerprint telah dilakukan pada ayu (Han et al. 1991),
japanese flounder (Hara et al. 1993), rainbow trout (Young et al. 1995), red sea bream (Kato et al. 2001).
Secara umum teknik RAPD cukup sederhana, murah dan dapat
dikerjakan dalam waktu relatif singkat dibandingkan dengan teknik
molekular lain (Darmono 1996; Prana dan Hartati 2003). Kuantitas DNA
yang dibutuhkan hanya sedikit (dibutuhkan 5-25 ng DNA dalam setiap
reaksi PCR) bahkan hingga 1.5 ng DNA (Pandey et al. 1996).
Perumusan dan Pendekatan Masalah
Kegiatan akuakultur tentang kajian respon penyakit ikan, evaluasi
pakan, pengujian obat dan sebagainya, memerlukan ikan uji atau ikan
percobaan yang relatif homogen secara genetis untuk menghindari bias yang
ditimbulkan oleh faktor keragaman individu sehingga akurasinya bisa
dipertanggungjawabkan. Homogen secara genetis yaitu memiliki
homozigositas genotipik, diutamakan untuk menciptakan populasi/strain
hewan percobaan. Pembuatan individu yang homozigot dengan cara seleksi
konvensional membutuhkan waktu yang lama. Teknologi ginogenesis dalam
dua generasi merupakan alternatif untuk menghasilkan klon. Klon hasil
ginogenesis diharapkan bergenotip homozigot pada hampir seluruh gen,
karena merupakan copy genom dari induk yang bergenotip homozigot.
3
3 tanpa materi genetis jantan, dimana pada tahap I (F1) menghalangi
pembelahan mitosis I sehingga dihasilkan diploid ginogenetik homozigot
dan pada tahap II (F2) menghalangi keluarnya badan polar II pada meiosis II
yang menghasilkan copy genom yang disebut klon. Verifikasi genetik
homozigositas klon ikan sumatra akan dianalisis dengan RAPD.
Tujuan dan Manfaat
Tujuan penelitian ini adalah untuk menerapkan teknologi
ginogenesis dalam memproduksi klon ikan sebagai hewan percobaan serta
melakukan verifikasi genotipik berdasarkan analisis RAPD, determinasi
kelamin dan karakterisasi meristik pada ikan sumatra. Hasil penelitian ini
diharapkan bermanfaat untuk mengembangkan metode pemurnian genotip
TINJAUAN PUSTAKA
Ikan Sumatra
Berdasarkan klasifikasinya ikan sumatra (
Puntius tetrazona
Bleeker)
termasuk dalam famili Cyprinidae, sub famili Cyprininae, pada genus
Puntius
dengan
nama spesies
Puntius tetrazona
Bleeker (Saanin 1984). Ikan sumatra dikenal dengan
nama sumatra barb atau
tiger barb
. Bentuk tubuhnya memanjang dan pipih ke
samping, ukuran tubuh maksimal 8 cm, warna dasar tubuhnya putih keperakan,
bagian atas tubuhnya berwarna agak sawo matang dengan corak hijau, sedangkan sisi
tubuhnya berwarna kemerah-merahan, terdapat empat buah garis berwarna hitam
kebiruan yang memotong tubuh ikan yaitu pada bagian kepala, tubuh bagian depan
sirip punggung, samping sirip punggung hingga jari-jari sirip anal yang pertama,
bagian batang ekor (Gambar 1). Bagian sirip punggung ada yang berwarna hitam
sedang beberapa lain berwarna kemerahan dan transparan (Sumpeno
et al.
2004).
Berdasarkan pemijahannya ikan sumatra termasuk ikan yang menghamburkan
telurnya, telur akan disebarkan diantara tanaman air dan menetas 24 jam kemudian.
Jumlah telur antara 150-200 butir/ekor (Sastrapraja
et al
. 1981).
Gambar 1 Penampilan morfologis ikan sumatra (
Puntius tetrazona
) betina (kiri) dan
jantan (kanan).
Penggunaan Sperma dari Spesies yang Berbeda
Penggunaan sperma ikan dari spesies yang berbeda pada percobaan
ginogenesis untuk memudahkan dalam verifikasi (konfirmasi) keturunan yang
dihasilkan, yaitu terdapat perbedaan karakteristik yang jelas pada keturunan ginogen
5
ginogenesis menggunakan donor sperma yang berasal dari spesies berbeda disajikan
pada Tabel 1.
Tabel 1 Spesies donor sperma pada ginogenesis dari beberapa spesies yang berbeda
Spesies
Spesies donor sperma
Sumber
Plecoglossus altivelis Spirinchus lanceolata
Taniguchi
et al
. (1990)
Common carp
Osteochilus hasselti
Puntius gonionotus
Hypopthalmichthys molitrix
Ctenopharyngodon idella
Sumantadinata
et al
. (1990)
Puntius gonionotus
Puntius schwanenfeldii
Siraj
et al
. (1993)
Clarias
sp.
Puntius gonionotus
Yulintine (1995)
Tinca tinca
Common carp
Linhart
et al.
(1995)
Klasifikasi ikan tawes termasuk dalam famili Cyprinidae, sub famili
Cyprininae, genus
Puntius
dengan spesies
Puntius gonionotus
(Saanin 1984)
(Gambar 2). Menurut Risnawati (1995), sperma ikan tawes dapat digunakan untuk
ginogenesis pada ikan sumatra karena memiliki ukuran diameter kepala spermatozoa
yang lebih kecil daripada ikan sumatra yaitu 1.496
versus
1.907 µm dan panjang ekor
sperma 31.147
versus
30.187 µm sehingga sperma ikan tawes dapat masuk ke dalam
lubang mikrofil dan menginseminasi telur ikan sumatra.
Gambar 2 Penampilan morfologis ikan tawes (
Puntius gonionotus
) jantan.
Ginogenesis
Ginogenesis adalah proses produksi embrio dari telur-telur yang dibuahi oleh
6
Menurut Sumantadinata (1997), teknologi ginogenesis memberikan banyak manfaat
diantaranya (1) mempercepat proses pemurnian (homozigositas), (2) membuat
populasi klon hanya dalam dua generasi, (3) membuat populasi tunggal kelamin
betina, misalnya pada ikan mas, (4) mempercepat proses seleksi dan (5)
mendeterminasi genotip jenis kelamin betina. Ginogenesis dapat terjadi secara alami
dan buatan. Ginogenesis secara alami jarang terjadi karena pada umumnya
spermatozoa yang membuahi sel telur dalam keadaan aktif (Golovinskaya 1972).
Namun, ginogenesis dapat berlangsung secara spontan seperti Pb II yang akan keluar
bertabrakan dengan spermatozoa yang akan masuk sehingga gamet jantan tidak jadi
masuk dan Pb II tetap berada pada posisinya (
double haploid
). Menurut Cherfas
(1981), ginogenesis alami dapat terjadi pada ikan crusian carp (
Carrasius auratus
gibelio
) dan vivipar kecil dari famili Poeciliidae (
Poecilia
dan
Poeciliopsis
).
Menurut Nagy
et al
. (1978) dan Sumantadinata (1997), ada dua tahap penting
dalam ginogenesis buatan. Pertama menonaktifkan bahan genetik dari gamet jantan,
antara lain dapat dilakukan dengan cara radiasi. Kedua meningkatkan jumlah zigot
diploid dengan cara pemberian kejutan panas pada fase meiosis II atau mitosis I.
Penggunaan sinar UV untuk inaktifasi materi genetik lebih banyak digunakan karena
selain murah, lebih mudah dan aman digunakan dibandingkan dengan sinar gamma,
sinar X dan betta (Lou dan Purdom 1984; Horvath dan Orban 1995). Perlakuan
meradiasi sperma tidak menyebabkan berkurangnya kemampuan sperma sebagai
fungsi membuahi telur dan sebagai
trigger
perkembangan embrio (Streisinger
et al.
1981; Arai 2001). Menurut Chourrout (1984), keberhasilan inaktifasi materi genetik
jantan dengan cara radiasi sperma, bila membuahi betina akan menghasilkan embrio
haploid yang tidak bertahan hidup. Menurut Sumantadinata
et al
. (1990), pada
ginogenesis ikan mas, proses
radiasi sperma dapat dilakukan dengan menggunakan
dua lampu UV yang masing-masing berkekuatan 15 watt untuk meradiasi sperma
dengan jarak penyinaran 15 cm.
7
2000). Berbagai macam kejutan tersebut mempunyai efektifitas yang berbeda untuk
beberapa spesies ikan. Kejutan panas dan dingin sering dilakukan dalam ginogenesis
ikan karena tidak memerlukan peralatan khusus. Sedangkan kejutan tekanan banyak
digunakan pada hewan amfibi. Walaupun metode kejutan tekanan hidrostatik
membutuhkan peralatan yang khusus dan lebih mahal, namun metode ini masih terus
dikembangkan karena resiko kerusakan embrio lebih sedikit. Penggunaan bahan
kimia juga digunakan untuk menahan proses pembentukan badan polar II pada telur
ikan yang baru dibuahi, antara lain dengan colchisine pada poliploid ikan brook trout
(Smith dan Lemoine 1979), nitrous oxide (Shelton
et al
. 1986) pada triploid ikan
rainbow trout.
Kejutan diberikan pada saat yang tepat setelah pembuahan (Hollebecq
et al
.
1986), pada saat meiosis kedua atau mitosis pertama (Lou dan Purdom 1984;
Taniguchi
et al
. 1988; Komen
et al
. 1988). Pemberian kejutan panas pada saat
meiosis kedua dimaksudkan untuk menahan keluarnya badan polar kedua sehingga
menghasilkan diploid ginogenetik. Sedangkan pada mitosis pertama, kejutan panas
akan menghalangi pemisahan genom haploid maternal yang telah mengalami
segregasi total sehingga menghasilkan zigot diploid (
double haploid
) (Chourrout
1984).
Menurut Taniguchi
et al
. (1988), diploid ginogenetik yang dihasilkan dari
perlakuan diploidisasi pada saat meiosis kedua dinamakan diploid ginogenetik
meiotik (G2N-meiotik/meiogen), sedangkan diploid ginogenetik yang dihasilkan
pada perlakuan diplodisasi saat mitosis pertama dinamakan diploid ginogenetik
mitotik (G2N-mitotik/mitogen). Menurut Tave (1986) dan Purdom (1993), individu
ginogen dimungkinkan mengalami penyimpangan biologis maupun fisiologis yang
diduga terkait dengan proses ginogenesis maupun munculnya gen-gen resesif yang
tidak menguntungkan.
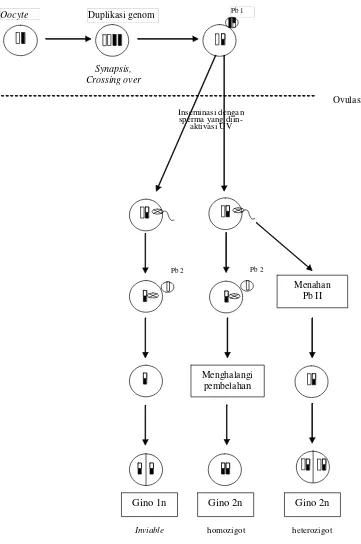
Pada G2N-meiotik genotip diploid berasal dari 1N kromosom pronukleus
betina dan 1 N badan polar II. Dengan demikian genotip meiogen dipengaruhi oleh
pindah silang antar gen pada lokus yang sama. Sedangkan pada G2N-homozigot/
8
Pb 1
Duplikasi genom Oocyte
Menghalangi pembelahan
Menahan Pb II
Gino 1n Gino 2n Gino 2n
Inviable homozigot heterozigot
Ovulasi Synapsis,
Crossing over
Inseminasi dengan sperma yang
diin-aktivasi UV
Pb 2 Pb 2
9
Ikan klon adalah individu homozigot identik dengan induknya, yaitu
dihasilkan melalui proses ginogenesis dua tahap (Sumantadinata 1997; Arai 2001).
Ginogenesis tahap pertama (generasi I) menghasilkan G2N-mitotik yaitu individu
homozigot identik (
double haploid
) dengan cara menghambat pembelahan pada fase
mitosis I. Ginogenesis tahap II (generasi II) adalah perbanyakan individu yang identik
dengan G2N-mitotik (generasi I) dengan melakukan ginogenesis fase meiosis yaitu
mencegah keluarnya badan kutub II. Klon hasil ginogenesis pada tahap II diharapkan
bergenotip homozigot pada hampir seluruh gen, karena merupakan kopi genom dari
genotip homozigot (G2N-mitotik).
Verifikasi Genetik Ikan Klon
RAPD
Verifikasi genetis ikan klon dapat dilakukan dengan berbagai metode antara
lain dengan
tissue grafting
, DNA
fingerprint
SSRa-PCR dan RAPD.
Tissue grafting
pernah dilakukan pada
ayu
fish
(Han
et al
. 1991),
Cyprinus carpio
(Komen
et al.
1991),
salmon
(Kobayashi
et al
. 1994). Metode DNA
fingerprint
telah dilakukan
pada
ayu fish
(Han
et al.
1991),
japanese flounder
(Hara
et al
. 1993),
rainbow trout
(Young
et al
. 1995),
red sea bream
(Kato
et al
. 2001). Sedangkan metode SSRa-PCR
dan RAPD digunakan pada
tilapia
(Jenneckens
et al
. 1991).
RAPD (
Random Amplified Polymorphic DNA
) adalah salah satu metode yang
digunakan untuk analisis profil DNA genom. Teknik RAPD ini merupakan suatu
metode analisis DNA genom dengan cara melihat pola pita DNA yang dihasilkan
setelah DNA genom diamplifikasi menggunakan primer acak. Prinsip dasar RAPD
adalah komplementasi urutan
basa primer dengan urutan basa DNA cetakan. Apabila
terdapat komplementasi urutan basa antara primer dan DNA cetakan, maka primer
akan menempel pada kedua ujung 3’OH utas DNA cetakan. Jika kedua situs
penempelan primer berada dalam jarak yang dapat diamplifikasi, maka produk PCR
akan diperoleh berupa fragmen atau pita DNA (Tingey
et al
. 1992).
Metode RAPD mendeteksi polimorfisme urutan nukleotida pita DNA hasil
10
akan berpasangan dengan utas tunggal DNA genom yang satu dan pada utas DNA
pasangannya dengan orientasi yang berlawanan. Selama situs penempelan primer
masih berada dalam jarak yang masih dapat diamplifikasi, maka akan diperoleh
produk DNA amplifikasi. Jarak tersebut umumnya tidak lebih dari 5000 bp. Semakin
pendek fragmen yang akan diamplifikasi semakin efisien amplifikasinya (Tingey
et
al
. 1992; Weising
et al
. 1995).
Rata-rata jumlah fragmen DNA yang dihasilkan sebuah primer tunggal
tergantung pada kekompleksan genom. Makin kompleks suatu genom akan makin
kompleks pola fragmen RAPD yang dihasilkan (Grattapaglia
et al
. 1992). Disamping
itu jumlah dan kualitas fragmen RAPD yang dihasilkan bergantung pada panjang dan
komposisi nukleotida penyusun primer, konsentrasi dan kemurnian DNA cetakan,
konsentrasi ion magnesium, aktivitas dan jumlah DNA polimerase dan temperatur
penempelan (Matondang
et al
. 2001; Promega 2001).
Secara umum RAPD lebih mudah, lebih murah, dan tekniknya lebih cepat
dibandingkan dengan RFLP (
Restriction Fragment Length Polymorphism
), SSR
(
Simple Sequence Repeats
) dan AFLP (
Amplified Fragment Length Polymorphism
)
(Darmono 1996). Hal ini didasarkan pada : (1) tidak memerlukan pengetahuan latar
belakang genom yang akan diteliti, (2) primer secara universal dapat digunakan untuk
organisme prokariot maupun eukariot, (3) mampu menghasilkan karakter yang relatif
tidak terbatas jumlahnya, (4) bahan-bahan yang digunakan relatif murah, (5) mudah
dalam hal preparasi dan (6) memberikan hasil lebih cepat dibandingkan dengan
analisis keragaman molekuler lainnya. Selain itu ada beberapa kelemahan RAPD.
Darmono (1996) merangkum kelemahan dari RAPD dari beberapa publikasi : (1)
pemunculan pita DNA kadang-kadang tidak konsisten. Hal ini lebih sering terjadi jika
suhu penempelan yang digunakan terlalu tinggi, (2) ruas DNA berulang sering
berlipat ganda, (3) homologi urutan nukleotida pada pita-pita DNA dengan mobilitas
yang pada gel tidak diketahui, (4) penanda RAPD bersifat dominan. Jumlah primer
yang digunakan dalam analisis sangat bergantung pada tujuan atau jenis informasi
11
Determinasi Kelamin
Jenis kelamin suatu individu ditentukan bersama oleh faktor genetis dan
lingkungan. Faktor genetik yang menentukan jenis kelamin adalah kromosom,
sedangkan kromosom yang memegang peranan utama dalam menentukan jenis
kelamin adalah kromosom kelamin atau gonosom. Faktor lingkungan seringkali
berpengaruh terhadap perubahan jenis kelamin. Perubahan ini menyebabkan karakter
kelaminnya berubah, namun susunan genetisnya tidak berubah. Jenis kelamin zigot
merupakan hasil keseimbangan antara jumlah gen penentu jantan dan betina,
sedangkan diferensiasi kelamin secara fungsional diatur oleh mekanisme genetik
melalui sistem endokrin embrio dimana prosesnya dipengaruhi oleh faktor
lingkungan.
Pengamatan jenis kelamin ikan dapat dilakukan secara visual dengan
mengamati ciri kelamin sekunder. Ikan sumatra betina dapat dibedakan dengan
bentuk tubuh yang lebih penuh dan warna merah yang lebih sedikit pada sirip ventral,
juga di bagian hidung (Innes 1994). Pada ikan sumatra jantan, sirip dan hidung
berwarna lebih merah dibandingkan ikan betina. Keaadan ini akan terlihat jelas pada
saat ikan sumatra akan memijah (Mc Inerny dan Gerard 1966).
Karakter Meristik
Pola pewarisan ciri meristik dapat digunakan untuk menelusuri hubungan
kekerabatan yang lebih spesifik dalam penelitian ginogenesis, dalam hal ini untuk
mengetahui keberhasilan segregasi dan rekonstruksi genom pada produksi
G2N-mitotik maupun klon. Pengukuran karakter meristik pada ikan diploid ginogen (G2N)
telah dilakukan oleh beberapa peneliti. Pada ikan mas, ukuran tubuh (panjang
standar) pada miogen dan G2N-mitotik tidak berbeda nyata dibandingkan dengan
kontrol normal pada umur yang sama (3 bulan), demikian pula dengan variasi
karakter meristik (jumlah vertebrate, jumlah tulang lunak sirip dan jumlah lembar
insang). Nilai variasi fenotif (Vp) pada G2N-mitotik kurang dari dua kali individu
normal pada kebanyakan sifat morfometrik dan nilai Vp tersebut lebih dari dua kali
12
diterangkan melalui rumus tentang Vp = Vg(1+F) + Ve untuk meiogen dan Vp =
METODOLOGI
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Nopember 2004 sampai April 2006, di
Kolam Babakan Sawah Baru, Laboratorium Pengembangbiakan dan Genetika Ikan
FPIK IPB dan Pusat Studi Sumberdaya Hayati dan Bioteknologi (PSSHB) IPB
Bogor.
Metode Penelitian
Ginogenesis
Pemeliharaan Induk Ikan Sumatra dan Ikan Tawes
Induk ikan sumatra jantan dan betina dipelihara secara terpisah dalam
akuarium berukuran 100x50x50 cm dengan menggunakan sistem
double bottom
menggunakan batuan zeolit dan diberi aerasi, pakan yang diberikan berupa
Chironomus
sp. dan pakan buatan berupa pelet. Ikan tawes (
Puntius gonionotus
Blekeer) jantan sebagai pendonor sperma dipelihara terpisah dalam kolam dan diberi
pakan pelet.
Pemijahan Ikan Sumatra
Induk ikan sumatra yang akan dipijahkan terlebih dahulu dipuasakan selama
satu hari untuk mencegah terjadinya penyumbatan lemak pada saluran telur atau
sperma dan untuk mempermudah dalam memilih induk betina yang siap memijah.
Pemijahan dilakukan pada akuarium berukuran 20x20x20 cm yang telah diisi air
dengan ketinggian 10 cm dan sekelilingnya ditutup dengan plastik berwarna hitam
diberi aerasi kecil dan enceng gondok. Ikan sumatra jantan dan betina disatukan pada
pukul 21.00 WIB dengan perbandingan 1 : 1. Pengamatan induk betina yang memijah
14
Produksi Klon dengan Metode Ginogenesis
Ginogenesis Tahap I (Mitogen) dan Ginogenesis Tahap II (Klon)
Pemijahan akan ditandai dengan pengeluaran telur (biasanya menempel pada
akar enceng gondok atau tersebar pada dasar akuarium). Ikan sumatra yang memijah
diambil lalu di
stripping
(diurut bagian perutnya secara perlahan-lahan menuju anus),
kemudian telur ditampung dan didistribusikan dalam 6 cawan : 3 cawan
masing-masing untuk kontrol normal (K2N), kontrol hibrid (K2H), kontrol UV (KUV) dan 3
cawan lainnya untuk perlakuan ginogenesis dengan waktu inisiasi kejutan panas yang
berbeda-beda sesuai dengan tahapannya (mitoginogenesis pada tahap I atau
meioginogenesis pada tahap II).
Sperma ikan tawes (donor) dan ikan sumatra diambil secara terpisah
menggunakan
syringe
tanpa jarum dengan cara mengurut pada bagian perutnya
menuju anus, kemudian sperma ikan tawes diencerkan 100 kali dalam labu
erlenmeyer menggunakan larutan fisiologis merk dagang Otsu-Ns (Normal saline)
dengan komposisi Osmolarity 306 Osm/l dan 0.9% b/v sodium chloride. Sebagian
sperma ikan tawes digunakan untuk pembuahan pada K2H dan sebagian lainnya
diradiasi untuk menginaktifasi materi genetik jantan dan digunakan pada pembuahan
telur KUV. Sperma ikan sumatra digunakan untuk pembuahan telur pada K2N.
Sperma yang akan diradiasi diletakkan dalam cawan petri setebal 1 mm (1.5 ml)
sambil digoyang supaya sperma merata di permukaan cawan, kemudian dimasukkan
ke dalam wadah penyinaran sinar UV selama 1.5 menit. Wadah penyinaran berupa
kotak berukuran 100x100x30 cm, berisi 3 buah lampu UV berkekuatan 15 watt
dengan jarak penyinaran 15 cm.
Pembuahan telur oleh sperma dilakukan dengan cara mencampurkan sperma
dan telur sambil diaduk-aduk perlahan menggunakan bulu ayam kemudian diberi
larutan pembuahan untuk meningkatkan derajat pembuahan. Larutan pembuahan
(
fertilizing solution
) dibuat dari campuran 30 g urea dengan 40 g NaCl dilarutkan
dalam 10 l air bersih (Woynarovich dan Horvath 1980). Telur yang sudah dibuahi
selanjutnya dituang pada saringan dalam bak fiber yang berisi air pada suhu 28
oC
15
(tahap II) pasca perlakuan dipindahkan pada akuarium inkubasi yang berukuran
20x20x10 cm untuk penetasan telur dan berisi air yang telah diberi larutan
metilen
blue
(mb) 2 mg/l untuk mencegah jamur pada telur.
Pada ginogenesis tahap I (mitoginogenesis), inisiasi kejutan panas diberikan
pada menit ke 18, 19 atau 20 setelah pembuahan (fase mitosis) yaitu dengan
merendam telur pada suhu 40
oC selama 1.5 menit pada wadah perendaman telur
(
water bath
) yang dilengkapi dengan termometer. Pada ginogenesis tahap II, ikan
yang digunakan sebagai induk adalah mitogen (G2N-mitotik), yang bertahan hidup
sampai dewasa dijadikan induk betina untuk proses ginogenesis meiotik guna
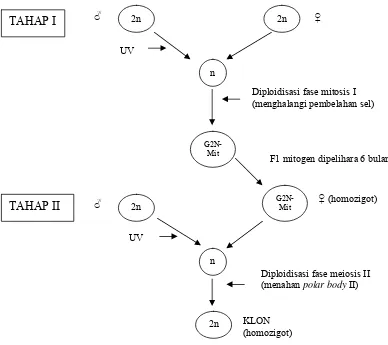
mendapatkan ikan klon (Gambar 4). Perlakuan kejutan panas 40
oC selama 1.5 menit
[image:31.612.112.500.329.674.2]diberikan pada menit ke 1 dan 2 setelah pembuahan (fase meiosis).
Gambar 4. Diagram skematik produksi klon
2n 2n
n
G2N- Mit
G2N- Mit 2n
n
2n ♂
♂ ♀
♀ (homozigot) Diploidisasi fase mitosis I (menghalangi pembelahan sel)
F1 mitogen dipelihara 6 bulan
Diploidisasi fase meiosis II (menahan polar body II)
KLON (homozigot)
TAHAP I
UV
UV
16
Perhitungan telur dilakukan pada 3 jam dan 10 jam pertama setelah telur
dibuahi (telur fertil), kemudian 12 sampai 30 jam setelah pembuahan dilakukan
perhitungan telur yang menetas (
Hatching Rate
/HR). Selanjutnya 4 hari dan 28 hari
setelah telur menetas dilakukan penghitungan kelangsungan hidup ikan (SR larva).
Telur, larva dan anak ikan yang mati diambil dengan menggunakan pipet dan
dihitung dengan menggunakan
handy counter
. Ikan diberi makan setelah berumur 2-3
hari menetas atau setelah kuning telur habis. Pakan yang diberikan untuk larva
sampai umur tujuh hari adalah plankton. Pada umur lima hari diberikan nauplius
artemia (
Artemia salina
) sampai umur tujuh hari. Seminggu berikutnya diberikan
kutu air
Daphnia
sp., setelah itu diberi
Chironomus
sp.
dan
pelet.
Verifikasi Genetik Ikan Klon
RAPD
Isolasi DNA Genom Ikan
Ekstraksi dan pemurnian genom DNA mengikuti prosedur PUREGENE.
Sampel sirip ikan yang digunakan ditimbang, berat setiap sampel 10-15 mg dan
dimasukkan dalam ependorf 1.5 ml, kemudian dilisis dengan menambahkan 300
l
cell
lysis solution
(Lampiran 1). Sampel digerus hingga hancur, kemudian
ditambah 5 l proteinase K (20 mg/ml), diinkubasi selama 24 jam pada suhu
55
oC.
Selanjutnya Rnase (4 mg/ml) ditambahkan dalam sampel sebanyak 1.5 l
yang dilakukan di atas es, kemudian diinkubasi pada suhu 37
oC selama 1 jam.
Tahap berikutnya sampel didinginkan pada suhu ruang, kemudian ditambah 100 l
larutan
protein precipitation
untuk pengendapan protein. Selanjutnya sampel
divortex selama 20 detik dan disentrifuse dengan kecepatan 14000 rpm pada suhu
4
oC selama 3 menit.
Pengendapan DNA dilakukan dengan memindahkan larutan supernatan yang
mengandung DNA ke dalam ependorf baru yang telah diisi 300 l isopropanol
100%, dibolak-balik dan disentrifuse pada 14000 rpm selama 1 menit.
17
terbalik hingga kering. Kemudian ditambahkan 300 l etanol 70% (v/v) dan
dibolak-balik agar DNA tercuci dengan sempurna. Ependorf disentrifuse kembali
pada kecepatan 14000 rpm selama 1 menit pada suhu 4
oC. Supernatan dibuang
dan pelet dikeringkan, kemudian ditambah TE 50 µl (Lampiran 2).
Analisis RAPD
Analisis RAPD terdiri dari 4 tahap : (1) uji kualitas dan kuantitas DNA
hasil isolasi; (2) seleksi primer; (3) amplifikasi DNA template melalui proses
PCR (
Polymerase Chain Reaction
); (4) elektroforesis dan visualisasi hasil
amplifikasi.
Uji Kuantitas dan Kualitas DNA
Kuantitas dan kualitas DNA dianalisis secara elektroforesis dan
spektrofotometer. Uji kuantitas DNA melalui elektroforesis dilakukan untuk
memperkirakan kuantitas per mikroliter DNA terisolasi dengan membandingkan
DNA terisolasi pada marker DNA 10,30,50 ng/µl. Pengujian DNA secara
elektroforesis ini pada prinsipnya adalah mengukur laju migrasi DNA pada gel
agarosa yang diberi tegangan tertentu dari arus (–) ke (+). Agarosa
disuspensikan di dalam larutan penyangga yang sesuai yaitu TAE lx dari larutan
TAE 50x (Lampiran 3) atau TBE lx dari larutan TBE 10x (Lampiran 4). Pada
umumnya gel agarosa menggunakan konsentrasi 0.8-1% (b/v) dalam larutan
TAE 1x. Konsentrasi agarosa tergantung pada besarnya fragmen DNA yang
dianalisis. Semakin kecil fragmen DNA, semakin tinggi konsentrasi agarosa
yang digunakan.
Suspensi agarosa dipanaskan dalam microwave hingga tidak terlihat lagi
butiran agarosa, dan larutan menjadi jernih (±60 detik). Setelah suhunya
mencapai 60-70 °C, agarosa dituangkan setebal 5 mm ke dalam tempat yang
telah disiapkan untuk menuang (
tray
yang dilengkapi sisir). Gel dibiarkan
membeku dan sisir diambil secara hati-hati, kemudian gel ditempatkan pada
alat/tanki elektroforesis sedemikian rupa sehingga lubang terletak pada kutub
18
DNA yang akan dianalisis dicampur dengan larutan pewarna (
loading
dye
) bromofenol biru 6x (Lampiran 5) untuk menandai laju migrasi. DNA yang
dianalisis berikut marker ( 10,20,30 ng) dimasukkan ke dalam sumur. Alat
elektroforesis ditutup untuk kemudian dihubungkan/dialiri listrik. Elektroforesis
berlangsung pada 100 volt selama ± 30 menit. Setelah selesai, penutup tanki
elektroforesis dibuka, gel agarosa diambil kemudian direndam dalam larutan EtBr
(Ethidium Bromida) dengan konsentrasi final 0.5
μ
g/ml selama 15-30 menit dan
selanjutnya dibilas dengan H
2O.
Uji kuantitas melalui spektrofotometer pada prinsipnya adalah melihat
densitas DNA secara optik (Optical Density-OD) pada panjang gelombang 260
nm dan disetarakan dengan 50 g/ ml setiap nilai OD = 1 pada absorbansi UV
gelombang tersebut. Kualitas DNA dapat diketahui dengan membandingkan
hasil OD pada absorbansi 260 nm terhadap 280 nm. Kualitas DNA yang bagus
adalah apabila rasio OD (260nm/280nm) berkisar 1.8-2.0. Rasio OD <1
menunjukkan adanya kontaminan pada DNA hasil isolasi. Kontaminan dapat
berupa pati, protein dan atau fenol.
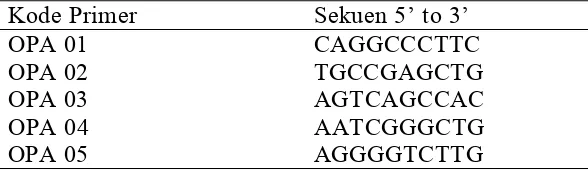
Primer
Primer RAPD dari Operon (Operon Alameda Technology Inc) yang
digunakan OPA 1, OPA 2, OPA 3, OPA 4, OPA 5 (Tabel 2). Dari lima primer
yang digunakan dilakukan seleksi untuk menentukan jenis primer yang bisa
[image:34.612.160.454.567.653.2]mengamplifikasi DNA genom.
Tabel 2 Primer-primer yang digunakan dalam RAPD-PCR
19
Amplifikasi PCR
Amplifikasi DNA dengan PCR menurut Yadav (2000) yang dimodifikasi
[image:35.612.152.460.198.339.2]dilakukan dengan cara menyediakan campuran utama (
master mix
) (Fermentas)
dalam eppendorf 2 ml (Tabel 3).
Tabel 3 Campuran komponen PCR
M
1M
2V
1(µl)
10x PCR buffer
1 x
2
2 mM dNTP mix
0.2 mM
2
Primer OPA (5 pmol)
5 pmol
1
Taq 5 u/µl (Fermentas)
1 u
0.2
25 mM MgCl
2.5 mM
2
ddH
2O
11.8
DNA 30 ng
1
V
220
Keterangan M1 : Konsentrasi stok; M2 : Konsentrasi yang diharapkan V1: Volume awal;
V2 : Volume total/akhir
Contoh DNA (hasil isolasi) sebanyak 1 l (30 ng) tiap eppendorf 0.5 ml
steril. Kemudian setiap 19 µl dari campuran utama dipipet dan dimasukkan pada
tiap-tiap eppendorf 0.5 ml kemudian dispin dan dimasukkan ke mesin PCR.
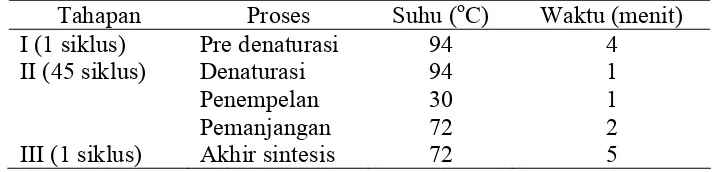
Secara umum proses PCR terdiri dari 3 tahap yaitu denaturasi
(penguraian utas ganda DNA), penempelan primer (
annealing
), pemanjangan
utas DNA primer yang komplemen template. Pre-denaturasi selama 4 menit
untuk aktifasi enzim taq polimerase, dan pada tahap akhir PCR ditambahkan
akhir sintesis 5 menit untuk meyakinkan semua hasil amplifikasi dalam bentuk
untai ganda. Proses waktu, suhu dan jumlah siklus masing-masing tahapan PCR
disajikan pada Tabel 4.
Tabel 4 Siklus, proses, suhu dan waktu dalam amplifikasi genom ikan sumatra
Tahapan Proses
Suhu
(
oC) Waktu
(menit)
I (1 siklus)
II (45 siklus)
III (1 siklus)
[image:35.612.145.501.613.699.2]20
Reaksi amplifikasi dilakukan menggunakan alat PCR (PTC-100TM MJ
Research, Inc.) dengan siklus termal sebanyak 45 kali. Hasil PCR dapat
difraksinasi dengan menggunakan gel agarosa 1.5% (b/v) dalam larutan TAE 1x.
Volume hasil PCR (yang dimigrasikan) diambil 8-10 l dan dicampur dengan 2
l
loading dye
6x. Hasil elektroforesis DNA divisualisasi menggunakan UV
transluminator dan didokumentasi dengan kamera yang telah terhubung pada
program komputer.
Identifikasi Jenis Kelamin
Jenis kelamin ikan sumatra diidentifikasi setelah ikan mencapai dewasa (6
bulan). Pengamatan jenis kelamin dilakukan secara visual dengan mengamati ciri
kelamin sekunder. Ikan sumatra jantan ditandai dengan badan yang lebih ramping dan
warna yang cerah pada bagian sekitar mulut, sirip ekor dan hidung berwarna lebih
merah. Sedangkan ikan sumatra betina warna agak kusam dan perutnya lebih buncit
setelah mencapai kematangan gonad.
Karakterisasi Meristik
Pengukuran meristik dilakukan pada ikan yang sudah berumur 6 bulan,
meliputi jumlah sisik pada
linea lateralis
, jumlah jari-jari lemah sirip punggung, sirip
dada, sirip perut, dan sirip anal.
Analisis Data
Keberhasilan ginogenesis pada produksi klon ikan sumatra dianalisis secara
deskriptif, dan ditampilkan dalam bentuk tabel. Analisis status genetik individual
hasil ginogenesis dengan teknik RAPD dibaca berdasarkan pita DNA tegas dan pita
DNA tipis secara konsisten. Pita DNA hasil amplifikasi yang terdeteksi pada
individu diberi skor 1 (ada) dan jika tidak terdeteksi diberi skor (0). Estimasi
kemiripan genetik individual diperoleh berdasarkan jumlah pita terdeteksi yang
dimiliki bersama. Untuk menentukan tingkat kesamaan yang terdapat pada lajur
yang berbeda ditentukan berdasarkan koefisien Dice atau rumus Nei dan Li (1979)
21
Keterangan : S
: Koefisien kemiripan
a dan b : dua individu yang dibandingkan
n
ab: jumlah pita DNA yang sama posisinya pada individu a dan b
n
a: jumlah pita DNA pada individu a
n
b: jumlah pita DNA pada individu b
Pengelompokan data matrik dan pembuatan dendrogram dilakukan dengan
metode
Unweight Pair Group Methode Arithmetic
(UPGMA) fungsi
Similarity
Qualitative
(SIMQUAL) program NTSYS versi 2.0 (Rohlf 1998).
Determinasi kelamin dianalisis dengan menghitung rasio jantan dan betina,
ciri meristik dianalisis dengan keragaman (V). Rumus untuk menghitung keragaman
(V) menurut Tave (1986) adalah sebagai berikut :
X =
Σ
xi/n
HASIL DAN PEMBAHASAN
Keberhasilan Klon Melalui Ginogenesis
Pada tahap I, telur pada kontrol normal dapat dibuahi sebesar 51% dan
dapat hidup pada hari ke 28 sekitar 3%, hal ini menunjukkan telur yang digunakan
relatif baik artinya telur yang digunakan bisa dibuahi oleh sperma (Tabel 5;
Lampiran 6). Pada kontrol UV menunjukkan indikasi bahwa radiasi terhadap
sperma berjalan efektif, hal ini dibuktikan dari derajat pembuahan yang tinggi,
embrio sedikit yang berkembang dan yang menetas hanya 0.7%, pada hari ke 4
mati semua (inaktifasi materi genetik yang menghasilkan individu haploid tidak
bertahan hidup pada KUV). Menurut Cherfas (1981) dan Arai (2001), embrio
yang terbentuk dari pembuahan sel telur oleh sperma yang diradiasi (KUV) adalah
haploid dimana pada umumnya tidak normal (abnormal) dikenal dengan haploid
syndrome dan akan mati selama perkembangan embrio sebelum atau beberapa saat setelah menetas, atau selama stadia awal larva sebelum mulai makan.
Pada kontrol hibrid (K2H) telur dapat berkembang hingga menetas hal ini
menunjukkan bahwa sperma dapat membuahi telur karena sperma dapat masuk
kedalam mikrofil sehingga terjadi pembuahan. Menurut Risnawati (1995), sperma
ikan tawes dapat digunakan untuk ginogenesis pada ikan sumatra karena memiliki
ukuran diameter kepala spermatozoa yang lebih kecil daripada ikan sumatra yaitu
1.496 µm versus 1.907 µm dan panjang ekor sperma 31.147 µm versus 30.187 µm
sehingga sperma ikan tawes dapat masuk ke dalam lubang mikrofil dan
menginseminasi telur ikan sumatra. Kematian kontrol hibrid setelah hari ke-4
diduga karena banyaknya embrio yang edema, cacat, dan kerusakan kuning telur
(Chevassus 1983). Mitogen yang hidup dipastikan hanya memiliki gen yang
berasal dari induk betina.
Persentase mitogen yang menetas dan bertahan hidup mencapai 2.6% pada
inisiasi kejutan panas ke-18 setelah pembuahan, kemudian 1.2% pada inisiasi
kejutan panas ke-19 dan 0.1% pada inisiasi kejutan panas ke-20. Rendahnya
kelangsungan hidup mitogen juga diakibatkan karena kejutan panas yang dapat
membuat kerusakan pada telur sehingga telur mati dan tidak sempat berkembang
(Hollebecq et al. 1986; Siraj et al. 1993).Menurut Komen et al. (1991) keturunan
23
memberikan peluang munculnya alel homozigot resesif yang biasanya bersifat
kurang menguntungkan, akibatnya lebih dari 80% yang gagal karena mortalitas
[image:39.612.132.534.204.482.2]dan infertilitas.
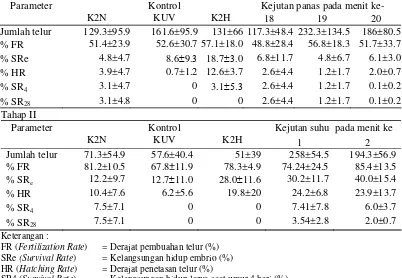
Tabel 5 Rerata keberhasilan ginogenesis menggunakan sperma ikan tawes yang
diradiasi dan suhu kejutan 40 oC selama 1.5 menit
Tahap I
Kejutan panas pada menit ke- Parameter
K2N
Kontrol
KUV K2H 18 19 20 Jumlah telur 129.3±95.9 161.6±95.9 131±66 117.3±48.4 232.3±134.5 186±80.5 % FR 51.4±23.9 52.6±30.7 57.1±18.0 48.8±28.4 56.8±18.3 51.7±33.7 % SRe 4.8±4.7 8.6±9.3 18.7±3.0 6.8±11.7 4.8±6.7 6.1±3.0 % HR 3.9±4.7 0.7±1.2 12.6±3.7 2.6±4.4 1.2±1.7 2.0±0.7 % SR4 3.1±4.7 0 3.1±5.3 2.6±4.4 1.2±1.7 0.1±0.2
% SR28 3.1±4.8 0 0 2.6±4.4 1.2±1.7 0.1±0.2
Tahap II
Kejutan suhu pada menit ke Parameter
K2N
Kontrol
KUV K2H 1 2
Jumlah telur 71.3±54.9 57.6±40.4 51±39 258±54.5 194.3±56.9 % FR 81.2±10.5 67.8±11.9 78.3±4.9 74.24±24.5 85.4±13.5
% SRe 12.2±9.7 12.7±11.0 28.0±11.6 30.2±11.7 40.0±15.4
% HR 10.4±7.6 6.2±5.6 19.8±20 24.2±6.8 23.9±13.7 % SR4 7.5±7.1 0 0 7.41±7.8 6.0±3.7
% SR28 7.5±7.1 0 0 3.54±2.8 2.0±0.7 Keterangan :
FR (Fertilization Rate) = Derajat pembuahan telur (%) SRe (Survival Rate) = Kelangsungan hidup embrio (%) HR (Hatching Rate) = Derajat penetasan telur (%)
SR4 (Survival Rate) = Kelangsungan hidup larva saat umur 4 hari (%) SR28 (Survival Rate) = Kelangsungan hidup ikan saat umur 28 hari (%)
K2H = Kontrol hibrid
K2N = Kontrol normal
KUV = Kontrol UV
Pada tahap II, perlakuan kontrol normal telur dapat dibuahi oleh sperma
ikan sumatra (Lampiran 7-10). Nilai derajat pembuahan pada ikan klon
dibandingkan dengan ginogenesis tahap I menunjukkan bahwa telur yang
dihasilkan mitogen memiliki kualitas yang bagus, artinya telur yang digunakan
bisa dibuahi oleh sperma. Pada kontrol UV dan hibrid tidak didapatkan individu
yang hidup sampai pada hari ke 4. Pada perlakuan kontrol UV telur dapat dibuahi
dan setelah menetas mati karena individu haploid hanya mempunyai 1 set
24
terhadap sperma berjalan efektif. Kematian kontrol hibrid diduga karena
banyaknya embrio yang cacat, edema dan kerusakan kuning telur (Chevassus
1983). Dengan demikian yang hidup dapat dipastikan ikan klon yang merupakan
copy genom dari induk ikan sumatra mitogen tanpa materi genetik jantan. Rerata kelangsungan hidup embrio pada inisiasi kejutan panas menit ke-2 lebih tinggi
dari pada menit ke-1 3.54% versus 2.04%. Rerata keberhasilan larva klon (SR4)
rendah diduga karena kerusakan kromosom karena perlakuan ginogenesis.
Dari hasil ginogenesis tahap I, didapatkan mitogen yang mempunyai
bentuk tubuh yang menyimpang (abnormal) sebesar 11% (2 ekor). Abnormalitas
mitogen berupa pembengkokan vertebra (depan sirip ekor) dan bagian ekor yang
pendek. Pada ginogenesis tahap II, didapatkan klon yang mengalami
penyimpangan (abnormal) sebesar 11% (2 ekor) berupa pembengkokan vertebra
(depan sirip ekor) dan ikan yang memutar. Menurut Tave (1986) dan Purdom
(1993), individu ginogen dimungkinkan mengalami penyimpangan biologis
maupun fisiologis yang diduga terkait dengan proses ginogenesis maupun
munculnya gen-gen resesif yang tidak menguntungkan.
Karakteristik Genetik Ikan Klon RAPD
Hasil seleksi dari lima primer OPA menunjukkan hanya ada dua primer
yang menunjukkan keragaman yaitu OPA 2 dan OPA 4. Amplifikasi
menggunakan 2 primer menghasilkan fragmen DNA dengan ukuran berkisar
300-3.000 bp dan jumlah pita yang bervariasi (Gambar 5; Lampiran 15-17). Perbedaan
hasil amplifikasi disebabkan adanya perbedaan jumlah tempat penempelan primer
dan jarak antara 2 primer yang menempel pada DNA cetakan. Sedangkan untuk
perbedaan ketajaman intensitas pita DNA merupakan hasil dari jumlah situs
penempelan yang serupa dari sekuen DNA berulang.
Variasi kuantitas DNA hasil amplifikasi dicerminkan oleh variasi
intensitas pendaran pita DNA di dalam gel agarosa di atas sinar UV. Semakin
banyak fragmen DNA maka pita DNA akan semakin jelas. Perbedaan intensitas
setiap pita tidak bisa digunakan untuk menduga jumlah copy potongan DNA pada
25
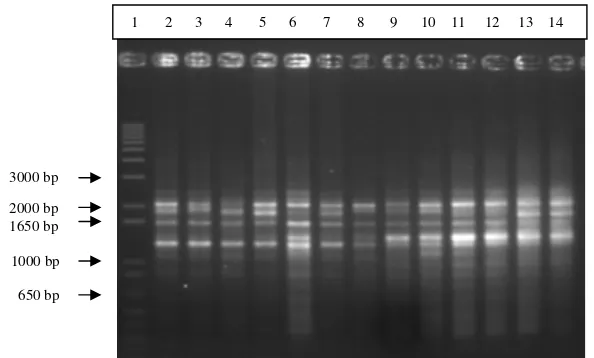
Gambar 5 Pola-pola pita 13 sampel ikan sumatra hasil RAPD mengunakan primer OPA 4; lajur 1 marker 1 kb plus, lajur 2-6 =K2N ; lajur 7-11 = mitogen; lajur 12-14 = klon. Running pada gel agarosa 1.5% (b/v); 50 volt.
Hasil pengamatan terhadap profil pita RAPD dari 2 primer yang
mengamplifikasi DNA genom ikan sumatra disajikan pada Tabel 6. Total pita
yang dihasilkan dari 2 primer yang digunakan adalah sebanyak 36 pita, 34 pita
(94.4%) adalah polimorfik dan 2 pita (5.5%) adalah monomorfik.
Tabel 6 Jumlah pita DNA dan jumlah pita polimorfik hasil amplifikasi DNA ikan sumatra dengan primer OPA 2 dan OPA 4
Primer Susunan basa
5’……….3’ Jumlah pita DNA Jumlah pita polimorfik OPA 2 OPA 4 TGCCGAGCTG AATCGGGCTG 17 19 16 18
Jumlah 36 34
Primer OPA 2 pada amplifikasi DNA genom ikan sumatra normal,
mitogen dan klon menghasilkan jumlah pita RAPD lebih sedikit dibanding OPA
4, sedangkan polimorfisme kedua primer tersebut 94.4% pada OPA 2 dan 94.7%
pada OPA 4. Weising et al. (1995) menyatakan bahwa pada dasarnya
polimorfisme pada DNA yang dianalisis RAPD merupakan hasil dari beberapa
kejadian, yaitu : (1) delesi DNA pada bagian genom yang mengalami penempelan
primer, (2) insersi DNA diantara dua situs penempelan primer, (3) subtitusi
nukleotida pada situs penempelan primer. Insersi DNA yang berukuran besar
diantara dua situs penempelan primer menyebabkan ketidakmampuan DNA
1 2 3 4 5 6 7 8 9 10 11 12 13 14
2000 bp
1000 bp 3000 bp
[image:41.612.149.490.454.523.2]26
polimerase untuk mensintesis DNA sehingga daerah tersebut tidak dapat
diamplifikasi. Insersi DNA yang berukuran kecil diantara dua situs penempelan
menyebabkan perubahan panjang daerah yang diamplifikasi; delesi pada situs
penempelan menyebabkan primer tidak dapat menempel (pada daerah tersebut),
sehingga tidak dapat diamplifikasi. Delesi diantara dua situs penempelan
menyebabkan perubahan ukuran daerah yang diamplifikasi. Subtitusi pada situs
penempelan menyebabkan primer tidak dapat menempel sehingga tidak terjadi
sintesis DNA. Pemilihan primer pada analisis RAPD mempengaruhi jumlah pita
DNA dan polimorfisme pita DNA yang dihasilkan, karena setiap primer memiliki
situs penempelan yang spesifik.
Analisis Kemiripan (Similarity)
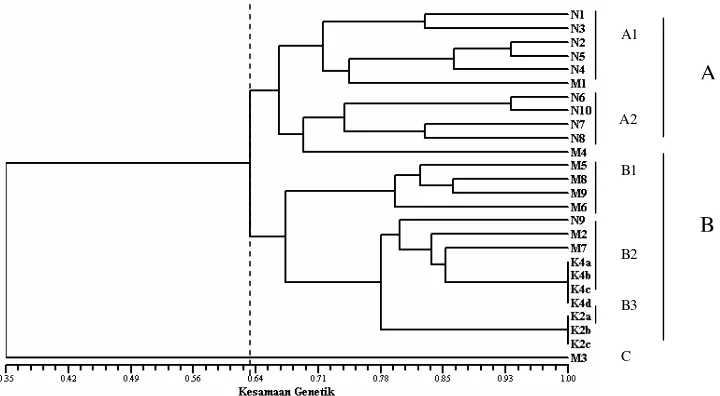
Berdasarkan penanda RAPD yang terdiri dari 2 primer (OPA2 dan OPA4)
menunjukkan hubungan genetik intrapopulasi yang dekat pada ikan sumatra klon
yaitu tingkat kemiripan 100% pada sampel K2a, K2b, K2c, demikian pula pada
K4a, K4b, K4c, K4d. Pohon filogenik berdasarkan kesamaan genetik (Gambar 6)
menghasilkan 3 kelompok A, B dan C dengan tingkat kesamaan 35%. Kelompok
A memiliki 2 sub kelompok (A1 dan A2), kelompok B memiliki 3 sub kelompok
(B1, B2, B3), kelompok C memiliki 1 individu. Sub kelompok A1 terdiri dari
individu K2N (5) dan individu mitogen (1) dengan kesamaan genetik 74%. Sub
kelompok A2 terdiri K2N (4) dan mitogen (1) dengan kesamaan genetik sekitar
70%. Sub kelompok A1 dan A2 mempunyai kesamaan genetik 67% (kelompok A
memiliki perbedaan genetik sebesar 34%).
Sub kelompok B1 terdiri mitogen (4) dengan kesamaan genetik sebesar
80%. Sub kelompok B2 terdiri K2N (1), mitogen (2), klon (4) sedangkan sub
kelompok B3 terdiri dari klon (3). Sub kelompok B1, B2, B3 mempunyai
kesamaan genetik 68% (kelompok B memiliki perbedaan genetik 32%). Sub
kelompok A dan sub kelompok B mempunyai kesamaan genetik 64%. Kelompok
C hanya terdiri 1 individu mitogen (M3). Kelompok A,B,C mempunyai kesamaan
genetik 35% (perbedaan genetik 65%). Dengan demikian dapat disimpulkan
27
Gambar 6 Dendrogram kesamaan genetik ikan sumatra normal (N), mitogen (M) dan klon (K) yang telah dikelompokkan (A, B, C).
Determinasi Kelamin
Berdasarkan hasil pengamatan jenis kelamin didapatkan rasio jantan dan
betina pada klon adalah 41.67 dan 58.33% sedangkan pada mitogen sebesar 37.5
dan 62.5% (Lampiran 18-20). Adanya individu jantan dari hasil ginogenesis ini
menurut Takahashi (1977); Takahashi dan Shimizu (1983) pada ikan Barbus
tetrazona dan Danio rerio (zebra fish), gonad mengalami perkembangan awal sebagai ovarium tetapi selanjutnya pada saat dewasa jaringan ovari mengalami
degenerasi (sel somatik meningkat) sehingga sedikitnya setengah populasi tetap
menjadi ovarium dan setengahnya lagi berkembang menjadi testis. Fenomena
deferensiasi kelamin pada ikan jenis ini dinilai menguntungkan terkait dengan
program perbanyakan klon secara masal dimana tidak perlu melakukan sex
reversal untuk mendapatkan ikan jantan pada klon hasil ginogenesis.
Karakter Meristik
Keragaman genetik (Vg) dapat mempengaruhi ekspresi fenotipik pada ciri
meristik yang diteliti. Hal ini terkait dengan meningkatnya koefisien silang dalam
(F) yang ditunjukkan pada persamaan keragaman fenotip (Vp) sebagai berikut :
Vp= (F)Vg + Ve pada individu normal, Vp = Vg(1+F)+Ve pada G2N-meotik,
atau Vp = 2Vg+Ve pada G2N-mitotik dan Vp = (1-F)Vg + Ve pada klon A
B
A1
A2
B1
B2
28
(Taniguchi 1990). Dalam hal ini, Ve adalah keragaman lingkungan, dimana dalam
penelitian ini kondisi lingkungan diasumsikan sama untuk semua perlakuan,
sehingga keragaman yang disebabkan oleh lingkungan dapat diabaikan. Oleh
karena itu perubahan keragaman fenotip sepenuhnya dipengaruhi oleh tingkat
keragaman genetik dan silang dalam. Menurut Taniguchi et al. (1988) nilai F
untuk G2N-mitotik adalah 1 dan untuk G2N-meiotik 0.5. Dengan demikian,
secara teoritis nilai keragaman fenotip G2N-mitotik (mitogen) adalah 2 kali nilai
keragaman fenotip ikan kontrol, sedangkan pada klon, nilai keragaman fenotip
sama dengan nilai keragaman genotip.
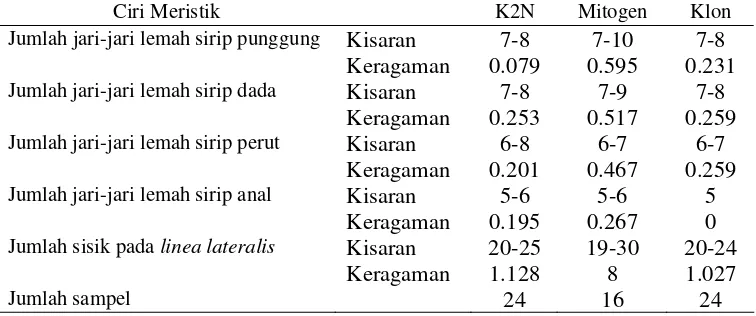
Ciri meristik mitogen mempunyai kisaran dan keragaman lebih besar dari
pada K2N pada jumlah jari-jari lemah sirip punggung, dada, perut, anal (Tabel 7;
Lampiran 18-20). Sedangkan klon, mempunyai kisaran dan keragaman yang lebih
[image:44.612.134.512.373.531.2]rendah dari mitogen.
Tabel 7 Kisaran dan keragaman ciri meristik pada ikan sumatra K2N, mitogen dan klon
Ciri Meristik K2N Mitogen Klon Jumlah jari-jari lemah sirip punggung Kisaran 7-8 7-10 7-8
Keragaman 0.079 0.595 0.231
Jumlah jari-jari lemah sirip dada Kisaran 7-8 7-9 7-8 Keragaman 0.253 0.517 0.259
Jumlah jari-jari lemah sirip perut Kisaran 6-8 6-7 6-7 Keragaman 0.201 0.467 0.259
Jumlah jari-jari lemah sirip anal Kisaran 5-6 5-6 5
Keragaman 0.195 0.267 0
Jumlah sisik pada linea lateralis Kisaran 20-25 19-30 20-24
Keragaman 1.128 8 1.027
Jumlah sampel 24 16 24
Ginogenesis tahap II (klon) menghasilkan keragaman fenotip yang lebih
rendah daripada ginogenesis tahap I (mitogen), diduga karena perlakuan diberikan
pada fase mitosis lebih rawan terjadi kegagalan rekonstruksi genom akibat pindah
silang, fragmentasi dan lain-lain. Sedangkan pada ginogenesis tahap II lebih
sederhana yaitu ketika perlakuan diberikan pada fase meiosis, maka badan polar II
yang dihalangi lepas akan bergabung dengan pronukleus membentuk diploid
29
Menurut Taniguchi et al. (1988) tingginya nilai keragaman pada
G2N-mitotik tidak saja disebabkan oleh pengaruh segregasi tetapi juga disebabkan oleh
munculnya gen-gen resesif yang tidak menguntungkan akibat silang dalam yang
30
SIMPULAN
Ikan klon dapat dihasilkan pada generasi kedua ginogenesis dimana
hubungan genetik berdasarkan tingkat kesamaan genetik klon hasil ginogenesis
dari induk yang sama mencapai 100%. Rasio jenis kelamin jantan dan betina pada
klon hasil ginogenesis adalah 41.67 dan 58.33%. Keragaman ciri meristik ikan
DAFTAR PUSTAKA
Abduh M. 1990. Penampilan generasi pertama diploid ginogenetik mitotik ikan Mas (Cyprinus carpio L) merah [skripsi] Bogor : Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Allendorf FW, Leary RF. 1984. Gynogenesis in Fishes in V.S. Kirpichnikov (Ed.). Genetic bases of fish selection. New York : Springer-Verlag, Berlin Heidelberg.
Arai K. 2001. Genetic improvement of aquaculture finfish species by chromosome manipulation techniques in Japan. Aquaculture 197 : 205-228.
Cherfas NB. 1981. Gynogenesis in Fishes in V.S. Kirpichnikov (Ed.). Genetic bases of fish selection. New York : Springer-Verlag, Berlin Heidelberg.
Cherfas NB, Peretz Y, Ben-Dom N, Gomelsky B, Hulata G. 1994. Induced diploid gynogenesis and polyploidy in the ornamental (koi) carp, Cyprinus carpio L. Theor Appl Genet 89:193-197.
Chevassus B. 1983. Hybridization in fish. Aquaculture 32 : 245-262.
Chourrout D. 1984. Pressure induced retention of second polar body and supression of first cleavage in rainbow trout : Production of all triploid, all tetraploids and heterozygous and homozygous diploid gynogenetics. Aquaculture 36 : 111-126.
Darmono TW. 1996. Ulas balik, analisis keragaman tanaman dengan teknik molekuler (Analysis of plant genetic variation with molecular technique). Hayati 3(1):7-11.
Disney JE, Johnson KR, Thorgaard GH. 1987. Intergenetic gene-transfer of six isozyme loci in rainbow trout by sperm chromosome fragmentation and gynogenesis. J Exp Zool 224(1) : 151-222.
Golovinskaya KA. 1972. Artificial Gynogenesis in Carp in B.I. Cherfas (Ed.) Genetic, Selection and Hybridization of Fish. Jerusalem : Wiener Pindery Ltd.
Galbusera P, Volckaert FAM, Ollevier F. 2000. Gynogenesis in the African
catfish Clarias gariepinus (Burchell, 1822) III. Induction of
32
Grattapaglia D, Chaparro J, Wilcox P, McCord S, Werner D, Amerson H, McKeand S, Bridgwater F, Whetten R, O’Malley D, Sederoff R. 1992. Mapping in woody plants with RAPD markers : Application to breeding in forestry and holticulture. In : Application of RAPD Tecnology to Plant Breeding. Joint Plant Breeding Symposia Series CSSA/ASHS/AGA. Minneapolis. p 37-40.
Han H, Taniguchi N, Tsujimura A. 1991. Production of clonal ayu by chromosome manipulation and confirmation by isozyme marker and tissue grafting. Nippon Suisan Gakkaishi 57(5):825-832.
Hara M, Dewa H, Yamamoto E. 1993. DNA fingerprinting with radioactive prove in clonal flounder Paralichthys olivaceus (in Japanese). Nippon Suisan Gakkaishi 59(4):731.
Hollebecq MG, Chourrout D, Wohlfarth G, Billard R. 1986. Diploid gynogenesis induced by heat shock after activation with UV-irradiated sperm in common carp. Aquaculture 54: 69-76.
Horvath L, Orban Z. 1995. Genome and gene manipulation in the common carp. Aquaculture 129 : 157-181.
Innes WT. 1994. Innes’s Exotic Aquarium Fishes. 21st Edition. A Work of
General Reference. USA : TFH Publications Inc.
Jenneckens I, Muller-Belecke A, Horstgen-Schwark G, Meyer J-N. 1999. Proof of the successful development of nile tilapia (Oreochromis niloticus) clones by DNA fingerprinting. Aquaculture 173:377-385.
John G, Reddy PVGK, Gupta SG. 1984. Artifisial gynogesis in two indian mayor carps, Labeo rohita (Ham.) and Catla catla (Ham.). Aquaculture 42 : 161-168.
Kato K, Hayashi R, Yuasa D, Yamamoto S, Miyashita S, Murata O, Kumai H. 2001. Production of cloned red sea bream, Pagrus major by chromosome manipulation. Aquaculture 207 : 19-27.
Kobayashi T, Ide A, Hiasa T, Fushiki S, Ueno K. 1994. Production of cloned amago salmon Oncorhynchus rhodurus. Fish Sci 60:275-281.
Komen J, Duynhouwer J, Richter CJJ, Huisman EA. 1988. Gynogenesis in common carp (Cyprinus carpio L.) I. Effect of genetic manipulation of sexual products and incubator of reduced genetic variation in hatchery trout. Trans. Amer Fish Soc 114 : 230-235.
33
production of homozygous gynogenetic clones and F1 hybrids. Aquaculture 92:127-142.
Linhart O, Kvasnicka P, Flajshans M, Kasal A, Rab P, Palecek J, Slechta V, Hamackova J, Prokes M. 1995. Genetic studies with tench, Tinca tinca L. : Induced meiotic gynogenesis and sex reversal. Aquaculture 92:127-142.
Lou YD, Purdom CE. 1984. Diploids gynogenesis induced hydrostatic pressure in rainbow trout (Salmo gairdneri R.). J Fish Biol 24 : 665-670.
Matondang I, Suharsono, Hartana A. 2001. Analisis keanekaragaman genetik kelapa dalam asal Maluku menggunakan teknik RAPD. Hayati 8(2): 31-34.
Mc Inerny D, Gerard G. 1996. All About Tropical Fish. New York : The Macmillan Co.
Muller-Belecke A, Horstgen-Schwark G. 2000. Performance testing of clonal Oreochromis niloticus Lines. Aquaculture 184:67-76.
Nagy A, Rajki K, Horvart L, Csanyi. 1978. Investigation on carp (Cyprinus carpio L) gynogenesis. J Fish Biol 13 : 215-224.
Naruse K, Ijiri K, Shima A, Egami N. 1985. The production of cloned fish in the medaka (Oryzias latipes). J Exp Zool 236:335-341.
Nei M, Li WS, 1979. Mathematical model for studying genetic variation in term of retriction endonucleases. Proc Natl Acad Sci USA 76:5269-5273.
Onozato H. 1984. Diplodization of gynogenetically activated salmonid eggs using hydrostatic pressure. Aquaculture 43:91-97.
Pandey RN, Adams RP, Flournoy LE. 1996. Inhibition of Random Amplified Polymorphic DNAs (RAPDs) by plant polysaccharides. Plant Molec Biol reporter 14:15-22.
Peruzzi S, Chatain B. 2000. Pressure and cold shock induction of meiotic gynogenesis and triploidy in the European sea bass, Dicentrarchus labrax L. : relative efficiency of method and parental variability. Aquaculture 189:23-37.
34
Promega. 2001. PCR Core System-Technical Bulletin. Instruction for use of products M7660 and M7665. USA : Promega Corporation.
Purdom CE. 1993. Genetics and Fish Breeding. Combridge : Chapman and Hall.
Risnawati NW. 1995. Ukuran dan morfologi sperma beberapa spesies ikan famili Cyprinidae [skripsi] Bogor : Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Rohlf FJ. 1998. NTSYSpc: Numerical Taxonomy and Multivariate Analysis System Version 2.0. User Guide. Exerter software. New York : Applied Biostatistics Inc.
Saanin H. 1984. Taksonomi dan Kunci Identifikasi Ikan I. Jakarta : Binacipta.
Sastrapraja S, Budiman A, Djajasasmita M, Kaswadji S. 1981. Ikan Hias. Indonesia : Lembaga Biologi Nasional-LIPI.
Shelton CJ, Macdonald AG, Johnstone R. 1986. Induction of triploidy in rainbow trout using nitrous oxide. Aquaculture 58:155-159.
Siraj SS, Seki S, Jee AK, Yamada Y, Taniguchi N. 1993. Diploid gynogenesis in lampan jawa, Puntius schwanenfeldii followed by temperature shock. Aquac