KARAKTERISTIK GENETIK
KLON IKAN SUMATRA (Puntius tetrazona Bleeker)
HASIL GINOGENESIS
TRI YUSUFI MARDIANA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2007
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa segala pernyataan dalam tesis
KARAKTERISTIK GENETIK KLON IKAN SUMATRA (Puntius tetrazona Bleeker) HASIL GINOGENESIS) adalah benar merupakan gagasan dan hasil
penelitian saya sendiri dibawah arahan komisi pembimbing. Semua data dan sumber informasi yang digunakan dalam tesis ini telah dinyatakan secara jelas dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis serta dapat diperiksa kebenarannya. Tesis ini belum pernah diajukan untuk memperoleh gelar pada program studi sejenis di Perguruan Tinggi lain.
Bogor, Agustus 2007
Tri Yusufi Mardiana NRP C 151030181
RINGKASAN
TRI YUSUFI MARDIANA. Karakteristik Genetik Klon Ikan Sumatra (Puntius
tetrazona Bleeker) Hasil Ginogenesis. Dibimbing oleh KOMAR
SUMANTADINATA, DINAR TRI SOELISTYOWATI dan UTUT WIDYASTUTI. Rekayasa set kromosom dengan teknologi ginogenesis 2 tahap telah dilakukan dalam rangka penyedian populasi klon ikan sumatra sebagai hewan percobaan. Penelitian ini bertujuan untuk memproduksi klon ikan sumatra dan melakukan verifikasi genotip klon hasil ginogenesis berdasarkan analisis RAPD, determinasi kelamin dan ciri meristik. Pada ginogenesis tahap I, kejutan panas diberikan pada fase mitosis I untuk mendapatkan mitogen sebagai calon induk klon. Pada ginogenesis tahap II, kejutan panas diberikan pada fase meiosis yang menghasilkan klon.
Ikan klon dapat dihasilkan pada generasi kedua ginogenesis. Amplifikasi RAPD-PCR menggunakan primer OPA 2 dan OPA 4 menghasilkan fragmen DNA dengan ukuran 300-3.000 bp. Kesamaan genetik klon hasil ginogenesis dari induk yang sama mencapai 100%. Kisaran ciri meristik pada klon lebih homogen dibandingkan pada mitogen dan kontrol normal. Rasio kelamin jantan dan betina pada klon sebesar 41.67% : 58.33%, sedangkan pada mitogen sebesar 37.5% : 62.5%.
ABSTRACT
TRI YUSUFI MARDIANA. The Genetic Characteristics of Gynogen Clon in Sumatra Fish (Puntius tetrazona Bleeker). Under supervision of KOMAR SUMANTADINATA, DINAR TRI SOELISTYOWATI, and UTUT WIDYASTUTI.
Chromosome manipulation with two steps of gynogenesis technology has done to provide the population of sumatra cloned fish as a trial animals. The aim of this study is to produce a strain of cloned fish and to verification of clonal status based on RAPD analysis, sex determination and meristic characterized. Production of cloned fish was obtained by gynogenesis. Reproduction using temperature shock treatment that involves first the induction of double haploid fish and suppresion of the first cleavege. Cloned fish can be produced to gynogenesis of second generation. The RAPD-PCR amplification which used OPA primer 2 and OPA 4 produce size 300-3000 bp of DNA fragment. Based on similarity analysis, the genetic similarity index of genetic clone raised to 100%. Rates of meristic characteristic on the clone is homogen than mytogen and normal control. Sex ratio of male and female on the clones are 41.67% : 58.33%, on otherwise mytogen are 37.5% : 62.5%
© Hak cipta milik IPB, tahun 2007
Hak cipta dilindungi
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apapun tanpa izin IPB
KARAKTERISTIK GENETIK
KLON IKAN SUMATRA (Puntius tetrazona Bleeker)
HASIL GINOGENESIS
TRI YUSUFI MARDIANA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2007
Judul : Karakteristik Genetik Klon Ikan Sumatra (Puntius tetrazona Bleeker) Hasil Ginogenesis
Nama : Tri Yusufi Mardiana NRP : C 151030181
Program Studi : Ilmu Perairan
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Komar Sumantadinata, MSc Ketua
Dr. Ir. Dinar Tri Soelistyowati, DEA Dr. Ir. Utut Widyastuti, MSi
Anggota Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Perairan
Prof. Dr. Ir. Enang Harris, MS Prof. Dr.Ir. Khairil A.Notodiputro, MS
PRAKATA
Syukur Alhamdulillah atas segala rahmat dan hidayah Allah SWT, sehingga penulisan tesis dengan judul KARAKTERISTIK GENETIK KLON IKAN
SUMATRA (Puntius tetrazona Bleeker) HASIL GINOGENESIS dapat
diselesaikan. Tesis ini diajukan untuk memperoleh gelar Magister pada Sekolah Pascasarjana Institut Pertanian Bogor.
Penghargaan dan ucapan terima kasih yang sebesar-besarnya kepada Bapak Prof. Dr. Ir. Komar Sumantadinata MSc., selaku ketua komisi pembimbing, serta Ibu Dr. Ir. Dinar Tri Soelistyowati, DEA selaku anggota komisi pembimbing yang telah memberikan kesempatan untuk ikut dalam kegiatan Hibah Penelitian dari Direktur Pembinaan Penelitian dan Pengabdian pada Masyarakat DIKTI, serta Ibu Dr. Ir. Utut Widyastuti, MSi selaku anggota komisi pembimbing. Terimakasih atas keikhlasan dan kesabaran memberikan bimbingan nasehat, arahan dan dorongan mulai dari penulisan proposal, selama pelaksanaan penelitian berlangsung sampai selesainya penulisan tesis ini.
Ucapan terima kasih juga saya sampaikan kepada Rektor Universitas Pekalongan, Departemen Pendidikan dan Kebudayaan Republik Indonesia melalui Dana Pendidikan BPPS sehingga studi berjalan dengan lancar. Terima kasih saya sampaikan kepada Kepala Laboratorium Pengembangbiakan dan Genetika Ikan FPIK IPB, Pusat Studi Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB, Laboratorium Ikan di Babakan atas izin lokasi penelitian, serta Pak Mul, Mbak Pepi, Mbak Lina. Tim ginogenesis (Elis, Siska, Rizal, Andi, Arti) dan tim Biorin (Ibu Ayi, Udin, Firdaus, Huda, Agustin, Zendi, Wiwid, Didi), Nazli, Hanum atas bantuannya selama penelitian. Terima kasih kepada orang tua, adik, kakak, suami dan anak tercinta atas segala dukungan, doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2007
RIWAYAT HIDUP
Penulis bernama Tri Yusufi Mardiana, dilahirkan di Blitar, Jawa Timur pada tanggal 29 Maret 1975. Penulis merupakan puteri ketiga dari empat bersaudara pasangan Bapak M. Zen Haryanta dan ibu Harmini. Pendidikan Sekolah Dasar ditempuh di SD Negeri II Srengat Blitar, lulus tahun 1987. Sekolah Menengah Pertama diselesaikan pada tahun 1990 di SMP I Srengat Blitar, Sekolah Menengah Atas ditempuh di SMA I Blitar Jurusan Fisika (A1) lulus tahun 1993.
Pada tahun 1993 penulis melanjutkan di Jurusan Perikanan Fakultas Perikanan dan Ilmu Kelautan Universitas Diponegoro Semarang melalui jalur PSSB (Program Seleksi Siswa Berpotensi) dan lulus Strata 1 tahun 1998. Tahun 2000 sampai sekarang, penulis bekerja sebagai staf pengajar di Fakultas Perikanan Universitas Pekalongan. Pada tahun 2003 penulis melanjutkan pendidikan Strata 2 di Institut Pertanian Bogor pada Program Studi Ilmu Perairan (AIR). Beasiswa pendidikan pascasarjana diperoleh dari Departemen Pendidikan dan Kebudayaan Republik Indonesia melalui Dana Pendidikan BPPS. Penulis telah menikah dengan Slamet Suharto, SPi dan telah dikaruniai dua anak, Hakimah Nur Yusla dan Mohammad Ghatfan Atiwiar.
DAFTAR ISI
Halaman
DAFTAR TABEL ……… xi
DAFTAR GAMBAR ………... xii
DAFTAR LAMPIRAN ……… xiii
PENDAHULUAN Latar Belakang ………... 1
Perumusan dan Pendekatan Masalah ……… 2
Tujuan dan Manfaat ………... 3
TINJAUAN PUSTAKA Ikan Sumatra ………. 4
Penggunaan Sperma dari Spesies yang Berbeda .……… 4
Ginogenesis ……… 5
Verifikasi Genetik Ikan Klon ………. 9
RAPD …… ……….. 9
Determinasi Kelamin ………... 11
Karakter Meristik ………... 11
METODOLOGI Waktu dan Tempat Penelitian ……… 13
Metode Penelitian ……….. 13
Ginogenesis ……….. 13
Pemeliharaan Induk Ikan Sumatra dan Ikan Tawes …… 13
Pemijahan Ikan Sumatra ………. 13
Produksi Klon dengan Metode Ginogenesis …………... 14
Verifikasi Genetik Ikan Klon ………... 16
RAPD……. ………. 16
Isolasi DNA Genom Ikan ……….. 16
Analisis RAPD ………... 17
Identifikasi Jenis Kelamin………... 20
Karakterisasi Meristik ………. 20
Analisis Data ……… 20
HASIL DAN PEMBAHASAN Keberhasilan Klon Melalui Ginogenesis ………. 22
Karakteristik Genetik Ikan Klon ……….. 24
RAPD …… ………. 24
Determinasi Kelamin………... 27
Karakter Meristik ……… 27
DAFTAR PUSTAKA ……….. 31
DAFTAR TABEL
Halaman
1 Spesies donor sperma pada ginogenesis dari beberapa spesies berbeda ………...
5
2 Primer-primer yang digunakan dalam RAPD-PCR………. 18
3 Campuran komponen PCR ……….. 19
4 Siklus, proses, suhu dan waktu dalam amplifikasi genom ikan sumatra………
19
5 Rerata keberhasilan ginogenesis menggunakan sperma ikan tawes yang diradiasi dan suhu kejutan 40 oC selama 1.5 menit ………….
23
6 Jumlah pita DNA dan jumlah pita polimorfik hasil amplifikasi DNA ikan sumatra dengan primer OPA2 dan OPA4………...
25
7 Kisaran dan keragaman ciri meristik pada ikan sumatra K2N, mitogen dan klon ……….
DAFTAR GAMBAR
Halaman
1 Penampilan morfologis ikan sumatra (Puntius tetrazona) betina dan jantan …………...
4
2 Penampilan morfologis ikan tawes jantan (Puntius gonionotus) …. 5
3 Diagram ginogenesis pada ikan ……… 8
4 Diagram skematik produksi klon ………. 15
5 Pola-pola pita 13 sampel ikan sumatra hasil RAPD mengunakan primer OPA 4 ………...
25
6 Dendrogram kesamaan genetik ikan sumatra normal, mitogen dan klon ………...
DAFTAR LAMPIRAN
Halaman
1 Komposisi Cell lysis Solution 38
2 Komposisi TE 1x……….. 38
3 Komposisi TAE 50x ………... 38
4 Komposisi TBE 10x ……… 38
5 Komposisi Loading dye 6x……….. 38
6 Keberhasilan mitogen dengan menggunakan metode ginogenesis tahap I ……….. 39 7 Keberhasilan produksi klon dengan metode ginogenesis tahap II menggunakan induk mitogen pada percobaan 1 ……….. 40 8 Keberhasilan produksi klon dengan metode ginogenesis tahap II pada percobaan 2 ……… 40 9 Keberhasilan produksi klon dengan metode ginogenesis tahap II pada percobaan 3 ………. 40 10 Keberhasilan produksi klon dengan metode ginogenesis tahap II menggunakan induk mitogen ……….. 41 11 Hasil spektofotometer DNA genom ikan sumatra normal ……….. 42
12 Hasil spektrofotometer DNA genom ikan sumatra mitogen ……... 42
13 Hasil spektrofotometerv DNA genom ikan sumatra klon ………... 42
14 Hasil ekstraksi DNA ikan sumatra normal, mitogen, klon ……….. 43 15 Pola-pola pita 12 sampel ikan sumatra normal, mitogen dan klon
hasil RAPD mengunakan primer OPA 2 ………
43
16 Pola-pola pita 12 sampel ikan sumatra normal, mitogen dan klon hasil RAPD mengunakan primer OPA 2 ……….
44
hasil RAPD mengunakan primer OPA 4 ……….
18 Hasil pengukuran meristik ikan sumatra normal ………. 45 19 Hasil pengukuran meristik ikan sumatra mitogen ………... 46 20 Hasil pengukuran meristik ikan sumatra klon ………. 47 21 Matrik kesamaan genetik ikan sumatra normal, mitogen dan klon 48
PENDAHULUAN
Latar Belakang
Kegiatan penelitian terhadap berbagai aspek akuakultur memerlukan ikan percobaan yang homogen sehingga pengaruh perlakuan tidak bias dengan ragam yang tinggi antar individu ikan percobaan. Ikan uji yang homogen semakin diperlukan untuk kajian respon penyakit ikan, evaluasi pakan, pengujian obat, evaluasi strain dan sebagainya (Sumantadinata 1997).
Ikan sumatra (Puntius tetrazona Bleeker) atau yang dikenal dengan nama tiger barb memiliki warna dasar kuning dengan belang hitam. Ikan ini dipertimbangkan sebagai ikan percobaan karena dapat memenuhi persyaratan seperti siklus hidupnya yang pendek (5-6 bulan), proses budidayanya mudah, selain itu juga memiliki ornamen warna yang menarik dan berukuran relatif kecil (3-6 cm).
Pembuatan individu yang homozigot dengan cara seleksi konvensional membutuhkan waktu yang lama. Thomson (1983) menyatakan bahwa satu generasi ginogenesis menghasilkan tingkat homozigositas yang sama dengan tujuh sampai delapan generasi perkawinan sekerabat (sib mating). Menurut Allendorf dan Leary (1984) galur murni dapat dihasilkan dengan 2 generasi ginogenetik, sedangkan dengan perkawinan sekerabat membutuhkan 20 generasi.
Pembentukan klon ikan dengan teknologi ginogenesis telah berhasil dilakukan antara lain pada zebra fish (Danio rerio) (Streisinger et al. 1981), medaka/japanese fish Oryzias latipes (Naruse et al. 1985), common carp Cyprinus carpio (Komen et al. 1991), ayu fish Plecoglossus altivelis (Han et al. 1991), amago salmon Oncorhynchus rhodurus (Kobayashi et al. 1994) dan tilapia Oreochromis niloticus (Muller-Belecke and Horstgen-Schwark 2000).
Teknologi ginogenesis pada ikan sumatra telah dilakukan oleh Soelistyowati et al. (2004) dimana lama waktu kejutan panas yang optimal
2
2 untuk menghasilkan persentase kelangsungan hidup larva tertinggi adalah 90 detik yaitu sebesar 15%, dengan kelangsungan hidup miogen lebih tinggi daripada mitogen. Kelangsungan hidup tertinggi dicapai saat kejutan panas diberikan pada menit ke-1 setelah pembuahan untuk miogen (9.19%) dan pada menit ke-18 setelah pembuahan untuk mitogen (7.7%).
Verifikasi status genetik ikan klon dapat dilakukan dengan tissue grafting, DNA fingerprint SSRa-PCR dan RAPD. Verifikasi status klon dengan metode RAPD dipakai pada tilapia (Jenneckens et al. 1999). Metode tissue grafting telah diteliti pada ayu fish (Han et al. 1991), Cyprinus carpio (Komen et al. 1991), salmon (Kobayashi et al. 1994). Metode DNA fingerprint telah dilakukan pada ayu (Han et al. 1991), japanese flounder (Hara et al. 1993), rainbow trout (Young et al. 1995), red sea bream (Kato et al. 2001).
Secara umum teknik RAPD cukup sederhana, murah dan dapat dikerjakan dalam waktu relatif singkat dibandingkan dengan teknik molekular lain (Darmono 1996; Prana dan Hartati 2003). Kuantitas DNA yang dibutuhkan hanya sedikit (dibutuhkan 5-25 ng DNA dalam setiap reaksi PCR) bahkan hingga 1.5 ng DNA (Pandey et al. 1996).
Perumusan dan Pendekatan Masalah
Kegiatan akuakultur tentang kajian respon penyakit ikan, evaluasi pakan, pengujian obat dan sebagainya, memerlukan ikan uji atau ikan percobaan yang relatif homogen secara genetis untuk menghindari bias yang ditimbulkan oleh faktor keragaman individu sehingga akurasinya bisa dipertanggungjawabkan. Homogen secara genetis yaitu memiliki homozigositas genotipik, diutamakan untuk menciptakan populasi/strain hewan percobaan. Pembuatan individu yang homozigot dengan cara seleksi konvensional membutuhkan waktu yang lama. Teknologi ginogenesis dalam dua generasi merupakan alternatif untuk menghasilkan klon. Klon hasil ginogenesis diharapkan bergenotip homozigot pada hampir seluruh gen, karena merupakan copy genom dari induk yang bergenotip homozigot. Produksi klon ikan dengan metode ginogenesis adalah produksi embrio
3
3 tanpa materi genetis jantan, dimana pada tahap I (F1) menghalangi pembelahan mitosis I sehingga dihasilkan diploid ginogenetik homozigot dan pada tahap II (F2) menghalangi keluarnya badan polar II pada meiosis II yang menghasilkan copy genom yang disebut klon. Verifikasi genetik homozigositas klon ikan sumatra akan dianalisis dengan RAPD.
Tujuan dan Manfaat
Tujuan penelitian ini adalah untuk menerapkan teknologi ginogenesis dalam memproduksi klon ikan sebagai hewan percobaan serta melakukan verifikasi genotipik berdasarkan analisis RAPD, determinasi kelamin dan karakterisasi meristik pada ikan sumatra. Hasil penelitian ini diharapkan bermanfaat untuk mengembangkan metode pemurnian genotip homozigot dalam produksi massal strain klon untuk hewan percobaan.
TINJAUAN PUSTAKA
Ikan Sumatra
Berdasarkan klasifikasinya ikan sumatra (Puntius tetrazona Bleeker) termasuk dalam famili Cyprinidae, sub famili Cyprininae, pada genus Puntius dengan nama spesies Puntius tetrazona Bleeker (Saanin 1984). Ikan sumatra dikenal dengan nama sumatra barb atau tiger barb. Bentuk tubuhnya memanjang dan pipih ke samping, ukuran tubuh maksimal 8 cm, warna dasar tubuhnya putih keperakan, bagian atas tubuhnya berwarna agak sawo matang dengan corak hijau, sedangkan sisi tubuhnya berwarna kemerah-merahan, terdapat empat buah garis berwarna hitam kebiruan yang memotong tubuh ikan yaitu pada bagian kepala, tubuh bagian depan sirip punggung, samping sirip punggung hingga jari-jari sirip anal yang pertama, bagian batang ekor (Gambar 1). Bagian sirip punggung ada yang berwarna hitam sedang beberapa lain berwarna kemerahan dan transparan (Sumpeno et al. 2004). Berdasarkan pemijahannya ikan sumatra termasuk ikan yang menghamburkan telurnya, telur akan disebarkan diantara tanaman air dan menetas 24 jam kemudian. Jumlah telur antara 150-200 butir/ekor (Sastrapraja et al. 1981).
Gambar 1 Penampilan morfologis ikan sumatra (Puntius tetrazona) betina (kiri) dan jantan (kanan).
Penggunaan Sperma dari Spesies yang Berbeda
Penggunaan sperma ikan dari spesies yang berbeda pada percobaan ginogenesis untuk memudahkan dalam verifikasi (konfirmasi) keturunan yang dihasilkan, yaitu terdapat perbedaan karakteristik yang jelas pada keturunan ginogen dan hibrid, atau sebagai penanda genetik (Disney et al. 1987). Beberapa contoh
5
ginogenesis menggunakan donor sperma yang berasal dari spesies berbeda disajikan pada Tabel 1.
Tabel 1 Spesies donor sperma pada ginogenesis dari beberapa spesies yang berbeda
Spesies Spesies donor sperma Sumber
Plecoglossus altivelis Spirinchus lanceolata Taniguchi et al. (1990)
Common carp Osteochilus hasselti Puntius gonionotus
Hypopthalmichthys molitrix Ctenopharyngodon idella
Sumantadinata et al. (1990)
Puntius gonionotus Puntius schwanenfeldii Siraj et al. (1993)
Clarias sp. Puntius gonionotus Yulintine (1995)
Tinca tinca Common carp Linhart et al. (1995)
Klasifikasi ikan tawes termasuk dalam famili Cyprinidae, sub famili Cyprininae, genus Puntius dengan spesies Puntius gonionotus (Saanin 1984) (Gambar 2). Menurut Risnawati (1995), sperma ikan tawes dapat digunakan untuk ginogenesis pada ikan sumatra karena memiliki ukuran diameter kepala spermatozoa yang lebih kecil daripada ikan sumatra yaitu 1.496 versus 1.907 µm dan panjang ekor sperma 31.147 versus 30.187 µm sehingga sperma ikan tawes dapat masuk ke dalam lubang mikrofil dan menginseminasi telur ikan sumatra.
Gambar 2 Penampilan morfologis ikan tawes (Puntius gonionotus) jantan.
Ginogenesis
Ginogenesis adalah proses produksi embrio dari telur-telur yang dibuahi oleh sperma tanpa sumbangan bahan genetik jantan (Nagy et al. 1978; John et al. 1984).
6
Menurut Sumantadinata (1997), teknologi ginogenesis memberikan banyak manfaat diantaranya (1) mempercepat proses pemurnian (homozigositas), (2) membuat populasi klon hanya dalam dua generasi, (3) membuat populasi tunggal kelamin betina, misalnya pada ikan mas, (4) mempercepat proses seleksi dan (5) mendeterminasi genotip jenis kelamin betina. Ginogenesis dapat terjadi secara alami dan buatan. Ginogenesis secara alami jarang terjadi karena pada umumnya spermatozoa yang membuahi sel telur dalam keadaan aktif (Golovinskaya 1972). Namun, ginogenesis dapat berlangsung secara spontan seperti Pb II yang akan keluar bertabrakan dengan spermatozoa yang akan masuk sehingga gamet jantan tidak jadi masuk dan Pb II tetap berada pada posisinya (double haploid). Menurut Cherfas (1981), ginogenesis alami dapat terjadi pada ikan crusian carp (Carrasius auratus
gibelio) dan vivipar kecil dari famili Poeciliidae (Poecilia dan Poeciliopsis).
Menurut Nagy et al. (1978) dan Sumantadinata (1997), ada dua tahap penting dalam ginogenesis buatan. Pertama menonaktifkan bahan genetik dari gamet jantan, antara lain dapat dilakukan dengan cara radiasi. Kedua meningkatkan jumlah zigot diploid dengan cara pemberian kejutan panas pada fase meiosis II atau mitosis I. Penggunaan sinar UV untuk inaktifasi materi genetik lebih banyak digunakan karena selain murah, lebih mudah dan aman digunakan dibandingkan dengan sinar gamma, sinar X dan betta (Lou dan Purdom 1984; Horvath dan Orban 1995). Perlakuan meradiasi sperma tidak menyebabkan berkurangnya kemampuan sperma sebagai fungsi membuahi telur dan sebagai trigger perkembangan embrio (Streisinger et al. 1981; Arai 2001). Menurut Chourrout (1984), keberhasilan inaktifasi materi genetik jantan dengan cara radiasi sperma, bila membuahi betina akan menghasilkan embrio haploid yang tidak bertahan hidup. Menurut Sumantadinata et al. (1990), pada ginogenesis ikan mas, proses radiasi sperma dapat dilakukan dengan menggunakan dua lampu UV yang masing-masing berkekuatan 15 watt untuk meradiasi sperma dengan jarak penyinaran 15 cm.
Perlakuan kejutan dapat berupa kejutan dingin (Purdom 1969; Cherfas et al. 1994), kejutan panas (Hollebecq et al. 1986; Komen et al. 1991; Cherfas et al. 1994; Galbusera et al. 2000) dan kejutan tekanan (Onozato 1984; Perruzi dan Chatain
7
2000). Berbagai macam kejutan tersebut mempunyai efektifitas yang berbeda untuk beberapa spesies ikan. Kejutan panas dan dingin sering dilakukan dalam ginogenesis ikan karena tidak memerlukan peralatan khusus. Sedangkan kejutan tekanan banyak digunakan pada hewan amfibi. Walaupun metode kejutan tekanan hidrostatik membutuhkan peralatan yang khusus dan lebih mahal, namun metode ini masih terus dikembangkan karena resiko kerusakan embrio lebih sedikit. Penggunaan bahan kimia juga digunakan untuk menahan proses pembentukan badan polar II pada telur ikan yang baru dibuahi, antara lain dengan colchisine pada poliploid ikan brook trout (Smith dan Lemoine 1979), nitrous oxide (Shelton et al. 1986) pada triploid ikan rainbow trout.
Kejutan diberikan pada saat yang tepat setelah pembuahan (Hollebecq et al. 1986), pada saat meiosis kedua atau mitosis pertama (Lou dan Purdom 1984; Taniguchi et al. 1988; Komen et al. 1988). Pemberian kejutan panas pada saat meiosis kedua dimaksudkan untuk menahan keluarnya badan polar kedua sehingga menghasilkan diploid ginogenetik. Sedangkan pada mitosis pertama, kejutan panas akan menghalangi pemisahan genom haploid maternal yang telah mengalami segregasi total sehingga menghasilkan zigot diploid (double haploid) (Chourrout 1984).
Menurut Taniguchi et al. (1988), diploid ginogenetik yang dihasilkan dari perlakuan diploidisasi pada saat meiosis kedua dinamakan diploid ginogenetik meiotik (G2N-meiotik/meiogen), sedangkan diploid ginogenetik yang dihasilkan pada perlakuan diplodisasi saat mitosis pertama dinamakan diploid ginogenetik mitotik (G2N-mitotik/mitogen). Menurut Tave (1986) dan Purdom (1993), individu ginogen dimungkinkan mengalami penyimpangan biologis maupun fisiologis yang diduga terkait dengan proses ginogenesis maupun munculnya gen-gen resesif yang tidak menguntungkan.
Pada G2N-meiotik genotip diploid berasal dari 1N kromosom pronukleus betina dan 1 N badan polar II. Dengan demikian genotip meiogen dipengaruhi oleh pindah silang antar gen pada lokus yang sama. Sedangkan pada G2N-homozigot/ mitogen merupakan double haploid kromosom pronukleus betina (1 sel telur).
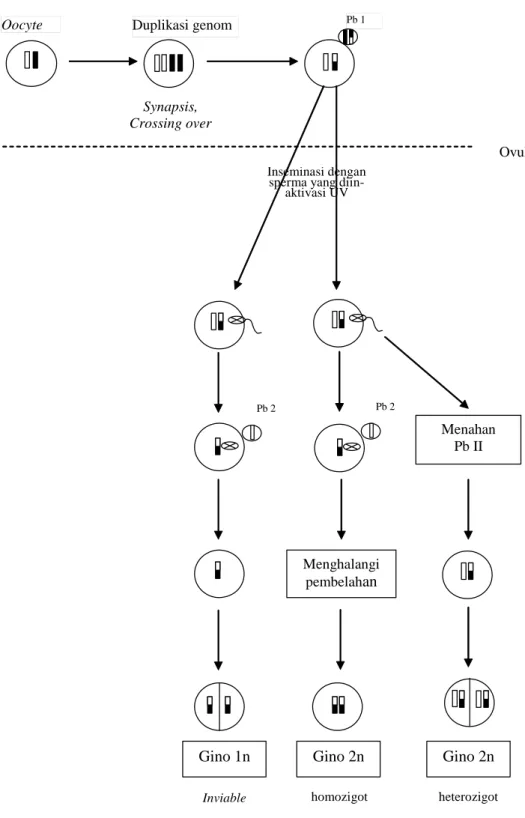
8 Pb 1 Duplikasi genom Oocyte Menghalangi pembelahan Menahan Pb II
Gino 1n Gino 2n Gino 2n
Inviable homozigot heterozigot
Ovulasi
Synapsis, Crossing over
Inseminasi dengan sperma yang
diin-aktivasi UV
Pb 2 Pb 2
Gambar 3 Diagram ginogenesis yang menghasilkan tipe ginogen homozigot atau heterozigot (Aray, 2001)
9
Ikan klon adalah individu homozigot identik dengan induknya, yaitu dihasilkan melalui proses ginogenesis dua tahap (Sumantadinata 1997; Arai 2001). Ginogenesis tahap pertama (generasi I) menghasilkan G2N-mitotik yaitu individu homozigot identik (double haploid) dengan cara menghambat pembelahan pada fase mitosis I. Ginogenesis tahap II (generasi II) adalah perbanyakan individu yang identik dengan G2N-mitotik (generasi I) dengan melakukan ginogenesis fase meiosis yaitu mencegah keluarnya badan kutub II. Klon hasil ginogenesis pada tahap II diharapkan bergenotip homozigot pada hampir seluruh gen, karena merupakan kopi genom dari genotip homozigot (G2N-mitotik).
Verifikasi Genetik Ikan Klon RAPD
Verifikasi genetis ikan klon dapat dilakukan dengan berbagai metode antara lain dengan tissue grafting, DNA fingerprint SSRa-PCR dan RAPD. Tissue grafting pernah dilakukan pada ayu fish (Han et al. 1991), Cyprinus carpio (Komen et al. 1991), salmon (Kobayashi et al. 1994). Metode DNA fingerprint telah dilakukan pada ayu fish (Han et al. 1991), japanese flounder (Hara et al. 1993), rainbow trout (Young et al. 1995), red sea bream (Kato et al. 2001). Sedangkan metode SSRa-PCR dan RAPD digunakan pada tilapia (Jenneckens et al. 1991).
RAPD (Random Amplified Polymorphic DNA) adalah salah satu metode yang digunakan untuk analisis profil DNA genom. Teknik RAPD ini merupakan suatu metode analisis DNA genom dengan cara melihat pola pita DNA yang dihasilkan setelah DNA genom diamplifikasi menggunakan primer acak. Prinsip dasar RAPD adalah komplementasi urutanbasa primer dengan urutan basa DNA cetakan. Apabila terdapat komplementasi urutan basa antara primer dan DNA cetakan, maka primer akan menempel pada kedua ujung 3’OH utas DNA cetakan. Jika kedua situs penempelan primer berada dalam jarak yang dapat diamplifikasi, maka produk PCR akan diperoleh berupa fragmen atau pita DNA (Tingey et al. 1992).
Metode RAPD mendeteksi polimorfisme urutan nukleotida pita DNA hasil amplifikasi PCR dengan hanya menggunakan satu primer tunggal. Primer tersebut
10
akan berpasangan dengan utas tunggal DNA genom yang satu dan pada utas DNA pasangannya dengan orientasi yang berlawanan. Selama situs penempelan primer masih berada dalam jarak yang masih dapat diamplifikasi, maka akan diperoleh produk DNA amplifikasi. Jarak tersebut umumnya tidak lebih dari 5000 bp. Semakin pendek fragmen yang akan diamplifikasi semakin efisien amplifikasinya (Tingey et
al. 1992; Weising et al. 1995).
Rata-rata jumlah fragmen DNA yang dihasilkan sebuah primer tunggal tergantung pada kekompleksan genom. Makin kompleks suatu genom akan makin kompleks pola fragmen RAPD yang dihasilkan (Grattapaglia et al. 1992). Disamping itu jumlah dan kualitas fragmen RAPD yang dihasilkan bergantung pada panjang dan komposisi nukleotida penyusun primer, konsentrasi dan kemurnian DNA cetakan, konsentrasi ion magnesium, aktivitas dan jumlah DNA polimerase dan temperatur penempelan (Matondang et al. 2001; Promega 2001).
Secara umum RAPD lebih mudah, lebih murah, dan tekniknya lebih cepat dibandingkan dengan RFLP (Restriction Fragment Length Polymorphism), SSR (Simple Sequence Repeats) dan AFLP (Amplified Fragment Length Polymorphism) (Darmono 1996). Hal ini didasarkan pada : (1) tidak memerlukan pengetahuan latar belakang genom yang akan diteliti, (2) primer secara universal dapat digunakan untuk organisme prokariot maupun eukariot, (3) mampu menghasilkan karakter yang relatif tidak terbatas jumlahnya, (4) bahan-bahan yang digunakan relatif murah, (5) mudah dalam hal preparasi dan (6) memberikan hasil lebih cepat dibandingkan dengan analisis keragaman molekuler lainnya. Selain itu ada beberapa kelemahan RAPD. Darmono (1996) merangkum kelemahan dari RAPD dari beberapa publikasi : (1) pemunculan pita DNA kadang-kadang tidak konsisten. Hal ini lebih sering terjadi jika suhu penempelan yang digunakan terlalu tinggi, (2) ruas DNA berulang sering berlipat ganda, (3) homologi urutan nukleotida pada pita-pita DNA dengan mobilitas yang pada gel tidak diketahui, (4) penanda RAPD bersifat dominan. Jumlah primer yang digunakan dalam analisis sangat bergantung pada tujuan atau jenis informasi yang diinginkan.
11
Determinasi Kelamin
Jenis kelamin suatu individu ditentukan bersama oleh faktor genetis dan lingkungan. Faktor genetik yang menentukan jenis kelamin adalah kromosom, sedangkan kromosom yang memegang peranan utama dalam menentukan jenis kelamin adalah kromosom kelamin atau gonosom. Faktor lingkungan seringkali berpengaruh terhadap perubahan jenis kelamin. Perubahan ini menyebabkan karakter kelaminnya berubah, namun susunan genetisnya tidak berubah. Jenis kelamin zigot merupakan hasil keseimbangan antara jumlah gen penentu jantan dan betina, sedangkan diferensiasi kelamin secara fungsional diatur oleh mekanisme genetik melalui sistem endokrin embrio dimana prosesnya dipengaruhi oleh faktor lingkungan.
Pengamatan jenis kelamin ikan dapat dilakukan secara visual dengan mengamati ciri kelamin sekunder. Ikan sumatra betina dapat dibedakan dengan bentuk tubuh yang lebih penuh dan warna merah yang lebih sedikit pada sirip ventral, juga di bagian hidung (Innes 1994). Pada ikan sumatra jantan, sirip dan hidung berwarna lebih merah dibandingkan ikan betina. Keaadan ini akan terlihat jelas pada saat ikan sumatra akan memijah (Mc Inerny dan Gerard 1966).
Karakter Meristik
Pola pewarisan ciri meristik dapat digunakan untuk menelusuri hubungan kekerabatan yang lebih spesifik dalam penelitian ginogenesis, dalam hal ini untuk mengetahui keberhasilan segregasi dan rekonstruksi genom pada produksi G2N-mitotik maupun klon. Pengukuran karakter meristik pada ikan diploid ginogen (G2N) telah dilakukan oleh beberapa peneliti. Pada ikan mas, ukuran tubuh (panjang standar) pada miogen dan G2N-mitotik tidak berbeda nyata dibandingkan dengan kontrol normal pada umur yang sama (3 bulan), demikian pula dengan variasi karakter meristik (jumlah vertebrate, jumlah tulang lunak sirip dan jumlah lembar insang). Nilai variasi fenotif (Vp) pada G2N-mitotik kurang dari dua kali individu normal pada kebanyakan sifat morfometrik dan nilai Vp tersebut lebih dari dua kali individu normal untuk kebanyakan sifat meristik. Fenomena tersebut dapat
12
diterangkan melalui rumus tentang Vp = Vg(1+F) + Ve untuk meiogen dan Vp = 2Vg+Ve untuk mitogen (Sumantadinata et al. 1990).
METODOLOGI
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Nopember 2004 sampai April 2006, di Kolam Babakan Sawah Baru, Laboratorium Pengembangbiakan dan Genetika Ikan FPIK IPB dan Pusat Studi Sumberdaya Hayati dan Bioteknologi (PSSHB) IPB Bogor.
Metode Penelitian Ginogenesis
Pemeliharaan Induk Ikan Sumatra dan Ikan Tawes
Induk ikan sumatra jantan dan betina dipelihara secara terpisah dalam akuarium berukuran 100x50x50 cm dengan menggunakan sistem double bottom menggunakan batuan zeolit dan diberi aerasi, pakan yang diberikan berupa
Chironomus sp. dan pakan buatan berupa pelet. Ikan tawes (Puntius gonionotus
Blekeer) jantan sebagai pendonor sperma dipelihara terpisah dalam kolam dan diberi pakan pelet.
Pemijahan Ikan Sumatra
Induk ikan sumatra yang akan dipijahkan terlebih dahulu dipuasakan selama satu hari untuk mencegah terjadinya penyumbatan lemak pada saluran telur atau sperma dan untuk mempermudah dalam memilih induk betina yang siap memijah. Pemijahan dilakukan pada akuarium berukuran 20x20x20 cm yang telah diisi air dengan ketinggian 10 cm dan sekelilingnya ditutup dengan plastik berwarna hitam diberi aerasi kecil dan enceng gondok. Ikan sumatra jantan dan betina disatukan pada pukul 21.00 WIB dengan perbandingan 1 : 1. Pengamatan induk betina yang memijah dilakukan keesokan harinya.
14
Produksi Klon dengan Metode Ginogenesis
Ginogenesis Tahap I (Mitogen) dan Ginogenesis Tahap II (Klon)
Pemijahan akan ditandai dengan pengeluaran telur (biasanya menempel pada akar enceng gondok atau tersebar pada dasar akuarium). Ikan sumatra yang memijah diambil lalu distripping (diurut bagian perutnya secara perlahan-lahan menuju anus), kemudian telur ditampung dan didistribusikan dalam 6 cawan : 3 cawan masing-masing untuk kontrol normal (K2N), kontrol hibrid (K2H), kontrol UV (KUV) dan 3 cawan lainnya untuk perlakuan ginogenesis dengan waktu inisiasi kejutan panas yang berbeda-beda sesuai dengan tahapannya (mitoginogenesis pada tahap I atau meioginogenesis pada tahap II).
Sperma ikan tawes (donor) dan ikan sumatra diambil secara terpisah menggunakan syringe tanpa jarum dengan cara mengurut pada bagian perutnya menuju anus, kemudian sperma ikan tawes diencerkan 100 kali dalam labu erlenmeyer menggunakan larutan fisiologis merk dagang Otsu-Ns (Normal saline) dengan komposisi Osmolarity 306 Osm/l dan 0.9% b/v sodium chloride. Sebagian sperma ikan tawes digunakan untuk pembuahan pada K2H dan sebagian lainnya diradiasi untuk menginaktifasi materi genetik jantan dan digunakan pada pembuahan telur KUV. Sperma ikan sumatra digunakan untuk pembuahan telur pada K2N. Sperma yang akan diradiasi diletakkan dalam cawan petri setebal 1 mm (1.5 ml) sambil digoyang supaya sperma merata di permukaan cawan, kemudian dimasukkan ke dalam wadah penyinaran sinar UV selama 1.5 menit. Wadah penyinaran berupa kotak berukuran 100x100x30 cm, berisi 3 buah lampu UV berkekuatan 15 watt dengan jarak penyinaran 15 cm.
Pembuahan telur oleh sperma dilakukan dengan cara mencampurkan sperma dan telur sambil diaduk-aduk perlahan menggunakan bulu ayam kemudian diberi larutan pembuahan untuk meningkatkan derajat pembuahan. Larutan pembuahan (fertilizing solution) dibuat dari campuran 30 g urea dengan 40 g NaCl dilarutkan dalam 10 l air bersih (Woynarovich dan Horvath 1980). Telur yang sudah dibuahi selanjutnya dituang pada saringan dalam bak fiber yang berisi air pada suhu 28 oC dan dilengkapi aerasi. Untuk tahapan mitoginogenesis (tahap I) atau meioginogenesis
15
(tahap II) pasca perlakuan dipindahkan pada akuarium inkubasi yang berukuran 20x20x10 cm untuk penetasan telur dan berisi air yang telah diberi larutan metilen
blue (mb) 2 mg/l untuk mencegah jamur pada telur.
Pada ginogenesis tahap I (mitoginogenesis), inisiasi kejutan panas diberikan pada menit ke 18, 19 atau 20 setelah pembuahan (fase mitosis) yaitu dengan merendam telur pada suhu 40 oC selama 1.5 menit pada wadah perendaman telur (water bath) yang dilengkapi dengan termometer. Pada ginogenesis tahap II, ikan yang digunakan sebagai induk adalah mitogen (G2N-mitotik), yang bertahan hidup sampai dewasa dijadikan induk betina untuk proses ginogenesis meiotik guna mendapatkan ikan klon (Gambar 4). Perlakuan kejutan panas 40 oC selama 1.5 menit diberikan pada menit ke 1 dan 2 setelah pembuahan (fase meiosis).
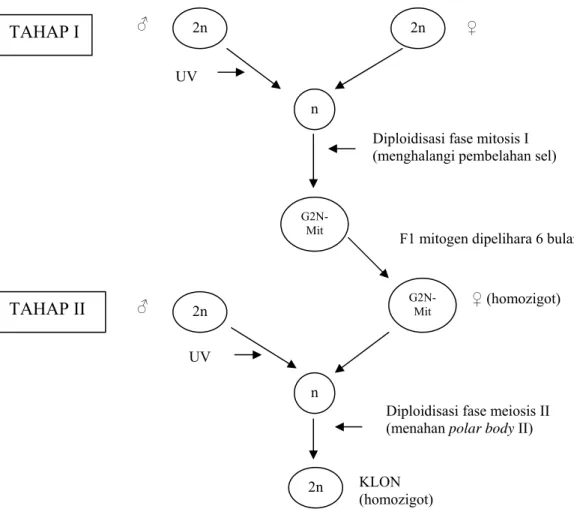
Gambar 4. Diagram skematik produksi klon
2n 2n n G2N- Mit G2N- Mit 2n n 2n ♂ ♂ ♀ ♀ (homozigot) Diploidisasi fase mitosis I (menghalangi pembelahan sel)
F1 mitogen dipelihara 6 bulan
Diploidisasi fase meiosis II (menahan polar body II) KLON (homozigot) TAHAP I UV UV TAHAP II
16
Perhitungan telur dilakukan pada 3 jam dan 10 jam pertama setelah telur dibuahi (telur fertil), kemudian 12 sampai 30 jam setelah pembuahan dilakukan perhitungan telur yang menetas (Hatching Rate/HR). Selanjutnya 4 hari dan 28 hari setelah telur menetas dilakukan penghitungan kelangsungan hidup ikan (SR larva). Telur, larva dan anak ikan yang mati diambil dengan menggunakan pipet dan dihitung dengan menggunakan handy counter. Ikan diberi makan setelah berumur 2-3 hari menetas atau setelah kuning telur habis. Pakan yang diberikan untuk larva sampai umur tujuh hari adalah plankton. Pada umur lima hari diberikan nauplius artemia (Artemia salina) sampai umur tujuh hari. Seminggu berikutnya diberikan kutu air Daphnia sp., setelah itu diberi Chironomus sp. dan pelet.
Verifikasi Genetik Ikan Klon RAPD
Isolasi DNA Genom Ikan
Ekstraksi dan pemurnian genom DNA mengikuti prosedur PUREGENE. Sampel sirip ikan yang digunakan ditimbang, berat setiap sampel 10-15 mg dan dimasukkan dalam ependorf 1.5 ml, kemudian dilisis dengan menambahkan 300 μl cell lysis solution (Lampiran 1). Sampel digerus hingga hancur, kemudian ditambah 5 μl proteinase K (20 mg/ml), diinkubasi selama 24 jam pada suhu 55 oC.
Selanjutnya Rnase (4 mg/ml) ditambahkan dalam sampel sebanyak 1.5 μl yang dilakukan di atas es, kemudian diinkubasi pada suhu 37 oC selama 1 jam. Tahap berikutnya sampel didinginkan pada suhu ruang, kemudian ditambah 100 μl larutan protein precipitation untuk pengendapan protein. Selanjutnya sampel divortex selama 20 detik dan disentrifuse dengan kecepatan 14000 rpm pada suhu 4 oC selama 3 menit.
Pengendapan DNA dilakukan dengan memindahkan larutan supernatan yang mengandung DNA ke dalam ependorf baru yang telah diisi 300 μl isopropanol 100%, dibolak-balik dan disentrifuse pada 14000 rpm selama 1 menit. Supernatan dibuang dan ependorf diletakkan di atas kertas tisu dengan posisi
17
terbalik hingga kering. Kemudian ditambahkan 300 μl etanol 70% (v/v) dan dibolak-balik agar DNA tercuci dengan sempurna. Ependorf disentrifuse kembali pada kecepatan 14000 rpm selama 1 menit pada suhu 4 oC. Supernatan dibuang dan pelet dikeringkan, kemudian ditambah TE 50 µl (Lampiran 2).
Analisis RAPD
Analisis RAPD terdiri dari 4 tahap : (1) uji kualitas dan kuantitas DNA hasil isolasi; (2) seleksi primer; (3) amplifikasi DNA template melalui proses PCR (Polymerase Chain Reaction); (4) elektroforesis dan visualisasi hasil amplifikasi.
Uji Kuantitas dan Kualitas DNA
Kuantitas dan kualitas DNA dianalisis secara elektroforesis dan spektrofotometer. Uji kuantitas DNA melalui elektroforesis dilakukan untuk memperkirakan kuantitas per mikroliter DNA terisolasi dengan membandingkan DNA terisolasi pada marker DNA λ 10,30,50 ng/µl. Pengujian DNA secara elektroforesis ini pada prinsipnya adalah mengukur laju migrasi DNA pada gel agarosa yang diberi tegangan tertentu dari arus (–) ke (+). Agarosa disuspensikan di dalam larutan penyangga yang sesuai yaitu TAE lx dari larutan TAE 50x (Lampiran 3) atau TBE lx dari larutan TBE 10x (Lampiran 4). Pada umumnya gel agarosa menggunakan konsentrasi 0.8-1% (b/v) dalam larutan TAE 1x. Konsentrasi agarosa tergantung pada besarnya fragmen DNA yang dianalisis. Semakin kecil fragmen DNA, semakin tinggi konsentrasi agarosa yang digunakan.
Suspensi agarosa dipanaskan dalam microwave hingga tidak terlihat lagi butiran agarosa, dan larutan menjadi jernih (±60 detik). Setelah suhunya mencapai 60-70 °C, agarosa dituangkan setebal 5 mm ke dalam tempat yang telah disiapkan untuk menuang (tray yang dilengkapi sisir). Gel dibiarkan membeku dan sisir diambil secara hati-hati, kemudian gel ditempatkan pada alat/tanki elektroforesis sedemikian rupa sehingga lubang terletak pada kutub (elektroda) negatif. Larutan bufer TAE lx dituangkan sampai gel terendam.
18
DNA yang akan dianalisis dicampur dengan larutan pewarna (loading
dye) bromofenol biru 6x (Lampiran 5) untuk menandai laju migrasi. DNA yang
dianalisis berikut marker (λ10,20,30 ng) dimasukkan ke dalam sumur. Alat elektroforesis ditutup untuk kemudian dihubungkan/dialiri listrik. Elektroforesis berlangsung pada 100 volt selama ± 30 menit. Setelah selesai, penutup tanki elektroforesis dibuka, gel agarosa diambil kemudian direndam dalam larutan EtBr (Ethidium Bromida) dengan konsentrasi final 0.5 μg/ml selama 15-30 menit dan selanjutnya dibilas dengan H2O.
Uji kuantitas melalui spektrofotometer pada prinsipnya adalah melihat densitas DNA secara optik (Optical Density-OD) pada panjang gelombang 260 nm dan disetarakan dengan 50 μg/ ml setiap nilai OD = 1 pada absorbansi UV gelombang tersebut. Kualitas DNA dapat diketahui dengan membandingkan hasil OD pada absorbansi 260 nm terhadap 280 nm. Kualitas DNA yang bagus adalah apabila rasio OD (260nm/280nm) berkisar 1.8-2.0. Rasio OD <1 menunjukkan adanya kontaminan pada DNA hasil isolasi. Kontaminan dapat berupa pati, protein dan atau fenol.
Primer
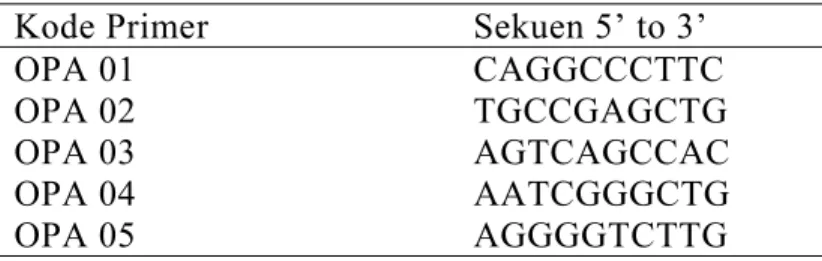
Primer RAPD dari Operon (Operon Alameda Technology Inc) yang digunakan OPA 1, OPA 2, OPA 3, OPA 4, OPA 5 (Tabel 2). Dari lima primer yang digunakan dilakukan seleksi untuk menentukan jenis primer yang bisa mengamplifikasi DNA genom.
Tabel 2 Primer-primer yang digunakan dalam RAPD-PCR
Kode Primer Sekuen 5’ to 3’
OPA 01 CAGGCCCTTC
OPA 02 TGCCGAGCTG
OPA 03 AGTCAGCCAC
OPA 04 AATCGGGCTG
19
Amplifikasi PCR
Amplifikasi DNA dengan PCR menurut Yadav (2000) yang dimodifikasi dilakukan dengan cara menyediakan campuran utama (master mix) (Fermentas) dalam eppendorf 2 ml (Tabel 3).
Tabel 3 Campuran komponen PCR
M1 M2 V1 (µl)
10x PCR buffer 1 x 2
2 mM dNTP mix 0.2 mM 2
Primer OPA (5 pmol) 5 pmol 1
Taq 5 u/µl (Fermentas) 1 u 0.2
25 mM MgCl 2.5 mM 2
ddH2O 11.8
DNA 30 ng 1
V2 20
Keterangan M1 : Konsentrasi stok; M2 : Konsentrasi yang diharapkan V1: Volume awal;
V2 : Volume total/akhir
Contoh DNA (hasil isolasi) sebanyak 1 μl (30 ng) tiap eppendorf 0.5 ml steril. Kemudian setiap 19 µl dari campuran utama dipipet dan dimasukkan pada tiap-tiap eppendorf 0.5 ml kemudian dispin dan dimasukkan ke mesin PCR.
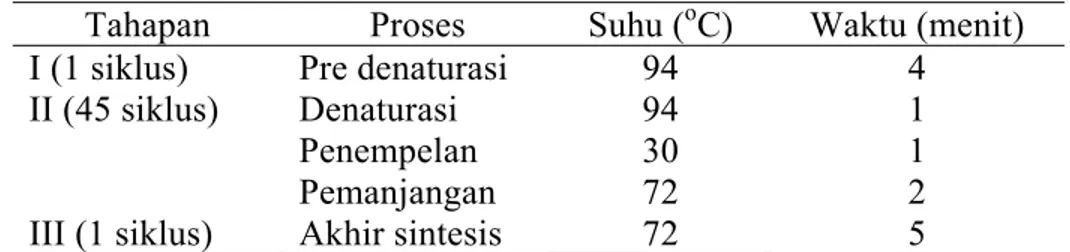
Secara umum proses PCR terdiri dari 3 tahap yaitu denaturasi (penguraian utas ganda DNA), penempelan primer (annealing), pemanjangan utas DNA primer yang komplemen template. Pre-denaturasi selama 4 menit untuk aktifasi enzim taq polimerase, dan pada tahap akhir PCR ditambahkan akhir sintesis 5 menit untuk meyakinkan semua hasil amplifikasi dalam bentuk untai ganda. Proses waktu, suhu dan jumlah siklus masing-masing tahapan PCR disajikan pada Tabel 4.
Tabel 4 Siklus, proses, suhu dan waktu dalam amplifikasi genom ikan sumatra
Tahapan Proses Suhu (oC) Waktu (menit)
I (1 siklus) II (45 siklus) III (1 siklus) Pre denaturasi Denaturasi Penempelan Pemanjangan Akhir sintesis 94 94 30 72 72 4 1 1 2 5
20
Reaksi amplifikasi dilakukan menggunakan alat PCR (PTC-100TM MJ Research, Inc.) dengan siklus termal sebanyak 45 kali. Hasil PCR dapat difraksinasi dengan menggunakan gel agarosa 1.5% (b/v) dalam larutan TAE 1x. Volume hasil PCR (yang dimigrasikan) diambil 8-10 μl dan dicampur dengan 2 μl loading dye 6x. Hasil elektroforesis DNA divisualisasi menggunakan UV transluminator dan didokumentasi dengan kamera yang telah terhubung pada program komputer.
Identifikasi Jenis Kelamin
Jenis kelamin ikan sumatra diidentifikasi setelah ikan mencapai dewasa (6 bulan). Pengamatan jenis kelamin dilakukan secara visual dengan mengamati ciri kelamin sekunder. Ikan sumatra jantan ditandai dengan badan yang lebih ramping dan warna yang cerah pada bagian sekitar mulut, sirip ekor dan hidung berwarna lebih merah. Sedangkan ikan sumatra betina warna agak kusam dan perutnya lebih buncit setelah mencapai kematangan gonad.
Karakterisasi Meristik
Pengukuran meristik dilakukan pada ikan yang sudah berumur 6 bulan, meliputi jumlah sisik pada linea lateralis, jumlah jari-jari lemah sirip punggung, sirip dada, sirip perut, dan sirip anal.
Analisis Data
Keberhasilan ginogenesis pada produksi klon ikan sumatra dianalisis secara deskriptif, dan ditampilkan dalam bentuk tabel. Analisis status genetik individual hasil ginogenesis dengan teknik RAPD dibaca berdasarkan pita DNA tegas dan pita DNA tipis secara konsisten. Pita DNA hasil amplifikasi yang terdeteksi pada individu diberi skor 1 (ada) dan jika tidak terdeteksi diberi skor (0). Estimasi kemiripan genetik individual diperoleh berdasarkan jumlah pita terdeteksi yang dimiliki bersama. Untuk menentukan tingkat kesamaan yang terdapat pada lajur yang berbeda ditentukan berdasarkan koefisien Dice atau rumus Nei dan Li (1979) yaitu : S = 2nab/ na+ nb
21
Keterangan : S : Koefisien kemiripan
a dan b : dua individu yang dibandingkan
nab : jumlah pita DNA yang sama posisinya pada individu a dan b na : jumlah pita DNA pada individu a
nb : jumlah pita DNA pada individu b
Pengelompokan data matrik dan pembuatan dendrogram dilakukan dengan metode Unweight Pair Group Methode Arithmetic (UPGMA) fungsi Similarity
Qualitative (SIMQUAL) program NTSYS versi 2.0 (Rohlf 1998).
Determinasi kelamin dianalisis dengan menghitung rasio jantan dan betina, ciri meristik dianalisis dengan keragaman (V). Rumus untuk menghitung keragaman (V) menurut Tave (1986) adalah sebagai berikut :
X = Σxi/n V = Σx2- (Σx)2/n n-1
HASIL DAN PEMBAHASAN
Keberhasilan Klon Melalui Ginogenesis
Pada tahap I, telur pada kontrol normal dapat dibuahi sebesar 51% dan dapat hidup pada hari ke 28 sekitar 3%, hal ini menunjukkan telur yang digunakan relatif baik artinya telur yang digunakan bisa dibuahi oleh sperma (Tabel 5; Lampiran 6). Pada kontrol UV menunjukkan indikasi bahwa radiasi terhadap sperma berjalan efektif, hal ini dibuktikan dari derajat pembuahan yang tinggi, embrio sedikit yang berkembang dan yang menetas hanya 0.7%, pada hari ke 4 mati semua (inaktifasi materi genetik yang menghasilkan individu haploid tidak bertahan hidup pada KUV). Menurut Cherfas (1981) dan Arai (2001), embrio yang terbentuk dari pembuahan sel telur oleh sperma yang diradiasi (KUV) adalah haploid dimana pada umumnya tidak normal (abnormal) dikenal dengan haploid syndrome dan akan mati selama perkembangan embrio sebelum atau beberapa saat setelah menetas, atau selama stadia awal larva sebelum mulai makan.
Pada kontrol hibrid (K2H) telur dapat berkembang hingga menetas hal ini menunjukkan bahwa sperma dapat membuahi telur karena sperma dapat masuk kedalam mikrofil sehingga terjadi pembuahan. Menurut Risnawati (1995), sperma ikan tawes dapat digunakan untuk ginogenesis pada ikan sumatra karena memiliki ukuran diameter kepala spermatozoa yang lebih kecil daripada ikan sumatra yaitu 1.496 µm versus 1.907 µm dan panjang ekor sperma 31.147 µm versus 30.187 µm sehingga sperma ikan tawes dapat masuk ke dalam lubang mikrofil dan menginseminasi telur ikan sumatra. Kematian kontrol hibrid setelah hari ke-4 diduga karena banyaknya embrio yang edema, cacat, dan kerusakan kuning telur (Chevassus 1983). Mitogen yang hidup dipastikan hanya memiliki gen yang berasal dari induk betina.
Persentase mitogen yang menetas dan bertahan hidup mencapai 2.6% pada inisiasi kejutan panas ke-18 setelah pembuahan, kemudian 1.2% pada inisiasi kejutan panas ke-19 dan 0.1% pada inisiasi kejutan panas ke-20. Rendahnya kelangsungan hidup mitogen juga diakibatkan karena kejutan panas yang dapat membuat kerusakan pada telur sehingga telur mati dan tidak sempat berkembang (Hollebecq et al. 1986; Siraj et al. 1993). Menurut Komen et al. (1991) keturunan mitogen menderita karena depresi inbreeding. Silang dalam yang sangat kuat
23
memberikan peluang munculnya alel homozigot resesif yang biasanya bersifat kurang menguntungkan, akibatnya lebih dari 80% yang gagal karena mortalitas dan infertilitas.
Tabel 5 Rerata keberhasilan ginogenesis menggunakan sperma ikan tawes yang diradiasi dan suhu kejutan 40 oC selama 1.5 menit
Tahap I
Kejutan panas pada menit ke- Parameter K2N Kontrol KUV K2H 18 19 20 Jumlah telur 129.3±95.9 161.6±95.9 131±66 117.3±48.4 232.3±134.5 186±80.5 % FR 51.4±23.9 52.6±30.7 57.1±18.0 48.8±28.4 56.8±18.3 51.7±33.7 % SRe 4.8±4.7 8.6±9.3 18.7±3.0 6.8±11.7 4.8±6.7 6.1±3.0 % HR 3.9±4.7 0.7±1.2 12.6±3.7 2.6±4.4 1.2±1.7 2.0±0.7 % SR4 3.1±4.7 0 3.1±5.3 2.6±4.4 1.2±1.7 0.1±0.2 % SR28 3.1±4.8 0 0 2.6±4.4 1.2±1.7 0.1±0.2 Tahap II
Kejutan suhu pada menit ke Parameter K2N Kontrol KUV K2H 1 2 Jumlah telur 71.3±54.9 57.6±40.4 51±39 258±54.5 194.3±56.9 % FR 81.2±10.5 67.8±11.9 78.3±4.9 74.24±24.5 85.4±13.5 % SRe 12.2±9.7 12.7±11.0 28.0±11.6 30.2±11.7 40.0±15.4 % HR 10.4±7.6 6.2±5.6 19.8±20 24.2±6.8 23.9±13.7 % SR4 7.5±7.1 0 0 7.41±7.8 6.0±3.7 % SR28 7.5±7.1 0 0 3.54±2.8 2.0±0.7 Keterangan :
FR (Fertilization Rate) = Derajat pembuahan telur (%) SRe (Survival Rate) = Kelangsungan hidup embrio (%) HR (Hatching Rate) = Derajat penetasan telur (%)
SR4 (Survival Rate) = Kelangsungan hidup larva saat umur 4 hari (%) SR28 (Survival Rate) = Kelangsungan hidup ikan saat umur 28 hari (%)
K2H = Kontrol hibrid
K2N = Kontrol normal
KUV = Kontrol UV
Pada tahap II, perlakuan kontrol normal telur dapat dibuahi oleh sperma ikan sumatra (Lampiran 7-10). Nilai derajat pembuahan pada ikan klon dibandingkan dengan ginogenesis tahap I menunjukkan bahwa telur yang dihasilkan mitogen memiliki kualitas yang bagus, artinya telur yang digunakan bisa dibuahi oleh sperma. Pada kontrol UV dan hibrid tidak didapatkan individu yang hidup sampai pada hari ke 4. Pada perlakuan kontrol UV telur dapat dibuahi dan setelah menetas mati karena individu haploid hanya mempunyai 1 set kromosom induk betina (Tave 1993) hal ini menunjukkan indikasi bahwa radiasi
24
terhadap sperma berjalan efektif. Kematian kontrol hibrid diduga karena banyaknya embrio yang cacat, edema dan kerusakan kuning telur (Chevassus 1983). Dengan demikian yang hidup dapat dipastikan ikan klon yang merupakan copy genom dari induk ikan sumatra mitogen tanpa materi genetik jantan. Rerata kelangsungan hidup embrio pada inisiasi kejutan panas menit ke-2 lebih tinggi dari pada menit ke-1 3.54% versus 2.04%. Rerata keberhasilan larva klon (SR4) rendah diduga karena kerusakan kromosom karena perlakuan ginogenesis.
Dari hasil ginogenesis tahap I, didapatkan mitogen yang mempunyai bentuk tubuh yang menyimpang (abnormal) sebesar 11% (2 ekor). Abnormalitas mitogen berupa pembengkokan vertebra (depan sirip ekor) dan bagian ekor yang pendek. Pada ginogenesis tahap II, didapatkan klon yang mengalami penyimpangan (abnormal) sebesar 11% (2 ekor) berupa pembengkokan vertebra (depan sirip ekor) dan ikan yang memutar. Menurut Tave (1986) dan Purdom (1993), individu ginogen dimungkinkan mengalami penyimpangan biologis maupun fisiologis yang diduga terkait dengan proses ginogenesis maupun munculnya gen-gen resesif yang tidak menguntungkan.
Karakteristik Genetik Ikan Klon RAPD
Hasil seleksi dari lima primer OPA menunjukkan hanya ada dua primer yang menunjukkan keragaman yaitu OPA 2 dan OPA 4. Amplifikasi menggunakan 2 primer menghasilkan fragmen DNA dengan ukuran berkisar 300-3.000 bp dan jumlah pita yang bervariasi (Gambar 5; Lampiran 15-17). Perbedaan hasil amplifikasi disebabkan adanya perbedaan jumlah tempat penempelan primer dan jarak antara 2 primer yang menempel pada DNA cetakan. Sedangkan untuk perbedaan ketajaman intensitas pita DNA merupakan hasil dari jumlah situs penempelan yang serupa dari sekuen DNA berulang.
Variasi kuantitas DNA hasil amplifikasi dicerminkan oleh variasi intensitas pendaran pita DNA di dalam gel agarosa di atas sinar UV. Semakin banyak fragmen DNA maka pita DNA akan semakin jelas. Perbedaan intensitas setiap pita tidak bisa digunakan untuk menduga jumlah copy potongan DNA pada setiap pita RAPD.
25
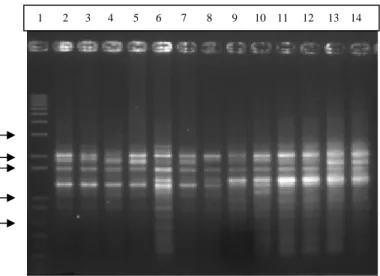
Gambar 5 Pola-pola pita 13 sampel ikan sumatra hasil RAPD mengunakan primer OPA 4; lajur 1 marker 1 kb plus, lajur 2-6 =K2N ; lajur 7-11 = mitogen; lajur 12-14 = klon. Running pada gel agarosa 1.5% (b/v); 50 volt.
Hasil pengamatan terhadap profil pita RAPD dari 2 primer yang mengamplifikasi DNA genom ikan sumatra disajikan pada Tabel 6. Total pita yang dihasilkan dari 2 primer yang digunakan adalah sebanyak 36 pita, 34 pita (94.4%) adalah polimorfik dan 2 pita (5.5%) adalah monomorfik.
Tabel 6 Jumlah pita DNA dan jumlah pita polimorfik hasil amplifikasi DNA ikan sumatra dengan primer OPA 2 dan OPA 4
Primer Susunan basa
5’……….3’ Jumlah pita DNA Jumlah pita polimorfik OPA 2 OPA 4 TGCCGAGCTG AATCGGGCTG 17 19 16 18 Jumlah 36 34
Primer OPA 2 pada amplifikasi DNA genom ikan sumatra normal, mitogen dan klon menghasilkan jumlah pita RAPD lebih sedikit dibanding OPA 4, sedangkan polimorfisme kedua primer tersebut 94.4% pada OPA 2 dan 94.7% pada OPA 4. Weising et al. (1995) menyatakan bahwa pada dasarnya polimorfisme pada DNA yang dianalisis RAPD merupakan hasil dari beberapa kejadian, yaitu : (1) delesi DNA pada bagian genom yang mengalami penempelan primer, (2) insersi DNA diantara dua situs penempelan primer, (3) subtitusi nukleotida pada situs penempelan primer. Insersi DNA yang berukuran besar diantara dua situs penempelan primer menyebabkan ketidakmampuan DNA
1 2 3 4 5 6 7 8 9 10 11 12 13 14 2000 bp 1000 bp 3000 bp 650 bp 1650 bp
26
polimerase untuk mensintesis DNA sehingga daerah tersebut tidak dapat diamplifikasi. Insersi DNA yang berukuran kecil diantara dua situs penempelan menyebabkan perubahan panjang daerah yang diamplifikasi; delesi pada situs penempelan menyebabkan primer tidak dapat menempel (pada daerah tersebut), sehingga tidak dapat diamplifikasi. Delesi diantara dua situs penempelan menyebabkan perubahan ukuran daerah yang diamplifikasi. Subtitusi pada situs penempelan menyebabkan primer tidak dapat menempel sehingga tidak terjadi sintesis DNA. Pemilihan primer pada analisis RAPD mempengaruhi jumlah pita DNA dan polimorfisme pita DNA yang dihasilkan, karena setiap primer memiliki situs penempelan yang spesifik.
Analisis Kemiripan (Similarity)
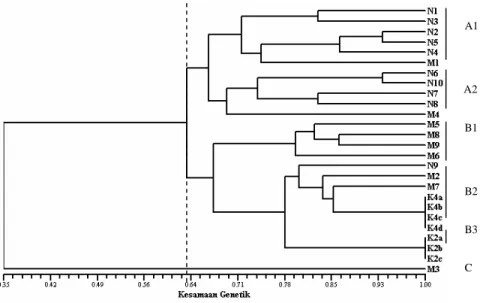
Berdasarkan penanda RAPD yang terdiri dari 2 primer (OPA2 dan OPA4) menunjukkan hubungan genetik intrapopulasi yang dekat pada ikan sumatra klon yaitu tingkat kemiripan 100% pada sampel K2a, K2b, K2c, demikian pula pada K4a, K4b, K4c, K4d. Pohon filogenik berdasarkan kesamaan genetik (Gambar 6) menghasilkan 3 kelompok A, B dan C dengan tingkat kesamaan 35%. Kelompok A memiliki 2 sub kelompok (A1 dan A2), kelompok B memiliki 3 sub kelompok (B1, B2, B3), kelompok C memiliki 1 individu. Sub kelompok A1 terdiri dari individu K2N (5) dan individu mitogen (1) dengan kesamaan genetik 74%. Sub kelompok A2 terdiri K2N (4) dan mitogen (1) dengan kesamaan genetik sekitar 70%. Sub kelompok A1 dan A2 mempunyai kesamaan genetik 67% (kelompok A memiliki perbedaan genetik sebesar 34%).
Sub kelompok B1 terdiri mitogen (4) dengan kesamaan genetik sebesar 80%. Sub kelompok B2 terdiri K2N (1), mitogen (2), klon (4) sedangkan sub kelompok B3 terdiri dari klon (3). Sub kelompok B1, B2, B3 mempunyai kesamaan genetik 68% (kelompok B memiliki perbedaan genetik 32%). Sub kelompok A dan sub kelompok B mempunyai kesamaan genetik 64%. Kelompok C hanya terdiri 1 individu mitogen (M3). Kelompok A,B,C mempunyai kesamaan genetik 35% (perbedaan genetik 65%). Dengan demikian dapat disimpulkan bahwa klon mempunyai kesamaan genetik intrapopulasi 100%.
27
Gambar 6 Dendrogram kesamaan genetik ikan sumatra normal (N), mitogen (M) dan klon (K) yang telah dikelompokkan (A, B, C).
Determinasi Kelamin
Berdasarkan hasil pengamatan jenis kelamin didapatkan rasio jantan dan betina pada klon adalah 41.67 dan 58.33% sedangkan pada mitogen sebesar 37.5 dan 62.5% (Lampiran 18-20). Adanya individu jantan dari hasil ginogenesis ini menurut Takahashi (1977); Takahashi dan Shimizu (1983) pada ikan Barbus tetrazona dan Danio rerio (zebra fish), gonad mengalami perkembangan awal sebagai ovarium tetapi selanjutnya pada saat dewasa jaringan ovari mengalami degenerasi (sel somatik meningkat) sehingga sedikitnya setengah populasi tetap menjadi ovarium dan setengahnya lagi berkembang menjadi testis. Fenomena deferensiasi kelamin pada ikan jenis ini dinilai menguntungkan terkait dengan program perbanyakan klon secara masal dimana tidak perlu melakukan sex reversal untuk mendapatkan ikan jantan pada klon hasil ginogenesis.
Karakter Meristik
Keragaman genetik (Vg) dapat mempengaruhi ekspresi fenotipik pada ciri meristik yang diteliti. Hal ini terkait dengan meningkatnya koefisien silang dalam (F) yang ditunjukkan pada persamaan keragaman fenotip (Vp) sebagai berikut : Vp= (F)Vg + Ve pada individu normal, Vp = Vg(1+F)+Ve pada G2N-meotik, atau Vp = 2Vg+Ve pada G2N-mitotik dan Vp = (1-F)Vg + Ve pada klon
A B A1 A2 B1 B2 C B3
28
(Taniguchi 1990). Dalam hal ini, Ve adalah keragaman lingkungan, dimana dalam penelitian ini kondisi lingkungan diasumsikan sama untuk semua perlakuan, sehingga keragaman yang disebabkan oleh lingkungan dapat diabaikan. Oleh karena itu perubahan keragaman fenotip sepenuhnya dipengaruhi oleh tingkat keragaman genetik dan silang dalam. Menurut Taniguchi et al. (1988) nilai F untuk G2N-mitotik adalah 1 dan untuk G2N-meiotik 0.5. Dengan demikian, secara teoritis nilai keragaman fenotip G2N-mitotik (mitogen) adalah 2 kali nilai keragaman fenotip ikan kontrol, sedangkan pada klon, nilai keragaman fenotip sama dengan nilai keragaman genotip.
Ciri meristik mitogen mempunyai kisaran dan keragaman lebih besar dari pada K2N pada jumlah jari-jari lemah sirip punggung, dada, perut, anal (Tabel 7; Lampiran 18-20). Sedangkan klon, mempunyai kisaran dan keragaman yang lebih rendah dari mitogen.
Tabel 7 Kisaran dan keragaman ciri meristik pada ikan sumatra K2N, mitogen dan klon
Ciri Meristik K2N Mitogen Klon
Jumlah jari-jari lemah sirip punggung Kisaran 7-8 7-10 7-8 Keragaman 0.079 0.595 0.231
Jumlah jari-jari lemah sirip dada Kisaran 7-8 7-9 7-8 Keragaman 0.253 0.517 0.259
Jumlah jari-jari lemah sirip perut Kisaran 6-8 6-7 6-7 Keragaman 0.201 0.467 0.259
Jumlah jari-jari lemah sirip anal Kisaran 5-6 5-6 5
Keragaman 0.195 0.267 0
Jumlah sisik pada linea lateralis Kisaran 20-25 19-30 20-24
Keragaman 1.128 8 1.027
Jumlah sampel 24 16 24
Ginogenesis tahap II (klon) menghasilkan keragaman fenotip yang lebih rendah daripada ginogenesis tahap I (mitogen), diduga karena perlakuan diberikan pada fase mitosis lebih rawan terjadi kegagalan rekonstruksi genom akibat pindah silang, fragmentasi dan lain-lain. Sedangkan pada ginogenesis tahap II lebih sederhana yaitu ketika perlakuan diberikan pada fase meiosis, maka badan polar II yang dihalangi lepas akan bergabung dengan pronukleus membentuk diploid homozigot (klon).
29
Menurut Taniguchi et al. (1988) tingginya nilai keragaman pada G2N-mitotik tidak saja disebabkan oleh pengaruh segregasi tetapi juga disebabkan oleh munculnya gen-gen resesif yang tidak menguntungkan akibat silang dalam yang kuat sehingga menyebabkan ketidakstabilan perkembangannya.
30
SIMPULAN
Ikan klon dapat dihasilkan pada generasi kedua ginogenesis dimana hubungan genetik berdasarkan tingkat kesamaan genetik klon hasil ginogenesis dari induk yang sama mencapai 100%. Rasio jenis kelamin jantan dan betina pada klon hasil ginogenesis adalah 41.67 dan 58.33%. Keragaman ciri meristik ikan klon lebih rendah daripada mitogen namun lebih tinggi daripada kontrol normal.
DAFTAR PUSTAKA
Abduh M. 1990. Penampilan generasi pertama diploid ginogenetik mitotik ikan Mas (Cyprinus carpio L) merah [skripsi] Bogor : Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Allendorf FW, Leary RF. 1984. Gynogenesis in Fishes in V.S. Kirpichnikov (Ed.). Genetic bases of fish selection. New York : Springer-Verlag, Berlin Heidelberg.
Arai K. 2001. Genetic improvement of aquaculture finfish species by chromosome manipulation techniques in Japan. Aquaculture 197 : 205-228.
Cherfas NB. 1981. Gynogenesis in Fishes in V.S. Kirpichnikov (Ed.). Genetic bases of fish selection. New York : Springer-Verlag, Berlin Heidelberg.
Cherfas NB, Peretz Y, Ben-Dom N, Gomelsky B, Hulata G. 1994. Induced diploid gynogenesis and polyploidy in the ornamental (koi) carp, Cyprinus carpio L. Theor Appl Genet 89:193-197.
Chevassus B. 1983. Hybridization in fish. Aquaculture 32 : 245-262.
Chourrout D. 1984. Pressure induced retention of second polar body and supression of first cleavage in rainbow trout : Production of all triploid, all tetraploids and heterozygous and homozygous diploid gynogenetics. Aquaculture 36 : 111-126.
Darmono TW. 1996. Ulas balik, analisis keragaman tanaman dengan teknik molekuler (Analysis of plant genetic variation with molecular technique). Hayati 3(1):7-11.
Disney JE, Johnson KR, Thorgaard GH. 1987. Intergenetic gene-transfer of six isozyme loci in rainbow trout by sperm chromosome fragmentation and gynogenesis. J Exp Zool 224(1) : 151-222.
Golovinskaya KA. 1972. Artificial Gynogenesis in Carp in B.I. Cherfas (Ed.) Genetic, Selection and Hybridization of Fish. Jerusalem : Wiener Pindery Ltd.
Galbusera P, Volckaert FAM, Ollevier F. 2000. Gynogenesis in the African catfish Clarias gariepinus (Burchell, 1822) III. Induction of endomitosis and the presence of residual genetic variation. Aquaculture 185 : 25-42.
32
Grattapaglia D, Chaparro J, Wilcox P, McCord S, Werner D, Amerson H, McKeand S, Bridgwater F, Whetten R, O’Malley D, Sederoff R. 1992. Mapping in woody plants with RAPD markers : Application to breeding in forestry and holticulture. In : Application of RAPD Tecnology to Plant Breeding. Joint Plant Breeding Symposia Series CSSA/ASHS/AGA. Minneapolis. p 37-40.
Han H, Taniguchi N, Tsujimura A. 1991. Production of clonal ayu by chromosome manipulation and confirmation by isozyme marker and tissue grafting. Nippon Suisan Gakkaishi 57(5):825-832.
Hara M, Dewa H, Yamamoto E. 1993. DNA fingerprinting with radioactive prove in clonal flounder Paralichthys olivaceus (in Japanese). Nippon Suisan Gakkaishi 59(4):731.
Hollebecq MG, Chourrout D, Wohlfarth G, Billard R. 1986. Diploid gynogenesis induced by heat shock after activation with UV-irradiated sperm in common carp. Aquaculture 54: 69-76.
Horvath L, Orban Z. 1995. Genome and gene manipulation in the common carp. Aquaculture 129 : 157-181.
Innes WT. 1994. Innes’s Exotic Aquarium Fishes. 21st Edition. A Work of General Reference. USA : TFH Publications Inc.
Jenneckens I, Muller-Belecke A, Horstgen-Schwark G, Meyer J-N. 1999. Proof of the successful development of nile tilapia (Oreochromis niloticus) clones by DNA fingerprinting. Aquaculture 173:377-385. John G, Reddy PVGK, Gupta SG. 1984. Artifisial gynogesis in two indian
mayor carps, Labeo rohita (Ham.) and Catla catla (Ham.). Aquaculture 42 : 161-168.
Kato K, Hayashi R, Yuasa D, Yamamoto S, Miyashita S, Murata O, Kumai H. 2001. Production of cloned red sea bream, Pagrus major by chromosome manipulation. Aquaculture 207 : 19-27.
Kobayashi T, Ide A, Hiasa T, Fushiki S, Ueno K. 1994. Production of cloned amago salmon Oncorhynchus rhodurus. Fish Sci 60:275-281. Komen J, Duynhouwer J, Richter CJJ, Huisman EA. 1988. Gynogenesis in
common carp (Cyprinus carpio L.) I. Effect of genetic manipulation of sexual products and incubator of reduced genetic variation in hatchery trout. Trans. Amer Fish Soc 114 : 230-235.
Komen, J, Bongers ABJ, Richter CJJ, Von Muiswinkel WB, Huisman EA. 1991. Gynogenesis in common carp (Cyprinus carpio L.) II. The
33
production of homozygous gynogenetic clones and F1 hybrids. Aquaculture 92:127-142.
Linhart O, Kvasnicka P, Flajshans M, Kasal A, Rab P, Palecek J, Slechta V, Hamackova J, Prokes M. 1995. Genetic studies with tench, Tinca tinca L. : Induced meiotic gynogenesis and sex reversal. Aquaculture 92:127-142.
Lou YD, Purdom CE. 1984. Diploids gynogenesis induced hydrostatic pressure in rainbow trout (Salmo gairdneri R.). J Fish Biol 24 : 665-670.
Matondang I, Suharsono, Hartana A. 2001. Analisis keanekaragaman genetik kelapa dalam asal Maluku menggunakan teknik RAPD. Hayati 8(2): 31-34.
Mc Inerny D, Gerard G. 1996. All About Tropical Fish. New York : The Macmillan Co.
Muller-Belecke A, Horstgen-Schwark G. 2000. Performance testing of clonal Oreochromis niloticus Lines. Aquaculture 184:67-76.
Nagy A, Rajki K, Horvart L, Csanyi. 1978. Investigation on carp (Cyprinus carpio L) gynogenesis. J Fish Biol 13 : 215-224.
Naruse K, Ijiri K, Shima A, Egami N. 1985. The production of cloned fish in the medaka (Oryzias latipes). J Exp Zool 236:335-341.
Nei M, Li WS, 1979. Mathematical model for studying genetic variation in term of retriction endonucleases. Proc Natl Acad Sci USA 76:5269-5273.
Onozato H. 1984. Diplodization of gynogenetically activated salmonid eggs using hydrostatic pressure. Aquaculture 43:91-97.
Pandey RN, Adams RP, Flournoy LE. 1996. Inhibition of Random Amplified Polymorphic DNAs (RAPDs) by plant polysaccharides. Plant Molec Biol reporter 14:15-22.
Peruzzi S, Chatain B. 2000. Pressure and cold shock induction of meiotic gynogenesis and triploidy in the European sea bass, Dicentrarchus labrax L. : relative efficiency of method and parental variability. Aquaculture 189:23-37.
Prana TK, Hartati NS. 2003. Identifikasi sidik jari DNA talas Indonesia dengan teknik RAPD : Skrining primer dan optimalisasi kondisi PCR. J Natur Indonesia 5(2) : 107-112.
34
Promega. 2001. PCR Core System-Technical Bulletin. Instruction for use of products M7660 and M7665. USA : Promega Corporation.
Purdom CE. 1993. Genetics and Fish Breeding. Combridge : Chapman and Hall.
Risnawati NW. 1995. Ukuran dan morfologi sperma beberapa spesies ikan famili Cyprinidae [skripsi] Bogor : Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Rohlf FJ. 1998. NTSYSpc: Numerical Taxonomy and Multivariate Analysis System Version 2.0. User Guide. Exerter software. New York : Applied Biostatistics Inc.
Saanin H. 1984. Taksonomi dan Kunci Identifikasi Ikan I. Jakarta : Binacipta.
Sastrapraja S, Budiman A, Djajasasmita M, Kaswadji S. 1981. Ikan Hias. Indonesia : Lembaga Biologi Nasional-LIPI.
Shelton CJ, Macdonald AG, Johnstone R. 1986. Induction of triploidy in rainbow trout using nitrous oxide. Aquaculture 58:155-159.
Siraj SS, Seki S, Jee AK, Yamada Y, Taniguchi N. 1993. Diploid gynogenesis in lampan jawa, Puntius schwanenfeldii followed by temperature shock. Aquaculture 59(6):957-962.
Smith LT,Lemoine HL.1979. Colchicine-induced polyploidy in brook trout. Prog. Fish-Cult 41: 86-88.
Soelistyowati DT, Sumantadinata K, Sudrajat AO. 2004. Rekayasa set kromosom dengan radiasi sperma ikan tawes (Puntius javanicus, Blkr) dan kejutan panas pada produksi diploid ginogenetik ikan sumatra (Puntius tetrazona, Blkr). Laporan Hibah Bersaing XII, DP3M DIKTI.
Sumantadinata K. 1997. Prospek bioteknologi dalam pengembangan akuakultur dan pelestarian sumberdaya perikanan [orasi ilmiah]. Bogor : Fakultas Perikanan, Institut Pertanian Bogor.
Sumantadinata K, Taniguchi N, Sugama K. 1990. The necessary conditions and the use of ultraviolet irradiated sperm from different species to induce gynogenesis of Indonesian common carp, in “ The Second Asian Fisheries Forum” (Ed. By Hirano R, Hanyu I.), Asian Fisheries Society, Manila, Phillipines. P: 539-542.
Sumpeno A, Poernomo, Muhdi S, Setiabudi E, Isjaturradhijah, Hertanto D, Dahlia UN. 2004. Direktori Ikan Hias. Cetakan I. Jakarta :
35
Direktorat Jendral Peningkatan Kapasitas Kelembagaan dan Pemasaran Departemen Kelautan dan Perikanan.
Streisinger G, Walker C, Dower N, Knauber D, Singer F. 1981. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature 291 : 293-296.
Takahashi H. 1977. Juvenile hermaphroditsm in the zebrafish, Brachydanio rerio. Bull Fac Fish, Hokkaido Univ 28: 57-65.
Takahashi H, Shimizu M. 1983. Juvenile intersexuality in a cyprinid fish, the Sumatra barb, Barbus tetrazona. Bull Fac Fish. Hokkaido Univ 34:69-78.
Taniguchi N. 1990. Chromosome Manipulation and Its Aplication for Aquaculture. In Suzuki R (Ed.) Koseisha Koseikaku. Tokyo, 104-117p.
Taniguchi N, Seki S, Fukai J, Kijima A, 1988. Induction of two type of gynogenesis diploids by hidrostatic pressure shock and verification by genetic marker in ayu. Nippon Suisan Gakkaishi 54 (9) : 1483-1491.
Taniguchi N, Hatanaka H, Seki S. 1990. Genetic variation in quantitative character of meiotic and mitotic gynogenetic diploid ayu, Plecoglossus altivelis. Aquaculture 85:223-233.
Tave D. 1986. Genetic for Fish Hatchery Manager. Connecticute : The AVI Publish. Co. Inc.
Tave D. 1993. Genetic for Fish Hatchery Manager. Connecticute : The AVI Publish. Co. Inc.
Thomson D. 1983. The efficiency of induced diploid gynogenesis in breeding. Aquaculture 33:237-244.
Tingey SV, Rafalski A, Williams JGK. 1992. Genetic analysis with RAPD markers. Di dalam : Application of RAPD Technology to Plant Breeding. Joint Plant Breeding Symposia Series CSSA/ASHG/AGA. Minneapolis. p 3-8.
Weising K, Nybon H, Wolff K, Meyer W. 1995. DNA Fingerprinting in Plants and Fungi. Boca Raton: CRC Press.
Woynarovich E, Horvath L. 1980. The Artificial Propagation of Warm Water Finfish. A manual for extension. Rome : FAO Fish Tech. Paper. No 201.