KARAKTERISASI MORFOLOGI DAN MOLEKULER
LARVA IKAN TERUMBU BESERTA STATUS KONSERVASI
DAN PERDAGANGAN
I GEDE WAHYU DANI DHARMAWAN
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Karakterisasi Morfologi dan Molekuler Larva Ikan Terumbu beserta Status Konservasi dan Perdagangan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
I GEDE WAHYU DANI DHARMAWAN. Karakterisasi Morfologi dan Molekuler Larva Ikan Terumbu beserta Status Konservasi dan Perdagangan. Dibimbing oleh HAWIS MADDUPPA dan MUJIZAT KAWAROE.
Identifikasi larva ikan biasanya dilakukan berdasarkan karakter morfologi. Namun, banyak dari karakter morfologi ikan tidak muncul sampai dewasa dan secara morfologi banyak berbeda dari dewasanya. Oleh karena itu, identifikasi menggunakan karakter molekuler dapat membantu mengidentifikasi tahap larva ikan di tingkat spesies. Tujuan dari penelitian ini adalah identifikasi larva ikan berdasarkan karakter morfologi dan molekuler. Selain itu, spesies yang diidentifikasi adalah korfirmasi untuk status konservasi dan perdagangan berdasarkan IUCN dan CITES. Berdasarkan identifikasi morfologi spesimen diidentifikasi hingga tingkat famili (famili Kuhlidae, famili Labridae, famili Apogonidae) tetapi, identifikasi menggunakan teknik molekuler, spesimen yang diidentifikasi hingga tingkat spesies (Ambassis marianus, Nectamia savayensis, Cheilinus undulatus). Tiga kategori status konservasi diidentifikasi: status risiko rendah (Ambassis marianus), status belum terdaftar (Nectamia savayensis) dan status genting (Cheilinus undulatus) . Dua status perdagangan diidentifikasi: tidak terdaftar (Ambassis Marianus dan Nectamia savayensis) dan status Appendix II (Cheilinus undulatus).
ABSTRACT
I GEDE WAHYU DANI DHARMAWAN. Morphological and Molecular Characterization of Reef Fish Larvae and Conservation Status and Trade. Supervised by HAWIS MADDUPPA and MUJIZAT KAWAROE.
Identification of fish larvae is usually done based on morphology characters. However, many of morphological characters of fish are not appeared until adult and many of them are morphologically different as their adult. Therefore, the identification using molecular characters can help identify the larval stages of fish in the species level. The purpose of this research was to identify fish larvae based on morphological and molecular characters. In addition, the identified species was confirm to the conservation and trade status based on IUCN and CITES. Based on morphological identification the specimens could only be identified up to family level (family Kuhlidae, family Labridae, family Apogonidae). However, identification using molecular technique, the spesimens could be identified up to species level (Ambassis marianus, Nectamia savayensis, Cheilinus undulatus). Three categories of conservation status was identified: low risk status (Ambassis marianus), not registered (Nectamia savayensis) and endangered status (Cheilinus undulatus). Two categories of trade status was identified: not listed (Ambassis marianus and Nectamia savayensis), and Appendix II (Cheilinus undulatus).
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan
pada
Departemen Ilmu dan Teknologi Kelautan
KARAKTERISASI MORFOLOGI DAN MOLEKULER
LARVA IKAN TERUMBU BESERTA STATUS KONSERVASI
DAN PERDAGANGAN
I GEDE WAHYU DANI DHARMAWAN
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Karakterisasi Morfologi dan Molekuler Larva Ikan Terumbu beserta Status Konservasi dan Perdagangan
Nama : I Gede Wahyu Dani Dharmawan NIM : C54100011
Disetujui oleh
Dr. Hawis Madduppa, S.Pi, M.Si Pembimbing I
Dr. Ir. Mujizat Kawaroe, M.Si Pembimbing II
Diketahui oleh
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2014 ini ialah larva ikan, dengan judul Karakterisasi Morfologi dan Molekuler Larva Ikan Terumbu beserta Status Konservasi dan Perdagangan.
Pada kesempatan kali ini penulis mengucapkan terimakasih kepada semua pihak yang telah membantu dalam penulisan dan penyusunan skripsi ini terutama kepada:
1. Tuhan Yang Maha Esa atas segala rahmat yang diberikan kepada penulis hingga dapat menyelesaikan penulisan skripsi ini.
2. Bapak Dr Hawis Madduppa, S.Pi, M.Si dan Ibu Dr. Ir. Majizat Kawaroe, M.Si selaku pembimbing, yang telah banyak memberi segala saran, bimbingan, dan nasihat selama penelitian berlangsung hingga karya ilmiah ini selesai.
3. Ibu Dr. Majariana Krisanti, S.Pi, M.Si atas peminjaman alat dan segala fasilitas yang diberikan selama penenelitian di Labotarium Biologi Mikro 1. 4. Keluarga besar “Nyame Polos” di Bali, Ni Made Wardani dan I Putu Widana,
orang tua tercinta dan I Made Wicaksana, saudara kandung tercinta atas dukungan dan semangat yang diberikan kepada penulis hingga dapat menyelesaikan penulisan skripsi ini.
5. Keluarga besar Ilmu dan Teknologi Kelautan angkatan 47 beserta Kesatuan Mahasiswa Hindu Dharma, Institut Pertanian Bogor atas dukungan dan semangat yang diberikan selama penyelesaian skripsi ini.
6. Reza Zulmi dan Aradea Bujana atas ketersediaannya dalam membantu proses pengolahan data.
7. Marine Biodiversity and Biosystematics Laboratory, atas peminjaman peralatan selama proses pengolahaan data dalam penelitian dan penulisan skripsi ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODE 2
Waktu dan Tempat Penelitian 2
Metode Pengambilan Data 3
Alat dan Bahan 3
Analisis Morfometrik dan Meristik 3
Analisis Genetika 4
Ekstraksi dan Amplifikasi DNA 4
Elektroforesis 5
Sekuensing DNA 5
Analisis Data 5
HASIL DAN PEMBAHASAN 6
Morfometrik dan Meristik 6
Karakter Molekuler 9
Status Konservasi dan Perdagangan 10
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
LAMPIRAN 14
DAFTAR TABEL
1 Pengukuran morfometrik larva ikan terumbu 6
2 Hasil identifikasi spesies larva ikan terumbu menggunakan
BLAST 10
3 Status konservasi dan status perdagangan spesies larva ikan 11
DAFTAR GAMBAR
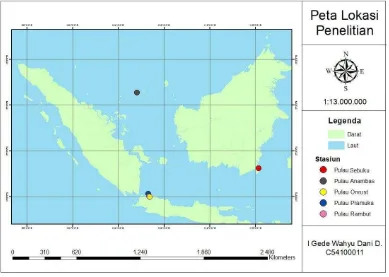
1 Peta lokasi penelitian 2
2 Karakter morfologi yang menjadi dasar pengukuran morfometrik
berdasarkan Leis dan Ewart 2004 4
3 Morfologi individu 1 larva ikan famili Ambassidae. 7 4 Morfologi individu 3 larva ikan famili Labridae 8 5 Morfologi individu 7 larva ikan famili Apogonidae 9
DAFTAR LAMPIRAN
6 Alat dan Bahan 14
7 Prosedur kerja Dino-Lite (Digital Microscope) Pro 2 14
8 Prosedur kerja PCR 16
9 Komposisi Master Mix pada PCR 16
PENDAHULUAN
Latar Belakang
Ikan merupakan salah satu jenis hewan vertebrata yang bersifat polikilotermis, yang pergerakan dan keseimbangan tubuhnya menggunakan sirip dan umumnya bernapas dengan insang serta hidup dalam lingkungan air (Rahardjo et al. 2011). Kemampunan untuk bergerak di dalam air dengan menggunakan sirip adalah salah satu adaptasi yang dilakuakan untuk menjaga keseimbangan sehingga tidak terpengaruh oleh gerakan air atau arah arus. Secara umum ikan akan melewati beberapa tahap dalam fase hidup dan mengubah ukuran serta penampilan mereka dari telur hingga menjadi dewasa.
Stadia awal perkembangan ikan yang utama terdiri dari tahapan stadia telur, larva, dan juvenil (Amarullah 2008). Menurut Termvidchakorn dan Hortle (2013) fase larva merupakan fase yang mencakup perkembangan hidup ikan mulai dari menetas sampai ikan menjadi remaja sedangkan juvenil merupakan salah satu tahap saat semua organ (kecuali gonad) berfungsi. Pada stadia larva, ikan mengalami perkembangan karakter sementara (transients larval character) seperti pola pigmen, duri, dan sirip di bagian kepala ataupun bagian lain yang memang dibutuhkan dalam adaptasinya dengan kondisi di alam, namun ketika memasuki stadia juvenil ikan mempunyai penampilan tubuh yang mendekati bentuk ikan dewasa meskipun pada dimensi yang lebih kecil, seluruh jari-jari sirip dan sisik telah lengkap terbentuk serta tulang sudah hampir seluruhnya mengeras (Amarullah 2008).
Ukuran larva yang sangat kecil, transparan dan bentuk tubuh masih sulit dibedakan dengan ukuran dewasa sehingga memerlukan identifikasi lebih lanjut. Pengidentifikasian larva dan juvenil ikan secara tradisional menggunakan karakterisasi morfologi seperti bentuk tubuh, pigmentasi, pengukuran dan penghitungan meristik beserta morfometrik (Ling Ko et al. 2013). Morfologi pada ikan sangat berhubungan dengan habitat ikan tersebut diperairan (Wahyuningsih dan Barus 2006). Kelemahan dalam karakterisasi morfologi adalah tidak cukup valid untuk mengidentifikasi setiap spesies terutama spesies yang tergolong langka dan cryptic species. Selain itu pada awal kehidupan ikan, banyak spesies dengan berbagai morfologi yang sama. Morfologi spesies yang sama dapat berubah dengan cepat dan signifikan selama perkembangan dari larva preflexion dan postflexion ke prejuvenil (Ling Ko et al. 2013). Dibandingkan dengan karakterisasi morfologi, teknik molekuler dapat membantu identifikasi ikan pada fase larva sampai pada tingkat spesies dan hanya membutuhkan sedikit jaringan tubuh dari larva ikan tersebut.
2
Tujuan Penelitian
1. Identifikasi larva ikan dengan menggunakan karakterisasi morfologi dan molekuler.
2. Mengetahui status konservasi berserta status perdagangannya pada beberapa pulau di Indonesia.
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada tanggal 6-8 September 2013 yang bertempat di Pulau Rambut dan Pulau Onrust, Kepulauan Seribu, DKI Jakarta sedangkan pengambilan sampel selanjutnya diambil oleh peneliti lain yang berlokasi di Pulau Pramuka pada tanggal 14-16 Maret 2014, Pulau Anambas, serta Pulau Sebuku pada tanggal 28-30 November 2013. Identifikasi morfologi termasuk didalamnya pengolahan data morfometrik dan meristik dilakukan di Laboratorium Biologi Mikro I, Departemen Manajemen Sumberdaya Perairan sedangkan untuk pengolahan data genetik dilakukan di Laboratorium Biodiversitas dan Biosistematika Kelautan, Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Peta lokasi penelitian dapat dilihat pada gambar berikut.
3
Metode Pengambilan Data
Pengambilan sampel larva ikan (Ichthyoplankton) dikumpulkan menggunakan larva net mesh size 250 mikron dan dibagian akhir jaring ini dilengkapi botol tempat penampungan sampel dengan diameter 2,5 cm dan tinggi 8 cm. Larva net tersebut dioprasikan dengan cara ditarik mengunakan perahu yang berkecepatan kurang lebih 2 knot selama 10 menit. Pengambilan sampel dilakukan dua kali yaitu searah aruh dan berlawanan arus. Sampel yang didapat kemudian dimasukkan dan diawetkan ke dalam tabung reaksi yang telah berisi ethanol 96% sebanyak 1 ml dan diberi label masing-masing individu (Subiyanto et al. 2008). Sebagian sampel larva ikan juga diambil dari koleksi pada Laboratorium Biodiversitas dan Biosistematika Kelautan.
Alat dan Bahan
Peralatan yang digunakan dalam penelitian ini dibagi menjadi 4 bagian, yang pertama adalah peralatan untuk pengukuran mersitik berserta morfometrik menggunakan alat bantu Dino-Lite Digital Microscope dilengkapi dengan perangkat lunak Dino-Lite Capture 2.0, dan buku indentifikasi larva ikan. Kedua merupakan peralatan untuk pengambilan sampel larva ikan terdiri dari larva net mesh size 250 mikron, GPS, ethanol, dan botol tube. Sedangkan ketiga merupakan peralatan dalam pengolahan genetika untuk larva ikan yaitu vortex, heating block, mikropipet, kalkulator, alat tulis, timbangan, gelas ukur, microwave, perangkat lunak Mega 5.0, larutan ekstraksi Chelex 10%, sarung tangan, etanol, ddH2O, buffer PCR, dNTP, enzim taq polymerase, MgCl2, primer, Agarosa, EtBr, loading dye, serta marker (Lampiran 1).
Analisis Morfometrik dan Meristik
4
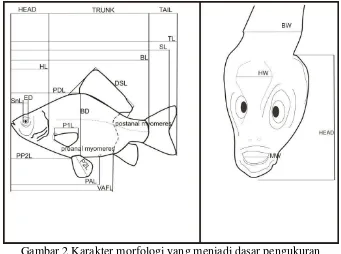
Gambar 2 Karakter morfologi yang menjadi dasar pengukuran morfometrik berdasarkan Leis dan Ewart 2004
Meristik mengacu pada jumlah fitur yang penting ditampilkan untuk setiap ikan. Fitur tersebut diantaranya adalah: penghitungan jari-jari keras dan lemah pada sirip dorsal, sirip kaudal, sirip anal, sirip ventral,dan sirip pektoral (Termvidchakorn dan Hortle 2013). Proses pengukuran morfometrik dan meristik pada penelitian ini dilakukan dengan menggunakan alat Dino-Lite (Digital Microscope) Pro 2 dengan perangkat lunak Dino-Lite Capture 2.0 yang dihubungkan pada laptop atau PC (Lampiran 2). Sedangkan identifikasi morfologi menggunakan buku petunjuk identifikasi, yaitu The Larvae of Indo-Pacific Coastal Fishes (Leis dan Ewart 2004).
Analisis Molekuler
Ekstraksi dan Amplifikasi DNA
5 Penelitian ini proses PCR diulang sebanyak 35 kali. Setiap siklus masing-masing terdiri dari tiga tahap yaitu tahap denaturation (peleburan) yang berlangsung pada suhu 95 oC selama 30 detik, tahap anneling (penempelan) berlangsung pada suhu 50 oC selama 30 detik, dan tahap ekstention (pemanjangan) berlangsung pada suhu 72 oC selama 1 menit. Proses amplifikasi dimulai dengan pengisian lembar kerja PCR dengan tanggal, jumlah sampel, tipe ekstraksi dan catatan lainnya (Lampiran 3). Pengisian lembar kerja ini bertujuan untuk menghitung berapa jumlah master mix (MM), enzim tag polimerase dan jumlah ekstrak yang dibutuhkan (Lampiran 3).
Elektroforesis
Elektroforesis bertujuan untuk pengecekan kualitas produk DNA yang dihasilkan pada proses PCR. Tahap awal dalam elektroforesis adalah pembuatan gel agarosa 1 % dengan pewarna Etidium Bromida sebagai media elektroforesis. Hasil PCR kemudian diambil sebanyak 4 µL yang akan dicampurkan dengan loading dye 1 µL dan disisipkan ke dalam sumur agarosa. Proses elektroforesis menggunakan mesin elektroforesis bertegangan 200 V dan arus 400 mA. Hasilnya dilihat pada mesin ultraviolet dengan panjang gelombang ultraviolet 254 nm dan difoto menggunakan kamera.
Sekuensing DNA
Sekuensing DNA merupakan teknik untuk mengurutkan nukleotida yang terdapat dalam DNA. Metode sekuensing yang digunakan adalah metode Sanger dengan menggunakan metode PCR sebagai pijakan namun terdapat penambahan reaksi tertentu. Pada proses sekuensing ini, DNA yang telah teramplifikasi positif selanjutnya akan dikirim ke Berkeley Sequencing Facility di Amerika untuk dilakukan pengurutan nukleotida (Zein dan Prawiradilaga 2013).
Analisis Data
6
HASIL DAN PEMBAHASAN
Morfometrik dan Meristik
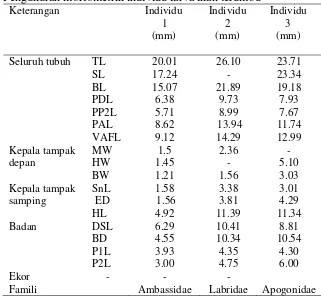
Berdasarkan hasil dari pengukuran morfometrik individu larva ikan diperoleh 3 famili yaitu famili Ambassidae, famili Labridae, dan famili Apogonidae. Hasil pengukuran morfometrik pada setiap individu larva ikan dapat dilihat pada Tabel 1.
Tabel 1 Pengukuran morfometrik individu larva ikan terumbu
Keterangan Individu
Famili Ambassidae Labridae Apogonidae
7
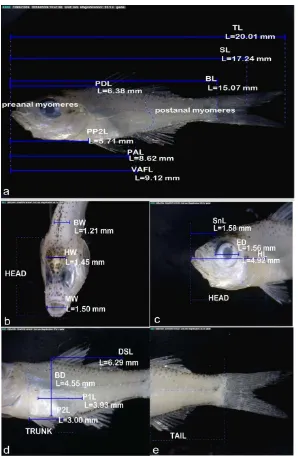
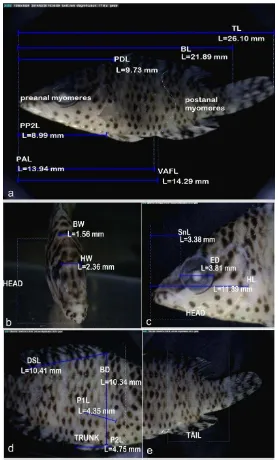
Gambar 3 Morfologi individu 1 larva ikan famili Ambassidae. a. Seluruh tubuh (perbesaran 23.1x), b. kepala tampak depan (perbesaran 42.7x), c. kepala tampak samping (perbesaran 39.2), c. badan (perbesaran 37.4x), d. ekor (perbesaran 38.4x).
8
terlalu tajam. Secara morfologi larva ikan famili Labridae dapat dilihat pada Gambar 4.
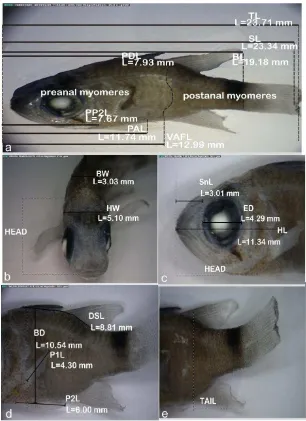
Gambar 4 Morfologi individu 3 larva famili Labridae. a. Seluruh tubuh (perbesaran 17.8x), b. kepala tampak depan (perbesaran 31.2x), c. kepala tampak samping (perbesaran 32.1x), d. badan (perbesaran 26.7x), e. ekor (perbesaran 23.1x).
9 pigmen putih gelap. Tipe mulut larva ikan Apogonidae berbentuk terminal dengan ekor berlekuk tunggal. Secara morfologi dan karakteristik famili Apogonidae dapat dilihat pada Gambar 5.
Gambar 5 Morfologi individu 7 larva ikan famili Apogonidae. a. Seluruh tubuh (perbesaran 20.5x), b. kepala tampak depan (perbesaran 27.6x), c. kepala tampak samping (perbesaran 30.3x), d. badan (perbesaran 25.8x), e. ekor (perbesaran 28.5x).
Karakter Molekuler
10
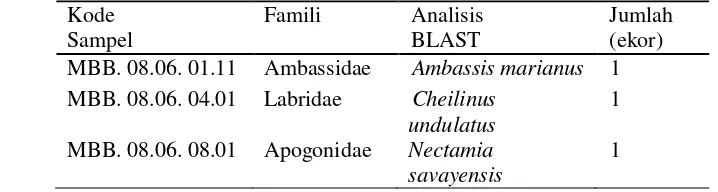
Hasil BLAST dalam pengindentifikasi menggunakan karakter molekuler dapat dilihat pada Tabel 2.
Tabel 2 Hasil identifikasi spesies larva ikan terumbu menggunakan BLAST.
Kode MBB. 08.06. 01.11 Ambassidae Ambassis marianus 1 MBB. 08.06. 04.01 Labridae Cheilinus
undulatus
1
MBB. 08.06. 08.01 Apogonidae Nectamia savayensis
1
Hasil BLAST (Tabel 2) memberikan informasi bahwa individu larva yang terdapat pada beberapa pulau di Indonesia teridentifikasi sebagai 3 individu yaitu Ambassis marianus, Cheilinus undulatus, dan Nectamia savayensis (Tabel 2). Tingkat kesamaan (homologi) yang diperoleh dari analisis BLAST sebesar 87-99%, yang menunjukkan bahwa identifikasi spesies larva ikan pada beberapa pulau di Indonesia memiliki kesamaan dengan data yang terdapat pada GeneBank (Lampiran 4).
Larva ikan pada famili Ambassidae teridentifikasi spesies Ambassis marianus. Hasil penelitian ini menunjukkan pada larva ikan spesies Ambassis marianus memiliki tingkat kemiripan (homologi) spesies dengan sepesies yang terdapat pada GeneBank mencapai 89% (Lampiran 4) dan urutan panjang basa nukleotida mencapai 706bp. Famili Labridae teridentifikasi spesies Cheilinus undulatus. Larva ikan jenis Cheilinus undulatus memiliki urutan panjang basa nukleotida mencapai 377bp dan persentase kemiripan spesies dengan spesies yang ada pada GeneBank mencapai 99% (Lampiran 4).
Famili Apogonidae teridentifikasi spesies Nectamia savayensis. Larva ikan jenis Nectamia savayensis memiliki urutan panjang basa nukleotida mencapai 699bp dan tingkat kemiripan spesies dengan spesies yang ada pada GeneBank mencapai 92% (Lampiran 4).
Karakter molekuler mampu mengkonfirmasi spesies yang telah dideskripsi secara morfologi dengan terdapatnya kesamaan pada tingkat famili antara identifikasi morfologi dan identifikasi menggunakan karakter molekuler, namun pada identifikasi morfologi hanya dapat mengidentifikasi sampai pada tingkat famili. Hal ini dikarenakan morfologi ikan pada fase larva sangat sulit dibedakan antara individu satu dengan yang lainnya dan ketersediaan buku pentunjuk pengidentifikasian yang terbatas.
Status Konservasi dan Status Perdagangan
11 CITES (Convention on International Trade in Endangered Species of Wild Fauna and Flora) terdapat 2 kategori untuk status perdagangan masing-masing spesies larva ikan. Hasil status konservasi dan status perdagangan masing-masing spesies larva ikan dapat dilihat pada Tabel 3.
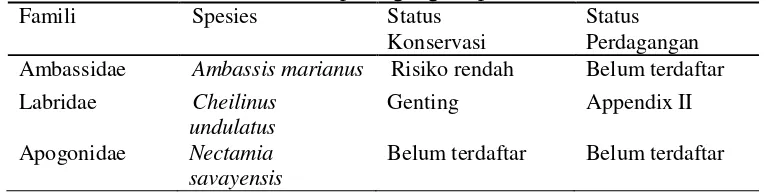
Tabel 3 Status konservasi dan status perdagangan spesies larva ikan
Famili Spesies Status
Konservasi
Status Perdagangan
Ambassidae Ambassis marianus Risiko rendah Belum terdaftar
Labridae Cheilinus
undulatus
Genting Appendix II
Apogonidae Nectamia
savayensis
Belum terdaftar Belum terdaftar
Menurut IUCN redlist (2013) larva ikan jenis Ambassis marianus termasuk dalam kategori resiko rendah. Hal ini mengindikasikan bahwa spesies ini belum belum banyak terekspoitasi, sedangkan menurut CITES (2013) spesies Ambassis marianus termasuk kedalam kategori belum terdaftar. Hal ini menunjukkan kemungkinan pada spesies ini belum pernah dilakukan observasi mengenai perdagangannya.
Berdasarkan IUCN redlist (2013) spesies Cheilinus undulates merupakan spesies larva ikan yang tergolong dalam kategori status genting artinya spesies larva ikan ini memiliki risiko kepunahan di alam pada waktu mendatang sehingga perlu diatur dalam hal pengelolaan penangkapannya sedangkan menurut CITES (2013) larva ikan spesies ini termasuk dalam kategori appendix II artinya spesies Cheilinus undulates belum terancam kepunahanya namun kemungkinan terancam punah apabila perdagangan spesies ini terus berlanjut tanpa adanya pengaturan yang baik. Terdapat satu spesies larva ikan yang saat ini masih belum terdaftar IUCN redlist dan CITES (2013) yaitu pada larva ikan spesies Nectamia savayensis. Hal tersebut mengindikasikan bahwa spesies larva ini sama sekali belum pernah dilakukan observasi mengenai status konservasi dan status perdagangannya, sehingga tidak diketahui secara pasti jumlah populasinya di alam.
Secara ekologis larva ikan memegang peranan yang cukup penting, sebagai suksesor atau menggantikan peran ikan-ikan dewasa di masa mendatang (Prianto et al. 2013). Menurunnya stok ikan di suatu perairan seringkali dikaitkan dengan tingginya intensitas penangkapan ikan-ikan dewasa. Keberhasilan larva ikan yang tumbuh dan berkembang menjadi juvenil hingga ikan dewasa sangat berpengaruh pada stok populasi ikan. Pemanfaatan sumberdaya perikanan yang tidak terkendali dan pesatnya pembangunan terutama di kawasan depan laut (water fornt) seringkali menjadi penyebab menurunnya populasi ikan (Amarullah 2008).
12
dalam air, pH, kadar-kadar garam anorganik serta senyawa organik dalam air. Faktor biologik meliputi makanan, kerumunan, sebaran, dan pemangsaan.
KESIMPULAN DAN SARAN
Kesimpulan
Identifikasi larva ikan terumbu dengan menggunakan karakter molekuler dapat mencapai tingkat spesies yaitu larva ikan jenis Ambassis marianus, Cheilinus undulatus, dan Nectamia savayensis. Identifkasi dengan menggunakan karakter morfologi dapat mencapai tingkat famili yaitu famili Ambassidae, Labridae, dan Apogonidae. Hal ini disebabkan karena ketersediaan referensi yang terbatas. Terdapat 3 kategori untuk status konservasi terhadap larva ikan hasil penelitian yaitu status risiko rendah pada spesies Ambassis marianus, status belum terdaftar spesies Nectamia savayensis dan status genting pada spesies Cheilinus undulatus. Pada status perdagangan terdapat 2 kategori yaitu belum terdaftar (Ambassis marianus, dan Nectamia savayensis) dan status appendix II (Cheilinus undulatus).
Saran
Perlu diadakan penelitian lebih lanjut mengenai identifikasi morfologi untuk biota larva dan juvenil ikan pada kondisi yang masih segar, sehingga lebih mudah dalam melakukan pengukuran meristik maupun morfometrik serta hasil foto yang didapat juga lebih baik. Disamping itu biota larva ikan pada kondisi yang masih segar dapat mempermudah dalam melakukan pengidentifikasi DNA khususnya pada tahap ekstraksi.
DAFTAR PUSTAKA
Amarullah HM. 2008. Hidro-Biologi Larva Ikan dalam Proses Rekrutmen. Jurnal Hidrosfir Indonesia. 3(2):75-82.
Baldwin CC, Mounts JH, Smith DG, Weigt LA. 2009. Genetic Identification and Color Descriptions of Early Life-Histroy Stages of Belizean Phaeoptyx and Astrapogon (Teleostei: Apogonidae) with Coments on Identification of Adult Phaeoptyx. The Journal of Zootaxa. 2009:1-22.
Cadrin SX, Friendland KD, Waldman JR. 2005. Stock Identification Methods Application in Fishery Science. Academic Press(UK):Elsevir.
13 Leis JM, Ewart BMC. 2004. The Larvae of Indo-Pacific Coastal Fishes. Sydney. Ko Hui-Ling, Wang Yu-Tze, Chiu Tai-Sheng, Lee Ming-An, Leu Ming-Yih,
Chang Kuang-Zong, Chen Wen-Yu, Shao Kwang-Tsao. 2013. Evaluating The Accuracy of Morphological Identification of Larval Fishes by Applying DNA Barcoding. The Journal of Plos One. 8(1)doi:10.1371/ journal. pone. 0053451.
[IUCN] International Union for Conservation of Nature and Natural Resources. 2013. IUCN Red list of threatened species [internet]. [diunduh 2014 Juni 6]. Tersedia pada:http:// http://www.iucnredlist.org/search.
Nontji, Anugerah. 2008. Plankton Laut. Indonesia (ID): LIPI Press. Nontji, Anugerah. 1984. Telur Ikan. Jurnal Oseana. 9(1):21-30.
Prianto E, Nurdawaty S, Kamal MM. 2013. Distribusi, Kelimpahan dan Variasi Ukuran Larva Ikan di Estuaria Sungai Musi. BAWAL. 5(2):73-79.
Puspasari R, Damar A, Kamal MM, Batu LD, Wiadnyana NN, Taufik M. 2013. Dinamika Larva Ikan Sebagai Dasar Opsi Pengelolaan Sumber Daya Ikan di Laguna Pulau Pari Kepulauan Seribu. Jurnal Kebijakan Perikanan Indonesia. 5(1):1-7.
Rahardjo MF, Sjafei DS, Affandi R, Sulistiono, Hutabarat J. 2011. Iktiology. Bandung (ID): Lubuk Agung.
Romimohtarto K, Juwana S. 2004. Meroplankton: Larva Hewan Laut yang Menjadi Plankton. Jakarta(ID): Djambatan.
Tamura Koichiro, Peterson Daniel, Peterson Nicholas, Stecher Glen, Nei Masotoshi, Kumar Sudhi. 2011. Mega 5: Molecular Evolutionary Genetics Analysis Using Maximum Mikelihood, Evolutionary Distance, and Maximum Parsimony Methods. The Journal of Mol Biol Evol. 28(2).doi:10.1093/molbev/msr121.
Temvidchakorn A, Hortle KG. 2013. A Guide to Larvae and Juveniles of Some Common Fish Species from the Mekong River Basin. Mekong River Commission.
14
Lampiran 1 Alat dan Bahan
Alat dan Bahan Unit Keterangan
Dino-Lite dan Perangkat lunak Dino Lite Capture
1 buah Pengukuran meristik dan
morfometrik
Buku identifikasi larva ikan 1 buah The Larvae of Indo-Pacific Coastal Fishes
GPS 1 buah Perekam posisi geografis
Larva net (mesh size 250 ) 1 buah Pengambilan larva ikan
Botol tube 1 ml 79 buah Tempat sampel
Ethanol 96% 1 ml Mengawetkan sampel
Perangkat lunak Mega 5.0 1 buah Mengolah data sekuen
Larutan Chelex 10% 1 ml Memisahkan DNA pada sampel
Sarung tangan 1 pasang Mencegah kontaminan
ddH2O 12,875 µM Sebagai pelarut
buffer PCR 2,5 µM Penyangga taq polymerase agar
bekerja optimal
dNTP 2 µM Untuk pemanjangan DNA
enzim taq polymerase 0,125 µM Sebagai katalis reaksi polimerasi
DNA
MgCl2 2 µM Sebagai indikator pewarna saat
proses PCR
Agarosa 1,5 gram Media untuk elektroforesis
EtBr 3 µl Sebagai pewarna
loading dye 1µM Pemberat DNA
Marker 4 µM Penanda panjang baspair DNA
Heating block 1 buah Untuk memecahkan DNA
Vortex 1buah Untuk mencampur larutan agar
homogen
Timbangan 1buah Menakar bahan yang digunakan
Primer 1,25 µM Penempelan dan memperpanjang
rantai basa
Lampiran 2 Prosedur kerja Dino-Lite (Digital Microscope) Pro 2
Sebelum melakukan pengukuran dengan menggunakan Dino-Lite Pro2, terlebih dahulu dilakukan pengkalibrasi pada alat ini. Tujuan kalibarasi adalah untuk menyesuaikan nilai kebenaran pada alat dengan ukuran standar agar meminimalisir error saat melakukan pengukuran. Adapun langkah-langkah untuk melakukan kalibrasi sebagai berikut:
15 4. Ketik angka sesuai dengan perbesaran yang digunakan misalnya “38”
kemudian tekan Enter .
5. Pada layout Dino-Lite akan muncul tanda garis putus-putus. 6. Sesuaikan garis tersebut dengan angka 0 dan 5.
7. Pada ”please enter to known distance” ketik angkat 5 dan pada unit pilih mm.
8. Kemudian klik Finish dan kalibarasi pun selesai.
Selanjutnya untuk langkah-langkah pengukuran morfometrik sebagai berikut: 1. Sebelum menggunakan Dino-Lite Pro 2, terlebih dahulu lakukan
penginstalan perangkat lunak Dino Caputer 2.0 pada laptop atau PC, kemudian sambungakan Dino-Lite Pro 2 pada laptop atau PC.
2. Jalankan perangkat lunak Dino-Lite Pro 2 pada laptop atau PC, kemudian lampu akan menyala pada Dino-Lite Pro 2 yang menandakan alat tersebut siap digunakan.
3. Setelah itu, kalibrasi Dino-Lite Pro 2 menggunakan calibration sampel agar ukurannya sesuai. Simpan kalibrasi yang telah dilakukan sesuai dengan nama yang diinginkan.
4. Ambil objek yang akan diamati dan letakkan pada alas yang akan menjadi background pada hasil foto , atur fokusnya sesuai keinginan. Apabila sudah mendapatkan fokus pada objek yang akan diambil gambarnya tekan tombol snapshot pada Dino-Lite.
5. Sebelum pengukuran dimulai, pada icon tulis angka sesuai dengan perbesaran yang dipakai saat pengambilan gambar di Dino-Lite misalnya 50.
16
Lampiran 3 Prosedur kerja PCR
1. Bersihkan meja dengan menyemprotkan etanol 96% kemudian gunakan sarung tangan.
2. Keluarkan reagen: ddH2O, dNTP, buffer PCR, MgCl2, Primer (BCH dan BCL) dari freezer untuk dicairkan.
3. Isi lembar kerja PCR dengan tanggal, jumlah sampel, metode ekstraksi, dan catatan lainnya.
4. Setelah semua bahan tersebut cair, jentikkan dengan jari pada setiap tabung agar tercampur.
5. Buat campuran Master Mix: gunakan mikro pipet, tambahkan bahan sesuai dengan volume yang telah dihitung dalam daftar di lembar PCR di tabung 0,5 mL. Gunakan tip berbeda untuk setiap penambahan reagen. Pipet naik turun untuk mencampur reagen sepenuhnya.
6. Gunakan mikro pipet, bagi 3 mL ke dalam setiap tabung PCR.
7. Pindahkan DNA ekstra Chelex dari ruang pendingin dan jika perlu, sentrifugasi singkat untuk menghilangkan kondesasi. Gunakan mikro pipet DNA rendah.
8. Jalankan program pada mesin PCR
9. Bersihkan tempat kerja, letakkan reagen ke dalam freezer dan ekstrak DNA ke dalam lemari pendingin.
Komposisi Master Mix pada PCR
MM
Standart Protokol AB1 1x ...
10X Buffer 2.5 ...
dntP 2 ...
MgCl2 2 ...
Primer F 1.25 ...
Primer R 1.25 ...
Amplitaq 0.125 ...
ddH2O 12.875 ...
Samples 3 3
17 Lampiran 4 Hasil pengurutan basa nukleotida (sequencing) pada sampel larva
ikan
#MBB.08.06.01.11_ Ambassis marianus
GGATGATAAAATTTATAATTTTGCCGTAACCGCGCATGCATTGGTAATAATTTTCTTTA TAGTTATGCCAATTATAATTGGAGGCTTTGGAAACTGACTAGTCCCACTAATAATCGC TGCCCCAGATATAGCATTTCCTCGAATAAACAATATGAGTTTCTGACTCCTACCCCCTT
#MBB.08.06.04.01_Cheilinus undulatus
GGCTTCGGAAACTGGCTAATCCCCCTTATGATCGGTGCCCCAGACATAGCCTTCCCCC GAATGAATAACATGAGTTTCTGACTCCTACCTCCTTCCTTCCTGCTTCTCCTTGCCTCC TCTGGTGTGGAAGCGGGAGCTGGGACCGGTTGGACAGTCTACCCTCCACTAGCTGGA #MBB.08.06.08.01_Nectamia savayensis
18
RIWAYAT HIDUP
Penulis dilahirkan di Bali pada tanggal 6 Juni 1992 dari ayah I Putu Widana dan ibu Ni Made Wardani. Penulis adalah putra pertama dari dua bersaudara. Tahun 2010 lulus dari SMA Negeri 1 Tabanan dan pada tahun yang penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Masuk IPB dan diterima di Departemen Ilmu dan Teknologi Kelautan.
Selama mengikuti perkuliahan penulis aktif sebagai pengurus HIMITEKA bagian Kewirausahaan Tahun 2011/2012. Bulan Juli-Agustus 2013 penulis melaksanakan Praktek Kerja Lapang di PT. Perikanan Nusantara (Persero) Cabang Benoa, Bali dengan judul “Inventarisasi Kapal dan Alat Tangkap di PT. Perikanan Nusantara (Persero) Cabang Benoa, Bali”. Penulis aktif sebagai anggota Keluarga Mahasiswa Hindu Dharma (KMHD) IPB Tahun 2010/2011 dan sebagai pengurus pada bidang Sosial Lingkungan KMHD IPB Tahun 2011/2012. Penulis mengikuti pendidikan dan pelatihan selam sertifikasi Open Water Tahun 2013.