UJI TOKSISITAS EKSTRAK ETANOL SERTA FRAKSI
n-HEKSANA DAN ETILASETAT TERIPANG
Pearsonothuria graeffei (Semper) TERHADAP
Artemia salina Leach
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
SITI AMELIA
NIM 111501084
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
UJI TOKSISITAS EKSTRAK ETANOL SERTA FRAKSI
n-HEKSANA DAN ETILASETAT TERIPANG
Pearsonothuria graeffei (Semper) TERHADAP
Artemia salina Leach
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
SITI AMELIA
NIM 111501084
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
UJI TOKSISITAS EKSTRAK ETANOL SERTA FRAKSI
n-HEKSANA DAN ETILASETAT TERIPANG
Pearsonothuria graeffei (Semper) TERHADAP
Artemia salina Leach
OLEH: SITI AMELIA NIM 111501084
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada tanggal: 23 November 2015
Pembimbing I, Panitia Penguji,
Dra. Suwarti Aris, M.Si., Apt. Dr. Panal Sitorus, M.Si., Apt.
NIP 195107231982032001 NIP 195310301980031002
Pembimbing II, Dra. Suwarti Aris, M.Si., Apt. NIP 195107231982032001
Dra. Aswita Hafni Lubis, M.Si., Apt. Drs. Suryadi Achmad., M.Sc., Apt. NIP 195304031983032001 NIP 195109081985031002
Dra. Herawati Ginting., M.Si., Apt. NIP 195112231980032002 Medan, Januari 2016
Fakultas Farmasi
Universitas Sumatera Utara Pejabat Dekan
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah memberikan
karunia yang berlimpah sehingga penulis dapat menyelesaikan penyusunan skripsi yang berjudul Uji Toksisitas Ekstrak Etanol Serta Fraksi n-Heksana dan Etilasetat Teripang Pearsonothuria graeffei (Semper) Terhadap Artemia salina Leach. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan terima kasih yang sebesar-besarnya kepada Ibu Dr. Masfria, M.S., Apt. selaku Pejabat Dekan Fakultas Farmasi yang telah menyediakan fasilitas kepada penulis selama perkuliahan di Fakultas Farmasi. Penulis juga mengucapkan terima kasih kepada Ibu Dra. Suwarti Aris, M.Si., Apt., Alm. Ibu Dra. Aswita Hafni Lubis, M.Si., Apt. dan Ibu Prof. Dr. Julia Reveny, M.Si., Apt. selaku dosen pembimbing, Bapak Dr. Panal Sitorus, M.Si., Apt., Bapak Drs. Suryadi Achmad, M.Sc., Apt. dan Ibu Dra. Herawaty Ginting, M.Si., Apt. selaku dosen penguji yang telah meluangkan waktu dan tenaga dalam membimbing penulis dengan penuh kesabaran dan tanggung jawab, memberikan petunjuk dan saran-saran selama penelitian hingga selesainya skripsi ini dan Ibu Dra. Juanita Tanuwijaya, M.Si., Apt. selaku dosen pembimbing akademik serta Bapak dan Ibu staf pengajar Fakultas Farmasi USU yang telah banyak membimbing penulis selama masa perkuliahan hingga selesai.
kepada abang M. Taufik Rahmadi dan adik Maulana Abdul Hakim atas limpahan kasih sayang, semangat dan doa yang tak ternilai dengan apa pun.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih belum sempurna, oleh karena itu penulis mengharapkan saran dan kritik yang membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, 23 November 2015 Penulis,
UJI TOKSISITAS EKSTRAK ETANOL SERTA FRAKSI n-HEKSANA DAN ETILASETAT TERIPANG Pearsonothuria graeffei (Semper)
TERHADAP Artemia salina Leach ABSTRAK
Teripang adalah salah satu hewan laut yang banyak tersebar di perairan Indonesia tetapi masih sangat jarang pemanfaatannya. Teripang mengandung senyawa metabolit sekunder yang berkhasiat menyembuhkan berbagai penyakit seperti diabetes mellitus, antiinflamasi, mencegah arteriosklerosis, antikanker, dan lain sebagainya. Salah satu senyawa metabolit sekunder yang umum dijumpai pada teripang adalah triterpenoid saponin. Penelitian ini bertujuan untuk mengetahui toksisitas dari teripang.
Pemeriksaan karakteristik simplisia hewan meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan kadar abu total, dan penetapan kadar abu tidak larut asam. Pemeriksaan golongan senyawa terhadap serbuk simplisia hewan meliputi pemeriksaan glikosida, saponin dan steroid/triterpenoid. Ekstraksi dilakukan dengan metode perkolasi dan fraksinasi dilakukan secara ekstraksi cair-cair. Pengujian toksisitas dari ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air teripang menggunakan metode Brine Shrimp Lethalty Test (BSLT) dengan hewan uji Artemia salina Leach.
Hasil pemeriksaan karakteristik simplisia adalah kadar air 9,47%, kadar sari larut air 36,56%, kadar sari larut etanol 24,01%, kadar abu total 28,75%, kadar abu tidak larut asam 3,66%. Hasil pemeriksaan golongan senyawa serbuk simplisia mengandung senyawa saponin, glikosida dan steroid/triterpenoida. Hasil pengujian toksisitas ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air dengan metode BSLT menggunakan hewan uji Artemia salina Leach berturut-turut adalah 0,8351 mcg/ml, 2,5573 mcg/ml, 51,7965 mcg/ml dan 12,2744 mcg/ml. Hasil penelitian ini menunjukkan bahwa ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air teripang Pearsonothuria graeffei (Semper,1868) memiliki aktivitas toksik yang ditandai dengan nilai LC50 < 1000 mcg/ml.
TOXICITY TEST OF ETHANOL EXTRACTS AND n-HEXANE ETYLACETAT FRACTION OF
Pearsonothuria graeffei
(Semper)
AGAINST Artemia salina Leach ABSTRACTSea cucumber are one of marine animals that widely spread in Indonesian marine but still hardly/rarely used. Sea cucumber contains secondary metabolites that used to cure various disease such as diabetes mellitus, antiinflamation, prevent arteriosklerosis, anticancer, etc. One of secondary metabolites compound that commonly found in sea cucumber is triterpen saponin. The aims of this research is to test the toxicity of simplex.
Simplex characterization including macroscopic, microscopic, determination of moisture content value, water extractable matter, ethanol extractable matter, ash content, and acid insoluble ash content. Determination of secondary metabolite of simplex powder including glycoside, saponin and steroid/triterpenoid. Extraction is held by using percolation method and fractionation was made using liquid-liquid extraction method. Toxicity examination of the ethanol extract, n-hexane fraction, ethylacetate fraction and water fraction of sea cucumber used Brine Shrimp Lethalty Test (BSLT) method with Artemia salina Leach.
The result of simplex characterization is obtained with moisture content value 9.47%, water extractable matter 36.56%, ethanol extractable matter 24.01%, ash content 28.75%, and acid insoluble ash content 3.66%. Determination of simplex powder show it contain glycoside, saponin and steroid/triterpenoid. Toxicity examination extract ethanol, n-hexane fraction, ethylacetate fraction and water fraction with BSLT method used Artemia salina Leach are 0.8351 mcg/ml, 2.5573 mcg/ml, 51.7965 mcg/ml and 12.2744 mcg/ml. These results show ethanol extract, n-hexane fraction, ethylacetat fraction and water fraction from
Pearsonothuria graeffei (Semper,1868) has a toxic activity with LC50 < 1000
mcg/ml.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Teripang ... 6
2.1.1 Morfologi teripang ... 6
2.1.2 Klasifikasi teripang ... 6
2.1.3 Kelamin dan reproduksi teripang ... 7
2.1.5 Kandungan gizi dan manfaat ... 8
2.2 Ekstraksi ... 10
2.3 Ekstraksi Cair-Cair ... 12
2.4 Brine Shrimp Lethality Test (BSLT) ... 12
2.5 Artemia salina Leach ... 13
2.5.1 Klasifikasi Artemia salina Leach ... 13
2.5.2 Siklus pertumbuhan Artemia salina Leach ... 14
2.5.3 Penggunaan Artemia sebagai hewan uji toksisitas ... 15
BAB III METODE PENELITIAN ... 17
3.1 Alat ... 17
3.2 Bahan ... 17
3.3 Pengumpulan dan Pengolahan Teripang ... 18
3.3.1 Pengumpulan teripang ... 18
3.3.2 Identifikasi hewan ... 18
3.3.3 Pengolahan teripang ... 18
3.4 Pembuatan Pereaksi ... 19
3.4.1 Pereaksi asam klorida 2N ... 19
3.4.2 Pereaksi Liebermann- Burchard ... 19
3.4.3 Pereaksi Molish ... 19
3.4.4 Larutan kloroform ... 19
3.4.5 Larutan kloralhidrat ... 19
3.4.6 Pereaksi timbal (II) asetat 0,4 N ... 19
3.4.7 Pereaksi asam nitrat 0,5 N ... 19
3.5 Pemeriksaan Karakteristik Hewan ... 20
3.5.2 Pemeriksaan mikroskopik ... 20
3.5.3 Penetapan kadar air ... 20
3.5.4 Penetapan kadar sari larut air ... 21
3.5.5 Penetapan kadar sari larut etanol ... 21
3.5.6 Penetapan kadar abu total ... 22
3.5.7 Penetapan kadar abu tidak larut asam ... 22
3.6 Pemeriksaan Golongan Senyawa Kimia ... 22
3.6.1 Pemeriksaan saponin ... 22
3.6.2 Pemeriksaan glikosida ... 23
3.6.3 Pemeriksaan steroida/triterpenoida ... 23
3.7 Pembuatan Ekstrak ... 23
3.7.1 Pembuatan ekstrak etanol ... 23
3.7.2 Fraksinasi ekstrak ... 24
1. Fraksinasi dengan n-heksana ... 24
2. Fraksinasi dengan etlasetat ... 24
3.8 Uji Toksisitas ... 25
BAB IV HASIL DAN PEMBAHASAN ... 27
4.1 Hasil Identifikasi Hewan ... 27
4.2 Pemeriksaan Makroskopis ... 27
4.3 Pemeriksaan Mikroskopis ... 27
4.4 Hasil Karakteristik ... 28
4.5 Hasil Pemeriksaan Golongan Senyawa ... 29
4.6 Hasil Uji Toksisitas ... 30
BAB V KESIMPULAN DAN SARAN ... 36
DAFTAR TABEL
Tabel Halaman
4.1 Hasil karakteristik serbuk simplisia teripang Pearsonothuria graeffei (Semper, 1868) ... 28 4.2 Hasil pemeriksaan golongan senyawa serbuk simplisia, ekstrak
etanol, fraksi n-heksana, etilasetat dan air ... 30 4.3 Hasil uji toksisitas ekstrak etanol, fraksi n-heksana, fraksi
etilasetat dan fraksi air ... 31 4.4 Hasil pengukuran LC50 dengan metode BSLT ... 33
4.5 Tingkat nilai toksisitas LC50 (Anderson, dkk. 1991) ... 34
DAFTAR GAMBAR
Gambar Halaman
1.1 Skema kerangka pikir penelitian ... 5
2.1 Siklus pertumbuhan Artemia salina Leach ... 14
4.1 Grafik log konsentrasi vs % kematian ekstrak etanol ... 32
4.2 Grafik log konsentrasi vs % kematian fraksi n- heksana ... 32
4.3 Grafik log konsentrasi vs % kematian fraksi etilasetat ... 33
DAFTAR LAMPIRAN
Lampiran Halaman
1. Surat hasil identifikasi hewan ... 40 2. Gambar teripang segar, simplisia dan serbuk simplisia
Pearsonothuria graeffei (Semper, 1868) ... 41 3. Mikroskopik serbuk simplisia teripang Pearsonothuria graeffei
(Semper, 1868) ... 44 4. Perhitungan penetapan kadar air serbuk simplisia teripang ... 45 5. Perhitungan penetapan kadar sari larut air serbuk simplisia
teripang ... 46 6. Perhitungan penetapan kadar sari larut etanol serbuk simplisia
teripang ... 47 7. Perhitungan penetapan kadar abu total serbuk simplisia
teripang ... 48 8. Perhitungan penetapan kadar abu tidak larut asam serbuk
simplisia teripang ... 49 9. Bagan kerja pengolahan teripang ... 50 10. Bagan pembuatan ekstrak etanol teripang ... 51 11. Bagan ekstraksi cair-cair dengan pelarut n-heksana dan
Etilasetat ... 52 12. Gambar wadah penetasan telur Artemia salina Leach ... 53 13. Perhitungan LC50 ekstrak etanol, fraksi n-heksana, fraksi
UJI TOKSISITAS EKSTRAK ETANOL SERTA FRAKSI n-HEKSANA DAN ETILASETAT TERIPANG Pearsonothuria graeffei (Semper)
TERHADAP Artemia salina Leach ABSTRAK
Teripang adalah salah satu hewan laut yang banyak tersebar di perairan Indonesia tetapi masih sangat jarang pemanfaatannya. Teripang mengandung senyawa metabolit sekunder yang berkhasiat menyembuhkan berbagai penyakit seperti diabetes mellitus, antiinflamasi, mencegah arteriosklerosis, antikanker, dan lain sebagainya. Salah satu senyawa metabolit sekunder yang umum dijumpai pada teripang adalah triterpenoid saponin. Penelitian ini bertujuan untuk mengetahui toksisitas dari teripang.
Pemeriksaan karakteristik simplisia hewan meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan kadar abu total, dan penetapan kadar abu tidak larut asam. Pemeriksaan golongan senyawa terhadap serbuk simplisia hewan meliputi pemeriksaan glikosida, saponin dan steroid/triterpenoid. Ekstraksi dilakukan dengan metode perkolasi dan fraksinasi dilakukan secara ekstraksi cair-cair. Pengujian toksisitas dari ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air teripang menggunakan metode Brine Shrimp Lethalty Test (BSLT) dengan hewan uji Artemia salina Leach.
Hasil pemeriksaan karakteristik simplisia adalah kadar air 9,47%, kadar sari larut air 36,56%, kadar sari larut etanol 24,01%, kadar abu total 28,75%, kadar abu tidak larut asam 3,66%. Hasil pemeriksaan golongan senyawa serbuk simplisia mengandung senyawa saponin, glikosida dan steroid/triterpenoida. Hasil pengujian toksisitas ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air dengan metode BSLT menggunakan hewan uji Artemia salina Leach berturut-turut adalah 0,8351 mcg/ml, 2,5573 mcg/ml, 51,7965 mcg/ml dan 12,2744 mcg/ml. Hasil penelitian ini menunjukkan bahwa ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air teripang Pearsonothuria graeffei (Semper,1868) memiliki aktivitas toksik yang ditandai dengan nilai LC50 < 1000 mcg/ml.
TOXICITY TEST OF ETHANOL EXTRACTS AND n-HEXANE ETYLACETAT FRACTION OF
Pearsonothuria graeffei
(Semper)
AGAINST Artemia salina Leach ABSTRACTSea cucumber are one of marine animals that widely spread in Indonesian marine but still hardly/rarely used. Sea cucumber contains secondary metabolites that used to cure various disease such as diabetes mellitus, antiinflamation, prevent arteriosklerosis, anticancer, etc. One of secondary metabolites compound that commonly found in sea cucumber is triterpen saponin. The aims of this research is to test the toxicity of simplex.
Simplex characterization including macroscopic, microscopic, determination of moisture content value, water extractable matter, ethanol extractable matter, ash content, and acid insoluble ash content. Determination of secondary metabolite of simplex powder including glycoside, saponin and steroid/triterpenoid. Extraction is held by using percolation method and fractionation was made using liquid-liquid extraction method. Toxicity examination of the ethanol extract, n-hexane fraction, ethylacetate fraction and water fraction of sea cucumber used Brine Shrimp Lethalty Test (BSLT) method with Artemia salina Leach.
The result of simplex characterization is obtained with moisture content value 9.47%, water extractable matter 36.56%, ethanol extractable matter 24.01%, ash content 28.75%, and acid insoluble ash content 3.66%. Determination of simplex powder show it contain glycoside, saponin and steroid/triterpenoid. Toxicity examination extract ethanol, n-hexane fraction, ethylacetate fraction and water fraction with BSLT method used Artemia salina Leach are 0.8351 mcg/ml, 2.5573 mcg/ml, 51.7965 mcg/ml and 12.2744 mcg/ml. These results show ethanol extract, n-hexane fraction, ethylacetat fraction and water fraction from
Pearsonothuria graeffei (Semper,1868) has a toxic activity with LC50 < 1000
mcg/ml.
BAB I PENDAHULUAN
1.1Latar Belakang
Indonesia adalah negara kepulauan yang memiliki banyak perairan dengan berbagai macam keanekaragaman biota laut, salah satunya adalah teripang. Teripang dapat ditemukan hampir diseluruh perairan, mulai dari daerah pasang surut yang dangkal sampai perairan yang lebih dalam. Daerah penyebaran teripang antara lain perairan pantai Madura, Jawa Timur, Bali, Sumba, Lombok, Aceh, Bengkulu, Bangka, Riau dan sekitarnya, Belitung, Kalimantan, Sulawesi, Maluku, Timor dan kepulauan seribu (Widodo, 2013).
Masyarakat di sekitar pantai telah memanfaatkan teripang cukup lama sebagai bahan makanan dan obat tradisional. Sebagai bahan pangan, teripang mempunyai nilai gizi yang cukup tinggi dan rasanya sangat lezat. Teripang kering mempunyai kadar protein tinggi yaitu 82%, dengan kandungan asam amino yang lengkap. Sebagai obat, teripang diketahui memiliki khasiat menyembuhkan berbagai penyakit, salah satunya adalah kanker (Widodo, 2013).
Penelitian yang telah dilakukan Reskiyanti (2013) menunjukkan bahwa teripang jenis Holothuria scabra bersifat sangat toksik dan memiliki potensi sebagai antikanker. Rasyid (2013) juga melaporkan bahwa ekstrak teripang
bahwa toksin yang dikandung teripang pada dasarnya adalah saponin triterpenoid yang merupakan komponen utama toksin pada Echinodermata. Saponin dihasilkan sebagai salah satu bentuk mekanisme pertahanan diri secara kimiawi bagi teripang di alam. Senyawa tersebut selain diduga digunakan sebagai pertahanan diri dari predator, juga diyakini memiliki efek biologis, termasuk diantaranya sebagai antijamur, sitotoksik melawan sel tumor, hemolisis, aktivitas kekebalan tubuh dan antikanker (Zhang, dkk., 2006).
Senyawa yang diduga memiliki aktifitas antikanker, harus diujikan terlebih dahulu pada hewan percobaan (Nurhayati, dkk., 2006). Penelitian ini menggunakan metode Brine Shrimp Lethality Test (BSLT) dengan larva udang
Artemia salina Leach sebagai hewan uji. Metode ini sederhana, cepat, tidak membutuhkan biaya yang besar, dan hasilnya dapat dipercaya, serta sering dikaitkan dengan metode penapisan senyawa antikanker sehingga uji ini sangat tepat digunakan dalam mengawali penelitian bahan alam (Meyer, dkk., 1982). Parameter yang diamati pada metode ini adalah nilai LC50, semakin kecil nilai
LC50 yang dimiliki ekstrak hewan maka akan semakin toksik (Inayah, dkk., 2012).
Teripang yang digunakan dalam penelitian ini diperoleh dari pulau Barang Lompo sebelah Barat kota Makasar, kecamatan ujung tanah, Makasar. Hal ini karena di perairan Makasar banyak terdapat teripang, baik yang alami maupun yang di budidayakan, dan harganya lebih ekonomis.
1.2 Perumusan Masalah
Berdasarkan uraian di atas, maka permasalahan dalam penelitian ini dapat dirumuskan sebagai berikut :
a. apakah karakteristik simplisia teripang Pearsonothuria graeffei memenuhi persyaratan mutu secara umum ?
b. apakah golongan senyawa kimia yang terdapat pada simplisia, ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air teripang Pearsonothuria graeffei ?
c. apakah terdapat perbedaan kekuatan toksisitas antara ekstrak etanol, fraksi n- heksana, fraksi etilasetat dan fraksi air teripang Pearsonothuria graeffei ?
1.3 Hipotesis
Hipotesis dalam penelitian ini adalah :
a. karakteristik simplisia teripang Pearsonothuria graeffei memenuhi persyaratan mutu secara umum
b. golongan senyawa kimia yang terdapat pada simplisia, ekstrak etanol, fraksi n -heksana, fraksi etilasetat dan fraksi air teripang Pearsonothuria graeffei adalah saponin, glikosida, dan steroid/triterpenoid.
c. terdapat perbedaan kekuatan toksisitas antara ekstrak etanol, fraksi n- heksana, fraksi etilasetat dan fraksi air teripang Pearsonothuria graeffei
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah :
a. untuk mengetahui karakteristik simplisia teripang Pearsonothuria graeffei
b. untuk mengetahui golongan senyawa kimia apa saja yang terdapat pada simplisia, ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air teripang Pearsonothuria graeffei
c. untuk mengetahui perbedaan kekuatan toksisitas antara ekstrak etanol, fraksi n- heksana, fraksi etilasetat dan fraksi air teripang Pearsonothuria graeffei
1.5 Manfaat Penelitian
Manfaat dari penelitian ini adalah dapat memberikan informasi kepada masyarakat tentang aktivitas toksisitas dari teripang Pearsonothuria graeffei
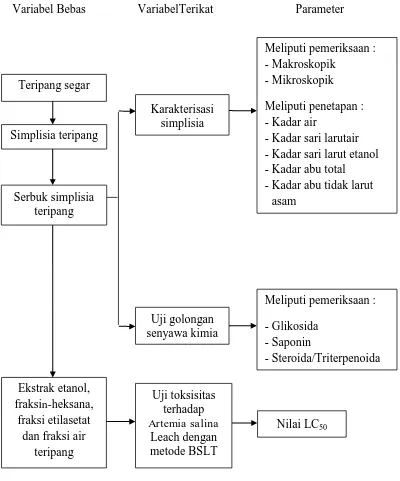
1.6 Kerangka Pikir Penelitian
Kerangka pikir penelitian ini dapat dilihat pada Gambar 1.1 berikut:
Gambar 1.1 Skema kerangka pikir penelitian
Ekstrak etanol, - Kadar sari larut etanol - Kadar abu total - Kadar abu tidak larut
asam Serbuk simplisia
teripang
BAB II
TINJAUAN PUSTAKA
2.1. Teripang
2.1.1. Morfologi teripang
Teripang adalah salah satu anggota hewan berkulit duri (Echinodermata), tetapi tidak semua jenis teripang mempunyai duri pada kulitnya. Duri-duri pada teripang tersebut sebenarnya merupakan rangka atau skelet yang tersusun dari zat kapur dan terdapat di dalam kulitnya (Widodo, 2013).
Teripang laut memiliki tubuh bulat panjang atau silindris, dengan mulut berada di ujung dan dubur di ujung lainnya. Mengingat bentuknya yang bulat panjang atau silindris menyerupai mentimun, maka teripang laut juga dikenal sebagai sea cucumber. Mulutnya dikelilingi oleh 20 tentakel atau lengan peraba yang bercabang-cabang yang berfungsi untuk menangkap makanan, dan dalam tentakel ini terdapat gigi yang tersusun seperti lampu yang disebut lentera
aristoteles. Tubuh seperti berlemak, tipis atau tebal dan licin, dengan kulit halus atau berbintil. Punggung lurus dengan 3-6 lingkaran tak beraturan, sedangkan pada bagian perut yang pipih atau rata dijumpai banyak kaki tabung. Warna tubuh teripang bervariasi, ada yang hitam, cokelat dan abu-abu. Teripang bergerak sangat lambat/lamban dan dalam melindungi diri dari musuhnya, teripang menggunakan lendir yang beracun dalam tubuhnya (Kuncoro, 2004).
2.1.2. Klasifikasi teripang
Berdasarkan hasil identifikasi yang dilakukan oleh Pusat Penelitian Oseanografi, Lembaga Ilmu Penelitian Indonesia (LIPI), klasifikasi teripang
Filum/Divisi : Echinodermata Kelas/Class : Holothuroidea
Bangsa/Ordo : Aspidochirotida Grube, 1840 Suku/Famili : Holothuriidae Ludwig, 1894
Marga/Genus : Pearsonothuria Levin, Kalin & Stonink, 1984 Jenis/Species : Pearsonothuria graeffei (Semper, 1868)
2.1.3. Kelamin dan reproduksi teripang
Teripang termasuk hewan dioecious atau dengan alat kelamin berumah dua sehingga alat kelamin jantan dan betina terletak pada individu yang berlainan. Jenis kelamin ini dapat diketahui bila dilakukan pembedahan, karena untuk membedakannya secara morfologis sulit dilakukan. Kelamin jantan biasanya berwarna putih seperti cairan susu sedangkan kelamin betina bulat berwarna kuning dengan ukuran 160-180 µm (Wibowo, dkk., 1997).
Pembuahan teripang bersifat eksternal atau terjadi diluar tubuh, biasanya di dalam air. Telur yang sudah dibuahi akan tenggelam dan menetas setelah 32 jam membentuk larva. Teripang masuk ke fase Auricularia, Doliolaria, Pentactula setelah fase larva dan terakhir menjadi teripang muda dengan kurun waktu 60 hari (Wibowo, dkk., 1997).
2.1.4. Habitat dan penyebaran
Teripang dapat ditemukan hampir di seluruh perairan pantai, mulai daerah pasang surut yang dangkal sampai perairan yang lebih dalam. Teripang umumnya menempati ekosistem terumbu karang dengan perairan yang jernih, bebas dari polusi, air relatif tenang dengan mutu air cukup bagus (Wibowo, dkk., 1997).
detritus, diatomi, protozoa, nematoda, dan juga foraminifera, radiolaria, dan partikel pasir atau hancuran karang (Widodo, 2013).
Penyebaran teripang di Indonesia sangat luas, antara lain perairan pantai Madura, Bali, Lombok, Aceh, Bengkulu, Bangka, Riau dan sekitarnya, Belitung, Kalimantan, Sulawesi, Maluku, Timor dan Kepulauan Seribu (Widodo, 2013).
2.1.5. Kandungan gizi dan manfaat
Teripang atau gamat telah dikenal dan dimanfaatkan sejak lama oleh bangsa Cina sebagai makanan mewah dan juga obat tradisional. Teripang digunakan untuk membantu mengatasi keluhan seperti menyembuhkan luka, meredakan rasa sakit di persendian, memperlancar sirkulasi darah dan secara umum dikonsumsi sebagai hidangan spesial untuk menjaga kesehatan karena dinilai sebagai ginseng laut (Widodo, 2013). Masyarakat Indonesia juga telah lama mengenal teripang. Masyarakat di sekitar pesisir sudah mengkonsumsi teripang secara turun temurun dengan terlebih dahulu melakukan pengolahan secara sederhana, seperti perebusan dan pengasapan serta pengawetan dilakukan dengan cara menjemur di panas matahari (Anonim, 2003).
Kandungan gizi yang terdapat pada teripang diantaranya vitamin A, vitamin B1 (thiamin), vitamin B2 (riboflavin), vitamin B3 (niasin), dan mineral khususnya kalsium, magnesium, zat besi, zinc, fosfor, natrium, kalium (Bordbar, dkk., 2011). Kandungan nutrisi teripang dalam kondisi kering terdiri dari protein sebanyak 82%, lemak 1,7%, kadar air 8,9%, kadar abu 8,6% dan karbohidrat 4,8% (Martoyo, dkk., 2006). Kandungan kimia teripang dalam keadaan basah yaitu 44 - 45% protein, 3 - 5% karbohidrat, dan 1,5% lemak (Anonim, 2003).
antitrombosis. Manfaat pengobatan dari teripang ini dapat dihubungkan oleh adanya kandungan bioaktif, seperti triterpen glikosida (saponin), kondroitin sulfat, glycosaminoglycan (GAGs), sterol, fenol, lektin, peptida, glikoprotein, dan asam amino esensial (Bordbar, dkk., 2011).
Menurut Zhang, dkk. (2006), senyawa metabolit yang dominan dihasilkan teripang adalah saponin. Saponin adalah suatu glikosida alami yang tersebar luas pada tumbuhan tinggi, tetapi dijumpai juga pada hewan seperti invertebrata laut (Podolak, dkk., 2010). Saponin merupakan senyawa aktif permukaan dan bersifat seperti sabun, serta dapat dideteksi berdasarkan kemampuannya membentuk busa dan menghemolisis sel darah (Harborne, 1987).
Saponin terdiri dari bagian glikon dan aglikon. Bagian aglikon dapat memiliki struktur steroid atau triterpenoid (Podolak, dkk., 2010). Steroid adalah triterpena yang kerangka dasarnya sistem cincin siklopentana perhidrofenantren. Steroid dahulu dianggap sebagai senyawa satwa, tetapi pada tahun-tahun terakhir ini makin banyak senyawa tersebut yang ditemukan dalam jaringan tumbuhan (Harborne, 1987).
senyawa, yaitu triterpena sebenarnya, steroid, saponin dan glikosida jantung (Harborne, 1987).
2.2. Ekstraksi
Ekstrak adalah sediaan kering, kental atau cair dibuat dengan menyari simplisia nabati atau hewani menurut cara yang cocok, di luar pengaruh cahaya matahari langsung (Depkes RI, 1979).
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Simplisia yang di ekstrak mengandung senyawa aktif yang dapat larut dan senyawa yang tidak dapat larut seperti serat, karbohidrat, protein dan lain-lain (Depkes RI, 2000).
Ekstraksi dengan menggunakan pelarut berdasarkan Depkes RI, 2000 yaitu:
1. Cara dingin a. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (kamar). Secara teknologi termasuk ekstraksi dengan prinsip metode pencapaian konsentrasi pada keseimbangan. Maserasi kinetik berarti dilakukan pengadukan yang kontinu (terus-menerus). Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama, dan seterusnya.
b. Perkolasi
sempurna (exhaustive extraction) yang umumnya dilakukan pada temperatur ruangan. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) terus-menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan.
2. Cara panas a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
b. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik. c. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara umum dilakukan pada temperatur 40-50oC.
d. Infundasi
Infundasi adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-98 oC selama waktu tertentu (15-20 menit).
e. Dekoktasi
2.3. Ekstraksi Cair-Cair
Ekstraksi cair-cair merupakan suatu teknik yang mana suatu larutan (biasanya dalam air) dibuat bersentuhan dengan suatu pelarut kedua (biasanya pelarut organik), yang pada hakikatnya tidak tercampurkan, pada proses ini terjadi pemindahan satu atau lebih zat terlarut (solute) kedalam pelarut yang kedua (Bassett, dkk., 1994).
Pemisahan yang dilakukan bersifat sederhana, bersih, cepat dan mudah, yang dapat dilakukan dengan cara mengocok-ngocok dalam sebuah corong pisah selama beberapa menit (Bassett, dkk., 1994). Analit-analit yang mudah terekstraksi dalam pelarut organik adalah molekul-molekul netral yang berikatan secara kovalen dengan substituen yang bersifat nonpolar atau agak polar. Senyawa-senyawa yang mudah mengalami ionisasi dan senyawa polar lainnya akan tertahan dalam fase air (Rohman, 2007).
Pelarut organik yang dipilih untuk ekstraksi pelarut ialah pelarut yang mempunyai kelarutan yang rendah dalam air (<10%), dapat menguap sehingga memudahkan penghilangan pelarut organik setelah dilakukan ekstraksi, dan mempunyai kemurnian yang tinggi untuk meminimalkan adanya kontaminasi sampel (Rohman, 2007).
2.4. Brine Shrimp Lethality Test (BSLT)
aktivitasnya dimonitor dengan BSLT menunjukkan adanya korelasi terhadap suatu uji spesifik antikanker. Toksisitas ditentukan dengan melihat harga LC50
yang dihitung berdasarkan analisis probit. Ekstrak ditentukan dengan melihat LC50 nya lebih kecil atau sama dengan 1000 mcg/ml (Harmita, dkk., 2008).
Brine Shrimp Lethality Test (BSLT) adalah pengujian yang sederhana, ini didasari pada kemampuan membunuh dari senyawa yang diuji pada organisme zoologi yaitu Artemia salina. BSLT digunakan secara luas untuk mengevaluasi toksisitas logam berat, pestisida, obat-obatan khususnya ekstrak tumbuhan (Wu, 2014). Hasil uji BSLT yang menunjukkan bahwa ekstrak tumbuhan bersifat toksik maka dapat dikembangkan ke penelitian lebih lanjut untuk mengisolasi senyawa sitotoksik tumbuhan sebagai usaha pengembangan obat alternatif antikanker (Kurniawan, 2012).
2.5. Artemia salina Leach
2.5.1. Klasifikasi Artemia salina Leach
Artemia adalah jenis udang-udangan kecil tingkat rendah yang digolongkan sebagai zooplankton. Artemia atau yang juga dikenal dengan nama
brine shrimp merupakan hewan dari kelas crustacea yang hidup di air bergaram.
Klasifikasi Artemia salina : Kingdom : Animalia Filum : Arthropoda Subfilum : Crustacea Kelas : Branchiopoda Ordo : Anostraca Famili : Artemiidae Genus : Artemia
Spesies : Artemia salina (Linnaeus, 1758) ( Dumitrascu, 2011).
2.5.2. Siklus pertumbuhan Artemia salina Leach
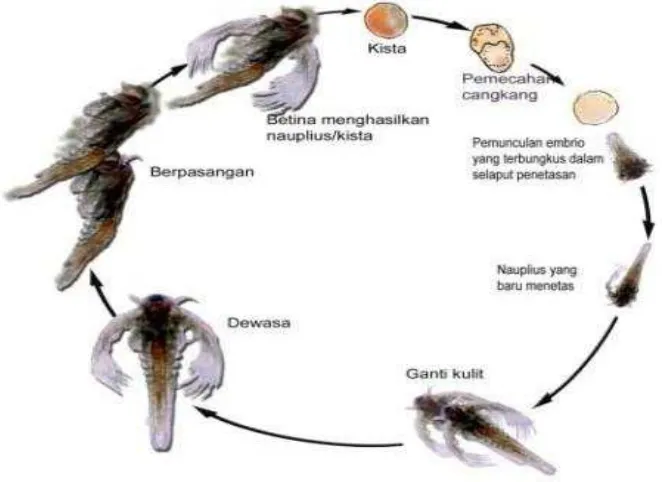
Gambar 2.1. Siklus pertumbuhan Artemia salina Leach (Bachtiar, 2003).
jantan. Populasi artemia yang berkembangbiak secara biseksual terdiri atas jenis jantan dan betina yang melakukan perkawinan, yang kemudian menghasilkan embrio (Bachtiar, 2003).
Daur hidup artemia mengalami beberapa fase sebagai berikut : a. Fase kista (telur)
Fase kista adalah suatu kondisi istirahat pada hewan crustacea tingkat rendah seperti artemia. Ketika direndam ke dalam air laut, kista atau telur akan menyerap air (hidrasi), akibatnya di dalam kista terjadi proses metabolisme embrio yang aktif. Berselang 24-48 jam kemudian, cangkang kista akan pecah dan muncul embrio yang masih terbungkus oleh selaput penetasan.
b. Fase nauplius
Nauplius adalah larva stadium tingkat pertama dari artemia. Embrio yang masih terbungkus selaput penetasan akan berkembang menjadi organisme baru yang dapat berenang bebas di perairan. Fase ini diawali oleh pecahnya selaput penetasan yang masih membungkus embrio (nauplius). Larva ini berwarna jingga kecokelatan karena membawa kuning telur yang melekat pada tubuhnya. Panjang tubuh nauplius 0,4-0,7 mm dengan berat 15-20 mcg.
c. Fase dewasa
Fase dewasa adalah kondisi nauplius yang telah berkembang menjadi artemia dewasa. Ciri artemia dewasa adalah terdapat sepasang mata majemuk dan antena sensor pada kepala serta memiliki saluran pencernaan. Tubuh artemia dewasa dapat mencapai 1-2 cm dan beratnya sekitar 10 mg (Bachtiar, 2003).
2.5.3. Penggunaan Artemia sebagai hewan uji toksisitas
menggunakan larva Artemia salina Leach sebagai hewan coba. Uji toksisitas dengan metode BSLT ini merupakan uji toksisitas akut, yaitu efek toksik dari suatu senyawa ditentukan dalam waktu singkat setelah pemberian dosis uji (Wibowo, dkk., 2013).
Penggunaan Artemia salina ini memang tidak spesifik untuk antikanker maupun fisiologis aktif tertentu, namun beberapa penelitian terdahulu menunjukkan adanya korelasi yang signifikan terhadap beberapa bahan, baik berupa ekstrak tanaman atau aksinya sebagai antikanker secara lebih cepat dibandingkan dengan prosedur pemeriksaan sitotoksik yang umum, misalnya dengan biakan sel kanker. Melihat adanya potensi sebagai antikanker tersebut, maka penelitian lanjutan dapat dilanjutkan, yaitu dengan mengisolasi senyawa berkhasiat yang terdapat di dalam ekstrak disertai dengan monitoring aktivitasnya dengan uji larva udang atau metode yang lebih spesifik sebagai antikanker (Meyer, dkk., 1982).
Pengujian menggunakan BSLT diterapkan dengan menentukan nilai
Lethal Concentration 50% (LC50) setelah perlakuan 24 jam. Nilai LC50
BAB III
METODE PENELITIAN
Penelitian yang dilakukan adalah penelitian eksperimental meliputi pengumpulan dan pengolahan hewan, identifikasi hewan, pemeriksaan karakteristik, pemeriksaan golongan senyawa kimia, pembuatan ekstrak dan fraksinasi, serta uji toksisitas dari ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air teripang menggunakan larva udang Artemia salina Leach. Penelitian dilakukan di Laboratorium Farmakognosi, Fakultas Farmasi, Universitas Sumatera Utara.
3.1. Alat
Alat–alat yang digunakan dalam penelitian ini adalah lemari pengering, seperangkat alat penetapan kadar air, mikroskop (Olympus), oven listrik (Stork), krus porselin, tanur (Nabertherm), neraca analitik (Vibra AJ), perkolator, blender (Panasonic), penangas air (Yenaco), rotary evaporator, cawan porselin, desikator, kaca objek, kaca penutup, spatula, bejana penetasan telur Artemia salina Leach, lampu 5 watt (Hannochs), dan alat-alat gelas laboratorium.
3.2. Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah teripang, telur
sulfat pekat, n-heksana (destilasi), etilasetat (destilasi), etanol (destilasi), toluen dan kloroform.
3.3. Pengumpulan dan Pengolahan Teripang 3.3.1. Pengumpulan teripang
Pengumpulan teripang dilakukan dengan cara purposif yaitu tanpa membandingkan dengan hewan serupa dari daerah lain. Teripang yang digunakan adalah Pearsonothuria graeffei yang di ambil dari pulau Barang Lompo sebelah Barat kota Makasar, Kecamatan Ujung Tanah, Makasar.
3.3.2. Identifikasi teripang
Identifikasi teripang dilakukan di Pusat Penelitian Oseanografi, Lembaga
Ilmu Penelitian Indonesia (LIPI). Teripang yang digunakan sama dengan teripang yang diidentifikasi atas nama Tobing, (2015). Hasil identifikasi dapat dilihat pada Lampiran 1, halaman 40.
3.3.3. Pengolahan teripang
Teripang yang telah dikumpulkan, dibersihkan isi perutnya dengan cara
3.4. Pembuatan Pereaksi
3.4.1. Pereaksi asam klorida 2 N
Sebanyak 17 ml larutan asam klorida pekat ditambahkan air suling hingga
100 ml (Depkes RI, 1979).
3.4.2. Pereaksi Liebermann- Burchard
Sebanyak 20 bagian asam asetat anhidrida dicampurkan dengan 1 bagian
asam sulfat pekat. Larutan penyemprotnya dibuat dengan 20 bagian asam asetat anhidrida dengan 1 bagian asam sulfat pekat dan 50 bagian kloroform. Larutan penyemprot ini harus dibuat baru (Harborne, 1987).
3.4.3. Pereaksi Molish
Sebanyak 3 g α-naftol dilarutkan dalam asam nitrat 0,5 N hingga diperoleh volume 100 ml (Depkes RI, 1995).
3.4.4. Air - kloroform
Sebanyak 2,5 ml kloroform dikocok dengan 900 ml air suling, encerkan
dengan air suling higga 1000 ml (Depkes RI, 1995).
3.4.5. Larutan kloralhidrat
Sebanyak 50 g kloralhidrat ditimbang dan dilarutkan dalam 20 ml air suling
(Depkes RI, 1995).
3.4.6. Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air suling bebas
karbondioksida secukupnya hingga 100 ml (Depkes RI, 1995).
3.4.7. Pereaksi asam nitrat 0,5 N
Sebanyak 3,4 ml asam nitrat pekat diencerkan dengan air suling hingga
3.5. Pemeriksaan Karakteristik Hewan
Pemeriksaan karakteristik hewan dilakukan pada hewan teripang yang di ambil pada waktu dan tempat yang sama, jenis yang sama, serta waktu pengerjaan karakterisasi dilakukan secara bersamaan dengan Tobing.
Pemeriksaan karakteristik hewan meliputi pemeriksaan makroskopik dan mikroskopik, penetapan kadar air, penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan kadar abu total, dan penetapan kadar abu tidak larut asam.
3.5.1. Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan terhadap teripang dengan cara mengamati bentuk, ketebalan, diameter, permukaan tubuh. Pemeriksaan organoleptis meliputi warna, bau dan rasa dari teripang.
3.5.2. Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia hewan
dengan cara menaburkan serbuk simplisia di atas kaca objek yang telah ditetesi dengan kloralhidrat dan ditutupi dengan kaca penutup kemudian dilihat dibawah mikroskop. Hasil mikroskopik dapat dilihat pada Lampiran 3, halaman 44.
3.5.3. Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen) (WHO, 1998).
Cara kerja : 1. Penjenuhan toluen
2. Penetapan kadar air simplisia
Sebanyak 5 g serbuk simplisia yang telah ditimbang seksama dimasukkan kedalam labu yang berisi toluen tersebut. Labu dipanaskan hati-hati selama 15 menit hingga toluen mendidih. Kecepatan tetesan diatur lebih kurang 2 tetesan perdetik, sampai sebagian air terdestilasi, kemudian kecepatan destilasi dinaikkan hingga 4 tetes perdetik. Bagian dalam pendingin dibilas dengan toluen setelah semua air terdestilasi. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan dingin sampai suhu kamar. Volume air dibaca dengan ketelitian 0,05 ml setelah air dan toluen memisah sempurna. Selisih kedua volume air dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Perhitungan penetapan kadar air dapat dilihat pada Lampiran 4, halaman 45.
3.5.4. Penetapan kadar sari larut air
Sebanyak 5 g serbuk yang telah dikeringkan diudara di maserasi selama 24
jam dengan 100 ml air-kloroform dalam labu bersumbat sambil berkali-kali dikocok selama 6 jam pertama kemudian dibiarkan selama 18 jam lalu disaring. Sejumlah 20 ml filtrat diuapkan hingga kering dalam cawan penguap berdasar rata yang telah ditara. Sisa dipanaskan pada suhu 105o C sampai bobot tetap. Kadar sari larut dalam air dihitung dengan persen terhadap bahan yang telah kering (Depkes RI, 1995). Perhitungan penetapan kadar sari larut air dapat dilihat pada Lampiran 5, halaman 46.
3.5.5. Penetapan kadar sari larut etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24
ditara dan sisanya dipanaskan pada suhu 105o C sampai bobot tetap. Kadar sari larut dalam etanol dihitung dalam persen terhadap bahan yang telah kering (Depkes RI, 1995). Perhitungan penetapan kadar sari larut etanol dapat dilihat pada Lampiran 6, halaman 47.
3.5.6. Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama
dimasukkan kedalam cawan porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan pada suhu 500-600o C selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah kering (WHO, 1998). Perhitungan penetapan kadar abu total dapat dilihat pada Lampiran 7, halaman 48.
3.5.7. Penetapan kadar abu tidak larut asam
Abu yang telah diperoleh dalam penetapan kadar abu dididihkan dalam 25
ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring dipijarkan sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang kering (Depkes RI, 1995). Perhitungan penetapan kadar abu tidak larut asam dapat dilihat pada Lampiran 8, halaman 49.
3.6.Pemeriksaan Golongan Senyawa Kimia 3.6.1. Pemeriksaan saponin
terbentuk busa setinggi 1 sampai 10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan asam klorida 2 N bila adanya saponin (Depkes RI, 1995).
3.6.2. Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia disari dengan 30 ml campuran etanol 95%
dengan air (7:3) dan 10 ml asam sulfat 2 N, direfluks selama 1 jam, didinginkan dan disaring. Sebanyak 20 ml filtrat ditambahkan 25 ml air dan 25 ml timbal asetat 0,4 M, dikocok, diamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3), dilakukan sebanyak 3 kali. Kumpulan sari air diuapkan pada temperatur tidak lebih dari 50o C. Sisanya dilarutkan dalam 2 ml metanol. Larutan sisa dimasukkan dalam tabung reaksi selanjutnya, diuapkan di atas penangas air, pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molish. Tambahkan 2 ml asam sulfat pekat melalui dinding tabung, terbentuknya cincin ungu pada batas kedua cairan bila adanya gula.
3.6.3. Pemeriksaan steroid/triterpenoida
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml n-heksana selama 2 jam, disaring, filtrat diuapkan dalam cawan penguap dan pada sisanya ditambahkan 1 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat. Terbentuk warna ungu atau merah berubah menjadi ungu atau biru hijau bila adanya steroida/triterpenoida (Harborne, 1987).
3.7.Pembuatan Ekstrak
3.7.1. Pembuatan ekstrak etanol
Pembuatan ekstrak dilakukan dengan metode perkolasi menggunakan
Cara kerja :
Sebanyak 400 g serbuk simplisia dimasukkan ke dalam bejana tertutup, lalu direndam dengan cairan penyari etanol 96% selama 3 jam. Massa dimasukkan ke dalam perkolator, lalu pelarut etanol dituang secukupnya sampai terdapat selapis larutan penyari di atas serbuk simplisia, mulut perkolator ditutup dengan plastik dan aluminium foil dan dibiarkan selama 24 jam. Kran perkolator dibuka setelah 24 jam dan cairan perkolat dibiarkan menetes dengan kecepatan 20 tetes per menit dan ditampung ke dalam botol berwarna bening. Perkolasi dihentikan setelah tetesan terakhir perkolat tidak bereaksi lagi dengan pereaksi untuk uji senyawa golongan steroid/triterpenoid (pereaksi Lieberman-Burchard) atau apabila sebanyak 500 mg cairan perkolat diuapkan di atas penangas air tidak meninggalkan sisa. Perkolat diuapkan dengan menggunakan rotary evaporator
pada suhu tidak lebih dari 40o C. Bagan pembuatan ekstrak etanol dapat dilihat pada Lampiran 10, halaman 51.
3.7.2. Fraksinasi ekstrak
1. Fraksinasi dengan n-heksana
Fraksinasi dilakukan dengan metode ekstraksi cair cair (ECC). 10 g ekstrak pekat teripang dilarutkan dalam 10 ml etanol, ditambah 50 ml air suling, kemudian diekstraksi dengan n- heksana sebanyak 50 ml menggunakan corong pisah yang diulang sebanyak tiga kali. Lapisan n- heksana dipisahkan dan kemudian diuapkan hingga diperoleh fraksi n- heksana kental.
2. Fraksinasi dengan etilasetat
dipisahkan dan ditampung kemudian diuapkan. Fraksi air yang diperoleh juga diuapkan untuk digunakan pada pengujian toksisitas. Bagan pembuatan fraksi dapat dilihat pada Lampiran 11, halaman 52.
3.8.Uji Toksisitas
Uji toksisitas dilakukan terhadap ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air menggunakan larva Artemia salina Leach, yaitu sebagai berikut :
Air laut buatan disiapkan dengan melarutkan 38 g garam tidak beriodium dengan air suling dicukupkan hingga 1 L, kemudian disaring. Bejana penetasan disekat menjadi dua bagian, yaitu bagian yang besar dan bagian yang kecil, lalu diberi lubang pada sekatnya. Air laut buatan dimasukkan ke dalam bejana, telur
Artemia salina Leach ditaburkan ke dalam bagian yang kecil kemudian bagian atasnya ditutup dengan aluminium foil sedangkan bagian yang besar dibiarkan terbuka menghadap lampu selama 48 jam, telur akan menetas menjadi larva dan siap digunakan untuk hewan uji. Gambar wadah penetasan dapat dilihat pada Lampiran 12, halaman 53.
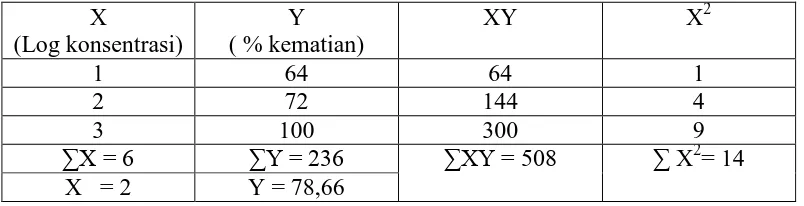
sampai 5 ml sehingga diperoleh larutan induk II dengan konsentrasi 1000 mcg/ml. Larutan induk II masing-masing ekstrak dipipet 0,5 ml lalu diencerkan sampai 5 ml sehingga diperoleh konsentrasi 100 mcg/ml. Konsentrasi 100 mcg/ml masing-masing ekstrak dipipet 0,5 ml lalu diencerkan sampai 5 ml sehingga diperoleh konsentrasi 10 mcg/ml. Kontrol dibuat dengan menambahkan pelarut ke dalam vial sesuai jumlah yang digunakan untuk melarutkan ekstrak, kemudian cukupkan dengan air laut buatan sampai 5 ml. Larva Artemia salina Leach ditambahkan sebanyak 10 ekor ke dalam masing-masing vial yang telah berisi larutan uji dan kontrol. Sebanyak 1 tetes suspensi ragi (3 mg dalam 5 ml air laut buatan) sebagai makanannya kemudian semua vial diletakkan dibawah cahaya lampu. Pengamatan dilakukan setelah 24 jam dan dihitung jumlah persentase kematian larva tiap dosis dan kontrol. Data dihitung menggunakan rumus Abbott :
Kematian = te -kontrol
kontrol x 100 %.
Data dianalisis dengan regresi linear untuk menentukan LC50 (Meyer, dkk.,
1982). Perhitungan LC50 ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Identifikasi Hewan
Hasil identifikasi teripang yang di lakukan di Pusat Penelitian Oseanografi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) yaitu teripang jenis
Pearsonothuria graeffei (Semper, 1868), marga Pearsonothuria Levin, Kalin & Stonink, 1984, suku Holothuriidae Ludwig, 1894, bangsa Aspidochirotida Grube, 1840, kelas Holothuroidea dan filum Echinodermata.
4.2. Pemeriksaan Makroskopis
Secara makroskopis, tubuh teripang segar berbentuk lonjong dengan panjang sekitar 65 cm dan lebar 10 cm, dengan mulut pada salah satu ujungnya dan anus pada ujung lainnya. Tubuhnya lunak dan berlendir, permukaan tubuhnya berwarna coklat dengan bercak berwarna hitam. Diameter tubuh bagian tengah lebih besar dari bagian ujungnya, yaitu bagian mulut dan anus.
Pemeriksaan makroskopis terhadap simplisia yaitu simplisia berwarna lebih pucat dan mengkerut. Pemeriksaan organoleptis terhadap teripang segar yaitu berbau spesifik, sedangkan serbuk simplisia berwarna cream, rasa asin, dan berbau spesifik.
4.3. Pemeriksaan Mikroskopis
(Semper, 1868) memiliki spikula bentuk rosset, pseudo- tables, spikula bentuk batang (rods).
4.4. Hasil Karakteristik
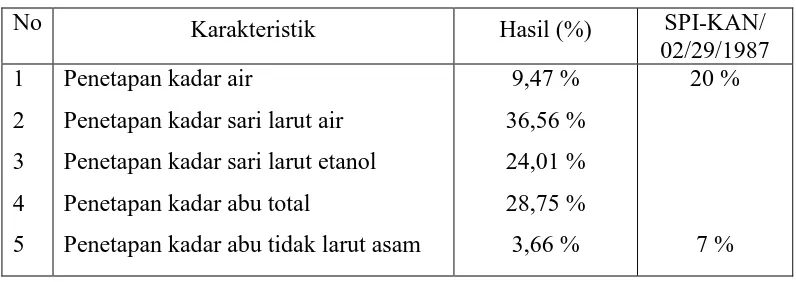
Menurut Tobing (2015), hasil pemeriksaan kadar air, kadar sari larut air, kadar sari larut etanol, kadar abu total, kadar abu tidak larut asam yang diperoleh dapat dilihat pada Tabel 4.1 berikut :
Tabel 4.1. Hasil karakteristik serbuk simplisia teripang Pearsonothuria graeffei
(Semper, 1868)
Penetapan kadar sari larut air Penetapan kadar sari larut etanol Penetapan kadar abu total
Penetapan kadar abu tidak larut asam
9,47 %
Penetapan kadar air dilakukan dengan menggunakan metode azeotropi (destilasi toluen), penetapan kadar sari larut etanol dan air dilakukan dengan menggunakan metode gravimetri, penetapan kadar abu total dan kadar abu tidak larut asam juga menggunakan metode gravimetri.
kadar air bertujuan untuk memberikan batasan minimal atau rentang tentang besarnya kandungan air di dalam bahan karena kadar air yang tinggi dapat menyebabkan pertumbuhan jamur dan reaksi enzimatis (Depkes RI, 2000).
Penetapan kadar sari bertujuan untuk mengetahui banyaknya senyawa yang terlarut dalam air dan etanol. Senyawa pada simplisia yang larut dalam etanol diperoleh 24,01% dan senyawa yang larut dalam air kloroform 36,56%. Senyawa yang larut air yaitu saponin, protein, vitamin B1 (thiamin), vitamin B2 (riboflavin), dan vitamin B3 (niasin), sedangkan senyawa yang larut etanol adalah saponin, steroid/triterpenoid, lemak, kolagen.
Hasil penetapan kadar abu total yang diperoleh yaitu 28,75 % . Kadar abu total yang tinggi dapat disebabkan karena teripang mengandung mineral yang cukup lengkap berupa kalsium, natrium, fosfor, kromium, mangan, zat besi, kobal, seng, dan vanadium (Martoyo, dkk., 2006). Kadar abu tidak larut asam yang diperoleh adalah 3,66%, dan yang termasuk dalam abu tidak larut asam adalah silikat. Kadar abu tidak larut asam juga memenuhi persyaratan mutu teripang kering yaitu (SPI-KAN/ 02/29/1987) sesuai Keputusan Menteri Pertanian RI No. 701/Kpts/TP.830/10/1987, sehingga masih aman untuk dimanfaatkan. Kadar abu bertujuan untuk memberikan gambaran kandungan mineral internal dan eksternal yang berasal dari proses awal sampai terbentuknya ekstrak (Depkes RI, 2000).
4.5. Hasil Pemeriksaan Golongan Senyawa
Tabel 4.2. Hasil pemeriksaan golongan senyawa serbuk simplisia, ekstrak etanol,
fraksi n- heksana, etilasetat dan air
No Pemeriksaan Hasil Serbuk
Keterangan : (+) = mengandung golongan senyawa (-) = tidak mengandung golongan senyawa
Hasil pemeriksaan saponin serbuk simplisia, terbentuk busa mencapai 5 cm dan tidak hilang setelah penambahan HCl 2N. Menurut Harborne (1987), Pembentukan busa yang mantap sewaktu mengekstraksi tumbuhan atau waktu memekatkan ekstrak merupakan bukti terpercaya akan adanya saponin.
Pemeriksaan glikosida terlihat adanya cincin ungu pada tabung reaksi setelah penambahan pereaksi Molish dan asam sulfat pekat. Steroid/triterpenoid positif apabila terdapat warna merah muda ungu sampai hijau biru dengan pereaksi Liebermann-Burchard.
Hasil pemeriksaan golongan senyawa pada ekstrak dan fraksi menunjukkan bahwa saponin dan glikosida positif pada ekstrak etanol, fraksi etilasetat dan fraksi air. Pemeriksaan steroid/ triterpenoid menunjukkan hasil yang positif pada ekstrak etanol dan fraksi n-heksana.
4.6. Hasil Uji Toksisitas
tercantum pada Tabel 4.3 berikut :
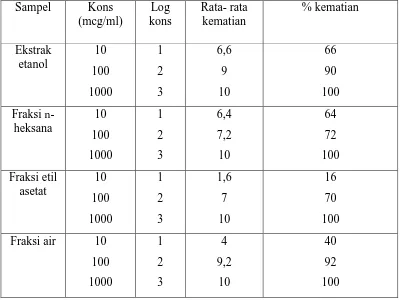
Uji toksisitas terhadap Artemia salina Leach dengan ekstrak etanol, fraksi
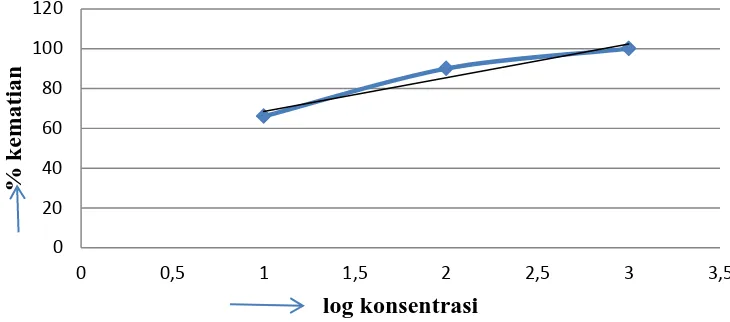
n- heksana, fraksi etilasetat dan fraksi air dilakukan sebanyak 5 kali pengulangan pada masing-masing konsentrasi yaitu 10 mcg/ml, 100 mcg/ml dan 1000 mcg/ml. Berdasarkan Tabel 4.3 diatas dapat dilihat pada ekstrak etanol persentase kematian hewan uji meningkat sebanding dengan peningkatan konsentrasi. Konsentrasi terkecil yaitu 10 mcg/ml telah memberikan efek kematian pada hewan uji mencapai 66% dan meningkat menjadi 100% pada konsentrasi 1000 mcg/ml. Kematian hewan uji ini dipengaruhi oleh kandungan golongan senyawa yang terdapat pada ekstrak etanol yaitu saponin.
mcg/ml kematian hewan uji 72% dan pada konsentrasi 1000 mcg/ml kematian hewan uji mencapai 100%.
Konsentrasi terkecil pada fraksi etilasetat yaitu 10 mcg/ml, % kematian hewan uji tidak mencapai 50%. Persentase kematian meningkat signifikan pada konsentrasi 100 mcg/ml dan 1000 mcg/ml yaitu masing-masing 70% dan 100%.
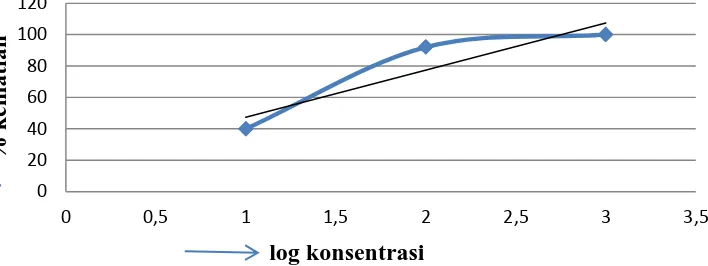
Hasil pengujian fraksi air, konsentrasi terkecil yaitu 10 mcg/ml tidak menimbulkan kematian hewan uji mencapai 50% tetapi hanya 40%. Kematian hewan uji meningkat pada konsentrasi 100 mcg/ml dan 1000 mcg/ml. Hubungan antara log konsentrasi dengan % kematian, dapat dilihat pada grafik dibawah ini.
Gambar 4.1. Grafik log konsentrasi vs % kematian ekstrak etanol
Gambar 4.2. Grafik log konsentrasi vs % kematian fraksi n- heksana
Gambar 4.3. Grafik log konsentrasi vs % kematian fraksi etilasetat
Gambar 4.4. Grafik log konsentrasi vs % kematian fraksi air
Grafik diatas menunjukkan adanya pengaruh konsentrasi terhadap kematian larva udang pada masing-masing ekstrak. Peningkatan kematian yang signifikan terlihat pada fraksi etilasetat dan juga fraksi air. Berdasarkan persamaan garis yang diperoleh, maka nilai LC50 untuk ekstrak dan fraksi dapat dilihat pada
Tabel 4.4 berikut :
Tabel 4.4. Hasil pengukuran LC50 dengan metode BSLT
Menurut Meyer, dkk. (1982), jika ekstrak mempunyai nilai LC50 < 1000
mcg/ml maka ekstrak tersebut bersifat toksik pada Artemia salina Leach dan pada sel kanker 9KB dan 9PS aktivitas sitotoksik dianggap signifikan ketika nilai LC50 ≤ 30 mcg/ml. Berda arkan ha il ter ebut dapat di impulkan bahwa ek trak
teripang dan fraksi-fraksinya bersifat toksik terhadap larva Artemia salina Leach.
Tabel 4.5. Tingkat Nilai Toksisitas LC50 (Anderson, dkk. 1991)
No Nilai LC50 (mcg/ml) Tingkat Toksisitas
1
Berdasarkan pembagian tingkat toksisitas LC50 menurut Anderson, dkk.
(1991) diatas, maka nilai LC50 yang diperoleh dari ekstrak etanol, fraksi n
-heksana, fraksi etilasetat dan fraksi air termasuk kedalam tingkat sangat toksik dimana rentang nilainya adalah 0 – 250 mcg/ml.
Perbedaan toksisitas antara ekstrak etanol, fraksi n- heksana, fraksi etilasetat dan fraksi air ini dapat disebabkan oleh senyawa yang terkandung pada masing-masing ekstrak. Nilai LC50 yang diperoleh pada ekstrak etanol sangat
yang lebih kuat dibandingkan fraksi etilasetat mungkin disebabkan terkonsentrasinya senyawa aktif teripang pada fraksi air yang bersifat polar. Menurut Zhang, dkk. (2006), senyawa metabolit yang dominan dihasilkan teripang adalah saponin. Saponin larut dalam air dan etanol tetapi tidak larut dalam eter (Robinson, 1995).
Saponin bekerja dengan menurunkan tegangan permukaan (Robinson, 1995). Menurunnya tegangan permukaan menyebabkan membran sel menjadi lebih permeabel, sehingga senyawa akan mudah untuk masuk ke dalam sel dan menyebabkan kerusakan sel. Amin, dkk. (2014) menjelaskan efek utama saponin adalah pelepasan protein dan enzim dari dalam sel, oleh sebab itu saponin merupakan golongan senyawa yang aktif dalam menghambat pertumbuhan sel.
Larva yang digunakan untuk uji toksisitas berumur 48 jam, karena pada umur ini anggota tubuh larva sudah lengkap dibandingkan pada saat larva itu menetas (Muaja, dkk., 2013). Pendapat lain menyatakan bahwa pada saat umur 48 jam, Artemia berada pada fase yang paling aktif membelah secara mitosis yang identik dengan sel kanker yang juga membelah secara mitosis (Kurniawan, 2012).
Brine Shrimp Lethalty Test (BSLT) merupakan salah satu metode uji toksisitas untuk menguji bahan-bahan yang bersifat sitotoksik. Uji toksisitas dengan metode BSLT ini merupakan uji toksisitas akut, yaitu efek toksik dari suatu senyawa ditentukan dalam waktu singkat setelah pemberian dosis uji. Pengujian menggunakan Brine Shrimp Lethalty Test (BSLT) diterapkan dengan menentukan nilai Lethal Concentration 50% (LC50) setelah perlakuan 24 jam.
Nilai LC50 merupakan angka yang menunjukkan konsentrasi suatu bahan
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
a. Hasil pemeriksaan makroskopis menunjukkan teripang segar memiliki bentuk tubuh lonjong dengan panjang sekitar 65 cm, lebar 10 cm, lunak dan berlendir, warna permukaan tubuhnya coklat dengan bercak berwarna hitam, sedangkan pada simplisia berwarna lebih pucat dan mengkerut. Hasil mikroskopis menunjukkan teripang terdiri dari spikula bentuk kancing (button), meja semu (pseudo table) dan batang (rods).
b. Golongan senyawa kimia yang terdapat pada simplisia, ekstrak etanol dan fraksi etilasetat adalah saponin, glikosida dan steroid/triterpenoid. Fraksi
n-heksana mengandung senyawa steroid/triterpenoid, sedangkan fraksi air mengandung saponin dan glikosida.
c. Ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air bersifat toksik pada Artemia salina Leach, dengan perbedaan kekuatan toksisitas nilai LC50 berturut-turut adalah 0,8351 mcg/ml, 2,5573 mcg/ml, 51,7965
mcg/ml dan 12,2744 mcg/ml.
5.2. Saran
a. Peneliti selanjutnya agar melakukan uji toksisitas dari beberapa jenis teripang yang berbeda
DAFTAR PUSTAKA
Anderson, J. E., Goetz C.M., Mc Laughlin J. L. 1991. A Blind Comparison of Simple Bench-top Bioassay and Human Tumor Cell Cytotoxicities as Antitumor Prescrenss. Natural Product Chemistry. Elseiver. Amsterdam. Anonim. (2003). Pembenihan Teripang Pasir (Holothuria scabra). Lampung :
Departemen Kelautan dan Perikanan. Hal. 1.
Amin, M.F., Yoswaty, D., dan Nurachmi, I. (2014). Daya Antibakteri Ekstrak Teripang Pasir (Holothuria scabra) Terhadap Pertumbuhan Bakteri (Salmonella typhi) Secara In Vitro.
Bachtiar, Y. (2003). Menghasilkan Pakan Alami Untuk Ikan Hias. Depok : Agromedia Pustaka. Hal. 17-18.
Bassett, J., Denney, R.C., Jeffrey, G.H., dan Mendham, J. (1994). Buku Ajar Vogel : Kimia Analisis Kuantitatif Anorganik. Edisi 4. Jakarta : EGC. Hal. 165.
Bordbar, S., Anwar, F., dan Saari, N. (2011). High-Value Components and Bioactives from Sea Cucumbers for Functional Foods - A Review. Mar Drugs. 9(10).
Cahyaningsih, S.D. (2012). Praktikum Fraksinasi. Dalam situs http://sdcahyaningsih.blogspot.com. Diakses tanggal 1 Agustus 2015. Depkes, RI. (1979). Farmakope Indonesia. Edisi ketiga. Jakarta : Direktorat
Jenderal Pengawas Obat dan Makanan. Hal. 649.
Depkes, RI. (1995). Materia Medika Indonesia. Jilid VI. Jakarta : Direktorat Jenderal Pengawas Obat dan Makanan. Hal. 302-306, 321-325, 336.
Depkes, RI. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta : Direktorat Jenderal Pengawas Obat dan Makanan. Hal. 10-11.
Kurniawan, H. (2012). Uji Toksisitas Akut Ekstrak Metanol Daun Kesum (Polygonum minus Huds) Terhadap Larva Artemia salina Leach dengan Metode Brine Shrimp Lethality Test (BSLT). Skripsi. Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan. Pontianak : Universitas Tanjungpura.
Martoyo, J., Aji, N., dan Winanto, T. (2006). Budidaya Teripang. Jakarta : Penebar Swadaya. Hal. 20.
Meyer, U.N., N.R. Ferigni, J.E. putnam, L.B. Ja Cobsen, D.E. Nichols, dan J.L. McLaughlin. (1982). Brine Shrimp : A Convenient General Bioassay For Active Plant Constituents. Planta Medica. 45: 31-34.
Muaja, A.D., Kolengan, H.S.J., dan Runtuwene, M.R.J. (2013). Uji Toksisitas dengan Metode BSLT dan Analisis Kandungan Fitokimia Ekstrak Daun Soyogik (Saurauia bracteosa DC) dengan Metode Soxhletasi. Jurnal MIPA UNSRAT. Hal. 117.
Nurhayati, A.P.D., Abdulgani, N., dan Febrianto, R. (2006). Uji Toksisitas Ekstrak Eucheuma Alvarezii Terhadap Artemia salina Sebagai Studi Pendahuluan Potensi Antikanker. Akta Kimindo. 2(1).
Podolak, I., Galanty, A., dan Sobolewska, D. (2010). Saponins As Cytotoxic Agents : A Review. Phytochem Rev. 9(3).
Pranoto, E.N., Ma’ruf, W.F., dan Pringgenie , D. (2012). Kajian Aktivitas Bioaktif Ekstrak Teripang Pasir (Holothuria scabra) Terhadap Jamur
Candida albicans. Jurnal Pengolahan dan Bioteknologi Hasil Perikanan. 1(1): 1.
Purcell, W.S., Samyn,Y., dan Conand,C. (2012). Commercially Important Sea Cucumbers Of The World. Rome : FAO Fish Finder. Hal. 38.
Rasyid, A. (2012). Identifikasi Senyawa Metabolit Sekunder Serta Uji Aktivitas Antibakteri dan Antioksidan Ekstrak Metanol Teripang Stichopus hermanii. Jurnal Ilmu dan Teknologi Kelautan Tropis. 4(2): 360.
Rasyid, A. (2013). Aktivitas Antibakteri dan Toksisitas Stichopus sp. Jurnal Ilmu dan Teknologi Kelautan Tropis.
Reskiyanti, T. (2013). Uji Toksisitas Ekstrak Teripang Holothuria scabra
Terhadap Artemia salina.Skripsi. Makasar : Universitas Hasanuddin. Robinson, T. (1995). Kandungan Organik Tumbuhan Tinggi. Bandung : Penerbit
ITB. Hal. 157.
Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta : Pustaka Pelajar. Hal. 46-47.
Tobing, C.N. (2015). Karakterisasi dan Uji Efek Ekstrak Etanol Teripang Jenis
Wibowo, S., Yunizal., Setiabudi, E., Erlina, M.D., dan Tazwir. (1997). Teknologi Penanganan dan Pengolahan Teripang (Holothuroidea). Jakarta : Pusat Penelitian dan Pengembangan Perikanan. Hal. 2-5.
Wibowo, S., Sediadi, B., Dwi, TH., dan Syamdidi. (2013). Artemia Untuk Pakan Ikan dan Udang. Jakarta : Penebar Swadaya. Hal. 67.
Widodo, A. (2013). Budidaya Teripang Khasiat dan Cara Olah Untuk Pengobatan. Yogyakarta : Pustaka Baru. Hal. 19.
Wu, C. (2014). An Important Player In Brine Shrimp Lethality Bioassay : The Solvent. J Adv Pharm Technol Res. 5(1).
WHO. (1998). Quality Control Methods For Medicinal Plant Materials. Switzerland. Hal. 31-33.
Zhang, Y.S., H.Y. Yi., dan H.F. Tang. (2006). Cytotoxic Sulfated Triterpene Glycosides From The Sea Cucumber Pseudocolochirus violaceus.
Lampiran 2. (Lanjutan) Gambar simplisia teripang Pearsonothuria graeffei
Lampiran 2. (Lanjutan) Gambar serbuk simplisia teripang Pearsonothuria graeffei
Lampiran 3. Gambar mikroskopik serbuk simplisia teripang Pearsonothuria graeffei (Semper, 1868) perbesaran 10 x 40
1
2
3
Keterangan :
1. spikula bentuk kancing (buttons)
Lampiran 7. Perhitungan penetapan kadar abu total serbuk simplisia teripang
1. Sampel 1
Berat sampel = 2,016 g Berat abu = 0,583 g
% kadar abu = 0,583 g
2,016 gx 100%
= 28,92 % 2. Sampel 2
Berat sampel = 2,007 g Berat abu = 0,629 g
% kadar abu = 0,629g
2,007 gx 100%
= 31,34 % 3. Sampel 3
Berat sampel = 2,012 g Berat abu = 0,523 g
% kadar abu = 0,523 g
2,012 gx 100%
= 25,99 %
Kadar abu total rata-rata = kadar 1 kadar 2 kadar 3
3
= 28,92 31,34 25,99
3
= 28,75 % % Kadar abu
=
Berat abu (g)Lampiran 8. Perhitungan penetapan kadar abu tidak larut asam serbuk simplisia
teripang
1. Sampel 1
Berat sampel = 2,016 g Berat abu = 0,06 g
% kadar abu = 0,06 g
2,016 gx 100%
= 2,98 % 2. Sampel 2
Berat sampel = 2,007 g Berat abu = 0,091 g
% kadar abu = 0,091 g
2,007 gx 100%
= 4,53 % 3. Sampel 3
Berat sampel = 2,012 g Berat abu = 0,07 g
% kadar abu = 0,07 g
2,012 gx 100%
= 3,48 %
Kadar abu tidak larut asam rata-rata = kadar 1 kadar 2 kadar 3
3
= 2,98 4,53 3,48
3
= 3,66 % % Kadar abu
=
Berat abu (g)Karakterisasi simplisia meliputi :
Lampiran 9. Bagan kerja pengolahan teripang
Dibersihkan isi perutnya
Dicuci dari pengotornya hingga bersih, tiriskan Ditimbang berat basah (2600 g)
Dipotong kecil-kecil (± 2x2 cm) Dikeringkan dalam lemari pengering
Ditimbang berat keringnya (775 g) Diperiksa organoleptis dan makroskopis Dihaluskan dengan blender
1. Pemeriksaan makroskopik 2. Pemeriksaan mikroskopik 3. Penetapan kadar air
4. Penetapan kadar sarilarut air 5. Penetapan kadar sari larut
etanol
6. Penetapan kadar abu total 7. Penetapan kadar abutidak
Lampiran 10. Bagan pembuatan ekstrak etanol teripang
Dimasukkan dalam wadah kaca
Dimaserasi dengan etanol selama 3 jam
Dipindahkan kedalam perkolator Dituang pelarut etanol secukupnya
sampai terdapat selapis larutan penyari diatas serbuk simplisia Ditutup mulut perkolator dengan
aluminium foil dan dibiarkan 24 jam Dibuka kran dan cairan perkolat dibiarkan menetes dengan kecepatan 20 tetes per menit dan ditampung dalam botol berwarna bening
Dihentikan perkolasi jika 500 mg filtrat terakhir tidak meninggalkan noda saat diuapkan
Diuapkan filtrat yang telah ditampung dengan menggunakan
rotary evaporator
400 g serbuk simplisia
Ekstrak kental etanol