OPTIMASI PRODUKSI PENISILIN ASILASE (PAc)
MENGGUNAKAN B. megaterium MS941 REKOMBINAN
YANG MENGANDUNG GEN pac DARI B. thuringiensis BGSC
BD1 DENGAN METODE RESPON PERMUKAAN
FENTRI PARAMITHA PUTRI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Optimasi Produksi Penisilin Asilase (PAc) Menggunakan B. megaterium MS941 Rekombinan yang Mengandung Gen pac dari B. thuringiensis BGSC BD1 dengan Metode Respon Permukaan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
Fentri Paramitha Putri
RINGKASAN
FENTRI PARAMITHA PUTRI. Optimasi Produksi Penisilin Asilase (PAc) Menggunakan B. megaterium MS941 Rekombinan yang Mengandung Gen pac
dari B. thuringiensis BGSC BD1 dengan Metode Respon Permukaan. Dibimbing oleh KHASWAR SYAMSU dan ASTUTIATI NURHASANAH
Penisilin asilase (PAc, EC 3.5.1.11) adalah enzim yang sangat berperan dalam reaksi hidrolisis benzilpenisilin untuk menghasilkan asam 6-amino penisilanat (6-APA) yang merupakan bahan dasar antibiotika penisilin semisintetis. Ukuran gen btpac-bd1 hasil amplifikasi PCR adalah 2397 bp. Respon surface methodology (RSM) atau metode permukaan respon dengan menggunakan dua variabel yang ditambahkan di media produksi, yaitu dengan xilosa sebagai induser dan CaCl2 sebagai kation divalent, telah digunakan untuk mendapatkan
aktivitas dan aktivitas spesifik enzim PAc maksimal oleh B. megaterium
btpacBD1. Untuk dapat mencapai tujuan ini, kombinasi lima tingkat konsentrasi xilosa (dengan rentang 0.13% s.d 0.87%) dengan lima tingkat konsentrasi CaCl2
(dengan rentang 0.64 mM s.d 4.36 mM) sebanyak 22 percobaan telah diujicobakan.
Kultivasi batch dilakukan menggunakan labu erlenmeyer kocok pada suhu 28°C agitasi 180 rpm selama 48 jam kultivasi dengan volume kerja 100 mL dan 100 µL tetrasiklin sebagai media seleksi. Setiap percobaan diinokulasi dengan 10% inokulum dengan OD578nm sebesar 0.6 – 0.8 (Rajendhran et al. 2002).
Pemisahan enzim dari media kultivasi dilakukan dengan sentrifugasi suhu 4°C 6000 rpm selama 15 menit. Aktivitas enzim PAc pada ekstrak enzim kasar diuji dengan metode Balasingham et al. (1972). Penentuan kadar protein menggunakan metode Bradford (1976) mengggunakan Bovine Serum Albumin sebagai standar. Aktivitas spesifik adalah jumlah unit enzim per milligram protein. Hasil komposisi media optimal diujicoba pada bioreaktor skala 10 Liter dengan volume kerja 5 Liter.
Metode Central Composite Design (CCD) yang digunakan untuk menganalisa pengaruh antara kombinasi xilosa dan CaCl2 ketika B. megaterium
btpacBD1 dikultivasi pada skala labu erlenmeyer menunjukkan bahwa xilosa dan CaCl2 memberikan pengaruh yang nyata terhadap aktivitas PAc dari B. megaterium btpacBD1 dan model kuadratik dipilih berdasarkan hasil percobaan dengan (R2=0.86 (nilai p < 0.0001)). Aktivitas spesifik PAc tertinggi tercapai dan saat konsentrasi xilosa dan CaCl2 0.49% dan 2.40 mM pada pH medium sekitar 7.
SUMMARY
FENTRI PARAMITHA PUTRI. Optimization for Penicillin acylase (PAc) Production by Recombinant B. megaterium MS941 containing pac gene from B. thuringiensis BGSC BD1 using Response Surface Methodology Supervised by KHASWAR SYAMSU and ASTUTIATI NURHASANAH
Penicillin G acylase (Penicillin amidohydrolase EC 3.5.1.11/ PAc) catalyzes the conversion of benzylpenicillin, via hydrolysis of the amide bond in the benzylpenicillin side chain, releasing phenylacetic acid and 6-aminopenicillanic acid (6-APA). 6-APA is a key intermediate in the production of various semisynthetic penicillins. The size of btpac-bd1 gene from PCR amplification was 2397 bp. Respon surface methodology (RSM) with two variables added to the production medium, i.e. xylose as inducer and CaCl2 as divalent cations, were
used to obtain the optimum and specific activity of PAc produced by Bacillus megaterium btpacBD1. For this purpose, five different xylose concentrations (ranging from 0.13% to 0.87%) and five different CaCl2 concentration (ranging
from 0.64 mM to 4.36 mM) were analysed in combinations, in a total of 22 experiments.
Batch cultivation was carried out with agitation at 28°C at 180 rpm for 48 hours
in 500 mL buffeled erlenmeyer flasks containing 100 mL of cultivation medium.
Each flask was then inoculated with 10% (v⁄v) inoculum with initial OD578nm
between 0.6 to 0.8 (Rajendhran et al. 2002).To harvest,culture was centrifuged at 4°C and 6000 rpm for 15 min. The PAc activity in the clear supernatant was assayed according to the Balasingham et al. method (1972). Protein assay was performed according to the Bradford method (1976) using bovine serum albumin as protein standard. Specific activity of PAc was expressed as units per mg protein. The optimum medium composition was applied in the scaled up fermentation using a 10 Liter bioreactorwith working volume 5 Liter.
Central composite design used for the analysis of treatment combinations showed that when B. megaterium strain btpacBD1was cultivated in shake flasks, xylose and CaCl2 had significant effects on PAc volumetric activity and the quadratic model was in good agreement with the experimental results (R2= 0.86 (p-value < 0.0001)). The maximum specific activity was reached when xylose and CaCl2 concentrations were 0.49% and 2.4 mM, respectively, and medium pH around 7. Under such conditions, the activity of PAc achieved was 1.318 ± 0.406 U/mL with protein concentration 0.0101 ± 0.01 mg/mL and spesific activity 130.669 ± 50.241 U/mg protein. The validation experiment in shake flasks demonstrated that with such medium composition the volumetric activity achieved was 1.294 ± 0.171 U/mL with protein concentration 0.0102 ± 0.0003 mg/mL and spesific activity of PAc 125.91 ± 13.309 U/mg. The optimum medium composition was applied in 10 L bioreactor. The optimum volumetric activity (2.0687 ± 0.0820 U/mL) and protein concentration (0.0078 ± 0.0008 mg/mL) were achieved 48 h after the start of the cultivation. However, the optimum PAc specific acivity (1260.52 ± 27.5711 U/mg protein) was achieved 18 h after the start of the cultivation.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
OPTIMASI PRODUKSI PENISILIN ASILASE (PAc)
MENGGUNAKAN B. megaterium MS941 REKOMBINAN
YANG MENGANDUNG GEN pac DARI B. thuringiensis BGSC
BD1 DENGAN METODE RESPON PERMUKAAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Optimasi Produksi Penisilin Asilase (PAc) Menggunakan B. megaterium MS941 Rekombinan yang Mengandung Gen pac dari
B. thuringiensis BGSC BD1 dengan Metode Respon Permukaan Nama : Fentri Paramitha Putri
NIM : P051114041
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Khaswar Syamsu, MScSt Ketua
Dr rer nat Astutiati Nurhasanah Anggota
Diketahui oleh
Ketua Program Studi Bioteknologi
Prof Dr Ir Suharsono, DEA
Tanggal Ujian: (22 Agustus 2014)
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2013 ini ialah optimasi produksi enzim, dengan judul Optimasi Produksi Penisilin Asilase (PAc) Menggunakan B. megaterium MS941 Rekombinan yang Mengandung Gen pac
dari B. thuringiensis BGSC BD1 dengan Metode Respon Permukaan.
Terima kasih penulis ucapkan kepada Bapak Prof. Dr. Ir. Khaswar Syamsu, MSc.St dan Ibu Dr. rer. nat Astutiati Nurhasanah selaku pembimbing, Ibu Dr. Ir, Mulyorini Rahayuningsih, M.Si. selaku dosen penguji, serta Ibu Dr. Niknik Nurhayati yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Ibu Dr. Is Helianti, M.Sc dan Ibu Dr. Budiasih Wahyuntari, M.Sc. beserta staff Laboratorium Teknologi Bioindustri (Biologi Molekuler non Virus dan Fermentasi) dan staff Laboratorium Bioteknologi (Recovery dan Fermentasi) dari Badan Pengkajian dan Penerapan Teknologi, yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada ayah, mama, adik-adik, mas galih, muti, sara serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
2 TINJAUAN PUSTAKA 5
3 METODE 9
Bahan 9
Alat 10
Prosedur Analisis Data 11
4 HASIL DAN PEMBAHASAN 15
Hasil 16
Pembahasan 25
5 SIMPULAN DAN SARAN 34
Simpulan 34
Saran 34
DAFTAR PUSTAKA 34
LAMPIRAN 40
DAFTAR TABEL
1. Penelitian produksi PAc 8
2. Rancangan percobaan Central Composite Design dengan dua faktor 13 3. Simbol faktor dan level yang digunakan pada Central Composite Design 13
DAFTAR GAMBAR
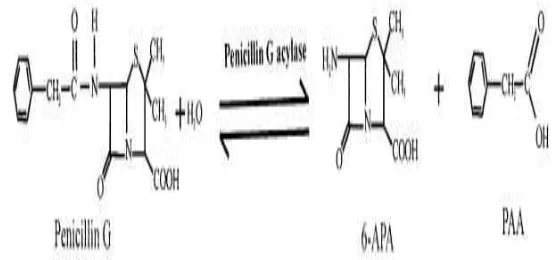
1. Reaksi hidrolisis penisilin G dengan enzim PAc (Rajendhran et al. 2004) 5
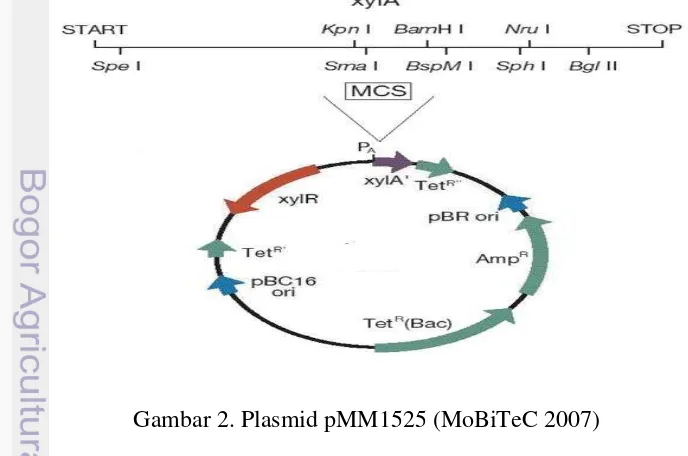
2. Plasmid pMM1525 (MoBiTeC 2007) 6
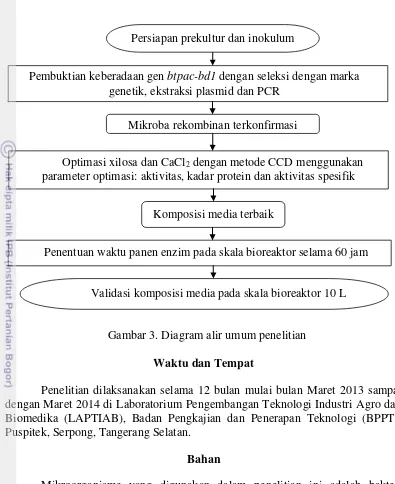
3. Diagram alir umum penelitian 9
4. Koloni tunggal B. megaterium btpacBD1 pada media seleksi 16 5. Hasil visualisasi plasmid pMMbtpac-bd1 hasil ekstraksi koloni
tunggal B. megaterium btpacBD1. 1: Marker 1 kb; 2: Kontrol positif; 3: Kontrol negatif (air); 4: Plasmid pMMbtpac-bd1 hasil ekstraksi 17 6. Hasil visualisasi gen btpac-bd1 hasil PCR dari plasmid hasil ekstraksi
koloni tunggal B. megaterium btpacBD1. 1: Marker 1 kb; 2: Kontrol negatif (air); 3: Kontrol positif; 4: Gen btpac-bd1 hasil PCR. 17 7. Pengaruh xilosa dan CaCl2 dengan level variabel terkodekan terhadap
aktivitas PAc 19
8. Pengaruh xilosa dan CaCl2 dengan level terkodekan terhadap aktivitas
spesifik PAc 20
9. Kurva pertumbuhan B. megaterium btpacBD1 dan aktivitas PAc dalam media optimal pada 28°C dengan aerasi 1.0 vvm dan agitasi
150 rpm selama 60 jam. 21
10. Kurva pertumbuhan B. megaterium btpacBD1 22 11. Grafik hubungan antara rerata aktivitas enzim PAc dengan waktu 22 12. Grafik hubungan antara rerata kadar protein dengan waktu 23 13. Grafik hubungan antara rerata aktivitas spesifik enzim PAc dengan
waktu 23
14. Kurva pertumbuhan B. megaterium btpacBD1( ) dan aktivitas PAc (A) kadar protein (B) dan aktivitas spesifik PAc (C) dalam media optimal pada 28°C dengan aerasi 1.0 vvm dan agitasi 150 rpm selama
48 jam. 24
DAFTAR LAMPIRAN
1. DNA marker 1 kb dan Oligonucleotide primer xyl3 dan xyl 4 40
2. Sekuens xylA 41
3. MCS plasmid pMM1525 42
4. Data pengukuran kurva standar 6-APA 43
5. Data pengukuran kurva standar protein Bovine Serum Albumin 44 6. Data hasil Analisa Respon pada Optimalisasi menggunakan Central
Composite Design 45
7. Perhitungan statistik data hasil optimasi dengan aktivitas sebagai
respon 46
8. Perhitungan statistik data hasil optimasi dengan kadar protein 48 9. Perhitungan statistik data hasil optimasi dengan aktivitas spesifik
sebagai respon 49
10. Hasil optimalisasi media produksi enzim PAc oleh B. megaterium
btpacBD1 51
11. Data hasil analisa verifikasi komposisi media optimal 52 12. Data hasil analisa OD sel, aktivitas, kadar protein dan aktivitas
spesifik enzim PAc selama 60 jam pada skala bioreaktor 53 13. Data hasil analisa OD sel, aktivitas, kadar protein dan aktivitas
DAFTAR SINGKATAN
6 APA : Asam 6-aminopenilsilanat CCD : Central Composite Design
LPS : Lipopolisakarida
Larutan CI : Larutan Chloroform Isoamyl alcohol
Larutan PCI : Larutan Phenol Chloroform Isoamyl alcohol
Larutan PDAB: Larutan p-dimethylamino-benzaldehyde
LB : Luria Bertani
LB cair-tet : Luria Bertani cair yang ditambah 1% tetrasiklin (12.5 mg/mL) LB padat-tet : Luria Bertani padat yang ditambah 1% tetrasiklin (12.5 mg/mL) MCS : Multiple Cloning Site
OD : Optical Density
PAc : Penicillin Acylase/ Penisillin Asilase PCR : Polymerase Chain Reaction
Pen-G : Penisilin G
pMMbtpac-bd1 : Plasmid pMM1525 rekombinan yang disisipkan gen btpac-bd1
RSM : Response Surface Methodology
Tc : Tetracyclin
XylA : Promotor Xilose A
1 PENDAHULUAN
Latar Belakang
Antibiotika yang paling banyak digunakan (sekitar 19% dari pasar antibiotik dunia) adalah penisilin G (Pen-G) (Parmar et al. 2000). Pen-G bekerja dengan menghambat kerja enzim transpeptidase sehingga pembentukan peptidoglikan dinding sel bakteri tidak terjadi pada fase produksi (Madigan et al. 2003). Saat ini penggunaan penisilin telah mengarah pada resistensi patogen karena digunakan dalam jumlah besar dan secara terus-menerus. Beberapa penelitian menunjukkan bahwa bakteri patogen dapat memproduksi enzim β-laktamase yang mampu menghidrolisis cincin β-laktam menjadi penisilin yang tidak aktif/ penicilloic acid (Navarro et al. 2004). Selain itu, pen-G merupakan antibiotik yang sensitif terhadap β-laktamase dan tidak stabil terhadap asam sehingga menimbulkan alergi pada beberapa penggunanya (Madigan et al. 2005). Oleh karena itu, dikembangkan antibiotik-antibiotik turunan pen-G melalui modifikasi struktur penisilin dengan membentuk produk penisilin semisintetik yang memiliki sifat-sifat yang lebih baik dari pada penisilin alami agar efektifitas antibiotik ini dapat diperoleh kembali (Wilson 1982; Hammond 1978).
Dalam industri, enzim yang dapat menghidrolisis Pen-G adalah penicillin G acylase (PGA) atau penisilin asilase (PAc) yang bekerja dengan memutus ikatan amida pada rantai samping sehingga menghasilkan inti molekul penisilin atau asam 6-aminopenilsilanat (APA) (Wilson 1982; Greenwood 1995). Zat 6-APA merupakan bahan baku utama untuk produksi penisilin semisintetik seperti metilsilin, ampisilin dan amoksisilin serta inhibitor β-laktamase (asam klavulanat) (Wilson 1982). Ampisilin dan amoksisilin adalah antibiotik yang dapat bekerja pada membran sel bakteri gram positif maupun negatif. Zat 6-APA dapat diproduksi melalui proses fermentasi, hidrolisis penisilin secara kimiawi, dan enzimatik. Proses hidrolisis pen-G menjadi 6-APA menggunakan enzim PAc dijadikan pilihan karena mudah dilakukan dan paling menguntungkan (Crueger dan Crueger 1984; Shewale dan Sivaraman 1989; Carrington 1971).
Langkah awal yang dilakukan untuk menghidrolisis pen-G menjadi 6-APA diperlukan enzim PAc. Peningkatan produksi PAc banyak dilakukan melalui optimasi rekayasa genetika dan optimasi bioproses berdasarkan komposisi media atau kondisi kultivasi. Penggunaan teknik rekayasa genetika telah berhasil mengembangkan strain yang menghasilkan PAc dalam jumlah besar, yaitu dengan teknologi DNA rekombinan dengan cara kloning gen pac ke dalam plasmid. Teknologi DNA rekombinan memungkinkan untuk mengubah urutan-urutan tertentu yang berkaitan dengan pengendalian ekspresi gen secara tepat dan terarah.
Bakteri gram negatif penghasil enzim PAc adalah Escherichia coli (Cole 1969), Kluyvera citrophila (Barbero et al. 1986), Providencia rettgeri (Proteus rettgeri) (Klei et al. 1995) dan Alcaligenes faecalis (Verhaert et al. 1997). Sedangkan bakteri gram positif berasal dari golongan Arthrobacter viscosus
(Ohashi et al. 1989) dan Bacillus megaterium (Chiang dan Bennet 1967). Selain
2
penyandi enzim PAc. Hasil analisa mikrobiologi menggunakan Serratia mercescens menunjukkan keempat galur B. thuringiensis tersebut menghasilkan enzim PAc yang mampu menguraikan Pen-G (Nurhayati 2009).
Namun bakteri yang memproduksi enzim PAc secara komersial adalah
E.coli dan B. megaterium (Vandamme dan Voets 1974). B. megaterium dengan aktivitas protease ekstraseluler yang relatif rendah telah dikembangkan sebagai sel inang untuk produksi protein rekombinan (Wittchen dan Meinhart 1995). Berbeda dengan ekspresi protein rekombinan pada E. coli yang biasanya terjadi secara intraseluler, ekspresi pada B. megaterium dapat dilakukan secara ekstraseluler, menggunakan vektor ekspresi yang tepat (misalnya yang dilakukan oleh Malten et al. 2006). Berbeda dengan ekspresi intraseluler di E. coli, proses panen dilakukan dengan sentrifugasi dingin karena sekresi protein langsung ke media kultivasi sehingga tahap lisis sel dengan sonikasi seperti pada E.coli tidak perlu dilakukan (Hammond 1978). Kekurangan E. coli lain adalah keberadaan lipopolisakarida (LPS) sebagai salah satu komponen membran luar pada bakteri gram negatif yang bersifat racun bagi manusia (endotoksin).
Kloning gen pac diamplifikasi dari DNA genom B. thuringiensis BGSC BD1. Produk amplifikasi Polymerase Chain Reaction (PCR) yaitu gen btpac-bd1
disisipkan ke DNA plasmid pMM1525 dengan menghilangkan sinyal peptida di dalam plasmid. Hal ini dilakukan karena berdasarkan urutan DNA gen btpac-bd1, diduga enzim PAc yang dihasilkan telah memiliki sinyal peptida sendiri yang mengarahkan untuk sekresi protein rekombinan keluar sel. Hasil konstruksi plasmid rekombinan diberi nama pMMbtpac-bd1 (Nurhayati 2009).
Menurut Yang et al. (2006), B. megaterium YYBm1 menghasilkan PAc tertinggi dengan penambahan xilosa 0.5% dan 2.5 mM CaCl2. Pemanfaatan
xilosa dapat mendorong promotor xylA untuk meningkatkan produksi enzim rekombinan yang lebih tinggi (Yang et al. 2006). Ion Ca2+ merupakan kation bivalen yang merupakan modulator positif yang menyebabkan perubahan konformasi sisi katalitik enzim, yang mempermudah interaksi dengan substrat sehingga meningkatkan aktivitas katalitik enzim (Susanti 2003). Kasche et al.
(2005) menambahkan bahwa Ca2+ adalah kofaktor untuk transportasi membran. Perbedaan penelitian ini dengan penelitian Yang et al. (2006) salah satunya adalah metode penelitian. Berbeda dengan penelitian Yang et al. (2006) yang melakukan penelitian dengan metode diskrit dengan melakukan percobaan berulang-ulang, penelitian ini menggunakan teknik optimasi menggunakan metode permukaan respon (Response Surface Methodology atau RSM) melalui
software Design-Expert yang menggunakan bantuan model statistika dan matematika untuk mengetahui respon dari kombinasi yang dilakukan. Oleh karena itu, permasalahan utama dalam penelitian ini adalah belum diperolehnya konsentrasi xilosa dan CaCl2 serta waktu kultivasi optimal pada produksi PAc.
3 Perumusan Masalah
Berdasarkan uraian pada latar belakang, maka dapat dirumuskan permasalahan sebagai berikut :
1. Apakah kultur stok bakteri B. megaterium btpacBD1 masih mengandung gen
bt-pacbd1
2. Bagaimana pengaruh besarnya kombinasi konsentrasi xilosa dan CaCl2
terhadap kultivasi produksi enzim PAc rekombinan
3. Bagaimana pengaruh komposisi media terpilih saat dilakukan kultivasi pada skala bioreaktor
4. Kapan waktu kutivasi terbaik untuk proses panen enzim PAc Tujuan Penelitian
Penelitian ini bertujuan untuk: 1. Mendeteksi keberadaan gen btpac-bd1
2. Mendapatkan komposisi media kultivasi optimal untuk produksi enzim PAc rekombinan berdasarkan konsentrasi xilosa dan CaCl2 dengan metode Central Composite Design (CCD)
3. Memproduksi enzim PAc rekombinan pada skala bioreaktor 4. Mendapatkan waktu panen enzim PAc terbaik
Manfaat Penelitian
Manfaat penelitian ini adalah untuk menghasilkan enzim PAc rekombinan yang dapat menghidrolisis antibiotik Pen-G sehingga menghasilkan zat 6-APA yang dapat digunakan sebagai bahan baku pembuatan penisilin semisintetik yang memiliki sifat dan kualitas yang lebih baik dari penisilin alami.
Ruang Lingkup Penelitian
Ruang lingkup penelitian seleksi dan optimasi media kultivasi untuk produksi enzim PAc oleh B. megaterium btpacBD1 rekombinan adalah sebagai berikut:
1. Penyiapan inokulum meliputi peremajaan sel pada media Luria Bertani padat yang ditambahkan tetrasiklin (12.5 mg/mL) sebanyak 1% (LB padat-tet) dan persiapan prekultur pada media LB cair-tet sebagai media seleksi. 2. Pembuktian keberadaan gen btpac-bd1 dilakukan dengan seleksi B.
megaterium btpacBD1 dengan marka genetik, ekstraksi plasmid pMMbtpac-bd1 dan Polymerase Chain Reaction (PCR)
3. Kultivasi produksi PAc menggunakan metode CCD dilakukan di inkubator kocok di dalam baffled erlenmeyer 500 mL dengan volume kerja 100 mL LB cair-tet (pH 7) pada suhu 28oC dan agitasi 180 rpm selama 48 jam. 4. Kultivasi produksi PAc dengan bioreaktor berkapasitas 10 liter dengan
volume kerja 5 Liter media hasil optimasi CCD (pH 7) pada suhu 28oC dan agitasi 150 rpm dengan aerasi 1 vvm selama 60 dan 48 jam.
4
2 TINJAUAN PUSTAKA
Penisilin G
Penisilin G (Pen-G) dikenal sebagai benzilpenisilin yang merupakan substrat dari enzim PAc untuk pengujian aktivitas enzim. Pen-G berbentuk garam kalium atau natrium yang berupa bubuk putih sampai sedikit kuning, tidak berbau, agak higroskopis relatif stabil di udara. Penisilin dapat menjadi non aktif apabila terkena pengaruh panas, sistein, NaOH, penicilinase (enzim yang terdapat dalam banyak bakteri yang dapat merusak penisilin) dan asam hidroklorat. Zat lain yang dapat merusak Penisilin antara lain adalah logam-logam berat seperti Cu, Ag, Fe, dan Zn (Sarah 2002).
Pen-G merupakan suatu antibiotika yang tidak dapat diberikan melalui mulut karena sifatnya yang tidak stabil dengan asam hidroklorat di lambung, bekerja pada lingkup kerja yang sempit (hanya efektif pada bakteri gram positif). Bakteri patogen yang resisten terhadap pen-G adalah Staphylococcus, Streptococcus, Enterococcus, Pneumococcus, B. antrachis, B. substilis, B. diptheria, Listeria monocytogenes, Clostridia, Gonococcus dan Meningococcus
(Wattimena et al. 1991) dan juga dapat menimbulkan alergi gatal-gatal serta reaksi efek samping yang menyebabkan penyakit (diare dan superinfeksi dari kandidiasis). Selain itu pen-G juga sangat sensitif terhadap enzim β-laktamase yang dapat memutus ikatan pada cincin β-laktam. Sifat dari antibiotika ini akan hilang jika cincin terputus karena β-laktamase, karena proses penghambatan enzim transpeptidase pada pembentukan lapisan peptidoglikan dinding sel bakteri tidak dapat terjadi. Selain itu, munculnya resistensi bakteri terhadap antibiotika dipengaruhi oleh adanya gen resistensi yang terdapat dalam plasmid, transposon, atau dalam kromosom bakteri (Morin dan Gorman 1995; Madigan et al. 2003). Penisilin Asilase (PAc, EC 3.5.1.11)
Penisilin asilase (PAc) dikenal sebagai penisilin amidase, penisilin transferase dan penisilin amidohidrolase dengan nomor golongan enzim (EC 3.5.1.11) Berdasarkan jenis substrat yang dihidrolisis, enzim ini terbagi menjadi: (1) penisilin G asilase yaitu dengan substrat benzilpenisilin; (2) penisilin V asilase yaitu dengan substrat fenoksimetilpenisilin; (3) Ampisilin asilase yaitu dengan substrat D-α aminobenzilpenisilin (ampisilin). Enzim ini dapat dihasilkan oleh E. coli secara intraselular. Pada gram positif enzim ini dihasilkan oleh B. megaterium
5
Gambar 1. Reaksi hidrolisis penisilin G dengan enzim PAc (Rajendhran et al. 2004)
Xilosa
Xilosa disebut gula kayu karena merupakan senyawa gula yang pertama kali diisolasi dari kayu. Rumus kimia xilosa adalah C5H10O5 dengan berat molekul
150,13 g/mol dan titik leleh 144 – 145°C. Xilosa merupakan salah satu penyusun utama dari hemiselulosa, yang terkandung sekitar 30% dalam tanaman. D-xilosa dapat diperoleh melalui hidrolisis hemiselulosa (xilan) baik secara enzimatis maupun asam. Xilosa diklasifikasikan sebagai monosakarida tipe aldopentosa yang memiliki 5 atom karbon dan satu gugus aldehid.
Kalsium klorida (CaCl2)
Kalsium klorida merupakan tipe ion halida yang terdiri dari kalsium (Ca) dan klorin (Cl). Garam ini berwarna putih, tidak berbau, tidak berwarna dan tidak mudah terbakar. Kalsium klorida dapat berfungsi sebagai sumber ion kalsium dalam larutan yang mudah larut dalam air (tidak seperti senyawa kalsium lain). Zat ini dapat berguna untuk menggantikan ion dari larutan. Hasil penelitiam Yang
et al. (2006) menunjukkan bahwa penambahan CaCl2 sebesar 2.5 mM akan
meningkatkan biomassa dari B. megaterium YYBm1 dan biomassa akan menurun jika ditambahkan CaCl2 sebesar 5 mM. Ion Ca2+ merupakan kation bivalen yang
merupakan modulator positif yang menyebabkan perubahan konformasi sisi katalitik enzim, yang mempermudah interaksi dengan substrat sehingga meningkatkan aktivitas katalitik enzim (Susanti 2003). Hal ini berdasarkan penelitian Duggleby et al. (1995) yang menunjukkan bahwa Ca2+ mempengaruhi formasi dari enzim PAc aktif. Hal ini diperkuat oleh (Kasche et al. 2005: Ignatova
et al. 2005) yang menyatakan bahwa Ca2+ adalah kofaktor untuk translokasi membran yang berperan dalam pelipatan dan pematangan enzim di periplasma. Bacillus megaterium dalam Sistem Ekspresi Protein Rekombinan
6
Kloning gen pac dari DNA B. thuringiensis BGSC BD1 (btpacBD1) dilakukan dengan menyisipkannya ke dalam B. megaterium MS941 menggunakan DNA plasmid pMM1525 untuk membentuk konstruk plasmid DNA rekombinan pMMbtpac-bd1 (Nurhayati 2009). Tahap dasar proses kloning adalah memasukkan fragmen DNA asing dengan ukuran yang spesifik ke dalam vektor dan dimasukkan ke dalam sel inang. Vektor ekspresi memiliki elemen genetik yang dapat mengkontrol proses transkripsi, translasi dan sekresi protein rekombinan yang akan diekspresikan dalam sel inang. Vektor memiliki sekuen pengatur transkripsi dan translasi gen asing untuk dapat mengekspresikan protein rekombinan (Glick dan Pasternak 2003; Sambrook dan Russell 2001).
Plasmid pMM1525 adalah suatu shuttle vector E.coli dan Bacillus yang dirancang untuk mengekspresikan gen asing, sehingga dapat dikenali oleh sel inang B. megaterium. Vektor ini dilengkapi dengan sinyal peptida yang memungkinkan disekresikannya enzim rekombinan keluar sel (ekstraseluler). Selain itu, adanya sekuens 6x His-tag membuat protein rekombinan dapat dideteksi dan dipurifikasi dari hasil ekspresi gen. Plasmid pMM1525 juga mengandung gen xylose-dependent repressor (xylR) yang merupakan gen pengkode protein represor yang akan menghambat transkripsi gen pac jika tidak terdapat xilosa Dengan adanya gen xylR, protein represor yang dihasilkan akan semakin banyak, sehingga pengontrolan ekspresi gen juga akan semakin kuat. Setelah ditambahkan suatu induser yang berupa xilosa, maka xylose repressor
pada plasmid akan dibebaskan dengan menginaktivasi protein represor dengan cara berikatan dengan protein represor tersebut. Protein represor yang tidak aktif tidak dapat berikatan dengan operator sehingga RNA polimerisase sel inang B. megaterium akan mentranskripsi sekuen gen yang berada di bawah sekuen promotor xylA yang memungkinkan terjadinya transkripsi gen pac jika diinduksi oleh xilosa. Hasil transkripsi tersebut kemudian ditranslasi menjadi protein rekombinan yang diinginkan (MoBiTec 2007).
Gambar 2. Plasmid pMM1525 (MoBiTeC 2007)
7 yang dirancang sebagai vektor ekspresi yang baik untuk sel prokariot. Plasmid pMM1525 (Gambar 4) mempunyai : (1) Promotor xlyA (PxlyA)untuk dikenali oleh
RNA polimerase Bacillus megaterium; (2) Sekuen operator xyl untuk meningkatkan pengikatan terhadap protein represor; (3) Gen xylR untuk mengkode protein repressor; (4) Multiple cloning site (MCS) yang dapat didigesti oleh berbagai enzim-enzim restriksi (antara lain BsrGI dan Xmal) sehingga beberapa pilihan enzim tersedia untuk menginsersikan gen pada posisi ini; (5)
Ribosome binding site (RBS) untuk meningkatkan laju translasi; (6) pBR/ColE1 untuk titik replikasi; (7) Gen TetR (Bac) untuk penyandi gen resistensi tetrasiklin
Bacillus; (8) Gen TetR’ , Tet R” untuk gen penyandi resistensi terhadap antibiotik tetrasiklin (9); Gen AmpR untuk gen penyandi resistensi ampisilin; (10) Sekuen purifikasi tag (6xHis, Strep or strep/6xHis-double) untuk deteksi dan purifikasi protein rekombinan yang dihasilkan (MoBiTec 2007).
Produksi Enzim PAc
Mikroorganisme penghasil PAc dapat beradaptasi dengan variasi komposisi media dan parameter kultivasi yang cocok. Untuk mengoptimasi produksi PAc, kondisi kultivasi dengan mengubah parameter yang saling terkait telah dilakukan (Liu et al. 2000; Maresova et al. 2001) dan berbagai komponen yang dibutuhkan seperti nutrien, sumber karbon dan sumber nitrogen juga telah dilakukan di jenis bakteri yang berbeda (Pinotti et al. 2000; Rajendhran et al.
2002, 2003; Yang et al. 2006; Leonita 2013; Putri 2013). Upaya peningkatan produktivitas PAc dari Bacillus megaterium ATCC 14945 masih terus dilakukan salah satunya melalui rekayasa genetika (Panbangred et al. 2000; Yang et al. 2006; Cecchini et al. 2007; Nurhayati 2009).
8
Tabel 1. Penelitian produksi PAc Metode
Penelitian
Bakteri Non Bakteri
Tipe liar Rekombinan Tipe liar
Diskrit Acevedo dan Cooney
Metode optimasi untuk rancangan percobaan statistik yang paling umum digunakan adalah Response Surface Methodology (RSM). Dengan RSM suatu model empiris dibangun berdasarkan data yang diperoleh dari percobaan yang telah dirancang sebelumnya. Central composite design diperkenalkan oleh Box dan Wilson pada tahun 1951 yang merupakan suatu rancangan yang terdiri dari rancangan faktorial tingkat dua dengan dua level (tertinggi dan terendah) ditambah dengan beberapa titik yang memungkinkan untuk meramalkan adanya efek interaksi antar faktor yang dicoba. Kelompok titik tambahan yang pertama disebut starting point yang merupakan matriks bujur sangkar yang diagonal utamanya bernilai ± 2k/4, dimana k adalah jumlah faktor yang dioptimasi. Sedangkan kelompok titik tambahan kedua disebut center point yang merupakan kombinasi dari semua titik tengah faktor yang akan dioptimasi. Central composite design banyak digunakan peneliti untuk merancang percobaan optimasi setelah faktor-faktor yang mempunyai pengaruh terhadap hasil akhir yang diinginkan diketahui melalui percobaan berdasarkan rancangan faktorial yang lain (Box dan Draper 2007).
3
METODE
Ruang lingkup penelitian yang dilakukan meliputi tahap pembuktian keberadaan gen btpac-bd1, persiapan inokulum, optimasi xilosa dan CaCl2 dengan
9
Waktu dan Tempat
Penelitian dilaksanakan selama 12 bulan mulai bulan Maret 2013 sampai dengan Maret 2014 di Laboratorium Pengembangan Teknologi Industri Agro dan Biomedika (LAPTIAB), Badan Pengkajian dan Penerapan Teknologi (BPPT), Puspitek, Serpong, Tangerang Selatan.
Bahan
Mikroorganisme yang digunakan dalam penelitian ini adalah bakteri rekombinan Bacillus megaterium btpacBD1 yang berasal dari kultur koleksi Laboratorium Teknologi Bioindustri (LTB-BPPT).
Bahan yang digunakan pada penelitian ini adalah SET buffer, lisozim. NaOH-SDS segar, kalium asetat 5M dingin, larutan PCI (phenol: chloroform: iso amyl alcohol), larutan CI (chloroform: iso amyl alcohol), larutan isopropanol, etanol 70%, DNAse, gel agarosa 1% dan larutan EtBr.
Mix PCR yang terdiri dari primer xyl 3 10 M, primer xyl 4 10 M, 10x
KAPA Buffer (B) with Mg2+, dNTP, KAPA Tag polymerase, hasil ekstraksi sel dan ddH2O. Komposisi media yang terdiri dariMOPS (pH 7.0), Tricin (pH 7.0),
MgCl2.6H2O, K2SO4, FeSO4.7 H2O, CaCl2, MnCl2.4H2O, NaCl, KCl, NH4Cl,
K2HPO4, glukosa, trace element solution, dan vitamin solution. (NH4)
6Mo7O24.4H2O, H3BO3, CoCl2, CuSO4, MnCl2, ZnSO4, biotin, niacin amida,
p-amino benzoat, Ca-panthotenate, pyridoxal / HCl, folacid, riboflavin, asam DL-6,8-thioctic, tiamin diklorida, MgSO4.7H2O, CaCl2.H2O, NaCl, yeast ekstrak,
Komposisi media terbaik Mikroba rekombinan terkonfirmasi
Pembuktian keberadaan gen btpac-bd1 dengan seleksi dengan marka genetik, ekstraksi plasmid dan PCR
Optimasi xilosa dan CaCl2 dengan metode CCD menggunakan
parameter optimasi: aktivitas, kadar protein dan aktivitas spesifik
Validasi komposisi media pada skala bioreaktor 10 L Persiapan prekultur dan inokulum
Penentuan waktu panen enzim pada skala bioreaktor selama 60 jam
10
tripton, xilosa, agar, dan tetrasiklin dalam etanol 100%, gliserol, garam fisiologis, etanol 95%, aquades, larutan asam asetat 20%, NaOH 50mM, metanol, penisilin G 0.5 M, pDAB (4 Para Dimetil Amino Benzaldehid), larutan buffer Na – fosfat 0.05 M pH 7 dan larutan Bradford (5x).
Alat
Alat yang digunakan dalam penelitian ini adalah Refrigerated Centrifuge
[Hitachi CR226], Rotor RIOA2, Cold Microsentrifuge Sorvall, Fresco, [Hettich Zentrifugen-micro 200R], deep freezer -80°C, Inlab pH meters (USA), Autoclave,
Laminar airflow, Inkubator kocok [GFL dan New Brunswick Scientific], Bioreaktor [Biostat], Spectrophotometer, Mastercycler personal, Electrophoresis,
Milipore dan alat gelas lain.
Prosedur Analisis Data
Pembuktian Keberadaan Gen btpac-bd1
Pembuktian keberadaan gen btpac-bd1 bertujuan untuk mengkonfirmasi mikroba yang digunakan pada penelitian merupakan mikroba rekombinan. Tahap yang dilakukan adalah dengan seleksi Bacillus megaterium btpacBD1 rekombinan dengan marka genetik, ekstraksi plasmid pMMbtpac-bd1 dan Polymerase Chain Reaction (PCR) koloni tunggal B. megaterium btpacBD1.
Seleksi Mikroba Rekombinan dengan Marka Genetik
Seleksi mikroba rekombinan dilakukan untuk mendapatkan koloni tunggal dari kultur seleksi isolat B. megaterium btpacBD1 rekombinan. Selain itu, koloni tunggal juga dapat digunakan untuk membuat kultur stok dalam gliserol 75% dan inokulum. Isolat diambil sebanyak 1 ose dan diinokulasi ke dalam 25 mL media LB padat yang ditambahkan 1% tetrasiklin 12.5 mg/mL (LB-tet padat) sebagai media seleksi menggunakan metode cawan kuadran secara aseptis di laminar air flow. Cawan petri ditutup dan diinkubasi pada 37°C selama 24 jam hingga terbentuk koloni tunggal. Komposisi media per liter terdiri dari 5 g NaCl, 10 g tripton, 5 g yeast ekstrak dan 15 g agar yang dilarutkan dalam air mili-Q (pH 7) (Yang et al. 2006).
Prosedur Deteksi Plasmid Rekombinan pMMbtpac-bd1 dengan Ekstraksi Plasmid (Voskuil dan Cambliss 1993) dan PCR
11 mg lisozim. Lalu 200 µL campuran diambil dan diinkubasi pada 37°C selama 10 menit. Setelah diinkubasi, campuran ditambahkan 350 µL NaOH-SDS segar dan diresuspensi hingga larutan menjadi jernih. Setelah jernih, campuran ditambahkan 350 µL larutan kalium asetat 5M dingin dan divortex selama 10 detik. Kemudian campuran disentrifugasi pada 13000 rpm selama 15 menit. Selanjutnya, 200 µL supernatan diambil dan diekstraksi dengan 200 µL larutan PCI (phenol:chloroform:isoamylalcohol dengan perbandingan 25:24:1). Campuran divorteks selama 1 menit dan disentrifugasi pada 13000 rpm selama 10 menit. Lalu akan terbentuk 3 fase, 70 µL fase bening diambil dan diekstraksi dengan larutan CI (chloroform:isoamylalcohol dengan perbandingan 24:1). Campuran divorteks dan disentrifugasi pada 13000 rpm selama 10 menit. Lalu akan terbentuk 2 fase, 40 µL fase bening diambil dan dipresipitasi dengan 40 µL larutan isopropanol. Kemudian campuran disentrifugasi pada 13000 rpm selama 20 menit. Supernatan dibuang dan endapan yang merupakan DNA plasmid dicuci dengan ethanol 70%. Campuran disentrifugasi pada 13000 rpm selama 5 menit. Supernatan dibuang dan endapan dikeringkan dengan vacuum evaporator selama 10 menit. Setelah endapan kering, DNA plasmid dilarutkan pada 50 µL air mili-Q yang mengandung 20 mg/mL DNAse. DNA plasmid hasil ekstraksi lalu di dielektroforesis pada gel agarosa 1% selama 25 menit. Lalu gel direndam pada larutan EtBr selama 10 menit. Gel dibilas dengan aquades dan hasil visualisasi dilihat. Jika terdapat pita tunggal, DNA plasmid hasil ekstraksi akan diuji selanjutnya dengan uji polymerase chain reaction (PCR).
Hasil ekstraksi plasmid rekombinan selanjutnya di uji PCR menggunakan primer xyl3 (5’-TTA TCC ACC GAA CTA AGT TGC TG-3’) dan primer xyl 4
(5’-TGG AGT GGT GAA TCC GTT AG-3’10 M) untuk mengamplifikasi gen
pac. Komposisi campuran PCR dengan total volume 50 mL mengandung 0.5 µL primer xyl3 10 M, 0.5 µL primer xyl4, 5.0 µL 10x KAPA Buffer (B) with Mg2+, 0.5 µL dNTP, 0.2 µL KAPA Tag polymerase, 2,0 µL hasil ekstraksi sel dan 41.3 µL ddH2O. Tahapan proses amplifikasi menggunakan mesin Thermal Cycler
adalah sebagai berikut: suhu 95°C selama 5 menit (Pre-denaturasi), suhu 94°C selama 1 menit (denaturasi), suhu 61°C selama 30 detik (Annealing/ penempelan), suhu 72°C selama 2 menit (Extension/ pemanjangan) dan suhu 72°C selama 10
Penyiapan inokulum dilakukan untuk mengadaptasi sel bakteri agar siap untuk dikultivasi pada media produksi. Seed culture dibuat dengan menginokulasi satu koloni tunggal hasil peremajaan isolat ke 15 mL media LB-tet cair yang diinkubasi pada inkubator kocok dengan agitasi 180 rpm, suhu 37°C sampai OD mencapai 0.6 – 0.8. Lalu 90 mL media LB-tet cair baru diinokulasi dengan 10 mL
12
Penentuan Batas Atas dan Batas Bawah Konsentrasi Xilosa
Optimasi konsentrasi xilosa dilakukan karena ekspresi gen pac pada B. megaterium btpacBD1 rekombinan diatur oleh promotor xyl untuk dapat menghasilkan enzim PAc. Penggunaan konsentrasi xilosa yang terlalu tinggi dikhawatirkan dapat membuat membran sel bakteri pecah sehingga perlu ditentukan konsentrasi xilosa yang tepat untuk menghasilkan enzim PAc yang optimal tanpa merusak sel B. megaterium selama proses kultivasi.
Batas atas dan batas bawah konsentrasi xilosa (X1) yang digunakan adalah
0.3% dan 0.7%. Hasil penelitian Yang et al. (2006) menjelaskan bahwa penambahan xilosa terbaik adalah sebesar 0.5%. Komposisi media produksi per liter terdiri dari 12.36 g MOPS (pH 7), 1.65 g Trisin (pH 7), 0.11g MgCl2.6H2O, Tetrasiklin (12.5 mg/mL) sebanyak 1% ditambahkan sebagai media seleksi. Komposisi trace element solution (10X) per 100 mL terdiri dari 3.708 mg (NH4)
6Mo7O24.4H2O, 24.73 mg H3BO3, 7.137 mg CoCl2 , 2.497 mg CuSO4, 15.832 mg
MnCl2 dan 2.875 mg ZnSO4 yang dilarutkan dalam air mili-Q (pH 7) dan
disterilisasi di autoklaf pada suhu 121°C 1 atm selama 15 menit. Komposisi vitamin solution (10X) per 100 mL terdiri dari 6 mg biotin, 20 mg niacin amida, 20 mg p-amino benzoat, 10 mg Ca-panthotenat, 100 mg pyridoxal/HCl 20 mg folacid, 50 mg riboflavin, 50 mg as.DL-6,8-thioctic dan 10 mg thiamin diklorida yang dilarutkan dalam air mili-Q (pH 7) dan disterilisasi syringe. Enam kelompok asam amino solution per liter terdiri dari 2.5 mg Gly dan 1.25 mg Ser (I), 2 mg Val, 1 mg Ile dan 0.5 mg Leu (II), 2.5 mg Ala (III), 0.4 mg Glu, 0.75 mg Gln, 2.5 mg Arg dan 1.25 mg Pro (IV), 1 mg His (V), serta 0.25 mg Asn, 0.25 mg Cys, 2.5 mg Lys, 1.25 mg Met, 1.25 mg Thr, 0.75 mg Asn (VI) yang dilarutkan dalam air mili-Q (pH 7) dan disterilisasi pada suhu 121°C 1 atm selama 15 menit.
Penentuan Batas Atas dan Batas Bawah Kadar CaCl2
Batas atas dan batas bawah konsentrasi CaCl2 (X2) yang digunakan adalah
3.5 mM dan 1.5 mM. Hasil penelitian Yang et al. (2006) menjelaskan bahwa penambahan 2.5 mM CaCl2 meningkatkan biomassa B. megaterium YYBm1
dengan aktivitas spesifik, 489.9 U/g CDW. Sedangkan penambahan 5 mM dapat mengganggu pertumbuhan biomassa dan aktivitas spesifik yaitu 287.3 U/g CDW. Rancangan untuk Optimasi Media
Setelah didapatkan batas atas dan batas bawah untuk konsentrasi xilosa (X1)
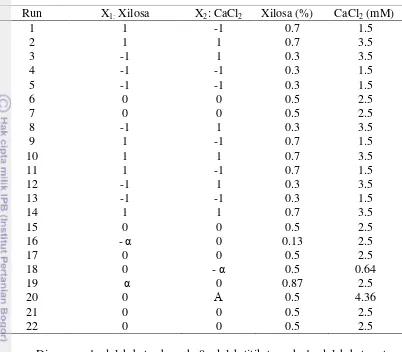
dan CaCl2 (X2) (Tabel 3). Nilai interval dimasukkan ke pengolahan data software Design Expert 9 (Stat Ease Inc, USA) dan diperoleh kombinasi lima tingkat konsentrasi xilosa (dengan rentang 0.13% s.d 0.87%) dengan lima tingkat konsentrasi CaCl2 (dengan rentang 0.64 mM s.d 4.36 mM) sebanyak 22 percobaan
13 Tabel 2. Rancangan percobaan Central Composite Design dengan dua faktor
Run X1: Xilosa X2: CaCl2 Xilosa (%) CaCl2 (mM)
Dimana, -1 adalah batas bawah, 0 adalah titik tengah, 1 adalah batas atas dan α adalah starting point. Kultivasi dilakukan dalam erlenmeyer 500 mL dengan volume kerja 100 mL pada pada inkubator kocok dengan suhu 28°C agitasi 180 rpm selama 48 jam.
Tabel 3. Simbol faktor dan level yang digunakan pada Central Composite Design
Faktor Level
Simbol -1.861 -1 0 1 1.861
Xilosa X1 0.13 0.3 0.5 0.7 0.87
CaCl2 X2 0.64 1.5 2.5 3.5 4.36
Hasil percobaan diplotkan pada persamaan polinomial ordo dengan model: Y = ao+ a1X1 + a2X2– a11X12– a22X22 + a12X1X2
Dimana Y adalah respon yang muncul, X1 adalah konsentrasi xilosa (%) ,
X2 adalah konsentrasi CaCl2 (mM), ao adalah konstanta, a1, a2 adalah koefisien
pengaruh linier xilosa dan CaCl2, a12 adalah koefisien pengaruh interaksi xilosa
14
Produksi PAc Rekombinan Skala Bioreaktor
Kombinasi terbaik hasil analisa RSM akan digunakan untuk uji coba produksi PAc pada skala bioreaktor. Proses kultivasi dilakukan dengan sistem curah pada bioreaktor 10 Liter dengan volume produksi 5 Liter dengan penambahan inokulum 500 mL. Kultivasi dilakukan dengan suhu 28°C pada agitasi 150 rpm dan aerasi 1 vvm.
Penentuan Waktu Panen Enzim Terbaik
Penelitian pendahuluan dilakukan untuk menentukan waktu panen enzim terbaik. Sampel diambil setiap 6 jam selama 60 jam dan diuji aktivitasnya. Selanjutnya, proses produksi pada bioreaktor dilakukan berdasarkan waktu panen enzim kutivasi terbaik dengan aktivitas PAc tertinggi berdasarkan penelitian pendahuluan..
Proses Panen Ekstrak Enzim Kasar (EEK) PAc Rekombinan
Proses panen enzim dilakukan dengan cara sentrifugasi kultur pada kecepatan 6000 rpm selama 15 menit pada suhu 4°C (Rajendhran et al. 2003). Supernatan diambil sebagai EEK yang akan dianalisa aktivitas dengan metode Balasingham et al. (1972) dan kadar protein dengan metode Bradford (1976). Prosedur Analisa Kerapatan bakteri atau Optical Density (OD)
Analisa dilakukan setiap 6 jam waktu kultivasi dengan mengambil 1 mL kultur dan absorbansi diukur pada panjang gelombang 578 nm (Yang et al. 2006). Jika lebih dari 1, maka perlu diencerkan dengan media. Kurva pertumbuhan menunjukkan hubungan antara jumlah sel dan aktivitas enzim dengan waktu sehingga dapat diketahui kapan aktivitas enzim PAc tertinggi.
Prosedur Uji Aktivitas PAc
15 enzim pada suhu 50°C selama 5 menit. Lalu ditambahkan 875 L reagen PDAB 0.5% dan diinkubasi selama 1 menit. Campuran ditambahkan 100 L substrat pen-G dan diinkubasi selama 1 menit. Lalu absorbansi diukur pada panjang gelombang 415 nm (Balasingham et al. 1972).
Hasil pembacaan selanjutnya dikonversikan ke dalam persamaan linear standar 6-APA dengan rumus:
Aktivitas enzim PAC (U/mL) = ([6-APA] x 1000) (BM x t x ve)
Dimana, [6-APA] adalah konsentrasi 6-APA yang dihasilkan, 1000 adalah faktor konversi dalam µmol, BM adalah berat molekul pen-G (216.25), t adalah waktu inkubasi pada suhu optimal (5 menit) dan Ve adalah volume ekstrak enzim kasar yang digunakan (25 µL = 0.025 mL).
Prosedur Analisa Kadar Protein
Analisa kadar protein dilakukan dengan menggunakan pereaksi Bradford dengan pengenceran 5 kali untuk mengetahui kadar protein pada enzim PAc dan media produksi. Kurva standar protein (Micro Assay) (Lampiran 5)dibuat dengan menganalisis absorbansi sampel yang berupa enzim murni dengan menimbang 2 mg Bovin Serum Albumin (BSA) yang dilarutkan dalam 10 mL mili-Q dengan variasi konsentrasiμ 0; 2.5; 5; 10; 15; 20 dan 25 ( g/mL). Selanjutnya, 800 L sampel ditambah 200 L pereaksi Bradford, divorteks dan diinkubasi selama 5 menit. Absorbansi diukur pada panjang gelombang 595 nm. Tahap diatas dilakukan untuk analisa kadar protein pada enzim PAc (duplo) dan blanko dengan mengganti sampel larutan BSA yang sudah didilusi. Pada enzim PAc sampel diganti dengan EEK, sedangkan pada blanko sampel diganti dengan media produksi (Bradford 1976).
Hasil absorbansi yang diperoleh dikonversikan ke dalam persamaan linear dari kurva standar BSA, kemudian besarnya absorbansi adalah sebanding dengan kadar protein dalam sampel.
Prosedur Penentuan Aktivitas Spesifik
Konsentrasi protein dan aktivitas PAc yang diperoleh digunakan untuk menentukan aktivitas spesifik enzim PAc. Aktivitas spesifik (U/mg) adalah hasil rasio aktivitas enzim (U/mL) dengan kadar protein (mg/mL).
Prosedur Analisa Bioinformatika Sinyal Peptida pada Gen btpac-bd1
Prosedur analisa bioinformatika dilakukan untuk mengetahui keberadaan sinyal peptida pada B. megaterium btpacBD1 (Petersen et al. 2011). Susunan basa nukleotida gen btpac-bd1 telah didepositkan pada Genbank dengan nomor akses ZP_04085306.1. Selanjutnya susunan basa nukleotida dianalisa menggunakan software SignalP: 4.1, portable version (Denmark) dan dapat diakses pada
16
HASIL DAN PEMBAHASAN
Hasil Pembuktian Keberadaan Gen btpac-bd1
Data hasil pembuktian keberadaan gen btpac-bd1 disajikan pada Gambar 4, Gambar 5 dan Gambar 6.
Seleksi Mikroba Rekombinan dengan Marka Genetik
Seleksi mikroba rekombinan dilakukan dengan menginokulasi kultur koleksi B. megaterium btpacBD1 dalam LB-tet padat (media seleksi). Koloni-koloni tunggal terlihat pada cawan petri setelah diinkubasi pada suhu 37°C selama 24 jam (Gambar 4). Koloni tunggal yang tumbuh diduga merupakan B. megaterium btpacBD1 yang tersisipi plasmid pMMbtpac-bd1 rekombinan yang mempunyai gen penyandi resisten terhadap antibiotik tertrasiklin.
Gambar 4. Koloni tunggal B. megaterium btpacBD1 pada media seleksi
Deteksi Plasmid Rekombinan pMMbtpac-bd1 dengan Ekstraksi Plasmid dan PCR
17 menunjukkan keberadaan gen btpac-bd1 sehingga kultur koleksi B. megaterium
btpacBD1 merupakan mikroba rekombinan yang telah terkonfirmasi sehingga dapat digunakan untuk ekspresi protein rekombinan dan optimasi komposisi media untuk produksi enzim PAc.
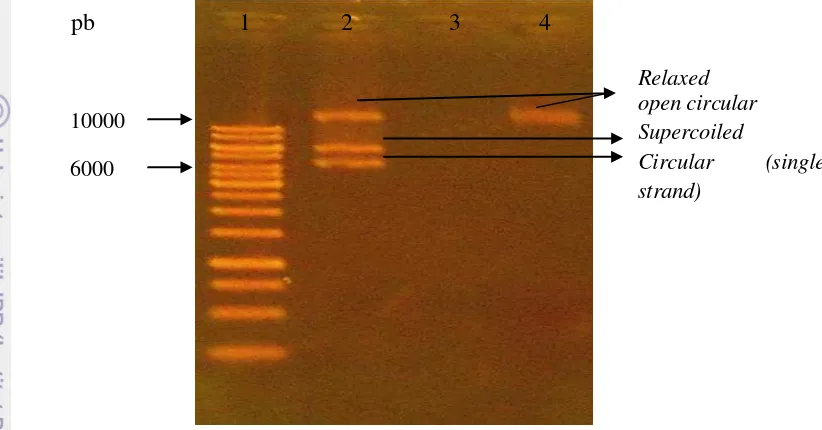
Gambar 5. Hasil visualisasi plasmid pMMbtpac-bd1 hasil ekstraksi koloni tunggal B. megaterium
btpacBD1. 1: Marker 1 kb; 2: Kontrol positif; 3: Kontrol negatif (air); 4: Plasmid pMMbtpac-bd1 hasil ekstraksi
Gambar 6. Hasil visualisasi gen btpac-bd1 hasil PCR dari plasmid hasil ekstraksi kultur B. megaterium
btpacBD1. 1: Marker 1 kb; 2: Kontrol negatif (air); 3: Kontrol positif; 4: Gen btpac-bd1 hasil PCR.
10000
6000 3000
2000
250
pb 1 2 3 4
3000
Relaxed open circular Supercoiled
Circular (single
strand)
18
Optimasi Media dengan metode Central Composite Design
Sebanyak 22 unit percobaan telah dilakukan. Aktivitas enzim PAc, kadar protein dan aktivitas spesifik enzim PAc adalah sebagai respon pada setiap percobaan disajikan pada Lampiran 6. Pada saat penelitian, sampel diambil dan diuji aktivitas enzim PAc, kadar protein dan aktivitas spesifik enzim PAc setiap 6 jam selama 48 jam kultivasi. Namun, hanya jam ke-48 yang memberikan model yang mewakili respon yang dapat digunakan untuk optimasi komposisi media produksi PAc rekombinan dari B. megaterium btpacBD1. Data hasil analisa model permukaan respon pada jam ke-48 disajikan pada Lampiran 7–11 dan Gambar 7 dan 8.
Respon: Aktivitas Enzim PAc
Sebelum uji aktivitas PAc rekombinan, dilakukan pengukuran kadar 6-APA untuk pembuatan kurva standar. Dari kurva standar 6-APA pada Lampiran 4 dan diperoleh persamaan matematika Y=0.459X+0.001 R2=0.991. Dari persamaan tersebut, maka nilai konsentrasi 6-APA dapat diketahui sehingga dapat dilakukan perhitungan sesuai dengan rumus aktivitas PAc.
Lampiran 7 menjelaskan bahwa hasil uji ANOVA terhadap model permukaan respon menunjukkan bahwa model kuadratik dan rancangan faktorial 2 faktor secara nyata dapat menjelaskan data yang diperoleh (nilai p <0.0001) pada tingkat kepercayaan 95%. Uji lanjut ketidakcocokan model (lack of fit) pada Lampiran 7 menunjukkan bahwa hanya model kuadratik yang secara tidak nyata menunjukkan ketidakcocokan (nilai p > 0.1142 dan R2 = 0.86 pada Lampiran 7.
Selanjutnya dilakukan analisa ANOVA terhadap model permukaan respon kuadratik (Lampiran 7). Hasil analisa kembali menjelaskan bahwa model kuadratik secara nyata (nilai p <0.0001) dapat menjelaskan data yang ada dengan uji lanjut ketidakcocokan model menunjukkan nilai p : 0.1142. Dengan demikian model kuadratik adalah model yang mewakili respon dan digunakan untuk optimasi komposisi media produksi PAc rekombinan dari B. megaterium.
Lampiran 7 (lanjutan) juga menjelaskan tentang perkiraan pengaruh setiap peubah dan interaksinya disertai dengan hasil uji beda nyata. Peubah yang mempunyai pengaruh nyata terhadap model pada tingkat kepercayaan 99% ditunjukkan dengan nilai p < 0.01. Dengan demikian model yang dapat menjelaskan data yang diperoleh adalah:
Y= 1.132 – 0.324 X12– 0.129 X22– 0.257 X1X2
Dimana Y adalah aktivitas PAc (U/mL), X1 adalah konsentrasi xilosa (%)
dan X2 adalah konsentrasi CaCl2 (mM). Persamaan diatas menunjukkan bahwa
xilosa dan CaCl2 mempunyai pengaruh yang nyata terhadap aktivitas enzim PAc
di dalam cairan kultivasi. Baik xilosa dan CaCl2 berpengaruh secara kuadratik.
Hasil ini menunjukkan bahwa xilosa dan CaCl2 mempuyai hubungan langsung
19 Plot permukaan respon sebagai fungsi dari dua peubah akan lebih memudahkan untuk melihat pengaruh dari peubah-peubah tersebut mengingat model yang digunakan adalah kuadratik. Pengaruh antar variabel terhadap aktivitas enzim PAc disajikan pada Gambar 7.
Design-Expert® Software
Berdasarkan hasil pengukuran kadar protein standar BSA (Bovine Serum Albumin), maka diperoleh kurva standar pada Lampiran 5 dan diperoleh kurva standar BSA dengan persamaan matematika Y=0.018X+0.193 R2=0.995. Dari persamaan tersebut, maka kadar protein pada ekstrak enzim kasar dapat diketahui.
Lampiran 8 menjelaskan bahwa hasil uji ANOVA terhadap model permukaan respon menunjukkan bahwa model kuadratik dan rancangan faktorial 2 faktor tidak memberikan pengaruh yang nyata (nilai p: 0.0191) pada tingkat kepercayaan 95% sehingga uji selanjutnya tidak perlu dilakukan.
Respon: Aktivitas Spesifik Enzim PAc
Lampiran 9 menjelaskaan bahwa hasil uji ANOVA terhadap model permukaan respon menunjukkan bahwa model kuadratik dan rancangan faktorial 2 faktor secara nyata dapat menjelaskan data yang diperoleh (p-value <0.0001) pada tingkat kepercayaan 95%.
20
kuadratik. Hasil analisa kembali menjelaskan bahwa model kuadratik secara nyata (nilai p <0.0001) dapat menjelaskan data yang ada (Lampiran 9).
Lampiran 9 juga menjelaskan tentang peubah yang mempunyai pengaruh nyata terhadap model pada tingkat kepercayaan 99% ditunjukkan dengan nilai p < 0.01. Dengan demikian model yang dapat menjelaskan data yang diperoleh adalah:
Y= 11.191 – 3.368 X12– 1.519 X22– 2.025 X1X2
Dimana Y adalah aktivitas spesifik PAc (U/mg), X1 adalah konsentrasi
xilosa (%) dan X2 adalah konsentrasi CaCl2 (mM). Persamaan diatas menunjukkan
bahwa xilosa dan CaCl2 mempunyai pengaruh yang nyata terhadap aktivitas
enzim PAc secara kuadratik. Berikut adalah plot pengaruh antar variabel terhadap aktivitas spesifik enzim PAc (Gambar 8).
Optimasi menggunakan perangkat lunak Design Expert versi 9 dilakukan untuk mendapatkan komposisi media yang dapat menghasilkan enzim PAc dengan aktivitas dan aktivitas spesifik tertinggi. Pada komposisi media yang mengandung 0.49% xilosa dan 2.40 mM CaCl2, secara teoritis akan menghasilkan
21 Produksi Skala Bioreaktor
Penentuan Waktu Panen Enzim Terbaik
Data hasil penentuan waktu panen enzim terbaik (berupa plot data hasil pengukuran nilai absorbansi OD sel dan aktivitas PAc) yang diproduksi selama 60 jam dilakukan untuk mengetahui kapan waktu produksi enzim PAc dengan aktivitas tertinggi (Gambar 9 dan Lampiran 12).
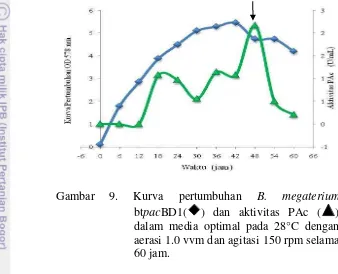
Gambar 9. Kurva pertumbuhan B. megaterium
btpacBD1( ) dan aktivitas PAc ( ) dalam media optimal pada 28°C dengan aerasi 1.0 vvm dan agitasi 150 rpm selama 60 jam.
Gambar 9 dan Lampiran 12 menjelaskan bahwa kurva pertumbuhan B. megaterium btpacBD1 dan aktivitas volumetrik (U/mL) ditentukan setiap 6 jam selama 60 jam. Fase eksponensial (log) terjadi antara jam 0 – 30 jam setelah kultivasi. Fase adaptasi (lag) tidak terdeteksi mungkin disebabkan oleh rentang waktu pengambilan sampel yang lebih panjang dari fase lag. Selanjutnya, fase stasioner terjadi antara jam 30 – 42 sebelum memasuki fase kematian, yaitu antara jam 48 – 60 waktu kultivasi. Aktivitas mulai terbentuk pada fase eksponensial (antara jam 18 – 42) dan mencapai aktivitas tertinggi pada fase kematian (jam ke-48) yaitu sebesar 2.0687 ± 0.0820 U/mL). Selanjutnya, aktivitas PAc mengalami penurunan yang signifikan.
Berdasarkan aktivitas PAc tertinggi yang dihasilkan, jam ke-48 dipilih sebagai waktu terbaik untuk panen enzim PAc sehingga waktu kultivasi untuk proses produksi PAc selanjutnya dilakukan selama 48 jam.
Kurva pertumbuhan Bacillus megaterium btpacBD1
22
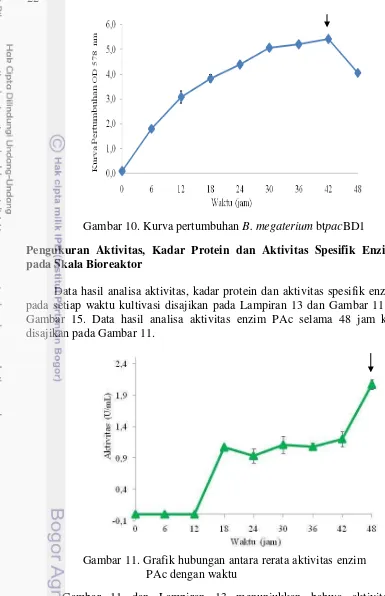
Gambar 10. Kurva pertumbuhan B. megaterium btpacBD1
Pengukuran Aktivitas, Kadar Protein dan Aktivitas Spesifik Enzim PAc pada Skala Bioreaktor
Data hasil analisa aktivitas, kadar protein dan aktivitas spesifik enzim PAc pada setiap waktu kultivasi disajikan pada Lampiran 13 dan Gambar 11 sampai Gambar 15. Data hasil analisa aktivitas enzim PAc selama 48 jam kultivasi disajikan pada Gambar 11.
Gambar 11. Grafik hubungan antara rerata aktivitas enzim PAc dengan waktu
23
Gambar 12. Grafik hubungan antara rerata kadar protein dengan waktu
Gambar 12 dan Lampiran 13 menunjukkan bahwa kadar protein meningkat secara signifikan pada jam ke-30. Selanjutnya, kadar protein tertinggi didapatkan pada jam ke-48 yaitu sebesar 0.0078 ± 0.0008 mg/mL.
Gambar 13. Grafik hubungan antara rerata aktivitas spesifik enzim PAc dengan waktu
Gambar 13 dan Lampiran 13 menunjukkan bahwa aktivitas spesifik enzim PAc tertinggi terjadi pada jam ke-18 yaitu sebesar 1260.521 ± 27.5711 U/mg. Artinya, tiap 1 mg protein dalam EEK memiliki aktivitas sebesar 1260.521 ± 27.5711 Unit. Setelah itu, aktivitas spesifik PAc mengalami penurunan yang signifikan setelah jam ke-18.
24
Gambar 14. Kurva pertumbuhan B. megaterium
25 Gambar 14A dan 14B menunjukkan bahwa aktivitas enzim PAc dan kadar protein mulai terbentuk pada fase log dan meningkat secara signifikan pada fase kematian (jam ke-48) yaitu masing-masing sebesar 2.0687 ± 0.0820 U/mL dan 0.0078 ± 0.0008 mg/mL. Gambar 15C menunjukkan bahwa aktivitas spesifik enzim PAc tertinggi terjadi pada fase log yaitu sebesar 1260.521 ± 27.5711 U/mg dan pada fase selanjutnya mengalami penurunan yang signifikan.
Analisa Bioinformatika Sinyal Peptida pada Gen btpac-bd1
Data hasil prediksi analisa bioinformatika menggunakan software signalP
version 4.1 pada gen btpac-bd1 disajikan pada Gambar 15.
Gambar 15. Hasil prediksi sinyal peptida pada gen btpac-bd1
Gambar 15 menjelaskan bahwa keberadaan sinyal peptida yang berkaitan dengan proses sekresi enzim PAc pada B. megaterium btpacBD1 tidak terdeteksi atau sangat lemah.
Pembahasan
Deteksi Plasmid Rekombinan pMMbtpac-bd1 dengan Ekstraksi Plasmid dan PCR
PAc rekombinan diperoleh dengan cara kultivasi menggunakan isolat
26
Tetrasiklin (tc) berfungsi sebagai antibiotik yang digunakan untuk menyeleksi bakteri rekombinan sehingga hanya B. megaterium btpacBD1 rekombinan yang dapat tumbuh dalam media ini karena plasmid pMM1525 yang digunakan sebagai vektor mempunyai gen penyandi resisten tc. Oleh karena itu, penambahan tc pada media dilakukan agar dapat menyeleksi bakteri rekombinan yang membawa plasmid, mempertahankan sifat resistensi dan mencegah kontaminasi, sehingga bakteri yang tumbuh dalam media produksi adalah bakteri yang mengandung plasmid rekombinan pMMbtpac-bd1.
Sebelum melakukan ekstraksi plasmid rekombinan, perlu dilakukan seleksi mikroba B. megaterium btpacBD1 menggunakan marka genetik di dalam media LB padat-tet. Koloni tunggal yang tumbuh diduga membawa plasmid rekombinan pMMbtpac-bd1. Koloni tunggal akan diproses untuk mengekstraksi plasmid rekombinan. Ekstraksi plasmid dilakukan karena pita tunggal tidak tervisualisasi saat proses PCR koloni dilakukan.
Koloni tunggal diinokulasi pada media LB cair-tet pada inkubator kocok pada suhu 37°C agitasi 70 rpm selama 20-24 jam hingga OD sel mencapai 0.6-0.8 pada panjang gelombang 578 nm (fase eksponensial). Selanjutnya, kultur disentrifugasi pada 5000 rpm selama 10 menit. Supernatan dibuang dan endapan diproses untuk mengekstraksi plasmid rekombinan.
Ekstraksi plasmid dilakukan dengan metode lisis alkali. Metode ini digunakan karena sel B. megaterium tidak dapat lisis jika dilakukan tanpa penambahan lisozim, tidak seperti sel E coli yang dapat lisis hanya dengan pemanasan di dalam buffer (Laemmli 1970).
Sel dipanen pada fase eksponensial karena sel bakteri relatif masih muda, sehingga memudahkan pemecahan membran sel. Lisis sel bakteri dilakukan secara kimia menggunakan lisozim yang merupakan suatu senyawa yang dapat merusak protein tanpa merusak molekul DNA maupun RNA. Proses lisis sel ini dipercepat dengan penambahan NaOH-SDS, yang akan menghilangkan molekul lipid sehingga membran sel perlahan akan pecah.
Sebagian besar protein dan RNA tidak larut sehingga penambahan larutan PCI diharapkan dapat mengekstrak protein dan memurnikan DNA. DNA dipisahkan dari debris sel dan protein melalui ekstraksi menggunakan larutan CI. Kloroform akan mendenaturasi protein dan melarutkan lipid serta memisahkan fase organik dan fase air dan pemisahan kedua fase ini disempurnakan oleh isoamilalkohol. Presipitasi protein akan terjadi tetapi DNA dan RNA tetap berada dalam fase air. Selanjutnya RNase akan mendegradasi molekul RNA (Susanti dan Ariani 2004).
Keberhasilan reaksi PCR dapat dipengaruhi oleh konsentrasi komponen seperti enzim DNA polimerase, DNA cetakan, primer, dNTP, buffer, serta kondisi reaksi PCR (Sambrook dan Russell 2001). Komposisi campuran PCR yang digunakan terdiri dari 0.5 µL primer xyl3 10 M, 0.5 µL primer xyl4 10 M, 5.0
µL 10x KAPA Buffer (B) with Mg2+, 0.5 µL dNTP, 0.2 µL KAPA Tag polymerase, 2,0 µL hasil ekstraksi sel dan 41.3 µL ddH2O steril.
27 Primer yang digunakan dalam reaksi PCR yaitu primer forward (xyl3) dan primer reverse (xyl4). Kedua primer ini merupakan primer spesifik gen pac
sehingga hanya plasmid yang mengandung gen pac saja yang dapat teramplifikasi dan menghasilkan fragmen DNA. Primer akan memotong rantai DNA antara 18-24 nukleotida yang dirancang berpasangan dengan rantai DNA template.
Deoksiribonukleotida trifosfat (dNTP) digunakan sebagai sumber nukleotida dalam reaksi PCR. KAPA Taq polymerase memiliki keaktifan dalam suhu tinggi, sehingga penambahan enzim tidak perlu dilakukan pada setiap siklus. Komponen lain seperti 10x buffer with Mg2+ berperan sebagai buffer untuk mempertahankan kestabilan pH. Sedangkan Mg2+ berperan sebagai kofaktor DNA
Taq polymerase. Air ddH2O steril ditambahkan sebagai pelarut.
Siklus PCR yang digunakan dalam penelitian adalah sebanyak 30 siklus. Menurut Yuwono (2006), umumnya PCR dilakukan dengan mengulang siklus reaksi sebanyak 20–30 siklus. Jika siklus terlalu banyak, konsentrasi produk yang tidak spesifik akan meningkat, sedangkan siklus yang terlalu sedikit akan mengurangi kuantitas produk yang diharapkan.
Tahapan dalam PCR terdiri dari pra denaturasi, denaturasi, annealing dan
extension (polimerisasi). Pra denaturasi dilakukan diawal reaksi pada suhu 95°C selama 5 menit untuk memastikan kesempurnaan denaturasi dan mengaktifkan DNA Taq Polymerase. Tahap denaturasi pada suhu 94°C selama 1 menit akan membuka untai ganda DNA menjadi untai tunggal DNA. Hal ini disebabkan oleh tingginya suhu denaturasi sehingga ikatan hidrogen diantara basa-basa yang komplemen terputus. Pada tahap ini, seluruh reaksi enzim tidak berjalan.
Selanjutnya annealing yaitu saat penempelan primer pada cetakan DNA berjalan pada 61°C selama 35 detik. Suhu annealing mempengaruhi kespesifikan penempelan primer. Pada tahap ini, primer xyl3 dan primer xyl4 akan menuju daerah yang spesifik yang memiliki komplemen dengan primer dan ikatan hidrogen akan terbentuk.
DNA Taq polymerase akan membentuk ikatan hidrogen yang sangat kuat dan tidak akan terputus apabila terjadi reaksi polimerisasi. Nilai temperature of melting (Tm) adalah suhu pada saat setengah dari molekul DNA mengalami denaturasi (Yuwono 2006). Primer untuk PCR yaitu xyl3 dan xyl4 memiliki nilai Tm masing-masing 61°C dan 60.4°C. Proses extension pada suhu 720C selama 2 menit. Primer yang telah menempel akan mengalami pemanjangan oleh DNA polimerase sehingga menghasilkan dua pasang untai ganda.
Pita tunggal hasil elektroforesis dihasilkan karena etidium bromida (EtBr) akan menginterkalasi (menyisip ke dalam) DNA. Penggunaan EtBr akan memendarkan sinar ultraviolet, jika gel disinari dengan ultraviolet dari bawah, maka akan tampak citra berupa pita-pita pada gel. Pita-pita tersebut adalah molekul-molekul DNA. Hasil elektroforesis gel agarosa menunjukkan fragmen DNA gen btpac-bd1 hasil amplifikasi PCR berukuran antara 2000 bp dan 3000 bp (Gambar 4). Hal ini sejalan dengan hasil penelitian Leonita (2013) dan Putri (2013) yang menyatakan bahwa pita tunggal hasil PCR koloni B. megaterium
BD1 dan CC1 rekombinan menunjukkan gen btpac-bd1 dan gen btpac-cc1 adalah fragmen DNA berukuran diatas 2000 pb. Sekuen nukleotida dari 2397 p bfragmen DNA penyandi penisilin asilase B. thuringiensis BD1 telah didepositkan pada
28
Menurut Wittman dan Krull (2010), ukuran pMM1525 adalah 7462 pb. Selanjutnya, konstruksi plasmid rekombinan menghasilkan konstruk pMM btpac-bd1 yang berukuran 9769 pb (Nurhayati 2009). Namun plasmid pMMbtpac-bd1
hasil ekstraksi menghasilkan pita tunggal yang berukuran lebih dari 10 kb. Kontrol positif plasmid pMMbtpac-bd1 memberikan 3 larik. Ketiga larik tersebut menunjukkan adanya berbagai bentuk konformasi DNA plasmid. Oleh karena itu, ukuran plasmid pMMbtpac-bd1 yang lebih dari 10 kb mungkin disebabkan oleh konformasi rilex open circular pMMbtpac-bd1. Hal ini sejalan dengan hasil penelitian Susanti dan Ariani (2004) yang menyatakan bahwa molekul DNA plasmid pHB201 memberikan 2 larik. Larik yang berada paling bawah adalah
super coiled monomer DNA,sedangkan pita paling atas merupakan DNA plasmid dengan konformasi rilex open circular. DNA plasmid memiliki konformasi
covalently closed circular (ccc).
Optimasi Media dengan metode Central Composite Design
Untuk mengevaluasi secara empiris hubungan antara suatu kelompok peubah dari suatu percobaan dan respon yang terukur berdasarkan kriteria tertentu dapat dilakukan suatu metode permukaan respon (Adinayarana dan Ellaiah 2002). Pengaruh peubah yang akan diuji terhadap proses perlu diketahui untuk mendekati model yang lebih mendekati kenyataan. Analisis lack of fit dilakukan untuk menunjukkan bahwa model yang dihasilkan adalah benar telah mewakili respon permukaan.
Produksi PAc rekombinan menggunakan modifikasi media Yang et al.
(2006) yang ditambahkan 1% tetrasiklin (12.5 mg/mL) dengan variasi xilosa dan CaCl2 yang berbeda (Lampiran 6). Media diatur pada pH 7 yang merupakan
kondisi optimal untuk pertumbuhan bakteri. Proses kultivasi berlangsung pada suhu 28°C agitasi 180 rpm selama 48 jam. Hasil analisa permukaan respon (Gambar 7 dan 8) menunjukkan bahwa xilosa dan CaCl2 berhubungan langsung
dengan enzim PAc yang disintesis B. megaterium btpacBD1.
Enzim yang diperoleh yaitu PAc rekombinan merupakan enzim yang bersifat dapat diinduksi, karena bakteri akan mengekspresikan gen penyandi pembentukan enzim PAc secara berlebih jika pada media ditambahkan senyawa penginduksi yaitu xilosa. Plasmid pMM1525 mengandung promotor gen xilosa isomerase (xylA) yang kuat, sehingga penambahan induser spesifik yaitu xilosa dapat mendorong promotor gen xylA untuk meningkatkan produksi enzim rekombinan yang lebih tinggi (Yang et al. 2006). Penambahan penginduksi dengan jumlah yang tepat dapat meningkatkan produktivitas PAc rekombinan dari
B. megaterium btpacBD1, tetapi jika konsentrasi penginduksi yang diberikan terlalu banyak, maka akan menyebabkan inhibisi terhadap bakteri itu sendiri. Plasmid pMM1525 mengandung gen xylose-dependent repressor (xylR) yang merupakan gen pengkode protein represor yang menghambat transkripsi gen pac