KEMAMPUAN BAKTERI TANAH DALAM MENGHAMBAT
PERTUMBUHAN Ganoderma boninense DAN Fusarium oxysporum
SECARA In Vitro DAN UJI PENGHAMBATAN PENYAKIT LAYU
Fusarium PADA BENIH CABAI MERAH
SKRIPSI
MUHAMMAD ASRIL
070805006
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
KEMAMPUAN BAKTERI TANAH DALAM MENGHAMBAT
PERTUMBUHAN Ganoderma boninense DAN Fusarium oxysporum SECARA In Vitro DAN UJI PENGHAMBATAN PENYAKIT LAYU Fusarium PADA
BENIH CABAI MERAH
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelas Sarjana Sains
MUHAMMAD ASRIL 070805006
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : KEMAMPUAN BAKTERI TANAH DALAM
MENGHAMBAT PERTUMBUHAN Ganoderma
boninense DAN Fusarium oxysporum SECARA In Vitro
DAN UJI PENGHAMBATAN PENYAKIT LAYU
Fusarium PADA BENIH CABAI MERAH
Kategori : SKRIPSI
Nama : MUHAMMAD ASRIL
Nomor Induk Mahasiswa : 070805006
Program Studi : SARJANA (S1) BIOLOGI
Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM
(FMIPA) UNIVERSITAS SUMATERA UTARA
Diluluskan di Medan, Desember 2011
Komisi Pembimbing :
Pembimbing II Pembimbing I
Prof. Dr. Erman Munir, M.Sc Prof. Dr. Dwi Suryanto, M.Sc. NIP. 1965110 199103 1 002 NIP. 19640409 199403 1 003
Diketahui / Disetujui oleh
Departemen Biologi FMIPA USU
PERNYATAAN
KEMAMPUAN BAKTERI TANAH DALAM MENGHAMBAT PERTUMBUHAN
Ganoderma boninense DAN Fusarium oxysporum SECARA In Vitro DAN UJI PENGHAMBATAN PENYAKIT LAYU Fusarium PADA BENIH CABAI MERAH
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Desember 2011
PENGHARGAAN
Puji dan syukur penulis sampaikan ke hadirat Allah SWT, yang telah melimpahkan karunia-Nya serta shalawat beriring salam penulis sampaikan kepada Nabi Muhammad SAW, sehingga penulis dapat menyelesaikan penulisan hasil penelitian yang berjudul “Kemampuan Bakteri Tanah dalam Menghambat Pertumbuhan Ganoderma boninense dan Fusarium oxysporum Secara In Vitro dan Uji Penghambatan Penyakit Layu Fusarium Pada Benih Cabai Merah” sebagai salah satu syarat untuk meraih gelar sarjana Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara, Medan.
Dalam kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada: Bapak Prof. Dr. Dwi Suryanto, M.Sc sebagai Dosen pembimbing 1, dan Bapak Prof. Dr. Erman Munir, M.Sc selaku Dosen pembimbing 2. Bapak Drs. Kiki Nurtjahja, M.Sc dan Dra. Isnaini Nurwahyuni, M.Sc selaku Dosen penguji yang telah memberikan banyak saran dan arahan dalam penulisan hasil penelitian ini. Bapak Prof. Dr. Ing. Ternala Alexander Barus, M.Sc, selaku Dosen Penasehat Akademik. Ketua Departemen Biologi, Ibu Dr. Nursahara Pasaribu, M.Sc dan seluruh staff pengajar dan pegawai di jurusan Biologi.
Penulis juga mengucapkan terima kasih kepada Ibu Nurhasni Muluk selaku Laboran di Laboratorium Biologi FMIPA USU dan kepada Ibu Roslina Ginting dan Bang Endra Raswin selaku Pegawai Administrasi Program Studi Biologi FMIPA USU.
Ungkapan terima kasih yang tak ternilai harganya penulis ucapkan kepada kepada Ayahanda tercinta Azis Amril serta Ibunda tercinta Yasmarli, terima kasih atas kasih sayang yang tulus yang telah diberikan selama ini. Skripsi ini akan menjadi skripsi pertama yang menghiasi rak buku di rumah kita. Kepada Nenek tersayang Nyak Aloih, juga saudara-saudariku tersayang Kak Zuriana dan adikku Zulham terima kasih untuk doa dukungan dan semangat yang telah kalian berikan. Dan kepada seluruh keluarga besar yang selalu memberikan motivasi dan dukungan tiada henti penulis ucapan terima kasih sebesar-besarnya.
Terima kasih kepada teman-teman kost di Asrama Putra Nanda, Billy, Reyhan, Franheit dan Putra yang begitu banyak membantu dalam penulisan skripsi ini dan atas suka, duka, dan tawa yang telah kita lewati bersama. Semoga semuanya tidak akan lekang oleh waktu. Terima kasih untuk sebuah momen indah kepada rekan-rekan Asisten Laboratorium Biologi Dasar dan Struktur Perkembangan Tumbuhan Rini, Oppy, Pinta, Intan, Eka, Mela dan Ahri terima kasih untuk kebersamaan yang telah diberikan.
Penulis juga mengucapkan terima kasih kepada rekan-rekan OSNPTI 2010 Irfan, Gatot, dan Bang Udin terima kasih untuk pertemanan singkat yang indah. Semoga skripsi ini bermanfaat untuk semua pihak dan semoga Allah SWT memberikan balasan atas apa yang telah diberikan. Amin ya Rabbal Alamin.
Medan, Desember 2011
KEMAMPUAN BAKTERI TANAH DALAM MENGHAMBAT
PERTUMBUHAN Ganoderma boninense DAN Fusarium oxysporum SECARA In Vitro DAN UJI PENGHAMBATAN PENYAKIT LAYU Fusarium PADA
BENIH CABAI MERAH
ABSTRAK
Penelitian tentang Kemampuan Bakteri Tanah dalam Menghambat Pertumbuhan
Ganoderma boninense dan Fusarium oxysporum Secara In Vitro dan Uji Penghambatan Penyakit Layu Fusarium Pada Benih Cabai Merah telah dilakukan di Laboratorium Mikrobiologi, Departemen Biologi FMIPA USU, Medan dari bulan April 2011 sampai Juli 2011. Dua belas isolat bakteri hasil isolasi yang telah diujikan memiliki kemampuan bervariasi dalam menghambat pertumbuhan jamur F. oxysporum dan G. boninense. Efektivitas paling tinggi isolat kitinolitik dan antijamur dalam menghambat pertumbuhan F. oxysporum masing-masing adalah BK15 dan KM01 dan diameter zona hambat masing-masing 20,45 mm dan 10,2 mm sedangkan efektivitas terendah masing-masing ditunjukkan oleh BK14 dan KM02 dengan diameter zona hambat sebesar 3,98 mm dan 6,69 mm. Untuk penghambatan G. boninense, isolat yang menunjukkan efektivitas paling tinggi adalah BK17 dan KM04 dengan masing-masing diameter zona hambat sebesar 22,74 mm dan 14,19 mm, sedangkan efektivitas terendah ditunjukkan oleh isolat BK14 dan AW02 dengan diameter zona hambat masing-masing sebesar 11,08 mm dan 4,6 mm. Isolat bakteri kitinolitik dan isolat bakteri antijamur yang digunakan sebagai pelapis benih cabai merah melalui perendaman mampu mengurangi persentase rebah kecambah yang disebabkan oleh F. oxysporum. Kombinasi antara BK13 dan KM04 memiliki kemampuan penghambatan tertinggi yaitu 83,33% dan KM04 (33,33%) yang memiliki kemampuan terendah.
Kata kunci: Bakteri antijamur, bakteri kitinolitik, bakteri tanah G. boninense dan layu
In Vitro ABILITY OF SOIL BACTERIA TO INHIBIT THE GROWTH OF Ganoderma boninense AND Fusarium oxysporum AND INHIBITION ASSAY OF
Fusarium WILT DISEASE OF CHILI SEEDS
ABSTRACT
A study on the in vitro ability of soil bacteria to inhibit the growth of Fusarium oxysporum and Ganoderma boninense and inhibition assay of Fusarium wilt disease of chili seeds has been done in the Laboratory of Microbiology, Department of Biology, Faculty of Mathematics and Natural Sciences, University of Sumatera Utara, Medan, started from April 2011 to July 2011. Twelve bacterial isolates showed ability to inhibit the growth of F. oxysporum and G. boninense to some extents. The most effective chitinolytic bacteria and antifungal bacteria to inhibit the growth of F. oxysporum was BK15 and KM01 with diameter of inhibition zone by 20.45 mm and 10.2 mm, respectively. Whereas, BK14 and KM04 showed relatively smaller diameter of inhibition by 3.98 mm and 6.69 mm, respectively. The growth of G. boninense was inhibited most effectively by BK17 and KM04 with diameter of inhibition of 22.74 mm and 14.19 mm, while the less effectiveness of the inhibition was showed by BK14 and AW02 with diameter of inhibition of 11.08 mm and 4.6 mm respectively. Chitinolytic bacterial isolates and antifungal bacterial isolates used to cover red pepper seed through soaking enabled to reduce seeds dumping off. The combination of BK13 and KM04 had the highest inhibition to reduce the dumping off by 83,33% and isolates KM04 (33,33%) had the lowest ability.
Keywords: Antifungal bacterial, chitinolytic bacteria, soil bacteria G. boninense and
DAFTAR ISI
3.4 Isolasi Bakteri Penghasil Antijamur dari Sampel Tanah 14 3.5 Karakterisasi Morfologi dan Identifikasi Bakteri Penghasil
Antijamur
3.6 Penentuan Bakteri Penghasil Enzim Kitinase
14 15 3.7 Uji Antagonis Isolat Bakteri Kitinolitik Terhadap Fusarium
oxysporum dan Ganoderma boninense
3.8 Uji Antagonis Isolat Bakteri Antijamur Terhadap F. oxysporum dan G. boninense
3.9 Pengamatan Struktur Hifa Abnormal
15
16 16 3.10 Pengujian Isolat Bakteri Antijamur Potensial Terhadap Isolat
Bakteri Kitinolitik Potensial 3.11 Uji Patogenitas F. oxysporum
3.12 Penghambatan Serangan F. oxysporum Pada Benih Cabai
BAB 4 HASIL DAN PEMBAHASAN
4.1 Hasil Isolasi dan Karakterisasi Bakteri penghasil Antijamur 4.2 Hasil Pengujian Bakteri Penghasil Enzim Kitinase
4.3 Uji Antagonisme Isolat Bakteri Kitinolitik Terhadap Fungi
Patogen
4.4 Uji Antagonisme Isolat Antijamur Terhadap Fungi patogen
4.5 Pengamatan Struktur Hifa Abnormal Jamur Patogen Setelah Uji Antagonis
4.6 Pengujian Isolat Bakteri Antijamur Potensial Terhadap Isolat Bakteri Kitinolitik Potensial
4.7 Uji Patogenitas F. oxysporum
4.8 Penghambatan Serangan F. oxysporum pada Benih Cabai Merah
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 5.2 Saran
DAFTAR PUSTAKA LAMPIRAN
24 26
29
32 32 34
40 40 40
DAFTAR GAMBAR
Halaman
Gambar 2.3.1 Koloni G. boninense pada media PDA umur 5 hari 9 Gambar 2.4.1
Gambar 3.7.1
Koloni F. oxysporum pada media PDA umur 4 hari
Metode pengukuran zona hambat bakteri kitinolitik terhadap koloni jamur Isolat bakteri penghasil kitinase Uji antagonisme bakteri kitinolitik
Uji antagonisme bakteri antijamur
Bentuk hifa abnormal setelah uji antagonis dengan bakteri kitinolitik
Bentuk hifa abnormal setelah uji antagonis dengan bakteri antijamur
30
31 Gambar 4.6.1 Uji antagonisme antar bakteri kitinolitik potensial dan
bakteri antijamur potensial 32
Gambar 4.7.1 Perbandingan kecambah sehat umur sehat dengan
kecambah terserang layu Fusarium 33
Gambar 4.8.1 Persentase rebah kecambah yang diinokulasikan
Fusarium dengan perlakuan bakteri antijamur dan
bakteri kitinolitik 34
Gambar 4.8.2 Persentase pengurangan rebah kecambah yang diinokulasikan Fusarium dengan perlakuan bakteri
kitinolitik dan bakteri antijamur 35
Gambar 4.8.3
Gambar 4.8.4
Perbedaan tinggi kecambah yang diinokulai Fusarium
dengan perlakuan uji
Perbedaan berat kering kecambah yang diinokulasi
Fusarium dengan perlakuan bakteri kitinolitik dan antijamur
37
DAFTAR TABEL
Halaman
Tabel 4.1.1 Karakter morfologi koloni dan sel, dan sifat biokimia
bakteri yang diisolasi dari tanah Bangka 21 Tabel 4.3.1
Tabel 4.4.1
Uji antagonisme antara bakteri kitinolitik dengan
G. boninense dan F. oxysporum
Uji antagonisme antara bakteri antijamur dengan
G. boninense dan F. oxysporum
25
DAFTAR LAMPIRAN
Halaman
Lampiran A Komposisi Medium MGMK Padat Dan Cara
Pembuatannya 47
Lampiran B Pembuatan Koloidal Kitin dengan Cara Hidrolisis
Parsial 48
Lampiran C Penyiapan Media Tanam 48
Lampiran D Data Rata-rata Tinggi Kecambah dari Minggu ke-1
sampai Minggu ke-4 49
Lampiran E Data Berat Kering Kecambah yang diiinokulasi
Fusarium dengan perlakuan bakteri antijamur dan
kitinolitik 49
Lampiran F Hasil Isolasi Bakteri Dari Sampel Tanah Pada Media
PDA-YT Umur 5 Hari. 50
Lampiran G Hasil Uji Biokimia 50
Lampiran H Isolat F. oxysporum 51
KEMAMPUAN BAKTERI TANAH DALAM MENGHAMBAT
PERTUMBUHAN Ganoderma boninense DAN Fusarium oxysporum SECARA In Vitro DAN UJI PENGHAMBATAN PENYAKIT LAYU Fusarium PADA
BENIH CABAI MERAH
ABSTRAK
Penelitian tentang Kemampuan Bakteri Tanah dalam Menghambat Pertumbuhan
Ganoderma boninense dan Fusarium oxysporum Secara In Vitro dan Uji Penghambatan Penyakit Layu Fusarium Pada Benih Cabai Merah telah dilakukan di Laboratorium Mikrobiologi, Departemen Biologi FMIPA USU, Medan dari bulan April 2011 sampai Juli 2011. Dua belas isolat bakteri hasil isolasi yang telah diujikan memiliki kemampuan bervariasi dalam menghambat pertumbuhan jamur F. oxysporum dan G. boninense. Efektivitas paling tinggi isolat kitinolitik dan antijamur dalam menghambat pertumbuhan F. oxysporum masing-masing adalah BK15 dan KM01 dan diameter zona hambat masing-masing 20,45 mm dan 10,2 mm sedangkan efektivitas terendah masing-masing ditunjukkan oleh BK14 dan KM02 dengan diameter zona hambat sebesar 3,98 mm dan 6,69 mm. Untuk penghambatan G. boninense, isolat yang menunjukkan efektivitas paling tinggi adalah BK17 dan KM04 dengan masing-masing diameter zona hambat sebesar 22,74 mm dan 14,19 mm, sedangkan efektivitas terendah ditunjukkan oleh isolat BK14 dan AW02 dengan diameter zona hambat masing-masing sebesar 11,08 mm dan 4,6 mm. Isolat bakteri kitinolitik dan isolat bakteri antijamur yang digunakan sebagai pelapis benih cabai merah melalui perendaman mampu mengurangi persentase rebah kecambah yang disebabkan oleh F. oxysporum. Kombinasi antara BK13 dan KM04 memiliki kemampuan penghambatan tertinggi yaitu 83,33% dan KM04 (33,33%) yang memiliki kemampuan terendah.
Kata kunci: Bakteri antijamur, bakteri kitinolitik, bakteri tanah G. boninense dan layu
In Vitro ABILITY OF SOIL BACTERIA TO INHIBIT THE GROWTH OF Ganoderma boninense AND Fusarium oxysporum AND INHIBITION ASSAY OF
Fusarium WILT DISEASE OF CHILI SEEDS
ABSTRACT
A study on the in vitro ability of soil bacteria to inhibit the growth of Fusarium oxysporum and Ganoderma boninense and inhibition assay of Fusarium wilt disease of chili seeds has been done in the Laboratory of Microbiology, Department of Biology, Faculty of Mathematics and Natural Sciences, University of Sumatera Utara, Medan, started from April 2011 to July 2011. Twelve bacterial isolates showed ability to inhibit the growth of F. oxysporum and G. boninense to some extents. The most effective chitinolytic bacteria and antifungal bacteria to inhibit the growth of F. oxysporum was BK15 and KM01 with diameter of inhibition zone by 20.45 mm and 10.2 mm, respectively. Whereas, BK14 and KM04 showed relatively smaller diameter of inhibition by 3.98 mm and 6.69 mm, respectively. The growth of G. boninense was inhibited most effectively by BK17 and KM04 with diameter of inhibition of 22.74 mm and 14.19 mm, while the less effectiveness of the inhibition was showed by BK14 and AW02 with diameter of inhibition of 11.08 mm and 4.6 mm respectively. Chitinolytic bacterial isolates and antifungal bacterial isolates used to cover red pepper seed through soaking enabled to reduce seeds dumping off. The combination of BK13 and KM04 had the highest inhibition to reduce the dumping off by 83,33% and isolates KM04 (33,33%) had the lowest ability.
Keywords: Antifungal bacterial, chitinolytic bacteria, soil bacteria G. boninense and
BAB 1
PENDAHULUAN
1.1Latar Belakang
Sebagai salah satu negara yang memiliki biodiversitas sangat besar, Indonesia
menyediakan banyak sumberdaya alam hayati yang tak ternilai harganya, dari bakteri
hingga jamur, tumbuhan, dan hewan. Pencarian isolat dan jenis organisme yang
potensial untuk digunakan dalam bidang industri, pertanian, dan kesehatan merupakan
pekerjaan yang harus terus dilakukan (Suryanto 2009).
Adanya mikroorganisme yang unggul merupakan salah satu faktor penting
dalam usaha produksi enzim. Oleh karena itu, penggalian mikroorganisme indigenous
penghasil kitinase perlu dilakukan di Indonesia. Keragaman hayati yang tinggi
memberikan peluang yang besar untuk mendapatkan mikroorganisme yang potensial
untuk dikembangkan sebagai penghasil enzim (Akhdiya 2003). Salah satu enzimnya
adalah kitinase. Kitinase adalah enzim yang mendegradasi kitin menjadi
N-asetilglukosamin, degradasi kitin dapat dilakukan oleh organisme kitinolitik dengan
melibatkan enzim kitinase (Muharni 2009). Kitinase ini dapat ditemukan dalam
berbagai organisme, kitinase dapat dihasilkan oleh bakteri dan jamur yang diperoleh
dari berbagai sumber seperti tanah atau perairan dengan cara menumbuhkannya di
media yang mengandung kitin koloidal. Aktivitas kitinase secara kualitatif dapat diuji
dengan penentuan zona bening disekitar pertumbuhan koloni pada media agar yang
mengandung kitin (Herdiyastuti et al. 2009). Organisme pendegradasi kitin umumnya
berasal dari kelompok mikroorganisme diantaranya adalah dari kelompok bakteri.
Bakteri yang dilaporkan memiliki aktivitas kitinolitik seperti, Vibrio furnissi, Serratia
Selain menghasilkan enzim, mikroorganisme juga dapat menghasilkan
antijamur seperti antibiotik. Kata antibiotik diberikan pada produk metabolik yang
dihasilkan suatu organisme tertentu, yang dalam jumlah amat kecil bersifat merusak
atau menghambat mikroorganisme lain (Pelczar & Chan 2005). Sampai saat ini telah
ditemukan lebih dari 3000 antibiotik, namun hanya sedikit saja yang diproduksi secara
komersil. Beberapa antibiotik telah dapat diproduksi dengan kombinasi sintesis
mikroorganisme dan modifikasi kimia, antara lain: golongan penisilin, sefalosporin,
dihidrostreptomisin klindamisin, tetrasiklin dan rifamisin. Bahkan ada yang telah
dibuat secara kimia penuh misalnya: kloramfenikol dan pirolnitrin (Suwandi 1989).
Mikroorganisme penghasil antibiotik dapat diisolasi dari tanah, air laut,
lumpur, kompos, limbah domestik, bahan makanan busuk dan lain-lain (Suwandi
1989). Namun kebanyakan mikroba penghasil antibiotik diperoleh dari mikroba tanah
terutama streptomises, bakteri dan jamur Tanah merupakan tempat interaksi biologis
yang paling dinamis dan mempunyai lima komponen utama yaitu mineral, air, udara,
zat organik dan organisme hidup dalam tanah antara lain: bakteri, aktinomisetes,
fungi, algae, dan protozoa (Setiadi 1989).
Bakteri- bakteri tanah yang dapat menghasilkan antibiotik diantaranya Serratia
plymuthica yang diisolasi dari tanah yang berpotensi sebagai agensia biokontrol yang
mampu menekan pertumbuhan jamur Verticillium dahlia (Herdyastuti et al. 2009),
selain itu bakteri seperti Pseudomonas (Burkholder et al. 1996; Schnider et al. 1995;
Thomashow et al. 1990), Kibdelosporangium aridum, Actinoplanes friuliensis (Müller
et al. 2007), dan Roseobacter clade-affiliated species ( Brinkhoff et al. 2004) dapat
menghasilkan antibiotik, namun kebanyakan antibiotik yang dihasilkan bakteri adalah
polipeptid yang terbukti kurang stabil, toksik dan sukar dimurnikan (Suwandi 1989).
Telah banyak penelitian yang dilakukan tentang mikroorganisme penghasil
antibiotik. Diantaranya adalah studi biosintesis antibiotik dan aktivitas antibiotik dari
jamur Penicillium chrysogenum (Sri et al. 2000), isolasi Actinomycetes dari tanah
sawah sebagai penghasil antibiotik (Ambarwati & Gama 2009), fungi penghasil
antibiotik dari fungi dermatofita (Kheira et al. 2007), aktivitas antibakteri ekstrak
Penelitian tentang mikroorganisme kitinolitik juga telah banyak dilakukan
diantaranya, keragaman genetik gen penyandi kitinase pada berbagai jenis bakteri dan
pemanfaatannya (Suryanto et al. 2006), potensi pemanfaatan isolat kitinolitik lokal
untuk pengendalian jamur ( Suryanto & Munir 2006), isolasi bakteri kitinolitik dan uji
aktivitas kitinase kasar (Ginting 2006) dan kajian pembiakan bakteri kitinolitik
Pseudomonas fluorescens dan Bacillus sp. Pada limbah organik dan formulasinya
sebagai pestisida hayati (Giyanto & Rustam 2009). Dengan semakin banyaknya
penelitian mengenai mikroorganisme penghasil antibiotik dan enzim kitinase maka
ketertarikan di bidang ini semakin meningkat.
Dalam beberapa kasus, mikroba digunakan dalam pengendalian fungi yang
mengganggu pertumbuhan berbagai jenis tanaman (Irawati 2008). Beberapa
diantaranya adalah Phytium sp. yang menyebabkan busuk benih, busuk akar dan
busuk pada tanaman, Ganoderma boninense yang menyebabkan busuk pangkal batang
yang sering ditemukan pada tanaman kelapa sawit dan Fusarium oxysporum yang
merupakan salah satu fungi patogen penyebab penyakit layu dan rebah kecambah
pada cabai (Semangun 2000).
Menurut
mempunyai pH rata-rata di bawah 5. Dewanta (2006) dan Irawati (2008) telah
meneliti bakteri penghasil enzim kitinase dari tanah Bangka yang berpotensi
menghambat pertumbuhan fungi patogen tanaman yaitu G. boninense dan
F. oxysporum. Hasil penelitian menunjukkan adanya kemampuan menghambat jamur.
Pada penelitian ini dilakukan isolasi bakteri kitinolitik dan bakteri antijamur dari tanah
Bangka dan menguji kemampuan hambatan terhadap G. boninense dan F. oxysporum.
Berdasarkan pemaparan di atas, pencarian bakteri penghasil antijamur dan
bakteri penghasil enzim kitinase baru dengan kemampuan yang lebih baik harus
dilakukan. Salah satunya adalah dengan upaya penelitian dan pengujian lebih lanjut
1.2Permasalahan
Bakteri kitinolitik dan bakteri antijamur diketahui memberikan manfaat sebagai
pengendali penyakit tanaman, tetapi informasi tentang kedua bakteri ini yang berasal
dari tanah Bangka masih perlu dikembangkan. Oleh karena itu perlu dilakukan
pencarian dan pengujian terhadap jamur patogen tanaman F. oxysporum dan
G. boninense secara in vitro dan pengujian kombinasi antara bakteri kitinolitik dan
bakteri antijamur untuk menghambat penyakit layu Fusarium
1.3Tujuan Penelitian
a. Untuk mengetahui potensi isolat bakteri tanah dalam menghambat
pertumbuhan jamur patogen tanaman F. oxysporum dan G. boninense secara
in vitro.
b. Untuk mengetahui kemampuan kombinasi antara bakteri kitinolitik dan bakteri
antijamur sebagai agen biokontrol F. oxysporum pada benih cabai merah.
1.4Hipotesis
a. Isolat bakteri tanah mampu menghambat pertumbuhan jamur patogen tanaman
F. oxysporum dan G. boninense secara in vitro.
b. Isolat bakteri tanah mampu menghambat pertumbuhan jamur F. oxysporum
1.5Manfaat Penelitian
a. Sebagai bahan informasi bagi pihak-pihak yang memerlukan tentang potensi
isolat bakteri asal tanah Bangka dalam menghambat jamur patogen tanaman
F. oxysporum dan G. boninense.
b. Dapat meningkatkan kualitas benih cabai merah terhadap serangan jamur
BAB 2
TINJAUAN PUSTAKA
2.1 Bakteri Penghasil Antijamur
Banyak dari kita menyangka bahwa semua bakteri menyebabkan penyakit.
Sesungguhnya hanya sebagian kecil saja yang memiliki potensi patogen, selebihnya
dapat dimanfaatkan untuk tujuan kesejahteraan manusia (Suryanto 2008). Padahal
tanpa disadari mikroorganisme melakukan banyak hal berguna bagi hidup seperti
keterlibatannya dalam siklus biogeokimia, penyedia senyawa tertentu di atmosfer dan
tanah. Salah satu nilai penting dari mikroorganisme adalah kemampuannya
menghasilkan metabolit sekunder seperti antibiotik. Mikroba di lingkungan sangat
beragam dan memiliki banyak aktivitas metabolisme dan produk-produk yang dapat
diaplikasikan dibidang industri. Namun, >99% mikroba di lingkungan tersebut tidak
dapat dikulturkan di bawah kondisi laboratorium, sehingga banyak potensi-potensi
yang belum dapat dimanfaatkan (Singh 2009).
Lingkungan tanah merupakan lingkungan yang terdiri dari gabungan antara
lingkungan abiotik dan lingkungan biotik. Gabungan dari kedua lingkungan ini
menghasilkan suatu wilayah yang dapat dijadikan sebagai tempat tinggal bagi
beberapa jenis makhluk hidup, salah satunya adalah mesofauna tanah (Rao 1994).
Organisme hidup dalam tanah antara lain bakteri, fungi, algae, dan protozoa
(Suwandi 1989). Selain jamur maupun bakteri ada juga mikroorganisme lain yang
dapat digunakan sebagai agen pengendali hayati, yaitu Actinomycetes yang termasuk
dalam dunia bakteri yang dapat memproduksi antibiotik (Sektiono et al. 2010).
Antibiotik merupakan substansi kimia alamiah hasil metabolisme sekunder
mikroorganisme, dalam konsentrasi yang rendah mempunyai kemampuan baik
menghambat pertumbuhan maupun membunuh mikroorganisme lain (Lay 1994).
yang mengancam keberadaannya. Substansi antibiotik ini menunjukkan aktivitas
toksisitas selektif dan mungkin berbeda pada tipa organisme. Antibiotik yang
diharapkan ke depan adalah antibiotik yang dapat menghambat pertumbuhan patogen
tapi tidak mempengaruhi inangnya (Gale 1960).
Berdasarkan toksisitasnya, antibiotik dibagi dalam 2 kelompok, yaitu
antibiotik dengan aktivitas bakteriostatik bersifat menghambat pertumbuhan mikroba
dan aktivitas bakterisida bersifat membinasakan mikroba lain. Antibiotik tertentu
aktivitasnya dapat ditingkatkan dari bakteriostatik menjadi bakterisida bila
konsentrasinya ditingkatkan (Suwandi 1989). Diantara semua mikroorganisme
penghasil antibiotik ini, bakteri aktinomisetes merupakan mikroorganisme penting
karena menghasilkan banyak sekali jenis antibiotik. Trimujoko (2005) telah berhasil
mengkoleksi beberapa jenis Actinomycetes yang mampu menghambat patogen
tanaman yang bersifat tular tanah (soil born). Hal ini tidak mengherankan karena
hampir 2/3 anggotanya diketahui memproduksi antibiotika di dalam tanah dan dapat
hidup secara saprofitik di dalam tanah. Meski demikian diperkirakan hanya 1-3% dari
semua jenis antibiotik yang dihasilkan oleh mikroorganisme baru ditemukan (Baltz
2005).
2.2 Bakteri Penghasil Enzim Kitinase
Mikroorganisme kitinolitik adalah mikroorganisme yang dapat mendegradasi kitin
dengan menggunakan enzim kitinase. Mikroorganisme ini dapat diperoleh dari
berbagai sumber seperti rizosphere, phyllosphere, tanah atau lingkungan air seperti
laut, danau atau limbah udang dan sebagainya. Selain lingkungan mesofil,
mikroorganisme kitinolitik juga dapat diisolasi dari lingkungan termofilik seperti
sumber air panas, daerah geotermal dan lain-lain (Herdyastuti et al. 2009).
Mikroba kitinolitik dapat ditapis dengan menggunakan medium mengandung
kitin. Mikroba diisolasi dari contoh dengan menggunakan medium garam koloidal
kitin disesuaikan dengan kondisi lingkungan darimana isolat berasal. Pembentukan
Selain bakteri penghasil antibiotik, bakteri kitinolitik juga berperan dalam
pengendalian hama dan penyakit tanaman (Suryanto & Munir 2006). Pada bidang
pertanian berfungsi sebagai agen biokontrol terhadap fungsi patogen maupun serangga
hama yang umumnya memiliki komponen kitin pada dinding selnya (Muharni 2009).
Seperti hasil pengujian daya hambat pertumbuhan beberapa jamur patogen tanaman
yang dilakukan oleh Suryanto & Munir (2006) mengindikasikan kemampuan
menghambat pertumbuhan jamur F. semitectum. Selain itu, enzim kitinase yang
dihasilkan oleh mikroorganisme kitinolitik mempunyai potensi tinggi untuk
mendegradasi limbah yang mengandung kitin, karena dengan adanya enzim kitinase
memungkinkan konversi kitin yang melimpah menjadi produk yang berguna
(Akhdiya 2003).
Mengingat pentingnya peranan kitinase dalam industri, maka berbagai usaha
akan dilakukan untuk meningkatkan produktivitas dan aktivitasnya antara lain,
mencari dan mengembangkan mikroorganisme baru yang memiliki kemampuan
memproduksi kitinase serta menseleksi strain mikroorganisme penghasil kitinase yang
tinggi (Muharni 2009). Adanya mikroorganisme yang unggul merupakan salah satu
faktor penting dalam usaha produksi enzim. Oleh karena itu, penggalian
mikroorganisme indigenous penghasil kitinase perlu dilakukan di Indonesia.
Keragaman hayati yang tinggi memberikan peluang yang besar untuk mendapatkan
mikroorganisme yang potensial untuk dikembangkan sebagai penghasil enzim
(Akhdiya 2003).
2.3 Ganoderma boninense
Busuk pangkal batang kelapa sawit disebabkan oleh G. boninense, yang dulu
disebut sebagai Fomes lucidus (W. Curt) Fr., Forma boninense Sacc., dan Ganoderma
miniatocinctum stey. Busuk pangkal batang (basal stem rot) adalah penyakit
terpenting pada perkebunan kelapa sawit dewasa ini termasuk indonesia
(Semangun 2000). Penelitian tentang penyakit busuk pangkal batang ini sudah banyak
dilakukan salah satunya yaitu Efektivitas introduksi fungi endofit pada bibit kelapa
(Irfan 2009). Cendawan G. boninense merupakan patogen tular tanah yang merupakan
parasitik fakultatif dengan kisaran inang yang luas dan mempunyai kemampuan
saprofitik yang tinggi (Risanda 2008). Fungi patogen ini biasanya dapat masuk ke
dalam badan tumbuhan melalui luka, lubang alami seperti hidatoda atau dengan
menembus permukaan tumbuhan yang utuh (Pelczar & Chan 2005).
Gejala yang ditimbulkan karena penyakit busuk pangkal batang kelapa sawit
yaitu pelepah daun tampak layu dan bewarna pucat, selanjutnya daun akan mengalami
nekrosis yang dimulai dari bagian daun paling tua hingga menyebar ke bagian daun
yang lebih muda. Selanjutnya pelepah daun akan patah dan menggantung. Daun
tombak (pupus) yang baru muncul tidak membuka dan berkumpul lebih dari tiga
helai. Dalam kondisi serangan yang berat, setelah 6-12 bulan muncul gejala serangan
pada daun, pangkal batang menghitam dan keluar getah pada bagian yang terinfeksi
sehingga tanaman akan tumbang dan mati (Fauzi et al. 2008).
Miselium G.boninense berwarna putih seperti kapas. Warna koloni permukaan
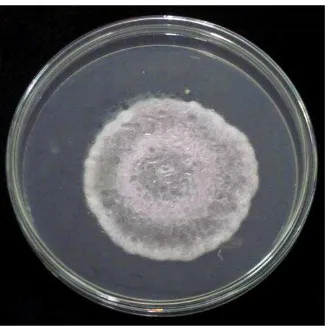
atas putih dan warna koloni permukaan bawah krem hingga kekuningan (Gambar
2.3.1)
Gambar 2.3.1 Koloni G. boninense pada media PDA umur 5 hari
2.4 Fusarium oxysporum
Fusarium oxysporum adalah jamur patogen yang dapat menginfeksi tanaman dengan
kisaran inang sangat luas (Mess et al. 1999). Jamur ini menyerang jaringan bagian
aliran air pada jaringan xylem (De Cal et al. 2000). Cendawan membentuk konidium
yang disebut sporodokium yang dibentuk pada permukaan tangkai atau daun sakit
pada tingkat yang telah lanjut. Konidiofor bercabang dan rata-rata mempunyai
panjang 70 μm. Cabang cabang samping biasanya bersel satu, panjang sampai 14 μm, konidium terbentuk pada ujung cabang utama dan pada cabang samping.
Mikrokonidium bersel satu atau dua, hialin, jorong atau agak memanjang, berukuran
5–7 x 2,5-3 μm. Mikronodium berbentuk sabit, bertangkai kecil, kebanyakan bersel 4, berukuran 22–6 x 4–5 μm. klamidospora bersel satu, jorong atau bulat, berukuran 7– 13 x 7–8 μm, terbentuk di tengah hifa atau pada makrokonidium, sering kali berpasangan (Semangun 2000). Pada keadaan yang tidak menguntungkan untuk
kelangsungan hidupnya, cendawan ini dapat membentuk klamidospora yang dapat
bertahan lama di dalam tanah (Alexopoulus & Mims 1979).
Koloni F. oxysporum pada media Potato Dextrosa Agar yang ditumbuhkan
pada suhu 25º C mencapai diameter 3,5-5,0 cm dalam waktu 3 hari. Miselia tampak
jarang atau banyak seperti kapas, kemudian menjadi seperti beludru, berwarna putih
atau salem dan biasanya agak keunguan yang tampak lebih kuat dekat permukaan
medium (Gambar 2.4.2). Permukaan bawah berwarna kekuningan hingga keunguan
(Gandjar et al. 1999).
Gambar 2.4.1 Koloni F. oxysporum pada media PDA umur 4 hari
Cendawan penyebab penyakit ini hidup di dalam tanah, masuk ke dalam akar
melalui lubang-lubang alami atau luka, lambat laun masuk ke bonggol. Dari sini
sebelum masuk ke batang semu/palsu. Pada tingkat infeksi lanjut miselium akan
meluas dari jaringan pembuluh ke parenkhim, selanjutnya patogen membentuk
konidia dalam jaringan tanaman dan mikrokonidia dapat terangkut melalui xilem
dalam arus transpirasi (Sulyo 1992). Konidia ini dapat berkembang menjadi
klamidospora yang dapat kembali masuk ke dalam tanah ketika jaringan yang
terinfeksi mati dan membusuk. Klamidospora ini tetap hidup dan bertahan dalam
jangka waktu yang cukup lama di dalam tanah . siklus penyakit akan berulang bila
klamidospora ini berkecambah dan tumbuh kembali baik sebagai saprofit atau
menyerang tanaman inang (Winarsih 2007), sehingga tanaman inang menjadi layu.
Di Indonesia penyakit layu sudah lama dikenal, tetapi pada umumnya orang
menduga bahwa penyakit ini hanya satu macam yaitu yang disebabkan oleh bakteri
(Pseudomonas solanacearum). Di negara-negara lain sudah lama dikenal bahwa
sebagian dari penyakit layu pada tanaman Solanaceae disebabkan oleh Fusarium
(Semangun 2000). Famili Solanaceae (tomat, kentang, cabai dan tanaman lainnya)
diinfeksi oleh jamur yang dapat menyebabkan layu Fusarium dan layu Verticillium.
Cabai merah (Capsicum annuum L.) termasuk dalam s
Tanaman cabai diperbanyak melalui biji yang ditanam dari tanaman yang sehat serta
bebas dari hama dan penyakit. Penggunaan benih yang unggul dan bermutu tinggi
merupakan syarat mutlak untuk mendapatkan produksi tanaman yang menguntungkan
secara ekonomis (Syamsuddin 2003), akan tetapi, bertanam cabai dihadapkan dengan
berbagai masalah (resiko), salah satu penyakit yang sering menyerang cabai adalah
layu Fusarium. Penyakit ini menghambat pertumbuhan cabai bahkan menyebabkan
kematian. Sehingga diperlukan suatu cara untuk mengatasinya. Upaya pengendalian
penyakit layu fusarium telah dilakukan namun petani belum menemukan cara
pengendalian yang benar-benar efektif dan ramah lingkungan. Peyebaran penyakit
layu fusarium yang cepat semakin memperparah keadaan, sehingga penggunaan
pestisida sintetis (fungisida) menjadi alternatif terakhir untuk mengendalikan patogen
Fusarium sp. di pertanaman cabai merah. Penggunaan fungisida mengakibatkan
patogen menjadi tahan terhadap fungisida, menimbulkan ras Fusarium baru, serta
dapat menimbulkan pencemaran lingkungan. Pengendalian patogen Fusarium sp.
lingkungan, yaitu dengan menerapkan metode ketahanan terimbas dan virokontrol
dengan mikovirus (Nugraheni 2010).
Menurut Prajnanta (1999), layu Fusarium biasa menyerang pada area
penanaman cabai. Gejala awal dari penyakit layu Fusarium adalah pucat tulang-tulang
daun, terutama daun-daun atas , kemudian diikuti dengan menggulungnya daun yang
lebih tua (epinasti) karena merunduknya tangkai daun, dan akhirnya tanaman menjadi
layu keseluruhan (Agrios 1988). Kadang-kadang kelayuan didahului dengan
menguningnya daun, terutama daun-daun bawah. Kelayuan dapat terjadi sepihak.
Pada tanaman yang masih sangat muda penyakit dapat menyebabkan tanaman mati
secara mendadak, karena pada pangkal batang terjadi kerusakan, sedangkan tanaaman
dewasa yanag terinfeksi sering dapat bertahan terus dan membentuk buah tetapi
hasilnya sanagat sedikit dan kecil-kecil (Semangun 2000).
2.6 Pengendalian Hayati Fungi Patogen Tanaman
Pengendalian jamur patogen tanaman dapat dilakukan dengan menggunakan agen
pengendali hayati. Agen pengendali hayati mikroba lebih aman digunakan karena
sedikit kemungkinan merugikan lingkungan dan mempunyai prospek yang baik,
sehingga menjadi pilihan alternatif dari penggunaan pestisida (Kobayashi et al. 2002).
Kesempatan untuk menemukan agen biokontrol untuk jamur patogen sangat besar,
mengingat Indonesia merupakan negara dengan biodiversitas yang tinggi. Mekanisme
penghambatan pertumbuhan oleh agen biokontrol terhadap jamur patogen tanaman
dapat melalui antibiotik yang dihasilkannya (Yuliar 2008).
Pengendalian hayati terhadap fungi patogen tanaman telah banyak dilakukan,
diantaranya F. oxysporum penyebab penyakit rebah kecambah, layu fusarium pada
cabai (Soesanto et al. 2008 ; Suryanto et al. 2010), penghambatan pertumbuhan jamur
dari tiga tanaman ekonomi Sumatera Utara oleh bakteri kitinolitik (Suryanto et al.
2010) G. boninense (Wibowo 2008) penyebab penyakit busuk pangkal batang. Masih
banyak lagi fungi patogen tanaman yang saat ini belum diketahui jenisnya dan
BAB 3
BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan April 2011 sampai Juli 2011, bertempat di
Laboratorium Mikrobiologi Departemen Biologi, Fakultas Matematika dan Ilmu
Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah: cawan petri (petridish), nampan
plastik ukuran 30 cm x 22 cm x 10 cm, tabung reaksi, rak tabung reaksi, gelas beaker,
gelas ukur, pipet serologi, karet penghisap, spatula, hockey stick, jarum ose, autoklaf,
oven, mikroskop, jangka sorong.
Bahan-bahan yang digunakan dalam penelitian ini antara lain: sampel tanah
dari Bangka yang diambil dari 19 titik pengambilan sampel, media Nutrien Agar
(NA), Potato Dextrose Agar (PDA), yeast extract, tripton, blank disc (Oxoid) dan
ketokonazol, medium garam minimum kitin (MGMK) dengan pH 6,8, aquadest,
alkohol 70%, Zat warna pewarnaan Gram, media-media uji Biokimia (Triple Sugar
Iron Agar (TSIA), Simon’s Citrat Agar (SCA), Sulfid Indol Motility (SIM), Glukosa,
H2O2 3%, gelatin), aluminium foil, isolat jamur, Fusariumoxysporum dan Ganoderma
boninense, yang diperoleh dari Laboratorium Mikrobiologi Departemen Biologi
Universitas Sumatera Utara. Isolat ditumbuhkan dalam media PDA dan diinkubasi
pada suhu 25-30°C selanjutnya disimpan di dalam kulkas hingga saatnya digunakan.
Sampel tanah diperoleh dari tanah Bangka. Sampel diambil sebanyak 100 g dengan
menggunakan sendok steril dan dimasukkan ke dalam kantong plastik yang telah
disterilkan. Sampel dibawa ke laboratorium untuk diisolasi. Sedangkan benih yang
digunakan adalah benih cabai merah komersial yang diperoleh dari pasar tradisional di
kota Medan.
3.4 Isolasi Bakteri Penghasil Antijamur dari Sampel Tanah
Sampel tanah ditimbang sebanyak 1 g, kemudian dimasukkan ke dalam tabung reaksi
dan dicukupkan volumenya menjadi 10 ml dengan menambahkan akuades steril. Lalu
dihomogenkan dengan vortex. Selanjutnya sebanyak 0,1 ml suspensi tanah
diinokulasikan pada media PDA + 0,5% yeast extract + 0,5% tripton (PDA-YT)
dalam cawan Petri, kemudian diratakan dengan menggunakan hockey stick. Kultur
diinkubasi dalam inkubator suhu 30º C selama 4 hari. Pengamatan dilakukan setiap
hari selama masa inkubasi. Isolat bakteri yang memiliki kemampuan menghambat
jamur ditunjukkan dengan zona bening di sekitar koloninya. Isolat ini kemudian
ditumbuhkan kembali pada media yang sama hingga nanti diperoleh isolat murni.
3.5 Karakterisasi Morfologi dan Identifikasi Bakteri Penghasil Antijamur
Identifikasi bakteri dilakukan berdasarkan ciri-ciri dan karakter morfologis, secara
makroskopis (visual) maupun mikroskopis. Karakterisasi dan identifikasi secara visual
berdasarkan bentuk, tepi, elevasi dan warna koloni. Isolat-isolat yang diperoleh
dilakukan karakterisasi sifat morfologi mencakup pewarnaan Gram, bentuk sel, tepi,
elevasi dan warna koloni. Pengamatan sifat biokimia mencakup uji sitrat (SCA), uji
katabolisme gula (TSIA), uji hidrolisis pati, uji motilitas (SIM), uji gelatin (nutrien
gelatin), dan uji katalase (larutan H2O2 3%).
Isolat bakteri yang telah diperoleh ditumbuhkan di Medium Garam Mineral Kitin
(MGMK) (Suryanto 2001). Isolat bakteri kitinolitik dapat diseleksi dengan
kemampuan mendegradasi media agar kitin yang dapat dilihat dengan adanya zona
bening di sekitar koloni bakteri (Muharni 2009). Bakteri yang memiliki zona bening
dikelompokkan ke dalam bakteri kitinolitik sedangkan yang tidak memiliki zona
bening dikelompokkan ke dalam bakteri antijamur.
3.7 Uji Antagonisme Isolat Bakteri Kitinolitik Terhadap F. oxysporum dan G. boninense.
Bakteri kitinolitik diremajakan di media koloidal kitin selama 72 jam pada suhu 30oC.
Kemampuan bakteri kitinolitik dalam menghambat pertumbuhan fungi diuji dengan
uji antagonisme in vitro dalam cawan Petri. Biakan fungi ditumbuhkan di tengah
media MGMK dengan jarak 3,5 cm dari cakram tempat inokulum bakteri. Biakan
tersebut diinkubasi selama 72 jam pada suhu ruang. Selanjutnya suspensi bakteri
kitinolitik yang telah dibuat dengan konsentrasi ≈ 10 8 sel/ml (standart McFarland) diinokulasikan pada cakram dengan diameter 0,6 cm di bagian tepi media kitin
sebanyak 10 μl, dibuat 2 kali pengulangan. Biakan diinokulasi pada suhu 30oC.
Akitivitas penghambatan ditentukan berdasarkan zona hambat yang terbentuk di
sekitar koloni. Pengamatan dimulai dari hari ke-2 sampai hari ke-7 (Irawati 2008).
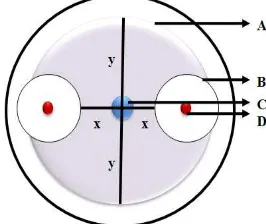
Gambar 3.7.1. Metode pengukuran zona hambat bakteri kitinolitik terhadap koloni jamur; A. Koloni jamur; B. Zona hambat bakteri kitinolitik terhadap koloni jamur; C. Titik tengah jamur diletakkan; D. Koloni bakteri kitinolitik; x. Diameter koloni jamur yang terhambat pertumbuhannya; y. Diameter koloni jamur normal (Suryanto 2001)
Pengukuran pertumbuhan fungi patogen dilakukan dengan cara mengukur
pertumbuhan fungi patogen pada sumbu Y (lihat skema di atas), dilakukan setelah
terjadi penghambatan bakteri kitinase terhadap fungi patogen dengan rumus uji
antagonis antagonis X-Y = hasil (Martorejo, 2001).
2
3.8 Uji Antagonisme Isolat Bakteri Penghasil Antijamur Terhadap F. oxysporum dan G. boninense
Bakteri antijamur diremajakan di media PDA-YT selama 72 jam pada suhu 30oC.
Kemampuan bakteri antijamur dalam menghambat pertumbuhan fungi diuji dengan
uji antagonisme in vitro dalam cawan Petri. Biakan fungi ditumbuhkan di tengah
media PDA-YT dengan jarak 3,5 cm dari cakram tempat inokulum bakteri. Biakan
tersebut diinkubasi selama 72 jam pada suhu ruang. Selanjutnya suspensi bakteri
penghasil antijamur yang telah dibuat dengan konsentrasi ≈ 10 8 sel/ml (standart McFarland) diinokulasikan pada cakram dengan diameter 0,6 cm di bagian tepi media
PDA-YT sebanyak 10 μl. Perlakuan diulangi sebanyak 2 kali. Kemudian diinokulasi pada suhu 30oC. Aktivitas penghambatan ditentukan berdasarkan zona hambat yang
terbentuk di sekitar koloni. Pengamatan dimulai dari hari ke-2 sampai hari ke-7.
3.9 Pengamatan Struktur Hifa Abnormal
Pengamatan secara mikroskopis dilakukan dengan cara mengamati ujung miselium
pada daerah zona hambat fungi patogen (Wibowo 2008). Ujung miselium fungi
patogen yang tumbuh pada permukaan media PDA dipotong berbentuk block square,
kemudian diletakkan pada objek glass. Selanjutnya diamati adanya abnormalitas
pertumbuhan miselium fungi patogen, berupa pembengkokan ujung miselium,
miselium pecah, miselium berbelah, miselium bercabang, miselium lisis dan miselium
tumbuh kerdil (Lorito et al. 1992).
Pengujian isolat bakteri antijamur potensial dengan metode difusi cakram. Dua isolat
bakteri kitinolitik yang memiliki diameter zona hambat tertinggi diuji dengan 2 isolat
bakteri yang memiliki zona hambat tertinggi pada uji antagonisme diuji kembali.
Cakram yang telah diberikan dengan 10 μl suspensi isolat bakteri penghasil antibiotik dengan konsentrasi 108 sel/ml diletakkan di atas sebaran isolat bakteri kitinolitik pada
cawan petri, kemudian diinkubasi selama 24 jam pada suhu 30°C. Pengamatan
dilakukan dengan pengukuran zona hambat yang terbentuk di sekitar kertas cakram
hingga hari keempat inkubasi. Diulangi perlakuan dengan cara bakteri antijamur
disebar pada media dan bakteri kitinolitik diteteskan pada cakram uji.
3.11 Uji Patogenitas F. oxysporum
Biakan F. oxysporum yang telah diremajakan di cawan Petri selama 7 hari
diinokulasikan pada 100 ml media PDB di dalam labu Erlenmeyer 250 ml dan
diinkubasi pada suhu 30oC selama 10 hari. Sebanyak 100 ml suspensi biakan
F. oxysporum dicampur dengan 500 g campuran tanah dan kompos steril (nisbah 3:1)
di dalam nampan plastik berukuran 30 cm x 22 cm x 10 cm. Ke dalam tiap nampan
ditanam 30 benih cabai lalu ditutup dengan plastik. Benih yang ditanam pada media
yang tidak diinokulasi F. oxysporum digunakan sebagai kontrol. Peubah yang diamati
adalah tanaman yang terserang rebah kecambah selama masa persemaian 30 hari.
Persentase rebah kecambah dihitung dari jumlah kecambah yang rebah dibagi jumlah
seluruh kecambah yang tumbuh (Suryanto et al. 2010).
Reisolasi dilakukan terhadap F. oxysporum dengan memotong jaringan pada
pangkal batang kecambah yang menunjukkan gejala rebah kecambah. Jaringan
tersebut didesinfeksi dengan larutan 2% NaClO, dicuci dengan air steril sebanyak tiga
kali dan ditanam pada media PDA. Isolat yang diperoleh diuji kembali patogenitasnya
sesuai dengan postulat Koch (Pelczar & Chan 2005).
Sebanyak 100 ml suspensi biakan F. oxysporum dicampur dengan 500 g campuran
tanah dan kompos steril (nisbah 3:1) dalam nampan plastik berukuran 30 cm x 22 cm
x 10 cm. Ke dalam tiap nampan ditanam 30 benih cabai yang telah direndam dengan
campuran suspensi bakteri kitinolitik dan bakteri antijamur selama 30 menit lalu
ditutup dengan plastik. Benih yang ditanam pada media yang tidak diinokulasi F.
oxysporum digunakan sebagai kontrol. Ulangan dilakukan sebanyak tiga kali untuk
masing-masing perlakuan. Peubah yang diamati adalah tanaman yang terserang rebah
kecambah, tinggi tanaman, jumlah daun, dan berat kering kecambah selama
persemaian 30 hari. Pengurangan persentase rebah kecambah dihitung dari rumus :
Pengurangan rebah kecambah =
Pengukuran tinggi kecambah dilakukan dengan batas terbawah bagian batang
yang tepat pada permukaan tanah, sedangkan batas teratas dihitung hingga ujung daun
yang diluruskan ke atas sejajar batang (Sitompul & Guritno 1995). Pengukuran berat
kering kecambah dilakukan pada akhir pengamatan melalui penimbangan kecambah
yang sudah dikeringkan pada suhu 80oC selama jangka waktu tertentu sampai
diperoleh berat kering yang konstan (Sitompul & Guritno 1995).
[{∑ (Kontrol(-)-∑(Kontrol(+)} - ∑ kecambah rebah]
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Isolasi dan Karakter Bakteri Penghasil Antijamur
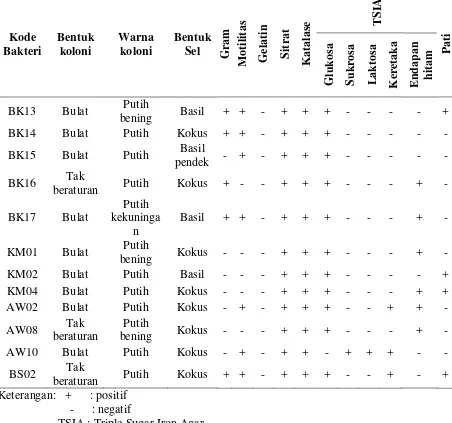
Hasil isolasi dari 19 titik pengambilan sampel tanah Bangka diperoleh 12 isolat
bakteri penghasil antijamur. Berdasarkan pengamatan yang dilakukan terhadap 12
isolat bakteri antijamur tersebut diperoleh karakter yang bervariasi seperti pada Tabel
4.1.1. Dari Tabel 4.1.1 diketahui bahwa 9 isolat yaitu BK 13, BK14, BK 15, BK 17,
KM01, KM02, KM04, AW02 dan AW10, berbentuk bulat, sedangkan 3 isolat lainnya
yaitu BK16, AW08 dan BS02 berbentuk tak beraturan. Warna koloni juga bervariasi,
1 isolat yaitu BK 17 berwarna putih kekuningan, 3 isolat yaitu BK 13, KM01 dan
AW08 berwarna putih bening, dan 8 isolat lainnya yaitu BK 14, BK15, BK 16,
KM02, KM04, AW02, AW10 dan BS02 berwarna putih. Beberapa isolat yang
merupakan hasil isolasi dapat dilihat pada Gambar 4.1.1. Bentuk sel masing-masing
isolat berbentuk kokus kecuali BK13, BK17 dan KM02 berbentuk basil dan BK15
berbentuk basil pendek. Berdasarkan pewarnaan gram, isolat BK 13, BK 14, BK 16,
BK 17, dan BS02 termasuk ke dalam Gram positif, sedangkan isolat lainnya yaitu BK
15, KM01, KM02, KM04, AW02, AW08, dan AW10 termasuk ke dalam Gram
negatif.
Menurut Lay (1994), pewarnaan Gram merupakan tahap penting dalam
pencirian dan identifikasi bakteri. Menurut Hadiotomo (1990), ciri-ciri bakteri gram
positif adalah struktur dinding selnya tebal, sekitar 15-80 nm, berlapis tunggal atau
monolayer. Dinding selnya mengandung lipid yang lebih normal (1-4%),
peptidoglikan ada yang sebagai lapisan tunggal. Komponen utama merupakan lebih
dari 50% berat ringan. Mengandung asam tekoat. Bersifat lebih rentan terhadap
penisilin. Pertumbuhan dihambat secara nyata oleh zat-zat warna seperti ungu kristal.
fisik., bakteri Gram positif juga dapat menghasilkan bahan-bahan yang
menguntungkan. Contohnya, antibiotik yang dihasilkan oleh bakteri dari kelompok
Actinomycetes. Antibiotik membunuh bakteri-bakteri Gram positif lainnya dengan
cara mencegah bakteri tersebut membentuk protein. Sedangkan Gram negatif
berwarna merah karena kompleks tersebut larut sewaktu pemberian larutan pemucat
dan kemudian mengambil zat warna kedua yang berwarna merah. Ciri-ciri bakteri
gram negatif yaitu Struktur dinding selnya tipis, sekitar 10 – 15 mm, berlapis tiga atau
multilayer. Dinding selnya mengandung lemak lebih banyak (11-22%), peptidoglikan
terdapat didalam lapisan kaku, sebelah dalam dengan jumlah sedikit ± 10% dari berat kering, tidak mengandung asam tekoat. Kurang rentan terhadap senyawa penisilin.
Komposisi nutrisi yang dibutuhkan relatif sederhana. Tidak resisten terhadap
gangguan fisik.
Uji biokimia sederhana yang dilakukan meliputi uji motilitas, uji gelatin, uji
sitrat, uji katalase, uji hidrogen sulfida dan uji pati. Uji motilitas yang dilakukan
menunjukkan bahwa 7 isolat yaitu BK13, BK14, BK15, BK17, AW02, AW10 dan
BS02 bersifat motil, sedangkan 5 isolat lainnya yaitu BK16, KM01, KM02, KM04
dan AW08 tidak bersifat motil. Hasil uji sitrat yang ditandai dengan perubahan media
dari hijau menjadi biru, mengindikasikan bahwa semua isolat mampu menggunakan
mampu menggunakan Na-sitrat sebagai satu-satunya sumber karbon. Dari uji katalase
dengan penambahan larutan H2O2 3% mengindikasikan bahwa semua isolat tidak
memiliki enzim katalase yang ditandai dengan tidak terbentuknya gelembung udara
disekitar koloni bakteri. Pada uji gelatinase semua isolat menunjukkan hasil yang
negatif yaitu tidak mencairnya media gelatin yang ditumbuhi oleh bakteri setelah
dimasukkan ke dalam freezer salama 30 menit. Sedangakan pada uji hidrolisis pati 4
isolat yaitu BK13, KM02, KM04 dan BS02 menunjukkan hasil positif dengan adanya
zona bening disekitar koloni yang telah diinkubasi selama 24 jam ketika ditetesi
dengan beberapa tetes iodine pada permukaan koloni bakteri. Hal ini menandakan
bahwa isolat tersebut mampu menghidrolisis pati dengan menghasilkan enzim
Tabel 4.1.1.Karakter morfologi koloni dan sel, dan sifat biokimia bakteri yang
Menurut Lay (1994), katalase adalah enzim yang mengkatalisasikan
penguraian hidrogen peroksida menjadi air dan O2. Hidrogen peroksida bersifat toksik
terhadap sel karena bahan ini menginaktivasikan enzim dalam sel. Hidrogen peroksida
terbentuk sewaktu metabolism aerob, sehingga mikroorganisme yang tumbuh dalam
lingkungan aerob harus menguraikan bahan toksik tersebut. Konsentrasi dalam
medium pembiakan Triple Sugar Iron Agar adalah 1/10 dari konsentrasi laktosa dan
sukrosa. Konsentrasi yang kecil ini dimaksudkan untuk mengetahui bila hanya
glukosa saja yang difermentasi, maka hasil fermentasi bagian “slant” karena sedikit,
oksigen lebih rendah, sehingga reaksi asam tetap dipertahankan. Pada uji gelatinase
dapat diketahui kemampuan mikroorganisme dalam menghidrolisis gelatin dan sifat
patogen galur mikroorganisme. Gelatin adalah protein yang diperoleh sewaktu
merebus tulang, tulang rawan atau jaringan ikat hewani lainnya. Protein ini bila
didinginkan membentuk “gel”. Beberapa mikroorganisme tertentu mampu
menguraikan molekul sehingga asam amino yang dihasilkan dapat digunakan sebagai
zat hara. Uji positif gelatinase ditandai dengan medium gelatin tetap cair setelah
dimasukkan ke dalam lemari pendingin selama 30 menit.
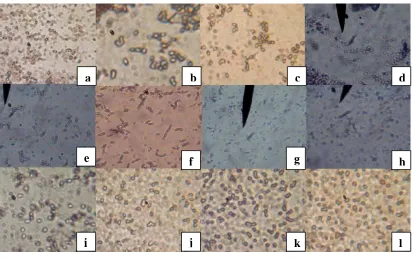
Gambar 4.1.1. Hasil pewarnaan Gram isolat (a) AW02, (b) BK15, (c) AW10, (d) KM02, (e) BK14, (f) BK13, (g) BK16, (h) AW08, (i) BS02, (j) KM01, (k) BK17 dan (l) KM04 (Perbesaran 100 x 10)
Sedangkan uji positif sitrat ditandai dengan berubahnya medium dari warna
hijau menjadi biru karena terjadi penghilangan asam dan peningkatan pH dalam media
yang menunjukkan bahwa mikroorganisme mampu menggunakan sitrat sebagai
satu-satunya sumber karbon. Sedangkan pada uji hidrolisis pati menunjukkan kemampuan
mikroorganisme menghasilkan enzim amilase, Kemampuan mikroorganisme
menghasilkan enzim amilase ditandai dengan terbentuknya zona bening di sekitar
koloni setelah ditambahkan dengan iodine. Zat pati bereaksi secara kimiawi dengan
iodine, reaksi ini terlihat sebagai warna biru-kehitaman. Warna biru kehitaman ini
terjadi bila molekul yodium masuk ke dalam bagian kosong pada molekul pati yang
berbentuk spiral. Proses ini menghasilkan molekul yang dapat mengabsorpsi semua
a b c d
e f
i j
g
k
h
cahaya, terkecuali warna biru. Bila zat pati telah diuraikan menjadi maltosa dan
glukosa, warna biru ini tidak terjadi karena tidak adanya bentuk spiral. Tidak
terbentuknya warna menunjukkan adanya hidrolisis pati (Lay 1994).
4.2 Hasil Pengujian Bakteri Penghasil Enzim Kitinase
Kemampuan bakteri dalam menghasilkan enzim kitinase dapat dilihat pada
pertumbuhan koloni bakteri yang ditanam pada media yang mengandung kitin.
Bakteri yang dapat menghasilkan enzim kitinase dibuktikan dengan adanya zona
bening di sekitar koloni bakteri. Dari hasil pengamatan yang dilakukan, dari 12 isolat
yang ditumbuhkan pada media MGMK 5 isolat yaitu BK13, BK14, BK15, BK16 dan
BK17 menunjukkan hasil yang positif yaitu adanya zona bening disekitar koloni, yang
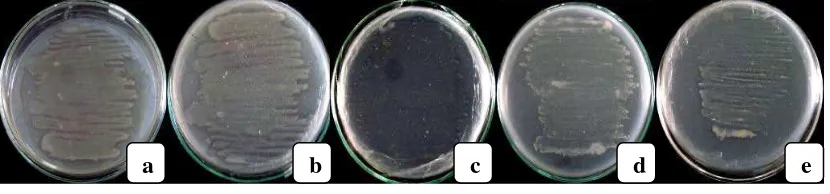
mengindikasikan bahwa kelima isolat tersebut menghasilkan enzim kitinase (Gambar
4.2.1).
Gambar 4.2.1. Isolat bakteri penghasil kitinase (a) BK13, (b) BK14, (c) BK15, (d) BK16 dan (e) BK17 pada media MGMK selama 3 hari
Menurut Suryanto & Munir (2006), mikroba kitinolitik dapat ditapis dengan
menggunakan medium yang mengandung kitin. Koloidal kitin merupakan salah satu
substrat yang dapat digunakan untuk menginduksi produksi enzim hidrolitik pada
fungi, bakteri dan aktinomisetes.
Menurut Muharni (2009), zona bening terbentuk karena terjadinya pemutusan
ikatan β−1, 4 homopolimer N-asetilglukosamin pada kitin oleh kitinase menjadi monomer N-asetilglukosamin. Susi (2002) menyatakan bahwa, besarnya zona bening
yang dihasilkan tergantung pada jumlah monomer N-asetilglukosamin yang dihasilkan
dari proses hidrolisis kitin dengan memutus ikatan β− 1, 4 homopolimer N-asetilglukosamin. Semakin besar jumlah monomer N-asetilglukosamin yang
dihasilkan maka akan semakin besar zona bening yang terbentuk di sekitar koloni.
4.3 Uji Antagonisme Isolat Bakteri Kitinolitik Terhadap Fungi Patogen
Hasil uji antagonisme 5 isolat bakteri kitinolitik terhadap fungi G. boninense dan F.
oxysporum menunjukkan bahwa kelima isolat bakteri kitinolitik mampu menghambat
pertumbuhan G. boninense dan F. oxysporum dengan kemampuan yang bervariasi.
Mekanisme penghambatan yang terjadi pada uji antagonisme dapat diamati dengan
terbentuknya zona bening sebagai zona penghambatan pertumbuhan bagi isolat
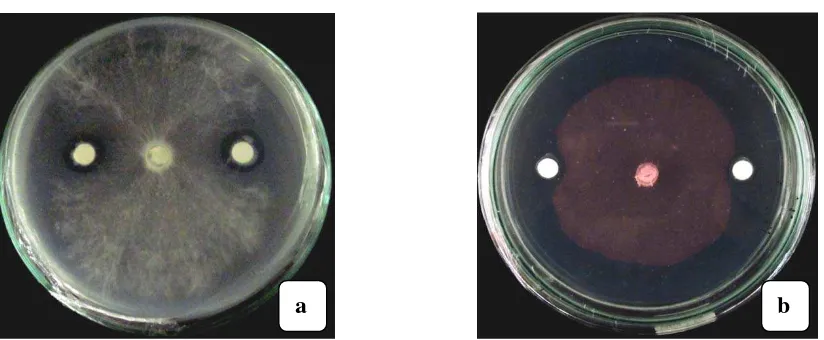
bakteri kitinolitik (Gambar 4.3.1)
Gambar 4.3.1. Uji antagonisme bakteri kitinolitik (a). terhadap G. boninense, (b) terhadap F. oxysporum pada media MGMK umur 4 hari
Zona hambat umumnya mulai teramati pada hari keempat dan jarak zona
hambat terus bertambah, sampai hari kedelapan. Bentuk zona hambat tersebut berupa
cerukan penipisan elevasi yang dapat dilihat pada Tabel 4.3.1. Efek penghambatan
masing-masing isolat bakteri kitinolitik tersebut terhadap fungi G. boninense dan F.
oxysporum dipengaruhi oleh keberadaan kitin pada media, sehingga kitinase pada
kelima isolat lebih cepat disekresikan. Adanya kitin pada media uji menyebabkan
produksi kitinase isolat bakteri tersebut terpacu untuk mendegradasi dinding sel fungi.
Ketika kitin yang ada di sekitar koloni sudah terurai maka bakteri kitinase akan
mengkolonisasi miselium fungi untuk menguraikan kitin yang ada pada dinding sel
fungi. Penguraian kitin pada dinding sel fungi menyebabkan penghambatan bagi
pertumbuhan fungi G. boninense dan F. oxysporum. Menurut Muharni (2009) kitin
sebagai substrat akan menginduksi aktivitas enzim kitinase. Kitinase merupakan
enzim yang mendegradasi kitin menjadi N-asetilglukosamin, degradasi kitin dapat
dilakukan oleh organisme kitinolitik dengan melibatkan enzim kitinase.
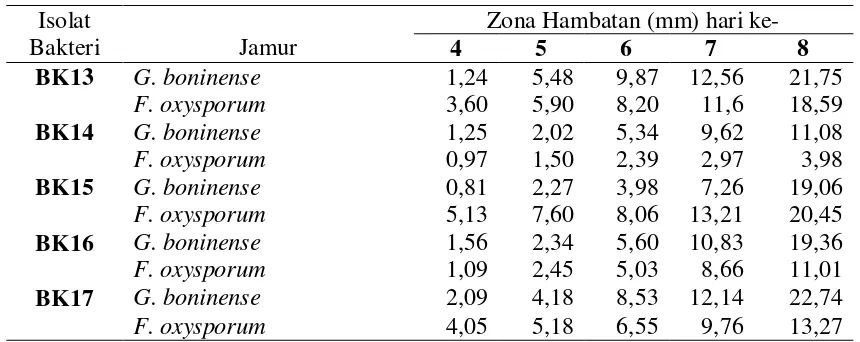
Tabel 4.3.1. Uji antagonisme antara lima isolat bakteri kitinolitik dengan G. boninense dan F. oxysporum
Isolat
Bakteri Jamur
Zona Hambatan (mm) hari ke-
4 5 6 7 8
Pada pengamatan hari kedelapan dari kelima isolat bakteri kitinolitik tersebut,
isolat yang menunjukkan efektivitas paling tinggi dalam menghambat pertumbuhan
jamur G. boninense adalah isolat BK17 dengan diameter 22,74 mm dan dan isolat
dengan efektivitas penghambatan terendah yaitu BK14 dengan zona hambat sebesar
11,08 mm. Untuk penghambatan F. oxysporum, isolat yang menunjukkan efektivitas
tertinggi adalah BK15 dengan diameter zona hambat sebesar 20,45 mm, dan isolat
dengan efektivitas penghambatan terendah yaitu BK14 dengan zona hambat sebesar
3,98 mm.
Selain kandungan kitin pada media uji, kandungan kitin pada dinding sel fungi
juga berpengaruh terhadap besarnya zona hambat isolat pada masing- masing fungi.
Menurut Rajaratham et al. (1998) semakin besar kandungan kitin pada dinding sel
maka semakin besar zona hambat yang terbentuk. Kitin pada jamur berbentuk
mikrofibril yang memiliki panjang yang berbeda tergantung pada spesies dan lokasi
selnya. Mikrofibril merupakan struktur utama dari dinding sel jamur dan terdiri atas
jalinan rantai-rantai polisakarida yang saling bersilangan membentuk anyaman.
Jalinan ini kuat berikatan pada matriks. Kandungan kitin pada jamur bervariasi dari
Pada mekanisme pertahanan tanaman terhadap fungi patogen, enzim kitinase
tidak hanya mendegradasi dinding sel fungi tetapi juga menghasilkan enzim kitinase.
Menurut Oku (1994), peranan kitinase dalam pertahanan tanaman terhadap serangan
patogen terjadi melalui dua cara, yaitu: (1) menghambat pertumbuhan fungi dengan
secara langsung menghidrolisis dinding miselia dan (2) melalui pelepasan elisitor
endogen oleh aktivitas kitinase yang kemudian memicu reaksi ketahanan sistemik
pada inang.
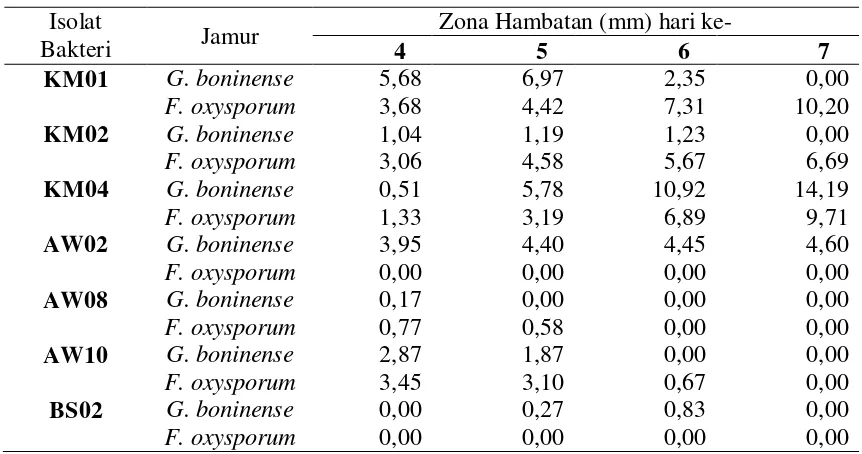
4.4 Uji Antagonisme Isolat Antijamur Terhadap Fungi Patogen
Hasil uji antagonisme 7 isolat bakteri antijamur terhadap fungi G. boninense dan F.
oxysporum menunjukkan bahwa ketujuh isolat bakteri antijamur mampu menghambat
pertumbuhan G. boninense dan F. oxysporum dengan kemampuan yang bervariasi..
Bentuk zona hambat tersebut berupa cerukan penipisan elevasi yang dapat dilihat pada
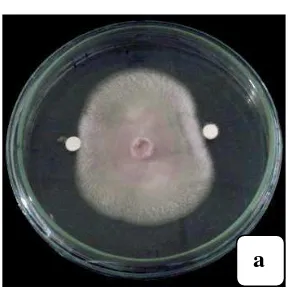
Gambar 4.4.1 berikut ini:
Gambar 4.4.1. Uji antagonis bakteri antijamur (a). terhadap F. oxysporum, (b). terhadap G. boninense pada media PDA-YT umur 4 hari
Zona hambat umumnya mulai teramati pada hari keempat dan jarak zona
hambat ada yang terus bertambah, sampai hari ketujuh dan ada juga yang semakin
berkurang. Hasil dari uji antagonisme ketujuh isolat bakteri antijamur tersebut dapat
dilihat pada Tabel 4.4.1:
Tabel 4.4.1. Uji antagonisme antara bakteri antijamur dengan G. boninense dan F. oxysporum
Isolat
Bakteri Jamur
Zona Hambatan (mm) hari ke-
4 5 6 7
Pada pengamatan hari ketujuh, ketujuh isolat bakteri antijamur tersebut, isolat
yang menunjukkan efektivitas paling tinggi dalam menghambat pertumbuhan jamur
G. boninense adalah isolat KM04 yaitu sebesar 14,19 mm dan isolat AW02 memiliki
efektifitas terendah yaitu sebesar 4,6 mm. Sedangkan kelima isolat lainnya pada
pengamatan hari ketujuh tidak lagi menunjukkan zona hambat. Akan tetapi pada
pengamatan hari keenam, KM02 dan BS02 masih menujukkan zona hambat yaitu
masing-masing sebesar 1,235 mm dan 0,83 mm. Sedangkan isolat lainnya yaitu KM01
dan AW10 memiliki zona hambat yang semakin berkurang setiap hari pengamatan
yaitu masing-masing hanya sebesar 2,35 mm dan 1,87 mm. Isolat AW08 tidak
memiliki zona hambat setelah hari keempat. Untuk penghambatan F. oxysporum,
isolat yang menunjukkan efektifitas paling tinggi adalah isolat KM01 yaitu sebesar
10,2 mm, dan isolat KM02 dengan efektivitas penghambatan terendah dengan zona
hambat sebesar 6,695 mm, dan 4 isolat lainnya tidak menunjukkan zona hambat
kecuali AW08 pada hari kelima yaitu sebesar 0,58 mm.
Variasi besarnya zona hambat pada masing-masing isolat menunjukkan tingkat
kemampuan yang berbeda-beda dari masing-masing isolat dalam menghasilkan bahan
antimikroba. Ukuran zona hambat kemungkinan dipengaruhi oleh sensivitas
oleh organisme. Menurut Cappucino & Sherman (1996), faktor-faktor yang
mempengaruhi timbulnya zona hambat berupa kemampuan difusi bahan antimikroba
ke dalam media dan interaksinya dengan mikroba yang diuji, jumlah mikroba yang
diujikan, kecepatan tumbuh mikroba uji, dan tingkat sensitifitas mikroba terhadap
bahan antimikroba.
Beberapa isolat seperti KM01 dan AW10 cenderung tidak memiliki
penghambatan lagi pada hari ketujuh, ini mungkin disebabkan karena konsentrasi
antimikroba yang dihasilkan tidak lagi mampu menghambat pertumbuhan jamur
patogen pada hari ketujuh. Kemampuan masing-masing isolat bakteri dalam
menghambat pertumbuhan jamur G. boninense dan F. oxysporum kemungkinan
disebabkan adanya senyawa antimikrobial yang dihasilkan oleh masing-masing
bakteri tersebut. Menurut Indratmi (2008), konsentrasi senyawa antimikrobia
mempunyai peranan yang penting. Umumnya mikroorganisme target akan mengalami
penghambatan pertumbuhan pada konsentrasi senyawa antimikrobia tertentu.
Dibawah konsentrasi tertentu senyawa antimikrobia menjadi tidak efektif lagi. Berarti
terdapat konsentrasi minimum yang efektif menghambat pertumbuhan suatu
organisme. Belum tampaknya efek antagonisme pada pengujian ini diduga senyawa
antimikrobia yang dihasilkan konsentrasinya masih terlalu rendah yaitu dibawah
konsentrasi minimum yang diperlukan untuk dapat menghambat pertumbuhan
miselium jamur.
Menurut Irawati (2008), kemampuan masing-masing isolat dalam menghambat
pertumbuhan fungi G. boninense, F. oxysporum dan P. citrinum belum tentu
merupakan peranan enzim kitinase semata, mungkin ada senyawa antimikrobial
lainnya yang dihasilkan oleh isolat yang mampu membantu enzim kitinase dalam
mendegradasi dinding sel fungi. Sedangkan menurut Weller et al. (1990), senyawa
metabolit yang dihasilkan suatu organisme meliputi antibiotik, enzim litik, senyawa
volatile dan zat lainnya yang bersifat toksik. Selain itu menurut Khalimi et al. (2010),
Kemampuan suatu agen hayati dalam menekan patogen biasanya melibatkan satu atau
beberapa cara mekanisme penghambatan. Mekanisme penghambatan bakteri terhadap
patogen adalah antibiotik, toksin, kompetisi ruang dan nutrisi. Mekanisme ini
4.5 Pengamatan Struktur Hifa Abnormal Jamur Patogen Setelah Uji Antagonis.
Pengamatan mikroskopis untuk melihat hifa abnormal Ganoderma boninense
dan F. oxysporum dilakukan pada hari kedelapan. Mekanisme antagonis yang terjadi
antara bakteri kitinolitik dan antijamur dengan G. boninense dan F. oxysporum
memiliki penghambatan hampir sama untuk semua isolat memiliki aktivitas antagonis
seperti menghambat pertumbuhan miselium dan penipisan dinding hifa G. boninense
dan F. oxysporum. Akibat aktivitas antagonis bakteri kitinolitik menyebabkan hifa G.
boninense dan F. oxysporum mengalami pertumbuhan yang abnormal yaitu berupa
hifa mengalami lisis, hifa mengalami pembengkokan, hifa menggulung, hifa kerdil,
hifa bercabang, hifa melilit dan hifa lisis. Akan tetapi akibat aktivitas antagonis
bakteri antijamur terhadap hifa G. boninense dan F. oxysporum mengalami
pertumbuhan yang abnormal tidak sebanyak pada aktivitas bakteri kitinolitik,
pertumbuhan yang abnormal hanya berupa hifa lisis, hifa membengkak dan hifa
keriting.
Dari hasil diatas dapat disimpulkan bahwa beberapa isolat bakteri kitinolitik
dan antijamur berpotensi untuk dikembangkan sebagai agen pengendali hayati fungi
patogen tanaman. Uji pendahuluan yang dilakukan untuk mengetahui kemampuan
bakteri kitinolitik menunjukkan bahwa terdapat isolat bakteri kitinolitik yang mampu
menghambat pertumbuhan fungi uji. Meski demikian, kemampuan menghambat
pertumbuhan fungi uji bervariasi (Suryanto et al. 2010). Hal ini menunjukkan
bahwa spesifisitas masing-masing bakteri berbeda.
Pada Gambar 4.5.1 dapat dilihat perubahan hifa G. boninense dan F.
oxysporum yang terjadi akibat interaksi antara isolat bakteri kitinolitik dengan G.
boninense dan F. oxysporum. Adanya aktivitas antagonisme yang kuat dari isolat
bakteri kitinolitik terhadap G. boninense dan F. oxysporum dengan mekanisme
hiperparasitisme dan enzimatik sehingga efektif menghambat pertumbuhan jamur
patogen tanaman dengan mendegradasi dinding selnya. Hifa fungi patogen mengalami
lisis, pembengkakan, melilit, membengkok dan menggulung. Lisis pada hifa
menunjukkan bahwa isolat bakteri kitinolitik mampu menghidrolisis dinding sel G.
Gambar 4.5.1. Bentuk hifa abnormal setelah uji antagonis dengan bakteri kitinolitik (a) hifa normal G. boninense, (b) hifa kerdil, (c)hifa bercabang, (d) hifa membengkok, (e) hifa melilit, (f) hifa normal F. oxysporum, (g) hifa melilit dan menggulung, (h) hifa lisis, (i) hifa melilit, (j) hifa menggulung (perbesaran 10x40)
Hifa fungi patogen yang mengalami pembengkakan dan menggulung diduga
sebagai mekanisme pertahanan dari patogen terhadap serangan isolat. Menurut
Indratmi (2008) hasil pengamatan secara mikroskopis menunjukkan adanya kerusakan
hifa jamur pada daerah di mana jamur patogen ini saling berinteraksi dengan isolat.
Kerusakan hifa yang teramati berupa perubahan bentuk / malformasi hifa patogen.
Hifa patogen menjadi berbentuk spiral dan melengkung-lengkung tidak beraturan dan
mengalami pemendekan. Sebagian hifa mengalami kekusutan dan pembengkakan
dinding sel. Hifa patogen yang mengalami kerusakan tersebut tidak ditemukan konidia
jamur. Isolat antagonis ini mampu menempel kuat pada hifa jamur dan penempelan
ini berhubungan dengan produksi β1-3 glucanase yang menyebabkan degradasi sebagian dinding sel hifa. Studi ini juga mendukung bahwa kompetisi nutrisi berperan
utama dalam aktifitas biokontrol berbagai isolat antagonis yang lain.
Sedangkan pada Gambar 4.5.2 dapat dilihat perubahan hifa G. boninense dan
F. oxysporum yang terjadi akibat interaksi antara isolat bakteri antijamur dengan G.
boninense dan F. oxysporum. Adanya aktivitas antagonisme yang kuat dari isolat
bakteri antijamur terhadap G. boninense dan F. oxysporum dengan mekanisme