ISOLASI, PENGELOMPOKKAN WARNA DAN OPTIMASI
MEDIA PERTUMBUHAN AKTINOMISET SELULOLITIK
ASAL HUTAN SULAWESI TENGAH
Oleh:
ASIH WIDAYANI
G 34102076
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ASIH WIDAYANI. Isolasi, Pengelompokkan Warna dan Optimasi Media Pertumbuhan Aktinomiset Selulolitik Asal Hutan Sulawesi Tengah. Dibimbing olehANJA MERYANDINIdan
YULIN LESTARI.
Sebanyak 63 isolat Aktinomiset diisolasi dari contoh tanah hutan Taman Nasional Lore Lindu, Sulawesi tengah. Isolat Aktinomiset dikelompokkan berdasarkan warna koloninya menjadi enam kelompok warna. Beberapa isolat menghasilkan pigmen terdifusi yang berbeda. Delapan isolat Aktinomiset diantaranya menghasilkan zona bening. Tiga isolat Aktinomiset terpilih berdasarkan indeks selulolitiknya, yaitu A5D4-3, D2D2-2, dan E2D1-2, diukur biomassanya dan diuji aktivitas selulasenya. Isolat A5D4-3 dan E2D1-2 memiliki biomassa terbesar ketika pepton ditambahkan pada media pertumbuhan CMC, sedangkan isolat D2D2-2 memiliki biomassa terbesar ketika ekstrak khamir ditambahkan pada media pertumbuhan CMC. Isolat A5D4-3 memiliki aktivitas FPase lebih besar (0.022 nkat/ml), dibanding CMCase dan aviselase ketika menggunakan media pertumbuhan CMC dengan penambahan pepton. Isolat D2D2-2 memiliki aktivitas CMCase lebih besar (0,373 nkat/ml), dibanding CMCase dan FPase ketika menggunakan media pertumbuhan CMC dengan penambahan ekstrak khamir. Isolat E2D1-2 memiliki aktivitas aviselase lebih besar (0,012 nkat/ml), dibandingkan CMCase dan FPase ketika menggunakan media pertumbuhan CMC dengan penambahan pepton.
ABSTRACT
ASIH WIDAYANI. Isolation, Colour Grouping and Growth Media Optimation of Cellulolytic Actinomycetes from Central Sulawesi Forest. Supervised byANJA MERYANDINIdanYULIN LESTARI.
ISOLASI, PENGELOMPOKKAN WARNA DAN OPTIMASI
MEDIA PERTUMBUHAN AKTINOMISET SELULOLITIK
ASAL HUTAN SULAWESI TENGAH
Skripsi
sebagai salah satu syarat untuk memperolah gelar
Sarjana Sains pada
Departemen Biologi
Oleh:
ASIH WIDAYANI
G 34102076
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Isolasi, Pengelompokkan Warna dan Optimasi Media Pertumbuhan Aktinomiset Selulolitik Asal Hutan Sulawesi Tengah
Nama : Asih Widayani NIM : G34102076
Menyetujui
Pembimbing I Pembimbing II
Dr. Anja Meryandini, MS Dr. Ir. Yulin Lestari
NIP. 131663016 NIP. 131779515
Mengetahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, MS NIP. 131473999
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat-Nya sehingga penulis berhasil menyelesaikan laporan skripsi ini. Penelitian ini berjudul Isolasi, Pengelompokkan Warna dan Optimasi Media Pertumbuhan Aktinomiset Selulolitik Asal Hutan Sulawesi Tengah, yang dilaksanakan dari bulan Februari hingga Agustus 2006 di Laboratorium Mikrobiologi Departemen Biologi FMIPA IPB.
Terima kasih penulis ucapkan kepada Dr. Anja Meryandini, MS. dan Dr. Ir. Yulin Lestari yang telah memberikan dana, ilmu, saran dan solusi selama penelitian. Penulis juga mengucapkan terima kasih kepada Dra. Triadiati, M.Si. yang telah memberikan contoh tanah dan Dr. Nisa Rachmania Mubarik, M.Si. sebagai Kepala Bagian Mikrobiologi Departemen Biologi FMIPA IPB. Mba Heni, ibu Kokoy, Bapak Endang, Bapak Jaka, dan Bapak Husen sebagai laboran di Laboratorium Mikrobiologi. Kepada teman-teman di Laboratorium Mikrobiologi Dewi, Nirli, Vitria, Mia, Dhilah, Mba elsie, Tika, Ari, Tika T, Desi, ibu It. Kepada teman baikku Awi, Neenda, Juve, Popi, Adisti, Ajeng dan teman-teman Biologi angkatan 39 yang tidak dapat disebutkan satu persatu atas segala dukungan dan doanya.
Tak lupa terima kasih kepada orang tuaku, seluruh keluarga, dan Mas Anto untuk doa, kasih sayang, dan dorongan semangatnya selama ini.
Penulis berharap semoga skripsi ini dapat bermanfaat.
Bogor, September 2006
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 13 Agustus 1984. Penulis merupakan anak kedua dari lima bersaudara dari Ayah Djuhanda dan Ibu Wiwi Suswiti.
DAFTAR ISI
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN... 1
Latar Belakang ... 1
Tujuan ... 2
WAKTU DAN TEMPAT ... 2
BAHAN DAN METODE ... 2
Bahan ... 2
Metode ... 2
Isolasi Aktinomiset ... 2
Colour grouping ... 2
Pengukuran indeks selulolitik... 2
Optimasi pertumbuhan isolat selulolitik terpilih pada media pertumbuhan yang berbeda... 2
Pengukuran biomassa ... 2
Pengukuran aktivitas selulase... 2
HASIL... 3
Isolasi Aktinomiset... 3
Colour Grouping... 3
Pengukuran Indeks Selulolitik... 3
Optimasi Pertumbuhan Isolat Selulolitik Terpilih pada Media Pertumbuhan yang Berbeda... 4
Pengukuran Aktivitas Selulase... 4
PEMBAHASAN ... 5
Isolasi Aktinomiset... 5
Colour Grouping ... 5
Pengukuran Indeks Selulolitik... 5
Optimasi Pertumbuhan Isolat Selulolitik Terpilih pada Media Pertumbuhan yang Berbeda... 6
Pengukuran Aktivitas Selulase... 6
SIMPULAN ... 7
SARAN ... 7
DAFTAR TABEL
1 Indeks selulolitik isolat terpilih ... 3 2 Biomassa tiga isolat selulolitik pada sumber karbon dan sumber nitrogen yang
berbeda setelah 10 hari pertumbuhan pada suhu ruang ... 4
DAFTAR GAMBAR
1 Persentase jumlah isolat Aktinomiset pada contoh tanah A, D, dan E... 3 2 Contoh masing-masing warna koloni isolat yang berbeda-beda ... 3 3 Aktivitas selulase isolat A5D4-3 pada media pertumbuhan CMC dengan penambahan
pepton dan media pertumbuhan avisel dengan penambahan pepton yang diuji pada suhu 40 ºC dan pH 6.5... 4 4 Aktivitas selulase isolat D2D2-2 pada media pertumbuhan CMC dengan penambahan
ekstrak khamir dan media pertumbuhan avisel dengan penambahan ekstrak khamir yang diuji pada suhu 40 ºC dan pH 6.5 ... 4 5 Aktivitas selulase isolat E2D1-2 pada media pertumbuhan CMC dengan penambahan
DAFTAR LAMPIRAN
1 Komposisi media agar-agar... 10
2 Komposisi media pertumbuhan... 11
3 Metode pengujian aktivitas CMCase (Miller 1959) ... 13
4 Metode pengujian aktivitas aviselase (Okada 1999) ... 13
5 Metode pengujian aktivitas FPase (Alam et al. 2004)... 13
6 Kurva standar glukosa... 13
7 Isolat Aktinomiset yang diisolasi dari contoh tanah dengan menggunakan media agar-agar CMC... 14
8 Pengelompokkan warna miselia Aktinomiset yang ditumbuhkan pada media YMA selama 14 hari pada suhu ruang ... 16
9 Zona bening yang terbentuk di sekitar koloni ... 17
10 Aktivitas selulase isolat A5D4-3 yang ditumbuhkan pada media pertumbuhan dengan penambahan pepton ... 18
11 Aktivitas selulase isolat D2D2-2 yang ditumbuhkan pada media pertumbuhan dengan penambahan ekstrak khamir... 18
1
PENDAHULUAN
Latar Belakang
Mikroorganisme membutuhkan nutrisi untuk mendukung pertumbuhan selnya. Nutrisi yang dibutuhkan terdiri atas makronutrien dan mikronutrien. Makronutrien yang dibutuhkan yaitu karbon (C), nitrogen (N), fosfor (P), sulfur (S), kalium (K), magnesium (Mg), kalsium (Ca), natrium (Na) dan besi (Fe). Mikronutrien yang dibutuhkan yaitu tembaga (Cu), mangan (Mn), seng (Zn), nikel (Ni), molibdenum (Mo), kobalt (Co) (Prescott et al. 1999). Hampir 50% berat kering sel terdiri atas karbon, oleh karena itu karbon (C) merupakan makronutrien yang paling utama dibutuhkan. Prokariot autotrof menggunakan CO2 sebagai satu-satunya sumber karbon, sedangkan yang bersifat heterotrof menggunakan molekul organik sebagai sumber karbon untuk pertumbuhan (Madiganet al.2000).
Selulosa, komponen terbesar tumbuhan, sebagai salah satu sumber karbon merupakan polimer linier anhidroglukosa dengan ikatan
β-1,4-glikosida (Li & Gao 1997). Di dalam tumbuhan, selulosa tersusun dalam bentuk fibril yang terdiri atas beberapa molekul selulosa yang diikat oleh ikatan hidrogen. Fibril-fibril tersebut membentuk kristal parsial yang merupakan ciri pembeda dari pati. Hidrolisis selulosa dapat dilakukan secara kimiawi maupun secara enzimatik menggunakan selulase(Haki & Rakshit 2003).
Selulase, enzim penghidrolisis selulosa, merupakan enzim kompleks yang terdiri atas: (1) kompleks endo-β-1,4- glukanase: endoselulase, Carboxymethyl cellulase
(CMCase), atau Cx selulase; (2) kompleks ekso- β-1,4-glukanase: selobiohidrolase, aviselase, atau C1 selulase; (3) β -1,4-glukosidase atau selobiase (Crueger & Creuger 1984). Banyak bakteri dapat tumbuh dengan selulosa sebagai sumber karbon, namun hanya beberapa kelompok bakteri yang mampu mendegrasi komponen selulosa secara keseluruhan. Bakteri yang mampu menghasilkan sistem selulase yang lengkap disebut dengan true cellulolytic bacteria, sedangkan yang hanya mampu menghasilkan endoglukanase dan β-glukosidase disebut
pseudocellulolytic bacteria (Coughlan & Mayer 1991). Sintesis selulase dapat diinduksi dengan keberadaan selulosa kristal atau avisel sebagai sumber karbon. Sebaliknya sumber karbon lain dapat menghambat sintesis selulase. Penambahan ekstrak khamir tidak berpengaruh secara langsung terhadap sintesis
selulase, tapi dapat menunjang pertumbuhan bakteri (Wartel & Schrempf 1996).
Bakteri selulolitik dapat bersifat aerob maupun anaerob. Dalam kondisi aerobik degradasi selulosa akan menghasilkan CO2 dan air, sedangkan dalam kondisi anaerobik akan menghasilkan metan selain CO2 dan air (Perez et al. 2002). Bakteri selulolitik yang bersifat aerob antara lain berasal dari genus
Cellulomonas, Cellovibrio, Pseudomonas, Serratia, Streptomyces. Bakteri selulolitik yang bersifat anaerob antara lain berasal dari genus Bacteroides, Clostridium, Ruminococcus(Coughlan & Mayer 1991).
Aktinomiset merupakan salah satu kelas dari filum Bacteria, ordo Actinomycetales. Berdasarkan ciri morfologi dan kandungan dinding selnya, genus Aktinomiset terbagi dalam dua kelompok, yaitu genus
Streptomyces dan genus non Streptomyces. Genus Streptomyces merupakan genus terbesar Aktinomiset. Streptomyces memiliki kemampuan untuk mendegradasi selulosa, hemiselulosa, dan lignin, yang banyak terdapat dalam tanaman (Holt et al. 1994; Madiganet al. 2000).
Aktinomiset masuk dalam kelompok bakteri berfilamen, Gram positif dengan % GC tertinggi diantara bakteri lainnya, yaitu sebesar 63-78% (Madigan et al. 2000). Aktinomiset bereproduksi dengan spora aerial (konidia) atau melalui fragmentasi miselia. Aktinomiset memiliki dua macam miselia, yaitu miselia aerial dan miselia substrat. Kedua miselia ini mampu menghasilkan pigmen yang menyebabkan perbedaan warna pada masing-masing koloni. Perbedaan warna masing-masing koloni dapat dijadikan tahap awal identifikasi genus dan spesies pada aktinomiset. Tahap identifikasi selanjutnya adalah uji produktivitas melanin, karena kelompok warna spora yang sama dapat dimiliki anggota yang berasal dari genus maupun spesies yang berbeda (Holt et al. 1994).
2
Taman Nasional Lore Lindu yang beriklim tropis dan terdiri atas hutan hujan tropis dan hutan perkebunan, terletak di desa Toro, Kabupaten Donggala, Sulawesi Tengah. Taman Nasional Lore Lindu memiliki kera-gaman flora yang tinggi, lebih dari 100 spesies tumbuhan dapat ditemukan di Taman Nasional ini. Kondisi hutan yang berserasah memungkinkan diisolasinya Aktinomiset selulolitik (Holt et al. 1994; Madigan et al. 2000).
Tujuan
Tujuan dari penelitian ini adalah untuk mengisolasi Aktinomiset selulolitik, menge -lompokkan koloni Aktinomiset berdasarkan warna, dan mengetahui media yang optimal untuk pertumbuhan dan aktivitas selulase Aktinomiset selulolitik.
WAKTU DAN TEMPAT
Penelitian dilaksanakan mulai bulan Februari sampai Agustus 2006 di Laboratorium Mikrobiologi Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
BAHAN DAN METODE
Bahan
Bahan yang digunakan yaitu contoh tanah hutan konservasi Taman Nasional Lore Lindu Sulawesi Tengah, yang terdiri atas (1) tanah hutan primer dengan vegetasi dominan tumbuhan hutan (A); (2) tanah hutan kakao namun masih banyak terdapat tumbuhan hutan, memiliki nama daerah pahawa pongko 1 (D); (3) tanah hutan dengan vegetasi dominan berupa tanaman kakao dan sedikit tumbuhan hutan, memiliki nama daerah pahawa pongko 2 (E).
Metode
Isolasi Aktinomiset. Isolasi Aktinomiset dari contoh tanah dilakukan dengan mengencerkan contoh tanah hingga 10-5 dan disebar pada media agar-agarCarboxy Methyl Cellulose (CMC) pH 7 (lampiran 1), diinkubasi selama 7 hari pada suhu ruang. Kemudian isolat yang diperoleh dimurnikan kembali pada media agar-agar CMC.
Colour grouping.Isolat Aktinomiset yang telah murni ditumbuhkan pada media Yeast Malt Agar(YMA) (lampiran 1) selama 14 hari
pada suhu ruang. Selanjutnya dilakukan pengelompokan isolat aktinomiset berdasar-kan warna koloninya.
Pengukuran indeks selulolitik. Isolat Aktinomiset yang telah murni ditumbuhkan pada media agar-agar CMC pH 7 dan diinkubasi selama 6 hari pada suhu ruang. Untuk mengetahui indeks selulolitik dila-kukan pewarnaan dengan congored 0.1 % sehingga zona bening yang terbentuk disekitar koloni terlihat jelas. Indeks selulolitik didapatkan melalui pengukuran zona bening yang terbentuk di sekitar koloni dikurangi diameter koloni dibagi diameter koloni.
Optimasi pertumbuhan isolat selulolitik terpilih pada media pertumbuhan yang berbeda. Optimasi pertumbuhan dilakukan dengan menumbuhkan tiga isolat selulolitik terpilih berdasarkan indeks selulolitik yang terbesar (isolat E2D1-2), sedang (isolat A5D4-3), dan terkecil (D2D2-2) pada enam media pertumbuhan yang berbeda. Media pertumbuhan yang digunakan yaitu CMC dengan penambahan (NH4)2SO4 (M1), CMC dengan penambahan pepton (M2), CMC dengan penambahan ekstrak khamir (M3), avisel dengan penambahan (NH4)2SO4 (M4), avisel dengan penambahan pepton (M5) dan avisel dengan penambahan ekstrak khamir (M6) (Lampiran 2). Sebanyak dua koloni isolat berdiameter 0.5 cm yang tumbuh pada media agar-agar CMC diinokulasikan ke dalam 50 ml media pertumbuhan dalam 250 ml erlenmeyer, diinkubasi dengan agitasi 140 rpm selama 10 hari pada suhu ruang dan diukur aktivitas selulasenya.
Pengukuran biomassa. Pengukuran biomassa dilakukan berdasarkan berat kering koloni isolat yang telah ditumbuhkan pada media pertumbuhan selama 10 hari. Endapan hasil sentrifugasi (4000 xg, 30 menit) dikeringkan pada suhu 80 ºC selama 24 jam dan dilakukan sebanyak dua kali ulangan, supernatan yang merupakan ekstrak kasar enzim selulase diuji aktivitasnya.
Pengukuran aktivitas selulase.Aktivitas
3
Tanah A 67% Tanah D 27% Tanah E 6%Persentase jumlah isolat Aktinomiset pada contoh tanah A, D, dan E.
Gambar 1
Pengukuran aktivitas CMCase dilakukan dengan menambahkan sebanyak 1 ml filtrat ekstrak kasar enzim dengan 1ml CMC 1 % dalam bufer fosfat 0.2 M pH 6.5, diinkubasi selama 2 jam pada suhu 40 ºC. Pengukuran aviselase dilakukan dengan menambahkan sebanyak 2 ml filtrat ekstrak kasar enzim dengan 2 ml avisel 2 % dalam bufer fosfat 0.2 M pH 6.5, diinkubasi selama 2 jam pada suhu 40 ºC. Reaksi dihentikan dengan penambahan 20 µl NaOH 2 M, kemudian disentrifugasi pada kecepatan 1500 xg selama 15 menit (Okada 1999). Pengukuran FPase dilakukan dengan menambahkan sebanyak 1 ml filtrat ekstrak kasar enzim dengan 0.5 g kertas saring Whatmann no. 1 (1 x 6 cm), diinkubasi selama dua jam pada suhu 40 ºC (Alamet al. 2004).
HASIL
Isolasi Aktinomiset
Dari 50 contoh tanah didapatkan 63 isolat Aktinomiset (Lampiran 7). Dari gambar 1 terlihat isolat Aktinomiset banyak dijumpai pada contoh tanah A dengan persentasi sebesar 66.67 %, sedangkan pada contoh tanah D sebesar 26.97 %, dan pada contoh tanah E sebesar 6.35 %.
Colour Grouping
Dari hasil pengamatan didapatkan 6 kelompok warna koloni yang berbeda serta 3 warna pigmen terdifusi (Gambar 3 dan Lampiran 8). Isolat A2D5-3 dan isolat A3D1-1 menghasilkan pigmen terdifusi berwarna coklat tua, isolat A2D4-1 menghasilkan pigmen terdifusi berwarna kuning, dan isolat D4D2-4 menghasilkan pigmen terdifusi berwana coklat. Beberapa isolat juga menghasilkan eksudat berupa cairan yaitu isolat A1D1-2, A1D3-1, A4D1-3, A4D1-4, dan D2D2-2.
Pengukuran indeks selulolitik
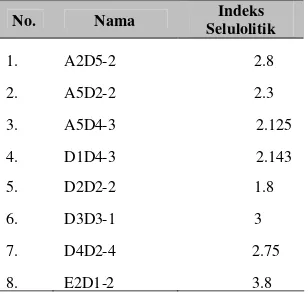
[image:12.595.329.486.90.348.2]Dari 63 koloni isolat yang didapatkan delapan diantaranya memiliki indeks selulolitik yang besar (Tabel 1 dan Lampiran 9). Indeks selulolitik terbesar dimiliki oleh isolat E2D1-2 yaitu sebesar 3.8, sedangkan indeks selulolitik terkecil dimiliki oleh isolat D2D2-2 yaitu sebesar 1.8.
Tabel 1 Indeks selulolitik isolat terpilih
No. Nama SelulolitikIndeks
1. A2D5-2 2.8
2. A5D2-2 2.3
3. A5D4-3 2.125
4. D1D4-3 2.143
5. D2D2-2 1.8
6. D3D3-1 3
7. D4D2-4 2.75
8. E2D1-2 3.8
Contoh masing-masing warna koloni isolat yang berbeda-beda. (a) Isolat A4D4-2 dengan warna koloni abu-abu; (b) Isolat A4D-1 dengan warna koloni abu-abu tua; (c) Isolat D1D2-2 dengan warna koloni coklat; (d) Isolat A4D3-3 dengan warna koloni hitam; (e) Isolat A4D3-5 dengan warna koloni merah muda; (f) Isolat D4D2-4 dengan warna koloni putih.
(a) (b)
(c) (d)
(f) (e)
[image:12.595.324.478.582.729.2]4
Optimasi Pertumbuhan Isolat Selulolitik Terpilih pada Media Pertumbuhan yang Berbeda
Data pada tabel 2 menunjukkan isolat A5D4-3 dan E2D1-2 memiliki pertumbuhan lebih baik pada media pertumbuhan M2 dengan biomassa masing-masing sebesar 30 mg dan 80 mg dibanding media pertumbuhan lainnya. Isolat D2D2-2 memiliki pertumbuhan lebih baik pada media pertumbuhan M2 dan M3 yaitu dengan biomassa masing-masing sebesar 70 mg.
Pengukuran Aktivitas Selulase
Pengukuran aktivitas selulase dilakukan sebanyak dua kali ulangan terhadap aktivitas CMCase, aviselase, dan FPase (Lampiran 10, 11, dan 12). Gambar 3 memperlihatkan aktivitas selulase isolat A5D4-3 pada media pertumbuhan CMC dengan penambahan pepton (M2) dan media pertumbuhan avisel dengan penambahan pepton (M5). Pada media pertumbuhan M2 aktivitas CMCase, aviselase, dan FPase memiliki aktivitas masing-masing sebesar 0.011, 0.015 dan 0.022 nkat/ml. Pada media pertumbuhan M5 aktivitas CMCase, aviselase, FPase memiliki aktivitas masing-masing sebesar 0.006, 0.004 dan 0.01 nkat/ml.
[image:13.595.332.495.231.305.2]Aktivitas selulsase isolat D2D2-2 pada media pertumbuhan CMC dengan penam-bahan ekstrak khamir (M3) dan media pertumbuhan avisel dengan penambahan ekstrak khamir (M6) terlihat pada gambar 4. Pada media pertumbuhan M3 aktivitas CMC -ase, avisel-ase, dan FPase memiliki aktivitas masing-masing sebesar 0.373, 0.069 dan 0.219 nkat/ml. Pada media pertumbuhan M6 aktivitas CMCase, aviselase, dan FPase memiliki aktivitas masing-masing sebesar 0.126, 0.11 dan 0.044 nkat/ml.
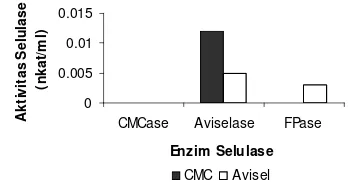
Gambar 5 memperlihatkan aktivitas selulase isolat E2D1-2 pada media pertumbuhan CMC dengan penambahan pepton (M2) dan media pertumbuhan avisel dengan penambahan pepton (M5). Pada media pertumbuhan M2 aktivitas aviselase sebesar 0.012 nkat/ml, sedangkan CMCase dan FPase tidak memiliki aktivitas. Pada media pertumbuhan M5 aktivitas aviselase dan FPase masing-masing sebesar 0.005 dan 0.003 nkat/ml, sedangkan CMCase tidak memiliki aktivitas.
Biomassa (mg) Media Pertumbuhan Isolat A5D4-3 Isolat D2D2-2 Isolat E2D1-2
M1 10 40 50
M2 30 70 80
M3 20 70 60
M4 2 12 52
M5 22 32 62
M6 12 52 42
Biomassa tiga isolat selulolitik pada sumber karbon dan sumber nitrogen yang berbeda setelah 10 hari pertumbuhan pada suhu ruang Tabel 2
Aktivitas selulase isolat A5D4-3 pada media pertumbuhan CMC dengan penambahan pepton dan media pertumbuhan avisel dengan penambahan pepton yang diuji pada suhu 40 ºC dan pH 6.5. Gambar 3 0 0.005 0.01 0.015 0.02 0.025
CMCase Aviselase FPase
Enzim Selulase A k ti v it as S e lu la s e (n ka t/ m l) CMC Avisel
Aktivitas selulase isolat D2D2-2 pada media pertumbuhan CMC dengan penambahan ekstrak khamir dan media pertumbuhan avisel dengan penambahan ekstrak khamir yang diuji pada suhu 40 ºC dan pH 6.5. . Gambar 4 0 0.1 0.2 0.3 0.4
CMCase Av iselase FPase
Enz im Selulas e
A k ti v it a s s e lu la s e (n k a t/ m l) CMC Avisel
[image:13.595.328.507.543.637.2]Aktivitas selulase isolat E2D1-2 pada media pertumbuhan CMC dengan penambahan pepton dan media pertumbuhan avisel de-ngan penambahan pepton yang diuji pada suhu 40 ºC dan pH 6.5. . Gambar 5 0 0.005 0.01 0.015
CMCase Aviselase FPase
5
PEMBAHASAN
Isolasi Aktinomiset
Tanah memiliki komposisi mikroorga-nisme yang sangat beragam, 10-33 % dian-taranya merupakan Aktinomiset dan genus
Streptomyces merupakan genus yang sangat melimpah. Kondisi tanah yang disukai Aktinomiset yaitu pada pH basa atau netral dan sangat sensitif pada kondisi tanah yang bersifat asam (Atlas & Bartha 1998). Habitat alami Aktinomiset yang meliputi tanah dan kompos menyebabkan genus ini memiliki kemampuan untuk mendegradasi selulosa (Mc Carthy 1987 diacu dalam Coughlan & Mayer 1991 ).
Isolasi Aktinomiset dilakukan dengan menggunakan media agar-agar selektif CMC pH 7 untuk mendapatkan isolat Aktinomiset selulolitik. Isolat Aktinomiset paling banyak ditemukan pada contoh tanah hutan primer (A) yaitu dengan persentase sebesar 66.67 %. Kondisi tanah yang berserasah me-mungkinkan didapatkannya isolat Aktinomiset selulolitik.
Colour Grouping
Berdasarkan hasil pengamatan terhadap 63 isolat Aktinomiset yang diremajakan pada media YMA, hanya 46 isolat yang berhasil ditumbuhkan. Hal ini mungkin dikarenakan isolat Aktinomiset sebelumnya ditumbuhkan pada media agar-agar CMC dengan sumber karbon yang minimal, sehingga isolat Aktinomiset tidak mampu untuk tumbuh.
Untuk sporulasi Streptomyces mem-butuhkan media dengan rasio C:N yang tinggi (Wendisch & Kutzner 1991). Beberapa media yang biasa digunakan yaitu: (1) media YMA; (2) media agar oatmeal; (3) media agar pati mineral inorganik; (4) media agar-agar gliserol-asparagin; (5) media trace salt solution; (6) media trace elements solution
SPV-4 (Shirling & Gottlieb 1966 diacu dalam Wendisch & Kutzner 1991 ; Voelskow 1988 diacu dalam Wendisch & Kutzner 1991).
Dalam penelitian ini digunakan media YMA untuk mengelompokan warna koloni Aktinomiset. Aktinomiset dapat menghasilkan pigmen yang beragam yang mewarnai struktur vegetatif dan miselia aerialnya. Selain itu juga Aktinomiset menghasilkan warna pigmen yang berdifusi. Beberapa warna pigmen yang telah dilaporkan yaitu: (1) oranye-merah tua atau violet; (2) merah violet-biru; (3) kuning-oranye; (4) hijau-keabu-abuan; (5) hijau; (6) merah kecoklatan-merah tua; (7) abu-abu-hitam (Wendisch & Kutzner 1991).
Berdasarkan letaknya, pigmen dibedakan atas: (1) endopigmen, yang hanya mewarnai koloni saja; (2) eksopigmen, yang dikeluarkan ke media. Eksopigmen bersifat larut dalam air dan berdifusi ke media.
International Streptomyces Project (ISP) melaporkan beberapa tipe warna miselia aerial pada Streptomyces, yaitu kuning, violet, merah, biru, hijau, abu-abu, dan putih (Wendisch & Kutzner 1991). Meskipun telah dilaporkan tipe warna miselia aerial pada
Streptomyces, namun ada beberapa warna miselia aerial yang tidak dapat didefinisikan. Ersya (2004) mengelompokkan warna spora Aktinomiset yang berasal dari Sumatra, Jawa, Kalimantan Timur, dan Tembagapura Irian Jaya menjadi 7 kelompok warna yaitu abu-abu, putih, hitam krem, coklat, merah muda, dan merah. Isolat Aktinomiset tersebut juga menghasilkan pigmen terdifusi yaitu kuning, coklat hitam, coklat, coklat muda, hijau tua, hijau dan krem. Dari 46 isolat yang ditumbuhkan pada media YMA didapat 6 kelompok koloni, yaitu merah muda, abu-abu, abu-abu tua, putih, coklat, dan hitam. Selain itu juga didapatkan tiga pigmen terdifusi, yaitu coklat tua, coklat, dan kuning.
Pengukuran indeks selulolitik
Pembentukan zona bening menunjukkan bahwa selulosa yang terdapat di dalam media dihidrolisis oleh enzim selulase menjadi senyawa yang sederhana yaitu selobiosa yang kemudian disederhanakan menjadi dua molekul glukosa (Perez et al. 2002). Pengukuran zona bening yang terbentuk disekitar koloni merupakan analisis semi kuantitatif aktivitas bakteri selulolitik (Coughlan & Mayer 1991). Koloni isolat yang ditumbuhkan pada media agar-agar CMC berumur 6 hari disiram dengan larutancongo red 0.1 %, untuk memperjelas terbentuknya zona bening. Congo red memiliki interaksi yang kuat dengan polisakarida yang mengandung rantai ikatan β-(1 4) D-glukopiranosil (Teather & Wood 1982).
6
menghidrolisis makromolekul seperti selulosa, kemudian hasil hidrolisis diserap sel (Crueger & Crueger 1984).
Optimasi Pertumbuhan Isolat Selulolitik Terpilih pada Media Pertumbuhan yang Berbeda
Faktor yang mempengaruhi pertumbuhan mikrob yaitu media pertumbuhan yang digunakan, suhu, pH, dan aerasi. Media tumbuh yang biasa digunakan terdiri atas: (1) media sintetik; dan (2) media kompleks. Media sintetik merupakan media sederhana yang seluruh komponennya telah diketahui (Prescott et al. 1999; Madigan et al. 2000). Aktinomiset, khususnya Streptomyces, merupakan bakteri kemoorganotropik yang dapat tumbuh pada media sintetik yang hanya mengandung sumber karbon organik (misal selulosa), sumber nitrogen inorganik (NH4
+ atau NO3-), dan beberapa garam mineral lainnya (Wendisch & Kutzner 1991).
Media kompleks mengandung komponen nutrisi yang lengkap seperti pepton, ekstrak daging, dan ekstrak khamir. Pepton merupakan protein hidrolisat yang berfungsi sebagai sumber karbon, sumber energi, dan sumber nitrogen (Prescott et al. 1999). Ekstrak khamir merupakan substrat terbaik pada sebagian mikroorganisme yang me-ngandung vitamin B dan dapat berfungsi sebagai sumber nitrogen dan sumber karbon.
Hasil pengukuran biomassa (Tabel 2), menunjukkan bahwa ketiga isolat memiliki pertumbuhan lebih baik ketika ditumbuhkan pada media pertumbuhan CMC dibandingkan media pertumbuhan avisel. Hal ini dika-renakan CMC, selulosa yang mudah larut, lebih mudah dihidrolisis dibanding avisel yang memiliki struktur kristalin. Isolat A5D4-3 dan isolat E2D1-2 tumbuh baik pada media pertumbuhan CMC dengan penambahan pepton, isolat D2D2-2 tumbuh baik pada media pertumbuhan CMC dengan penambahan ekstrak khamir dibandingkan media pertumbuhan lainnya. Hal ini me-nunjukkan meskipun Aktinomiset mampu tumbuh pada media yang sederhana, namun pertumbuhannya akan lebih baik jika menggunakan media kompleks.
Pengukuran Aktivitas Selulase
Hasil pengukuran aktivitas selulase ketiga isolat selulolitik terpilih, menunjukkan media pertumbuhan dapat menginduksi aktivitas selulase yang berbeda pada ketiga isolat Aktinomiset. Adhi et al. (1989) melaporkan
Streptomyces viridosporusT7A dan S. badius
menghasilkan endoglukanase (CMCase) ketika ditumbuhkan pada media yang menggunakan ekstrak khamir. Selain itu pula, sumber karbon yang berbeda dapat mempengaruhi aktivitas selulase yang berbeda pula (Coughlan & Mayer 1991). MacKenzie
et al. (1987) melaporkan S. flavogriseusdan
S. olivochromogenes menghasilkan selulase yang lebih tinggi ketika ditumbuhkan pada media xilan dibanding selulosa sebagai sumber karbon.
Hasil pengukuran aktivitas selulolitik (gambar 3, 4 dan 5) menunjukkan, aktivitas CMCase, aviselase, dan FPase lebih besar ketika ditumbuhkan pada media CMC sebagai sumber karbon dibandingkan avicel. Isolat A5D4-3 memiliki aktivitas FPase lebih baik dibanding CMCase dan aviselase ketika menggunakan media pertumbuhan CMC dengan penambahan pepton. Isolat D2D2-2 memiliki aktivitas CMCase lebih baik dibanding aktivitas aviselase dan FPase ketika menggunakan media pertumbuhan CMC dengan penambahan ekstrak khamir. Isolat ED212 memiliki aktivitas aviselase lebih baik dibanding aktivitas CMCase dan FPase ketika menggunakan media pertumbuhan CMC dengan penambahan pepton.
Berbagai kondisi dapat menginduksi kerja enzim. Kondisi substrat yang minimum mengakibatkan kerja enzim memecah substrat menjadi lambat, sedangkan pada substrat yang melimpah memungkinkan kontak antara enzim dengan substrat lebih besar, sehingga akan menghasilkan produk yang lebih banyak (Prescott et al. 1999). Hal ini terjadi pada aktivitas selulolitik yang tinggi ketika Aktinomiset ditumbuhkan pada media pertumbuhan dengan penambahan pepton atau ekstrak khamir. Keberadaan pepton atau ekstrak khamir menunjang pertumbuhan bakteri sehingga enzim yang dihasilkan lebih banyak.
Hidrolisis selulase seutuhnya membu-tuhkan interaksi yang sinergis antara aktivitas endoglukanase dan eksoglukanase. Endo-glukanase aktif menghidrolisis selulosa amorf dan selulosa terlarut (CMC), sedangkan eksoglukanase aktif menghidrolisis selulosa kristalin (Coughlan & Mayer 1991). Endoglukanase dan eksoglukanase akan menghidrolisis selulosa menjadi selobiosa, kemudian β-glukosidase akan memecah selobiosa menjadi dua molekul glukosa (Perez
7
saring Whatmann no. 1 sebagai substrat. Kertas saring merupakan substrat yang majemuk karena memiliki ujung-ujung bebas dan amorf sampai serat-serat kristalin.
Berdasarkan gambar 3, 4, dan 5, dapat terlihat bahwa hanya isolat A5D4-3 yang memiliki enzim endoglukanase (CMCase) dan eksoglukanase (aviselase) yang bekerja secara sinergis. Isolat D2D2-2 memiliki aktivitas CMCase yang tinggi namun aktivitas aviselase yang rendah sehingga memiliki aktivitas FPase yang tidak tinggi. Hal yang sama dimiliki oleh isolat E2D1-2 yang hanya memiliki aktivitas aviselase.
SIMPULAN
Dari 50 contoh tanah didapatkan 63 isolat Aktinomiset, delapan diantaranya mampu menghasilkan zona bening disekitar koloni. Dari 46 isolat yang mampu tumbuh baik didapatkan 6 kelompok warna koloni. Penambahan pepton dan ekstrak khamir pada media pertumbuhan CMC dapat lebih me-ningkatkan pertumbuhan ketiga isolat Aktinomiset selulolitik terpilih dibandingkan (NH4)2SO4. Aktivitas selulase lebih tinggi ketika CMC digunakan sebagai sumber karbon, dibanding dengan ketika avisel digunakan sebagai sumber karbon. Pada isolat A5D4-3, pepton menginduksi aktivitas FPase, pada isolat D2D2-2 ekstrak khamir menginduksi aktivitas CMCase, sedangkan pada isolat E2D1-2 pepton menginduksi aktivitas aviselase.
SARAN
8
DAFTAR PUSTAKA
Adhi TP, Korus RA, Crawford DL. 1989. Production of mayor ekstrasellular enzymes during lignocellulose degradation by two Streptomycetes in agitated submerged cultur.
Appl Environ Microbiol 5: 1165-1168.
Alam MZ, Manchur MA, Anwar MN. 2004. Isolation, purification, characterization of cellulolytic enzymes produced by Streptomyces omiyaensis. J Biol Sci10: 1647-1653.
Atlas RM, Bartha R. 1998. Microbial
Ecology. Ed ke-4.
Benjamin/Cummings Publishing.
Coughland MP, Mayer F. 1991. The cellulose decomposing bacteria and their enzyme systems. Di dalam Balows A, Triper HG, Dworkin M, Harder W, Schleifer KH, editor. The Prokaryotes, A Handbook on Biology of Bacteria: Ecophysiology, Isolation, Identification, Application. Vol I. New York: Springer Verlag. Hlm 460-516.
Crueger W, Crueger A. 1984.Biotechnology: A Textbook of Industri
Microbiology. Brock TD, editor. Sunderland: Minauer Associates.
Dybkaer R. 2001. Unit ”katal” for catalytic activity.J Pure Appl Chem73: 927-931.
Ersya DA. 2004. Pencirian Actinomycetes isolat lokal: colour grouping, produksi pigmen melanin, dan resistensi antibiotik [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Haki GD, Rakshit SK. 2003. Developments in
industrially important thermostable enzymes: a review. Bioresource Technol89: 17-34.
Holt et al. 1994. Bergey’s Manual of Determinative Bacteriology. Ed ke-9. Baltmore: Williams and wilkins. Jang HD, Chang KS. 2005. Thermostable
cellulase from Streptomyces sp. : scale up production in a fermenter. Biotechnol Letters 27: 239-242.
Li X, Gao P. 1997. CMC-liquefying enzyme a low molecular mass initial cellulose decomposing cellulase responsible for fragmentation from
Streptomyces sp. LX. J Appl Microbiol83: 59-66.
Madigan MT, Martinko JM, Parker J. 2000.
Biology of Microorganisms. Ed ke-9. New Jersey: Prentice Hall.
MacKenzie CR, Bilous D, Schneider H, Johnson KG. 1987. Induction of cellulolytic and xylanolytic enzyme systems in Streptomyces sp. Appl Environ Microbiol53: 2835-2839 Miller GL. 1959. Dinitrosalisic assay. Anal
Chem31: 426-428.
Okada G. 1999. A novel concept for the enzymatic degradation mechanism of native cellulose. Di dalam: Ohmiya
et al., editor. Genetics Biochemistry
and Ecology of Cellulose
Degradation Cel. Tokyo: Uni Publisher. Hlm 76-85. Perez J, Dorado JM, Rubia T de la, Martinez
J. 2002. Biodegradation and biochemical treatments of cellulose, hemicellulose, and lignin: an overview. Int Microbiol 5: 53-63.
Prescott LM, Harley JP, Klein DA. 1999.
Microbiology. New York: Mc Graw Hill.
Teather RM, Wood PJ. 1982. Use of congo red polysacharide interactions in enumeration and characterization of cellulolytics bacteria from the bovine rumen. Appl Environ Microbiol 43: 777-780.
Walter S, Schrempf H. 1996. Physiological studies of cellulase (avicelase) synthesis in Streptomyces reticuli
[catatan penelitian]. Appl Environ Microbial62: 1065-1069.
9
10
Lampiran 1 Komposisi media agar-agar
Media agar-agar CMC (100 ml) Komposisi Jumlah (gram)
CMC 1
MgSO4.7H2O 0.02 KNO3 0.075 K2HPO4 0.05 FeSO4.7H2O 0.002 CaCl2.2H2O 0.004 Pepton 0.2 Agar-agar 1.5
Komposisi media agar-agar YM (100 ml) Komposisi Jumlah (gram) Ekstrak khamir 0.4
11
Lampiran 2 Komposisi media pertumbuhan
Media pertumbuhan 1 (M1) (100 ml) Komposisi Jumlah (gram)
CMC 1
MgSO4.7H2O 0.02 KNO3 0.075 K2HPO4 0.05 FeSO4.7H2O 0.002 CaCl2.2H2O 0.004 (NH4)2SO4 0.2
Media pertumbuhan 2 (M2) (100 ml) Komposisi Jumlah (gram)
CMC 1
MgSO4.7H2O 0.02 KNO3 0.075 K2HPO4 0.05 FeSO4.7H2O 0.002 CaCl2.2H2O 0.004 Pepton 0.2
Media pertumbuhan 3 (M3) (100 ml) Komposisi Jumlah (gram)
CMC 1
MgSO4.7H2O 0.02 KNO3 0.075 K2HPO4 0.05 FeSO4
.
7H2O 0.002 CaCl2.2H2O 0.004 Ekstrak khamir 0.2
Media pertumbuhan 4 (M4) (100 ml) Komposisi Jumlah (gram) Avisel 1
MgSO4 .
7H2O 0.02 KNO3 0.075 K2HPO4 0.05 FeSO4.7H2O 0.002 CaCl2
.
2H2O 0.004 (NH4)2SO4 0.2
Media pertumbuhan 5 (M5) (100 ml) Komposisi Jumlah (gram) Avisel 1
12
Media pertumbuhan 6 (M6) (100 ml) Komposisi Jumlah (gram) Avisel 1
13
y = 2.1276x - 0.0837
R2= 0.9987
0 0.2 0.4 0.6 0.8 1
0 0.1 0.2 0.3 0.4 0.5
Kons entrasi Glukos a (m g/m l)
A
b
s
o
rb
a
n
s
i
Lampiran 3 Metode pengujian aktivitas CMCase (Miller 1959)
Pereaksi Blanko (ml) Kontrol (ml) Sampel (ml)
Substrat CMC 1 % 1 1 1
Ekstrak kasar enzim - - 1
Inkubasi pada suhu 40 ºC selama 2 jam
Akuades 1 -
-DNS 2 2 2
Ekstrak kasar enzim - 1
-Larutan dikocok dan dipanaskan pada suhu 100 ºC selama 15 menit Larutan didinginkan lalu diukur absorbansi pada panjang gelombang 540 nm
Lampiran 4 Metode pengujian aktivitas aviselase (Okadaet al. 1999)
Pereaksi Blanko (ml) Kontrol (ml) Sampel (ml)
Substrat Avisel 2 % 1 1 2
Ekstrak kasar enzim - - 2
Inkubasi pada suhu 40 ºC selama 2 jam
Reaksi dihentikan dengan penambahan 20μl NaOH 2M, kemudian disentrifugasi pada kecepatan 1500 xg selama 15 menit, sebanyak 2 ml larutan ditambahkan DNS
Akuades 1 -
-DNS 2 2 2
Ekstrak kasar enzim - 1
-Larutan dikocok dan dipanaskan pada suhu 100 ºC selama 15 menit Larutan didinginkan lalu diukur absorbansi pada panjang gelombang 540 nm
Lampiran 5 Metode pengujian aktivitas FPase (Alamet al. 2004)
Pereaksi Blanko Kontrol Sampel Substrat kertas saring
Whatmann n0.1 (1x 6 cm)
1 1 1
Ekstrak kasar enzim - - 1
Inkubasi pada suhu 40 ºC selama 2 jam
Akuades 1 ml -
-DNS 2 ml 2 ml 2 ml
Ekstrak kasar enzim - 1 ml -Larutan dikocok dan dipanaskan pada suhu 100 ºC selama 15 menit Larutan didinginkan lalu diukur absorbansi pada panjang gelombang 540 nm
14
Lampiran 7 Isolat Aktinomiset yang diisolasi dari contoh tanah dengan menggunakan media agar-agar CMC
No ContohTanah
Jumlah Mikrob (105)
Isolat No ContohTanah
Jumlah Mikrob (105)
Isolat
1 A1D1 17 A1D1-1 A1D1-2 A1D1-4
27 D1D3 23
-2 A1D2 18 - 28 D1D4 22 D1D4-2 D1D4-3
3 A1D3 19 A1D3-1 A1D3-2 A1D3-3
29 D1D5 31
-4 A1D4 14 - 30 D2D1 12
-5 A1D5 10 - 31 D2D2 15 D2D2-2
6 A2D1 12 - 32 D2D3 17
-7 A2D2 15 - 33 D2D4 20 D2D4-2 D2D4-3 D2D4-4
8 A2D3 20 - 34 D3D1 20 D3D1-1
9 A2D4 22 - 35 D3D2 17 D3D2-1 D3D2-3 D3D2-4
10 A2D5 16 A2D5-2 A2D5-3
36 D3D3 17 D3D3-1
11 A3D1 17 A3D1-1 37 D3D4 10
-12 A3D2 29 A3D2-1 38 D4D1 9 D4D1-2
13 A3D4 10 - 39 D4D2 9 D4D2-1 D4D2-4
14 A3D5 35 - 40 D4D5 30 -15 A4D1 36 A4D1-1
A4D1-2 A4D1-3 A4D1-4 A4D1-5
41 D5D1 25 D5D1-4
16 A4D2 24 A4D2-1 42 D5D2 9
-17 A4D3 32 A4D3-1 A4D3-2 A4D3-3 A4D3-5 A4D3-6 A4D3-7
-15
No Contoh Tanah
Jumlah Mikrob (105)
Isolat No Contoh Tanah
Jumlah Mikrob (105)
Isolat
18 A4D4 29 A4D4-1 A4D4-2 A4D4-3
44 E1D1 10 E1D1-1
19 A4D5 13 A4D5-1 A4D5-2 A4D5-3 A4D5-5
45 E1D2 9
-20 A5D1 5 A5D1-1 A5D1-2 A5D1-3
46 E1D3 15
-21 A5D2 5 A5D2-1 A5D2-2
47 E1D4 10
-22 A5D3 11 A5D3-1 A5D3-2 A5D3-5
48 E1D5 9 E1D5-2
23 A5D4 17 A5D4-1 A5D4-2 A5D4-3
49 E2D1 7 E2D1-1 E2D1-2
24 A5D5 10 A5D5-1 A5D5-2
50 E2D2 12
-25 D1D1 21
16
Lampiran 8 Pengelompokkan warna miselia Aktinomiset yang ditumbuhkan pada media YMA selama 14 hari pada suhu ruang
No Warna Isolat No Warna Isolat No Warna Isolat
1 Merah muda A1D1-1 17 Hitam A4D3-3 33 D2D4-2 2 A4D1-2 18 Abu-abu A1D1-2 34 D3D1-1 3 A4D1-3 19 A1D1-4 35 Putih A5D1-1
4 A4D1-4 20 A1D3-1 36 A5D1-3
5 A4D1-5 21 A2D5-2 37 A5D3-1
6 A4D2-1 22 A2D5-3 38 A5D3-5
7 A4D3-5 23 A3D1-1 39 D1D4-3
8 A4D3-6 24 A4D3-1 40 D2D4-4
9 A4D3-7 25 A4D4-2 41 D3D2-1
10 A5D4-1 26 A4D5-1 42 D3D2-4
11 A5D4-2 27 A4D5-2 43 D4D2-4
12 D1D2-1 28 A5D2-2 44 E2D1-2
13 D2D2-2 29 A5D3-2 45 Abu-abu tua A2D4-1 14 coklat A4D4-3 30 A5D4-3 46 A4D1-1
15 D1D2-2 31 A5D5-1
17
Lampiran 9 Zona bening yang terbentuk di sekitar koloni
Keterangan: (a) Isolat A2D5-2; (b) Isolat A5D2-2; (c) Isolat A5D4-3; (d) Isolat D1D4-3; (e) Isolat D2D2-2; (f) Isolat D3D3-1; (g) Isolat D4D2-4; (h) Isolat E2D1-2
(a) (b) (c) (d) (e)
18
Lampiran 10 Aktivitas selulase isolat A5D4-3 yang ditumbuhkan pada media pertumbuhan dengan penambahan pepton
Enzim Sumber Karbon Aktivitas Selulase(nkat/ml)
CMCase CMC 0.011
Avisel 0.006 Aviselase CMC 0.015 Avisel 0.004
FPase CMC 0.022
Avisel 0.01
Lampiran 11 Aktivitas selulase isolat D2D2-2 yang ditumbuhkan pada media pertumbuhan dengan penambahan ekstrak khamir
Enzim Sumber Karbon Aktivitas Selulase (nkat/ml)
CMCase CMC 0.373
Avisel 0.126 Aviselase CMC 0.069 Avisel 0.011
FPase CMC 0.219
Avisel 0.044
Lampiran 12 Aktivitas selulase isolat E2D1-2 yang ditumbuhkan pada media pertumbuhan dengan penambahan pepton
Enzim Sumber Karbon Aktivitas Selulase(nkat/ml)
CMCase CMC 0
Avisel 0
Avicelase CMC 0.012 Avisel 0.005
FPase CMC 0