Oleh
MUSFIROTUN AINI
Skripsi
Sebagai salah satu syarat untuk mencapai gelar Sarjana Perikanan
pada
Program Studi Budidaya Perairan Fakultas Pertanian Universitas Lampung
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
PENERAPAN TEKNIK IMOTILISASI BENIH
IKAN NILA (Oreochromis niloticus) MENGGUNAKAN EKSTRAK DAUN BANDOTAN (Ageratum conyzoides) PADA TRANSPORTASI BASAH
Musfirotun Aini 1), Mahrus Ali 2), Berta Putri 2)
ABSTRAK
Transportasi benih nila (Oreochromis niloticus) merupakan tahapan penting dalam keberhasilan pembesaran nila. Pemanfaatan bahan pembius lokal seperti daun bandotan (Ageratum conyzoides) dilakukan untuk mengantisipasi permasalahan transportasi basah berupa aktivitas metabolisme benih yang tinggi yang menyebabkan stres dan sintasan benih menjadi rendah. Penelitian bertujuan untuk mengetahui konsentrasi ekstrak daun bandotan yang paling baik untuk teknik imotilisasi dan pengaruhnya terhadap tingkat sintasan benih ikan nila.
Penelitian ini menggunakan rancangan acak lengkap dengan perlakuan A (0 mg/L), B (1,585 mg/L ekstrak daun bandotan), C (2,512 mg/L ekstrak daun
bandotan), dan D (3,982 mg/L ekstrak daun bandotan), masing-masing perlakuan 6 ulangan. Parameter yang diamati adalah uji toksisitas, kecepatan pingsan, lama pulih sadar, tingkat kelangsungan hidup, kecepatan pertumbuhan dan kualitas air (suhu, oksigen terlarut dan pH). Hasil penelitian menunjukkan bahwa konsentrasi ekstrak daun bandotan antar perlakuan berbeda nyata (P>0,01) terhadap periode imotilisasi, lama waktu pulih sadar, sintasan setelah transportasi dan pemeliharaan. Konsentrasi ekstrak daun bandotan antar perlakuan tidak berbeda nyata (P<0,05) terhadap kecepatan pertumbuhan harian benih nila. Konsentrasi yang sesuai untuk teknik imotilisasi sebesar 3,982 mg/L dengan tingkat kelangsungan hidup benih 95,55%.
Kata kunci : daun bandotan, ekstrak, benih nila, imotilisasi, pembesaran
1
) Mahasiswa Jurusan Budidaya Perairan Fakultas Pertanian Universitas Lampung
E-mail: musfirotun.aini@yahoo.com
2
) Dosen Staf pengajar Jurusan Budidaya Perairan Fakultas Pertanian Universitas Lampung
DAFTAR ISI
Halaman
DAFTAR TABEL ... i
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN ... iii
I. PENDAHULUAN 1.1Latar Belakang ... 1
1.2Tujuan Penelitian ... 3
1.3Manfaat Penelitian ... 3
1.4Kerangka Pemikiran ... 3
1.5Hipotesis ... 6
II.TINJAUAN PUSTAKA 2.1Biologi Ikan Nila ... 7
2.1.1 Klasifikasi Ikan Nila ... 7
2.1.2 Marfologi Ikan Nila ... 8
2.1.3 Habitat dan Kebiasaan Hidup Ikan Nila ... 9
2.1.4 Makanan dan Kebiasaan Makan Ikan Nila ... 9
2.2Transportasi Ikan ... 10
2.3Biologi Daun Bandotan ... 11
2.3.1 Klasifikasi dan Deskripsi Daun Bandotan ... 11
2.3.2 Fitokimia Daun Bandotan ... 12
2.3.3 Ekstraksi ... 13
2.3.4 Imotilisasi ... 14
III. METODE PENELITIAN 3.1Waktu dan Tempat ... 17
3.2Alat dan Bahan ... 17
3.3Prosedur Penelitian... 17
3.3.1 Penelitian Pendahuluan ... 18
3.3.1.1 Persiapan Ikan Uji ... 18
3.3.1.2 Pembuatan Ekstrak Daun Bandotan ... 19
3.3.1.3 Pembuatan Larutan stok... 19
3.3.1.4 Penentuan Selang Konsentrasi ... 20
3.3.2 Penelitian Utama ... 21
3.3.2.1Persiapan ... 21
3.3.2.2Imotilisasi Ikan ... 22
3.3.2.3Pengemasan ... 22
3.3.2.4Simulasi Transportasi ... 23
3.3.2.5Pengamatan Pulih Sadar ... 23
3.3.2.6Pemeliharaan Benih ... 23
3.4Analisis Data ... 24
3.5Parameter yang Diamati ... 25
3.5.1 Uji Toksisitas ... 25
3.5.2 Kecepatan Pingsan ... 25
3.5.3 Lama Pulih Sadar ... 25
3.5.4 Survival Rate Simulasi Transportasi ... 25
3.5.5 Kecepatan Pertumbuhan Harian ... 26
3.5.6 Kualitas Air ... 26
IV. HASIL DAN PEMBAHASAN 4.1Hasil Penelitian ... 27
4.1.1 Toksisitas Daun Bandotan ... 27
4.1.2 Kecepatan Pingsan ... 28
4.1.3 Lama Waktu Pulih Sadar ... 29
4.1.4 Survival Rate Simulasi Transportasi ... 30
4.1.5 Kecepatan Pertumbuhan Harian ... 31
4.2Pembahasan... ... 33
4.2.1 Toksisitas Daun Bandotan ... 33
4.2.2 Kecepatan Pingsan ... 35
4.2.3 Lama Waktu Pulih Sadar ... 41
4.2.4 Survival Rate Simulasi Transportasi ... 43
4.2.5 Kecepatan Pertumbuhan Harian ... 45
V.KESIMPULAN DAN SARAN 5.1Kesimpulan.... ... 48
5.2Saran ... ... 48 DAFTAR PUSTAKA
I. PENDAHULUAN
1.1Latar Belakang
Kegiatan budidaya ikan nila semakin diminati oleh pembudidaya ikan air tawar. Permintaan benih ikan nila yang semakin meningkat menyebabkan penyediaan benih harus dilakukan secara kontinyu. Salah satu tahapan yang penting dalam penyediaan benih ikan adalah kegiatan transportasi benih, terutama jika areal budidaya berjauhan dengan tempat pembenihan (hatchery).
Menurut Junianto (2003), kegiatan transportasi terdiri atas dua macam yaitu sistem basah (dengan media air) dan sistem kering (tanpa media air). Transportasi sistem basah lebih menguntungkan karena lebih efisien, dapat mengangkut benih dalam jumlah yang lebih banyak, dan jarak tempuh transportasi lebih jauh. Sedangkan sistem kering lebih rentan untuk benih karena tidak menggunakan media air yang merupakan habitat bagi ikan.
Permasalahan yang sering dihadapi oleh petani benih ikan nila adalah perubahan kualitas air selama transportasi, seperti O2 dalam media air yang
menurun, peningkatan CO2 dan NH3 yang mengakibatkan ikan stres sehingga
faktor penyebab ikan stres, sehingga diperlukan penelitian dengan memanfaatkan sumberdaya lokal untuk mengantisipasi ikan stres selama transportasi.
Salah satu upaya yang dapat dilakukan adalah dengan menekan aktivitas metabolisme tubuh ikan serta konsumsi oksigen selama transportasi namun tetap mempertimbangkan aspek keamanan dan kesehatan ikan, teknik ini dikenal dengan imotilisasi. Menurut Suryaningrum dkk. (2005), imotilisasi adalah suatu kegiatan untuk menurunkan aktivitas metabolisme dan respirasi biota perairan menggunakan suhu rendah dan bahan antimetabolit.
Penelitian menggunakan ekstrak bahan alami untuk teknik imotilisasi telah dilakukan oleh Sukarsa (2005) yang menggunakan ekstrak alga laut (Coulerpa sertulorides), ekstrak biji buah keben (Barringtonia asiatica) sebagai bahan
anestesi Ikan Kerapu Macan (Ephinephelus fuscoguttatus) (Septiarusli dkk, 2012), dan ekstrak biji karet (Hevea brasailiensis) (Ongge, 2001). Sedangkan penelitian menggunakan tanaman bandotan telah dilakukan oleh Arindra (2007), yang menyatakan bahwa daun bandotan memberikan pengaruh penenang pada ikan.
Berdasarkan hasil penelitian menyatakan bahwa ekstrak daun bandotan mengandung etanol, polifenol, dan flavonoid yang memiliki sifat analgesik (Evacuasiany dkk, 2008), selain itu juga adanya senyawa saponin (Septiarusli dkk, 2012), dan kandungan minyak atsiri (Harijati, 1989) dapat mengurangi laju metabolisme hingga bersifat anestetik pada ikan.
efektif untuk dapat diterapkan pada teknik imotilisasi benih ikan nila yang akan ditransportasikan.
1.2Tujuan Penelitian
Penelitian ini dilakukan dengan tujuan untuk mengetahui konsentrasi ekstrak daun bandotan yang sesuai dan tingkat kelangsungan hidup benih ikan nila dalam transportasi sistem basah.
1.3Manfaat Penelitian
Penelitian ini diharapkan dapat memberi informasi kepada peneliti, praktisi, dan mahasiswa mengenai salah satu bahan alami alternatif yang dapat digunakan untuk imotilisasi pada transportasi basah.
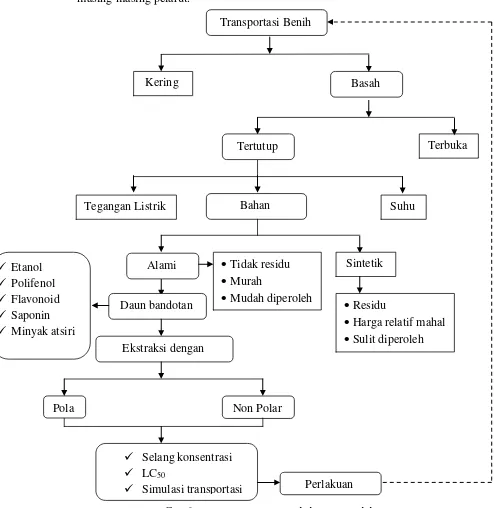
1.4 Kerangka Pemikiran
Kegiatan transportasi benih ikan umumnya dilakukan menggunakan transportasi sistem basah dan sistem kering. Transportasi sistem basah lebih memungkinkan dalam transportasi ikan karena media yang digunakan dapat diatur sedemikian rupa hingga sama dengan tempat hidup ikan sebelumnya.
Transportasi benih ikan secara praktis dilakukan dengan tingkat kepadatan yang tinggi agar biaya lebih murah dan efisien. Namun dalam aplikasinya, kepadatan benih ikan yang tinggi mengakibatkan benih-benih ikan menjadi stres dan lebih rentan mengalami kematian.
antimetabolik. Penambahan bahan antimetabolik dapat dijadikan sebagai bahan penenang untuk meminimalisir kematian dan stres benih ikan. Bahan metabolik yang digunakan terdiri dari bahan alami dan sintetis.
Bahan anestetik sintetis seperti tricaine (MS-22) adalah bahan yang biasa digunakan dalam kegiatan pembiusan induk ikan, benih dan ikan hias pada sistem transportasi yang bertujuan agar tingkat kelulusan hidup ikan masih tinggi ketika sampai ditempat tujuan. Akan tetapi penggunaan bahan kimia memiliki kelemahan seperti menimbulkan residu yang membahayakan keamanan pangan, harganya relatif mahal dan relative sulit diperoleh (Subangsinghe, 1997), sehingga perlu dicari bahan alami sebagai alternatif. Penggunaan bahan alami digunakan karena tidak menyebabkan residu dalam tubuh ikan (Chotimah dkk, 2009). Selain itu, harga relatif murah dan mudah diperoleh. Salah satu bahan alami tersebut adalah ekstrak daun bandotan (Ageratum conyzoides).
Daun bandotan mengandung metabolit sekunder seperti: flavonoid, alkaloid, etanol, polifenol, saponin, terpena, kromen, kromon, benzofuran, kumarin, minyak atsiri, sterol dan tannin (Kamboj and Saluja, 2010; Evacuasiany dkk, 2008; Kardono, 2003; Heyne, 1987).
Berdasarkan kandungan yang dimiliki oleh daun bandotan, beberapa senyawa diantaranya dapat memberikan efek analgesik, seperti: etanol, flavonoid, dan polifenol, selain itu juga dapat memberikan efek anestetik seperti minyak atsiri dan saponin. Sehingga daun bandotan berpotensi untuk diterapkan dalam teknik imotilisasi benih ikan dalam kegiatan transportasi.
yang digunakan dalam proses ekstraksi. Secara sederhana pelarut yang biasa digunakan terbagi atas pelarut polar dan non polar. Senyawa polar akan larut dalam pelarut polar dan senyawa non-polar akan larut dalam pelarut non-polar, sehingga perlu dilakukan perlakuan penelitian perbedaan jenis pelarut untuk melihat efektifitas anestetik masing-masing senyawa yang dilarutkan oleh masing-masing pelarut.
Gambar 1. Kerangka Pemikiran Penelitian Transportasi Benih
Terbuka Basah
Bahan Suhu
Kering
Tertutup
Tegangan Listrik
Sintetik Alami
Residu
Harga relatif mahal Sulit diperoleh Daun bandotan
Etanol
Polifenol
Flavonoid
Saponin
Minyak atsiri
Ekstraksi dengan
Pola Non Polar
Selang konsentrasi
LC50
Simulasi transportasi Perlakuan Tidak residu
Murah
1.5 Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah
Ho : τi = 0 : Tidak ada konsentrasi daun bandotan yang sesuai untuk teknik
imotilisasi benih ikan nila dalam kegiatan transportasi basah pada selang kepercayaan 95%.
H1 : τi ≠ 0 : Minimal ada satu konsentrasi daun bandotan yang sesuai untuk
teknik imotilisasi benih ikan nila dalam kegiatan transportasi basah pada selang kepercayaan 95%.
Ho : τi = 0 : Tidak ada pengaruh konsentrasi daun bandotan terhadap tingkat
kelangsungan hidup benih ikan nila dalam kegiatan transportasi basah pada selang kepercayaan 95%.
H1 : τi ≠ 0 : Minimal ada satu pengaruh konsentrasi daun bandotan terhadap
II. TINJAUAN PUSTAKA
2.1Biologi Ikan Nila 2.1.1 Klasifikasi Ikan Nila
Klasifikasi ikan nila berdasarkan Suyanto (2003) adalah sebagai berikut : Filum : Chordata
Sub-filum : Vertebrata Kelas : Osteichthyes Sub-kelas : Acanthoptherigii Ordo : Percomorphi Sub-ordo : Percoidea Family : Cichlidae Genus : Oreochromis
Spesies : Oreochromis niloticus.
Ikan nila (Oreochromis niloticus) pada awalnya dimasukkan ke dalam jenis Tilapia nilotica atau ikan dari golongan tilapia yang mengerami telur dan larva di
dalam mulutnya. Pada tahun 1982 nama ilmiah ikan nila menjadi Oreochromis niloticus. Perubahan nama tersebut telah disepakati dan dipergunakan oleh
2.1.2 Morfologi Ikan Nila
Ikan nila memiliki bentuk tubuh pipih memanjang ke samping, makin ke perut makin terang. Mempunyai garis vertikal 9-11 buah berwarna hijau kebiruan. Pada sirip ekor terdapat 6-12 garis melintang yang ujungnya berwarna kemerah-merahan, sedangkan punggungnya terdapat garis-garis miring. Mata tampak menonjol agak besar dengan bagian tepi berwarna hijau kebiru-biruan. Letak mulut ikan nila terminal, posisi sirip perut terhadap sirip dada thorochis, garis susuk (linea lateralis) terputus menjadi dua bagian. Jumlah sisik pada garis rusuk 34 buah dan tipe sisik stenoid (ctenoid). Bentuk sirip ekor berpinggiran tegak (Kordi, 1997). Morfologi ikan dapat dilihat pada Gambar 2.
Gambar 2. Benih Ikan Nila (Oreochromis niloticus) (Sumber : Dokumen Pribadi)
2.1.3 Habitat dan Kebiasaan Hidup Ikan Nila
Ikan nila mempunyai habitat di perairan tawar, seperti sungai, danau, waduk dan rawa. Tetapi karena toleransinya yang tinggi terhadap salinitas, maka ikan dapat hidup dan berkembang biak di perairan payau dan laut. Salinitas yang disukai antara 0 - 35 ppt. Ikan nila yang masih kecil lebih tahan terhadap perubahan lingkungan dibanding dengan ikan yang sudah besar (Suyanto, 2003).
Menurut Panggabean (2009), kualitas air yang sesuai dengan habitat ikan nila adalah pH optimal antara 7 - 8, suhu optimal antara 25 - 30oC, dan salinitas 0 - 35 ppt, amoniak antara 0 - 2,4 ppm, dan DO berkisar antara 3 - 5 ppm.
2.1.4 Makanan dan Kebiasaan Makan Ikan Nila
Ikan nila memakan makanan alami berupa plankton, perifiton dan tumbuh-tumbuhan lunak seperti hydrilla, ganggang sutera dan klekap. Oleh karena itu, ikan nila digolongkan ke dalam omnivora (pemakan segala). Untuk budidaya, ikan nila tumbuh lebih cepat hanya dengan pakan yang mengandung protein sebanyak 20 - 25%.
Dari penelitian lebih lanjut kebiasaan makan ikan nila berbeda sesuai tingkat usianya. Benih-benih ikan nila ternyata lebih suka mengkomsumsi zooplankton, seperti rototaria, copepoda dan cladocera. Ikan nila ternyata tidak hanya mengkonsumsi jenis makanan alami tetapi ikan nila juga memakan jenis makanan tambahan yang biasa diberikan, seperti dedak halus, tepung bungkil kacang, ampas kelapa dan sebagainya.
2.2Transportasi Ikan
Menurut Effendi (2004), yang dinamakan transportasi ikan hidup adalah usaha memindahkan ikan dari suatu sentra produksi ke daerah sentra konsumsi dengan kepadatan tinggi, biaya rendah, kelangsungan hidup ikan tinggi, dan kondisi ikan sehat sampai tujuan.
Transportasi ikan hidup terbagi menjadi dua yaitu sistem tertutup dan sistem terbuka. Sistem tertutup adalah menggunakan wadah yang tertutup dengan segala persyaratan yang dibutuhkan untuk bertahan hidup selama transportasi dan tidak ada hubungan langsung antara air media dengan udara luar (Berka, 1986). Dalam transportasi tertutup kebutuhan oksigen ikan selama transportasi disediakan dengan cara memasukan oksigen murni sehingga bisa berdifusi kedalam air media transportasi menjadi oksigen terlarut yang bisa dimanfaatkan oleh ikan (Effendi, 2004).
Transportasi tertutup terbagi menjadi sistem basah dan kering. Berdasarkan Wibowo (1993), pada transportasi sistem basah, media dituntut sama dengan tempat hidup ikan sebelumnya seperti air dan oksigen. Sistem transportasi ini lebih menguntungkan, efesiensi penggunaan tempat, ikan yang diangkut lebih banyak, dan dapat ditransportasikan hingga jarak yang jauh. Sedangkan transportasi sistem kering adalah menggunakan media selain air seperti serbuk gergaji.
penggantian air selama transportasi, dan pencegahan menggunakan bahan kimia selama transportasi ikan (Berka, 1986).
Faktor yang berpengaruh penting pada transportasi ikan adalah tersedianya oksigen terlarut yang memadai. Kemampuan ikan untuk mengkonsumsi oksigen dipengaruhi oleh toleransi terhadap stres, suhu, air, pH, konsentrasi CO2, dan sisa
metabolisme lain seperti amoniak (Junianto, 2003).
2.3Biologi Daun Bandotan
2.3.1 Klasifikasi dan Deskripsi Daun Bandotan
Tanaman bandotan dalam taksonomi tumbuhan diklasifikasikan dalam kingdom Plantae, superdivisi Spermatophyta, divisi Magnoliophyta, kelas Magnoliopsida, sub-kelas Astericae, ordo Asterales, familia Asteraceae, genus
Ageratum, spesies Ageratum conyzoides. L (Sukamto, 2007).
Menurut Sukamto (2007), tumbuhan ini di berbagai daerah Indonesia memiliki nama yang berbeda antara lain di Jawa disebut bandotan, di Sumatera dikenal daun tombak, dan di Madura disebut wedusan. Tanaman ini mempunyai daya adaptasi yang tinggi, sehingga mudah tumbuh dimana-mana dan sering menjadi gulma yang merugikan para petani.
Bentuk fisik tanaman bandotan dapat dilihat pada Gambar 3.
Gambar 3. Tanaman Bandotan
2.3.2 Fitokimia Daun Bandotan
Pada dasarnya tumbuhan memproduksi dua jenis senyawa, yaitu metabolit primer dan metabolit sekunder. Metabolit sekunder merupakan produk khas yang ditemukan pada tumbuhan tertentu, sedangkan metabolit primer merupakan produk essensial yang terdapat pada semua makhluk hidup yang digunakan untuk kelangsungan hidup dan berkembang biak, misalnya protein, lemak, dan asam nukleat.
Naim (2004) menyatakan bahwa tanaman memiliki suatu kemampuan yang hampir tidak terbatas untuk mensintesis senyawa-senyawa aromatik, kebanyakan dari senyawa tersebut adalah kelompok senyawa fenol.
terpena, kromen, kromon, benzofuran, kumarin, minyak atsiri, sterol dan tannin (Ming 1999; Kamboj & Saluja, 2010).
Berdasarkan Nurdjanah (2007), penggunaan bahan alami seperti ekstrak daun bandotan yang mengandung senyawa organik dapat digunakan untuk bahan anestesi atau imotilisasi dengan memanfaatkan senyawa dari golongan alkaloid dan aromatik. Beberapa golongan alkaloid yang dapat digunakan diantaranya saponin, treonin, dan morfin. Golongan alkaloid memiliki sifat analgesik, antibakteri, dan anti kanker. Sedangkan dari golongan senyawa aromatik diantaranya eugenol, elemycin, myristicin, polifenol, dan safrole yang bersifat menimbulkan daya halusinasi jika digunakan dalam konsentrasi tertentu.
Menurut Kardono (2003), bahwa daun bandotan bandotan mempunyai efek spasmolitik dan analgesik serta memberikan pengaruh relaksasi pada otot polos. Sedangkan Arindra (2007), menyatakan bahwa daun bandotan dapat memberikan pengaruh menenangkan pada ikan sehingga mengurangi ekskresi produk metabolik.
2.3.3 Ekstraksi
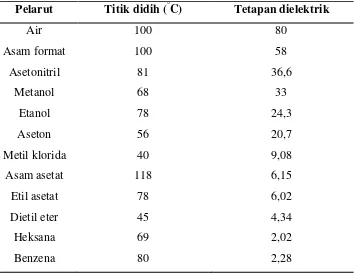
Dalam ekstraksi, prinsip dasar pemilihan pelarut pada proses ekstraksi adalah kepolaran senyawa yang dianalisis harus sama dengan kepolaran pelarutnya. Umumnya ekstraksi dilakukan untuk pemisahan dalam laboratorium, misalnya pemisahan senyawa-senyawa organik (fase organik) dari larutan berair (fase air) dengan menggunakan pelarut yang tidak dapat bercampur (Harvey, 2000).
kepolaran dan gugus polar pada senyawa yang akan diekstrak seperti gugus OH, COOH, dan juga gugus fungsi lainnya. Dengan mengetahui sifat metabolit yang akan diekstraksi, maka dengan mudah dapat dipilih pelarut yang sesuai berdasarkan kepolaran metabolit dan pelarut.
Senyawa polar akan larut dalam pelarut polar dan senyawa non-polar akan larut dalam pelarut non-polar. Derajat kepolaran bergantung pada ketetapan dielektrik, makin besar tetapan dielektrik maka akan semakin polar pelarut tersebut. Beberapa pelarut organik yang sering digunakan dalam proses ekstraksi dapat dilihat pada Tabel 1.
Tabel 1. Beberapa Pelarut Organik dan Sifat Fisiknya Pelarut Titik didih (°C) Tetapan dielektrik
Air 100 80
Asam format 100 58
Asetonitril 81 36,6
Metanol 68 33
Etanol 78 24,3
Aseton 56 20,7
Metil klorida 40 9,08
Asam asetat Etil asetat Dietil eter Heksana Benzena
118 78 45 69 80
6,15 6,02 4,34 2,02 2,28 (Sumber : Anonim, 2008).
2.3.4 Imotilisasi
ditransportasikan. Kondisi imotil diperlukan agar proses metabolisme benih ikan berkurang sehingga aktivitas fisiologis, kebutuhan oksigen dan produksi CO2
benih ikan menjadi rendah (Nitibaskara dkk, 2006).
Terdapat beberapa teknik imotilisasi biota perairan, yaitu dengan menggunakan suhu rendah atau zat anti metabolit (anestesi). Teknik imotilisasi menggunakan bahan anti metabolit alami yang dapat digunakan untuk membius benih ikan antara lain ekstrak biji karet, minyak cengkeh, dan ekstrak akar tuba, sedangkan bahan anti metabolit sintetis yang biasa digunakan dalam transportasi ikan hidup adalah MS-222 dan CO2. Sedangkan menggunakan suhu rendah dapat
dilakukan dengan penurunan suhu secara bertahap maupun secara langsung (Suryaningrum dkk, 2005).
Teknik imotilisasi dapat dilakukan menggunakan bahan anestesi alami. Anestesi merupakan suatu kondisi ketika tubuh atau bagian tubuh kehilangan kemampuan untuk merasa (insensibility). Imotilisasi memiliki tujuan agar ikan yang diimotilisasikan bersifat imotil saat ditransportasikan. Imotilisasi sendiri memiliki prinsip hibernasi dimana suatu organisme diusahakan metabolismenya dapat ditekan hingga kondisi minimum untuk mempertahankan hidupnya lebih lama lagi (Schoemaker, 1991 dalam Suryaningrum, 2005).
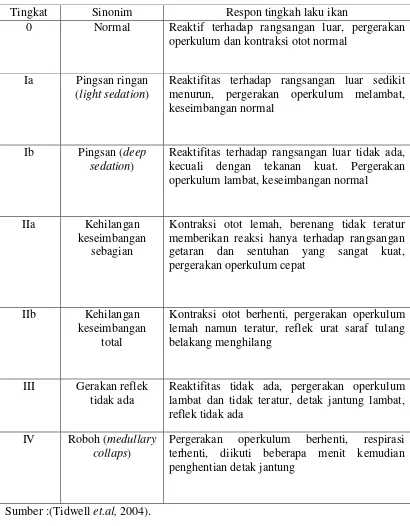
Tabel 2. Respon Tingkah Laku Ikan dalam Tahap Pemingsanan Tingkat Sinonim Respon tingkah laku ikan
0 Normal Reaktif terhadap rangsangan luar, pergerakan operkulum dan kontraksi otot normal
Ia Pingsan ringan (light sedation)
Reaktifitas terhadap rangsangan luar sedikit menurun, pergerakan operkulum melambat, keseimbangan normal
Ib Pingsan (deep sedation)
Reaktifitas terhadap rangsangan luar tidak ada, kecuali dengan tekanan kuat. Pergerakan operkulum lambat, keseimbangan normal
IIa Kehilangan keseimbangan
sebagian
Kontraksi otot lemah, berenang tidak teratur memberikan reaksi hanya terhadap rangsangan getaran dan sentuhan yang sangat kuat, pergerakan operkulum cepat
IIb Kehilangan keseimbangan
total
Kontraksi otot berhenti, pergerakan operkulum lemah namun teratur, reflek urat saraf tulang belakang menghilang
III Gerakan reflek tidak ada
Reaktifitas tidak ada, pergerakan operkulum lambat dan tidak teratur, detak jantung lambat, reflek tidak ada
IV Roboh (medullary collaps)
Pergerakan operkulum berhenti, respirasi terhenti, diikuti beberapa menit kemudian penghentian detak jantung
III. METODE PENELITIAN
3.1Waktu dan Tempat
Penelitian ini telah dilakukan pada bulan April – Oktober 2013, bertempat di Laboratorium Budidaya Perikanan Fakultas Pertanian Universitas Lampung.
3.2Alat dan Bahan
Materi penelitian yang digunakan terdiri dari alat dan bahan penelitian. Alat yang digunakan pada penelitian ini meliputi: tandon ember plastik besar sebagai penampungan, akuarium 30x30x20 cm3, aerator, stopwatch, timbangan digital, saringan, blender, kertas label, alat tulis, DO meter, termometer, pH meter, kantong plastik ukuran 20 cm x 35 cm dengan tebal 2 mm, karet, styrofoam 50 x 35 x 30 cm3, pipet tetes, tabung oksigen, dan lakban.
Bahan penelitian yang digunakan adalah benih ikan nila berukuran 3-5 cm sebanyak 360 ekor, ekstrak daun bandotan, air murni, akuades, gas oksigen, pakan komersil, dan es batu.
3.3 Prosedur Penelitian
(LC-50) dengan melakukan uji toksisitas menggunakan metode probit menurut Finney (1971).
Penelitian utama berupa kegiatan simulasi transportasi menggunakan sistem media air (basah) dengan bahan imotilisasi ekstrak daun bandotan.
3.3.1 Penelitian Pendahuluan 3.3.1.1Persiapan Ikan Uji
Ikan yang digunakan dalam penelitian dilakukan aklimatisasi terlebih dahulu selama 1 minggu dengan menempatkan benih ikan pada akuarium yang bersuhu 26-28oC. Aklimatisasi ini dilakukan agar benih ikan nila dapat menyesuaikan dengan kondisi air yang digunakan dalam penelitian.
Ikan uji yang digunakan adalah benih ikan nila yang memiliki panjang total 3-5 cm yang didapat dari lokasi Balai Benih Ikan di Natar Lampung - Selatan. Benih ikan nila yang digunakan sebagai hewan uji adalah benih ikan yang sehat dan tidak cacat. Benih ikan yang sehat ditandai dengan gerak renang aktif, reaktif terhadap rangsangan dari luar, sisik tidak lepas, mulut dan sirip tidak cacat atau luka, mata cerah dan tidak ada bercak putih.
3.3.1.2Pembuatan Ekstrak Daun Bandotan
Pembuatan ekstrak daun bandotan dilakukan menurut metode Quinn (1988) dalam Pramono (2002) yang dimodifikasi sebagai berikut:
Daun bandotan disortasi untuk memilih daun yang berwarna hijau tua dan
dibersihkan dari kotoran yang melekat pada daun.
Daun bandotan yang telah disortasi dikeringkan, lalu dihancurkan dan
ditimbang terlebih dahulu.
Daun bandotan yang telah halus dicampurkan dengan akuades dengan
perbandingan 1:2 dan dihomogenkan sampai membentuk campuran.
Campuran tersebut diaduk sampai merata setiap 1 jam sekali selama 24 jam
untuk memastikan senyawa-senyawa aktif yang terkandung dalam daun bandotan keluar dan terlarut dalam akuades.
Campuran bahan disaring menggunakan kertas saring/kain untuk memperoleh
filtrat yang terbebas dari kotoran dan ampas.
Filtrat yang berupa ekstrak kasar disimpan dalam botol berwarna gelap
sebelum digunakan sebagai zat antimetabolik.
3.3.1.3Pembuatan Larutan Stok
Pada pembuatan larutan stok didapatkan berdasarkan hasil percampuran 400 gram daun bandotan kering yang telah dihancurkan dengan 800 ml akuades. Hasil pembentukan larutan ekstrak yang didapatkan adalah 37 gram.
3.3.1.4Penentuan Selang Konsentrasi
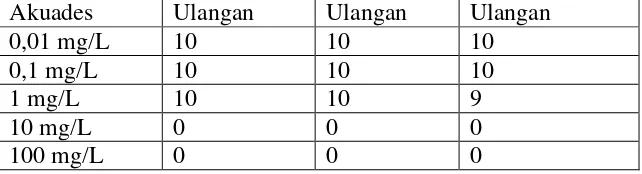
Pada tahap ini bertujuan untuk memperoleh konsentrasi ambang atas dan ambang bawah bahan anestetik ekstrak daun bandotan. Konsentrasi ambang adalah konsentrasi yang menyebabkan 95% populasi hewan uji hidup dalam waktu 48 jam (ambang bawah) dan konsentrasi yang menyebabkan hewan uji mati dalam waktu 24 jam (ambang atas).
Pada penentuan konsentrasi ambang digunakan derajat konsentrasi ekstrak daun bandotan (bahan uji), yaitu 0,01 mg/L, 0,1 mg/L, 1 mg/L, 10 mg/L, dan 100 mg/L. Setiap konsentrasi merupakan perlakuan yang diulang sebanyak 3 kali. Pengamatan dilakukan pada jam ke-24 dan 48, dihitung mulai bahan uji dimasukkan dalam wadah uji. Pada setiap wadah percobaan dimasukkan 10 ekor benih ikan nila. Selama percobaan benih ikan nila tidak diberi pakan dan air media dioksigenasi. Benih ikan nila yang mati pada setiap perlakuan dicatat dan dikeluarkan dari wadah percobaan.
3.3.1.5Penentuan Uji Toksisitas
Pengujian aktivitas bahan anestetik ekstrak daun bandotan meliputi penentuan toksisitas yang dinyatakan dengan Median Lethal Concentration (LC-50) merupakan konsentrasi yang menyebabkan 50% hewan uji mengalami kematian.
( )(1)
N = Konsentrasi ambang atas n = Konsentrasi ambang bawah k = Jumlah konsentrasi yang diuji
a = Konsentrasi terkecil dalam deret yang akan ditentukan
Dengan rumus (1) dapat dihitung nilai konsentrasi terkecil. Selanjutnya dapat dihitung berturut-turut konsentrasi b, c, d dan e dengan menggunakan rumus (2).
Penentuan Median Lethal Concentration (LC50) menurut deret logaritmik
Mempersiapkan kantung plastik yang diisi dengan 1 L akuades.
Menyiapkan es batu yang telah diperkecil ukurannya dengan cara dihancurkan,
es berfungsi menjaga suhu agar tetap dingin
3.3.2.2Imotilisasi Ikan
Sebelum melaksanakan imotilisasi, benih ikan nila dipuasakan/diberok terlebih
dahulu selama 48 jam.
Benih ikan nila diimotilisasi dengan menyiapkan akuarium berukuran 30 x 20
x 30 cm3 dan mengisinya dengan akuades sebanyak ¾ bagian akuarium selanjutnya memasukan 15 ekor benih ikan nila dan menambahkan ekstrak daun bandotan hingga di dalam akuarium terdapat konsentrasi yang diinginkan serta mengukur kualitas airnya.
Mengamati efek yang dihasilkan dari proses anestesi yaitu dengan cara
mencatat lama waktu imotilisasi sampai keseluruhan imotil.
3.3.2.3Pengemasan (Packing)
Menyiapkan wadah styrofoam dan mencucinya hingga bersih tanpa sabun.
Memasukkan benih ikan nila yang sudah terbius ke dalam kantung plastik yang
telah dirangkap dan berisi akuades, kemudian diberi gas oksigen murni. Suhu air dijaga pada 15°C dan perbandingan antara akuades, ikan dan oksigen adalah 1 : 1 : 2.
Kantung plastik yang berisi benih ikan nila tersebut kemudian diikat rapat
3.3.2.4Simulasi Transportasi
Ikan yang telah dikemas dilakukan simulasi transportasi di tempat dengan
asumsi bahwa jarak tempuh dihitung sama dengan dengan waktu transportasi dan goncangan saat dalam perjalanan seminimal mungkin. Simulasi transportasi dilakukan selama 6 jam berdasarkan ukuran benih dan kepadatan yang digunakan (Ismail, 1992).
3.3.2.5Pengamatan Pulih Sadar
Langkah-langkah dalam pengamatan pulih sadar adalah sebagai berikut:
Menyiapkan akuarium sebanyak 24 buah dan masing-masing diisi air sebanyak
10 liter dan mengukur kualitas airnya.
Benih ikan nila yang telah selesai ditransportasikan diambil kemudian
dimasukan kedalam akuarium dan diamati sampai benih sadar sebagai indikator benih ikan nila bergerak aktif dan juga diamati waktu pulih sadar benih ikan nila.
3.3.2.6Pemeliharaan Benih
Mempersiapkan akuarium yang telah diisi air dan memberikan aerasi dalam
akuarium tersebut selama 48 jam sebelum digunakan untuk memelihara ikan. Ikan uji tersebut dipelihara selama 30 hari.
Pakan yang diberikan adalah pakan buatan komersial dengan frekuensi dua
kali sehari, pagi pukul 08.00 dan sore pukul 16.00 WIB.
Penyiponan dilakukan setiap hari dan dilakukan pergantian air 100% selama 3
Setelah memelihara ikan selanjutnya melakukan penghitungan survival rate
dan pertumbuhan harian.
3.4 Analisis Data
Perlakuan yang diujikan adalah konsentrasi di bawah sublethal dari ekstrak daun bandotan berdasarkan deret logaritmik dengan perlakuan konsentrasi uji 0 ml/L (sebagai kontrol), 1,585 mg/L, 2,512 mg/L, 3,982 mg/L, masing-masing perlakuan 6 kali ulangan dan dilakukan simulasi waktu transportasi 6 jam.
Penelitian menggunakan metode eksperimen dengan rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL). Model rancangan yang digunakan yaitu:
Yij = µ + τi +
ε
iji = 1, 2, 3....a j = 1, 2, 3....a Keterangan :
Yij = Nilai pengamatan dari perlakuan konsentrasi ekstrak daun bandotan ke-i terhadap imotilisasi benih ikan nila ke-j
µ = Nilai tengah populasi
τi = Pengaruh aditif dari perlakuan konsentrasi ekstrak daun bandotan i = Jumlah perlakuan
j = Jumlah satuan percobaan / ulangan
ε
ij = Pengaruh galat percobaan perlakuan konsentrasi ekstrak daun bandotan ke-i terhadap imotilisasi benih ikan nila ke-j3.5Parameter yang Diamati 3.5.1 Uji Toksisitas
Pengujian toksisitas LC50 menggunakan metode analisis probit (Finney,
1971).
3.5.2 Kecepatan Imotilisasi
Kecepatan imotilisasi diukur pada saat mulai memberikan bahan antimetabolik sampai benih ikan nila imotil. Ciri-ciri ikan imotil ditandai dengan pergerakan operkulum yang lambat dan ikan berdiam di dasar akuarium.
3.5.3 Lama Pulih Sadar
Lama pulih sadar benih ikan nila diamati sejak simulasi transportasi dengan cara benih ikan nila dimasukan kedalam akuarium yang berisi air tawar. Air tawar yang digunakan telah diaerasi selama 24 jam selanjutnya dihitung sampai ikan sadar dari imotil dan ikan terlihat aktif pergerakannya.
3.5.4 Survival Rate Simulasi Transportasi
Nilai ikan yang hidup pada pengujian setelah dilakukan uji simulasi transportasi. Nilai ini dapat diketahui setelah melaksanakan pengujian pulih sadar. Menurut Anastasia (2009), untuk menghitung survival rate (SR) dapat digunakan dengan rumus:
SR = —— x 100% Keterangan :
SR : derajat kelangsungan hidup Nt : jumlah ikan akhir (ekor) No : jumlah ikan awal (ekor)
Nt
3.5.5 Kecepatan Pertumbuhan Harian
Kecepatan pertumbuhan harian (Growt rate) adalah laju pertumbuhan dalam kurun waktu tertentu dalam satuan hari. Menurut Effendi (1997), kecepatan pertumbuhan harian dapat dinyatakan dengan rumus :
GR = Wt - W0
t Keterangan:
GR = Kecepatan pertumbuhan harian (gram/hari) t = Lama pemeliharaan (hari)
Wt = bobot rata-rata akhir(gram) W0 = bobot rata-rata awal(gram)
3.5.6 Kualitas Air
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian dapat disimpulkan bahwa:
1. Konsentrasi yang sesuai untuk teknik imotilisasi benih ikan nila pada transportasi basah selama 6 jam adalah 3,982 mg/L.
2. Survival rate benih ikan nila terbaik mencapai 95,55% pada konsentrasi ekstrak daun bandotan 3,982 mg/L selama transportasi 6 jam.
5.2 Saran
DAFTAR PUSTAKA
Anastasia, RD. 2009. Kualitas Sperma Pasca Pengangkutan dari Induk Ikan Mas Koki (Carassius auratus) yang Dianestesi dengan Minyak Biji Pala. (Skripsi). Jurusan Budidaya Perairan Fakultas Pertanian Universitas Lampung. Lampung.
Andriyanto, Sutisna, A., Manalu, W. 2009. Potensi Penggunaan Acepromazine sebagai Sediaan Transquilizier pada Transportasi Ikan Patin. Jurnal Berkala Perikanan. (38)1: 8-11
Anonim. 2008. Pelarut Organik. http://www.usm.maine.edu/newton. [diakses 09 Maret 2013 pukul 15.00 WIB]
Arindra, D. 2007. Penggunaan Daun Bandotan (Ageratum conyzoides) sebagai Bahan Antimetabolik Alami untuk Menekan Konsumsi Oksigen Ikan Mas (Cyprinus carpio) selama Transportasi. (Skripsi).Fakultas Kedoteran Hewan. Universitas Airlangga. Surabaya. 39 hal.
Berka, R. 1986. The Transport of Live Fish. A Review. FAO of the United Nations. Roma. 52 p.
Chotimah, DN. Wahju Tjahjaningsih. Laksmi Sulmartini. Thomas V, Widiyatno. Juni Triastuti. 2009. Respon Daya Cerna dan Respirasi Benih Ikan Mas (Cyprinus carpio) Pasca Transportasi dengan Menggunakan Daun Bandotan (Ageratum conyzoides) sebagai Bahan Antimetabolik. Jurnal Ilmiah Perikanan dan Kelautan Vol. 1 No. 1, April 2009. Fakultas Perikanan dan Kelautan Universitas Airlangga dan Fakultas Kedokteran Hewan Universitas Airlangga. Surabaya.
Dewi, M. K. 1995. Kajian Penggunaan MS-222 sebagai Bahan Pembius pada Penanganan Lobster Hijau Pasir (Paneliru homarus) Hidup. (Skripsi). Fakultas Perikanan, IPB. Bogor.
Effendi, H. 2004. Telaah Kualitas Air bagi Pengelolaan Sumberdaya dan Lingkungan Perairan. Departemen Sumberdaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor
Evacuasiany E, Susy Tjahjani, Defri Ferdiansyah Noor. 2008. Efek Ekstrak Etanol Daun Bandotan (Ageratum Conyzoides L.) sebagai Analgetik terhadap Mencit Galur Swiss Webster. Fakultas Kedokteran. Universitas Kristen Maranatha. Bandung.
Fauziah, NR. 2006. Pemingsanan Ikan Mas (Cyprinus carpio) Menggunakan Ekstrak Tembakau, Ekstrak Mengkudu dan Ekstrak Cengkeh. Jurnal Penelitian. Institut Pertanian Bogor. (9):2-3.
Finney, DJ. 1971. Probit Analysis. Third Edition. Director of the Agricultural Research Council Unit of Statistics. United States.
Fujaya, Y. 2004. Fisiologi Ikan. Dasar Pengembangan Teknik Perikanan. Rineka Cipta. Jakarta. Hal. 114-115: 124.
Ferreira, J. T., H.J. Schoonbee dan G.L. Smith. 1984. The Uptake of the Anesthetic Benzoncaine Hydrichloride by the Gills and the Skin of Three Freshwater Fish Spesies. Journal of Fish Biologi Vol 25 No. 1. The Fisheries Society the British Isles.
Gunn, E. 2001. Floundering in the Foibes of Fish Anestesia. P 211.
Harijati, A.M. 1989. Diktat Kuliah Makanan Ikan. Universitas Brawijaya. Malang. 52 hal.
Harvey D. 2000. Modern Analytical Chemistry. New York: The McGraw-Hill Companies, Inc
Heyne, K. 1987. Tumbuhan Berguna Indonesia. Jilid II. Badan Litbang Departemen Kehutanan.
Ismail A dan A. Sudrajat. 1992. Budidaya Ikan Bandeng (Chanos-chanos P) Sistem Penggelondongan dan Pembesaran di Tambak. Penebar Swadaya: Jakarta.
Junianto. 2003. Teknik Penanganan Ikan. Penebar Swadaya. Jakarta. Hal. 93-111. Kamboj, A dan A. K. Saluja. 2010. Ageratum conyzoides L.: A Review on its Phytochemical and Pharmacological Profile. International Journal of Green Pharmacy: 59-68.
Khairuman dan Amri, K. 2008. Buku Pintar Budidaya 15 Ikan Konsumsi. PT Agromedia Pustaka. Jakarta Selatan
Kordi. 1997. Budidaya Ikan Nila. Dahara Prize. Semarang. Hal. 180-181;182;
Ming LC. 1999. Ageratum conyzoides: A tropical source of medicinal and Agricultural product. J. Janick, ASHS Press, Alexandria, VA.
Naim, R. 2004. Teh Hijau sebagai Antikanker. Medika, no. 6, Juni. Bogor. Fakultas Kedokteran Hewan – IPB.
Nitibaskara R, Wibowo S, Uju. 2006. Penanganan dan Transportasi Ikan Hidup untuk Konsumsi. Departemen Teknologi hasil Perairan. FakultasPerikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor
Nurdjanah N. 2007. Teknologi Pengolahan Pala. Badan Penelitian dan Pengembangan Pascapanen Pertanian. Departemen Pertanian.
Ongge, D. 2001. Studi Penggunaan Ekstrak Biji Karet (Hevea brasailiensis Muell. Arg) sebagai Bahan Pemingsan dalam Transportasi Ikan Nila Gift (Oreochromis sp.) Hidup Sistem Kering. (Skripsi). Fakultas Perikanan dan Ilmu Kelautan IPB. Bogor.
Panggabean,A. 2009. Budidaya Ikan Nila (Oreochromis niloticus). Departemen Kehutanan. Fakultas Pertanian. Sumatra Utara. Hal 2; 3 ;8 ; 12-14
Pramono, V. 2002. Penggunaan Ekstrak Caulerpa racemosa Sebagai Bahan Pembius pada Pra Transportasi Ikan Nila (Oreochromis niloticus) Hidup. (Skripsi). Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Quinn, R. J. 1988. Chemistry of Aqueous Marine Ekstracts: Isolation Teqniques
in Bioorganic Marine Chemistry. Vol. 2. Spronger-Verlag. Berlin Heidelberg.
Ross, L. G. And B. Ross. 1999. Anesthetic and Sedative Techniques for Aquatic Animals. Blackwell Science. London. 159 p.
Rukmana, R. 1997. Ikan Nila Budidaya Prospek Agribisnis. Kanisius. Yogyakarta.
Steel, RGD and Torie, HJ. 1991. Prinsip dan Prosedur Statistika Suatu Pendekatan Biometrik. Gramedia. Jakarta.
Subashingshe, S. 1997. Live Fish Handling and Transportation. INFO FISH International 2 : 39 – 43.
Sudama, DNA. 2012. Penggunaan Minyak Cengkeh (Eugenia aromatica) sebagai Anestetik pada Transportasi Benih Nila Merah (Oreochromis sp.) tanpa Media Air. (Skripsi). Jurusan Budidaya Perairan Fakultas Pertanian Universitas Lampung. Lampung.
Sukamto. 2007. Bandotan (Ageratum conyzoides)Ttanaman Multi Fungsi yang menjadi Inang Potensial Virus Tanaman. Warta Puslitbangbun 13: Desember 2007.
Sukarsa, D. 2005. Penerapan Teknik Imotilisasi Menggunakan Ekstrak Alga Laut (Coulerpa sertulorides) dalam Transportasi Ikan Kerapu (Ephinephelus suilus) Hidup Tanpa Media Air. Buletin Teknologi Hasil Perikanan. (8)1: 12-24. Staf Pengajar Departemen Teknologi Hasil Perairan FKIP IPB. Suryaningrum TD, Utomo BSD, Wibowo S. 2005. Teknologi Penanganan dan
Transportasi Krustasea Hidup. Jakarta: Badan Riset Kelautan dan Perikanan, Slipi.
Suryanti, 1998. Pemingsanan Ikan Nila Merah (Oreochromis sp.) Hidup dengan Perlakuan Suhu Rendah dan Minyak Cengkeh dalam Transportasi Sistem Kering. (Skripsi). Fakultas Perikanan dan Ilmu Kelautan, IPB. Bogor.
Suyanto, S.R. 2003. Nila. PT Penebar Swadaya. Jakarta.
Tahe, S. 2008. Penggunaan Phenoxyethanol, Suhu Dingin dan Kombinasi Suhu Dingin dan Phenoxyethanol dalam Pembiusan Bandeng Umpan. Jurnal Media Akuakultur. (3)2: 7-9. Balai Riset Budidaya Air Payau. Maros. Tidwell H. James, Shawn D. Coyle, Robert M. Durborow. 2004. Anesthetics in
Aquaculture. SRAC Publication No. 3900
Wibowo, S. 1993. Penerapan Teknik Penanganan dan Transportasi Ikan Hidup di Indonesia. Sub BPPL. Slipi Jakarta.
Tabel 7. Mortalitas Benih Ikan Nila pada Uji Selang Konsentrasi (Range Finding Test) Akuades Ulangan Ulangan Ulangan
0,01 mg/L 10 10 10
0,1 mg/L 10 10 10
1 mg/L 10 10 9
10 mg/L 0 0 0
100 mg/L 0 0 0
Konsentrasi ambang atas : 10 mg/L Konsentrasi ambang bawah : 1 mg/L
Ambang atas = konsentrasi terendah yang menyebabkan semua ikan mati Ambang bawah = konsentrasi tertinggi yang menyebabkan semua ikan hidup
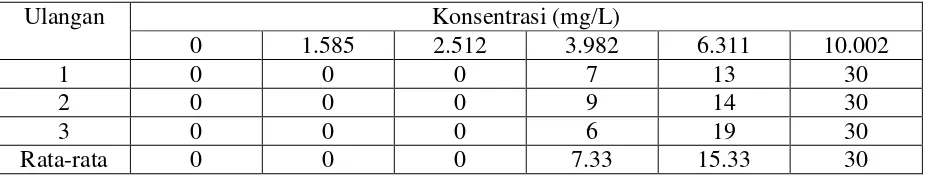
Tabel 8. Persentase Mortalitas Benih Ikan Nila dalam Waktu 24 Jam
Ulangan Konsentrasi (mg/L)
0 1.585 2.512 3.982 6.311 10.002
1 0 0 0 7 13 30
2 0 0 0 9 14 30
3 0 0 0 6 19 30
Rata-rata 0 0 0 7.33 15.33 30
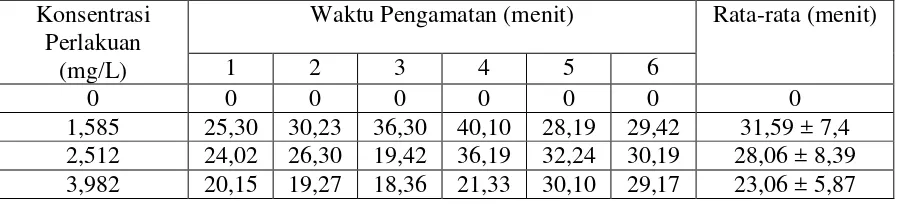
Tabel 10. Lama waktu imotilisasi benih ikan nila Konsentrasi
Perlakuan (mg/L)
Waktu Pengamatan (menit) Rata-rata (menit)
1 2 3 4 5 6
0 0 0 0 0 0 0 0
1,585 25,30 30,23 36,30 40,10 28,19 29,42 31,59 ± 7,4 2,512 24,02 26,30 19,42 36,19 32,24 30,19 28,06 ± 8,39 3,982 20,15 19,27 18,36 21,33 30,10 29,17 23,06 ± 5,87
Tabel 11. Analisis Sidik Ragam Waktu Imotilisasi Ulangan Konsentrasi ekstrak daun bandotan
(mg/L)
0 1,585 2,512 3,982
1 0 25,3 24,02 20,15
2 0 30,23 26,3 19,27
3 0 36,3 19,42 18,36
4 0 40,1 36,19 21,33
5 0 28,19 32,24 30,1
6 0 29,42 30,19 29,17
ΣY 0 189,54 168,36 138,38
ΣY 0 31,59 28,06 23,06
∑
Tabel 12. Tabel Sidik Ragam Waktu Imotilisasi
SK DB JK KT F
Hitung
F 5% F 1%
Perlakuan(P) 3 3641,01 1213,67 51,73** 3,10 4,94
Galat (G) 20 469,27 23,46
Total 23 4110,28
F Hit >> F tabel
Maka Tolak H0pada α : 0,01 atau minimal ada satu perlakuan konsentrasi yang berpengaruh sangat
nyata terhadap waktu imotilisasi benih ikan nila. Koefisien Keragaman (KK)
√
√
KK > F 5 % maka dilanjutkan dengan uji lanjut BNJ
Uji Lanjut BNJ
√
√
perlakuan dari yang terendah hingga yang tertinggi.
Perlakuan Rata-rata
Rata –rata
Karena d tidak melewati ujung c maka d dibatalkan. Dan c yang melewati ujung b dan terdapat di perlakuan B, C, dan D maka kesimpulan yang dapat diambil adalah perlakuan B, C, dan D tidak saling berbeda nyata pengaruhnya. Namun diantara tiga perlakuan diatas yang mendapatkan hasil terbaik untuk waktu imotilisasi tercepat adalah perlakuan D yaitu 3,982 mg/L dengan waktu imotilisasi 23,06 menit.
Tabel 13. Kualitas Air Imotilisasi Benih Ikan Nila
Tabel 14. Lama Pulih sadar Benih Ikan Nila
Konsentrasi Perlakuan
(mg/L)
Waktu Pengamatan (menit)
Rata-rata (menit)
1 2 3 4 5 6
0 0 0 0 0 0 0 0
1,585 8,10 6,24 6,28 8,13 6,28 4,48 6,59 ± 1,83 2,512 12,32 8,17 6,28 8,13 8,09 8,17 8,53 ± 3,02 3,982 14,19 12,34 12,32 12,28 10,08 12,32 12,26 ± 2,06
Tabel 15. Analisis Sidik Ragam Lama Pulih Sadar
Ulangan
Konsentrasi ekstrak daun bandotan (mg/L)
0 1,585 2,512 3,982
1 0 8,10 12,32 14,19
2 0 6,24 8,17 12,34
3 0 6,28 6,28 12,32
4 0 8,13 8,13 12,28
5 0 6,28 8,09 10,08
6 0 4,48 8,17 12,32
ΣY 0 39,51 51,16 73,53
ΣY 0 6,59 8,53 12,26
∑
Tabel 16. Tabel Sidik Ragam Waktu Pulih Sadar
SK DB JK KT F Hitung F 5% F 1%
Perlakuan(P) 3 474,11 158,04 83,62** 3,10 4,94
Galat (G) 20 37,95 1,89
Total 23 512,06
F Hit >> F tabel
Maka Tolak H0pada α : 0,01 atau minimal ada satu perlakuan konsentrasi yang berpengaruh sangat
nyata terhadap waktu pulih sadar benih ikan nila. Koefisien Keragaman (KK)
√
√
KK > F 5 % maka dilanjutkan dengan uji lanjut BNJ
Uji Lanjut BNJ
√
√
Untuk membedakan antar perlakuan maka dilakukan pengujian dengan mengurutkan setiap perlakuan dari yang terendah hingga yang tertinggi.
Perlakuan Rata-rata
A 0 a
B 6,59 bcd C 8,53 bcd
D 12,26 d
Karena d melewati ujung c dan terdapat di perlakuan B, C, dan D maka kesimpulan yang dapat diambil adalah perlakuan B, C, dan D tidak saling berbeda nyata pengaruhnya. Namun diantara tiga perlakuan diatas yang mendapatkan hasil terbaik untuk waktu pulih sadar yaitu < 10 menit adalah perlakuan B dan C yaitu 1,585 mg/L dan 2,512 mg/L dengan waktu imotilisasi 6,59 menit dan 8,53 menit.
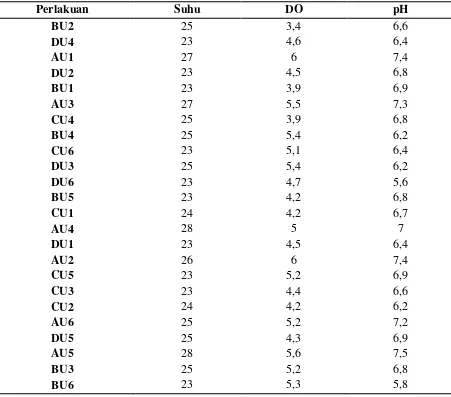
Tabel 17. Kualitas Air Lama Pulih Sadar Benih Ikan Nila
Perlakuan Suhu DO pH
BU2 26 4,9 7,2
DU4 26 5,3 7
AU1 27 6 7,4
DU2 25 5,9 7,2
BU1 26 5,2 8
AU3 27 5,5 7,3
CU4 27 5,5 7,4
BU4 28 6 7,2
CU6 26 6 8
DU3 29 5,6 6,9
DU6 27 5,5 7,3
BU5 26 5,2 7,8
CU1 26 5,3 7,1
AU4 29 4,4 6,9
DU1 25 5,9 7,8
AU2 26 6 7,5
CU5 26 5,9 7,8
CU3 25 5,4 7,1
CU2 27 4,9 7,4
AU6 25 5,2 7,2
DU5 28 6,2 7,7
AU5 26 5,3 7,4
BU3 29 5,6 7
BU6 27 6,2 7,3
Lampiran 6. Data Hasil Survival Rate Benih Ikan Nila Setelah Transportasi Tabel 18. Survival Rate Benih Ikan Nila setelah Transportasi
Tabel 13. Analisis Sidik Ragam Survival Rate Transportasi
Tabel 19. Tabel Sidik Ragam SR Transportasi
SK DB JK KT F Hitung F 5% F 1%
Perlakuan(P) 3 22602,91 7534,30 39,40** 3,10 4,94
Galat (G) 20 3824,16 191,21
Total 23 26427,07
F Hit >> F tabel
Maka Tolak H0pada α : 0,01 atau minimal ada satu perlakuan konsentrasi yang berpengaruh sangat
nyata terhadap survival rate transportasi benih ikan nila. Koefisien Keragaman (KK)
√
√
KK > F 5 % maka dilanjutkan dengan uji lanjut BNJ
Uji Lanjut BNJ
√
√
perlakuan dari yang terendah hingga yang tertinggi.
Perlakuan Rata-rata
A 17,77 a
B 66,67 bc
C 90 c
D 95,55 c
Karena d tidak melewati ujung c maka d dibatalkan. Dan c yang melewati ujung b dan terdapat di perlakuan B, C, dan D maka kesimpulan yang dapat diambil adalah perlakuan B, C, dan D tidak saling berbeda nyata pengaruhnya. Namun diantara tiga perlakuan diatas yang mendapatkan hasil terbaik untuk survival rate transportasi adalah perlakuan D yaitu 3,982 mg/L dengan survival rate 95,55%.
Lampiran 7. Data Hasil Kecepatan Pertumbuhan Benih Ikan Nila Tabel 20. Kecepatan pertumbuhan harian
Konsentrasi Perlakuan
(mg/L)
Kecepatan pertumbuhan harian (gram/hari)
Rata-rata (gram/hari)
1 2 3 4 5 6
0 0,3 0,09 0 0 0 0 0
1,585 0,33 0,22 0,07 0,37 0,44 0,04 6,59 ± 1,83 2,512 0,4 0,05 0,09 0,21 0,13 0,38 8,53 ± 3,02 3,982 0,07 0,25 0,3 0,26 0,06 0,42 12,26 ± 2,06
Tabel 21. Analisis Sidik Ragam Kecepatan Pertumbuhan Harian Ulangan Konsentrasi ekstrak daun bandotan
(mg/L)
0 1,585 2,512 3,982
1 0,3 0,33 0,4 0,07
2 0,09 0,22 0,05 0,25
3 0 0,07 0,09 0,3
4 0 0,37 0,21 0,26
5 0 0,44 0,13 0,06
6 0 0,04 0,38 0,42
ΣY 0,39 1,47 1,26 1,36
ΣY 0,07 0,25 0,21 0,23
∑
Tabel 22. Tabel Sidik Ragam Kecepatan Pertumbuhan Harian
SK DB JK KT F Hitung F 5% F 1%
Perlakuan(P) 3 0,12 0,04 2 tn 3,10 4,94
Galat (G) 20 0,41 0,02
Total 23 0,53
F Hit < F tabel
Maka Terima H0 pada α : 0,05 atau tidak ada pengaruh perlakuan konsentrasi terhadap kecepatan
pertumbuhan benih ikan nila. Karena hasil analisis data menunjukkan tidak berpengaruh nyata, maka tidak dilakukan uji lanjut.
Tabel 23. Kecepatan pertumbuhan harian
Lampiran 8. Dokumentasi penelitian a. Bahan yang digunakan
Daun bandotan Serbuk ekstrak daun bandotan
b. Alat yang digunakan
Akuarium Styrofoam
c. Kegiatan selama penelitian
Pengamatan pulih sadar Pemasukan benih ke dalam plastik