ANALISIS RESPON TOLERANSI PADI NIPPONBARE
TRANSGENIK TERHADAP SALINITAS TINGGI
GANTI SWARA PRATAMA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
GANTI SWARA PRATAMA. Analisis Respon Toleransi Padi Nipponbare
Transgenik terhadap Salinitas Tinggi. Dibimbing oleh EMAN KUSTAMAN dan
TRI JOKO SANTOSO.
ABSTRACT
GANTI SWARA PRATAMA. Response Tolerance Analysis to High Salinity of
Nipponbare Transgenic Rice. Under the direction of EMAN KUSTAMAN and
TRI JOKO SANTOSO.
GANTI SWARA PRATAMA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Analisis Respon Toleransi Padi Nipponbare Transgenik Terhadap
Salinitas Tinggi
Nama
: Ganti Swara Pratama
NIM
: G84051862
Disetujui
Komisi Pembimbing
Ir. Eman Kustaman
Dr. Tri Joko Santoso, M.Si.
Ketua
Anggota
Diketahui
Dr.Ir. I Made Artika, M.App.Sc.
Ketua Departemen Biokimia
Untaian rasa syukur penulis panjatkan kepada Allah SWT karena atas
segala nikmat dan karunia Nya sehingga penelitian dan penulisan skripsi ini dapat
diselesaikan. Penelitian ini telah dilaksanakan di Laboratorium Biologi Molekuler,
Kelompok Peneliti Biologi Molekuler, Balai Besar Penelitian dan Pengembangan
Bioteknologi dan Sumber Daya Genetik Pertanian (BB Biogen) dari bulan
November 2009 sampai Pebruari 2010 dengan judul Analisis Respon Toleransi
Padi Nipponbare Transgenik terhadap Salinitas Tinggi.
Terima kasih penulis ucapkan kepada Ir. Eman Kustaman dan atas
bimbingan dan saran-saran yang diberikan. Terima kasih juga kepada lembaga
Riset dan Teknologi yang memberikan dana penelitian atas nama Dr. Tri Joko
Santoso, M.Si. Terima kasih juga penulis sampaikan kepada dosen-dosen
biokimia, staf biokimia dan peneliti BB Biogen atas semua bantuannya. Ucapan
terima kasih kepada Dewi Praptiwi, Aditya Rizko Nugroho, dan Isty Khomawatie
sebagai rekan kerja yang banyak membantu dalam kegiatan penelitian.
Penghargaan setinggi-tingginya penulis sampaikan kepada kedua orang
tua tercinta atas perhatian, kasih sayang dan doanya. Semoga karya ilmiah ini
bermanfaat bagi para pembaca dan bagi ilmu pengetahuan khususnya bidang
biokimia.
Bogor, Juli 2010
RIWAYAT HIDUP
Penulis dilahirkan di Tasikmalaya, Jawa Barat pada tanggal 25 Maret 1987
dari bapak Endang Koswara dan ibu Elis Liswara. Penulis merupakan anak ke dua
dari tiga bersaudara. Tahun 2005 penulis lulus dari SMU Negeri 1 Ciawi
Tasikmalaya dan pada tahun yang sama lulus seleksi masuk Institut Pertanian
Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) pada
Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam
(FMIPA).
Halaman
DAFTAR GAMBAR ... .. ix
DAFTAR TABEL ... .. ix
DAFTAR LAMPIRAN ... .. ix
PENDAHULUAN ... .... 1
TINJAUAN PUSTAKA
Deskripsi tanaman padi ... 1
Faktor transkripsi
DREB
dan
ERF
... 2
Cekaman Salinitas pada Tanaman ... 3
Polymerase Chain Reaction
(PCR) ... 5
BAHAN DAN METODE
Bahan dan Alat ... 7
Metode Penelitian ... 7
HASIL DAN PEMBAHASAN
Respon Padi Transgenik dengan 25 mM NaCl ... 9
Respon Padi Transgenik dengan 150 mM NaCl
...
12
Hasil Analisis PCR Tanaman-Tanaman yang Diduga Transgenik ... 13
SIMPULAN DAN SARAN ... .. 16
DAFTAR PUSTAKA ... .. 16
DAFTAR GAMBAR
Halaman
1 Mekanisme faktor transkripsi dalam mengatur ekspresi gen ... 3
2 Tahapan amplifikasi DNA pada PCR ... 6
3 Konstruksi plasmid
pCAMBIA
... 9
4 Grafik pertumbuhan panjang akar tanaman selama 15 hari perlakuan
25 mM NaCl ... .. 10
5 Akar tanaman padi setelah 15 hari cekaman 25 mM NaCl... .. 10
6 Grafik pertumbuhan tinggi tanaman selama 15 hari perlakuan 25 mM
NaCl ... .. 12
7 Tanaman padi setelah 15 hari cekaman 25 mM NaCl ... 12
8 Penampakan gejala padi yang timbul akibat perlakuan 150 mM NaCl ... 13
DAFTAR TABEL
Halaman
1 Pengelompokan berdasarkan indeks pertumbuhan panjang akar tanaman
padi Nipponbare-
OsDREB1A
... 9
2 Pengelompokan berdasarkan indeks pertumbuhan panjang akar tanaman
padi Nipponbare-
OsERF1
... 10
3 Pengelompokan berdasarkan indeks pertumbuhan tinggi tanaman padi
Nipponbare-
OsDREB1A
... 11
4 Pengelompokan berdasarkan indeks pertumbuhan tinggi tanaman padi
Nipponbare-
OsERF1
... 11
5 Hasil skoring berdasarkan tingkat gejala padi Nipponbare-
OsDREB1A
... 13
6 Hasil skoring berdasarkan tingkat gejala padi Nipponbare-
OsERF1
... 13
1 Tahapan alur penelitian ... 20
2 Hasil pengukuran panjang akar padi Nipponbare-
OsDREB1A
untuk
perlakuan 25 mM NaCl ... 21
3 Hasil pengukuran tinggi tanaman padi Nipponbare-
OsDREB1A
untuk
perlakuan 25 mM NaCl ... 23
4 Hasil pengukuran panjang akar padi Nipponbare-
OsERF1
untuk
perlakuan 25 mM NaCl ... 26
5 Hasil pengukuran tinggi tanaman padi Nipponbare-
OsERF1
untuk
perlakuan 25 mM NaCl ... 28
6 Hasil skoring padi Nipponbare-
OsDREB1A
perlakuan 150 mM NaCl ... 30
7 Hasil skoring padi Nipponbare-
OsERF1
perlakuan 150 mM NaCl ... 31
8 Hasil pengukuran konsentrasi DNA tanaman putatif transgenik
Nipponbare-
OsDREB1A
dan Nipponbare-
OsERF1
perlakuan 25 mM
NaCl ... 32
9 Hasil pengukuran konsentrasi DNA tanaman putatif transgenik
Nipponbare-
OsDREB1A
dan Nipponbare-
OsERF1
perlakuan 150 mM
NaCl ... 33
10 Elektroforegram produk PCR tanaman padi Nipponbare-
OsDREB1A
dan
Nipponbare
-OsERF1
putatif transgenik hasil seleksi dengan 25 mM
NaCl dengan primer spesifik
HPT
... 34
11 Elektroforegram produk PCR tanaman padi Nipponbare-
OsDREB1A
dan
Nipponbare-
OsERF1
putatif transgenik hasil seleksi dengan 150 mM
PENDAHULUAN
Padi merupakan salah satu makanan pokok lebih dari setengah penduduk di belahan dunia termasuk Indonesia (Kibria et al. 2008) Seiring dengan peningkatan jumlah penduduk dalam rangka pemenuhan kebutuhan akan beras maka produksi padi secara nasional perlu ditingkatkan dan distabilkan untuk menjamin ketahanan pangan. Namun demikian, usaha untuk meningkatkan produksi padi nasional masih menghadapi banyak kendala diantaranya adalah kendala biotik maupun abiotik. Adanya perubahan iklim global menambah kekhawatiran dan tantangan ke depan di dalam peningkatan produktivitas padi secara berkelanjutan. Hal ini dikarenakan perubahan iklim global tersebut mempunyai implikasi yang cukup serius diantaranya adalah peningkatan suhu bumi, semakin meluasnya area atau lahan yang mengalami kekeringan sementara di sisi lain beberapa area terjadi genangan (terendam banjir) dan peningkatan salinitas pada lahan-lahan di sekitar pantai akibat meluapnya (intrusi) air laut ke daratan dan naiknya permukaan air laut. Oleh karena itu, diperlukan langkah-langkah antisipatif dan strategis untuk menghadapi perubahan tersebut.
Beberapa ilmuwan menyatakan bahwa salinitas lahan pertanian telah menjadi masalah serius dalam produksi tanaman padi di Indonesia. Daerah produksi padi yang terletak di wilayah pesisir pantai seperti Pulau Jawa, Sulawesi Selatan, Aceh dan daerah lainnya menghadapi masalah salinitas ini. Salinitas tinggi yang ditandai dengan kandungan garam yang tinggi pada tanah akan bersifat racun bagi tanaman sehingga mengganggu proses fisiologis dan fisik pada tanaman (Haque 1999).
Beberapa tahun terakhir ini, gen-gen yang diinduksi oleh cekaman abiotik seperti kekeringan dan salinitas telah ditemukan terutama pada tanaman arabidopsis. Penemuan ini memberi kesempatan yang sangat luas dan penting untuk memperbaiki sifat toleran terhadap salinitas tinggi melalui pendekatan rekayasa genetika.
Penelitian lebih lanjut diketahui bahwa gen ethylene responsive factor (ERF) dan gen
dehydration responsive element binding
(DREB) merupakan faktor transkripsi spesifik tanaman yang sangat penting peranannya dalam pengaturan respon tanaman dan menginduksi gen-gen lain yang berhubungan dengan cekaman abiotik termasuk salinitas, (Xiong & Fei 2006; Zhang et al. 2004).
Peranan gen-gen faktor transkripsi ERF
dan DREB dalam hubungannya dengan toleransi terhadap salinitas tinggi sangat penting. Oleh karena itu isolasi gen-gen tersebut dan introduksi kembali (over-ekspresi) ke genom tanaman padi dilakukan melalui vektor bakteri Agrobacterium tumefaciens menggunakan padi kultivar Nipponbare(Trijatmiko et al. 2006). Kultivar Nipponbare digunakan untuk introduksi gen karena kemampuan regenerasi dan transformasinya yang sangat tinggi (Rahmawati 2006).
Tujuan penelitian ini untuk menganalisis respon toleransi padi transgenik
Nipponbare-OsDREB1A dan Nipponbare-OsERF1
terhadap salinitas tinggi dan menguji keberadaan gen-gen faktor transkripsi yang bertanggung jawab terhadap toleransi salinitas tinggi (OsDREB1A dan OsERF1) dengan menggunakan teknik PCR. Hipotesis penelitian ini adalah ekspresi tinggidarifaktor transkripsi OsDREB1A dan OsERF1
meningkatkan ekspresi gen-gen yang berhubungan dengan cekaman abiotik sehingga tanaman padi mampu bertahan dalam kondisi salinitas yang tinggi serta gen-gen tersebut yang telah disisipkan ke dalam genom tanaman padi dapat dideteksi keberadaannya dengan menggunakan PCR. Manfaat penelitian ini untuk menghasilkan tetua padi Nipponbare transgenik yang toleran salinitas tinggi untuk didonorkan ke padi varietas unggul.
TINJAUAN PUSTAKA Deskripsi Tanaman Padi
Padi adalah salah satu tanaman budidaya terpenting dalam peradaban manusia. Meskipun terutama mengacu pada jenis tanaman budidaya, padi juga digunakan untuk mengacu pada beberapa jenis dari marga (genus) yang sama, yaitu padi liar. Produksi padi dunia menempati urutan ketiga dari semua serealia setelah jagung dan gandum. Selain itu, padi merupakan sumber karbohidrat utama bagi mayoritas penduduk dunia (Rahmawati 2006).
tersusun dalam spikelet, khusus untuk padi satu spikelet hanya memiliki satu floret, buah dan biji sulit dibedakan karena merupakan bulir (grain) atau kariopsis (Hattori 1999). Terdapat dua spesies padi yang dibudidayakan manusia yaitu Oryza sativa yang berasal dari daerah hulu sungai di kaki Pegunungan Himalaya (India dan Tibet) dan O. glaberrima
yang berasal dari Afrika Barat (hulu Sungai Niger). O.sativa terdiri atas dua varietas yaitu
Indica dan Japonica (Rahmawati 2006). Padi kultivar Nipponbare merupakan jenis padi yang termasuk dalam varietas Japonica
dengan karakteristik umumnya berumur panjang, postur tanaman tinggi mencapai 110 sampai 120 cm, namun mudah rebah, anakan produktif 10 sampai 14 batang, warna kaki hijau, warna batang hijau, daun tebal, warna daun telinga putih, warna daun hijau, muka daun kasar pada sebelah bawah, posisi daun tegak, warna gabah kuning bersih, paleanya memiliki bulu (awn), bijinya cenderung bulat dan bentuk tanaman tegak (Siregar 2001).
Faktor Transkripsi DREB dan ERF
Faktor transkripsi adalah protein regulator yang menempel pada DNA dan protein regulator lainnya yang mengakibatkan terjadinya ekpresi gen. Faktor transkripsi ini mempunyai bagian-bagian yang spesifik atau biasa disebut dengan domain. Faktor transkripsi ini terdiri atas 2 domain, yaitu DNA binding domain dan cis-acting domain
(Haake 2002).
Gen dehydration responsive element binding (DREB) merupakan faktor transkripsi dari gen famili EREBP yang mengatur ekspresi dari sejumlah gen yang bertanggung jawab terhadap sifat ketahanan terhadap cekaman lingkungan. Gen ethylene responsive factor (ERF) merupakan faktor transkripsi spesifik tanaman yang penting peranannya dalam pengaturan respon tanaman terhadap cekaman biotik dan abiotik (Xiong & Fei 2006).
Gen-gen faktor transkripsi DREB dan ERF
telah berhasil diisolasi dan diekspresikan secara berlebih pada tanaman (Xiong & Fei 2006). Faktor transkripsi DREB ketika diekspresikan berlebih pada Arabidopsis mampu meningkatkan ekspresi ratusan gen yang terkait cekaman sehingga menimbulkan ketahanan terhadap salinitas tinggi, kekeringan, dan suhu dingin (Kasuga et al.
1999). Begitu pula dengan ortolog dari DREB
pada padi, yaitu OsDREB1A ketika ekspresikan berlebih pada Arabidopsis meningkatkan toleransi terhadap salinitas
tinggi, kekeringan dan suhu dingin (Dubouzet
et al. 2003). Bukti-bukti ini mengindikasikan adanya konservasi mekanisme molekuler dan fungsi dari famili faktor transkripsi DREB ini pada monokotil dan dikotil. Demikian juga dengan faktor transkripsi ERF telah dipelajari untuk mengatur pertumbuhan dan perkembangan tanaman serta untuk toleransi terhadap salinitas (Zhang et al. 2004). Ekspresi berlebih gen ERF dari tomat pada tanaman padi telah terbukti meregulasi gen-gen yang responsif terhadap cekaman dan meningkatkan toleransi terhadap salinitas tinggi (Gao et al. 2004).
Sejumlah gen yang diinduksi oleh cekaman abiotik seperti salinitas tinggi, kekeringan dan suhu dingin telah ditemukan. Gen-gen target tersebut meliputi gen-gen yang menyandikan enzim-enzim yang diperlukan untuk biosintesis berbagai osmoprotektan, enzim-enzim yang mengelimasi spesies oksigen aktif, protein-protein embriogenesis, enzim-enzim untuk detoksifikasi dan faktor transkripsi. Berdasarkan Zhu (2001) gen-gen yang terlibat dan yang terinduksi dalam ketahanan terhadap cekaman abiotik dapat dikelompokkan yaitu rd (responsive to dehydration), erd (early responsive to dehydration), cor (cold-regulated), lti ( low-temperature induced) dan kin ( cold-inducible).
Mekanisme responsif tanaman terhadap cekaman lingkungan telah dipelajari secara mendalam pada tanaman model Arabidopsis. Respon-respon tanaman yang terinduksi oleh cekaman lingkungan melibatkan jejaring transduksi sinyal dan aktivasi cepat ekspresi gen (Desveaux et al. 2003). Cekaman lingkungan seperti salinitas tinggi, temperatur rendah dan kekeringan menginduksi sejumlah sinyal seluler yang diintergrasikan di dalam inti sel oleh sekelompok faktor transkripsi yang menginduksi pemrograman kembali transkripsi secara masif (Nimchuk et al. 2003).
Faktor transkripsi merupakan alat yang sangat ampuh dalam rekayasa genetik, mengingat kemampuannya untuk menempel pada bagian promoter dari gen-gen target dan mengatur transkripsinya (Gambar 1). Kemampuan penempelan faktor transkripsi
3
dengan menurunkan potensial air intraseluler, pengikatan ion-ion logam dan mencari spesies-spesies aktif (Cong et al. 2008).
Pendekatan untuk merakit sifat toleran terhadap cekaman lingkungan adalah dengan memodifikasi tingkat faktor transkripsi yang mempunyai keuntungan dan kompetensi dalam meningkatkan level atau tingkatan protein dalam individu tersebut dengan konsep fungsi protein yang protektif (Roosens
et al. 2001). Berdasarkan Shi et al. (2003) tujuan dari strategi ekspresi tinggi adalah membuat ekspresi gen yang telah diketahui fungsinya agar terekspresi secara berlebihan atau bisa juga digunakan untuk mengekspresikan gen yang berasal dari jenis tanaman yang berbeda bahkan dari mikrob sekalipun. Aplikasi teknik ini sering digunakan pada tanaman pangan komersial atau tanaman untuk bahan dasar dari suatu produk tertentu.
Strategi ekspresi tinggi ini biasanya dibantu oleh promoter-promoter tertentu. Ekspresi tinggi cDNA DREB dengan promoter 35S CaMV (Cauliflower Mozaic Virus) atau promoter pemacu cekaman rd29A
menghasilkan ekspresi yang kuat pada gen target pemacu cekaman dan tanaman transgenik ini memiliki toleransi lebih tinggi terhadap kekeringan, kadar garam tinggi dan cekaman suhu rendah (Slamet & Loedin 2000). Menurut Kasuga et al. (1999) penggunaan promoter pemacu rd29A
termasuk promoter konstitutif pada ekspresi tinggi DREB atau ERF dapat meminimalkan efek negatif terhadap pertumbuhan tanaman.
Gambar 1 Mekanisme faktor transkripsi dalam mengatur ekspresi gen.
Cekaman Salinitas pada Tanaman
Cekaman biasanya didefinisikan sebagai faktor luar yang tidak menguntungkan yang berpengaruh buruk terhadap pertumbuhan, reproduksi, dan kelangsungan hidup tanaman (Gardener 2001). Menurut Fallah (2006),
pada umumnya cekaman lingkungan pada tanaman dikelompokkan menjadi dua, yaitu: (1) cekaman biotik yang terdiri atas kompetisi intra spesies dan antar spesies, infeksi oleh hama dan penyakit, dan (2) cekaman abiotik berupa suhu (tinggi dan rendah), air (kelebihan dan kekurangan), radiasi (ultraviolet, infra merah, dan radiasi mengionisasi), kimiawi (garam, gas, dan pestisida), angin, dan suara.
Tanaman yang tumbuh di tanah bergaram akan mengalami dua tekanan fisiologis yang berbeda. Pertama, pengaruh racun dari beberapa ion tertentu seperti natrium dan klorida, yang lazim terdapat dalam tanah bergaram, yang akan menghancurkan struktur enzim dan makromolekul lainnya, merusak organel sel, mengganggu fotosintesis dan respirasi, akan menghambat sintesis protein dan mendorong kekurangan ion (Marschner 2005). Kedua, tanaman yang dihadapkan pada potensial osmotik yang rendah dari larutan tanah bergaram akan terkena resiko
physiological drought karena tanaman-tanaman tersebut harus mempertahankan potensial internal osmotik yang lebih rendah dalam rangka untuk mencegah pergerakan air akibat osmosis dari akar ke tanah. Tanaman mungkin akan menyerap ion untuk mempertahankan potensial osmotik internal yang rendah, namun hal ini akan menyebabkan kelebihan ion yang pada akhirnya mengakibatkan terjadinya penurunan pertumbuhan pada beberapa tanaman (Greenway & Munns 2001). Sebagai tambahan, tingginya konsentrasi garam akan menyebabkan penurunan permeabilitas akar terhadap air dan mengakibatkan penurunan laju masuknya air ke dalam tanaman (Marschner 2005).
proses fotosintesis oleh mekanisme yang dijelaskan oleh Gale et al. (1999) di atas.
Kadar garam yang tinggi dalam larutan tanah di daerah perakaran tanaman, menyebabkan tekanan osmotik yang tinggi dan berkurangnya ketersediaan unsur kalium bagi tanaman (Berstein 2003). Salinitas tanah akan menghambat pembentukan akar-akar baru dan akar tanaman mengalami kesukaran dalam menyerap air karena tingginya tekanan osmotik larutan tanah. Keadaan ini selanjutnya akan menyebabkan terjadinya kekeringan pada tanaman (Sipayung & Rosita 2006).
Tanaman sampai batas-batas tertentu masih dapat mengatasi tekanan osmotik yang tinggi karena tingginya kandungan garam dalam tanah. Fallah (2006) menyatakan bahwa titik kritis kandungan garam bagi tanaman di lapangan adalah jika permukaan air tanah sedalam 3 meter mempunyai kandungan garam lebih dari 1000 ppm.
Menurut Dorrenbos & Kassam (2001) kemampuan tanaman menyerap air pada lingkungan bergaram akan berkurang sehingga gejala yang ditimbulkan mirip dengan gejala kekeringan. Gejala-gejala yang tampak seperti daun cepat menjadi layu, terbakar, berwarna biru kehijau-hijauan, pertumbuhan daun yang kecil, dan pada akhirnya tanaman akan mati kekeringan. Selain itu terjadi pula penurunan jumlah daun dan stomata per satuan luas daun, meningkatnya daun sukulen serta terjadinya penebalan lapisan kutikula dan lilin di permukaan daun (Bintoro MH 1999). Perubahan struktur ini disebabkan karena berkurangnya jumlah air yang dapat diserap oleh tanaman. Di samping itu transpirasi per unit luas daun pada kebanyakan tanaman menurun dengan meningkatnya salinitas tanah (Sipayung & Rosita 2006).
Salinitas tanah dapat menekan laju fotosintesis per satuan luas daun pada beberapa jenis tanaman, seperti bawang, kacang-kacangan, kapas, tomat, barley, gandum, dan jagung. Secara umum fotosintesis berkurang sebanding dengan peningkatan salinitas tanah. Mekanisme utama penakanan laju fotosintesisi terjadi karena menutupnya stomata sebagai akibat tidak seimbangnya air. Sebaliknya peningkatan salinitas tanah akan meningkatkan laju respirasi akar dan jaringan tanaman lainnya (Poljakoff-Mayber & Gale 2002).
Apabila salinitas tanah meningkat secara tiba-tiba maka kemampuan akar tanaman untuk menyerap air akan berkurang karena
tingginya tekanan osmotik larutan tanah. Dalam keadaan ini tanaman akan berusaha menyesuaikan tekanan osmotik selnya dengan maksud untuk mencegah dehidrasi dan kematian. Proses ini disebut penyesuaian osmotik (Sipayung & Rosita 2006).
Tanaman yang tumbuh pada tanah salin atau mendapat perlakuan NaCl akan mengakumulasikan prolin, suatu asam amino yang dapat larut. Akumulasi prolin tersebut merupakan usaha tanaman untuk menyesuaikan tekanan osmotik. Penyesuaian tekanan osmotik ini membutuhkan energi sehingga akan mengurangi pertumbuhan tanaman (Bernstein 2003).
Selain adanya masalah tekanan osmotik yang merugikan pertumbuhan tanaman, pada tanah-tanah salin seringkali juga terjadi ketidakseimbangan ketersediaan hara tanaman. Hal ini disebabkan karena kadar hara tertentu tersedia dalam jumlah yang tinggi dan dapat menekan ketersediaan unsur hara lainnya. Di samping itu adanya bahaya keracunan dari natrium (Na), klorida (Cl) dan ion-ion lainnya (Bernstein 2003 ; Gardener et al. 2001).
Toleransi tanaman terhadap salinitas dapat dinyatakan dalam berbagai cara, yaitu: (1) Kemampuan tanaman untuk hidup pada tanah salin; (2) Produksi yang dihasilkan pada tanah salin; (3) Hasil relatif pada tanah salin dibandingkan dengan hasil pada tanah normal; (4) Salinitas maksimum yang dapat dialami tanaman tanpa terjadi penurunan hasil; dan (5) Persentase penurunan hasil setiap unit peningkatan salinitas tanah (Maas & Hoffman 1998).
Levitt (2003) menyatakan bahwa mekanisme ketahanan tanaman terhadap salinitas dapat dibagi dua, yaitu: kemampuan untuk menghindar dan toleransi. Untuk menghindari terjadinya dehidrasi karena tekanan osmotik yang tinggi, tanaman dapat mengakumulasikan garam atau ion-ion dan senyawa organik yang dapat larut. IRRI (1998) melaporkan bahwa tanaman padi yang toleran dapat mempertahankan keseimbangan antara tekanan osmotik dalam tajuk dan akar dengan media melalui akumulasi ion-ion dalam akar dan prolin dalan tajuk.
5
aktif masing-masing ke luar tanaman dan ke dalam vakuola. Sedangkan dilusi dapat terjadi dengan adanya pertumbuhan yang cepat. Hal ini disimpulkan dari hasil analisis bahwa bagian yang tumbuh cepat mengandung Na dan Cl lebih rendah dari bagian yang tumbuh lambat.
Tanaman dapat toleran terhadap NaCl karena mempunyai kemampuan menahan pengaruh racun dari NaCl dan ketidakseimbangan hara. Toleransi terhadap defisiensi K dapat dimiliki tanaman yang mampu memanfaatkan Na untuk menggantikan sebagian K yang dibutuhkan (Levitt 2003). Menurut Harjadi & Yahya (2001) mekanisme ketahanan tanaman terhadap cekaman lingkungan, seperti salinitas, dapat dibedakan menjadi mekanisme morfologi dan mekanisme fisiologi.
Perubahan bentuk morfologi dan anatomi yang khas untuk memperbaiki status air tanaman, seperti ukuran daun lebih kecil, jumlah stomata lebih sedikit, penebalan kutikula, berkurangnya diferensiasi, perkembangan jaringan pembuluh, dan lignifikasi akar lebih awal, merupakan mekanisme morfologi terhadap ketahanan salinitas. Sedangkan bentuk mekanisme fisiologi adalah kemampuan tanaman menyesuaikan diri terhadap tekanan osmotik yang mencakup: penyerapan maupun akumulasi ion-ion dan sintesis senyawa organik, mengatur konsentrasi garam dalam sitoplasma melalui transport membran, dan ketahanan relatif membran dalam mengatur transfer ion dan solut lainnya dari sitoplasma dan vakuola serta organel lainnya (Maas & Hoffman 1998).
Menurut Zhou et al. (2007) gejala keracunan garam pada tanaman padi berupa terhambatnya pertumbuhan, berkurangnya anakan, ujung-ujung daun bewarna keputihan dan sering terlihat bagian-bagian yang khlorosis pada daun, dan penurunan hasil gabah mencapai 50%. Lebih jauh, Rahmawati (2006) menyimpulkan bahwa padi relatif lebih toleran terhadap salinitas saat perkecambahan, akan tetapi tanaman bisa jadi rentan saat pindah tanam, bibit masih muda, dan pembungaan. Pengaruh lebih jauh terhadap tanaman padi adalah: 1) berkurangnya kecepatan perkecambahan karena pengaruh turgor; 2) berkurangnya tinggi tanaman dan jumlah anakan; 3) pertumbuhan akar terhambat; 4) sterilitas biji meningkat; 5) kurangnya bobot 1000 gabah dan kandungan protein total dalam biji karena penyerapan Na yang berlebihan; 6) berkurangnya bobot
kering tanaman; dan 7) berkurangnya penambatan N2 secara biologi dan lambatnya
mineralisasi tanah.
Polymerase Chain Reaction (PCR)
Teknik Polymerase Chain Reaction
dirintis oleh Kary Mullis pada tahun 1983. Penerapan PCR banyak dilakukan di bidang biokimia dan biologi molekular. PCR merupakan metode untuk amplifikasi primer oligonukleotida yang dikendalikan secara enzimatis untuk sekuen DNA yang diinginkan tanpa menggunakan organisme. Teknik tersebut mampu mengamplifikasi sekuen hingga berlipat pada tingkatan 105 - 106 dari sejumlah kecil (nanogram) cetakan DNA, dengan latar sekuen yang tidak relevan yaitu DNA genom total (Mikkelsen & Corton 2004). Prasyarat untuk mengamplifikasi sekuen dengan teknik PCR adalah mengetahui sekuen tertentu yang mengapit sekuen DNA yang diamplifikasi sehingga oligonukleotida spesifik dapat diperoleh (David 2005).
Menurut Clark & Christopher (2008), komponen-komponen untuk melakukan PCR terdiri atas sejumlah kecil molekul DNA, termasuk segmen DNA yang akan diamplifikasi; primer PCR, Primer merupakan oligonukelotida utas tunggal yang sekuennya dirancang komplementer dengan ujung fragmen DNA yang ingin disalin. Primer menentukan awal dan akhir daerah yang akan disalin; enzim DNA polimerase (Taq polimerase) yang stabil terhadap panas, dan diperoleh dari Thermus aquaticus; nukleotida yang dibutuhkan untuk membuat DNA baru; dan mesin PCR yang menggunakan cycler termal otomatis untuk mengatur temperatur.
forward harus dihindari saling berkomplemen, sehingga tidak dapat saling membentuk ikatan atau menyatu satu sama lainnya (Kidd & Ruano 2002).
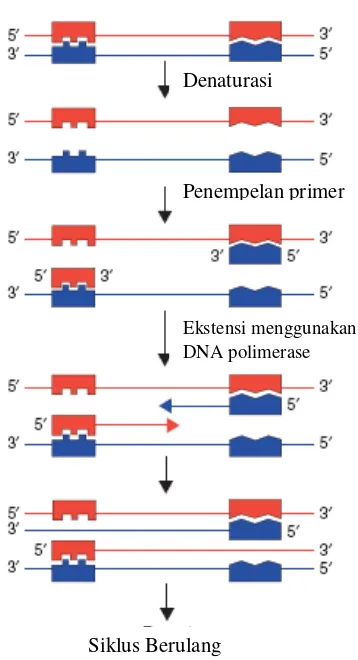
Reaksi PCR secara umum dilakukan dalam tiga tahap. Tahap denaturasi (melting) merupakan tahap awal reaksi yang berlangsung pada suhu tinggi, yaitu 94–96°C sehingga ikatan hidrogen DNA terdenaturasi dan DNA menjadi berutas tunggal. Biasanya pada tahap awal PCR tahap ini dilakukan agak lama (sampai 5 menit) untuk memastikan semua utas DNA terpisah. Pemisahan ini menyebabkan DNA tidak stabil dan siap menjadi cetakan bagi primer (Innis & Gelfand 1999).
Tahap kedua adalah penempelan (annealing) atau hibridisasi antara oligonukleotida primer dengan utas tunggal cetakan DNA. Primer menempel secara spesifik pada bagian cetakan DNA yang komplementer urutan basanya. Hal ini dilakukan pada suhu antara 45–60°C. Suhu yang tidak tepat menyebabkan tidak terjadinya penempelan atau primer menempel di sembarang tempat pada cetakan DNA.
Tahap terakhir adalah ekstensi. Suhu untuk proses ini tergantung dari jenis DNA polimerase yang dipakai. Proses ini biasanya menggunakan Taq polimerase dan dilakukan pada suhu 76°C.. Setelah tahap ini selesai, siklus diulang kembali mulai dari tahap satu, sehingga menunjukkan perkembangan yang terjadi pada siklus-siklus selanjutnya. Akibat denaturasi dan renaturasi, beberapa utas baru menjadi cetakanbagi primer lain dan akhirnya terdapat utas DNA yang panjangnya dibatasi oleh primer yang dipakai. Jumlah DNA yang dihasilkan berlimpah karena penambahan terjadi secara eksponensial (Gambar 2) (Innis & Gelfand 1999).
Fragmen DNA hasil amplifikasi PCR biasanya ditampakkan melalui elektroforesis. Elektroforesis merupakan teknik yang digunakan untuk memisahkan dan memurnikan fragmen-fragmen DNA. Prinsip elektroforesis adalah memisahkan molekul berdasarkan muatannya. DNA yang bermuatan negatif karena adanya fosfat akan bergerak ke arah kutub positif. Fragmen DNA mempunyai muatan negatif yang sama untuk tiap-tiap ukuran panjang, sehingga pergerakan DNA ini akan memiliki kecepatan yang sama untuk mencapai kutub positif. Media yang digunakan dalam elektroforesis antara lain: membran selulosa, gel pati, gel poliakrilamida, dan gel agarosa (Clark & Christopher 2008).
Gambar 2 Tahapan amplifikasi DNA pada PCR (Reece 2004).
Pergerakan yang sama antar molekul DNA ini tidak akan dapat digunakan untuk memisahkan DNA berdasarkan ukurannya. Hal inilah yang menyebabkan digunakannya gel untuk memperlambat pergerakan DNA. Gel ini merupakan polimer sehingga akan membentuk semacam jaring-jaring untuk memerangkap DNA. DNA dengan ukuran yang lebih besar akan lebih sulit melewati lubang atau pori dari gel, sehingga DNA dengan sendirinya akan terpisah berdasarkan besarnya ukuran karena kemampuan dari DNA yang berbeda-beda dalam melewati lubang atau pori dalam gel (Mikkelsen & Corton 2004).
Elektroforesis gel biasanya dilakukan untuk tujuan analisis, namun dapat pula digunakan sebagai teknik preparatif untuk memurnikan molekul sebelum digunakan dalam metode-metode sekuensing DNA, atau
immuno blotting yang merupakan metode-metode karakterisasi lebih lanjut. Gel yang digunakan adalah agarosa yang berasal dari ekstrak rumput laut yang telah dimurnikan. Marka atau penanda (marker) yang digunakan
Denaturasi
Penempelan primer
Ekstensi menggunakan DNA polimerase
7
pada proses elektroforesis merupakan campuran molekul dengan ukuran berbeda-beda yang dapat digunakan untuk menentukan ukuran molekul dalam pita sampel. Setelah elektroforesis selesai, dilakukan metode pewarnaan (staining) dan pencucian atau penghilangan warna (destaining). Pewarnaan gel agarosa dilakukan dengan menggunakan larutan etidium bromida (ETBr) selama 15 menit. Hal ini dilakukan dengan tujuan agar molekul sampel berpendar dalam sinar ultraviolet. Penghilangan warna dilakukan dengan cara gel dimasukkan ke dalam air (akuades) selama 5 hingga 7 menit (Clark & Christopher 2008).
BAHAN DAN METODE Bahan dan Alat
Bahan-bahan yang digunakan dalam tahap pengujian cekaman salinitas tinggi adalah benih padi transgenik Nipponbare yang membawa gen OsDREB1A, benih padi transgenik Nipponbare yang membawa gen
OsERF1, benih padi Nipponbare tipe liar, benih padi Nonabokra, NaCl, larutan Yoshida sebagai media tumbuh padi dengan komposisi 40 ppm NH4NO3, 10 ppm NaH2PO4.2H2O, 40
ppm K2SO4, 40 ppm CaCl2, 40 ppm
MgSO4.7H2O, 0,5 ppm MnCl2.4H2O,
0,05ppm (NH4)6.Mo7O24.4H2O, 0,2 ppm
H3BO3, 0,01 ppm ZnSO4.7H2O, 0,01 ppm
CuSO4.5H2O, 2ppm FeCl3.6H2O dan air.
Bahan-bahan yang digunakan untuk isolasi DNA tanaman padi transgenik adalah daun padi, 2% polivinil pirolidon, 700 µl buffer ekstraksi (20 mM EDTA, 100 mM Tris-HCl pH 8.0, 1.4 M NaCl, 2% CTAB, 2% PVP, dan 0.2% merkaptoetanol), larutan fenol-kloroform-isoamilalalkohol (25:24:1) (v/v/v) sebanyak 700 µl, Natrium asetat 3 M, isopropanol, etanol 70%, dan buffer TE 1x. Bahan-bahan yang digunakan untuk menguji hasil isolasi DNA dengan PCR adalah 50 ng DNA hasil isolasi, larutan buffer 1x (20 mM Tris-HCl pH 8.0, 100 mM KCl, 0.1 mM EDTA, 1 mM DTT, 50% glycerol, 0.5% Tween 20, dan 0.5% nonidet P40), akuades steril, 200 uM masing-masing dNTP (dATP, dCTP, dGTP, dTTP), 50 ng masing-masing primer Forward dan Reverse, 1.5 mM MgCl2,
0.15 unit enzim TaqDNA polymerase. Bahan-bahan yang digunakan untuk elektroforesis yaitu loading dye, bufer TAE 1x, agarosa, DNA hasil isolasi atau hasil PCR, marker, etidium bromida, dan akuades.
Alat-alat yang digunakan ialah akuarium kaca volume 40 liter, aerator, gunting,
microfuge, autopipet, neraca analitik, autoklaf, ruang asam, laminar, vorteks, gelas piala, tabung reaksi magnetic stirrer, spektrofotometer, pH meter, UV illuminator Chemidoc EQ Biorad, elektroforesis, tip, Erlenmeyer, tabung mikro, inkubator bergoyang, kuvet, kertas aluminium,
stopwatch, waterbath, microwave, stirrer plate, cawan petri, cool box, dan gelas ukur.
Metode Penelitian
Pengujian Cekaman Salinitas 25 mM NaCl (Chen & Guo 2008)
Benih-benih dari masing-masing tanaman yang terdiri atas tanaman padi Nipponbare transgenik, tanaman padi Nipponbare non-transgenik, dan tanaman padi Nonabokra sebagai kontrol positif disterilkan dan di oven selama tiga hari dan kemudian dikecambahkan secara in vitro pada cawan petri. Tanaman padi setelah berumur dua minggu kemudian ditumbuhkan pada larutan Yoshida yang mengandung unsur hara yang dibutuhkan untuk pertumbuhan tanaman dan dibiarkan tumbuh normal selama dua hari di rumah kaca. Sebelum diberi perlakuan cekaman, dilakukan terlebih dahulu pengukuran parameter-parameter tanaman yang terdiri dari tinggi tanaman dan panjang akarnya. Tanaman padi kemudian diberi perlakuan cekaman salinitas dengan penambahan NaCl sehingga konsentrasi akhir larutan adalah 25 mM. Larutan Yoshida yang telah ditambahkan NaCl diatur sehingga memiliki pH 5, dan dipertahankan selama perlakuan cekaman. Perlakuan cekaman dilakukan selama 15 hari, setiap lima hari dilakukan pengamatan respon tanaman dengan mengukur kembali tinggi tanaman dan panjang akarnya, dan setiap dua hari sekali dilakukan pengukuran pH larutan Yoshida untuk mempertahankan pH 5 untuk menjaga keseimbangan unsur hara dalam larutan.
tanaman toleran, dan (5) tanaman sangat toleran. Masing-masing pengamatan respon dibandingkan dengan tanaman kontrol yang terdiri atas tanaman padi tipe liar dan padi Nonabokra.
Pengujian Cekaman Salinitas 150 mM NaCl (Gregorio 1997)
Prosedur awal pengujian pada umumnya sama seperti metode Chen & Guo (2008). Tanaman padi dari masing-masing varietas yang sudah berumur dua minggu dipindahkan ke larutan media tumbuh Yoshida dan tanaman dibiarkan beradaptasi selama dua hari. Tanaman padi kemudian diberi perlakuan dengan penambahan NaCl sehingga konsentrasi akhir NaCl dalam larutan Yoshida adalah 150 mM. Larutan Yoshida yang telah ditambahkan NaCl diatur sehingga memiliki pH 5, dan dipertahankan selama perlakuan cekaman. Perlakuan cekaman NaCl ini dilakukan selama 65 jam. Pengamatan respon tanaman padi terhadap cekaman salinitas tinggi dilakukan dengan pemberian skoring berdasarkan gejala yang ditunjukkan, antara lain: (1) sangat toleran, (2) toleran, (3) sedikit toleran, (4) rentan, dan (5) sangat rentan.
Isolasi DNA Genom Total (Doyle & Doyle 1987)
Isolasi DNA dengan metode CTAB dilakukan melalui tiga tahap yaitu preparasi ekstrak sel, pemurnian DNA, dan pemekatan DNA. Preparasi ekstrak sel dimulai dengan penggerusan daun padi sebanyak lebih kurang 0.5 gram dalam mortar steril yang diberi bufer ekstraksi sebanyak 1000 µL (2 x 500µL). Hasil gerusan dimasukkan ke dalam tabung mikro 2 mL, kemudian diinkubasi di dalam penangas air pada suhu 65 ˚C selama 15 menit.
Pemurnian DNA dilakukan melalui penambahan natrium asetat 3M sebanyak 100 µL dan kloroform isoamilalkohol sebanyak 900 µL ke dalam tabung, kemudian dikocok hingga merata. Suspensi selanjutnya disentrifugasi dengan kecepatan 19336 g selama 5 menit. Pemekatan DNA dilakukan dengan penambahan natrium asetat 3M sebanyak 70 µL dan isopropanol sebanyak 500 µ L ke dalam supernatan dan dicampur perlahan. Sampel disentrifugasi pada kecepatan 19336 g selama 5 menit. Pelet yang diperoleh dicuci dengan 500 µL etanol 70%. Campuran disentrifugasi kembali selama 2 menit pada kecepatan 19336 g. Pelet selanjutnya dikeringkan pada dalam oven selama 10 menit. Pelet yang telah kering
dilarutkan dalam bufer TE yang mengandung ribonuklease sebanyak 50 µL dan diinkubasi pada suhu 37 ˚C selama 30 menit.
Pengukuran Konsentrasi dan Kemurnian DNA
DNA hasil isolasi selanjutnya dilakukan kuantifikasi untuk melihat konsentrasi dan kemurniannya dengan menggunakan spektrofotometer. Total volume yang digunakan untuk pengukuran sebanyak 400 µL dengan faktor pengenceran sebesar 200 kali. Larutan blanko yang digunakan adalah ddH2O. Sebanyak 2 µ L DNA ditambahkan
dengan 398 µ L akuades dalam kuvet. Pengukuran konsentrasi DNA dilakukan pada panjang gelombang 260 nm, sedangkan protein diukur pada panjang gelombang 280. Jumlah radiasi UV yang diserap oleh larutan DNA sebanding dengan jumlah DNA dalam sampel yang diukur. Kemurnian larutan DNA dapat dihitung melalui perbandingan A260 nm
dengan A280 nm. Batas kemurnian yang biasa
dipakai dalam analisis molekuler pada rasio A260/A280 adalah 1.8-2.0 (Sambrook et al.
1989). DNA yang sudah diukur konsentrasinya diencerkan sehingga mendapatkan konsentrasi yang seragam untuk digunakan dalam análisis PCR.
Analisis Molekuler Tanaman Padi Putatif Transgenik Menggunakan Teknik PCR
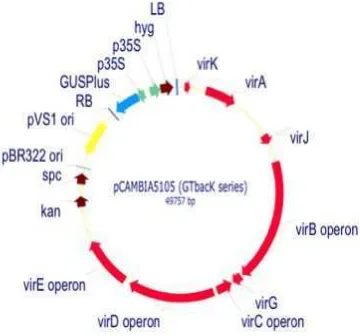
Amplifikasi gen OsDREB1 pada genom tanaman padi transgenik dilakukan dengan menggunakan primer spesifik yaitu HPT (hygromycin phospho transferase) yang mengamplifikasi bagian gen higromisin yang merupakan marka seleksi pada plasmid pCAMBIA yang disisipkan (Gambar 3). Primer ini memiliki sekuen forward 5’ GAT GCC TCC GCT CGA AGT AGC G 3’ dan sekuen reverse . 5’ GCA TCT GCC GTG CAC ATG 3’. Ukuran produk amplifikasi PCR yang dihasilkan adalah 500 bp. Amplifikasi PCR dilakukan pada volume total reaksi 20 µl yang mengandung 2-5 µl DNA genomik cetakan, dNTPs dengan konsentrasi 25 µM, sepasang primer spesifik masing-masing dengan konsentrasi 0.2 µM, MgCl2
9
dilanjutkan dengan 35 siklus yang terdiri atas : denaturasi pada suhu 94ºC selama 30 detik, penempelan primer pada suhu 60ºC selama 30 detik, pemanjangan primer pada suhu 720C selama 45 detik. Pemanjangan primer terakhir selama 7 menit pada suhu 720C. Selain DNA sampel juga digunakan DNA plasmid pCAMBIA sebagai kontrol positif (+) dan DNA padi non transgenik serta air (tanpa DNA cetakan) masing-masing sebagai kontrol negatif (-). Produk PCR (amplikon) kemudian dielektroforesis dengan menggunakan gel agarosa.
Gambar 3 Konstruksi plasmid pCAMBIA.
Elektroforesis Produk Hasil PCR Menggunakan Gel Agarosa
Terlebih dahulu disiapkan 1% gel agarosa dengan 1x buffer TBE (Tris Boric Acid EDTA). Agarosa dipanaskan sampai mendidih lalu diamkan pada suhu ruang beberapa detik. Setelah suhu agarosa cukup dingin lalu dituangkan pada cetakan. Setelah gel agarosa memadat kemudian dimasukkan ke dalam tangki elektroforesis yang berisi 0.5x buffer TBE. Sebanyak 10 µl produk PCR dari masing-masing sampel ditambahkan dengan 2 µl loading dye dan dicampur sempurna, kemudian dimasukkan ke dalam sumur di dalam gel. Untuk menentukan ukuran dari produk PCR disertakan juga DNA standar (100 bp ladder) sebagai pembanding. Sampel dielektroforesis dengan tegangan 90 volt selama kurang lebih 1.5 jam. Setelah itu, gel agarose diwarnai dengan larutan etidium bromida (10 mg/l) selama 10 menit dan dicuci dengan air selama 20-30 menit. Gel agarose kemudian ditampakkan dengan Chemidoc gel system (Biorad).
HASIL DAN PEMBAHASAN
Respon Padi Transgenik dengan Cekaman 25 mM NaCl
Pengujian respon salinitas dilakukan terhadap 96 tanaman dari dua galur padi Nipponbare transgenik yang telah diintroduksikan konstruksi ekspresi tinggi gen
OsDREB1A dan 49 tanaman dari enam galur Nipponbare transgenik yang telah diintroduksikan konstruksi ekspresi tinggi gen
OsERF1. Sebagai Kontrol positif digunakan padi varietas Nonabokra yang secara alami telah teruji sebagai varietas yang sangat toleran terhadap cekaman salinitas tinggi dan padi Nipponbare tipe liar (wild type) digunakan sebagai kontrol negatif dalam pengujian.
Berbagai variasi respon yang berbeda dihasilkan dari tanaman padi yang telah ditumbuhkan pada media larutan Yoshida yang mengandung 25 mM NaCl. Pengukuran terhadap parameter panjang akar setiap lima hari memperlihatkan pertumbuhan akar yang bervariasi dari setiap tanaman yang diuji. Hasil Pengelompokan tanaman berdasarkan indeks pertambahan panjang akar selama 15 hari perlakuan (panjang akar hari ke 15 dikurangi hari ke 0) dapat dibedakan menjadi lima kelompok. Kelompok 1 adalah tanaman yang menunjukkan pertambahan panjang akar dibawah 3,0 cm dikategorikan sebagai tanaman yang sangat rentan, kelompok 2 adalah tanaman yang pertambahan panjang akarnya antara 3,0 – 6,0 cm dikategorikan sebagai tanaman yang rentan, kelompok 3 adalah tanaman yang pertambahan panjang akarnya antara 6,1 – 9,0 cm dikategorikan sebagai tanaman yang agak toleran, kelompok 4 adalah tanaman yang pertambahan panjang akarnya antara 9,1 – 12,0 cm dikategorikan sebagai tanaman yang toleran, dan kelompok 5 adalah tanaman yang pertambahan panjang akarnya lebih dari 12,0 cm dikategorikan sebagai tanaman yang sangat toleran (Tabel 1 & Tabel 2).
Tabel 1 Pengelompokan berdasarkan indeks pertumbuhan panjang akar tanaman padi Nipponbare-OsDREB1A
kelompok Indeks pertambahan panjang akar (cm)
Jumlah tanaman
1 < 3,0 4
2 3,0 – 6,0 15
3 6,1 – 9,0 36
4 9,1 – 12,0 24
5 > 12,0 17
Tabel 2 Pengelompokan berdasarkan indeks pertumbuhan panjang akar tanaman padi Nipponbare-OsERF1
kelompok Indeks pertambahan panjang akar (cm)
Jumlah tanaman
1 < 3,0 11
2 3,0 – 6,0 10
3 6,1 – 9,0 9
4 9,1 – 12,0 6
5 > 12,0 13
Jumlah 49
Berdasarkan pengamatan profil tanaman serta dibandingkan dengan tanaman kontrol tipe liar dan padi Nonabokra, maka dari kelima kelompok tersebut dapat diduga bahwa tanaman transgenik yang mengandung gen
OsDREB1A dan OsERF1 adalah kelompok 4 dan kelompok 5. Hal ini karena tanaman tipe liar tersebar masuk ke dalam kelompok 1, kelompok 2, dan kelompok 3, sementara padi Nonabokra sebagai kontrol positif berada pada kelompok 4 dan kelompok 5.
Ekspresi tinggi faktor transkripsi
OsDREB1A maupun OsERF1 pada padi meningkatkan toleransi tanaman terhadap cekaman salinitas (Hu et al. 2008). Hal ini dapat dilihat dari parameter pertumbuhan akar. Hasil penelitian menunjukkan padi putatif transgenik memperlihatkan pertumbuhan akar yang normal. Artinya pada setiap 5 hari pengukuran menunjukkan adanya pertambahan panjang akar yang signifikan sama seperti yang ditunjukkan padi Nonabokra. Kelompok tipe liar memperlihatkan pertumbuhan akar yang terhambat dimulai dari hari ke lima setelah cekaman (Gambar 4). Perbedaan laju pertambahan panjang akar ini lebih jelas ditunjukkan pada Gambar 5. Tanaman I.5D20 merupakan galur padi
Nipponbare-OsDREB1A yang mewakili tanaman putatif transgenik, tanaman I.5D24 merupakan galur padi Nipponbare-OsDREB1A yang diduga bukan transgenik. Laju pertambahan panjang akar tertinggi ditunjukkan oleh tanaman I.5D20 yang merupakan tanaman putatif transgenik dengan nilai indeks pertambahan panjang akarnya sebesar 15,8 cm. Padi Nonabokra memiliki nilai indeks pertambahan panjang akar sebesar 14,6 cm. Laju pertambahan panjang akar yang rendah ditunjukkan oleh tanaman I.5D24 yang diduga bukan transgenik dan tanaman padi tipe liar dengan indeks pertambahan panjang akar masing-masing 4,8 cm dan 6,2 cm. Kedua tanaman tersebut terlihat mengalami tekanan setelah hari ke lima perlakuan cekaman.
Gambar 4 Pertumbuhan panjang akar tanaman selama 15 hari perlakuan 25 mM NaCl.
Gambar 5 Akar tanaman padi setelah 15 hari cekaman 25 mM NaCl, a) tipe liar, b) I.5D24, c) I.5D20, d) Nonabokra.
Informasi tentang mekanisme pengaruh salinitas tinggi terhadap pertumbuhan akar masih sangat terbatas. Akan tetapi, dari data yang dihasilkan menunjukkan terjadi penghambatan pertumbuhan akar dengan adanya konsentrasi tinggi dari senyawa NaCl pada media tumbuhnya.
Pengaruh NaCl terhadap pertumbuhan akar belum dapat ditentukan secara pasti apakah disebabkan oleh pengaruh osmotik atau toksisitas ion tertentu. Hirrel (1998) telah melakukan percobaan untuk mengidentifikasi pengaruh ion spesifik Na dan Cl dari NaCl terhadap pertumbuhan akar bayam. Hasilnya pertumbuhan akar tidak dipengaruhi oleh konsentrasi natrium atau klorida dibawah 5000 ppm. Beberapa peneliti juga telah melakukan penelitian tentang pengaruh potensial air terhadap pertumbuhan akar. Secara umum pertumbuhan akar bayamdalam larutan mengandung polietilen glikol (PEG) dengan potensial air antara 0 dan –1 Mega Pascal (MPa) (Farid et al. 2006), dan tebu pada potensial air antara –0.017 dan –3.1 MPa (Daniels & Trappe 2003) mengalami penurunan secara linier dengan penurunan potensial air. Penelitian-penelitian di atas
0 5 10 15 20 25
0 5 10 15 20
p a n ja n g a k a r (c m ) hari I.5D20 I.5D24 nonabokra tipe liar
11
menunjukkan bahwa rendahnya potensial air adalah pembatas yang sangat penting dalam pertumbuhan akar. Jadi pengaruh utama NaCl terhadap pertumbuhan akar adalah karena gaya osmotik bukan karena toksisitas ion natrium dan klorida.
Berbagai variasi respon yang berbeda juga dihasilkan dari pengukuran tinggi tanaman. Oleh karena itu dibuat pengelompokan berdasarkan indeks pertumbuhan tinggi tanaman. Kelompok 1 adalah tanaman yang menunjukkan pertambahan tinggi dibawah 5,0 cm dikategorikan sebagai tanaman sangat rentan, kelompok 2 adalah tanaman yang pertambahan tingginya antara 5,0–10,0 cm dikategorikan sebagai tanaman rentan, kelompok 3 adalah tanaman yang pertambahan tingginya antara 10,1–15,0 cm dikategorikan sebagai tanaman agak toleran, kelompok 4 adalah tanaman yang pertambahan tingginya antara 15,1–20,0 cm merupakan tanaman toleran, dan kelompok 5 adalah tanaman yang pertambahan tingginya lebih dari 20,0 cm merupakan tanaman sangat toleran (Tabel 3& Tabel 4).
Hasil perhitungan indeks pertumbuhan tinggi tanaman ini apabila dibandingkan dengan hasil perhitungan indeks panjang akar semakin memperkuat dugaan bahwa tanaman yang termasuk kelompok 4 dan kelompok 5 adalah tanaman putatif transgenik yang toleran salinitas tinggi. Hal ini karena 100 % tanaman kelompok 4 dan kelompok 5 pada tabel indeks akar menunjukkan respon yang baik pula terhadap pertumbuhan tinggi tanamannya. Artinya semua tanaman padi Nipponbare-OsDREB1A, yaitu 38 tanaman yang merupakan kelompok 4 dan kelompok 5 pada pengukuran tinggi tanaman juga merupakan tanaman kelompok 4 dan 5 pada pengukuran indeks akarnya. Begitu pula pada tanaman padi Nipponbare-OsERF1. Semua tanaman kelompok 4 dan kelompok 5 pada pengukuran tinggi tanaman juga merupakan tanaman kelompok 4 dan kelompok 5 pada pengukuran indeks akarnya.
Tabel 3 Pengelompokan berdasarkan indeks pertumbuhan tinggi tanaman padi Nipponbare-OsDREB1A
kelompok Indeks tinggi tanaman (cm)
Jumlah tanaman
1 < 10,0 13
2 10,0 – 15,0 3
3 15,1 – 20,0 42 4 20,1 – 25,0 18
5 > 25,0 20
Jumlah 96
Tabel 4 Pengelompokan berdasarkan indeks pertumbuhan tinggi tanaman padi Nipponbare-OsERF1
kelompok Indeks tinggi tanaman (cm)
Jumlah tanaman
1 < 10,0 18
2 10,0 – 15,0 9 3 15,1 – 20,0 4 4 20,1 – 25,0 16
5 > 25,0 2
Jumlah 49
Hasil pengamatan terhadap laju pertumbuhan tinggi tanaman menunjukkan bahwa tanaman kelompok 4 dan 5, yaitu sebanyak 38 dari 96 tanaman padi Nipponbare-OsDREB1A serta sebanyak 18 dari 49 tanaman padi Nipponbare-OsERF1
merupakan tanaman padi putatif transgenik. Hal ini karena galur-galur tanaman tersebut memiliki profil laju pertambahan tinggi tanaman yang baik seperti yang ditunjukkan tanaman kontrol positif padi Nonabokra. Sedangkan tanaman kelompok 1, kelompok 2, dan kelompok 3 baik padi
Nipponbare-OsDREB1A maupun Nipponbare-OsERF1
diduga bukan merupakan tanaman transgenik karena menunjukkan laju pertambahan tinggi tanaman yang rendah bahkan tertekan seperti yang ditunjukkan tanaman padi tipe liar sebagai kontrol negatif.
0 5 10 15 20 25 30 35 40
0 5 10 15 20
T in g g i ta n a m a n ( c m ) hari I.5D20 I.5D24 Nonabokra tipe liar
Gambar 6 Pertumbuhan tinggi tanaman selama 15 hari perlakuan 25 mM NaCl.
Penampakkan perbedaan tinggi tanaman dari keempat galur tersebut lebih jelas diperlihatkan pada Gambar 7. Setelah diberikan cekaman 25 mM NaCl selama 15 hari terlihat bahwa tanaman putatif transgenik I.5D24 dan tanaman padi kontrol positif Nonabokra jauh lebih tinggi dibandingkan padi tipe liar dan padi yang diduda bukan transgenik I.5D24.
Berdasarkan hasil penelitian pengukuran terhadap parameter tinggi tanaman menunjukkan bahwa konsentrasi 25 mM NaCl menyebabkan terhambatnya pertumbuhan tanaman padi yang termasuk ke dalam kelompok rentan. Hasil ini mendukung penelitian Zhou et al. (2007) yang menyatakan bahwa laju pertumbuhan tinggi tanaman padi dan gandum menurun secara diferensial dengan bertambahnya konsentrasi NaCl di dalam media tumbuh tanaman.
Gambar 7 Tanaman padi setelah 15 hari cekaman 25 mM NaCl, a) tipe liar, b) I.5D24, c) I.5D20, d) Nonabokra.
Beberapa peneliti telah melakukan penelitian tentang pengaruh NaCl terhadap pertumbuhan tinggi tanaman. Akan tetapi tidak diketahui secara pasti apakah proses fisiologi yang terjadi pada tanaman padi juga sama. Hirrel (1998) telah melakukan percobaan untuk mengidentifikasi pengaruh ion spesifik Na dan Cl dari NaCl terhadap pertumbuhan tinggi tanaman bayam. Hasilnya pertumbuhan tinggi tanaman menurun dan terhambat oleh adanya konsentrasi Na atau Cl dibawah 5000 ppm. Pengaruh potensial air terhadap pertumbuhan tinggi tanaman juga telah dipelajari. Penurunan potensial osmotik menyebabkan pengurangan laju pertumbuhan tinggi tanaman tebupada potensial air antara – 0.017 dan –3.1 MP (Daniels & Trappe 2003). Jadi, baik efek racun ion Na atau Cl dan potensial osmotik mempengaruhi pertumbuhan tinggi tanaman.
Menurut Sinaga (2008) salinitas tinggi akan mengganggu aktivitas fisiologis maupun morfologis tanaman. Hal ini karena tanaman mengalami kekurangan air akibat penurunan potensial air. Tanaman merespon kekurangan air dengan mengurangi laju transpirasi untuk penghematan air. Terjadinya kekurangan air pada daun akan menyebabkan sel-sel penjaga kehilangan turgornya. Oleh karena pembesaran sel adalah suatu proses yang tergantung pada turgor, maka kekurangan air akan menghambat pertumbuhan daun muda sehingga proses pertambahan tinggi tanaman menjadi terhambat. Shalhevet et al. (2001) menyatakan selain penurunan potensial air, pengaruh cekaman salinitas pada pertumbuhan tanaman diakibatkan oleh ketidakseimbangan hara dalam tanaman.
Respon Padi Transgenik dengan Cekaman 150 mM NaCl
Padi termasuk ke dalam kelompok tanaman yang memiliki toleransi sedang terhadap salinitas (Soertini 2001). Oleh karena itu untuk keperluan seleksi padi transgenik yang toleran terhadap salinitas karena adanya over-ekspresi faktor transkripsi OsDREB1A
maupun OsERF1 diperlukan pengujian terhadap konsentrasi NaCl yang lebih tinggi. Metode yang biasa digunakan oleh
International Rice Research Institute (IRRI) adalah dengan perlakuan 150 mM NaCl selama 65 jam. Hal ini dilakukan supaya terjadi penampakkan perbedaan yang lebih jelas antara padi transgenik dan yang bukan transgenik. Padi transgenik yang mencerminkan padi toleran salinitas akan
13
dapat bertahan hidup secara normal pada kondisi cekaman salinitas tinggi. Artinya tidak memperlihatkan gejala kerusakan apapun akibat konsentrasi NaCl yang tinggi. Sementara padi yang bukan transgenik memperlihatkan adanya gejala kerusakan yang tampak jelas akibat konsentrasi tinggi NaCl. Gejala yang terlihat adalah pertumbuhan tanaman terhenti, daun menggulung dan mengering pada bagian ujung, terjadi gejala khlorosis, dan bahkan terjadi kematian pada beberapa tanaman yang sangat rentan (Gambar 8).
Seleksi padi transgenik terhadap cekaman 150 mM NaCl dilakukan terhadap 96 tanaman dari dua galur padi Nipponbare transgenik yang diintroduksikan gen OsDREB1A dan 54 tanaman dari dua galur Nipponbare transgenik yang diintroduksikan gen OsERF1. Disertakan pula padi varietas Nonabokra sebagai kontrol positif dan Nipponbare tipe liar sebagai kontrol negatif.
Gejala yang diperlihatkan oleh tanaman setelah perlakuan bervariasi baik pada Nipponbare-OsDREB1A maupun
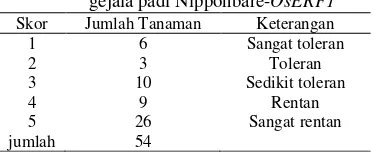
Nipponbare-OsERF1. Menurut Gregorio et al. (1997) berdasarkan tingkat gejala yang timbul, dilakukan skoring terhadap semua tanaman. Skor 1 apabila tanaman tumbuh normal dan tidak menunjukkan gejala pada daun, dikategorikan tanaman sangat toleran. Skor 2 apabila pertumbuhan tanaman mendekati normal tetapi ujung daun dan sebagian kecil daun berwarna keputihan dan menggulung, dikategorikan tanaman toleran. Skor 3 apabila pertumbuhan terhambat, banyak daun yang menggulung dan hanya sedikit yang memanjang, dikategorikan tanaman sedikit toleran. Skor 4 apabila pertumbuhan terhenti, banyak daun mengalami kekeringan, dikategorikan tanaman rentan. Skor 5 apabila tanaman mati, dikategorikan tanaman sangat rentan (Tabel 5 & Tabel 6).
Gambar 8 Penampakkan gejala padi yang timbul akibat perlakuan 150 mM NaCl.
Berdasarkan pengamatan, kelompok tanaman dengan skor 1 dan 2 diduga merupakan galur-galur tanaman padi transgenik yang toleran terhadap salinitas tinggi. Hasil dugaan ini adalah berdasarkan hasil perbandingan dengan gejala kerusakan yang ditunjukkan oleh tanaman-tanaman padi kontrol. Semua padi Nipponbare tipe liar sebagai kontrol negatif mengalami kematian, sedangkan semua tanaman padi Nonabokra yang merupakan kontrol positif menunjukkan pertumbuhan yang normal dan tidak menunjukkan gejala kerusakan pada daunnya.
Johnson (1999) dan McKimmie & Dobrenz (2001) menyatakan bahwa toleransi terhadap cekaman NaCl berhubungan dengan ketidakmampuan tanaman yang rentan untuk mengurangi pengangkutan ion Nadan Cl ke pucuk dan sebaliknya tanaman toleran menjaga konsentrasi yang rendah dari ion Na dan Cldalam pucuk sementara konsentrasi ion Na meningkat pada jaringan akar. Cong et al. (2008) menambahkan mengenai mekanisme ketahanan akibat penurunan potensial air. Berdasarkan penelitiannya tanaman yang tahan dapat mengakumulasi protein-protein hidrofilik seperti prolin yang melindungi tanaman dengan cara menurunkan potensial air intraseluler sehingga dapat menyeimbangkan potensial osmotik sel dengan lingkungannya. Ekspresi tinggi gen faktor transkripsi OsDREB1A dan OsERF1
dapat meningkatkan ekspresi dari gen-gen target yang berhubungan dengan ketahanan terhadap salinitas seperti salah satunya adalah gen yang menyandikan protein-protein hidrofilik sehingga meningkatkan toleransi tanaman padi terhadap salinitas tinggi (Xiong & Fei 2006; Zhang et al. 2004).
Tabel 5 Hasil skoring berdasarkan tingkat gejala padi Nipponbare-OsDREB1A
Skor Jumlah Tanaman Keterangan
1 17 Sangat toleran
2 3 Toleran
3 30 Sedikit toleran
4 24 Rentan
5 jumlah
22 96
Sangat rentan
Tabel 6 Hasil skoring berdasarkan tingkat gejala padi Nipponbare-OsERF1
Skor Jumlah Tanaman Keterangan
1 6 Sangat toleran
2 3 Toleran
3 10 Sedikit toleran
4 9 Rentan
5 jumlah
26 54
Hasil Analisis PCR Tanaman-Tanaman Padi Putatif Transgenik
Menurut Welsh (2007), apabila terdapat perbedaan antara dua individu pada lingkungan yang sama dan dapat diukur, maka perbedaan ini berasal dari variasi genotipe kedua tanaman tersebut. Dengan demikian, toleransi tanaman yang tahan terhadap konsentrasi tinggi NaCl nampaknya berhubungan dengan adanya keberhasilan ekspresi tinggi gen faktor transkripsi
OsDREB1A maupun OsERF1. Oleh karena itu tanaman transgenik masih perlu dikarakterisasi secara molekuler untuk mengkonfirmasi integritas gen yang dintroduksikan di dalam genom tanaman.
Tanaman padi putatif transgenik diuji secara molekuler dengan teknik PCR mengunakan primer spesifik HPT
(hygromycin phospho transferase). Alasan tidak digunakannya primer spesifik untuk gen
OsDREB1A ataupun OsERF1 karena strategi ekspresi tinggi merupakan penyisipan gen
OsDREB1A dan OsERF1 padi ke dalam genom padi. Oleh karena tanaman padi secara alami mempunyai gen-gen tersebut, apabila diamplifikasi menggunakan primer
OsDREB1A atau OsERF1 maka akan
didapatkan hasil yang positif baik padi transgenik maupun bukan transgenik. Oleh karena itu diperlukan strategi lain salah satunya adalah menggunakan primer spesifik gen yang terdapat pada satu konstruksi di dalam plasmid yang diintroduksikan ke dalam genom tanaman. Primer yang umum digunakan adalah primer HPT yang merupakan gen marka seleksi yang menyandikan sifat ketahanan terhadap antibiotik higromisin. Selain DNA dari tanaman putatif transgenik, disertakan pula kontrol negatif yaitu DNA padi Nipponbare tipe liar yang menunjukkan hasil yang negatif. Selain itu ditambahkan juga kontrol negatif PCR menggunakan ddH2O dan kontrol
positif menggunakan plasmid yang mengandung konstruksi gen hpt, serta marker 1 kb. Sampel-sampel tanaman putatif transgenik yang dianalisis yaitu padi Nipponbare-OsDREB1A dan
Nipponbare-OsERF1 baik hasil perlakuan 25 mM NaCl maupun 150 mM NaCl. Hasil analisis PCR untuk semua tanaman putatif transgenik tersebut ditunjukkan pada Tabel 7.
Hasil positif ditunjukkan dengan terbentuknya pita produk PCR (amplikon) berukuran 500 pasang basa (bp). Sedangkan hasil negatif apabila tidak terbentuknya amplikon berukuran 500 bp. Amplikon ini
merupakan hasil amplifikasi terhadap gen hpt. Artinya sampel tanaman yang menghasilkan amplikon ini positif merupakan tanaman transgenik. Hal ini karena di dalam genom tanaman tersebut telah mengandung gen hpt
yang sebelumnya tidak ditemukan pada genom aslinya. Selain itu bisa disimpulkan juga bahwa tanaman tersebut mengandung konstruksi gen ekspresi tinggi OsDREB1A
atau OsERF1, karena gen-gen tersebut masih berada dalam satu konstruksi dengan gen hpt
yang disisipkan ke dalam genom tanaman. Tabel 7 Hasil analisis PCR menggunakan
primer HPT
Kode Tanaman Hasil PCR
OsDREB1A 25mM
I.4D6 I.4D9 I.4D10, I.4D11
I.4D14 I.4D19
I.4D20, I.4D23, I.5D2, I.5D7, I.5D8, I.5D9, I.5D11, I.5D15, I.5D18, I.5D20, II.4D2, II.4D3,
II.4D4, II.4D5, II.4D6, II.4D7 II.4D9
II.4D16, II.4D17, II.4D23, II.5D2, II.5D14, II.5D20
II.5D22
OsERF1 25mM NAE5.5-4, NAE5.5-7, NAE5.5-8, NAE5.5-10 NAE5.5-11, NAE5.5-12 NAE5.5-13, NAE5.5-15, NAE5.5-16, NAE41B-8, NAE39.1-2, NAE41B-3, NAE41B-4, NAE39.5-1, NAE39.5-2, NAE39.5-3, NAE39.5-5, NAE41B-2
OsDREB1A 150mM I.4D1, I.4D11
I.4D16
I.4D20, I.4D23, I.5D9, I.5D19, I.5D20, I.5D21, I.5D23,
I.5D25, II.4D2 II.4D4 II.4D5, II.4D13, II.5D7
II.5D10 II.5D12, II.5D17, II.5D25
OsERF1 150mM NAE41.B-11 NAE41.B-17 NAE41.B-18, NAE41.B-23, NAE41.B-24, NAE41.B-25 NAE5.5-9, NAE5.5-16 NAE5.5-22 Keterangan:
15
Tanaman putatif transgenik hasil seleksi 25 mM NaCl yang dianalisis dengan teknik PCR merupakan tanaman yang menunjukkan pertumbuhan normal baik tinggi tanaman maupun panjang akarnya. Hasil analisis PCR terhadap 30 tanaman padi putatif transgenik Nipponbare-OsDREB1A menunjukkan bahwa terdapat 24 tanaman positif PCR mengandung gen hpt dan konstruksi ekspresi tinggi OsDREB1A. Sedangkan enam tanaman lainnya menunjukkan hasil negatif . Tanaman yang negatif berdasarkan hasil PCR adalah
I.4D6, I.4D10, I.4D11, I.4D19, II.4D9, dan II.5D22.
Hasil analisis PCR terhadap 18 tanaman padi Nipponbare-OsERF1 putatif transgenik berdasarkan perlakuan 25 mM NaCl menunjukkan bahwa terdapat 14 tanaman yang positif mengandung gen hpt dan konstruksi over-ekspresi OsERF1, sedangkan empat tanaman lainnya menunjukkan hasil negatif PCR. Tanaman yang negatif berdasarkan hasil PCR adalah NAE5.5-11, NAE5.5-12, NAE39.5-5, dan NAE41B-2.
Berdasarkan hasil análisis PCR untuk padi Nipponbare-OsDREB1A maupun
Nipponbare-OsERF1, masih terdapat beberapa tanaman yang diduga transgenik ternyata bukan transgenik. Hal ini ditunjukkan oleh hasil PCR yang negatif atau tidak menunjukkan terbentuknya pita amplikon berukuran 500 bp pada gel hasil elektroforesis. Sebanyak enam dari 30 galur tanaman
Nipponbare-OsDREB1A yang diduga transgenik
menunjukkan hasil negatif PCR, dan sebanyak empat dari 18 galur tanaman
Nipponbare-OsERF1 menunjukkan hasil yang negatif PCR. Hal ini terjadi karena kemungkinan ada beberapa hal yang tidak terkontrol (escape). Pertama, konsentrasi NaCl pada media larutan Yoshida sudah menurun selama 15 hari perlakuan. Oleh karena itu beberapa tanaman padi yang bukan transgenik mampu melakukan recovery (pulih dari tekanan cekaman dan hidup normal kembali). Hal ini sesuai dengan hasil penelitian Harjadi & Yahya (2005) yang menyatakan bahwa bentuk ketahanan tanaman terhadap cekaman lingkungan bersifat dapat balik, artinya tanaman akan tumbuh normal kembali apabila kondisi lingkungannya dikembalikan pada keadaan yang normal. Kedua, lamanya waktu yang digunakan untuk perlakuan pemaparan NaCl tidak cukup untuk bisa menekan pertumbuhan tanaman-tanaman tersebut, karena tingkat kesehatan yang dimiliki tanaman-tanaman tersebut lebih baik daripada tanaman bukan transgenik yang lain. Oleh
karena itu tanaman-tanaman tersebut masuk ke dalam kelompok yang diduga transgenik karena penampilannya yang menunjukkan pertumbuhan normal seperti yang ditunjukkan tanaman yang benar-benar transgenik dan padi Nonabokra. Akan tetapi apabila waktu pemaparan NaCl diperpanjang kemungkinan tanaman-tanaman tersebut juga pada akhirnya akan menunjukkan pertumbuhan yang tertekan seperti yang ditunjukkan tanaman padi Nipponbare tipe liar.
Hasil analisi PCR terhadap 20 galur tanaman putatif trangenik padi
Nipponbare-OsDREB1A hasil seleksi dengan perlakuan 150 mM NaCl menunjukkan bahwa terdapat 17 galur yang positif mengandung gen hpt dan konstruksi ekspresi tinggi OsDREB1A. sedangkan sebanyak tiga tanaman lainnya menunjukkan hasil negatif. Galur tanaman yang negatif berdasarkan hasil análisis PCR adalah I.4D16, II.4D4, dan II.5D10.
Hasil analisis PCR terhadap sembilan galur tanaman putatif transgenik padi Nipponbare-OsERF1 berdasarkan hasil seleksi dengan perlakuan cekaman 150 mM NaCl menunjukkan bahwa terdapat 6 galur tanaman yang positif mengandung gen hpt dan konstruksi ekspresi tinggi OsERF1. Sebanyak tiga galur tanaman lainnya menunjukkan hasil negatif PCR. Tanaman yang negatif berdasarkan hasil PCR adalah NAE41.B-17, NAE5.5-9, dan NAE5.5-16.
Hasil analisis PCR ini masih menunjukkan adanya tanaman putatif transgenik baik Nipponbare-OsDREB1A maupun
Nipponbare-OsERF1 yang negatif atau bukan transgenik. Sebanyak tiga galur tanaman dari 20 pada tanaman putatif transgenik
Nipponbare-OsDREB1A menunjukkan hasil negatif. Sementara pada tanaman putatif transgenik Nipponbare-OsERF1 sebanyak tiga galur dari sembilan menunjukkan hasil negatif. Setelah dibandingkan dengan hasil pengelompokan dan skoring tanaman, enam tanaman yang menunjukkan hasil negatif tersebut ternyata merupakan galur-galur yang termasuk ke dalam kelompok 2 yang dikategorikan toleran. Sementara 23 tanaman yang menunjukkan hasil positif termasuk ke dalam kelompok 1 yang dikategorikan sangat toleran. Hal ini menunjukkan bahwa tanaman transgenik yang mengandung konstruksi ekspresi tinggi gen
Hasil ini mendukung penelitian Kitashiba
et al. (2006) yang menyatakan bahwa faktor transkripsi DREB yang ketika diekspresikan berlebih pada Arabidopsis mampu menimbulkan ketahanan terhadap salinitas tinggi dan kekeringan. Tanaman Arabidopsis yang mengandung konstruksi over-ekspresi gen DREB memiliki ketahanan yang tinggi sehingga tanaman mampu tumbuh secara normal pada media yang mengandung konsentrasi tinggi NaCl.
SIMPULAN DAN SARAN Simpulan
Toleransi terhadap salinitas tinggi dari tanaman padi Nipponbare transgenik lebih baik dibandingkan dengan padi Nipponbare tipe liar. Hasil perlakuan cekaman 25 mM NaCl menunjukkan pertumbuhan tinggi tanaman dan panjang akar padi transgenik lebih baik daripada tipe liar. Didapatkan 48 tanaman putatif transgenik dan 38 dari 48 tanaman tersebut merupakan tanaman transgenik. Hasil perlakuan cekaman 150 mM NaCl menunjukkan padi transgenik mampu hidup normal sedangkan semua padi tipe liar mati. Diperoleh 29 tanaman putatif transgenik dan 23 dari 39 tanaman tersebut merupakan tanaman transgenik. Analisis respon dengan perlakuan 150 mM NaCl lebih baik digunakan karena memperlihatkan perbedaan respon toleransi yang lebih signifikan antara padi transgenik dan tipe liar.
Saran
Perlu dilakukan analisis lebih lanjut untuk mengetahui ekspresi gen OsDREB1A dan
OsERF1 melalui Reverse Transcription-PCR untuk analisis hasil transkripsi gen (mRNA). Selain itu tanaman transgenik juga perlu dikarakterisasi secara biokimia seperti pengukuran konsentrasi prolin dalam tanaman untuk menentukan apakah gen tersebut berfungsi dengan benar.
DAFTAR PUSTAKA
Bernstein L. 2003. Effects of salinity and sodicity on plant growth. Phytopathol 13 : 295-312.
Bintoro MH. 1999. Pengaruh NaCl terhadap pertumbuhan tanaman terung kultivar senryo dan kultivar akanasu. Bul. Agr. 3: 126-134.
Chen X, Guo Z. 2008. Tobacco OPBP1 enhances salt tolerance and disease resistance of transgenic rice. Int. J. Mol. Sci. 9:2601-2613.
Clark W, Christopher K. 2008. Introduction to DNA: Spechtrophotometry, Degradation, and the “Frangekel” Eksperimen. Plant Biotechnology 22: 52. [terhubung berkala]. http://www. zoo. utoronto. /vol-22/5-clark. Html [20 Okt 2009].
Cong L, Zheng HC, Zhang YX, Chai TY. 2008. Arabidopsis DREB1A confers high salinity tolerance and regulates the expression of GA dioxygenases in tobacco. Plant Sci. 174:156-164. Daniels BA, Trappe JM. 2003. Factors
affecting spore germination of vesicular-arbuscular mycorrhizal fungus Glomus epigaeus. Mycologi 72 : 457-463. David MK. 2005. Rekayasa Genetika. Jakarta:
Grasindo.
Desveaux D et al. 2005. Whirly transcription factors: defense gene regulation beyond.
Trends in Plant Science 10: 95-102. Dharmawan, Agus H. 2005. Ekologi Hewan.
Malang: UM Pr.
Dorrenbos J, Kassam AH. 2001. Yield Response to Water. Roma: Food and Agriculture Organization of the United Nation.
Doyle JJ, Doyle JL. 1990. Isolation of plant DNA from fresh tissue. Focus 12:13-15 Dubouzet JG et al. 2003. OsDREB genes in
rice, Oryza sativa encode transcription activators that function in drought, high-salt and cold-responsive gene expression. Plant Journal 33: 751-763. Fallah, Fajar A. 2006. Perspektif Pertanian
dalam Lingkungan yang Terkontrol.
AgroBiogen 5: 36-44.
Farid et al. 2006. Variasi somaklonal tebu tahan salinitas melalui mutagenesis in vitro. J Agrivigor 5: 247-258.
Gale J, Kohl HC, Hagan RM. 1999. Changes in