PENAPI
ANTAGON
HAYATI
PISAN DAN KARAKTERISASI BAKTER
GONIS YANG BERPOTENSI SEBAGA
TI UNTUK PENGENDALIAN PENY
KARAT PUTIH PADA KRISAN
RATDIANA
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2012
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan dengan sebenarnya bahwa tesis yang berjudul, Penapisan dan Karakterisasi Bakteri Antagonis yang Berpotensi sebagai Agens Hayati untuk Pengendalian Penyakit Karat Putih pada Krisan adalah hasil karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2012
ABSTRACT
RATDIANA. Screening and Characterization of Bacterial Antagonists as Potential Agents for the Biological Control of the Chrysanthemum White Rust Disease.. Supervised by ARIS TRI WAHYUDI and GIYANTO
White rust disease caused by Puccinia horiana (Basidiomycetes: Uredinales) is the major problem on chrysanthemum plantation and caused yield lost until 100%. Biocontrol is an alternative way to control this disease. Therefore, the aims of this study are to obtain antagonist bacterial as biocontrol agents of chrysanthemum white rust disease, to identify the potential isolate and their biocontrol character, charachterized their biocontrol mechanism, and to know the role of their chitinolytic activity on germination of teliospore. The methods used in this study are selection of antagonistic bacteria which are able to control this disease in-vitro, characterized of potential antagonist bacteria with polymerase chain reaction of a 16S rRNA gene and physiology and biochemical character, characterized the mechanism of inhibition teliospore germination, and the role of chitinolytic activity in antagonism activity using transposon mutagenesis. The result showed that out of 29 bacterial isolates, 12 isolates had chitinolityc activity. The twelve isolates were the potential antagonist agents to control teliospore germination with percentage above 90%. Isolate K2 was the most potential antagonist bacteria to control this disease. This isolate could inhibit the germination up to 98% and had the highest chitinolytic activity among the isolates. Based on 16S rRNA gene partial sequences analysis and physiology and biochemical characters, this isolate was identified as Chromobacterium sp. The major mechanism was antibiosis. It is showed from the biocontrol activity which are bacteria’s cell colonization, lytic activity, and disintegrated of protoplasm. This bacteria produced cyanide acid (HCN) and phenazine beside chitinolytic enzyme. Chitinolytic activity was not a single factor in the mechanism of antibiosis but other secondary metabolic compounds produced by this bacteria also come into play. It is showed on the results of mutagenesis that transconjugants which had no chitinolytic activity was still able to inhibit germination of teliospora, whereas transconjugants which still had an activity equal to or smaller than wild type bacteria, the inhibitory were lower. It was indicated that chitinase was not the most important compound that inhibited the germination of teliopsore. There was another compound have the bigger role such as hydrogen cyanide, phenazine, or other substances produced by
Chromobacterium sp..
Keyword : Chrysanthemum white rust disease, biocontrol mechanism,
Chromobacterium sp.
RINGKASAN
RATDIANA. Penapisan dan Karakterisasi Bakteri Antagonis yang Berpotensi sebagai Agens Hayati untuk Pengendalian Penyakit Karat Putih pada Krisan. Dibimbing oleh ARIS TRI WAHYUDI dan GIYANTO
Krisan merupakan salah satu komoditas tanaman hias utama di Indonesia. Salah satu kendala dalam budidaya tanaman krisan adalah penyakit karat daun krisan yang disebabkan oleh Puccinia horiana (Basidiomycetes:Uredinales). Secara umum gejala yang ditimbulkan berupa pustul berwarna kuning oranye yang diselimuti tepung seperti karat pada permukaan bawah daun. Pustul tersebut lama-lama akan berubah putih seiring dengan perkembangannya. Infeksi dari cendawan karat bersifat lokal dan terkadang menjadi gejala sistemik. Kerusakan yang ditimbulkan dapat mencapai 100% sehingga tanaman tidak menghasikan bunga karena infeksi terjadi sejak tanaman berumur 30 hari setelah tanam.
Teknik pengendalian penyakit tanaman umumnya menggunakan pestisida dan varietas tanaman yang tahan. Alasan utama penggunaan pestisida karena efeknya dapat langsung dilihat dalam waktu yang singkat, mudah didapatkan, praktis, dan dapat bersifat kuratif atau preventif. Penggunaan yang terus menerus dan tidak sesuai dengan aturan efektivitasnya dapat berkurang atau hilang karena menimbulkan resistensi pada patogen. Selain itu beberapa pestisida tidak dapat terurai sehingga dapat mencemari lingkungan. Sehingga dianggap kurang aman dan efektif. Pengendalian dengan menggunakan varietas tahan bersifat preventif. Namun dianggap kurang efektif karena sifat ketahanan tersebut dapat dipatahkan. Hal ini terjadi karena sifat virulensi dari patogen tersebut dapat cepat berubah. Oleh karena itu dibutuhkan suatu alternatif pengendalian yang efektif, efisien, dampak dari pengendaliannya dapat bertahan lama, dan ramah lingkungan. Biokontrol atau pengendalian hayati dapat dijadikan solusi.
Agens antagonis yang digunakan untuk mengendalikan cendawan patogen memiliki beberapa mekanisme antara lain dapat menghasilkan beberapa jenis enzim yang memiliki kemampuan mendegradasi dinding sel cendawan seperti kitinase dan glukanase, dapat berkompetisi untuk menguasai ruang dan nutrisi, dapat menghasilkan antibiotik yang bersifat anticendawan seperti fenazin, dan 2,4-diacetyl phloroglucinol (DAPG), serta dapat menghasilkan senyawa-senyawa lain yang bersifat anticendawan seperti HCN. Bakteri dari kelompok Pseudomonas, Bacillus, serta cendawan Trichoderma
dan Gliocladium adalah agens-agens antagonis yang telah banyak digunakan.
Selain bakteri dan cendawan tersebut ada satu bakteri yang potensial untuk digunakan dalam pengendalian cendawan patogen yaitu Chromobacterium sp.
Seleksi bakteri antagonis dilakukan dengan melihat potensinya dalam menghambat perkecambahan teliospora cendawan karat Puccinia horiana secara in vitro dan aktivitas kitinolitiknya berdasarkan pengukuran indeks kitinolitik. Identifikasi bakteri antagonis potensial dilakukan dengan perunutan sekuens gen 16S rRNA dan karakter fisiologis biokimianya. Karakterisasi sifat-sifat biokontrol dilakukan dengan menguji produksi senyawa yang bersifat anticendawan seperti asam sianida (HCN) dan antibiotik fenazin. Pengujian produksi asam sianida dengan menggunakan indikator alkali pikrat. Produksi antibiotik fenazin dengan mengamplifikasi gen pengkodenya menggunakan dua pasang primer yaitu PHZX: 5’-TTT TTT CAT ATG CCT GCT TCG CTT TC-3’ dan PHZY: 5’-TTT GGA TCC TTA AGT TGG AAT GCC TCC-3’ yang digunakan untuk mendeteksi adanya gen fenazin (phzXY), serta PHZ1 5’-GGC GAC ATG GTC AAC GG-3’ dan PHZ2 5’-CGG CTG GCG GCG TAT TC-3’ yang digunakan untuk mendeteksi adanya gen fenazin (phzAF).
Karakterisasi peranan aktivitas kitinolitik dalam mengendalikan penyakit karat putih dilakukan dengan transposon mutagenesis menggunakan plasmid pUTmini-Tn5Km1. Seleksi transkonjugan dilakukan pada media kitin dengan menambahkan kanamisin untuk mendapatkan koloni transkonjugan dengan berbagai aktivitas kitinolitik. Masing-masing koloni transkonjugan dengan berbagai aktivitas kitinolitik dan selanjutnya diuji sifat antagonismenya untuk melihat peran dari aktivitas kitinolitik terhadap penghambatan perkecambahan teliospora.
Berdasarkan aktivitas kitinolitiknya, dari 29 isolat yang digunakan terdapat 12 isolat yang memiliki aktivitas kitinolitik. Keduabelas isolat agens antagonis yang diujikan berpotensi menghambat perkecambahan teliospora cendawan P. horiana dengan persentase penghambatan lebih dari 90%. Isolat K2 menjadi bakteri antagonis terpilih karena memiliki aktivitas kitinolitik paling besar dan penghambatan terhadap perkecambahan teliospora yang baik yaitu 98,3%. Isolat K2 teridentifikasi sebagai Chromobacterium sp. berdasarkan perunutan sekuens gen 16S rRNA secara parsial dan karakterisasi fisiologi biokimianya. Bakteri ini memproduksi beberapa senyawa yaitu asam sianida (HCN), antibiotik fenazin, enzim kitinase, dan pigmen violacein yang bersifat antagonis terhadap cendawan patogen. Mekanisme penghambatan yang dimiliki oleh bakteri antagonis K2 adalah antibiosis. Antibiosis ditunjukan dengan adanya proses lisis , protoplasma yang terdegradasi, dan kolonisasi sel Chromobacterium sp. pada teliospora. Aktivitas kitinolitik bukan faktor utama yang berperan dalam penghambatan perkecambahan teliospora. Ada faktor lain yang berperan seperti asam sianida, fenazin, dan violacein yang dihasilkan Chromobacterium sp.
©Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
PENAPISAN DAN KARAKTERISASI BAKTERI
ANTAGONIS YANG BERPOTENSI SEBAGAI AGENS
HAYATI UNTUK PENGENDALIAN PENYAKIT
KARAT PUTIH PADA KRISAN
RATDIANA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Mikrobiologi
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Judul Penelitian : Penapisan dan Karakterisasi Bakteri Antagonis yang Berpotensi sebagai Agens Hayati untuk Pengendalian Penyakit Karat Putih pada Krisan
Nama : Ratdiana
NIM : G351090161
Disetujui, Komisi Pembimbing
Diketahui
Koordinator Mayor Mikrobiologi
Dr. Ir. Gayuh Rahayu
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc.Agr
Tanggal ujian : 28 Desember 2011 Tanggal lulus: Dr. Aris Tri Wahyudi, M.Si.
Ketua
PRAKATA
Puji syukur Alhamdulillah penulis panjatkan kehadirat Allah SWT atas berkah dan rahmat-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul “Penapisan dan Karakterisasi Bakteri Antagonis yang Berpotensi sebagai Agens Hayati untuk Pengendalian Penyakit Karat Putih pada Krisan”. Penelitian ini dilakukan pada bulan Juli 2010 sampai Juli 2011 di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian dan Laboratorium Mikrobiologi, Departemen Biologi, FMIPA Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada berbagai pihak yang telah banyak membantu selama kegiatan penelitian berlangsung. Ucapan terima kasih penulis ucapkan kepada Dr. Aris Tri Wahyudi, M.Si dan Dr. Giyanto, M.Si atas bimbingan dan arahannya.
Terima kasih kepada Kepala dan Staf Laboratorium Bakteriologi Tumbuhan Departemen Proteksi Tanaman dan Laboratorium Mikrobiologi Departemen Biologi IPB yang telah membantu penulis selama penelitian. Kedua orang tua, suami Adib Sulhan Purnomo, SE serta anak saya Adina Nareshwari, dan keluarga besar tercinta atas doa dan dukungannya. Tidak lupa saya ucapkan terima kasih kepada teman-teman seperjuangan di Laboratorium Bakteri dan Laboratorium Mikrobiologi, serta teman-teman mikrobiologi 2009 atas semua bantuan dan kerjasamanya.
Bogor, Januari 2012
RIWAYAT HIDUP
Penulis dilahirkan di Lampung Selatan pada tanggal 10 Maret 1985, putri bungsu dari dua bersaudara dari pasangan Bapak Radikun dengan Ibu Purwati.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xiv
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA ... 4
Penyakit Karat Daun Krisan ... 4
Pengendalian Hayati ... 5
Chromobacterium sp. ... 7
Analisis Genetika dengan Menggunakan Transposon ... 9
BAHAN DAN METODE ... 12
Waktu dan Tempat Penelitian ... 12
Bahan Penelitian ... 12
Seleksi dan Identifikasi Isolat Bakteri Antagonis yang Berpotensi Mengendalikan Penyakit Karat Putih ... 12
Peremajaan Isolat ... 12
Potensi Antagonisme Isolat Bakteri Antagonis ... 12
Penghitungan Indeks Kitinolitik ... 14
Pemilihan Bakteri Antagonis Potensial ... 14
Identifikasi Isolat Bakteri Antagonis Potensial ... 15
Perunutan Sekuens 16S rRNA dan Padanannya pada Gene Bank ... 15
Karakterisasi sifat-sifat fisiologis dan biokimia ... 15
Karakterisasi Mekanisme Penghambatan Bakteri Antagonis Potensial ... 16
Uji Produksi Asam Sianida (HCN) ... 16
Amplifikasi Gen Pengkode Antibiotik Fenazin dengan PCR ... 16
Karakterisasi Peran Aktivitas Kitinolitik Bakteri Antagonis dalam Mengendalikan Penyakit Karat Putih ... 17
Mutagenesis dengan pUT Mini-Tn5Km1 ... 17
HASIL ... 18
Seleksi dan Identifikasi Isolat Bakteri Antagonis yang Berpotensi Mengendalikan Penyakit Karat Putih ... 18
Identifikasi Isolat Bakteri Antagonis Potensial ... 19
Karakterisasi Mekanisme Penghambatan Bakteri Antagonis Potensial ... 25
Aktivitas Penghambatan Perkecambahan Teliospora ... 25
Karakterisasi Mekanisme Penghambatan Bakteri Antagonis Potensial ... 25
Karakterisasi Peran Aktivitas Kitinolitik Bakteri Antagonis dalam Mengendalikan Penyakit Karat Putih ... 28
Mutagenesis dengan pUT Mini-Tn5Km1 ... 28
PEMBAHASAN ... 30
Potensi Antagonisme Isolat Bakteri Antagonis ... 30
Identifikasi Isolat Bakteri Antagonis Potensial ... 31
Karakterisasi Mekanisme Penghambatan Bakteri Antagonis Potensial ... 32
Karakterisasi Peran Aktivitas Kitinolitik Bakteri Antagonis dalam Mengendalikan Penyakit Karat Putih ... 34
KESIMPULAN DAN SARAN ... 39
Kesimpulan ... 39
Saran ... 39
DAFTAR TABEL
Halaman
1. Isolat bakteri Pseudomonas dan asalnya yang digunakan
dalam penelitian ini ... 13
2. Potensi isolat-isolat bakteri antagonis dalam menghambat
perkecambahan teliospora Puccinia horiana ... 19
3. Analisis hasil sekuens gen 16S rRNA secara parsial
dari isolat K2 ... 22
4. Karakteristik biokimia dan fisiologis isolat K2 ... 24
5. Persentase perkecambahan teliospora dengan perlakuan
transkonjugan ... 29
DAFTAR GAMBAR
Halaman
1. Plasmid pUT Mini-Tn5Km1 ... 10
2. Aktivitas hidrolisis koloidal kitin oleh beberapa
isolat-isolat antagonis ... 19
3. Perkecambahan teliospora ... 21
4. Koloni isolat K2 ... 22
5. Kesejajaran sekuens gen 16S rRNA isolat K2 dengan sekuens gen 16S rRNA Chromobacterium sp (Ch)
secara parsial pada GenBank ... 23
6. Mekanisme antagonisme bakteri antagonis terhadap
teliospora P. horiana ... 26
7. Produksi asam sianida (HCN) Chromobacterium sp. ... 27
8. Amplifikasi gen pengkode fenazin dengan primer
PHZ1 dan PHZ2 pada Chromobacterium sp. ... 27
PENDAHULUAN
Latar Belakang
Krisan merupakan salah satu komoditas tanaman hias utama di Indonesia.
Salah satu kendala dalam budidaya tanaman krisan adalah penyakit karat daun
krisan yang disebabkan oleh Puccinia horiana (Basidiomycetes: Uredinales).
Secara umum gejalanya berupa pustul berwarna kuning oranye yang diselimuti
tepung seperti karat pada permukaan bawah daun. Seiring dengan
perkembangannya pustul akan berubah menjadi putih. Infeksi dari cendawan karat
bersifat lokal dan terkadang dapat menjadi gejala sistemik (Agrios 2005).
Kerusakan yang ditimbulkannya dapat mencapai 100%, sehingga tanaman tidak
menghasikan bunga karena infeksi terjadi sejak tanaman berumur 30 HST
(Hanudin et al. 2004).
Teknik pengendalian penyakit tanaman umumnya menggunakan pestisida
dan varietas tanaman yang tahan penyakit. Alasan utama penggunaan pestisida
karena efeknya dapat langsung dilihat dalam waktu yang singkat, mudah
didapatkan, praktis, dan dapat bersifat kuratif atau preventif. Penggunaan
pestisida yang terus menerus dan tidak sesuai dengan aturan dapat menurunkan
efektivitasnya. Selain itu juga dapat menimbulkan resistensi pada patogen.
Beberapa jenis pestisida tidak dapat terurai sehingga dapat mencemari
lingkungan. Oleh karena itu penggunaan pestisida dianggap kurang aman dan
efektif. Pengendalian dengan menggunakan varietas tahan penyakitdan kultur
teknis lainnya bersifat preventif. Namun demikian, hal ini dianggap kurang efektif
karena sifat ketahanan tersebut dapat dipatahkan. Hal ini terjadi karena sifat
virulensi dari patogen tersebut dapat cepat berubah. Oleh karena itu dibutuhkan
suatu alternatif pengendalian yang efektif, efisien, dampak dari pengendaliannya
dapat bertahan lama, dan ramah lingkungan. Biokontrol atau pengendalian secara
hayati dapat dijadikan sebagai salah satu alternatifnya.
Biokontrol adalah penghambatan pertumbuhan, infeksi atau reproduksi
satu organisme menggunakan organisme lain (Baker & Cook 1996). Biokontrol
merupakan salah satu alternatif metode pengendalian penyakit tanaman yang
hayati. Salah satu organisme yang digunakan dalam biokontrol adalah antagonis
dari patogen tanaman yang merupakan musuh alami dari patogen yang telah ada
di lingkungan. Masing-masing agens biokontrol memiliki mekanisme tertentu
dalam mengendalikan patogen tanaman. Mekanisme yang terjadi antara lain
hiperparasitisme atau predasi, antibiosis, produksi enzim litik dan
senyawa-senyawa lain , kompetisi, serta menstimulasi ketahanan tanaman dari serangan
patogen .
Kompetisi terjadi karena terbatasnya nutrisi yang tersedia di habitatnya
seperti besi (Fe) yang konsentrasinya sangat rendah (Loper & Buyer 1991; Beattie
& Lindow 1999; Kageyama & Nelson 2003). Mekanisme antibiosis melibatkan
produksi senyawa antibiotik yang bersifat racun dan dapat membunuh patogen
(Islam et al. 2005; Leclére et al. 2005; Li et al. 2008). Parasitisasi atau
hiperparasitasi terjadi secara langsung pada propagul patogen tersebut. Ada empat
kelompok hiperparasit yaitu hipovirus, parasit fakultatif, bakteri patogen obligat,
dan predator (Benhamou & Chet 1997; Milgroom & Cortesi 2004).
Senyawa-senyawa metabolit skunder dan Senyawa-senyawa lain yang bersifat volatil seperti asam
sianida adalah mekanisme yang lain (Anderson et al. 2004; Kulakiotu et al. 2004;
Phillips et al. 2004). Senyawa-senyawa yang dikeluarkan oleh bakteri antagonis
juga dapat menstimulasi ketahanan tanaman terhadap serangan patogen. Aktivitas
ini merupakan mekanisme yang terakhir dan sifatnya tidak langsung berhubungan
dengan patogen tanaman. Mekanisme yang dimiliki oleh agens antagonis
berbeda-beda dalam mengendalikan cendawan patogen.
Agens antagonis yang digunakan untuk mengendalikan cendawan patogen
memiliki beberapa mekanisme antara lain dapat menghasilkan beberapa jenis
enzim yang memiliki kemampuan mendegradasi dinding sel cendawan seperti
kitinase dan glukanase, dapat berkompetisi untuk menguasai ruang dan nutrisi,
dapat menghasilkan antibiotik yang bersifat anticendawan seperti fenazin, dan
2,4-diacetyl phloroglucinol (DAPG), serta dapat menghasilkan senyawa-senyawa
lain yang bersifat anticendawan seperti HCN. Bakteri dari kelompok
Pseudomonas, Bacillus, serta cendawan Trichoderma dan Gliocladium adalah
Tujuan
1. Mendapatkan isolat bakteri antagonis yang mampu mengendalikan penyakit karat
putih pada krisan.
2. Mengidentifikasi isolat bakteri antagonis terpilih dan mengkarakterisasi sifat-sifat
biokontrolnya.
3. Mengkaji mekanisme penghambatan dari bakteri antagonis terpilih terhadap
perkecambahan cendawan karat putih.
4. Mengetahui peran aktivitas kitinolitik bakteri antagonis terpilih dalam
penghambatan perkecambahan cendawan karat putih.
Manfaat
Hasil yang didapatkan dari penelitian ini diharapkan menjadi informasi
untuk mengendalikan penyakit karat dan dapat digunakan untuk meningkatkan
TINJAUAN PUSTAKA
Penyakit Karat Daun Krisan
Penyakit karat pada krisan disebabkan oleh dua macam cendawan yaitu
Puccinia chrysanthemi Roze (karat hitam) dan P. horiana Henn (karat putih). Di
daerah tropis seperti Indonesia, serangan karat putih lebih umum dijumpai
daripada karat hitam. Gejala serangan karat putih berupa bintil-bintil (pustul)
putih pada permukaan bawah daun yang berisi telium (teliospora) cendawan dan
terjadi lekukan-lekukan mendalam berwarna pucat pada permukaan daun bagian
atas. Teliospora bersel dua dan berdinding tebal. Pada serangan lebih lanjut,
penyakit ini dapat menghambat perkembangan bunga. Selain pada daun, penyakit
ini juga terjadi pada kelopak dan bunga. Pengendalian penyakit ini antara lain
dengan menggunakan varietas yang resisten, penyemprotan fungisida, dan
menggunakan agens antagonis (EPPO 1983).
Cendawan P. horiana merupakan cendawan obligat, tidak memiliki inang
alternatif. Cendawan ini tidak dapat ditumbuhkan pada media artifisial seperti
Potato Dextrose Agar (PDA). Spora cendawan ini dapat menyebar melalui angin,
air, ataupun menempel pada berbagai permukaan. Ada dua jenis spora dari
cendawan ini, yaitu teliospora dan basidiospora. Teliospora adalah bentuk spora
bersel dua berdinding tebal yang tahan terhadap kondisi kering dan kondisi yang
tidak menguntungkan. Spora ini dapat bertahan hingga delapan minggu pada
kondisi yang tidak menguntungkan. Badiospora adalah struktur yang sensitif
terhadap kekeringan. Basidiospora memerlukan kelembaban yang tinggi, sekitar
90% dan air untuk dapat berkecambah (Agrios 2005).
Perkecambahan teliospora membutuhkan kondisi lingkungan dengan
kelembaban 95% atau lebih, kisaran suhu antara 13 sampai 27 ° C, dengan suhu
optimum 17 ° C. Basidiospora akan dilepaskan 2 sampai 6 jam setelah teliospora
berkecambah dan akan segera berkecambah pada permukaan daun krisan jika
terdapat air. Gejala akan muncul antara 9 sampai 10 hari pada kondisi rumah kaca.
Siklus akan terjadi 7 hari setelah basidiospora berkecambah. Secara in vitro pustul
akan muncul 20 hari setelah inokulasi pada kondisi gelap (Contreras & García,
Proses perkecambahan teliospora diawali dengan pembentukan sel
sporagen yang merupakan permulaan terbentuknya sel teliospora. Setelah
terjadinya pembagian inti sel dan sekat menjadi dua, sehingga terbentuk
teliospora yang memiliki dua sel dengan dua inti pada setiap selnya. Kematangan
teliospora diikuti oleh meningkatnya kerapatan sitoplasma, menghilangnya
vakuola, dan akumulasi kandungan lemak dan material glikogen. Selanjutnya
terbentuk tabung kecambah dan diikuti dengan beberapa kali proses meiosis yang
merupakan proses pemanjangan tabung kecambah. Tahapan selanjutnya adalah
pembentukan basidiospora (Harder 1977).
Kelembaban udara, suhu, dan inang merupakan faktor-faktor yang
mempengaruhi perkecambahan (Contreras & García 2008). Teliospora merupakan
bentuk spora yang mampu bertahan pada kondisi lingkungan yang kurang
menguntungkan. Jika kelembaban udara mencapai 95% dan suhu udara mencapai
17 ºC yang merupakan suhu optimumnya, maka dormansi dari teliospora tersebut
berhenti dan akan mulai berkecambah. Inang sangat erat kaitannya dengan sifat
cendawan ini yang termasuk parasit obligat. Hal ini berarti keberadaan inang
menjadi salah satu faktor penting karena cendawan ini tidak dapat hidup dan
berkembang tanpa adanya inang.
Pengendalian Hayati
Pengendalian hayati atau biokontrol adalah pengurangan jumlah inokulum
atau aktivitas terjadinya penyakit oleh patogen dengan menggunakan satu atau
beberapa organisme lain selain manusia (Baker & Cook 1996). Aktivitas ini
meliputi pengambatan pertumbuhan, kemampuan menginfeksi, keganasan,
virulensi, dan berbagai aktivitas dari patogen lainnya. Proses infeksi,
perkembangan gejala, dan reproduksi termasuk aktivitas yang dihambat dalam
pengendalian hayati. Organisme yang digunakan dalam pengendalian hayati
antara lain individu atau populasi yang avirulen atau hipovirulen yang terdapat
pada spesies patogen tersebut, tanaman inang yang telah dimanipulasi secara
genetik secara kultur teknis atau menggunakan organisme lain sehingga tanaman
menjadi resisten terhadap patogen, dan yang terkakhir adalah antagonis yang
merupakan musuh alami dari patogen. Oleh karena itu pengendalian hayati
yang sesuai untuk antagonis, resistensi tanaman inang melalui pemulian tanaman
yang dapat meningkatkan resistensi terhadap patogen atau sesuai dengan aktivitas
antagonis, dan introduksi secara masal antagonis, strain yang nonpatogen, atau
organisme yang menguntungkan lainnya.
Mekanisme biokontrol dapat terjadi melalui hiperparasitisme atau predasi,
antibiosis, produksi enzim litik dan senyawa-senyawa lain, serta kompetisi.
Mekanisme biokontrol yang pertama adalah hiperparasitisme. Pada mekanisme
ini, patogen diserang secara langsung. Agens biokontrol akan membunuh
propagul atau patogen itu secara langsung. Secara umum hiperparasit terbagi
menjadi empat kelompok besar yaitu bakteri patogen obligat, hipovirus, parasit
fakultatif, dan predator. Mikroorganisme yang memiliki kemampuan predasi pada
umumnya patogen yang menjadi targetnya tidak spesifik tetapi hasil
pengendaliannya tidak dapat diprediksi.
Antibiosis adalah mekanisme yang disebabkan oleh aktivitas antibiotik.
Antibiotik adalah senyawa racun yang dihasilkan mikroorganisme dan konsentrasi
rendah dapat meracuni atau membunuh mikroorganisme lainnya. Antibiotik yang
diproduksi oleh mikroorganisme khususnya agens antagonis sangat efektif untuk
menekan perkembangan patogen tanaman. Beberapa strain agens antagonis dapat
menghasilkan beberapa antibiotik yang dapat menekan satu atau banyak patogen,
contohnya adalah kelompok Bacillus dan Pseudomonas. Bacillus cereus strain
UW85 yang memproduksi zwittermisin dan kanosamin. Agens antagonis
Pseudomonas putida WC358r dapat memproduksi fenazin dan DAPG yang dapat
menekan beberapa penyakit tanaman di lahan gandum (Glandorf et al. 2001).
Mekanisme ketiga adalah produksi enzim litik dan senyawa-senyawa
lainnya. Enzim litik ini memiliki kemampuan untuk menghidrolisis berbagai
senyawa polimer seperti kitin, selulosa, hemiselulosa, protein, dan DNA.
Senyawa-senyawa polimer tersebut merupakan bagian dari penyusun
struktur-struktur sel patogen. Aktivitas dari enzim-enzim litik tersebut secara tidak
langsung dapat menghambat patogen tanaman. Salah satu contohnya adalah
Lysobacter dan Myxobacteria yang menghasilkan berbagai enzim litik dalam
jumlah banyak dan beberapa isolat efektif dalam menekan cendawan patogen
adalah senyawa lain yang dapat menghambat patogen tanaman selain
enzim-enzim litik.
Mekanisme yang keempat adalah kompetisi. Bagi mikroorganisme, tanah
dan permukaan tanaman menjadi habitat dengan keterbatasan nutrisi. Oleh karena
itu, antar mikroorganisme yang ada saling berkompetisi untuk mendapatkan
nutrisi agar dapat bertahan. Jika kompetisi ini melibatkan agens biokontrol dan
patogen maka dapat berperan dalam menekan penyakit tanaman. Hal ini terjadi
jika agens biokontrol dapat menguasai nutrisi yang tersedia dengan jumlah
populasi yang melebihi populasi patogen. Nutrisi yang paling esensial adalah besi
(Fe). Besi yang tersedia di alam tidak dapat larut dalam air dengan konsentrasi
sangat rendah yaitu 10-18 Molar. Oleh karena itu agar dapat memanfaatkan Fe,
mikroorganisme harus memiliki strategi tertentu untuk mendapatkannya.
Siderofor adalah senyawa yang dapat mengikat Fe. Di alam,
mekansime-mekanisme tersebut dapat bekerja secara sinergis artinya dalam mengendalikan
suatu penyakit empat mekanisme tersebut berperan (Baker & Cook 1996).
Chromobacterium sp.
Chromobacterium sp. adalah bakteri gram negatif yang hidup bebas dan
banyak terdapat di tanah dan air pada daerah tropis sampai subtropis. Bakteri ini
bersifat anaerobik fakultatif dan oksidase positif. Sebagai sumber energi,
Chromobacterium sp. memfermentasi glukosa, sukrosa, trehalosa, N
-asetilglukosamin, dan glukonat. Bakteri ini dapat ditumbuhkan pada media
nutrient agar dengan bentuk koloni cembung datar dan licin dengan warna ungu
karena memproduksi pigmen berwarna ungu yang disebut violacein. Namun
pigmentasi ini bisa berbeda antara satu strain dengan strain lainnya. Bakteri ini
tidak dapat tumbuh pada suhu 4 °C dan dapat tumbuh baik antara suhu 15 °C
sampai 37 °C. Chromobacterium sp. bukan bakteri patogen manusia tetapi
terkadang dapat menginfeksi manusia dan dapat menyebabkan luka di kulit yang
disebut septisemia (Kaufman et al. 1986; Lee et al. 1999).
Genom dari Chromobacterium sp. telah dikarakterisasi dan berpotensi
untuk dikembangkan untuk beberapa aplikasi bioteknologi (Brazilian National
Genome Project Consortium 2003). Aspek yang dapat dikembangkan antara lain
yang bersifat antagonis terhadap hama dan penyakit tanaman, serta perakitan
varietas tanaman yang tahan herbisida di bidang pertanian, penghasil antibiotik
seperti fenazin dan antibiotik lainnya dengan potensi sebagai antitumor,
hemolisin, dan antikoagulan di bidang kedokteran. Di bidang industri, bakteri ini
dapat dimanfaatkan untuk menghasilkan plastik yang dapat didegradasi dan juga
menghasilkan selulosa.
Senyawa-senyawa penting dan bersifat racun yang dihasilkan
Chromobacterium sp. antara lain violacein, asam sianida (HCN), enzim kitinase,
dan beberapa antibiotik (McClean et al. 1997; Durán & Menck 2001; Brazilian
National Genome Project Consortium 2003). Violacein adalah turunan dari
senyawa indol yang bersifat antitumor, antimikrobial, antiviral, dan antiparasit
(Durán et al. 2007). Hidrogen sianida adalah senyawa yang dapat menghambat
kerja dari enzim sitokrom c oksidase yang ditemukan pada membran mitokondria
sel eukariot (Isom & Way 1984). Ikatan antara sianida dengan kompleks enzim ini
akan mengganggu transfer elektron ke oksigen sehingga secara aerobik tidak
dapat menghasilkan ATP untuk energi. Jadi senyawa ini dapat digunakan untuk
mengontrol cendawan patogen yang merupakan organisme eukariot.
Kitinase adalah enzim yang memiliki kemampuan untuk mendegradasi
senyawa kitin dan mekanisme kerjanya adalah menghidrolisis ikatan β-1,4
glikosidase yang menghubungkan monomer-monomer GlcNAc (N
-asetilglukosamin). Enzim ini dapat menguraikan dinding sel cendawan dan hasil
hidrolisisnya digunakan oleh bakteri kitinolitik sebagai sumber karbon, energi
(oligosakarida), dan nitrogen (Chernin et al. 1995; Boer et al. 2001).
Chromobacterium sp. menghasilkan beberapa antibiotik seperti fenazin
yang dalam bidang kedokteran berpotensi sebagai antitumor sedangkan dalam
bidang pertanian untuk mengendalikan cendawan patogen, hemolisin yang
memiliki potensi sebagai antikoagulan, aztreonam yang merupakan antibiotik
monobaktam dan aktif terhadap gram negatif yang aerobik, aerosianidin efektif
untuk organisme gram positif, dan aerocavin yang efektif untuk gram negatif dan
positif. Pigmen ungu violacein juga memiliki sifat antibiotik terhadap Amoeba dan
Chromobacterium sp. berpotensi sebagai agens antagonis untuk patogen
tanaman karena menghasilkan beberapa senyawa yang bersifat anticendawan
seperti asam sianida (HCN), enzim kitinase, dan antibiotik fenazin. Rhizoctonia
solani, Fusarium sp., Phomopsis sp., Cercospora kikuchi, Corynespora sp.,
Aspergillus sp, dan Colletotrichum sp. adalah cendawan-cedawan patogen yang
berhasil dikendalikan oleh bakteri ini (Barreto et al. 2008; Park et al.2005).
Analisis Genetika dengan Menggunakan Transposon
Transposon adalah elemen DNA yang dapat meloncat dan menyisip pada
DNA lain. DNA yang disisipi oleh transposon dapat mengalami mutasi dan akan
dihasilkan banyak mutan. Hal ini terjadi karena transposon akan menyisip pada
sekuens DNA secara random. Teknik ini dinamakan transposon mutagenesis.
Transposon yang digunakan untuk mutagenesis memiliki beberapa syarat antara
lain frekuensi untuk transposisi harus besar, memiliki target yang tidak spesifik,
harus membawa sifat resistensi antibiotik tertentu, dan memiliki kisaran inang
yang luas.
Transposon Tn5 telah banyak digunakan dalam transposon mutagenesis
khususnya untuk bakteri gram negatif dan telah dibuat beberapa turunannya dan
disebut minitransposon. Turunan-turunan ini masing-masing membawa gen
resisten antibiotik yang spesifik seperti kanamisin, kloramfenikol,
streptomisin-spektinomisin, dan tetrasiklin. Selain itu beberapa turunannya juga telah disisipi
oleh beberapa gen lain yang berfungsi untuk berpindah dari sel donor serta
ekspresi gen di dalam sel resipien (De Lorenzo et al.1990).
Menurut Goryshin & Reznikoff (1998) ada 3 makromolekul penting yang
berhubungan dengan proses transposisi dari Tn5 ini. Ketiga makromolekul
tersebut adalah DNA transposon yang terdapat pada DNA donor, transposase
yang panjangnya 476 asam amino dan berperan dalam mengkatalis transposisi
atau perpindahan DNA transposon ke DNA target. Makromolekul yang ketiga
adalah urutan DNA target yang komplemen dengan DNA transposon. Sehingga
ketiga komponen tersebut harus ada dalam proses transposisi.
Salah satu transposon turunan dari Tn5 adalah transposon mini-Tn5Km1
(Herrero et al. 1990; De Lorenzo et al. 1990). Pada minitransposon terdapat gen
kloramfenikol, streptom
penanda seleksi.
Gambar 1 Plasmid pUT Mini-T yang terdapat pada pl pengkode transposas memiliki gen pengkode Peta situs restriksi da NotI yang memudahka berulang (IS)
masing-Selain itu, pada
NotI yang mempermuda
dijadikan vektor kloni
diapit oleh sekuens
transposon Tn5 (Gam
luar bagian dari transpos
membawanya, yaitu
yaitu bakteri pembaw
A
B
ptomisin-spektinomisin, dan tetratsiklin yang be
Tn5Km1. A. Peta plasmid pUT Mini-Tn5Km plasmid ini membawa sifat resistensi terhadap
ase (tnp) berada di luar dari transposon da kode untuk berpindah (mobRP4) dengan car dari Mini-Tn5Km1. Transposon ini memiliki hkan untuk proses kloning yang diapit oleh dua
-masing sebanyak 19 pasang basa.
pada transposon terdapat situs kloning yang sa
mudah proses kloning. Hal ini berarti bahwa t
oning untuk penyisipan gen tertentu pada krom
ns berulang sebanyak 19 pasang basa yan
ambar 1A). Enzim transposase dari transposon
nsposon. Transposase ini berada pada genom da
u pUT (Gambar 1B). Plasmid ini akan berpinda
bawa plasmid pUT (Escherichia coli S17-1λ pir
g berfungsi sebagai
5Km1. Transposon dap kanamisin. Gen on dan plasmid ini ara konjugasi. B. iliki situs kloning h dua sekuens yang
sangat unik, yaitu
transposon dapat
omosom. Situs ini
ang berasal dari
poson ini berada di
dari plasmid yang
pindah dari donor,
melalui proses konjugasi. Setelah berpindah, transposase akan bekerja
melompatkan transposon pada DNA genom resipien secara random. Plasmid pUT
ini tidak akan bertahan lama pada sel resipien dan akhirnya hancur beserta
transposase karena tidak akan direplikasi oleh sel resipien. Oleh karena itu, satu
sel resipien dapat disisipi oleh minitransposon lainnya dan hanya dibatasi oleh
kemampuan penanda seleksi yang berbeda-beda.
Transposon mutagenesis adalah teknik yang banyak digunakan untuk
mengidentifikasi gen yang mengkode beberapa senyawa metabolisme dan fungsi
khusus dari suatu organisme (Mills 1985). Dalam bidang biokontrol, Boucher et
al. (1989) memanfaatkan transposon Tn5 untuk membuat mutan Pseudomonas
solanacearum yang avirulen dan digunakan untuk mengendalikan bakteri yang
virulen. Transposon ini juga dapat digunakan untuk mutasi fungsi dari suatu gen
dan menyebabkan gen lain memproduksi senyawa tertentu secara terus menerus
seperti yang dilakukan oleh Schnider et al. (1995) yaitu ekspresi dari gen pqq
dihentikan sehingga bakteri tersebut dapat memproduksi antibiotik pyoluteorin
secara terus menerus. Anderson et al. (2004) juga menggunakan Tn5 untuk
mengkloning gen pengkode enzim protease ekstraselular dari P. fluorescens
sehingga meningkatkan produksi antibiotik Pantoea agglomerans untuk
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan Juli 2010 sampai Juli 2011 di
Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas
Pertanian dan Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, Institut
Pertanian Bogor.
Bahan Penelitian
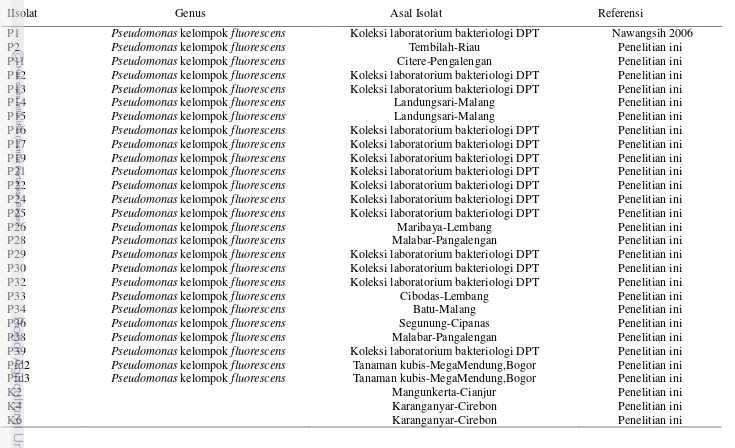
Isolat dan strain bakteri yang digunakan dalam penelitian ini tertera pada
Tabel 1. Teliospora yang digunakan diambil dari gejala pustul karat putih (white
rust disease) pada tanaman krisan.
Seleksi dan Identifikasi Isolat Bakteri Antagonis yang Berpotensi Mengendalikan Penyakit Karat Putih
Peremajaan Isolat. Isolat bakteri antagonis yang digunakan adalah dari kelompok bakteri gram negatif. Media yang digunakan adalah King’s B agar
(protease pepton no.3 20 g, K2HPO4 1.5 g, MgSO4.7H2O 1.5 g, gliserol 15 ml,
agar 15 g, dan aquades 1 L) untuk meremajakan bakteri kelompok Pseudomonas
dan media Tryptic Soybean Agar (TSA) siap pakai (Difco) untuk kelompok
bakteri antagonis lainnya.
Potensi Antagonisme Isolat Bakteri Antagonis. Pengujian in-vitro terhadap cendawan karat dilakukan dengan menggunakan metode yang
dikembangkan oleh Mueller et al. (2005) dengan modifikasi. Kultur bakteri
antagonis yang berumur 24 jam diteteskan sebanyak 100 µl pada gelas objek dan
dikeringanginkan. Setelah itu serbuk teliospora dari pustul cendawan karat
P.horiana dipanen dengan menggunakan cover glass diletakan di atas kultur
bakteri tersebut. Gelas objek disimpan pada cawan yang telah dilapisi kertas tisu
yang dibasahi untuk menjaga kelembaban dan diinkubasi pada suhu 17°C selama
24 jam dalam kondisi gelap. Sebagai kontrol digunakan suspensi teliospora yang
tidak diberi perlakuan bakteri antagonis. Setelah 24 jam, dilakukan pengamatan di
bawah mikroskop untuk menghitung jumlah teliospora yang berkecambah.
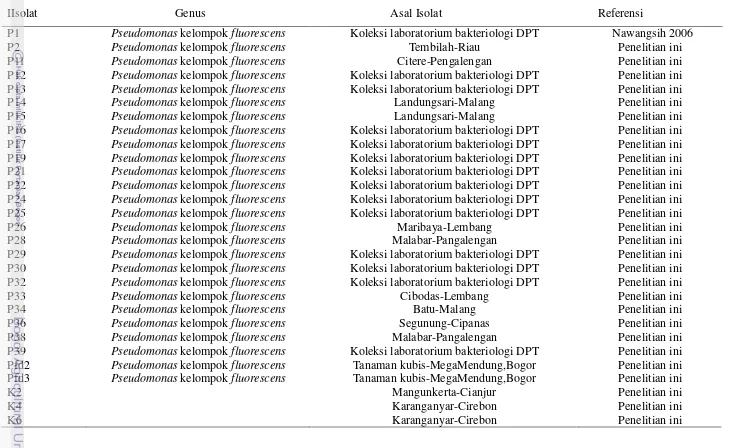
Tabel 1 Isolat bakteri Pseudomonas dan asalnya yang digunakan dalam penelitian ini
IIsolat Genus Asal Isolat Referensi
P1 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Nawangsih 2006
P2 Pseudomonas kelompok fluorescens Tembilah-Riau Penelitian ini
P11 Pseudomonas kelompok fluorescens Citere-Pengalengan Penelitian ini
P12 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Penelitian ini
P13 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Penelitian ini
P14 Pseudomonas kelompok fluorescens Landungsari-Malang Penelitian ini
P15 Pseudomonas kelompok fluorescens Landungsari-Malang Penelitian ini
P16 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Penelitian ini
P17 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Penelitian ini
P19 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Penelitian ini
P21 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Penelitian ini
P22 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Penelitian ini
P24 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Penelitian ini
P25 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Penelitian ini
P26 Pseudomonas kelompok fluorescens Maribaya-Lembang Penelitian ini
P28 Pseudomonas kelompok fluorescens Malabar-Pangalengan Penelitian ini
P29 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Penelitian ini
P30 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Penelitian ini
P32 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Penelitian ini
P33 Pseudomonas kelompok fluorescens Cibodas-Lembang Penelitian ini
P34 Pseudomonas kelompok fluorescens Batu-Malang Penelitian ini
P36 Pseudomonas kelompok fluorescens Segunung-Cipanas Penelitian ini
P38 Pseudomonas kelompok fluorescens Malabar-Pangalengan Penelitian ini
P39 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Penelitian ini
Pfd2 Pseudomonas kelompok fluorescens Tanaman kubis-MegaMendung,Bogor Penelitian ini Pfd3 Pseudomonas kelompok fluorescens Tanaman kubis-MegaMendung,Bogor Penelitian ini
K2 Mangunkerta-Cianjur Penelitian ini
K4 Karanganyar-Cirebon Penelitian ini
Persentase perkecambahan dan persentase penghambatan dihitung menggunakan
rumus berikut:
%
100%
%
%
% 100 %
Keterangan: Rumus diatas berlaku dengan asumsi bahwa teliospora pada
perlakuan kontrol berkecambah 100%.
Penghitungan Indeks Kitinolitik. Penghitungan aktivitas kitinase menggunakan metode yang digunakan Tahtamouni et al. (2006) dengan
modifikasi. Isolat bakteri ditumbuhkan pada media LB 10% (tripton 1 g, NaCl
0.5 g, ekstrak khamir 0.5 g, dan aquades 1 L) dengan penambahan serbuk kitin
1%. Sebanyak 25 l dari masing-masing kultur bakteri diteteskan pada media
kitin (K2HPO4 0.7 g, MgSO4.7H2O 0.5 g, KH2PO4 0.3 g, FeSO4.7H2O 0.01 g,
MnCl2 0.001, ZnSO4 0.001, koloidal kitin 1%, agar 20 g, dan aquades 1 L).
Pengujian untuk setiap isolat dilakukan tiga ulangan dan diinkubasi pada suhu
30°C selama 14 hari. Lebar zona bening menunjukan indeks kitinolitik dari
masing-masing isolat. Penghitungan berdasarkan persamaan Y=Y2-Y1 ( Y=
besarnya indeks kitinolitik, Y2= diameter zona bening dan diameter koloni, dan
Y2= diameter koloni).
Pemilihan Bakteri Antagonis Potensial. Karakterisasi mekanisme antagonis dilakukan pada bakteri antagonis yang menunjukan sifat antagonisme
yang paling baik dari bakteri antagonis lainnya secara kualitas dan kuantitasnya.
Selain itu, pemilihan juga didasarkan pada tingkat sensitivitasnya terhadap
antibiotik yang akan digunakan sebagai penanda seleksi. Plasmid yang membawa
transposon yang akan digunakan memiliki gen penyandi resistensi terhadap
kanamisin. Oleh karena itu dipilih bakteri antagonis yang sensitif terhadap
kanamisin. Sehingga transposon yang menyisip pada genom bakteri
menyebabakan bakteri memiliki sifat resistensi terhadap kanamisin. Isolat-isolat
kanamisin dengan konsentrasi 50 µg/ml semalaman. Setelah semalaman diamati
pertumbuhannya. Jika bakteri tersebut dapat tumbuh pada media LB dengan
kanamisin maka bakteri tersebut bersifat resisten terhadap antibiotik tersebut dan
sifat sensitif ditunjukan dengan tidak adanya pertumbuhan. Selanjutnya bakteri
yang sensitif tersebut dipilih untuk dikarakterisasi gen-gennya.
Identifikasi Isolat Bakteri Antagonis Terpilih
Perunutan Sekuens 16S rRNA dan Padanannya pada Gene Bank.
Isolasi DNA bakteri antagonis dilakukan dengan menggunakan kit ekstraksi
(Genaid) sesuai dengan protokol pada manualnya. Selanjutnya DNA tersebut
diamplifikasi dengan menggunakan primer 16S rRNA yaitu 63f (primer forward-
5’- CAGGCCTAACACATGCAAGTC -3’) dan 1387r (primer reverse-
5’-GGGCGGWGTGTACAAGGC-3’) (Marchesi et al. 1998). Komponen PCR yang
digunakan adalah KAPA Taq Ready Mix (KAPA Biosystems) sebanyak 12.5 µl,
10 pmol untuk masing-masing primer, DNA genom, dan ddH2O hingga volume
reaksi 25 µl. Tahapan PCR adalah predenaturasi pada suhu 94 ºC selama 2
menit, denaturasi pada suhu 95 ºC selama 1 menit, pelekatan primer (annealing)
pada suhu 55 ºC selama 1 menit, pemanjangan (elongation) pada suhu 72 ºC
selama 1.5 menit, proses ini diakhiri dengan pemanjangan DNA pada suhu 72 ºC
selama 5 menit. Fragmen DNA hasil amplifikasi dielektroforesis menggunakan
agarose dengan konsentrasi akhir 1%. Selanjutnya DNA tersebut disekuensing
dengan menggunakan jasa PT. Genetika Science, dan dilihat kesamaan urutan
basanya dengan menggunakan program BLAST (http://blast.ncbi.nlm.nih.gov/).
Karakterisasi Sifat-Sifat Fisiologis dan Biokimia. Pengujian sifat fisiologis dan biokimia dilakukan mengacu pada Bergey Manual untuk bakteri
hasil karakterisasi dengan molekuler yang telah dilakukan sebelumnya. Pengujian
dilakukan dengan menggunakan Microgen Gn-ID A+B Panel (Microgen
Karakterisasi Mekanisme Penghambatan Bakteri Antagonis Potensial
Uji produksi Asam Sianida (HCN). Produksi asam sianida dapat diketahui dengan menggunakan indikator alkali pikrat (Reddy et al. 2008).
Produksi asam sianida oleh isolat bakteri antagonis dapat dideteksi dengan
perubahan warna kertas indikator dari kuning menjadi oranye kecoklatan pada
kertas saring yang dicelupkan pada larutan indikator. Kultur bakteri yang
berumur 24 jam diinokulasikan pada medium agar miring TSA yang ditambahkan
4.4 g/L glisin. Setelah itu pada masing-masing tabung reaksi diberikan sepotong
kertas saring Whatman No.1 yang telah dicelupkan ke dalam larutan 0.5% asam
pikrat dan 2% sodium karbonat (Na2CO3) sebagai indikator pada bagian dalam
tabung reaksi. Kultur bakteri di dalam tabung reaksi diinkubasi pada suhu ruang
selama 3 sampai 5 hari.
Amplifikasi Gen Pengkode Antibiotik Fenazin dengan PCR. Gen pengkode antibiotik fenazin diamplifikasi dari DNA genom bakteri antagonis
dengan menggunakan dua pasang primer yaitu PHZX: 5’-TTT TTT CAT ATG
CCT GCT TCG CTT TC-3’ dan PHZY: 5’-TTT GGA TCC TTA AGT TGG AAT
GCC TCC-3’ yang digunakan untuk mendeteksi adanya gen fenazin (phzXY),
serta PHZ1 5’-GGC GAC ATG GTC AAC GG-3’ dan PHZ2 5’-CGG CTG GCG
GCG TAT TC-3’ yang digunakan untuk mendeteksi adanya gen fenazin (phzAF).
Komponen PCR yang digunakan adalah KAPA Taq Ready Mix (KAPA
Biosystems) sebanyak 12.5 µl, 10 pmol untuk masing-masing primer, DNA
genom, dan ddH2O hingga volume reaksi 25 µl. Produk PCR gen target
menggunakan primer PHZX dan PHZY adalah 1.1 kb. Siklus PCR terdiri dari
denaturasi awal 94 ºC selama 1.50 menit, dilanjutkan dengan 30 siklus denaturasi
94 ºC selama 45 detik, penempelan primer 58 ºC selama 45 detik, pemanjangan
72 ºC selama 1.75 menit dan pemanjangan akhir 72 ºC selama 1 menit.
Sedangkan untuk produk PCR gen target menggunakan primer PHZ1 dan PHZ2
adalah 1.4 kb. Siklus PCR terdiri dari denaturasi awal 94ºC selama 2 menit,
dilanjutkan dengan 30 siklus denaturasi 94ºC selama 1 menit, penempelan primer
56ºC selama 45 detik, pemanjangan 72ºC selama 1.75 menit dan pemanjangan
Karakterisasi Peranan Aktivitas Kitinolitik Bakteri Antagonis dalam Mengendalikan Penyakit Karat Putih
Mutagenesis dengan pUT Mini-Tn5Km1. Transposon mutagenesis dilakukan dengan metode konjugasi antara bakteri antagonis sebagai resipien
dengan E.coli S17-1λ pir yang merupakan pembawa plasmid pUT mini Tn5-Km1
sebagai donor (De Lorenzo et al. 1990). Bakteri antagonis ditumbuhkan
semalaman (suhu ruang, 100 rpm) pada media LB sampai konsentrasi sel 108 dan
dipanen selnya dengan sentrifugasi selama 8 menit pada kecepatan 10.000 rpm.
Setelah itu dicuci menggunakan NaCl 0.85% 3 kali. E.coli S17-1λ pir
ditumbuhkan selama 18 jam (suhu 37 °C, 80 rpm) pada LB yang ditambahkan
kanamisin 50 µg/ml dan ampisilin 50 µg/ml. Pemanenan dan pencucian sel
dilakukan seperti sebelumnya. Kedua pelet diresuspensikan dengan 40 µl LB
,dicampur, dan diteteskan pada membran steril yang diletakan di atas media LA.
Selanjutnya diinkubasi selama 24 jam pada suhu 37 °C. Setelah 24 jam, membran
diambil, dimasukan ke dalam tabung yang telah berisi 1 ml NaCl 0.85%, dan
dikocok dengan vorteks. Sebanyak 100 µl kultur bakteri disebar pada media TSA
yang ditambah kanamisin 50 µg/ml. Hasil transkonjugan ditunjukan dengan
koloni yang dapat tumbuh pada media tersebut. Seleksi transkonjugan dilakukan
pada media kitin untuk mendapatkan koloni transkonjugan dengan berbagai
aktivitas kitinolitik. Masing-masing koloni transkonjugan dengan aktivitas
kitinolitik yang berbeda selanjutnya diuji sifat antagonismenya untuk melihat
HASIL
Seleksi dan Identifikasi Isolat Bakteri Antagonis yang Berpotensi Mengendalikan Penyakit Karat Putih
Potensi Antagonisme Isolat Bakteri Antagonis. Berdasarkan aktivitas kitinolitiknya, dari 29 isolat yang digunakan terdapat 12 isolat yang memiliki
aktivitas kitinolitik. Keduabelas isolat agens antagonis yang diujikan berpotensi
menghambat perkecambahan teliospora cendawan P. horiana dengan persentase
penghambatan lebih dari 90% (Tabel 2). Teliospora pada perlakuan kontrol
mampu berkecambah dengan baik dengan presentase perkecambahan 100%.
Sedangkan untuk perlakuan dengan menggunakan bakteri antagonis teliospora
yang berkecambah antara 0.5% sampai 3.5%. Isolat P36 menunjukan persentase
penghambatan yang paling rendah yaitu 96.55 dan isolat P29 yang menunjukan
presentase penghambatan yang terbesar yaitu 99.7%. Isolat yang memiliki
penghambatan yang baik dengan presentase penghambatan antara 98% sampai
99.5% adalah P11, P25, K2, P21, P26, P34, dan P28. Beberapa isolat menunjukan
penghambatan yang sama yaitu P25 dan K2 sebesar 98.3% serta P26 dan P34
sebesar 99.2%.
Aktivitas kitinolitik (Gambar 2) yang ditunjukan dengan nilai indeks
kitinolitik ternyata tidak berkorelasi positif dengan aktivitas antagonismenya
terhadap cendawan karat. Berdasarkan hasil pada tabel 2, diketahui bahwa isolat
dengan indeks kitinolitik yang tinggi persentase penghambatannya masih lebih
rendah dari isolat dengan indeks kitinolitik yang lebih rendah. Isolat K2 dengan
indeks kitinolitik tertinggi (22.6) memiliki persentase penghambatan yang sama
dengan isolat P25 yang indeks kitinolitiknya 5.6 yaitu sebesar 98.3%. Jika
dibandingkan dengan isolat yang memiliki indeks kitinolitik rendah lainnya,
persentase penghambatan isolat K2 lebih rendah. Penghambatan paling baik
ditunjukan oleh isolat P29 yaitu 99.7% yang memiliki indeks kitinolitik 10.1
yang termasuk dalam kategori sedang. Sedangkan penghambatan terendah juga
Tabel 2 Potensi isolat-isola teliospora P. horiana.
Keterangan: Aktivitas d kitinolitik >12, sedang m 1-8, dan tidak menunjuka
Gambar 2 Aktivitas hidrolisis Aktivitas kitinolitik kitinolitik 22.6 dan zona B. Zona bening (tanda dari Chromobacterium C. Isolat P25 yang me merah) lebih kecil da tidak memiliki aktivit
Penghambatan jumlah teliosporanya, Nama Isolat Pers Perkeca (% P11
P21 1.4
P25 1.7
P26 0.8
P28 0.5
P29 0.3
P30 2.3
P34 0.8
P36 3.5
K2 1.7
K4
K6 3.3
Kontrol 100
olat bakteri antagonis dalam menghambat .
ditentukan berdasarkan indeks kitinolitik .Kuat m menunjukan indeks kitinolitik 9-12, rendah menunjuka
kan aktivitas (Tahtamouni et al. 2006)
is koloidal kitin oleh beberapa isolat-isola
k Chromobacterium sp. lebih kuat ditandai
n zona bening (tanda panah merah) yang terbent nda panah merah) yang dihasilkan oleh isolat ium sp. dan masuk kategori kuat dengan indeks menunjukan aktivitas sedang dengan zona beni dari isolat K6. D. Menunjukan isolat bakteri vitas, tidak terbentuk zona bening (tanda panah m
tan perkecambahan tidak hanya terjadi be
a, tetapi juga tabung kecambah yang tebentuk.
rsentase ecambahan (%) Persentase Penghambatan Perkecambahan (%) I
2 98
1.4 98.6
1.7 98.3
0.8 99.2
0.5 99.5
0.3 99.7
2.3 97.7
0.8 99.2
3.5 96.5
1.7 98.3
1 99
3.3 96.7
100 0
D
C
B
t perkecambahan
menunjukan indeks kan indeks kitinolitik
olat antagonis. A. ndai dengan indeks ntuk sangat lebar. olat K6 lebih kecil ks kitinolitik 11.6. ning (tanda panah ri antagonis yang ah merah).
berdasarkan pada
uk. Pada perlakuan
[image:33.595.55.507.73.830.2]kontrol (Gambar 3A), tabung kecambah (metabasidium) sudah terbentuk dan
berkembang dengan sempurna setelah 24 jam inkubasi. Berdasarkan gambar
tersebut, pada tabung kecambah terjadi aliran protoplasma dari teliospora.
Teliospora terlihat kosong. Setelah 72 jam, tabung kecambah membentuk
basidiospora dan struktur lainnya seperti sterigma atau tangkai basidiospora
(Gambar 3B). Sedangkan teliospora yang diberi perlakuan bakteri antagonis,
tabung kecambah sudah muncul pada 24 jam inkubasi tetapi perkembangannya
tidak sempurna (Gambar 3C dan 3D). Tidak terjadi proses pemanjangan tabung
kecambahnya sehingga setelah 72 jam, tabung kecambah masih sama seperti
sebelumnya. Tabung kecambahnya menjadi lebih besar (Gambar 3D).
Basidiospora juga tidak terbentuk.
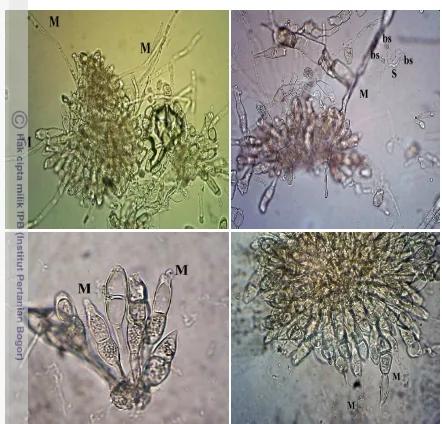
Identifikasi Isolat Bakteri Antagonis Potensial.
Berdasarkan potensi antagonismenya dan aktivitas kitinolitik terhadap
cendawan karat, isolat K2 (Gambar 4) dipilih untuk diidentifikasi dan
dikarakterisasi mekanisme penghambatannya. Hal ini berdasarkan persentase
penghambatannya yang tinggi yaitu 98.3% dan sensitifitasnya terhadap antibiotik
kanamisin karena transkonjugan yang dihasilkan akan menjadi resisten terhadap
kanamisin.
Berdasarkan hasil analisis gen 16S rRNA nya, isolat K2 teridentifikasi
sebagai Chromobacterium sp dengan derajat kemiripan mencapai 99% (Tabel 3
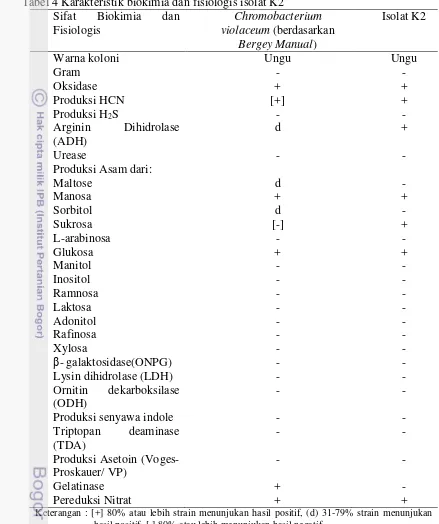
dan Gambar 5). Secara fisiologis dan biokimia, bakteri ini sangat mudah
ditumbuhkan pada media yang mengandung gula-gula sederhana seperti glukosa
dan sukrosa (Tabel 4). Hal lainnya adalah bakteri ini memproduksi pigmen
berwarna ungu baik pada media padat maupun media cair. Hal ini diperkuat lagi
dengan hasil uji fisiologis (Tabel 4), yang menyatakan bahwa isolat K2 sebagai
Chromobacterium sp.. Ciri khas dari bakteri ini adalah koloninya yang berwarna
ungu, cembung, dan licin. Hal tersebut sama dengan koloni dari isolat K2
Bakteri ini me
ini ditunjukan oleh ha
sedangkan bakteri ini
sebagai sumber ener
sukrosa, dan glukos
dihidrolase dan dapa
[image:36.595.101.489.234.730.2]dapat mereduksi nitra
Tabel 3 Analisis hasil
Nama Isolat
Homol
K2 Chromobac m sp. 06 ribosomal gene, com sequenc
Gambar 4 Koloni isol berwarna un analisis ke teridentifika pigmen ya
memiliki sifat oksidatif fermentatif atau anaerob
h hasil uji fisiologisnya di mana hasil uji oks
ini juga dapat memfermentasi beberapa gula
nerginya. Gula-gula yang dapat difermentasi
ukosa. Isolat K2 juga bereaksi positif terhada
pat menghasilkan asam sianida (HCN). Selain
trat.
sil sekuens gen 16S rRNA secara parsial dari is
ologi No Akses di GenBank Derajat Kemiripan Sk Mak obacteriu
p. 06 16S al RNA omplete quence
AY117560.1 99% 1267
solat K2. Isolat ditumbuhkan pada media TSA na ungu dengan bentuk koloni cembung, dan lic kesejajaran sekuens gen 16S rRNAny ifikasi sebagai Chromobacterium sp.. Warna ung
yang diproduksi oleh bakteri ini yang disebut vi
rob fakultatif. Hal
oksidasenya positif
ula-gula sederhana
si adalah manosa,
hadap uji arginin
ain itu bakteri ini
isolat K2 Skor aksim al E-value
1267 0.0
K2 10 AGGGTGCTTGCACCGCTGACGAGTGGCGAACGGGTGAGTAATGCGTCGGAATGTACCGTG 69 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Ch 31 AGGGTGCTTGCACCGCTGACGAGTGGCGAACGGGTGAGTAATGCGTCGGAATGTACCGTG 90
K2 70 TAATGGGGGATAGCTCGGCGAAAGCCGGATTAATACCGCATACGCCCTGAGGGGGAAAGT 129 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Ch 91 TAATGGGGGATAGCTCGGCGAAAGCCGGATTAATACCGCATACGCCCTGAGGGGGAAAGT 150
K2 130 GGGGGACCGTAAGGCCTCACGTTATACGAGCAGCCGACGTCTGATTAGCTAGTTGGTGAG 189 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Ch 151 GGGGGACCGTAAGGCCTCACGTTATACGAGCAGCCGACGTCTGATTAGCTAGTTGGTGAG 210
K2 190 GTAAAGGCTCACCAAGGCGACGATCAGTAGCGGGTCTGAGAGGATGATCCGCCACACTGG 249 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Ch 211 GTAAAGGCTCACCAAGGCGACGATCAGTAGCGGGTCTGAGAGGATGATCCGCCACACTGG 270
K2 250 GACTGAGACACGGCCCAGACTCCTACGGGAGGCAGCAGTGGGGAATTTTGGACAATGGGC 309 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Ch 271 GACTGAGACACGGCCCAGACTCCTACGGGAGGCAGCAGTGGGGAATTTTGGACAATGGGC 330
K2 310 GCAAGCCTGATCCAGCCATGCCGCGTGTCTGAAGAAGGCCTTCGGGTTGTAAAGGACTTT 369 ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Ch 331 GCAAGCCTGATCCAGCCATGCCGCGTGTCTGAAGAAGGCCTTCGGGTTGTAAAGGACTTT 390
K2 370 TGTTCGGGAGGAAATCCCGCTGGTTAATACCTGGCGGGGATGACAGTACCGGAAGAATAA 429 ||||||||||||||||||||||||||||||||||||||||||||||||||||| |||||| Ch 391 TGTTCGGGAGGAAATCCCGCTGGTTAATACCTGGCGGGGATGACAGTACCGGA-GAATAA 449
K2 430 GCACCGGCTAACTACGTGCCAGCAGCCGCGGTAATACGTAGGGTGCAAGCGTTAATCGGA 489 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Ch 450 GCACCGGCTAACTACGTGCCAGCAGCCGCGGTAATACGTAGGGTGCAAGCGTTAATCGGA 509
K2 490 ATTACTGGGCGTAAAGCGTGCGCAGGCGGTTGTGCAAGTCTGATGTGAAAGCCCCGGGCT 549 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Ch 510 ATTACTGGGCGTAAAGCGTGCGCAGGCGGTTGTGCAAGTCTGATGTGAAAGCCCCGGGCT 569
K2 550 TAACCTGGGAACGGCATTGGAGACTGCACGACTAGAGTGCGTCAGAGGGGGGTAGAATTC 609 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Ch 570 TAACCTGGGAACGGCATTGGAGACTGCACGACTAGAGTGCGTCAGAGGGGGGTAGAATTC 629
K2 610 CCACGTGTAGCAGTGAAATGCGTAGAGATGTGGAGGAATACCGATGGCGAAGGCAGCCCC 669 ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ch 630 C-ACGTGTAGCAGTGAAATGCGTAGAGATGTGGAGGAATACCGATGGCGAAGGCAGCCCC 688
K2 670 CTGGGATGACACTGACGCTTCATGCTACGAAAGCGTGGGGGAGC 713 ||||||||||||||||||| ||||| |||||||||||||| ||| Ch 689 CTGGGATGACACTGACGCT-CATGC-ACGAAAGCGTGGGG-AGC 729
Tabel 4 Karakteristik biokimia dan fisiologis isolat K2 Sifat Biokimia dan
Fisiologis
Chromobacterium
violaceum (berdasarkan
Bergey Manual)
Isolat K2
Warna koloni Ungu Ungu
Gram - -
Oksidase + +
Produksi HCN [+] +
Produksi H2S - -
Arginin Dihidrolase (ADH)
d +
Urease - -
Produksi Asam dari: Maltose Manosa Sorbitol Sukrosa L-arabinosa Glukosa Manitol Inositol Ramnosa Laktosa Adonitol Rafinosa Xylosa d + d [-] - + - - - - - - - - + - + - + - - - - - - -
β- galaktosidase(ONPG) - -
Lysin dihidrolase (LDH) - -
Ornitin dekarboksilase (ODH)
- -
Produksi senyawa indole - -
Triptopan deaminase (TDA)
- -
Produksi Asetoin (Voges-Proskauer/ VP)
- -
Gelatinase + -
Pereduksi Nitrat + +
Karakterisasi Mekanisme Penghambatan Bakteri Antagonis Potensial
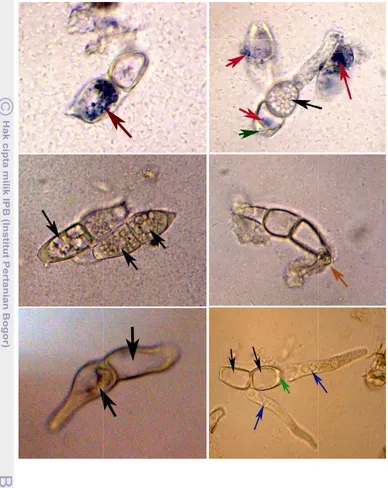
Aktivitas Penghambatan Perkecambahan Teliospora. Berdasarkan hasil pengamatan di bawah mikroskop terdapat beberapa aktivitas penghambatan
yang terjadi (Gambar 6). Penghambatan yang terjadi antara lain kolonisasi sel-sel
Chromobacterium sp. berwarna ungu yang dapat menghambat keluarnya tabung
kecambah walaupun mahkota telispora sudah terbuka (Gambar 6B). Aktivitas
lainnya adalah protoplasnya mengalami disintegrasi (Gambar 6C). Gambar 6D
menunjukan protoplas keluar dari sel teliospora karena dinding selnya
terdegradasi. Gambar 6E menunjukan teliospora yang belum berkecambah dan
tidak terjadi disintegrasi pada protoplasmanya. Sedangkan gambar 6F menunjukan
perkecambahan teliospora, tabung kecambah keluar dari mahkota teliospora dan
terjadi aliran protoplas.
Karakterisasi Mekanisme Penghambatan Bakteri Antagonis Potensial. Produksi senyawa antibiotik dan senyawa lainnya adalah mekanisme lain yang dimiliki oleh bakteri antagonis. Berdasarkan hasil pengujian produksi
senyawa antibiotik fenazin dan senyawa asam sianida pada isolat K2 menunjukan
bahwa bakteri ini memiliki kemampuan memproduksi kedua senyawa tersebut.
Asam sianida terdeteksi pada hari pertama inkubasi yang ditunjukan dengan
perubahan warna kertas indikator dari kuning menjadi merah oranye (Gambar 7).
Gen pengkode antibiotik fenazin berhasil diamplifikasi dengan
menggunakan primer PHZ1 dan PHZ2. Hasilnya ditunjukan dengan pita DNA
berukuran 1.4 kb (kilobase pair) dan 1.1 kb (Gambar 8). Sedangkan kontrol P.
aureofaciens 30-84 menghasilkan pita berukuran 1.4 kb, 1.2 kb, dan 400 bs.
Produk PCR dengan menggunakan primer tersebut adalah pita DNA berukuran
1.4 kb. Isolat K2 memiliki gen penyandi phzAF yang ditunjukan dengan pita
DNA berukuran 1.4 kb. Beberapa pita DNA yang terbentuk ada kemungkinan
menyandikan gen fenazin lainnya yang ikut dapat diamplifikasi dengan
menggunakan primer ini. Pita DNA yang berukuran 1.1 kb merupakan gen
penyandi fenazin lainnya, yaitu phzXY jika diamplifikasi menggunakan primer
PHZX dan PHZY. Namun dengan menggunakan primer PHZ1 dan PHZ2 pita
Gambar 6 Mekanism horiana. berwarna panah hi metabasidi sp.(tanda pa disintegras disintegras terdegrada Kontrol te hitam) tida
nisme antagonisme bakteri antagonis terhada . A. Sel Chromobacterium sp. (tanda pana na ungu mengkolonisasi teliospora. B. Bagian
hijau) teliospora sudah terbuka tetapi t idium. Selain itu terdapat kolonisasi sel Chr nda panah merah), dan protoplas (tanda panah hi
rasi. C. Protoplas (tanda panah hitam) teliospor rasi. D. Protoplas teliospora keluar dari sel y
dasinya dinding sel (tanda panah oranye) teliospora yang belum berkecambah. Protopl tidak mengalami disintegrasi. F. Kontrol
[image:40.595.112.500.106.594.2]berkecamba (tanda pana sel teliospo
Gambar 7 Produksi a (tanda pan oranye.
Gambar 8 Amplifika pada Chr Pseudomonas berukuran didapatka
1, 1, 1,1
mbah. Metabasidium (tanda panah biru) kelua anah hijau) dan protoplas (tanda panah hitam) ospora ke metabasidium.
i asam sianida (HCN) Chromobacterium sp . panah hitam) yang semula berwarna kuning b
kasi gen pengkode fenazin dengan primer P
hromobacterium sp.. Pada perlakuan kontrol
udomonas aureofaciens 30-84 didapatkan dua
ukuran 1.4 kb, 1.2 kb, dan 400 bp, sedangkan kan pita DNA berukuran 1.6 kb, 1.4 kb, 1.1
M K
+
K 2
M K
luar dari mahkota ) berpindah dari
p . Kertas indikator berubah menjadi
PHZ1 dan PHZ2 ontrol (K+) dengan dua pita DNA n pada isolat K2 1.1 kb, dan 700 bp.
Marker (Promega
Karakterisasi Peran Karat Putih
Mutagenesis
Chromobacterium sp.
secara acak dan disele
berbagai kriteria akti
pada media kitin+Km
tumbuh. Oleh karena
Hanya 62 koloni trans
dan diseleksi pada m
perbedaan aktivitas ki
Gambar 9 Aktivitas besar dar no.84), C transkonj tipe liar menunjuka
yang digunakan adalah gene rule 1 K ga)
anan Aktivitas Kitinolitik dalam Mengendal is dengan pUTMini-Tn5Km1. Frekuensi
sp. adalah 8.1 x 108. Seratus koloni transkonj
eleksi. Seleksi dilakukan untuk mencari transkonj
ktivitas kitinolitik. Seleksi ini tidak dapat dila
m 50 µg/ml karena transkonjugan-transkonju
na itu seleksi awal dilakukan pada media TSA+
anskonjugan yang memiliki viabilitas atau kem
media kitin+ Km 50 µg/ml. Hasil seleksi menunj
kitinolitik dari transkonjugan yang terpilih (Ga
as kitinolitik transkonjugan. C1 menunjukan ari bakteri tipe liar oleh transkonjugan K284 ( , C2 menunjukan aktivitas sama dengan bakte konjugan K272, C3 menunjukan aktivitas lebih ke
r oleh transkonjugan K285 (ditunjukan oleh nunjukan tidak ada aktivitas oleh transkonjugan K239.
C
2
C
1
C
3
C
4
Kb DNA ladder
dalikan Penyakit
nsi transkonjugasi
nskonjugan dipilih
nskonjugan dengan
dilakukan langsung
konjugan tidak dapat
A+ Km 50 µg/ml.
mampuan tumbuh
enunjukan adanya
Gambar 9).
[image:42.595.104.487.93.808.2]Mutagenesis pada isolat Chromobacterium sp. mempengaruhi aktivitas
kitinolitik transkonjugan dan aktivitas antagonisme (Tabel 5). Transkonjugan
yang tidak memiliki aktivitas