BAB I
PENDAHULUAN
1.1 Latar Belakang
Lahan gambut tropis dunia meliputi areal seluas 40 juta hektar dan 50% diantaranya terdapat di Indonesia (Maltby & Immirizi 1993 dalam Murdiyarso et al. 2004) dengan perincian di Sumatera seluas 7,20 juta ha, Kalimantan 5,76 juta ha dan Papua seluas 7,97 juta ha (Wahyunto et al. 2005). Hutan rawa gambut merupakan hutan yang tumbuh di atas lapisan gambut (tumpukan bahan organik yang sedikit terurai) dengan tebal 1-20 m dan digenangi air gambut yang berasal dari air hujan sehingga miskin hara (Soerianegara 1977). Hutan rawa gambut merupakan habitat berbagai flora-fauna dan memiliki atau dapat memberikan berbagai jasa lingkungan seperti pengatur tata air, penyerap dan penyimpan karbon (Wibisono et al. 2005).
Tingginya laju kerusakan lahan gambut di Indonesia (150.000 ha per tahun) menyebabkan berkurang atau hilangnya fungsi ekologis maupun sosial ekonomi lahan gambut. Kerusakan lahan gambut tersebut disebabkan oleh kegiatan penebangan, kebakaran, pertambangan dan konversi lahan sehingga perlu adanya usaha rehabilitasi yang sesuai (Sugandhy 1997 dalam Istomo 2002). Menurut Wibisono et al. (2005), dalam rangka upaya rehabilitasi hutan rawa gambut, jenis tanaman yang dikembangkan sebaiknya merupakan jenis lokal dengan pertimbangan bahwa jenis lokal tersebut memenuhi aspek ekologis yang sesuai dengan kondisi lokasi penanaman.
tanah yang tinggi. Jenis ini selain memberikan keuntungan secara ekologis, juga dapat memberikan keuntungan ekonomis berupa kayu atau kayu bakar bagi masyarakat lokal.
Salah satu upaya memperbanyak jenis ini untuk pelestarian plasma nutfah yaitu melalui teknik kultur jaringan. Teknik perbanyakan dengan kultur jaringan memiliki beberapa keunggulan yaitu dapat memproduksi bibit dalam jumlah besar, bebas dari penyakit serta perbanyakan tidak tergantung musim (Santoso & Nursandi 2003). Pengembangan kultur jaringan tanaman berkayu masih menemui banyak kesulitan disebabkan sterilisasi eksplan yang sulit karena tanaman induk hidup di lapangan, memiliki kecepatan multiplikasi atau replikasi sangat rendah dan keluarnya senyawa fenolik sehingga eksplan menjadi berwarna cokelat dan akhirnya tidak dapat tumbuh (Hendaryono & Wijayani 1994). Darmono (2003) mengemukakan tumbuhan yang berasal dari lapang mengandung debu, kotoran dan berbagai kontaminan hidup pada permukaannya dan bahkan pada bagian jaringan. Kondisi tumbuhan yang terserang penyakit atau terkontaminasi mikroorganisme baik eksternal maupun internal, tidak mudah untuk dilakukan pengkulturan.
Teknik kultur jaringan tumih yang dilakukan saat ini merupakan penelitian awal. Oleh karena itu, penelitian kultur jaringan tumih yang dilakukan dengan mengkaji perbanyakan tumih melalui teknik kultur jaringan menjadi hal yang penting. Penelitian ini merupakan penelitian pendahuluan dalam teknik penyiapan dan sterilisasi eksplan tumih.
1.2 Tujuan Penelitian
Tujuan penelitian ini adalah mengidentifikasi keberhasilan dari teknik penyiapan eksplan dan sterilisasi eksplan tumih dilihat dari peluang hidup, tingkat kontaminasi dan tingkat pencokelatan (browning).
1.3 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Ekologi Jenis Tumih
2.1.1 Taksonomi
Tumih mempunyai nama daerah marapat (Dayak, Ngaju, Kalimantan), perepat (Palembang), perepat darat (Belitung) dan teruntum batu (Bangka) (Heyne 1987). Menurut Boer dan Lemmens (1998), tumih memiliki klasifikasi sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledonae Ordo : Anisophylleales Famili : Anisophylleaceae Genus : Combretocarpus
Spesies : Combretocarpus rotundatus (Miq.) Danser
2.1.2 Ciri Morfologi
Pohon tumih berukuran sedang sampai besar dengan tinggi mencapai 40 m dan diameter mencapai 100 cm. Permukaan kulit batang tidak beraturan dan beralur dalam, berwarna cokelat terang sampai cokelat keabu-abuan sedangkan bagian dalam kulit batang keras, berwarna cokelat kejingga-jinggaan. Jenis ini hidup di daerah rawa, terkadang dengan bantalan dari akar nafas berwarna cokelat kemerahan berbentuk seperti benang (Boer & Lemmens 1998).
Sumber: Soepadmo et al. (1995)
Gambar 1 Combretocarpus rotundatus (Miq.) Danser (A. Ranting-daun yang berbuah; B. Buah potongan melintang; C. Bunga; D. Bunga tanpa kelopak, mahkota dan benang sari; E. Mahkota bunga; F. Benang sari).
2.1.3 Daerah Penyebaran dan Tempat Tumbuh
Tumih tersebar di Sumatera, Kalimantan dan pulau di sekitarnya (Kepulauan Riau, Bangka, Belitung) (Boer & Lemmens 1998). Menurut Argent et al. (1998), di Kalimantan, penyebaran jenis ini tercatat dari Sarawak, Brunei, Sabah, Kalimantan Barat dan Tengah. Jenis ini ditemukan pada tanah berpasir, gambut dan rawa air tawar sampai 100 m, pada tegakan yang rapat. Menurut Boer dan Lemmens (1998), jenis ini paling melimpah pada hutan sekunder atau hutan dengan kanopi terbuka. Jenis ini tumbuh pada tanah tergenang di hutan gambut dan kerangas dengan ketinggian mencapai 100 - 300 m dpl.
2.1.4 Manfaat Tumih
Jenis ini dapat digunakan untuk kayu pertukangan dan kayu bakar. Kayu dari jenis ini secara lokal banyak digunakan untuk konstruksi atau bantalan rel kereta api, tetapi membutuhkan perlakuan pengawetan. Kayu tumih juga digunakan untuk konstruksi perahu, mebel, lantai, dan panel (Boer & Lemmens 1998).
4 cm
3 cm
3 cm
2 mm
2.2 Teknik Perbanyakan Kultur Jaringan
2.2.1 Pengertian Kultur Jaringan
Kultur jaringan merupakan teknik mengisolasi bagian-bagian tanaman seperti protoplasma, sel, jaringan atau organ, serta menumbuhkan bagian-bagian tersebut dalam media buatan aseptik dengan tujuan agar bagian-bagian tersebut memperbanyak diri dan beregenerasi kembali menjadi tanaman lengkap (Gunawan 1995). Menurut Zulkarnain (2009), kultur jaringan merupakan suatu upaya mengisolasi bagian-bagian tanaman (protoplas, sel, jaringan, dan organ), kemudian mengkulturkannya pada nutrisi buatan yang steril di bawah kondisi lingkungan terkendali sehingga bagian-bagian tanaman tersebut dapat beregenerasi menjadi tanaman yang lengkap kembali. Menurut Gamborg dan Shyluk (1981) yang diacu dalam Zulkarnain (2009), tipe-tipe kultur berdasarkan macam eksplan yang digunakan dalam sistem kultur jaringan tanaman yaitu kultur organ (pucuk, meristem, potongan daun, akar, tunas), kultur kalus, kultur sel dan kultur protoplas.
2.2.2 Prinsip Dasar Kultur Jaringan
2.2.3 Manfaat Kultur Jaringan
Zulkarnain (2009) menyatakan bahwa aplikasi teknik kultur jaringan tanaman memiliki manfaat utama yaitu perbanyakan klon atau perbanyakan massal dari tanaman. Adapun manfaat-manfaat lain dari kultur jaringan dalam beberapa hal khusus yaitu:
1. Perbanyakan klon secara cepat yang pada prinsipnya setiap sel dapat diinduksi untuk beregenerasi menjadi individu tanaman lengkap. Dalam waktu singkat dapat dihasilkan individu tanaman dalam jumlah yang besar.
2. Kondisi aseptik kultur jaringan tanaman mampu menyediakan bahan tanaman yang bebas patogen dalam jumlah yang besar. Melalui kultur meristem, dapat diregenerasikan tanaman yang bebas virus.
3. Produksi tanaman pada teknik kultur jaringan tidak tergantung pada musim sehingga melalui teknik ini terbuka peluang untuk memperbanyak tanaman di sepanjang tahun.
4. Pelestarian plasma nutfah menggunakan ruang yang kecil dan mudahnya menciptakan kondisi yang sesuai, menjadikan kultur jaringan sebagai suatu cara praktis untuk menyimpan bahan tanaman dari genotipe terpilih baik tanaman pertanian maupun tanaman langka yang terancam punah.
5. Memperbanyak tanaman yang sulit diperbanyak secara vegetatif konvensional, dapat dilakukan dengan manipulasi terhadap lingkungan kultur (perlakuan hormon, cahaya, suhu) atau dengan menggunakan bahan eksplan yang memiliki daya meristematik tinggi.
2.2.4 Faktor-faktor yang Mempengaruhi Keberhasilan Teknik Kultur
Jaringan
2.2.4.1 Pemilihan Bahan Tanaman (Eksplan)
berkembang menjadi tanaman. Syarat yang harus dipenuhi dalam memilih bahan yang digunakan untuk kultur jaringan diantaranya jaringan yang sedang aktif pertumbuhannya seperti tunas, daun, mata tunas, tangkai tunas dan ujung akar. Bahan yang diambil semuda mungkin dan dijaga sterilitasnya. Hal ini dikarenakan keberhasilan kultur jaringan sangat dipengaruhi oleh gagal atau tidaknya menjaga sterilitasnya.
Gunawan (1987) menyatakan bahwa tingkat kontaminasi permukaan setiap bahan tanaman berbeda-beda tergantung dari jenis tanaman, bagian tanaman yang digunakan, morfologi permukaan (misalnya berbulu atau tidak), lingkungan tumbuhnya (green house atau lapang), musim waktu mengambil (musim hujan atau kemarau), umur tanaman (seedling atau tanaman dewasa), dan kondisi tanamannya (sehat atau tidak). Menurut Semangun (1989), pengambilan bahan tanaman yang dilakukan pada musim hujan memiliki tingkat kontaminasi yang lebih tinggi dibandingkan pada musim kemarau. Hal ini dikarenakan pada musim hujan terjadi peningkatan kelembaban tanah dan kelebihan air yang cenderung mendukung pertumbuhan jamur maupun bakteri secara cepat pada lingkungan tumbuh tempat pengambilan tanaman.
2.2.4.2 Sterilisasi Eksplan
Sterilisasi bahan tanaman (eksplan) merupakan langkah awal yang cukup penting dan dapat menentukan keberhasilan penanaman secara in vitro. Eksplan yang akan ditanam pada media tumbuh harus bebas dari mikroorganisme. Sterilisasi eksplan biasanya dilakukan dengan cara merendam eksplan dalam larutan kimia sistemik pada konsentrasi dan waktu perendaman tertentu, baik menggunakan satu macam maupun bermacam-macam sterilan (Hobir et al. 1992). Prinsip dasar sterilisasi yaitu mensterilkan eksplan dari berbagai mikroorganisme, tetapi eksplannya tidak ikut mati. Setiap tanaman memerlukan perlakuan khusus sehingga sebelum mengkulturkan tanaman baru perlu dilakukan percobaan sterilisasi (Sandra 2003).
muda) seperti daun, tangkai daun, anther dan sebagainya. Bahan-bahan yang digunakan untuk sterilisasi permukaan eksplan diantaranya:
1. Natrium hipoklorit dengan nama dagang Clorox. Konsentrasi untuk sterilisasi tergantung dari kelunakan eksplan, dapat 5% hingga 20% dengan waktu antara 5 sampai 10 menit.
2. Mercuri klorit dengan nama dagang sublimat 0,05%. Penggunaan bahan kimia ini harus hati-hati karena bersifat racun. Cara perlakuan sterilisasi sama dengan Natrium hipoklorit, hanya waktu sterilisasinya lebih pendek karena bersifat keras. Bila sterilisasi terlalu lama dapat menyebabkan kerusakan pada eksplan (berwarna cokelat).
3. Alkohol 70% yang dapat menekan pertumbuhan jamur.
Gunawan (1987) mengemukakan bahwa bahan tanaman dari lapangan mengandung debu, kotoran-kotoran dan berbagai kontaminan hidup pada permukaannya. Kontaminan hidup dapat berupa cendawan, bakteri, serangga dan telurnya serta spora. Dalam beberapa hari, kontaminan akan memenuhi seluruh botol kultur. Eksplan yang tertutup kontaminan akhirnya mati, sebagai akibat langsung dari serangan cendawan/bakteri atau secara tidak langsung akibat persenyawaan racun yang diproduksi cendawan/bakteri. Beberapa jenis bahan yang digunakan dalam sterilisasi permukaan adalah kalsium hipoklorit, natrium hipoklorit, hidrogen peroksida, gas klorin, perak nitrat, merkuri klorit, betadine, fungisida, antibiotik dan alkohol. Kisaran konsentrasi dan lama waktu perendaman bahan sterilan dapat dilihat pada Tabel 1.
Tabel 1 Kisaran konsentrasi dan lama waktu perendaman bahan sterilan
Sumber : Gunawan (1987)
Bahan Konsentrasi Lama Perendaman
Kalsium hipoklorit 1 – 10% 5 – 30 menit
Natrium hipoklorit 1 – 2% 7 – 15 menit
Hidrogen peroksida 3 – 10% 5 – 15 menit
Perak nitrat 1% 5 – 30 menit
Merkuri klorid 0,1 – 0,2% 10 – 20 menit
Gas klorin - 1 – 4 jam
Betadine 10% 5 – 10 menit
Fungisida 2 g/l 20 -30 menit
Antibiotik 50 mg/l ½ - 1 jam
Zulkarnain (2009) menyatakan bahwa beberapa sumber kontaminan mikroorganisme pada sistem kultur jaringan yaitu secara internal (kontaminan terbawa di dalam jaringan), secara eksternal (kontaminan berada di permukaan eksplan) akibat prosedur sterilisasi yang kurang sempurna, kondisi eksplan, lingkungan kerja dan pelaksanaan penanaman yang kurang hati-hati dan kurang teliti, medium sebagai akibat proses strilisasi yang tidak sempurna serta dari serangga atau hewan kecil yang berhasil masuk ke dalam botol kultur setelah diletakkan di dalam ruang kultur ataupun ruang stok. Sumber kontaminan yang paling sulit diatasi adalah yang berasal dari eksplan. Oleh karena itu, dalam memilih suatu metode sterilisasi harus selektif.
2.2.4.3Faktor Lingkungan
Hal-hal yang mutlak harus terkendali dalam kultur jaringan yaitu lingkungan yang mempengaruhinya (kelembapan, temperatur, cahaya), serta kondisi yang steril (Santoso dan Nursandi 2003). Menurut Zulkarnain (2009), kelembapan relatif di dalam ruang kultur sekitar 70%, namun kebutuhan kelembapan didalam wadah kultur mendekati 90%. Kisaran temperatur optimum yang dibutuhkan untuk pertumbuhan tidak selalu sama untuk setiap spesies tanaman. Santoso dan Nursandi (2003) menyatakan temperatur yang dibutuhkan untuk dapat terjadi pertumbuhan yang optimum yaitu berkisar 20°C hingga 30°C. Untuk pengaturan pencahayaan yang harus diperhatikan yaitu periodisasi pencahayaan dan intensitas pencahayaan.
2.2.4.4Media Kultur
Media kultur dasar yang sering digunakan adalah media Murashige and Skoog yang memiliki keistimewaan yaitu memiliki kandungan nitrat, kalium dan amonium yang tinggi. Selain itu, media MS mengandung jumlah hara organik yang layak untuk memenuhi kebutuhan banyak jenis sel tanaman dalam kultur (Gunawan 1987).
sumber karbon dan energi, vitamin dan zat pengatur tumbuh tanaman dan komponen-komponen pengoptimal pertumbuhan yaitu N-organik, asam organik, substrat komplek, arang aktif, dan lain-lain. Dalam kultur jaringan, beberapa garam organik yang dibutuhkan dalam jumlah yang banyak (unsur makro) diantaranya N, K, P, S (anion), Ca, dan Mg (kation), sedangkan garam organik yang dibutuhkan dalam jumlah yang sedikit (unsur mikro) yaitu Fe, Mn, Zn, B, Cu dan Mo. Sumber karbon yang dianggap standar adalah sukrosa dan glukosa. Sumber karbon yaitu fruktosa juga dapat digunakan namun memiliki tingkat efektifitas yang kurang dibandingkan sukrosa dan glukosa.
Vitamin dibutuhkan dalam jumlah kecil dan memiliki fungsi katalitik pada sistem enzim. Vitamin yang dianggap essensial yaitu tiamin (vitamin B1).
Pemberian tiamin mampu memberikan pertumbuhan yang lebih baik bila dibandingkan tidak ditambahkan tiamin. Beberapa vitamin lain yang ditambahkan yaitu asam p-aminobenzoat, asam askorbat (vitamin C), biotin, kolin klorida, vitamin B12, asam folat, kalsium pantotenat, dan riboflavin (vitamin B2) (Gamborg
& Shyluk 1981 dalam Santoso & Nursandi 2003).
Sitokinin merupakan senyawa yang dapat meningkatkan pembelahan sel pada jaringan tanaman, serta dapat mengatur pertumbuhan dan perkembangan tanaman. Selain itu, sitokinin juga terlibat di dalam kontrol perkecambahan pucuk, mempengaruhi absisi daun, transport auksin, memungkinkan bekerjanya giberelin dengan menghilangkan penghambat tumbuh dan menunda penuaan. Sitokinin yang paling banyak digunakan yaitu kinetin, benziladenin (BAP) dan zeatin (Kyte 1983 dalam Hendaryono & Wijayani 1994). Peran sitokinin yang lain yang dikemukakan oleh Santoso dan Nursandi (2003) yaitu pemecahan dormansi, mendorong proses morfogenesis, pembungaan, pertunasan, pembentukan kloroplas dan pembukaan stomata.
Huetteman dan Preece (1993) menyatakan bahwa BAP (6-benzyl amino purine) dan TDZ (Thiadiazuron) merupakan dua jenis sitokinin dengan tipe urea yang berbeda. Sitokinin tipe urea seperti TDZ memiliki aktivitas lebih kuat dibanding tipe adenin atau purin seperti BAP. TDZ merupakan sitokinin yang juga bersifat merangsang multiplikasi pucuk dalam konsentrasi rendah dan dapat menghasilkan tunas kerdil dengan kualitas rendah pada konsentrasi yang tinggi. Menurut Devilana (2005), dalam kultur jaringan Nenas, TDZ dengan konsentrasi 1x10-1 ppm menghasilkan jumlah tunas aksilar dan tunas adventif tertinggi pada lima minggu setelah tanam.
Sukmadjaja et al. (2007) yang diacu dalam Isnaeni (2008) menyatakan bahwa penggunaan TDZ dan BAP sebagai salah satu zat pengatur tumbuh pada komoditas pisang dengan pemberian 0,1 ppm TDZ tanpa penambahan BAP serta pemberian BAP pada konsentrasi rendah (0,5 ppm) yang dikombinasikan dengan TDZ 1,5 ppm merupakan konsentrasi zat pengatur tumbuh yang memberikan hasil penambahan jumlah tunas yang lebih tinggi dibandingkan dengan kontrol dan perlakuan lainnya.
2.2.5 Kultur Pucuk
eksplan steril. Menurut Gunawan (1987), pucuk yang berisi meristem dan jaringan-jaringan yang lebih mudah diisolasi. Dalam kultur pucuk, ukuran 0,3 - 1,0 cm digunakan sebagai bahan awal. Pada umumnya, pertumbuhan pucuk memerlukan zat pengatur tumbuh dalam media. Tahapan pertumbuhan dan tipe pertumbuhan menentukan jenis dan konsentrasi zat pengatur tumbuh yang diperlukan. Kisaran konsentrasi zat pengatur tumbuh yang digunakan disajikan pada Tabel 2.
Tabel 2 Zat pengatur tumbuh yang digunakan dalam kultur pucuk
Zat Pengatur Tumbuh Media I (mg/l) Media II (mg/l) Media III (mg/l)
Auksin
NAA 0.05 – 1.0 0.05 – 0.2 0.1 – 5.0
IBA 0.01 – 1.0 0.05 – 2.0 0.3 – 2.0
IAA 0.05 – 1.0 0.05 – 1.5 0.3 – 5.0
Sitokinin
BAP 0.2 – 3.0 0.1 – 5.0 -
Kinetin 0.3 – 2.0 0.3 – 2.0 -
ZiP 0.75 – 3.0 2 -
Giberelin
GA3 0.01 – 0.1 0.2 -
BAB III
METODOLOGI
3.1 Lokasi dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Bioteknologi Lingkungan Pusat Penelitian Lingkungan Hidup, Institut Pertanian Bogor (PPLH IPB). Penelitian ini berlangsung mulai dari bulan Maret 2011 sampai bulan Agustus 2011.
3.2 Alat dan Bahan
Alat-alat yang digunakan dalam persiapan bibit yaitu polybag, kertas koran, kardus, gunting stek, paranet dan plastik. Dalam pembuatan media, alat-alat yang digunakan yaitu gelas piala, gelas ukur biasa, pipet volumetrik, neraca analitik, pH meter, panci, pengaduk, autoklaf, karet gelang dan plastik. Sedangkan alat-alat yang digunakan dalam kegiatan sterilisasi dan penanaman yaitu spatula, cawan petri, skalpel, pisau, pinset, lampu bunsen, laminar air flow cabinet, stopwatch, aluminium foil, plastik wrap dan handsprayer; serta alat tulis dan kamera digital untuk kegiatan pengamatan.
Bahan yang digunakan dalam persiapan bibit yaitu kompos, pasir, sekam padi, serbuk gergaji dan cocopeat. Dalam kegiatan sterilisasi dan penanaman, bahan-bahan yang digunakan yaitu fungisida, bakterisida, hormon tunas, Hyponex hijau, alkohol 70%, deterjen, air steril, HgCl2, Clorox, antiseptik (betadine) dan
eksplan tumih bagian pucuk, sedangkan dalam pembuatan media, bahan-bahan yang diperlukan yaitu larutan stok media MS (Murashige dan Skoog), agar-agar, gula pasir, air steril, antibiotik ppm, BAP (6-benzyl amino purine) dan TDZ (Thiadiazuron).
3.3 Prosedur Kerja
3.3.1 Persiapan Bibit Tumih
Pengambilan anakan tumih dengan metode puteran dilakukan dengan mengeruk anakan sehingga akar dan tanah menjadi satu, kemudian anakan dimasukkan ke dalam polybag. Setelah itu, polybag yang berisi anakan dimasukkan dalam plastik besar kemudian diberi air gambut hingga menutupi seperempat bagian polybag, lalu ditutup sampai rapat sehingga air tidak dapat keluar dan dimasukkan ke dalam kardus. Sedangkan anakan tumih yang diambil dengan metode cabutan dilakukan dengan mencabut anakan dan memisahkan tanah dari akar anakan, kemudian anakan dibungkus menggunakan kertas koran. Anakan yang telah dibungkus kertas koran dimasukkan ke dalam plastik besar dan diberi air gambut sampai kertas koran menjadi lembap serta dimasukkan dalam kardus.
Anakan tumih yang diambil dengan metode puteran dan cabutan dipindahkan ke media tanam yang telah disediakan sebelumnya di Rumah Kaca Ekologi Hutan, Fakultas Kehutanan IPB. Anakan yang diambil dengan metode puteran langsung dipindahkan ke media tanam di dalam polybag. Pada anakan dengan metode cabutan, dilakukan pengurangan daun sehingga tersisa sepertiga daun. Tujuan dari pemotongan daun untuk mengurangi penguapan dari tanaman tersebut. Pemotongan dilakukan dengan menggunakan gunting stek yang telah disterilisasi menggunakan alkohol 70%. Anakan yang telah dipindahkan diberi sungkup UV dan paranet 65% yang bertujuan untuk menjaga suhu, kelembapan dan intensitas cahaya.
3.3.2 Karantina Tanaman
Karantinadilakukan untuk mensterilisasi tanaman dari kontaminan berupa jamur atau bakteri yang berasal dari alam. Proses karantina yang dilakukan yaitu dengan menyemprot hormon tunas 10 ml/l atau Hyponex hijau 2 g/l pada pagi hari. Pada sore hari disemprot fungisida (Antracol) 1 g/l + bakterisida (Agrept) 1 g/l. Dalam pelaksanaannya, proses sterilisasi hanya dilakukan satu kali dalam seminggu. Hal ini dikarenakan kondisi bibit yang belum stabil serta menghindari kematian bibit tumih.
3.3.3 Sterilisasi
Sterilisasi lingkungan kerja untuk kultur in vitro terdiri dari lingkungan umum (ruang transfer secara keseluruhan) dan lingkungan khusus (lingkungan di dalam laminar air flow cabinet).
Steriliasi alat-alat kerja yaitu pinset, skalpel, gunting dan botol kultur dicuci menggunakan deterjen sampai bersih kemudian dikeringkan. Alat-alat tersebut dibungkus menggunakan kertas koran kemudian diautoklaf selama satu jam pada suhu 121⁰C sampai 126⁰C dan tekanan 1,5 atm. Alat-alat yang telah diautoklaf dimasukkan ke dalam laminar air flow cabinet untuk disinari ultraviolet (UV). Sterilisasi pada laminar air flow cabinet yaitu dengan menyemprot permukaan atau meja kerja dengan alkohol 70% dan menghidupkan blower pada laminar air flow cabinet. Lampu ultraviolet dalam laminar air flow cabinet dinyalakan selama satu hingga dua jam sebelum melakukan kegiatan di laminar air flow cabinet, ini bertujuan untuk mengurangi kontaminan di tempat kerja. Pinset dan mata pisau yang digunakan pada proses inisiasi dicelupkan ke dalam alkohol 70% dan dibakar di atas api bunsen untuk menjaga sterilitas sebelum kegiatan pemotongan dan penanaman eksplan.
Media kultur yang digunakan disterilkan menggunakan autoklaf selama 20 menit pada suhu 121⁰C sampai 126⁰C dengan tekanan 1,5 atm. Untuk mengetahui perubahan atau kontaminasi yang terjadi sebelum digunakan, media perlu disimpan selama dua hingga tiga hari.
Perlakuan sterilisasi yang dilakukan merupakan perlakuan yang dianggap optimal berdasarkan literatur dikarenakan jumlah eksplan yang terbatas. Proses sterilisasi eksplan yang dilakukan yaitu sterilisasi di luar dan di dalam laminar air flow cabinet. Proses sterilisasi eksplan di luar laminar air flow cabinet yaitu: 1. Anakan tumih yang telah dikarantina, diambil pucuk yang masih menguncup
dari bahan induk dengan panjang 1-2 cm.
2. Eksplan pucuk yang telah dipotong dari bahan induk dicuci bersih pada air mengalir dan diusap dengan kapas basah untuk menghilangkan kotoran yang menempel.
4. Eksplan dibilas dengan menggunakan air steril sebanyak dua kali masing-masing 5 menit.
Proses sterilisasi lanjut di dalam laminar air flow cabinet yaitu pencucian eksplan menggunakan air steril sebanyak satu kali selama 5 menit. Setelah itu, eksplan direndam menggunakan larutan HgCl2 (0,1 gram/100 ml) 20% selama 7
menit. Selanjutnya, perendaman eksplan dilakukan menggunakan Clorox 5% selama 3 menit, kemudian perendaman eksplan dengan larutan betadine 10 tetes/100 ml selama 5 menit. Eksplan yang telah direndam dengan betadine dibilas menggunakan air steril sebanyak tiga kali masing-masing selama 5 menit.
3.3.4 Pembuatan Media Kultur
3.3.4.1 Pembuatan Larutan Stok
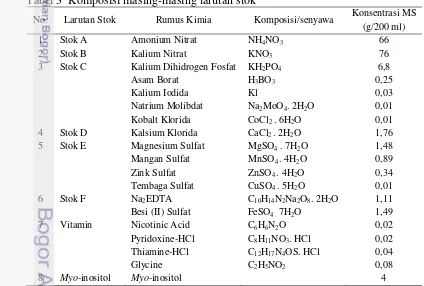
Pembuatan media dasar kultur yaitu membuat larutan stok yang terdiri atas larutan stok A, larutan stok B, larutan stok C, larutan stok D, larutan stok E, larutan stok F, stok myo-inositol, stok vitamin dan stok zat pengatur tumbuh. Masing-masing unsur pembentuk larutan stok ditimbang kemudian dilarutkan ke dalam air steril sebanyak satu liter dan disimpan di tempat bertemperatur rendah (lemari es). Komposisi masing-masing larutan stok dapat dilihat pada tabel 3. Tabel 3 Komposisi masing-masing larutan stok
No. Larutan Stok Rumus Kimia Komposisi/senyawa Konsentrasi MS
(g/200 ml)
1 Stok A Amonium Nitrat NH4NO3 66
2 Stok B Kalium Nitrat KNO3 76
3 Stok C Kalium Dihidrogen Fosfat
Asam Borat Kalium Iodida Natrium Molibdat Kobalt Klorida
KH2PO4
H3BO3
Kl
Na2MoO4. 2H2O
CoCl2 . 6H2O
6,8 0,25 0,03 0,01 0,01
4 Stok D Kalsium Klorida CaCl2 . 2H2O 1,76
5 Stok E Magnesium Sulfat
Mangan Sulfat Zink Sulfat Tembaga Sulfat
MgSO4 . 7H2O
MnSO4 . 4H2O
ZnSO4 . 4H2O
CuSO4 . 5H2O
1,48 0,89 0,34 0,01
6 Stok F Na2EDTA
Besi (II) Sulfat
C10H14N2Na2O8. 2H2O
FeSO4 . 7H2O
1,11 1,49
7 Vitamin Nicotinic Acid
Pyridoxine-HCl Thiamine-HCl Glycine
C6H6N2O
C8H11NO3. HCl
C12H17N4OS. HCl
C2H5NO2
0,02 0,02 0,04 0,08
8 Myo-inositol Myo-inositol 4
3.3.4.2Pembuatan Media MS dengan Antibiotik ppm
Tahapan yang dilakukan selanjutnya setelah pembuatan larutan stok adalah pembuatan medium MS (Murashige and Skoog) dengan antibiotik ppm. Langkah-langkah pembuatan media MS dengan antibiotik ppm yaitu sebagai berikut :
1. Memasukkan larutan stok A, B, C, D, E, F, myo-inositol masing-masing 5 ml, vitamin 2 ml dan antibiotik ppm sebanyak 1 ml ke dalam gelas piala.
2. Menambahkan gula pasir sebanyak 30 gram dan aquades sehingga volume menjadi 1000 ml.
3. Mengukur kadar pH larutan yang berkisar antara pH 5 - 6. Jika pH < 5 maka ditambahkan larutan NaOH secara bertahap sehingga media mencapai pH 5 - 6 dan jika pH > 6 maka ditambahkan larutan HCl secara bertahap sehingga media mencapai pH 5 - 6.
4. Memasukkan agar-agar bubuk sebanyak 6 gram ke dalam larutan dan diaduk hingga rata kemudian larutan media dimasukkan dalam panci dan dimasak hingga mendidih.
5. Media yang telah mendidih dimasukkan dalam botol kultur dengan ukuran masing-masing 10 ml. Botol yang telah dituang media, ditutup menggunakan plastik dan diikat menggunakan karet sampai tertutup rapat.
6. Botol yang telah berisi media disterilisasi menggunakan autoklaf selama 20 menit pada suhu 121oC sampai 126oC dan tekanan 1,5 atm.
7. Botol berisi media yang telah diautoklaf dibungkus menggunakan plastik yang telah disemprot dengan alkohol 70% kemudian disimpan di dalam lemari dengan suhu ruangan.
3.3.4.3Pembuatan Media Perlakuan
Pada media perlakuan, ditambahkan BAP dan TDZ sesuai konsentrasi yang telah ditentukan. Pembuatan media perlakuan ini diawali dengan proses yang sama pada pembuatan media kontrol (MS0 + ppm 1 ml). Penambahan BAP dan
kemudian dicampurkan agar-agar. Larutan yang telah tercampur agar-agar dimasak hingga mendidih dan dituang ke dalam botol-botol kultur yang telah steril masing-masing sebanyak 10 ml. Botol yang telah dituang media, ditutup menggunakan plastik dan diikat menggunakan karet sampai tertutup rapat. Botol yang telah berisi media disterilisasi menggunakan autoklaf selama 20 menit pada suhu 121oC sampai 126oC dan tekanan 1,5 atm. Botol berisi media yang telah diautoklaf dibungkus menggunakan plastik yang telah disemprot dengan alkohol 70% kemudian disimpan di dalam lemari dengan suhu ruangan.
3.3.5 Penanaman
Cawan petri yang akan digunakan untuk penanaman, terdiri dari dua macam yaitu cawan petri berukuran kecil yang berisi tissue dan cawan petri berukuran besar. Cawan petri berukuran kecil dan berukuran besar terlebih dahulu disterilisasi menggunakan autoklaf dan cawan petri tersebut dimasukkan ke laminar air flow cabinet. Untuk peletakan eksplan dilakukan dengan dua cara yaitu cawan petri yang berukuran kecil bertujuan untuk mengurangi air yang menempel pada eksplan sedangkan cawan petri berukuran besar bertujuan untuk memotong eksplan yang berukuran 1-2 cm. Pemotongan eksplan dilakukan pada bagian eksplan yang luka dan terkena bahan sterilan. Potongan eksplan kemudian ditanam pada media kultur. Botol kultur yang telah ditanam eksplan ditutup rapat dengan menggunakan aluminium foil dan plastik kemudian diikat dengan karet dan dilapisi dengan plastik wrap. Setelah tahap inisiasi, botol kultur yang telah berisi eksplan diletakkan di ruang kultur yang suhu dan cahaya telah diatur. Cahaya yang digunakan pada pagi hingga sore hari yaitu dari pantulan cahaya matahari, sedangkan pada sore hingga malam hari menggunakan cahaya lampu.
3.3.6 Pengamatan
Pengamatan terhadap hasil inisiasi dilakukan selama 4 minggu setelah tanam (MST), setiap 1 minggu sekali. Adapun parameter yang diamati adalah : 1. Persentase rata-rata eksplan tumih yang hidup ditandai dengan eksplan yang
berwarna kehijauan
2. Persentase rata-rata eksplan yang mengalami kontaminasi ditandai dengan munculnya kontaminan berupa jamur dan bakteri
Total perlakuan yang diamati berjumlah 16 perlakuan dan setiap perlakuan terdiri dari 7 ulangan sehingga secara keseluruhan terdapat 112 satuan percobaan. Interaksi antar faktor dari percobaan yang dilakukan dapat dilihat pada Tabel 4. Tabel 4 Interaksi faktor jenis zat pengatur tumbuh dan konsentrasinya
Keterangan :
A0 : BAP konsentrasi 0 ml/l B0 : TDZ konsentrasi 0 ml/l A1 : BAP konsentrasi 0,5 ml/l B1 : TDZ konsentrasi 0,05 ml/l A2 : BAP konsentrasi 1 ml/l B2 : TDZ konsentrasi 0,1 ml/l A3 : BAP konsentrasi 1,5 ml/l B3 : TDZ konsentrasi 0,5 ml/l
3.4Analisis Data
Perhitungan meliputi persentase peluang hidup, kontaminasi oleh jamur dan bakteri serta pencokelatan pada eksplan menggunakan rumus sebagai berikut : % Peluang Hidup = Σ eksplan yang memiliki peluang hidup x 100%
N
% Kontaminasi = Σ eksplan terkontaminasi x 100% N
% Pencokelatan = Σ eksplan mengalami pencokelatan x 100% N
Keterangan : N = Jumlah total eksplan tiap perlakuan
Zat Pengatur Tumbuh
dan Konsentrasinya B0 B1 B2 B3
A0 A0B0 A0B1 A0B2 A0B3
A1 A1B0 A1B1 A1B2 A1B3
A2 A2B0 A2B1 A2B2 A2B3
BAB IV
HASIL DAN PEMBAHASAN
4.1Hasil
4.1.1 Peluang Hidup Eksplan Tumih
Jumlah eksplan tumih yang ditanam sebanyak 112 eksplan yang telah diinisiasi pada media kultur dan diamati selama 4 minggu setelah tanam (MST). Dari hasil pengamatan diperoleh 25 eksplan tumih yang masih tetap bertahan, 21 eksplan mengalami pencokelatan (browning) dan 66 eksplan yang mengalami kontaminasi. Dari hasil pengamatan diperoleh hasil kontaminasi lebih tinggi dibandingkan eksplan yang masih tetap bertahan hidup. Hasil pengamatan dapat dilihat lebih jelas pada Tabel 5.
Tabel 5 Data eksplan tumihyang memiliki peluang hidup hingga 4 MST
Ulangan Perlakuan A0 B0 A0 B1 A0 B2 A0 B3 A1 B0 A1 B1 A1 B2 A1 B3 A2 B0 A2 B1 A2 B2 A2 B3 A3 B0 A3 B1 A3 B2 A3 B3
1 - br br - br - br - br br - - - br - -
2 - - - - - - - - v br - - - v br -
3 v - - v - - - - - - - - - br v -
4 v - - - - - br - - - - br - v - -
5 - br br v - br v br v - - - br v - br
6 v v - v v v v v - - v br - - v -
7 v - - br v - - - - v - br v v - -
Total 4 1 - 3 2 1 2 1 2 1 1 - 1 4 2 -
Keterangan : v = bertahan (25 eksplan) br = browning (21 eksplan)
- = kontaminasi (66 eksplan)
Data dari Tabel 6 menunjukkan persentase peluang hidup eksplan tumih pada masing-masing jenis media perlakuan. Persentase peluang hidup eksplan tumih pada perlakuan A0B0 dan A3B1 memiliki persentase peluang hidup paling tinggi. Sementara itu persentase peluang hidup terendah terdapat pada perlakuan A0B1, A1B1, A1B3, A2B1, A2B2 dan A3B0 sehingga diperoleh rata-rata hasil persentase peluang hidup 22,32%.
Tabel 6 Persentase peluang hidup eksplan tumih Perlakuan Rata-rata A0 B0 A0 B1 A0 B2 A0 B3 A1 B0 A1 B1 A1 B2 A1 B3 A2 B0 A2 B1 A2 B2 A2 B3 A3 B0 A3 B1 A3 B2 A3 B3 % peluang hidup 57. 14 14. 29 -
42. 86 28. 57 14. 29 28. 57 14. 29 28. 57 14. 29 14. 29 -
14. 29
57. 14
28.
Kondisi eksplan tumih yang masih tetap bertahan dan memiliki peluang hidup selama empat minggu ditandai dengan pucuk masih berwarna hijau, mata tunas mengalami pertumbuhan serta kondisi eksplan dan media yang tidak terserang oleh jamur dan bakteri. Hal ini dapat dilihat pada Gambar 2.
Gambar 2 Kondisi eksplan tumihyang tetap bertahan.
4.1.2 Persentase Kontaminasi Eksplan
Tabel 7 Persentase kontaminasi eksplan tumihselama 4 MST
No. Jenis Media
Total Kontaminasi (Eksplan) % Kontaminasi Minggu 1 Minggu 2 Minggu 3 Minggu 4
1 A0B0 1 2 42.86
2 A0B1 1 3 57.14
3 A0B2 4 1 71.43
4 A0B3 2 1 42.86
5 A1B0 3 1 57.14
6 A1B1 1 4 71.43
7 A1B2 3 42.86
8 A1B3 4 1*) 71.43
9 A2B0 4 57.14
10 A2B1 2 2 57.14
11 A2B2 6 85.71
12 A2B3 4 57.14
13 A3B0 3 1 1 71.43
14 A3B1 1 14.29
15 A3B2 2 1 1 57.14
16 A3B3 4 1 1*) 85.71
Rata-rata 58.93
*)
kontaminasi bakteri
Data dari Tabel 7 menunjukkan bahwa tingkat kontaminasi paling besar terjadi pada minggu kedua setelah inisiasi, sedangkan pada minggu ketiga dan keempat, tingkat kontaminasi mulai berkurang. Hal ini sesuai dengan penelitian Gunawan (2007), yang menyatakan bahwa kontaminasi jamur mencapai puncaknya pada 11 hari setelah inisiasi sebesar 80%.
Kondisi eksplan tumih yang terkontaminasi jamur menutupi sebagian atau seluruh bagian eksplan tumih. Hal ini ditandai dengan hifa jamur yang sudah menempel baik pada bagian eksplan maupun pada media (Gambar 3).
Kondisi eksplan tumih yang terkontaminasi bakteri ditandai dengan munculnya cairan atau lendir di sekitar eksplan yang berwarna keruh dan tidak terdapat hifa jamur yang menempel pada bagian eksplan dan media. Hal ini dapat dilihat pada Gambar 4.
Gambar 4 Kondisi eksplan tumihyang terkontaminasi bakteri.
4.1.3 Persentase Pencokelatan Eksplan Tumih
Persentase pencokelatan rata-rata pada eksplan tumih setelah pengamatan selama 4 MST mencapai 18,75% seperti tertera pada Tabel 8.
Tabel 8 Persentase pencokelatan eksplan tumihselama 4 MST
No. Jenis Media
Total Pencokelatan (Eksplan) % Pencokelatan Minggu 1 Minggu 2 Minggu 3 Minggu 4
1 A0B0 0.00
2 A0B1 1 1 28.57
3 A0B2 2 28.57
4 A0B3 1 14.29
5 A1B0 1 14.29
6 A1B1 1 14.29
7 A1B2 2 28.57
8 A1B3 1 14.29
9 A2B0 1 14.29
10 A2B1 1 1 28.57
11 A2B2 0.00
12 A2B3 2 1 42.86
13 A3B0 1 14.29
14 A3B1 1 1 28.57
15 A3B2 1 14.29
16 A3B3 1 14.29
Rata-rata 18.75
mengalami pelukaan akibat pemotongan. Pencokelatan pada eksplan tumih dapat dilihat lebih jelas pada Gambar 5.
Gambar 5 Kondisi pencokelatanpada eksplan tumih.
4.2Pembahasan
Bagian dari anakan yang dikulturkan dalam penelitian ini adalah bagian pucuk yang masih menguncup. Ini dikarenakan jaringan muda yang terdapat pada bagian pucuk mudah tumbuh dan pertumbuhannya dapat dipercepat dengan menambahkan zat pengatur tumbuh (ZPT). Hal ini sesuai dengan pendapat Jayusman dan Setiawan (2006), penggunaan eksplan pucuk dalam kegiatan kultur jaringan pada dasarnya sudah tepat karena eksplan pucuk merupakan bagian jaringan muda dan mudah tumbuh (meristem) sehingga apabila ditambahkan zat pengatur tumbuh (ZPT) dengan konsentrasi yang tepat pada media tanam akan dapat mendorong pertumbuhan tunas.
ciri-ciri eksplan tumih berwarna cokelat dan 66 eksplan mengalami kontaminasi akibat serangan jamur dan bakteri. Jumlah eksplan yang terkontaminasi lebih tinggi dibandingkan eksplan yang masih bertahan hidup, yang disebabkan pada saat inisiasi, eksplan yang ditanam masih membawa kontaminan berupa jamur dan bakteri.Kontaminasi juga dapat dipengaruhi oleh bibit tumih yang diambil berasal dari alam dan kondisi tempat tumbuh yang berair. Hal ini sesuai dengan pendapat Semangun (1989), yang menyatakan bahwa pengambilan bahan tanaman pada musim hujan terjadi peningkatan kelembaban tanah dan kelebihan air yang cenderung mendukung pertumbuhan jamur maupun bakteri secara cepat pada lingkungan tumbuh tempat pengambilan tanaman.
Data dari Tabel 6 menunjukkan bahwa persentase peluang hidup yang tinggi pada perlakuan A3B1. Hal ini dipengaruhi oleh penggunaan TDZ pada konsentrasi yang rendah (0,05 ml/l) dengan BAP pada konsentrasi yang tinggi (1,5 ml/l). Konsentrasi yang optimal pada media TDZ dan BAP dapat mempengaruhi peluang hidup eksplan tumih. Pada media TDZ dan BAP juga memiliki kadar asam yang sesuai yaitu pH 5-6, hal ini juga dipengaruhi karena tumih berasal dari tanah yang memiliki kadar pH rendah. Hal ini sesuai dengan pendapat Hendaryono dan Wijayani (1994) bahwa sel-sel tanaman yang dikembangkan dengan teknik kultur jaringan memiliki toleransi pH optimal yaitu antara 5-6.
Ciri-ciri eksplan yang berhasil ditunjukkan dengan daun dan batang masih berwarna hijau, media dan eksplan tidak terserang jamur dan bakteri serta tunas yang masih berwarna hijau atau tumbuh. Hal ini sesuai dengan pendapat Anonim (2005) bahwa ciri-ciri eksplan yang berhasil dikulturkan yaitu terlihat hijau, pertumbuhan awal membentuk tunas-tunas kecil atau mata tunas yang berkembang/membesar, serta eksplan dan media tidak terkontaminasi jamur atau bakteri.
hari setelah inisiasi sebesar 80%. Menurut Darmono (2003), mikroorganisme yang terdapat dalam ruang antar sel membutuhkan waktu untuk keluar dari dalam ruang antar sel. Setelah keluar, mikroorganisme akan menginfeksi semua bagian eksplan. Kontaminasi oleh jamur dan bakteri juga dipengaruhi oleh masuknya spora jamur dan bakteri ke dalam botol kultur pada saat inisiasi serta kondisi eksplan yang kurang steril. Tingkat kontaminasi yang tinggi disebabkan oleh jamur yaitu sebesar 57,14%. Sementara itu, kontaminasi oleh bakteri tidak terlalu banyak yaitu 1,79%. Hal ini dikarenakan bibit yang diambil berasal dari lingkungan yang tergenang dan kondisi pengambilan pada saat musim hujan. Hal ini sesuai dengan pendapat Semangun (1989) menyatakan bahwa pengambilan bahan tanaman yang dilakukan pada musim hujan memiliki tingkat kontaminasi yang lebih tinggi dibandingkan pada musim kemarau.
Tingkat kontaminasi yang tinggi dalam penelitian ini sama dengan penelitian pendahuluan ulin (Eusideroxylon swagery) yang dilakukan oleh Witjaksono dan Hoesen (2003) dengan eksplan yang diambil dari lapang, yaitu memiliki tingkat kontaminasi sebesar 60% sampai 70%. Pada penelitian pendahuluan ini, perlu dilakukan karantina yang lebih intensif pada anakan tumih yang dilakukan di rumah kaca. Hal ini diharapkan dapat menekan laju pertumbuhan jamur yang dibawa pada saat inisiasi di dalam botol kultur. Hal ini sesuai dengan pendapat Jayusman dan Setiawan (2006) melaporkan bahwa pada inisiasi jenis tanaman gambut yaitu ramin (Gonystylus bancanus) menunjukkan persentase kontaminasi sebesar 33% sampai 42%. Bahan tanaman yang berasal dari cabutan anakan alam dan stek di Propinsi Riau dan Kalimantan Tengah terlebih dahulu dilakukan tahap pra-kondisi yang intensif dalam rumah kaca.
berasal dari lapangan memiliki tingkat kontaminasi yang relatif lebih tinggi, rata-rata mencapai 85% yang disebabkan oleh jamur dan bakteri.
Eksplan yang mengalami pencokelatan dipengaruhi oleh adanya senyawa fenol pada tumih yang dikeluarkan pada saat bagian pucuk tumih mengalami pelukaan akibat pemotongan. Hal ini sesuai dengan pendapat Sandra (2003) pencokelatan terjadi karena eksplan mengeluarkan senyawa fenol yang kemudian teroksidasi sehingga menghasilkan senyawa berwarna cokelat yang disebut quinon. Bagian pucuk tumih mengalami pencokelatan yang relatif cepat setelah dipotong dari tanaman induk dan saat pemotongan dalam cawan petri. Hal ini sesuai dengan pendapat Santoso dan Nursandi (2003), pencokelatan pada kultur jaringan terdiri dari pencokelatan secara mekanik yang terjadi karena proses pelukaan. Pencokelatan karena pelukaan banyak terjadi pada kultur tanaman yang banyak mengandung senyawa hidroksiphenol dan tanin.
Jenis tumih dari famili Anisophylleaceae mengandung senyawa fenolik yaitu tanin (Wiart 2006). Hal ini memungkinkan terjadi proses pencokelatan pada jenis ini baik secara enzimatis maupun secara mekanis saat pelukaan (pemotongan eksplan dari tanaman induk dan pemotongan saat di cawan petri). Kondisi pencokelatan pada eksplan tumih akan menyebabkan kematian eksplan. Hal ini dikarenakan eksplan tidak dapat menyerap nutrisi yang tersedia pada media secara maksimal sehingga secara perlahan-lahan eksplan akan mengalami kematian. Sukmadjaja dan Mariska (2003) mengemukakan oksidasi senyawa fenolik dapat menghambat dan bersifat toksik bagi pertumbuhan eksplan, serta mengakibatkan kematian eksplan.
Upaya yang dapat dilakukan untuk mengurangi resiko pencokelatan pada eksplan tumih yaitu dengan menghilangkan senyawa fenol pada eksplan tumih yang dilakukan dengan cara membilas eksplan pada air mengalir. Hal ini sesuai dengan pendapat Hendaryono dan Wijayani (1994) bahwa pembilasan eksplan secara terus-menerus pada air yang mengalir dapat mengurangi pencokelatan pada eksplan. Pada percobaan eksplan tumih cara ini belum memberikan pengaruh yang nyata untuk mengurangi pencokelatan. Cara lain yang dapat dilakukan adalah pencegahan oksidasi komponen fenolik. Menurut Witjaksono dan Hoesen (2005), vitamin C (asam askorbat dan asam sitrat) sebagai antioksidan mampu mengurangi oksidasi senyawa fenol. Hendaryono dan Wijayani (1994) mengemukakan bahwa cara lain yang dapat dilakukan untuk mengurangi tingkat pencokelatan yaitu dengan penambahan vitamin C pada medium dengan dosis yang berbeda-beda pada tiap tanaman (dosis yang umum digunakan yaitu 50 ml sampai 100 ml per 100 ml).
Proses sterilisasi eksplan pucuk tumih pada saat dibersihkan setelah dipotong dari indukan memerlukan ketelitian yang tinggi. Hal ini disebabkan batang pada eksplan tumih memiliki tekstur yang berlekuk sehingga memungkinkan adanya kontaminan masih tertinggal. Teknik yang dapat digunakan yaitu eksplan dibersihkan dengan kapas yang telah dibasahi kemudian diusapkan secara berulang pada bagian pucuk terutama bagian lekukan.
Pembersihan eksplan pucuk tumih dengan menggunakan alkohol 70% sebaiknya tidak dilakukan karena penggunaan alkohol 70% menyebabkan eksplan tumih menjadi cokelat. Hal ini sesuai dengan pendapat Widaningrum (2000) bahwa teknik sterilisasi dengan alkohol 70% pada tunas aksilar bambu tali dengan lama perendaman 7 sampai 10 menit, dapat mengakibatkan bahan eksplan mengalami dehidrasi yang kemudian diikuti pengeluaran klorofil dari jaringan sehingga jaringan eksplan berwarna cokelat.
BAB V
KESIMPULAN DAN SARAN
Kesimpulan
Bagian dari anakan yang diambil untuk dikulturkan dalam penelitian ini adalah bagian pucuk. Ini disebabkan jaringan muda pada bagian pucuk yang mudah tumbuh. Eksplan tumih yang masih bertahan hidup berjumlah 25 eksplan yang memiliki ciri-ciri daun dan batang yang masih berwarna hijau. Sedangkan 21 eksplan mengalami pencokelatan yang memiliki ciri-ciri eksplan tumih berwarna cokelat dan 66 eksplan mengalami kontaminasi akibat serangan jamur dan bakteri. Persentase rata-rata peluang hidup pada eksplan tumih mencapai 22,32%, kontaminasi oleh jamur sebesar 57,14% dan oleh bakteri sebesar 1,79% serta persentase rata-rata pencokelatan pada eksplan yaitu sebesar 18,75%. Penelitian pendahuluan yang telah dilakukan dikategorikan berhasil dengan masih bertahannya daun dan batang yang berwarna hijau sebanyak 25 eksplan. Sementara itu, untuk mengurangi kontaminan yang terdapat pada bibit yang digunakan, dilakukan karantina yang lebih intensif dalam rumah kaca yaitu dengan memberikan fungisida dan bakterisida. Hal ini dapat mengurangi tingkat kontaminasi jamur dan bakteri yang terbawa oleh eksplan.
Saran
KONSERVASI IN VITRO
JENIS TUMBUHAN GAMBUT
TUMIH (Combretocarpus rotundatus (Miq.) Danser)
VIANTI
DEPARTEMEN
KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
DAFTAR PUSTAKA
Anonim. 2005. Anda Bertanya, Pakar dan Praktisi Menjawab : Anggrek, Bunga dengan Aneka Pesona Bentuk dan Warna. Jakarta : Agromedia Pustaka.
Anwar N. 2007. Pengaruh Media Multiplikasi terhadap Pembentukan Akar pada Tunas In Vitro Nenas (Ananas comosos (L.) Merr.) cv. Smooth Cayenne di Media Perakaran [skripsi]. Bogor : Departemen Budidaya Pertanian Fakultas Pertanian Institut Pertanian Bogor.
Argent G, Saridan A, Campbell EJF, Wilkie P, Fairweather G, Hadiah JT, Middleton DJ, Pendry C, Pinard M, Warwick M, Yulita KS. 1998. Manual of The Larger and More Important Non Dipterocarp Trees of Central Kalimantan, Indonesia. Volume ke-1. Samarinda : Forest Research Institute.
Armini NM, Wattimena GA, Gunawan LW. 1991. Perbanyakan Tanaman. Di dalam : Bioteknologi Tanaman. Bogor : Pusat Antar Universitas (PAU) Institut Pertanian Bogor.
Asnawati, Wattimena GA, Machmud M, Purwito A. 2002. Studi Regenerasi dan Produksi Protoplas Mesofil Daun Beberapa Klon Tanaman Kentang (Solanum tuberosum L.). Buletin Agronomi 30 (3) : 87-91.
Boer E dan Lemmens RHMJ. 1998. Combretocarpus Hook. f. Di dalam : Plant Resources of South-East Asia No 5(3). Timber Trees: Lesser-known Timbers. Bogor : Prosea Foundation.
Conger BV. 1981. Cloning Agricultural Plants via In Vitro Technique. Florida : CRC Press Inc.
Darmono DW. 2003. Menghasilkan Anggrek Silangan. Jakarta : Penebar Swadaya.
Devilana, MR. 2005. Pengaruh Sitokinin (TDZ) dan Auksin (IAA dan NAA) terhadap Multiplikasi Nenas (Ananas comosos (L.) Merr.) cv. Queen dalam Perbanyakan Kultur Jaringan [skripsi]. Bogor : Departemen Budidaya Pertanian Fakultas Pertanian Institut Pertanian Bogor.
Gunawan LW. 1987. Teknik Kultur Jaringan. Bogor : Laboratorium Kultur Jaringan Tanaman Pusat Antar Universitas (PAU) Bioteknologi Institut Pertanian Bogor.
_____________. 1995. Teknik Kultur Jaringan In Vitro dalam Hortikultura. Jakarta : Penebar Swadaya.
Hartman HT, Kester DE, Davis-Jr FT. 1990. Plant Propagation : Principles and Practices. New Jersey : Prentice-Hall International, Inc.
Hendaryono DPS, Wijayani A. 1994. Teknik Kultur Jaringan : Pengenalan dan Petunjuk Perbanyakan Tanaman secara Vegetatif-Modern. Yogyakarta : Penerbit Kanisius.
Heyne K. 1987. Tumbuhan Berguna Indonesia III. Jakarta : Badan Litbang Kehutanan.
Hobir, Sukmadjaja D, Mariska I. 1992. Aplikasi Kultur Jaringan dalam Produksi Bibit pada Beberapa Tanaman Industri. Di dalam : Prosiding Forum Komunikasi Ilmiah Penelitian Aplikasi Bioteknologi Kultur Jaringan pada Tanaman Industri; Bogor, 29 Februari 1992. Bogor : Badan Penelitian dan Pengembangan Pertanian-Pusat Penelitian dan Pengembangan Tanaman Industri.
Huetteman CA, Preece JE. 1993. Thiadizuron : A Potent Cytokinin for Woody Plant Tissue Culture.Plant Cell, Tissue and Organ Culture 33 : 105-109.
Isnaeni N. 2008. Pengaruh TDZ terhadap Inisiasi dan Multiplikasi Kultur In Vitro Pisang Raja Bulu (Musa paradisiacal. AAB. Group) [skripsi]. Bogor : Departemen Agronomi dan Hortikultura Fakultas Pertanian Institut Pertanian Bogor.
Istomo. 2002. Kandungan Fosfor dan Kalsium serta Penyebarannya pada Tanah dan Tumbuhan Rawa Gambut, Studi Kasus di Wilayah Bagian Kesatuan Pemangkuan Hutan Bagan, Kabupaten Rokan Hilir, Riau [Disertasi]. Bogor : Program Pascasarjana Institut Pertanian Bogor.
Jayusman, Setiawan A. 2006. Inisiasi Tunas Ramin melalui Kultur Jaringan. Jurnal Penelitian Hutan Tanaman 3 (1) : 53-62.
Murdiyarso D, Rosalina U, Hairiah K, Muslihat L, Suryadiputra INN dan Jaya A. 2004. Petunjuk Lapangan: Pendugaan Cadangan Karbon pada Lahan Gambut. Proyek Climate Change, Forests and Peatlands in Indonesia. Bogor : Wetlands International–Indonesia Programme dan Wildlife Habitat Canada.
Parera DF. 1997. Pengaruh Tingkat Konsentrasi Air Kelapa terhadap Pertumbuhan dan Perbanyakan Tanaman Anggrek Dendrobium spp. melalui Teknik Kultur Jaringan. Jurnal Ilmu Pengetahuan dan Teknologi Universitas Pattimura 2 : 57-64.
Purba HI. 2009. Pengaruh Jenis Media dan Konsentrasi Picloram terhadap Induksi Embrio Somatik Manggis (Garcinia mangostana L.) [skripsi]. Bogor : Departemen Agronomi dan Hortikultura Fakultas Pertanian Institut Pertanian Bogor.
Saito H, Shibuya M, Tuah SJ, Turjaman M, Takahashi K, Jamal Y, Segah H, Putir PE, Limin SH. 2005. Initial Screening of Fast-Growing Tree Spesies being Tolerant of Dry Tropical Peatlands in Central Kalimantan, Indonesia. Journal of Forestry Research 2 (2) : 1-10.
Sandra E. 2003. Kultur Jaringan Anggrek Skala Rumah Tangga. Jakarta : AgroMedia Pustaka.
Santoso U, Nursandi F. 2003. Kultur Jaringan Tanaman. Malang : Universitas Muhammadiyah Malang Press.
Semangun H. 1989. Penyakit-penyakit Tanaman Hortikultura di Indonesia. Yogyakarta : UGM Press.
Soepadmo E, Mohamed AL, Kiew R, Lee HS, Wong KM. 1995. Tree Flora of Sabah and Sarawak. Volume ke-1. Malaysia : Forest Research Institute Malaysia.
Suminar E, Sobardini D, Murgayanti. 2007. Multiplikasi In Vitro Jeruk Keprok Garut (Citrus nobilis var. chrysocarpha) untuk Perbanyakan Bibit Bebas Penyakit secara Massal. Laporan Penelitian Peneliti Muda (LITMUD) UNPAD. Bandung : Fakultas Pertanian Universitas Padjajaran.
Suryowinoto M. 1991. Pemuliaan Tanaman secara In Vitro. Yogyakarta : Kanisius.
Wahyunto, Ritung S, Suparto, Subagyo H. 2005. Sebaran Gambut dan Kandungan Karbon di Sumatera dan Kalimantan. Proyek Climate Change, Forests and Peatlands in Indonesia. Bogor : Wetlands International Indonesia Programme-Wildlife Habitat Canada.
Wiart C. 2006. Medicinal Plant of Asia and the Pasific. http://www.drugs well.com/winow/+winowPlants%20of%20Asia%20and%22Pacific/2757842 9-Medicinal-Plants-of-Asia-and-thePacific.htm#LinkTarget_157390m [9 September 2011].
Wibisono ITC, Siboro L, Suryadiputra INN. 2005. Panduan Rehabilitasi dan Teknik Silvikultur di Lahan Gambut. Proyek Climate Change, Forest and Peatland in Indonesia. Bogor : Wetlands International Indonesia Programme-Wildlife Habitat Canada.
Widaningrum WE. 2000. Teknik Sterilisasi dalam Kultur Jaringan Eksplan Tunas Aksilar Bambu Tali (Gigantochloa apus Kurz) [skripsi]. Bogor : Departemen Manajemen Hutan Fakultas Kehutanan Institut Pertanian Bogor.
Witjaksono, Hoesen DSH. 2003. Pertumbuhan Eksplan Tunas Pucuk dan Buku Tunas Asal Kecambah Ulin secara In Vitro. Laporan Teknik Proyek Pengkajian dan Pemanfaatan Sumberdaya Hayati. Bogor : Pusat Penelitian Biologi-Lembaga Ilmu Pengetahuan Indonesia (LIPI).
______________________. 2005. Pertumbuhan Kultur Jaringan Tumbuhan Ulin (Eusideroxylon swagery) dan Ramin (Gonystylus bancanus). Laporan Teknik Teknologi Perbanyakan Tumbuhan Kayu Endemik. Bogor : Pusat Penelitian Biologi-Lembaga Ilmu Pengetahuan Indonesia (LIPI).
KONSERVASI IN VITRO
JENIS TUMBUHAN GAMBUT
TUMIH (Combretocarpus rotundatus (Miq.) Danser)
VIANTI
DEPARTEMEN
KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
RINGKASAN
VIANTI. Konservasi In Vitro Jenis Tumbuhan Gambut Tumih (Combretocarpus rotundatus (Miq.) Danser). Di bawah bimbingan EDHI SANDRA dan ISTOMO.
Tumih (Combretocarpus rotundatus (Miq.) Danser) merupakan salah satu jenis lokal yang direkomendasikan dalam kegiatan rehabilitasi lahan gambut yang terganggu. Jenis ini dapat diklasifikasikan jenis yang cepat tumbuh dan toleran terhadap kondisi kering dan terbuka sehingga cocok untuk mengawali penanaman dalam usaha rehabilitasi hutan rawa gambut. Salah satu upaya memperbanyak jenis ini untuk pelestarian plasma nutfah yaitu melalui teknik kultur jaringan. Pengembangan kultur jaringan tanaman berkayu masih menemui banyak kesulitan karena sterilisasi eksplan yang sulit, kecepatan multiplikasi sangat rendah dan keluarnya senyawa fenolik sehingga eksplan menjadi berwarna cokelat. Penelitian ini merupakan penelitian pendahuluan dalam teknik penyiapan dan sterilisasi eksplan tumih. Tujuan dari penelitian ini adalah mengidentifikasi keberhasilan dari teknik penyiapan eksplan dan sterilisasi eksplan tumih dilihat dari peluang hidup, tingkat kontaminasi dan tingkat pencokelatan (browning).
Penelitian dilakukan pada bulan Maret 2011 hingga Agustus 2011 di Laboratorium Bioteknologi Lingkungan Pusat Penelitian Lingkungan Hidup (PPLH), IPB. Bahan tanaman yang digunakan adalah pucuk tumih yang disterilisasi dengan menggunakan deterjen, HgCl2, Clorox dan dibilas dengan air
steril. Eksplan diinisiasi pada media MS dengan penambahan BAP yaitu 0 ml/l; 0,5 ml/l; 1 ml/l dan 1,5 ml/l serta TDZ yaitu 0 ml/l; 0,05 ml/l; 0,1 ml/l dan 0,5 ml/l. Penelitian ini menggunakan 16 perlakuan dan setiap perlakuan terdiri dari 7 ulangan, sehingga secara keseluruhan terdapat 112 satuan percobaan.
Berdasarkan hasil pengamatan, eksplan tumih yang masih bertahan hidup selama 4 minggu berjumlah 25 eksplan dengan ciri-ciri daun dan batang yang masih berwarna hijau, sedangkan 21 eksplan mengalami pencokelatan dengan ciri-ciri eksplan berwarna cokelat, dan 66 eksplan mengalami kontaminasi akibat serangan jamur dan bakteri. Persentase rata-rata peluang hidup pada eksplan tumih mencapai 22,32%, kontaminasi oleh jamur sebesar 57,14% dan oleh bakteri sebesar 1,79% serta persentase rata-rata pencokelatan pada eksplan yaitu sebesar 18,75%. Penelitian pendahuluan yang telah dilakukan dikategorikan berhasil dengan masih bertahannya daun dan batang yang berwarna hijau sebanyak 25 eksplan. Sementara itu, untuk mengurangi kontaminan yang terdapat pada bibit yang digunakan, dilakukan karantina yang lebih intensif dalam rumah kaca yaitu dengan memberikan fungisida dan bakterisida. Hal ini dapat mengurangi tingkat kontaminasi jamur dan bakteri yang terbawa oleh eksplan.
SUMMARY
VIANTI. In Vitro Conservation of Peatland Species Tumih (Combretocarpus rotundatus (Miq.) Danser). Under supervision of EDHI SANDRA and ISTOMO.
Tumih (Combretocarpus rotundatus (Miq.) Danser) is one of local species which is recommended for rehabilitation of disturbed peatland area. This species is classified as fast growing species and tolerant to dry and open area, thus suitable for pioneer plant of rehabilitation efforts in peat swamp forest. One of its multiplication efforts for germplasm conservation is tissue culture. Development of woody plant’s tissue culture is facing difficulties such as in explants sterilization phase, its low rate of multiplication and its phenolic compound which cause explants browning. This research was a preliminary research of explants preparation and sterilization techniques of tumih. The objective of this research was to identify the success of explants preparation and sterilization of tumih, observed from its survival rate, contamination level and browning level.
This research was carried out at March to August 2011 at Environmental Biotechnology Laboratory of Environmental Research Centre of IPB. The tip of tumih were used as explants material. Sterilization included the use of detergent, HgCl2, Clorox, and sterilized water. Those explants were then initiated in MS
media added with BAP with concentration of 0 ml/l; 0,5 ml/l; 1 ml/l and 1,5 ml/l, and TDZ with concentration of 0 ml/l; 0,05 ml/l; 0,1 ml/l and 0,5 ml/l. This research used 16 treatments with 7 repetition of each treatment, thus there are 112 experiment units.
Result showed that there were 25 explants which survived, characterized by green colour on its leaves and stems. Browning, characterized by brown colour of explants, occured on 21 explants, while fungal and bacterial contamination occured on 66 explants. The average percentage of survival explants was 22,32%, contaminated by fungi was 57,14%, contaminated by bacteria was 1,79%, and browning was 18,75%. This preliminary research were categorized into success which was indicated by green colour on the leaves and stems of its 25 survival explants. In order to decrease contaminant contained in plants source, a more intensive quarantine measure was needed. Fungicide and bactericide sprayed on to source of explants could reduce the rate of fungal and bacterial contamination carried by the explants.
KONSERVASI IN VITRO
JENIS TUMBUHAN GAMBUT
TUMIH (Combretocarpus rotundatus (Miq.) Danser)
VIANTI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan pada Departemen Konservasi Sumberdaya Hutan dan Ekowisata
Fakultas Kehutanan Institut Pertanian Bogor
DEPARTEMEN
KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi berjudul Konservasi In Vitro
Jenis Tumbuhan Gambut Tumih (Combretocarpus rotundatus (Miq.) Danser)
adalah benar-benar hasil karya saya sendiri dengan bimbingan dosen pembimbing dan belum pernah digunakan sebagai karya ilmiah pada perguruan tinggi atau lembaga manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, November 2011
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas terselesaikannya penyusunan skripsi berjudul “Konservasi In Vitro Jenis Tumbuhan Gambut Tumih (Combretocarpus rotundatus (Miq.) Danser)”
sebagai salah satu syarat memperoleh gelar Sarjana Kehutanan di bawah bimbingan Ir. Edhi Sandra, M.Si dan Dr. Ir. Istomo, MS.
Tumih merupakan salah satu jenis lokal yang direkomendasikan dalam kegiatan rehabilitasi lahan gambut yang terganggu. Salah satu upaya memperbanyak jenis ini untuk pelestarian plasma nutfah yaitu melalui teknik kultur jaringan. Penelitian ini dilakukan untuk mengidentifikasi keberhasilan dari teknik penyiapan eksplan dan sterilisasi eksplan tumih dilihat dari peluang hidup, tingkat kontaminasi dan tingkat pencokelatan (browning). Penelitian ini akan memberikan informasi sebagai acuan dalam perbanyakan tumih melalui teknik kultur jaringan dalam pelestarian plasma nutfah secara in vitro dan teknik budidaya tumih.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, baik dalam hal penyajian isi materi dan tata bahasa. Semoga skripsi ini dapat bermanfaat bagi pihak-pihak yang membutuhkan.
Bogor, November 2011
RIWAYAT HIDUP
Penulis dilahirkan di Mentok, Bangka Barat pada tanggal 30 Mei 1989 sebagai anak keenam dari enam bersaudara pasangan Bapak Y. Sutarno Hardjo Sukarto dan Ibu Maria Magdalena Sriwati. Penulis menyelesaikan pendidikan Sekolah Dasar (SD) pada tahun 2001 di SD Katolik Santa Maria Mentok, kemudian melanjutkan pendidikan di SMP Katolik Santa Maria Muntok pada tahun 2001 sampai dengan 2004. Pendidikan Sekolah Menengah Atas (SMA) diselesaikan pada tahun 2007 di SMAN 1 Muntok. Pada tahun yang sama penulis diterima sebagai mahasiswa di Institut Pertanian Bogor melalui Jalur Beasiswa Utusan Daerah (BUD) pada Departemen Konservasi Sumberdaya Hutan dan Ekowisata, Fakultas Kehutanan.
Selama menuntut ilmu di IPB, penulis aktif dalam organisasi Himpunan Mahasiswa Konservasi Sumberdaya Hutan dan Ekowisata (HIMAKOVA) sebagai anggota Kelompok Pemerhati Flora “Rafflesia” (KPF). Praktek Lapang Kehutanan yang pernah diikuti oleh penulis adalah Praktek Pengenalan Ekosistem Hutan (PPEH) di Suaka Margasatwa Gunung Sawal dan Cagar Alam Pangandaran pada tahun 2009, Praktek Pengelolaan Hutan (PPH) di Hutan Pendidikan Gunung Walat (HPGW) Sukabumi pada tahun 2010 dan Praktek Kerja Lapang Profesi (PKLP) di Taman Nasional Sebangau, Provinsi Kalimantan Tengah pada tahun 2011.
UCAPAN TERIMA KASIH
Penulis mengucapkan puji dan syukur kepada Tuhan Yang Maha Esa atas berkat dan penyertaan-Nya selama proses penyusunan skripsi ini sehingga dapat terselesaikan dengan baik. Pada kesempatan ini penulis juga mengucapkan terima kasih yang sebesar-besarnya kepada semua pihak yang telah membantu baik moril maupun materil, terutama kepada :
1. Bapak Ir. Edhi Sandra, M.Si selaku pembimbing pertama dan Bapak Dr. Ir. Istomo, MS selaku pembimbing kedua yang telah memberikan bimbingan, nasehat dan arahan selama penelitian hingga penyelesaian skripsi ini.
2. Bapak Prof. Dr. Ir. Hardjanto, MS selaku dosen penguji dan Ibu Eva Rachmawati, S.Hut, M.Si selaku ketua sidang atas masukan dalam perbaikan dan penyempurnaan skripsi ini.
3. Seluruh staf pengajar DKSHE atas ilmu pengetahuan dan bimbingan selama kuliah hingga penyelesaian skripsi.
4. Orang tua (Bapak Y. Sutarno Hardjo Sukarto dan Ibu Maria Magdalena Sriwati) dan kakak (F. Yesi, F. Yudhistira, Veronika, Yuliana Vita dan Mikael Voni) yang terus memberikan doa dan dorongan dalam menyelesaikan kuliah.
5. Pemerintah Daerah (PEMDA) Kabupaten Bangka Barat yang telah memberikan kesempatan untuk melanjutkan kuliah di IPB melalui Beasiswa Utusan Daerah serta dorongan dan bantuan dalam menyelesaikan kuliah. 6. Bapak Benny dan keluarga yang telah memberikan bantuan selama kegiatan
pengambilan bibit di Kelurahan Kereng Bangkirai, Kecamatan Sabangau, Propinsi Kalimantan Tengah.
7. Mba Yuli Fitriani, S.Hut selaku Manager Laboratorium Bioteknologi Lingkungan Pusat Penelitian Lingkungan Hidup (PPLH) IPB, Mas Rohmat dan Mba Neti yang telah memberikan bantuan, bimbingan dan dukungan selama pelaksanaan penelitian.
9. Dwi Woro Navy Probowati, Neina Febrianti, Niechi Valentino, Randhi Fauzi Kiswantara, Monica Ade Ayu Dewayani, Arry R. Rahayu, Riadi Antasa, Dzikrullah al Khaq, Agung Kriswiyanto, Ahmad Arief Hilman, Mochamad Hendri Mulyawan dan Berto D. Naibaho yang telah memberikan bantuan dan semangat selama kegiatan penelitian.
10. Dewi Puspitasari, Belinda Dwi Yunanti, Angga Prayana, Dahlan, Seruni Diah Kertawiji dan I Made Haribhawana Wijaya yang telah memberikan bantuan dalam pengambilan bibit di Kalimantan Tengah serta pengalaman selama Praktek Kerja Lapang Profesi (PKLP).
11. Teman-teman seperjuangan dari Beasiswa Utusan Daerah Bangka Barat atas dorongan dan semangat dalam menyelesaikan kuliah di IPB.
12. Teman-teman di Laboratorium Konservasi Keanekaragaman Tumbuhan yang telah memberikan bantuan dan dorongan dalam menyelesaikan skripsi. 13. Seluruh mahasiswa Departemen Konservasi Sumberdaya Hutan dan
Ekowisata angkatan 44 atas masukan dan saran serta pengalaman selama kuliah.
i
DAFTAR ISI
Halaman
DAFTAR ISI... i
DAFTAR TABEL... iii
DAFTAR GAMBAR... iv
DAFTAR LAMPIRAN... v
I. PENDAHULUAN... 1 1.1 Latar Belakang... 1.2 Tujuan Penelit ian... 1.3 Manfaat Penelit ian...
1 2 2
II. TINJAUAN PUSTAKA... 3 2.1 Ekologi Jenis Tumih... 3 2.1.1 Taksonomi………... 3 2.1.2Ciri Morfologi………... 3 2.1.3 Daerah Penyebaran dan Tempat Tumbuh...……….... 4 2.1.4 Manfaat Tumih... 4 2.2 Teknik Perbanyakan Kultur Jaringan... 5 2.2.1 Pengertian Kultur Jaringan... 5 2.2.2Prinsip Dasar Kultur Jaringan... 5 2.2.3 Manfaat Kultur Jaringan... 6 2.2.4 Faktor-faktor yang Mempengaruhi Keberhasilan Teknik
Kultur Jaringan... 6 2.2.4.1 Pemilihan Bahan Tanaman (Eksplan)... 6 2.2.4.2Sterilisasi Eksplan... 7 2.2.4.3 Faktor Lingkungan... 9 2.2.4.4 Media Kultur... 9 2.2.5 Kultur Pucuk... 11
ii 3.3.1 Persiapan Bibit Tumih... 13 3.3.2 Karantina Tanaman... 14 3.3.3 Sterilisasi... 14 3.3.4 Pembuatan Media Kultur... 16 3.3.4.1 Pembuatan Larutan Stok... 16 3.3.4.2 Pembuatan Media MS dengan Antibiotik ppm... 17 3.3.4.3 Pembuatan Media Perlakuan... 17 3.3.5 Penanaman... 18 3.3.6 Pengamatan... 18 3.4 Analisis Data... 19
IV. HASIL DAN PEMBAHASAN... 20 4.1 Hasil... 20 4.1.1 Peluang Hidup Eksplan Tumih... 20 4.1.2 Persentase Kontaminasi Eksplan... 21 4.1.3 Persentase Pencokelatan Eksplan Tumih... 23 4.2 Pembahasan... 24
V. KESIMPULAN DAN SARAN... 30 Kesimpulan... 30 Saran... 30
DAFTAR PUSTAKA... 31
iii
DAFTAR TABEL
No Halaman 1 Kisaran konsentrasi dan lama waktu perendaman bahan sterilan... 8 2 Zat pengatur tumbuh yang digunakan dalam kultur pucuk... 12 3 Komposisi masing-masing larutan stok... 16 4 Interaksi faktor jenis zat pengatur tumbuh dengan
konsentrasinya... 19 5 Data eksplan tumih yang memiliki peluang hidup hingga 4
iv
DAFTAR GAMBAR
No Halaman 1 Combretocarpus rotundatus (Miq.) Danser (A. Ranting-daun yang