Lampiran 1. Bagan Alir Proses Destruksi Kering
Herba Meniran
Ditimbang sebanyak 25 gram di atas krus Ditambahkan 5 ml HNO3 50%
Diarangkan di atas hot plate
Diabukan dalam tanur dengan temperatur awal 100◦C dan perlahan–lahan temperatur dinaikkan hingga suhu 500◦C dengan interval 25◦C setiap 5 menit
Ditambahkan 5 ml HNO3 (1:1)
Diuapkan pada hot plate sampai kering
Hasil
Dilakukan selama 10 jam dan dibiarkan hingga dingin pada desikator
Abu
Dilakukan selama 1 jam dan dibiarkan hingga dingin pada desikator
Dibersihkan
Dimasukkan kembali ke dalam tanur dengan temperatur awal 100˚C dan perlahan – lahan temperatur dinaikkan hingga suhu 500˚C dengan interval 25˚C setiap 5 menit.
Dicuci bersih dan dibilas dengan akuabides Dipotong kecil-kecil
Dibilas krus porselen sebanyak tiga kali dengan 10 ml akuabides. Dicukupkan dengan akuabides hingga garis tanda
Dimasukkan ke dalam botol Larutan sampel
Disaring dengan kertas saring Whatman No.42
Filtrat
Dibuang 5 ml filtrat pertama untuk menjenuhkan kertas saring
Dilakukan analisis kualitatif
Dilakukan analisis kuantitatif dengan Spektrofotometer Serapan Atom pada λ 422,7 nm untuk kadar kalsium, pada 766,5 nm untuk kadar kalium, dan pada λ 589,0 nm untuk kadar natrium
Lampiran 3. Data Kalibrasi Kalsium dengan Spektrofotometer Serapan Atom
No. Konsentrasi (µg/mL) (X)
Absorbansi (Y)
1. 0,0000 -0,0002
2. 0,2000 0,0109
3. 0,4000 0,0197
4. 0,6000 0,0287
5. 0,8000 0,0371
6. 1,0000 0,0459
Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r)
No. X Y XY X2 Y2
1. 0,0000 -0,0002 0,0000 0,0000 0,000000
2. 0,2000 0,0109 0,00218 0,0400 0,000118
3. 0,4000 0,0197 0,00788 0,1600 0,000388
4. 0,6000 0,0287 0,01722 0,3600 0,000827
5. 0,8000 0,0371 0,02968 0,6400 0,001376
6. 1,0000 0,0459 0,04590 1,0000 0,002107
∑ X3,0000 = 0,5000 Y = 0,02372 0,1423 0,10286 2,2000 0,004817
a =
( )
X n X n Y X XY / / 2 2∑
∑
∑
∑ ∑
− − =(
)
(
3,0000)
/6 2000 , 2 6 / ) 1423 , 0 ( 0000 , 3 10286 , 0 2 − − = 0,0453 Y = a X + b b = Y− aX= 0,02372 – (0,0453)(0,5000) = 0,00107
=
03170 , 0
03171 , 0
Lampiran 4. Data Kalibrasi Kalium dengan Spektrofotometer Serapan Atom
No. Konsentrasi (µg/mL) (X)
Absorbansi (Y)
1. 0,0000 -0,0013
2. 2,0000 0,0796
3. 4,0000 0,1643
4. 6,0000 0,2305
5. 8,0000 0,3126
6. 10,0000 0,3919
Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r)
No. X Y XY X2 Y2
1. 0,0000 -0,0013 0,0000 0,0000 0,00000
2. 2,0000 0,0796 0,1419 4,0000 0,00633
3. 4,0000 0,1643 0,6572 16,0000 0,02699
4. 6,0000 0,2305 1,3830 36,0000 0,05313
5. 8,0000 0,3126 2,5008 64,0000 0,09772
6. 10,0000 0,3919 3,9190 100,0000 0,15358 ∑ X30,0000 = 5,0000 Y1,1776 = 0,1962 8,6019 220,0000 0,33776
a =
( )
X n X n Y X XY / / 2 2∑
∑
∑
∑ ∑
− − =(
)(
)
(
30,0000)
/6 0000 , 220 6 / 1776 , 1 0000 , 30 8,6019 2 − − = 0,03871 Y = a X + b b = Y− aX= 0,1962 – (0,03871)(5,0000) = -0,0023
=
(
)(
)
(
)
{
220,0000− 30,0000 2 /6}
{
0,33776−(
1,1776)
2 /6}
−=
2,71500 71392 , 2
Lampiran 5. Data Kalibrasi Natrium dengan Spektrofotometer Serapan Atom
No. Konsentrasi (µg/mL) (X)
Absorbansi (Y)
1. 0,0000 -0,0005
2. 0,2000 0,0551
3. 0,4000 0,0992
4. 0,6000 0,1558
5. 0,8000 0,2010
6. 1,0000 0,2443
Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r)
No. X Y XY X2 Y2
1. 0,0000 -0,0005 0,00000 0,0000 0,000000
2. 0,2000 0,0551 0,01102 0,0400 0,003036
3. 0,4000 0,0992 0,03968 0,1600 0,009840
4. 0,6000 0,1558 0,09348 0,3600 0,024273
5. 0,8000 0,2010 0,16080 0,6400 0,040401
6. 1,0000 0,2443 0,24430 1,0000 0,059682
∑ X3,0000 = 0,5000 Y0,7549 = 0,1258 0,64846 2,2000 0,137232
a =
( )
X n X n Y X XY / / 2 2∑
∑
∑
∑ ∑
− − =(
)
(
3,0000)
/6 2000 , 2 6 / ) 7549 , 0 ( 0000 , 3 0,64846 2 − − = 0,3871 Y = a X + b b = Y− aX= 0,1258 – (0,3871)(0,5000) = -0,0677
=
(
)(
)
(
)
{
2,2000− 3,0000 2 /6}
{
0,137232−(
0,7549)
2 /6}
−
=
2710 , 0
2707 , 0
Lampiran 6. Hasil Analisis Kadar Kalsium, Kaliumdan Natrium padaHerbaMeniran Muda
1.Hasil analisis kadar kalsium Sampel Berat Sampel
(g) Absorbansi (A) Konsentrasi (µg/mL) Kadar (mg/100g)
1 25,0106 0,0153 0,3109 78,9471
2 25,0103 0,0157 0,3179 80,7062
3 25,0106 0,0154 0,3118 79,0503
4 25,0105 0,0158 0,3206 81,3605
5 25,0106 0,0155 0,3137 79,6020
6 25,0104 0,0158 0,3206 81,3608
2. Hasil analisis kadar kalium Sampel Berat Sampel
(g) Absorbansi (A) Konsentrasi (µg/mL) Kadar (mg/100g)
1 25,0106 0,0883 2,2328 555,3201
2 25,0103 0,0880 2,2252 553,3895
3 25,0106 0,0894 2,2610 562,4230
4 25,0105 0,0884 2,2354 555,9680
5 25,0106 0,0883 2,2328 555,3201
6 25,0104 0,0884 2,2354 555,9702
3. Hasil analisis kadar natrium
Sampel Berat Sampel (g) Absorbansi (A) Konsentrasi (µg/mL) Kadar (mg/100g)
1 25,0106 0,0419 0,1581 28,3011
2 25,0103 0,0430 0,1626 28,5854
3 25,0106 0,0415 0,1565 28,1978
4 25,0105 0,0431 0,1630 28,1979
5 25,0106 0,0428 0,1618 28,5335
Persamaan Regresi: Y= 0,0453X + 0,00107 X = 0453 , 0 00107 , 0 0152 , 0 −
= 0,3119 µg/mL
Konsentrasi Kalsium= 0,3119 µg/mL
(g) Sampel Berat n pengencera Faktor x (mL) Volume x (µg/mL) i Konsentras (µg/g) Logam
Kadar =
= g mLx mLx g 0106 , 25 ) 250 ( 25 / µ 3119 , 0
= 78,9471 µg/g = 78,9471 mg/100g 2. Contoh perhitungan kadar kalium
Berat sampel yang ditimbang = 25,0106 gram Absorbansi (Y) = 0,0829
Persamaan Regresi: Y= 0,0387X + 0,0023
X = 0387 , 0 0023 , 0 0883 , 0 −
= 2,2222 µg/ml
Lampiran 7. (lanjutan) (g) Sampel Berat n pengencera Faktor x (ml) Volume x (µg/ml) i Konsentras (µg/g) Logam
Kadar =
= g mlx mlx g 0106 , 25 ) 250 ( 25 / µ 2222 , 2
= 555,3201 µg/g = 555,3201 mg/100g
3. Contoh perhitungan kadar natrium
Berat sampel yang ditimbang = 25,0106 gram Absorbansi (Y) = 0,0419
Persamaan Regresi: Y= 0,3871X −0,0677
X = 3871 , 0 0677 , 0 0419 , 0 +
= 0,2831 µg/ml
Konsentrasi Natrium = 0,2831 µg/ml
(g) Sampel Berat n pengencera Faktor x (ml) Volume x (µg/ml) i Konsentras (µg/g) Logam
Kadar =
= g mlx mlx g 0106 , 25 ) 100 ( 25 / µ 2831 , 0
2 25,0104 0,0190 0,3793 98,9102
3 25,0105 0,0193 0,3815 100,5648
4 25,0106 0,0191 0,3760 99,4611
5 25,0101 0,0194 0,3826 101,1181
6 25,0106 0,0189 0,3727 98,3578
2. Hasil analisis kadar kalium Sampel Berat Sampel
(g)
Absorbansi (A)
Konsentrasi (µg/mL)
Kadar (mg/100g)
1 25,0105 0,1315 3,3400 1668,5498
2 25,0104 0,1340 3,4041 1700,8428
3 25,0105 0,1320 3,3529 1675,0071
4 25,0106 0,1312 3,3324 1664,6688
5 25,0101 0,1315 3,3400 1668,5765
6 25,0106 0,1309 3,3247 1660,7945
3. Hasil analisis kadar natrium
Sampel Berat Sampel (g)
Absorbansi (A)
Konsentrasi (µg/mL)
Kadar (mg/100g)
1 25,0105 0,0569 0,2192 80,4363
2 25,0104 0,0565 0,2176 80,1785
3 25,0105 0,0573 0,2209 80,6946
4 25,0106 0,0564 0,2172 80,1132
5 25,0101 0,0561 0,2160 79,9212
Lampiran 9. Contoh Perhitungan Kadar Kalsium, Kalium dan Natrium pada HerbaMeniran Tua
1. Contoh perhitungan kadar kalsium
Berat sampel yang ditimbang = 25,0105 gram Absorbansi (Y) = 0,0192
Persamaan Regresi: Y= 0,0453X + 0,00107
X = 0453 , 0 00107 , 0 0192 , 0 −
= 0,4002 µg/mL
Konsentrasi Kalsium = 0,4002 µg/mL
(g) Sampel Berat n pengencera Faktor x (mL) Volume x (µg/mL) i Konsentras (µg/g) Logam
Kadar =
= g mLx mLx g 0105 , 25 ) 250 ( 25 / 0,4002µ
= 100,0131 µg/g = 100,0131 mg/100g 2. Contoh perhitungan kadar kalium
Berat sampel yang ditimbang = 25,0105 gram Absorbansi (Y) = 0,1315
Persamaan Regresi: Y= 0,0387X + 0,0023
X = 0387 , 0 0023 , 0 1315 , 0 −
= 3,3385 µg/ml
= 1668,5498 µg/g = 1668,5498 mg/100g
3. Contoh perhitungan kadar natrium
Berat sampel yang ditimbang = 25,0105 gram Absorbansi (Y) = 0,0569
Persamaan Regresi: Y= 0,3871X −0,0677
X = 3871 , 0 0677 , 0 0569 , 0 +
= 0,3218 µg/ml
Konsentrasi Natrium = 0,3218 µg/ml
(g) Sampel Berat n pengencera Faktor x (ml) Volume x (µg/ml) i Konsentras (µg/g) Logam
Kadar =
= g mlx mlx g 0105 , 25 ) 250 ( 25 / 0,3218µ
Lampiran 10. Perhitungan Statistik Kadar Kalsium dalam Sampel 1. Perhitungan statistik kadar kadar kalsium dalam herbameniran muda
No. Xi
Kadar (mg/100g) (Xi-X) (Xi-X)
2
1. 78,9471 -1,2240 1,4981
2. 80,7062 0,5351 0,2863
3. 79,0503 -1,1208 1,2562
4. 81,3605 1,1894 1,4146
5. 79,6020 -0,5691 0,3238
6. 81,3608 1,1897 1,4153
∑ 481,0269
X= 80,1711
6,1943
SD =
( )
1 -n X -Xi 2
∑
= 1 6 6,1943 − = 1,1130Pada interval kepercayaan 99% dengan nilai α = 0.01, dk = 5 diperoleh nilai t tabel = α /2, dk = 4,0321.
Data diterima jika t hitung< t tabel.
t hitung =
n SD X Xi / −
t hitung1 =
6 / 1130 , 1 1,2240 -= 2,6936
t hitung2 =
6 / 1,1130
0,5351
= 1,1775
t hitung3 =
t hitung6 =
6 / 1,1130
1,1897
= 2,6181
Dari hasil perhitungan di atas didapat semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar kalsium dalam herbameniranmuda: µ = X ± (t (α/2, dk) x SD / √n )
= 80,1711± ( 4,0321 x 0,4544/√6) = (80,1711±1,8324) mg/100g
2. Perhitungan statistik kadar kadar kalsium dalam herbameniran tua
No. Xi
Kadar (mg/100g) (Xi-X) (Xi-X)
2
1. 100,0131 0,2755 0,0759
2. 98,9102 -0,8248 0,6803
3. 100,5648 0,8273 0,6844
4. 99,4611 -0,2764 0,0764
5. 101,1181 1,3806 1,9060
6. 98,3578 -1,3797 1,9035
∑ 598,4251
X= 99,7375
5,3265
SD =
( )
1 -n
X -Xi 2
∑
=
1 6 5,3265
Lampiran 10. (lanjutan)
Pada interval kepercayaan 99% dengan nilai α = 0.01, dk = 5 diperoleh nilai t tabel = α /2, dk = 4,0321.
Data diterima jika t hitung< t tabel.
t hitung =
n SD X Xi / −
t hitung1 =
6 / 1,0321
0,2755
= 0,6537
t hitung2 =
6 / 1,0321 0.8248 -= 1,9572
t hitung3 =
6 / 1,0321
0,8273
= 1,9632
t hitung4 =
6 / 1,0321 0,2764 -1 = 0,6559
t hitung5 =
6 / 1,0321
1,3806
= 3,2762
t hitung6 =
6 / 1,0321
1,3797
= 3,2740
Dari hasil perhitungan di atas didapat semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar kalsium dalam herbameniran tua: µ = X ± (t (α/2, dk) x SD / √n )
3. 562,4230 6,0246 36,2958
4. 555,9680 -0,4304 0,1852
5. 555,3201 -1,0783 1,1627
6. 555,9702 -0,4282 0,1833
∑ 3338,3909
X = 556,3984
48,0433
SD =
( )
1 -n X -Xi 2
∑
= 1 6 48,0433 − = 3,0997Pada interval kepercayaan 99% dengan nilai α = 0.01, dk = 5 diperoleh nilai t tabel = α /2, dk = 4,0321.
Data diterima jika t hitung< t tabel.
t hitung =
n SD X Xi / −
t hitung1 =
6 / 3,0997 1,0783 -= 0,8519
t hitung2 =
6 / 3,0997 3,0089 -= 2,3772
t hitung3 =
6 / 3,0997
6,0246
Lampiran 11. (lanjutan)
t hitung4 =
6 / 3,0997 0,4304 = 0,3400
t hitung5 =
6 / 3,0997 1,0783 = 0,8519
t hitung6 =
6 / 3,0997 0,4282 = 0,3383
Untuk itu perhitungan diulangi dengan cara yang sama tanpa mengikutsertakan data ke-3
No. Xi
Kadar (mg/100g) (Xi-X ) (Xi-X )
2
1. 555,3201 0,1265 0,0160
3. 553,3895 -1,8040 3,2544
4. 555,9680 0,7745 0,5988
5. 555,3201 0,1266 1,0002
6. 555,9702 0,7767 0,6032
∑ 2775,9679
X = 555,1935
5,4736
SD=
( )
1 -n X -Xi 2
∑
= 1 5 5,4736 − = 1,1697Pada interval kepercayaan 99% dengan nilai α = 0.01 dk = 4 diperoleh nilai t tabel = α /2, dk = 4,6041.
Data diterima jika t hitung< t tabel.
t hitung 1 =
5 / 1,1697
0,1265
t hitung 5 =
5 / 1,1697
0,1266
= 0,2420
t hitung 6 =
5 / 1,1697
0,7767
= 1,4848
Dari hasil perhitungan di atas didapat semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar Kalium dalam herbameniranmuda : µ = X ± (t (α/2, dk) x SD / √n )
= 555,1935± (4,6041 x 1,1697 / √5 ) = (555,1935±2,4085 ) mg/100g
2. Perhitungan statistik kadar kalium dalam herbamenirantua
No. Xi
Kadar (mg/100g) (Xi-X) (Xi-X)
2
1. 1668,5498 -4,5234 20,4616
2. 1700,8428 27,7695 771,4790
3. 1675,0071 1,9339 3,7399
4. 1664,6688 -8,4044 70,6339
5. 1668,5765 -4,4967 20,2203
6. 1660,7945 -12,2787 150,7664
∑ 10038,4395
X= 1673,0732
Lampiran 11. (lanjutan)
SD =
( )
1 -n X -Xi 2
∑
= 1 6 1037,3011 − = 14,4034Pada interval kepercayaan 99% dengan nilai α = 0.01, dk = 5 diperoleh nilai t tabel = α /2, dk = 4,0321.
Data diterima jika t hitung< t tabel.
t hitung =
n SD X Xi / −
t hitung1 =
6 / 14,4034 4,5234 -= 0,7691
t hitung2 =
6 / 14,4034
27,7695
= 4,7215
t hitung3 =
6 / 14,4034
1,9339
= 0,3288
t hitung4 =
6 / 14,4034 8,4044 = 1,4289
t hitung5 =
6 / 14,4034 4,4967 = 0,7645
t hitung6 =
6 / 4034 , 4 1 12,2787 = 2,0877
6. 1660,7945 -6,7248 45,2229
∑ 8337,5967
X = 1667,5193
111,5947
SD=
( )
1 -n X -Xi 2
∑
= 1 5 111,5947 − = 5,2819Pada interval kepercayaan 99% dengan nilai α = 0.01 dk = 4 diperoleh nilai t tabel = α /2, dk = 4,6041.
Data diterima jika t hitung< t tabel.
t hitung 1 =
5 / 5,2819
1,0304
= 0,4362
t hitung3 =
5 / 5,2819
7,4878
= 3,4654
t hitung 4 =
5 / 5,2819 2,8505 = 1,2748
t hitung 5 =
5 / 5,2819
1,0572
= 0,4728
t hitung 6 =
Dari hasil perhitungan di atas didapat semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar Kalium dalam herbamenirantua: µ = X ± (t (α/2, dk) x SD / √n )
3. 28,1978 -0,1593 0,0253
4. 28,1979 -0,1594 0,0253
5. 28,5335 0,1764 0,0311
6. 28,3271 -0,0300 0,0009
∑ 170,1428
X= 28,3571
0,1378
SD =
( )
1 -n X -Xi 2
∑
= 1 6 0,1378 − = 0,1660Pada interval kepercayaan 99% dengan nilai α = 0.01, dk = 5 diperoleh nilai t tabel = α /2, dk = 4,0321.
Data diterima jika t hitung< t tabel.
t hitung =
n SD X Xi / −
t hitung1 =
6 / 0,1660 0,0560 -= 0,8271
t hitung2 =
6 / 0,1660
0,2283
= 3,3722
t hitung3 =
Lampiran 12. (lanjutan)
t hitung4 =
6 / 0,1660 0,194 = 2,3545
t hitung5 =
6 / 0,1660
0,1764
= 2,6056
t hitung6 =
6 / 0,1660 0,0300 = 0,4431
Dari hasil perhitungan di atas didapat semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar natrium dalam herbameniran muda: µ = X ± (t (α/2, dk) x SD / √n )
= 28,3571± ( 4,0321 x 0,1660/√6) = (28,3571±0,2733) mg/100g
2. Perhitungan statistik kadar natrium dalam herba meniran tua
No. Xi
Kadar (mg/100g) (Xi-X) (Xi-X)
2
1. 80,4363 0,2472 0,0611
2. 80,1785 -0,0105 0,0001
3. 80,6946 0,5056 0,2556
4. 80,1132 -0,0758 0,0057
5. 79,9212 0,2678 0,0717
6. 79,7905 -0,3985 0,1588
∑ 481,1343
X= 80,1890
0,5530
SD =
( )
t hitung = n SD X Xi / −
t hitung1 =
6 / 0,3325
0,2472
= 1,8238
t hitung2 =
6 / 0,3325 0.0105 -= 0,0773
t hitung3 =
6 / 0,3325
0,5056
= 3,7258
t hitung4 =
6 / 0,3325 0,0758 = 0,5585
t hitung5 =
6 / 0,3325 0,2678 = 1,9734
t hitung6 =
6 / 0,3325 0,3985 = 2,9366
Dari hasil perhitungan di atas didapat semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar natrium dalam herbameniran muda: µ = X ± (t (α/2, dk) x SD / √n )
Lampiran 13. Pengujian Beda Nilai Rata-Rata Kadar Kalsium pada Sampel HerbaMeniran Muda dan HerbaMeniran Tua
No. Meniran Muda Meniran Tua
1. X1 = 80,1711 X2 = 99,7375
2. S1 = 1,1130 S2 = 1,0321
Dilakukan uji F dengan taraf kepercayaan 99% untuk mengetahui apakah variasi
kedua populasi sama (σ1 = σ2) atau bebeda (σ1 ≠ σ2 ).
− Ho : σ1 = σ2
H1 : σ1 ≠ σ2
− Nilai kritis F yang diperoleh dari tabel (F0,01/2 (5,5))adalah = 14,94
Daerah kritis penolakan : hanya jika Fo≥ 14,94
Fo = 2 2 2 1 S S
Fo = 2
2
1,0321 1,1130
Fo = 1,1629
− Dari hasil ini menunjukkan bahwa Ho diterima dan H1 ditolak sehingga
disimpulkan bahwa σ1 = σ2 .simpangan bakunya adalah :
Sp =
2 ) 1 ( ) 1 ( 2 1 2 2 2 2 1 1 − ++ − − n n S n S n = 2 6 6 0321 , 1 1 6 1130 , 1 1
6 2 2
t0,01/2 = ± 3,1693 untuk df = 6+6-2 = 10
− Daerah kritis penerimaan : -3,1693 ≤ to ≤ 3,1693
Daerah kritis penolakan : to< -3,1693 dan to> 3,1693
to =
(
)
2 1
2 1
/ 1 / 1
x -x
n n
s +
=
(
)
6 1 6 1 0733 , 1
99,7375
-80,1711 +
= -31,5790
Karena to = -31,5790< -3,1693 maka hipotesis ditolak. Berarti terdapat perbedaan
Lampiran 14. Pengujian Beda Nilai Rata-Rata Kadar Kalium pada SampelHerba Meniran Muda dan HerbaMeniran Tua
No. Meniran Muda Meniran Tua
1. x1 = 555,1935
2
x = 1667,5193 2. S1 = 1,1697 S2 = 5,2819
Dilakukan uji F dengan taraf kepercayaan 99% untuk mengetahui apakah variasi
kedua populasi sama (σ1 = σ2) atau bebeda (σ1 ≠ σ2 ).
− Ho : σ1 = σ2
H1 : σ1 ≠ σ2
− Nilai kritis F yang diperoleh dari tabel (F0,01/2 (4,5))adalah = 15,56
Daerah kritis penolakan: hanya jika Fo≥ 15,56.
Fo = 2 2 2 1 S S
Fo = 2 2 2819 , 5 1,1697
Fo = 0,0490
− Dari hasil ini menunjukkan bahwa Ho diterima dan H1 ditolak sehingga
disimpulkan bahwa σ1 = σ2 .simpangan bakunya adalah :
Sp =
2 1 1 2 1 2 2 2 2 1 1 − − − n + n )S (n + )S (n = 2 5 5 2819 , 5 1 5 1697 , 1 1
5 2 2
t0,01/2 = ± 3,3554 untuk df = 5+5-2 = 8
− Daerah kritis penerimaan : -3,3554 ≤ to ≤ 3,3554
Daerah kritis penolakan : to< -3,3554 dan to>3,3554
to =
(
)
2 1
2 1
/ 1 / 1
x -x
n n
s +
=
(
)
5 1 5 1 8253 , 3
1667,5193
-555,1935
+
= -459,7717
Karena to = -459,7717<-3,3554 maka hipotesis ditolak. Berarti terdapatperbedaan
Lampiran 15. Pengujian Beda Nilai Rata-Rata Kadar Natrium pada Sampel HerbaMeniran Muda dan HerbaMeniran Tua
No. Meniran Muda Meniran Tua
1. X1 = 28,3571 X2 = 80,1890
2. S1 = 0,1660 S2 = 0,3325
Dilakukan uji F dengan taraf kepercayaan 99% untuk mengetahui apakah variasi
kedua populasi sama (σ1 = σ2) atau bebeda (σ1 ≠ σ2 ).
− Ho : σ1 = σ2
H1 : σ1 ≠ σ2
− Nilai kritis F yang diperoleh dari tabel (F0,01/2 (5,5)) adalah = 14,94
Daerah kritis penolakan : hanya jika Fo≥ 14,94
Fo = 2 2 2 1 S S Fo = 2 2 3325 , 0 0,1660
Fo = 0,2492
− Dari hasil ini menunjukkan bahwa Ho diterima dan H1 ditolak sehingga
disimpulkan bahwa σ1 = σ2 .simpangan bakunya adalah :
Sp =
2 1 1 2 1 2 2 2 2 1 1 − − − n + n )S (n + )S (n = 2 6 6 0,3325 1 6 1660 , 0 1
6 2 2
t0,01/2 = ± 3,1693 untuk df = 6+6-2 = 10
− Daerah kritis penerimaan : -3,1693 ≤ to ≤ 3,1693
Daerah kritis penolakan : to< -3,1693 dan to> 3,1693
to =
(
)
2 1
2 1
/ 1 / 1
x -x
n n
s +
=
(
)
6 1 6 1 0,2627
80,1890
-28,3571 +
= -341,8990
Karena to = -341,8990< -3,1693 maka hipotesis ditolak. Berarti terdapat perbedaan
Lampiran 16. Perhitungan Batas Deteksi dan Batas Kuantitasi 1. Perhitungan batas deteksi dan batas kuantitasi logam kalsium Y = 0,0453X + 0,00107
Slope = 0,0453
No.
Konsentrasi (µg/ml)
X
Absorbansi
Y Yi Y-Yi (Y-Yi)
2
1. 0,0000 -0,0002 0,00107 -0,00127 0,0000016129 2. 0,2000 0,0109 0,01013 0,00077 0,0000005929 3. 0,4000 0,0197 0,01919 0,00051 0,0000002601 4. 0,6000 0,0287 0,02825 0,00045 0,0000002025 5. 0,8000 0,0371 0,03731 0,00021 0,0000000441 6. 1,0000 0,0459 0,04637 0,00047 0,0000002209
∑ 0,0000029334
X
SY =
(
)
2 2 − −
∑
n Yi Y = 4 34 0,00000293 = 0,0008564Batas deteksi (LOD) =
slope X SY x 3 = 0453 , 0 0008564 , 0 3 x
= 0,0567 µg /ml
Batas kuantitasi (LOQ) =
slope X SY x 10 = 0453 , 0 0008564 , 0 10 x
No. (µg/ml) X
Absorbansi
Y Yi Y-Yi (Y-Yi)
2
1. 0,0000 -0,0013 0,0023 -0,0036 0,00001296
2. 2,0000 0,0796 0,0797 -0,0001 0,00000001
3. 4,0000 0,1643 0,1571 0,0072 0,00005184
4. 6,0000 0,2305 0,2345 -0,0040 0,00001600
5. 8,0000 0,3126 0,3119 0,0007 0,00000049
6. 10,0000 0,3919 0,3893 0,0026 0,00000676
∑ 0,00008806
X
SY =
(
)
2 2 − −
∑
n Yi Y = 4 0,00008806 = 0,004692Batas deteksi (LOD) =
slope X SY x 3 = 0387 , 0 0,004692 3 x
= 0,3637µg /ml
Batas kuantitasi (LOQ) =
slope X SY x 10 = 0387 , 0 0,004692 10 x
Lampiran 16. (lanjutan)
3. Perhitungan batas deteksi dan batas kuantitasi logam natrium Y = 0,3871X - 0,0677
Slope = 0,3871
No.
Konsentrasi (µg/ml)
X
Absorbansi
Y Yi Y-Yi (Y-Yi)
2
1. 0,0000 -0,0005 -0,0677 0,0672 0,004515840 2. 0,2000 0,0551 0,00972 0,04538 0,002059344 3. 0,4000 0,0992 0,08714 0,01206 0,000145443 4. 0,6000 0,1558 0,16456 0,00876 0,000076737 5. 0,8000 0,2010 0,24198 -0,04098 0,001679360 6. 1,0000 0,2443 0,31940 -0,0751 0,005640010
∑ 0,014116734
X
SY =
(
)
2 2 − −
∑
n Yi Y = 4 4 0,01411673 = 0,059406Batas deteksi (LOD) =
slope X SY x 3 = 3871 , 0 0,059406 3 x
= 0,4604µg /ml
Batas kuantitasi (LOQ) =
1 25,0017 0,0309 0,6612 164,6135 105,56%
2 25,0018 0,0306 0,6547 162,9573 102,29%
3 25,0017 0,0307 0,6569 163,5098 104,18%
4 25,0019 0,0306 0,6547 162,9567 103,49%
5 25,0019 0,0308 0,6589 164,0603 104,87%
6 25,0017 0,0306 0,6547 162,9580 103,49%
∑ 150,0107 623,88%
X 25,0017 103,98%
2. Hasil analisis kadar kalium setelah ditambahkan larutan baku kalium
Sampel
Berat Sampel
(g)
Absorbansi (A)
Konsentrasi (µg/ml)
Kadar (mg/100g)
Persen Perolehan
Kembali
1 25,0017 0,1740 4,4292 1109,0977 98,92%
2 25,0018 0,1737 4,4216 1107,1554 98,57%
3 25,0017 0,1738 4,4241 1107,8058 98,67%
4 25,0019 0,1739 4,4266 1108,4429 98,80%
5 25,0019 0,1737 4,4216 1107,1509 98,57%
6 25,0017 0,1740 4,4292 1009,0977 98,92%
∑ 15,0051 592,45%
Lampiran 17. (lanjutan)
3. Hasil analisis kadar natrium setelah ditambahkan larutan baku natrium
Sampel
Berat Sampel
(g)
Absorbansi (A)
Konsentrasi (µg/ml)
Kadar (mg/100g)
Persen Perolehan
Kembali
1 25,0017 0,1466 0,5847 55,3566 96,43%
2 25,0018 0,1469 0,5859 55,4338 96,71%
3 25,0017 0,1468 0,5855 55,4082 96,61%
4 25,0019 0,1469 0,5859 55,4336 96,71%
5 25,0019 0,1466 0,5847 55,3561 96,43%
6 25,0017 0,1467 0,5851 55,3824 96,52%
∑ 15,0051 579,41%
0453 , 0
Konsentrasi setelah ditambahkan larutan baku = 0,6585 µg/ml
CF = volume(ml) x Faktor pengenceran
sampel Berat ) / i(µ Konsentras × ml g 250 x 25ml g 25,0017 / 0,6585µ ×
= g ml
= 164,6135 µg/g = 164,6135 mg/100g
Kadar sampel setelah ditambah larutan baku (CF) = 164,6135 mg/100g
Kadar rata-rata sampel sebelum ditambah larutan baku (CA) = 80,1711 mg/100g
(untuk penambahan baku dinaikkan 10%) = 80,1711 mg/ 100 g x 10 g/100 ml = 80,1711µg /ml
Jumlah (ml) baku yang ditambahkan = 80,1711 µg /ml x 25,0017 g 1000 µg /ml = 2,0179 ml digenapkan menjadi 2 ml Berat sampel rata-rata uji recovery =25,0017 g
Kadar larutan standar yang ditambahkan (C*A)
C*A = mlyangditambahkan
rata -rata sampel Berat n ditambahka yang logam i Konsentras × = g ml g 0017 , 25 / µ 1000
Lampiran 18. (lanjutan)
CF- CA
C*A = g mg g mg 100 / 79,9945 100 / ) 1711 , 80 6135 , 164 ( − x 100%
= 105,56 %
2. Contoh perhitungan uji perolehan kembali kadar kalium Persamaan regresi : Y = 0,0387X + 0,0023
ml g
X 4,4366µ /
0387 , 0 0023 , 0 1740 , 0 = + =
Konsentrasi setelah ditambahkan larutan baku = 4,4366 µg/ml
CF = volume(ml) x Faktor pengenceran
sampel Berat ) / i(µ Konsentras × ml g 250 x 25ml g 25,0017 / 4,4366µ ×
= g ml
= 1109,0977 µg/g = 1109,0977mg/100g
Kadar sampel setelah ditambah larutan baku (CF) = 1109,0977 mg/100g
Kadar rata-rata sampel sebelum ditambah larutan baku (CA) = 555,1935 mg/100g
(untuk penambahan baku dinaikkan 10%) = 555,1935 mg/100 g x 10 g/ 100 ml = 555,1935µg /ml
Jumlah (ml) baku yang ditambahkan = 555,1935µg /ml x 25,0017 g 1000µg /ml = 13,8807 ml digenapkan menjadi 14 ml Berat sampel rata-rata uji recovery = 25,0017g
=
g 0017 ,
25 x 14ml
= 559,9619µg/g = 559,9619 mg/100g
CF- CA
C*A = g mg g mg 100 / 559,9619 100 / ) 1935 , 555 0977 , 1109 ( − x100%
= 98,92 %
3. Contoh perhitungan uji perolehan kembali kadar natrium Persamaan regresi : Y = 0,3871X - 0,0677
ml g
X 0,5536µ /
3871 , 0 0677 , 0 1466 , 0 = + =
Konsentrasi setelah ditambahkan larutan baku = 0,5536 µg/ml
CF = volume(ml) x Faktor pengenceran
sampel Berat ) / i(µ Konsentras × ml g 100 x 25ml g 25,0017 / 0,5536µ ×
= g ml
= 55,3566 µg/g = 55,3566 mg/100g
Kadar sampel setelah ditambah larutan baku (CF) = 55,3566 mg/100g
Lampiran 18. (lanjutan)
Kadar rata-rata sampel sebelum ditambah larutan baku (CA) = 28,3571 mg/100g
(untuk penambahan baku dinaikkan 10%) = 28,3571 mg/100g x 10 g/ 100 ml = 28,3571µg /ml
Jumlah (ml) baku yang ditambahkan = 28,3571µg /ml x 25,0017 g 1000µg /ml = 0,7089 ml digenapkan menjadi 0,7 ml Berat sampel rata-rata uji recovery = 25,0017 g
Kadar larutan standar yang ditambahkan (C*A)
C*A = mlyangditambahkan
rata -rata sampel Berat n ditambahka yang logam i Konsentras × = g ml g 0017 , 25 / µ 1000
x 0,7 ml
= 27,9981 µg/g = 27,9981mg/100g
CF- CA
C*A = g mg g mg 100 / 27,9981 100 / ) 3571 , 38 3566 , 55 ( − x 100% = 96,43%
2. 102,29 -1,69 2,8561
3. 104,18 0,20 0,0400
4. 103,49 -0,49 0,2401
5. 104,87 0,89 0,7921
6. 103,49 -0.49 0,2401
∑ 623,88 6,6648
X 103,98 1,1108
SD =
( )
1 -n
X -Xi 2
∑
=
1 6 6,6648
−
= 1,1545
RSD = x
X SD
_ 100%
= 100%
103,98 1,1545
x
Lampiran 19. (lanjutan)
2. Perhitungan simpangan baku relatif (rsd) kadarkalium
No. % Perolehan Kembali
(Xi) (Xi-X) (Xi-X)
2
1. 98,92 0,18 0,0324
2. 98,57 -0,17 0,0289
3. 98,67 -0,07 0,00499
4. 98,80 0,06 0,0036
5. 98,57 -0,17 0,0289
6. 98,92 0,18 0,0324
∑ 592,45 0,1311
X 98,74 0,0218
SD =
( )
1 -n
X -Xi 2
∑
=
1 6 0,1311
−
= 0,1619
RSD = x
X SD
_ 100%
= 100%
74 , 98 0,1619
x
3. 96,61 0,04 0,0016
4. 96,71 0,14 0,0196
5. 96,43 -0,14 0,0196
6. 96,52 -0,05 0,0025
∑ 579,41 0,0825
X 96,57 0,0137
SD =
( )
1 -n
X -Xi 2
∑
=
1 6 0,0825
−
= 0,1284
RSD = x
X SD
_ 100%
= 100%
57 , 96 0,1284
x
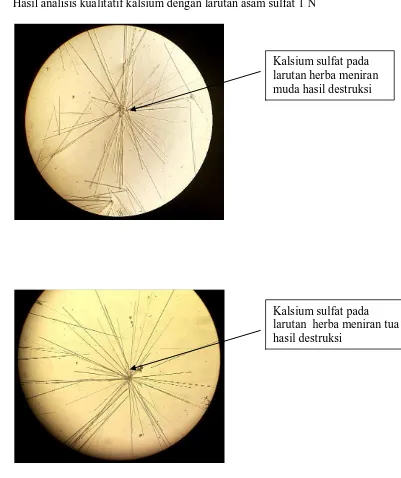
Gambar 3. Gambar kristal kalsium sulfat (perbesaran 10x40)
muda hasil destruksi
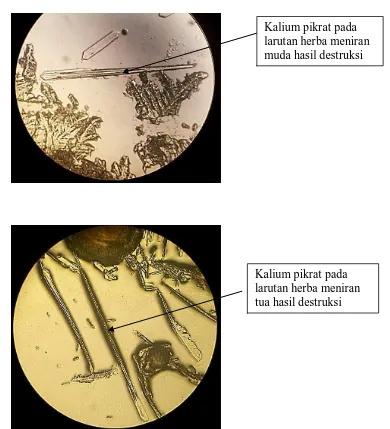
2. Hasil analisis kualitatif kalium dengan larutan asam pikrat 1% b/v
Gambar 4. Gambar kristalkalium pikrat (perbesaran 10x40)
Kalium pikrat pada larutan herba meniran muda hasil destruksi
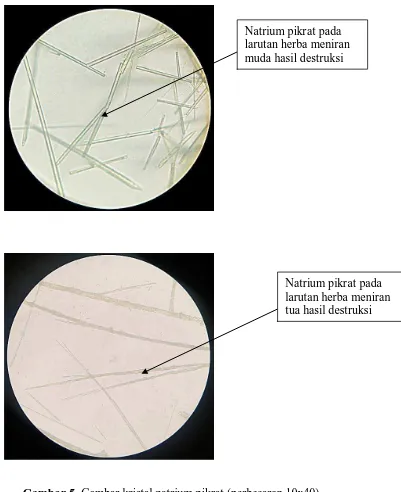
Gambar 5. Gambar kristal natrium pikrat (perbesaran 10x40)
Lampiran 23. Gambar Alat Spektrofotometer Serapan Atom dan Tanur
Gambar 1.. Atomic Absorption Spectrophotometer Hitachi Z-2000
[image:51.595.148.481.427.678.2]Anonim. (2014). Makalah Meniran. Diakses 20Agustus 2014.
www.vnezz.blogspot.com/2012/04/07/contoh-makalah-meniran.html Bassett, J., Denney, R. C., Jeffery, G. H., dan Mendham, J. (1994). Vogel’s
Textbook of Quantitative Inorganic Analysis Including Elementary Instrumental Analysis. Penerjemah: Hadiyana Pudjaatmaka dan L.Setiono. (1994). Buku Ajar Vogel Kimia Analisis Kuantitatif Anorganik.Edisi Keempat. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 557-559.
Budiarto, E. (2004). Metodologi Penelitian Kedokteran. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 46.
Budiyanto, M. A. K. (2001). Dasar-Dasar Ilmu Gizi. Edisi Kedua. Cetakan I.Malang: UMM-Press. Hal. 59.
Ditjen POM. (1979). Farmakope Indonesia. Edisi III.Jakarta: Departemen Kesehatan RI. Hal. 744.
Ditjen POM. (1994). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan RI. Hal. 1126, 1213.
Ermer, J., dan Miller, J. H. McB. (2005). Method Validation in Pharmaceutical Analysis. Weinheim: Wiley-Vch Verlag GmbH & Co. KGaA. Hal. 171. Focht, L. C. (1988). Metals in Plants and Pet Foods Atomic Absorption
Spectrophotometric Method. Dalam: Official Methods of the Association of Official Analytical Chemist. Horwitz, W. (2000). Volume I. Edisi Ketujuhbelas. Arlington: AOAC International. Hal. 4.
Gandjar, I. G., dan Rohman, A. (2007). Kimia Farmasi Analisis. Cetakan IV. Yogyakarta: Pustaka Pelajar. Hal. 298, 305-312, 319.
Horne, M. M., dan Swearingen, P. L. (1993).Pocket Guide to Fluid, Electrolytes, and Acid-Base Balance. Edisi Kedua. Cetakan I. Penerjemah: Indah dan Monika. (1995). Keseimbangan Cairan, Elektrolit, dan Asam-Basa. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 91.
Isaac, R.A. (1990). Metals in Plants Atomic Absorption Spectrophotometric Method. Dalam:Official Methods of the Association of Official Analytical Chemist. Helrich, K. Edisi Kelimabelas. Virginia: AOAC International. Hal. 42.
Kardinan, A., dan Kusuma, F. R. (2004). Meniran Penambah Daya Tahan Tubuh Alami. Jakarta: Agromedia Utama. Hal. 6-14.
Khopkar, S. M. (1985). Basic Concepts of Analytical Chemistry. Penerjemah: A. Saptorahardjo. (2008). Konsep Dasar Kimia Analitik. Jakarta: UI-Press. Hal. 283, 298.
Rivai, H., Nurdin, H., Suyani, H., dan Bakhtiar, A. (2011). Pengaruh Cara Pengeringan terhadap Mutu Herba Meniran (Phyllanthus niruri LINN.). Majalah Farmasi Indonesia (22)1. Diakses 01Juni 2014. http://dosen.narotama.ac.id/wp-content/uploads/2012/02/Pengaruh-cara-pengeringan-terhadap-mutu-herba-meniran.pdf
Rosmarkam, E., dan Yuwono, N. W. (2002). Ilmu Kesuburan Tanah.Edisi Keempat. Yogyakarta: Penerbit Kanisius. Hal. 205-206.
Shargel, L., dan Andrew, B. C. (1999). Applied Biopharmaceutics and Pharmacokinetics. New York: Prentice-Hall International, Inc. Hal. 15. Sudjana. (2005). Metode Statistika. Edisi VI. Bandung: Tarsito. Hal. 93, 168, 239. Suhardjo., dan Kusharto, C. M. (1992). Prinsip-prinsip Ilmu Gizi. Yogyakarta:
Penerbit Kanisius. Hal. 77.
Thomas, A.N.S. (1992). Tanaman Obat Tradisional. Cetakan XV. Volume 2 Yogyakarta: Penerbit Kanisius. Hal. 81-82.
Trihardjana. (2007). Kajian Potensi Diuretika dari Beberapa Jenis Tanaman di Sekitar Rumah. Diakses 03 Juni 2014.
http://staff.uny.ac.id/sites/default/files/131782835/deuritik%20tanaman 20sekitar%20rumah.pdf
Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara Medan pada bulan Februari 2014 - Juni 2014.
3.2 Bahan–Bahan 3.2.1 Sampel
Sampel yang digunakan dalam penelitian ini adalah herbameniran muda dan herbameniran tua yang diperoleh secara purposif di desa Pematang Johar Martubung Kecamatan Medan Labuhan Sumatera Utara.
3.2.2 Pereaksi
Bahan-bahan yang digunakan dalam penelitian ini berkualitas pro analisis keluaran E. Merck yaituakuabides (Laboratorium Penelitian Fakultas Farmasi USU), asam nitrat 65% b/v, asam pikrat 1% b/v, asam sulfat 96% v/v, etanol 96% v/v, larutan baku kalium 1000 µg/mL, larutan baku kalsium 1000 µg/mL dan larutan baku natrium 1000 µg/mL.
3.3 Alat–Alat
spatula, tanur (Nabertherm) dan spektrofotometer serapan atom Hitachi Z-2000 lengkap dengan lampu katoda kalsium, kalium dan natrium.
3.4 Identifikasi Sampel
Identifikasi sampel dilakukan oleh bagian Herbarium Bogoriense Bidang Botani Pusat Penelitian Biologi-LIPI Bogor.
3.5 Pembuatan Pereaksi 3.5.1 Larutan HNO350% b/v
Sebanyak 500 mL larutan asam nitrat65% b/v diencerkan dengan 500 mL akuabides (Isaac, 1988).
3.5.2 Larutan H2SO4 1 N
Sebanyak 3 mL larutan asam sulfat 96% v/v diencerkan dengan akubides hingga 100 mL (Ditjen POM, 1979).
3.5.3Larutan asam pikrat 1% b/v
Sebanyak 1 gram asam pikrat dilarutkan dalam akuabides hingga 100 mL(Ditjen POM, 1979).
3.6 Prosedur Penelitian 3.6.1 Pengambilan Sampel
3.6.3 Proses DestruksiKering
Sampel yang telah dihaluskan ditimbang seksama sebanyak 25 gram dalam krus porselen, ditambahkan 5 mL HNO3 50%, diarangkan di atas hot
plate,lalu diabukan dalam tanur dengan temperatur awal 100℃ dan perlahan– lahan temperatur dinaikkan hingga suhu 500℃ dengan interval 25℃ setiap 5 menit. Setelah dilakukan pengabuan selama 10 jam, suhu tanur diturunkan, pada±27℃ krus porselen dikeluarkan dan dibiarkan hingga dingin pada desikator. Abu ditambahkan 5 mLHNO3 50%, kemudian diuapkan pada hot plate sampai
kering. Krus porselen dimasukkan kembali ke dalam tanur dengan temperatur awal 100℃ dan perlahan-lahan temperatur dinaikkan hingga suhu 500℃ dengan interval 25℃ setiap 5 menit. Pengabuan dilakukan selama 1 jam dan dibiarkan hingga dingin pada desikator (Focht, 1988). Bagan alir proses dekstruksi kering dapat dilihat pada Lampiran 1, halaman 43.
3.6.4 Pembuatan Larutan Sampel
Sampel hasil destruksi dilarutkan dalam 5 mL HNO350%, lalu
selanjutnya ditampung ke dalam botol (Horwitz, 2000). Larutan ini digunakan untuk analisis kualitatif dan kuantitatif terhadap logam kalsium, kalium dan natrium yang terkandung di dalamnya.Sebelum dilakukan analisis kuantitatif dengan spektrofotometer serapan atom, terlebih dahulu dilakukan analisis kualitatif. Bagan alir pembuatan larutan sampel dapat dilihat pada Lampiran 2, halaman 44.
3.6.5 Analisis Kualitatif 3.6.5.1 Kalsium
Uji nyala
Dibersihkan kawat Ni/Cr dengan HCl pekat lalu dipijar pada api bunsen sampai tidak memberikan warna khusus pada nyala bunsen. Kemudian dicelupkan kawat ke dalamlarutan hasil destruksi lalu dipijar pada api bunsen, amati warna yang terjadi pada nyala bunsen. Jika terdapat kalsium akan terbentuk warna merah bata pada nyala tersebut (Vogel,1979).
Uji kristal kalsium dengan asam sulfat 1N
Larutan sampel hasil destruksi sebanyak 1-2 tetes diteteskan pada object glass kemudian ditetesi dengan larutan asam sulfat 1N dan etanol 96% v/v akan terbentuk endapan putih lalu diamati di bawah mikroskop. Jika terdapat kalsium akan terlihat kristal berbentuk jarum (Vogel, 1979).
3.6.5.2 Kalium Uji nyala
Jika terdapat kalium, akan terlihat kristal berbentuk jarum–jarum besar (Vogel, 1979).
3.6.5.3 Natrium Uji Nyala
Dibersihkan kawat Ni/Cr dengan HCl pekat lalu dipijar pada api bunsen sampai tidak memberikan warna khusus pada nyala bunsen. Kemudian dicelupkan kawat ke dalamlarutan hasil destruksi dipijar pada api bunsen, amati warna yang terjadi pada nyala bunsen.. Jika terdapat natrium, akan dihasilkan nyala kuning pada nyala tersebut (Vogel, 1979).
Uji kristal natrium dengan asam pikrat
Larutan zat diteteskan 1-2 tetes pada object glass kemudian ditetesi dengan larutan asam pikrat, dibiarkan ± 5 menit lalu diamati di bawah mikroskop. Jika terdapat natrium, akan terlihat kristal berbentuk jarum halus tersusun di pinggir (Vogel, 1979).
3.6.6Analisis Kuantitatif 3.6.6.1 Kalsium
Pembuatan larutan induk bakukalsium
hingga garis tanda. Diperoleh konsentrasi kalsium pada Larutan Induk Baku (LIB) I adalah 10 µg/mL.
Pembuatan kurva kalibrasi kalsium
Dari LIB I dipipet masing-masing 1,0 mL; 2,0 mL; 3,0 mL; 4,0 mL; dan 5,0 mL dimasukkan ke dalam labu tentukur 50 mL dan diencerkan dengan akuabides hingga garis tanda sehingga diperoleh larutan dengan konsentrasi 0,2 µg/mL; 0,4 µg/mL; 0,6 µg/mL; 0,8 µg/mL; dan 1,0 µg/mL, lalu dilakukan pengukuran pada panjang gelombang 422,7 nm dengan tipe nyala udara-asetilen. Penetapan kadar kalsium dalam sampel
Larutan sampel herba meniran muda dan herba meniran tua hasil destruksi dipipet sebanyak 0,2 mL dimasukkan ke dalam labu tentukur 50 mL dan dicukupkan dengan akuabides hingga garis tanda (Faktor pengenceran = 50/0,2 = 250 kali). Lalu diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada panjang gelombang 422,7 nm dengan tipe nyala udara-asetilen.Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku kalsium. Konsentrasi kalsium dalam sampel dihitung berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.6.6.2 Kalium
Pembuatan larutan induk bakukalium
panjang gelombang 766,5 nm dengan tipe nyala udara-asetilen. Penetapan kadar kalium dalam sampel
Larutan sampel herbameniran muda hasil dekstruksi dipipet sebanyak 0,2 mL dimasukkan ke dalam labu tentukur 50 mL dan diencerkan dengan akuabides hingga garis tanda (Faktor pengenceran = 50/0,2 = 250 kali) dan larutan sampel herbameniran tua hasil destruksi dipipet sebanyak 0,1 mL dimasukkan ke dalam labu tentukur 50 mL dan diencerkan dengan akuabides hingga garis tanda (Faktor pengenceran = 50/0,1 = 500 kali). Larutan diukur absorbansinya dengan spektrofotometer serapan atom pada panjang gelombang 766,5 nm dengan tipe nyala udara-asetilen. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku kalium. Konsentrasi kalium dalam sampel dihitung berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.6.6.3 Natrium
Pembuatan larutan induk bakunatrium
Pembuatan kurva kalibrasi natrium
Dari LIB I dipipet masing-masing 0,5 mL; 1,0 mL; 1,5 mL; 2,0 mL; dan 2,5 mL dimasukkan ke dalam labu tentukur 25 mL dan diencerkan dengan akuabides hingga garis tanda sehingga diperoleh larutan dengan konsentrasi 0,2 µg/mL; 0,4 µg/mL; 0,6 µg/mL; 0,8 µg/mL; dan 1 µg/mL, lalu dilakukan pengukuran pada panjang gelombang 589,0 nm dengan tipe nyala udara-asetilen. Penetapan kadar natrium dalam sampel
Larutan sampel herbameniran muda hasil dekstruksi dipipet sebanyak 0,5 mL dimasukkan ke dalam labu tentukur 50 mL dan diencerkan dengan akuabides hingga garis tanda (faktor pengenceran = 50/0,5 = 100 kali) dan larutan sampel herba menirantua hasil dekstruksi dipipet sebanyak 0,2 mL dimasukkan ke dalam labu tentukur 50 mL dan diencerkan dengan akuabides hingga garis tanda (faktor pengenceran = 50/0,2 = 250 kali). Larutan diukur absorbansinya dengan spektrofotometer serapan atom pada panjang gelombang 589,0 nm dengan tipe nyala udara-asetilen. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku natrium. Konsentrasi natrium dalam sampel dihitung berdasarkan persamaan garis regresi dari kurva kalibrasi.
Menurut Gandjar dan Rohman (2007), kadar logam kalsium, kalium dan natrium dalam sampel dapat dihitung dengan cara sebagai berikut:
(g) Sampel Berat
n pengencera Faktor
x (mL) Volume x
(µg/mL) i
Konsentras (µg/g)
Logam
berikut:
SD =
( )
1 -n
X -Xi 2
∑
Keterangan : Xi = Kadar sampel
−
X = Kadar rata-rata sampel n = Jumlah perlakuan
Untuk mencari t hitung digunakan rumus:t hitung =
n SD
X Xi
/
−
dan untuk menentukan kadar mineral di dalam sampel dengan interval kepercayaan 99%, α = 0.01, dk = n-1, dapat digunakan rumus:
Kadar Mineral : µ = X ± (t(α/2, dk) x SD / √n ) Keterangan : X − = Kadar rata-rata sampel
SD = Standar Deviasi dk = Derajat kebebasan (dk = n-1)
3.6.7.2 Pengujian Beda Nilai Rata-Rata Antar Sampel
Menurut Ermer dan Miller (2005), sampel yang dibandingkan adalah independen dan jumlah pengamatan masing-masing lebih kecil dari 30 dan variansi (σ) tidak diketahui sehingga dilakukan uji F untuk mengetahui apakah variansi kedua populasi sama (σ1 = σ2)atau berbeda (σ1 ≠ σ2) dengan
menggunakan rumus sebagai berikut:
Fo = 2
2 2 1 S S
Keterangan : Fo = Beda nilai yang dihitung
S1 = Standar deviasi terbesar
S2= Standar deviasi terkecil
Apabila dari hasilnya diperoleh Fo tidak melewati nilai kritis F maka
dilanjutkan uji dengan distribusi t dengan rumus: (X1 – X2)
t
o=
Sp √1/n1 + 1/n2
Keterangan : X1 = kadar rata-rata sampel 1 n 1 = Jumlah perlakuan sampel 1
X2 = kadar rata-rata sampel 2 n 2 = Jumlah perlakuan sampel 2
Sp = Simpangan baku
jika Fo melewati nilai kritis F, dilanjutkan uji dengan distribusi t dengan rumus :
(X1 – X2)
to =
√S12/n1 + S22/n2
Batas deteksi merupakan jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan. Sedangkan batas kuantitasi merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama.
Menurut Harmita (2004), batas deteksi dan batas kuantitasi ini dapat dihitung dengan rumus sebagai berikut:
Simpangan Baku ( X
SY ) =
(
)
2 2
− −
∑
n Yi Y
Batas deteksi (LOD) =
slope X SY x
3
Batas kuantitasi (LOQ) =
slope X SY x
10
3.6.9 Uji Perolehan Kembali (Recovery)
(konsentrasi 1000 µg/mL), 14 mL larutan baku kalium (konsentrasi 1000 µg/mL) dan 0,7 mL larutan baku natrium (konsentrasi 1000 µg/mL).
Herbameniranmuda yang telah dihaluskan ditimbang secara seksama sebanyak 25 gram di dalam krus porselen, lalu ditambahkan 2 mL larutan baku kalsium (konsentrasi 1000 µg/mL), 14 mL larutan baku kalium (konsentrasi 1000 µg/mL) dan 0,7 mL larutan baku natrium (konsentrasi 1000 µg/mL), kemudian dilanjutkan dengan prosedur destruksi kering seperti yang telah dilakukan sebelumnya.
Menurut Harmita (2004),persen perolehan kembali dapat dihitung dengan rumus di bawah ini:
CF- CA
Keterangan :
CA = Kadar logam dalam sampel sebelum penambahan baku
CF = Kadar logam dalam sampel setelah penambahan baku
C*A = Kadar larutan baku yang ditambahkan
3.6.10 Simpangan Baku Relatif
Menurut Harmita (2004), keseksamaan atau presisi diukur sebagai simpangan baku relatif atau koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang memenuhi persyaratan menunjukkan adanya keseksamaan metode yang dilakukan.Menurut Harmita (2004),adapun rumus untuk menghitung simpangan baku relatif adalah:
C*A
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Sampel
Hasil identifikasi sampel yang dilakukan oleh bagian Herbarium Bogoriense Bidang Botani Pusat Penelitian Biologi LIPI-Bogor terhadap herba meniran adalah jenis Phyllanthus urinaria L. suku Phyllanthaceae. Hasil identifikasi sampel dapat dilihat pada Lampiran 20, halaman87.
4.2 Analisis Kualitatif
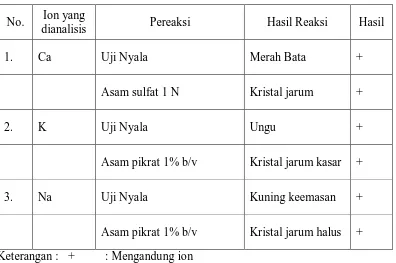
Analisis kualitatif dilakukan sebagai analisis pendahuluan untuk mengetahui ada atau tidaknya ion-ionkalsium, kaliumdan natrium dalam sampel. Data dapat dilihat pada Tabel 1 dan Lampiran 22, halaman 90.
Tabel1.Hasil analisis kualitatif pada sampel herbameniran mudayang telah didestruksi
No. Ion yang
dianalisis Pereaksi Hasil Reaksi Hasil
1. Ca Uji Nyala Merah Bata +
Asam sulfat 1 N Kristal jarum +
2. K Uji Nyala Ungu +
Asam pikrat 1% b/v Kristal jarum kasar +
3. Na Uji Nyala Kuning keemasan +
Asam sulfat 1 N Kristal jarum +
2. K Uji Nyala Ungu +
Asam pikrat 1% b/v Kristal jarum kasar +
3. Na Uji Nyala Kuning keemasan +
Asam pikrat 1% b/v Kristal jarum halus + Keterangan : + : Mengandung ion
Tabel 1 dan 2di atas menunjukkan bahwa larutan sampel yang diperiksa mengandung ion kalsium, kalium, dan natrium. Sampel positif mengandung ion kalsium karena menghasilkan endapan putih CaSO4 berbentuk kristal jarum
[image:70.595.116.512.136.399.2]4.3 Analisis Kuantitatif
4.3.1 Kurva Kalibrasi Kalsium, Kaliumdan Natrium
[image:71.595.116.510.260.513.2]Kurva kalibrasi kalsium, kaliumdan natrium diperoleh dengan cara mengukur absorbansi dari larutan baku ketiganya pada panjang gelombang masing-masing.
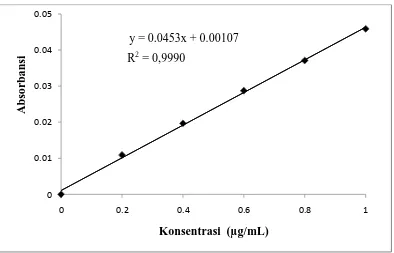
Gambar 1. Kurva kalibrasi kalsium y = 0.0453x + 0.00107
0 0.01 0.02 0.03 0.04 0.05
0 0.2 0.4 0.6 0.8 1
A
bs
or
ban
si
Gambar 2. Kurva kalibrasi kalium
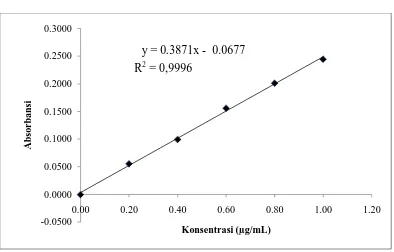
Gambar 3. Kurva kalibrasi natrium
Dari gambar 1, 2, dan 3 diperoleh diperoleh persamaan garis regresi yaitu Y = 0,0453X + 0,00107 untuk kalsium, Y = 0,0387X + 0,0023 untuk kalium dan
0 0.1
0 2 4 6 8 10
A
Konsentrasi (µg/mL)
y = 0.3871x - 0.0677
-0.0500 0.0000 0.0500 0.1000 0.1500 0.2000 0.2500 0.3000
0.00 0.20 0.40 0.60 0.80 1.00 1.20
Abso
r
ban
si
Konsentrasi (µg/mL)
[image:72.595.115.509.404.656.2]Y = 0,3871X - 0,0677 untuk natrium.Berdasarkan gambar di atas diperoleh hubungan yang linear antara konsentrasi dengan absorbansi, dengan koefisien korelasi (r) kalsium sebesar 0,9990, kalium sebesar 0,9996 dan natrium sebesar 0,9991. Nilai r ≥ 0,95 menunjukkan adanya korelasi linier yang menyatakan adanya hubungan antara X (Konsentrasi) dan Y (Absorbansi) (Shargel dan Andrew, 1999). Data hasil pengukuran absorbansi larutan baku kalsium, kaliumdan natriumdan perhitungan persamaan garis regresi dapat dilihat pada Lampiran 3sampai dengan Lampiran 5,halaman 45 sampai halaman 50.
4.3.2 Analisis Kadar Kalsium, Kalium dan Natrium pada HerbaMeniran Muda dan HerbaMeniran Tua
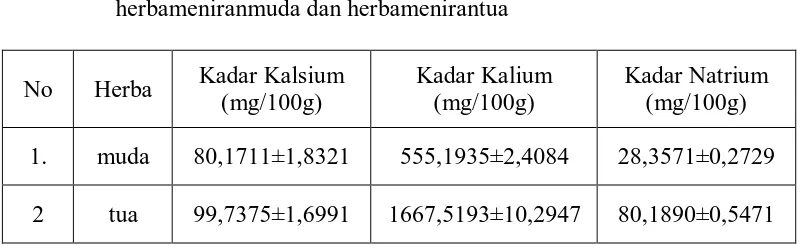
herbameniranmuda dan herbamenirantua
No Herba Kadar Kalsium (mg/100g)
Kadar Kalium (mg/100g)
Kadar Natrium (mg/100g) 1. muda 80,1711±1,8321 555,1935±2,4084 28,3571±0,2729
2 tua 99,7375±1,6991 1667,5193±10,2947 80,1890±0,5471
Data yang ditunjukkan tabel 3 di atas diuji kembali secara statistik untuk mengetahui beda nilai kadar rata-rata ketiga mineral pada sampel dengan kadar rata-rata mineral antar kedua sampel (Perhitungan dapat dilihat pada Lampiran 13 sampai dengan Lampiran 15,halaman 69 sampai halaman 74). Hasil perhitungan uji statistik dapat dilihat pada Tabel 4 berikut ini.
Tabel 4. Hasil Uji Beda nilai rata-rata kadar kalsium, kalium dan natrium antar sampel
No. Kadar Herba t hitung t table Hasil
1. Kalsium Muda -31,5790 3,1693 Beda
Tua 2. Kalium
Muda
-459,7717 3,3554 Beda
Tua
3. Natrium
Muda
341,8990 3,1693 Beda
[image:74.595.112.513.226.350.2]Berdasarkan Tabel 4 di atas dapat diketahui bahwa kadar kalsium, kalium, dan natrium pada herbameniranmuda lebih kecil dibandingkan dengan kadar kalsium, kalium, dan natriumpada herbameniran tua. Hal ini disebabkan karena kadar hara dalam tanaman bekorelasi dengan pertumbuhan tanaman. Sebaiknya, kadar kalium pada tanaman tua lebih tinggi dari pada tanaman muda. Artinya kadar mineral yang terdapat pada tanaman tua biasanya lebih besar dibandingkan kadar mineral pada tanaman muda. Beberapa faktor yang mempengaruhi kadar mineral dalam tanaman antara lain : kadar mineral tanah tempat tumbuh tanaman, sifat genetis tanaman, dan faktor lingkungan (pH, struktur tanah, pemupukan, curah hujan) (Rosmarkam dan Yuwono, 2002).Oleh karena itu, kadar mineral pada herbamenirantua lebih tinggi daripada herba mudanya sehingga herbamenirantua baik digunakan untuk mengimbangi asupan kalsium, kalium, dan natrium.
4.3.3 Batas Deteksi dan Batas Kuantitasi
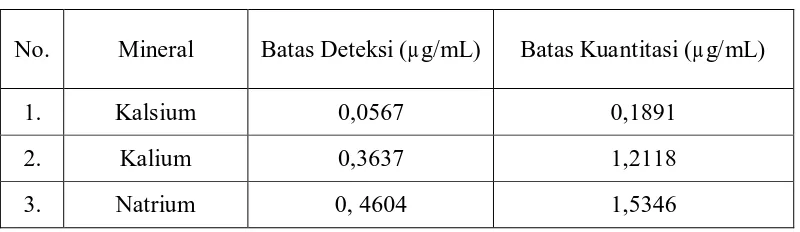
[image:75.595.113.513.591.707.2]Berdasarkan data kurva kalibrasi kalsium, kalium dan natrium diperoleh batas deteksi dan batas kuantitasi untuk ketiga mineral tersebut. Batas deteksi dan batas kuantitasi kalsium, kalium dan natrium dapat dilihat pada Tabel 5.
Tabel 5. Batas deteksi dan batas kuantitasi kalsium, kalium dan natrium
No. Mineral Batas Deteksi (µg/mL) Batas Kuantitasi (µg/mL)
1. Kalsium 0,0567 0,1891
2. Kalium 0,3637 1,2118
pada pengukuran sampel berada diatas batas deteksi dan batas kuantitasi. Perhitungan batas deteksi dan batas kuantitasi dapat dilihat pada Lampiran 16, halaman75.
4.3.4 Uji Perolehan Kembali (Recovery)
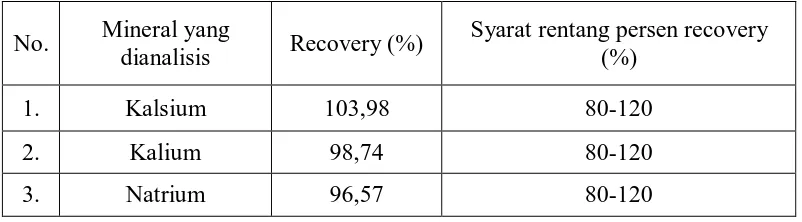
Hasil uji perolehan kembali (recovery)kadar kalsium, kalium dan natrium setelah penambahan masing-masing larutan baku kalsium, kaliumdan natrium dalam sampel dapat dilihat pada Tabel 6 berikut ini.
Tabel 6.Persen uji perolehan kembali (recovery) kadar kalsium, kaliumdan natrium dalam sampel
No. Mineral yang
dianalisis Recovery (%)
Syarat rentang persen recovery (%)
1. Kalsium 103,98 80-120
2. Kalium 98,74 80-120
3. Natrium 96,57 80-120
[image:76.595.112.513.471.582.2]kembali (recovery) ini memenuhi syarat akurasi yang telah ditetapkan, jika rata-rata hasil perolehan kembali (recovery) berada pada rentang 80-120%(Miller, 2005). Hasil uji perolehan kembali (recovery) kadar kalsium, kalium dan natrium setelah penambahan masing-masing larutan baku dan contoh perhitungan dapat dilihat pada Lampiran 17 sampai Lampiran 18, halaman 78 sampai halaman 83. 4.3.5 Simpangan Baku Relatif
[image:77.595.116.510.415.530.2]Nilai simpangan baku dan simpangan baku relatif untuk kalsium, kalium dan natrium pada umbi rumput teki dapat dilihat pada Tabel 6, sedangkan perhitungannya dapat dilihat pada Lampiran 19, halaman 84 sampai denganhalaman 86.
Tabel 7. Nilai simpangan baku dan simpangan baku relatif kalsium, kalium dan natrium dalam sampel
No. Mineral Simpangan Baku Simpangan Baku Relatif
1. Kalsium 1,1545 1,11%
2. Kalium 0,1619 0,16 %
3. Natrium 0,1284 0,13%
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Herba meniran muda dan herba meniran tua memiliki kandungan mineral kalsium, kalium dan natrium.
b. Hasil penetapan kadar kalsium, kalium dan natrium secara spektrofotometri serapan atom menunjukkan bahwa kadar kalsium dalam herbameniran muda dan herba meniran tua adalah (80,1711±1,8324)mg/ 100g dan (99,7375±1,6991) mg/100 g; kadar kalium dalam herba meniran muda dan herba meniran tua adalah (555,1935±2,4085) mg/100 g dan (1667,5193±10,8758) mg/100g; dan kadar natrium dalam herba meniran muda dan herba meniran tua adalah (28,3571±0,2733) mg/100g dan (80,1890±0,5471) mg/100 g.
c. Hasil uji statistik yaitu uji beda rata-rata kadar kalsium, kalium, dan natrium antara herba meniran muda dan herba meniran tua terdapat perbedaan signifikan dimana kadar kalsium, kalium, dan natrium herba meniran tua lebih tinggi daripada herba meniran muda.
5.2 Saran
Menurut Kardinan dan Kusuma (2004) taksonomi tumbuhan meniran adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledonae Bangsa : Euphorbiales Suku : Euphorbiaceae Marga : Phyllanthus
Jenis : Phyllanthus urinaria L. 2.1.2 Deskripsi Tumbuhan
Meniran (Phyllanthus urinaria L.) merupakan terna liar yang berasal dari Asia tropik yang tersebar di seluruh daratan Asia termasuk Indonesia. Kini, terna ini telah tersebar ke Benua Afrika, Amerika, dan Australia. Meniran tumbuh di daerah dataran rendah hingga dataran tinggi dengan ketinggian 1.000 meter di atas permukaan laut(Kardinan dan Kusuma, 2004).
sekitar pekarangan rumah, baik di pedesaan maupun di perkotaan. Meniran mempunyai akar tunggang dan sepasang bunga, yaitu bunga jantan yang keluar di bawah ketiak daun dan bunga betina yang keluar di atas ketiak daun. Daun meniran mirip dengan daun asam, berbentuk lonjong dan tersusun majemuk(Kardinan dan Kusuma, 2004).
Di beberapa daerah di Indonesia, meniran dikenal dengan nama ba’me tano, sidukung anak, dudukung anak, baket sikolop (Sumatera); meniran ijo, meniran merah, memeniran (Jawa); bobolungo, sidukung anak (Sulawesi); serta gosau ma dungi, gusau ma dungi roriha, belalang babiji (Maluku). Beberapa nama asing di antaranya zhen zu cao, hsieh hsia chu, ye xia zhu (Cina); chanca piedra, quebra pedra, kilanelli (India); child pick a back (Inggris); stone breaker, shaterrstone, chamber bitter, leafflower, quinine weed (Amerika Selatan); dan arrebenta pedira (Brasil). Nama umum atau nama dagangnya adalah meniran(Kardinan dan Kusuma, 2004).
(peluruh air seni dan mencegah pembentukan kristal kalsium oksalat), ekspektoran (peluruh dahak), hipoglikemik (menurunkan kadar glukosa darah), serta sebagai immunostimulan (merangsang sel imun bekerja lebih aktif) (Kardinan dan Kusuma, 2004).
Berbeda dengan temulawak yang telah teruji mampu menormalkan fungsi lever, meniran memiliki khasiat lebih dari itu. Ekstrak meniran mampu mengurangi replika virus hepatitis. Tidak hanya kadar SGOT dan SGPT yang dapat diturunkan, tetapi juga jumlah virus yang ada dalam hati tersebut (Kardinan dan Kusuma, 2004).
Berdasarkan data klinis empiris dan klinis di atas dapat disimpulkan bahwa meniran efektif untuk mengobatiberagam penyakit diantaranya batu ginjal atau empedu, infeksi saluran pernafasan atas, diabetes, infeksi kandung kemih, diare, malaria atau demam, gonorhoe, radang ginjal, hepatitis, epilepsi atau ayan, influenza, dan tuberkulosis (TBC). Meniran juga dipakai untuk menyembuhkan penyakit kelamin sipilis dan bermanfaat sebagai pembersih darah dan berbagai penyakit kulit (Kardinan dan Kusuma, 2004).
digunakan untuk mengobati beragam penyakit, seperti diare, malaria, sariawan, batu ginjal, sakit kuning, ayan, sakit gigi, gonorhoe, dan antiradang (Kardinan dan Kusuma, 2004).
Di Vietnam dan Kamboja, meniran digunakan untuk menangkal TBC. Di Thailand secara tradisional, herba ini digunakan untuk menangkal demam dan peluruh air seni. Di Malaysia digunakan untuk menghadang penyakit kulit, sipilis dan gonorhoe. Sementara itu, di India berdasarkan pengobatan ayurvedic, sejak 2.000 tahun yang lalu, meniran secara luas digunakan untuk mengobati gangguan menstruasi, diare, gangguan pada kulit, diabetes, kencing nanah, dan terbukti mampu mengatasi hepatitis B (Kardinan dan Kusuma, 2004).
Di Peru, meniran dicampur dengan perasan air jeruk nipis diminum sebagai tonikum untuk penderita diabetes mellitus dan penderita hepatitis. Terna ini dipercaya mampu merangsang pengeluaran batu empedu dan meningkatkan fungsi hati. Di Suriname, meniran digunakan untuk menangkal kolik, gangguan ginjal, dan berbagai penyakti lever akut atau kronis (Kardinan dan Kusuma, 2004).
2.1.4 Kandungan Meniran
4-metoxy-2.2 Mineral
Mineral merupakan salah satu unsur yang memegang peranan penting dalam pemeliharaan fungsi tubuh, baik pada tingkat sel, jaringan, organ, maupun fungsi tubuh secara keseluruhan. Mineral digolongkan ke dalam mineral makro dan mineral mikro. Mineral makro adalah mineral yang dibutuhkan tubuh dalam jumlah lebih dari 100 mg/hari, sedangkan mineral mikro dibutuhkan kurang dari 100 mg/hari. Mineral makro adalah natrium, klorida, kalium, kalsium, fosfor, magnesium dan sulfur, sedangkan yang termasuk mineral mikro, seperti besi, seng, iodium dan selenium (Almatsier, 2006).
Berdasarkan kebutuhannya di dalam tubuh, mineral dapat digolongkan menjadi 2 kelompok utama yaitu mineral makro dan mineral mikro. Mineral makro adalah mineral yang menyusun hampir 1% dari total berat badan manusia dan dibutuhkan dengan jumlah lebih dari 100 mg/hari, sedangkan mineral mikro merupakan mineral yang dibutuhkan dengan jumlah kurang dari 100 mg /hari (Almatsier, 2006).
2.2.1 Kalsium
Kalsium merupakan mineral yang paling banyak terdapat di dalam tubuh, yaitu 1,5 – 2% dari berat badan orang dewasa atau kurang lebih sebanyak 1 kg. Kalsium mempunyai berbagai fungsi dalam tubuh antara lain pembentukan tulang dan gigi, mengatur pembekuan darah, katalisator reaksi-reaksi biologik, kontraksi otot serta menjaga permeabilitas membran sel (Almatsier, 2006).
Angka kecukupan rata-rata sehari untuk kalsium bagi orang Indonesia ditetapkan oleh Widyakarya Pangan dan Gizi LIPI (1998) sebagai berikut bayi 300 – 400 mg, anak – anak 500 mg, remaja 600 – 700 mg, dewasa 500 – 800 mg, ibu hamil dan menyusui ± 400 mg. Konsumsi kalsium hendaknya tidak melebihi 2500 mg sehari. Kelebihan kalsium dapat menimbulkan batu ginjal atau gangguan ginjal. Di samping itu, dapat menyebabkan konstipasi. Kelebihan kalsium bisa terjadi bila menggunakan suplemen kalsium berupa tablet atau bentuk lain (Almatsier, 2006).
Kekurangan kalsium pada masa pertumbuhan dapat menyebabkan gangguan pertumbuhan. Tulang kurang kuat, mudah bengkok dan rapuh. Semua orang dewasa, terutama sesudah usia 50 tahun, kehilangan kalsium dari tulangnya. Tulang rapuh dan mudah patah. Hal ini dinamakan osteoporosis. Kadar kalsium dalam darah yang sangat rendah dapat menyebabkan tetani atau kejang. Kepekaan serabut saraf dan pusat saraf terhadap rangsangan, sehingga terjadi kejang otot misalnya pada kaki (Almatsier, 2006).
dari natrium (110 g) (Winarno, 1995). Seperti halnya natrium, kalium merupakan ion bermuatan positif, akan tetapi berbeda dengan natrium, kalium terutama terdapat di dalam sel. Perbandingan natrium dan kalium di dalam cairan intraselular adalah 1:10, sedangkan di dalam cairan ekstraselular 28:1. Sebanyak 95% kalium tubuh berada di dalam cairan ekstraselular (Almatsier, 2006).
Distribusi kalium diantara CES dan cairan intraselular (CIS) dipengaruhi oleh pH CES, serta oleh banyak hormon, termasuk insulin, epinefrin, dan aldosteron. Peningkatan pada hormon ini menyebabkan peningkatan perpindahan kalium ke dalam sel-sel. Perubahan akut pada pH serum diasidosis, sebagai contoh, kelebihan ion-ion hidrogen bergerak ke dalam sel-sel untuk menjadi buffer. Untuk mempertahankan listrik netral dalam sel, ion positif lain (mis. kalium) harus dikeluarkan. Pada alkalosis yang sebaliknya terjadi. Ion hidrogen pindah keluar sel dan ion kalium pindah untuk menggantikannya(Horne dan Swearingen, 1993).
saluran GI, dan kulit. Kalium dapat hilang dari CES karena perpindahan intraselular atau anabolisme jaringan (Horne dan Swearingen, 1993).
Kekurangan kalium menyebabkan lemah, lesu, kehilangan nafsu makan, kelumpuhan, mengigau dan konstipasi. Kelebihan kalium akut dapat terjadi bila konsumsi melalui saluran cerna atau tidak melalui saluran cerna (parenteral) melebihi 18 g untuk orang dewasa tanpa diimbangi oleh kenaikan ekskresi. Hiperkalemia akut dapat menyebabkan gagal jantung yang berakibat kematian. Kelebihan kalium dapat terjadi bila ada gangguan fungsi ginjal (Almatsier, 2006). 2.2.3 Natrium
Natrium adalah kation utama dalam cairan ekstraseluler. 35-40% natrium ada di dalam kerangka tubuh. Makanan sehari – hari biasanya cukup mengandung natrium yang dibutuhkan tubuh. Oleh karena itu, tidak ada penetapan kebutuhan natrium sehari. Taksiran kebutuhan natrium sehari untuk orang dewasa adalah sebanyak 500 mg. Kebutuhan natrium didasarkan pada kebutuhan untuk pertumbuhan, kehilangan natrium melalui keringat dan sekresi lain. Dianjurkan untuk membatasi konsumsi garam dapur hingga 6 gram sehari (ekivalen dengan 2400 mg natrium). Pembatasan ini dilakukan karena peranan potensial natrium dalam menimbulkan tekanan darah tinggi (Almatsier, 2006).
oleh atom-atom netral, dan sinar yang diserap biasanya sinar tampak atau sinar ultraviolet (Gandjar dan Rohman, 2007)
Spektrofotometri serapan atom digunakan untuk analisis kuantitatif unsur-unsur mineral dalam jumlah sekelumit (trace) dan sangat sekelumit (ultratrace). Cara analisis ini memberikan kadar total unsur mineral dalam suatu sampel dan tidak tergantung pada bentuk molekul mineral dalam sampel tersebut. Cara ini cocok untuk analisis sekelumit mineral karena mempunyai kepekaan yang tinggi (batas deteksi kurang dari 1 ppm), pelaksanaanya relatif sederhana, dan interferensinya sedikit (Gandjar dan Rohman, 2007).
Metode spektrofotometri serapan atom berprinsip pada absorpsi cahaya oleh atom. Atom-atom menyerap cahaya pada panjang gelombang tertentu, tergantung pada sifat unsurnya. Cahaya pada panjang gelombang ini mempunyai cukup energi untuk mengubah tingkat elektronik suatu atom. Transi