AMPLIFIED POLYMORPHISM DNA
) IKAN NILEM
(
Osteochilus hasselti
) DI JAWA BARAT
MULYASARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis dengan judul Karakteristik Fenotip e
Morfomeristik dan Keragaman Genotipe RAPD (Randomly Amplified
Polymorphism DNA) Ikan Nilem (Osteochilus hasselti) di Jawa Barat adala h karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2010
MULYASARI. Characteristics of Morphomeristic Phenotype and RAPD (Randomly Amplified Polymorphism DNA) Genotype Variation of Sharkminnow fish (Osteochilus hasselti) at West Java. UNDER DIRECTION OF DINAR TRI
SOELISTYOWATI AND ANANG HARI KRISTANTO.
Research on genetic variation was done to conduct breeding program as the effort to maintain and increase the production of nilem fish at West Java. The aim of this study was to estimate the variation of the intra and inter population of nilem fish from West Java by using morphomeristic and RAPD methods. The result showed that the different morphometric of sharkminnow fish was able to be described by four morphometric characters which were B4, C1, C5 and C6. Genetic distance of nilem fish were between 0.0153-0.1392. Based on morphomeristics and RAPD analysis, sharkminnow fish had different genus with were and beureum panon.
RINGKASAN
MULYASARI. Karakteristik Fenotipe Morfomeristik dan Keragaman Genotip
RAPD (Randomly Amplified Polymorphism DNA) Ikan Nilem (Osteochilus
hasselti) di Jawa Barat. DIBIMBING OLEH DINAR TRI SOELISTYOWATI DAN ANANG HARI KRISTANTO.
Ikan nilem Osteochillus sp, merupakan ikan Cyprinid yang banyak terdapat di daerah Jawa Barat dan potensial untuk dikembangkan menjadi produk unggulan perikanan budidaya dari kawasan Priangan. Selama ini budidaya ikan nilem di karamba dan sawah masih sangat terbatas. Pemeliharaannya hanya bersifat sampingan dari hasil budidaya secara polikultur bersama-sama dengan ikan mas, mujair atau gurame, sehingga produksinya masih relatif rendah.
Untuk mempertahankan dan meningkatkan produksi ikan nilem yang berkelanjutan, hal ini perlu didukung oleh program pemuliaan atau perbaikan genetik stok yang unggul secara genetik. Perbaikan mutu genetik suatu jenis ikan berhubungan erat dengan tingkat keragaman genetik. Keragaman genetik penting keberadaannya dalam populasi dan terus menerus dikelola dan harus diperluas agar selalu tersedia bahan untuk meningkatkan stok yang unggul.
Informasi keragaman genetik, status genetik dan keunggulan sifat suatu populasi menjadi dasar kegiatan dalam melakukan program pemuliaan ikan. Dalam hal ini, seleksi dan persilangan merupakan dua metode yang dapat dilakukan dalam perbaikan mutu genetik untuk meningkatkan produktivitas suatu jenis ikan. Program seleksi dapat diterapkan jika keragaman genetik ikan nilem itu tinggi, dan apabila keragaman genetik rendah mungkin bisa dilakukan persilangan (hibridisasi).
Tujuan penelitian ini adalah melakukan identifikasi fenotipe morfomeristik dan genotip RAPD dari genus ikan nilem Osteochillus di sentra budidaya yang terdapat di daerah Jawa Barat dan menelusuri keragaman intra dan inter populasi beberapa jenis ikan nilem untuk mengetahui faktor-faktor yang mungkin mempengaruhi keberadaan gen pool dan potensinya. Penelitian di lakukan di Balai Riset Per ikanan Budidaya Air Tawar Bogor, waktu pelaksanaan penelitian akan dilakukan selama 7 bulan.
Karakterisasi truss morfometrik dilakukan dengan membagi tubuh ikan menjadi 4 bagian besar (A, B, C, D) dan 10 titik truss yaitu: 1) sirip dada, 2) mulut, 3) sirip perut, 4) insang, 5) sirip pangkal anal, 6) sirip pangkal punggung, 7) sirip ujung anal, 8) sirip ujung punggung, 9) sirip bawah pangkal ekor, dan 10) sirip atas pangkal ekor. Selanjutnya masing-masing jarak titik truss di seluruh badan ikan tadi dihubungkan dan diukur dengan penggaris sehingga dari 10 titik truss diperoleh 21 karakter.
Karakterisasi meristik dilakukan dengan mendeskripsikan morfologi tubuh, serta menghitung jumlah sirip punggung (dorsal fin), sirip dada (pectoral fin), sirip perut (ventral fin) dan sirip anal (anal fin).
berkisar antara 0,0153-0,1392 yang menunjukkan bahwa keenam populasi ikan nilem hijau merupakan satu spesies. Disamping itu faktor lingkungan (rekrutmen, kualitas air dan sistem budidaya) diduga berpengaruh terhadap karakteristik Fenotipe ikan nilem hijau yang terdapat di Jawa Barat. Hasil analisis biometrik dan RAPD, menunjukkan bahwa ikan nilem hijau dan nilem merah berbeda genus dengan ikan nilem were dan nilem beureum panon.
© Hak cipta milik IPB, tahun 2010
Hak cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan
atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan
pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan,
penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak
merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya
POLYMORPHISM DNA
) IKAN NILEM
Osteochilus hasselti
DI
JAWA BARAT
MULYASARI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Polymorphism DNA) ikan nilem (Osteochilus hasselti) di Jawa Barat
Nama : Mulyasari
NIM : C151070281
Disetujui
Komisi Pembimbing,
Dr. Ir. Dinar Tri Soelistyowati, DEA. Dr. Ir.Anang Hari Kristanto, M.Sc. Ketua Anggota
Diketahui
Ketua Program Studi Ilmu Akuakultur Dekan Sekolah Pascasarjana IPB
Prof. Dr. Ir. Enang Harris, M.S. Prof.Dr. Ir. Khairil A Notodiputro. M.S.
PRAKATA
Puji syukur Alhamdulillahirobil’alamin penulis panjatkan kehadirat Allah
SWT yang telah melimpahkan rahmat, hikmat, dan karunia-Nya sehingga penulis
dapat menyelesaikan studi dan penulisan tesis yang berjudul “Karakteristik
fenotipe morfomeristik dan keragaman genotipe RAPD (Randomly Amplified
Polymorphism DNA) ikan nilem (Osteochilus hasselti) di Jawa Barat”.
Atas selesainya penelitian dan penulisan tesis ini, penulis mengucapkan
terima kasih kepada Dr. Dinar Tri Soelistyowati, DEA dan Dr. Anang Hari
Kristanto, MSc selaku komisi pembimbing, serta Dr. Alimuddin selaku dosen
penguji. Di samping itu, penulis sampaikan rasa terimakasih kepada Kepala Balai
Riset Perikanan Budidaya Air Tawar Bogor, Dr. Estu Nugroho dan Ir. Irin Iriana
Kusmini, MSi yang telah memberikan fasilitas penuh selama penelitian.
Ungkapan terimakasih juga disampaikan kepada seluruh keluarga atas segala doa
dan dukungannya selama ini. Selain itu penulis mengucapkan terima kasih kepada
Glenni H. H. Spi, Iskandariah Spi, Sri Sundari, dan Sabariah SPi serta rekan-rekan
mahasiswa Program Studi Ilmu Akuakultur, Sekolah Pascasarjana IPB angkatan
2009, yang telah banyak membantu dalam proses penelitian dan penyusunan tesis.
Dalam penyusunan tesis ini penulis menyadari masih banyak terdapat
kekurangan. Namun demikian, semoga karya ilmiah ini bermanfaat bagi mereka
yang membutuhkan. Amin.
Bogor, Januari 2010
Mulyasari
Penulis dilahirkan di Ujung Pandang pada tanggal 22 Maret 1972 dari
ayah Fuad Cholik dan ibu Eti Yumiati. Penulis merupakan anak ke empat dari
enam bersaudara. Tahun 1990 penulis lulus dari SMA Negeri 1 Ujung Pandang
dan pada tahun 1990 masuk Jurusan Perpustakan dan Informatika Pertanian,
Fakultas Politeknik Pertanian, Program Diploma 2, Institut Pertanian Bogor.
Kemudian Tahun 1992 masuk pada Jurusan Teknologi Industri Pertanian,
Fakultas Teknologi Pertanian, Institut Teknologi Indonesia dan lulus pada tahun
1997. Pada tahun 2000 diterima sebagai staf peneliti di Pusat Riset Pengolahan
Produk dan Sosial Ekonomi Kelautan dan Per ikanan Jakarta, dari tahun 2006
sampai sekarang ditempatkan sebagai peneliti di Balai Riset Perikanan Budidaya
Air Tawar Bogor. Penulis melanjutkan studi ke Program Studi Ilmu Akuakultur,
Sekolah Pascasarjana Institut Pertanian Bogor tahun 2007 dengan izin dari
Kepala Balai Riset Perikanan Budidaya Air Tawar Bogor dan Kepala Badan
Riset Kelautan Perikanan atas sponsor dari Pusdiklat Aparatur Departemen
DAFTAR ISI
Ragam Genotipe dengan Penanda Molekuler RAPD …………. 8
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 11
Bahan Uji …………... 11
Karakterisasi Morfologi.. ... 12
Karakterisasi Genotipe dengan Penanda Molekuler RAPD ... 14
Pengumpulan Data Pendukung... 18
Analisis Data ... 18
HASIL DAN PEMBAHASAN Karakteristik Fenotipe dan Genotipe Ikan Nilem Hijau di Jawa Barat ... 20
Hubungan Interspesifik Empat Jenis Ikan Nilem di Tasikmalaya Jawa Barat ……… 31
Parameter Lingkungan dan Sistem Budidaya ... 40
DAFTAR PUSTAKA ... 52
DAFTAR TABEL
No Uraian
H
alaman1 Rerata 21 karakter fenotipe truss morfometrik enam populasi nilem hijau di Jawa Barat ... ... 20
2 Koefisien keragaman (CV) morfometrik enam populasi ikan
nilem hijau di Jawa Barat ... 21
3 Persentase sharing component (nilai indeks kesamaan) enam
populasi ikan nilem hijau di Jawa Barat ... 24
4 Rerata enam karakter meristik dari enam populasi ikan nilem
hijau di Jawa Barat ... 25
5 Koefisien keragaman (CV) dari enam karakter meristik pada
enam populasi ikan nilem hijau di Jawa Barat ………. 25
6 Matriks korelasi antar karakter meristik enam populasi ikan nilem hijau di Jawa Barat ... 26
7 Heterozigositas dan persentase polimorfisme enam populasi ikan nilem hijau di Jawa Barat hasil RAPD menggunakan primer
OPA-11 ... 28
8 Uji perbandingan berpasangan Fst enam populasi ikan nilem
hijau di Jawa Barat ... 29
9 Matriks jarak genetik inter populasi ikannilem hijau di Jawa Barat 30
10 Rerata 21 karakter fenotipe truss morfometrik empat jenis ikan
nilem di Tasikmalaya (Jawa Barat) ……… 31
11 Koefisien keragaman morfometrik empat jenis ikan nilem di
Tasikmalaya (Jawa Barat) ... 32
12 Persentase sharing component (indeks kesamaan) empat jenis
ikan nilem yang terdapat di daerah Tasikmalaya (Jawa Barat)... 33
13 Heterozigositas dan persentase polimorfisme empat jenis ikan nilem dari Tasikmalaya (Jawa Barat) hasil RAPD
14 Uji perbandingan berpasangan Fst empat jenis ikan nilem di
Tasikmalaya (Jawa Barat) ... 39
15 Matriks jarak genetik antar beberapa jenis ikan nilem yang
terdapat di daerah Tasikmalaya Jawa Barat ... 39
16 Parameter lingkungan yang diamati pada enam lokasi budidaya
ikan nilem di Jawa Barat ... 41
17 Data kualitas air dari enam lokasi budidaya ikan nilem
di Jawa Barat ... 42
DAFTAR GAMBAR
No Uraian Halaman
1 Jenis-jenis ikan nilem yang terdapat di Jawa Barat : (1) nilem hijau,
(2) nilem merah, (3) nilem were dan 4) nilem beureum panon... 2
2 Lokasi pengambilan sampel ... 11
3 Pengukuran karakter truss morfometrik... 13
4 Diagram alir prosedur ekstraksi DNA genom ikan ... 16
5 Diagram alir prosedur RAPD menggunakan teknik PCR ... 17
6 Penyebaran karakter morfometrik enam populasi ikan nilem hijau di Jawa Barat ... 23
7 Dendrogram hubungan inter populasi ikan nilem hijau di Jawa Barat berdasarkan fenotipe morfometrik ... 24
8 Penyebaran karakter meristik enam populasi ikan nilem hijau yang terdapat di daerah Jawa Barat ... 27
9 Dendrogram hubungan inter populasi ikan nilem hijau di Jawa Barat berdasarkan fenotipe meristik ………. 27
10 Pola fragmen RAPD ikan nilem hijau dari enam populasi di Jawa Barat yang diamplifikasi menggunakan primer OPA-11 ... 28
11 Dendrogram hubungan kekerabatan enam populasi ikan nilem hijau yang terdapat di Jawa Barat ……….. 30
12 Penyebaran karakter morfometrik empat jenis ikan nilem yang terdapat di Tasikmalaya (Jawa Barat) ... 33
13 Dendrogram hubungan inter spesifik 4 jenis ikan nilem yang terdapat di Tasikmalaya (Jawa Barat) berdasarkan Fenotipe morfomeristik ... 34
14 Pola fragmen RAPD empat jenis ikan nilem yang dibudidayakan di daerah Tasikmalaya (Jawa Barat), diamplifikasi menggunakan primer OPA-11 ... 38
16 Skor kondisi budidaya dan jarak genotipe ikan nilem di Jawa
Barat .. ……….. 47
DAFTAR LAMPIRAN
No Uraian Halaman
1 Matriks korelasi enam populasi ikan nilem hijau di Jawa Barat
yang diukur menggunakan metode truss morfometrik ... 57
2 Uji signifikansi 21 karakter morfometrik enam populasi ikan
nilem hijau di Jawa Barat ... 58
3 Uji signifikansi enam karakter meristik enam populasi ikan
nilem hijau di Jawa Barat ... 59
4 Uji signifikans i 21 karakter morfometrik empat jenis ikan
nilem yang terdapat di daerah Tasikmalaya Jawa Barat... 59
5 Polimorfisme panjang fragmen RAPD hasil amplifikasi menggunakan primer OPA-11 enam populasi ikan nilem
hijau di Jawa Barat ... 64
6 Polimorfisme panjang fragmen RAPD hasil amplifikasi menggunakan primer OPA-11 empat jenis ikan nilem di Jawa
Latar Belakang
Ikan nilem Osteochilus hasselti, merupakan ikan Cyprinid yang banyak terdapat
di daerah Jawa Barat. Ikan nilem ini sangat potensial untuk dikembangkan menjadi
produk unggulan perikanan budidaya dari kawasan Priangan. Dari sisi ekonomi,
kelestarian lingkungan, dan produksi, budidaya ikan ini menguntungkan. Nilai ekonomis
ikan nilem meningkat setelah dijadikan produk olahan misalnya baby fish goreng,
dendeng dan pindang, diasap dan dikalengkan (Rahardjo dan Marliani 2007). Telur ikan
nilem digemari masyarakat karena rasanya yang lezat dan mempunyai peluang sebagai
komoditas ekspor (Winarlin et al. 2006; Subagja et al. 2006a). Dari aspek lingkungan
ikan nilem berperan sebagai biocleaning agent karena sifatnya yang suka memakan
detritus dan perifiton sehingga ikan ini bisa digunakan untuk membersihkan keramba
jaring apung. Sedangkan dari segi budidayanya ikan nilem ini mudah dipelihara pada
kondisi air yang berbeda-beda, memiliki kelangsungan hidup dan reproduksi yang tinggi
(Cholik et al. 2005) serta tahan terhadap penyakit (Subagja et al. 2006a). Berdasarkan
keunggulan dan potensinya, Menteri Kelautan dan Perikanan mengukuhkan ikan ini
sebagai salah satu komoditas Gerakan Mina Padi Rakyat atau GEMPAR pada tanggal 3
Mei 2006 (Subagja et al. 2006a,b).
Selama ini budidaya ikan nilem di karamba dan sawah masih sangat terbatas.
Pemeliharaannya hanya bersifat sampingan dari hasil budidaya secara polikultur
bersama-sama dengan ikan mas, mujair atau gurame, sehingga produksinya masih relatif
rendah. Menurut Subagja, et al. (2006b) produksi ikan nilem cenderung menurun
sehingga dikhawatirkan dapat mengakibatkan kepunahan padahal nilem memiliki potensi
masa depan yang cukup baik. Untuk mempertahankan dan meningkatkan produksi ikan
nilem yang berkelanjutan, hal ini perlu didukung oleh program pemuliaan atau perbaikan
genetik stok yang unggul secara genetik. Perbaikan mutu genetik suatu jenis ikan
berhubungan erat dengan tingkat keragaman genetik. Keragaman genetik penting
keberadaannya dalam populasi dan terus menerus dikelola dan harus diperluas agar selalu
2
status genetik (gene pool) dan keunggulan sifat suatu populasi menjadi dasar kegiatan
dalam melakukan program pemuliaan ikan. Dalam hal ini, seleksi dan persilangan
merupakan dua metode yang dapat dilakukan dalam perbaikan mutu genetik untuk
meningkatkan produktivitas suatu jenis ikan. Program seleksi dapat diterapkan jika
keragaman genetik ikan nile m itu tinggi, dan apabila keragaman genetik rendah mungkin
bisa dilakukan persilangan (hibridisasi).
Berdasarkan performa ikan nilem yang dibudidayakan di daerah Jawa Barat
terdapat empat jenis ikan nilem yaitu ikan nilem hijau (Gambar 1-1), ikan nilem merah
(1-2), ikan nilem were (Gambar 1-3) yang memiliki warna keperakan seperti ikan
bandeng dan ikan nilem mata merah atau beureum panon (Gambar 1-4). Ikan nilem were
berasal dari sungai yang terdapat di daerah Sumedang. Bila dibandingkan dengan ikan
nilem jenis lain, ikan were ini memiliki kecepatan tumbuh paling tinggi namun memiliki
kelemahan karena sisiknya yang mudah lepas. Keanekaragaman performa ikan nilem
tersebut diduga karena memiliki perbedaan potensi genetik yang dipengaruhi oleh faktor
lingkungan (sistem budidaya) dan aliran gen terkait dengan sistem rekrutmen (seleksi dan
breeding).
Gambar 1. Jenis- jenis ikan nilem yang terdapat di Jawa Barat : (1) nilem hijau, (2) nilem merah, (3) nilem were dan (4) nilem beureum panon
Selama ini keragaman genetik ikan nilem hanya terbatas pada informasi
morfologinya sedangkan informasi genetik belum banyak dilakukan. Informasi
keragaman genetik yang diperlukan sebagai dasar pengambilan keputusan untuk
peningkatan mutu genetik dan seleks i.
1 2
Perumusan Masalah
Dalam rangka penyediaan stok induk untuk tujuan pemuliaan dan penyusunan
strategi pada program pemuliaan ikan nilem dengan memanfaatkan sumber genetik lokal,
maka diperlukan data base mengenai status spesifik yang menggambarkan perbedaan dan
distribusi keragaman genetik intra- dan inter-populasi ikan nilem di Jawa Barat
berdasarkan karakteristik fenotipe maupun genotipenya.
Dengan demikian pemuliaan dapat dilakukan secara rasional dengan
memanfaatkan sumber genetik induk dari satu lokasi atau beberapa lokasi yang
berkualitas maupun dari jenis strain yang berbeda untuk memproduksi benih-benih
unggul yang berkelanjutan.
Tujuan Penelitian
Identifikasi fenotipe morfomeristik dan genotipe RAPD dari genus ikan nilem
Osteochillus di sentra budidaya yang terdapat di daerah Jawa Barat, menelusuri
keragaman intra- dan inter-populasi beberapa jenis ikan nilem untuk mengetahui
faktor-faktor yang mungkin mempengaruhi keberadaan gene pool dan potensinya.
Manfaat Penelitian
Hasil penelitian yang berupa data base genetik ikan nilem berguna dalam
manajemen broodstock yang terkontrol untuk tujuan pemuliaan yang berkelanjutan dalam
TINJAUAN PUSTAKA
Ikan Nilem
Nilem (Osteochilus hasselti) merupakan ikan endemik Indonesia yang hidup di
sungai-sungai, danau dan rawa-rawa, tersebar di pulau Jawa, Sumatera dan Kalimantan.
Namun, sejalan dengan perkembangan, ikan tersebut kemudian dibudidayakan di
kolam-kolam untuk tujuan komersial. Secara nasional keberadaannya kurang begitu populer
kecuali di Jawa Barat. Hampir 80 % produksi nasional ikan nilem berasal dari Jawa Barat
(Cholik et al. 2005).
Panjang tubuh ikan nilem dapat mencapai 32 cm. Bentuk tubuh ikan nilem agak
memanjang dan pipih, ujung mulut runcing dengan moncong (rostral) terlipat, serta bintik
hitam besar pada ekornya, dan terdapat sungut di mulutnya. Menurut Kottelat (1993)
Osteochilus hasselti CV mempunyai ciri-ciri sebagai berikut : SL. 320, LL. 30-33,
terdapat sisik 51/2 antara awal sirip punggung dan gurat sisi, tidak ada tubus keras pada
moncong, 6-9 baris bintik-bintik berwarna sepanjang barisan sisik (walaupun tidak selalu
jelas), terdapat bintik bulat besar pada batang ekor, batang ekor dikelilingi 16 sisik dan
bagian depan sirip punggung dikelilingi 26 sisik. Terdapat 12-18 1/2 jari-jari bercabang
pada sirip punggung.
Ikan nilem diklasifikasikan sebagai berikut (Nelson 1994):
Species : Osteochillus hasselti
Ikan nilem hidup di lingkungan air tawar dengan kisaran pH antara 6,0-7,0 dan
kandungan oksigen terlarut yang cukup (Cholik et al. 2005). Ikan ini merupakan jenis
ikan pemakan detritus dan jasad penempel yang disebut epifiton dan perifiton, pada
stadia larva dan benih ikan ini pemakan fitoplankton dan zooplankton atau jenis alga ber
sel satu seperti diatom dan ganggang yang termasuk ke dalam kelas Cyanophyceae dan
Chlorophyceae (Syandri, 2004; Cholik et al. 2005).
Ikan nilem mampu hidup dan berkembang biak pada perairan jernih dan berpasir
serta berada pada kawasan berelevasi tinggi. Ikan nilem memiliki potensi reproduksi
yang cukup tinggi. Seekor nilem betina dapat menghasilkan telur sebanyak
80.000-110.000 butir telur dan memijah sepanjang tahun (Cholik et al. 2005). Pemijahan secara
alami di mulai pada awal musim penghujan. Ikan ini bersifat ovipar dan pembuahan
terjadi di luar tubuhnya. Induk ikan jantan nilem mulai memijah pada umur sekitar satu
tahun dengan panjang 20 cm dan berat antara 80-100g. Sedangkan untuk induk betina
mulai memijah pada umur 1 tahun dengan berat di atas 120 g (Cholik et al. 2005).
Di daerah Priangan (Jawa Barat) ikan nilem sangat diminati dan digemari
terutama dalam bentuk olahan seperti pindang nilem yang merupakan santapan terkenal,
disamping itu ikan ini banyak dijual dalam bentuk cemilan, dendeng dan telurnya pun
sangat digemari masyarakat. Harga ikan ini dapat mencapai hingga lebih dari 200%
setelah muncul inovasi produk olahan nilem tersebut (Rahardjo dan Marliani 2007).
Dengan melihat keunggulan tersebut, ikan ini memiliki prospek yang bagus sebagai
komoditas perikanan yang potensial untuk dikembangkan.
Keragaman Genetik
Keragaman genetik adalah hirarki paling rendah dalam tingkat keragaman hayati.
Keragaman hayati meliputi keragaman habitat, komunitas, populasi sampai dengan
spesies. Keragaman genetik merupakan cerminan keragaman dalam suatu spesies yang
disebut subspesies (Soewardi 2007). Menurut Dunham (2004), keragaman genetik
penting untuk keberlangsungan hidup suatu spesies dalam jangka waktu yang lama.
6
memberikan kemampuan suatu spesies atau populasi beradaptasi terhadap perubahan
lingkungan. Semakin beragam sumberdaya genetik suatu populasi, akan semakin tinggi
kemampuan populasi tersebut untuk bertahan hidup dalam jangka waktu yang lama dan
semakin tinggi pula daya adaptasi terhadap perubahan lingkungan sekitar. Kurangnya
variasi genetik atau terlalu banyak homozigositas dapat menurunkan ketahanan hidup dan
fitness suatu individu atau populasi (Dunham 2004).
Ada beberapa faktor yang mempengaruhi tingkat keragaman genetik suatu
populasi ikan, yaitu faktor yang dapat meningkatkan keragaman genetik atau
penambahan gen antara lain adalah mutasi dan migrasi serta faktor yang dapat
menurunkan tingkat keragaman yaitu inbreeding dan seleksi.
Mutasi adalah perubahan struktur DNA yang menghasilkan gen serta genotipe
baru dimana gen yang mampu beradaptasi dengan perubahan lingkungan itulah yang
bertahan (seleksi alam). Laju mutasi yang terjadi di alam berjalan lambat, namun
menyediakan cukup keragaman genetik bagi populasi (Soewardi 2007).
Migrasi adalah proses perpindahan gen antar populasi. Suatu populasi yang
terisolasi dari populasi lain karena faktor fisik seperti sungai, gunung, dan sebagainya
bila bertemu dengan populasi lain akan terjadi perpindahan gen (gene flow) diantara
keduanya. Apabila ini terjadi maka kedua populasi tersebut dalam kurun waktu tertentu
akan memiliki kemiripan atau serupa secara genetik (Soewardi (2007). Menurut Irwanto
(2006), arus gen atau perpindahan gen berlangsung pada tingkatan spesies melalui suatu
proses yang disebut introgression yaitu introduksi gen yang secara terus menerus terjadi
pada suatu proses hibridisasi. Hibridisasi akan membawa secara bersama-sama dua
kompleks genetik induk yang berlainan sehingga akan menciptakan suatu genotipe baru.
Organisme baru ini mungkin tidak dapat menyesuaikan diri dan tidak dapat bersaing
dengan jenis organisme yang sama dengan induknya, atau sebaliknya kemungkinan
genotipe baru tersebut malah dapat tumbuh dan bereproduksi dengan baik. Kemunculan
genotipe baru umumnya terjadi karena aliran gen. Proses ini berlangsung beberapa kali
dan menghasilkan populasi hampir serupa dengan induknya yang membawa beberapa
gen atau gen kompleks yang ditransfer dari satu jenis indukan kepada yang lain (Irwanto
adalah sumber yang dapat meningkatkan variasi genetik dalam banyak populasi (Irwanto
2006).
Seleksi mengubah frekuensi alel terkait dengan peluang untuk menyumbangkan
satu atau lebih genotipe pada generasi berikutnya (Soewardi 2007). Perubahan struktur
genetik ditentukan oleh pemilihan fitness genotipe dimana individu yang tidak mampu
bertahan akan tersingkir dan tidak terlibat dalam pembentukan generasi berikutnya.
Penghanyutan gen adalah pencuplikan materi genetik yang berlangsung tidak
biasa pada saat pembentukan gamet dan fertilisasi sehingga menyebabkan menurunnya
keragaman genetik suatu populasi. Penurunan keragaman genetik ini dapat menurunkan
kemampuan suatu populasi untuk beradaptasi dengan perubahan lingkungan.
Penghanyutan gen akan terjadi jika sebagian kecil dari populasi terpisah dari populasi
asal yang besar. Populasi kecil yang terpisah ini akan membawa sebagian kecil
keragaman genetik dari populasi asalnya sehingga kedua populasi itu akan memiliki gene
pool yang berbeda. Penghanyutan gen dapat pula terjadi karena sebagian besar populasi
mati sehingga populasi yang tersisa akan membentuk populasi baru. Akibatnya populasi
baru akan memiliki gene pool yang lebih terbatas dibanding dengan populasi asal
(Soewardi 2007) .
Fenotipe Morfomeristik
Fenotipe adalah suatu karakteristik yang dapat diamati dan diukur dari suatu
organisme. Ekspresi fenotipe (P) ditentukan oleh faktor genotipe (G) dan lingkungan (E)
serta interaksi keduanya (GE) sebagai berikut :
P = G + E + GE (Hardjosubroto 1994)
Karakter morfologi dari kategori fenotipe morfomeristik menggambarkan bentuk
luar dan ukurannya. Karakter morfologi banyak digunakan dalam bidang biologi
perikanan untuk mengukur perbedaan dan hubungan antara berbagai kategori taksonomi
(Turan 1999). Namun kelemahan utama dari pengukuran karakter morfologi ini pada
level intra spesifik adalah adanya keragaman fenotipe yang sangat dipengaruhi oleh
perubahan lingkungan (Turan 1999). Kelenturan fenotip ik ini terkait dengan proses
8
yang mengarah pada perubahan morfologi, reproduksi dan ketahanan hidup. Perubahan
fenotipe ini tidak berarti adanya perubahan genetik dari suatu populasi sehingga adanya
perbedaan fenotipe diantara populasi tidak dapat dikatakan sebagai adanya perbedaan
genetik. Meskipun dipengaruhi oleh lingkungan, karakter morfologi juga memiliki
kelebihan yaitu dalam mengidentifikasi stok ikan terutama bila tidak cukup waktu untuk
mengumpulkan perbedaan genetik antar populasi karena perubahan genetik terjadi sangat
lambat pada populasi ukuran besar khususnya karena penghanyutan gen secara acak
(Turan 1999).
Performa karakter morfologi dipetakan secara pengukuran morfometrik dan
meristik (morfomeristik). Ukuran morfometrik dapat digunakan untuk membedakan
populasi ikan yaitu meliputi pengukuran panjang total, panjang standar, panjang kepala
dan tinggi badan. Namun pengukuran berdasarkan karakter-karakter tersebut dinilai
masih memiliki kelemahan karena hanya memberikan gambaran bentuk tubuh ikan
secara umum (Widiyati 2003). Sebagai suatu alternatif, dikenal suatu metode
morfometrik yang lebih baru yaitu sistem jaringan truss atau truss morfometrik. Menurut
Pollar et al. (2007), metode ini dapat memberikan informasi yang lebih lengkap dalam
menggambarkan suatu bentuk ikan. Pada metode ini ditentukan titik-titik truss baik
secara vertikal, horizontal maupun diagonal. Pemilihan titik truss di sepanjang tubuh ikan
merupakan faktor penting dalam rangka mendapatkan informasi sebanyak-banyaknya
mengenai tubuh ikan, oleh karena itu penentuan titik truss adalah khas untuk setiap jenis
ikan (Widiyati 2003).
Metode ini telah berhasil cukup baik diterapkan pada beberapa spesies ikan antara
lain ikan nila (Oreochromis niloticus) (Widiyati et .al. 2004), udang galah
(Macrobrachium rosenbergii) (Hadi et al. 2002), baung (Mystus nemurus) (Nugroho et
al. 2005), ikan anchovy (Engraulis encrasicolus L.) (Turan et al. 2004), Tor tambroides
(Pollar et al. 2007), ikan sardin (Sardina pilchardus) (Silva2003).
Performa meristik melibatkan penghitungan jumlah jari- jari sirip, tulang atau
tulang rawan dari bagian tubuh ikan. Fenotipe meristik sering digunakan untuk
identifikasi dan membedakan genera, spesies, strain, persilangan, populasi atau kelompok
spesies dan individu (Sherizan 2007). Beberapa contoh identifikasi berdasarkan data
Pengukuran performa morfologi lebih mudah dilakukan dan biayanya jauh lebih murah
dibandingkan dengan pemetaan karakter genotipe.
Ragam Genotipe dengan Penanda Molekuler RAPD
Salah satu metode terbaru untuk mengukur variasi genotipe secara lebih akurat
adalah pada tingkat DNA. Marker DNA ini memiliki beberapa keunggulan dibanding
morfometrik, meristik atau marker protein (alozim) untuk penelitian struktur stok dan
variasi genetik (Jayasangkar 2005). Marker DNA banyak diaplikasikan untuk identifikasi
spesies, evaluasi filogeni, menggambarkan struktur stok, pemetaan gen, konservasi gen,
marker untuk seleksi, penentuan strategi pemuliaan dan penentuan variasi genetik
(Jayasangkar 2005).
Penentuan variasi genetik secara molekuler ini dapat dilakukan dengan berbagai
macam metode antara lain adalah Random Amplified Polymorphism DNA (RAPD), DNA
mitokondria dengan teknik Restriction Fragment Length Polymorphism (RFLP) atau
DNA mikrosatelit. Analisis marka RAPD pada sekuens DNA polimorfik yang dipisahkan
oleh gel elektroforesis setelah proses PCR menggunakan satu atau sepasang primer
oligonukleotida pendek secara acak (8-12 base pair) dapat menggambarkan tingkat
polim orfisme genetiknya. Polimorfisme terjadi karena adanya pertukaran basa pada
pasangan primer-situs ikatan atau dari perubahan panjang sekuens yang disebabkan oleh
delesi, insersi dan rearrangements (Dunham 2004).
Kemampuan RAPD dalam mendeteksi polimorfisme cukup tinggi karena primer
oligonukleotida bisa mendata genom yang memiliki situs ikatan perfect dan subperfect
dalam reaksi PCR (Dunham 2004; Liu 2007). Saat dua situs ikatan berjarak cukup dekat
(3000 bp atau kurang), pita RAPD akan terlihat pada gel. Biasanya setiap primer RAPD
mampu mengamplifikasi beberapa pita yang diantaranya polimorfik bahkan untuk
populasi yang sekerabat (Dunham 2004). Variasi genetik dan perbedaan dalam atau
antara taxa biasanya dihitung dari ada tidaknya pita DNA yang muncul yang diatur oleh
perubahan sekuens DNA untuk setiap lokus (Liu 2007).
Menurut Liu (2007), marka RAPD telah digunakan secara luas untuk identifikasi
spesies dan strain ikan dan moluska, analisis struktur populasi udang dan alga, analisis
10
digunakan untuk studi linkage-mapping pada spesies ikan. Linkage map menghasilkan
sejumlah marka RAPD untuk determinasi kelamin, dan juga pola warna, ketahanan
terhadap penyakit, respon imun serta trait kualitatif lain, disamping trait kuantitatif yang
dapat digunakan untuk linkage selection (Jayasangkar 2005). Teknik RAPD telah
digunakan dalam penelitian ikan Barbus sp asal Spanyol (Callejas & Ochando 2003),
ikan mas (Cyprinus carpio) (Bártfai et al. 2001), alga merah (Gelidiumsesquipedale)
(Alberto et al. 1999), rumput laut Kappaphycus alavarezii (Parenrengi et al. 2006) dan
ikan batak (Tor soro) (Asih et al. 2008).
Menurut Beaumont dan Hoare (2003), teknik RAPD merupakan teknik analisis
DNA yang cepat dan murah dalam mendapatkan data molekuler genetik. Hal serupa juga
dinyatakan oleh Dunham (2004), bahwa RAPD memiliki kriteria sebagai sistem marka
yang ideal karena polimorfiknya yang tinggi, mudah dan cepat, serta ekonomis.
Disamping itu RAPD tidak membutuhkan probe atau informasi sekuens seperti untuk
analisis RFLP dan DNA satelit. Sedangkan menurut Liu (2005), RAPD memiliki semua
keunggulan sebagai marka hasil PCR, primer yang digunakan tersedia secara komersial
dan teknik ini tidak membutuhkan pengetahuan mengenai target sekuens DNA atau
Tempat dan Waktu
Penelitian di lakukan di Balai Riset Perikanan Budidaya Air Tawar Bogor. Waktu
pelaksanaan penelitian dilakukan selama 7 bulan.
Pengadaan Ikan\
Ikan yang digunakan sebagai bahan penelitian ini terdiri dari jenis-jenis ikan
nilem yang terdapat di daerah Jawa Barat yaitu Bogor, Tasikmalaya, Kuningan,
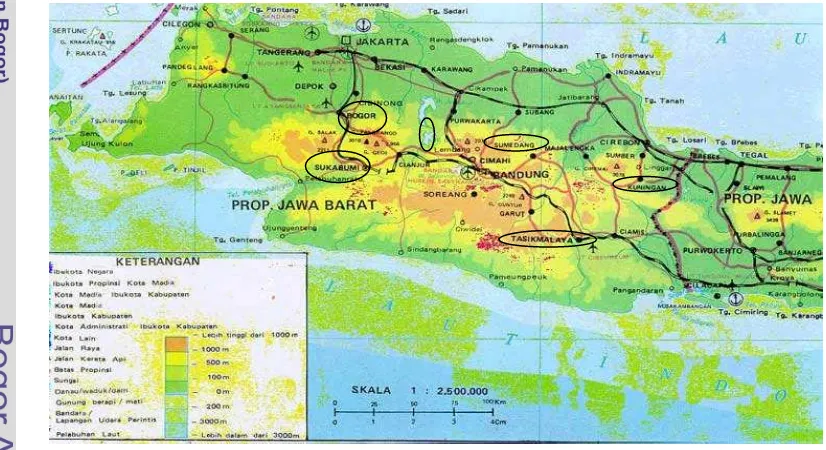
Sumedang, Cirata dan Sukabumi (Gambar 2). Jumlah sampel yang digunakan untuk
analisis morfomeristik masing-masing strain dan lokasi adalah 20 ekor sedangkan untuk
analisis DNA sampel yang digunakan adalah 10 ekor. Pengambilan sampel dilakukan
dengan bantuan pembudidaya setempat. Selanjutnya dari lokasi pengambilan, untuk
analisis DNA sampel disimpan dalam larutan alkohol 70% sebelum dilakukan analisis
lebih lanjut.
12
Karakterisasi Morfologi
Fenotipe Truss Morfometrik
Pengukuran morfologi ikan nilem dilakukan menggunakan metode truss morfometrik.
Metode ini berupa pengukuran jarak titik-titik tanda yang akan dibuat pada kerangka
tubuh. Pemilihan titik truss pada kerangka tubuh ikan merupakan faktor penting dalam
truss morfometrik. Pemilihan titik truss pada ikan nilem diadaptasi dari titik truss pada
ikan mas berdasarkan metode Strauss dan Bookstein (1982) yang dimodifikasi oleh
Corti et al. (1988) yaitu :
1. Titik di bagian atas sirip dada
2. Titik di ujung mulut
3. Titik di akhir sirip perut
4. Titik di atas ujung insang
5. Titik di awal sirip anal
6. Titik di awal sirip punggung
7. Titik di akhir sirip anal
8. Titik di akhir sirip punggung
9. Titik di bawah sirip ekor
10.Titik di atas sirip ekor
Kesepuluh titik tersebut diperoleh dengan cara meletakkan ikan contoh di atas
kertas yang tidak tembus air (posisi kepala menghadap ke kiri) kemudian titik di seluruh
badan pada ikan ditentukan dengan menggunakan paku kecil sehingga terlihat jelas untuk
dibuat garis antar titik (Gambar 3). Selanjutnya masing-masing jarak titik truss di seluruh
badan ikan tadi dihubungkan dan diukur dengan penggaris. Jarak yang diukur meliputi
panjang. lebar, dan diagonal tubuh ikan nilem. Berdasarkan garis-garis tersebut, tubuh
ikan kemudian dibagi atas empat bagian besar dan diberi kode yaitu A, B, C dan D.
Masing-masing menghasilkan enam karakter sehingga dari 10 titik truss diperoleh 21
karakter yaitu :
A1 : Jarak antara titik di akhir sirip perut dengan titik di bagian atas sirip dada
A2 : Jarak antara titik di bagian atas sirip dada dengan titik di ujung mulut
A3 : Jarak antara titik di ujung mulut dengan titik di ujung bagian atas insang
A5 : Jarak antara titik di akhir sirip perut dengan titik di ujung mulut
A6 : Jarak antara titik di bagian ujung atas insang dengan titik di bagian atas sirip dada
B1 : Jarak antara titik di akhir sirip perut dengan titik di awal sirip anal
B3 : Jarak antara titik di ujung bagian atas insang dengan titik di awal sirip punggung
B4 : Jarak antara titik di awal sirip punggung dengan titik di awal sirip anal
B5 : Jarak antara titik di awal sirip anal dengan titik di ujung bagian atas insang
B6 : Jarak antara titik di awal sirip punggung dengan titik di akhir sirip perut
C1 : Jarak antara titik di awal sirip anal dengan titik di akhir sirip anal
C3 : Jarak antara titik di awal sirip punggung dengan titik di akhir sirip punggung
C4 : Jarak antara titik di akhir sirip punggung dengan titik di akhir sirip anal
C5 : Jarak antara titik di awal sirip punggung dengan titik di akhir sirip anal
C6 : Jarak antara titik di awal sirip anal dengan titik di akhir sirip punggung
D1 : Jarak antara titik di akhir sirip anal dengan titik di awal sirip ekor bawah
D3 : Jarak antara titik di akhir sirip punggung dengan titik di awal sirip ekor atas
D4 : Jarak antara titik di awal sirip ekor atas dengan titik di awal sirip ekor bawah
D5 : Jarak antara titik di akhir sirip punggung dengan titik di awal sirip ekor bawah
D6 : Jarak antara titik di akhir sirip anal dengan titik di awal sirip ekor atas
Mengingat ukuran dan umur ikan tidak seragam, oleh karena itu setiap karakter
ikan nilem tersebut perlu dibagi dengan panjang standar ikan.
14
Fenotipe Meristik
Pengukuran meristrik untuk mengukur keragaman genetik enam populasi ikan
nilem yang terdapat di Jawa Barat dilakukan dengan cara menghitung jumlah sirip
punggung (dorsal fin), sirip dada (pectoral fin), sirip perut (ventral fin) dan sirip anal
(anal fin). Sedangkan pengukuran meristik untuk identifikasi spesifik suatu jenis ikan
dilakukan berdasarkan metoda Kottelat (1993) dan klasifikasi dilakukan berdasarkan
Nelson (1994).
Karakterisasi Genotipe dengan Penanda Molekuler RAPD
Pengukuran genotip e ikan dilakukan menggunakan metode RAPD (Nugroho,
1997) diawali dengan proses ekstraksi DNA genom, kemudian uji kualitas DNA, seleksi
primer, amplifikasi DNA menggunakan teknik Polymerase Chain Reaction (PCR) dan
terakhir adalah analisis data.
Ekstraksi DNA
Sampel ikan berupa sirip dorsal ditimbang sebanyak 0,5-1 mg dan dimasukkan
ke dalam tabung Eppendorf 1,5 ml, kemudian dilisis dengan menambahkan larutan lisis
(10mM tris HCl pH 7,5, 125mM NaCl, 10mM EDTA pH 7,5, 0,5% SDS dan 4 M urea)
sebanyak 500 ul dan Protein Kinase sebanyak 15 ul. Setelah itu dikocok menggunakan
alat vorteks dan diinkubasi pada suhu 37oC selama 24 jam atau sampai sirip hancur.
Selanjutnya ditambahkan larutan Fenol : Kloroform : Isoamilalkohol (PCI) dengan
perbandingan 25:24:1 sebanyak 1000 ul dan di sentrifugasipada kecepatan 10.000 rpm
selama 10 menit. Supernatan lalu dipindahkan ke tabung baru dan ditambahkan etanol
90% sebanyak 1000 ul dan Na asetat sebanyak 10 ul lalu di sentrifugasipada kecepatan
10.000 rpm selama 10 menit. Supernatan dibuang dan pellet dikering anginkan sampai
etanol menguap. DNA dilarutkan dengan menambahkan rehydration solution sebanyak
100 ul dan disimpan pada suhu 4oC selama semalam atau pada suhu 65oC selama 1 jam.
Jika DNA belum akan digunakan dalam jangka waktu lama maka disimpan pada suhu –
Uji kualitas DNA
Uji kualitas DNA dilakukan dengan teknik elektroforesis. Pengujian ini pada
prinsipnya adalah mengukur laju migrasi DNA pada gel agarose. Agarose 1% dilarutkan
dalam buffer TBE 1x dan dipanaskan sampai mendidih dan larutan bewarna bening.
Setelah itu larutan agarose hangat-hangat kuku dituangkan ke dalam cetakan gel yang
telah dilengkapi sisir. Gel dibiarkan membeku dan sisir diambil secara hati-hati. Gel
kemudian ditempatkan pada alat/tangki elektroforesis dengan posisi lubang berada pada
posisi kutub negatif. Larutan buffer TBE1x dituang sampai gel terendam. DNA yang
akan dianalisis dicampur dengan bromophenol blue 6x untuk menandai laju migrasi. Alat
elektroforesis kemudian ditutup untuk dihubungkan dengan aliran listrik. Elektroforesis
berlangsung pada 100 Volt selama 30 menit. setelah selesai penutup alat elektroforesis
dibuka, gel agarose diambil kemudian direndam dalam larutan etidium bromida dengan
konsentrasi final 0,5 µg/ml selama 15-30 menit dan selanjutnya dibilas dengan akuades.
Hasil divisualisasi menggunakan ultra violet transluminator.
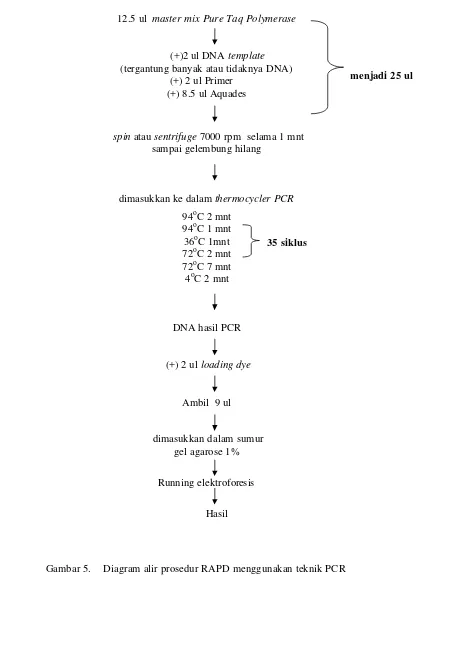
Amplifikasi DNA dengan teknik PCR
Sebelum amplifikasi DNA, dilakukan seleksi primer untuk mendapatkan jenis
primer yang sesuai. Amplifikasi DNA dilakukan menggunakan metode PCR dengan
komposisi bahan sebagai berikut : 2 ul DNA genom hasil ekstraksi, 2 ul primer, 8,5 ul
distilled water dicampur dengan 12,5 ul master mix PCR Fermentas (komposisi : PCR
buffer, enzim Taq polymerase, MgCl2 dan dNTP mix) sehingga total volume menjadi 25
ul. Campuran tersebut kemudian dimasukkan ke dalam mesin PCR yang sudah
diprogram. Secara umum proses PCR terdiri dari tiga tahap yaitu denaturasi (penguraian
utas ganda DNA), penempelan primer (annealing) dan pemanjangan utas DNA
(elongasi). Pre-denaturasi dilakukan pada suhu 94oC selama 2 menit untuk memastikan
kesempurnaan denaturasi, sedangkan denaturasi dilakukan pada suhu 94oC selama 1
menit, annealing pada suhu 36oC selama 1menit, dan elongasi pada suhu 72oC selama 2
menit. Elongasi akhir dilakukan pada suhu 72oC selama 7 menit untuk meyakinkan
proses elongasi berjalan sempurna, proses PCR ini berjalan sebanyak 35 siklus. Untuk
mengetahui keberhasilan amplifikasi primer yang dicobakan, campuran 9 ul hasil PCR
dengan 2 ul loading dye dielektroforesis pada gel agarose 2% (w/v) dalam larutan TBE
16
agar pita DNA dapat terlihat pada cahaya ultra violet untuk keperluan dokumentasi
menggunakan kamera. Gene Ruler 100bp DNA ladder digunakan sebagai standar untuk
menentukan ukuran fragmen hasil amplifikasi (Gambar 5).
Sampel 0.5-1 mg
(+) larutan lisis 500 ul
(+) Protein Kinase 15 ul
Vorteks
Inkubasi suhu 37oC sampai hancur
(+)Fenol:Kloroform:Isoamilalkohol (PCI) 1000 ul
Sentrifugasi 10.000 rpm, 10 mnt
Ambil supernatan
(+) etanol 90% 1000 ul
(+) Na asetat 10 ul
sentrifuge 10.000 rpm, 10 mnt
ambil pellet
kering anginkan sampai tdk ada etanol
(+) DNA rehydration sol. 100 ul, suhu 4oC 1 mlm/65oC 1 jam
Jk blm akan digunakan : elektroforesis Simpan suhu 2-8oC (short term)
Suhu –20oC (long term)
12.5 ul master mix Pure Taq Polymerase
(+)2 ul DNA template
(tergantung banyak atau tidaknya DNA) (+) 2 ul Primer
(+) 8.5 ul Aquades
spin atau sentrifuge 7000 rpm selama 1 mnt sampai gelembung hilang
dimasukkan ke dalam thermocycler PCR
94oC 2 mnt 94oC 1 mnt
36oC 1mnt 72oC 2 mnt 72oC 7 mnt 4oC 2 mnt
DNA hasil PCR
(+) 2 ul loading dye
Ambil 9 ul
dimasukkan dalam sumur gel agarose 1%
Running elektroforesis
Hasil
Gambar 5. Diagram alir prosedur RAPD menggunakan teknik PCR
35 siklus
18
Pengumpulan Data Pendukung
Pengumpulan data pendukung dilakukan untuk mengetahui pengaruh lingkungan
terhadap perubahan morfologi maupun genotip e ikan nilem. Pengaruh lingkungan yang
diamati adalah: sistem budidaya (pemupukan, padat tebar, nutrisi) dan sistem rekrutmen
(peremajaan). Pengumpulan data dilakukan melalui wawancara dengan pembudidaya di
lokasi pengambilan sampel dan melalui data sekunder.
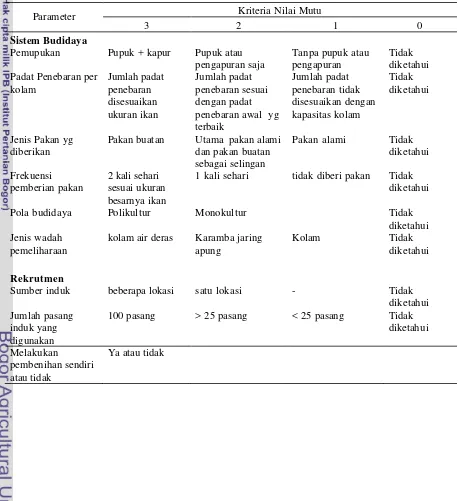
Tabel 1. Kriteria nilai mutu untuk sistem budidaya dan rekrutmen
Parameter Kriteria Nilai Mutu
3 2 1 0
Sistem Budidaya
Pemupukan Pupuk + kapur Pupuk atau
pengapuran saja
Pakan buatan Utama pakan alami
dan pakan buatan
1 kali sehari tidak diberi pakan Tidak
diketahui
Pola budidaya Polikultur Monokultur Tidak
diketahui Jenis wadah
pemeliharaan
kolam air deras Karamba jaring
Analisis data
Parameter yang diukur dalam penelitian ini adalah keragaman genetik dan
morfologi serta filogenetik dari ikan nilem yang ada di daerah Jawa Barat. Untuk
mengukur parameter tersebut di atas, ada beberapa karakter yang dianalisis sebagai
berikut:
1. Karakter fenotipe truss morfometrik dan meristik
a. Rerata truss morfometrik
b. Rerata koefisien keragaman (CV) karakter truss morfometrik dan persentasi
ukuran fenotipe meristik
c. Uji signifikansi dan korelasi
d. Analisis canonical discriminant dilakukan untuk mendapatkan pola penyebaran
karakter morfologi ikan nilem
Zjk = a + W1X1k + W2X2k+...+WnXnk
Dimana :
Zjk = Nilai (skor) diskriminan dari responden (obyek) ke- i
a = Intercept
Xnk = Variabel independen n untuk objek ke-k
Wn = Koefisien atau timbangan diskriminan untuk variabel independen
e. Analisis sharing component
f. Analisis hirarki cluster dilakukan untuk mendapatkan matriks jarak genetik dan
dendogram populasi ikan nilem
Analisis data dilakukan menggunakan program software SPSS 11.5
2. Karakter genotip dengan RAPD
a. Derajat polimorfisme
P 0.95 = Jumlah lokus polimorfik x 100%
Jumlah lokus total
20
n
h = 1 – S Xi2 i=1 Dimana :
h= heterozigositas
n= jumlah sampel
Xi2 = frekwensi alel ke –i
c. Jarak genetik
D= -ln Jab
(Ja x Jb)0.5
Dimana :
D = Jarak genetik
Jab = frekwensi haplotipe pada lokus populasi yang sama
Ja dan Jb = frekwensi haplotipe pada populasi A dan B
Untuk menentukan jarak genetik dan pembuatan dendrogram dilakukan dengan
metode Unweight Pair Group Methods Arithmetic (UPGMA), data biner
dianalisis dengan menggunakan program komputer Tools For Population
Genetic Analysis (TFPGA) (Miller, 1997).
3. Data Pendukung
Hasil
Karakteristik Fenotipe dan Genotipe Ikan Nilem Hijau di Jawa Barat
Truss Morfometrik
Pengukuran truss morfometrik dilakukan terhadap 21 karakter ikan nilem yang
berasal dari enam populasi yaitu Sukabumi, Bogor, Cirata, Sumedang, Tasikmalaya dan
Kuningan. Keragaman morfometrik dinyatakan dalam koefisien keragaman karakter
(CV). Rerata dan simpangan baku dari enam populasi tersebut disajikan dalam Tabel 2
sedangkan koefisien keragaman karakter truss morfometrik disajikan dalam Tabel 3.
22
Tabel 3. Koefisien keragaman (CV) morfometrik enam populasi ikan nilem hijau di Jawa Barat
Karakter yang diukur Koefisien keragaman (%)
SKB BGR CRT SMD TSM KNG Rerata
Koefisien keragaman 21 karakter ikan nilem yang diukur, memiliki nilai rata-rata
yang tergolong rendah yaitu berkisar antara 3,38 sampai 10,35%. Karakter yang memiliki
nilai CV tertinggi adalah karakter D1 (Jarak antara titik di akhir sirip anal dengan titik di
awal sirip ekor bawah), sedangkan karakter yang memiliki nilai terendah adalah karakter
C5 (Jarak antara titik di awal sirip punggung dengan titik di akhir sirip anal) (Tabel 3).
Analisis korelasi dilakukan untuk mengetahui derajat hubungan antar karakter.
Dalam penelitian ini terdapat perbedaan nilai korelasi karakter baik positif maupun
Nilai positif menunjukkan adanya hubungan yang sejalan antara satu karakter dengan
karakter lainnya. Sedangkan nilai negatif menunjukkan hubungan yang berlawanan
antara satu karakter dengan karakter yang lain. Nilai korelasi positif tertinggi diperoleh
antara A4 (Jarak antara titik di ujung bagian atas insang dengan titik di bagian atas sirip
perut) dengan A5 (Jarak antara titik di akhir sirip perut dengan titik di ujung mulut) yaitu
sebesar 0,706, sedangkan untuk korelasi positif terendah diperoleh antara A2 (Jarak
antara titik di bagian atas sirip dada dengan titik di ujung mulut) dengan A4 (Jarak antara
titik di ujung bagian atas insang dengan titik di bagian atas sirip perut ) dengan nilai
sebesar 0,013. Nilai korelasi negatif tertinggi adalah antara A3 (Jarak antara titik di ujung
mulut dengan titik di ujung bagian atas insang) dengan B3 (Jarak antara titik di ujung
bagian atas insang dengan titik di awal sirip punggung) dengan nilai sebesar -0,429,
sedangkan untuk nilai korelasi negatif terendah adalah antara C3 (Jarak antara titik di
awal sirip punggung dengan titik di akhir sirip punggung) dengan C6 (Jarak antara titik
di awal sirip anal dengan titik di akhir sirip punggung) yaitu sebesar -0,002.
Uji signifikansi dilakukan untuk melihat karakter mana yang tidak berbeda untuk
dijadikan sebagai karakter penciri atau marka dari suatu jenis ikan. Berdasarkan uji F
distribusi diketahui bahwa dari 21 karakter yang diuji, 17 karakter berbeda nyata ( P<
0,05) dan hanya 4 karakter yang tidak berbeda nyata (P>0,05) yaitu karakter B4 (Jarak
antara titik di awal sirip punggung dengan titik di awal sirip anal), C1 (Jarak antara titik
di awal sirip anal dengan titik di akhir sirip anal), C4 (Jarak antara titik di awal sirip
punggung dengan titik di akhir sirip anal) dan C5 (Jarak antara titik di awal sirip anal
dengan titik di akhir sirip punggung). Hal analisis statistik ini menunjukkan bahwa
keempat karakter tersebut merupakan penciri ikan nilem (Lampiran 2).
Hasil analisis penyebaran karakter morfometrik ikan nilem antar populasi
disajikan dalam Gambar 6. Dalam gambar tersebut diperlihatkan karakter morfologi ikan
nilem yang berasal dari Sukabumi mengumpul di sebelah kanan ordinat Y dan bagian
bawah axis X. Sedangkan karakter ikan nilem asal Bogor mengumpul di sebelah kiri
ordinat Y dan berada disekitar dan bawah axis X. Karakter ikan nilem asal Cirata berada
di sebelah kanan ordinat Y dan di atas axis X, sedangkan karakter nilem asal Sumedang
berada disekitar garis nol dari axis X dan Y. Karakter nilem Tasikmalaya berada
24
sebelah kanan ordinat Y dan disekitar garis 0 axis X. Populasi Sukabumi bersinggungan
dengan populasi dari kuningan dan Sumedang. Populasi dari Bogor hanya bersinggungan
dengan populasi dari Tasikmalaya. Sedangkan populasi Tasikmalaya selain
bersinggungan dengan populasi Bogor juga bersinggungan dengan populasi Sumedang.
Populasi Sumedang bersinggungan dengan populasi dari Sukabumi, Cirata dan
Kuningan.
Gambar 6. Penyebaran karakter morfometrik enam populasi ikan nilem hijau di Jawa Barat
Hasil dari penyebaran karakter morfometrik diperkuat oleh nilai dari sharing
component morfometrik atau indeks kesamaan inter-populasi ikan nilem hijau di Jawa
Barat. Pendugaan sharing component ini dilakukan dengan menggunakan hasil analisis
diskriminan berdasarkan kesamaan ukuran tubuh tertentu.
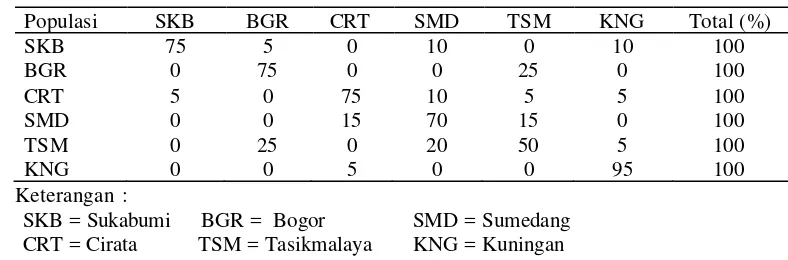
Kesamaan intra- populasi dari Sukabumi adalah sebesar 75%, populasi ini sharing
dengan Bogor sebanyak 5% dan sharing dengan Sumedang dan Kuningan
masing-masing 10%. Kesamaan intra populasi dari Bogor adalah 75% dan hanya memiliki
kesamaan dengan Tasikmalaya sebanyak 25%, Sedangkan kesamaan intra-populasi
Sukabumi dan Kuningan masing-masing 5%. Kesamaan intra-populasi Sumedang
adalah sebesar 70% memiliki kesamaan dengan Cirata dan Tasikmalaya masing-masing
sebanyak 15%, Tasikmalaya memiliki kesamaan intra-populasi paling rendah dibanding
populasi lain yaitu sebesar 50% dan sharing dengan Bogor sebanyak 25%, Sumedang
20% dan Kuningan 5%. Sedangkan Kuningan memiliki kesamaan intra-populasi paling
tinggi diantara populasi lainnya yaitu sebesar 95% sharing hanya dengan populasi dari
Cirata sebesar 5% (Tabel 4).
Dalam bentuk dendrogram, hubungan inter-populasi ikan nilem hijau di Jawa
Barat terbagi menjadi tiga kelompok utama (Gambar 7). Kelompok pertama terdiri dari
populasi Cirata, Sumedang, Sukabumi dan Kuningan. Sedangkan kelompok kedua adalah
antara kelompok pertama dengan populasi Tasikmalaya dan kelompok ketiga adalah
kelompok kedua dengan populasi Bogor.
26
Meristik
Pengukuran meristik ikan nilem hijau yang berasal dari 6 lokasi di daerah Jawa
Barat dilakukan dengan cara menghitung jumlah dari sirip dorsal, sirip pektoral kanan
dan kiri, sirip ventral kanan dan kiri serta sirip anal. Rerata dan simpangan baku dari
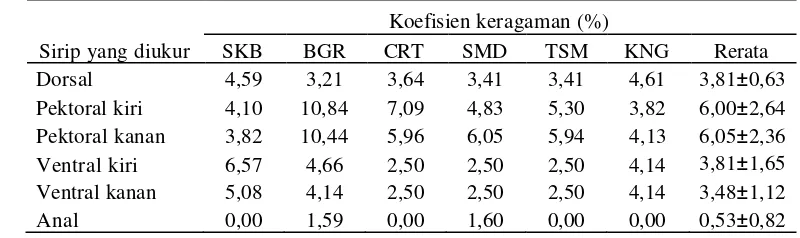
karakter meristik ikan nilem yang diuji disajikan dalam Tabel 5.
Tabel 5. Rerata enam karakter meristik dari enam populasi ikan nilem hijau di Jawa
Koefisien dari karakter-karakter ikan nilem hijau yang diukur menggunakan
metode meristik, cenderung rendah. Koefisien keragaman tertinggi ada pada karakter
sirip pektoral kanan yaitu 6,05, sedangkan koefisien keragaman terendah adalah karakter
sirip anal yaitu 0,53 (Tabel 6).
Tabel 6. Koefisien keragaman (CV) dari enam karakter meristik pada enam populasi ikan nilem hijau di Jawa Barat
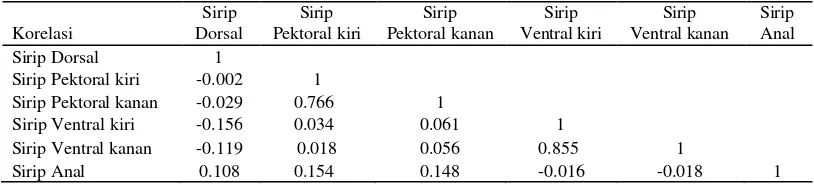
Analisis korelasi yang dilakukan dalam penelitian ini memiliki korelasi karakter
baik positif maupun negatif pada ikan nilem hijau yang berasal dari enam populasi di
Jawa Barat (Tabel 7). Nilai korelasi positif tertinggi adalah antara sirip ventral kiri
dengan sirip ventral kanan yaitu sebesar 0,855, sedangkan untuk korelasi positif terendah
adalah antara sirip pektoral kiri dengan sirip ventral kanan nilai sebesar 0,018. Nilai
korelasi negatif tertinggi adalah antara sirip dorsal dengan sirip ventral kiri yaitu sebesar
-0,156, sedangkan untuk nilai korelasi negatif terendah adalah antara sirip dorsal dengan
sirip pektoral kiri yaitu sebesar -0,002.
Tabel 7. Matriks korelasi antar karakter mer istik enam populasi ikan nilem hijau di Jawa Barat
Berdasarkan uji F distribusi diketahui bahwa dari 6 karakter yang diuji yaitu sirip
dorsal, sirip pektoral kiri, sirip pektoral kanan, sirip ventral kiri, sirip ventral kanan dan
sirip anal tidak ada yang berbeda nyata (P>0,05) (Lampiran 3).
Hasil analisis penyebaran karakter meristik ikan nilem hijau antar populasi
disajikan dalam Gambar 8. Dalam gambar tersebut diperlihatkan karakter morfologi ikan
nilem yang berasal dari Sukabumi mengumpul di antara perpotongan ordinat Y dan axis
28
Gambar 8. Penyebaran karakter meristik enam populasi ikan nilem hijau yang terdapat di daerah Jawa Barat
Dendrogram mengenai hubungan inter-populasi ikan nilem hijau di Jawa Barat
disajikan dalam Gambar 9. Dalam dendrogram tersebut, ikan nilem hijau di bagi menjadi
empat kelompok utama yaitu kelompok pertama adalah kelompok yang terdiri dari
populasi Bogor, Cirata dan Kuningan. Kemudian kelompok kedua adalah populasi
Bogor-Cirata- Kuningan dengan populasi Tasikmalaya. Kelompok ketiga adalah populasi
Bogor-Cirata- Kuningan-Tasikmalaya dengan Sumedang. Sedangkan kelompok keempat
adalah kelima populasi tersebut diatas dengan populasi Sukabumi.
0 5 10 15 20 25
Keragaman Genotipe RAPD
Dari 20 primer yang dicoba ada 4 primer yang menghasilkan fragmen-fragmen
dari DNA nilem yang di uji. Namun hanyai 1 primer menunjukkan hasil PCR yang paling
baik. Primer OPA-11 mempunyai fragmen yang dapat digunakan sebagai pembeda
diantara populasi ikan nilem hijau yang diuji. Gambar hasil RAPD disajikan dalam
Gambar 10. Beberapa fragmen RAPD yang didapatkan mengindikasikan fragmen
spesifik populasi yakni fragmen yang hanya didapatkan pada populasi tertentu. Misalnya
fragmen 1100 bp yang hanya didapatkan pada populasi Sumedang dan fragmen 400 bp
pada populasi Bogor. Fragmen 3100 bp hanya dimiliki oleh populasi Sumedang dan
Kuningan, fragmen 1700 bp hanya ada pada populasi Sumedang dan Tasikmalaya,
fragmen 225 bp pada populasi Bogor dan Sukabumi, sedangkan fragmen 1300 dan 500
bp pada populasi Bogor dan Kuningan. Fragmen 2900 dan 1500 bp hanya dimiliki oleh
populasi Tasikmalaya, Sumedang, dan Bogor, sedangkan fragmen 1600 bp hanya ada
pada populasi Tasikmalaya, Sumedang dan Kuningan. Fragmen 750 bp didapatkan pada
semua populasi ikan nilem di Jawa Barat kecuali Sukabumi (Lampiran 5).
Gambar 10. Pola fragmen RAPD ikan nilem hijau dari enam populasi di Jawa Barat
yang diamplifikasi menggunakan primer OPA-11
Keragaman genetik yang ditentukan oleh nilai rata-rata heterozigositas dan
persentase polimorfisme ikan nilem hijau yang dianalisis disajikan dalam Tabel 8.
Heterozigositas dari enam populasi ikan nilem hijau di Jawa Barat memiliki nilai yang
hampir sama berkisar antara 0,1054-0,2138. Nilai heterozigositas tertinggi terlihat pada
populasi dari Sumedang (0,2138) dan nilai terendah adalah ikan yang berasal dari
Sukabumi (0,1054). Sedangkan persentase polimorfisme dari enam populasi ikan nilem
hijau tersebut berkisar antara 40-68%. Persentase polimorfisme tertinggi berasal dari
Bogor Sukabumi Sumedang Tasikmalaya Kuningan Cirata
1000 bp
30
daerah Sumedang yaitu 68%, sedangkan persentase polimorfisme terendah berasal dari
Cirata yaitu 40%.
Tabel 8. Heterozigositas dan persentase polimorfisme enam populasi ikan nilem hijau di Jawa Barat hasil RAPD menggunakan primer OPA-11
SKB BGR CRT SMD TSM KNG
Heterozigositas 0,1054 0,1674 0,1095 0,2138 0,1698 0,1877
Polimorfisme (%) 44 64 40 68 64 60
Keterangan :
SKB = Sukabumi BGR = Bogor SMD = Sumedang CRT = Cirata TSM = Tasikmalaya KNG = Kuningan
Secara statistik dengan menggunakan uji perbandingan berpasangan Fst
menunjukkan bahwa tidak terdapat perbedaan genetik yang nyata antara populasi ikan
yang diuji (P>0,05) kecuali antara populasi Sumedang dengan Sukabumi, Bogor dan
Cirata serta antara populasi Tasikmalaya dengan Sukabumi (P<0,05) seperti terlihat pada
Tabel 9.
Tabel 9. Uji perbandingan berpasangan Fst enam populasi ikan nilem hijau di Jawa Barat
SKB BGR CRT SMD TSM KNG
Jarak genetik (D) yang dihitung menurut Nei (1978) secara komputasi dengan
program TFPGA berdasarkan fragmen RAPD dari primer OPA-11 antara koleksi ikan
nilem hijau tertera pada Tabel 10. Berdasarkan perhitungan jarak genetik dari 6 populasi
ikan nilem hijau, diperoleh nilai jarak genetik terdekat adalah antara populasi dari Cirata
dengan Kuningan yaitu 0, 0175dan antara populasi Bogor dengan Cirata yaitu 0,0233.
Berikutnya adalah jarak genetik antara populasi Kuningan dengan populasi Sumedang
yaitu 0,0251, populasi Kuningan dengan populasi Tasikmalaya (0,0317) dan antara
populasi Bogor dengan populasi Tasikmalaya (0,0337) serta populasi Cirata dengan
populasi Tasikmalaya (0,0525). Selanjutnya adalah jarak genetik antara populasi
Sumedang dengan populasi Tasikmalaya (0,0528), populasi Bogor dengan Sumedang
(0,0618), populasi Bogor dengan Sukabumi (0,0770), dan antara populasi Cirata dengan
Sukabumi (0,0773). Kemudian antara Sumedang dengan Cirata (0,0815) dan antara
Sumedang dengan Sukabumi yaitu sebesar 0,1046. Sedangkan jarak genetik terjauh
adalah antara Sukabumi dengan Tasikmalaya (0,1392).
Tabel 10. Matriks jarak genetik inter-populasi ikan nilem hijau di Jawa Barat
SKB BGR CRT SMD TSM KNG
SKB *****
BGR 0,0770 *****
CRT 0,0773 0,0233 *****
SMD 0,1046 0,0618 0,0815 *****
TSM 0,1392 0,0337 0,0525 0,0528 *****
KNG 0,0875 0,0175 0,0153 0,0251 0,0317 *****
Keterangan :
SKB = Sukabumi BGR = Bogor SMD = Sumedang CRT = Cirata TSM = Tasikmalaya KNG = Kuningan
Dendrogram yang dibentuk berdasarkan jarak genetik tersebut dengan
menggunakan program Unweighted Pair Group Arithmatic Average (UPGMA)
memperlihatkan hubungan terdekat adalah antara populasi Cirata dengan Kuningan,
Bogor dan Tasikmalaya sedangkan yang terjauh adalah antara keempat populasi tersebut
32
Keterangan : SKB = Sukabumi BGR = Bogor CRT = Cirata SMD = Sumeda TSM = Tasikmalaya KNG = Kuningan
Gambar 11. Dendrogram hubungan kekerabatan enam populasi ikan nilem hijau yang terdapat di Jawa Barat
Hubungan Interspesifik Empat Jenis Ikan Nilem di Tasikmalaya
(Jawa Barat)
Truss Mo rfometrik
Pengukuran truss morfometrik dilakukan terhadap 21 karakter dari empat jenis
ikan nilem yang berasal dari Tasikmalaya (Jawa Barat) yaitu ikan nilem hijau, nilem
merah, nilem were dan nilem beurem panon atau baragala. Rerata dan simpangan baku
disajikan dalam Tabel 11, sedangkan koefisien keragaman morfometrik empat jenis ikan
nilem yang ada di Tasikmalaya disajikan dalam Tabel 12.
CRT
KNG
BGR
TSM
SMD
Tabel 11. Rerata 21 karakter fenotipe truss morfometrik empat jenis ikan nilem di Tasikmalaya (Jawa Barat)
Karakter yang diukur
Rerata
Nilem Hijau Nilem Merah Nilem Were N. Beureum Panon
A1 0,28±0,03 0,31±0,04 0,30±0,02 0,31±0,03
Nilai rata-rata distribusi F dari 21 karakter ikan nilem terdapat perbedaan yang
nyata, kecuali pada karakter B5 (Jarak antara titik di awal sirip anal dengan titik di ujung
bagian atas insang) (Lampiran 4). Hasil analisis penyebaran karakter fenotipik inter
spesifik ikan nilem memperlihatkan populasi yang memiliki karakteristik ikan nilem
hijau mengumpul di sebelah kiri ordinat Y dan bagian bawah axis X. Demikian pula
dengan karakter istik ikan nilem merah yang mengumpul di sebelah kiri ordinat Y dan
bawah axis X. Karakter istik fenotipe ikan nilem were berada di sebelah kiri ordinat Y dan
di atas axis X, sedangkan karakteristik nilem beureum panon berada di sebelah kanan
ordinat Y dan disekitar garis nol dari axis X. Distribusi karakteristik populasi ikan nilem
hijau dengan nilem merah saling bersinggungan, sedangkan populasi nilem were dan
34
Tabel 12. Koefisien keragaman morfometrik empat jenis ikan nilem di Tasikmalaya (Jawa Barat)
Berdasarkan nilai indeks kesamaan atau sharing component (Tabel 13), diketahui
bahwa karakteristik nilem hijau terdistribusi secara bersama-sama dengan populasi nilem
merah (15%) dan tidak ditemukan dalam populasi ikan nilem were dan nilem beureum
panon (0%). Sedangkan nilem merah ditemukan dalam populasi nilem hijau sebesar
20% dan tidak terdistribusi dalam populasi ikan nilem were maupun nilem beureum
panon. Nilem were memiliki keseragaman internal sebesar 100% dan tidak terdapat
dalam populasi nilem hijau, nilem merah maupun dengan nilem beureum panon. Nilem
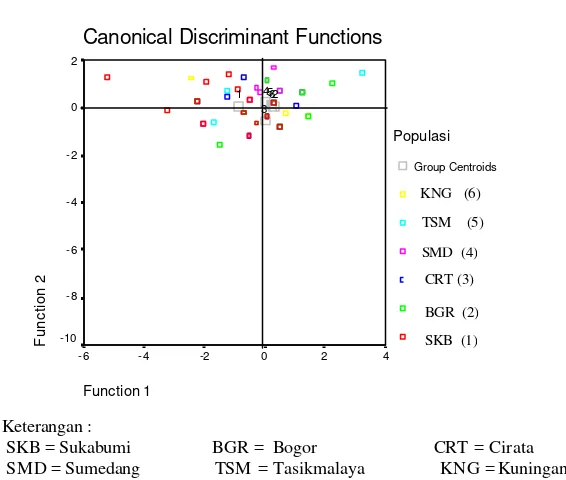
Canonical Discriminant Functions
Gambar 12. Penyebaran karakter morfometrik empat jenis ikan nilem yang terdapat di Tasikmalaya ( Jawa Barat)
Tabel 13. Persentase sharing component ( indeks kesamaan) empat jenis ikan nilem yang terdapat di daerah Tasikmalaya (Jawa Barat)
Jenis Nilem Hijau Nilem Merah Nilem Were Nilem Beureum Panon Total (%)
Nilem Hijau 85 15 0 0 100
Nilem Merah 20 80 0 0 100
Nilem Were 0 0 100 0 100
Nilem Beureum Panon 0 0 0 100 100
Secara skematis yang digambarkan melalui dendrogram (Gambar 13), hubungan
keempat jenis ikan nilem yang terdapat di daerah Jawa Barat digambarkan dalam tiga
kelompok yaitu : 1 ) kelompok ikan nilem hijau dengan ikan nilem merah, 2) kelompok
nilem hijau-nilem merah dengan ikan nilem were, 3) kelompok ikan nilem hijau-nilem
merah- nilem were dengan nilem beureum panon.
(4)
(3)
(2)
36
Gambar 13. Dendrogram hubungan inter spesifik 4 jenis ikan nilem yang terdapat di Tasikmalaya (Jawa Barat) berdasarkan fenotipe morfometrik
Meristik
Pengukuran secara meristik telah dilakukan terhadap empat jenis ikan nilem yang
terdapat di Jawa Barat yaitu antara lain ikan nilem hijau, nilem merah, ikan nilem were
dan ikan nilem beureum panon.
Ikan Nilem Hijau
Berdasarkan hasil pengukuran meristik dengan melihat deskripsi dari ikan nilem
hijau ini yaitu :
• Jari bercabang sirip punggung 12-18 ½
• 6-9 baris bintik-bintik gelap pada sisi tubuh, bagian kepala dan tubuh bagian atsa lebih gelap, di batang ekor ada bulatan hitam
• Tidak ada tubus di moncong, bibir atas bagian bawah terbagi menjadi beberapa bagian (bentuk endomorf)
Dapat diklasifikasikan (Nelson, 1994) bahwa ikan nilem hijau adalah :
Superorder : Ostariophysi
Ordo : Cypriniformes
Familia: Cyprinidae
Genus : Osteochillus
Species : Osteochillus hasselti
Ikan Nilem Merah
Berdasarkan hasil pengukuran meristik dengan melihat deskripsi dari ikan nilem
merah ini yaitu :
• Jari bercabang pada sirip anal 5, jari bercabang pada sirip dorsal 15
• Linea lateralis 34, sisik antara linea lateralis dan awal sirip punggung 5 ½ , sisik pada batang ekor 16
• Moncongnya menyiku ke atas, keras, tidak ada tubus di moncong namun dijumpai tonjolan yang mengeras
• Bibirnya berumbai, bibir atas bagian ventral terbagi-bagi (endomorf)
• Pola warna tubuh kuning oranye dengan bercak kehitaman di tubuh
• Dari ciri-ciri di atas ikan ini tergolong genus Osteochillus, namun belum diketahui spesiesnya
Klasifikasi menurut Nelson ( 1994), ikan nilem merah termasuk ke dalam: