AKTIVITAS EKSTRAK KASAR TANIN DAUN PEPAYA
DALAM MENGURANGI EKSPRESI GEN PEMBENTUK
STAPHYLOCOCCAL ENTEROTOXIN A
TRI ISTI RAHAYU
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Aktivitas Ekstrak Kasar Tanin Daun Pepaya dalam Mengurangi Ekspresi Gen Pembentuk Staphyococcal Enterotoxin A adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Tri Isti Rahayu
RINGKASAN
TRI ISTI RAHAYU. Aktivitas Ekstrak Kasar Tanin Daun Pepaya dalam Mengurangi Ekspresi Gen Pembentuk Staphyococcal Enterotoxin A. Dibimbing oleh HARSI DEWANTARI KUSUMANINGRUM dan SITI NURJANAH.
Daun pepaya banyak digunakan untuk mengempukkan daging karena memiliki enzim papain. Dalam aplikasinya daun pepaya sering digunakan untuk membungkus daging. Daun pepaya juga diketahui memiliki kemampuan antibakteri. Salah satu komponen bioaktif pada daun pepaya yang berperan sebagai anti bakteri adalah tanin. Tanin diketahui dapat menghambat pertumbuhan bakteri dengan merusak sel bakteri, salah satunya adalah Staphylococcus aureus.
S. aureus dapat menyebabkan keracunan makanan karena menghasilkan
enterotoxin. Salah satu enterotoxin yang dihasilkan disandikan oleh gen sea. Tanin juga dilaporkan dapat mengganggu metabolisme dengan berinteraksi dengan DNA Calf thymus. Tanin selain dapat menghambat pertumbuhan S.aureus
diharapkan juga mampu berinteraksi dengan DNA S. aureus sehingga akhirnya dapat menyebabkan terhambatnya ekspresi penyandi gen sea.
Penelitian ini bertujuan untuk membandingkan prosedur ekstraksi tanin dari daun pepaya, memverifikasi keberadaan gen sea pada 2 jenis isolat S.aureus (SJ1 dan S10), menentukan aktivitas antimikroba ekstrak kasar tanin terhadap S.aureus
dan menentukan kemampuan ekstrak kasar tanin daun pepaya dalam mengurangi ekspresi gen sea secara relatif dengan menggunakan Reverse Transcriptase Real- Time PCR
Ekstraksi ekstrak kasar tanin dari daun pepaya Calina dengan dilakukan dengan membndingkan metode kombinasi antara proses refluks dan maserasi dengan metode Ultrasound Assisted Extraction (UAE). Isolat S. aureus SJ1 dan S10 diverifikasi secara molekuler apakah merupakan penghasil SEA. Isolat ini selanjutnya digunakan pada tahapan penentuan aktivitas antimikroba ekstrak kasar tanin dengan metode cakram (konsentrasi 0 mg/mL, 50 mg/mL dan 100 mg/mL) dan pengenceran makro (konsentrasi 0 mg/mL, 5 mg/mL, 10 mg/mL dan 20 mg/mL), pemaparan S. aureus dengan ekstrak kasar tanin daun pepaya (konsentrasi 0 mg/mL, 5 mg/mL dan 10 mg/mL), serta pada pengukuran tingkat ekspresi gen sea secara relatif dengan qRT-PCR.
Ekstraksi menggunakan metode kombinasi antara proses refluks dan maserasi menghasilkan jumlah rendemen yang lebih tinggi (4.27%) dibandingkan dengan menggunakan metode UAE (1.83%). Kultur SJ1 yang diisolasi dari sate jeroan dan S10 yang berasal dari susu sapi mentah positif merupaan bakteri
S.aureus dilihat dari terbentuknya amplikon berukuran 240 pb dan positif merupaka penghasil SEA dilihat dari terbentuknya amplikon berukuran 120 pb. Selama 24 jam pemaparan, ekstrak kasar tanin hasil refluks dan maserasi dengan konsentrasi 20 mg/mL mampu menekan pertumbuhan S.aureus secara nyata. Pemaparan S.aureus dengan ekstrak kasar tanin konsentrasi 5 mg/mL dan 10 mg/mL selama 1 jam belum mampu menurunkan jumlah S.aureus namun mampu menurunkan jumlah ekspresi gen sea secara signifikan yaitu 6.65 kali dan 11.83 kali pada SJ1 serta 2.75 kalidan 4.35 kali pada S10.
SUMMARY
TRI ISTI RAHAYU. Activity of Crude Tannin Extract of Papaya Leaves in Reducing Staphylococcal Enterotoxin A Gene Expression. Supervised by HARSI DEWANTARI KUSUMANINGRUM and SITI NURJANAH.
Papaya leaves are widely utilized as a meat tenderizer because they have
papain enzyme. On its application, papaya leaves are often used to wrap meat. Papaya leaves have also been known to possess anti-bacterial activities. One of the important bioactive components which served as anti-bacterial agents is tannins. Tannins can inhibit bacterial growth by destroying the bacterial cells, such as Staphylococcus aureus. S. aureus can cause food poisoning because it produces an enterotoxin. One of the enterotoxins which has been known is encoded by the sea gene. Tannins have also been reported to interfere with the metabolism by interacting with calf thymus DNA. Thus, tannins can inhibit S. aureus growth and was expected to interact with S. aureus DNA, and finally could decrease the expression of sea-encoding gene.
This research was aimed to compare the extraction procedure of tannin from papaya leaves, verify the existence of genes sea on 2 isolates of S. aureus (SJ1 and S10), determine the antimicrobial activity of crude tannin extract towards S. conventional PCR to verify the ability to produce SEA. These isolates were then used to determine antimicrobial activity of crude tannin extract by disc diffussion method (concentration 0 mg/mL, 50 mg/mL and 100 mg/mL) and macro dilution method (concentration 0 mg/ml, 5 mg/mL, 10 mg/mL and 20 mg/mL), exposure of crude tannins extract from papaya leaves on S. aureus (concentration of 0 mg/ml, 5 mg/mL and 10 mg/mL), and measurement of sea gene relative expression by qRT-PCR.
Extraction using combination between reflux and maceration process produced a higher amount of yield (4.27%) compared to using UAE (1.83%). SJ1 culture that was isolated from offal satay and S10 from raw cow's milk were tannin extract at low concentrations 5 mg/mL and 10 mg/mL were able to reduce
sea gene relative expression in S. aureus. S. aureus by 6.65 times and 11.83 times at SJ1 and 2.75 times and 4.35 times at S10.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
AKTIVITAS EKSTRAK KASAR TANIN DAUN PEPAYA
DALAM MENGURANGI EKSPRESI GEN PEMBENTUK
STAPHYLOCOCCAL ENTEROTOXIN A
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji syukur penulis panjatkan kehadirat Tuhan Yang Maha Kuasa karena telah melimpahkan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penyusunan tesis yang berjudul Aktivitas Ekstrak Kasar Tanin Daun Pepaya dalam Mengurangi Ekspresi Gen Pembentuk Staphyococcal Enterotoxin A. Tesis ini disusun untuk memenuhi salah satu syarat untuk menyelesaikan pendidikan strata dua (S2) Program Studi Ilmu Pangan, Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Harsi Dewantari Kusumaningrum dan Dr Siti Nurjanah, STP, MSi selaku pembimbing yang telah memberikan pengarahan, bimbingan, saran, motivasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Ucapan terimakasih kepada Direktorat Jendral Pendidikan Tinggi, Kementerian Pendidikan dan Kebudayaan Republik Indonesia yang telah memberikan beasiswa BPPDN Calon Dosen dan telah mendanai penelitian ini melalui Hibah Penelitian Unggulan Perguruan Tinggi Lanjutan tahun 2014-2015 atas nama Dr. Ir. Harsi D Kusumaningrum. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Puspo Edi Giriwono PhD dan Dr Ir Endang Prangdimurti MSi selaku Sekretaris Program Studi Ilmu Pangan IPB, yang telah memberikan masukan pada saat ujian sidang tesis untuk membuat karya ilmiah ini menjadi lebih baik.
Ungkapan terima kasih yang tak terhingga juga penulis ucapkan kepada kedua orang tua bapak Drs. I Made Dharmaputra dan ibu Dra. Sayu Made Susilawati, kakak, adik serta seluruh keluarga besar tercinta, atas segala doa, semangat, dukungan, motivasi dan kasih sayangnya selama ini. Penulis juga ingin menyampaikan terima kasih kepada semua pihak, teknisi laboratorium, pacar (W Hendra Wiradinatha) dan teman-teman yang telah membantu dan berbagi ilmu dalam penelitian ini. Terima kasih kepada teman-teman seperjuangan Pascasarjana Ilmu Pangan IPB. Semoga karya tulis ini bermanfaat bagi kemajuan ilmu pengetahuan selanjutnya.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Hipotesis 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Pepaya 3
Tanin 3
Ekstraksi Tanin 4
Staphylococcus aureus dan Staphylococcal enterotoxin 5 Identifikasi S. aureus secara Molekuler dengan PCR 6
Quantitative Reverse Transcription PCR (qRT-PCR) 7
Kuantifikasi Ekspresi Gen 7
3 METODE 8
Waktu dan Tempat Penelitian 8
Bahan dan Alat 8
Prosedur Penelitian 8
Ekstraksi Ekstrak Kasar Tanin Daun Pepaya 9
Verifikasi Kultur S. aureus 9
Penentuan Aktivitas Antimikroba Ekstrak Kasar Tanin 11 Pemaparan Ekstrak Kasar Tanin Daun Pepaya terhadap S. aureus 11
Isolasi mRNA dan Sintesis cDNA 11
Pengukuran Ekspresi Gen Sea dengan qRT-PCR 12
Analisa Data 13
4 HASIL DAN PEMBAHASAN 13
Karakteristik Daun Pepaya 13
Rendemen Ekstraksi Ekstrak Kasar Tanin Daun Pepaya 14
Verifikasi kultur 15
Potensi Antimikroba Ekstrak Kasar Tanin terhadap S. aureus 17
Pengurangan Ekspresi Gen SeaS. aureus 18
5 SIMPULAN DAN SARAN 23
Simpulan 23
Saran 23
LAMPIRAN 28
DAFTAR TABEL
1 Hasil Ekstraksi Ekstrak Kasar Tanin Daun Pepaya 14 2 Nilai Ekspresi Relatif Gen Sea dengan Metode 2-ΔΔCT 21
DAFTAR GAMBAR
1 Struktur kimia tanin 3
2 Kurva amplifikasi pada qPCR 7
3 Diagram alir penelitian 9
4 Amplifikasi gen penyandi sea dan 16S rRNA 15
5 Kurva pelelehan gen penyandi sea dan 16S rRNA kultur S. aureus 16 6 Penghambatan ekstrak kasar tanin terhadap S.aureus pada berbagai
konsentrasi dengan metode cakram 17
7 Pengaruh konsentrasi tanin terhadap pertumbuhan S. aureus setelah 24
jam pada suhu 37oC dengan metode pengenceran makro 18 8 Pengaruh ekstrak kasar tanin daun pepaya terhadap pertumbuhan
S.aureus selama 0 jam dan 1 jam pada suhu ruang 19 9 Kurva amplifikasi gen sea setelah pemaparan ekstrak kasar tanin pada
berbagai konsentrasi selama 1 jam 19
10 Kurva pelelehan cDNA hasil pemaparan kultur SJ1 21 11 Penurunan ekspresi relatif gen sea setelah pemaparan ekstrak kasar
tanin selama 1 jam. 22
DAFTAR LAMPIRAN
12 Hasil uji ANOVA dan Duncan jumlah Log S. aureus kultur SJ1 pada
pemaparan 0 jam 28
13 Hasil uji ANOVA dan Duncan jumlah Log S. aureus kultur SJ1 pada
pemaparan 1 jam 29
14 Hasil uji ANOVA dan Duncan jumlah Log S. aureus kultur S10 pada
pemaparan 0 jam 30
15 Hasil uji ANOVA dan Duncan jumlah Log S. aureus kultur S10 pada
pemaparan 1 jam 31
16 Hasil uji ANOVA dan Duncan jumlah Log S. aureus kultur SJ1 setelah
pemaparan ekstrak kasar tanin selama 24 jam 32
17 Hasil uji ANOVA dan Duncan jumlah Log S. aureus kultur S10 setelah
pemaparan ekstrak kasar tanin selama 24 jam 33
18 Hasil uji ANOVA dan Duncan nilai CT gen 16S rRNA S. aureus kultur
SJ1 setelah pemaparan ekstrak kasar tanin selama 1 jam 34 19 Hasil uji ANOVA dan Duncan nilai CT gen seaS. aureus kultur SJ1
setelah pemaparan ekstrak kasar tanin selama 1 jam 35 20 Hasil uji ANOVA dan Duncan nilai CT gen 16S rRNA S. aureus kultur
S10 setelah pemaparan ekstrak kasar tanin selama 1 jam 36 21 Hasil uji ANOVA dan Duncan nilai CT gen sea S. aureus kultur S10
22 Hasil uji ANOVA dan Duncan nilai penurunan ekspresi gen sea pada S.
aureus kultur SJ1 setelah pemaparan ekstrak kasar tanin selama 1 jam 38 23 Hasil uji ANOVA dan Duncan nilai penurunan ekspresi gen sea pada S.
1 PENDAHULUAN
Latar Belakang
Daun pepaya banyak digunakan untuk mengempukkan daging karena memiliki enzim papain yang merupakan enzim protease yang dapat memecah protein. Enzim ini memiliki aktivitas endo maupun ekso peptidase yang bekerja pada gugus sulfidril sehingga merupakan protease yang baik. Aplikasi daun pepaya sering digunakan untuk membungkus daging (Adachukwu et al. 2013). Daun pepaya juga telah diketahui mempunyai aktivitas anti jamur serta anti bakteri. Komponen bioaktif penting sebagai agen anti bakteri yang terdapat pada daun pepaya adalah saponin, alkaloid, steroid, flavonoid dan tanin (Yusha et al.
2009).
Kandungan komponen bioaktif golongan fenolik salah satunya tanin dikenal dapat menghambat pertumbuhan bakteri dengan merusak sel bakteri (Lim 2006: Maliki 2012). Saat ini senyawa ini juga dilaporkan dapat menginaktivasi toksin yang dihasilkan bakteri staphylococcal a-toxin (Choi et al. 2007). Tanin juga dilaporkan dapat mengganggu metabolisme dengan berinteraksi dengan DNA
Calf thymus (Labieniec dan Gabryelak 2006).
Daging merupakan makanan dengan sumber nutrisi yang tinggi yang dapat dimanfaatkan oleh mikroba sebagai media pertumbuhannya termasuk bakteri patogen seperti Staphylococcus aureus. S. aureus dapat menyebabkan keracunan makanan karena menghasilkan enterotoxin yang dapat menimbulkan gejala seperti mual, muntah dan kram perut. Dalan jumlah yang sangat kecil, 1 µg enterotoxin
telah mampu menyebabkan keracunan (Proft dan Fraser 2003). Toksin yang dihasilkan oleh bakteri ini cukup tahan panas dibandingkan dengan sel vegetatif S. aureus itu sendiri (Keroutan et al. 2007). Nilai ketahanan panas dari enterotoxin
ini didasarkan pada nilai D- value pada 121oC dan 100oCdengan rentang waktu dari 9.9-11.4 hingga 70 menit (Medvedova dan Valik. 2012). Salah satu gen yang berperan menghasilkan toksin pada S. aureus ini adalah gen sea.
Hasil penelitian Handayani et al. 2014 menunjukkan bahwa S. aureus
penghasil Staphylococcal Enterotoxin A (SEA) ditemukan pada berbagai jenis makanan hewani diantaranya susu sapi, telur balado, tumis usus serta sate jeroan. Adanya alternatif untuk mengendalikan produksi toksin pada S. aureus sangat dibutuhkan. Salah satu komponen bioaktif penting pada daun pepaya yaitu alkaloid telah dilaporkan dapat mengurangi ekspresi gen pembentuk SEA. Selain alkaloid diharapkan komponen bioaktif lain juga dapat berperan sama. Tanin yang juga merupakan salah satu komponen bioaktif pada daun pepaya selain dapat menghambat pertumbuhan bakteri S. aureus (Maliki 2012), kemungkinan juga dapat berinteraksi dengan DNA S. aureus dan dapat menyebabkan terhambatnya ekspresi penyandi gen sea. Oleh karena itu, analisis pengaruh ekstrak kasar tanin daun pepaya terhadap ekspresi gen sea dapat dilakukan untuk mengetahui aktivitas ekstrak kasar tanin tersebut terhadap penghambatan gen penyandi SEA.
2
mengetahui konsentrasi optimal yang dibutuhkan untuk penghambatan ekspresi gen sea.
Perumusan Masalah
Daun pepaya sering digunakan dalam pengolahan daging. Ekstrak daun pepaya diketahui memiliki kandungan fitokimia seperti alkaloid, saponin, flavonoid dan tanin yang memiliki aktivitas anti mikroba.
S. aureus adalah bakteri patogen pangan karena menghasilkan enterotoxin
salah satunya adalah SEA yang diekspresikan oleh gen sea. Tanin selain mampu menginaktifkan S. aureus, kemungkinan juga dapat mempengaruhi ekspresi gen
sea dan menghambat pembentukan toksin. Oleh karena itu perlu dikaji aktivitas ekstrak kasar tanin daun pepaya terhadap gen penyandi SEA.
Tujuan Penelitian
Tujuan umum dari penelitian ini adalah untuk mengetahui apakah ekstrak kasar tanin daun pepaya dapat mengurangi ekspresi gen sea dilihat dengan kuantifikasi menggunakan qRT-PCR. Serta mengetahui konsentrasi optimal yang dibutuhkan untuk penghambatan ekspresi gen sea. Tujuan khusus dari penelitian ini adalah:
1. Membandingkan 2 proses ekstraksi tanin pada daun pepaya
2. Memverifikasi keberadaan gen sea pada 2 jenis isolat S.aureus (SJ1 dan S10). 3. Menentukan aktivitas antimikroba ekstrak kasar tanin terhadap total S.aureus.
4. Mengkuantifikasi ekspresi gen sea secara relatif terhadap gen 16S rRNA setelah pemaparan ekstrak kasar tanin daun pepaya menggunakan RT-PCR
Hipotesis
Ekstrak kasar tanin daun pepaya dapat mengurangi ekspresi gen sea
sehingga produksi toksin S.aureus dapat dihambat.
Manfaat Penelitian
Penelitian mengenai efektivitas ekstrak kasar tanin daun pepaya dalam mengurangi ekspresi gen sea ini diharapkan dapat memberikan manfaat berupa: 1. Informasi mengenai efektivitas dan mekanisme daun pepaya sebagai
antimikroba alami.
3
1
TINJAUAN PUSTAKA
Pepaya
Pepaya (Carica papaya) merupakan tanaman yang dapat hidup di wilayah subtropis maupun daerah tropis. Tanaman ini kemungkinan berasal dari Meksiko selatan dan Costa Rika (Krishna et al. 2008). Tanaman ini berbentuk batang dengan ketinggian mencapai 5-10 meter dan memiliki susunan spiral daun yang terletak pada bagian puncak batang (Adachukwu et al 2013). Tanaman pepaya populer karena buahnya yang sering dikonsumsi. Tidak hanya itu, bagian lain dari tanaman pepaya juga sering digunakan sebagai olahan makanan maupun obat tradisional. Bunga dan daun pepaya sering diolah menjadi sayuran (Krishna et al.
2008)
Daun pepaya sering digunakan sebagai pengempuk daging karena mengandung enzim papain yang memiliki aktivitas proteolitik. Selain itu daun pepaya juga dipercaya mampu menghambat pertumbuhan mikroba karena mengandung komponen bioaktif yang berperan sebagai antimikroba. Ekstrak daun pepaya mampu menghambat pertumbuhan bakteri S. aureus, Escherichia coli,
Micrococus luteus, Pseudomonas aeruginosa, Bacillus cereus, Proteus vulgaris,
Enterococcus faecalis, Salmonella thypi, Salmonella parathypi A, Aspergillus niger, A. flavus, Candida albicans dan C. tropicalis (Anibijuon dan Udeze 2009; Alabi et al. 2012 dan Baskaran et al. 2012).
Tanin
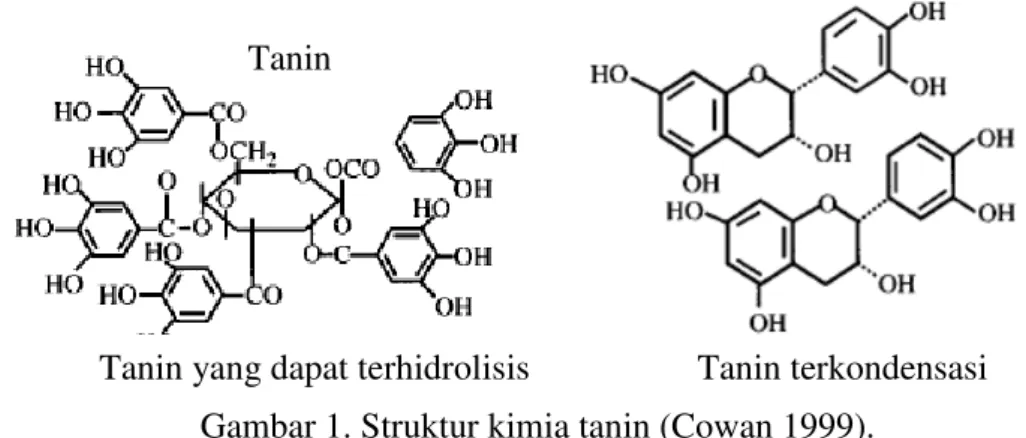
Tanin secara umum dikelompokan dalam golongan fenolik. Tanin dapat bersifat sebagai koagulan dengan berat molekul berkisar 500-3000 dalton. Tanin dibagi menjadi 2 jenis yaitu tanin yang dapat terhidrolisis (hydrolyzable) dan yang tidak (condensed). Tanin yang dapat dihidrolisis berbasis asam galic yang berupa kumpulan ester D-glucose, sedangkan condensed tanin merupakan derivat dari monomer flavonoid (Gambar 1). Tanin dapat terbentuk dari monomer flavonoid dan juga dari proses polimerasi quinon (Cowan 1999) .
Gambar 1. Struktur kimia tanin (Cowan 1999).
Tanin memiliki banyak manfaat diantaranya menstimulasi sel phagocytic, sebagai anti tumor, anti berbagai jenis infeksi serta antimikroba. Tanin
Tanin
4
membentuk kompleks dengan protein secara non spesifik dan membentuk efek hidrofobik sebagai ikatan kofalen. Efek anti mikroba tanin dikarenakan tanin berikatan dengan adhesin, menginaktifkan enzim dan merusak sel mikroba (Cowan 1999). Beberapa penelitian menunjukkan pentingnya tanin sebagai antimikroba. Penelitian yang dilakukan Fereira et al. 2012 menunjukkan tanin yang bersumber dari A humile dapat menghambat beberapa jenis bakteri patogen (S. aureus (ATCC 6538), P. aeruginosa (ATCC 27853) and E. faecalis (ATCC 29212)) masing- masing dengan konsentrasi sebesar 2 µg/L, 1 µg/L, dan 1 µg/L menggunakan metode pengenceran mikro. Tanin yang diisolasi dari daun pepaya (Ficus carica L) menunjukkan penghambatan terhadap S. aureus pada konsentrasi 25 mg/mL dengan zona hambat sebesar 11 mm dan terhadap Proteus mirabilis 90 mg/mL dengan zona hambat 8 mm (Maliki 2012). Penelitian Yunfeng et al. 2015 menunjukkan bahwa ekstrak Pomgrante rind yang kaya akan tanin mampu menghambat pertumbuhan Listeria monocytogenes pada konsentrasi 5 mg/mL. Hasil penelitian Banso dan Adeyemo 2007 menunjukkan tanin dari ekstrak
Dichrostachys cinerea memiliki efek penghambatan terhadap S. aureus, Shigella boydii, Shigella flexneri, E. coli and P. aeruginosa dengan kisaran konsentrasi tanin 4.0 dan 5.5 mg/mL. Studi lain yang dilakukan tahun 2006 oleh Asres et al.
dan Lim et al. menujukan tanin yang bersumber dari Combertum molledan dan
Rhizophora apiculata efektif berperan sebagai antimikroba terhadap bakteri gram negatif dan gram positif. Walaupun komponen spesfik dari ekstrak tanin belum diketahui secara jelas, namun kemampuannya dalam menghambat bakteri gram positif dan negatif ini sangat potensial untuk diaplikasikan pada industri farmasi. Selain menghambat bakteri, tanin juga dapat menghambat pertumbuhan jamur dan khamir. Hasil penelitian Colak et al. 2010 menunjukkan bahwa penambahan asam tanat sintetis pada proses pikeling dapat menghambat pertumbuhan Aspergillus niger, Aspergillus fumigatus, Aspergillus flavus, Penicillium granulatum,
Penicillium granulasum dan Geotrium candidum. Selain itu hasil penelitian Labienic dan Gabrielak (2006) menunjukkan tanin dan turunannya mampu berinteraksi dengan DNA yang menyebabkan rusaknya rantai DNA Calf thymus
sehingga berakibat pada perubahan oksidatif pada protein membentuk formasi dengan grup karbonil.
Ekstraksi Tanin
5 Pada proses ekstraksi senyawa fenolik termasuk tanin dapat digunakan pelarut organik maupun non organik. Penggunaan pelarut organik secara luas telah dilakukan, namun penggunaan pelarut ini cenderung memiliki resiko bahaya yang lebih besar dibandingkan penggunaan pelarut non organik seperti asam dan basa (Khoddami et al. 2013). Penggunaan pelarut non organik seperti alkali (NaoH) pada ekstraksi fenolik dari sorgum menunjukkan hasil yang lebih baik dibandingkan penggunaan pelarut organik aseton yang umum digunakan untuk ekstraksi fenolik (Blackwell 2012). Selain itu proses ekstraksi fenolik tanin juga pernah dilakukan oleh Maliki 2012 dengan hasil tidak adanya komponen bioaktif lain selain fenolik dan tanin.
Staphylococcus aureus dan Staphylococcal enterotoxin
Staphylococcus aureus merupakan bakteri patogen karena dapat menyebabkan keracunan makanan atau Staphylococcal Food Poisoning (SFP) akibat enterotoxin yang dihasilkan (Kerouanton et al. 2006). Bakteri ini tergolong bakteri gram positif berbentuk kokus, non motil, tidak membentuk spora dan bersifat anaerob fakultatif. Bakteri ini juga tergolong bakteri mesofilik yang dapat bertahan pada kondisi kering dalam waktu yang cukup lama serta tahan terhadap gula dan garam dengan kisaran suhu 6-48oC. Bakteri ini dapat ditemukan pada tanah, air, udara, pada hidung dan kulit hewan berdarah panas (Schelin et al.
2011). Infeksi bakteri ini selain menyebabkan keracunan, juga dapat menyebabkan toxic shock syndrome, pneumonia dan infeksi pada luka. S. aureus
yang merupakan enterotoxin atau Staphylococcal enterotoksi (SE) terdapat 21 jenis yang dikelompokan menjadi 2 bagian yaitu entrotoksin klasik dan non klasik. Enterotoxin yang tergolong klasik adalah SEA, SEB, SEC, SED, dan SEE. Sedangkan yang non klasik adalah SE1, SE1G, SE1H, SE1J, SE1k, SE1L, SE1M, SE1N, SE1O, SE1P, SE1Q, SER, SES, SET, SE1U dan SE1V (Hennekinne 2007).
Staphylococcal enterotoksi (SE) bersifat tahan panas dan resisten terhadap gastrointestinal saat proses pencernaan. SE menyebabkan keracunan dengan masa inkubasi yang cukup singkat yaitu sekitar 2-6 jam setelah mengkonsumsi makanan. Gejala keracunan yang ditimbulkan berupa mual, muntah, sakit perut serta diare. SE yang paling banyak menimbulkan keracunan (SFP) adalah SEA (Schelin et al. 2011). Dalam jumlah kecil yaitu kurang dari 1 μg SEA telah dapat menimbulkan penyakit. Hal ini disebabkan SEA merupakan superantigen yang dapat berinteraksi dengan banyak sel T secara non spesifik. Interaksi ini menyebabkan pelepasan sikotoksin yang tidak terkontrol dan berakibat terjadinya infeksi akut dan shock sehingga menimbulkan gejala mual dan muntah-muntah (Proft dan Fraser 2003).
SEA merupakan toksin yang ditemukan dalam S. aureus dalam jumlah besar yang merupakan penyebab utama SFP. SEA berupa polipeptida yang terdiri atas 233 asam amino yang disintesis dari 744 pasang basa gen sea. Gen sea dibawa oleh bakteriofag yang disisipkan pada kromosom bakteri sebagai profag dan berperilaku sebagai bagian dari genom bakteri (Schelin et al. 2011). Ekspresi gen
6
diproduksi pada pertengahan fase eksponensial pertumbuhan (Balaban dan Rasooly 2000). Hasil analisis sekuen daerah promotor menunjukkan bahwa strain yang memproduksi gen sea dapat dikelompokan menjadi dua kelompok yaitu strain yang memproduksi SEA dalam jumlah besar (kelompok SEA1) dan dalam
jumlah rendah (kelompok SEA2) (Brost dan Betley 1994).
Identifikasi S.aureus secara Molekular dengan PCR
`Isolat S. aureus diidentifikasi menggunakan DNAnya yang diisolasi dan digunakan sebagai cetakan untuk mengamplifikasi primer penyandi 16S rRNA yang spesifik menunjukkan S. aureus. DNA yang digunakan diperoleh dari dari isolasi DNA bakteri S. aureus. Proses Isolasi DNA dilakukan dengan tiga tahap yaitu perusakan sel bakteri, ekstraksi DNA dengan menggunakan pelarut serta presipitsi DNA ( Moore et al. 2004).
Proses perusakan sel bakteri dilakukan untuk mengeluarkan isi sel termasuk bahan genetiknya yaitu DNA. Perusakan sel bakteri dilakukan dengan cara digesti menggunakan enzim dan lisis dengan detergen. Enzim yang biasanya digunakan ialah lisozim. Lisozim mengkatalis hidrolisis pada ikatan β- 1,4- glikosidik di antara N-asetilmuramic acid dengan N- acetylglucosamin pada lapisan peptidoglikan bakteri. Selain lisozim, enzim lain yang juga sering digunakan adalah proteinase- K. Enzim ini merupakan golongan protease yang memotong di dekat gugus karboksil dari gugus asam amino alifatik dan peptida yang terdapat pada peptidoglikan dinding sel bakteri. Selain enzim, detergen juga digunakan untuk merusak sel mikroba. Detergen dapat membentuk ikatan yang kuat dengan protein yang menyebabkan denaturasi ireversibel. Detergen yang sering digunakan adalah sodium dodecylsulfate (SDS) dan cetyl trimethylammonium bromide (CTAB). SDS merupakan detergen anionik yang dalam konsentrasi rendah dapat berikatan dengan protein yang terikat pada sel dan lipoprotein. Sedangkan CTAB merupakan detergen kationik yang dapat mendenaturasi dan mempresipitasi lipopolisakarida dan protein dinding sel.
Perusakan sel bakteri dilakukan dalam larutan bufer dengan pH antara 8-9 yang mengandung agen pengkelat logam seperti ethylenediamine-tetraacetic acid
(ETDA). pH basa akan mengurangi interaksi elektrostatik antara DNA dan protein yang bersifat basa sehingga memfasilitasi denaturasi protein seluler lain dan menghambat aktivitas nuklease. EDTA dapat mengikat kation divalen (Mg2+ dan Mn2+) sehingga mengurangi stabilitas dari dinding dan membran serta menghambat nuklease yang membutuhkan kation logam.
7
Quantitative Reverse Transcription PCR (qRT-PCR)
Transkripsi balik (reverse transcription) yang diikuti real time PCR (qPCR) adalah metode yang dapat digunakan untuk mendeteksi dan mengkuantifikasi mRNA dengan cara mengubahnya menjadi cDNA. cDNA selanjutnya akan digunakan sebagai cetakan pada qPCR. Produk yang teramplifikasi selanjutnya dimonitor dengan adanya fluoresens pada setiap siklus PCR. Fluoresens dapat dihasilkan dari adanya pelacak yang ditambahkan. Pelacak fluoresens adalah reagen yang menentukan kespesifikan hasil. Penggunaan pelacak dalam tahap deteksi menawarkan sensitivitas yang tinggi.
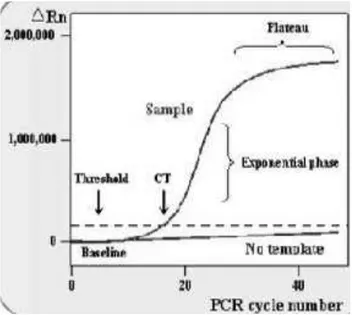
Pengujian real time ini menentukan titik awal terdeteksinya amplifikasi produk awal. Hal ini ditentukan melalui angka siklus (cycle treshold) atau dikenal dengan CT, saat intensitas emisi zat warna reporter berada di atas background
noise (Gambar 2). Semakin tinggi jumlah kopi awal target asam nukleat, semakin cepat peningkatan fluoresens, sehingga nilai CT semakin rendah. Korelasi linier
antara produk PCR dan intensitas fluoresens dapat digunakan untuk menentukan jumlah DNA cetakan pada awal reaksi (Bustin 2005).
Gambar 2. Kurva amplifikasi pada qPCR (NCBI 2014).
Kuantifikasi Ekspresi Gen
Kuantifikasi ekspresi gen dengan qPCR dapat dilakukan dengan dua metoda yaitu kuantifikasi absolut dan kuantifikasi relatif. Kuantifikasi absolut menghubungkan sinyal PCR jumlah salinan input dengan menggunakan kurva kalibrasi. Kurva kalibrasi didasarkan pada konsentrasi molekul DNA standar yang telah diketahui. Kuantitas sampel DNA target yang tidak diketahui, diinterpolasi dari berbagai kuantitas standar yang diketahui. Sedangkan kuantifikasi relatif tidak memerlukan standar (Bio-Rad 2006).
8
data ekspresi gen relatif adalah dengan membandingkan nilai CT masing-masing.
Perbandingan CT mengasumsikan bahwa efisiensi PCR mendekati 1 dan efisiensi
dari gen target mirip dengan efisiensi PCR gen referensi (Bio-Rad 2006). Langkah pertama yang dilakukan dalam penentuan ekspresi gen adalah dengan menormalkan nilai CT sampel yang diuji dan kontrol dengan rumus ΔCT sampel =
(CT gen target - CT gen referensi) sampel dan ΔCT kontrol = (CT gen target - CT
gen referensi) kontrol. Selanjutnya adalah dengan menormalkan ΔCT sampel uji
ke ΔCT kalibrator, dengan rumus 2-ΔΔCT = [(CT gen target - CT gen referensi)
sampel - (CT gen target - CT gen referensi) kontrol tanpa perlakuan]. Penurunan
kspresi gen dihitung dari rasio ekspresi gennya dengan nilai 2-ΔΔCT, menunjukkan berapa kali lipat perubahan ekspresi gen target dengan adanya perlakuan yang diberikan dibandingkan dengan kontrol (Schmittgen dan Livak 2008).
2
METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan dari bulan November 2014 hingga bulan Agustus 2015. Penelitian dilakukan di Laboratorium Mikrobiologi dan Laboratorium Kimia Pangan Departemen Ilmu dan Teknologi Pangan IPB serta Laboratorium Mikrobiologi dan Bioteknologi Pangan SEAFAST Center IPB, Institut Pertanian Bogor.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah daun pepaya Calina yang diperoleh dari Pusat Kajian Holtikultura Tropika (PKHT) Institut Pertanian Bogor dan isolat S.aureus yang mengandung gen pembentuk toksin SEA koleksi Harsi D Kusumaningrum yaitu SJ1 yang diisolasi dari sate jeroan dan S10 yang diisolasi dari susu sapi segar, isolat bakteri kontrol S. aureus American type culture collection (ATCC) 25923, serta GeneJet RNA Purification Kit (Thermo Fisher Scientific, Massachusetts, USA), RevertAid First Strand cDNA Synthesis Kit
(Thermo Fisher Scientific, Massachusetts, USA), primer SEA (SEA1 [TTGGAAA CGG TTAAAACGAA] dan SEA2 [GAAC CTTCC CATCA AAAA CA]), primer 16S rRNA (16sF [CCGCC TGGGGAGTACG] dan 16sR3 [AAGG GTTGCGCT CGTTTGC]) (Lee et al. 2007); dan KAPA SYBR® FAST qPCR Kit master mix (Kappa Biosystems, Massachusetts, USA).
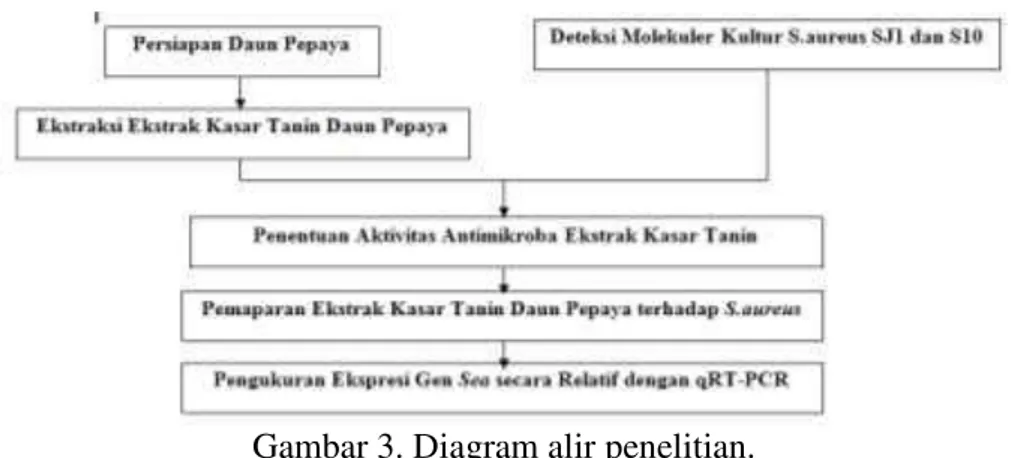
Prosedur Penelitian
9
Gambar 3. Diagram alir penelitian.
Ekstraksi Ekstrak Kasar Tanin Daun Pepaya
Daun pepaya Calina segar dikeringkan dengan freeze dryer (Martin Christ Gamma 2-16 LSC) selama 24 jam kemudian diblender dan diayak. Ekstraksi tanin daun pepaya dilakukan dengan memodifikasi metode yang dilakukan oleh Maliki 2012. Proses refluks selama 24 jam (non stop) yang dilakukan oleh Maliki, digantikan dengan proses refluks bertahap hingga mencapai 24 jam refluks dan 48 jam maserasi (dengan total keseluruhan 3 hari). Selain itu proses refluks diganti dengan Ultrasound Assisted Extraction (UAE) 40 kHZ selama 1 jam untuk metode UAE. Sebanyak 40 gram bubuk daun pepaya dimasukkan ke dalam 250 ml NaOH 10% (Merck & Co., New Jersey, USA), kemudian selanjutya direfluks bertahap (8 jam refluks dilanjutkan dengan 16 jam maserasi. Refluks dan maserasi dilakukan 3 kali siklus) dengan suhu saat proses refluks mencapai 85oC dan diultrasonikasi selama 1 jam dengan ultrasonic bath (Bransonic Ultrasonic Cleaner model 8510E MTH, Branson Ultrasonic Corporation, Connecticut, USA) pada suhu 50oC (untuk metode UAE). Selanjutnya sampel disaring menggunakan kertas saring Whatman no 1 dan filtrat yang diperoleh ditambahkan 10 ml H2SO4 10% (Merck & Co., New Jersey, USA) dan disaring kembali. Filtrat
selanjutnya dicuci dengan NaHCO3 (Merck & Co., New Jersey, USA) yang telah
dilarutkan lalu disentrifugasi (Hermle Z383K; Hermle Labortechnik GmbH, Wehingen, Saint Nom, Jerman) dan diperoleh endapan asam dan garam. Endapan yang diperoleh selanjutnya dikeringkan dengan menggunakan freeze dryer.
Verifikasi Kultur S.aureus
Verifikasi kultur dilakukan secara molekuler dengan mengisolasi DNA yang selanjutnya akan dideteksi dengan menggunakan Polymerase Chain Reacttion
10
TE 1x. Selanjutnya, ditambahkan 100 μl lisozim (10mg/ml) kemudian dicampurkan hingga homogen dan diinkubasi pada 37oC selama 1 jam (tabung dibolak balik setiap 15 menit). Sebanyak 30 μl SDS 10% dan 10 μl proteinase K (10 mg/ml) ditambahkan dan diinkubasi kembali pada 37°C selama 1 jam (tabung dibolak-balik setiap 15 menit). Ditambahkan 100 μl NaCl 5 M dan 80 μl CTAB -NaCl (10% CTAB di dalam 0.7 M -NaCl) yang telah dipanaskan pada 65°C. Inkubasi selama 10 menit pada 65°C. Setelah itu tambahkan kloroform dengan volume yang sama dengan suspensi. Kemudian divorteks dan disentrifugasi pada 21 000 x g selama 5 menit. Supernatan dipindahkan ke dalam tabung baru dan diekstraksi 2 kali dengan Phenol Chloroform Isoamil (PCI) (25:24:1) dan 1 kali dengan Chloroform Isoamil (CI), dengan volume yang sama dengan suspensi kemudian disentrifugasi pada 21 000 x g selama 10 menit. Fase aqueous pada bagian atas dipindahkan ke tabung baru dan dilakukan presipitasi DNA menggunakan isopropanol absolut dingin sebanyak 0.7 x volume supernatan. Campuran tersebut diinkubasi pada suhu -20°C selama 1 jam dan disentrifugasi pada 21000 × g selama 10 menit. Supernatan dibuang dan pelet dicuci dengan 1 ml etanol 70% lalu disentrifugasi pada 21 000 x g selama 5 menit. Pelet DNA dikeringkan dan diresuspensi dengan 30 μl akuabides.
DNA hasil ekstraksi selanjutnya diukur konsentrasi dan kemurniannya. Konsentrasi dan kemurnian isolat DNA ditentukan dengan mengukur absorbansi pada panjang gelombang 260 nm dan 280 nm dengan menggunakan Nano Drop
2000 Sectrophotometer (Thermo Fisher Scientific, Massachusetts, USA). Kemurnian DNA yang baik memiliki nilai rasio antara 1,8 sampai 2,0 (Handayani
et al. 2014).
Amplifikasi gen penyandi 16S rRNA dan sea dilakukan dengan menggunakan Thermal Cycler 2720 dan Swift Spectrum Thermal Cycler 48 (Esco Healthcare Pte. Ltd, Singapore). Isolat DNA diamplifikasi dengan primer yang spesifik untuk S.aureus yaitu primer 16sF dan 16sR3 dengan amplikon sebesar 240 pb, serta gen sea diamplifikasi dengan primer SEA1 dan SEA2 dengan amplikon sebesar 120 pb (Lee et al. 2007; Handayani et al. 2014). Siklus PCR yang digunakan yaitu 1 siklus pradenaturasi selama 5 menit pada 95°C, 30 siklus amplifikasi (denaturasi 1 menit pada 95°C, annealing 1 menit pada 55°C, dan
extension 1 menit pada 72°C), dan terminasi selama 5 menit pada 72°C (Lee et al.
2007). Campuran reaksi PCR yang digunakan sebanyak 25 μl, terdiri dari 12.5 μl
DreamTaq Green master mix, 1 μl setiap primer (10 μM), 2 μl DNA cetakan
(1000 ng/μl), dan 8.5 μl air bebas nuklease.
11 Penentuan Aktivitas Antimikroba Ekstrak Kasar Tanin
Sebelum penentuan penghambatan S. aureus dengan ekstrak kasar tanin dilakukan persiapan isolat S. aureus. Isolat S. aureus berumur 18 - 24 jam pada media TSB disentrifugasi pada 9 500 × g selama 10 menit dan pelet bakteri disuspensikan pada garam fisiologis 0.85% (konsentrasi mikroba berkisar 1.5 × 108 CFU/ml). Tahap awal penentuan aktivitas antimikroba dilakukan dengan proses penampisan menggunakan metode disc diffusion oleh Kirby dan Bauer (Imelda et al. 2014). Suspensi bakteri diinokulasikan menggunakan cotton swab
steril pada seluruh permukaan MHA. Setelah itu, diletakkan disc steril (ø 6 mm,
Oxoid, Hampshire, UK) dan ditambahkan dengan 10 μl ekstrak tanin (10, 20, 30, 40 dan 50 mg/ml). Diletakan juga disk dengan penambahan 10 μl aquades steril sebagai kontrol negatif. Kemudian diinkubasi pada 37oC selama 24 jam. Aktivitas antibakteri terlihat dengan adanya zona penghambatan (termasuk diameter disc) terhadap pertumbuhan bakteri S. aureus.
Tahapan selanjutnya dilakukan pengenceran makro. Sebanyak 100 μl suspensi S. aureus berumur 18-24 jam dengan konsentrasi tertentu diinokulasikan ke dalam 1 ml media TSB yang mengandung ekstrak kasar tanin daun pepaya pada berbagai konsentrasi (0 mg/mL, 5 mg/mL, 10 mg/mL dan 20 mg/mL). Kultur bakteri kemudian diinkubasi pada 37°C selama 24 jam dan digoyang dengan kecepatan 150 rpm. Selanjutnya, dibuat seri pengenceran dari kultur bakteri pada setiap konsentrasi ekstrak tanin dan disebar pada media TSA
Triptone Soya agar (TSA) (40g/ liter; Oxoid Ltd., UK). Media tersebut diinkubasi pada 37°C selama 48 jam dan dilakukan penghitungan jumlah bakteri (Mazzola et al. 2009).
Pemaparan Ekstrak Kasar Tanin Daun Pepaya terhadap S. aureus
Sebanyak 20 μl suspensi S.aureus penghasil SEA, dengan konsentrasi 108
CFU/mL, dipipet ke dalam 2 ml media TSB yang telah ditambahkan dengan ekstrak tanin daun pepaya dengan konsentrasi ( 0 mg/mL, 5 mg/mL dan 10 mg/mL), kemudian diinkubasi pada suhu ruang selama 1 jam dan digoyang dengan kecepatan 150 rpm. Kemudian dilakukan perhitungan jumlah sel bakteri sebelum dan setelah diinkubasi selama 1 jam dengan menggunakan metode agar sebar pada media TSA (Modifikasi Handayani et al. 2014). Selain itu juga dilakukan pengukuran ekspresi gen sea menggunakan Real-Time PCR.
Isolasi mRNA dan Sintesis cDNA
12
dihomogenkan dengan vorteks selama 15 detik. Sampel ditambahkan 180 μl etanol 96% dicampurkan dengan menggunakan pipet. 700 μl sampel kemudian dipindahkan ke dalam GeneJET RNA purification column yang telah dipasangkan dengan collection tube (CT) dan disentrifugasi pada 12000 x g selama 1 menit. Residu sampel yang terdapat pada CT kembali dimasukkan ke dalam GeneJET RNA purification column yang sama dan disentrifugasi 12000 rpm selama 1 menit. Kemudian GeneJET RNA purification column dengan CT baru dipasangkan. Selanjutnya 700 μl wash buffer I ditambahkan lalu disentrifugasi selama 1 menit pada 12000 x g. 600 μl wash buffer II ditambahkan pada cairan yang terdapat pada CT yang sama, kemudian disentrifugasi pada 12000 x g selama 1 menit. Larutan pada CT dibuang dan tahap penambahan 250 μl wash buffer II kembali dilakukan pada 12000 x g selama 2 menit. Selanjutnya dilakukan pengeringan matriks column dengan cara PerfectBind RNA column
dipasangkan dengan CT, kemudian disentrifugasi selama 1 menit dengan kecepatan 12000 x g. Selanjutnya GeneJET RNA purification column tersebut dipasangkan dengan tabung 1,5 ml. 50 μl air bebas nuklease ditambahkan pada matriks, lalu sentrifugasi selama 1 menit pada 12000 x g untuk mengelusi RNA. Kemurnian RNA ditentukan dengan mengukur rasio A260/A280.
Selanjutnya RNA disintesis menjadi cDNA. Sintesis cDNA menggunakan
RevertAid First Strand cDNA Synthesis Kit dengan primer spesifik untuk gen sea
(SEA 1 dan SEA 2) dan gen penyandi S.aureus (16s F dan 16s R3) sebagai gen referensi untuk normalisasi (Lee et al. 2007 dan Handayani et al. 2014) digunakan untuk sintesis cDNA. Sintesis cDNA dilakukan sesuai dengan petunjuk yang terdapat pada kit. Sintesis cDNA dilakukan dengan cara membuat campuran reaksi terdiri atas 1 μg RNA total, 20 ρmol setiap primer, dan air bebas nuklease hingga volume 12 μl. Campuran tersebut diinkubasi pada 65oC selama 10 menit.
Selanjutnya, ditambahkan 4 μl buffer reaksi 5x, 1 μl RiboLock RNAse Inhibitor
(20 u/μl). Campuran reaksi diinkubasi pada suhu 42o
C selama 60 menit. Reaksi dihentikan melalui pemanasan pada 70oC selama 5 menit.
Pengukuran Ekspresi Gen Sea secara Relatif dengan qRT-PCR
Real-Time PCR dilakukan menggunakan Swift Spectrum Thermal Cycler
48. Kondisi PCR yang digunakan, yaitu pre-denaturasi selama 1 menit pada 95oC, 45 siklus amplifikasi (denaturasi 1 menit pada suhu 95oC, annealing 1 menit pada 55oC, extention 1 menit pada 72o C) dan terminasi pada 72oC selama 5 menit.
volume 20 μl. Pembacaan fluoresensi dilakukan setelah setiap tahap extension dan
13
sea merupakan nilai 2-ΔΔCT, yaitu dengan nilai ΔΔCT diperoleh dari selisih antara
ΔCT gen sea dengan gen 16S rRNA bakteri yang mengalami pemaparan ekstrak
kasar tanin dengan ΔCT gen sea dengan gen 16S rRNA bakteri tanpa pemaparan
tanin.
2-ΔΔCT = [(CT gen sea– CT gen 16S rRNA) S.aureus dengan paparan tanin – (CT gen sea– CT gen 16S rRNA) S.aureus tanpa pemaparan tanin].
Penurunan ekspresi gen dihitung melalui rasio antara nilai 2-ΔΔCT tanpa perlakuan penambahan ekstrak kasar tanin dibandingkan dengan nilai 2-ΔΔCT dengan perlakuan peambahan ekstrak kasar tanin.
Analisis Data
Pengukuran data dilakukan sebanyak tiga kali ulangan. Data yang diperoleh dari hasil pengujian diolah secara statistik menggunakan analisis sidik ragam (ANOVA) pada tingkat kepercayaan 95% (taraf signifikan 0,05). Jika hasil uji berbeda nyata maka dilanjutkan dengan uji lanjut Duncan.
3
HASIL DAN PEMBAHASAN
Karakteristik Daun Pepaya
Daun pepaya muda segar varietas Calina mempunyai kadar air sebesar 76.99 ± 1.69% Hasil penelitian lain yang dilakukan Handayani et al. 2014 dan Nofrianti 2015 menunjukkan kadar air daun pepaya Calina yang hampir sama dengan yang diperoleh yaitu sebesar 78.17% dan 78.93%. Penelitian lain pengukuran kadar air daun pepaya dilakukan oleh Nowfia et al. 2012 menyebutkan kadar air daun pepaya segar sebesar 81.27 – 85.17 %. Perbedaan nilai kadar air daun pepaya yang diperoleh ini sangat tergantung dari bagian daun serta varietas pepaya.
14
mempertahankan total fenol dan flavonoid pada sayuran seperti wortel, ubi dan tomat. Hasil penelitian Irondi et al. (2013) juga menunjukkan proses pengeringan menggunakan pengering beku menghasilkan ekstrak biji pepaya dengan total fenol, flavonoid, karotenoid, tanin dan vitamin C tertinggi dibandingkan dengan metode pengeringan lainnya. Metode pengeringan selanjutnya yang memberikan hasil terbaik setelah pengeringan beku adalah pengeringan dengan udara, diikuti pengeringan oven dan selanjutnya pengeringan dengan sinar mata hari memberikan efek rendahnya kandungan komponen bioaktif pada biji pepaya. Menurunnya kandungan komponen bioaktif pada ekstrak dengan metode pengeringan dengan udara disebabkan adanya degradasi enzimatik karena keberadaan oksigen selama proses pengeringan. Pada proses pengeringan dengan oven cenderung mengalami kerusakan karena penggunaan suhu yang cukup tinggi untuk pengeringan. Metode pengeringan dengan sinar matahari menyebabkan rendahnya kadar komponen bioaktif pada ekstrak karena pada prosesnya sampel terpapar oksigen bebas, panas serta sinar matahari yang dapat merusak komponen bioaktif pada biji pepaya (Irondi et al. 2013).
Rendemen Ekstraksi Ekstrak Kasar Tanin Daun Pepaya
Proses ekstraksi komponen bioaktif sangat ditentukan dari proses pemecahan dinding sel untuk memastikan komponen tersebut dapat keluar dan terekstrak. Ekstraksi menggunakan metode konvensional yaitu kombinasi antara proses refluks dan maserasi menghasilkan jumlah redemen yang lebih tinggi dibandingkan dengan menggunakan metode UAE yang merupakan metode modern (Tabel 1).
Tabel 1. Hasil ekstraksi ekstrak kasar tanin daun pepaya
Proses ekstraksi Rendemen (%)
UAE 1.83 ±0.54
Refluks + maserasi 4.27 ± 0.45
Hasil penelitian yang dilakukan olek Cobzak et al. 2005 juga menunjukkan hasil serupa. Konsentrasi tanin ekstrak Rubus idaeus yang diperoleh dari proses ekstraksi menggunakan metode refluks lebih besar dibandingkan dengan UAE yaitu sebesar 3.22 mg/mL dengan refluks dan 2. 26 mg/mL dengan UAE. Jumlah rendemen ekstrak kasar tanin yang dihasilkan dengan proses refluks yang dilakukan ini juga menunjukkan hasil yang sangat berbeda dengan yang dilakukan oleh Maliki 2012 yaitu sebesar 1,85%. Hal ini dapat disebabkan oleh jenis daun pepaya yang digunakan berbeda. Selain itu perbedaan yang sangat besar juga dapat disebabkan oleh perbedaan lamanya kontak antara pelarut dan daun pepaya, karena proses refluks berjalan bertahap (terdapat kombinasi antara proses refluks dan maserasi), sedangkan proses refluks yang dilakukan Maliki berlangsung hanya 24 jam (tanpa penambahan maserasi). Lamanya proses ekstraksi mempengaruhi hasil rendemen ekstrak komponen bioaktif (Bandar et al
15 terbentuknya peronggaan sel. Selanjutnya gelombang ultrasonik akan mempercepat pelepasan isi sel sehingga pengeluaran komponen bioaktif berlangsung lebih cepat (Azmir et al. 2013).
Verifikasi Kultur S. aureus Penghasil Gen Sea
Kultur S.aureus yang digunakan adalah kultur yang telah diisolasi dan diidentifikasi sebelumnya secara konvensional dan molekular oleh Handayani et al. (2012). Kultur yang digunakan berasal dari sate jeroan (SJ1) dan dari susu sapi mentah (S10) yang dibandingkan dengan kulur murni S.aureus ATCC 25923 yang diketahui tidak menghasilkan gen sea. Dari hasil ekstraksi DNA diperoleh konsentrasi dan kemurnian DNA. Kedua parameter ini ditentukan melalui nilai absorbansi yang diperoleh pada panjang gelombang 260 dan 280 nm. Isolat DNA yang diperoleh memiliki kemurnian berkisar antara 1.93–2.02, sedangkan konsentrasi DNA berkisar antara 12.6 – 644.5 ng/µl. Hasil ekstraksi DNA dari ketiga kultur S. aureus memiliki kemurnian yang baik, yaitu dengan nilai rasio A260/A280 di antara 1.8 – 2.0. Walaupun pada DNA kultur S10 lebih dari 2.0, namun perbedaan nilainya kecil. Isolat DNA dengan nilai rasio A260/A280 di bawah 1.8 mengindikasikan kontaminasi protein, sedangkan nilai rasio lebih besar dari 2.0 menunjukkan keberadaan RNA yang ikut terekstrak (Moore et al. 2004). Hasil kemurnian DNA yang baik sangat ditentukan dari proses ekstrksinya. Tahap kritis yang perlu diperhatikan dalam ekstraksi DNA adalah saat ekstraksi dengan pelarut organik seperti fenol dan kloroform untuk memisahkan DNA dengan komponen lain. Secara umum fenol efektif dalam mendenaturasi protein, sedangkan kloroform efektif untuk polisakarida (Moore et al. 2004).
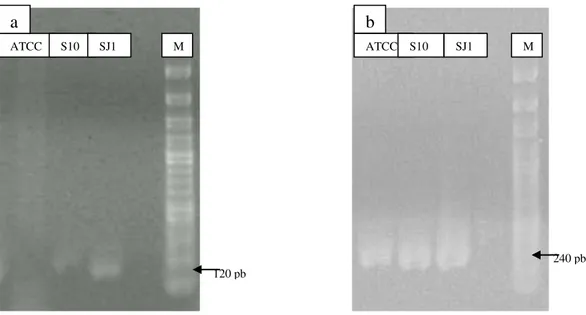
Gambar 4. Amplifikasi gen penyandi sea (a) dan 16S rRNA (b) kultur SJ1 dan S10 (M= Marker)
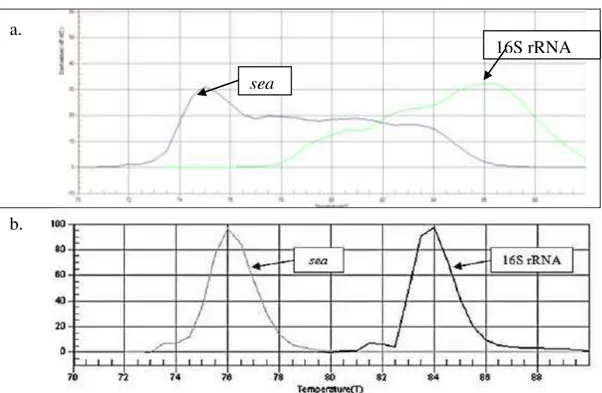
Kultur SJ1 dan S10 merupakan S.aureus penghasil SEA yang disandikan dengan gen 16S rRNA dan gen sea diperlihatkan pada hasil amplifikasi kedua gen ini dari PCR standar (Gambar 4). Primer SEA 1 dan SEA 2 menghasilkan
b
ATCC S10 SJ1 M ATCC S10 SJ1 M
120 pb
240 pb
16
amplikon dengan ukuran 120 pb (Gambar 4a) sedangkan primer 16s R3 dan 16s F yang menandakan kultur S. aureus menghasilkan amplikon sebesar 240 pb, pita yang sama yang ditunjukkan oleh amplifikasi kultur murni S.aureus ATCC 25923 (Gambar 4b). Hasil ini sesuai dengan yang dilakukan Lee et al. 2007 dan Handayani et al. 2014.
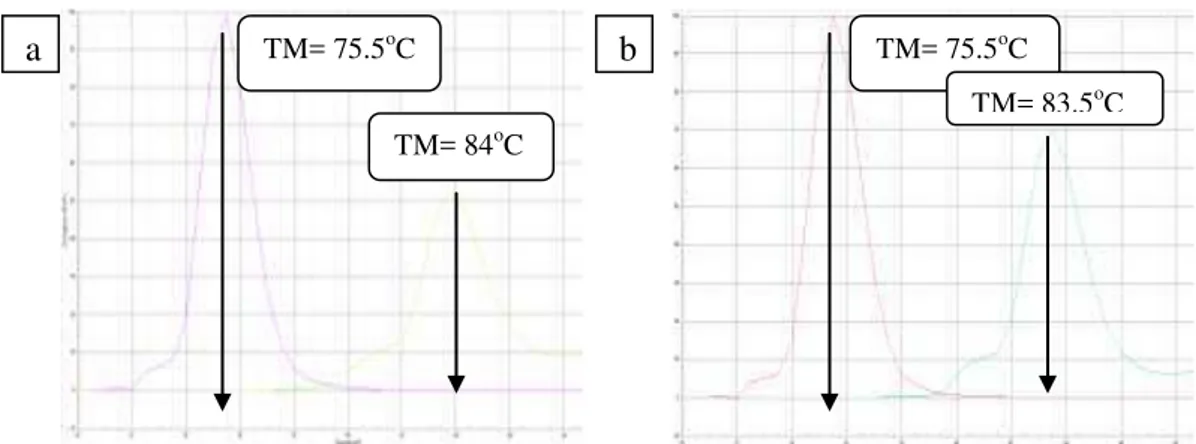
Verifikasi kultur SJ1 dan S10 juga dapat dilihat dari amplifikasinya pada kurva pelelehan menggunakan Real Time PCR (Gambar 5). Terbentuknya puncak pada suhu 84oC menandakan DNA mengamplifikasi primer 16s R3 da 16s F yang merupakan penyandi gen 16S rRNA untuk S.aureus. Puncak yang terbentuk pada kisaran 75-76oC menandakan adanya amplifikasi primer SEA1 dan SEA2 yang merupakan penyandi untuk gen sea. Hasil ini serupa dengan yang dilakukan Handayani et al. 2014 yang menunjukkan puncak kurva pelelehan gen penyandi 16S rRNA pada 84oC dan gen sea pada 76oC. Secara umum, proses verifikai dapat dilakukan dengan memilih salah satu jenis PCR saja. Namun, karena dalam prosesnya, proses RT-PCR yang dilakukan menggunakan penanda nonspesifik SYBR Green, perlu dilakukan konfirmasi dengan PCR standar.
Gambar 5. Kurva pelelehan gen penyandi sea (ungu) dan 16S rRNA (hijau) kultur
S. aureus ( a. SJ1 dan b. S10).
SEA yang disandikan oleh gen sea merupakan salah satu toksin yang paling banyak ditemukan di antara jenis enterotoxin lainnya yang dihasilkan oleh
S. aureus. Hasil survei yang dilakukan Rall et al. 2010 menunjukkan gen sea
terdapat pada 9 dari 17 isolat S.aureus yang diisolasi dari tangan dan hidung pekerja. Hasil penelitian Derzelle et al. 2009 juga menunjukkan ditemukannya gen sea pada kutur S.aureus yang diisolasi dari berbagai makanan seperti salad,
cream bun, susu segar, kue coklat, rillettes, nougatine, dan spaghettis. SEA berupa polipeptida yang terdiri atas 233 asam amino yang disintesis dari 744 pasang basa gen sea. Gen sea dibawa oleh bakteriofag yang disisipkan pada kromosom bakteri sebagai profag dan berperilaku sebagai bagian dari genom bakteri (Schelin et al. 2011). Ekspresi gen sea tidak dipengaruhi oleh pertumbuhan bakteri. Jumlah SEA yang diproduksi dipengaruhi oleh polimorfisme bakteri yang membawa profag. SEA mulai diproduksi pada pertengahan fase eksponensial pertumbuhan (Balaban dan Rasooly 2000).
TM= 84oC
TM= 75.5oC TM= 75.5oC TM= 83.5oC
17 Potensi Antimikroba Ekstrak Kasar Tanin terhadap S. aureus
Penentuan potensi antimikroba ekstrak kasar tanin dilihat dengan menggunakan metode cakram. Pemaparan ekstrak kasar tanin yang diperoleh dari hasil refluks menunjukkan penghambatan yang kurang kuat terhadap pertumbuhan S. aureus kultur SJ1 dan S10. Hal ini dilihat dari kecilnya zona bening yang terbentuk di sekitar cakram. Dengan konsentrasi ekstrak tanin yang cukup tinggi yaitu 50 mg/mL dan 100 mg/ mL hanya menghasikan zona bening antara 7.40-9.13 mm (Gambar 6). Konsentrasi ekstrak kasar tanin sebesar 50 mg/ mL menunjukkan zona hambat sebesar 7.40±0.35 mm pada kultur SJ1 dan 8.24±0.25 mm pada kultur S10. Sedangkan konsentrasi 100 mg/ mL mampu menghambat hingga 8.46±0.17 mm pada kultur SJ1 dan 9.13±0.40 mm pada kultur S10.
Gambar 6. Penghambatan ekstrak kasar tanin terhadap S.aureus pada berbagai konsentrasi dengan metode cakram (a. 0, b. 50 dan c. 100 (mg/mL)). Hasil penelitian yang dilakukan oleh Maliki 2012 menunjukkan hasil yang berbeda. Ekstrak kasar tanin daun pepaya dengan metode yang hampir sama (modifikasi penambahan proses maserasi) menunjukkan penghambatan yang cukup kuat terhadap S.aureus. Pada konsentrasi 25 mg/mL ekstrak kasar tanin daun pepaya yang dilakukan Maliki 2012, secara signifikan mampu menghambat pertumbuhan S.aureus diperlihatkan dari adanya zona bening yang cukup besar yaitu 11 mm. Perbedaan efektivitas ekstrak kasar tanin ini dapat disebabkan karena perbedaan waktu kontak antara pelarut dengan daun pepaya selama proses ekstraksi. Pelarut NaOH 10% yang digunakan dalam ekstraksi ekstrak kasar tanin merupakan pelarut anorganik yang cenderung lebih aman digunakan dibandingkan pelarut organik yang umum digunakan. NaOH merupakan pelarut yang bersifat korosif sehingga mampu memecah sel dan menyebabkan keluarnya komponen sel. Namun, waktu kontak yang terlalu lama, tidak hanya dapat menyebabkan kerusakan sel, namun komponen bioaktif yang diinginkan juga dapat megalami kerusakan.
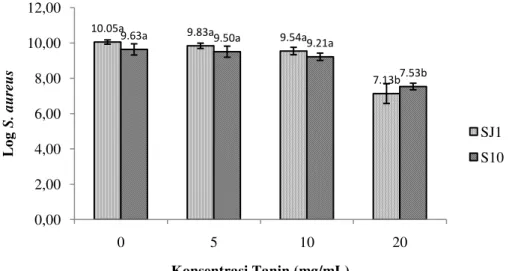
Hasil pemaparan ekstrak kasar tanin dengan metode macro diluttion pada konsentrasi yang lebih tinggi, yaitu 20 mg/mL secara signifikan mampu menekan pertumbuhan jumlah S.aureus kultur SJ1 dan S10 (Gambar 7). Hal ini dikarenakan tanin merupakan salah satu komponen bioaktif yang memiliki fungsi sebagai antimikroba dengan berikatan dengan adesin, menginaktifkan enzim serta merusak dinding sel mikroba, sehingga metabolisme mikroba menjadi terganggu dan akhirnya menyebabkan kematian (Cowan 1999).
18
Gambar 7. Pengaruh konsentrasi tanin terhadap pertumbuhan S. aureus setelah 24 jam pada suhu 37oC dengan metode pengenceran makro.
Beberapa penelitian menunjukkan efektivitas tanin dari berbagai sumber memiliki kemampuan sebagai antimikroba. Tanin dengan konsentrasi 6.25 mg/mL hasil ekstraksi dari R. Apiculata mampu menghambat pertumbuhan S. aureus dan memberikan efek bakterisidal pada konsentrasi 12.5 mg/mL (Lim et al. 2006). Penelitian yang dilakukan Akiyama et al. 2001 menunjukkan tanin dan turunannya dengan konsentrasi >4.5 mg/mL memiliki efek penghambatan pada 18 strain S.aureus. Machado et al. 2003 memperkirakan mekanisme penghambatan
S.aureus disebabkan karena tanin bereaksi dengan protein terkonjugasi dari enzim pada dinding sel (contoh oksidoreduktase) yang terjadi di antara sitoplasma dan dinding sel. Aktivitas antibakteri dari tanin berbanding lurus antara dosis pemberian tanin dan aktivitas perusakan pada membran bilayer (Funatogawa et al.
2004).
Pengurangan Ekspresi Gen Sea pada S. aureus.
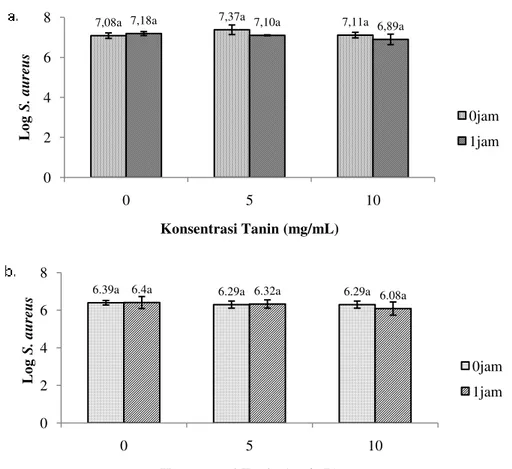
Pengurangan ekspresi gen sea pada S. aureus kultur SJ1 dan S10 dilakukan pada jumlah mikroba yang konstan. Konsentrasi ekstrak kasar tanin yang digunakan adalah konsentrasi yang belum mampu menekan pertumbuhan S. aureus. Pemaparan ekstrak kasar tanin selama 1 jam tidak menunjukkan adanya perbedaan yang nyata terhadap perubahan jumlah S. aureus SJ1 dan S10 (Gambar 8). Walaupun terjadi penurunan jumlah S. aureus dengan penambahan ekstrak kasar tanin, namun jumlah tersebut tidak berbeda nyata.
Jumlah S. aureus pada setiap perlakuan konsentrasi ekstrak kasar tanin juga tidak berbeda nyata ditunjukkan dari nilai cycle threshold (CT) gen penyandi 16S rRNA yang menandakan keberadaan S. aureus. Walaupun demikian, penambahan ekstrak kasar tanin ini mempengaruhi nilai CT dari gen sea.
19
Gambar 8. Pengaruh ekstrak kasar tanin daun pepaya terhadap pertumbuhan S. aureus selama 0 jam dan 1 jam pada suhu ruang (a. SJ1 dan b. S10) . Pengaruh ekstrak kasar tanin terhadap nilai CT gen sea ditunjukkan dari kurva amplifikasi gen sea yang bergerak ke kanan dengan peningkatan penambahan ekstrak kasar tanin (Gambar 9). Kurva menunjukkan penurunan jumlah copy DNA gen sea.
20
Hasil penelitian Derzelle et al. 2009 menunjukkan hampir sebagian besar
S.aureus yang diisolasi dari beberapa bahan makanan mengandung gen sea. Gen
sea yang ditemukan dari berbagai isolasi memiliki kisaran nilai CT gen yang sama yaitu antara 19-23. Nilai CT ini diperoleh dari hasil ekstraksi RNA kultur yang diubah menjadi cDNA, selanjutnya dilihat kesesuaiannya pada kurva pelelehan (Gambar 10). RNA bersifat lebih labil dibandingkan dengan DNA, sehingga proses pengerjaannya harus lebih berhati - hati. Selain itu, faktor proses ekstraksi juga menjadi sangat penting diperhatikan. Proses ekstraksi RNA telah banyak dilakukan dengan menggunakan kit. Pemilihan kit yang sesuai dapat menghasilkan RNA dengan kemurnian yang lebih baik. RNA yang baik selanjutnya akan menghasilkan cDNA cetakan yang baik dengan tingkat kontaminasi yang lebih rendah. Adanya kontaminasi DNA inilah yang menyebabkan terbentuknya puncak yang tidak sesuai pada proses RT-PCR menggunakan SYBR Green. SYBR Green merupakan pelacak non spesifik yang dapat mendeteksi semua DNA utas ganda, termasuk primer dimer, DNA kontaminan, dan produk PCR dari primer yang salah menempel. Walaupun bersifat tidak spesifik, SYBR Green banyak digunakan karena murah, mudah didapatkan dan mudah dalam pengerjaannya (Kumar et al. 2012).
Hasil ekstraksi RNA dengan menggunakan GeneJet RNA Purification Kit
menunjukkan hasil ekstraksi RNA yang kurang baik dengan kisaran kemurnian RNA yang rendah yaitu antara 1.72-2.58. RNA yang baik memiliki nilai kemurnian di atas 2. Bila nilai kemurniannya berada di bawah itu menandakan masih adanya kontaminasi DNA (Imbeaud et al. 2005). Ekstraksi kultur S.aureus
yang sama juga pernah dilakukan Handayani et al. (2014) dengan menggunakan
kit yang berbeda yaitu peqGOLD Bacterial RNA Kit menghasilkan kemurnian RNA yang cukup tinggi yaitu 3.3 - 4.5. Hasil kemurnian RNA yang diperoleh jauh lebih baik dibandingkan mengunakan GeneJet RNA Purification Kit yang digunakan pada penelitian ini. Hasil ekstraksi yang kurang baik akan menghasilkan kurva pelelehan yang tidak tajam (Gambar 10a), sedangkan hasil yang baik menunjukkan kurva dengan puncak tajam (Gambar 10b).
Hal ini dimungkinkan karena peqGOLD Bacterial RNA Kit merupakan kit
spesifik untuk mengekstraksi RNA yang berasal dari bakteri, sedangkan GeneJet RNA Purification Kit bersifat universal. Selain itu, pada proses ekstraksi RNA menggunakan peqGOLD Bacterial RNA Kit terdapat tahapan penghilangan DNA dengan penambahan DNAse, sedangkan pada GeneJet RNA Purification Kit tidak ada.
Kemurnian hasil ekstraksi RNA akan mempengaruhi kualitas cDNA sebagai cetakan. Hal ini juga dapat berpengaruh pada nilai CT yang dihasilkan. Nilai CT dari cDNA kultur SJ1 tanpa pemaparan yang diperoleh dengan GeneJet RNA Purification Kit menghasilkan nilai yang lebih besar yaitu 16.88 untuk 16S rRNA dan 19.84 untuk gen sea, dibandingkan dengan yang diperoleh Handayani
21
Gambar 10. Kurva pelelehan cDNA hasil pemaparan kultur SJ1 ( a. ekstrak kasar tanin dan b. ekstrak kasar alkaloid ( sumber: Handayani et al. 2012). Pemaparan ekstrak kasar tanin selama 1 jam tidak mengakibatkan perbedaan yang signifikan terhadap nilai gen 16S rRNA. Kedua kultur SJ1 dan S10 memiliki kisaran nilai CT 16S rRNA yang hampir sama yaitu antara 15.68-16.88. Nilai CT gen sea berbeda dengan nilai gen 16S rRNA. Nilai CT gen sea ini cenderung lebih besar yang menandakan jumlah gennya lebih rendah (Tabel 2). Pada kedua kultur keberadaan gen sea cenderung berbeda. Kultur SJ1 memiliki kadungan gen sea yang lebih besar dibandingkan dengan kultur S10. Hal ini juga telah ditunjukkan pada verifikasi kultur awal (Gambar 4), terlihat pita hasil elektroforesis gen sea pada kultur S10 yang terbentuk lebih tipis dibandingkan dengan pita gen sea pada kultur SJ1.
Tabel 2. Nilai ekspresi relatif gen sea dengan metode 2-ΔΔCT
22
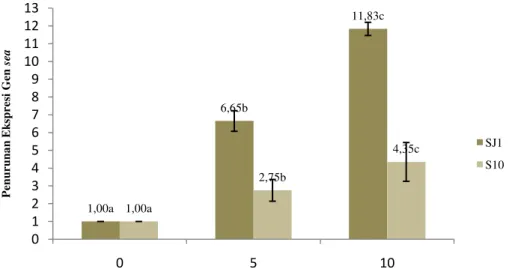
Pemaparan S.aureus dengan ekstrak kasar tanin konsentrasi 5 mg/mL dan 10 mg/mL telah mampu menurunkan jumlah ekspresi gen sea secara signifikan yaitu 6.65 kali dan 11.83 kali pada SJ1 serta 2.75 kali dan 4.35 kali pada S10 (Gambar 11). Beberapa studi juga menunjukkan efek tanin dalam menurunkan ekspresi gen. Penelitian yang dilakukan Sarabhai et al. 2013 menunjukkan ellagic acid yang berasal dari Terminalia chebula Retz mampu menurunkan ekspresi gen yang mengatur pembentukan faktor virulensi ekstraseluler pada Pseudomonas aeruginosa. Pemaparan ekstrak sebesar 0.5 mg/mL mampu menurunkan ekspresi gen lasI dan rhlI yang merupakan autoinducer synthase sebesar 89% dan 90%, serta menurunkan ekspresi gen lasR dan rhlR yang merupakan reseptor cognate
sebesar 90% dan 93%. Hasil penelitian serupa juga ditunjukkan oleh hasil penelitian Xu et al. 2015 yang menunjukkan tanin dari Pomegrante rind mampu mengurangi ekspresi 3 jenis gen virulen pada Listeria monocytogenes (prfA, inlA
dan hly) dengan penambahan ekstrak tanin sebesar 2.5 mg/mL yaitu sebesar 17, 34 dan 28 kali. Perubahan jumlah ekspresi gen ini dapat disebabkan karena tanin mampu berinteraksi dengan DNA yang menyebabkan rusaknya rantai DNA. Hal ini juga sesuai dengan hasil penelitian Labienic dan Gabrielak (2006) yang menunjukkan bahwa asam dari tanin dan turunannya mampu berinteraksi dengan DNA Calf thymus dan merusak DNA. Penelitian sebelumnya yang dilakukan Labienic dan Gabrielak (2005) menunjukkan senyawa polifenol berkontribusi terhadap kerusakan rantai DNA sehingga berakibat pada perubahan oksidatif pada protein dengan membentuk formasi dengan grup karbonil. Ebeler (2013) juga menyebutkan golongan polifenol mampu menginterkelasi DNA dan menyebabkan terhambatnya enzim topoisomerase yang terlibat dalam proses transkripsi, rekombinasi, segergasi dan perbaikan DNA.
Gambar 11. Penurunan ekspresi relatif gen sea setelah pemaparan ekstrak kasar tanin selama 1 jam.
23 lebih besar dibandingkan dengan S10, dilihat dari nilai CT gen sea yaitu 19.84 pada kultur SJ1 dan 23.89 pada kultur S10. Nofrianti 2015 menyebutkan bahwa
S.aureus yang diisolasi dari berbagai bahan makanan memiliki sensitivitas yang berbeda-beda terhadap antibiotik. Sensitivitas yang berbeda ini akan mempengaruhi kemampuan dalam produksi protein. Hasil penelitian Nofrianti 2015 juga menunjukkan pada pemberian ekstrak alkaloid dari daun pepaya pada konsentrasi rendah yaitu 0.25 mg/mL mampu menurunkan ekspresi gen sea lebih besar pada kultur SJ1 yaitu 4.91 kali dibandingkan dengan kultur S10 sebesar 3.10 kali.
4
SIMPULAN DAN SARAN
Simpulan
Proses ekstraksi tanin daun pepaya dengan metode kombinasi antara refluks dan maserasi meningkatkan jumlah rendemen ekstrak yang dihasilkan. Deteksi kultur SJ1 dan S10 secara molekuler menunjukkan kedua kultur ini merupakan S. aureus penghasil gen sea. Ekstrak kasar tanin hasil refluks dan maserasi dengan konsentrasi 20 mg/mL mampu menekan pertumbuhan S. aureus secara nyata. Serta pemaparan ekstrak kasar tanin daun pepaya dengan konsentrasi 5 mg/mL dan 10 mg/mL selama 1 jam mampu menurunkan ekspresi gen sea pada S. aureus
kultur SJ1 sebesar 6.65 dan 11.83, serta pada kultur S10 sebesar 2.75 dan 4.35.
Saran
Berdasarkan hasil yang diperoleh dari penelitian ini maka disarankan untuk menggunakan RNA kit yang spesifik untuk ekstraksi RNA dari bakteri. Selain itu dapat dilakukan penelitian mengenai aktivitas ekstrak kasar tanin daun pepaya terhadap SEA yang dihasilkan S. aureus.
DAFTAR PUSTAKA
Adachukwu I, Ann O, Faith E. 2013. Phytochemical analysis of paw-paw (Carica Papaya) leaves. Int. J. Life Sci. Biotech & Pharm. Res2. 3:347-351.
Akiyama H, Fujii K, Yamasaki O, Oono T, Iwatsuki K. 2001. Antibcterial action of several tannins against Staphylococcus aureus. J. Antimicrob. Chemoter. 48: 487-491.
Alabi OA, Haruna MT, Anokwuru CP, Jegede T, Abia H, Okegbe VU, Esan BE. 2012. Comparative studies on antimicrobial properties of extracts of fresh and dried leaves of Carica papaya (L) on clinical bacterial and fungal isolates. Adv. Appl. Sci. Res 3(5): 3107-3114.
Anibijuwon II, Udeze AO. 2009. Antimicrobial activity of Carica papaya
24
Asres K., Mazumder A, Bucar F., 2006. Antimicrobial and antifungal activities of extracts of Combertum molle. J. Ethiop. Med.44, 269-277.
Azmir J, Zaidul ISM, Rahman MM, Shafir KM, Mahmoed A, Sahena F, Jahurul MHA, Ghafoor K, Norulaini NAN, Omar AKM. 2013. Techniques for extraction of bioactive compounds from plant materials: A review. J. Food Eng. 117: 426-436
Balaban N, Rasooly A. 2000. Review staphylococcal enterotoxins [ulasan]. Int. J. Food Microbiol 61: 1-10.
Bandar H, Hijazi A, Rammal H, Hachem A, Saad Z, Badan B. 2013. Techniques for the extraction of bioactive compounds from Lebanese Urtica doica. Am. J. Phytomed. Clin. Ther. 2321-2748.
Banso A. and Adeyemo SO., 2007. Evaluation of antibacterial properties of tannins isolated from Dichrostachys cinerea. J. African Biotech. 6 (15): 1785-1787
Baskaran C, Ratha bai V, Velu S, Kumaran K. 2012. The efficacy of Carica papaya leaf extract on some bacterial and a fungal strain by well diffusionmethod. Asian Pac J Trop Dis 2: S658-S662.doi: 10.1016/S2222-1808(12)60239-4.
Bio-Rad Laboratories. 2006. Optimizing Real Time PCR: A focused approach for exceptional Real-Time qPCR results. Canada.
Blackwell LD. 2012. Alkaline extraction of phenolic compounds from intact sorgum kernels. Int. J. Food Sci & Tech. 47:2671-2675.
Borst DW, Betley MJ. 1994. Phage-associated differences in staphylococcal enterotoxin A gene (sea) expression correlate with sea allele class. Infect. extraction efficiency, from Rubus idaeus, Cydonia oblonga and Rumex acetosa, using different extractiontechniques and spectrophotometric quantification. Seria F Chemia 8:55-59
Colak SM,Yapici BM, Yapici AN, 2010. Determination of antimicrobial activity of tannin acid in pickling process. Roman. Biotech. Lett. 15(3): 5325-5330 Cowan MM. 1999. Plant products as antimicrobial agent. Clin Microbiol
Rev.12(4): 564-582.
Derzelle S, Dilasser F, Duquenne M, Deperrois V. 2009. Differential temporal expression of the staphylococcal enterotoxins gene during cell growth. J. Food Microbiol. 26: 896-904.
Ebeler SE. 2013. Wine and cancer. Carkeet C, Gran K, Randolph RK, Venzon DS, Izzy SM, Editor. Phytochemicals: Health promotion and therapeutic potential. United States of America:CRC Press.
Ferreira PRB, Mendes CSO, Rodrigues CG, Rocha JCM, Royo VA, Valerio HM, Oliveria DA. 2012. Antibacterial activity tannin- rich fraction from leaves of