TRANSPORTASI BENIH IKAN GABUS
Channa striata
DENGAN KEPADATAN BERBEDA PADA
MEDIA BERSALINITAS 3 PPT
JANNESA NASMI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul “Transportasi Benih Ikan Gabus Channa striata dengan Kepadatan Berbeda pada Media Bersalinitas 3 ppt” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2016
Jannesa Nasmi
RINGKASAN
JANNESA NASMI. Transportasi Benih Ikan Gabus Channa striata dengan Kepadatan Berbeda pada Media Bersalinitas 3 ppt. Dibimbing oleh KUKUH NIRMALA dan RIDWAN AFFANDI.
Ikan gabus merupakan ikan air tawar yang memiliki bentuk kepala menyerupai ular sehingga disebut Snakehead. Ikan gabus menjadi komoditas budidaya ekonomis karena selain sebagai ikan konsumsi, daging ikan gabus yang mengandung albumin berkhasiat mempercepat pengeringan luka pascaoperasi dan dapat meningkatkan daya tahan tubuh. Kegiatan pembesaran benih ikan gabus telah banyak dilakukan di daerah Jawa Barat dan Jawa Timur. Adapun suplai benih umumnya berasal dari hasil tangkapan alam dari Kalimantan Selatan dan Kalimantan Timur. Karena adanya jarak antara tempat sumber benih dan tempat pembesaran, maka dilakukan transportasi benih ikan gabus.
Salah satu upaya untuk mengefisiensikan biaya transportasi adalah dengan menambah kepadatan ikan dalam media transportasi. Kepadatan ikan yang tinggi dalam media menyebabkan CO2 di media semakin meningkat karena proses
respirasi. Senyawa CO2 bereaksi dengan air menghasilkan asam karbonat (H2CO3)
yang dapat menurunkan pH dalam air. Perubahan kondisi lingkungan ini akan menyebabkan ikan mengalami stres sehingga mengganggu kondisi fisiologis dan akhirnya dapat menyebabkan kematian.
Jumlah konsumsi oksigen dipengaruhi oleh kebutuhan energi. Semakin banyak energi yang dibutuhkan maka jumlah konsumsi oksigen semakin meningkat. Penambahan garam di dalam media dapat membantu ikan dalam mengurangi penggunaan energi, karena apabila tekanan osmotik lingkungan mendekati tekanan osmotik cairan tubuh ikan, maka energi hasil metabolisme hanya sedikit yang digunakan untuk penyesuaian diri dengan tekanan osmotik lingkungan. Tujuan penelitian ini adalah menganalisis pengaruh pemberian garam 3 ppt ke dalam media transportasi dengan kepadatan ikan yang berbeda terhadap perubahan kualitas air, tingkat kelangsungan hidup, laju pertumbuhan harian dan tingkat stres pascatransportasi.
pada media bersalinitas 0 ppt. Hasil penelitian menunjukkan bahwa tingkat kelangsungan hidup dan laju pertumbuhan pascatransportasi tidak berbeda nyata pada kepadatan yang berbeda serta pada perlakuan tanpa garam. Tingkat stres perlahan telah kembali normal hingga hari ke-21 pemeliharaan.
SUMMARY
JANNESA NASMI. Snakehead Seed Transportation with Different Densities in 3 ppt Salinity Media. Supervised by KUKUH NIRMALA and RIDWAN AFFANDI.
Snakehead is a freshwater fish which has a shape resembling the head of a snake so-called Snakehead. Snakehead becomes economical aquaculture commodities because its meat contain albumin which believed to accelerate the post-surgery recovery and increase immunities. Snakehead’s rearing has a lot to do in West Java and East Java. The supply of seed generally derived from South Kalimantan and East Kalimantan. Snakehead’s rearing has a lot to do in West Java and East Java. Because of the distance between seed’s sources and farm, the larvae need to be transported.
One of the efforts to streamline transportation costs is increasing the density of larvae in transport media. High density in closed transportation media effects increased the concentration CO2. CO2 reacts with water and formed carbonic acid (H2CO3) which can decrease the pH of water. Environmental
changing will cause stress that interfere with physiological conditions and can eventually lead to death.
The oxygen consumption depends from energy. The more energy that needed, the more oxygen consumed. Salt addition in transportation media can reduce the osmoregulation energy budget of fish, because when environmental salinity approach the salinity of fish, the less energy expended for maintaining internal equilibrium. The aim of this research is to analyze the effects of 3 ppt salt addition into the transportation media with the water quality, survival rate, daily growth rate and post transportation stress levels.
High seeds densities in transportation media has become a problem because it can decrease the value of dissolved oxygen and increase carbon dioxide from the respiration process. High levels of carbon dioxide in water decrease the pH of water. The present study was aimed to ensure the effect 3 ppt transportation into media water salinity addition with different densities in the water quality, suvival rate, daily growth rate and stress level after transportation.
showed no significant differences in the survival rate and growth rate at the different densities without salt addition. The levels of stress were slightly back to normal in 21 days rearing.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
TRANSPORTASI BENIH IKAN GABUS
Channa striata
DENGAN KEPADATAN BERBEDA PADA
MEDIA BERSALINITAS 3 PPT
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2016
ii
iv
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah subhanahu wa ta’ala atas segala karunia dan berkah-Nya sehingga serangkaian karya ilmiah yang berjudul “Transportasi Benih Ikan Gabus Channa striata dengan Kepadatan Berbeda pada Media Bersalinitas 3 ppt” ini dapat diselesaikan dengan baik.
Terima kasih penulis ucapkan dengan hormat kepada Dr Ir Kukuh Nirmala, MSc dan Prof Dr Ir Ridwan Affandi, DEA selaku pembimbing selayaknya orang tua yang telah banyak memberikan arahan dan masukan baik tekhnis maupun non tekhnis kepada penulis sehingga karya ilmiah ini dapat diselesaikan. Terimakasih juga penulis ucapkan kepada Dr Ir Mia Setiawati MSi selaku dosen penguji luar komisi pada ujian tesis atas segala saran yang diberikan sehingga tesis ini menjadi lebih baik.
Penulis juga mengucapkan terima kasih dan rasa hormat kepada ayahanda Ir Nasril serta ibunda Ir Syafmimi dan juga adik-adik Jenitia Nasmi dan M Hidayat Nasmi beserta keluarga besar atas segala dukungan, kesabaran, pengertian, doa dan kasih sayangnya selama penulis menjalani masa studi.
Ucapan terima kasih tak lupa penulis sampaikan kepada rekan rekan yang selama masa studi dapat menjadi motivasi dan memberikan pengaruh yang positif bagi penulis; Agustina Buulolo SPi; Anny Hary Ayu SPi; Humairani SPi MSi; Asih Makarti Muktitama SPi; Yuliana Asri SPi MSi; Mufti Islam Insani SSi; Shella Marlinda SPi; Christy Lopulisa SPi; serta keluarga besar Program Studi Ilmu Akuakultur lain yang tidak bisa disebutkan satu persatu. Terimakasih juga penulis sampaikan kepada Faridan Muchlis Purdiansyah SKel atas segala motivasi dan kesabaran yang diberikan selama penulis menjalani masa studi.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2016
vi
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN viii
1 PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 2
Tujuan 3
Hipotesis 3
2 METODE 3
Penelitian Tahap 1 3
Waktu dan Tempat 3
Rancangan Percobaan 4
Pelaksanaan Penelitian 4
Parameter Uji 4
Analisis Data 5
Penelitian Tahap II 5
Waktu dan Tempat 5
Pelaksanaan Penelitian 5
Parameter Uji 6
Analisis Data 8
3 HASIL DAN PEMBAHASAN 8
Hasil 8
Penelitian Tahap 1 8
Fisika-Kimia Air 10
Tingkat Kelangsungan Hidup (TKH) selama Transportasi 10
Penelitian Tahap II 11
Tingkat Kelangsungan Hidup (TKH) selama Pascatranspotasi 11
Laju Pertumbuhan Harian (LPH) 12
Gradien Osmotik (GO) 13
Respons Glukosa Darah 14
Respons pH Darah 14
Eritrosit (Sel Darah Merah) 15
Leukosit (Sel Darah Putih) 16
Hemoglobin 17
Hematokrit 17
Aktivitas Lisozim 18
Fisika-Kimia Air Pemeliharaan 19
vii
4 SIMPULAN DAN SARAN 25
Simpulan 25
Saran 25
DAFTAR PUSTAKA 25
LAMPIRAN 29
RIWAYAT HIDUP 38
RIWAYAT
DAFTAR TABEL
1 Parameter pengukuran fisika-kimia air selama penelitian 4 2 Kisaran nilai fisika-kimia air pemeliharaan benih ikan gabus selama
21 hari pemeliharaan pascatransportasi 8
DAFTAR GAMBAR
1. Nilai parameter fisika-kimia air transportasi benih ikan gabus dengan kepadatan berbeda pada media bersalinitas 3 ppt 9 2. Tingkat kelangsungan hidup benih ikan gabus dengan kepadatan
berbeda pada media bersalinitas 3 ppt 11
3. Tingkat kelangsungan hidup benih ikan gabus selama 21 hari
pemeliharaan pascatransportasi 12
4. Benih ikan gabus yang hidup selama 21 hari pemeliharaan
pascatransportasi 12
5. Laju pertumbuhan harian benih ikan gabus selama 21 hari
pemeliharaan pascatransportasi 13
6. Nilai gradien osmotik benih ikan gabus pascatransportasi 14 7. Kadar respons glukosa darah benih ikan gabus selama 21 hari
pemeliharaan pascatransportasi 13
8. Kadar pH darah benih ikan gabus selama 21 hari pemeliharaan
pascatransportasi 14
9. Kadar eritrosit benih ikan gabus selama 21 hari pemeliharaan
pascatransportasi 16
10. Kadar leukosit benih ikan gabus selama 21 hari pemeliharaan
pascatransportasi 16
11. Kadar hemoglobin benih ikan gabus selama 21 hari pemeliharaan
pascatransportasi 17
12. Kadar hematokrit benih ikan gabus selama 21 hari pemeliharaan
pascatransportasi 18
13. Kadar aktivitas lisozim benih ikan gabus selama 21 hari pemeliharaan
viii
DAFTAR LAMPIRAN
1 Hasil analisis ragam tingkat kelangsungan hidup transportasi benih ikan gabus dengan kepadatan berbeda pada media bersalinitas 3 ppt 29 2 Hasil analisis ragam tingkat kelangsungan hidup benih ikan gabus
selama 21 hari pemeliharaan pascatransportasi 29 3 Hasil analisis ragam laju pertumbuhan harian benih ikan gabus
selama 21 hari pemeliharaan pascatransportasi 29 4 Hasil analisis ragam gradien osmotik benih ikan gabus
pascatransportasi 30
5 Hasil analisis ragam glukosa darah benih ikan gabus selama 21 hari
pemeliharaan pascatransportasi 30
6 Hasil analisis pH darah benih ikan gabus selama 21 hari pemeliharaan
pascatransportasi 31
7 Hasil analisis ragam eritrosit benih ikan gabus selama 21 hari
pemeliharaan pascatransportasi 32
8 Hasil analisis ragam leukosit benih ikan gabus selama 21 hari
pemeliharaan pascatransportasi 34
9 Hasil analisis ragam hemoglobin benih ikan gabus selama 21 hari
pemeliharaan pascatransportasi 34
10 Hasil analisis ragam hematokrit benih ikan gabus selama 21 hari
pemeliharaan pascatransportasi 35
11 Hasil analisis ragam aktivitas lisozim benih ikan gabus selama 21 hari
1 PENDAHULUAN
Latar Belakang
Ikan gabus (Channa striata) merupakan ikan tawar yang memiliki bentuk kepala menyerupai ular sehingga disebut Snakehead. Ikan ini juga dikenal dengan nama ikan kutuk, ikan haruan, ikan gapo, ikan dalak atau ikan jilo. Ikan gabus menjadi komoditas budidaya ekonomis karena selain sebagai ikan konsumsi, daging ikan gabus yang mengandung albumin berkhasiat mempercepat pengeringan luka pascaoperasi dan meningkatkan daya tahan tubuh (Rahmawanty
et al. 2014). Sumber benih utama pada kegiatan budidaya ikan gabus adalah dari hasil tangkapan alam (Muslim 2007). Menurut Pusdatin KKP (2014) volume produksi perikanan tangkap di perairan umum pada tahun 2013 didominasi oleh ikan gabus. Produksinya sebesar 36.205 ton dari total 408.364 ton produksi perikanan tangkap di perairan umum. Saat ini kegiatan pembesaran ikan gabus telah banyak dilakukan di daerah Jawa Barat dan Jawa Tengah, benih ikan gabus yang digunakan umumnya didatangkan dari Kalimantan Selatan dan Kalimantan Timur yang merupakan daerah penghasil utama ikan gabus. Perbedaan jarak antara lokasi penghasil benih dengan lokasi pembesaran menyebabkan butuhnya transportasi benih untuk menunjang kegiatan produksi.
Transportasi ikan hidup terbagi dua, yaitu sistem kering dan sistem basah. Transportasi sistem kering dilakukan dengan cara ikan dibius dan diangkut tanpa menggunakan media air namun tetap menjaga suhu dan kelembapan media transportasi (Sufianto 2008). Transportasi sistem basah terbagi atas dua metode yakni sistem terbuka dan sistem tertutup. Transportasi sistem terbuka menggunakan media air dengan pemberian aerasi secara terus menerus, transportasi ini dilakukan untuk jumlah ikan yang diangkut relatif sedikit, jarak tempuhnya dekat, serta dalam waktu yang relatif singkat. Pada penelitian ini digunakan transportasi sistem tertutup karena transportasi ikan dapat dilakukan dalam jumlah yang banyak, jarak yang jauh dan waktu yang relatif lama. Pada transportasi sistem tertutup, ikan diangkut dalam wadah yang tertutup dengan pemberian gas O2 dalam jumlah terbatas yang telah diperhitungkan sesuai dengan
kebutuhan selama pengangkutan (Wibowo 1993).
Salah satu upaya untuk mengefisiensikan biaya transportasi adalah dengan menambah kepadatan ikan dalam media transportasi. Kepadatan ikan yang tinggi dalam media transportasi tertutup menjadi masalah karena kebutuhan oksigen (O2)
juga semakin meningkat. Kebutuhan O2 yang meningkat menyebabkan CO2 di
perairan semakin meningkat karena proses respirasi. Tingginya kadar CO2
menyebabkan pH air menurun, karena CO2 yang bereaksi dengan air
menghasilkan asam karbonat (H2CO3). Perubahan kondisi lingkungan saat
transportasi menyebabkan ikan mengalami stres sehingga mempengaruhi kondisi fisiologis ikan. Stres adalah suatu fenomena biologis yang non-spesifik dari suatu perubahan lingkungan atau faktor lain yang mempengaruhi daya adaptasi
2
Penelitian Wahyu (2015) transportasi ikan gabus dengan kepadatan 75 ekor.L-1 menghasilkan tingkat kelangsungan hidup sebesar 69% dan kematian total pada pemeliharaan hari ke-21. Oleh karena itu diperlukan teknologi transportasi yang tepat untuk meningkatkan kelangsungan hidup ikan gabus. Pada penelitian Emu (2010) bahwa penambahan garam di dalam media transportasi ikan patin dapat mempertahankan kondisi kualitas air, mengurangi tingkat stres, mempertahankan tingkat kelangsungan hidup dan laju pertumbuhan tetap tinggi setelah dilakukannya transportasi. Penambahan garam di dalam media dapat membantu ikan dalam mengurangi penggunaan energi, karena apabila salinitas lingkungan mendekati salinitas cairan tubuh ikan, maka energi hasil metabolisme hanya sedikit yang digunakan untuk penyesuaian diri dengan tekanan osmotik lingkungan. Kondisi ini membuat ikan menjadi lebih tenang, sehingga mengurangi jumlah konsumsi oksigen (Marlina 2011). Selain itu, garam juga digunakan untuk mengurangi toksisitas amonia di dalam air karena jika laju metabolisme meningkat maka laju eksresi juga ikut meningkat (Nirmala et al. 2012).
Konsentrasi salinitas yang digunakan pada penelitian ini mengacu pada penelitian Purnamawati & Dewantoro (2016) yang menyatakan bahwa salinitas air yang baik untuk pertumbuhan ikan gabus adalah sebesar 3 ppt. Oleh karena itu, perlu dilakukan penelitian transportasi ikan gabus dengan penambahan garam 3 ppt untuk mengetahui tingkat kelangsungan hidup dan kepadatan yang maksimal dalam transportasi sehingga menghasilkan metode transportasi yang lebih baik.
Rumusan Masalah
Salah satu upaya untuk mengefisiensikan biaya transportasi adalah dengan menambah kepadatan ikan dalam media transportasi. Namun, kepadatan ikan yang tinggi dalam media transportasi menyebabkan tingginya jumlah kematian ikan. Kepadatan dalam media transportasi tertutup berpengaruh terhadap kebutuhan oksigen. Semakin banyak oksigen yang diserap ikan maka kandungan CO2 meningkat karena proses respirasi. Senyawa CO2 bereaksi dengan air
menghasilkan asam karbonat (H2CO3) yang dapat menurunkan pH di air.
3
Tujuan
Penelitian ini dilakukan dengan tujuan untuk :
1. Menganalisis pengaruh penambahan garam ke dalam media transportasi dengan kepadatan ikan yang berbeda terhadap perubahan kondisi kualitas air dan kelangsungan hidup ikan gabus selama transportasi.
2. Menganalisis tingkat kelangsungan hidup, laju pertumbuhan dan tingkat stres selama 21 hari pemeliharaan pascatransportasi.
3. Menentukan kepadatan maksimal ikan gabus dalam transportasi sistem tertutup.
Hipotesis
Hipotesis yang diajukan pada penelitian ini adalah penambahan garam 3 ppt pada media transportasi ikan gabus dapat mempertahankan kualitas air tetap baik dan mengurangi tingkat stres ikan sehingga akan diperoleh kelangsungan hidup yang tinggi.
2 METODE
Penelitian dilaksanakan melalui dua tahap, yaitu penelitian Tahap I (transportasi) dan Tahap II (pemeliharaan pascatransportasi). Penelitian Tahap I bertujuan untuk memperoleh informasi mengenai pengaruh penambahan garam terhadap perubahan kondisi kualitas air pada saat transportasi ikan gabus. Ikan gabus yang telah ditransportasi pada penelitian Tahap I kemudian pada Tahap II dipelihara dengan tujuan untuk melihat pengaruh transportasi terhadap tingkat stres.
Penelitian Tahap I
Waktu dan Tempat
Penelitian Tahap I dilaksanakan pada pada tanggal 15 November–16 November 2015 selama 24 jam. Transportasi dilakukan dari tempat pengambilan ikan “Andhi Fish Farm” di Yogyakarta ke stasiun kota Yogyakarta dengan menggunakan mobil selama ±7 jam. Lalu dari stasiun Yogyakarta menuju stasiun Senen Jakarta dengan menggunakan kereta api selama ±9 jam, dari stasiun Senen Jakarta menuju kampus IPB Dramaga dengan menggunakan mobil selama ±5 jam.
Rancangan Percobaan
4
K = 30 ekor ikan gabus (tanpa garam) A = 30 ekor ikan gabus
B = 45 ekor ikan gabus C = 60 ekor ikan gabus D = 75 ekor ikan gabus
Keterangan : perlakuan A, B, C dan D dengan media bersalinitas 3 ppt
Pelaksanaan Penelitian
Persiapan
Biota uji yang digunakan adalah ikan gabus dengan ukuran bobot rata-rata 2,6±0,2 g dan panjang 6,6±0,2 cm. Benih berasal dari hasil budidaya pembenihan ikan air tawar milik “Andhi Fish Farm” di Yogyakarta. Benih ikan gabus yang digunakan adalah benih yang sehat, bugar dan tidak cacat fisik.
Wadah yang digunakan selama transportasi adalah kantong plastik
polyethylene dan kotak Styrofoam. Kantong plastik polyethylene (PE) yang digunakan berukuran 28x50 cm2. Salah satu bagian ujung kantong plastik dipasang keran aerasi untuk memudahkan pengambilan sampel air.
Kegiatan Transportasi
Sebelum dilakukan transportasi ikan gabus dipuasakan selama 2 hari, hal ini bertujuan mengurangi laju metabolisme dan mengurangi pembuangan feses. Masing-masing kantong plastik diisi air 1,2 liter dan ditambahkan garam sebesar 3 ppt. Ikan dimasukkan kedalam masing-masing kantong plastik sesuai dengan perlakuan kepadatan. Setiap kantong diinjeksi oksigen murni dengan perbandingan 1:3 (air:oksigen). Kantong diikat dengan karet lalu dimasukkan ke dalam kotak styrofoam. Pada setiap styrofoam diberi es batu dan ditutup rapat. Lalu dilakukan transportasi selama 24 jam. Selama transportasi dilakukan pengambilan sampel air sebanyak 20 mL per kantong pada jam ke- 0, 6, 12, 18 dan 24 untuk pengamatan perubahan kondisi kualitas air. Pengamatan tingkat kelangsungan hidup dilakukan pada jam ke-24 transportasi.
Parameter Uji
Parameter Fisika-Kimia Air
Parameter fisika-kimia air yang diukur antara lain suhu, oksigen terlarut (OT), amonia (NH3), karbondioksida (CO2) dan pH air (Tabel 1).
Tabel 1 Parameter pengkuran fisika-kimia air selama penelitian Fisika-kimia air Satuan Alat ukur/Metode
Suhu oC Termometer
Oksigen terlarut (OT) mg.L-1 DO-meter Amonia (NH3) mg.L-1 Spektrofotometer
Karbondioksida (CO2) mg.L-1 Titrasi
5
Tingkat Kelangsungan Hidup (TKH)
Tingkat kelangsungan hidup dihitung berdasarkan Ricker (1975):
TKH
=
x 100
Keterangan :
TKH = Tingkat kelangsungan hidup(%)
Nt = Jumlah ikan pada akhir transportasi (ekor) N0 = Jumlah ikan pada awal transportasi (ekor)
Analisis Data
Data yang diperoleh ditabulasi dengan Microsoft Excel 2010. Parameter tingkat kelangsungan hidup dianalisis ragam (ANOVA) pada selang kepercayaan 95% dengan bantuan perangkat lunak SPSS 17.0. Apabila data berbeda nyata maka dilanjutkan dengan uji Duncan. Parameter fisika-kimia air dianalisis secara deskriptif yang disajikan dalam bentuk grafik.
Penelitian Tahap II
Waktu dan Tempat
Penelitian Tahap II dilaksanakan pada tanggal 16 November–7 Desember 2015 selama 21 hari. Pemeliharaan ikan gabus pascatransportasi dilakukan di Laboratorium Lingkungan BDP FPIK IPB, Departemen Budidaya Perairan (BDP), Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Uji osmolaritas di Laboratorium Embriologi FKH IPB. Uji glukosa darah ikan dilakukan di Laboratorium Fisiologi Fakultas Kedokteran Hewan (FKH) IPB. Uji hematologi dilakukan di Laboratorium Kesehatan Ikan BDP FPIK IPB. Uji aktivitas lisosim dilakukan di Laboratorium Reproduksi dan Genetika Organisme Akuatik. Uji fisika-kimia air dan pH darah dilakukan di Laboratorium Lingkungan BDP FPIK IPB.
Pelaksanaan Penelitian
Setelah ditransportasi ikan dibongkar dan dipelihara untuk mengetahui adanya efek dari transportasi. Pemeliharaan ini dilakukan selama 21 hari dalam media akuarium berukuran 1,0x0,5x0,5 m3 dengan padat tebar awal 30 ekor ikan per-akuarium dan salinitas media air pemeliharaan sebesar 0 ppt. Benih ikan gabus dipelihara dan diberi pakan berupa pelet dengan metode at satiation.
6
dilakukan pada hari ke-0, hari ke-1, hari ke-4, hari ke-7, hari ke-14 dan hari ke-21. Pengamatan respons tingkat stres dilakukan melalui pengujian pada sampel darah ikan. Sampel darah diambil sebanyak 0,5 ml pada masing-masing ulangan. Pengambilan sampel darah dilakukan dengan menggunakan syringe 1 ml pada
vena caudalis.
Parameter Uji
Laju Pertumbuhan Harian(LPH)
Laju pertumbuhan harian dihitung dengan menggunakan rumus Ricker (1975):
Keterangan :
α = Laju pertumbuhan harian(%)
Wt = Berat rata-rata pada akhir pemeliharaan W0 = Berat rata-rata pada awal pemeliharaan
t = Periode penelitian (hari)
Gradien Osmotik (GO)
Pengukuran GO dilakukan untuk mengetahui tekanan osmotik antara media dan organisme akibat pemberian garam kedalam wadah transportasi. Pengukuran gradien osmotik dengan mengukur cairan osmolaritas darah dan air media, kemudian dilakukan pengukuran menggunakan alat Osmometer Automatik Roebling. Perhitungan gradien osmotik dihitung dengan menggunakan rumus menurut Anggoro (1992), yaitu :
GO (Osmol.kg-1) = [Nilai tekanan osmotik plasma–Nilai tekanan osmotik media]
Kadar Glukosa Darah
Kadar glukosa darah diukur dengan metode Wedemeyer & Yasutake (1977). Plasma sebanyak 50 μl ditambahkan ke dalam 3,5 ml reagen warna ortho-toluidin
dalam asam asetat glasial. Campuran tersebut dimasukkan dalam air mendidih selama 10 menit. Setelah didinginkan dalam suhu ruang, nilai absorbsinya diukur dengan spektrofotometer pada panjang gelombang 635 nm. Kadar glukosa darah dihitung dengan rumus sebegai berikut :
GD =
x GSt
Keterangan:
GD = Konsentrasi glukosa darah (mg.dL-1) AbsSp = Absorbansi sampel
7 GSt = Konsentrasi glukosa standar (mg.dL-1)
Hematologi (gambaran darah)
Pengambilan darah dilakukan dengan menggunakan syringe steril pada bagian vena caudalis ikan uji. Sebelum digunakan, jarum suntik terlebih dahulu dibasahi dengan Na-Sitrat 3,8% yang berfungsi sebagai antikoagulan. Sampel darah diambil untuk pengukuran parameter jumlah eritrosit, jumlah leukosit, hemoglobin dan hematokrit.
- Jumlah sel darah merah (eritrosit)
Jumlah eritrosit dihitung menurut metoda Blaxhall dan Daisley (1973). Sampel darah diencerkan dengan larutan Hayem untuk menghancurkan sel darah putih agar jumlah sel darah merah dapat dihitung. Pengenceran dilakukan dengan menggunakan pipet pencampur berskala maksimum 11 yang dilengkapi pengaduk. Darah dihisap dengan pipet hingga skala 1, kemudian dihisap larutan Hayem hingga skala 11 menggunakan pipet yang sama. Pipet digoyang selama 15 menit agar darah tercampur secara merata, sedangkan larutan pada ujung pipet yang tidak tercampur segera dibuang. Darah yang teraduk diteteskan kedalam hemositometer yang dilengkapi gelas penutup hingga memenuhi seluruh permukaan yang berskala, selanjutnya dilakukan penghitungan dibawah mikroskop.
- Jumlah sel darah putih (leukosit)
Jumlah leukosit dihitung dengan metoda Blaxhall dan Daisley (1973). Sampel darah diencerkan dengan larutan Turks untuk menghancurkan sel darah merah agar jumlah sel darah putih dapat dihitung. Untuk mengencerkan leukosit digunakan pipet berskala maksimal 11 yang dilengkapi pengaduk. Mula-mula darah dihisap hingga skala 1, kemudian dilanjutkan dengan menghisap larutan Turks hingga skala 11. Pencampuran dilakukan dengan mengaduk pipet selama 15 menit agar darah tercampur secara merata. Setelah pencampuran selesai, teteskan kedalam hemositometer yang dilengkapi gelas penutup hingga memenuhi seluruh permukaan yang berskala, selanjutnya dilakukan penghitungan leukosit dibawah mikroskop.
- Kadar hemoglobin (Hb)
Kadar hemoglobin diukur menurut metode Sahli (Wedemeyer dan Yasutake, 1977) yaitu dengan mengisi tabung sahlinometer dengan larutan HCl 0,1 N sampai garis skala 10 merah, kemudian ditempatkan diantara 2 tabung warna standar. Darah ikan dari tabung mikro diambil dengan pipet Sahli sebanyak 0,02 mL dan dimasukkan ke tabung Sahli, kemudian didiamkan selama 3 menit. Selanjutnya ditambahkan akuades dengan pipet tetes sedikit demi sedikit dan diaduk sampai berubah warna tepat sama dengan warna standar. Kadar hemoglobin dinyatakan dalam g.dL-1 pada skala kuning.
- Kadar hematokrit (Ht)
8
Aktivitas Lisozim
Aktivitas lisozim diukur dengan metode Ellis (1990). Plasma (30 µ l) ditambahkan suspensi cair bakteri Micrococcus lysodeikiticus (sigma) sebanyak 170 µl (0,2 mg.mL-1) dalam 0,1 M Phosphate buffered saline pH 6,2 pada suhu 25 ºC. Dilakukan dua kali pembacaan adsorpsi pada panjang gelombang 540 nm di
Microplate reader (Kayto RT-2100C) selama 30 detik pencampuran dan 30 menit pencampuran. Unit aktivitas lisozim akan dibatasi sejumlah enzim yang menyebabkan penurunan absorbans 0,001 min-1.
Analisis Data
Data yang diperoleh ditabulasi dengan Microsoft Excel 2010. Parameter tingkat kelangsungan hidup, laju pertumbuhan harian, gradien osmotik, glukosa darah, pH darah, hematologi dan aktivitas lisozim dianalisis ragam (ANOVA) pada selang kepercayaan 95% dengan bantuan perangkat lunak SPSS 17.0. Apabila data berbeda nyata maka dilanjutkan dengan uji Duncan. Parameter fisika-kimia air dianalisis secara deskriptif.
3 HASIL DAN PEMBAHASAN
Hasil
Penelitian Tahap I
Kegiatan penelitian tahap I adalah transportasi. Parameter yang diamati meliputi fisika-kimia air (suhu, oksigen terlarut, NH3, CO2 dan ph air) dan tingkat
kelangsungan hidup selama transportasi.
Parameter Fisika-Kimia Air selama Transportasi
9
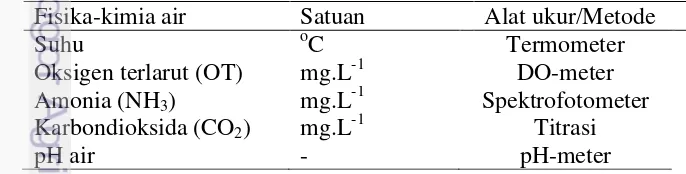
Gambar 1 Nilai parameter fisika-kimia air selama transportasi benih ikan gabus dengan kepadatan berbeda pada media bersalinitas 3 ppt;
(a) suhu ; (b) oksigen terlarut; (c) NH3; (d) CO2; (e) pH
Suhu pada jam ke-6 mengalami penurunan akibat penambahan es batu dan pada jam berikutnya perlahan mengalami kenaikan. Suhu dalam media pengepakan selama 24 jam berkisar 22-27oC.
DO pada jam ke-6 mengalami kenaikan karena terjadi difusi oksigen akibat goncangan saat transportasi dan pada jam berikutnya mulai mengalami penurunan. Konsentrasi DO pelakuan 30 (tanpa garam) pada jam ke-24 memiliki nilai terkecil sebesar 4,7±0,19 mg.L-1. Menurunnya nilai DO juga seiring semakin tingginya kepadatan pada suatu media transportasi, yaitu pada perlakuan 75 ekor
10
sebesar 5,4±0,10 mg.L-1, perlakuan 60 ekor sebesar 6,3±0,14 mg.L-1, perlakuan 45 ekor sebesar 6,8±0,13 mg.L-1 dan perlakuan 30 ekor (3 ppt garam) sebesar 6,8±0,06 mg.L-1.
Konsentasi NH3 dari setiap perlakuan mengalami peningkatan konsentrasi
seiring dengan semakin lamanya waktu transportasi. Pada jam ke-24 dapat dilihat bahwa konsentrasi NH3 terendah pada perlakuan 30 ekor (3 ppt garam) sebesar
0,025±0,001 mg.L-1, diikuti oleh perlakuan 45 ekor sebesar 0,026±0,001 mg.L-1, perlakuan 60 ekor sebesar 0,028±0,000 mg.L-1, perlakuan 75 ekor sebesar 0,031±0,001 mg.L-1 dan perlakuan 30 ekor (tanpa garam) memiliki konsentrasi NH3 tertinggi yaitu sebesar 0,031±0,001 mg.L-1.
Konsentrasi CO2 dalam media air pengangkutan terus mengalami
peningkatan dari jam ke-0 hingga jam ke-24. Pada jam ke-24 konsentrasi CO2
tertinggi terdapat pada perlakuan 30 ekor (tanpa garam) sebesar 37,40±0,02 mg.L-1. Semakin tinggi jumlah kepadatan dalam media transportasi menyebabkan konsumsi oksigen semakin banyak. Konsentrasi CO2 tertinggi pada perlakuan 75
ekor sebesar 31,24±0,03 mg.L-1, perlakuan 60 ekor sebesar 25,30±0,03 mg.L-1, perlakuan 45 ekor sebesar 21,78±0,03 mg.L-1 dan terkecil pada perlakuan 30 ekor sebesar 15,40±0,02 mg.L-1.
Nilai pH mengalami penurunan, hal ini dikarenakan semakin meningkatnya kadar CO2 seiring dengan bertambahnya waktu transportasi. Nilai
pH dalam media pengepakan selama 24 jam berkisar antara 6,8-7,1.
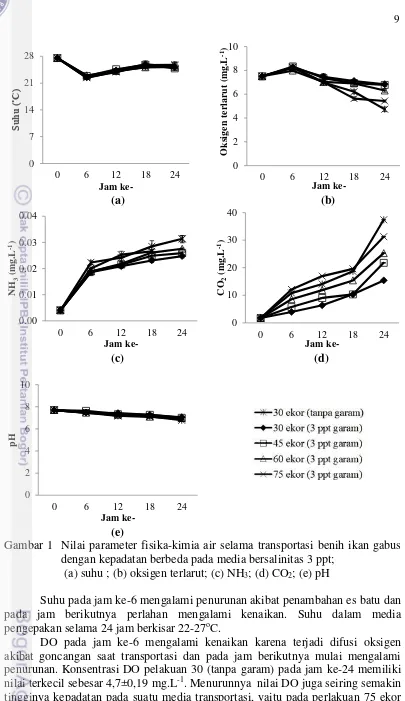
Tingkat Kelangsungan Hidup (TKH) Benih Ikan Gabus selama Transportasi
11
Gambar 2 Tingkat kelangsungan hidup (TKH) benih ikan gabus dengan kepadatan berbeda pada media bersalinitas 3 ppt. Huruf kecil yang berbeda dalam grafik menunjukkan beda nyata (p<0,05)
Penelitian Tahap II
Kegiatan penelitian tahap II adalah pemeliharaan pascatransportasi. Parameter yang diamati meliputi parameter tingkat kelangsungan hidup, laju pertumbuhan harian, gradien osmotik, glukosa darah, ph darah, hematologi, aktivitas lisozim dan fisika-kimia air pemeliharaan (suhu, oksigen terlarut, NH3,
CO2 dan ph air)
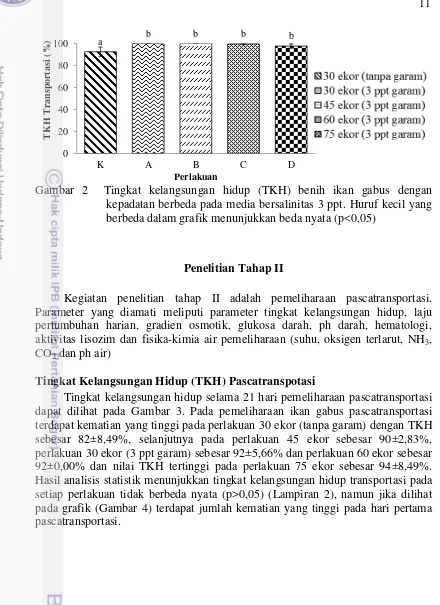
Tingkat Kelangsungan Hidup (TKH) Pascatranspotasi
12
Gambar 3 Tingkat kelangsungan hidup (TKH) benih ikan gabus selama 21 hari pemeliharaan pascatransportasi. Huruf kecil yang sama dalam grafik menunjukkan beda nyata (p>0,05)
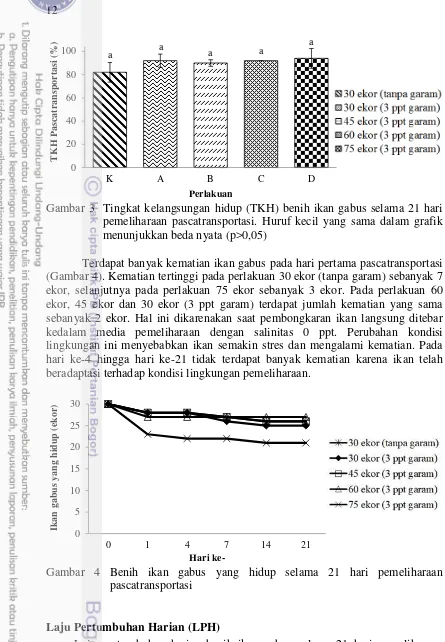
Terdapat banyak kematian ikan gabus pada hari pertama pascatransportasi (Gambar 4). Kematian tertinggi pada perlakuan 30 ekor (tanpa garam) sebanyak 7 ekor, selanjutnya pada perlakuan 75 ekor sebanyak 3 ekor. Pada perlakuan 60 ekor, 45 ekor dan 30 ekor (3 ppt garam) terdapat jumlah kematian yang sama sebanyak 2 ekor. Hal ini dikarenakan saat pembongkaran ikan langsung ditebar kedalam media pemeliharaan dengan salinitas 0 ppt. Perubahan kondisi lingkungan ini menyebabkan ikan semakin stres dan mengalami kematian. Pada hari ke-4 hingga hari ke-21 tidak terdapat banyak kematian karena ikan telah beradaptasi terhadap kondisi lingkungan pemeliharaan.
Gambar 4 Benih ikan gabus yang hidup selama 21 hari pemeliharaan pascatransportasi
Laju Pertumbuhan Harian (LPH)
13 1,91±0,07%, 1,78±0,11%, 1,64±0,26% dan 1,62±0,19%. Hasil analisis statistik menunjukkan laju pertumbuhan harian pada setiap perlakuan tidak beda nyata (p>0,05) (Lampiran 3). Hal ini berarti pemberian garam dan kepadatan ikan saat transportasi tidak berpengaruh terhadap laju pertumbuhan harian pascatransportasi.
Gambar 5 Laju pertumbuhan harian benih ikan gabus pada pemeliharaan 21 hari pascatransportasi. Huruf kecil yang sama dalam grafik menunjukkan beda nyata (p>0,05).
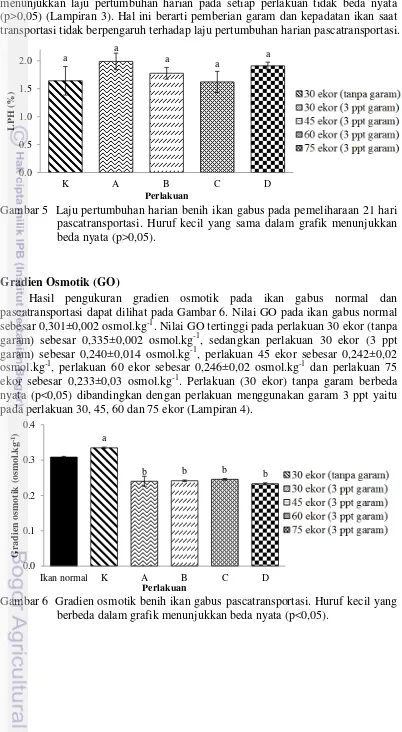
Gradien Osmotik (GO)
Hasil pengukuran gradien osmotik pada ikan gabus normal dan pascatransportasi dapat dilihat pada Gambar 6. Nilai GO pada ikan gabus normal sebesar 0,301±0,002 osmol.kg-1. Nilai GO tertinggi pada perlakuan 30 ekor (tanpa garam) sebesar 0,335±0,002 osmol.kg-1, sedangkan perlakuan 30 ekor (3 ppt garam) sebesar 0,240±0,014 osmol.kg-1, perlakuan 45 ekor sebesar 0,242±0,02 osmol.kg-1, perlakuan 60 ekor sebesar 0,246±0,02 osmol.kg-1 dan perlakuan 75 ekor sebesar 0,233±0,03 osmol.kg-1. Perlakuan (30 ekor) tanpa garam berbeda nyata (p<0,05) dibandingkan dengan perlakuan menggunakan garam 3 ppt yaitu pada perlakuan 30, 45, 60 dan 75 ekor (Lampiran 4).
Gambar 6 Gradien osmotik benih ikan gabus pascatransportasi. Huruf kecil yang berbeda dalam grafik menunjukkan beda nyata (p<0,05).
14
Respons Glukosa Darah
Hasil pengukuran konsentrasi glukosa darah ikan gabus normal, pascatransportasi dan pemeliharaan dapat dilihat pada Gambar 7. Pengamatan pada hari ke-0 pascatransportasi menunjukkan konsentrasi glukosa darah semua perlakuan mengalami peningkatan dibandingkan nilai glukosa darah ikan gabus normal. Nilai glukosa darah pada ikan gabus normal sebesar 28,048±0,23 mg.dl-1. Nilai glukosa darah tertinggi pada hari ke-0 pascatransportasi terdapat pada perlakuan 30 ekor (tanpa garam) sebesar 66,806±1,31 mg.dl-1, kemudian perlakuan 75 ekor sebesar 60,414±2,17 mg.dl-1, perlakuan 60 ekor sebesar 58,491±0,49 mg.dl-1, perlakuan 45 ekor sebesar 56,357±0,84 mg.dl-1 dan terendah pada perlakuan 30 ekor (3 ppt garam) sebesar 54,412±2,64 mg.dl-1. Hasil analisis statistik menunjukkan nilai glukosa darah hari ke-0 pada setiap perlakuan berbeda nyata (p<0,05) (Lampiran 5). Pada hari ke-4 hingga hari ke-21 nilai glukosa darah telah mendekati normal, hal ini berarti ikan sudah tidak mengalami stres.
Gambar 7 Kadar glukosa darah benih ikan gabus selama 21 hari pemeliharaan pascatransportasi. Huruf kecil yang berbeda dalam grafik menunjukkan beda nyata (p<0,05).
Respons pH Darah
15
Gambar 8 Kadar pH darah benih ikan gabus selama 21 hari pemeliharaan pascatransportasi. Huruf kecil yang berbeda dalam grafik menunjukkan beda nyata (p<0,05).
Respons Hematologi
Parameter darah merupakan salah satu indikator stres pada ikan. Beberapa parameter yang dapat memperlihatkan perubahan pada darah adalah, jumlah sel darah merah (eritrosit), jumlah sel darah putih (leukosit), kadar hemoglobin dan kadar hematokrit.
Eritrosit (Sel Darah Merah)
16
Gambar 9 Kadar eritrosit benih ikan gabus selama 21 hari pemeliharaan pascatransportasi. Huruf kecil yang berbeda dalam grafik menunjukkan beda nyata (p<0,05).
Leukosit (Sel Darah Putih)
Hasil pengukuran kadar leukosit ikan gabus normal, pascatransportasi dan pemeliharaan dapat dilihat pada Gambar 10. Pengamatan pada hari ke-0 pascatransportasi menunjukkan kadar leukosit semua perlakuan mengalami peningkatan dibandingkan kadar leukosit ikan gabus normal. Nilai leukosit ikan gabus normal sebesar 4,11x104±0,30 sel.mm-3. Nilai leukosit tertinggi pada hari ke-0 pascatransportasi terdapat pada perlakuan 45 ekor sebesar 5,84x104±0,40 sel.mm-3, perlakuan 30 ekor (3 ppt garam) sebesar 5,82x104±0,40 sel.mm-3, perlakuan 75 ekor sebesar 5,78x104±0,28 sel.mm-3, perlakuan 60 ekor sebesar 5,63 x104±0,35 sel.mm-3 dan perlakuan 30 ekor (tanpa garam) sebesar 5,62x104±0,73 sel.mm-3. Hasil analisis statistik menunjukkan nilai leukosit hari ke-0 pada setiap perlakuan tidak berbeda nyata (p>0,05) (Lampiran 8). Pada hari ke-1 hingga hari ke-21 nilai leukosit telah mendekati normal, hal ini berarti ikan sudah tidak mengalami stres.
17
Hemoglobin
Hasil pengukuran kadar hemoglobin ikan gabus normal, pascatransportasi dan pemeliharaan dapat dilihat pada Gambar 11. Pengamatan pada hari ke-0 pascatransportasi menunjukkan kadar hemoglobin semua perlakuan mengalami peningkatan dibandingkan kadar hemoglobin ikan gabus normal. Nilai hemoglobin ikan gabus normal sebesar 2,95±0,21 g%. Nilai hemoglobin tertinggi pada hari ke-0 pascatransportasi terdapat pada perlakuan 30 ekor (tanpa garam) sebesar 4,65±0,21 g%, selanjutnya nilai hemoglobin pada perlakuan 75 ekor sebesar 4,45±0,21 g%, perlakuan 45 ekor sebesar 4,40±0,14 g% , perlakuan 60 ekor sebesar 23,3 ±0,92 g% dan nilai terkecil pada perlakuan 30 ekor (3 ppt garam) sebesar 4,10±0,14 g%. Hasil analisis statistik menunjukkan nilai kadar hemoglobin hari ke-0 pada setiap perlakuan berbeda nyata (p<0,05) (Lampiran 9). Pada hari ke-4 hingga hari ke-21 nilai hemoglobin telah mendekati normal, hal ini berarti ikan sudah tidak mengalami stres.
Gambar 11 Kadar hemoglobin benih ikan gabus selama 21 hari pemeliharaan pascatransportasi. Huruf kecil yang berbeda dalam grafik menunjukkan beda nyata (p<0,05).
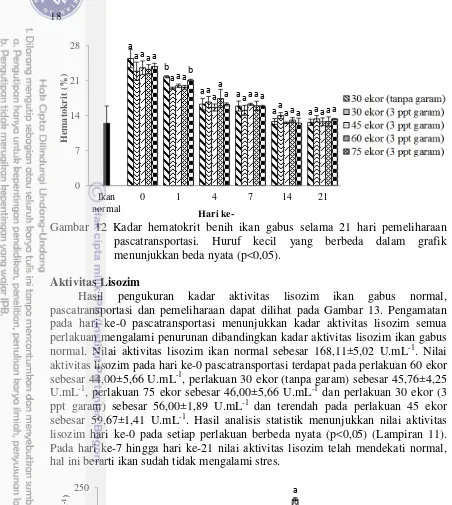
Hematokrit
Hasil pengukuran kadar hematokrit ikan gabus normal, pascatransportasi dan pemeliharaan dapat dilihat pada Gambar 12. Pengamatan pada hari ke-0 pascatransportasi menunjukkan nilai hematokrit semua perlakuan mengalami peningkatan dibandingkan nilai hematokrit ikan gabus normal. Nilai hematokrit ikan gabus normal sebesar 12,5±3,46%. Nilai hematokrit tertinggi pada hari ke-0 pascatransportasi terdapat pada perlakuan 30 ekor (tanpa garam) sebesar 25,4±1,84%, kemudian perlakuan 75 ekor sebesar 23,8±0,64%, perlakuan 45 ekor sebesar 23,6±1,34%, perlakuan 60 ekor sebesar 23,3±0,92% dan perlakuan 30 ekor (garam 3 ppt) sebesar 22,9±1,84%. Hasil analisis statistik menunjukkan nilai kadar hematokrit hari ke-0 pada setiap perlakuan tidak berbeda nyata (p>0,05) (Lampiran 10). Pada hari ke-4 hingga hari ke-21 nilai hematokrit telah mendekati normal, hal ini berarti ikan sudah tidak mengalami stres.
18
Gambar 12 Kadar hematokrit benih ikan gabus selama 21 hari pemeliharaan pascatransportasi. Huruf kecil yang berbeda dalam grafik menunjukkan beda nyata (p<0,05).
Aktivitas Lisozim
Hasil pengukuran kadar aktivitas lisozim ikan gabus normal, pascatransportasi dan pemeliharaan dapat dilihat pada Gambar 13. Pengamatan pada hari ke-0 pascatransportasi menunjukkan kadar aktivitas lisozim semua perlakuan mengalami penurunan dibandingkan kadar aktivitas lisozim ikan gabus normal. Nilai aktivitas lisozim ikan normal sebesar 168,11±5,02 U.mL-1. Nilai aktivitas lisozim pada hari ke-0 pascatransportasi terdapat pada perlakuan 60 ekor sebesar 44,00±5,66 U.mL-1, perlakuan 30 ekor (tanpa garam) sebesar 45,76±4,25 U.mL-1, perlakuan 75 ekor sebesar 46,00±5,66 U.mL-1 dan perlakuan 30 ekor (3 ppt garam) sebesar 56,00±1,89 U.mL-1 dan terendah pada perlakuan 45 ekor sebesar 59,67±1,41 U.mL-1. Hasil analisis statistik menunjukkan nilai aktivitas lisozim hari ke-0 pada setiap perlakuan berbeda nyata (p<0,05) (Lampiran 11). Pada hari ke-7 hingga hari ke-21 nilai aktivitas lisozim telah mendekati normal, hal ini berarti ikan sudah tidak mengalami stres.
19
Fisika-Kimia Air Pemeliharaan
Nilai fisika-kimia air selama pemeliharaan masih layak untuk kehidupan benih ikan gabus (Boyd 1990). Hal ini dikarenakan pengelolaan kualitas air pemeliharaan dilakukan dengan menggunakan filter sirkulasi setiap akuarium dan dilakukan penyiponan setiap hari untuk mengurangi kotoran sisa pakan dan sisa metabolisme ikan. Hasil pengukuran nilai fisika-kimia air selama pemeliharan dapat dilihat pada Tabel 2.
Tabel 2 Kisaran nilai fisika-kimia air pemeliharaan benih ikan gabus selama 21 hari pemeliharaan pascatransportasi
Parameter Kisaran Nilai Tinjauan Pustaka Suhu (ºC) 28,7 – 30,2 28-32 (Boyd 1981)
Suhu merupakan parameter penting dalam kegiatan transportasi ikan karena mempengaruhi laju metabolisme ikan, proses biologis, proses kimia, dan parameter
kualitas air lainnya. Fluktuasi suhu selama transportasi ikan gabus sebesar 0,2 oC
selama satu jam. Fluktuasi suhu tersebut masih dalam kondisi yang normal dan tidak membahayakan bagi kelangsungan hidup benih ikan gabus. Menurut Stickney (1979) bahwa fluktuasi suhu yang membahayakan bagi ikan adalah 5 oC dalam satu jam.
20
lengkungan insang (Banerjee 2007). Keberadaan organ tersebut menyebabkan oksigen bukan merupakan faktor pembatas keberhasilan transportasi benih ikan
Konsentasi NH3 dari setiap perlakuan mengalami kenaikan seiring dengan
tingginya kepadatan dalam media transportasi. Pada penelitian (Wahyu 2015) menyatakan bahwa konsentrasi NH3 meningkat seiring dengan bertambahnya
kepadatan ikan yang digunakan. Konsentrasi NH3 yang baik untuk benih ikan,
yaitu < 0,02 mg.L-1 (Boyd 1981). Perlakuan 30 ekor (tanpa garam) memiliki nilai NH3 yang lebih tinggi dibandingkan dengan perlakuan dengan penambahan garam
3 ppt. Sesuai dengan penelitian Nirmala et al. (2012) bahwa penambahan garam akan meningkatkan ionic strength yang dapat menurunkan toksisitas amonia. Penambahan garam yang juga berarti peningkatan salinitas air dapat menurunkan toksisitas NH3 untuk ikan salmon Atlantik (Alabaster & Shurben 1979). Tingginya
konsentrasi amonia di dalam air menyebabkan eksresi amonia di insang terhambat. Hambatan tersebut membuat amonia di dalam terakumulasi sehingga mengurangi afinitas hemoglobin mengikat oksigen. Kondisi tersebut dapat memicu kematian ikan saat transportasi. Tersedianya ion Na+ di media berfungsi untukpertukaran ion NH3dari dalam darah ikan melintasi sel-sel branchial (Maetz 1973). Selain itu
kondisi ikan gabus dengan penambahan garam 3 ppt menjadi lebih tenang dikarenakan menurunnya gradien osmotik yang berdampak pada menurunnya penggunaan energi ikan, sehingga laju metabolisme lebih rendah dan bahan buangan metabolisme yang dihasilkan pun menjadi lebih sedikit.
Konsentrasi CO2 dalam media air pengangkutan terus mengalami
peningkatan dari jam ke-0 hingga jam ke-24. Konsentrasi CO2 yang baik untuk
benih ikan, yaitu < 0,02 mg.L-1 (Boyd 1981). Konsentrasi CO2 pada setiap
perlakuan diluar ambang batas yang rekomendasikan untuk ikan. Kadar CO2 yang
tinggi (hipercapnia) menyebabkan pH darah menjadi lebih asam (acidosis)
sehingga kadar O2 darah menurun melalui mekanisme efek Root. Kedua kondisi
ini menyebabkan ikan meningkatkan laju ventilasi insang. Selanjutnya ikan akan mati karena kekurangan O2, meskipun kandungan O2 di air media transportasi
tinggi. Hal ini sesuai dengan hasil penelitian Black et al (1954), yang menunjukkan bahwa saat ikan mati kandungan oksigen di dalam air lebih tinggi ketika tekanan CO2 meningkat. Tersedianya ion Cl- di dalam media berfungsi
untuk pertukaran ion HCO3 - dari dalam darah ikan melintasi insang (Smith 1982).
Hal ini berarti penggunaan garam 3 ppt dalam media transportasi dapat mengurangi kandungan CO2 di dalam darah.
Nilai pH air selama transprtasi masih dalam pada kisaran yang baik untuk bagi ikan gabus yaitu 6-8,6 (Boyd 1981). Penurunan nilai pH disebabkan peningkatan konsentrasi CO2 pada media transportasi. Senyawa CO2 selama
respirasi akan bereaksi dengan air sehingga menghasilkan asam karbonat (H2CO3)
yang dapat menurunkan pH air William & Robert (1992).
Kematian ikan yang terjadi pada kegiatan transportasi tertutup salah satunya disebabkan karena kandungan NH3 dan CO2 yang melebihi batas toleransi
ikan. Dari hasil data fisika-kimia air diatas perlakuan 30 ekor (tanpa garam) memiliki nilai NH3 dan CO2 lebih tinggi dibandingkan dengan perlakuan dengan
21 Tingginya kandungan CO2 di dalam air menyebabkan eksresi CO2 di insang
terhambat. Kandungan CO2 yang tinggi (hipercapnia) yang menyebabkan pH
darah menjadi lebih asam (acidosis) sehingga kadar O2 darah menurun melalui
mekanisme efek Root.
Kematian saat transportasi disebabkan ikan gagal mengatasi dan beradaptasi terhadap stres akibat memburuknya kualitas air. Kematian saat pascatransportasi merupakan pengaruh lanjutan dari stres saat transportasi. Stres yang terlalu tinggi menyebabkan ikan sulit memulihkan keseimbangan fisiologis di dalam tubuhnya, kemudian berakibat kematian saat pemeliharaan pascatransportasi. Kematian pada pascatransportasi disebut juga dengan delayed mortality atau hauling loss (Wedemeyer 1996). Kematian tertinggi terdapat pada pemeliharaan pascatransportasi hari ke-1. Tingginya kematian benih ikan gabus ini diakibatkan tingginya tingkat stres pascatransportasi dan benih yang tidak dapat beradaptasi dengan lingkungan baru. Pada hari ke-4 hingga hari ke-21 tidak terdapat banyak kematian, karena ikan telah beradaptasi pada kondisi lingkungan. Hal ini dibuktikan dari hasil pengukuran parameter respons stres yang semakin membaik hingga hari ke-21.
Hasil pengamatan menunjukkan laju pertumbuhan harian (LPH) tidak berpengaruh oleh kepadatan ikan saat transportasi. Hal tersebut disebabkan ikan yang bertahan hidup telah mampu mengatasi stres saat transportasi dan beradaptasi dengan kondisi wadah pemeliharaan. Hasil penelitian Procarione et al. (1999) pada ikan Rainbow trout juga menunjukkan kondisi stres tidak selalu menyebabkan laju pertumbuhan ikan menurun. Menurunnya laju pertumbuhan akibat stres dan tekanan lainnya tidak berlaku secara umum pada seluruh ikan (McCormick 1998).
Hasil penelitian ini menunjukkan bahwa kepadatan ikan gabus dalam media transportasi tidak mempengaruhi nilai gradien osmotik. Perlakuan 30 ekor, 45 ekor, 60 ekor dan 75 ekor dengan menggunakan garam 3 ppt merupakan kondisi
isosmotic (nilai osmolaritas cairan tubuh mendekati nilai osmolaritas cairan media). Gradien osmotik yang semakin rendah membuat energi yang digunakan untuk proses osmoregulasi semakin sedikit, sehingga penggunaan energi dapat dialihkan untuk pertumbuhan dan juga dapat meningkatkan kelangsungan hidup (Setiyoningsih 2014). Sebaliknya perlakuan tanpa garam (30 ekor) menunjukkan bahwa benih ikan gabus bersifat hyperosmotic, yang artinya semakin besarnya energi yang digunakan untuk proses osmoregulasi lebih besar (Corrion et al.
2005). Hal yang sama dikemukakan oleh Arjona et al. (2008) bahwa semakin tinggi gradien osmotik, dapat menyebabkan penggunaan energi untuk osmoregulasi akan semakin tinggi pula. Ketika ikan membutuhkan energi untuk proses osmoregulasi, maka ikan akan memanfaatkan sumber energi yang ada di dalam tubuhnya, yakni oksigen untuk oksidasinya (Marlina 2011). Dengan demikian menunjukkan jika gradien osmotik yang rendah akan menghemat energi dan mengurangi konsumsi oksigen. Hal ini sesuai dengan pelakuan 30 ekor (tanpa garam) memiliki nilai DO lebih rendah dibandingkan perlakuan dengan penambahan garam 3 ppt, yang artinya ikan lebih banyak mengkonsumsi oksigen untuk proses osmoregulasi.
22
kelebihan air yang diekskresikan melalui proses osmoregulasi. Hal ini juga dijelaskan oleh Evans (2008) yaitu ikan air tawar yang memiliki tekanan osmotik cairan tubuh yang lebih tinggi daripada tekanan osmotik medianya akan meningkatkan aliran air ke dalam tubuh dan menyebabkan kehilangan NaCl secara difusi melalui epithel insang permeabel. Untuk menjaga konsentrasi internal menjadi terlalu encer maka ikan mengekskresikan urine hypotonic dalam volume yang relatif besar dan menyerap NaCl secara aktif melintasi epitel insang.
Peningkatan glukosa darah atau hyperglecemia pada setiap perlakuan hari ke-0 pascatransportasi menunjukkan ikan mengalami stres saat transportasi (Abreu et al. 2008). Mekanisme terjadinya perubahan performa glukosa darah selama stres yaitu adanya perubahan lingkungan yang akan diterima oleh organ reseptor. Informasi tersebut disampaikan ke otak bagian hipotalamus melalui sistem syaraf, dan selanjutnya sel kromaffin menerima perintah melalui serabut syaraf symphatik untuk mensekresikan hormon katekolamin. Hormon ini akan mengaktivasi enzim-enzim yang telibat dalam katabolisme simpanan glikogen hati dan otot serta menekan sekresi hormon insulin, sehingga glukosa darah mengalami peningkatan. Selanjutnya pada saat yang bersamaan hipothalamus otak mensekresikan CRF (corticoid releasing facktor) yang meregulasi kelenjar
pituitary untuk mensekresikan ACTH (Adeno-cortico-tropik hormone), MSH (Melanophore-Stimulating hormone) dan p-End (p-endorphin). Hormon tersebut akan meregulasi sekresi hormon kortisol dari sel internal. Diketahui bahwa kortisol akan menggertak enzim-enzim yang terlibat dalam glukoneogenesis yang menghasilkan peningkatan glukosa darah yang bersumber dari non karbohidrat. Konsentrasi glukosa darah pada hari ke-4 hingga hari ke-21 pemeliharaan memperlihatkan tren menurun mendekati nilai glukosa darah pada ikan gabus normal sebelum transportasi. Hal ini dikarenakan kondisi lingkungan pemeliharaan mendukung untuk kehidupan ikan gabus. Pada saat terjadinya katabolisme protein untuk membentuk glukosa juga menghasilkan asam amino, sehingga asam amino dalam darah mengalami peningkatan. Meningkatnya asam amino dalam darah akan mengaktifasi insulin kembali sehingga mampu melakukan transport glukosa, sehingga glukosa dalam darah akan menurun kembali (Wendelaar 1997).
Penurunan nilai pH darah menunjukkan ikan mengalami stres saat transportasi (Wood et al. 1997). Tingginya nilai gradien osmotik pada pada perlakuan 30 ekor (tanpa garam) menyebabkan ikan lebih banyak membutuhkan energi untuk osmoregulasi sehingga ikan menjadi hiperaktif dan aktivitasnya menjadi meningkat. Energi dihasilkan dari pemecahan glikogen melalui jalur metabolisme anaerob menyebabkan produksi asam laktat meningkat dan lepasnya CO2 ke dalam darah (Wahyu 2015). Keberadaan asam laktat dan CO2
menyebabkan pH darah menurun sehingga terjadi asidosis. Asidosis menyebabkan afinitas hemoglobin mengikat oksigen menjadi berkurang (Bohr effect) dan menurunnya kapasitas darah dalam mengangkut oksigen (Root effect)
23 dalam tubuh atau hipoksia, sehingga menyebabkan suplai oksigen untuk proses metabolisme energi berkurang.
Menurunnya konsentrasi oksigen terlarut dan meningkatnya konsentrasi CO2 dalam media air saat transportasi menyebabkan laju ventilasi insang menjadi
meningkat, namun CO2 darah sulit untuk berdifusi keluar dari insang karena
tingginya konsentrasi CO2 di dalam media air transportasi. Proses difusi
dipengaruhi perbedaan tekanan antara CO2 dalam darah dengan CO2 yang ada
pada media air transportasi (Wedemeyer 1996). Kondisi tersebut menyebabkan konsentrasi CO2 di dalam darah semakin meningkat (hypercapnia) sehingga
memperburuk asidosis yang terjadi dan semakin menurunkan afinitas hemoglobin terhadap oksigen. Akibatnya ikan sulit memenuhi energi untuk mengatasi stres dan terjadi kematian (Delince et al. 1987). Hal tersebutlah yang diduga menyebabkan perlakuan 30 ekor (tanpa garam) memiliki nilai TKH selama transportasi lebih rendah dibandingkan dengan perlakuan penambahan garam 3 ppt.
Fungsi utama sel darah merah adalah dalam pengangkutan oksigen. peningkatan kontraksi limpa akan mengakibatkan terjadi pelepasan sel-sel darah merah sehingga nilai hematokrit, hemoglobin dan eritosit juga turut meningkat. Dengan meningkatnya nilai hematokrit, hemagolobin dan eritosit maka ikan akan memaksimalkan pengikatan oksigen yang masuk ke dalam jaringan darah (El- Deendan dan Rongers 1992).
Peningkatan jumlah sel darah merah menunjukkan ikan mengalami stres saat transportasi (Abreu et al. 2008; Supriyono et al. 2010; Supriyono et al. 2011). Stres menyebabkan ikan membutuhkan jumlah energi yang besar untuk mempertahankan keseimbangan homeostasis di dalam tubuhnya (Iwama 1998). Energi tersebut dihasilkan dari pemecahan glikogen pada proses metabolisme anaerob yang diatur oleh hormon kortisol (Mommsen et al. 1999). Metabolisme tersebut menyebabkan kebutuhan oksigen menjadi meningkat dan memicu ikan mengalami hipoksia (Delince et al. 1987). Pemecahan glikogen juga meningkatkan produksi CO2 di dalam tubuh. Kedua hal tersebut menyebabkan
ikan harus mengoptimalkan fungsi sistem sirkulasi. Kondisi ini menyebabkan sel kromafin merilis hormon katekolamin sebagai respons primer stres ke dalam darah (Bonga 1997). Meningkatnya hormon katekolamin menyebabkan total SDM menjadi meningkat untuk meningkatkan afinitas dan kapasitas darah dalam mengangkut oksigen (Bonga 1997; Pankhurst 2011). Peningkatan total SDM berfungsi untuk menutupi kekurangan suplai oksigen dan mempercepat proses ekskresi CO2 keluar dari tubuh. Peningkatan total SDM yang lebih tinggi
menunjukkan tingkat stres yang lebih tinggi dialami oleh ikan.
24
Hemoglobin merupakan komponen dari sel darah merah yang untuk berfungsi mengangkut oksigen dari lingkungan ke sel di dalam tubuh dan mengangkut karbondioksida hasil metabolisme dengan arah sebaliknya (Jensen et al. 1998). Peningkatan kadar hemoglobin menunjukkan ikan mengalami stres saat transportasi (Supriyono et al. 2010). Perlakuan 30 ekor (tanpa garam) memiliki nilai hematokrit lebih tinggi dibandingkan dengan perlakuan penambahan garam 3 ppt, karena ikan membutuhkan oksigen untuk proses osmoregulasi. Hal ini sesuai dengan pernyataan Wells et al. (2005) bahwa 1 gram hemoglobin dapat mengikat kira-kira 1,34 mL oksigen. Sekresi hormon katekolamin saat ikan stres berfungsi untuk meningkatkan afinitas dan kapasitas darah dalam mengangkut oksigen (Pankhurst 2011). Sekresi tersebut juga meningkatkan kadar hemoglobin ikan, karena sintesis hemoglobin dilakukan bersamaan dengan produksi sel darah merah (Bonga 1997; Olver et al. 2011).
Kadar hematokrit merupakan perbandingan antara sel darah merah dan plasma darah, serta berpengaruh terhadap pengaturan sel darah merah (Hesser 1960). Perubahan nilai hematokrit merupakan salah satu indikator stres pada ikan (Witeska 2005). Hormon katekolamin menyebabkan pembengkakan sel darah merah dan meningkatkan jumlah sel yang beredar. Sebagai hasilnya jumlah sel darah merah, hematokrit dan hemoglobin menjadi meningkat (Bonga 1997). Sekresi hormon kortisol saat ikan mengalami stres juga berpengaruh meningkatkan kadar hematokrit (Mommsen et al. 1999). Menurut Jawad et al.
(2004) peningkatan kadar hematokrit dipengaruhi oleh dua faktor yaitu perubahan parameter lingkungan terutama suhu perairan serta keadaan fisiologi ikan terkait dengan energi yang dibutuhkan. Pengamatan pada hari ke-1 sampai ke-21 menunjukkan semua perlakuan mendekati nilai kadar hematokrit ikan normal. Hal ini menunjukkan benih ikan gabus telah beradaptasi dengan lingkungan yang baru.
Konsentrasi aktivitas lisozim pada hari ke-0, hari ke-1 dan hari ke-4 pascatransportasi menurun dikarenakan pengaruh dari transportasi. Sesuai dengan penelitian Mock dan Peters (1990) bahwa aktivitas lisozim ikan Rainbow trout
mengalami penurunan dikarenakan stres karena pengaruh dari transportasi. Pada kondisi ini sistem kekebalan tubuh ikan menjadi menurun dan mudah terinfeksi bakteri. Pada hari berikutnya aktivitas lisozim mengalami peningkatan mendekati nilai aktivitas lisozim pada ikan normal. Ini artinya sistem kekebalan tubuh pada ikan sudah kembali pada kondisi normal.
25
4 SIMPULAN DAN SARAN
Simpulan
1. Penambahan garam ke dalam media transportasi dengan kepadatan berbeda mampu mempertahankan kualitas air dan menekan mortalitas dibandingkan dengan perlakuan tanpa penambahan garam.
2. Perlakuan penambahan garam ke dalam media transportasi menghasilkan tingkat kelangsungan hidup dan laju pertumbuhan yang lebih tinggi dibandingkan dengan perlakuan tanpa penambahan garam, serta tingkat stres ikan pascatransportasi telah kembali normal pada hari ke-4 pascatransportasi. 3. Pada penelitian ini kepadatan 75 ekor.L-1 ikan gabus dapat diangkut dalam
kondisi yang baik (tingkat stres yang rendah).
Saran
1. Perlu penelitian lebih lanjut dengan tingkat kepadatan yang lebih tinggi dari 75 ekor.L-1, sehingga diperoleh informasi kepadatan yang maksimal guna meminimalisir biaya transportasi.
2. Berdasarkan fakta banyaknya kematian ikan gabus sampai hari pertama pascatransportasi, sebaiknya ikan dibugarkan dalam media yang menggunakan kadar garam 3 ppt sesaat setelah pengangkutan.
DAFTAR PUSTAKA
Abreu JS, Sanabaria-Ochoa AI, Goncalves FD, Urbinati EC. 2008. Stress responses of juvenile matrinxã (Brycon amazonicus) after transport in a closed system under different loading densities. Cienc. Rural. 38(5): 1413-1417.
Alabaster JS, Shurben DG. 1979. The effect of dissolved oxygen and salinity on the toxicity of ammonia to smolts of salmon, Salmo salar L. Journal of Fish Biology. 15: 705-712.
Anderson DP, Siwick A. 1993. Basic Hematology and Serology for Fish Health Programs. Paper presented in Second Symposium on Desease in Asia
Aquaculture “Aquatic Animal Health and Environment”; 1993 Okt 25-29; Thailand. Filipina(PH):Asia Fisheries Society. hlm 185-202.
Anggoro S. 1992. Efek osmotik berbagai tingkat salinitas media terhadap daya tetas telur dan vitalitas larva udang windu Penaeus monodon Fabricius [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Arjona J.F, Chacoff LV, Jarabo IR, Gonçalves O, Páscoa I, María P, Río MD and Mancera JM. 2009. Tertiary stress responses in Senegalese sole (Solea
senegalensis Kamp.1858) to osmotic challenge : implication for
26
Banerjee TK. 2007. Histopathology of respiratory organs of certain air-breathing fishes of India. Fish Physiol Biochem. 33(4): 441-454.
Berenbrink M. 2011. Evolution of root effect. Farrell AP, editor. Encyclopedia of Fish Physiology: From Genome to Environment. London (UK): Academic Press. pp. 921-928.
Black EC, Fry FEJ, Black VS. 1954. The influence of carbondioxide on the utilization of oxygen by some freshwater fish. Canadian Journal of Zoology. 32: 408-420.
Blaxhall PC, Daisley KW. 1972. Routine haematological methods for use with fish blood. J Fish Biology. 5:577-581.
Bonga SW. 1997. The stress response in fish. Physiol Rev. 77(3): 591-625.
Boyd CE. 1981. Water Quality in Warm Water Fish Pond. Massachusetts (US): Kluwer Academic.
Boyd CE. 1990. Water Quality for Pond Aquaculture. Birmingham (US):
Birmingham Publishing.
Corrion RL, Alvarellos SS, Guzma´n JM, Marı´a P, Rı´o MD, Soengas JL, Manceraa JM. 2005. Growth performance of gilthead sea bream conditions : Implication for osmoregulation and energy metabolism. Aquaculture. 250(3-4):849-861.
Davis AK, Maney DL, Maerz JC. 2008. The use of leukocyte profiles to measure stress in vertebrates: a review for ecologists. Funct Ecol. 22(5): 760-772. Delince GA, Campbell D, Janssen JAL, Kutty MN. 1987. Seed production:
Establisment of African regional aquaculture centre. Rome (IT): Food ands Agriculture Organization of the United Nations. 118 p.
Ellis EA. 1990. Techniques in Fish Immunolog: Serum Anti-Proteases in Fish. California(US): Sos Publications
El-Deen MAS, WA Rogers. 1992. Acute toxicity and some hematological change in grass carp exposed to diquat. J. Aquatic Animal Health. 4: 277-280. Emu S. 2010. Pemanfaatan garam pada pengangkutan sistem tertutup benih ikan
patin pangiussp berkepadatan tinggi dalam media yang mengandung zeolite dan arang aktif [tesis]. Bogor (ID): Institut Pertanian Bogor.
Evans DH. 2008. Teleost fish osmoregulation: what have we learned since august krogh, homer smith, and ancel keys. Am J Physiol Regul Integr Comp Physiol. 295:704-713.
Hesser EF. 1960. Methods for routine haematology. Progressive Fish Culturist.
22(4): 164-171.
Humairani. 2015. Respons stres benih udang galah macrobrachium rosenbergii
terhadap penambahan zeolit, karbon aktif, minyak cengkeh dan garam pada transportasi tertutup [tesis]. Bogor (ID): Institut Pertanian Bogor.
Iwama GK. 1998. Stress in fish. Ann N Y Acad Sci. 851(1): 304-310.
Jawad LA, Al Mukhtar MA, Ahmed HK. 2004. The relationship between hematokrit and some biological parameters of the indian shad Telamosa ilisha. Animal Biodiversity and Concervation. 27:47-52.
Jensen G.L. 1990. Transportation of warmwater fish: Procedures and loading rates.
Southern Regional Aquaculture Center Publication. No. 392. Mississippi (US) Mississippi State University
Maetz J. 1973. Na+/NH4+, Na+/H+ exchanges and NH3 movement across the gill of
27 Makmur S. 2002. Mengapa Terjadi Stres Pada Ikan. Warta Penelitian Perikanan
Indonesia. 2:18 – 20.
Marlina E. 2011. Optimasi Osmolaritas Media dan Hubungannya dengan Respons Fisiologis Benih Ikan Baung (Hemibagrus nemurus) [tesis]. Bogor (ID): Institut Pertanian Bogor.
McCormick SD, Shrimpton JM , Carey JB, O'dea MF, Sloan KE, Moriyama S, Björnsson BT. 1998. Repeated acute stress reduces growth rate of Atlantic salmon parr and alters plasma levels of growth hormone, insulin-like growth factor I and cortisol. Aquaculture. 168(1): 221-235.
Muntaziana MPA, Amin SMN, Rahman MA, Rahim AA, Marimuthu K. 2013. Present culture status of the endangered snakehead, Channa striatus (Bloch, 1793). Asian J Anim Vet Adv. 8(2): 369-375.
Muslim M. 2007. Potensi peluang dan tantangan budidaya ikan gabus (Channa striatus) di propinsi Sumatera Selatan. Prosiding Seminar Nasional Forum
Perairan Umum Indonesia IV; 2007 Nov 30; Palembang, Indonesia. Depok
(ID): Badan Riset Kelautan dan Perikanan, Pusat Riset Perikanan Tangkap. Mock A, Peters G. 1990. Lysozyme activity in Rainbow trout, Oncorhynchus
mykiss (walbaum), stressed by handling, transport and water pollution. Fish Biology. 37 : 873-885. benih ikan gurami Osphronemus goramy Lac. Jurnal Akuakultur Indonesia. 11(2): 190-201.
Olver CS, Andrews GA, Smith JE, Kaneko JJ. 2011. Erythrocyte Structure and Function Weiss DJ, Wardrop KJ. Editor. Schalm's Veterinary Hematology. Singapore (SG): John Wiley & Sons. pp. 123-130.
Pankhurst NW. 2011. The endocrinology of stress in fish: an environmental perspective. Gen Comp Endocr. 170(2): 265-275.
Procarione LS, Barry TP, Malison JA. 1999. Effects of high rearing densities and loading rates on the growth and stress responses of juvenile rainbow trout. N Am J Aquac. 61(2): 91-96.
Purnamawati, Dewantoro E. 2016. Kelayakan budidaya ikan gabus (Channa striata) pada media sulfat masam. Seminar Penelitian Dasar (Fundamental 2016); 2016 Feb 17-19; Surabaya, Indonesia. Jakarta (ID): Direktorat Jendral Pendidikan Tinggi.
[Pusdatin KKP] Pusat Data dan Informasi Kementerian Kelautan Perikanan. 2014. Statistik kelautan dan perikanan 2013. Kementerian Kelautan Perikanan (ID).
Rahmawanty D, Anwar E, Bahtiar A. 2014. Formulasi gel menggunakan daging ikan haruan (Channa striata) sebagai penyembuh luka. Media Farmasi. 11(1) : 29-40.
28
Setiyoningsih PR. 2014. Respons gelondongan ikan bandeng (Chanos Chanos) akibat perubahan salinitas dengan penambahan kalsium klorida (CaCl2)
pada durasi yang berbeda. Jurnal Penelitian UNISLA. 5(2):6-17
Sufianto B. 2008. Uji transportasi ikan maskoki (Carassius auratus Linnaeus) hidup sistem kering dengan perlakuan suhu dan penurunan konsentrasi oksigen [tesis]. Bogor (ID): Institur Pertanian Bogor.
Supriyono E, Budiyanti, Budiardi T. 2010. Respons fisiologi benih ikan kerapu macan Ephinephelus fuscoguttatus terhadap penggunaan minyak sereh dalam transportasi tertutup dengan kepadatan tinggi. IJMS. 15(2): 103-112. Supriyono E, Syahputra R, Ghozali MFR, Wahjuningrum D, Nirmala K, Kristanto
AH. 2011. Efektivitas pemberian zeolit, arang aktif, dan minyak cengkeh terhadap hormone kortisol dan gambaran darah benih ikan patin
Pangasionodon hypopthalamus pada pengangkutan dengan kepadatan tinggi.
J Iktio Indones. 11(1): 67-75.
Stickney RR. 1979. Principles of Warmwater Aquaculture. New York (US): John Willey and Sons.
Wahyu. 2015. Respons fisiologis juvenil ikan gabus Channa striata pada transportasi sistem tertutup [tesis]. Bogor (ID): Institut Pertanian Bogor. Wedemeyer GA. 1996. Transportation and handling : Pennel W, Barton BA,
editor. Principles of Salmonid Culture. Amsterdam (NL) : Elsevier Inc. pp. 727-755.
Wells RMG, Baldwin J, Seymour RS, Christian K. Britain T. 2005. Blood cell fuction and haematology intwo tropical freshwater fishes from Australia.
Comprative Biochemistry and Physiology (A). 141:87-93
Wendelaar BSE. 1997. The stress response in fish. Physiol. Rev.77:591-625. Wibowo S. 1993. Penerapan Teknologi Penanganan dan Transportasi Ikan
Hidup di Indonesia. Jakarta: Sub BPPL, Slipi.
William AW, Robert MD. 1992. Interaction of pH, carbon dioxide, alkalinity and hardnes in fish ponds. J. SRAC Publication: 464: 1-4.