KEMAMPUAN CONDITIONED MEDIUM
DARI KULTUR PRIMER PANKREAS DEWASA
DALAM MENGARAHKAN (DIFERENSIASI)
EMBRYONIC STEM CELLS MENCIT MENJADI
SEL BETA PANKREAS
DINI BUDHIARKO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Kemampuan Conditioned Medium
Dari Kultur Primer Pankreas Dewasa Dalam Mengarahkan (Diferensiasi)
Embryonic Stem Cells Menjadi Sel Beta Pankreas adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Mei 2010
ABSTRACT
DINI BUDHIARKO. The Ability of Conditioned Medium Resulted from Primary Culture of Adult Pancreas to Differentiate Mouse Embryonic Stem Cells into Pancreatic Beta Cells. Under direction of ITA DJUWITA and ADI WINARTO.
The ability of embryonic stem cells (ESC) to differentiate into all cell types of the body has become a new hope in curing various degenerative diseases including diabetes. In diabetes, ESC can be used as a cell source that can be differentiated into pancreatic beta cells before being transplanted. The differentiation of ESC was influenced by several growth factors, such as activin, fibroblast growth factor, retinoic acid, and transforming growth factor. In this research, we examined the influence of conditioned medium (CM) resulted from the primary culture of adult mouse pancreas in various concentration (0%, 10%, 30%, and 50%) toward differentiation of ESC into pancreatic beta cells. Differentiation of ESC into pancreatic beta cells indicated by the positive result from dithizone staining and the expression of proinsulin 1 and proinsulin 2 genes. The results showed that ESC cultured with 50% CM concentration had higher quality of colour intensity than the 30% and 10% concentration (P < 0.05). The RNA analysis clearly showed that dithizone positive cells are expressing proinsulin 1 and proinsulin 2, which indicate gene mark of pancreatic beta cells. In conclusion, CM resulted from the primary culture of adult mouse pancreas was able to differentiate ESC into pancreatic beta cells with 50% CM as the optimum concentration to direct ESC differentiation into pancreatic beta cells.
RINGKASAN
DINI BUDHIARKO. Kemampuan Conditioned Medium Dari Kultur Primer Pankreas Dewasa Dalam Mengarahkan (Diferensiasi) Embryonic Stem Cell
Mencit Menjadi Sel Beta Pankreas. Dibimbing oleh ITA DJUWITA dan ADI WINARTO.
Pankreas merupakan kelenjar endokrin dengan salah satu fungsinya sebagai penghasil insulin, yaitu hormon yang mengubah glukosa dalam darah menjadi glikogen. Peningkatan kadar glukosa dalam darah yang tidak diimbangi dengan peningkatan insulin merupakan salah satu karakter dari penyakit diabetes. Diabetes dikelompokan dalam 2 kategori, yaitu tipe 1 dan 2. Pada umumnya diabetes tipe 1 terjadi akibat kegagalan sistem imun tubuh dan ditanggulangi dengan pemberian insulin harian ataupun transplantasi organ. Kendala dalam ketersediaan insulin, ketersediaaan organ dan kesesuaiannya, serta efek samping akibat penggunaan immunosuppresan menjadi kendala yang dihadapi. Penggunaan cell replacement therapy atau terapi berbasis sel merupakan alternatif lain yang dapat digunakan. Cara ini mengurangi permasalahan yang timbul akibat penggunaan immunosuppresan. Namun tetap menghadapi kendala pada ketersediaan sumber sel yang digunakan. Untuk memenuhi kebutuhan tersebut maka digunakanlah stem cells sebagai alternatif sumber sel.
Stem cells adalah sel yang belum berdiferensiasi yang memiliki sifat
pluripotent, yaitu kemampuan untuk berproliferasi dan berdiferensiasi menjadi berbagai tipe sel dalam tubuh dengan fungsi yang lebih spesifik. Berdasarkan sumbernya stem cells dapat dikelompokan menjadi 2 kelompok utama, yaitu embrionik (embryonic stem cells, ESC) dan non-embrionik (adult stem cells, ASC). Embryonic stem cells adalah stem cells yang diperoleh atau diisolasi dari embrio. Sedangkan ASC adalah stem cells yang ditemukan diberbagai jaringan tubuh (tulang, otak, hati, kulit, lemak, otot dan darah) yang memiliki fungsi untuk menjaga keseimbangan dan memperbaiki jaringan.
Pada cell replacement therapy, stem cells diarahkan menjadi sel beta pankreas sebelum kemudian ditransplantasikan pada resipien. Pengarahan stem cells menjadi suatu tipe sel tertentu sangat dipengaruhi oleh faktor intrinsik dan lingkungan ekstraselular. Beberapa metode pengarahan yang telah dilakukan antara lain, melalui modifikasi genetik, penggunaan growth factor, penggunaan
extracellular matrix serta conditioned medium (CM).
Embryonic stem cells diperoleh dengan mengisolasi inner cell mass (ICM) dari embrio pada fase blastosis menggunakan metode immunosurgery. Embryonic stem cells kemudian dikultur dalam medium DMEM-high glucose (Sigma, USA) yang mengandung non-essential amino acid 1%, FBS 10%, penicillin-streptomycin (Sigma, USA) 5μl/ml, mercaptoethanol (Sigma, USA) 0,1 mM,
Leukimia Inhibitory Factor/LIF (Sigma, USA) 20 ng/ml. Diferensiasi ESC menjadi sel penghasil insulin dilakukan dengan mengkultur ESC dalam medium diferensiasi, yaitu medium tanpa LIF yang mengandung CM dengan konsentrasi volume per volume (v/v) 0%, 10%, 30% dan 50% selama 14 hari. Paramater yang diamati adalah pembentukan sel beta pankreas yang teridentifikasi melalui pewarnaan dithizone dan kemampuannya dalam mengekspresikan mRNA proinsulin 1 dan proinsulin 2.
Hasil pewarnaan dithizone memperlihatkan adanya intensitas warna yang berbeda pada tiap koloni ESC, yaitu merah muda, merah, dan merah tua. Pewarnaan dithizone merupakan pewarnaan yang mengikat zinc (zinc-binding substance) sehingga menghasilkan warna merah muda hingga merah tua pada sel-sel yang mengandung zinc (Zn). Zinc dalam sel-sel beta pankreas berfungsi sebagai pengikat insulin sehingga membentuk dimer ataupun hexamer yang mempermudah penyimpanan insulin dalam secretory vesicles pada sel beta pankreas. Variasi warna yang dihasilkan menandakan adanya perbedaan konsentrasi atau jumlah Zn yang terkandung di dalam suatu sel. Peningkatan warna pada pewarnaan dithizone dapat disimpulkan sebagai adanya peningkatan akumulasi Zn yang berasosiasi dengan peningkatan jumlah insulin di dalam sel beta pankreas.
Perbedaan konsentrasi CM dalam medium pengarahan menghasilkan perbedaan warna (merah muda, merah dan merah tua) pada saat pewarnaan dithizone. Untuk mempermudah dalam menganalisa data maka warna merah muda diberi skor 1, merah diberi skor 2 dan merah tua diberi skor 3. Secara statistik warna yang dihasilkan pada pewarnaan dithizone menunjukkan hasil yang secara nyata berbeda. Perlakuan CM 50% merupakan hasil yang terbaik diikuti dengan perlakuan CM 30%. Sedangkan pada perlakuan CM 10% tidak memperlihatkan hasil yang berbeda nyata dengan perlakuan CM 0% (kontrol) (P > 0,05). Hal tersebut sejalan dengan Vaca et al. (2006) yakni konsentrasi CM yang umum digunakan dalam pengarahan stem cell menjadi sel beta pankreas adalah 50%.
Pita pada gel hasil elektroforesis produk RT-PCR menunjukkan bahwa B-actin terekspresi pada seluruh perlakuan yang menandakan tidak terjadi kesalahan pada proses analisa, baik pada pengisolasian RNA maupun proses RT-PCR yang dilakukan. Hasil elektroforesis juga memperlihatkan bahwa proinsulin 2 terekspresi pada seluruh perlakuan sedangkan pada proinsulin 1 hanya perlakuan 1 yang tidak mengekspresikan adanya proinsulin 1.
adalah insulin yang masih berikatan dengan C-peptide. Ekspresi proinsulin 2 yang ditemukan pada seluruh perlakukan dan ekspresi proinsulin 1 pada perlakuan 2, 3, dan 4 menandakan bahwa pada perlakukan tersebut (2, 3, dan 4) mengandung sel-sel beta pankreas yang dihasilkan dari proses diferensiasi ESC.
Berdasarkan hasil penelitian dapat disimpulkan bahwa penggunaan CM yang dihasilkan dari kultur primer pankreas dewasa mampu mengarahkan diferensiasi ESC menjadi sel beta pankreas dengan konsentrasi optimum 50%. Sel-sel beta pankreas yang terbentuk mampu mengekspresikan mRNA dari gen insulin 1 dan 2.
© Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan
KEMAMPUAN CONDITIONED MEDIUM
DARI KULTUR PRIMER PANKREAS DEWASA
DALAM MENGARAHKAN (DIFERENSIASI)
EMBRYONIC STEM CELLS MENCIT
MENJADI SEL BETA PANKREAS
DINI BUDHIARKO
TESIS
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Sains Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji syukur kepada Allah Bapa di Surga atas segala berkat, rahmat, dan penyertaan-Nya yang senantiasa bagi penulis selama penelitian hingga terselesaikannya tesis dengan judul Kemampuan Conditioned Medium Dari Kultur Primer Pankreas Dewasa Dalam Mengarahkan (Diferensiasi) Embryonic Stem Cells Mencit Menjadi Sel Beta Pankreas. Tesis ini merupakan salah satu syarat untuk memperoleh gelar Magister dalam program studi Sains Veteriner pada program PASCASARJANA Institut Pertanian Bogor.
Berbagai kendala dan permasalahan yang dihadapi dalam penelitian dan penulisan tesis ini telah terselesaikan berkat bantuan, dukungan, dan kerjasama dengan berbagai pihak. Dengan penuh rasa syukur, penulis menyampaikan terima kasih kepada semua pihak yang telah berperan baik secara langsung maupun tidak langsung terhadap terhadap penyelesaian tesis ini, yaitu:
1. Ibu Dr. drh Ita Djuwita, M.Phil., selaku Ketua Komisi Pembimbing dan Bapak drh. Adi Winarto, Ph.D., selaku Anggota Komisi Pembimbing, atas segala bimbingan, arahan, dan masukan yang diberikan dalam penelitian dan penulisan tesis ini.
2. Bapak dr. Boenjamin Setiawan, Ph.D., Bapak Ferry Sandra, drg., Ph.D., Ibu dr. Caroline Tan Sardjono, Ph.D., Bapak Ahmad Utomo, Ph.D., dan dr. Santoso Cornain, Ph.D., atas kesempatan yang diberikan kepada penulis untuk melanjutkan pendidikan Strata 2 di IPB.
3. Stem Cell and Cancer Institute dan PT. Kalbe Farma, Tbk., yang telah menjadi sponsor dalam pendidikan dan penelitian, serta rekan-rekan di Stem Cell and Cancer Institute atas dukungannya selama penulis melakukan pendidikan Strata 2 di IPB.
5. Prof. drh. Bambang Pontjo P., M.S., Ph.D., selaku Ketua Program Studi Sains Veteriner, yang juga telah meluangkan waktunya untuk dapat hadir dalam sidang thesis dan memberikan masukan serta dukungan yang menjadi suatu kebanggaan tersendiri bagi penulis, dan segenap staf Program Studi Sains Veteriner serta Sekolah Pasca Sarjana IPB.
6. Dwi Agustina, S.Si., Harry Murti, S.Si., Riris Lindiawati S.Si., Bapak Dr. Ir. Thomas Mata Hine, M.Si., Bapak Ir. Bayu Rosadi, M.Si., serta rekan-rekan Program Studi Sains Veteriner 2006 dan Program Studi Biologi Reproduksi 2004-2006, atas masukan, bantuan, dan dukungannya selama ini.
7. Keluarga ku dan Mas Yohanes yang senantiasa menemani dan mendukung dalam doa dan kasih.
Serta seluruh pihak yang tidak mungkin disebutkan satu persatu dalam tulisan ini. Semoga semua kebaikan dan bantuan yang telah diberikan akan dilipatgandakan oleh Allah Bapa.
Akhir kata, penulis menyadari bahwa tesis ini masih jauh dari sempurna. Namun, semoga tesis ini dapat berguna dalam penelitian dan pengembangan stem cells sebagai alternatif dalam pengobatan terhadap penyakit-penyakit degeneratif, khususnya penggunaan stem cells dalam penanganan diabetes.
Bogor, Mei 2010
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 13 April 1980 dari ayah Drs. Aloysius Djamilan Budhiarko dan ibu Christina T. Penulis merupakan putri ketiga dari lima bersaudara.
Pada tahun 1998 penulis menamatkan pendidikan di SMA Bunda Hati Kudus dan pada tahun yang sama melanjutkan pendidikan di Universitas Indonesia melalui seleksi Ujian Masuk Perguruan Tinggi Negeri. Pada perguruan tinggi tersebut penulis memilih Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam dan menyelesaikan studinya dengan gelar Sarjana Sains pada tahun 2004.
DAFTAR ISI
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvi
PENDAHULUAN ... 1
Latar Belakang ... 1
Kerangka Pemikiran ... 2
Tujuan dan Manfaat Penelitian ... 3
Hipotesis Penelitian ... 3
TINJAUAN PUSTAKA ... 4
Pankreas ... 4
Proses Pembentukan Insulin ... 6
Diabetes dan Penanganannya ... 8
Embryonic Stem Cells ... 9
Isolasi Inner Cell Mass ... 11
Kultur Embryonic Stem Cells ... 14
Karakteristik Embryonic Stem Cells ... 15
Diferensiasi Embryonic Stem Cells Menjadi Sel Beta Pankreas ... 15
Conditioned Medium 16 MATERI DAN METODE PENELITIAN ... 18
Tempat dan Waktu Penelitian ... 18
Rancangan Percobaan ... 18
Tahapan dan Prosedur Kerja ... 18
Pembuatan Conditioned Medium ... 18
Penyediaan Embryonic Stem Cells ... 19
Pengarahan Embryonic Stem Cells Menjadi Sel Beta Pankreas 21 Analisa Sel Beta Pankreas ... 21
Kemampuan Ekspresi Gen Insulin ... 22
Analisa Data ... 24
HASIL DAN PEMBAHASAN ... 25
Produksi Conditioned Medium ... 25
Penyediaan Embryonic Stem Cells ... 28
Koleksi Blastosit dan Isolasi Inner Cell Mass ... 28
Kultur Embryonic Stem Cells dan Uji Pluripotensi ... 29
Pengarahan Embryonic Stem Cells Menjadi Sel Beta Pankreas ... 31
Kemampuan Ekspresi Gen Insulin ... 35
SIMPULAN DAN SARAN ... 37
Simpulan ... 37
Saran ... 37
DAFTAR PUSTAKA ... 38
DAFTAR TABEL
1. Primer yang digunakan dalam RT-PCR ... 23 2. Persentase perolehan blastosis ... 28 3. Hasil pewarnaan dithizone pada pengarahan ESC menjadi sel beta
DAFTAR GAMBAR
1. Pankreas manusia ... 4
2. Proses sintesis insulin ... 7
3. Embrio fase blastosit ... 12
4. Isolasi ICM dengan metode immunosurgery ... 13
5. Morfologi sel yang ditemukan pada kultur primer pankreas ... 26
6. Pewarnaan dithizone pada kultur primer pankreas ... 27
7. Hasil positif pada pewarnaan alkaline phosphatase terhadap koloni ICM ... 30
8. Sel-sel beta pankreas berbentuk bulat yang dihasilkan pada pengarahan ESC ... 31
9. Hasil pewarnaan dithizone pada pengarahan ESC ... 32
10. Jalur diferensiasi yang diaktifkan oleh fibroblast growth factors .... 35
PENDAHULUAN
Latar Belakang
Pankreas merupakan organ dengan salah satu fungsinya sebagai penghasil insulin, yaitu hormon yang mengubah glukosa dalam darah menjadi glikogen. Peningkatan kadar glukosa dalam darah yang tidak diimbangi dengan peningkatan insulin merupakan salah satu karakter dari penyakit diabetes (Beattie & Hayek 2004). Diabetes dikelompokan dalam 2 kategori, yaitu tipe 1 dan 2. Diabetes tipe 1 pada umumnya terjadi akibat kegagalan sistem imun tubuh sehingga merusak sel beta pankreas. Sedangkan diabetes tipe 2 terjadi akibat resistensi insulin ataupun kurangnya jumlah insulin yang disekresikan oleh sel beta pankreas (Noguchi 2007).
Penanggulangan diabetes tipe 1 dilakukan dengan pemberian insulin harian ataupun transplantasi organ. Namun, ketersediaan insulin yang tidak dapat diperoleh dengan mudah, ketersediaaan organ yang didonorkan dan tingkat kesesuaian organ terhadap resipien, serta efek samping yang ditimbulkan akibat penggunaan immunosuppresan menjadi kendala yang sering dihadapi (Burns et al. 2004, Sameer et al. 2006). Alternatif lain yang dapat dilakukan dalam penanganan diabetes tipe 1 adalah penggunaan cell replacement therapy atau terapi berbasis sel dengan cara hanya menggantikan sel-sel yang rusak dengan sel-sel baru, yaitu mentransplantasikan sel-sel beta pankreas pada pasien. Cara ini mengurangi permasalahan yang timbul akibat penggunaan immunosuppresan. Akan tetapi cara ini tetap pula menghadapai kendala pada ketersediaan sumber sel yang digunakan, yaitu sel-sel beta pankreas. Untuk memenuhi kebutuhan tersebut maka digunakanlah stem cells sebagai alternatif sumber sel (Brolen et al. 2005, Sameer et al. 2006).
Stem cells adalah sel yang belum berdiferensiasi yang memiliki sifat
pluripotent, yaitu suatu kemampuan untuk berproliferasi dan berdiferensiasi menjadi berbagai tipe sel dalam tubuh dengan fungsi yang lebih spesifik (NIH 2001). Pada penggunaannya dalam cell replacement therapy khususnya yang berkaitan dengan diabetes, sebelum ditransplantasikan pada pasien stem cells
2
Pengarahan stem cells menjadi suatu tipe sel tertentu (sel-sel beta pankreas) sangat dipengaruhi oleh faktor intrinsik dan lingkungan ekstraselularnya sehingga dalam mengarahkan diferensiasi stem cells diperlukan lingkungan yang mendukung diferensiasi tersebut (Ding & Schultz 2004).
Kerangka Pemikiran
Pengarahan stem cell menjadi sel penghasil insulin (sel-sel beta pankreas) telah banyak dilakukan. Beberapa metode pengarahan yang telah dilakukan antara lain, melalui modifikasi genetik sehingga sel akan mengekspresikan
pancreas specific promotor atau melalui diferensiasi spontan yang kemudian diikuti dengan seleksi, penggunaan growth factor (seperti activin, fibroblast growth factor, retinoic acid, dan transforming growth factor) (Shi et al. 2005; Ku et al. 2004; Skoudy et al. 2004), penggunaan extracellular matrix (seperti laminin, firbronectin dan collagen) (Blyszczuk et al. 2004; Schroeder et al.
2006) serta conditioned medium (CM) (Vaca et al. 2006).
3
Tujuan dan Manfaat Penelitian
Penelitian ini bertujuan untuk menganalisa kemampuan berbagai konsentrasi CM yang dihasilkan dari kultur primer pankreas mencit dewasa dalam mengarahkan (diferensiasi) ESC mencit menjadi sel beta pankreas. Hasil penelitian ini diharapkan dapat memberikan manfaat dalam mengarahkan diferensiasi ESC menjadi sel beta pankreas terutama dalam penggunaan CM sebagai media diferensiasi. Aplikasi dari penelitian ini diharapkan akan memberikan kontribusi bagi penelitian di bidang kesehatan khususnya yang berkaitan dengan penanggulangan penyakit diabetes yang ditimbulkan akibat kerusakan sel beta pankreas.
Hipotesis Penelitian
4
TINJAUAN PUSTAKA
Pankreas
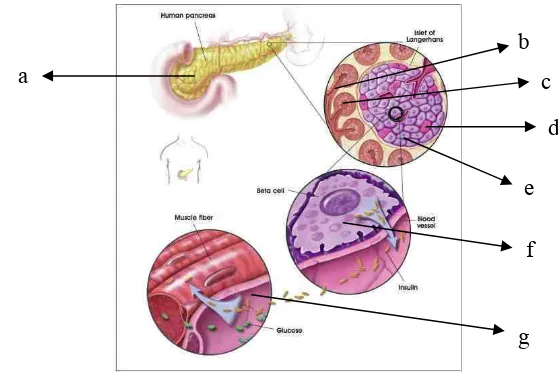
Pankreas adalah organ yang memiliki 2 fungsi yang berbeda, yaitu menghasilkan hormon dan mensekresikan enzim. Organ tersebut terdiri dari 3 komponen utama, yaitu jaringan eksokrin yang terdiri dari sel-sel acinar dan saluran pankreas (pancreatic duct)serta endokrin berupa pulau-pulau Langerhans (islet of Langerhans) (Gambar 1). Sel-sel eksokrin (sel-sel acinar) bertanggung jawab terhadap produksi enzim. Enzim yang dihasilkan kemudian akan disalurkan ke dalam duodenum melalui saluran pankreas (pancreatic duct). Berbeda dengan keduanya, sel-sel endokrin dari pulau-pulau Langerhans memiliki fungsi untuk mensekresikan hormon yang kemudian akan dialirkan melalui aliran darah ke seluruh tubuh. Sel-sel endokrin yang letaknya tersebar diantara sel-sel eksokrin memiliki jumlah yang sangat sedikit bila dibandingkan dengan eksokrin. Pada pankreas perbandingan antara jumlah sel-sel endokrin dan eksokrin mencapai 1 : 10. (Ramiya et al. 2000, Murtaugh et al. 2007).
Gambar 1. Pankreas manusia, (a) pankreas, (b) sel acinar, (c) saluran pankreas, (d) sel alfa, (e) sel beta, (f) sel beta pankreas mensekresikan insulin ke dalam pembuluh darah, (g) insulin membantu penyerapan glukosa pada sel otot (NIH 2001).
a
b c
d
e
f
5
Pada awal pembentukannya, sel-sel endokrin pada pankreas dihasilkan dari tunas (buds) yang muncul pada sel-sel epitel pada saluran pakreas atau disebut juga dengan epithelium duct cells. Tunas tersebut kemudian tumbuh hingga membentuk struktur spheroid. Setelah berbentuk spheroid, kumpulan sel tersebut kemudian bermigrasi ke dalam jaringan acinar, mengalami angiogenesis (pembentukan pembuluh darah) dan menjadi matang (mature). Kematangan sel-sel endokrin tersebut ditandai dengan kemampuan sel-sel-sel-sel tersebut untuk menghasilkan hormon dan mensekresikannya ke dalam pembuluh darah (Ramiya
et al. 2000, Peck et al. 2002, Oliver-Krasinski & Stoffers 2008).
Sel-sel endokrin/pulau-pulau Langerhans merupakan suatu kumpulan sel yang terdiri dari 5 tipe sel yang berbeda, yaitu sel alfa (α) yang mensekresikan hormon glukagon, sel beta (β) mensekresikan insulin, sel delta ( ) mensekresikan somatostatin, sel PP mensekresikan pancreatic polypeptide, serta sel epsilon ( ) yang mensekresikan ghrelin (Murtaugh et al. 2007). Namun, sel epsilon hanya dapat ditemukan pada saat pembentukan dan perkembangan pankreas. Setelah kelahiran jumlah sel tersebut akan menurun hingga akhirnya menghilang. Hal tersebut menyebabkan sel-sel epsilon tidak banyak diketahui (Brissova & Powers 2008).
6
Proses Pembentukan Insulin
Insulin merupakan protein yang dihasilkan oleh sel beta dari pulau-pulau Langerhans pankreas. Gen yang bertanggung jawab terhadap produksi insulin pada mencit dan tikus (rodentia) adalah insulin 1 dan insulin 2. Kedua gen tersebut bukan merupakan pasangan gen atau alel (non-allelic insulin genes) (Artner & Stein 2008). Insulin 1 berasal dari insulin 2 karena insulin 1 merupakan hasil duplikasi dari insulin 2. Perbedaan antara kedua gen tersebut terletak pada pengurangan sekitar 500 basepairs (bp) di bagian awal (upstream) pada situs trankripsi pada insulin 1. Selain itu pada bagian yang mengkode (coding region) pada insulin 1 juga hanya diselingi oleh 1 intron. Intron tersebut jika disesuaikan letaknya pada insulin 2 berada pada intron pertama, sedangkan intron kedua dan selanjutnya tidak dimiliki oleh insulin 1 (Devaskar et al. 1993, Giddings et al. 1994, Artner & Stein 2008).
Ekspresi dari insulin 2 sebagai gen asal (ancestral gene) diekspresikan tidak hanya pada organ pankreas namun juga dapat ditemukan ekspresinya pada bagian otak. Sedangkan ekspresi dari insulin 1 hanya dapat ditemukan pada pankreas. Pada pankreas ekspresi kedua gen tersebut (insulin 1 dan insulin 2) menunjukkan ekspresi yang sama besar/setara yang menandakan bahwa kedua gen tersebut memiliki peranan yang sebanding di dalam sintesa insulin pada pankreas (Devaskar et al. 1993, Giddings et al. 1994).
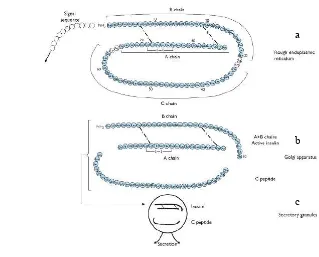
Pada proses sintesis insulin, gen insulin akan ditranskripsikan menjadi mRNA yang kemudian akan ditranslasi menjadi prekursor protein yang disebut preproinsulin. Preproinsulin tersusun dari 4 bagian dengan urutan sebagai berikut, rantai A, C-peptide, rantai B dan signalpeptide (berupa hydrophobic N-terminal).
Signal peptide adalah suatu peptida yang terdapat pada prekursor protein dan merupakan karakteristik dari protein yang akan disekresikan oleh hewan, tumbuhan maupun bakteri. Signal peptide pada prekursor protein tersebut menyandi tujuan atau tempat dimana prekursor protein akan dibawa dan mengalami proses selanjutnya (post-translation process). Ketika disekresikan ke dalam sitosol signal peptide akan berinteraksi dengan signal recognition particle
7
dan rantai B). Proinsulin kemudian akan ditranslokasikan ke dalam lumen retikulum endoplasmik (RE) melalui peptide-conducting channel dan mengalami perubahan bentuk sehingga menghasilkan bentuk dasar dari insulin akibat ikatan sulfida yang terbentuk antara sulfid pada rantai A dan B. Setelah itu, proinsulin kemudian dibawa menuju golgi aparatus (badan golgi) untuk dikemas dan kemudian dilepas ke dalam sitoplasma berupa kantung-kantung yang nantinya akan disekresikan (secretory vesicles). Di dalam secretory vesicles tersebut proinsulin mengalami proses pematangan yaitu pemisahan rantai insulin dengan peptida penghubungnya (connecting peptide atau C-peptide) sehingga dihasilkan insulin dan C-peptide (Gambar 2). Keduanya kemudian akan disekresikan secara bersamaan ke dalam darah pada saat terjadi peningkatan glukosa dalam darah
(Bosher 2001 & Steiner 2008).
Gambar 2. Proses sintesis insulin. (a) proinsulin dalam retikulum endoplasma membentuk bentuk dasar insulin, terjadi ikatan sulfida antar sulfid pada rantai A dan B, (b) proinsulin kemudian dikemas oleh badan golgi berupa kantung (vesicles), (c) dalam vesicles proinsulin mengalami pematangan membentuk insulin dan C-peptide dan siap disekresikan oleh secretory granules (Bosher 2001).
a
b
8
Diabetes dan Penanganannya
Sel beta pankreas dan sel alfa merupakan komponen terpenting dalam sel endokrin pada pankreas. Setelah mengkonsumsi makanan (karbohidrat), kadar gula (glukosa) dalam darah akan meningkat. Insulin yang dihasilkan oleh sel beta pankreas akan menstimulasi penyerapan glukosa oleh sel-sel tubuh serta menstimulasi hati untuk mengubah glukosa menjadi glikogen dan menyimpannya dalam hati dan otot. Sedangkan pada saat terjadi penurunan glukosa, sel alfa akan mensekresikan hormon glukagon yang menstimulasi hati untuk mengubah glikogen menjadi glukosa (Bouwens & Rooman 2005).
9
Namun, pengobatan tersebut dapat menyebabkan terjadinya kelelahan pada sel beta sehingga dalam proses yang berkelanjutan diabetes tipe 2 akan berubah menjadi diabetes tipe 1 (Dugi 2006, Noguchi 2007, Oliver-Krasinski & Stoffers 2008).
Secara alami peningkatan jumlah sel beta pankreas terjadi pada saat masa tubuh meningkat atau saat adanya pertambahan berat badan serta pada masa kehamilan. Hal tersebut disebabkan karena di dalam pankreas terdapat sel-sel progenitor yang terstimulasi untuk membentuk sel beta pankreas guna memenuhi peningkatan kebutuhan tubuh akan insulin (Bouwens 2004). Namun, kecepatan pembentukan sel beta pankreas yang tidak dapat mengimbangi kerusakan dan kematian sel, serta adanya autoimmune attack pada diabetes tipe 1 menyebabkan pasien harus mendapatkan transplantasai sel beta pankreas.
Kesulitan dalam pengadaan sel beta pankreas disebabkan karena sel-sel tersebut tidak dapat diperbanyak melalui metode kultur. Selain itu jumlah sel yang diperlukan dalam satu kali proses transplantasi juga cukup banyak (Colman
et al. 2004). Hal tersebut menunjukkan kendala yang harus dihadapi dalam penggunaan cell replacement therapy untuk menanggulangi penyakit diabetes yang timbul akibat kerusakan sel beta pankreas.
Embryonic Stem Cells
Stem cells adalah sel yang memiliki kemampuan untuk memperbaharui diri (self-renewal) dan berdiferensiasi menjadi sel lain dengan fungsi yang lebih spesifik. Kemampuan tersebut ditentukan oleh daya plastisitas yang dimilikinya atau disebut juga dengan sifat pluripoten. Sifat pluripoten menyebabkan stem cells mampu berdiferensiasi menjadi berbagai tipe sel dalam tubuh yang dihasilkan dari tiga lapis kecambah, yaitu ektoderm, mesoderm, dan endoderm. Namun demikian, sifat pluripoten tersebut akan berkurang seiring dengan terjadinya diferensiasi atau pembentukan sel yang lebih spesifik (Burdon et al.
2002, NIH 2001, Mayhal et al. 2004).
10
membentuk koloni berlapis yang kompak (compact multilayered colonies). Karakteristik lain yang dimiliki oleh stem cells adalah fase G1 yang pendek pada siklus selnya, serta memiliki aktivitas telomerase yang tinggi, dan ukuran telomere yang lebih panjang bila dibandingkan dengan sel-sel pada umumnya (Bhat et al. 2004).
Berdasarkan sumbernya stem cells dapat dikelompokan menjadi 2 kelompok utama, yaitu embrionik (embryonic stem cells, ESC) dan non-embrionik (adult stem cells, ASC). Embryonic stem cells adalah stem cells yang diperoleh atau diisolasi dari embrio. Sedangkan ASC atau yang juga dikenal sebagai mesenchymal stem cells (MSC) ataupun multipotent adult progenitor cells
(MAPC), adalah sel yang ditemukan di berbagai jaringan tubuh yang memiliki fungsi untuk menjaga keseimbangan dan memperbaiki jaringan tubuh. Adult stem cells dapat diisolasi dari sumsum tulang, otak, hati, kulit, lemak, otot, dan darah (Davila et al. 2004). Namun dari kedua sumber utama stem cells tersebut, ESC merupakan stem cells yang paling baik karena kemampuan proliferasinya dalam waktu yang lebih panjang (long-term self-renewal) dan kemampuan diferensiasinya menjadi berbagai tipe sel dari 3 lapis kecambah, serta imunitas yang lebih rendah bila dibandingkan dengan stem cells dari sumber lainnya (NIH 2001, Lie & Xie 2005).
Embryonic stem cells mulai diisolasi pada tahun 1980an. Diawali dengan keberhasilan Evans dan Kaufman dalam mengisolasi inner cell mass dari blastosis mencit pada tahun 1981. Selain itu, Evans dan Kaufman juga berhasil menemukan kondisi kultur in vitro yang baik sehingga dapat menumbuhkan ESC mencit hingga menghasilkan cell lines (sel yang telah diisolasi dan dikultur secara in vitro dengan tetap mempertahankan sifat-sifat yang dimilikinya). Pada penelitian-penelitian selanjutnya selain berhasil membiakkan stem cells para peneliti juga melakukan pengarahan stem cells secara in vitro sehingga stem cells
11
Berbagai penelitian pada hewan coba telah dilakukan dengan menggunakan stem cells sebagai terapi terhadap suatu penyakit dengan hasil yang lebih baik bila dibandingkan dengan terapi konvensional. Penyakit-penyakit yang dapat disembuhkan dengan menggunakan stem cells antara lain luka bakar, penyakit jantung, stroke, diabetes tipe 1, osteoarthritis dan rheumatoid arthritis, Parkinson dan Alzheimer, serta penyakit-penyakit lain yang diakibatkan kerusakan sistem saraf (NIH 2001, Bhat et al. 2005). Namun penggunaan stem cells tidak hanya terbatas dalam terapi pada penyakit tapi juga digunakan pada penelitian-penelitian dasar (basic research) seperti dalam memahami kejadian kompleks yang terjadi dalam proses perkembangan (development). Selain itu
stem cells juga digunakan dalam mempelajari fungsi-fungsi gen yang terkait dalam mekanisme “on” dan “off” nya suatu gen, ataupun pada proses pengembangan suatu obat (drug development) (NIH 2001, Davila et al. 2004, Bhat et al. 2005, Trounson 2006).
Isolasi Inner Cell Mass
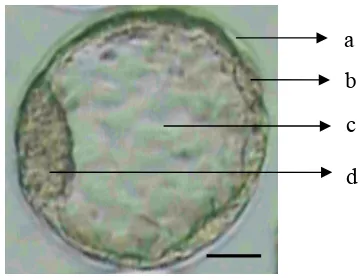
Embryonic stem cells diperoleh dengan mengisolasi inner cell mass (ICM) dari embrio pada fase blastosis. Blastosis adalah suatu tahapan pada perkembangan embrionik pada saat embrio mencapai pertumbuhan pada hari ke 4 setelah terjadinya pembuahan. Pada saat tersebut embrio mengalami kompaksi dan sel-sel pada bagian paling luar akan mensekresikan suatu cairan. Dominasi cairan tersebut akan mendesak sel-sel yang berada pada bagian dalam sehingga terkumpul pada satu sisi dan menghasilkan suatu rongga yang berisi cairan yang disebut dengan blastosol. Sel-sel yang mengeliling pada bagian paling luar dinamakan trophectoderm. Sedangkan sel-sel yang terkumpul pada bagian tengah disebut dengan inner cell mass (ICM) (Nagy et al. 2003, O’Shea et al. 2004, Zwaka & Thomson 2005) (Gambar 3). Inner cell mass tersebut yang kemudian akan diisolasi dan menjadi sumber dari ESC.
12
Namun sebelum dilakukan isolasi ICM, zona pelucida yang membungkus blastosis harus dihilangkan terlebih dahulu. Zona pellucida adalah lapisan glikoprotein yang membungkus embrio, yang berfungsi untuk menjaga kesatuan embrio saat embrio belum mengalami kompaksi (pre-compacted). Pada in vivo,
zona pellucia akan lisis akibat enzim tripsin yang dihasilkan oleh sel-sel
tropechtoderm, yang disebut dengan stripsin (Budhiarko et al. 2008). Pada in vitro, proses penghilangan zona pellucida dilakukan dengan menggunakan enzim pronase berkonsentrasi 0,25-0,50% (Oh et al. 2005) ataupun menggunakan asam tyrode (Cowan et al. 2004, Skottman & Hovatta 2006).
Gambar 3. Embrio fase blastosis: (a) zona pellucida; (b) trofoblas; (c) blastosol; (d) inner cell mas, ICM. Bar = 40 μm
Pengisolasian ICM dari blastosis dapat dilakukan dengan metode
immunosurgery, microsurgery atapun enzimatik (Nagy et al. 2003, Bryja et al.
2006). Umumnya metode yang banyak digunakan adalah metode
immunosurgery. Prinsip dasar dalam metode immunosurgery adalah pengisolasian ICM dengan cara melisiskan sel-sel trophectoderm yang ada di sekeliling ICM. Pelisisan sel-sel trophectoderm dilakukan dengan bantuan antibodi dan komplemen. Antibodi akan berikatan dengan sel-sel trophectoderm
(antigen) sehingga terbentuk kompleks antigen-antibodi. Kemudian dengan penambahan komplemen akan terjadi lisis pada sel-sel trophectoderm akibat
13
adanya aktivasi cascade complement yang menyebabkan terjadinya membrane attack complex (Nagy et al. 2003) sehingga diperoleh ICM sebagai hasil akhir (Gambar 4).
Pada microsurgery, ICM diperoleh dengan melakukan pembedahan mikro terhadap blastosis. Sedangkan pada metode enzimatik digunakan enzim trypsin dengan konsentrasi 2.5% (Bryja et al. 2006). Namun selain kedua metode tersebut, isolasi juga dapat dilakukan dengan cara alami yaitu dengan membiarkan blastosis untuk melekat (attach) dan kemudian mengisolasi ICM yang berupa agregat (Cowan et al. 2004, Bryja et al. 2006, Hoffman & Carpenter 2005). Ataupun menggunakan teknik single cell embryobiopsy yaitu teknik yang umum digunakan pada saat melaluikan pre-implantation genetic diagnosis (PGD) (Chung et al. 2005, Skottman & Hovatta 2006).
Gambar 4. Isolasi ICM dengan metode immunosurgery: (a) blastosis diinkubasi dengan rabbit anti-mouse serum; (b) dilanjutkan dengan
menginkubasi blastosis dengan guinea pig complement; (c) sel-sel trofoblas mengalami lisis sehingga diperoleh ICM (Nagy et al. 2003)
Dibandingkan dengan teknik immunosurgery, penggunaan microsurgery
dianggap lebih menguntungkan dalam proses isolasi ESC pada manusia. Hal ini disebabkan karena tidak terjadinya kontak antara blastosis dengan antibodi yang berasal dari hewan yang umumnya digunakan pada proses immunosurgery. Kelemahan pada metode immunosurgery adalah risiko terbawanya sisa sel trophectoderm pada proses isolasi yang dapat mempengaruhi dan menghambat pertumbuhan ESC (Stojkovic et al. 2005, Skottman & Hovatta 2006).
c b
14
Kultur Embryonic Stem Cell
Inner cell mass yang diperoleh kemudian dikultur dengan tetap mempertahankan sifat undifferentiated yang dimilikinya (Pour et al. 2004). Pada umumnya ESC dikultur dalam dulbecco’s modified eagle’s medium (DMEM) (Sigma, USA) yang mengandung fetal bovine serum (FBS) 10-20% (Sigma, USA), β-mercaptoethanol 0,1 mM (Sigma, USA), nonessential amino acids 1% (Sigma, USA), penicillin-streptomycin 5 μl/ml (Sigma, USA), dan Leukimia inhibitory factor (LIF) 20 ng/ml. Penambahan LIF dalam medium kultur berfungsi untuk mempertahankan sifat undifferentiated ESC. Leukimia inhibitory factor akan berikatan dengan komplek reseptor heterodimer (heterodimeric receptor complex) yang terdiri dari LIF receptor (LIFR) dan reseptor gp 130. Ikatan tersebut akan mengaktifkan faktor transkripsi Janus-associated tyrosine kinases (JAK) yang melekat pada reseptor LIF dan gp 130 sehingga mengalami fosforilasi. JAK yang terfosforilasi akan mengikat signal transducer and activator of transcription 3 (STAT3). Ikatan yang terbentuk antara STAT3 dan JAK menyebabkan STAT3 terfosforilasi dan memiliki kecenderungan untuk membentuk dimer. STAT3 dalam bentuk dimer tersebut kemudian akan bertranslokasi ke dalam nukleus dan mengaktifkan gen-gen yang terkait dalam kemampuan self-renewal ESC (Burdon et al. 2002, Yu & Thomson 2008).
Selain penggunaan LIF, pada kultur ESC juga digunakan feeder layer
berupa mouse embryonic fibroblast (MEF). Penggunaan MEF dalam kultur ESC dapat mengurangi konsentrasi LIF yang digunakan yaitu dari 20 ng/ml menjadi 10 ng/ml. Hal tersebut disebabkan karena MEF juga mensekresikan basic fibroblast growth factor (bFGF) dan LIF yang berperan dalam mempertahankan sifat
15
Karakteristik Embryonic Stem Cells
Embryonic stem cells memiliki karakteristik sebagai berikut berasal dari embrio yang belum melekat pada dinding rahim (preimplantation); dapat berproliferasi tanpa berdiferensiasi dalam waktu yang panjang; dapat berkembang menjadi berbagai sel yang berasal dari 3 lapis kecambah (endoderm, mesoderm, dan ektoderm) (Kitiyanant et al. 2000).
Molekul penanda yang dapat digunakan dalam mendeteksi keadaan
undifferentiated pada ESC antara lain adanya Stage Specific Embryonic Antigen
(SSEA), Octamer-4 (Oct4), dan Nanog. Stage specific embryonic antigen adalah glikoprotein spesifik yang diekspresikan pada awal perkembangan embrionik dan
stem cells yang belum berdiferensiasi (undifferentiated stem cells). Terdapat 3 tipe SSEA yang berperan dalam ESC, yaitu SSEA-1, -3 dan -4. SSEA-1 diekspresikan pada permukaan preimplantaion embryo dan teratocarcinoma stem cells. SSEA-3 dan -4 disintesis selama oogenesis dan ditemukan pada permukaan oosit, zigot, dan awal pembelahan embrio. Embryonic stem cells pada primata,
embryonic carcinoma (EC) dan ESC manusia mengekspresikan SSEA-3 dan SSEA-4, sedangkan SSEA-1 diekspresikan oleh ESC mencit. Sedangkan Oct4 dan Nanog adalah faktor transkripsi yang berperan dalam menjaga ESC pada fase
undifferentiated (NIH 2001, Hoffman & Carpenter 2005, Wobus & Boheler 2005).
Selain itu keadaan belum berdiferensiasi (undifferentiated) dapat pula diketahui dengan melihat aktivitas dari enzim alkaline phosphatase (AP).
Menurut O’Connor et al. 2008 pewarnaan AP merupakan indikator yang sensitif, spesifik dan kuantitatif untuk mengetahui tingkat pluripotensi pada ESC.
Diferensiasi Embryonic Stem Cells Menjadi Sel Beta Pankreas
16
yang diikuti seleksi, penggunaan growth factors (seperti activin, fibroblast growth factor, retinoic acid, dan transforming growth factor) (Shi et al. 2005; Ku et al.
2004; Skoudy et al. 2004), penggunaan extracellular matrix (seperti laminin,
firbronectin dan collagen) (Blyszczuk et al. 2004; Schroeder et al. 2006) serta penggunaan conditioned medium (CM) (Vaca et al. 2006).
Sel beta pankreas yang terbentuk dari hasil pengarahan ESC dapat diidentifikasi dari adanya warna merah yang dihasilkan pada pewarnaan dithizone, ataupun dari pewarnaan imunohistokimia serta analisa menggunakan ELISA untuk melihat adanya insulin yang dihasilkan (Shiroi et al. 2002, Lin et al.
2006, Vaca et al. 2006). Selain itu dapat juga dilakukan analisa terhadap
Connecting-peptide (C-peptide), yaitu suatu peptida yang dihasilkan dari proses sintesis insulin (Rajagopal et al. 2003, Marques et al. 2004, Vaca et al. 2006). Sel beta pankreas juga dapat diidentifikasi melalui ekspresi dari mRNA yang dihasilkan pada proses sintesa insulin (proinsulin 1 dan 2) (Shiroi et al. 2005, Ku
et al. 2004, Lin et al. 2006).
Conditioned Medium
Conditioned medium adalah suatu medium yang diperoleh dari supernatan suatu kultur sel. Penggunaan CM dalam pengarahan stem cells dilakukan karena CM dianggap mengandung protein-protein yang disekresikan dalam kultur sel sebelumnya. Conditioned medium dapat digunakan dalam mempertahankan
undifferentiated pada stem cells ataupun mendukung diferensiasi stem cells
menjadi suatu tipe sel tertentu. Beberapa penelitian yang telah dilakukan pada
stem cells menggunakan CM antara lain, penggunaan CM yang dihasilkan dari kultur sel fibroblas dalam mempertahankan sifat undifferentiated ESC (Xu et al.
2004, Ouyang et al. 2007), CM dari kultur sel glial untuk mengarahkan diferensiasi ESC menjadi sel neuron (Tian et al. 2005), CM dari kultur sel testis yang mengarahkan diferensiasi ESC sehingga membentuk struktur ovari yang mengandung oosit (Lacham-Kaplan et al. 2005), dan CM dari kultur pankreas untuk mengarahkan diferensiasi ESC menjadi sel beta pankreas (Vaca et al.
17
Penggunan CM yang dihasilkan dari kultur primer pankreas fetus usia 16.5 hari yang disertai dengan modifikasi genetik (penyisipan gen tertentu untuk kemudian dilakukan screening) telah mengarahkan diferensiasi ESC menjadi sel beta pankreas melalui ekspresi insulin dan C-peptide yang dihasilkan (Vaca et al.
2006). Penelitian mengenai regenerasi pankreas pada hewan model memperlihatkan bahwa ductal cells mengandung kumpulan progenitor yang akan membentuk sel-sel endokrin melalui ekspresi pdx1. Sel-sel endokrin yang dihasilkan muncul sebagai tunas/buds yang letaknya dekat dengan saluran pankreas/ducts (Colman et al. 2004). Selain itu kultur primer pankreas ataupun sel-sel pancreatic ducts yang dikultur selama 3-4 minggu menunjukkan adanya sel beta pankreas melalui pewarnaan dithizone pada akhir masa kultur (Katdare et al. 2004, Leng 2005, Lin 2006). Kedua hal tersebut membuktikan bahwa pankreas memiliki sel-sel progenitor yang terletak pada saluran pankreas/ducts
18
MATERI DAN METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Embriologi, Departemen Anatomi, Fisiologi, dan Farmakologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor dan Laboratorium Stem Cell and Cancer Institute, Pulomas, Jakarta. Penelitian dilaksanakan pada bulan Maret 2009 hingga Desember 2009, dengan penelitian pendahuluan dilaksanakan dari bulan Juni 2008 sampai dengan Februari 2009.
Rancangan Percobaan
Diferensiasi ESC menjadi sel beta pankreas dirancang menggunakan Rancangan Acak Lengkap (RAL) dengan tiga kali pengulangan. Perlakuan yang dilakukan adalah pengkulturan ESC dengan medium yang mengandung CM dengan konsentrasi 0%, 10%, 30%, dan 50%. Parameter yang diamati adalah diferensiasi ESC menjadi sel beta pankreas dengan cara pengamatan langsung setelah hari ke-21 pada sel yang berwarna merah setelah pewarnaan dithizone serta kemampuan ekspresi dari gen yang bertanggung jawab menghasilkan insulin yaitu gen proinsulin 1 dan proinsulin 2 yang mengekspresikan adanya produksi insulin pada sel beta pankreas. Hasil positif analisa mRNA dilihat secara kualitatif dari intensitas pita hasil RT-PCR pada gel agarose.
Tahapan dan Prosedur Kerja
Pembuatan Conditioned Medium
Conditioned medium (CM) diperoleh dari supernatan medium kultur primer pankreas mencit dewasa. Kultur primer pankreas dilakukan sesuai dengan Katdare et al. (2004) dan Leng & Lu (2005) dengan modifikasi. Pankreas diisolasi dari mencit usia 8 minggu yang dikorbankan secara cervicalis dislocation. Setelah diisolasi pankreas dicuci dengan larutan Dulbecco’s Phosphate Buffer Saline (DPBS) (Gibco, USA) yang mengandung 5μl/ml
19
dalam larutan DPBS yang mengandung 112,25 units/ml colagenase (Sigma, USA) selama 10 menit pada suhu 37°C. Suspensi sel kemudian disaring menggunakan penyaring nilon (nylon strainer) berukuran 100 μm. Supernatan yang diperoleh kemudian disentrifuse dengan kecepatan 200g selama 10 menit. Pelet yang diperoleh lalu dicuci dengan DPBS sebanyak 3 kali dan 1 kali dengan
Dulbecco’s Modified Eagle’s Medium (DMEM)/Ham’s F12 (Sigma, USA). Pelet kemudian dikultur selama 7 hari dalam medium DMEM/Ham’s F12 yang mengandung fetal bovine serum (FBS) 20% (Sigma, USA), non-essential amino acids (NEAA) 1% (Sigma, USA), β-mercaptoethanol 0.1 mM (Sigma, USA),
penicillin-streptomycin (Sigma, USA) 5μl/ml.
Setelah 7 hari sel kemudian dikultur dalam medium tanpa serum hingga hari ke 21. Pengkoleksian CM dilakukan mulai hari ke 9 hingga 21 dengan interval setiap 48 jam. Conditioned medium yang diperoleh lalu difilter dengan
millipore berukuran 0.22 μm dan disimpan berupa aliquot pada suhu -18°C sebelum digunakan sebagai perlakuan.
Penyediaan Embryonic Stem Cell
a. Superovulasi dan Koleksi Embrio Tahap Blastosis
20
mengandung FBS 1%. Embrio kemudian diisolasi menggunakan pipet pasteur dan mikroskop stereo (Nikon, SMZ-2T, Japan). Pencucian dan pengkulturan embrio dilakukan dalam medium kultur berupa drop-drop mikro bervolume 40 μl yang diatasnya telah dilapisi dengan mineral oil (Sigma, USA). Embrio kemudian dikultur selama 24 jam dalam medium DMEM yang mengandung FBS (Sigma, USA) 10%, penicillin-streptomycin (Sigma, USA) 5μl/ml, non-essential amino acids (Sigma, USA) 1%, dan β-mercaptoethanol 0.1 mM sebelum dilakukan pengisolasian inner cell mass/ ICM .
b. Isolasi Inner Cell Mass
Isolasi ICM dilakukan sesuai dengan metode Nagy et al. (2003) dan Kim
et al. (2005). Pada embrio tahap blastosis yang masih memiliki zona pelucida dilakukan pelisisan zona dengan menginkubasi blastosis dalam DPBS yang mengandung enzim pronase 0.25% (Sigma, USA) selama 7-10 menit atau hingga zona pelucida menghilang. Blastosis kemudian dicuci dalam medium kultur yang mengandung serum untuk menghentikan kerja enzim pronase. Sebelum dilakukan isolasi ICM, blastosis terlebih dahulu dicuci dalam medium tanpa serum.
Isolasi ICM dilakukan dengan menggunakan metode immunosurgery. Blastosis diinkubasi dalam DMEM yang mengandung rabbit anti-mouse serum
(Sigma, USA) 25% selama 90 menit, kemudian dicuci dalam DMEM tanpa serum dan diinkubasi kembali dalam DMEM yang mengandung guinea pig complement
(Sigma, USA) 25% selama 90 menit. Proses isolasi ICM kemudian dilanjutkan dengan melakukan pemipetan berulang dan pencucian untuk menghilangkan sel-sel trofoblas yang masih melekat. ICM yang diperoleh kemudian dikultur dalam medium kultur ESC.
c. Kultur dan Pasase Embryonic Stem Cell
Inner cell mass dikultur dalam medium DMEM-high glucose (Sigma, USA) yang mengandung non-essential amino acid 1%, FBS 10%, penicillin-streptomycin (Sigma, USA) 5μl/ml, mercaptoethanol (Sigma, USA) 0,1 mM,
21
d. Pewarnaan Alkaline Phosphatase
Koloni-koloni ESC terlebih dahulu dicuci dengan DPBS sebanyak 2 kali sebelum dilakukan fiksasi. Proses fiksasi dilakukan dengan menginkubasi ESC dalam DPBS yang mengandung paraformaldehide 4%selama 20 menit pada suhu ruang. Setelah difiksasi, ESC kemudian dicuci sebanyak 2 kali menggunakan DPBS. Embryonic stem cells yang telah difiksasi lalu diinkubasi dalam larutan substrat alkaline phosphatase (AP) yang mengandung naphtol AS-MX phosphate
(Sigma, USA) 200 μg/ml dan Fast Red TR Salt (Sigma, USA) 1 mg/ml dalam Tris Buffer 100 mM dengan pH 8.2 selama 30 menit pada suhu ruang. Embryonic stem cells kemudian dicuci dengan DPBS. Embryonic stem cells yang positif mengandung enzim AP akan berwarna merah yang menandakan bahwa sel-sel tersebut masih bersifat pluripoten (Kitiyanant et al. 2000).
Pengarahan Embryonic Stem Cells Menjadi Sel Beta Pankreas
Diferensiasi ESC menjadi sel penghasil insulin dilakukan sesuai dengan protocol Schroeder et al. (2006) yang telah dimodifikasi. Embryonic stem cells
terlebih dahulu dicuci dengan DPBS sebanyak 2 kali dan diinkubasi dengan DPBS yang mengandung trypsin/EDTA 0.25% selama 3 menit pada suhu 37°C, lalu ditambahkan medium kultur yang mengandung FBS 15%. Populasi sel kemudian dihomogenkan menggunakan pipet hingga menjadi sel-sel tunggal atau
cluster-cluster kecil. Sel lalu dikultur pada cawan petri yang telah dilapisi dengan gelatin (Sigma, USA) 0.1% dan dikultur selama 48 jam dalam medium kultur yang mengandung serum. Setelah 48 jam sel kemudian dicuci dengan medium kultur tanpa serum dan dikultur selama 14 hari dalam medium pengarahan, yaitu medium yang mengandung CM dengan konsentrasi volume per volume (v/v) 0%, 10%, 30% dan 50%.
Analisa Sel Beta Pankreas
Untuk mendeteksi adanya sel beta yang terbentuk dilakukan pewarnaan
dithizone (Sigma, USA) sesuai dengan Shiroi et al. (2002). Larutan stok
22
membuat larutan pewarnaan, 10 μl larutan stok diencerkan dengan 1ml DPBS kemudian difilter menggunakan mikrofilter berukuran 0.22 μm. Sebelum dilakukan pewarnaan sel dicuci terlebih dahulu dengan DPBS. Pewarnaan kemudian dilakukan dengan menginkubasi sel selama 15 menit dalam larutan pewarnaan pada suhu 37°C. Sel kemudian dicuci dengan DPBS dan diamati dengan mikroskop. Sel-sel yang positif (sel beta pankreas yang mengandung insulin) akan terlihat berwarna merah dengan pewarnaan tersebut.
Kemampuan Ekspresi Gen Insulin
Untuk membuktikan adanya ekspresi gen insulin pada sel beta pankreas yang dihasilkan dari pengarahan ESC dilakukan deteksi mRNA dari insulin 1 dan insulin 2 dengan metode Reverse Transcription-Polymerase Chain Reaction (RT-PCR). Kedua gen tersebut merupakan gen yang menghasilkan hormon insulin pada sel beta pankreas.
Setelah dilakukan kultur selama 14 hari, sel kemudian dicuci dengan DPBS dan diinkubasi dengan 1 ml Trizol (Invitrogen) selama 5 menit. Seluruh supernatan kemudian dipindahkan ke dalam tabung berukuran 2 ml dan ke dalamnya ditambahkan kloroform sebanyak 200 μl. Kemudian dihomogenkan dan diinkubasi selama 10 menit pada suhu ruang. Larutan kemudian disentrifus dengan kecepatan 12000 g selama 15 menit pada suhu 4°C. Supernatan berupa cairan bening dipindahkan ke dalam tube baru berukuran 1.5 ml dan ditambahkan dengan isoprophil alkohol (isopropanol) sebanyak 500 μl, dicampur hingga homogen dan diinkubasi selama 10 menit pada suhu ruang. Larutan kemudian disentrifus dengan kecepatan 12000g selama 10 menit pada suhu 4°C. Supernatan kemudian dibuang dan pada pelet yang diperoleh ditambahkan etanol DEPCdH2O
23
Reaksi reverse transcription dilakukan menggunakan Transcriptor
(Roche) dan reaksi PCR dilakukan menggunakan Go Tag Green Mastermix
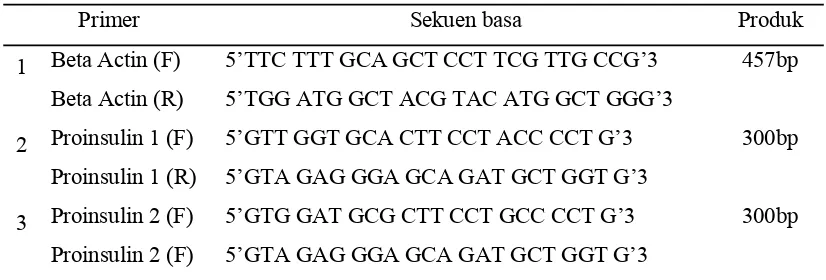
(Promega, USA). Primer yang digunakan adalah b-actin (kontrol), proinsulin 1 dan proinsulin 2 (Tabel 1).
Tabel 1. Primer yang digunakan dalam RT-PCR
Primer Sekuen basa Produk 1 Beta Actin (F) 5’TTC TTT GCA GCT CCT TCG TTG CCG’3 457bp
Total campuran pada reaksi awal transkripsi adalah 13 μl yang terdiri dari
Anchored-oligo (dT) primer 1 μl, total RNA 7 μl, dan water-PCR grade 7 μl. Campuran kemudian dihomogenkan lalu diinkubasi pada suhu 65°C selama 10 min. Setelah itu campuran langsung didinginkan dalam es dan ditambahkan dengan Transcriptor buffer 4 μl, RNase inhibitor 0.5 μl, Deoxynucleotide 2 μl, dan Transcriptase 0.5 μl hingga volume total campuran menjadi 20 μl. Campuran kemudian dihomogenkan dan dimasukkan ke dalam mesin PCR (GeneAmp PCR System 9600) serta diinkubasi pada suhu 50°C selama 60 menit diikuti dengan pemanasan pada suhu 85°C selama 5 menit. cDNA yang dihasilkan kemudian langsung digunakan sebagai cetakan atau template pada reaksi PCR atau disimpan pada suhu -80°C.
Pada reaksi PCR, total campuran terdiri dari Go tag green mastermix 12.5
μl, primer sense 1.25 μl, primer antisense 1.25 μl, DNA template 5 μl, dan
24
dan insulin 1: 62°C dan insulin 2: 64°C) selama 45 detik, suhu extension 72°C selama 1 min dan final extension 72°C selama 5 menit (Lampiran 1). Produk PCR kemudian dianalisa menggunakan gel agarose dengan konsentrasi agarose 2.5% yang mengandung EthidiumBromide (EtBr) 1.25 μl/ml. Produk PCR yang dianalisa dalam setiap proses elektroforesis adalah 10 μl pada sampel dan 4μl pada kontrol. Elektroforesis dilakukan pada voltase 95 volt selama 60 menit menggunakan gel electrophoresis system (Bio Rad). Hasil elektroforesis kemudian dibaca menggunakan Gbox XT (Eppendorf).
Analisa Data
25
HASIL DAN PEMBAHASAN
Produksi Conditioned Medium
Conditioned medium pada penelitian ini diperoleh dari kultur primer pankreas mencit dewasa. Penggunaan pankreas dari mencit dewasa pada kultur primer dilakukan karena sel-sel progenitor yang ada di dalam pankreas dari mencit dewasa akan membentuk sel beta pankreas kembali pada saat dikultur selama 21 hari. Dengan demikian, CM yang dihasilkan akan mengandung protein-protein yang berperan dalam pembentukan sel beta pankreas (Katdare et al. 2004, Leng & Lu 2005). Selain itu, keuntungan lain dari penggunaan pankreas mencit dewasa adalah kemudahan dalam proses isolasi pankreas. Hal tersebut disebabkan jaringan lemak yang ada di sekitar pankreas tidak akan terbawa pada proses isolasi sehingga tidak akan mengganggu pertumbuhan kultur primer pankreas. Sedikitnya jumlah mencit yang dikorbankan bila dibandingkan dengan penggunaan pankreas dari mencit berumur 1-3 hari (neonatal) juga merupakan keuntungan yang diperoleh dari penggunaan pankreas yang berasal dari mencit dewasa.
Isolasi sel dilakukan sesuai dengan Katdare et al. (2004) dan Leng & Lu (2005). Sel-sel yang telah diisolasi kemudian dikultur dalam medium yang mengandung serum 20% selama 7 hari. Pengkulturan tersebut dilakukan agar kultur mencapai konfluen sebelum dilakukan pengkoleksian CM. Setelah konfluen, sel-sel kemudian dikultur dalam medium tanpa serum selama 14 hari (hari ke 7-21) dan pengkoleksian CM dilakukan setiap 48 jam. Conditioned medium dikoleksi dari 3 buah cawan petri berdiameter 6 cm. Conditioned medium
yang diperoleh kemudian disaring dengan filter 0.22 μm dan disimpan dalam tabung bervolume 1.5 ml (aliquot) pada suhu -18°C hingga akan digunakan.
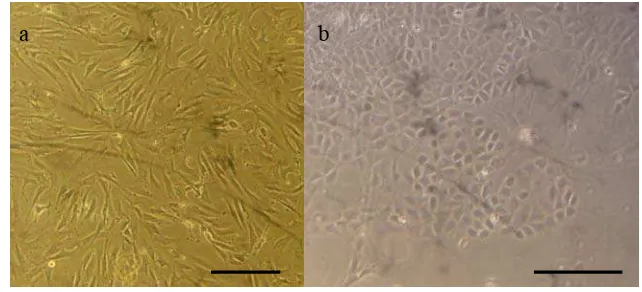
Pada kultur primer pankreas ditemukan 2 tipe morfologi sel yang berbeda, yaitu fibroblast-like cells dan epithelial-like cells (Gambar 5). Morfologi
26
Gambar 5. Morfologi sel yang ditemukan pada kultur primer pankreas; (a)
Fibroblast-like cells; (b) Epithelial-like cells. Bar = 50 μm.
Menurut Gao et al. (2003) terdapat 4 tipe sel yang umum dijumpai pada kultur primer pankreas, yaitu endokrin (sel-sel islet), eksokrin (acinar dan duct cells) dan fibroblas. Namun, sel-sel endokrin (sel-sel islet) dan sebagian sel-sel eksokrin (sel-sel acinar) akan tereliminasi pada saat pengkulturan. Hal tersebut disebabkan kemampuan melekat dan daya tahan hidup yang rendah dari sel-sel tersebut sehingga diperlukan adanya matriks dan penambahan media tertentu dalam pengkulturannya (Gao et al. 2003).
Pada penelitian ini, pada kutur primer pankreas tidak digunakan matriks khusus, melainkan cawan petri hanya dilapisi dengan gelatin 0.1%. Selain itu juga, tidak dilakukan penambahan bahan-bahan yang menunjang pertumbuhan dari sel-sel islet ataupun acinar. Berdasarkan Gao et al. (2003) pada kultur primer pankreas pada penelitian ini tidak akan ditemukan adanya sel-sel beta pankreas yang merupakan bawaan atau hasil dari isolasi organ.
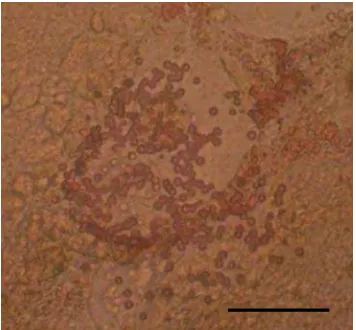
Namun untuk memastikan hal tersebut, dilakukan pewarnaan dithizone pada hari ke 7, 14 dan 21 atau sebelum dan selama pengkoleksian CM serta setelah masa pengkulturan kultur primer berakhir atau setelah 21 hari masa kultur. Hasil pewarnaan dithizone pada hari ke 7 dan 14 tidak memperlihatkan hasil yang positif, yaitu ditemukannya sel-sel yang berwarna merah. Warna merah yang dihasilkan dari pewarnaan dithizone menandakan adanya/terbentuknya sel beta pankreas pada kultur primer (Katdare et al. 2004, Leng & Lu 2005). Hasil positif baru ditemukan pada saat pewarnaan dilakukan pada kultur primer yang telah
27
mencapai 21 hari masa kultur (Gambar 6). Hasil tersebut selain membuktikan bahwa tidak ada sel beta yang merupakan hasil dari isolasi organ pankreas, juga membuktikan bahwa terjadi pembentukan sel beta pankreas pada kultur primer. Dengan demikian CM yang diperoleh diyakini akan mengandung protein-protein yang berperan dalam pembentukan sel beta pankreas.
Gambar 6. Pewarnaan dithizone pada kultur primer pankreas; (a) Negatif, (b) Positif, adanya warna merah. Bar = 50 μm.
Sel-sel yang positif terhadap pewarnaan dithizone tersebut berupa sel-sel tunggal berbentuk bulat atau kelompok/koloni yang dihasilkan dari sel-sel tunggal tersebut. Sel-sel dengan morfologi demikian mulai terlihat pada saat kultur primer mencapai konfluen. Sel-sel yang awalnya hanya berupa tunas-tunas baru tersebut muncul dari sel-sel fibroblas-like cell, tampak seperti melayang, namun sebenarnya terhubung dengan sel-sel fibroblast-like cells sehingga sel-sel tersebut tidak akan hilang pada saat penggantian medium.
Menurut Ilieva et al. (1999) CM yang diperoleh dari kultur duct cells
hamster mengandung insuline-like growth factor II (IGF II), sedangkan sel-sel endokrin menghasilkan insulin serta sel-sel fibroblas menghasilkan fibroblast growth factor (FGF). Berdasarkan hal tersebut, maka CM yang diperoleh dari kultur primer pankreas pada penelitian ini diduga mengandung IGF II dan FGF. Selaras dengan dominansi fibroblast-like cells pada kultur primer, maka konsentrasi FGF akan jauh lebih banyak dibandingkan dengan IGF II. Sedangkan insulin sebagai hasil sekresi dari sel beta pankreas tidak akan ditemukan karena
28
hasil pewarnaan dithizone sebelum dan selama pengkoleksian CM tidak menunjukkan adanya sel beta pankreas. Namun, untuk membuktikan hal tersebut masih perlu dilakukan penelitian lebih lanjut mengenai kandungan protein yang terkandung dalam CM.
Penyediaan Embryonic Stem Cell
Koleksi Blastosis dan Isolasi Inner Cell Mass
Embryonic stem cells diperoleh dengan mengisolasi ICM dari embrio tahap blastosis pada 3,5 days postcoitum atau hari ke-4 setelah penyuntikan hormon hCG (Nagy et al. 2003). Jumlah blastosis yang diperoleh dari hasil koleksi adalah 44,51% dari jumlah total embrio. Embrio yang diperoleh tidak seluruhnya berada pada tahap blastosis, masih ditemukan pula embrio pada tahap morula. Ketidakseragaman pada perkembangan embrio tersebut disebabkan adanya perbedaan pada perkembangan masing-masing embrio. Untuk meningkatkan jumlah blastosis, embrio yang diperoleh kemudian dikultur selama 24 jam agar embrio tahap morula dapat berkembang menjadi blastosis. Pengkulturan tersebut terbukti dapat meningkatkan persentase jumlah blastosis dari 44,51% meningkat menjadi 75,91% (Tabel 2). Peningkatan jumlah blastosis yang diperoleh meningkatkan jumlah ICM yang dapat diisolasi sebagai sumber ESC.
Tabel 2. Persentase perolehan blastosis
Jumlah embrio Jumlah blastosis (%)
Saat koleksi Setelah 24 jam kultur 218 + 4,51 44,51 + 3,51 75,91 + 11,14
Sebelum dilakukan proses isolasi ICM, zona pellucida yang membungkus blastosis harus dihilangkan terlebih dahulu. Proses penghilangan zona pellucida
29
Pada umumnya ketebalan zona pellucida pada blastosis adalah 7 μm (Nagy et al. 2003). Secara alami setelah embrio mencapai tahap blastosis, embrio akan mensekresikan enzim yang akan melisiskan glikoprotein, yaitu komponen yang menyusun zona pellucida (Budhiarko et al. 2008). Karena pertumbuhan embrio yang tidak seragam menyebabkan ketebalan zona pellucida pada tiap blastosis juga akan bervariasi. Hal tersebut juga mempengaruhi lamanya waktu yang diperlukan dalam penginkubasian blastosis dengan enzim pronase. Blastosis yang sudah tidak memiliki zona pellucida kemudian dicuci dan dipindahkan ke dalam drop-drop bervolume 40 μl berisi DMEM yang mengandung serum. Hal tersebut dilakukan untuk menghentikan dan menghilangkan sisa-sisa enzim pronase pada proses sebelumnya.
Selanjutnya pada blastosis dilakukan isolasi ICM dengan metode
immunosurgery. Proses isolasi diawali dengan menginkubasi blastosis dalam medium tanpa serum yang mengandung rabbit anti-mouse antibody. Setelah itu blastosis dicuci dengan medium tanpa serum dan diinkubasi dalam medium tanpa serum yang mengandung complement sera from guinea pig. Perbandingan antara medium dengan antibodi dan medium dengan komplemen adalah 1 : 3 dengan proses inkubasi selama 90 menit. Konsentrasi antibodi dan komplemen serta lamanya waktu inkubasi merupakan hasil optimasi yang telah dilakukan sebelumnya.
Pada saat blastosis diinkubasi dalam rabbit anti-mouse antibody, antibodi akan berikatan dengan sel-sel trofoblas pada permukaan blastosis. Saat proses isolasi ICM dilanjutkan dengan penginkubasian blastosis dalam complement sera from guinea pig, complement akan mengenali antibodi dan melisiskan sel-sel trofoblas yang berikatan dengan antibodi. Setelah sel-sel trofoblas lisis maka akan diperoleh ICM sebagai hasil akhir (Nagy et al. 2003).
Kultur Embryonic Stem Cell dan Uji Pluripotensi
30
faktor transkripsi STAT3. STAT3 kemudian akan mengaktifkan gen-gen yang berperan dalam proses self renewal (Burdon et al. 2002, Yu & Thomson 2008).
Konsentrasi LIF yang digunakan dalam kultur ESC adalah 20 ng/ml. Penggunaan konsentrasi tersebut disebabkan karena dalam kultur ESC tidak digunakan fibroblas sebagai feeder layer sehingga diperlukan dosis LIF yang lebih tinggi untuk mempertahankan sifat undifferentiated ESC. Sebagai feeder layer fibroblas selain berfungsi mensekresikan basic fibroblast growth factor
(bFGF) dan LIF yang berperan dalam mempertahankan sifat undifferentiated juga merupakan substrat sebagai tempat melekat ESC. Sedangkan pada penelitian ini kultur ESC yang dilakukan menggunakan gelatin sebagai substrat untuk melekatnya ESC.
Salah satu karakter dari ESC adalah bersifat pluripoten, yaitu mampu berdiferensiasi menjadi semua tipe sel tubuh. Sifat tersebut akan berkurang dan menghilang seiring dengan terjadinya diferensiasi (Burdon et al. 2002). Untuk memastikan bahwa ESC yang akan diarahkan menjadi sel beta pankreas masih bersifat pluripoten dan belum berdiferensiasi maka dilakukan uji pluripotensi menggunakan pewarnaan alkaline phosphatase (AP).
31
Menurut O’Connor et al. (2008) pewarnaan AP merupakan indikator yang sensitif, spesifik, dan kuantitatif terhadap ESC yang belum berdiferensiasi, dimana tingkat pluripotensinya masih tinggi. Hasil positif pada pewarnaan AP ditunjukkan dengan timbulnya warna merah yang menandakan adanya enzim AP pada koloni ESC. Warna merah pada pewarnaan AP tersebut dihasilkan dari reaksi yang terjadi antara larutan AP (naphtol AS-MX phosphate dan Fast Red TR Salt) dengan enzim AP sehingga warna merah pada Fast Red TR Salt akan berikatan dengan enzim AP pada koloni ESC (Kitiyanant et al. 2000). Hasil pewarnaan AP menunjukkan bahwa pada 30 koloni ESC yang dilakukan pewarnaan, 96.97% koloni ESC memperlihatkan hasil yang positif atau masih bersifat pluripoten dan belum berdiferensiasi (Gambar 7).
Pengarahan Embryonis Stem Cells Menjadi Sel Beta Pankreas
Pengarahan ESC menjadi sel penghasil insulin diawali dengan mengkultur ESC yang telah ditripsinasi dalam medium tanpa LIF selama 48 jam. Kemudian dilanjutkan dengan mengkultur ESC dalam medium pengarahan, yaitu medium yang mengandung CM dengan konsentrasi 0% (kontrol negatif), 10%, 30% dan 50% (berturut-turut adalah perlakuan 1, 2, 3, dan 4) selama 14 hari. Pengamatan hasil pengarahan ESC menjadi sel penghasil insulin (insulin-like cells) dilakukan setelah hari ke 14 pengkulturan dalam medium pengarahan.
32
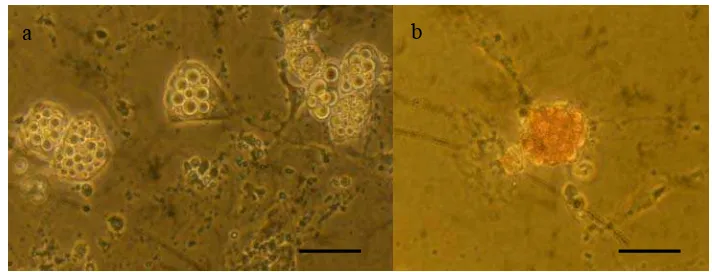
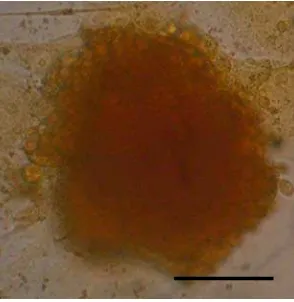
Pada pewarnaan dithizone morfologi sel beta pankreas yang dihasilkan dari pengarahan ESC tampak berupa sel-sel bulat (Gambar 8). Sedangkan morfologi sel berupa koloni seperti yang ditemukan pada kultur primer pankreas (Gambar 6) tidak terlihat dengan jelas. Hal tersebut disebabkan ukuran sel beta pankreas dari hasil pengarahan ESC yang sangat kecil bila dibandingkan dengan sel beta pankreas yang terbentuk pada kultur primer pankreas. Selain itu hampir seluruh sel beta pankreas hasil pengarahan ESC tumbuh membentuk kelompok atau agregat sehingga sulit untuk melihat morfologi sel secara jelas.
Hasil pewarnaan dithizone memperlihatkan adanya intensitas warna yang berbeda pada tiap koloni ESC, yaitu merah muda, merah, dan merah tua. (Gambar 9).
Gambar 9. Hasil pewarnaan dithizone pada pengarahan ESC; (a) Merah muda; (b) Merah; (c) Merah tua. Bar = 10 μm.
Pewarnaan dithizone adalah pewarnaan yang mengikat zinc (zinc-binding substance) sehingga menghasilkan warna merah muda hingga merah tua pada sel-sel yang mengandung zinc (Zn) (Shiroi et al. 2005). Selain pada sel beta pankreas, konsentrasi Zn yang tinggi juga dapat ditemukan pada organ-organ lain seperti testis dan usus halus. Namun pewarnaan dithizone merupakan pewarnaan yang spesifik terhadap sel beta pankreas sehingga tidak akan mewarnai sel-sel lain selain sel beta pankreas (McNary 1954).
33
sehingga membentuk dimer ataupun hexamer yang akan mempermudah dalam penyimpanan insulin dalam secretory vesicles pada sel beta pankreas (Chausmer 1998). Peningkatan warna pada pewarnaan dithizone dapat disimpulkan sebagai adanya peningkatan akumulasi Zn yang berasosiasi dengan peningkatan jumlah insulin di dalam sel beta pankreas.
Tabel 3. Hasil pewarnaan dithizone pada pengarahan ESC menjadi sel beta pankreas
intensitas warna (skor) Rataan intensitas Supercript yang berbeda pada kolom yang sama menunjukkan perbedaaan yang nyata (P < 0.05) antara warna yang dihasilkan pada pewarnaan dithizone.
Perbedaan konsentrasi CM dalam medium pengarahan menghasilkan perbedaan warna pada saat pewarnaan dithizone (Tabel 3). Untuk mempermudah dalam menganalisa data maka koloni ESC dibedakan berdasarkan warna yang dihasilkan warna merah muda diberi skor 1, merah diberi skor 2 dan merah tua diberi skor 3. Secara statistik warna yang dihasilkan pada pewarnaan dithizone menunjukkan hasil yang secara nyata berbeda. Perlakuan 4 (CM dengan konsentrasi 50%) merupakan hasil yang terbaik diikuti dengan perlakuan 3 (CM konsentrasi 30%) (P < 0.05). Sedangkan pada perlakuan 2 (CM dengan konsentrasi 10%) tidak memperlihatkan hasil yang berbeda nyata dengan perlakuan 1 (medium tanpa CM/kontrol) (P > 0.05). Hal tersebut sejalan dengan Vaca et al. (2006) yakni konsentrasi CM yang umum digunakan dalam pengarahan stem cell menjadi sel beta pankreas adalah 50%.
34
sel alfa dan sel beta yang akan mensekresikan glukagon dan insulin. Sedangkan
duct cells mensekresikan insuline-like growth factors IIdan sel-sel fibroblas akan menghasilkan fibroblast growth factor (FGF) (Ilieva et al. 1999).
Insulin yang dihasilkan oleh sel-sel endokrin pankreas menurut Ku et al.
(2004) bukanlah merupakan faktor utama yang mendukung diferensiasi ESC menjadi sel beta pankreas. Hal tersebut dibuktikan melalui penggunaan insulin pada kultur ESC yang tidak meningkatkan pembentukan sel beta pankreas pada kultur pengarahan ESC menjadi sel beta pankreas (Ku et al. 2004). Namun, menurut Vaca et al. (2006) meski insulin tidak dapat memberikan pengaruh secara langsung pada diferensiasi ESC menjadi sel beta pankreas, insulin diduga dapat berinteraksi dengan protein-protein lain yang pada akhirnya dapat memberi pengaruh pada diferensiasi ESC menjadi sel beta pankreas. Sedangkan glukagon yang disekresikan oleh sel alfa diketahui memiliki peranan dalam proses inisiasi pada awal pembentukan sel beta pankreas dan peningkatan jumlah sel beta pankreas pada diferensiasi ESC serta peningkatan sekresi insulin oleh sel beta pankreas (Bai et al. 2005, List & Habener 2004, Gittes 2009, Prasadan et al.
2002).
Serupa dengan insulin dan glukagon, peranan IGF II pada pengarahan ESC menjadi sel beta pankreas belum diketahui secara pasti. Penggunaan growth factor tersebut pada kultur sel beta pankreas berkaitan dengan kemampuannya dalam meningkatkan viabilitas sel melalui penghambatan atau pencegahan terjadinya proses apoptosis pada sel beta pankreas (Ilieva et al. 1999, Hill et al.
2000, Petrik et al. 2003, Nagatomo et al. 2005).
Berbeda dengan insulin, glukagon, dan IGF II, FGF banyak digunakan dalam pengarahan stem cells menjadi sel beta pankreas. Fibroblast growth factor
memiliki peranan dalam mengarahkan diferensiasi sel progenitor menjadi sel-sel endokrin (Ta et al. 2006). Selain itu, FGF juga memiliki peranan sebagai
chemoattractanct yang menstimulasi pembentukan agregat dari sel-sel islet (Hardikar et al. 2003). Fibroblast growth factor juga diketahui dapat menstimulasi diferensiasi stem cells menjadi sel beta pankreas melalui rangkaian