ABSTRAK
MELIANA. Studi Variasi Fenotipik Keladi Merah (Caladium bicolor(W.Aint)Vent) Hasil Kultur Jaringan. Dibimbing olehDIAH RATNADEWIdanEDHI SANDRA.
Keladi merah (Caladium bicolor(W.Aint)Vent.) Blume) merupakan salah satu jenis tanaman hias daun. Secara konvensional, tanaman ini diperbanyak secara vegetatif sehingga pembentukan genotipe-genotipe baru tergolong sempit. Upaya peningkatan ragam genetik dilakukan dengan variasi somaklonal yaitu melalui organogenesisin vitro. Penelitian ini bertujuan untuk mengidentifikasi variasi fenotipik keladi merah hasil variasi somaklonal dari kultur jaringan. Bahan tanaman yang digunakan adalah daun muda tanaman keladi merah. Media dasar yang digunakan adalah Murashige and Skoog (MS) yang ditambahkan BAP 10 mg/l dan NAA 0,5 mg/l. Penelitian terdiri dari 3 tahap yaitu inisiasi, multiplikasi dan aklimatisasi. Pada tahap inisiasi eksplan membentuk tunas pada 8 MSK. Tahap multiplikasi dilakukan 2 kali dengan interval waktu 2 bulan; jumlah akar menunjukkan nilai yang tinggi dibandingkan rerata jumlah daun dan tunas. Pada tahap aklimatisasi parameter yang diamati adalah karakter morfologi dan warna daun pada umur dua bulan setelah diaklimatisasi. Hasil penelitian menunjukkan bahwa secara visual tanaman hasil multiplikasi memiliki karakter morfologi yang berbeda dengan tanaman induknya. Dari hasil subkultur ke-1 diperoleh 5 tanaman sedangkan subkultur ke-2 diperoleh 6 tanaman yang bervariasi.
Kata kunci :Caladium bicolor(W. Aint)Vent, Kultur jaringan, Variasi morfologi.
ABSTRACT
MELIANA. Study of Phenotypic Variation of Wild Cocoyam (Caladium bicolor (W.Aint)Vent) Resulted from Tissue Cultures. Supervised byDIAH RATNADEWIand EDHI SANDRA.
Wild cocoyam (Caladium bicolor(W.Aint)Vent) Blume) is one of the ornamental leaf plants. Conventionally,this plant reproduces vegetatively. So, the generation of new genotypes is rare. Effort to increase genetic variation of plant was conducted through somaclonal variation in in vitro culture. The research goal is to identify the phenotypic variation of wild cocoyam from tissue culture due to somaclonal variation. Young leaves were taken as the plant material. Murashige and Skoog (MS) medium added with BAP 10 mg/l and NAA 0,5 mg/l used as the basic medium. The research had three steps: initiation, multiplication and acclimatization which was done 2 times in time 2 month interval. Roots were more abundant than the average number of leaves and buds. While at the acclimatization step, morphological characters of leaves was observed at the age of 2 months after being acclimatized. The visual results of this research showed that regenerated plants have morphological characters that were different fromit’s parent. The first subculture gained 5 plants while the second subculture gained 6 plants with phenotypic variation.
Keladi merah (Caladium bicolor (W.Aint) Vent) merupakan salah satu jenis tanaman hias dilihat dari bentuk dan warna daunnya. Daun Caladium mempunyai ukuran dan warna yang bervariasi. Batang berbentuk bulat dan membentuk umbi di bagian bawah permukaan tanah. Bunganya berbentuk bulat memanjang dan tertutup oleh seludang yang dimanfaatkan untuk tempat perkembangbiakan (Prihmantoro 1997). Bentuk dan keindahan warna daunnya membuat tanaman ini sangat cocok untuk tanaman lanskap dan tanaman pot (Deng dan Harbaugh 2006). Caladium berasal dari Amerika Selatan terutama di daerah yang beriklim tropika dan dijadikan sebagai sumber pendapatan. Warna daunCaladiumyang indah serta perawatannya yang mudah dan tahan lama menyebabkan permintaan akan jenis tanaman ini meningkat (Aliet al. 2007).
Pada umumnya Caladium
diperbanyak dengan umbinya. Perbanyakan dengan cara tersebut menyebabkan kecilnya peluang pembentukan genotipe-genotipe baru, produksi bibit dihasilkan dalam waktu yang lama serta menjadi rentan terhadap hama dan penyakit (Gill et al. 1994; Deng et al. 2007). Maka dibutuhkan produksi benih tanaman Caladium secara lebih cepat, serta bebas dari hama dan penyakit. Salah satu teknik yang digunakan untuk mengatasi permasalahan tersebut adalah dengan perbanyakan melalui kultur jaringan.
Perbanyakan in vitro dapat dilakukan dengan menggunakan dua cara yaitu melalui organogenesis dan embriogenesis. Organogenesis adalah suatu proses untuk membentuk dan menumbuhkan tunas dari jaringan meristematik. Regenerasi eksplan menjadi organ dan planlet dapat diperoleh melalui jalur organogenesis langsung dan tidak langsung. Organogenesis langsung yaitu eksplan
langsung menumbuhkan sel
organogenesis tidak langsung terjadi pembentukan kalus terlebih dahulu (Hadipoentyanti et al. 2008). Embriogenesis merupakan proses perkembangan sel vegetatif atau sel-sel somatik yang diperoleh dari berbagai sumber eksplan (Zulkarnain 2009). Dalam penelitian ini proses kultur jaringan akan dilakukan melalui organogenesis langsung yaitu dengan induksi tunas.
Kelebihan dari teknik kultur jaringan tanaman adalah dapat juga menghasilkan keanekaragaman fenotipe. Pada tanaman hias, hal itu justru seringkali diharapkan dan memiliki nilai jual yang tinggi. Keanekaragaman fenotipe yang timbul dari proses mikropropagasi disebut keragaman somaklonal. Keragaman somaklonal dapat muncul akibat faktor fisiologis, faktor biokimia, faktor genetik tanaman, atau oleh faktor lingkungan (Larkin dan Scowcroft 1981). Fenomena variasi somaklonal tersebut dapat ditunjukkan dengan adanya daun tanaman yang mengalami albino, tanaman menjadi kerdil (pendek), perubahan bentuk dan warna daun, batang, bunga, ukuran umbi, ketajaman dan variasi daun (Kumar 1995).
memiliki keunggulan-keu pada tanaman asalnya. B dilakukan oleh para p menghasilkan keragaman tanaman; diantaranya den zat pengatur tumbuh menggunakan sinar gamm ini, menggunakan zat pen konsentrasi tinggi dan menggulung keladi merah variasi yang ditimbulkan. Tujuan
Penelitian ini bert mengidentifikasi variasi fe merah (Caladium bicolo Vent.) hasil variasi som kultur jaringan.
METODOLOGI PEN Waktu dan Tempat
Penelitian dilaksanaka Oktober 2010 hingga bertempat di Laborato Jaringan Departemen Bio Matematika dan Ilmu Alam, Institut Pertanian Bo Alat dan Bahan
Alat yang diguna timbangan, erlenmeyer, pip ukur, pengaduk, botol st alumunium foil, pinset, gu Laminar Air Flow Cab cawan petri,plastik wrap.
Bahan yang digun tanaman keladi merah (Ga diambil dari Laborato Jaringan Unit Uji, Departe
Gambar 1 Indukan tan merah.
eunggulan dari . Berbagai cara peneliti untuk an pada suatu engan perlakuan h kuat atau mma. Penelitian engatur tumbuh eksplan daun ah untuk melihat
.
ertujuan untuk fenotipik keladi olor (W. Ait) omaklonal dari
NELITIAN
kan pada bulan a Mei 2011 atorium Kultur iologi, Fakultas u Pengetahuan Bogor.
nakan adalah , pipet ukur, gelas steril, autoklaf, gunting, bunsen, abinet (LAFC), p.
unakan adalah Gambar 1) yang torium Kultur rtemen Biologi.
tanaman keladi
Media MS (Murashige a (Tabel Lampiran Benzylaminopurine (BA naphthalenacetic acid (NA untuk sterilisasi (deterjen (5,25% NaClO) 5% dan 2,5% g/l, Dithane M-45 1 g/l da steril.
Metode
Pemilihan eksplan
Eksplan yang digunak daun muda yang masih m berumur 1 minggu dan ter hama dan penyakit.
Gambar 2 Daun menggulun digunakan sebaga Pembuatan media
Botol yang digunak penyimpanan kultur adalah dengan ukuran 200 ml. Botol disterilkan terlebih dahulu me autoklaf selama ± 20 menit 121°C. Selanjutnya adalah media MS menggunak Erlenmeyer 1000 ml. La makro, hara mikro, vitami dicampurkan hingga rata, ditambahkan ZPT BAP 10 NAA 0,5 mg/l. Campur tersebut kemudian menggunakan aquades hingg l. Setelah itu, pH larutan diu pH meter hingga pada kisar Tahap selanjutnya adalah agar sebanyak 8 g/l, kemud media dididihkan. Media dit dalam botol kultur mas sebanyak 25 ml. Botol yang media lalu disterilkan dala selama 20 menit pada suhu
2
e and Skoog)
1),
6-AP), α -AA), bahan jen, Bayclin ,5%, Agrept 1 dan aquades
akan adalah menggulung terbebas dari
lung yang agai eksplan.
memiliki keunggulan-keu pada tanaman asalnya. B dilakukan oleh para p menghasilkan keragaman tanaman; diantaranya den zat pengatur tumbuh menggunakan sinar gamm ini, menggunakan zat pen konsentrasi tinggi dan menggulung keladi merah variasi yang ditimbulkan. Tujuan
Penelitian ini bert mengidentifikasi variasi fe merah (Caladium bicolo Vent.) hasil variasi som kultur jaringan.
METODOLOGI PEN Waktu dan Tempat
Penelitian dilaksanaka Oktober 2010 hingga bertempat di Laborato Jaringan Departemen Bio Matematika dan Ilmu Alam, Institut Pertanian Bo Alat dan Bahan
Alat yang diguna timbangan, erlenmeyer, pip ukur, pengaduk, botol st alumunium foil, pinset, gu Laminar Air Flow Cab cawan petri,plastik wrap.
Bahan yang digun tanaman keladi merah (Ga diambil dari Laborato Jaringan Unit Uji, Departe
Gambar 1 Indukan tan merah.
eunggulan dari . Berbagai cara peneliti untuk an pada suatu engan perlakuan h kuat atau mma. Penelitian engatur tumbuh eksplan daun ah untuk melihat
.
ertujuan untuk fenotipik keladi olor (W. Ait) omaklonal dari
NELITIAN
kan pada bulan a Mei 2011 atorium Kultur iologi, Fakultas u Pengetahuan Bogor.
nakan adalah , pipet ukur, gelas steril, autoklaf, gunting, bunsen, abinet (LAFC), p.
unakan adalah Gambar 1) yang torium Kultur rtemen Biologi.
tanaman keladi
Media MS (Murashige a (Tabel Lampiran Benzylaminopurine (BA naphthalenacetic acid (NA untuk sterilisasi (deterjen (5,25% NaClO) 5% dan 2,5% g/l, Dithane M-45 1 g/l da steril.
Metode
Pemilihan eksplan
Eksplan yang digunak daun muda yang masih m berumur 1 minggu dan ter hama dan penyakit.
Gambar 2 Daun menggulun digunakan sebaga Pembuatan media
Botol yang digunak penyimpanan kultur adalah dengan ukuran 200 ml. Botol disterilkan terlebih dahulu me autoklaf selama ± 20 menit 121°C. Selanjutnya adalah media MS menggunak Erlenmeyer 1000 ml. La makro, hara mikro, vitami dicampurkan hingga rata, ditambahkan ZPT BAP 10 NAA 0,5 mg/l. Campur tersebut kemudian menggunakan aquades hingg l. Setelah itu, pH larutan diu pH meter hingga pada kisar Tahap selanjutnya adalah agar sebanyak 8 g/l, kemud media dididihkan. Media dit dalam botol kultur mas sebanyak 25 ml. Botol yang media lalu disterilkan dala selama 20 menit pada suhu
e and Skoog)
1),
6-AP), α -AA), bahan jen, Bayclin ,5%, Agrept 1 dan aquades
akan adalah menggulung terbebas dari
lung yang agai eksplan.
3
tekanan 17,5 psi. Setelah itu, media disimpan selama 3 hari pada suhu ruangan, untuk memastikan ada tidaknya kontaminasi pada media tersebut.
Sterilisasi Alat dan Eksplan
Sterilisasi botol, cawan petri, alat-alat diseksi dilakukan dengan menggunakan autoklaf pada tekanan 17,5 psi pada suhu 121ºC selama 30 menit. Mula-mula bahan eksplan dicuci menggunakan air kran selama 15 menit, lalu dipotong selebar ± 5 cm, selanjutnya direndam didalam deterjen selama 5-7 menit, lalu dibilas dengan air kran.
Tahap selanjutnya dilakukan di dalam LAFC (Laminar Air Flow Cabinet) secara aseptik. Potongan-potongan daun direndam dalam bakterisida (Agrept 1 g/l) selama 30 menit, kemudian dalam fungisida (Dithane 1 g/l) selama 15 menit, selanjutnya dibilas hingga bersih dengan aquades steril. Eksplan dipindahkan ke dalam botol kultur steril. Selanjutnya dilakukan sterilisasi bertingkat dengan Bayclin (5,25% NaClO) sebanyak 5% selama 10 menit dan 2,5% selama 5 menit. Setiap penggantian bahan sterilan, dilakukan pembilasan dengan aquades steril sebanyak 3 kali. Eksplan yang telah disterilkan dipotong sepanjang 1 cm dan ditanam dalam media yang telah disiapkan.
Fase Inisiasi dan Multiplikasi
Penanaman dilakukan secara aseptik di LAFC. Tahap inisiasi menggunakan zat pengatur tumbuh BAP 10 mg/l yang dikombinasikan dengan NAA 0,5 mg/l. Pada tahap multiplikasi dilakukan pemisahan propagul dan ditanam dalam media dengan komposisi yang sama. Hal tersebut dilakukan sebanyak 2 kali, subkultur ke-1 dan subkultur ke-2 dengan interval waktu 2 bulan.
Pemeliharaan kultur
Kultur disimpan pada ruangan dengan suhu 25°C, intensitas cahaya sebesar 1000 Lux selama 16 jam/hari.
Aklimatisasi
Planlet dari subkultur ke-1 dan ke-2 dikeluarkan dari botol kultur untuk diaklimatisasi. Planlet yang diaklimatisasi adalah mempunyai tinggi ± 5 cm, jumlah akar dan daun lebih dari 3. Aklimatisasi dilakukan dengan menggunakan tanah, sekam dan pupuk kompos dengan perbandingan 1:1:1 dalam polybag. Planlet dicuci bersih dengan menggunakan air kran, agar media tidak menempel pada planlet. Selanjutnya pot disimpan dengan penyungkupan selama 2 minggu, kemudian secara berangsur-angsur sungkup dibuka.
Pengamatan
Pengamatan awal dilakukan 3-4 hari setelah pengkulturan untuk melihat kemungkinan terjadinya kontaminasi. Pengamatan selanjutnya dilakukan dalam 2 tahap, yaitu:
a. Pengamatan di laboratorium meliputi saat muncul tunas, jumlah tunas, saat muncul daun, jumlah daun, saat muncul akar dan jumlah akar, yang diamati seminggu sekali selama 7 minggu.
b.Pengamatan di fase aklimatisasi meliputi parameter ketahanan hidup, tinggi tanaman, panjang daun, lebar daun, jumlah daun, warna dan bentuk daun.
HASIL Fase Inisiasi
tekanan 17,5 psi. Setelah itu, media disimpan selama 3 hari pada suhu ruangan, untuk memastikan ada tidaknya kontaminasi pada media tersebut.
Sterilisasi Alat dan Eksplan
Sterilisasi botol, cawan petri, alat-alat diseksi dilakukan dengan menggunakan autoklaf pada tekanan 17,5 psi pada suhu 121ºC selama 30 menit. Mula-mula bahan eksplan dicuci menggunakan air kran selama 15 menit, lalu dipotong selebar ± 5 cm, selanjutnya direndam didalam deterjen selama 5-7 menit, lalu dibilas dengan air kran.
Tahap selanjutnya dilakukan di dalam LAFC (Laminar Air Flow Cabinet) secara aseptik. Potongan-potongan daun direndam dalam bakterisida (Agrept 1 g/l) selama 30 menit, kemudian dalam fungisida (Dithane 1 g/l) selama 15 menit, selanjutnya dibilas hingga bersih dengan aquades steril. Eksplan dipindahkan ke dalam botol kultur steril. Selanjutnya dilakukan sterilisasi bertingkat dengan Bayclin (5,25% NaClO) sebanyak 5% selama 10 menit dan 2,5% selama 5 menit. Setiap penggantian bahan sterilan, dilakukan pembilasan dengan aquades steril sebanyak 3 kali. Eksplan yang telah disterilkan dipotong sepanjang 1 cm dan ditanam dalam media yang telah disiapkan.
Fase Inisiasi dan Multiplikasi
Penanaman dilakukan secara aseptik di LAFC. Tahap inisiasi menggunakan zat pengatur tumbuh BAP 10 mg/l yang dikombinasikan dengan NAA 0,5 mg/l. Pada tahap multiplikasi dilakukan pemisahan propagul dan ditanam dalam media dengan komposisi yang sama. Hal tersebut dilakukan sebanyak 2 kali, subkultur ke-1 dan subkultur ke-2 dengan interval waktu 2 bulan.
Pemeliharaan kultur
Kultur disimpan pada ruangan dengan suhu 25°C, intensitas cahaya sebesar 1000 Lux selama 16 jam/hari.
Aklimatisasi
Planlet dari subkultur ke-1 dan ke-2 dikeluarkan dari botol kultur untuk diaklimatisasi. Planlet yang diaklimatisasi adalah mempunyai tinggi ± 5 cm, jumlah akar dan daun lebih dari 3. Aklimatisasi dilakukan dengan menggunakan tanah, sekam dan pupuk kompos dengan perbandingan 1:1:1 dalam polybag. Planlet dicuci bersih dengan menggunakan air kran, agar media tidak menempel pada planlet. Selanjutnya pot disimpan dengan penyungkupan selama 2 minggu, kemudian secara berangsur-angsur sungkup dibuka.
Pengamatan
Pengamatan awal dilakukan 3-4 hari setelah pengkulturan untuk melihat kemungkinan terjadinya kontaminasi. Pengamatan selanjutnya dilakukan dalam 2 tahap, yaitu:
a. Pengamatan di laboratorium meliputi saat muncul tunas, jumlah tunas, saat muncul daun, jumlah daun, saat muncul akar dan jumlah akar, yang diamati seminggu sekali selama 7 minggu.
b.Pengamatan di fase aklimatisasi meliputi parameter ketahanan hidup, tinggi tanaman, panjang daun, lebar daun, jumlah daun, warna dan bentuk daun.
HASIL Fase Inisiasi
kultur mencapai 33%. Kon menyerang eksplan beru dan bakteri, namun konta lebih banyak ditemui. mengalami organogenes sebanyak 16 kultur. Sedan mengalami organogen langsung.
Selama fase inisiasi, ditanam mengalami p morfologi pada setiap min 1 MSK eksplan mulai MSK eksplan semakin m berwarna hijau dan p muncul nodul-nodul kalu ujung eksplan. Minggu nodul semakin menghijau ke-8 terbentuknya propag tunas berwarna hijau.
Kedua puluh ekspla laju pertumbuhan dan p yang sama. Eksplan membentuk nodul-nodul akhirnya berubah warna m dan mati (Gambar 3).
Gambar 3 Eksplan yang m kematian dan ber Fase multiplikasi Fase Subkultur ke-1
Setelah fase inisias minggu, eksplan disubku baru dengan komposisi ya subkultur ke-1) dan dilakukan 8 minggu lagi. Lampiran 9, terlih pembentukan tunas dan propagula yang tumbuh.
Pertumbuhan tunas y dengan kuncup yang berwarna hijau yang te
ontaminan yang rupa cendawan taminasi bakteri i. Kultur yang esis langsung angkan 4 kultur enesis tidak i, eksplan yang perkembangan inggunya. Pada i membesar, 2 membesar dan pada 4 MSK lus pada ujung-u ke-7 nodujung-ul- nodul-jau dan minggu agul dan tunas-lan mengalami perkembangan yang tidak ul bakal tunas menjadi cokelat
mengalami erwarna coklat.
iasi selama 8 kultur ke media yang sama (fase n pengamatan i. Pada Gambar rlihat proses dan akar dari .
yang ditandai g memanjang terbentuk dari
nodul-nodul. Tunas yang terb fase subkultur ke-1, merup adventif. Daun yang berukuran kecil dan berw Pembentukan akar dimulai pa ke-2, terlihat dengan ad adventif berwana putih pengamatan yang dilakuk minggu ke-8 terjadi peningka tunas, daun dan akar.
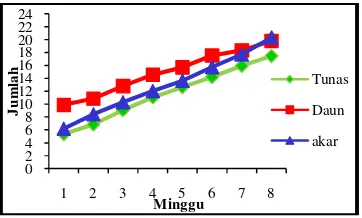
Gambar 4 Hasil rerata jum daun dan akar p keladi merah pada ke-1.
Gambar 4 menunjukk jumlah tunas, daun dan terbentuk pada fase subkultur rerata jumlah tunas dari 20 ku 8 MSK meningkat dari 2, 7,75 dan menunjukk pertumbuhan linier. Rerata ju pada minggu ke-1 yaitu 5,5 minggu ke-8 mencapai 14, hubungan antara pertumbu dengan daun yang berkorel Sama halnya dengan pertumb dan daun, pertumbuh menunjukkan pola pertumb masih meningkat pada 8 MSK Fase Subkultur ke-2
Pada fase multiplikasi (su 2) pengamatan dilakukan sela juga, terhitung setelah pemisahan planlet hasil subk Selama periode kultur, parameter terhadap jumlah t dan akar.
Pada Gambar Lampiran pertumbuhan planlet hasil su 2. Pertumbuhan tunas, daun
0 2 4 6 8 10 12 14 16 18
1 2 3 4 5 6 7
J u m la h Minggu 4 erbentuk pada upakan tunas terbentuk rwarna hijau. pada minggu adanya akar tih. Selama ukan hingga gkatan jumlah
jumlah tunas, pada kultur ada subkultur
kkan rerata n akar yang tur ke-1. Data kultur selama 2,15 menjadi kkan pola jumlah daun ,50 dan pada 4,4. Terlihat buhan tunas relasi positif. mbuhan tunas uhan akar buhan yang SK.
(subkultur ke-elama 8 MSK dilakukan bkultur ke-1. ur, diamati h tunas, daun an 10 terlihat subkultur ke-un, dan akar,
7 8
Tunas
mengalami peningkatan selama 8 minggu. Peningkatan tersebut sangat pesat bila dibandingkan dengan subkultur ke-1.
Gambar 5 Hasil rerata jumlah tunas, daun dan akar keladi merah pada subkultur ke-2.
Pertumbuhan tunas, daun dan akar pada fase subkultur ke-2 lebih besar dari pada subkultur ke-1. Hal ini terlihat dari hasil rerata parameter pada setiap fase subkultur. Jumlah akar pada setiap subkultur menunjukkan nilai rerata yang tertinggi pada minggu ke-8.
Aklimatisasi
Pada tahap aklimatisasi, planlet disungkup atau disimpan dalam ruangan gelap selama 2 minggu. Pada kondisiin vitro planlet diregenerasikan di dalam lingkungan dengan kelembabpan tinggi dan bersifat heterotrof, kemudian planlet harus berubah menjadi autotrof bila dipindahkan ke tanah dan lingkungan luar. Yang siap untuk diaklimatisasi adalah planlet dengan tinggi sekitar 5 cm, jumlah daun dan akar lebih dari 3. Pengukuran yang dilakukan pada saat tanaman akan diaklimatisasi dapat dilihat pada Tabel Lampiran 2 dan 3.
Planlet hasil aklimatisasi dari subkultur 1, diamati pada minggu ke-8 setelah dipindahkan ke lingkungan luar dapat dilihat pada Tabel Lampiran 4. Pengukuran terhadap parameter-parameter yang digunakan menunjukkan hasil yang bervariasi. Dalam hal ini, tanaman yang berhasil hidup setelah diaklimatisasi sekitar 86,7% dari 30 planlet. Sebagian planlet mengalami kematian pada minggu ke-2 yakni pada
nomor 16, 22, 25 dan 28. Hal ini disebabkan tanaman mengalami kekeringan dan pembusukan. Tabel Lampiran 5 memperlihatkan hasil aklimatisasi setelah subkultur ke-2 diamati pada minggu ke-8. Dari 35 planlet yang ditanam, 85,7% berhasil tumbuh dengan baik. Kematian planlet terjadi pada nomor 16, 24, 29, 31 dan 35. Kematian pada aklimatisasi ke-2 dengan sebab yang sama seperti planlet hasil subkultur ke-1.
Pengamatan terhadap bentuk dan warna daun dilakukan setelah tanaman berumur 2 bulan setelah aklimatisasi. Kontrol (Gambar 1) yang digunakan adalah indukan keladi merah yang diperoleh dari Laboratorium Unit Uji, Departemen Biologi, dan dijadikan sebagai pembanding untuk melihat variasi morfologi yang dihasilkan dari subkultur ke-1 dan ke-2.
Pada Gambar Lampiran 11 memperlihatkan ciri-ciri morfologi hasil subkultur ke-1 yang menunjukkan adanya perbedaan bila dibandingkan dengan kontrol. Dari 26 tanaman, diperoleh 5 tanaman yang mempunyai variasi bentuk dan warna yang berbeda. Hasil subkultur ke-2, dari 30 tanaman, dihasilkan 6 tanaman yang menunjukkan adanya variasi (Gambar Lampiran 12). Secara keseluruhan variasi bentuk dan warna daun hasil aklimatisasi subkultur ke-1 dan ke-2 tersaji pada Tabel Lampiran 6 dan 7.
PEMBAHASAN
Teknik kultur jaringan tanaman merupakan perbanyakan tanaman dengan cara mengambil jaringan mikro tanaman yang ditumbuhkan secara in vitro menjadi tanaman yang sempurna dalam jumlah yang tidak terbatas. Teknik ini didasarkan pada teori totipotensi sel. Totipotensi merupakan suatu fenomena dimana sel tanaman mempunyai kemampuan untuk beregenerasi menjadi tanaman utuh bila ditumbuhkan pada lingkungan yang cocok (Salisbury & Ross 1995). Keberhasilan penggunaan teknik kultur
0 2 4 6 8 10 12 14 16 18 20 22 24
1 2 3 4 5 6 7 8
6
jaringan sangat tergantung pada jenis eksplan yang dikulturkan, media yang digunakan dan lingkungan tumbuh dimana kultur ditumbuhkan (Gunawan 1988). Pemilihan eksplan berupa daun menggulung yang masih muda merupakan salah satu faktor penting yang menentukan keberhasilan teknik kultur jaringan. Pada daun yang menggulung jaringan meristematik masih aktif membelah diri, sehingga akan lebih mudah tumbuh. Selain itu eksplan dipilih yang mempunyai sifat morfologi dan fisiologi yang baik agar mendapat kultur yang baik pula. Roset dan Bokelman (1980) dalam Sutjahjo (1994), menyatakan bahwa eksplan yang berasal dari daun atau bagian daun memberikan keragaman genetik yang lebih besar daripada eksplan dari bagian tanaman lainnya. Menurut George & Sherrington (1984) sumber eksplan dapat mempengaruhi pertumbuhaan dan potensi morfogenetik. Untuk mendapatkan kalus atau organogenesis, lebih baik digunakan daun berikut tulang daunnya.
Organogenesis merupakan proses pembentukan organ dari jaringan eksplan. Organogenesis terjadi karena dipicu oleh beberapa hal, yaitu komponen yang terkandung pada media, faktor endogen selama eksplan mulai dikulturkan, serta senyawa manitol selama inisiasi eksplan (Fahey 1986). Regenerasi tanaman melalui jalur organogenesis langsung terjadi apabila tunas terbentuk dari potongan organ seperti daun, batang dan akar tanpa melalui kalus (Lestari & Yunita 2008). Fase Inisiasi
Eksplan yang dikulturkan sebanyak 30 dari satu induk tanaman. Kontaminan yang menyerang eksplan berupa cendawan dan bakteri, namun kontaminasi bakteri lebih banyak ditemui. Kontaminasi cendawan dan bakteri dapat berasal dari ruang kultur, permukaan eksplan, dan jaringan eksplan bagian dalam. Perkembangan eksplan sampai dengan terbentuknya tunas terjadi selama 8 minggu (Gambar
Tunas berkembang dari meristem apikal, sehingga tunas yang muncul akan berkembang membentuk suatu formasi daun. Pertumbuhan tunas dipengaruhi oleh faktor lingkungan yang menguntungkan bagi aktifitas enzim, auksin endogen, kofaktor dan sitokinin. Pertumbuhan daun terjadi bersamaan dengan pertumbuhan tunas. Menurut Widyastuti (2004) sitokinin merupakan suatu zat pengatur tumbuh sintetik yang tidak mudah dirombak oleh sistem enzim dari tanaman sehingga dapat memacu induksi dan multiplikasi tunas. Senyawa nitrogen yang terkandung dalam sitokinin berperan untuk proses sintesis asam-asam amino dan protein secara optimal yang selanjutnya digunakan untuk proses pertumbuhan dan perkembangan eksplan yang dalam hal ini pembentukan daun (Gardneret al.1991).
Setelah 8 MSK pada fase inisiasi, tunas yang tumbuh disubkultur dan diamati selama 8 minggu lagi. Pertumbuhan akar terjadi pada fase subkultur ke-1, yaitu pada 2 MSK dan mengalami peningkatan. Kenyataan ini diperkuat oleh pernyataan Rochiman dan Haryadi (1973), tunas yang berkembang akan menghasilkan auksin yang dapat merangsang pembentukan akar.
Fase Multiplikasi
Hasil subkultur ke-1 menunjukkan rata-rata jumlah tunas, jumlah daun dan jumlah akar berturut-turut yaitu 7,75; 14,4 dan 14,85. Hasil tersebut menunjukkan rata-rata pertumbuhan akar meningkat dengan pesat, sebanding dengan jumlah daun. Hal ini diduga, eksplan yang ditanam pada media kultur menghasilkan auksin endogen, yang menyebabkan pertumbuhan eksplan lebih diarahkan pada pemanjangan sel dan pembentukan akar. Ada pula beberapa tanaman yang tidak berespon terhadap zat pengatur tumbuh yang diberikan (faktor eksogen). Pendapat tersebut didukung oleh Ahmad et al. (2004) bahwa akar yang tumbuh pada media dengan hormon sitokinin yang
lebih tinggi dari pada auksin, kemungkinan diinduksi oleh faktor endogen. Menurut Gunawan (1988) bahwa interaksi antara zat pengatur tumbuh eksogen dan endogen menentukan arah perkembangan suatu kultur. Janick (1979), diacu dalam Ratna (2002) menegaskan bahwa pembentukan akar terjadi karena adanya pergerakan auksin ke bawah, karbohidrat dan rooting cofactor (zat-zat berinteraksi dengan auksin yang mengakibatkan terbentuknya akar).
Percobaan kedua, planlet yang belum mempunyai akar, hasil subkultur ke-1 dipindahkan ke dalam media baru dengan komposisi media yang sama. Hasil subkultur ke-2 menunjukkan rata-rata jumlah tunas, daun dan akar berturut-turut yaitu 17,45; 19,8 dan 20,35. Kecepatan multiplikasi tunas, nilai rerata jumlah tunas, nilai rerata jumlah daun, dan rerata jumlah helai daun mengalami peningkatan dua kali lipat dibandingkan subkultur ke-1. Hasil penelitian Pratiwi (2009) menunjukkan bahwa multiplikasi Anthurium plowmanii ada peningkatan jumlah tunas, daun dan akar lebih tinggi dibandingkan dengan subkultur ke-1. Hal ini dimungkinkan karena propagula yang dipindahkan sudah berbentuk planlet, sehingga kecepatan multiplikasi kuncup adventif yang berikutnya lebih tinggi dibanding yang masih berbentuk jaringan eksplan.
Aklimatisasi
8
aklimatisasi dapat disebabkan oleh faktor lingkungan yaitu, kelembaban udara dan intensitas cahaya. Kelembapan yang rendah dapat mengakibatkan kematian pada planlet. Hal ini karena planlet hasil kultur jaringan terbiasa hidup di lingkungan dengan kelembapan tinggi, sedangkan intensitas cahaya yang tinggi akan menyebabkan suhu lingkungan yang tinggi pula disertai dengan rendahnya kelembabpan udara (Zulkarnain 2009).
Menurut De Klerk (1990), terlihatnya perbedaan fenotipe tanaman merupakan salah satu cara memperkirakan ada atau tidaknya keragaman genetik. Fenomena variasi somaklonal ini dapat dilihat dari perubahan bentuk dan warna daun, serta bentuk daun. Dilihat dari Gambar Lampiran 11 dan 12, variasi yang terjadi dapat diduga sebagai keragaman somaklonal. Sumber eksplan merupakan faktor penting yang dapat mempengaruhi frekuensi terjadinya variasi, baik variasi fenotipe maupun genotipe (Karf 1995; Kumar 1995;Faried et al. 2006). Semakin tua suatu jaringan yang dikulturkan, semakin besar variasi yang ditimbulkan. Keragaman pada planlet disebabkan oleh adanya sel-sel yang bermutasi atau variasi polisomik dari jaringan tertentu (Thorpe 1990).
Keragamaan genetik yang terjadi di dalam kultur jaringan bisa disebabkan oleh perubahan struktur kromosom, penggandaan jumlah kromosom dan perubahan gen (Anthony et al. 2000). Menurut Karf (1995), banyak bukti menunjukkan variasi somaklonal dipengaruhi oleh zat pengatur tumbuh, terutama pada konsentrasi tinggi dalam media. Kemungkinan zat pengatur tumbuh tersebut bertindak sebagai mutagen. Konsentrasi garam-garam nutrien yang tinggi seperti kalsium dan EDTA pada media kultur juga meningkatkan ketidaknormalan kromosom pada kultur sel (Kumar 1995). Selanjutnya konsentrasi sukrosa tinggi dapat menginduksi poliploidisasi sel yang akan menghasilkan keragaman
genetik yang dapat memproduksi varietas baru dengan karakter fisik dan fenotipe tertentu, seperti perubahan performa pertumbuhan, warna bunga, peningkatan ukuran dan daya adaptasi. Poliploidisasi tersebut akibat peristiwa nondisjunction (segregasi yang tidak normal dari kromosom pada saat meiosis atau mitosis) sehingga terjadi peningkatan ukuran sel dan jaringan tanaman termasuk perubahan bentuk dan warna. Variasi juga dapat ditimbulkan oleh ketidakseimbangan gen atau tidak sempurnanya kromosom.
SIMPULAN
Kultur jaringan keladi merah sudah menghasilkan variasi somaklonal setelah 16 MSK. Subkultur ke-1 menghasilkan 5 tanaman sedangkan subkultur ke-2 memberikan 6 tanaman yang bervariasi secara fenotipik.
SARAN
Perlu dilakukan penelitian lebih lanjut tentang variasi yang ditimbulkan pada proses multiplikasi sehingga dapat menghasilkan keragaman yang memiliki nilai jual yang tinggi. Perlu pula dilakukan deteksi genetik terhadap variasi tersebut sehingga bisa mengetahui penyebab dari keragaman yang ditimbulkan.
DAFTAR PUSTAKA
Aisyah S. 2000. Perakitan baru Artemisia (Artemisia annua. L) melalui induksi dan keragaman somaklonal.[skripsi]. Bogor. Institut Pertanian Bogor, Fakultas Pertanian. Ahmad EU, Hayashi. T, Yazawa S. 2004. Auxins increase the occurrence of leaf-colour variants in Caladium regenerated from leaf explants.Sci Hort100: 153–171. Ali A, A. Munawar, S. Naz. 2007. Anin
aklimatisasi dapat disebabkan oleh faktor lingkungan yaitu, kelembaban udara dan intensitas cahaya. Kelembapan yang rendah dapat mengakibatkan kematian pada planlet. Hal ini karena planlet hasil kultur jaringan terbiasa hidup di lingkungan dengan kelembapan tinggi, sedangkan intensitas cahaya yang tinggi akan menyebabkan suhu lingkungan yang tinggi pula disertai dengan rendahnya kelembabpan udara (Zulkarnain 2009).
Menurut De Klerk (1990), terlihatnya perbedaan fenotipe tanaman merupakan salah satu cara memperkirakan ada atau tidaknya keragaman genetik. Fenomena variasi somaklonal ini dapat dilihat dari perubahan bentuk dan warna daun, serta bentuk daun. Dilihat dari Gambar Lampiran 11 dan 12, variasi yang terjadi dapat diduga sebagai keragaman somaklonal. Sumber eksplan merupakan faktor penting yang dapat mempengaruhi frekuensi terjadinya variasi, baik variasi fenotipe maupun genotipe (Karf 1995; Kumar 1995;Faried et al. 2006). Semakin tua suatu jaringan yang dikulturkan, semakin besar variasi yang ditimbulkan. Keragaman pada planlet disebabkan oleh adanya sel-sel yang bermutasi atau variasi polisomik dari jaringan tertentu (Thorpe 1990).
Keragamaan genetik yang terjadi di dalam kultur jaringan bisa disebabkan oleh perubahan struktur kromosom, penggandaan jumlah kromosom dan perubahan gen (Anthony et al. 2000). Menurut Karf (1995), banyak bukti menunjukkan variasi somaklonal dipengaruhi oleh zat pengatur tumbuh, terutama pada konsentrasi tinggi dalam media. Kemungkinan zat pengatur tumbuh tersebut bertindak sebagai mutagen. Konsentrasi garam-garam nutrien yang tinggi seperti kalsium dan EDTA pada media kultur juga meningkatkan ketidaknormalan kromosom pada kultur sel (Kumar 1995). Selanjutnya konsentrasi sukrosa tinggi dapat menginduksi poliploidisasi sel yang akan menghasilkan keragaman
genetik yang dapat memproduksi varietas baru dengan karakter fisik dan fenotipe tertentu, seperti perubahan performa pertumbuhan, warna bunga, peningkatan ukuran dan daya adaptasi. Poliploidisasi tersebut akibat peristiwa nondisjunction (segregasi yang tidak normal dari kromosom pada saat meiosis atau mitosis) sehingga terjadi peningkatan ukuran sel dan jaringan tanaman termasuk perubahan bentuk dan warna. Variasi juga dapat ditimbulkan oleh ketidakseimbangan gen atau tidak sempurnanya kromosom.
SIMPULAN
Kultur jaringan keladi merah sudah menghasilkan variasi somaklonal setelah 16 MSK. Subkultur ke-1 menghasilkan 5 tanaman sedangkan subkultur ke-2 memberikan 6 tanaman yang bervariasi secara fenotipik.
SARAN
Perlu dilakukan penelitian lebih lanjut tentang variasi yang ditimbulkan pada proses multiplikasi sehingga dapat menghasilkan keragaman yang memiliki nilai jual yang tinggi. Perlu pula dilakukan deteksi genetik terhadap variasi tersebut sehingga bisa mengetahui penyebab dari keragaman yang ditimbulkan.
DAFTAR PUSTAKA
Aisyah S. 2000. Perakitan baru Artemisia (Artemisia annua. L) melalui induksi dan keragaman somaklonal.[skripsi]. Bogor. Institut Pertanian Bogor, Fakultas Pertanian. Ahmad EU, Hayashi. T, Yazawa S. 2004. Auxins increase the occurrence of leaf-colour variants in Caladium regenerated from leaf explants.Sci Hort100: 153–171. Ali A, A. Munawar, S. Naz. 2007. Anin
STUDI VARIASI FENOTIPIK KELADI MERAH
(Caladium bicolor(W. Aint)Vent.) HASIL KULTUR JARINGAN
MELIANA ROSMADEWI SUNARYA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Journal of Agriculture and Biology 5:731-735.
Anthony JF Griffiths, Jeffrey H. Miller, David T. Suzuki, Richard C. Lewontin, William M. Gelbart. 2000. An Introduction to Genetic Analysis, W.H. 12 Freeman and Company, New York.
Deng Z, BK. Harbaugh. 2006. ’Garden White’-A large white fancy-leaved Caladium for sunny landscapes and large containers. Hort Sci 41: 840– 844.
Deng ZJ, F. Goktepe, B. Harbaugh. 2007. Assessment of genetic diversity and relationships among Caladium cultivars and species using molecular markers J. American Soc Hort Sci 132: 147– 277.
De Klerk 1990. How to measure somaclonal variation. Act Bot Neerland39 :129-144.
Fahey JW, J.N Reed, TL Ready, GM Pace. 1986. Somatic embryogenesis from three commercially important inbreds of Zea mays. Plant Cell Reports5:35-38.
Faried MD, Yunus M, Nasrudin. 2006. Variasi somaklonal tebu tahan salinitas melalui mutagenesis in vitro.J Agrivivor5 (3) : 247-258. Gardner FP, RB Pearce, RL Mitchell.
1991.Fisiologi Tanaman Budidaya. Herawati S, penerjemah. Jakarta. UI Press.
Geier T. 1986. Factors affecting plant regeneration for leaf segments of Anthurium sccherzerianum Schott. (Araceae) cultured in vitro. Plant Cell, Tissue Organ Culture.6 : 115-125.
George EF, PD Sherrington. 1984.Plant Propagation by Tissue Culture. Exengetics Limited. England.
Gill RIS,SS Gill, SS Gosal, 1994. Vegetative propagation of Eucalyptus tereticornis Sm. Through tissue culture, Plant tissue culture. Bangladesh Association for Plant Tissue Culture 4: 59–67. Gunawan LW. 1988. Teknik Kultur
Jaringan. Laboratorium Kultur Jaringan Tanaman Pusat Antar Universitas (PAU) Biotek IPB, Bogor.
Hadipoentyanti E, Amalia, Nursalam, Hartati SY, Suhesti S. 2008. Perakitan Varietas Untuk Ketahanan Nilam Terhadap Penyakit Layu Bakteri. Di dalam: Industri Minyak Atsiri yang Berkelanjutan: Peluang dan Tantangan. Prosiding Konferensi Nasional Minyak Atsiri 2008; Surabaya, 2-4 Desember 2008. Surabaya: Departemen Perindustrian. hlm 17-28.
Hartman RD. 1974. Dasheen mosaic virus and other phytopathogens eliminated fromCaladium, taro and cocoyam by culture of shoot tips. New Phytol64: 237–246.
Karf A. 1995. Somaclonal variation as tool for crop improvement. Euphytica85: 295-302.
Kumar A. 1995. Somaclonal Variation. Cell and Molecular Ganetics Departemen, Scottish Crop Research Institute, Invergowrie Dudee. Canada.
Larkin PJ, Scowcroft WR. 1981. Somaclonal variation-a novel source of variability from cell culture for plant improvement. Theor Appl Gen. 60:197-214. Lestari GE, Yunita R. 2008. Induksi
10
Lecouffe M. 1981.Caladium humboldtii and it's cultivar 'Marcel'.Aroideana, 4: 114–119
Podwyszynska M. 2005. Somaclonal variaton in micropropagated Tulip based on phenotype observation. J. Frutt Otman13: 109-122.
Pratiwi I. 2009. Pengaruh Jenis Media Dasar dan Kinetin untuk Induksi Organogenesis Anthurium Gelombang Cinta (Anthurium plowmanii) SecaraIn Vitro.[skripsi]. Bogor. Institut Pertanian Bogor, Fakultas Pertanian.
Prihmantoro. 1997. Tanaman Hias Daun. Cetakan Pertama. Jakarta: Penebar Swadaya.
Ratna N. 2002. Pengaruh Auksin dan Pemanasan Terhadap Pertumbuhan Stek Tanaman Mawar.[skripsi]. Bogor. Institut Pertanian Bogor, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Rianawati S, Agus P, Budi M, Ridho K, Suryanah. 2009. Embriogenesis somatik dari eksplan daun anggrek Phalaenopsissp. L.J Agron 3:240-248.
Rochiman K, Haryadi DD. 1973. Pembiakan Vegetatif. Bogor: Institut Pertanian Bogor Fakultas Pertanian Depatemen Agronomi dan Hortikultura.
Santoso U, Nursandi F. 2003. Kultur Jaringan Tanaman. Universitas Muhammadiyah Malang Press. Malang.
Salisbury FB, Ross CW.1995. Fisiologi Tanaman. Diah RL, Sumaryono, penerjemah. Jilid ke-1&3. Bandung: Penerbit ITB. Terjemahan dari: Plant Physiol.
Sutjahjo TA. 1994. Induksi keragaman somaklon kearah ketenggangan terhadap keracunan alumunium pada
tanaman jagung.[disertasi]. Bogor. Program Pascasarjana, Institut Pertanian Bogor.
Taji AM, Dodd WA, Williams RR. 1992. Plant Tissue Culture Preactice. Botany Departemen, Univercity New England, Armidale.
Thorpe TA. 1990. The current status of plant tissue culture. P.1-33. In SS Bhojwani (ed).Plant Tissue Culture: Applications and Limitations. Elsevier Sci. Publishers. Amsterdam .New York.
Widyastuti N. 2004. Abnormalitas Pertumbuhan dan Morfogenesis
Pada Planlet Krisan
(Chrysanthemum morifolium) dan Kalalili (Zantedeschia rehmannii) dalam Kultur In Vitro. Pusat Pengkajian Dan Penerapan Teknologi Bioindustri, Badan Pengkajian Dan Penerapan Teknologi, Jakarta.
MELIANA ROSMADEWI SUNARYA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
ABSTRAK
MELIANA. Studi Variasi Fenotipik Keladi Merah (Caladium bicolor(W.Aint)Vent) Hasil Kultur Jaringan. Dibimbing olehDIAH RATNADEWIdanEDHI SANDRA.
Keladi merah (Caladium bicolor(W.Aint)Vent.) Blume) merupakan salah satu jenis tanaman hias daun. Secara konvensional, tanaman ini diperbanyak secara vegetatif sehingga pembentukan genotipe-genotipe baru tergolong sempit. Upaya peningkatan ragam genetik dilakukan dengan variasi somaklonal yaitu melalui organogenesisin vitro. Penelitian ini bertujuan untuk mengidentifikasi variasi fenotipik keladi merah hasil variasi somaklonal dari kultur jaringan. Bahan tanaman yang digunakan adalah daun muda tanaman keladi merah. Media dasar yang digunakan adalah Murashige and Skoog (MS) yang ditambahkan BAP 10 mg/l dan NAA 0,5 mg/l. Penelitian terdiri dari 3 tahap yaitu inisiasi, multiplikasi dan aklimatisasi. Pada tahap inisiasi eksplan membentuk tunas pada 8 MSK. Tahap multiplikasi dilakukan 2 kali dengan interval waktu 2 bulan; jumlah akar menunjukkan nilai yang tinggi dibandingkan rerata jumlah daun dan tunas. Pada tahap aklimatisasi parameter yang diamati adalah karakter morfologi dan warna daun pada umur dua bulan setelah diaklimatisasi. Hasil penelitian menunjukkan bahwa secara visual tanaman hasil multiplikasi memiliki karakter morfologi yang berbeda dengan tanaman induknya. Dari hasil subkultur ke-1 diperoleh 5 tanaman sedangkan subkultur ke-2 diperoleh 6 tanaman yang bervariasi.
Kata kunci :Caladium bicolor(W. Aint)Vent, Kultur jaringan, Variasi morfologi.
ABSTRACT
MELIANA. Study of Phenotypic Variation of Wild Cocoyam (Caladium bicolor (W.Aint)Vent) Resulted from Tissue Cultures. Supervised byDIAH RATNADEWIand EDHI SANDRA.
Wild cocoyam (Caladium bicolor(W.Aint)Vent) Blume) is one of the ornamental leaf plants. Conventionally,this plant reproduces vegetatively. So, the generation of new genotypes is rare. Effort to increase genetic variation of plant was conducted through somaclonal variation in in vitro culture. The research goal is to identify the phenotypic variation of wild cocoyam from tissue culture due to somaclonal variation. Young leaves were taken as the plant material. Murashige and Skoog (MS) medium added with BAP 10 mg/l and NAA 0,5 mg/l used as the basic medium. The research had three steps: initiation, multiplication and acclimatization which was done 2 times in time 2 month interval. Roots were more abundant than the average number of leaves and buds. While at the acclimatization step, morphological characters of leaves was observed at the age of 2 months after being acclimatized. The visual results of this research showed that regenerated plants have morphological characters that were different fromit’s parent. The first subculture gained 5 plants while the second subculture gained 6 plants with phenotypic variation.
MELIANA ROSMADEWI SUNARYA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sajana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Studi Variasi Fenotifik Keladi Merah (Caladium bicolor(W. Aint)Vent.) Hasil Kultur Jaringan.
Nama : Meliana Rosmadewi Sunarya
NIM : G34070023
Menyetujui
Pembimbing I Pembimbing II
Dr.Ir Diah Ratnadewi Ir. Edhi Sandra M, Si
NIP 195703261981032001 NIP 196610191993031002
Diketahui
Dr. Ir. Ence Darmo Jaya Supena, M.Si NIP 196410021989031002
rahmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Skripsi yang berjudul “Studi Variasi Fenotifik Keladi Merah (Caladium bicolor (W.Aint) Vent.) Hasil Kultur Jaringan” disusun untuk suatu syarat memperoleh gelar sarjana bidang Biologi di Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Ibu Dr.Ir.Diah Ratnadewi dan Bapak Ir.Edhi Sandra, M.Si selaku pembimbing serta Ucu Riyantini Maulida S.Si, M.Si dan staf Laboratorium Kultur Jaringan Unit Uji Departemen Biologi atas saran yang telah diberikan.
Ungkapan terimakasih juga disampaikan kepada ayahanda, ibunda, kakak-kakakku, serta seluruh keluarga, atas doa dan kasih sayangnya. Disamping itu, penghargaan penulis sampaikan kepada Dian Arizona S.Hut atas dukungan, do’a dan kasih sayang yang diberikan. Teman-teman seperjuangan Biologi 44, Dini, Desi, Ovi, Wardud, Kemala, Yana atas kasih sayang yang telah kalian berikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2011
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 12 Mei 1990 di Sumedang, Jawa Barat dari pasangan Bapak Ade Sunarya dan Ibu Asih Sukaesih. Penulis merupakan anak ketiga dari tiga bersaudara. Penulis mengawali pendidikan di SDN Malati tahun 1995-2001. Selanjutnya di SMPN 2 Sumedang tahun 2001-2004 dan pendidikan menengah atas di SMAN 2 Sumedang tahun 2004-2007. Pada tahun 2007 diterima sebagai mahasiswa Institut Pertanian Bogor melalui jalur Undangan Siswa Masuk IPB (USMI). Pada Tahun 2007 penulis diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
DAFTAR GAMBAR... iii DAFTAR LAMPIRAN... iii PENDAHULUAN
Latar Belakang ... 1 Tujuan Penelitian ... 2 METODOLOGI PENELITIAN
Waktu dan Tempat ... 2 Bahan dan Alat... 2 Metode Penelitian ... 2 Pemilihan eksplan... 2 Pembuatan media... 2 Sterilisasi alat dan eksplan... 3 Fase inisiasi dan multiplikasi... 3 Pemeliharaan kultur... 3 Aklimatisasi... 3 Pengamatan... 3 HASIL
Fase Inisiasi... 3 Fase Multiplikasi... 4 Fase subkultur ke-1 ... 4 Fase subkultur ke-2 ... 4 Aklimatisasi ... 5
PEMBAHASAN
DAFTAR GAMBAR
Halaman 1. Indukan tanaman keladi merah ... 2 2. Daun menggulung yang digunakan sebagai eksplan ... 2 3. Eksplan yang mengalami kematian dan berwarna coklat ... 4 4. Hasil rerata jumlah tunas, daun dan akar pada kultur keladi merah pada
subkultur ke-1 ... 4 5. Hasil rerata jumlah tunas, daun dan akar pada kultur keladi merah pada
subkultur ke-2 ... 5
DAFTAR LAMPIRAN
Halaman 1 Tabel Komposisi medium Murashige and Skoog (1965)... 12 2 Tabel Berbagai parameter pertumbuhan tanaman saat sebelum subkultur
ke-1 dalam media aklimatisasi ... 13 3 Tabel Berbagai parameter pertumbuhan tanaman saat sebelum subkultur
4 ke-2 dalam media aklimatisasi ... 14 5 Tabel Hasil aklimatisasi keladi merah dari subkultur ke-1, diamati pada
minggu ke-8 setelah aklimatisasi ... 15 6 Tabel Hasil aklimatisasi keladi merah dari subkultur ke-2, diamati pada
minggu ke-8 setelah aklimatisasi ... 16 7 Tabel Variasi tampilan morfologi keladi merah hasil subkultur ke-1... 17 8 Tabel Variasi tampilan morfologi keladi merah hasil subkultur ke-2... 18 9 Gambar Kondisi eksplan pada tahap inisiasi dari 1 MSK sampai 8 MSK.... 19 10 Gambar Penampakan kultur dari 1 MSK sampai 8 MSK di fase subkultur
ke-1 ... 20 11 Gambar Penampakan kultur dari 1 MSK sampai 8 MSK di fase subkultur
Keladi merah (Caladium bicolor (W.Aint) Vent) merupakan salah satu jenis tanaman hias dilihat dari bentuk dan warna daunnya. Daun Caladium mempunyai ukuran dan warna yang bervariasi. Batang berbentuk bulat dan membentuk umbi di bagian bawah permukaan tanah. Bunganya berbentuk bulat memanjang dan tertutup oleh seludang yang dimanfaatkan untuk tempat perkembangbiakan (Prihmantoro 1997). Bentuk dan keindahan warna daunnya membuat tanaman ini sangat cocok untuk tanaman lanskap dan tanaman pot (Deng dan Harbaugh 2006). Caladium berasal dari Amerika Selatan terutama di daerah yang beriklim tropika dan dijadikan sebagai sumber pendapatan. Warna daunCaladiumyang indah serta perawatannya yang mudah dan tahan lama menyebabkan permintaan akan jenis tanaman ini meningkat (Aliet al. 2007).
Pada umumnya Caladium
diperbanyak dengan umbinya. Perbanyakan dengan cara tersebut menyebabkan kecilnya peluang pembentukan genotipe-genotipe baru, produksi bibit dihasilkan dalam waktu yang lama serta menjadi rentan terhadap hama dan penyakit (Gill et al. 1994; Deng et al. 2007). Maka dibutuhkan produksi benih tanaman Caladium secara lebih cepat, serta bebas dari hama dan penyakit. Salah satu teknik yang digunakan untuk mengatasi permasalahan tersebut adalah dengan perbanyakan melalui kultur jaringan.
Perbanyakan in vitro dapat dilakukan dengan menggunakan dua cara yaitu melalui organogenesis dan embriogenesis. Organogenesis adalah suatu proses untuk membentuk dan menumbuhkan tunas dari jaringan meristematik. Regenerasi eksplan menjadi organ dan planlet dapat diperoleh melalui jalur organogenesis langsung dan tidak langsung. Organogenesis langsung yaitu eksplan
langsung menumbuhkan sel
organogenesis tidak langsung terjadi pembentukan kalus terlebih dahulu (Hadipoentyanti et al. 2008). Embriogenesis merupakan proses perkembangan sel vegetatif atau sel-sel somatik yang diperoleh dari berbagai sumber eksplan (Zulkarnain 2009). Dalam penelitian ini proses kultur jaringan akan dilakukan melalui organogenesis langsung yaitu dengan induksi tunas.
Kelebihan dari teknik kultur jaringan tanaman adalah dapat juga menghasilkan keanekaragaman fenotipe. Pada tanaman hias, hal itu justru seringkali diharapkan dan memiliki nilai jual yang tinggi. Keanekaragaman fenotipe yang timbul dari proses mikropropagasi disebut keragaman somaklonal. Keragaman somaklonal dapat muncul akibat faktor fisiologis, faktor biokimia, faktor genetik tanaman, atau oleh faktor lingkungan (Larkin dan Scowcroft 1981). Fenomena variasi somaklonal tersebut dapat ditunjukkan dengan adanya daun tanaman yang mengalami albino, tanaman menjadi kerdil (pendek), perubahan bentuk dan warna daun, batang, bunga, ukuran umbi, ketajaman dan variasi daun (Kumar 1995).
memiliki keunggulan-keu pada tanaman asalnya. B dilakukan oleh para p menghasilkan keragaman tanaman; diantaranya den zat pengatur tumbuh menggunakan sinar gamm ini, menggunakan zat pen konsentrasi tinggi dan menggulung keladi merah variasi yang ditimbulkan. Tujuan
Penelitian ini bert mengidentifikasi variasi fe merah (Caladium bicolo Vent.) hasil variasi som kultur jaringan.
METODOLOGI PEN Waktu dan Tempat
Penelitian dilaksanaka Oktober 2010 hingga bertempat di Laborato Jaringan Departemen Bio Matematika dan Ilmu Alam, Institut Pertanian Bo Alat dan Bahan
Alat yang diguna timbangan, erlenmeyer, pip ukur, pengaduk, botol st alumunium foil, pinset, gu Laminar Air Flow Cab cawan petri,plastik wrap.
Bahan yang digun tanaman keladi merah (Ga diambil dari Laborato Jaringan Unit Uji, Departe
Gambar 1 Indukan tan merah.
eunggulan dari . Berbagai cara peneliti untuk an pada suatu engan perlakuan h kuat atau mma. Penelitian engatur tumbuh eksplan daun ah untuk melihat
.
ertujuan untuk fenotipik keladi olor (W. Ait) omaklonal dari
NELITIAN
kan pada bulan a Mei 2011 atorium Kultur iologi, Fakultas u Pengetahuan Bogor.
nakan adalah , pipet ukur, gelas steril, autoklaf, gunting, bunsen, abinet (LAFC), p.
unakan adalah Gambar 1) yang torium Kultur rtemen Biologi.
tanaman keladi
Media MS (Murashige a (Tabel Lampiran Benzylaminopurine (BA naphthalenacetic acid (NA untuk sterilisasi (deterjen (5,25% NaClO) 5% dan 2,5% g/l, Dithane M-45 1 g/l da steril.
Metode
Pemilihan eksplan
Eksplan yang digunak daun muda yang masih m berumur 1 minggu dan ter hama dan penyakit.
Gambar 2 Daun menggulun digunakan sebaga Pembuatan media
Botol yang digunak penyimpanan kultur adalah dengan ukuran 200 ml. Botol disterilkan terlebih dahulu me autoklaf selama ± 20 menit 121°C. Selanjutnya adalah media MS menggunak Erlenmeyer 1000 ml. La makro, hara mikro, vitami dicampurkan hingga rata, ditambahkan ZPT BAP 10 NAA 0,5 mg/l. Campur tersebut kemudian menggunakan aquades hingg l. Setelah itu, pH larutan diu pH meter hingga pada kisar Tahap selanjutnya adalah agar sebanyak 8 g/l, kemud media dididihkan. Media dit dalam botol kultur mas sebanyak 25 ml. Botol yang media lalu disterilkan dala selama 20 menit pada suhu
2
e and Skoog)
1),
6-AP), α -AA), bahan jen, Bayclin ,5%, Agrept 1 dan aquades
akan adalah menggulung terbebas dari
lung yang agai eksplan.
tekanan 17,5 psi. Setelah itu, media disimpan selama 3 hari pada suhu ruangan, untuk memastikan ada tidaknya kontaminasi pada media tersebut.
Sterilisasi Alat dan Eksplan
Sterilisasi botol, cawan petri, alat-alat diseksi dilakukan dengan menggunakan autoklaf pada tekanan 17,5 psi pada suhu 121ºC selama 30 menit. Mula-mula bahan eksplan dicuci menggunakan air kran selama 15 menit, lalu dipotong selebar ± 5 cm, selanjutnya direndam didalam deterjen selama 5-7 menit, lalu dibilas dengan air kran.
Tahap selanjutnya dilakukan di dalam LAFC (Laminar Air Flow Cabinet) secara aseptik. Potongan-potongan daun direndam dalam bakterisida (Agrept 1 g/l) selama 30 menit, kemudian dalam fungisida (Dithane 1 g/l) selama 15 menit, selanjutnya dibilas hingga bersih dengan aquades steril. Eksplan dipindahkan ke dalam botol kultur steril. Selanjutnya dilakukan sterilisasi bertingkat dengan Bayclin (5,25% NaClO) sebanyak 5% selama 10 menit dan 2,5% selama 5 menit. Setiap penggantian bahan sterilan, dilakukan pembilasan dengan aquades steril sebanyak 3 kali. Eksplan yang telah disterilkan dipotong sepanjang 1 cm dan ditanam dalam media yang telah disiapkan.
Fase Inisiasi dan Multiplikasi
Penanaman dilakukan secara aseptik di LAFC. Tahap inisiasi menggunakan zat pengatur tumbuh BAP 10 mg/l yang dikombinasikan dengan NAA 0,5 mg/l. Pada tahap multiplikasi dilakukan pemisahan propagul dan ditanam dalam media dengan komposisi yang sama. Hal tersebut dilakukan sebanyak 2 kali, subkultur ke-1 dan subkultur ke-2 dengan interval waktu 2 bulan.
Pemeliharaan kultur
Kultur disimpan pada ruangan dengan suhu 25°C, intensitas cahaya sebesar 1000 Lux selama 16 jam/hari.
Aklimatisasi
Planlet dari subkultur ke-1 dan ke-2 dikeluarkan dari botol kultur untuk diaklimatisasi. Planlet yang diaklimatisasi adalah mempunyai tinggi ± 5 cm, jumlah akar dan daun lebih dari 3. Aklimatisasi dilakukan dengan menggunakan tanah, sekam dan pupuk kompos dengan perbandingan 1:1:1 dalam polybag. Planlet dicuci bersih dengan menggunakan air kran, agar media tidak menempel pada planlet. Selanjutnya pot disimpan dengan penyungkupan selama 2 minggu, kemudian secara berangsur-angsur sungkup dibuka.
Pengamatan
Pengamatan awal dilakukan 3-4 hari setelah pengkulturan untuk melihat kemungkinan terjadinya kontaminasi. Pengamatan selanjutnya dilakukan dalam 2 tahap, yaitu:
a. Pengamatan di laboratorium meliputi saat muncul tunas, jumlah tunas, saat muncul daun, jumlah daun, saat muncul akar dan jumlah akar, yang diamati seminggu sekali selama 7 minggu.
b.Pengamatan di fase aklimatisasi meliputi parameter ketahanan hidup, tinggi tanaman, panjang daun, lebar daun, jumlah daun, warna dan bentuk daun.
HASIL Fase Inisiasi
kultur mencapai 33%. Kon menyerang eksplan beru dan bakteri, namun konta lebih banyak ditemui. mengalami organogenes sebanyak 16 kultur. Sedan mengalami organogen langsung.
Selama fase inisiasi, ditanam mengalami p morfologi pada setiap min 1 MSK eksplan mulai MSK eksplan semakin m berwarna hijau dan p muncul nodul-nodul kalu ujung eksplan. Minggu nodul semakin menghijau ke-8 terbentuknya propag tunas berwarna hijau.
Kedua puluh ekspla laju pertumbuhan dan p yang sama. Eksplan membentuk nodul-nodul akhirnya berubah warna m dan mati (Gambar 3).
Gambar 3 Eksplan yang m kematian dan ber Fase multiplikasi Fase Subkultur ke-1
Setelah fase inisias minggu, eksplan disubku baru dengan komposisi ya subkultur ke-1) dan dilakukan 8 minggu lagi. Lampiran 9, terlih pembentukan tunas dan propagula yang tumbuh.
Pertumbuhan tunas y dengan kuncup yang berwarna hijau yang te
ontaminan yang rupa cendawan taminasi bakteri i. Kultur yang esis langsung angkan 4 kultur enesis tidak i, eksplan yang perkembangan inggunya. Pada i membesar, 2 membesar dan pada 4 MSK lus pada ujung-u ke-7 nodujung-ul- nodul-jau dan minggu agul dan tunas-lan mengalami perkembangan yang tidak ul bakal tunas menjadi cokelat
mengalami erwarna coklat.
iasi selama 8 kultur ke media yang sama (fase n pengamatan i. Pada Gambar rlihat proses dan akar dari .
yang ditandai g memanjang terbentuk dari
nodul-nodul. Tunas yang terb fase subkultur ke-1, merup adventif. Daun yang berukuran kecil dan berw Pembentukan akar dimulai pa ke-2, terlihat dengan ad adventif berwana putih pengamatan yang dilakuk minggu ke-8 terjadi peningka tunas, daun dan akar.
Gambar 4 Hasil rerata jum daun dan akar p keladi merah pada ke-1.
Gambar 4 menunjukk jumlah tunas, daun dan terbentuk pada fase subkultur rerata jumlah tunas dari 20 ku 8 MSK meningkat dari 2, 7,75 dan menunjukk pertumbuhan linier. Rerata ju pada minggu ke-1 yaitu 5,5 minggu ke-8 mencapai 14, hubungan antara pertumbu dengan daun yang berkorel Sama halnya dengan pertumb dan daun, pertumbuh menunjukkan pola pertumb masih meningkat pada 8 MSK Fase Subkultur ke-2
Pada fase multiplikasi (su 2) pengamatan dilakukan sela juga, terhitung setelah pemisahan planlet hasil subk Selama periode kultur, parameter terhadap jumlah t dan akar.
Pada Gambar Lampiran pertumbuhan planlet hasil su 2. Pertumbuhan tunas, daun
0 2 4 6 8 10 12 14 16 18
1 2 3 4 5 6 7
J u m la h Minggu 4 erbentuk pada upakan tunas terbentuk rwarna hijau. pada minggu adanya akar tih. Selama ukan hingga gkatan jumlah
jumlah tunas, pada kultur ada subkultur
kkan rerata n akar yang tur ke-1. Data kultur selama 2,15 menjadi kkan pola jumlah daun ,50 dan pada 4,4. Terlihat buhan tunas relasi positif. mbuhan tunas uhan akar buhan yang SK.
(subkultur ke-elama 8 MSK dilakukan bkultur ke-1. ur, diamati h tunas, daun an 10 terlihat subkultur ke-un, dan akar,
7 8
Tunas
mengalami peningkatan selama 8 minggu. Peningkatan tersebut sangat pesat bila dibandingkan dengan subkultur ke-1.
Gambar 5 Hasil rerata jumlah tunas, daun dan akar keladi merah pada subkultur ke-2.
Pertumbuhan tunas, daun dan akar pada fase subkultur ke-2 lebih besar dari pada subkultur ke-1. Hal ini terlihat dari hasil rerata parameter pada setiap fase subkultur. Jumlah akar pada setiap subkultur menunjukkan nilai rerata yang tertinggi pada minggu ke-8.
Aklimatisasi
Pada tahap aklimatisasi, planlet disungkup atau disimpan dalam ruangan gelap selama 2 minggu. Pada kondisiin vitro planlet diregenerasikan di dalam lingkungan dengan kelembabpan tinggi dan bersifat heterotrof, kemudian planlet harus berubah menjadi autotrof bila dipindahkan ke tanah dan lingkungan luar. Yang siap untuk diaklimatisasi adalah planlet dengan tinggi sekitar 5 cm, jumlah daun dan akar lebih dari 3. Pengukuran yang dilakukan pada saat tanaman akan diaklimatisasi dapat dilihat pada Tabel Lampiran 2 dan 3.
Planlet hasil aklimatisasi dari subkultur 1, diamati pada minggu ke-8 setelah dipindahkan ke lingkungan luar dapat dilihat pada Tabel Lampiran 4. Pengukuran terhadap parameter-parameter yang digunakan menunjukkan hasil yang bervariasi. Dalam hal ini, tanaman yang berhasil hidup setelah diaklimatisasi sekitar 86,7% dari 30 planlet. Sebagian planlet mengalami kematian pada minggu ke-2 yakni pada
nomor 16, 22, 25 dan 28. Hal ini disebabkan tanaman mengalami kekeringan dan pembusukan. Tabel Lampiran 5 memperlihatkan hasil aklimatisasi setelah subkultur ke-2 diamati pada minggu ke-8. Dari 35 planlet yang ditanam, 85,7% berhasil tumbuh dengan baik. Kematian planlet terjadi pada nomor 16, 24, 29, 31 dan 35. Kematian pada aklimatisasi ke-2 dengan sebab yang sama seperti planlet hasil subkultur ke-1.
Pengamatan terhadap bentuk dan warna daun dilakukan setelah tanaman berumur 2 bulan setelah aklimatisasi. Kontrol (Gambar 1) yang digunakan adalah indukan keladi merah yang diperoleh dari Laboratorium Unit Uji, Departemen Biologi, dan dijadikan sebagai pembanding untuk melihat variasi morfologi yang dihasilkan dari subkultur ke-1 dan ke-2.
Pada Gambar Lampiran 11 memperlihatkan ciri-ciri morfologi hasil subkultur ke-1 yang menunjukkan adanya perbedaan bila dibandingkan dengan kontrol. Dari 26 tanaman, diperoleh 5 tanaman yang mempunyai variasi bentuk dan warna yang berbeda. Hasil subkultur ke-2, dari 30 tanaman, dihasilkan 6 tanaman yang menunjukkan adanya variasi (Gambar Lampiran 12). Secara keseluruhan variasi bentuk dan warna daun hasil aklimatisasi subkultur ke-1 dan ke-2 tersaji pada Tabel Lampiran 6 dan 7.
PEMBAHASAN
Teknik kultur jaringan tanaman merupakan perbanyakan tanaman dengan cara mengambil jaringan mikro tanaman yang ditumbuhkan secara in vitro menjadi tanaman yang sempurna dalam jumlah yang tidak terbatas. Teknik ini didasarkan pada teori totipotensi sel. Totipotensi merupakan suatu fenomena dimana sel tanaman mempunyai kemampuan untuk beregenerasi menjadi tanaman utuh bila ditumbuhkan pada lingkungan yang cocok (Salisbury & Ross 1995). Keberhasilan penggunaan teknik kultur
0 2 4 6 8 10 12 14 16 18 20 22 24
1 2 3 4 5 6 7 8
6
jaringan sangat tergantung pada jenis eksplan yang dikulturkan, media yang digunakan dan lingkungan tumbuh dimana kultur ditumbuhkan (Gunawan 1988). Pemilihan eksplan berupa daun menggulung yang masih muda merupakan salah satu faktor penting yang menentukan keberhasilan teknik kultur jaringan. Pada daun yang menggulung jaringan meristematik masih aktif membelah diri, sehingga akan lebih mudah tumbuh. Selain itu eksplan dipilih yang mempunyai sifat morfologi dan fisiologi yang baik agar mendapat kultur yang baik pula. Roset dan Bokelman (1980) dalam Sutjahjo (1994), menyatakan bahwa eksplan yang berasal dari daun atau bagian daun memberikan keragaman genetik yang lebih besar daripada eksplan dari bagian tanaman lainnya. Menurut George & Sherrington (1984) sumber eksplan dapat mempengaruhi pertumbuhaan dan potensi morfogenetik. Untuk mendapatkan kalus atau organogenesis, lebih baik digunakan daun berikut tulang daunnya.
Organogenesis merupakan proses pembentukan organ dari jaringan eksplan. Organogenesis terjadi karena dipicu oleh beberapa hal, yaitu komponen yang terkandung pada media, faktor endogen selama eksplan mulai dikulturkan, serta senyawa manitol selama inisiasi eksplan (Fahey 1986). Regenerasi tanaman melalui jalur organogenesis langsung terjadi apabila tunas terbentuk dari potongan organ seperti daun, batang dan akar tanpa melalui kalus (Lestari & Yunita 2008). Fase Inisiasi
Eksplan yang dikulturkan sebanyak 30 dari satu induk tanaman. Kontaminan yang menyerang eksplan berupa cendawan dan bakteri, namun kontaminasi bakteri lebih banyak ditemui. Kontaminasi cendawan dan bakteri dapat berasal dari ruang kultur, permukaan eksplan, dan jaringan eksplan bagian dalam. Perkembangan eksplan sampai dengan terbentuknya tunas terjadi selama 8 minggu (Gambar
Tunas berkembang dari meristem apikal, sehingga tunas yang muncul akan berkembang membentuk suatu formasi daun. Pertumbuhan tunas dipengaruhi oleh faktor lingkungan yang menguntungkan bagi aktifitas enzim, auksin endogen, kofaktor dan sitokinin. Pertumbuhan daun terjadi bersamaan dengan pertumbuhan tunas. Menurut Widyastuti (2004) sitokinin merupakan suatu zat pengatur tumbuh sintetik yang tidak mudah dirombak oleh sistem enzim dari tanaman sehingga dapat memacu induksi dan multiplikasi tunas. Senyawa nitrogen yang terkandung dalam sitokinin berperan untuk proses sintesis asam-asam amino dan protein secara optimal yang selanjutnya digunakan untuk proses pertumbuhan dan perkembangan eksplan yang dalam hal ini pembentukan daun (Gardneret al.1991).
Setelah 8 MSK pada fase inisiasi, tunas yang tumbuh disubkultur dan diamati selama 8 minggu lagi. Pertumbuhan akar terjadi pada fase subkultur ke-1, yaitu pada 2 MSK dan mengalami peningkatan. Kenyataan ini diperkuat oleh pernyataan Rochiman dan Haryadi (1973), tunas yang berkembang akan menghasilkan auksin yang dapat merangsang pembentukan akar.
Fase Multiplikasi
Hasil subkultur ke-1 menunjukkan rata-rata jumlah tunas, jumlah daun dan jumlah akar berturut-turut yaitu 7,75; 14,4 dan 14,85. Hasil tersebut menunjukkan rata-rata pertumbuhan akar meningkat dengan pesat, sebanding dengan jumlah daun. Hal ini diduga, eksplan yang ditanam pada media kultur menghasilkan auksin endogen, yang menyebabkan pertumbuhan eksplan lebih diarahkan pada pemanjangan sel dan pembentukan akar. Ada pula beberapa tanaman yang tidak berespon terhadap zat pengatur tumbuh yang diberikan (faktor eksogen). Pendapat tersebut didukung oleh Ahmad et al. (2004) bahwa akar yang tumbuh pada media dengan hormon sitokinin yang
lebih tinggi dari pada auksin, kemungkinan diinduksi oleh faktor endogen. Menurut Gunawan (1988) bahwa interaksi antara zat pengatur tumbuh eksogen dan endogen menentukan arah perkembangan suatu kultur. Janick (1979), diacu dalam Ratna (2002) menegaskan bahwa pembentukan akar terjadi karena adanya pergerakan auksin ke bawah, karbohidrat dan rooting cofactor (zat-zat berinteraksi dengan auksin yang mengakibatkan terbentuknya akar).
Percobaan kedua, planlet yang belum mempunyai akar, hasil subkultur ke-1 dipindahkan ke dalam media baru dengan komposisi media yang sama. Hasil subkultur ke-2 menunjukkan rata-rata jumlah tunas, daun dan akar berturut-turut yaitu 17,45; 19,8 dan 20,35. Kecepatan multiplikasi tunas, nilai rerata jumlah tunas, nilai rerata jumlah daun, dan rerata jumlah helai daun mengalami peningkatan dua kali lipat dibandingkan subkultur ke-1. Hasil penelitian Pratiwi (2009) menunjukkan bahwa multiplikasi Anthurium plowmanii ada peningkatan jumlah tunas, daun dan akar lebih tinggi dibandingkan dengan subkultur ke-1. Hal ini dimungkinkan karena propagula yang dipindahkan sudah berbentuk planlet, sehingga kecepatan multiplikasi kuncup adventif yang berikutnya lebih tinggi dibanding yang masih berbentuk jaringan eksplan.
Aklimatisasi
8
aklimatisasi dapat disebabkan oleh faktor lingkungan yaitu, kelembaban udara dan intensitas cahaya. Kelembapan yang rendah dapat mengakibatkan kematian pada planlet. Hal ini karena planlet hasil kultur jaringan terbiasa hidup di lingkungan dengan kelembapan tinggi, sedangkan intensitas cahaya yang tinggi akan menyebabkan suhu lingkungan yang tinggi pula disertai dengan rendahnya kelembabpan udara (Zulkarnain 2009).
Menurut De Klerk (1990), terlihatnya perbedaan fenotipe tanaman merupakan salah satu cara memperkirakan ada atau tidaknya keragaman genetik. Fenomena variasi somaklonal ini dapat dilihat dari perubahan bentuk dan warna daun, serta bentuk daun. Dilihat dari Gambar Lampiran 11 dan 12, variasi yang terjadi dapat diduga sebagai keragaman somaklonal. Sumber eksplan merupakan faktor penting yang dapat mempengaruhi frekuensi terjadinya variasi, baik variasi fenotipe maupun genotipe (Karf 1995; Kumar 1995;Faried et al. 2006). Semakin tua suatu jaringan yang dikulturkan, semakin besar variasi yang ditimbulkan. Keragaman pada planlet disebabkan oleh adanya sel-sel yang bermutasi atau variasi polisomik dari jaringan tertentu (Thorpe 1990).
Keragamaan genetik yang terjadi di dalam kultur jaringan bisa disebabkan oleh perubahan struktur kromosom, penggandaan jumlah kromosom dan perubahan gen (Anthony et al. 2000). Menurut Karf (1995), banyak bukti menunjukkan variasi somaklonal dipengaruhi oleh zat pengatur tumbuh, terutama pada konsentrasi tinggi dalam media. Kemungkinan zat pengatur tumbuh tersebut bertindak sebagai mutagen. Konsentrasi garam-garam nutrien yang tinggi seperti kalsium dan EDTA pada media kultur juga meningkatkan ketidaknormalan kromosom pada kultur sel (Kumar 1995). Selanjutnya konsentrasi sukrosa tinggi dapat menginduksi poliploidisasi sel yang akan menghasilkan keragaman
genetik yang dapat memproduksi varietas baru dengan karakter fisik dan fenotipe tertentu, seperti perubahan performa pertumbuhan, warna bunga, peningkatan ukuran dan daya adaptasi. Poliploidisasi tersebut akibat peristiwa nondisjunction (segregasi yang tidak normal dari kromosom pada saat meiosis atau mitosis) sehingga terjadi peningkatan ukuran sel dan jaringan tanaman termasuk perubahan bentuk dan warna. Variasi juga dapat ditimbulkan oleh ketidakseimbangan gen atau tidak sempurnanya kromosom.
SIMPULAN
Kultur jaringan keladi merah sudah menghasilkan variasi somaklonal setelah 16 MSK. Subkultur ke-1 menghasilkan 5 tanaman sedangkan subkultur ke-2 memberikan 6 tanaman yang bervariasi secara fenotipik.
SARAN
Perlu dilakukan penelitian lebih lanjut tentang variasi yang ditimbulkan pada proses multiplikasi sehingga dapat menghasilkan keragaman yang memiliki nilai jual yang tinggi. Perlu pula dilakukan deteksi genetik terhadap variasi tersebut sehingga bisa mengetahui penyebab dari keragaman yang ditimbulkan.
DAFTAR PUSTAKA
Aisyah S. 2000. Perakitan baru Artemisia (Artemisia annua. L) melalui induksi dan keragaman somaklonal.[skripsi]. Bogor. Institut Pertanian Bogor, Fakultas Pertanian. Ahmad EU, Hayashi. T, Yazawa S. 2004. Auxins increase the occurrence of leaf-colour variants in Caladium regenerated from leaf explants.Sci Hort100: 153–171. Ali A, A. Munawar, S. Naz. 2007. Anin
Journal of Agriculture and Biology 5:731-735.
Anthony JF Griffiths, Jeffrey H. Miller, David T. Suzuki, Richard C. Lewontin, William M. Gelbart. 2000. An Introduction to Genetic Analysis, W.H. 12 Freeman and Company, New York.
Deng Z, BK. Harbaugh. 2006. ’Garden White’-A large white fancy-leaved Caladium for sunny landscapes and large containers. Hort Sci 41: 840– 844.
Deng ZJ, F. Goktepe, B. Harbaugh. 2007. Assessment of genetic diversity and relationships among Caladium cultivars and species using molecular markers J. American Soc Hort Sci 132: 147– 277.
De Klerk 1990. How to measure somaclonal variation. Act Bot Neerland39 :129-144.
Fahey JW, J.N Reed, TL Ready, GM Pace. 1986. Somatic embryogenesis from three commercially important inbreds of Zea mays. Pla