PENGOLAHAN AIR ASAM TAMBANG
MENGGUNAKAN BIOFILM BAKTERI PEREDUKSI
SULFAT
MUCHAMAD YUSRON
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
ii
PERNYATAAN MENGENAI DISERTASI
Dengan ini saya menyatakan bahwa disertasi Pengolahan Air Asam Tambang Menggunakan Biofilm Bakteri Pereduksi Sulfat adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis yang telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Oktober 2009
iii
ABSTRACT
MUCHAMAD YUSRON. Treatment of Acid Mine Drainage using Biofilm of Sulfate Reducing Bacteria. Under supervision of DWI ANDREAS SANTOSA, BIBIANA W. LAY and ANAS MIFTAH FAUZI.
Many mining and mineral processing industries discharge sulfate and metal containing wastewater, which is called acid mine drainage. The formation of acid mine drainage is generally the result of uncontrolled oxidation of the sulfide minerals present in the terrain in which the drainage flows with concomitant leaching of the metals. The high sulfate content in acid mine drainage can be reduced through chemical neutralization or biological treatment. Active biological treatment has been widely applied by using sulfate reducing microorganisms. These microorganisms can sustain life in acid environment. The aims of the research were: (i) to isolate and identify sulfate reducing bacteria collected from acid environment, (ii) to study environmental factors that influence growth of sulfate reducing bacteria, (iii) to treat acid mine drainage using suspended cell reactor system of sulfate reducing bacteria, and (iv) to evaluate the effectiveness of biofilm of sulfate reducing bacteria reactor for acid mine drainage treatment. The research consists of several stages which started with exploration and identification of sulfate reducing bacteria. On the final stage, the effectiveness of biofilm of sulfate reducing bacteria for acid mine drainage treatment was studied. Four promising isolates of sulfate reducing bacteria which can sustain in acid environment were obtained from coal mining area at Muara Enim, South Sumatra. The bacteria are classified as Desulfovibrio sp., which is characterized as straight rods, motile, non spore- forming and able to grow in simple organic carbon. The activity of bacteria depends on environmental conditions. The optimum pH of Desulfovibrio sp. range between 5-7, and able to reduce sulfate content of about 82-90%. Rice straw can be used as a carbon organic source for bacterial growth. The application of freely suspended sulfate reducing bacteria cell reactor efficiently reduce sulfate and metal content of wastewaters, however operation still need long residence time. With 30 days residence time, 89% of sulfate content was reduced, 97% of dissolved Fe and Mn were reduced and pH increased to 7.5. The application of biofilm of sulfate reducing bacteria cell system reactor was found more efficient in reducing sulfate and metal content of acid mine drainage. With 144 hours residence time, 77.16% of sulfate content was reduced, 88.72% of dissolved Mn and 69.72% of dissolved Fe were reduced, and pH increased up to 7. By using biofilm of sulfate reducing bacteria cell system, sulfate and metal content can be reduced to a value that meet standard quality of industrial wastewaters within 68-80 hours residence time.
iv
RINGKASAN
MUCHAMAD YUSRON. Pengolahan Air Asam Tambang Menggunakan Biofilm Bakteri Pereduksi Sulfat. Dibawah bimbingan : DWI ANDREAS SANTOSA, BIBIANA W. LAY dan ANAS MIFTAH FAUZI.
Air asam tambang merupakan limbah pencemar lingkungan yang terjadi akibat aktifitas pertambangan. Limbah ini terjadi karena adanya proses oksidasi bahan mineral pirit (FeS2) dan bahan mineral sulfida lainnya yang tersingkap ke
permukaan tanah dalam proses pengambilan bahan mineral tambang. Proses kimia dan biologi dari bahan-bahan mineral tersebut menghasilkan sulfat dengan tingkat kemasaman yang tinggi. Secara langsung maupun tidak langsung tingkat kemasaman yang tinggi mempengaruhi kualitas lingkungan dan kehidupan organisme.
Upaya untuk mengurangi dampak negatif air asam tambang ini telah dilakukan, baik melalui penggunaan bahan kimia maupun secara biologi. Penambahan bahan alkalin akan meningkatkan nilai pH, mempercepat laju oksidasi ion fero (Fe2+), serta mengendapkan logam terlarut dalam bentuk hidroksida dan karbonat. Teknologi lain adalah pembuatan lahan basah (wetland), baik yang aerob maupun anaerob. Adanya tanaman pada sistem lahan basah ini memberikan kontribusi dalam peningkatan kandungan bahan organik melalui zat-zat hasil sekresi dan dekomposisi sisa tanaman. Cara lain yang diharapkan bisa memberikan keuntungan lebih besar adalah dengan memanfaatkan bakteri pereduksi untuk meningkatkan alkalinitas dan mengimobilisasi logam- logam berbahaya. Untuk meningkatkan daya kerja bakteri pereduksi sulfat dalam reaktor adalah dengan mengimobilisasi sel-sel bakteri pada suatu permukaan partikel padatan, sehingga terbentuk biofilm. Dengan adanya biofilm tersebut diharapkan akan meningkatkan efektivitas bakteri dalam meningkatkan pH dan mengendapkan logam berbahaya dalam limbah air asam tambang.
Penelitian ini dilaksanakan dengan tujuan : (i) mengisolasi dan mengidentifikasi bakteri pereduksi sulfat yang mampu tumbuh dan beraktivitas pada kondisi masam, (ii) mengetahui faktor- faktor lingkungan yang mempengaruhi pertumbuhan bakteri pereduksi sulfat, (iii) mengolah air asam tambang dengan menggunakan bakteri pereduksi sulfat dalam reaktor sistem tersuspensi, dan (iv) mengetahui kinerja reaktor biofilm bakteri pereduksi sulfat untuk mereduksi air asam tambang.
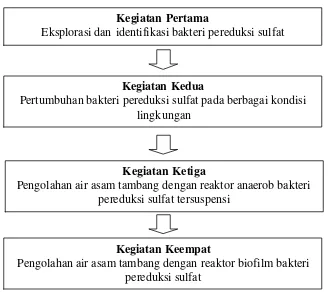
Penelitian ini terdiri dari 4 kegiatan, yaitu (1) Eksplorasi dan identifikasi bakteri pereduksi sulfat, (2) Pertumbuhan bakteri pereduksi sulfat pada berbagai kondisi lingkungan, (3) Pengolahan air asam tambang dengan reaktor anaerob bakteri pereduksi sulfat tersuspensi, dan (4) Pengolahan air asam tambang dengan reaktor biofilm bakteri pereduksi sulfat. Kegiatan 1 dilaksanakan dengan menggunakan metode deskriptif, kegiatan 2 sampai 4 menggunakan metode eksperimen di laboratorium.
v Identifikasi dilakukan hanya pada isolat yang dianggap unggul dengan media padat maupun media cair. Penentuan tipe morfologi, pewarnaan Gram dan pewarnaan spora dilakukan dari biakan media padat.
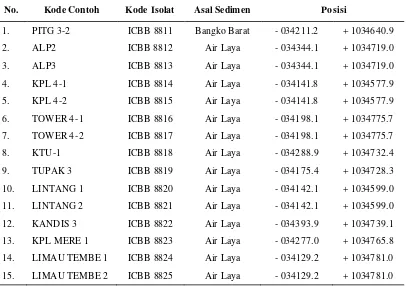
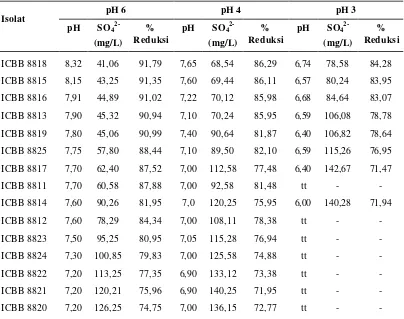
Kegiatan kedua dilakukan untuk mempelajari faktor- faktor yang mempengaruhi pertumbuhan bakteri pereduksi sulfat, antara lain pH, konsentrasi (kandungan) sulfat, dan sumber karbon. Pada kegiatan ketiga, pengolahan air asam tambang dilakukan dengan menggunakan kolom pengolahan pada kondisi anaerob bakteri pereduksi sulfat tersuspensi. Kolom dibuat dari kaca dengan ukuran diameter panjang 10 cm, lebar 15, dan tinggi 20 cm, sehingga total volume kolom 3000 cm3. Limbah asam tambang dimasukkan ke dalam kolom dengan ditambahkan nutrisi starter berupa asam laktat sebanyak 10 mL/L limbah dan isolat bakteri pereduksi sulfat yang telah ditumbuhkan. Tiga isolat yang digunakan pada tahap ini adalah ICBB 8815, ICBB 8816, dan ICBB 8818.
Pada kegiatan keempat, unit pengolahan air asam tambang menggunakan biofilm bakteri pereduksi sulfat terdiri dari 3 bak yang terbuat dari kaca, yakni bak pengisi, bak pengolah dan bak penampung. Bak pengolah yang merupakan reaktor anaerob dibuat dengan volume 6000 mL dan dimensi dengan ukuran panjang 20 cm, lebar 15 cm dan tinggi 20 cm. Pada bak pengolah ini diisi 1500 g limbah jerami dan 4000 g batu vulkan (sebagai media tumbuh biofilm), sehingga volume efektif reaktor adalah 3000 mL. Pengolahan limbah dilakukan secara anaerob dengan menggunakan sistem curah (batch). Imobilisasi bakteri pereduksi sulfat dilakukan dengan membiarkan kolom dalam kondisi anaerob selama 14 hari sehingga terbentuk biofilm. Pengamatan pertumbuhan bakteri pereduksi sulfat yang menempel pada permukaan batu vulkan dilakukan dengan menggunakan metode Scanning Electron Microscopy (SEM). Pengolahan limbah secara anaerob dilakukan dengan 3 perlakuan, yaitu (1) jerami padi (sebagai kontrol), (2) jerami padi dan ICBB 8815, dan (3) jerami padi dan ICBB 8818.
Dari penelitian ini diperoleh bahwa kondisi kolam penampungan yang banyak mengandung sulfat dan pH rendah merupakan habitat yang sesuai untuk pertumbuhan bakteri pereduksi sulfat. Namun demikian kelompok bakteri tersebut mempunyai karakteristik yang berbeda, dilihat dari waktu tumbuh dan kemampuan mereduksi sulfat. Dari kegiatan isolasi ini diperoleh empat isolat unggul bakteri pereduksi sulfat yang mampu tumbuh pada pH 3. Keempat isolat tersebut tergolong dalam kelompok Desulfovibrio sp., bakteri yang berbentuk batang, motil, tidak membentuk spora dan menggunakan laktat sebagai sumber organik.
Aktivitas bakteri dalam mereduksi sulfat sangat dipengaruhi oleh kondisi lingkungan. Bakteri Desulfovibrio sp. dapat tumbuh pada pH rendah, namun pH optimum untuk pertumbuhan bakteri pereduksi sulfat adalah 5-7, dan mampu mereduksi sulfat dengan tingkat efisiensi 82-90%. Kebutuhan laktat sebagai sumber organik untuk aktivitas bakteri dapat dipenuhi dari bahan organik yang mudah terlapuk.
vii
©
Hak cipta milik Institut Pertanian Bogor, tahun 2009
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh kara tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepenttingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar bagi Institut Pertanian Bogor
viii
PENGOLAHAN AIR ASAM TAMBANG MENGGUNAKAN
BIOFILM BAKTERI PEREDUKSI SULFAT
MUCHAMAD YUSRON
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Pengelolaan Sumberdaya Alam dan Lingkungan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
ix Judul Disertasi : Pengolahan Air Asam Tambang Menggunakan Biofilm
Bakteri Pereduksi Sulfat Nama : Muchamad Yusron
NRP : P062050211
Program Studi : Pengelolaan Sumberdaya Alam dan Lingkungan
Disetujui :
Komisi Pembimbing
Dr. Ir. Dwi Andreas Santosa Ketua
Prof. Dr. drh. Bibiana W. Lay, M.Sc. Anggota
Dr. Ir. Anas Miftah Fauzi, M.Eng Anggota
Diketahui :
Ketua Program Studi Pengelolaan Sumberdaya Alam dan Lingkungan
Prof. Dr. Ir. Surjono H. Sutjahjo, MS.
Dekan Sekolah Pascasarjana Institut Pertanian Bogor
Prof. Dr. Ir. Khairil A. Notodiputro, MS.
x
PRAKATA
Puji syukur penulis panjatkan keha dirat Allah Yang Maha Kuasa yang telah melimpahkan rahmat dan kasih sayang Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan disertasi dengan judul “Pengolahan Air Asam Tambang Menggunakan Biofilm Bakteri Pereduksi Sulfat”. Disertasi ini merupakan salah satu syarat penyelesaian pendidikan program Doktor (S3) pada Program Studi Pengelolaan Sumberdaya Alam dan Lingkungan, Sekolah Pascasarjana, Institut Pertanian Bogor.
Pada kesempatan ini penulis ingin menyampaikan ucapan terima kasih yang sebesar-besarnya kepada :
1. Dr. Ir. Dwi Andreas Santosa, Prof. Dr. drh. Bibiana W. Lay, M.Sc. dan Dr. Ir. Anas Miftah Fauzi, M.Eng. selaku ketua dan anggota komisi pembimbing yang telah banyak memberikan bimbingan dan arahan sejak penyusunan proposal, pelaksanan penelitian hingga selesainya penyusunan disertasi ini.
2. Ketua Program Studi Pengelolaan Sumberdaya Alam dan Lingkungan yang telah banyak memberikan arahan, dorongan dan motivasi selama masa studi sampai penyusunan disertasi ini.
3. Ucapan terima kasih penulis sampaikan secara khusus kepada Dr. Ir. Dwi Andreas Santosa yang telah menyediakan bahan penelitian dan peralatan laboratorium sehingga penulis dapat menyelesaikan keseluruhan tahapan penelitian.
4. Perusahaan tambang batu bara PT. Bukit Asam, Muara Enim yang telah mengijinkan penulis melakukan penelitian selama di lapang dan menyediakan limbah air asam tambang.
5. Kepala Balai Penelitian Tanaman Obat dan Aromatik, Departemen Pertanian, yang telah memberikan kesempatan dan ijin kepada penulis untuk melanjutkan studi pada Sekolah Pascasarjana Institut Pertanian Bogor.
6. Seluruh staf dan teknisi pada Laboratorium Bioteknologi Lingkungan,
xi 7. Istri tercinta Erliza Noor yang selalu dengan sabar memberikan dorongan,
semangat dan doa yang tiada hentinya. Untuk kedua anak saya Faisal Rifqi dan Raihan Rifqi terima kasih banyak atas pengertian, kesabaran dan doanya.
Akhirnya penulis berharap agar karya ilmiah ini dapat bermanfaat yang yang membaca dan membutuhkan informasi yang berkaitan dengan disertasi ini.
Bogor, Oktober 2009
xii
RIWAYAT HIDUP
xiii
DAFTAR ISI
Halaman
DAFTAR TABEL . . . xv
DAFTAR GAMBAR . . . xvi
DAFTAR LAMPIRAN . . . xviii
PENDAHULUAN . . . 1
Latar Belakang . . . 1
Kerangka Pemikiran . . . 3
Perumusan Masalah . . . 6
Tujuan Penelitian . . . . . . 8
Hipotesis . . . 8
Manfaat Penelitian . . . 9
Novelty . . . 9
TINJAUAN PUSTAKA . . . . . . 10
Limbah Air Asam Tambang . . . . . . . 10
Teknik Remediasi Air Asam Tambang . . . 14
Bakteri Pereduksi Sulfat . . . 19
Teknologi Biofilm . . . 28
Pembentukan Biofilm . . . 29
METODE PENELITIAN . . . 31
Metode Penelitian . . . 31
Pelaksanaan Penelitian . . . 32
Metode Analisa . . . . . . . . 39
Analisa Data . . . . . . . 40
Penyimpanan Biakan . . . . . . 41
HASIL DAN PEMBAHASAN . . . 42
Eksplorasi dan Identifikasi Bakteri Pereduksi Sulfat . . . 42 Pertumbuhan Bakteri Pereduksi Sulfat pada Berbagai Kondisi Lingkungan . . .
49
Pengolahan Air Asam Tambang dengan Reaktor Bakteri Pereduksi Sulfat Sistem Tersuspensi . . .
xiv Pengolahan Air Asam Tambang dengan Bioreaktor Biofilm Bakteri Pereduksi Sulfat . . .
69
xv
DAFTAR TABEL
Halaman
1. Beberapa hasil studi penggunaan biofilm dalam pengolahan air asam tambang . . .
5
2. Donor elektron dan sumber karbon bakteri pereduksi sulfat . . . 22 3. Data termodinamika oksidasi beberapa sumber karbon dan energi
selama reduksi sulfat secara biologi . . . 25
4. Indikasi keberadaan bakteri pereduksi sulfat dari lumpur di kolam penampungan air asam tambang di pertambangan batu bara Muara Enim, Sumatera Selatan . . . 7. Kemampuan reduksi sulfat isolat bakteri pereduksi sulfat pada pada
konsentrasi sulfat 500 mg/L dan pH awal 3, 4 dan 6 . . . 47
8. Karakteristik empat isolat unggul bakteri pereduksi sulfat . . . 48 9. Pengaruh pH media terhadap waktu tumbuh bakteri pereduksi sulfat,
konsentrasi sulfat 1000 mg/L . . . 50
10. Pengaruh pH terhadap efisiensi bakteri dalam mereduksi sulfat . . . . 54 11. Tingkat kenaikan pH pada pH awal media yang berbeda . . . 57 12. Waktu tumbuh isolat bakteri pereduksi sulfat pada beberapa level
konsentrasi sulfat pada pH 4 . . . 58
13. Pengaruh konsentrasi sulfat awal terhadap total sulfat yang tereduksi 58 14. Waktu tumbuh isolat bakteri pereduksi sulfat pada laktat dan limbah
jerami padi sebagai sumber karbon organik . . . 60
15. Karakteristik kimia limbah air asam tambang PIT-1, Bangko Barat, Muara Enim . . .
64
xvi 4. Skema proses metabolisme reduksi sulfat dan pemanfaatan sumber
karbon . . . 21
5. Skema aliran elektron dalam sel Desulfovibrio, dimana H2 atau
senyawa organik sebagai sumber energi dan sulfat sebagai akseptor elektron . . .
22
6. Skema mekanisme siklus hidrogen untuk menghasilkan energi pada Desulfovibrio yang tumbuh pada laktat sebagai sumber energi dan sulfat sebagai akseptor elektron . . .
23
7. Bagan pelaksanaan kegiatan penelitian . . . 31 8. Rancangan reaktor pengolahan air asam tambang secara anaerob .. . . 37 9. Rancangan reaktor biofilm bakteri pereduksi sulfat untuk
pengolahan air asam tambang . . . 38
10. Indikasi terjadinya reduksi sulfat oleh bakteri pereduksi sulfat hasil isolasi di kolam penampungan limbah air asam tambang di Muara Enim, Sumatera Selatan . . .
44
11. Pengaruh pH terhadap kecepatan tumbuh beberapa isolat bakteri pereduksi sulfat . . .
50
12. Pengaruh pH terhadap pertumbuhan empat isolat bakteri pereduksi sulfat . . .
52
13. Kandungan sulfat pada akhir penelitian pada level pH yang berbeda . 54 14. Total sulfida yang terbentuk pada akhir pengamatan pada level pH
yang berbeda . . . 55
15. Pengaruh pH dan bakteri pereduksi sulfat terhadap nilai pH akhir . . . 56 16. Pengaruh konsentrasi sulfat terhadap kemampuan bakteri dalam
mereduksi sulfat . . . 59
17. Pengaruh konsentrasi sulfat awal terhadap kandungan sulfida yang terbentuk . . .
59
18. Pengaruh sumber karbon organik terhadap pola pertumbuhan bakteri pereduksi sulfat Desulfovibrio sp. ICBB 8818 . . .
62
19. Pengaruh sumber karbon terhadap kemampuan bakteri dalam mereduksi sulfat . . .
63
xvii 21. Pola pertumbuhan tiga isolat bakteri pereduksi sulfat pada reaktor
bakteri pereduksi sulfat tersuspensi . . . 65
22. Penurunan konsentrasi sulfat pada limbah air asam tambang pada reaktor bakteri pereduksi sulfat tersuspensi . . .
66
23. Peningkatan sulfida yang terbentuk pada reaktor bakteri pereduksi sulfat tersuspensi . . .
67
24 Peningkatan pH limbah air asam tambang pada reaktor bakteri pereduksi sulfat tersuspensi . . .
68
25. Penurunan konsentrasi logam terlarut limbah air asam tambang pada reaktor bakteri pereduksi sulfat tersuspensi . . .
69
26. Foto permukaan batu vulkan hasil pengamatan dengan scanning electron microscopy perbesaran 10.000x. . . .
71
27. Grafik penurunan konsentrasi sulfat dan produksi sulfida pada reaktor biofilm bakteri pereduksi sulfat . . .
74
28. Grafik kenaikan pH limbah air asam tambang pada reaktor biofilm bakteri pereduksi sulfat . . .
75
29. Grafik peningkatan COD limbah air asam tambang pada reaktor biofilm bakteri pereduksi sulfat . . .
76
30. Grafik penurunan konsentrasi logam terlarut limbah air asam tambang dengan reaktor biofilm bakteri pereduksi sulfat . . .
xviii
DAFTAR LAMPIRAN
Halaman
1. Morfologi dan karakter fisiologi bakteri hasil isolasi dari lumpur kolam penampungan limbah air asam tambang PT Bukit Asam, Muara Enim . . .
92
2. Baku Mutu Air Limbah Kegiatan Penambangan Batu Bara, Keputusan Menteri Negara Lingkungan Hidup Nomor : 113 Tahun 2003 . . .
93
3. Data pengamatan pengaruh pH terhadap waktu tumbuh BPS . . . 94 4. Data pengamatan pengaruh pH media pertumbuhan empat isolat BPS 95 5. Data pengamatan pengaruh pH media terhadap sisa sulfat . . . 96 6. Data pengamatan pengaruh pH media terhadap persentase reduksi
sulfat . . . .. . . .. . . 97
7. Data pengamatan pengaruh pH media terhadap pembentukan sulfida 98 8. Data pengamatan pengaruh pH terhadap kenaikan pH . . . 99 9. Data pengamatan pengaruh pH media terhadap delta kenaikan pH . . 100 10. Data pengamatan pengaruh konsentrasi sulfat terhadap waktu
tumbuh BPS . . . .. . . .. . . 101
11. Data pengamatan pengaruh konsentrasi sulfat terhadap reduksi sulfat 102 12. Data pengamatan pengaruh konsentrasi sulfat terhadap persentase
reduksi sulfat . . . 103
13. Data pengamatan pengaruh konsentrasi sulfat terhadap pembentukan sulfida . . . . . .
104
14. Data pengamatan pengaruh laktat sebagai sumber karbon organik terhadap waktu tumbuh BPS, kenaikan pH, sisa sulfat dan sulfida yang terbentuk . . . . . .
105
15. Data pengamatan pengaruh jerami padi sebagai sumber karbon organik terhadap waktu tumbuh BPS, kenaikan pH, sisa sulfat dan sulfida yang terbentuk . . . . . .
106
16. Data pengamatan pengaruh sumber karbon organik terhadap pertumbuhan BPS ICBB 8818 . . . . . .
107
17. Data pengamatan pola pertumbuhan tiga isolat BPS pada reaktor BPS tersuspensi . . . . . .
108
18. Data pengamatan penurunan konsentrasi sulfat pada reaktor BPS tersuspensi . . . . . .
109
19. Data pengamatan peningkatan konsetrasi sulfida pada reaktor BPS tersuspensi . . . . . .
110
xix 21. Data pengamatan penurunan Fe dan Mn terlarut pada reaktor BPS
tersuspensi . . . . . .
112
22. Data pengamatan penurunan konsentrasi sulfat dalam reaktor biofilm BPS . . . . . .
113
23. Data pengamatan peningkatan konsentrasi sulfida dalam reaktor biofilm BPS . . . . . .
114
24. Data pengamatan kenaikan pH dalam reaktor biofilm BPS . . . 115 25. Data pengamatan penurunan Mn terlarut dalam reaktor biofilm BPS 116 26. Data pengamatan penurunan Fe terlarut dalam reaktor biofilm BPS 117
I.
PENDAHULUAN
1.1 Latar BelakangSelama empat dekade terakhir industri tambang menjadi salah satu tulang punggung perkembangan ekonomi dan sosial di Indonesia. Hasil survei industri pertambangan Indonesia yang dilakukan oleh Pricewaterhouse Coopers tahun 2002 (Wahju, 2003) memperlihatkan bahwa total kontribusi industri pertambangan terhadap ekonomi nasional tahun 2001 sebesar Rp. 14,3 triliun dan memberikan kontribusi terhadap perkembangan regional dan masyarakat sebesar Rp. 279 miliar. Pada tahun 2004 produksi batu bara Indonesia mencapai 127 juta ton dan meningkat menjadi 150 juta ton pada tahun 2005. Dengan produksi sebesar itu pada tahun 2004 Indonesia mampu mengekspor batubara lebih dari 95 juta ton. Dari data yang ada saat ini, sumber batu bara (resources) sebanyak 57,8 milyar ton. Dari jumlah tersebut hanya 7 milyar ton yang merupakan cadangan pasti. Sebagian besar cadangan tersebut hanya tersebar di Sumatera Selatan (37 persen), Kalimantan Timur (35 persen) dan Kalimantan Selatan (26 persen).
Industri pertambangan merupakan industri yang mendukung pertumbuhan ekonomi, tetapi juga menyebabkan perubahan lingkungan. Industri pertambangan mempunyai potensi besar untuk memberikan manfaat bagi masyarakat, terutama untuk daerah terpencil. Industri pertambangan dikenal sebagai industri pionir karena investasi pertambangan memerlukan pembangunan infrastruktur yang mampu membuka suatu wilayah dari isolasi geografis. Disisi lain industri pertambangan juga merupakan industri yang dapat menimbulkan perubaha n lingkungan secara drastis, sehingga dapat mengancam kelestarian fungsi lingkungan dan fungsi sosial kehidupan masyarakat. Banyak sekali bukti pencemaran lingkungan sebagai akibat kegiatan pertambangan.
Salah satu pencemaran lingkungan yang terjadi akibat aktifitas pertambangan adalah air asam tambang. Air asam tambang terjadi karena adanya proses oksidasi bahan mineral pirit (FeS2) dan bahan mineral sulfida lainnya.
pirit, air dan oksigen. Seperti diketahui deposit mineral batubara mengandung 1-20 persen bahan pirit-sulfur dan sulfur organik (Johnson dan Hallberg, 1-2005).
Proses kimia dan biologi dari bahan-bahan mineral pirit tersebut menghasilkan ion sulfat dengan tingkat kemasaman yang tinggi, atau yang lebih dikenal dengan air asam tambang (Acid Mine Drainage). Air asam tambang tersebut kemudian menyebar masuk ke tanah-tanah di sekitarnya dan bahkan masuk ke aliran air sungai. Tingkat kemasaman yang tinggi pada limbah air asam tambang secara langsung maupun tidak langsung mempengaruhi kualitas lingkungan dan kehidupan organisme. Sebagian besar tumbuhan dan hewan tidak mampu hidup pada pH rendah, sehingga merusak keragaman ekosistem, dan hanya mikroorganisme asidofil yang mampu bertahan dan hidup pada pH rendah (Ingledew, 1990).
Tingkat kemasaman yang tinggi meningkatkan kelarutan logam- logam berbahaya, seperti As, Cd, Cr, dan Pb, yang sering berasosiasi dengan mineral pirit (Sobolewski, 1999). Meningkatnya kelarutan logam- logam tersebut sangat membahayakan organisme air, karena akan berakibat pada keracunan dan bahkan dapat menyebabkan kematian hewan air. Oleh karena itu, peningkatan kelarutan logam berbahaya tersebut akan mempengaruhi keseimbangan ekosistem.
Keberadaan logam terlarut sangat berbahaya bagi kesehatan manusia dan kelangsungan hidup di lingkungan. Walaupun pada konsentrasi yang sangat rendah efek ion logam terlarut dapat berdampak langsung ataupun terakumulasi dalam rantai makanan (Suhendrayatna, 2001). Logam terlarut tersebut dapat ditransfer dengan jangkauan yang sangat jauh di lingkungan, berpotensi mengganggu kehidupan biota lingkungan dan pada akhirnya berpengaruh terhadap kesehatan manusia.
tambang yang cukup luas. Namun demikian, sampai saat ini belum ada data kuantitatif dampak kerusakan lingkungan sebagai akibat limbah air asam tambang.
1.2 Kerangka Pemikiran
Upaya untuk mengurangi dampak negatif air asam tambang ini telah dilakukan, baik melalui penggunaan bahan kimia maupun secara biologi. Salah satu proses pengolahan aktif adalah dengan menambahkan bahan kimia yang dapat menetralisir kemasaman limbah. Penambahan bahan alkalin akan meningkatkan nilai pH, mempercepat laju oksidasi ion fero (Fe2+), serta mengendapkan logam terlarut dalam bentuk hidroksida dan karbonat.
Beberapa bahan penetralisir yang banyak digunakan antara lain adalah kalsium oksida, kalsium karbonat, sodium hidroksida, magnesium oksida dan magnesium hidroksida (Johnson dan Hallberg, 2005). Efektivitas masing- masing bahan tersebut sangat beragam. Sodium hidroksida (NaOH) jauh lebih efektif tetapi harganya sangat mahal. Penggunaan bahan kimia tersebut sangat efektif dalam mengolah air asam tambang, tetapi biaya operasionalnya sangat tinggi, serta menghasilkan lumpur limbah yang sangat banyak, terutama pada penggunaan senyawa kalsium.
Teknologi lain yang juga banyak dikembangkan adalah pembuatan lahan basah (wetland), baik yang aerob ma upun anaerob. Adanya tanaman pada sistem lahan basah ini memberikan kontribusi meningkatkan kandungan bahan organik melalui zat- zat hasil sekresi dan dekomposisi sisa tanaman. Disamping itu, pengurangan konsentrasi logam sebagian terjadi karena proses pengendapan logam dengan adanya reduksi sulfat secara biologi, dan sebagian kecil juga diserap oleh tanaman.
Strategi yang diharapkan bisa memberikan keuntungan lebih besar adalah dengan memanfaatkan mikroorganisme untuk menghasilkan dan meningkatkan alkalinitas dan mengimobilisasi logam- logam berbahaya. Beberapa mikroorganisme mampu tumbuh dan hidup di lingkungan yang banyak mengandung sulfat, dan memanfaatkan ion sulfat sebagai terminal akseptor elektron dan memanfaatkan bahan organik sebagai donor elektron (Moosa et al., 2002), atau yang banyak dikenal sebagai bakteri pereduksi sulfat. Beberapa genus bakteri pereduksi sulfat antara lain adalah Desulfobacter, Desulfococcus, Desulfotomaculum, Desulfomonas, Desulfomena, Desulbacterium, Desulfovibrio, Desulfosarcina, Desulfomonile, Thermodesulfofhabdus dan Desulfocinum.
Pemanfaatan bakteri pereduksi sulfat untuk mengolah air asam tambang telah banyak diteliti, namun sebagian besar masih dalam bentuk sel bebas. Kelemahan dari pendekatan ini adalah bahwa sel bebas bakteri bisa tercuci oleh aliran air, sehingga mengurangi efektifitas daya kerjanya. Salah satu cara untuk meningkatkan daya kerja bakteri pereduksi sulfat adalah dengan mengimobilisasi sel-sel bakteri pada suatu permukaan partikel padatan, sehingga terbentuk biofilm. Dengan adanya biofilm tersebut diharapkan akan meningkatkan efektivitas bakteri dalam meningkatkan pH dan mengendapkan logam berbahaya dalam limbah air asam tambang.
Tabel 1. Beberapa hasil studi penggunaan biofilm dalam pengolahan air asam tambang
1.3 Perumusan Masalah
Limbah air asam tambang merupakan permasalahan lingkungan yang dihadapi di seluruh industri tambang di dunia. Melihat permasalahan lingkungan yang ditimbulkan, beberapa tindakan telah dilakukan untuk mengurangi atau menghilangkan dampak negatif tersebut. Salah satu langkah adalah langkah preventif, yakni menghindari terjadinya limbah air asam tambang. Prinsip langkah preventif ini adalah menghindari terjadinya proses oksidasi bahan mineral pirit dan sulfida lainnya (Johnson dan Hallberg, 2005), yakni dengan menyimpan batuan mineral pirit dalam kondisi anaerob. Upaya preventif ini cukup sulit untuk diterapkan, sehingga langkah yang bisa dilakukan adalah meminimalkan dampak negatif limbah air asam tambang terhadap aliran dan ekosistem sungai, serta dampak negatif tersebut terhadap lingkungan yang lebih luas.
Ada beberapa teknik yang telah dikembangkan untuk mengurangi dampak negatif limbah asam tambang. Teknik remediasi tersebut dapat dikelompokkan menjadi remediasi abiotik dan biologi (Johnson dan Hallberg, 2005). Teknik remediasi abiotik yang telah dikembangkan antara lain dengan cara menetralisir sifat masam tersebut yakni dengan menambahkan bahan kimia (Coulton et al., 2003). Teknik ini dikenal dengan perlakuan aktif. Penambahan bahan-bahan alkalin pada limbah asam tambang akan meningkatkan pH, mempercepat laju oksidasi kimia dari ion Fe2+ dan mengendapkan logam- logam yang ada pada larutan dalam bentuk hidroksida atau karbonat.
Strategi remediasi secara biologi (bioremediasi) didasarkan pada kemampuan beberapa mikroorganisme untuk menghasilkan dan meningkatkan alkalinitas dan mengimobilisasi logam- logam berbahaya. Pendekatan penting dalam pengolahan air asam tambang adalah meningkatkan pH dan mengurangi konsentrasi sulfat, yang merupakan faktor penting untuk menghilangkan logam beracun dari limbah air asam tambang. Oleh karena itu, Suyasa (2002) mencoba meningkatkan pH dan mengurangi logam terlarut dengan memanfaatkan bakteri pereduksi sulfat.
sering terjadi pada saat substrat sumber energi mikroorganisme berada dalam jumlah yang kurang mencukupi (Marshal, 1998), sehingga mampu memanfaatkan keterbatasan tersebut secara efisien. Donian (2002) mendefinisikan biofilm sebagai sekumpulan sel mikrob yang berasosiasi dan menempel pada matriks padatan terutama bahan-bahan polisakarida, serta bahan-bahan lain seperti partikel batuan, mineral kristal, dan lain- lain. Pembentukan biofilm tersebut menciptakan kondisi lingkungan yang optimal bagi aktivitas mikrob (Santegoeds,
et al., 1998). Oleh karena itu, pembentukan dan pemanfaatan biofilm bakteri pereduksi sulfat akan meningkatkan efektivitas bakteri dalam meningkatkan pH dan mengendapkan logam berbahaya dalam limbah air asam tambang.
Berdasarkan permasalahan, secara ringkas permasalahan dan upaya yang dapat dilakukan untuk mengurangi dampak negatif limbah air asam tambang disajikan pada Gambar 1.
Gambar 1. Perumusan masalah air asam tambang
REMEDIASI
ABIOTIK REMEDIASI
BIOLOGI
BIOFILM BAKTERI PEREDUKSI SULFAT
LIMBAH RAMAH LINGKUNGAN
AIR ASAM TAMBANG
BAHAN KIMIA MIKROB
Dari uraian tersebut, permasalahan yang dipecahkan dalam penelitian ini adalah :
1. Ada mikrob di alam yang mampu tumbuh dan berkembang pada kondisi asam. Seberapa jauh mikrob tersebut dapat dimanfaatkan dalam pengolahan limbah air asam tambang ?
2. Faktor lingkungan apa saja yang mempengaruhi pertumbuhan mikrob bakteri pereduksi sulfat ?
3. Apakah bakteri pereduksi sulfat yang terimobilisasi dalam bentuk biofilm lebih efektif dalam mereduksi sulfat dan logam- logam terlarut dibandingkan dalam bentuk sel bebas ?
1.4 Tujuan Penelitian
Tujuan utama dari penelitian ini adalah menghasilkan teknologi pengolahan limbah air asam tambang dengan memanfaatkan teknik biofilm bakteri pereduksi sulfat. Untuk mendapatkan hasil tersebut, maka tujuan masing- masing kegiatan penelitian adalah sebagai berikut,
1. Mengisolasi dan mengidentifikasi bakteri pereduksi sulfat yang mampu tumbuh dan beraktivitas pada kondisi masam,
2. Mengetahui faktor-faktor lingkungan yang mempengaruhi pertumbuhan bakteri pereduksi sulfat,
3. Mengolah air asam tambang dengan menggunakan bakteri pereduksi sulfat dalam reaktor sistem tersuspensi,
4. Mengetahui kinerja reaktor biofilm bakteri pereduksi sulfat untuk mereduksi air asam tambang
1.5 Hipotesis
Sesuai dengan tujuan masing- masing tahapan kegiatan, maka hipotesis penelitian secara keseluruhan adalah :
2. Pertumbuhan dan aktifitas bakteri pereduksi sulfat dipengaruhi faktor lingkungan
3. Efisiensi mikrob dalam mereduksi sulfat dalam air asam tambang lebih tinggi dalam kondisi terimobilisasi (biofilm) dibandingkan dengan kondisi tersuspensi.
4. Efisiensi mikrob dalam mereduksi kandungan logam dalam air asam tambang lebih tinggi dalam kondisi terimobilisasi (biofilm) dibandingkan dengan kondisi tersuspensi.
1.6. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberi manfaat sebagai berikut : 1. Bakteri pereduksi sulfat yang diisolasi dari ekosistem spesifik di Indonesia
mampu menambah penge tahuan dan kekayaan sumberdaya hayati
2. Teknologi biofilm bakteri pereduksi sulfat ini mampu dimanfaatkan secara lebih luas dalam praktek di lapangan, sehingga dapat mengurangi dampak negatif limbah asam tambang terhadap lingkungan.
1.7. Novelty
II. TINJAUAN PUSTAKA
2.1. Limbah Air Asam TambangLimbah air asam tambang merupakan permasalahan lingkungan yang dihadapi di seluruh industri tambang di dunia. Di Amerika Serikat pencemaran limbah air asam tambang di seluruh wilayah pertambangan mencakup area sekitar 25.000 hektar dan mencemari wilayah aliran air permukaan yang cukup luas (Durkin dan Herrmann, 1994). Di Indonesia di wilayah industri pertambangan limbah air asam tambang menjadi permasalahan lingkungan yang krusial. Hasil monitoring limbah pertambangan batu bara di Kalimantan, atau pertambangan tembaga di Nusa Tenggara dan Papua, memperlihatkan bahwa limbah air bua ngan tambang masih melebihi ambang batas mutu air. Hal ini yang menyebabkan kondisi lingkungan di sekitar limbah buangan tersebut mengalami kerusakan.
Air asam tambang adalah limbah yang mengancam kelestarian lingkungan yang terbentuk akibat kegiatan pertambangan. Johnson dan Hallberg (2005) mengemukakan bahwa pada tahun 1989 diperkirakan 19.300 km badan sungai dan 72.000 hektar danau dan bendungan di berbagai belahan di dunia mengalami kerusakan karena limbah air asam tambang, walaupun tingkat kerusakan tersebut sulit untuk diukur secara tepat.
Proses terjadinya air asam tambang telah diuraikan secara rinci oleh Johnson (2003). Air asam tambang merupakan hasil reaksi oksidasi batuan tambang yang kaya akan mineral sulfida. Banyak jenis mineral sulfida yang ada di alam, seperti pyrrhotite (FeS), arsenopirit (FeAsS), chalcopirit (CuFeS2), dan
pirit (FeS2). Pirit merupakan mineral sulfida yang banyak dijumpai pada
pertambangan batu bara. Batuan sulfida tersebut mengalami oksidasi dengan adanya air dan oksigen, yang dikatalis oleh bakteri pengoksida besi dan sulfur, seperti Thiobacillus ferrooxidans, Leptospirillum ferrooxidans dan Thiobacillus thiooxidans (Schipper, 2004; Cohen, 2005; Johnson dan Halberg, 2005).
Reaksi oksidasi pirit (FeS2) dapat ditulis dengan persamaan sebagai
berikut:
FeS2(s) + 7/2 O2 + H2O à Fe2+ + 2SO42- + 2H+ (1)
Fe2+ + 1/4 O2 + H+ à Fe3+ + ¼ H2O (2)
FeS2(s) + 14Fe3+ + 8H2O à 15 Fe2+ + 2SO42- + 16 H+ (3)
Fe3+ + 3H2O à Fe(OH)3(s) + 3H+ (4)
Secara keseluruhan oksidasi pirit mengikuti persamaan berikut,
FeS2(s) + 15/4 O2 + 7/2 H2O à Fe(OH)3(s) + 2SO42- + 4H+ + energi (5)
Reaksi (1) dan (2) menunjukkan oksidasi mineral sulfida pirit membentuk ion Fe3+, sulfat dan beberapa proton pembentuk kemasaman, sehingga kondisi lingkungan menjadi lebih asam. Ion Fe3+ merupakan pengoksida yang cukup kuat, sehingga mempercepat oksidasi mineral sulfida membentuk ion sulfat (Fowler dan Crundwell, 1998). Penurunan kemasaman lingkungan merupakan kondisi yang cukup sesuai bagi pertumbuhan mikrob asidofilik pengoksida besi dan sulfur.
Proses oksidasi pirit menjadi Fe2+ dan SO42- sangat dipengaruhi oleh
konsentrasi Fe3+ dan pH lingkungan. Peningkatan konsentrasi Fe3+ akan mempercepat laju oksidasi pirit, sedangkan peningkatan nilai pH lingkungan akan menghambat laju oksidasi pirit (Williamson dan Rimstidt, 1994). Hossner dan Doolittle (2003) mengemukakan bahwa pada nilai pH di bawah 4, ion Fe3+ akan mudah larut dan menjadi pengoksida kuat bagi mineral sulfida. Pada kondisi demikian laju oksidasi FeS2 berubah sesuai dengan perubahan waktu tergantung
pada konsentrasi FeS2. Pada nilai pH lebih dari 4, laju oksidasi FeS2 akan konstan
sepanjang waktu, dan pada nilai pH di atas 4,5, oksidasi FeS2 lebih banyak terjadi
dengan adanya oksigen, sedang bakteri T. ferrooxidans kurang aktif.
Proses oksidasi ion Fe2+ menjadi Fe3+ dipercepat dengan adanya mikrob pengoksida besi, seperti T. ferrooxidans dan L. ferrooxidans. T. ferrooxidans
mampu memanfaatkan Fe3+ untuk mengoksidasi senyawa sulfur, tetapi laju oksidasi sulfur tersebut jauh lebih rendah dibandingkan dengan oksidasi Fe2+ (Lizama dan Suzuki, 1989). Laju oksidasi FeS2 akan dipercepat dengan adanya
Fe3+ dan bakteri T. ferrooxidans (Fowler et al., 1999). Hossner dan Doolittle (2003) mengemukakan bahwa dengan adanya aktivitas bakteri pengoksida, laju oksidasi meningkat sampai 106 kali lipat, sedang Schrenk et al. (1998) mengemukakan bahwa percepatan laju pelarutan pirit ole h bakteri mencapai 10-5 µmol Fe per sel per hari pada pH 0,7 dan suhu 42oC.
Keberadaan bakteri pengoksida Fe dan sulfur sangat mempengaruhi laju oksidasi mineral pirit. Sand dan Gehrke (2006) mengemukakan bahwa bakteri pengoksida T. ferrooxidans tidak ha nya mampu meningkatkan laju oksidasi pirit melebihi laju oksidasi yang terjadi secara kimia, tetapi bakteri T. ferrooxidans
juga mampu berinteraksi langsung dengan mineral melalui sekresi ektraselular atau melalui oksidasi dengan enzim spesifik mineral sulfida yang ada di permukaan dinding sel, dengan mengikuti persamaan seperti di bawah ini
FeS2 + H2O + 7/2O2 Fe2+ + 2SO42- + 2H+
Proses pelarutan dan oksidasi mineral oleh bakteri terjadi melalui singgungan langsung bakteri dengan permukaan partikel mineral. Naveke (1986) menggambarkan pentingnya peran bakteri dalam proses pelarutan dan oksidasi pirit seperti pada Gambar 2. FeS2 akan terurai menjadi Fe2+ dan S2-. Selanjutnya
bakteri T. ferrooxidans akan berperan dalam mengoksidasi Fe2+ menjadi Fe3+ seperti disajikan pada Gambar 3(a). T. ferrooxidans mengoksidasi Fe2+ untuk menghasilkan energi yang kemudian dimanfaatkan untuk pertumbuhan dan per-kembangan sel bakteri. Sedangkan S2- atau S0 dioksidasi menjadi SO42- oleh T. ferrooxidans bersama-sama denga n T. thiooxidans, seperti pada Gambar 3. Proses oksidasi S2- menjadi SO42- mengikuti reaksi berikut,
Gambar 2. Proses pelarutan mineral pirit oleh bakteri Thiobacillus sp.
(a)
(b)
Gambar 3. Proses oksidasi besi dan sulfur oleh bakteri Thiobacillus sp.
Bakteri T. ferrooxidans mengoksidasi sulfida menjadi sulfat untuk mendapatkan energi bagi pertumbuhannya. Melalui proses tersebut, T. ferrooxidans mampu melarutkan logam dari senyawa sulfida secara langsung maupun tidak langsung seperti reaksi berikut (Lizama dan Suzuki, 1987),
MS + 2O2 à M2+ + SO42- (secara langsung)
dimana MS adalah logam sulfida dan M2+ adalah ion logam bervalensi 2. Ion Fe2+ dan S0 akan teroksidasi oleh T. ferrooxidans membentuk Fe3+ dan SO42-.
Terbentuknya ion sulfat sangat mempengaruhi kemasaman lingkungan. Pada pH 2.5 sampai 3.5, sulfat akan melarutkan ion- ion logam dari bentuk karbonat dan oksidanya dan relatif rendah terhadap logam sulfida (Greenberg et al., 1992). Disamping itu, adanya ion Fe3+ yang merupakan pengoksida kuat mampu melarutkan mineral- mineral logam sulfida, seperti timbal, tembaga, seng dan kadmium, seperti persamaan berikut :
MS + 2Fe3+ à M2+ + S2- + 3Fe2+
Melalui reaksi tersebut, logam- logam berat dalam mineral sulfida akan teroksidasi menjadi ion logam yang terlarut (Leduc dan Ferroni, 1994). Dengan adanya kandungan sulfat dan logam yang terlarut menyebabkan limbah air asam tambang sangat berbahaya bagi kehidupan flora dan fauna, serta ekosistem secara keseluruhan (Downing, 2002).
Tingkat kemasaman yang tinggi meningkatkan kelarutan logam- logam berbahaya, seperti As, Cd, Cr, Pb, dan Se. Meningkatnya kelarutan logam- logam tersebut akan sangat membahayakan organisme air, karena akan berakibat pada keracunan dan bahkan dapat menyebabkan kematian hewan air. Dengan demikian, peningkatan kelarutan logam berbahaya tersebut akan mempengaruhi keseimbangan ekosistem.
Tingkat kemasaman yang tinggi pada limbah air asam tambang secara langsung maupun tidak langsung mempengaruhi kualitas lingkungan dan kehidupan organisme. Sebagian besar tumbuhan dan hewan tidak mampu hidup pada pH rendah, dan hanya mikroorganisme asidofil yang mampu bertahan dan hidup pada pH rendah (Ingledew, 1990). Sampai saat ini limbah air asam tambang ini belum dikelola dengan baik, sehingga mencemari sistem perairan darat, dan bahkan mencemari perairan pesisir dan laut.
2.2. Teknik Remediasi Air Asam Tambang
proses pasif, sedang Johnson dan Halberg (2005) mengelompokkan teknologi tersebut berdasarkan pada bahan yang digunakan, yakni remediasi abiotik dan remediasi biologi.
Proses aktif lebih sering kali dimaksudkan sebagai aplikasi penambahan bahan alkalis secara terus menerus untuk menetralkan limbah air asam tambang, sedangkan istilah proses pasif adalah penggunakan ekosistem lahan basah (wetland) baik secara alami maupun buatan. Beberapa peneliti mengemukakan bahwa kelebihan dari proses pasif adalah biaya yang dibutuhkan untuk pemeliharaan lahan basah lebih sedikit dibandingkan proses aktif.
2.2.1. Strategi remediasi abiotik
Berdasarkan prosesnya, strategi remediasi abiotik dapat dikelompokkan menjadi teknologi aktif dan teknologi pasif.
2.2.1.1. Teknologi aktif
Teknologi yang banyak berkembang untuk mengurangi dampak negatif air asam tambang adalah proses pengolahan aktif, termasuk didalamnya penambahan bahan kimia yang dapat menetralisir kemasaman limbah. Penambahan bahan alkalin akan meningkatkan nilai pH, mempercepat laju oksidasi ion fero (Fe2+), serta mengendapkan logam terlarut dalam bentuk hidroksida dan karbonat.
2.2.1.2. Teknologi pasif
Salah satu cara penambahan bahan alkalin pada limbah air asam tambang adalah dengan menggunakan anoxic limestone drains (ALD). Teknik ini dimaksudkan untuk menambahkan bahan alkalin (kapur) dalam kondisi anoksik sehingga dapat mempertahankan ion Fe2+ dalam bentuk tereduksi dan mengendapkan Fe(OH)3 dalam kapur. Penambahan bahan kapur akan
meningkatkan nilai pH pada kisaran 6-7 yang akan mendorong pengendapan logam.
Dibandingkan lahan basah kompos buatan (constructed compost wetlands), biaya yang dibutuhkan dalam penerapan teknik ALD jauh lebih sedikit, namun teknik ini tidak dapat diterapkan pada semua limbah air asam tambang. Pada kondisi dimana air asam tambang mengandung ion ferri atau aluminium yang tinggi, penerapan teknik ALD akan memberikan hasil yang cukup baik. Namun dengan adanya endapan hidroksida akan mengurangi permeabilitas drainase, dan hal ini sering terjadi sekitar 6 bulan setelah pembuatan ALD. Oleh karena itu, teknik ALD ini diterapkan dan merupakan bagian dari pengolahan pasif, yang diterapkan bersama-sama dengan lahan basah aerob atau lahan basah kompos. Kleinmann et al. (1998) melaporkan bahwa penambahan ALD pada lahan basah buatan mampu mengolah air asam tambang dengan efektif.
2.2.2. Strategi remediasi biologi 2.2.2.1. Proses biologi
direduksi, seperti nitrat, proses ini tidak banyak berpengaruh terhadap proses pembentukan dan pengolahan air asam tambang.
Mikroorganisme yang mampu melakukan fotosintesis akan memanfaatkan basa lemah (bikarbonat) dan menghasilkan basa kuat (ion hidroksil) seperti persamaan berikut ini,
6HCO3- + 6H2O à C6H12O6 + 6O2 + 6OH-
Reduksi ion Fe3+ yang terlarut tidak menurunkan kemasaman larutan, sedangkan reduksi senyawa Fe3+ dalam bentuk padatan akan mempengaruhi kemasaman larutan, dengan mengikuti persamaan di bawah ini,
Fe(OH)3 + 3H+ + e-à Fe2+ + 3H2O
dimana e- adalah donor elektron yang diperoleh dari bahan organik. Bakteri yang mengkatalisis proses reduksisulfat menjadi sulfida akan menghasilkan kondisi alkalin dengan mengubah asam kuat (H2SO4) menjadi asam yang lebih lemah
(H2S) seperti persamaan berikut ini,
SO42- + 2CH2O + 2H+à H2S + 2H2CO3
H2S dan 2H2CO3 yang terbentuk selama proses reduksi SO42- dalam larutan akan
berkeseimbangan dengan senyawa H2S, HS-, S2-, CO2, HCO3- dan CO32-.
Senyawa tersebut merupakan penyangga sehingga kemasaman larutan menjadi netral atau agak basa.
Peningkatan nilai pH memperbaiki kondisi air asam tambang. Disamping itu, proses reduksi SO42- merupakan mekanisme penting untuk menghilangkan
logam dari air asam tambang. Logam- logam tersebut akan bereaksi dengan sulfida membentuk logam sulfida yang tidak larut, seperti persamaan berikut,
Zn2+ + H2S à ZnS + 2H+
2.2.2.2. Sistem biologi pasif : lahan basah aerob
Pada dasarnya lahan basah aerob adalah buatan manusia yang dibentuk dengan menggali tanah dan mengisinya dengan tanah dan liat sebagai media tumbuh bagi tanaman lahan basah. Air asam tambang kemudian dialirkan dalam lahan basah tersebut.
Laju aliran air asam tambang yang lambat menghasilkan waktu tinggal yang tinggi. Pada proses ini logam akan dihilangkan melalui proses oksidasi dan mengendapkannya dalam bentuk logam oksihidroksida atau logam hidroksida. Sebagai ilustrasi dari reaksi tersebut dapat digambarkan reaksi ion Fe sebagai contoh, seperti pada reaksi di bawah ini,
Fe2+ + 1/4 O2 + H+à Fe3+ + 1/2 H2O
Fe3+ + 2H2O à FeOOH + 3H+
4Fe3+ + 12H2O à 4Fe(OH)3 + 12H+
Proses oksidasi Fe masih menjadi perdebatan, apakah oksidasi tersebut murni oksidasi abiotik, atau dipercepat dengan adanya aktivitas mikroorganisme (Johnson dan Hallberg, 2005).
Tanaman lahan basah memberikan kontribusi meningkatkan kandungan bahan organik melalui zat-zat hasil sekresi dan dekomposisi sisa tanaman. Disamping itu, pengurangan konsentrasi logam sebagian terjadi karena proses pengendapan logam dengan adanya reduksi sulfat secara biologi, dan sebagian kecil juga diserap oleh tanaman.
Keuntungan dari sistem ini adalah biaya yang dibutuhkan relatif kecil dibandingkan dengan sistem aktif. Namun demikian sistem ini juga mempunyai kelemahan, diantaranya adalah bahwa sistem ini menurunkan nilai pH karena adanya pelepasan H+ selama proses pengendapan logam. Disamping itu, proses sistem lahan basah sangat lambat dan membutuhkan lahan yang luas.
2.2.2.3. Sistem biologi pasif : Lahan basah anaerob
menjadi media tumbuh bagi tanaman lahan basah dan sumber energi bagi pertumbuhan bakteri pereduksi sulfat. Bakteri tersebut juga menghasilkan kondisi alkalin melalui proses oksidasi bahan organik dan memanfaatkan energi yang dihasilkan untuk reduksi sulfat. Reaksi pelepasan alkalin oleh bahan kapur dan reduksi sulfat dengan adanya asetat sebagai senyawa organik digambarkan pada persamaan reaksi berikut ini,
CaCO3 + H+à Ca2+ + HCO3
-SO42- + CH3COO-à H2O + CO2 + HCO3- + S
2-Dengan adanya aliran air asam tambang melalui bahan organik menyebabkan kondisi anoksik. Kondisi ini akan mendorong pertumbuhan bakteri pereduksi sulfat dan menghasilkan sulfida. Pada kondisi tidak ada oksigen bebas , oksidasi logam akan berjalan lebih lambat sehingga pembentukan logam oksihidroksida juga lambat dibandingkan dengan kondisi aerob. Hilangnya logam terjadi melalui pengendapan dalam bentuk logam sulfida, sebagian diserap oleh tanaman, dijerap dalam bentuk bahan organik dan dalam bentuk logam hidroksida dan logam oksihidroksida (Wouls dan Ngwenya, 2004). Kelemahan dari sistem ini adalah terjadinya pelapisan batu kapur oleh logam hidroksida dan logam oksihidroksida yang mengendap. Disamping itu, sistem ini membutuhkan area yang cukup luas.
2.2.2.4. Sistem biologi pasif : Successive alkalinity producing system
Successive alkalinity producing system (SAPS) merupakan suatu teknik yang mengkombinasikan teknologi lahan basah kompos dengan anoxic limestone drains (ALD). Pada sistem ini batu kapur diletakkan di bagian dasar, sedangkan bahan organik berada di atas batu kapur. Air asam tambang dilewatkan dan keluar dari sistem melalui bagian dasar sistem. Kandungan oksigen dalam air asam tambang akan berkurang dengan adanya bahan organik, yang kemudian akan melewati batu kapur yang bersifat alkalin (Johnson dan Hallberg, 2005).
2.3. Bakteri Pereduksi Sulfat
sulfat (SO42-), tiosulfat (S2O32-) dan sulfit (SO32-) sebagai akseptor elektron
terminal dalam respirasi metabolismenya, yang kemudian direduksi menjadi sulfida. Disamping itu, untuk memenuhi kebutuhan hidupnya, bakteri pereduksi sulfat juga memerlukan susbtrat organik – umumnya asam organik rantai pendek – seperti asam laktat dan piruvat, yang dihasilkan oleh aktivitas fermentasi bakteri anaerob lainnya. Bakteri pereduksi sulfat merupakan heterotrof anaerob. Sampai saat ini tela h dikenal lebih dari 10 genus bakteri pereduksi sulfat. Bakteri pereduksi sulfat yang dikenal dan ditemukan secara luas di alam antara lain adalah
Desulfovibrio dan Desulfotomaculum (Moodie dan Ingledew, 1991).
Berdasarkan cara penguraian asam organik, bakteri pereduksi sulfat dapat dikelompokkan menjadi dua kelompok (Kleikemper et al., 2002). Kelompok pertama mengoksidasi senyawa donor secara tidak sempurna, dan menghasilkan senyawa asetat. Kelompok Desulfotomaculum yang membentuk spora dan
Desulvofibrio yang tidak membentuk spora merupakan bakteri yang mengoksidasi senyawa organik secara tidak sempurna. Kelompok kedua mampu tumbuh menggunakan alkohol, asetat, asam lemak berbobot molekul tinggi, dan benzoat, seperti Desulfotomaculum acetoxidans, Desulfobacter, Desulfococcus,
Desulfosacrina dan Desulfonema (Detmers et al., 2001). Beberapa spesies dan genus bakteri anaerob dapat bertahan sementara dengan adanya oksigen, namun membutuhkan lingkungan anaerob (tanpa oksigen) untuk pertumbuhannya.
2.3.1. Sumber Karbon dan Energi Bakteri Pereduksi Sulfat
Ada beberapa tipe sumber karbon dan energi yang digunakan oleh bakteri pereduksi sulfat. Lens et al., (1998) mengemukakan bahwa bakteri pereduksi sulfat mampu memanfaatkan berbagai macam sumber karbon. Karbon tersebut merupakan sumber energi bagi aktivitas metabolisme dan kehidupan mikroorganisme. Reaksi reduksi sulfat oleh bakteri pereduksi sulfat mengikuti persamaan seperti berikut,
SO42- + 8e- + 4H2O à S2- + 8OH
juga berfungsi sebagai sumber energi. Skema proses metabolisme reduksi sulfat dan pemanfaatan sumber karbon disajikan pada Gambar 4. Pada tahap awal sumber karbon akan dioksidasi dan menghasilkan ATP, kemudian ATP tersebut dimanfaatkan untuk mereduksi sulfat menjadi sulfida. Pada kondisi dimana hidrogen dipergunakan sebagai donor elektron, maka CO2 akan dimanfaatkan
sebagai sumber karbon. Beberapa sumber karbon yang dapat dipergunakan oleh bakteri pereduksi sulfat disajikan pada Tabel 2.
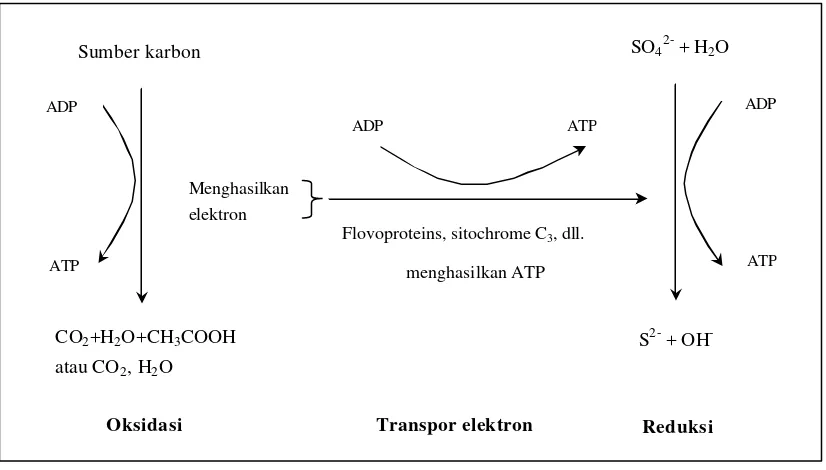
Gambar 4. Skema proses metabolisme reduksi sulfat dan pemanfaatan sumber karbon (Postgate, 1984)
Banyak teori yang membahas mekanisme reduksi sulfat oleh bakteri pereduksi sulfat, salah satunya yang dikemukakan oleh Matias et al., (2005). Pada mekanisme ini, energi yang diperoleh dari oksidasi laktat ditransfer ke hidrogenase yang berada di sitoplasma dan menghasilkan H2. H2 kemudian
dioksidasi kembali untuk menghasilkan elektron, dan melepaskan proton H+ yang dipergunakan untuk mendorong pembentukan ATP. ATP kemudian dipergunakan dalam proses bertahap reduksi sulfat menjadi S2-(Gambar 5).
Sumber karbon
CO2+H2O+CH3COOH
atau CO2, H2O ADP
ATP
Menghasilkan elektron
Flovoproteins, sitochrome C3, dll.
menghasilkan ATP
SO42- + H2O
S2- + OH
-ADP
ATP
ADP ATP
Tabel 2. Donor elektron dan sumber karbon bakteri pereduksi sulfat (Hansen, 1988)
Kelompok Senyawa Sumber karbon dan energi
Anorganik Hidrogen, karbon dioksida
Asam monokarboksilat Format, asetat, propionat, isobutarat, 2- dan 3- metilbutirat, asam lemak C tinggi (sampai C20), piruvat, laktat
Asam dikarboksilat Suksinat, fumarat, malat, oksalat, maleinat, glutarat, pimelat
Alkohol Metanol, etanol, propanol, butanol, glikol etilen, 1, 2 dan 1,3 –
propenediol, gliserol
Asam amino Lisin, serin, sistin, treonin, valin, leusin, isoleusin, aspartat, glutamat, fenolalanin
Lain-lain Kolin, furfural, oksamat, fruktosa, benzoat, 2-, 3-, dan
4-OH-benzoat, sikloheksan karbonat, hipurat, asam nikotin, indol, antranilat, quinolin, fenol, p-cresol, katechol, resorcinol, hidroquinin, protokatechuat, floroglusinol, pirogalol, 4-OH-fenilasetat, 3-fenilpropionat, 2-aminobenzoat, dihydroksiaseton
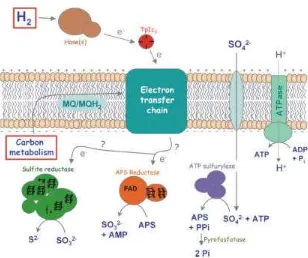
Gambar 5. Skema aliran elektron dalam sel Desulfovibrio, dimana H2 atau
Mekanisme lain adalah yang diusulkan oleh Odom dan Peck (1981). Mekanisme ini merupakan model siklus hidrogen yang dimanfaatkan oleh bakteri yang hidup dengan laktat sebagai sumber karbon organik (Gambar 6). Elektron dari laktat akan digunakan oleh hidrogenase sitoplasma untuk menghasilkan hidrogen yang dapat melewati membran sel dan digunakan oleh dehidrogenase periplasma. Proton yang dihasilkan akan tetap berada di periplasma, sedangkan elektron ditransfer keluar membran sel untuk mereduksi sulfat.
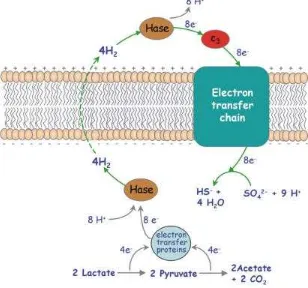
Gambar 6. Skema mekanisme siklus hidrogen untuk menghasilkan energi pada
Desulfovibrio yang tumbuh pada laktat sebagai sumber energi dan sulfat sebagai akseptor elektron (Odom dan Peck, 1981; Dikutip atas ijin Carrondo, 2009).
Desulfotomaculum thermocisternum merupakan bakteri yang memanfaatkan hidrogen sebagai donor elektron dalam mereduksi sulfat (Nielsen
et al., 1996). Beberapa spesies bakteri pereduksi sulfat dilaporkan mampu mengoksidasi bahan organik seperti alkana (C13 sampai C18), 1-alkena (C15 dan
m-etiltoluen, p-xylen, naftalena, etilbenzen dan benzen (Perez-Jimenez et al., 2001; Elshahed dan McInerney, 2001; Morash et al., 2001; Harms et al., 1999; So dan Young, 1999; Nakagawa et al., 2002), sedangkan Widdel (1992) dan Dhillon et al. (2003) melaporkan bahwa Desulfobacterium memanfaatkan dan menguraikan asam lemak rantai pendek, etanol dan laktat.
Berdasarkan kemampuannya dalam mengoksidasi sumber karbon, bakteri pereduksi sulfat dibagi menjadi dua kelompok, yakni (1) kelompok yang mengoksidasi sumber karbon secara sempurna menjadi CO2, dan (2) kelompok
yang mengoksidasi sumber karbon tidak sempurna menghasilkan asetat dan CO2.
Beberapa spesies dari genus Desulfobacter, Desulfosarcina, Desulfococcus, Desulfobacterium, Desulfoorculus, Desulfomonile dan Desulfonema termasuk dalam kelompok yang mengoksidasi sumber karbon secara sempurna, termasuk beberapa spesies diantaranya adalah Desulfotomaculum acetoxidans, Desulfotomaculum sapomandens dan Desulfovibrio baarsii (Postgate, 1984; Colleran et al., 1995). Spesies bakteri pereduksi sulfat yang mengoksidasi sumber karbon secara tidak sempurna antara lain adalah Desulfovibrio thermophilus, Desulfovibrio sapovarans, Desulfomas pigra, Thermodesulfobacterium commune, dan sebagian besar spesies dari genus
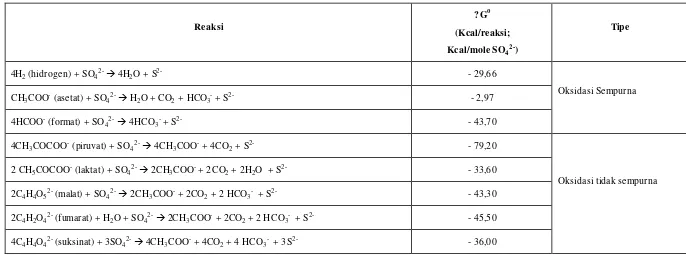
Desulfotomaculum, Desulfomonas dan Desulfobulbus (Colleran et al., 1995). Tabel 3 menyajikan standar energi yang dibutuhkan (? Go) dalam proses oksidasi beberapa sumber karbon yang berbeda.
Postgate (1984) mengemukakan bahwa laktat merupakan sumber karbon yang paling banyak dimanfaatkan oleh bakteri pereduksi sulfat. Kelemahan penggunaan laktat adalah bahwa hanya sebagian dari laktat yang dioksidasi menjadi asetat dan CO2, sehingga jumlah laktat yang dibutuhkan untuk mereduksi
sulfat lebih banyak. Disamping itu, dengan adanya asetat yang dihasilkan menyebabkan peningkatan COD pada sistem perairan.
Tabel 3. Data termodinamika oksidasi beberapa sumber karbon dan energi selama reduksi sulfat secara biologi (Postgate, 1984).
Reaksi
? Go
(Kcal/reaksi;
Kcal/mole SO42-)
Tipe
4H2 (hidrogen) + SO42-à 4H2O + S2- - 29,66
Oksidasi Sempurna
CH3COO- (asetat) + SO42-à H2O + CO2 + HCO3- + S2- - 2,97
4HCOO- (format) + SO42-à 4HCO3- + S2- - 43,70
4CH3COCOO- (piruvat) + SO42-à 4CH3COO- + 4CO2 + S2- - 79,20
Oksidasi tidak sempurna
2 CH5COCOO- (laktat) + SO42-à 2CH3COO- + 2CO2 + 2H2O + S2- - 33,60
2C4H4O52- (malat) + SO42-à 2CH3COO- + 2CO2 + 2 HCO3- + S2- - 43,30
2C4H2O42- (fumarat) + H2O + SO42-à 2CH3COO- + 2CO2 + 2 HCO3- + S2- - 45,50
4C4H4O42- (suksinat) + 3SO42-à 4CH3COO- + 4CO2 + 4 HCO3- + 3S2- - 36,00
2 C3H5O3- + SO42- à 2 CH3COO- + 2 CO2 + 2 H2O + S
2-(laktat) (asetat)
Reduksi sulfat dapat terjadi pada kisaran pH, tekanan, suhu dan salinitas yang lebar, namun ketersediaan senyawa karbon sebagai donor elektron dan molekul hidrogen dapat menjadi pembatas. Disamping itu, reduksi sulfat juga dihambat oleh kehadiran oksigen, nitrat, dan ion Fe (III), dan kehadiran bakteri metanogenik yang juga memanfaatkan donor elektron (Bratcova et al., 2002).
2.3.2. Peranan Bakteri Pereduksi Sulfat
Bakteri pereduksi sulfat adalah bakteri yang memanfaatkan sulfat (SO42-),
tiosulfat (S2O32-), sulfit (SO32-) sebagai penerima elektron di dalam respirasi
metabolismenya (Hockin dan Gadd, 2003). Dalam respirasinya bakteri pereduksi sulfat memerlukan substrat organik sebagai donor elektron. Substrat organik tersebut umumnya berupa asam-asam organik rantai pendek seperti asam laktat, piruvat, dan asam organik lainnya. Di alam substrat tersebut dihasilkan dari aktivitas fermentasi bakteri anaerob lainnya.
Bakteri pereduksi sulfat juga menggunakan H2 sebagai sumber donor
elektron yang utama, seperti yang terjadi pada reaktor laju tinggi. Bakteri pereduksi sulfat akan menggunakan senyawa karbon jika ketersediaan sulfat melebihi ketersediaan hidrogen yang dapat dioksidasi, yakni 4 mol hidrogen per mol sulfat (Tsukamoto dan Miller, 1999).
Oksidasi asam laktat oleh bakteri pereduksi sulfat menjadi asam piruvat berlangsung dengan bantuan enzim dehidrogenase. Piruvat kemudian dikonversi menjai asetil fosfat dan karbondioksida dengan melepaskan ion hidrogen. Rangkaian transformasi laktat ini melibatkan enzim piruvat dehidrogenase, fosfotransasetilase dan sitoplasmik hidrogenase yang dimiliki oleh kelompok bakteri pereduksi sulfat (Ogata dan Yagi, 1986; Czechowski dan Rossmoore, 1990).
Kelompok bakteri pereduksi sulfat mengoksidasi bahan organik dan H2
2 CH2O + SO42- à H2S + 2 HCO3- (x)
5 H2 + SO42- à H2S + 4 H2O + 2e (y)
Pembentukan bikarbonat mengindikasikan kemampuan bakteri pereduksi sulfat dalam mengontrol pH di sekitar lingkungan mikronya (Cohen, 2005). Ion bikarbonat yang dihasilkan selama proses reduksi sulfat akan membentuk kesetimbangan antara CO2, HCO3-, dan CO32-. Meskipun demikian, ion
bikarbonat merupakan bentuk utama yang terdapat pada pH optimal dimana respirasi secara desimilasi sulfat oleh bakteri pereduksi sulfat berlangsung. Peningkatan pH tersebut akan meningkatkan proses hidrolisa dan pengendapan beberapa ion logam dalam bentuk hidroksida dan oksida (Stumm dan Morgan, 1981).
Proses reaksi ion sulfida juga dipengaruhi oleh pH lingkungan dimana reaksi berlangsung. Bentuk kesetimbangannya seperti pada persamaan berikut,
H2S (g) H2S (l) HS- S2- (Lens et al., 1998)
dimana HS- terbentuk pada pH netral, S2- terbentuk pada pH tinggi dan bersifat terlarut, sedang H2S terbentuk pada pH rendah dan bersifat tidak terlarut. Ion
sulfida (S2-) yang terbentuk akan bereaksi dengan ion logam terlarut untuk membentuk lo gam sulfida yang tidak larut mengikuti persamaan berikut,
M2+ + S2- MS (s)
dimana M2+ adalah kation logam bervalensi dua.
Proses reduksi sulfat sangat dipengaruhi oleh beberapa kondisi, antara lain waktu tinggal, pH, suhu, oksigen terlarut, dan potensial redoks. Bakteri pereduksi sulfat adalah bakteri anaerob obligat yang membutuhkan lingkungan mikro anaerob dengan nilai potensial redoks < -100 mV. Willow dan Cohen (2003) mengemukakan bahwa pH optimal bagi pertumbuhan bakteri pereduksi sulfat berkisar antara 5 sampai 8, sedang Suyasa (2002) memperoleh bahwa bakteri pereduksi sulfat yang diisolasi dari ekosistem air hitam Kalimantan mampu menyesuaikan diri pada pH 2.5, dan menunjukkan pertumbuhan yang pesat pada kisaran pH antara 4 dan 7.
pKa(7.0) pKa(12.9)
2.4. Teknologi Biofilm
Biofilm adalah sekumpulan sel mikroorganisme yang melekat erat ke suatu permukaan sehingga berada dalam keadaan diam, tidak mudah lepas atau berpindah tempat. Pelekatan ini disertai dengan penumpukan bahan organik yang diselubungi oleh matrik polimer ekstraseluler yang dihasilkan oleh bakteri tersebut (Donian, 2002). Pembentukan biofilm tersebut menciptakan kondisi lingkungan yang optimal bagi aktivitas mikrob (Santegoeds et al., 1998).
Biofilm terbentuk karena adanya interaksi antara bakteri dan permukaan yang ditempeli. Interaksi ini terjadi sangat ditentukan oleh beberapa faktor seperti kelembaban permukaan, ketersediaan makanan, pembentukan matrik ektraseluler, serta faktor fisiko-kimia lainnya seperti interaksi muatan permukaan dan bakteri, ikatan ion, ikatan van der Walls, pH, dan tegangan permukaan (Donian, 2002).
Waktu yang diperlukan untuk membentuk biofilm sangat beragam, tergantung dari jenis mikrob, permukaan bahan penempelan dan kondisi lingkungan. Bakteri pereduksi sulfat mulai membentuk biofilm antara 1-2 minggu setelah inkubasi. Santegoeds et al. (1998) melaporkan bahwa bakteri pereduksi sulfat mulai membentuk biofilm satu minggu setelah inokulasi, sedang Beyenal dan Lewandowski (2004) mendapatkan bahwa pada media hematit biofilm bakteri pereduksi sulfat mulai terbentuk 2 minggu setelah inkubasi.
Acinetobacter calcoaceticus mulai terimobilisai membentuk biofilm 24 jam setelah inokulasi (Hrenovic et al., 2005). Selanjutnya dikemukakan bahwa kecepatan pembentukan biofilm juga ditentukan oleh tipe permukaan dan ukuran partikel.
Kelebihan mikrob yang membentuk biofilm antara lain adalah sel mikrob mampu bertahan pada kondisi makanan yang terbatas (Marshal, 1998). Disamping itu, Watnik dan Kolter (2000) mengemukakan bahwa sel dalam bentuk biofilm mempunyai kemampuan bertahan yang lebih baik pada kondisi yang tidak menguntungkan. Pada mikrob patogen, sel mempunyai laju transfer gen yang lebih tinggi dibandingkan dengan pada sel plankton.
aliran yang lebih tinggi (Hrenovic et al., 2005). Kondisi ini yang memungkinkan bahwa teknologi biofilm mampu meningkatkan efisiensi bioremediasi. Masak et al. (2003) membuktikan bahwa dengan menggunakan teknik biofilm laju penghilangan meningkat secara signifikan.
Melihat keunggulan biofilm, teknologi ini telah banyak diterapkan pada pengendalian pencemaran lingkungan, terutama untuk menguraikan senyawa organik menjadi senyawa anorganik, seperti penguraian pentan dengan menggunakan Arthrobacter sp. (Ionata et al., 2005), penguraian limbah toluen (Di Lorenzo et al., 2005), remediasi limbah merkuri (von Canstein et al., 2001), serta dalam pencemaran lingkungan lainnya.
2.5. Pembentukan Biofilm
Pada kondisi yang memungkinkan, secara alami mikroorganisme akan membentuk biofilm. Lingkungan yang ideal untuk membentuk biofilm adalah jika ada kontak antara permukaan benda padat dengan cairan. Menurut Donian (2002), pembentukan biofilm diawali dengan pengkondisian permukaan padatan, yakni dengan penempelan molekul bahan organik pada permukaan padatan. Hal ini terjadi segera setelah terjadi kontak antara permukaan benda padat dengan cairan. Pada tahapan berikutnya, sel bakteri akan melekat ke permukaan dengan adanya daya tarik elektrostatis dan fisik. Sel bakteri tersebut selanjutnya menempel pada permukaan padatan dengan adanya extracellular polymeric substances (EPS). O’Toole (2003) mengemukakan bahwa EPS tersebut tidak hanya berfungsi sebagai bahan pengikat antara sel dengan permukaan padatan, tetapi berperan dalam sistem pertukaran ion untuk mengikat nutrisi dalam air yang dibutuhkan untuk pertumbuhan sel. Pada saat ketersediaan nutrisi mencukupi, sel bakteri berkembang dan sel baru membentuk EPS tersendiri. Perkembangan semacam ini terus berlanjut, sehingga membentuk kelompok koloni yang saling terkait.
permukaan sel sangat mempengaruhi proses adhesi karena permukaan yang hidrofobik meningkatkan interaksi dengan permukaan padatan. Keberadaan fimbirae dan flagela juga mempengaruhi kecepatan pelekatan sel ke permukaan dengan cara mengurangi pengaruh daya tolak yang terjadi antar permukan.
Proses pembentukan biofilm juga dipengaruh oleh faktor lingkunga n, diantaranya adalah permukaan bahan padatan, luas area permukaan, kecepatan laju alir dan ketersediaan nutrisi. Karakteristik permukaan bahan padatan menjadi faktor kunci yang menentukan proses penempelan sel bakteri (Donian, 2002). Penempelan koloni bakteri lebih mudah terjadi pada permukaan yang kasar. Hal ini dikarenakan pada permukaan yang kasar, pemukaan padatan semakin luas. Karakateristik fisiko-kimia permukaan juga sangat menentukan laju penempelan. Sel bakteri lebih cepat menempel pada permukaan hidrofobik dan non polar dari permukaan yang bersifat hidrofilik. Bakteri pada umumnya mempunyai muatan negatif, tetapi masih mempunyai komponen permukaan hidrofobik. Cordas et al.
III. METODE PENELITIAN
3.1. Metode PenelitianPenelitian ini terdiri dari 4 kegiatan. Kegiatan 1 dilaksanakan dengan menggunakan metode deskriptif, kegiatan 2 sampai 4 menggunakan metode eksperimen di laboratorium.
3.1.1. Tahapan Kegiatan Penelitian
Kegiatan penelitian dilaksanakan dalam empat tahapan seperti pada bagan berikut :
Gambar 7. Bagan pelaksanaan kegiatan penelitian
3.1.2. Lokasi dan Waktu Penelitian
Pelaksanaan kegiatan penelitian dilakukan di beberapa laboratorium. Kegiatan isolasi bakteri pereduksi sulfat sampai pengolahan air asam tambang pada reaktor biofilm dilakukan di Laboratorium Bioteknologi Lingkungan,
Indonesian Center for Biodiversity and Biotechnology (ICBB), Bogor. Identifikasi bakteri hasil isolasi dilakukan di Laboratorium Mikrobiologi Fakultas
Kegiatan Pertama
Eksplorasi dan identifikasi bakteri pereduksi sulfat
Kegiatan Kedua
Pertumbuhan bakteri pereduksi sulfat pada berbagai kondisi lingkungan
Kegiatan Ketiga
Pengolahan air asam tambang dengan reaktor anaerob bakteri pereduksi sulfat tersuspensi
Kegiatan Keempat
Kedokteran Hewan IPB, sedangkan pengamatan pembentukan biofilm pada batu vulkan menggunakan Scanning Electron Microscopy dilakukan di Laboratorium Pengujian Material, Pusat Penelitian Metalurgi, LIPI Serpong. Analisa kimia dilakukan di Laboratorium Tanah, Balai Penelitian Penelitian Obat dan Aromatik Bogor. Penelitian secara keseluruhan dilaksanakan selama 24 bula n, mulai Februari 2007 sampai Februari 2009.
3.2. Pelaksanaan Penelitian
3.2.1. Eksplorasi dan Identifikasi Bakteri Pereduksi Sulfat 3.2.1.1. Isolasi
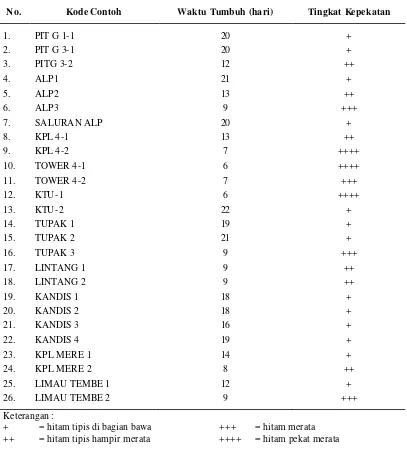
Bakteri pereduksi sulfat diisolasi dari ekosistem air asam di kolam penampungan air asam tambang indus tri batu bara PT Bukit Asam, Sumatera Selatan. Lokasi pengambilan sampel dilakukan di beberapa titik pada kolam penampungan air asam tambang. Sebanyak 26 sampel tanah diambil dari sedimen (bagian bawah) perairan, sesuai dengan metode pengambilan sampel mikrobiologi tanah. Sampel diambil sebanyak 100-200 g tanah, dimasukkan ke dalam tabung berwarna gelap, kemudian diisi air hingga penuh dan dikemas dalam kondisi anaerob dengan cara ditutup rapat.
secara perlahan- lahan sampai penuh dan ditutup rapat. Media tersebut kemudian diinkubasi pada suhu 35 oC.
Tumbuhnya bakteri pereduksi sulfat ditandai dengan berubahnya media menjadi berwarna hitam (dengan terbentuknya sulfida) yang menunjukkan aktivitas bakteri pereduksi sulfat. Pengamatan dilakukan saat perubahan warna hingga seluruh media berwarna hitam. Isolat yang tumbuh diberi skor tingkat kepekatan wana hitamnya.
3.2.1.2. Pemurnian
Pemurnian isolat dilakukan dengan metode pengenceran (Tauro et al., 1986). Isolat yang diperoleh dikocok dengan vorteks hingga terbentuk suspensi. Tingkat pengenceran sepuluh kali dilakukan dengan memindahkan secara aseptik 1 mL suspensi mikrob ke dalam tabung yang berisi 9 mL larutan fisiologi 0,85% lalu dihomogenisasi. Suspensi tersebut diencerkan lebih lanjut dengan cara yang sama hingga pada tingkat pengenceran 1012. Suspensi pada tingkat pengenceran terakhir dipindahkan secara aseptik sebanyak 1 mL ke dalam tabung ulir yang telah berisi media cair steril 1/3 bagian, lalu media ditambahkan secara perlahan-lahan hingga penuh dan ditutup rapat dan diinkubasi pada suhu 35 oC. Pengamatan dilakukan terhadap waktu pertumbuhan biakan mulai dari munculnya warna hitam hingga seluruh tabung menghitam. Isolat yang tumbuh pada tingkat pengenceran terakhir diindikasikan sebagai biakan dengan satu jenis sel bakteri pereduksi sulfat.
3.2.1.3. Seleksi