KARAKTERISASI SENYAWA ANTIMIKROBA DARI
BAKTERI
Lactobacillus fermentum
DENGAN
MEDIA
WHEY
DANGKE
RAJMI FARIDAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Karakterisasi Senyawa Antimikroba dari Bakteri Lactobacillus fermentum dengan Media Whey Dangke
adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2017
Rajmi Faridah
RINGKASAN
RAJMI FARIDAH. Karakterisasi Senyawa Antimikroba dari Bakteri
Lactobacillus fermentum dengan Media Whey Dangke. Dibimbing oleh EPI
TAUFIK dan IRMA ISNAFIA ARIEF.
Dangke merupakan makanan khas Kabupaten Enrekang yang dibuat tanpa melalui proses fermentasi. Proses pembuatan dangke menghasilkan by product
(hasil sampingan) berupa whey. Whey dangke dapat digunakan sebagai media
pertumbuhan bakteri asam laktat karena mengandung nutrisi yang tinggi.
Lactobacillus fermentum (L. fermentum) merupakan salah satu bakteri asam laktat
yang mampu menghasilkan bakteriosin. Tujuan dari penelitian adalah untuk menganalisis potensi dangke sebagai media pertumbuhan L. fermentum asal
dangke untuk menghasilkan bakteriosin.
Strain L. fermentum asal dangke yang digunakan yaitu A323L, B323K, dan
C113L. Metode penelitian meliputi beberapa tahap yaitu persiapan Bakteri Asam Laktat (BAL) dan bakteri patogen, pengujian nutrisi whey, pewarnaan Gram,
pembuatan kurva pertumbuhan, dan purifikasi bakteriosin. Peubah yang diamati yaitu total BAL, nilai pH, total asam tertitrasi (TAT), aktivitas antimikroba bakteri L. fermentum, konsentrasi protein dan aktivitas antimikroba bakteriosin.
Total BAL, Nilai TAT, nilai pH dianalisis menggunakan rancangan acak kelompok (RAK) pola faktorial, sedangkan aktivitas antimikroba bakteri, antimikroba bakteriosin dan konsentrasi protein dianalisis dengan menggunakan rancangan acak lengkap (RAL), data yang berbeda nyata dianalisis lebih lanjut dengan uji Duncan.
Hasil penelitian menunjukkan bahwa fase logaritmik pada kurva pertumbuhan L. fermentum A323L yaitu pada waktu inkubasi 24-28 jam
sedangkan B323K dan C113L pada waktu inkubasi 20-24 jam. Zona hambat yang dihasilkan oleh semua strain L. fermentum termasuk kategori lemah karena
diameternya hanya kurang lebih 3 mm.
Whey dangke dapat dimanfaatkan sebagai media pertumbuhan L. fermentum
asal dangke karena BAL tersebut mampu mencapai fase pertumbuhan logaritmik. Namun kebutuhan nutrisi dalam media whey dangke belum tercukupi untuk
menghasilkan bakteriosin. L. fermentum strain A323L, B323K, C113L asal
dangke hanya mampu menghasilkan daya hambat kategori lemah (zona hambat kurang dari 3 mm) pada media whey dangke. Namun diantara ketiganya, strain
yang terbaik adalah C113L.
Kata kunci: Lactobacillus fermentum, whey dangke, bakteriosin
SUMMARY
RAJMI FARIDAH. The Characterization of Antimicrobial Coumpounds of
Lactobacillus fermentum with Whey Dangke Medium. Supervised by EPI
TAUFIK dan IRMA ISNAFIA ARIEF.
Dangke is a local dairy product of Enrekang, South Sulawesi, produced from cow's milk or buffalo without fermentation. Dangke processing produced a by-product called whey. Nutritional components in whey can be utilized by lactic
acid bacteria (LAB) as a nutritional source of growth. One of bacteriocin producing lactic acid bacteria is Lactobacillus fermentum (L. fermentum). The
study was aimed to utilize whey as growth media of L. fermentum isolated from
dangke, and analyze its bacteriocins production.
L. fermentum strain isolated from dangke, which used in this research were
A323L, B323K, and C113L. Research method consist of preparation of LAB and pathogenic bacteria, whey nutrient analysis, Gram staining, manufacture of the
growth curve and purification of bacteriocins. The variables observed were total LAB, pH value, total titratable acid (TTA), antimicrobial activity of L. fermentum, protein concentration and bacteriocin antimicrobial activity. Factorial
randomized block design was used for analysis total titratable acidity, pH value, and total bacteria. Whether completely randomized design was used for analysis of antimicrobial activity, bacteriocin and protein concentration. Data were analyzed by analysis of variance, and if the significant different were found, Duncan test was then used.
The result showed that, the incubation time of L. fermentum strain A323L
were occurred in were at the incubation time of 24-28 hours, whilst strain B323K and C113L were at 20-24 hours.
Dangke whey can be used as a medium for the growth of L. fermentum it is
capable of achieving a logarithmic growth phase. The nutritional requirements of the bacteria has not been fulfilled by whey dangke as medium to produce
bacteriocins. Inhibition zone of all strain of L. fermentum was categorized as weak
in whey dangke medium, but strain C113L was the best among them.
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Produksi dan Teknologi Peternakan
KARAKTERISASI SENYAWA ANTIMIKROBA DARI
BAKTERI
Lactobacillus fermentum
DENGAN
MEDIA
WHEY
DANGKE
RAJMI FARIDAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepasa Allah SWT, atas rahmat dan karunia yang telah diberikan-Nya sehingga penyusunan tesis ini daat diselesaikan. Shalawat dan salam semoga senantiasa dicurahkan kepada nabi Muhammad SAW. Judul yang dipilih dalam penelitian ini dilaksanakan sejak
bulan Desember 2015 sampai Mei 2016 ialah Karaterisasi Senyawa Antimiroba
i Bakteri Lactobacilus fermentum dengan Media Whey Dangke.
Terima kasih penulis ucapkan kepada pihak-pihak yang telah banyak membatu dalam proses penyelesaian tesis ini, terutama kepada bapak r Epi
Tauik, SPt MVPH MSi selaku ketua komisi pembimbing, dan Ibu Dr Irma lsnaia Arief, SPt MSi selaku anggota komisi pembimbing, atas dukungan selama membimbing penulis sejak penyusunan proposal dan pelaksanaan enelitian hinga selesainya enulisan tesis ini. Terima kasih kepada Ibu Prof Dr drh Hj Miaay B Sudawanto selaku penguji luar komisi aas saran dan nasehat
keada penulis.
Terima kasih kepada Diretorat Jenderal Pendidikan Tinggi (DIKTI) yang telah memerikan Beasiswa Fresh Graduate (FG) kepada penulis. Dwi Febriantini
n se1h safLaboratorium Teknologi Hasil Temak dan Laboratorium Faku1tas
Paan IPB terima kasih atas banannya selama enulis melaksn
penelitian.
Terima kasih yang tak terhingga penulis haturkan kepada Ayahanda Abd. Rajah n Ibunda Djamilah sera adik-adik penulis (Rajma Fastawa n Najmi
Nilaidah) atas doa dan dukungan yang tiada henti untuk penulis. Tenan-tean ann 2014 Prorm Studi Ilmu Produksi dn Teknologi Petemakan s do' a,
dukungan dan kebersamaannya selama mengikuti pendidikan. Tenan satu tim enulis Hasniar Burhan SPt, Andi Nurul Mukhlisah SPt, dan Setiawan Putra Syah St MSi, serta sahabat penulis Fadliah SPt dan Wahyuni SPt yang senantiasa memberi dukungan dan bantuan kepada enulis. Pihak-pihak lain yang membantu dan mendukung penulis selama ini yang tidak dapat enulis sebutkan u ersatu.
Semoga tesis ini bermanfaat bagi masyarakat dan perkembangan ilmu pengetahuan.
Bogor, Febrari 2017
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
2 METODE 3
Waktu dan Tempat Penelitian 3
Bahan dan Peralatan 3
Prosedur Penelitian 3
Rancangan Percobaan dan Analisis Data 6
3 HASIL DAN PEMBAHASAN 7
Komponen Nutrisi Whey Dangke 7
Karakteristik L. fermentum A323L, B323K, C113L 8 Kurva Pertumbuhan L. fermentum A323L, B323K, C113L 9
Aktivitas Antimikroba 13
Konsentrasi Protein 15
Aktivitas Antimikroba Strain L. fermentum setelah purifikasi 16
4 SIMPULAN DAN SARAN 17
Simpulan 17
Saran 17
DAFTAR PUSTAKA 18
LAMPIRAN 21
DAFTAR TABEL
1 Kandungan Nutrisi Whey Dangke 8
2 Karakteristik Strain L. fermentum 9
3 Pertumbuhan L. fermentum A323L, B323K, C113L 11
4 Hasil Uji Aktivitas Antimikroba L. fermentum A323L, B323K, C113L 13
5 Hasil Uji Aktivitas Antimikroba bakteriosin 17
DAFTAR GAMBAR
1 Gambaran Umum Penelitian 2
2 Kurva Pertumbuhan L. fermentum A323L, B323K, C113L 10
3 Zona hambat aktivitas strain L. fermentum A323L, B323K, C113L 14
4 Konsentrasi protein strain L. fermentum A323L, B323K, C113L 15
DAFTAR LAMPIRAN
1 Analisis Ragam nilai total BAL L. fermentum asal dangke 22
2 Analisis Ragam nilai TAT L. fermentum asal dangke 24
3 Analisis Ragam nilai pH L. fermentum asal dangke 24
4 Analisis Ragam Aktivitas Antimikroba Strain L. fermentum terhadap
E. coli 25
5 Analisis Ragam Aktivitas Antimikroba Strain L. fermentum terhadap
S.aureus 25
6 Analisis Ragam Konsentrasi Protein 25
7 Analisis Ragam Aktivitas Antimikroba bakteriosin terhadap E. coli 26
8 Analisis Ragam Aktivitas Antimikroba Strain bakteriosin terhadap
S. aureus 26
9 Uji t-student daya hambat L. fermentum terhadap E.coli dan S.aureus 26
1
1 PENDAHULUAN
Latar Belakang
Bakteri asam laktat (BAL) adalah bakteri yang mampu memfermentasikan gula atau karbohidrat untuk memproduksi asam laktat dalam jumlah besar. Ciri-ciri bakteri asam laktat secara umum adalah selnya bereaksi positif terhadap pewarnaan Gram, bereaksi negatif terhadap katalase dan tidak membentuk spora (Carr et al. 2002). BAL bersifat anaerob fakultatif yang mampu hidup pada
berbagai habitat yang cukup luas di alam seperti pada tanaman, saluran pencernaan hewan dan manusia, pada produk makanan kalengan, produk susu, produk fermentasi, buah-buahan dan sayur-sayuran tropis (Makarova et al. 2006).
BAL yang secara alami terdapat dalam pangan dan pemanfaatannya dalam proses fermentasi yang aman dan bermanfaat terhadap kesehatan menjadikannya sebagai
GRAS (Generally Recognized as Safe) untuk dikonsumsi oleh manusia
(FAO/WHO 2002).
Keunggulan dari BAL yaitu sifatnya yang mampu menghambat bakteri patogen karena menghasilkan senyawa antimikroba yaitu bakteriosin. Bakteriosin
yang dihasilkan oleh BAL sangat menguntungkan untuk diterapkan pada industri makanan pada umumnya terutama makanan-makanan hasil fermentasi karena aman untuk kesehatan manusia (Karpinski dan Szkaradkiewicz 2013). Kelebihan dari bakteriosin sebagai pengawet tersebut yaitu aktivitasnya yang mampu menghambat pertumbuhan beberapa bakteri kontaminan penyebab pembusukan makanan dan penyakit yang ditularkan melalui makanan (food borne disease)
(Abdelbasset dan Djamila 2008).
Salah satu jenis BAL yang dapat menghasilkan bakteriosin yaitu
Lactobacillus fermentum (L. Fermentum) (Adedire, et al. 2016; Singh et al.
2013; Yong et al. 2010). Syah et al. (2016) mengemukakan bahwa L. fermentum
dapat diisolasi dari dangke (sejenis keju segar yang dihasilkan dari susu sapi atau kerbau tanpa proses fermentasi). Faktor yang sangat berpengaruh untuk pertumbuhan L. fermentum yaitu media pertumbuhannya (Fardiaz, 1992a). Media
pertumbuhan L. fermentum yang umum digunakan yaitu de Man Rogosa Sharp Broth (MRSB), namun harga di pasaran sangat tinggi. Oleh karena itu perlu
adanya alternatif pengganti yang relatif lebih murah. Beberapa penelitian mengemukakan bahwa whey kefir dan whey dari berbagai jenis keju dapat
dimanfatkan sebagai alternatif pengganti media tersebut (Almeida et al. 2008;
Gorsek dan Pecar, 2016; Horackova et al. 2014; Lavari et al. 2016). Whey
merupakan hasil sampingan (by product) dari pembuatan keju dan produk
sejenisnya yang pada umumnya belum termanfaatkan secara maksimal.
Whey dari pembuatan dangke Di Kabupaten Enrekang, Propinsi Sulawesi
Selatan, belum dimanfaatkan secara maksimal, sebagian besar hanya terbuang ke lingkungan menjadi limbah. Whey dangke mengandung beberapa nutrisi yaitu
asam laktat, lemak, protein, dan laktosa (Fatma et al. 2012). Studi tentang
pemanfaatan whey dangke sebagai media pertumbuhan L. fermentum asal dangke
untuk menghasilkan bakteriosin belum banyak dilakukan. Oleh karena itu sangat penting dilakukan kajian tentang pertumbuhan L. fermentum asal dangke tersebut
pada media whey dangke.
2
Perumusan Masalah
Whey dangke di Kabupaten Enrekang sebagian dimanfaatkan oleh peternak
sebagai minuman untuk pedet dan sebagai pupuk cair. Pemanfaatan whey dangke
tersebut belum maksimal karena whey masih ada yang terbuang menjadi limbah
setelah proses pembuatan dangke. Whey dangke memiliki kandungan nutrisi yang
dapat dimanfaatkan untuk pertumbuhan BAL. Oleh karena itu dalam penelitian ini dilakukan upaya penggunaan media alternatif untuk pertumbuhan BAL penghasil bakteriosin.
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk menganalisis whey dangke sebagai
media pertumbuhan L. fermentum asal dangke dan menganalisis produksi
bakteriosin L. fermentum asal dangke pada media pertumbuhan whey dangke.
Manfaat Penelitian
Memberikan informasi mengenai karakteristik whey dangke sebagai media pertumbuhan bakteri dan bakteriosin yang dihasilkan oleh L. fermentum asal
dangke pada media whey dangke.
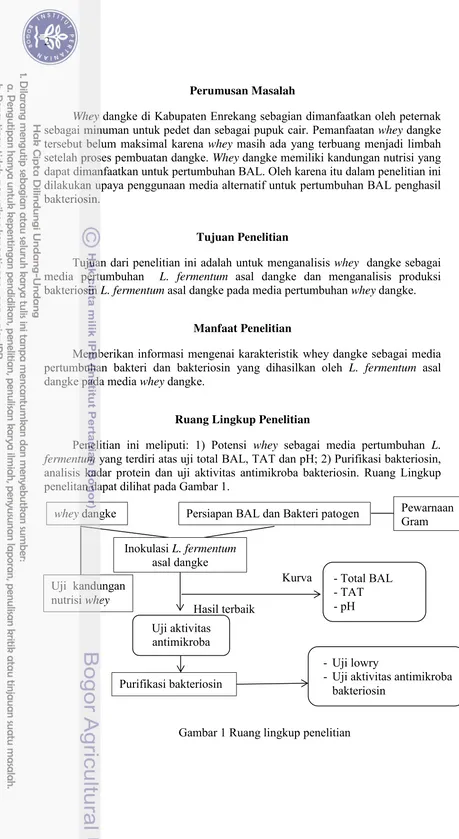
Ruang Lingkup Penelitian
Penelitian ini meliputi: 1) Potensi whey sebagai media pertumbuhan L. fermentum yang terdiri atas uji total BAL, TAT dan pH; 2) Purifikasi bakteriosin,
analisis kadar protein dan uji aktivitas antimikroba bakteriosin. Ruang Lingkup penelitan dapat dilihat pada Gambar 1.
whey dangke Persiapan BAL dan Bakteri patogen
3
2 METODE PENELITIAN
Waktu dan Tempat
Penelitian ini telah dilaksanakan pada bulan Desember 2015 – Mei 2016. Pembuatan whey dangke dilaksanakan di Laboratorium Teknologi Hasil Ternak
Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor, uji kandungan nutrisi whey dangke dilaksanakan di
Laboratorium PT. Bukit Baros, Sukabumi. Pembuatan kurva pertumbuhan, purifikasi bakteriosin, uji aktivitas antimikroba dan uji lowry dilaksanakan di Laboratorium Terpadu Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Bahan dan Alat
Bahan utama dalam penelitian ini adalah whey dangke, strain L. fermentum
A323L, B323K, dan C113L (Syah et al. 2016), papain murni 0,3%, kristal violet,
iodine, safranin, MRSB, de Man Rogosa Sharp Agar (MRSA), Muller Hinton Agar (MHA), Tryptic Soy Agar (TSA), Trypticase Soy Broth (TSB), alkohol,
spirtus, akuades, Natrium klorida (NaCl), Natrium hidroksida (NaOH) 0,1 N, indikator Phenolphthalein (PP), bakteri patogen yaitu Eschericia coli (E. coli)
ATCC 25922, dan Staphylococcus aureus (S. Aureus) ATCC 25293, amonium
sulfat, Kalium dihidrogen fosfat (KH2PO4), Kalium hidrogen fosfat (K2HP4),
Natrium karbonat (Na2CO3), Natrium Kalium Tartarat (Na-K-Tatrat), Copper
sulphate (CuSO4), folin, Bovine Serum Albumin (BSA), paper disc diameter 5.5
mm membran saring miliphore berdiameter 0.22 µm.
Alat yang digunakan yaitu tabung reaksi, cawan petri, gelas piala, botol,
Erlenmeyer, pipet volumetrik, objek glass, paper glass, mikropipet, tip, bunsen,
pemanas, alat sentrifuse, timbangan analitik, autoklaf, refrigerator, freezer, inkubator, waterbath, colony counter, vortex, pHmeter SCHOTT, buret, kapas,
aluminium foil, kertas saring, spektofotometer UV-VIS, tabung falcon, vial,
centrifuge dan alat tulis.
Prosedur Penelitian Pembuatan Whey Dangke
Dangke diolah dari susu sapi yang dipanaskan dengan api kecil sampai hampir mendidih, kemudian ditambahkan koagulan berupa papain murni 0.3% pada suhu 80 ºC, kemudian ditambahkan garam sebanyak 0.4% (Mukhlisah 2017). Setelah terjadi pemisahan antara gumpalan dan cairan berwarna kuning, gumpalan tersebut dimasukkan ke dalam cetakan khusus yang terbuat dari tempurung kelapa (bagian ujungnya dilubangi untuk jalan ke luar cairan) dan whey ditampung untuk
4
Uji Nutrisi Whey Dangke (Kabui et al. 2014)
Lactoscan digunakan untuk menganalisis lemak, total padatan, berat jenis, protein, titik beku dan penambahan air.Sampel di masukkan dalam gelas ± 20 mL kemudian Laktoscan di hidupkan dengan di aliri listrik. Sampel dimasukkan pada tempat analisis. Prinsip kerja lactoscan yaitu sampel masuk ke dalam alat laktoscan, lalu melewati pancaran gelombang bunyi dan sampel akan keluar lagi. Hasil analisis keluar setelah sampel melewati gelombang bunyi.
Pemeriksaan Kemurnian Kultur Bakteri
L. fermentum yang telah yang telah diisolasi dari dangke pada penelitian
sebelumnya dikonfirmasi kembali untuk memastikan kemurniannya dengan cara ditumbuhkan pada media MRSA dengan metode striking plate dan diinkubasi
pada suhu 37 ºC selama 24 jam, kemudian diambil satu koloni yang dianggap
sebagai koloni bakteri asam laktat dan dimasukkan ke MRSB, kultur ini disebut kultur stok. Setiap kultur stok dilakukan penyegaran pada media MRSB sebelum dilakukan pengujian. Sebanyak 1 ml kultur diinokulasikan ke dalam media MRSB. Kultur kemudian diinkubasi pada suhu 37 ºC selama 24 jam yang hasilnya disebut
kultur kerja. Kultur kerja ini yang digunakan untuk mengkonfirmasi bakteri uji. Uji yang dilakukan adalah uji pewarnaan Gram.
Sampel bakteri dari koloni yang homogen dioleskan pada kaca objek kemudian difiksasi panas. Olesan bakteri kemudian diteteskan dengan Kristal violet selama satu menit, kemudian diratakan, dibilas dengan aquades dan dikering udarakan. Setelah kering, olesan bakteri diteteskan iodium dan diratakan kembali, kering udara selama dua menit, kemudian dibilas aquades dan ditiriskan. Preparat dicuci dengan pemucat warna yaitu etanol 95% tetes demi tetes selama 30 detik, kemudian dicuci segera dengan aquades dan ditiriskan. Setelah kering preparat diteteskan minyak imersi dan diamati di bawah mikroskop untuk melihat bentuk dan warna dinding sel setelah dilakukan pewarnaan. Bakteri yang termasuk dalam kelompok Gram positif akan menunjukkan warna ungu atau biru keunguan, sedangkan kelompok bakteri Gram negatif akan menunjukkan warna merah safranin (Waluyo 2008).
Persiapan Bakteri (Arief et al. 2015a)
Ketiga strain L. fermentum yang telah diisolasi dari dangke (Syah. et al
2016) ditumbuhkan pada MRSB sedangkan bakteri patogen ditumbuhkan pada TSB dan TSA. Semua bakteri patogen ditumbuhkan pada TSA sebagai kultur. Kultur disimpan pada suhu -20 ºC, kultur diinkubasi pada suhu 37 ºC sebelum
digunakan.
Pengujian Total Bakteri Asam Laktat (Kalsum dan Sjofjan 2012)
Pengujian total bakteri dilakukan dengan metode pour plate (Cawan tuang).
Sampel yang akan diuji diencerkan dengan pengenceran 10-1-10-8. Satu mL
sampel dari pengenceran 10-6, 10-7,10-8 dimasukkan ke dalam cawan petri steril.
5
sampai memadat lalu diinkubasi pada inkubator pada suhu 37 ºC selama 24 jam dalam keadaan terbalik.
Pengukuran pH (AOAC 2005)
pH meter dinyalakan dan dinetralkan selama 15-30 menit dan distandardisasi dengan larutan buffer pH 4 dan pH 7. Sampel dapat diukur setelah pH meter dikalibrasi. pH meter dicelup pada sampel lalu dibiarkan sampai angka pH meter stabil. Setelah dilakukan pengukuran, pH meter kemudian dibilas dengan akuades dan dikeringkan dengan tissu.
Pengujian Total Asam Tertitrasi (TAT) (AOAC 2005)
Total asam tertitrasi dapat dianalisis dengan metode titrasi dengan NaOH 0.1 N dan penoftalin 1% sebagai indikator. Rumus yang digunakan adalah:
[Keasaman =ml NaOH x N NaOH x . 9Berat Sampel x ]
Uji Aktivitas Antimikroba (Hosni et al. 2013)
Pengujian aktivitas antimikroba L. fermentum menggunakan metode paper disc. E.coli dan S.aureus sebagai bakteri uji diencerkan sesuai dengan standar 0.5
McFarland (108 cfu ml-1) kemudian diratakan pada media MHA. Paper disc steril
kemudian dimasukkan ke dalam sampel 50 µL kemudian diletakkan pada media lalu diinkubasi pada suhu 37 ºC selama 48 jam. Setelah diinkubasi zona bening yang terbentuk kemudian diukur menggunakan jangka sorong. Hasil pengukuran tersebut kemudian dikurangi dengan diameter paper disc yaitu 5.5 mm.
Purifikasi dengan Menggunakan Presipitasi Amonium Sulfat (Arief et al. 2015b)
Whey 100% masing-masing diinokulasi dengan 3 strain L. fermentum asal
dangke berbeda sebanyak 10% (v/v), kemudian diinkubasi pada suhu 37 ºC
selama 24 jam, selanjutnya dilakukan sentrifugasi pada kecepatan 10 000 rpm selama 20 menit (suhu 4 ºC). Supernatan kemudian disaring menggunakan
membran saring miliphore berdiameter 0.22 µm dengan tujuan memperoleh
supernatan bebas sel. Supernatan bebas sel kemudian dievaporasi dengan menggunakan Heidolph VV micro evaporator sampai volumenya menjadi
6
Analisis Kadar Protein metode Lowry (Lowry et al. 1951)
Langkah pertama dalam uji lowry yaitu dengan membuat pereaksi, pereaksi pertama yaitu NaOH 0.1 N sebanyak 0.4 gram ditambahkan dengan akuades sampai volumenya mencapai 100 mL. Hasil pengenceran kemudian diambil sebanyak 2 mL dan ditambahkan dengan Na2COs sebanyak 2% (w/v). Pereaksi
kedua yaitu Na+K+ tartrate 1% (w/v) ditambahkan dengan CuSO
4.5H2O 0.5%
(w/v). Pereaksi pertama dan kedua dicampur dan dihomogenisasi sebagai pereaksi ketiga. Pereaksi keempat yaitu menggunakan Folin-ciocalteu diencerkan menggunakan akuades dengan perbandingan 1:1.
Sampel bakteriosin kasar sebanyak 0.2 mL dimasukkan ke dalam kuvet ditambahkan dengan akuades sebanyak 3.8 mL, selanjutnya ditambahkan dengan pereaksi ketiga sebanyak 5.5 mL kemudian diinkubasi selama 10-15 menit. Langkah selanjutnya yaitu menambahkan folin sebanyak 0.5 mL lalu diinkubasi pada suhu 4 ºC selama 30 menit. Absorban dibaca pada A 650 nm. Untuk kurva
standar, digunakan BSA dengan konsentrasi 0; 0.1; 0.2; 0.4; 0.6; 0.8 dan 1.0 mg mL-1.
Rancangan Percobaan dan Analisis Data Total BAL, Nilai TAT dan Nilai pH
Rancangan percobaan yang digunakan adalah rancangan acak kelompok (RAK) pola faktorial untuk menganalisis nilai total asam tertitrasi, nilai pH dan total bakteri. Faktor pertama yaitu strain L. fermentum (A323L, B323K dan
C113L) dan faktor kedua yaitu waktu inkubasi (Jam), sedangkan kelompok adalah waktu pelaksanaan penelitian yang berbeda (ulangan). Model statistika yang digunakan sebagai berikut:
Hijk = µ + Ki + Pj + Pk + (Pj x Pk) + eijk Keterangan:
Hijk = Nilai pengamatan dari perlakuan ke-j (j = perlakuan strain bakteriosin L. fermentum asal dangke yang berbeda) dan perlakuan ke-k (k = waktu
inkubasi inkubasi) pada kelompok ke-i (waktu pelaksanaan) µ = Nilai tengah umum
Ki = Pengaruh kelompok ke-i (waktu pelaksanaan)
Pj = Pengaruh faktor perlakuan strain bakteriosin L. fermentum asal dangke yang berbeda
Pk = Pengaruh faktor waktu inkubasi inkubasi
Pj x Pk = Interaksi perlakuan strain bakteriosin L. fermentum asal dangkeyang
berbeda dan waktu inkubasi inkubasi
Eijk = Galat akibat perlakuan ke-j (strain berbeda) dan perlakuan ke-k (waktu inkubasi) pada kelompok ke-i (waktu pelaksanaan)
7
Aktivitas Antimikroba Bakteri, Bakteriosin dan Uji Lowry
Rancangan yang digunakan untuk menganalisis uji aktivitas antimikroba bakteri, bakteriosin dan uji Lowry adalah rancangan acak lengkap (RAL). Faktor perlakuan adalah strain L. fermentum (A323L, B323K dan C113L). Model
statistik rancangan acak lengkap (RAL) berdasar pada Mattjik dan Sumertajaya (2013) adalah sebagai berikut:
Yijk = µ + i + ij Keterangan:
Yijk = Nilai respon akibat pengaruh perlakuan pada taraf ke-i (i = perlakuan strain bakteriosin L. fermentum asal dangkeyang berbeda) pada ulangan ke-j
µ = Nilai tengah umum
i = Pengaruh perlakuan jenis bakteriosin strain L. fermentum asal dangkeyang
berbedapada taraf ke-i
ij = Pengaruh galat percobaan ke- i dan pada ulangan ke- j.
Data yang diperoleh dianalisis dengan analisis ragam dan apabila hasil yang diperoleh adalah nyata akan dilanjutkan dengan Uji Duncan (Mattjik dan Sumertajaya, 2013).
Perbandingan daya hambat L. fermentum terhadap S. aureus dan E. coli
dianalisis menggunakan student t test dengan persamaan sebagai berikut:
� = − µ s/√n
Keterangan: t = t hitung
= rata-rata daya hambat strain L. fermentum
µ = rata-rata terhadap S. aureus dan E. coli
s = standar deviasi daya hambat terhadap S. aureus dan E. coli
n = jumlah sampel strain L. fermentum
3 HASIL DAN PEMBAHASAN
Komponen Nutrisi Whey Dangke
Whey susu merupakan serum atau bagian air dari susu yang tersisa setelah
pemisahan curd yang merupakan hasil koagulasi protein susu dengan penambahan
asam atau enzim proteolitik (Vinderola et al. 2000). Salah satu hasil olahan susu
yang menghasilkan whey yaitu proses pembuatan dangke. Kandungan nutrisi whey
dangke dapat dilihat pada Tabel 1.
Nilai komponen padatan whey dangke yaitu 7.55% (Tabel 1). Hasil tersebut
sejalan dengan penelitian Panesar et al. (2007) bahwa total padatan yang
dihasilkan dari whey keju manis dan asam yaitu sebesar 6.3-7%. Lemak dari whey
8
sebelumnya. Fatma et al. (2013) mengemukakan bahwa whey dangke
menghasilkan lemak sebesar 0.2% (Tabel 1). Penelitian yang dilakukan oleh Almeida et al. (2008) menggunakan whey keju menghasilkan lemak sebesar 0.5%.
Perbedaan kandungan nutrisi whey yang dihasilkan dalam pembuatan keju
disebabkan karena komposisi susu, proses pembuatan, dan bahan penggumpal yang digunakan tidak sama (Altiok 2004).
Tabel 1 Komponen nutrisi whey dangke
Komponen Nilai
Laktosa yang dihasilkan dari whey dangke yaitu sebesar 5.49% (Tabel 1).
Hasil tersebut sejalan dengan hasil penelitian Fatma et al. (2013) bahwa
kandungan laktosa whey dangke yaitu sebesar 5.08%. Panesar et al. (2007)
menyatakan bahwa komponen laktosa dalam whey berpotensi dimanfaatkan oleh
BAL untuk pertumbuhannya. Kandungan protein dalam whey dangke yaitu 0.36
%. Hasil tersebut sangat rendah dibandingkan dengan beberapa penelitian sebelumnya. Hal tersebut mungkin disebabkan karena dalam proses pembuatan dangke dengan menggunakan papain murni, protein dari susu yang digunakan sebesar 2.76% hampir terkoagulasi sempurna sehingga protein whey sangat
rendah. Protein whey yang dihasilkan umumnya berkisar 0.6-1% (Fatma et al.
2013; Panesar et al. 2007; Gallardo et al. 2005).
Nilai pH dari whey dangke yaitu 6.40 (Tabel 1), nilai tersebut sejalan
dengan penelitian yang telah dikemukakan oleh Fatma et al. (2013) bahwa nilai
pH whey dangke yaitu sebesar 6. 31. Gallardo et al. (2005) mengemukakan bahwa
nilai pH dari berbagai macam whey berbeda-beda tergantung pada jenis dan
konsentasi bahan penggumpal, perlakuan pemisahan curd dengan whey, dan
pemisahan sisa lemak dari whey.
Karakteristik L. fermentum A323L, B323K, C113L
Karakteristik strain L. fermentum dilakukan untuk membuktikan kemurnian
dari bakteri yang digunakan. Karakterisasi yang dilakukan meliputi sifat morfologi dan bentuk dari strain L. fermentum. Hasil pewarnaan Gram (Tabel 2)
menunjukkan bahwa ketiga strain L. fermentum termasuk bakteri Gram positif,
berbentuk batang tunggal atau koloni, susunan rantai pendek. Syah et al. (2016)
menyatakan bahwa BAL yang diisolasi dari dangke merupakan beberapa strain dari L. fermentum diantaranya yaitu A323L, B323K dan C113L. Ketiga strain L. fermentum merupakan Gram positif dan dapat tumbuh pada suhu 37-45 ºC serta
9
katalase negatif, dan tidak berspora. L. fermentum tersebut berbentuk batang
tunggal, koloni dan susunan rantai pendek.
Tabel 2 Karakteristik strain L. fermentum
Strain Pewarnaan Gram Morfologi Gambar Morfologi
L. fermentum
A323L Gram positif Berbentuk batang tunggal atau koloni, susunan rantai pendek
L. fermentum
B323K Gram positif Berbentuk batang tunggal atau koloni, susunan rantai pendek
L. fermentum
C113L Gram positif Berbentuk batang tunggal atau koloni, susunan rantai pendek
Prinsip kerja pewarnaan Gram yaitu kristal violet akan terserap oleh dinding sel bakteri, selanjutnya iodine akan mempertahankan kristal violet. Penambahan alkohol akan menghidrasi peptidoglikan sehingga kristal violet dan iodine tertahan pada bakteri Gram positif. Dinding sel bakteri Gram positif tersusun atas 90% peptidoglikan, sedangkan sisanya adalah lipid. Hal tersebut menyebabkan pori-pori dinding sel mengecil, permeabilitas berkurang dan warna ungu kristal violet tidak dapat keluar (Pelczar dan Chan 2007).
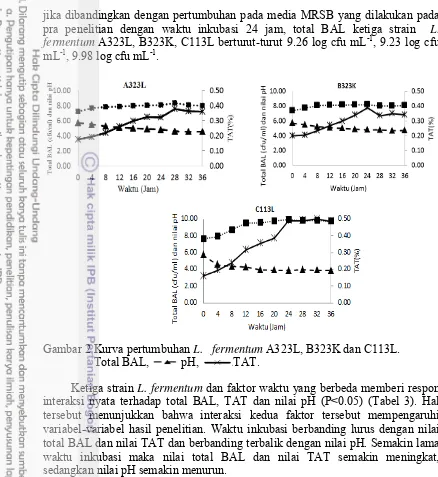
Kurva Pertumbuhan (Total BAL, Nilai TAT dan Nilai pH)
Kurva pertumbuhan L. fermentum diperoleh dari hasil pengukuran populasi
BAL, uji total asam tertitrasi, dan uji pH pada waktu inkubasi yang berbeda yaitu setiap 4 jam. Bakteri asam laktat memiliki beberapa fase pertumbuhan yaitu fase adaptasi, logaritmik (eksponensial), tetap (statis) dan penurunan (kematian). Fase tersebut dimulai dari adaptasi, pertumbuhan cepat, tetap sampai pada fase kematian bakteri (Fardiaz 1992a). Kurva pertumbuhan L. fermentum dapat dilihat
pada Gambar 2.
Pada ketiga strain L. fermentum memenuhi populasi (total BAL) yang
berpengaruh nyata pada media whey dangke (P<0.05) (Lampiran 1.1). Hal
tersebut menunjukkan bahwa dangke dapat dimanfaatkan sebagai media pertumbuhan bakteri. Fatma et al. (2012) melaporkan bahwa whey dangke dapat
10
jika dibandingkan dengan pertumbuhan pada media MRSB yang dilakukan pada pra penelitian dengan waktu inkubasi 24 jam, total BAL ketiga strain L. fermentum A323L, B323K, C113L berturut-turut 9.26 log cfu mL-1, 9.23 log cfu
mL-1, 9.98 log cfu mL-1.
Gambar 2 Kurva pertumbuhan L. fermentum A323L, B323K dan C113L.
Total BAL, pH, TAT.
Ketiga strain L. fermentum dan faktor waktu yang berbeda memberi respon
interaksi nyata terhadap total BAL, TAT dan nilai pH (P<0.05) (Tabel 3). Hal tersebut menunjukkan bahwa interaksi kedua faktor tersebut mempengaruhi variabel-variabel hasil penelitian. Waktu inkubasi berbanding lurus dengan nilai total BAL dan nilai TAT dan berbanding terbalik dengan nilai pH. Semakin lama waktu inkubasi maka nilai total BAL dan nilai TAT semakin meningkat, sedangkan nilai pH semakin menurun.
Ketiga strain terus mengalami peningkatan hingga 20-28 jam waktu inkubasi sebesar 8.29-9.94 cfu ml-1 dan mengalami penurunan secara perlahan
setelah jam tersebut. Hal tersebut menunjukkan bahwa L. fermentum mengalami
fase logaritmik pada jam ke 20-28. Kalsum dan Sjofjan (2012) melaporkan bahwa pertumbuhan L. fermentum pada media MRSB mengalami fase logaritmik pada
22 jam waktu inkubasi sedangkan pada media rice bran adalah 18 jam inkubasi.
Perbedaan tersebut disebabkan karena kandungan protein pada media whey
dangke masih tergolong rendah jika dibandingkan dengan MRSB. Kandungan laktosa pada media rice bran lebih tinggi dibandingkan dengan whey dangke.
11
Tabel 3 Pertumbuhan L. fermentum A323L, B323K, C113L
Perlakuan 0 4 8 12 16 Waktu Inkubasi 20 24 28 32 36 Rata-rata
Total BAL (log cfu ml-1)
A323L 7.18±0.47 7.64±0.01 7.82±0.03 7.85±0.10 7.96±0.06 8.00±0.11 8.05±0.14 8.29±0.16 8.07±0.27 7.93±0.17 7.88±0.33a
B323K 7.38±0.08 7.72±0.13 8.06±0.08 8.11±0.00 8.14±0.03 8.18±0.00 8.20±0.00 8.03±0.12 8.01±0.28 8.06±0.38 8.01±0.27a
C113L 7.61±0.08 7.91±0.24 8.71±0.89 9.53±0.07 9.55±0.15 9.75±0.01 9.94±0.05 9.80±0.02 9.83±0.07 9.72±0.02 9.24±0.86b
Rata-rata 7.39±0.29a 7.76±0.24b 8.20±0.89c 8.50±0.07d 8.55±0.14d 8.64±0.01d 8.73±0.05d 8.71±0.01d 8.64±0.07d 8.57±0.02d
TAT (%)
A323L 0.17±0.02 0.19±0.00 0.22±0.00 0.26±0.02 0.30±0.02 0.32±0.00 0.32±0.00 0.38±0.01 0.36±0.01 0.36±0.03 0.29±0.07a
B323K 0.20±0.00 0.21±0.00 0.23±0.01 0.27±0.01 0.30±0.00 0.34±0.00 0.39±0.00 0.34±0.00 0.35±0.01 0.34±0.01 0.29±0.07a
C113L 0.16±0.00 0.20±0.01 0.24±0.00 0.32±0.00 0.36±0.00 0.39±0.00 0.49±0.01 0.49±0.01 0.50±0.01 0.49±0.00 0.36±0.13b
Rata-rata 0.18±0.02a 0.20±0.01b 0.23±0.01c 0.28±0.03d 0.32±0.03e 0.35±0.03f 0.40±0.07g 0.40±0.08g 0.40±0.08g 0.40±0.10g
pH
A323L 5.71±0.02 5.47±0.01 5.22±0.00 5.08±0.02 4.98±0.01 4.86±0.01 4.80±0.01 4.58±0.01 4.51±0.01 4.50±0.01 4.97±0.40a
B323K 5.71±0.01 5.49±0.00 5.24±0.01 5.09±0.00 5.00±0.00 4.88±0.00 4.80±0.00 4.77±0.00 4.70±0.01 4.71±0.01 5.04±0.34a
5C113L 5.71±0.02 4.54±0.70 4.36±0.01 4.25±0.00 3.95±0.01 3.89±0.01 3.86±0.00 3.95±0.02 3.89±0.04 3.86±0.01 4.27±0.63b
Rata-rata 5.71±0.01a 5.17±0.39b 4.94±0.45c 4.81±0.43c 4.65±0.45d 4.55±0.51de 4.49±0.48ef 4.43±0.39ef 4.37±0.36ef 4.36±0.39f
Huruf dibelakang angka yang berbeda pada baris dan kolom yang sama menunjukkan hasil yang berbeda nyata (P<0.05).
12
Hasil uji Duncan menunjukkan bahwa total BAL strain A323L dan B323K nyata lebih rendah dibandingkan dengan C113L (P<0.05) (Lampiran 1.2). Pertumbuhan L. fermentum C113L lebih cepat dibandingkan dengan kedua strain
bakteri lainnya. Hal tersebut dimungkinkan karena L. fermentum C113L
mempunyai sifat pertumbuhan yang lebih cepat. Todar (2013) menyatakan bahwa pertumbuhan bakteri tergantung pada kemampuan sel untuk membentuk protoplasma baru dari nutrisi yang tersedia di lingkungan.
Waktu inkubasi pada jam ke-0, ke-4 dan ke-8 berbeda dengan setiap perlakuan lainnya (P<0.05) (Lampiran 1.3). Pada waktu inkubasi tersebut, pertumbuhan bakteri berada pada tahap adaptasi. Todar (2013) menyatakan bahwa lamanya fase adaptasi tergantung pada berbagai faktor, salah satunya yaitu waktu yang diperlukan untuk pulih dari kerusakan fisik atau stres pada saat inokulasi, waktu yang diperlukan untuk sintesis koenzim penting, dan waktu yang dibutuhkan untuk mensintesis enzim baru yang diperlukan untuk membantu metabolisme substrat yang terdapat di dalam media tumbuh. Buckle et al. (2007)
menambahkan bahwa fase adaptasi dipengaruhi oleh spesies dan umur dari sel inokulum serta lingkungan dari bakteri itu sendiri.
Nilai TAT pada ketiga strain L. fermentum mengalami peningkatan seiring
dengan peningkatan jumlah bakteri asam laktat hingga 0.38-0.42%. Ketiga strain memberi respon yang sangat nyata terhadap TAT (P<0.05) (Lampiran 2.1). Peningkatan tersebut disebabkan karena L. fermentum merombak kandungan
nutrisi pada whey dangke menjadi asam laktat. Panesar et al. (2007)
mengemukakan adanya β-galaktosidase yang dihasilkan oleh mikroorganisme menyebabkan laktosa yang ada dalam produk terhidrolisis menjadi glukosa dan galaktosa. Monosakarida yang terbentuk akan mengalami proses glikolisis hingga terbentuk asam piruvat. Asam piruvat tersebut dengan adanya laktat dehidrogenase menerima kembali pasangan elektron yang berasal dari oksidasi asam gliseraldehid 3-pospat dalam proses glikolisis sehingga tereduksi menjadi asam laktat. Charalampopoulos et al. (2003) menambahkan bahwa asam laktat
sebagai produk utama fermentasi akan terdisosiasi menghasilkan H+ dan
CH3CHOHCOO-.
L. fermentum C113L memberi respon TAT yang nyata lebih tinggi
dibandingkan dengan setiap perlakuan lainnya (P<0.05) (Lampiran 2.1). Hal tersebut sejalan dengan nilai total BAL. Fatma et al. (2012) mengemukakan
bahwa BAL akan tumbuh dan berkembang dengan cara merombak komponen nutrisi whey dengan merombak komponen nutrisi (laktosa) untuk memenuhi
kebutuhan energi. Hasil akhir proses perombakan adalah asam laktat.
Asam laktat yang dihasilkan semakin meningkat seiring dengan meningkatnya waktu inkubasi. Waktu inkubasi pada jam ke-0, ke-4 dan ke-8 merupakan fase adaptasi. Kemudian jam ke-20 berbeda dengan waktu inkubasi sebelumnya dan berbeda dengan waktu berikutnya. Waktu inkubasi pada jam ke-20 mulai memasuki fase logaritmik sehingga berbeda dengan waktu lainnya dan berbeda pada tiga titik jam terakhir karena telah memasuki fase stasioner (Lampiran 2.3).
Kondisi asam laktat berbanding terbalik dengan kondisi pH yang semakin menurun seiring dengan meningkatnya waktu inkubasi. Strain L. fermentum yang
13
peningkatan keasaman dalam medium dan menyebabkan turunnya pH media. Adanya ion H+ yang dihasilkan oleh asam laktat dari proses disosiasi dapat
menurunkan nilai pH. Nilai pH yang terhitung merupakan konsentrasi H+ yang
dihasilkan selama proses fermentasi. Semakin banyak asam laktat yang dihasilkan maka konsentrasi ion H+ semakin meningkat dan terukur di pengukuran pH (Charalampopoulos et al. 2003). Berdasarkan uji Duncan L.fermentum C113L
memberi respon nilai pH yang nyata lebih rendah dibandingkan dengan strain lainnya (P<0.05) (Lampiran 3.2). Hal tersebut sejalan dengan nilai total BAL dan nilai TAT. Nurwantoro dan Djarijah (1994) menyatakan bahwa terbentuknya asam laktat dari hasil metabolisme BAL menyebabkan keasaman sehingga konsentrasi ion hidrogen meningkat dan menyebabkan pH menurun.
Semakin lama penyimpanan berarti semakin memberi kesempatan bagi bakteri asam laktat untuk mengubah laktosa menjadi asam laktat, sehingga ion hidrogen bebas dalam susu fermentasi akan meningkat. Meningkatnya jumlah asam laktat ini dapat menurunkan pH karena semakin banyaknya konsentrasi ion H+ (Gianti dan Nuriani, 2011). Nilai pH pada jam ke-0 sampai jam ke-16 berbeda dengan setiap perlakuan lainnya (P<0.05) (Lampiran 3.3). Hal tersebut menunjukkan bahwa pada jam tersebut, BAL masih aktif melakukan metabolisme dan menghasilkan asam laktat sehingga nilai pH terus mengalami penurunan.
Aktivitas Antimikroba L. fermentum A323L, B323K, C113L
Aktivitas antimikroba dilanjutkan dari fase logaritmik menuju fase stationer dari kurva pertumbuhan strain L. fermentum. Aktivitas antimikroba dilakukan
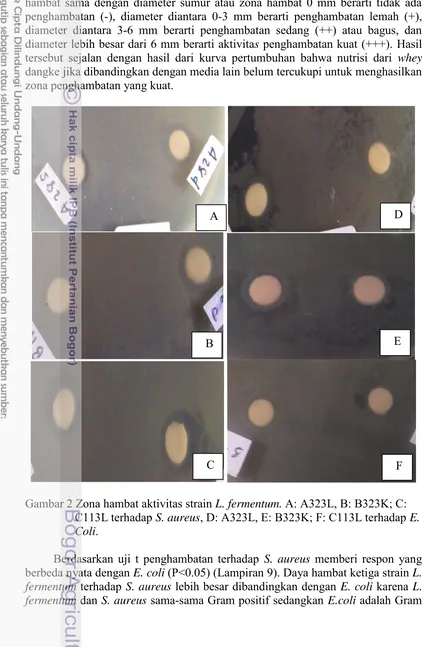
dengan metode cakram, zona bening (tempat yang tidak ditumbuhi dengan bakteri uji) disekitar cakram merupakan aktivitas antimikroba. Zona bening yang terbentuk tersebut diukur dengan menggunakan jangka sorong. Hasil uji aktivitas antimikroba dapat dilihat pada Tabel 1.
Ketiga strain L. fermentum memberi respon nyata terhadap zona hambat
terhadap E. coli dan S. aureus (P<0.05) (Lampiran 4.1 dan 5.1). Beberapa
penelitian terdahulu membuktikan bahwa L. fermentum menghasilkan bakteriosin
yang dapat menghambat pertumbuhan beberapa bakteri patogen (Riaz et al. 2010;
Zhang et al. 2010; Singh et al. 2013). Fardiaz (1992b) menyatakan bahwa zat
antimikroba bersifat bakteriosidal, bakteriostaltik, fungisidal, fungistatik dan germisidal. Karpiński dan Szkaradkiewicz (2013) menyatakan bahwa bakteriosin merupakan substrat protein antimikroba yang dapat mencegah strain-strain yang sensitif yakni bakteri Gram negatif dan Gram positif.
Tabel 4 Hasil Uji aktivitas antimikroba L. fermentum A323L, B323K, C113L
Bakteri Indikator Strain L. fermentum
A323L B323K C113L ---mm---
E. coli ATCC 25922 2.15±0.00a 2.36±0.01b 3.07±0.06c S. aureusATCC 25293 2.82±0.02a 3.10±0.01b 3.34±0.09c
14
Diameter zona hambat ketiga strain terhadap E. coli dan S. aureus termasuk
kategori lemah karena nilainya kurang lebih dari 3 mm setelah dikurangi dengan diameter paper disc. Pan et al. (2009) menyatakan bahwa Kekuatan aktivitas
antimikroba dikategorikan pada ukuran diameter zona hambat: diameter zona hambat sama dengan diameter sumur atau zona hambat 0 mm berarti tidak ada penghambatan (-), diameter diantara 0-3 mm berarti penghambatan lemah (+), diameter diantara 3-6 mm berarti penghambatan sedang (++) atau bagus, dan diameter lebih besar dari 6 mm berarti aktivitas penghambatan kuat (+++). Hasil
tersebut sejalan dengan hasil dari kurva pertumbuhan bahwa nutrisi dari whey
dangke jika dibandingkan dengan media lain belum tercukupi untuk menghasilkan zona penghambatan yang kuat.
Gambar 2 Zona hambat aktivitas strain L. fermentum. A: A323L, B: B323K; C:
C113L terhadap S. aureus, D: A323L, E: B323K; F: C113L terhadap E. Coli.
Berdasarkan uji t penghambatan terhadap S. aureus memberi respon yang
berbeda nyata dengan E. coli (P<0.05) (Lampiran 9). Daya hambat ketiga strain L. fermentum terhadap S. aureus lebih besar dibandingkan dengan E. coli karena L. fermentum dan S. aureus sama-sama Gram positif sedangkan E.coli adalah Gram
A D
B E
15
negatif. Singh et al. (2013) melaporkan bahwa Lactobacillus fermentum
mempunyai daya hambat yang lebih besar terhadap S. aureus (12 mm)
dibandingkan dengan E. coli (8 mm). Ray dan Miller (2003) menyatakan bahwa
bakteriosin dari bakteri Gram positif lebih efisien menghambat bakteri Gram positif karena membran terluar dari bakteri Gram negatif umumnya bersifat hidrofilik sehingga dapat menghalangi kerja bakteriosin. Daya hambat terhadap S. aureus dan E. coli dapat dilihat pada Gambar 2.
Hasil uji Duncan menunjukkan bahwa semua strain L. fermentum memberi
respon yang berbeda terhadap strain lainnya pada daya hambat terhadap E.coli
dan S. aureus (P<0.05) (Lampiran 4.2 dan 5.2). Fardiaz (1992b) menyatakan
bahwa daya hambat antimikroba dipengaruhi oleh beberapa faktor, salah satunya adalah strain dari bakteri penghasil bakteriosin itu sendiri.
Konsentrasi Protein
Konsentrasi protein diperoleh dari hasil purifikasi yaitu tahap pemurnian menggunakan amonium sulfat yang bertujuan untuk pengendapan. Selanjutnya dilakukan tahap dialisis menggunakan membran dialisis dan akhirnya menghasilkan bakteriosin kasar. Konsentrasi protein bakteriosin kasar ketiga strain L. fermentum dapat dilihat pada Gambar 3.
Gambar 3 Konsentrasi protein strain L. fermentum masing-masing strain. ( )
A323L, ( ) B323K, ( ) C113L.
Ketiga strain L. fermentum memberi respon yang berpengaruh nyata
terhadap konsentrasi protein (P<0.05) (Lampiran 6.1). Hasil tersebut sejalan
dengan kurva pertumbuhan dan hasil uji aktivitas antimikroba. Gambar 3 menunjukkan bahwa konsentrasi bakteriosin dari strain C113L nyata lebih tinggi dibandingkan dengan strain lainnya (P<0.05) (Lampiran 6.2). Adedire et al.
(2016) melaporkan bahwa L. fermentum asal ampas singkong menghasilkan
konsentrasi 1.2 mg ml-1 pada tahap pemurnian amonium sufat. Perbedaan tersebut dimungkinkan karena perbedaan media pertumbuhan dan strain bakteri. Singh et
16
al. (2013) menyatakan bahwa produksi bakteriosin sangat ditentukan oleh
kandungan nutrisi dalam media pertumbuhan. Hasil penelitian Arief et al. (2015a)
dengan menggunakan spesies bakteri berbeda yaitu L. plantarum menghasilkan
protein bakteriosin yaitu 117.1-178,4 mg mL-1 pada tahap pemurnian
menggunakan amonium sulfat dan 40.1-97.9 mg mL-1 setelah tahap pemurnian menggunakan cation exchange chromatography.
Aktivitas Antimikroba Strain L. fermentum setelah purifikasi
Aktivitas antimikroba dari hasil dialis diperoleh dengan menggunakan metode yang sama dengan uji aktivitas antimikroba pada pada strain L. fermentum
sebelum purifikasi yaitu dengan menggunakan metode paper disc. Hasil uji
aktivitas bakteriosin dapat dilihat pada tabel 2.
Bakteriosin yang dipurifikasi dari setiap strain L. fermentum memberi
respon nyata terhadap daya hambat E. coli dan S. aureus (P<0.05) (Lampiran 7.1
dan 8.1). Hal tersebut menunjukkan bahwa bakteriosin dapat menghambat pertumbuhan bakteri patogen baik Gram positif maupun Gram negatif. Hal tersebut sesuai dengan pendapat Karpiński dan Szkaradkiewicz (2013) yang menyatakan bahwa bakteriosin merupakan substrat protein antimikroba yang dapat menghambat bakteri Gram positif dan Negatif. Nes et al. (2015)
menambahkan bahwa bakteriosin bekerja dengan cara merusak dinding sel bakteri lain sehingga protein sel terdenaturasi sehingga mengganggu metabolisme dalam sel dan menghambat kerja enzim intraseluler. Daya hambat semua strain L. fermentum terhadap S. aureus dan E. coli termasuk kategori lemah karena nilainya
kurang lebih 3 mm setelah dikurangi dengan diameter paper disc. Hal tersebut
berdasarkan pendapat Pan et al. (2009) yang menyatakan bahwa diameter diantara
0-3 mm berarti penghambatan lemah (+) sedangkan daya hambat antara 3-6 mm termasuk kategori sedang. Hal tersebut disebabkan bahan komponen terbesar dari bakteriosin adalah protein (Karpiński dan Szkaradkiewicz 2013). Whey dangke
yang digunakan untuk pertumbuhan L. fermentum hanya mengandung protein
sebesar 0.36% (20 mL)-1, sebagian besar terkoagulasi menjadi curd dangke.
Protein susu yang dibuat dangke yaitu 2.76% (20 mL)-1 (hasil uji pra penelitian).
Berdasarkan penelitian Mukhlisah (2017) bahwa protein dangke adalah 14.22% dengan rendemen 14.11% dari total susu yang dibuat dangke. Dari hasil tersebut dapat dikalkulasi bahwa protein susu yang terkoagulasi menjadi dangke yaitu sekitar kurang lebih 1.70% (20 mL)-1.
Hasil uji Duncan menunjukkan bahwa setiap strain menunjukkan respon yang berbeda dengan strain lainnya (P<0.05) (Lampiran 7.2 dan 8.2). Ray dan Miller (2003) melaporkan bahwa satu strain bakteri dapat menghasilkan lebih dari satu macam bakteriosin, dan banyak strain dari spesies berbeda dapat memproduksi bakteriosin sama tetapi ada juga yang menghasilkan bakteriosin yang berbeda. Karpiński dan Szkaradkiewicz (2013) menambahkan bahwa strain
Lactobacillus yang sama dapat menghasilkan jenis bakteriosin yang berbeda-beda,
contohnya Lactobacillus acidophillus ada yang menghasilkan asidofilin, asidolin,
17
sangat khusus. Bakteriosin kelas II merupakan peptida dengan berat atom rendah yang tahan panas, terdiri atas 36-44 asam amino dan berat molekul <10 kDa. Bakteriosin kelas III mempunyai peptida berberat atom tinggi yang tidak tahan panas dan berat molekul >30 kDa, sedangkan bakteriosin kelas IV belum diketahui dengan jelas identitasnya.
Tabel 5 Uji aktivitas antimikrobastrain L. fermentum setelah purifikasi
Bakteri Indikator Strain L. fermentum
A323L B323K C113L
---mm---
E. coli ATCC 25922 1.97±0.02a 2.32±0.00b 2.58±0.08c S. aureusATCC 25293 2.69±0.02a 2.95±0.01b 3.35±0.06c
Huruf dibelakang angka yang berbeda pada baris yang sama menunjukkan hasil yang berbeda nyata (P<0.05).
Berdasarkan hasil uji t daya hambat terhadap S. aureus memberi respon
yang berbeda nyata dengan daya hambat terhadap E. coli (P<0.05) (Lampiran 10).
Daya hambat terhadap S. aureus lebih besar dibandingkan dengan E. coli. Fardiaz
(1992b) mengemukakan bahwa dinding sel bakteri Gram positif 90% tersusun atas peptidoglikan sedangkan sisanya adalah asam teikoat, sedangkan bakteri Gram negatif sebaliknya, dinding selnya hanya 5-20% peptidoglikan sisanya sebagian besar terdiri dari protein, lipopolisakarida dan lipoprotein.
4 SIMPULAN DAN SARAN
Simpulan
Whey dangke dapat dimanfaatkan sebagai media pertumbuhan L. fermentum
C113L karena BAL tersebut mampu mencapai fase pertumbuhan logaritmik. Namun kebutuhan nutrisi dalam media whey dangke belum tercukupi untuk
menghasilkan bakteriosin.
L. fermentum strain A323L, B323K, C113L yang diisolasi dari dangke
hanya mampu menghasilkan daya hambat kategori lemah pada media whey
dangke. Namun diantara ketiganya, berdasarkan semua peubah yang diamati, strain yang terbaik adalah C113L.
Saran
Diperlukan penelitian lebih lanjut mengenai potensi whey sebagai media
pertumbuhan L. fermentum untuk menghasilkan bakteriosin dengan menggunakan
18
DAFTAR PUSTAKA
Abdelbasset M, Djamila K. 2008. Antimicrobial activity of autochthonous lactic acid bacteria strained from Algerian traditional fermented milk “Raïb”. Afr J Biotech. 7(16).
AdedireO, Adegboye O, Osesusi A. 2016. Studies on the mode of action of
bacteriocin produced by Lactobacillus fermentum CrT21. IJSR. 5(5).
Agati V, Guyot JP, Guyot JM, Talamond P, Hounhouigan DJ. 1998. Isolation and Characterization of new amilolytic Strain of Lactobacillus fermentum from
fermented douze doughs (mawe and ogi) from Benin. J Appl Microbiol.
18:512-520.
Almeida K, Tamime A, Oliveira M. 2008. Acidification rates of probiotic bacteria in Minas frescal cheese whey. LWT Food Sci Technol. 41(2):311-316.
Altiok, D. 2004. Kinetic modeling of lactid acid production from whey.
Dissertation Department Food Engineering Izmir Institute of Technology, Turkey. [internet]. [diunduh 2017 Feb 1]. Tersedia pada: http://www.library.iyte.edu.tr/tezler/master/gidahu/T000471.pdf.
[AOAC] Association Official Analitycal Chemistry. 2005a. Official Method of Analysis. 18th Ed. Washington D.C.
Arief II, Budiman C, Jenie BSJ, Andreas E, dan Yuneni A. 2015a. Plantaricin IIA-1A5 from Lactobacillus plantarum IIA-1A5 displays bactericidal activity against Staphylococcus aureus. Benef Microbes 6(4):603-613.
Arief II, Jenie BSL, Astawan M, Fujiyama K, Witarto AB. 2015b. Identification and probiotic characteristics of lactic acid bacteria isolated from Indonesian local beef. Asian J Anim Sci.9:25-36.
Buckle KA, Edwards RE, Fleet GH, Wootton M. 2007. Ilmu Pangan. Purnomo H
Adiono, penerjemah. Jakarta (ID): UI Pr. Terjemahan dari: Food Science.
Carr FJ, Chill D, Maida N. 2002. The lactic acid bacteria: a literature survey. Critl Revs Microbiol. 28(4):281-370.
Charalampopoulos D, Pandiella S, Webb C. 2003. Evaluation of the effect of malt, wheat and barley extracts on the viability of potentially probiotic lactic acid bacteria under acidic conditions. Int J Food Microbiol. 82(2):133-141.
[FAO/WHO] Food and Agriculture Organization/World Health Organization. 2002. Guidelines for The Evaluation of Probiotics in Food. London (UK): Ontario.
Fardiaz S. 1992a. Mikrobiologi Pangan I. PT. Jakarta (ID): Gramedia Pustaka
Utama.
Fardiaz S. 1992b. Analisis Mikrobiologi Pangan. Jakarta (ID): PT. Raja Garfindo
Pesada.
Fatma, Soeparno S, Nurliyani N, Hidayat C, Taufik M. 2013. Karakteristik Whey
Limbah Dangke dan Potensinya Sebagai Produk Minuman dengan Menggunakan Lactobacillus acidophilus Fncc 0051 (Characteristics of Whey from Dangke Waste and Its Potential as Beverage Product by using Lactobacillus acidophilus FNCC 0051). J Agritech. 32(04).
Gallardo EFJ, Kelly AL, Delahunty CM. 2005. Sensory characteristics and related volatile flavor compound of different types of whey. JDairy Scien 88:
19
Gianti I, Nuriani E. 2011. Pengaruh penambahan gula dan lama pemyimpanan terhadap kualitas fisik susu fermentasi. J I Teknol Has Ter. 6(1):28-33.
Gorsek A, Pecar D. 2016. Propagation of natural starter culture in whey:
optimization and kinetic study. Chem Engin Trans. 49:481-486.
10.3303/CET164908.
Hata T, Tanaka R, Ohmomo S. 2010. Strainion and characterization of plantaricin
ASM1: A new bacteriocin produced by Lactobacillus plantarum A-1. J Food Microbiol. 137:94-99.
Horáčkova S, Sedláčková P, Sluková M, Plocková A. 2014. Influence of Whey, Whey Component and Malt on the Growth and Acids Production of Lactobacilli in Milk. Czech J Food Sci. 32(6):526–531.
Hosni K, Hassen I, Sebeic H, Casabianca H. 2013. Secondary metabolites from Chrysanthemum coronarium (Garland) flowerheads: Chemical composition and biological activities. Indus Crops Prod. 44:263– 271.
Kabui KK, Arimi SM, Kang’ethe EK, Omore A, Makokha S, Nduhiu G, Mainga AO Macharia JK. A determination of raw milk quality and the most suitable microbiological test at the milk collection level in two regions of Kenya. Int J Vet Sci. 4(2):55-59.
Kalsum U, Sjofjan U. 2012. The growth of Lactobacillus fermentum strained from
quail intestine on rice bran medium. J Trop Life Sci. 2(3):58-61.
Karpiński T, Szkaradkiewicz Ak. 2013. Characteristic of bacteriocines and their
application. Pol J Microbiol. 62(3):223-235.
Lavari L , Lanniello R, Paez R , Zotta T , Cuatrin A, Reinheimer J , Parente E , Vinderola G. 2016. Growth of Lactobacillus rhamnosus 64 in whey
permeate and study of the effect of mild stresses on survival to spray drying.
LWT Food Sci Technol. 63: 322-330.
Lowry OH, Rosebrough NJ, Farrar AL, Randall RJ. 1951. Protein measurement with the folin phenol reagent. J Biol Chem. 193:265-275.
Makarova K, Slesarev A, Wolf Y, Sorokin A, Mirkin B, Koonin E, Pavlov A, Pavlova N, Karamychev V, Polouchine N. 2006. Comparative genomics of the lactic acid bacteria. Proc Ntl Acad Sci. 103(42):15611-15616.
Marzoeki AA. 1978. Penelitian peningkatan mutu dangke. Makassar [ID]: Balai Penelitian Kimia Departemen Perindustrian.
Mattjik AA, Sumertajaya M. 2013. Perancangan Percobaan dengan Aplikasi SAS dan Minitab Jilid 1. Bogor (ID): IPB Pr.
Mukhlisah AN. 2017. Kualitas kimia, fisik dan cemaran mikroba dangke sebagai respon terhadap perbedaan suhu pemanasan dan konsentrasi papain. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Nes IF, Gabrielsen C, Brede DA, Diep DB. 2015. Novel Developments in Bacteriocins from Lactic Acid Bacteria. Biotech Lactic Acid Bact: Novel Applications:80.
Nurwantoro dan Djarijah AS. 1994. Mikrobiologi Pangan Hewan Nabati.
Yogyakarta (ID): Kanisus.
Pan X, Chen F, Wu T, Tang H, Zhao Z. 2009. The acid, bile tolerance and antimicrobial property of Lactobacillus acidophilus NIT. J Food Control.
20:598-602.
Panesar PS, Kennedy JF, Gandhi DN, Bunko K. 2007. Bioutilisation of whey for
20
Pelczar MJ, Chan ECS. 1988. Dasar-Dasar Mikrobiologi 2. Jakarta (ID): UI Pr.
Ray B, Miller KW. 2003. Bacteriocins Other than Nisin: The Pediocin-Like
Cystibiotics of lactic acid bacteria. Wyoming (US): CRC Pr.
Riaz S, Nawaz SK, Hasnain S. 2010. Bacteriocins produced by L. fermentum and L. acidophilus can inhibit cephalosporin resistant E. coli. Braz J Microbiol.
41(3):643-648.
Singh R, Sivasubramani K, Jayalakshmi S. 2013. Strainion and production of bacteriocin by marine Lactobacillus fermentum SBS001. Int J Curr Microbiol App Sci. 2(4):67-73.
Surono IS. 2004. Probiotik Susu Fermentasi dan Kesehatan. Jakarta (ID): PT. Tri
Cipta Karya.
Syah SP, Sumantri C, Arief II, Taufik E. 2016. Strainion and identification of indigenous lactic acid bacteria by sequencing the 16S rRNA from dangke, a traditional cheese from Enrekang, South Sulawesi. Pakistan J of Nutrition:
In press.
Todar K. 2013. The growth of bacterial populations. [diunduh 15 Juli 2016]. Tersedia pada: http://textbookofbacteriology.net/growth.html.
Vinderola CG, Gueimonde M, Delgado T, Reinheimer JA de los Reyes – Gavilan CG. 2000. Characteristics carbonated fermented milk and survival of probiotik
bacteria. Int Dairy J. 10:213-220.
Waluyo L. 2008. Teknik dan Metode Dasar Dalam Mikrobiologi. Malang (ID):
UMM Pr.
21
22
Lampiran 1.1 Analisis ragam nilai total BAL L. fermentum asal dangke
Sumber keragaman Db JK KT F P
Perlakuan Strain 2 22.66 11.33 285.32 0.00
Perlakuan waktu 9 11.15 1.24 31.21 0.00
Strain*Waktu 18 4.72 0.26 6.60 0.00
Galat 29 1.15 0.04
Total 58 39.69
Lampiran 1.2 Hasil uji Duncan total BAL strain L. fermentum asal dangke
Perlakuan Strain Rataan Homogeneous Groups
A323L 7.88 a
B323K 7.99 a
C113L 9.24 b
Lampiran 1.3 Hasil Uji Duncan total BAL strain L. fermentum asal dangke
terhadap waktu Perlakuan Waktu
(Jam) Rataan Homogeneous Groups
0 7.39 a
4 7.75 b
8 8.20 c
12 8.50 d
16 8.55 d
20 8.65 d
24 8.74 d
28 8.71 d
32 8.64 d
23
Lampiran 2.1 Analisis ragam nilai TAT L. fermentum asal dangke
Sumber keragaman Db JK KT F P
Perlakuan Strain 2 0.12 0.06 348.65 0.00
Perlakuan waktu 9 0.38 0.04 492.24 0.00
Strain*Waktu 18 0.10 0.01 32.75 0.00
Galat 29 0.02 0.01
Total 58 0.52
Lampiran 2.2 Hasil Uji Duncan TAT strain L. fermentum asal dangke
Perlakuan Strain Rataan Homogeneous Groups
A323L 0.26 a
B323K 0.28 a
C113L 0.36 b
Lampiran 2.3 Hasil Uji Duncan TAT strain L. fermentum asal dangke
terhadap waktu
Perlakuan Waktu (Jam) Rataan Homogeneous Groups
0 0.18 a
4 0.20 b
8 0.23 c
12 0.26 d
16 0.29 e
20 0.32 f
24 0.40 g
28 0.40 g
32 0.40 g
24
Lampiran 3.1 Analisis Ragam nilai pH L. fermentum asal dangke
Sumber keragaman Db JK KT F P
Perlakuan Strain 2 3.56 3.88 216.57 0.00
Perlakuan waktu 9 1.21 1.84 73.83 0.00
Strain*Waktu 18 0.07 1.65 4.06 0.00
Galat 29 0.02 0.04
Total 58 16.19
Lampiran 3.2 Hasil Uji Duncan pH strain L. fermentum asal dangke
Perlakuan Strain Rataan Homogeneous Groups
A323L 4.47 a
B323K 5.08 a
C113L 4.22 b
Lampiran 3.3 Hasil Uji Duncan pH strain L. fermentum asal dangke terhadap
waktu
Perlakuan Waktu (Jam) Rataan Homogeneous Groups
0 5.71 a
4 5.17 b
8 4.94 c
12 4.81 c
16 4.65 d
20 4.55 de
24 4.49 ef
28 4.43 ef
32 4.37 ef
25
Lampiran 4.1 Analisis Ragam Aktivitas Antimikroba Strain L. fermentum
terhadap E. coli
Sumber keragaman Db JK KT F P
Perlakuan Strain 2 0.93 0.48 38.47 0.00
Galat 2 0.00 0.00
Total 4 0.93
Lampiran 4.2 Hasil Uji Duncan Antimikroba Strain L. fermentum terhadap E. coli
Perlakuan Strain Rataan Homogeneous Groups
A323L 2.15 a
B323K 2.36 b
C113L 3.07 c
Lampiran 5.1 Analisis Ragam Aktivitas Antimikroba Strain L. fermentum
terhadap S. aureus
Sumber keragaman Db JK KT F P
Perlakuan Strain 2 0.27 0.13 68.11 0.01
Galat 2 0.00 0.00
Total 5 0.28
Lampiran 5.2 Hasil Uji Duncan Antimikroba Strain L. fermentum terhadap S. aureus
Perlakuan Strain Rataan Homogeneous Groups
A323L 2.82 a
B323K 3.10 b
C113L 3.34 c
Lampiran 6.1 Ragam Konsentrasi Protein Bakteriosin
Sumber keragaman Db JK KT F P
Perlakuan Strain 2 876.13 438.06 1.66 0.00
Galat 2 0.53 0.26
Total 5 936
Lampiran 6.2 Hasil Uji Duncan Konsentrasi Protein Bakteriosin
Perlakuan Strain Rataan Homogeneous Groups
A323L 58.95 a
B323K 78.43 b
26
Lampiran 7.1 Analisis Ragam Aktivitas Antimikroba Bakteriosin terhadap E. coli
Sumber keragaman Db JK KT F P
Perlakuan Strain 2 0.38 0.19 116.11 0.00
Galat 2 0.00 0.00
Total 5 0.38
Lampiran 7.2 Hasil Uji Duncan Antimikroba Strain L. fermentum terhadap E. coli
Perlakuan Strain Rataan Homogeneous Groups
A323L 1.97 a
B323K 2.32 b
C113L 2.58 c
Lampiran 8.1 Analisis Ragam Aktivitas Antimikroba Bakteriosin terhadap S. aureus
Sumber keragaman Db JK KT F P
Perlakuan Strain 2 0.44 0.22 174.52 0.01
Galat 2 0.00 0.00
Total 5 0.45
Lampiran 8.2 Hasil Uji Duncan Antimikroba Strain L. fermentum terhadap S. aureus
Perlakuan Strain Rataan Homogeneous Groups
A323L 2.69 a
B323K 2.95 b
C113L 3.35 c
Lampiran 9 Uji t-student daya hambat L.fermentum terhadap E.coli dan
S.aureus
Perlakuan N Rata-rata Standar deviasi T P
E.coli 3 8.03 0.43 15.62 0.03 S.aureus 3 8.73 0.10
Lampiran 10 Uji t-student daya hambat bakteriosinterhadap E.coli dan
S.aureus
Perlakuan N Rata-rata Standar deviasi T P
27