STATUS AKROSOM DAN KUALITAS POST-THAWED SPERMATOZOA
PADA BEBERAPA RUMPUN SAPI DARI DUA
BALAI INSEMINASI BUATAN
YULIDA NOFA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Status Akrosom Spermatozoa dan Kualitas Semen Beku pada Beberapa Rumpun Sapi dari Dua Balai Inseminasi Buatan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2017
Yulida Nofa
RINGKASAN
YULIDA NOFA. Status Akrosom dan Kualitas Post-Thawed spermatozoa pada beberapa Rumpun Sapi dari Dua Balai Inseminasi Buatan. Dibimbing oleh NI WAYAN KURNIANI KARJA dan R. IIS ARIFIANTINI.
Serangkaian proses kriopreservasi dapat menurunkan kualitas spermatoza serta berpotensi mengalami kerusakan pada akrosom. Pembentukan kristal es dan kejutan dingin (cold shock) dapat merusak membran spermatozoa sehingga berpotensi menyebabkan kerusakan akrosom. Keutuhan akrosom spermatozoa merupakan kunci keberhasilan fertilisasi karena berperan penting dalam proses reaksi akrosom. Tujuan dari penelitian ini adalah mengevaluasi status akrosom dan kualitas semen post-thawed spermatozoa pada beberapa rumpun sapi dari dua Balai Inseminasi Buatan (BIB). Semen beku sapi limosin, ongole, simental dan brahman dari kedua BIB di-thawing kemudian dievaluasi motilitas spermatozoa, membran plasma utuh (MPU) serta evaluasi Tudung Akrosom Utuh (TAU) spermatozoa menggunakan pewarnaan Trypan Blue-Giemsa (TBG) dan
Coomassie Brilliant Blue G-250 (CBB 250).
Hasil penelitian menunjukkan bahwa persentase motilitas spermatozoa pada rumpun sapi limousin, ongole, simmental dan brahman pada BIB A berturut-turut yaitu (50%; 51%; 51%; 47%), dan BIB B (51%, 46%, 47%, 46%). Motilitas spermatozoa rumpun sapi limousin, ongole dan simmental pada BIB A lebih tinggi dibandingkan motilitas spermatozoa rumpun sapi brahman, sedangkan BIB B persentase motilitas spermatozoa tertinggi terdapat pada rumpun sapi limosin dibandingkan ketiga rumpun sapi lainnya (P<0.05). Gerakan individu spermatozoa pada beberapa rumpun sapi pada kedua balai tidak terdapat perbedaan (P>0.05) dengan kisaran nilai skor antara 2.20-2.40. Persentase MPU spermatozoa pada keempat rumpun sapi di BIB A berturut-turut (71.50%, 72.53%, 70.80%, 69.30%) dan BIB B (72.60%, 64.90%, 66.20%, 71.00%). Persentase MPU spermatozoa keempat rumpun sapi di BIB A menunjukkan nilai yang hampir sama pada kisaran 69.30-72.53% (P>0.05). Balai B MPU spermatozoa rumpun sapi limousin dan brahman lebih tinggi dibandingkan rumpun sapi ongole dan simmental. Persentase TAU spermatozoa pada keempat rumpun sapi di BIB A dari hasil kedua pewarnaan menunjukkan nilai yang hampir sama pada kisaran 90.40-98.10% (P>0.05), sedangkan nilai TAU spermatozoa rumpun sapi ongole dengan nilai 95.00% pada BIB B menggunakan pewarnaan CBB G250 lebih tinggi dibandingkan rumpun limousin, simmental dan brahman (91.70%; 87.20%; 90.20 %) (P>0.05). Dapat disimpulkan bahwa rumpun sapi tidak berpengaruh terhadap kualitas spermatozoa post-thawed yang berasal dari BIB berbeda. Pewarnaan CBB G250 dinilai lebih efisien dibandingkan pewarnaa TBG untuk evaluasi status akrosom spermatozoa.
SUMMARY
YULIDA NOFA. Acrosome Status and Quality of Frozen Sperm from several Cattle Breed Produced by Artificial Insemination Centres. Supervised by NI WAYAN KURNIANI KARJA and R. IIS ARIFIANTINI.
A series of cryopreservation process resulting a detrimental effect to the sperm quality such as loss of sperm motility, sperm viability, membrane integrity and potentially damage to the acrosome. Ice crystal formation and cold shock are the causes of these damages. Acrosomal integrity is the key point of successful fertilization, because only sperm with intact acrosome that can undergo acrosome reaction and penetrate the zona pellucida of the oocytes. The aim of this study was to evaluate the quality and acrosomal status of frozen semen of several cattle breeds from two Artificial Insemination (AI) center. Frozen semen of limousine, ongole, simmental and brahman bulls were thawed and evaluated to determine sperm motility, individual movement and Plasma Membrane Integrity (PMI). Acrosomal status were assessed using Trypan Blue-Giemsa (TBG) and Coomassie Brilliant Blue G-250 (CBB G250) staining.
The results showed that the percentage of sperm motility of limousine, ongole, simmental and brahman bull from AI center A were 50%, 51%, 51% and 47% respectively, whereas from AI center were B 51%, 46%, 47%, 46% respectively. Sperm of limousine, ongole and simmental bulls from AI center A have a higher motility than other bull in the same AI center (P<0.05). The were no differences (P>0.05) on individual movement among of the group from both AI center with a range scores between 2.20-2.40 (P>0.05). The percentage of sperm with PMI of limousine, ongole, simmental and brahman from AI center A were 71.50%, 72.53%, 70.80%, 69.30% respectively, while from AI center B were 72.60%, 64.90%, 66.20%, 71.00% respectively. The percentage of PMI of all breeds from AI center A werw differ in range of 69.30-72.53% (P>0.05), AI center B, limousine and brahman have higher PMI than ongole and simmental bull. Whereas, the percentage of acrosomal integrity of all breeds from AI center A in both staining method were not differ with the range of 90.40-9810% (P>0.05). The persentage of acrosomal integrity of ongole bull from AI center A using CBB G250 staining was highest (95.00%) than limousine, simmental and brahman bull (91.70%, 87.20%, 90.20%) (P<0.05). It can be concluded that cattle breeds have no effect on the quality of frozen semen from both AI center. Coomassie Brilliant Blue G250 staining considered more efficient compared to TBG staining to evaluate the acrosomal status of sperm.
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Reproduksi
STATUS AKROSOM DAN KUALITAS POST-THAWED SPERMATOZOA
PADA BEBERAPA RUMPUN SAPI DARI DUA
BALAI INSEMINASI BUATAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2017
PRAKATA
Puji dan syukur penulis ucapkan kepada Allah SWT atas segala karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini berkaitan dengan judul “Status Akrosom dan Kualitas Post-Thawed Spermatozoa pada Beberapa Rumpun Sapi dari Dua Balai Inseminasi Buatan”. Keutuhan akrosom spermatozoa berhubungan dengan keberhasilan fertilisasi dalam program Inseminasi Buatan. Karya ilmiah ini juga berisikan informasi mengenai protokol analisis penggunakan pewarnaan Trypan Blue-Giemsa dan Coomassie Brilliant Blue G250 untuk evaluasi keutuhan akrosom spermatozoa sapi yang tepat dan selanjutnya dapat dipergunakan sebagai bahan referensi untuk pemeriksaan akrosom spermatozoa beberapa sapi pejantan yang ada di Balai Inseminasi Buatan yang ada di Indonesia. Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada ibu Drh Ni Wayan Kurniani Karja, MP. PhD selaku ketua komisi pembimbing dan ibu Prof Dr R. Iis Arifiantini, MSi selaku anggota komisi pembimbing atas bimbingan dan arahannya sehingga tesis ini dapat diselesaikan secara sempurna. Terima kasih saya ucapkan juga kepada selaku penguji luar komisi ibu Prof Dr Drh Tuty Laswardi Yusuf MS, serta bapak Prof Dr Drh Mohamad Agus Setiadi selaku ketua Program Studi Biologi Reproduksi Pascasarjana IPB. Ucapan terima kasih juga penulis sampaikan kepada seluruh dosen Program Studi Biologi Reproduksi Pascasarjana IPB. Terima kasih tidak lupa saya ucapkan kepada Balai Inseminasi Buatan Nasional maupun Daerah beserta kepala laboratorium In Vitro Fertilization yang telah bersedia menyediakan tempat untuk penelitian ini. Karya ilmiah ini didedikasikan untuk kedua orang tua „Darussalam dan Rafitni‟, kakak „Yoki Daikhwa, SP.‟ dan adikku tercinta „Melgo Sandri dan Apriliada Resvi‟ serta keluarga besar yang tidak ada lelahnya memberi motivasi dan dukungannya selama penulis menempuh studi. Terimakasih kepada Sdri Siska Nurmala Sari Ssi, Dwi Natalia Spd, Magfira Spt. Msi dan Alvien Nur Aini, Ssi. Msi, Nofri Zayani Ssi. Msi, Siska Adelia Ssi. Msi atas kebersamaannya selama penulis menempuh studi. Rekan-rekan mahasiswa Program Studi Biologi Reproduksi dan khususya angkatan 2014 atas bantuan dan kebersamaannya saya ucapkan terima kasih. Akhirnya, semoga karya ilmiah berupa tesis ini dapat memberikan informasi yang bermanfaat dan berguna bagi semuanya.
Bogor, Februari 2017
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2 Manfaat Penelitian 2 2 TINJAUAN PUSTAKA 3 Perkembangan Inseminasi Buatan 3
Karakteristik Spermatozoa Sapi 3
Kriopreservasi Semen 4
Mekanisme Kapasitasi dan Reaksi Akrosom 5
Pewarnaan Akrosom Spermatozoa Menggunakan CBB G250 dan TBG 7
3 METODE 8 Waktu dan Tempat 8 Materi Penelitian 8
4 HASIL DAN PEMBAHASAN 10
Hasil 10
Pembahasan 12
5 SIMPULAN 15
Simpulan 15
DAFTAR PUSTAKA 15
LAMPIRAN 20
DAFTAR TABEL
1 Motilitas spermatozoa semen beku pada BIB A dan BIB B 10 2 Gerakan individu spermatozoa semen beku dari berbagai rumpun pada
BIB A dan BIB B 10
3 Membran Plasma Utuh spermatozoa semen beku beberapa rumpun
sapi post thawing dari dua BIB 11
4 Akrosom Utuh pada beberapa rumpun sapi pada BIB A dan BIB B 11
DAFTAR GAMBAR
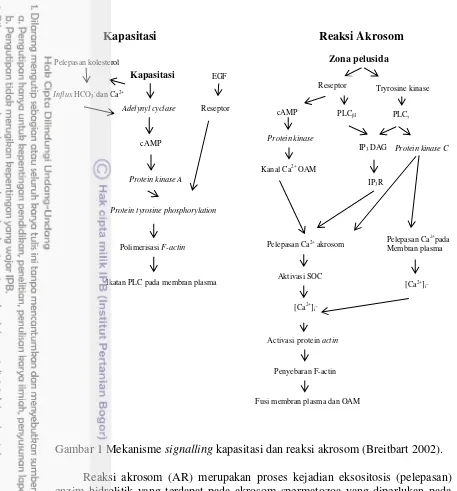
1 Mekanisme signaling kapasitasi dan reaksi akrosom 6 2 Akrosom Utuh dan akrosom tidak utuh hasil pewarnaan TBG; AU dan
1.
PENDAHULUAN
Latar Belakang
Kriopreservasi semen merupakan suatu teknik penyimpanan materi genetik (spermatozoa) dalam keadaan beku. Pembekuan semen bertujuan untuk pemanfaatan pejantan secara optimal dalam mengatasi keterbatasan jumlah pejantan dan penghematan biaya dalam pemeliharaan pejantan. Semen beku saat ini diproduksi oleh Balai Inseminasi Buatan (BIB) Nasional dan Balai Inseminasi Buatan Daerah (BIBD). Semen beku yang diproduksi harus sesuai dengan persyaratan mutu yang ditetapkan oleh Badan Standardisasi Nasional (BSN) yang tertuang dalam Standar Nasional Indonesia (SNI) Nomor 4869: 2008 Bagian 1 mengenai semen beku sapi (Sukmawati et al. 2015). Pengujian kualitas semen beku sesuai persyaratan mutu yang ditetapkan pada SNI Nomor 4869: 2008 Bagian 1 tersebut adalah penilaian motilitas dan gerakan individu saja. Beberapa indikator lain yang diperlukan untuk prediksi kemampuan fertilisasi spermatozoa salah satunya adalah pengujian status akrosom.
Indikator yang digunakan dalam prediksi kemampuan fertilisasi spermatozoa ditunjukkan berdasarkan motilitas dan skor gerakan individu, indikator tersebut dirasa belum mewakili secara keseluruhan kemampuan fertilisasi spermatozoa. Motilitas dan gerakan individu spermatozoa hanya menunjukkan kemampuan spermatozoa hidup dan kecepatan bergerak normal untuk melewati organ reproduksi betina. Neild et al. (2005) menyatakan bahwa untuk keberhasilan fertilisasi, spermatozoa harus memiliki akrosom dalam kondisi utuh dalam melakukan fungsi reaksi akrosom pada waktu yang tepat, melepaskan enzim serta memfasilitasi spermatozoa dalam menembus zona pelusida. Suhu penyimpanan spermatozoa pada proses pembekuan semen adalah -196o C dalam nitrogen cair.
Serangkaian proses pembekuan hingga thawing tersebut dapat menyebabkan kejutan dingin, stres osmotik dan pembentukan kristal es. Ketiga kejadian tersebut akan memengaruhi kualitas spermatozoa meliputi penurunan motilitas, viabilitas, perubahan permeabilitas dan perubahan komponen lipid pada membran (Holt 2000). Penurunan fungsi membran sel berhubungan dengan kemampuan spermatozoa untuk membuahi oosit (Flesch et al. 2000). Membran plasma memiliki peranan penting dalam melindungi organel sel terutama akrosom spermatozoa. Akrosom spermatozoa memiliki inner acrosome membrane (IAM) dan outer acrosome membran (OAM) yang akan berperan dalam pelepasan enzim penetrasi oosit selama reaksi akrosom pada waktu fertilisasi (Cardullo dan Florman 1993).
Perubahan komponen lipid pada membran spermatozoa dapat mengganggu stabilitas membran serta berpotensi mengalami kerusakan akrosom (Esteves et al.
2
Keutuhan akrosom spermatozoa dapat diamati menggunakan metode pewarnaan Chlortetracycline (Wattimena 2006) atau dengan teknik histokimia lektin seperti yang dilaporkan oleh Fannessia et al. (2015). Kedua metode tersebut sangat kompleks dan cukup mahal sehingga kurang aplikatif bila diterapkan di lapang. Metode pewarnaan yang lebih sederhana yang mungkin bisa diterapkan di lapang adalah pewarnaan Trypan Blue-Giemsa (TBG) dan Coomassie Brilliant Blue G-250 (CBB G250). Pewarnaan TBG telah digunakan dalam evaluasi akrosom spermatozoa berbagai spesies seperti sapi dan babi (Kovacs dan Foote 1992) sedangkan pewarna CBB G250 dilaporkan pada spermatozoa kelinci (Larson dan Miller 1999) dan manusia (De Oliveira et al. 2011). Kedua pewarna tersebut memiliki kemampuan afinitas yang tinggi terhadap protein dan diharapkan mampu untuk mendeteksi akrosom spermatozoa. Giemsa pada pewarnaan TBG merupakan pewarna yang mampu berikatan dengan protein membran sel yang melindungi bagian akrosom spermatozoa. Coomassie Brilliant Blue G-250 diketahui dapat berikatan dengan protein seperti glikoprotein dengan berat molekul 30 kDa (Bolwell et al. 1980). Mengingat akrosom sangat penting untuk fertilisasi, oleh karena itu penelitian ini bertujuan untuk mengevaluasi kualitas dan status akrosom spermatozoa semen beku pada beberapa rumpun sapi dari salah satu BIB dan BIBD.
Tujuan Penelitian
1. Evaluasi status akrosom dan kualitas post-thawed spermatozoa pada beberapa rumpun sapi yang berasal dari Balai Inseminasi Buatan.
2. Efektivitas pewarnaan Coomassie Brilliant Blue G-250 dan Trypan Blue- Giemsa untuk menentukan status akrosom spermatozoa.
Manfaat Penelitian
1. Memberikan informasi tentang status akrosom dan kualitas post-thawed
spermatozoa pada beberapa rumpun sapi yang berasal dari Balai Inseminasi Buatan.
2. Memberikan informasi tentang efektifitas pewarnaan Coomassie Brilliant Blue
3
2.
TINJAUAN PUSTAKA
Perkembangan Balai Inseminasi Buatan
Balai Inseminasi Buatan (BIB) nasional maupun daerah merupakan instansi pemerintah yang melaksanakan produksi dan pemasaran benih unggul ternak serta pengembangan IB. Dalam perkembangannya BIB tersebut memproduksi semen beku yang telah disebarkan dalam maupun keluar daerah untuk pelaksanaan IB di Indonesia. Perkembangan IB saat ini tersebar di seluruh Indonesia, hal ini dikarenakan masyarakat telah menyadari arti dan manfaat IB untuk meningkatkan produktivitas ternaknya. Menyadari arti penting IB tersebut maka hampir setiap daerah propinsi di Indonesia melalui Dinas Peternakan/Dinas Peternakan dan Kesehatan Hewan mendirikan Balai Inseminasi Buatan atau UPT Inseminasi Buatan. Balai Inseminasi Buatan yang aktif dalam melakukan fungsi di antaranya dua Balai Inseminasi Buatan Nasional (BIB) dan 14 Balai Inseminasi Buatan Daerah (BIBD). Balai-balai tersebut mendistribusikan semen beku yang diproduksi sendiri maupun berasal dari BIB nasional untuk disalurkan ke dalam maupun luar daerah untuk dimanfaatkan dalam pelaksanaan IB.
Pengendalian mutu semen beku sapi yang dilaksanakan di BIB terdiri atas pengendalian mutu semen segar, pengendalian mutu selama proses produksi dan pengendalian mutu semen beku. Pengendalian mutu sudah dijalankan secara terstruktur dengan adanya uji/pemeriksaan motilitas semen secara berkala. Persyaratan mutu tersebut ditetapkan oleh Badan Standardisasi Nasional (BSN) dan tertuang dalam standar mutu produksi semen beku sapi SNI 4869: 2008 Bagian 1 meliputi daya tahan terhadap pembekuan yang rutin dilakukan yakni motilitas post thawing lebih dari 40% dan gerakan individu 2-3 (Sukmawati et al. 2015).
Semen beku memiliki keunggulan yaitu dapat digunakan dalam jangka waktu yang lama namun memiliki kelemahan yaitu kualitas semen dapat menurun setelah semen dibekukan. Kualitas semen beku sangat ditentukan oleh beberapa faktor di antaranya adalah faktor sumber daya manusia, pejantan sebagai sumber semen, peralatan dan jenis pengencer yang digunakan. Sapi pejantan yang digunakan pada beberapa BIB sudah terakreditasi oleh lembaga sertifikasi produk (LSpro) benih dan bibit ternak. Pemilihan pejantan harus memenuhi standar untuk dapat dijadikan bibit unggul juga berpedoman pada Permentan/NOMOR 101.OT.140/7/2014 mengenai pedoman pembibitan ternak. Pejantan yang merupakan sumber semen memiliki sifat unggul, bebas dari gangguan penyakit baik menular maupun tidak, serta memiliki libido yang tinggi untuk menghasilkan kualitas semen yang bagus dan teruji.
Karakteristik Spermatozoa Sapi
Spermatozoa mamalia terdiri atas tiga komponen utama yaitu head (kepala),
4
lipid membran (Nollan et al. 1995). Fosfolipid berorientasi hidrofilik pada permukaan kepala dan hidrofobik pada bagian ekor ke arah interior membran.
phosphatidylserine (PS) dan phosphatidylethanolamine (PE) yang terlokasi pada membran dalam, sedangkan sphingomyeline (SM) dan phosphatidylcholine (PC) terlokalisasi di lapisan luar membran (Gadella et al. 1999). Fosfolipid membran berkisar 65-70% dari total lipid memberikan fluidity pada membran (Holt 2000). Membran plasma spermatozoa juga terdiri atas 300 protein yang berbeda dan 92% protein membran ekstraseluler pada semua sel eukariotik berupa glikokonjugat (Schroter et al. 1999).
Spermatozoa memiliki kromosom haploid atau setengah dari jumlah DNA sel somatik pada spesies yang sama dan dihasilkan melalui pembelahan meiosis selama pembentukan spermatozoa (Ball dan Peters 2004). Kepala spermatozoa terdiri atas dua daerah yaitu daerah akrosom anterior yang dilapisi oleh tudung akrosom dan daerah post akrosom yang berbatasan dengan ekor. Akrosom berasal dari golgi kompleks selama tahapan awal spermiogenesis, yang mengandung enzim akrosin, hyaluronidase dan enzim-enzim hidrotik lainnya yang terlibat pada proses fertilisasi. Akrosom spermatozoa terbentuk pada tahap spermiogenesis selama spermatogenesis. Spermiogenesis merupakan perubahan yang terjadi selama tahap spermatid sehingga terbentuk sel spermatozoa normal. Perubahan morfologik spermatozoa selama tahapan spermiogenesis meliputi pembentukan akrosom, leher dan ekor spermatozoa (Hess dan Franca 2005).
Akrosom spermatozoa organel internal terletak di daerah anterior kepala dan mengandung enzim hidrolitik yang berperan dalam reaksi akrosom selama fertilisasi (Toshimori 1998). Akrosom membran tersusun atas inner acrosome
membrane yang berlawanan membungkus nukleus dan outer acrosome membrane
yang berhubungan dengan membran plasma (Eddy 1994). Kriopreservasi Semen
Kriopreservasi merupakan suatu teknik penyimpanan sel hewan, tumbuhan ataupun materi genetik lain (termasuk spermatozoa dan oosit) dalam keadaan beku melalui reduksi aktivitas metabolisme tanpa memengaruhi organel di dalam sel sehingga fungsi fisiologis, biologis dan morfologis tetap ada (Gazali dan Tambing 2002). Prinsip terpenting dari kriopreservasi sel spermatozoa ialah pengeluaran air dari dalam sel (dehidrasi) sebelum intraseluler membeku. Dehidrasi tidak terjadi akan terbentuk kristal es besar di dalam sel yang dapat merusak sel dan apabila terjadi dehidrasi yang sangat hebat maka sel akan mengalami kekeringan sehingga sel mengalami kematian (Supriatna dan Pasaribu 1992). Pembentukan kristal es selama proses kriopreservasi sel spermatozoa menyebabkan terjadinya penumpukan elektrolit di dalam sel. Hal tersebut mengakibatkan terjadi kerusakan sel secara mekanik. Elektrolit yang menumpuk akan merusak dinding sel sehingga pada waktu pencairan kembali permeabilitas membran plasma akan menurun dan sel akan mati. Pembentukan kristal es kemungkinan berkaitan dengan perubahan tekanan osmotik dalam fraksi yang tidak mengalami pembekuan (Watson 2000).
5 diikuti fertilisasi oosit. Spermatozoa dalam kondisi hidup di saluran reproduksi betina diperlukan untuk melakukan fungsi fisiologis pada waktu ovulasi (Watson 2000; Graham dan Moce 2005). Gangguan lipid pada membran plasma selama kriopreservasi dapat menyebabkan kerusakan sel lebih lanjut serta dapat menyebabkan kematian spermatozoa (Watson 1995).
Tartaglione dan Ritta (2004) mengatakan kualitas dan keberhasilan kriopreservasi semen dapat dipengaruhi oleh beberapa faktor seperti bahan pengencer yang digunakan. Watson (2000) menambahkan kriopreservasi menyebabkan 50% spermatozoa imotil sehingga menimbulkan penurunan kemampuan fertilisasi. Berbagai pendekatan yang dilakukan dalam menurunkan potensi kerusakan spermatozoa seperti modifikasi pengencer dan protokol pembekuan semen. Agen krioprotektan seperti gliserol dan komponen lain seperti kuning telur, susu dalam pengencer telah dilaporkan dapat mengurangi efek kerusakan pembekuan tersebut (Batellier et al. 2001).
Pengencer berperan dalam melindungi spermatozoa dari kejutan dingin, stres osmotik dan perubahan stabilitas dan permeabilitas membran serta menyediakan substrat energi untuk metabolisme spermatozoa. Peran lipoprotein dan fosfolipid yang ditemukan dalam kuning telur melindungi membran spermatozoa dengan cara meningkatkan proporsi kolesterol/fosfolipid di membran sehingga mengurangi kejutan dingin (Medeiros et al. 2002) dan meningkatkan viabilitas sel (Kulaksiz et al. 2010). Komposisi dan distribusi fosfolipid membran dalam dan luar dari spermatozoa sangat penting dalam memberikan sifat permeabilitas dan fluiditas pada membran. Phosphatidylserine (PS) dan
phosphatidylethanolamine (PE) terutama terlokalisasi pada membran dalam sedangkan sphingomyeline (SM) dan phosphatidylcholine (PC) berada pada bagian luar membran (Gadella et al. 1999; Hammerstedt et al. 1990).
Mekanisme Kapasitasi dan Reaksi Akrosom
6
Kapasitasi Reaksi Akrosom
Gambar 1 Mekanisme signalling kapasitasi dan reaksi akrosom (Breitbart 2002). Reaksi akrosom (AR) merupakan proses kejadian eksositosis (pelepasan) enzim hidrolitik yang terdapat pada akrosom spermatozoa yang diperlukan pada saat fertilisasi (Allen dan Green 1997). Ikatan dengan zona pelusida menstimulasi spermatozoa mengalami reaksi akrosom diawali dengan terjadi fusi antara membran luar akrosom dengan melewati membran plasma (Yanagimachi 1995). Zona pelusida oosit berikatan dengan dua reseptor pada membran plasma mengaktifkan PLC1 dan memungkinkan pengaturan aktivitas AC untuk produksi cAMP dan pengaktifan PKA. Reseptor lainnya adalah tyrosine kinase (TK) dalam pengaktifan PLC dan bergabung dengan PLC 1 untuk menghasilkan IP3 dan DAG. Protein kinase A dan IP3 akan membuka kanal ion Ca2+ pada membran luar akrosomal dan DAG mengaktifkan PKC untuk membuka kanal ion Ca2+ pada membran plasma. Hasilnya, terjadinya peningkatan konsentrasi Ca2+ pada sitosol dan akrosomal yang menyebabkan fusi antara plasma membran dan membran luar akrosom untuk melepaskan enzim dari akrosom (Breirtbart 2002).
7 Akrosom spermatozoa berperan penting selama proses fertilisasi, akrosom terdiri atas enzim hidrolitik yang berperan dalam reaksi akrosom selama interaksi dengan zona pelusida oosit (Yamagata et al. 1998). Akrosom spermatozoa harus dalam keadaan utuh untuk dapat mengikat zona pelusida sebelum pelepasan enzim dan memungkinkan spermatozoa menembus zona pelusida (Wassarman et al. 2004). Spermatozoa terikat pada zona pelusida dari oosit melalui reseptor permukaan sel atau protein yang mengikat pada eksterior spermatozoa akrosom utuh (Bookbinder et al. 1995). Permukaan spermatozoa dan akrosom mengandung enzim protease yang memiliki kemampuan dalam melisiskan sel kumulus dan zona pelusida oosit tersebut (Bedford 1998).
Pewarnaan Akrosom Spermatozoa Menggunakan Trypan blue-Giemsa dan
Coomassie Brilliant Blue G-250
Pewarnaan TBG dan CBB G250 dalam evaluasi integritas akrosom memiliki beberapa keunggulan: 1) hasil pewarnaan dapat dianalisis menggunakan mikroskop cahaya; 2) fiksasi sederhana dan cepat, memiliki kemampuan mempertahankan integritas membran selama pewarnaan; dan 3) hasil pewarnaan dapat disimpan (Didion et al. 1989). Giemsa dan CBB G250 merupakan pewarna yang mampu berikatan dengan protein pada membran sehingga diasumsikan dapat mewarnai spermatozoa dengan baik. Membran plasma spermatozoa diperkirakan terdiri atas 300 protein yang berbeda dan sekitar 92% protein membran ekstraseluler pada semua sel eukariotik berupa glikokonjugat (Schroter et al. 1999). Integritas membran plasma spermatozoa dapat ditentukan oleh pewarna
trypan blue yang tidak dapat melewati membran pada sel spermatozoa yang masih hidup, di mana pewarna akan melewati membran sel yang telah mati. Selanjutnya pewarna giemsa berhubungan dengan deteksi ada tidaknya akrosom spermatozoa dengan mengindikasikan akrosom bewarna ungu cerah pada saat utuh (Serafini et al. 2013). Pewarna trypan blue menghasilkan warna gelap, lebih stabil dan tidak memiliki efek negatif terhadap pewarnaan giemsa. Oleh karena itu, pewarnaan
trypan blue menghasilkan ulasan warna yang cerah untuk pewarnaan akrosom (Kovacs dan Foote 1992).
8
3.
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan di Laboratorium In Vitro Fertilization (IVF), Divisi Reproduksi dan Kebidanan, Departemen Klinik Reproduksi dan Patologi, Fakultas Kedokteran Hewan Institut Pertanian Bogor pada bulan Maret - Juni dalam container nitrogen cair suhu -196oC.
Thawing Semen beku
Semen beku dikeluarkan dari container penyimpanan menggunakan pinset dan dimasukkan ke dalam water bath suhu 37o C selama 30 detik, seluruh isi
straw dimasukkan ke dalam microtube. Selama pengamatan semen disimpan dalam water bath suhu 37o C.
Motilitas dan Gerakan Individu
Penilaian motilitas spermatozoa dilakukan untuk mengetahui jumlah spermatozoa yang bergerak maju ke depan. Preparat motilitas disiapkan dengan cara meneteskan 20 µL semen menggunakan mikropipet di atas objek gelas kemudian ditutup dengan gelas penutup. Persentase motilitas spermatozoa dinilai dari 0 hingga 100% secara estimasi pada lima lapang pandang dengan cara membandingkan jumlah spermatozoa yang bergerak maju ke depan dengan gerakan spermatozoa yang lainnya. Motilitas spermatozoa dievaluasi menggunakan mikroskop Nikon FDX-35, pembesaran 400x dan dilengkapi
heating table (37° C).
Membran Plasma Utuh (MPU)
Pemeriksaan keutuhan membran plasma spermatozoa menggunakan
9 Keutuhan Akrosom Spermatozoa
a. Pewarnaan Trypan blue-Giemsa (TBG)
Pewarnaan TBG dimulai dengan meneteskan semen dan larutan trypan blue
yang dilarutkan menggunakan NaCl 0.81% secara bersamaan lalu dihomogenkan perlahan, dibuat preparat ulas dan dikeringkan secara vertikal. Preparat diwarnai menggunakan larutan neutral red dengan komposisi (86 mL HCl 1.0 N, 14 mL
formaldehide 37% , 0.2 g neutral red), preparat diwarnai selama 2-5 menit dengan cara meratakan larutan ke permukaan preparat lalu dikeringkan, preparat dibilas menggunakan air mengalir serta dikeringkan kembali.
Tahapan pewarnaan berikutnya preparat direndam dalam staining jar yang berisikan larutan giemsa 5%, dibiarkan pada suhu ruang selama 3 hari, kemudian dibilas kembali dengan mencelupkan ke dalam wadah berisi air selama 2 menit. Setelah dikeringkan, ulasan dihangatkan menggunakan heating table (40o C) (Kovacs dan Foote 1992). Preparat ditutup menggunakan gelas penutup menggunakan perekat entellan dan evaluasi dilakukan pada 200 sel menggunakan mikroskop cahaya dengan lensa objektif perbesaran 400x. Spermatozoa dengan Tudung Akrosom Utuh (TAU) berwarna ungu pada bagian kepala sedangkan spermatozoa dengan akrosom yang tidak utuh akan bewarna lavender pucat atau pudar. Status akrosom dihitung dengan menghitung jumlah spermatozoa dengan TAU dibagi dengan total jumlah spermatozoa dikali 100%.
b. Pewarnaan Coomassie Brilliant Blue G-250 (CBB G250).
Pewarna CBB G250 ditimbang sebanyak 27.5 mg, kemudian dilarutkan dalam 1.25 mL methanol, 2.5 mL glacial acetic, 6.2 ml air mili-Q dicampur hingga larut menggunakan stirrer. Semen diambil sebanyak 10 µl disentrifus pada 1400 rpm terlebih dahulu dalam 1 mL medium TALP. Supernatan dibuang dan endapan semen difiksasi menggunakan dua tetes paraformaldehyde 4% selama 10 menit. Sentrifus kedua menggunakan larutan amonium acetate pH 9, komposisi 0.7708 mg amonium acetate dengan menggunakan pelarut air mili-Q, setelah disentrifus selama 8 menit supernatan dibuang kembali dan endapan semen diambil menggunakan pipet, diteteskan bersamaan dengan larutan perwarna CBB G250 lalu dihomogenkan, kemudian dibuat preparat ulas dan dibiarkan selama 2 menit (De Oliveira et al. 2011). Preparat dibilas dan dikeringkan, selanjutnya preparat ditutup dengan gelas penutup yang telah ditambahkan satu tetes entellan sebagai perekat. Preparat dievaluasi menggunakan mikroskop cahaya dengan pembesaran 400x dan dihitung 200 sel. Spermatozoa dengan kepala berwarna biru gelap dikategorikan sebagai TAU sedangkan kepala spermatozoa yang tidak menyerap warna dikategorikan sebagai akrosom yang tidak utuh. Status akrosom dihitung dengan menghitung jumlah spermatozoa dengan TAU dibagi dengan total jumlah spermatozoa dikali 100%.
Analisis Data
10
4.
HASIL DAN PEMBAHASAN
HASIL
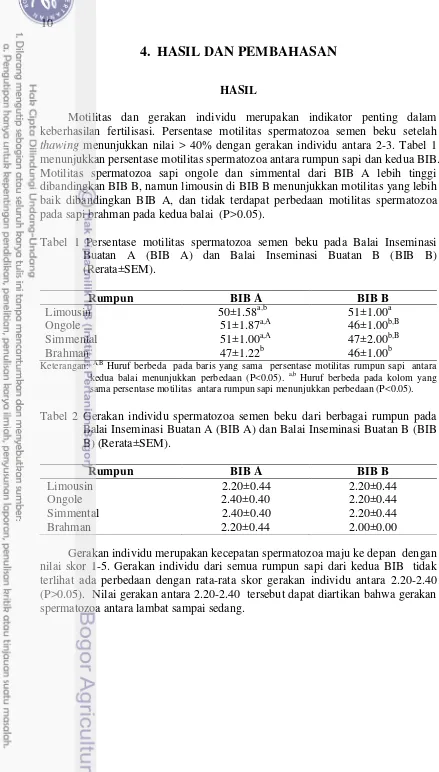
Motilitas dan gerakan individu merupakan indikator penting dalam keberhasilan fertilisasi. Persentase motilitas spermatozoa semen beku setelah
thawing menunjukkan nilai > 40% dengan gerakan individu antara 2-3. Tabel 1 menunjukkan persentase motilitas spermatozoa antara rumpun sapi dan kedua BIB. Motilitas spermatozoa sapi ongole dan simmental dari BIB A lebih tinggi dibandingkan BIB B, namun limousin di BIB B menunjukkan motilitas yang lebih baik dibandingkan BIB A, dan tidak terdapat perbedaan motilitas spermatozoa pada sapi brahman pada kedua balai (P>0.05).
Tabel 1 Persentase motilitas spermatozoa semen beku pada Balai Inseminasi Buatan A (BIB A) dan Balai Inseminasi Buatan B (BIB B) sama persentase motilitas antara rumpun sapi menunjukkan perbedaan (P<0.05).
Tabel 2 Gerakan individu spermatozoa semen beku dari berbagai rumpun pada Balai Inseminasi Buatan A (BIB A) dan Balai Inseminasi Buatan B (BIB B) (Rerata±SEM).
11 Tabel 3 Persentase MPU spermatozoa semen beku beberapa rumpun sapi dari Balai Inseminasi Buatan A (BIB A) dan Balai Inseminasi Buatan B (BIB B) (Rerata±SEM). rumpun sapi antara kedua BIB. a,b,c Huruf berbeda pada kolom sama menunjukkan perbedaan MPU antara rumpun sapi pada balai yang sama (P<0.05).
Persentase MPU antar rumpun sapi pada BIB A menunjukkan nilai yang hampir sama antara 69.30 sampai dengan 72.53%. Sapi limousin dan brahman pada BIB B memiliki Nilai MPU sama, keduanya lebih tinggi dari ongole dan simmental (Tabel 3). Nilai MPU antara balai menunjukkan ongole dan simmental pada BIB A lebih baik daripada BIB B.
Tabel 4 Persentase Tudung Akrosom Utuh (TAU) pada beberapa rumpun sapi pada Balai Inseminasi Buatan A (BIB A) dan Balai Inseminasi Buatan B (BIB B) (Rerata±SEM). Keterangan :a,b,c Huruf berbeda pada kolom yang sama menunjukkan perbedaan persentase TAU
antara rumpun sapi BIB B pada pewarnaan Coomassie Brilliant Blue G250 (CBB G250) (P<0.05).
12
PEMBAHASAN
Kualitas spermatozoa semen beku post-thawing
Hasil penelitian motilitas post-thawing lebih dari 46-51% dan gerakan individu 2-3. Spermatozoa setelah pembekuan dan perlakuan thawing akan bergerak lebih lambat dibandingkan semen segar. Perbedaan kecepatan tersebut salah satunya adalah dalam semen beku diberikan bahan pengencer seperti skim dan kuning telur, akibatnya gerakan akan lebih lambat. Proses pembekuan juga akan menyebabkan spermatozoa mengalami kerusakan sehingga gerakannya lebih lambat. Penurunan motilitas spermatozoa setelah pembekuan dan thawing dapat terjadi berkisar 24-64% (Ozkavukcu et al. 2008).
Penurunan motilitas tersebut dapat disebabkan karena spermatozoa mengalami kejutan dingin serta stres osmotik yang berlebihan. Connell et al.
(2002) melaporkan penurunan motilitas berkaitan dengan aktivitas dari mitokondria. Kerusakan mitokondria mengakibatkan terjadinya gangguan produksi adenosine triphosphate (ATP). Mitokondria merupakan sumber utama energi oksidatif sel dalam produksi ATP melalui rantai transpor elektron. Silva dan Gadella (2006) menambahkan energi berupa ATP merupakan hasil glikolisis pada mitokondria yang berperan dalam kerja mikrotubul sehingga spermatozoa mampu bergerak secara bebas.
Kualitas semen beku pada penelitian ini menunjukkan nilai yang bervariasi, hal tersebut dapat disebabkan oleh karakteristik biofisik dan biokimia dari membran spermatozoa. Faktor umur merupakan salah satu yang dapat berpengaruh terhadap kualitas semen beku. Argaman et al. (2013) melaporkan konsentrasi kolesterol di bagian ekor lebih tinggi pada sapi jantan dewasa dibandingkan sapi jantan muda. Hal tersebut diduga menyebabkan variasi dari kualitas semen beku pada umur pejantan yang berbeda. Terkait perubahan profil lipid membran spermatozoa tersebut persentase kualitas semen beku yang diperoleh antara rumpun sapi pada balai yang sama maupun balai berbeda bervariasi dalam kualitas. Pembekuan menyebabkan lipid pada membran mengalami perubahan dari fase lentur ke fase gel (padat). Lipid membran pada fase gel tersebut mudah rusak dan sobek akibat pembentukan kristal es yang tajam selama pembekuan.
Kualitas semen beku pada beberapa rumpun sapi berbeda-beda, namun kualitas yang ditunjukkan berada dalam kisaran normal untuk keberhasilan fertilisasi. Komponen fosfolipid yang ditemukan pada kuning telur dan susu skim berperan dalam melindungi plasma membran dari efek cold shock (Medeiros et al.
2002). Fosfolipid melakukan fusi melalui membran spermatozoa, menggantikan beberapa fosfolipid membran spermatozoa yang telah rusak dengan demikian mengurangi efek dari perubahan suhu (Graham dan Foote 1987). Susu skim mengandung lipoprotein dan lesitin sehingga bisa digunakan dalam pengencer semen untuk melindungi spermatozoa dari pengaruh kejutan dingin (cold shock).
13 Persentase keutuhan membran plasma berkisar antara 64-72%, persentase keutuhan membran tersebut masih dalam kisaran normal. Pembentukan kristas es tajam dan kejutan dingin dapat menurunkan kualitas membran spermatozoa, penumpukan elektrolit akan merusak membran sel spermatozoa pada saat thawing
sehingga permeabilitas membran plasma menurun (Watson 2000). Faktor tersebut hanya merusak membran plasma tetapi tidak berpengaruh pada akrosom spermatozoa. Akrosom spermatozoa selain dilindungi oleh membran plasma juga terdapat membran luar maupun dalam yang juga berfungsi melindungi akrosom sehingga mampu melakukan penetrasi spermatozoa pada waktu fertilisasi oosit.
Keutuhan Akrosom Spermatozoa Semen Beku
Spermatozoa harus memiliki akrosom dalam keadaan utuh sehingga memiliki kemampuan untuk berikatan dengan zona pelusida oosit dan mengalami reaksi akrosom dan melepaskan enzim untuk keberhasilan fertilisasi (Graham dan Moce 2005). Kemampuan fertilisasi spermatozoa dipengaruhi oleh kualitas spermatozoa seperti memiliki motilitas, integritas membran dan akrosom yang tinggi dalam berkemampuan melewati organ reproduksi betina dan melakukan fusi dengan oosit (Ward et al. 2003). Metode yang berkembang saat ini dalam prediksi kemampuan fertilisasi spermatozoa belum menunjukkan hasil yang memuaskan. Indikator keutuhan akrosom sangat diperlukan dalam mengetahui kemampuan fertilisasi spermatozoa untuk keberhasilan IB. Pewarnaan yang digunakan dalam penelitian ini mampu mendeteksi status akrosom spermatozoa setelah mengalami pembekuan.
Hasil penelitian menunjukkan bahwa status akrosom spermatozoa setelah dilakukan thawing menunjukkan persentase yang tinggi berkisar antara 87-98%. berdasarkan pewarnaan CBB G-250 dan TBG. Persentase keutuhan akrosom tersebut mengindikasikan bahwa tidak terdapat kerusakan spermatozoa yang dapat menurunkan kemampuan fertilisasinya. Menurut Hernandez et al. (2012) spermatozoa kehilangan kemampuan fertilisasi apabila diperoleh kerusakan akrosom melebihi 50%. Kerusakan akrosom spermatozoa tersebut berkaitan dengan fungsi membran sebagai pelindung akrosom spermatozoa. Kolesterol merupakan salah satu komponen penyusun membran spermatozoa dan juga berfungsi memberikan sifat fluidity pada membran sehingga tidak mudah rusak. Kandungan kolesterol tinggi pada membran akan membuat membran semakin bersifat lentur sebaliknya semakin rendah kandungan kolesterol pada membran akan menyebabkan spermatozoa semakin mudah mengalami kerusakan.
14
menambahkan reaksi akrosom merupakan proses pelepasan enzim penetrasi yang memungkinkan spermatozoa dapat menembus zona pelusida dan membuahi oosit. Namun, apabila reaksi akrosom terjadi sebelum spermatozoa mencapai bertemu dengan oosit, spermatozoa akan kehilangan kemampuan untuk fertilisasi.
Pewarnaan akrosom spermatozoa menggunakan Coomassie Brilliant Blue G-250 (CBB GG-250) dan Trypan Blue- Giemsa (TBG)
Akrosom memegang peranan penting dalam proses fertilisasi. Inisiasi ikatan spermatozoa dengan zona pelusida akan memicu terjadinya reaksi akrosom dan menyebabkan pelepasan serta aktivasi dari enzim akrosom, sehingga spermatozoa mampu melakukan penetrasi zona pelusida (Miranda et al. 2009).
Gambar 2 Hasil pewarnaan akrosom menggunakan pewarna CBB G250 (A) dan
pewarna TBG (B): (a) Tudung Akrosom Utuh (TAU), (b) akrosom yang tidak utuh.
Gambaran status akrosom spermatozoa pada gambar A menggunakan pewarnaan CBB G250: (a) spermatozoa dengan TAU akan berwarna biru gelap (b) yang memiliki akrosom tidak utuh akan terlihat pudar/tidak terwarnai, sedangkan gambar B menggunakan pewarnaan TBG: (a) spermatozoa dengan TAU menyerap warna ungu (b) spermatozoa yang memiliki akrosom tidak utuh akan bewarna lavender pucat/pudar. Untuk memastikan akrosom yang rusak ditandai dengan bagian kepala yang tidak beraturan. Hasil pewarnaan spermatozoa menggunakan TBG menunjukkan pewarna giemsa memiliki kemampuan berikatan dengan protein pada membran terutama pada OAM spermatozoa dan giemsa memiliki berat molekul kecil dan fusi melewati membran (Chowdhury et al. 2014). Keutuhan akrosom dianalisis berdasarkan hasil pewarnaan spermatozoa ditandai dengan tingkat penyerapan warna. Sampel semen beku menggunakan pengencer skim kuning telur, sehingga hasil pewarnaan yang diperoleh kurang baik. Pewarnaan TBG diketahui kurang efisien digunakan dalam evaluasi semen beku. Hal ini disebabkan komponen pengencer yang ikut terwarnai yang menyebabkan hasil pewarnaan lebih sulit untuk dianalisis, dan pewarnaan TBG membutuhkan waktu cukup lama untuk dapat dianalis dibandingkan dengan pewarnaan CBB G250 (Kovacs dan Foote 1992).
15 spermatozoa terwarnai dan dapat dibedakan. Dengan demikian apabila bagian dari akrosom spermatozoa mengalami kerusakan atau tidak utuh sel spermatozoa tidak mampu dalam menyerap warna dengan baik dan hasil pewarnaan akan terlihat pudar. Ketidakberaturan di bagian kepala juga dapat dijadikan salah satu indikasi membran plasma telah mengalami kerusakan serta berpotensi terhadap kerusakan akrosom.
5.
SIMPULAN
Bangsa sapi tidak berpengaruh terhadap kualitas semen post-thawed
spermatozoa yang berasal dari BIB berbeda. Perwarnaan CBB G250 untuk evaluasi status akrosom lebih efisien dibandingkan dengan TBG.
DAFTAR PUSTAKA
Allen CA, Green DP. 1997. The mammalian acrosome reaction: gateway to sperm fusion with the oocyte?. Bioassay. 19: 241-247.
Ana M, Salicioni, Mark D, Platt, Eva V, Wertheimer, Enid A, Alicia A, Julian S, Pablo E, Visconti. 2007. Signalling pathways involved in sperm capacitation. Spermatology. 65: 245-259.
Argaman NA, Mahgrefthe K, Zeron Y, Roth Z. 2013. Variation in lipid profiles within semen compartments the bovine model of aging. Theriogenology. 80:712-721.
Bedford JM. 1998. Mammalian fertilization misread? sperm penetration of the eutherian zona pellucida is unlikely to be a lytic event. Bio of Reprod. 59: 1275-1287.
Bolwell GP, Callow JA, Evans. 1980. Preliminary characterization of putative gamete receptors from eggs and sperm. J Cell. 43: 209-224.
Bookbinder LH, Cheng A, Bleil JD. 1995. Tissue and species-specific expression of sp56 mouse sperm fertilization protein. Science. 25: 86-89.
Breitbart H. 2002. Intracelullar calcium regulation in sperm capacitation and acrosomal reaction. Mol and Cell Endo 187: 139-144.
Breitbart, H. 2003. Signaling pathways in sperm capacitation and acrosome reaction. Cell Mol Biol. 49 (3): 321-327.
Cardullo RA, Florman HM. 1993. Strategies and methods for evaluating the acrosome reaction. Methods Enzymol. 225: 136-153.
Celeghini ECC, Nascimento J, Raphael CF, Andrade AFC, Arruda RP. 2010. Simultaneous assessment of plasmatic, acrosomal, and mitochondrial membranes in ram sperm by fluorescent probes. Arq Bras Med Vet Zootec. 3(62): 536-543.
16
parameters of male fertility in bovines. Explor Anim Med Res. 4: 101-107.
Connell MO, Clure MN, Lewis SEM. 2002. The effect of cryopreservation on sperm morphology motility and mitochondrial function. Hum Reprod.
17(3): 704-709.
Cross NL, Hanks SE. 1991. Effects of cryopreservation on human sperm acrosomes. Hum Reprod. 6 (12): 79-83.
De Lamirande E, Leclerc P, Gagnon C. 1997. Capacitation as a regulatory event that primes spermatozoa for the acrosome reaction and fertilization. Mol Hum Reprod. 3(3): 175-194.
De Oliveira VP, Marques MG, Simoes R, Assumpcao MEOD and Visintin JA. 2011. Influence of caffeine and chondroitin sulfate on swine sperm capacitation and in vitro embrio production. Acta Sci Vet. 39 (2): 960. Didion BA, Dorbinski JR, Giles JR, Graves CN. 1989. Staining procedure to
detect viability and the true acrossome reaction in sperm of various species.
Gamete Res. 22: 51-57.
Eddy EM. 1994. The Spermatozoon. In Knobil E, Neill JD (eds): “The Physiology of Reproduction.” New York: Raven Press Ltd. pp β9-77.
Esteves SC, Sharma RK, Thomas AJ, Agarwal A. 1998. Effect of in vitro incubation on spontaneous acrosome reaction in fresh and cryopreserved human spermatozoa. Int J Fertil Womens Med. 43(2): 35- 42.
Fannessia LD, Karja NWK, Adnyane IKM, Setiadi MA. 2015. Pelacakan kerusakan akrosom domba spermatozoa selama proses pembekuan dengan teknik histokimia lektin. J Vet. 16(4): 560-568.
Flesch FM, Colenbrander B, Van Golde LMG, Gadella BM. 2000. Capacitation induced molecular alterations in the plasma membrane of boar sperm in relation to zona pellucida affinity. Boar Semen Preserv. 4: 21-31.
Gadella BM, Miller NGA, Colenbrander B, Van Golde LMG, Harrison RAP. 1999. Flow cytometric detection of transbilayer movement of fluorescent phospholipid analogues across the boar sperm plasma membrane: elimination of labeling artifacts. Mol Reprod and Dev. 53:108-125.
Gazali M, Tambing SN. 2002. Kriopreservasi sel spermatozoa. Hayati. 9 (1):27- 32.
Graham JK, Foote RH. 1987. Effect of several lipids, fatty acyl chain length, and degree of unsaturation on the motility of bull sperm after cold shock and
Hernandez PJE, Fernandez RF, Rodriguez SJL, Soto MYG, Verona JEH, Garcia RAD. 2012. Post-thaw acrosomal viability and reaction in sperm obtained from equine epididymis tail. Rev Salud Anim. 34 (2): 84-88.
Hess R, Franca LR. 2005. History of the sertoli cell discovery. In: Griswold M, Skinner M, Ed. Sertoli cell biology. New York: Academic Press.
17 Kovacs A, Foote RH. 1992. Viability and acrosome staining of bull, boar and
rabbit spermatozoa. Biotech Histochem. 67(3): 120-124.
Kulaksiz R, Cebi C, Akcay E, Daskin A. 2010. The protective effect of egg yolk from different avian species during the cryopreservation of Karayaka ram semen. Small RuminRes. 88: 12-15.
Larson JL, Miller DJ. 1999. Simple histochemical stain for acrosomes on sperm from several species. Mol Reprod and Develop. 52: 445-449.
Medeiros CMO, Forell F, Oliveria ATD, Rodrigues JL. 2002. Current status of sperm cryopreservation: why isn‟t it better?. Theriogenology. 57: 327-344.
Miranda PV, Allaire A, Sosnik J, Visconti PE. 2009. Localization of low-density detergent-resistant membrane proteins in intact and acrosome-reacted mousesperm. Biol Reprod. 80: 897-904.
Moore AI, Squires EL, Graham JK. 2005. Adding cholesterol to the stallion sperm plasma membrane improve cryosurvival. Cryobiology. 51: 241-249.
Neild DN, Gadella BM, Aguero A, Stout TAE, Colenbrander B. 2005. Capacitation, acrosome function and chromatin structure in stallion sperm.
Anim Reprod Sci. 89: 47–56.
Nollan JP, Magargee SF, Posner RG, Hammerstedt RH. 1995. Flow cytometric analysis of transmembrane phospholipid movement in bull sperm.
Biochemistry. 28(34): 15-39.
Ozkavukcu S, Erdemli E, Isik A, Oztuna D, Karahuseyinoglu S. 2008. Effects of cryopreservation on sperm parameters and ultrastructural morphology of human spermatozoa. J Assist Reprod Genet. 25: 403-411.
Schroter S, Derr P, Conradt HS, Nimtz M, Hale G, Kirchhoff C. 1999. Male-specific modification of human CD52. Bio Chem J. 42(274): 29862-29873. Serafini R, Longobardi V, Spadetta M, Neri D, Ariota B, Gasparrini B, Di Palo R.
2013. Trypan Blue/Giemsa staining to assess sperm membrane integrity in salernitano stallions and its relationship to pregnancy rates. Reprod in Dom Anim. 49(1): 41-7.
Silva PFN, Gadella BM. 2006. Detection of damage in mammalian sperm cells.
Theriogenology. 65: 958-978.
Sukmawati E, Arifiantini RI, Purwantara B. 2015. Daya tahan spermatozoa terhadap proses pembekuan pada berbagai jenis sapi pejantan unggul. JITV.
19(3): 168-175.
Supriatna I, Pasaribu FH. 1992. In vitro fertilizaton. Transfer Embrio dan
Pembekuan Embrio. Bogor. PAU IPB.
Tartaglione CM, Ritta MN. 2004. Prognostic value of spermatological parameters as predictors of in vitro fertility of frozen-thawed bull semen.
Theriogenology. 62: 1245-1252.
Toshimori K. 1998. Maturation of mammalian spermatozoa: modifications of the acrosome and plasma membrane leading to fertilization. Cell Tissue Res.
293: 177-187.
Tulsiani DRP, Komiya Y, Araki. 1997. Mammalian fertilization: a carbohydrate mediated event. Biol Reprod. 57: 487-494.
18
cholesterol release signals an increase in protein tyrosine phosphorylation during mouse sperm capacitation. Dev Biol. 214: 429-443.
Ward MA, Kaneko T, Kusakabe H, Biggers JD, Whittingham DG, Yanagimachi R. 2003. Long-Term Preservation of Mouse Spermatozoa after Freeze-Drying and Freezing Without Cryoprotection. Bio of Reprod 69: 2100-2108. Wassarman PM, Jovine L, Litscher ES. 2004. Egg-sperm interactions at
fertilization in mammals. Eur J Obstet Gynecol ReprodBiol. 115(1): 57–60. Watson PF. 1995. Recent developments and concepts in the cryopreservation of spermatozoa and the assessment of their post-thawing function. Reprod. Fertil Dev. 7: 871-891.
Watson PF. 2000. The causes of reduced fertility with cryopreserved semen. Anim Reprod Sci. 60: 481-492.
Wattimena J. 2006. Pengaruh waktu inkubasi terhadap pola kapasitasi dan reaksi akrosom spermatozoa domba in vitro. JITV. 11(4): 295-301.
Yamagata K, Murayama K, Kohno N, Kashiwabara S. 1998. Amino benzamidine-sensitive acrosomal protease(s) other than acrosin serve the sperm penetration of the egg zona pellucida in mouse. Zygote. 4(6): 311-319. Yanagimachi R. 1995. Mammalian Fertilization. In: Knobile E, Neill JD (eds)
19
20
Lampiran 1 Medium TALP 50 mL untuk menilai akrosom spermatozoa
Bahan Jumlah
NaCl KCl NaHCO3
NaH2PO42H2O MgCl26H2O HEPES
sodium pyruvate natrium lactate
0.32725 g 0.01 g 0.105 g 0.0031 g
21
RIWAYAT HIDUP
Penulis lahir pada tanggal 01 Juli 1991 di Kenagarian Sirukam Kab. Solok, Sumatera Barat. Penulis merupakan anak kedua dari empat bersaudara dari pasangan Bapak Darussalam dan Ibu Rafitni. Pendidikan sarjana ditempuh di Program Studi Ilmu Peternakan, Fakultas Peternakan Universitas Andalas, lulus pada tahun 2014. Berkesempatan untuk melanjutkan Magister Program Studi Biologi Reproduksi Pascasarjana IPB diperoleh pada tahun 2014. Karya ilmiah yang berjudul “Status Akrosom dan Kualitas Post-Thawed Spermatozoa beberapa Rumpun Sapi dari Dua Balai Inseminasi Buatan” telah diajukan pada Jurnal Acta Veterinaria Indonesia, Fakultas Kedokteran Hewan Institut Pertanian Bogor. Karya ilmiah tersebut merupakan bagian dari program S-2 penulis.