PEROLEHAN KEMBALI KITOSAN TERKOMPLEKS BESI ( II )
MENGGUNAKAN PENGKELAT SITRAT DAN OKSALAT
TESIS
Oleh
PANTAS SILABAN
117006026/KIM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PEROLEHAN KEMBALI KITOSAN TERKOMPLEKS BESI ( II )
MENGGUNAKAN PENGKELAT SITRAT DAN OKSALAT
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh gelar Magister Sains dalam Program Studi Ilmu Kimia pada Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Sumatera Utara
Oleh
PANTAS SILABAN
117006026/KIM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUANALAM
UNIVERSITAS SUMATERA UTARA
Judul Tesis : PEROLEHAN KEMBALI KITOSAN TERKOMPLEKS BESI ( II ) MENGGUNAKAN PENGKELAT SITRAT DAN OKSALAT
Nama Mahasiswa : PANTAS SILABAN Nomor Pokok : 117006026
Program Studi : Magister Ilmu Kimia
Menyetujui, Komisi Pembimbing
Dr. Tini Sembiring. MS. Dr. Nimpan Bangun. MSc.
Ketua Anggota
Ketua Program Studi, Dekan,
Prof. Basuki Wirjosentono, MS, Ph.D Dr. Sutarman, MSc.
Telah diuji pada
Tanggal : 04 Juli 2013
PANITIA PENGUJI TESIS
KETUA : Dr. Tini Sembiring, MS
Anggota : 1. Dr. Nimpan Bangun, MSc
2. Prof. Basuki Wirjosentono, MS, Ph.D
3. Prof. Dr. Zul Alfian, MSc
4. Prof.Dr. Harry Agusna, MSc, M.Phil
PERNYATAAN ORISINALITAS
PEROLEHAN KEMBALI KITOSAN TERKOMPLEKS BESI (II)
MENGGUNAKAN PENGKELAT SITRAT DAN OKSALAT
TESIS
Dengan ini saya menyatakan bahwa saya mengakui semua karya tesis ini adalah hasil kerja saya sendiri kecuali kutipan dan ringkasan yang tiap satuannya telah dijelaskan sumbernya dengan benar.
Medan, Juni 2013
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH
UNTUK KEPENTINGAN AKADEMIS
Sebagai Sivitas Akademika Universitas Sumatera Utara, saya yang bertanda tangan di bawah ini:
Nama : Pantas Silaban
Nomor Pokok : 117006026
Program Studi : Magister Ilmu Kimia Jenis Karya Ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Eksklusif (Non-Exclusif Royalty Free Right) atas Tesis saya yang berjudul:
PEROLEHAN KEMBALI KITOSAN TERKOMPLEKS BESI (II)
MENGGUNAKAN PENGKELAT SITRAT DAN OKSALAT
beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Non-Eksklusif ini, Universitas Sumatera Utara berhak menyimpan, mengalih media, memformat, mengelola dalam bentuk data-base, merawat dan mempublikasikan Tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan sebagai pemegang dan atau sebagai pemilik hak cipta.
Demikian pernyataan ini dibuat dengan sebenarnya.
Medan, Juli 2013
RIWAYAT HIDUP
DATA PRIBADI
Nama : Drs.Pantas Silaban
Tempat/Tanggal Lahir : Siborong-borong, 01 Oktober 1966
Alamat : Jalan Bunga Rampai -1 No.6. Simalingkar-B Medan.
Telepon/HP : 081361396724
Instansi Tempat Bekerja : SMA Methodist-1 Medan
Alamat Sekolah : Jalan Hang Tuah No.4 Medan.
Telepon : 061-4152542
DATA PENDIDIKAN
SD : SD Negeri Onanganjang Taput : Tamat : 1979
SMP : SMP Negeri Onanganjang Taput : Tamat : 1982
SMA : SMA Negeri 5 Medan : Tamat : 1985
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa,karena
dengan kasih dan karunia yang diberikanNya kepada penulis,sehingga penulis dapat
menyelesaikan penulisan tesis ini dengan judul ”
PEROLEHAN KEMBALI
KITOSAN
TERKOMPLEKS
BESI
(II)
MENGGUNAKAN
PENGKELAT SITRAT DAN OKSALAT “
Tesis ini merupakan tugas akhir penulis pada Sekolah Pascasarjana Universitas Sumatera Utara.Penulis mengucapkan terimakasih yang sebesar-besarnya kepada Pemerintah
Republik Indonesia c.q. Pemerintah Provinsi Sumatera Utara yang telah memberikan
bantuan dana sehingga penulis dapat melaksanakan Program Magister Sains pada
Program Studi Magister Ilmu Kimia Program Pascasarjana FMIPA Universitas
Sumatera Utara.
Dengan selesainya ini perkenangkanlah penulis mengucapkan terimakasih yang
sebesar-besarnya kepada:
Rektor Universitas Sumatera Utara, bapak Prof. Dr. dr. Syahrial Pasaribu
DTM&H, M.Sc(CTM)SPA(K) atas kesempatan dan fasilitas yang diberikan kepada
penulis untuk mengikuti dan menyelesaikan pendidikan Program Master Sains.
Dekan Fakultas MIPA Universitas Sumatera Utara, Bapak Dr. Sutarman, M.Sc
atas kesempatan menjadi mahasiswa Program Magister Sains pada Program
Pascasarjana FMIPA Universitas Sumatera Utara.
Ketua Program Studi Magister Ilmu Kimia Bapak Prof. Basuki Wirjosentono.
MS. PhD dan sekretaris Program Studi Magister Ilmu Kimia, Bapak Dr. Hamonangan
Nainggolan, M.Sc. Beserta seluruh Staf Pengajar pada Program Studi Magister Kimia
Sekolah Pascasarjana Universitas Sumatera Utara.
Terimakasih yang tak terhingga dan penghargaan yang setinggi-tingginya,
penulis ucapkan kepada Ibu Dr. Tini Sembiring, MS selaku Ketua Komisi
Pembimbing yang sangat banyak membantu dan mengarahkan penulis dalam
menyelesaikan tesis ini.
Rekan-rekan guru yang telah banyak membantu dan memberikan sumbangan pikiran
selama penulis mengikuti pendidikan. Rekan-rekan mahasiswa Sekolah Pascasarjana
Universitas Sumatera Utara khususnya Program Studi Magister Ilmu Kimia angkatan
2011 yang senantiasa memberikan motivasi kepada penulis.
Kepada orangtua saya Bapak Bungaran Silaban (Alm) sewaktu hidupnya
mendoakan penulis dan Ibu tercinta Dorkas Sihombing yang setiap saat mendoakan
penulis Selama dalam pendidikan dan penyesaikan tesis ini. Secara khusus penulis
mengucapkan terimakasih dan sayang yang mendalam buat istri tercinta Simto
Simamora SPd yang senantiasa memberikan dorongan dengan penuh kesabaran,
pengertian dan mendoakan keberhasilan penulis dalam menyelesaikan studi ini.
Terlebih lagi terimaksih dan sayang yang teramat dalam kepada anak-anakku terkasih
Dodi Silaban, Bangun Ferdinand Silaban, Stella Tri ananda Silaban, Betsaida Silaban
dan Karyn Silaban.
Akhir kata penulis berharap semoga tesis ini bermanfaat bagi semua pihak dan
penulis menyadari masih banyak kekurangan dan kesalahan dalam tugas akhir ini.
Kritik dan saran yang sifatnya membangun, penulis harapkan untuk perbaikan
selanjutnya.
PEROLEHAN KEMBALI KITOSAN TERKOMPLEKS BESI ( II )
MENGGUNAKAN PENGKELAT SITRAT DAN OKSALAT
ABSTRAK
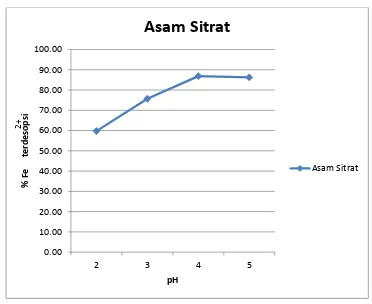
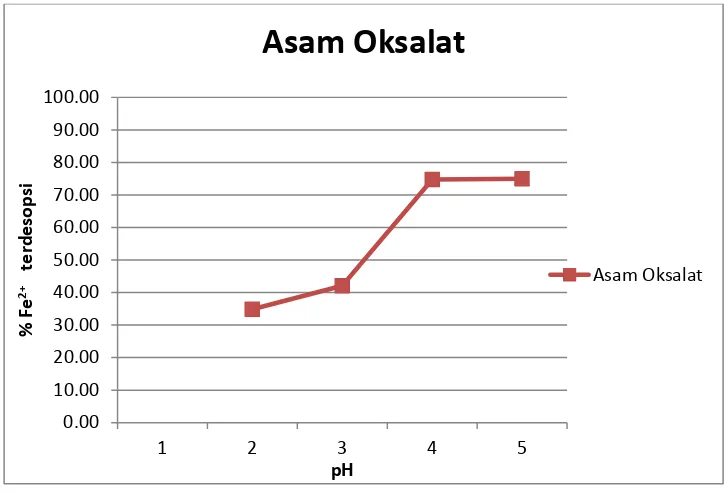
Telah dilakukan penelitian tentang penggunaan kitosan sebagai penyerap pada larutan standar besi (II) 1000 ppm. Proses adsorpsi kitosan adalah berdasarkan pada pengikatan ion logam melalui biopolymer dalam berbagai gugus fungsional seperti gugus amino dan hidroksi dalam kitosan. Hasil penyerapan kitosan dianalisis menggunakan Spektrofotometer Serapan Atom (SSA). Selanjutnya dilakukan proses desorpsi dengan menggunakan asam sitrat dan asam oksalat sebagai pengkelat. Ternyata ion Fe2+ yang teradsorpsi oleh kitosan dapat didesorpsi oleh asam sitrat dan asam oksalat masing-masing variasi pH = 2, 3, 4, dan 5 dengan waktu kontak 60 menit. Dari hasil analisa dengan alat Spektrometer Serapan Atom, pada pH = 5 asam sitrat dapat melepaskan ion Fe2+ = 89,21 %. Sedangkan asam oksalat hanya dapat melepaskan ion Fe2+ = 75,00 %.
Dalam penelitian ini asam sitrat lebih baik melepaskan ion Fe2+ daripada asam oksalat.
RECOVERY COMPLEXES CHITOSAN OF FERUM (II)
USING CHELATING CITRIC AND OXALIC
ABSTRACT
The research on the use of chitosan as an absorbent in the standard solution of iron (II) 1000 ppm. Has been done chitosan adsorption process is based on the binding of metal ions through the trending biopolymer functional groups such as amino and hydroxyl groups in chitosan. Chitosan absorption results were analyzed by using Atomic absorption spectrophotometer (AAS). Desorption process is then performed by using citric acid and oxalic acid as the chelating agent. It turns out that the adsorbed Fe2+ ions by chitosan can be desorpted by citric acid and oxalic acid respectively – each variation of pH = 2, 3, 4,and 5 with a contact time of 60 minutes. Throungh the analysis with atomic absorption spectrophotometer, the pH = 5 citric acid can release Fe2+ ions = 89,21 %. Meanwhile, oxalic acid can only release the ions Fe2+ = 75,00 %.
In this research, citric acid is better to realese of ions Fe2+ than oxalic acid.
DAFTAR ISI
2.3.2.Sifat dan kegunaan Kitosan 11
2.3.3.Sumber-sumber Kitosan 11
2.3.5. Interaksi kitosan dengan ion logam 13
2.4. Pengkelatan 14
2.5.Asam sitrat 16
2.5.1.Sifat Fisika dan Kimia 18
2.5.2.Sejarah 18
2.5.3.Pembuatan 18
2.5.4.Kegunaan 19
2.5.5.Keamanan 20
2.6.Asam Oksalat dan sifat-sifatnya 21
2.6.1. Pengaruh asam oksalat terhadap tubuh manusia 22
2.7.Adsorpsi 23
2.7.1.Pengertian Adsorbsi 23
2.7.2.Faktor- factor yang mempengaruhi adsorpsi 24
2.7.3.Menentukan konsentrasi logam yang terserap 25
2.7.4.Menentukan Persen regenerasi Kitosan 25
2.7.5.Tipe Sistem Adsorbsi 25
2.8.Adsorben 25
2.9.Desorpsi 27
2.10.Methode Dekstruksi 28
2.11.Prinsip Dasar Analisa Spektrometri Serapan Atom (SSA) 29
2.11.1.Sumber Radiasi 30
2.11.2.Nyala 30
2.11.3.Sistem Pembakar-Pengabut (nebulizer) 30
2.11.4.Monokromotor 31
2.11.5.Detektor 31
2.11.6.Read Out 31
2.11.7.Cara Kerja SSA 31
3.1.Alat dan Bahan 33
3.1.1.Alat-alat yang digunakan 33
3.1.2.Bahan yang digunakan 33
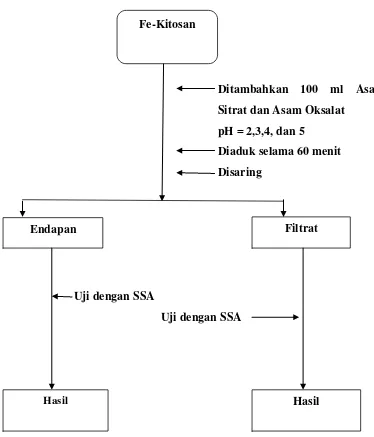
3.2.Prosedur penelitian 34
3.2.1.Pembuatan Larutan HCl 8 M 34
3.2.2.Pembuatan Larutan baku logam Besi (Fe) 1000 mg/L 34
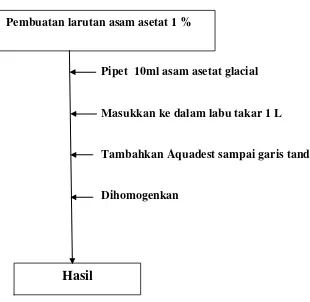
3.2.3.Pembuatan Larutan Asetat 1 % 34
3.2.4.Pembuatan Asam sitrat pH = 2 34
3.2.5.Pembuatan Asam sitrat pH = 3 35
3.2.6.Pembuatan Asam Sitrat pH = 4 35
3.2.7.Pembuatan Asam Sitrat pH = 5 35
3.2.8.Pembuatan Asam Oksalat pH = 2 35
3.3.9.Pembuatan Asam Oksalat pH =3, 4, 5 36
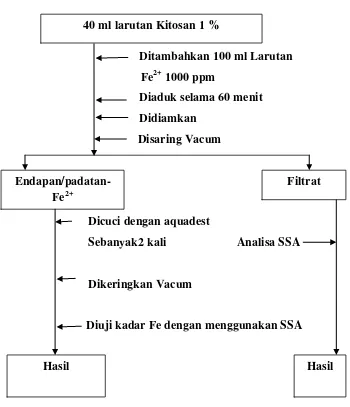
3.3.11.Penggunaan Kitosan untuk menyerap Logam Besi (Fe) 36
3.3.12.Uji Desorpsi Fe2+ dengan Asam Sitrat dan Oksalat 36
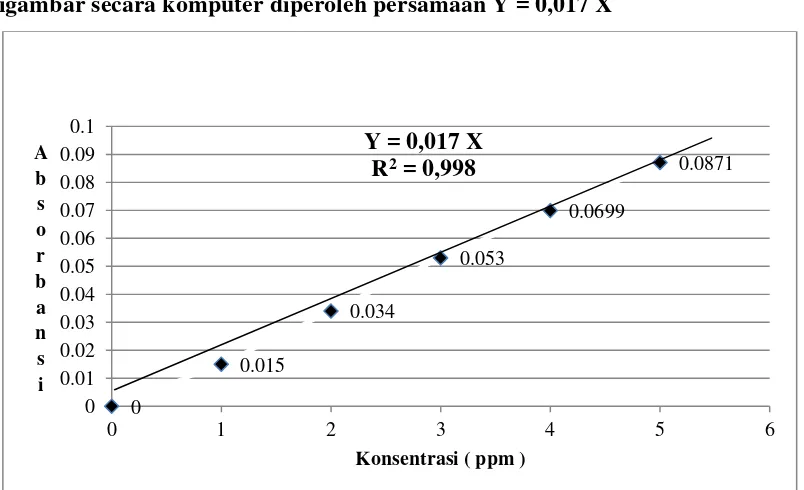
3.2.13.Prosedur Kerja dan Pembuatan Kurva Kalibrasi (SNI 01-4866-1998) 37
3.3.Bangan Penelitian 33
BAB 4 HASIL DAN PEMBAHAN 41
4.1. Hasil Penelitian dan Pengolahan Data 41
4.1.1.Data hasil pengukuran Kadar logam besi 41
4.1.2. Adsorpsi Fe2+ pada kitosan 42
4.1.3.Proses desorpsi Fe2+ dari kitosan besi 43
BAB 5 KESIMPULAN DAN SARAN 48
5.1.Kesimpulan 48
5.2.Saran 48
LAMPIRAN 52
DAFTAR TABEL
Tabel Judul Halaman
2.1. Karakteristik kitosan dengan beberapa parameter yang penting 10
2.2. Bentuk, sifat dan kegunaan Kitosan 12
4.1. Data hasil pengukuran absorbansi larutan standar Fe 41
4.2. Data desorpsi dengan menggunakan asam sitrat sebagai pengkelat 43
DAFTAR GAMBAR
Gambar Judul Halaman
2.1. Gambar Struktur kitin 9
2.2. Gambar Struktur Kitosan 9
2.3. Gambar mekanisme pengikatan logam besi oleh kitosan 13
2.4. Gambar mekanisme pengikatan logam Fe2+ oleh asam sitrat 15
2.5. Gambar mekanisme pengikatan logam Fe2+ oleh asam oksalat 15
2.6. Gambar skematis SSA 29
3.1 Gambar pembuatan asam asetat 1% 37
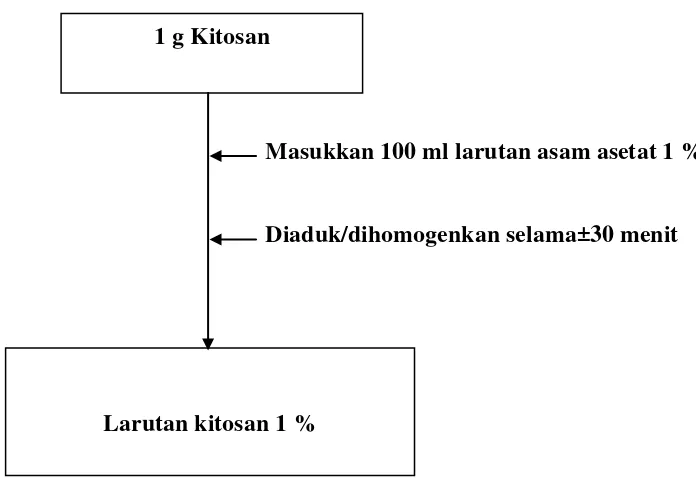
3.2. Gambar pembuatan larutan Kitosan pengkelat Fe2+ 38
3.3. Gambar Adsorpsi Fe2+ dengan larutan kitosan 39
PEROLEHAN KEMBALI KITOSAN TERKOMPLEKS BESI ( II )
MENGGUNAKAN PENGKELAT SITRAT DAN OKSALAT
ABSTRAK
Telah dilakukan penelitian tentang penggunaan kitosan sebagai penyerap pada larutan standar besi (II) 1000 ppm. Proses adsorpsi kitosan adalah berdasarkan pada pengikatan ion logam melalui biopolymer dalam berbagai gugus fungsional seperti gugus amino dan hidroksi dalam kitosan. Hasil penyerapan kitosan dianalisis menggunakan Spektrofotometer Serapan Atom (SSA). Selanjutnya dilakukan proses desorpsi dengan menggunakan asam sitrat dan asam oksalat sebagai pengkelat. Ternyata ion Fe2+ yang teradsorpsi oleh kitosan dapat didesorpsi oleh asam sitrat dan asam oksalat masing-masing variasi pH = 2, 3, 4, dan 5 dengan waktu kontak 60 menit. Dari hasil analisa dengan alat Spektrometer Serapan Atom, pada pH = 5 asam sitrat dapat melepaskan ion Fe2+ = 89,21 %. Sedangkan asam oksalat hanya dapat melepaskan ion Fe2+ = 75,00 %.
Dalam penelitian ini asam sitrat lebih baik melepaskan ion Fe2+ daripada asam oksalat.
RECOVERY COMPLEXES CHITOSAN OF FERUM (II)
USING CHELATING CITRIC AND OXALIC
ABSTRACT
The research on the use of chitosan as an absorbent in the standard solution of iron (II) 1000 ppm. Has been done chitosan adsorption process is based on the binding of metal ions through the trending biopolymer functional groups such as amino and hydroxyl groups in chitosan. Chitosan absorption results were analyzed by using Atomic absorption spectrophotometer (AAS). Desorption process is then performed by using citric acid and oxalic acid as the chelating agent. It turns out that the adsorbed Fe2+ ions by chitosan can be desorpted by citric acid and oxalic acid respectively – each variation of pH = 2, 3, 4,and 5 with a contact time of 60 minutes. Throungh the analysis with atomic absorption spectrophotometer, the pH = 5 citric acid can release Fe2+ ions = 89,21 %. Meanwhile, oxalic acid can only release the ions Fe2+ = 75,00 %.
In this research, citric acid is better to realese of ions Fe2+ than oxalic acid.
BAB 1
PENDAHULUAN
1.1.Latar Balakang
Senyawa koordinasi merupakan senyawa yang tersusun atas atom pusat danligan
(sejumlah anion atau molekul netral yang mengelilingi atom atau kelompok atom pusat
tersebut) dimana keduanya diikat dengan ikatan koordinasi. Pembentukan senyawa
koordinasi dapat terjadi pada atom pusat umumnya dari logam transisi dengan
ligan-ligan anion maupun molekul netral.Ditinjau dari konsep asam-basa Lewis, atom pusat
dalam senyawa koordinasi berperan sebagai asam Lewis (akseptor penerima pasangan
elektron), sedangkan ligan sebagai basa Lewis (donor pasangan electron). (Nuryono,
2003).
Ion cadmium dapat diikat dalam jumlah yang besar (2-1700 ppm) menggunakan
kitosan , juga ion merkuri dan ion nikel. Untuk menghemat biaya kitosan, maka
kitosan yang telah dipakai perlu didaur ulang, dengan proses desorpsi untuk
melepaskan ion logam dari kitosan.
Muzarelitt 1974 melaporkan merkuri dari kitosan dengan memberikan larutan 10
mM KI, sementara Randall 1979 telah meregenerasi kitosan menggunakan larutan 0,2
N NH4Cl. Pemakaian bahan untuk desorpsi ini menunjukkan adanya pengaruh pH
larutan pengadsorpsi ( Jha, 1988 ).
Perlakuan proses desorpsi ion Cd dalam bebagai pH lebih lanjut (Tzu and Yu,
2012 ) telah dipelajari.
Dalam penelitian ini telah dipelajari penggunaan asam pengkelat seperti asam sitrat
dan asam oksalat yang dapat memberikan proton dan juga membentuk suatu komplek
antara logam Fe dengan ion pengkelat tersebut.
Kitosan adalah suatu polimer alam yang mengandung gugus NH2 sehingga dapat
membentuk senyawa koordinasi dengan ion logam transisi.
Kitosan dihasilkan oleh deasetilasi molekul basa N (nitrogen) parsial pada kitin, yang
secara komersil diekstrak dari kulit udang dan kerang. Deasetilasi tersebut berlangsung
secara enzimatis dibantu oleh kitin deasetilase.
Polimer kitosan dapat terbentuk dari berbagai tingkat deasetilasi. Kitosan secara alami
ditemukan paada dinding sel fungi kelas Zygomycetes dan pada kutikula serangga.Informasi mengenai peran biologis kitosan didapat dari penelitian
menggunakan model khamir Saccharomyces cerevisiae.
Kitosan diproduksi secara komersil dalam skala besar di berbagai belahan dunia,
termasuk Jepang, Amerika Utara, Polandia, Italia, Rusia, Norwegia, dan India.
Banyaknya permintaan akan kitosan dipicu fakta akan keunikan karakteristik
biologisnya seperti biodegradabilitas, biokompabilitas, dan tidak beracun, sehingga
memungkinkan aplikasi di berbagai bidang.Meskipun sangat berlimpah di alam,
namun pemanfaatan kitosan baru berkembang pada dua dekade terakhir. Kini kitosan
banyak digunakan di bidang pangan, farmasi, medis, tekstil, pertanian, dan industri
lain misalnya purifikasi limbah. Beberapa tahun terakhir, kitosan menarik banyak
perhatian karena menunjukkan aktivitas anti mikrobial terhadap fungi, bakteri, dan
virus. Aplikasi komersil dari aktivitas komersil kitosan antara lain penggunaan sebagai
pengawet makanan, obat anti infeksi, dan tekstil bebas mikroba.
Selain bahan pengawet, kitosan telah berperan sebagai pengikat logam berat
seperti Pb,Cd,Hg,Cu,Zn telah dilaporkan oleh beberapa peneliti seperti (Hutahaean,
2001), maka kaitan ini akan dipelajari bagaimana pengaruh Kitosan terhadap
absorbansi dari Fe.
Kitosan adalah poli (2-amino-2-deoksi-β-(1,4)-D-glukopiranosa) dengan rumus molekul (C6H11NO4)n.
Kitosan dapat terlarut dalam beberapa organik,HCl encer,HNO3 encer,H3PO4
encer,dan CH3COOH encer,tetapi tidak larut dalam basa kuat dan asam kuat pekat.
Dalam kondisi asam berair,gugus amino(-NH2) kitosan akan menangkap H+ dari
inilah yang menyebabkan kitosan bertindak sebagai garam,sehingga dapat larut dalam
air,analog dengan pelarutan garam dapur dalam air.
Pasangan elektron pada gugus –OH dan –NH2 akan berperan sebagai ligan
(basa lewis,donor pasangan electron) yang dapat berinteraksi dengan zat warna
kationik atau kation logam melalui mekanisme pembentukan ikatan kovalen
koordinasi (kompleks).
Jumlah gugus –NH2 kitosan lebih banyak dibandingkan dengan kitin,kemampuan
adsorpsi kitosan lebih tinggi dari pada kitin terhadap logam besi (Fe).
Dalam hal diatas, penulis tertarik meneliti larutan yang mengandung logam
besi dapat diadsorpsi oleh kitosan dan kemudian didesorpsi oleh pengkelat asam sitrat
juga asam oksalat.Akan tetapi masih sedikit dilaporkan bagaimana logam mengalami
desorpsi daripada kitosan. Telah dilaporkan bahwa cadmium yang teradsorpsi pada
kitosan dapat terdesorpsi dengan adanya ion H+ dalam konsentrasi tertentu (Tzu dan
Yu, 2012 ).
Seperti penelitian desorpsi ion Cd dari kitosan maka akan dipelajari bagaimana
ion besi terikat pada kitosan dilepaskan ( terdesorpsi) menggunakan asam sitrat dan
asam oksalat sebagai sumber ion H+.
1.2.Permasalahan
Dalam penelitian ini akan dicoba memperoleh kembali kitosan yang sudah dipakai
untuk mengabsorpsi besi ( II ) dengan menggunakan asam sitrat dan asam oksalat
sebagai pengkelat.
1. Apakah kitosan terkompleks besi dapat diperoleh kembali dengan
menggunakan asam sitrat dan asam oksalat.
2. Bagaimana pelepasan kembali kitosan dari kitosan terkompleks besi ( II )
dengan menggunakan asam sitrat dan asam oksalat.
1.3.Pembatasan Masalah
Dalam penelitian ini masalah dibatasi dengan
2. Eksperimen terhadap kadar ion besi(Fe2+) pada larutan sediaan dengan
menggunakan kitosan
1.4.Tujuan Penelitian
Untuk mendapatkan kembali kitosan dari kitosan besi ( II ) terkompleks sehingga
dapat digunakan kembali.
1.5. Manfaat Penelitian
Dengan tujuan tersebut diatas penelitian ini bermanfaat :
1. Bahan informasi penggunaan kitosan sebagai absorben besi ( II ) dan juga asam
sitrat dan asam oksalat sebagai zat pengkelat yang dapat mengembalikan kembali
kitosan .
2. Memberikan manfaat kepada penulis dalam usaha mengembangkan pengetahuan
dan pengalaman ilmiah dalam bidang penelitian.
1.6. Lokasi Penelitian
Adapun lokasi penelitian ini dilakukan di Laboratorium Kimia Anorganik dan kimia
Analitik FMIPA-USU
1.7. Metodologi Penelitian
Metode yang digunakan dalam penelitian ini adalah:
1.Metode Eksperimen
2.Metode Spektrofotometer Serapan Atom (SSA).
BAB 2
TINJAUAN PUSTAKA
2.1. Logam
Logam menurut pengertian orang awam adalah barang yang padat dan berat, biasanya
digunakan orang untuk alat atau perhiasan yaitu besi, baja, emas, dan perak. Padahal
masih banyak logam lain yang penting dalam proses biologis mahluk hidup misalnya
kobalt, mangan, dan lain-lain.
Pada dasarnya logam dibagi menjadi 2 bagian yaitu logam esensial dan logam
non esensial. Logam esensial adalah logam yang sangat membantu dalam proses
fisiologis mahluk hidup yaitu membantu kerja enzim atau pembentukan organ dari
mahluk hidup itu sendiri. Sedangkan logam non esensial adalah logam yang
peranannya dalam tubuh mahluk hidup belum diketahui, kandungannya dalam jaringan
sangat kecil dan apabila kandungannya tinggi dapat merusak organ-organ tubuh
mahluk hidup yang bersangkutan (Darmono,1995).
2.2. Besi(Fe)
Besi atau ferum (Fe) adalah berwana putih keperakan, liat dan dapat dibentuk. Di alam
didapat sebagai hermatit. Di dalam air minum Fe menimbulkan rasa, warna (kuning),
pengendapan pada dinding pipa,pertumbuhan bakteri besi dan kekeruhan.Besi
dibutuhan oleh tubuh dalam pembentukan hemoglobin sehingga jika kekurangan Fe
akan mempengaruhi pembentukan Hb tersebut.Sel darah merah muda (korpuskula)
mengandung Hb dan bahan ini diproduksi oleh sumsum tulang untuk mengganti sel
darah merah yang rusak. Kemudian dari sel darah merah yang rusak ini besi
dibebaskan dan dipakai lagi untuk bahan pembentukan sel darah merah muda.Besi juga terdapat dalam serum protein yang disebut “transferin” yang berperan dalam mentranspor besi dari jaringan satu ke jaringan lain.
Besi juga berperan dalam aktifitas beberapa enzim seperti sitokrom dan flavor
dapat mengekskresikan Fe. Karenanya mereka sering mendapat transfuse darah, warna
kulitnya menjadi hitam karena akumulasi Fe (Juli Soemirat,1996)
Kekurangan Fe dalam diet akan mengakibatkan defiensi Fe,kasus defiensi ini
merupakan factor yang di sebabkan oleh malnutrisi, hambatan absorbsi, pendarahan
dan hamil yang berulang kali. Karena tubuh sangat efisien dalam menyimpan Fe, diet
yang sangat rendah jarang menyebabkan defisiensi Fe. Dua penyebab utama kasus
difiensi pada orang dewasa adalah kehilangan darah yang berat pada penderita tumor
pada saluran pencernaan ,ulcer lambung dan pendarahan waktu mensturasi. disamping
itu defiensi disebabkan oleh penyakit parasit dan penurunan daya absorbs Fe ini
menyebabkan Anemia. Gejala klinis dari anemia karena defiensi Fe adalah :
kelemahan, fatigue, sulit bernafas waktu berolahraga, kepala pusing, nausea, konstipasi
atau diare, penurunan nafsu makan,kulit,dan selaputlendir terlihat pucat karena
penurunan sirkulasi hemoglobin, kuku menjadi pucat dan tipis berkerut,kasar dan
cekung serta terasa dingin pada tangan dan kaki (Darmono 1995).
Sekalipun Fe itu diperlukan oleh tubuh, tetapi dalam dosis besar dapat merusak
dinding usus. Kematian sering kali disebabkan oleh rusaknya dinding usus ini. Debu
Fe juga dapat diakumulasi didalam alveori dan menyebabkan berkurangnya fungsi
paru-paru (Juli Soemirat,1996).
Ligan dapat dikelompokkan atas monodentat, bidentat, polidentat.
a. Ligan Monodentat yaitu ligan yang hanya mampu memberikan satu pasang elektron
kepada satu ion logam pusat dalam senyawa koordinasi. Misalnya : ion halida, H2O
dan NH3. Atom N dan O dapat mendonorkan sepasang electron kepada atom pusat
seperti ion Fe2+
b. Ligan Bidentat yaitu ligan yang mempunyai dua atom donor sehingga mampu
memberikan dua pasang elektron. Dalam pembentukan ikatan koordinasi, ligan
bidentat akan menghasilkan struktur cincin dengan ion logamnya (sering disebut cincin
kelat). Ligan bidentat dapat berupa molekul netral (seperti diamin, difosfin, disulfit)
c. Ligan Polidentat yaitu ligan-ligan yang memiliki lebih dari dua atom donor.
Ligan ini dapat disebut tri, tetra, penta, atau heksadentat, bergantung pada jumlah atom
donor yang ada.Ligan polidentat tidak selalu menggunakan semua atom donornya
untuk membentuk ikatan koordinasi. Misalnya : EDTA sebagai heksadentat mungkin
hanya menggunakan 4 atau 5 atom donornya bergantung pada ukuran dan stereokimia
kompleks.
Berdasarkan jenis ikatan koordinasi yang terbentuk, ligan dapat dikelompokkan
sebagai berikut.
a. Ligan yang tidak mempunyai elektron sesuai untuk ikatan π dan orbital kosong
sehingga ikatan yang terbentuk hanya ikatan σ, seperti H-, NH3, SO32-, atau
RNH2.
b. Ligan yang mempunyai dua atau tiga pasang elektron bebas yang selain
membentuk ikatan σ, juga dapat membentuk ikatan π dengan ion logam, seperti N3-, O2-, OH-, S2-, NH2-, R2S, R2O, NH2, dan ion benzena.
c. Ligan yang memiliki orbital π-antiikatan kosong dengan tingkatan benzene
rendah yang dapat menerima elektron yang orientasinya sesuai dari logam,
seperti CO, R3P, CN-, py, dan acac.
d. Ligan yang tidak ada pasangan elektron bebasnya, tetapi memiliki electron
ikatan-π, seperti alkena, alkuna, benzena, dan anion siklopentadienil.
e. Ligan yang membentuk dua ikatan σ dengan dua atom logam terpisah dan
kemudian membentuk jembatan. Sebagai contoh, OH-, O2-, CO. (Nuryono,
2003)
Menurut Kirk dan Othmer ( 1965 ), senyawa pembentuk kompleks merupakan
sejenis molekul organic ( ligan ) yang menyebabkan sebuah ion logam memiliki lebih
dari satu posisi, misalnya melalui dua atau lebih grup electron donor dalam ligan.
Pembentukan senyawa kompleks dapat terjadi jika ada reaksi antara ion logam yang
dinamakan ion inti dengan komponen-komponen lain yang disebut ion negatif atau
mengikat ion logam melalui ikatan koordinat kovalen, dimana yang bertindak sebagai
donor electron disini adalah ligan. Senyawa kompleks yang terbentuk bisa bermuatan
negative, positif, atau nol.
2.3. Kitin dan Kitosan
Rumus molekul kitosan adalah (C6H11NO4)n yaitu suatu poli (2-amino-2-deoksi-β-(1→
4)-D-glukopiranosa yang memiliki radikal-radikal CH2OH, -NH2,-OH, dan-CH3.
Kitin dan kitosan merupakan suatu polimer alami berbentuk lurus yang
mempunyai berat molekul besar dan masing- masing unit berikatan sacara β –D(1-4), dapat dibiodegradi secara alami, tidak toksik, bersifat adsorben, sukar larut dalam
pelarut selulosa, dan reaktivitas rendah.
Kitin dan kitosan mempunyai jumlah nitrogen 6,8%, dibandingkan dengan
selulosa yang disubstitusi secara sintetis (1,25%), karena mengandung nitrogen maka
kitin dan kitosan sangat berguna sebagai chelating agent.
Kitosan merupakan senyawa yang tidak larut dalam air, larut dalam basa kuat,
sedikit larut dalam HCl dan HNO3, dan H3PO4 dan larut dalam H2SO4.Kitosan tidak
beracun, mudah mengalami biogradasi dan bersifat polielektolik dan tidak larut dalam
air [Hirano, 1986]. Disamping itu kitosan dapat dengan mudah berinteraksi dengan
zat-zat organik lainnya seperti protein. Oleh karena itu, kitosan relatif lebih banyak
digunakan pada beberapa bidang industri terapan dan industri kesehatan [Muzzarelli,
1986]. Meskipun sumber kitin di alam bermacam-macam, namun sampai saat ini
sumber utama yang praktis dieksplorasi adalah kulit udang-udangan yang secara
ekonomis sangat potensial. Misalnya udang windu, lobster,kepiting dan lain-lain. Kulit
udang-udangan ini merupakan sumber utama yang saat ini cukup banyak tersedia
Rumus struktur kitin dan kitosan dapat dilihat pada gambar 2.1dan 2.2 dibawah ini.
Gambar 2.1: Struktur kitin.(Muzzarelli, 1977 )
H CH2OH H CH2OH
O O
O
OH H
H NH2 H NH2 n
Gambar 2.2: Struktur kitosan( Muzzarelli, 1977 )
2.3.1. Derajat Deasetilasi
Derajat deasetilasi adalah persentasi gugus asetilasi yang berhasil dihilangkan selama
proses deasetilasi kitin. Derajat deasetilasi berperan penting dalam proses penyerapan.
Pertambahan nilai derajat deasetilasi menyebabkan bertambahnya jumlah gugus amina
bebas ( Milot, 1998 ). Berat molekul kitosan dan derajat deasetilasi juga dapat
proses penyerapan. Beberapa publikasi menyatakan bahwa derajat deasetilasi akan
dapat meningkatkan keupayaan dalam proses penyerap ion logam. Ini disebabkan
meningkatnya gugus amina bebas didalam praktiknya berat molekul dan derajat
deasetilasi bertambah nilainya juga membawa pengaruh pada sifat fisik dan
fisikokimia pada porositas, viskositas, dan titik leburnya ( Agusnar H., 1990 ).
Perbedaan antara kitin dengan kitosan terdapat dalam derajat deasetilasinya. Kitosan
mempunyai derajat deasetilasi 80 – 90 % akan tetapi kebanyakan publikasi menggunakan istilah kitosan apabila derajat deasetilasi lebih besar dari 70 %.
Tabel 2.1.Karakteristik kitosan dengan beberapa parameter yang penting
______________________________________________________
No Parameter Nilai
_______________________________________________________
1 Bentuk partikel Dari bubuk sampai serpihan
_______________________________________________________
Kualitas kitosan berdasarkan penggunaannya dapat dibagi kedalam 3 jenis yaitu:
1.Kualitas teknis,
2.Pangan
2.3.2.Sifat dan kegunaan Kitosan
1. Merupakan Polimer poliamin berbentuk linear
2. Mempunyai gugus amina aktif
3. Mempunyai kemampuan untuk mengkhelat beberapa logam.
Sedangkan sifat biologi kitosan antara lain :
1. Bersifat biokompatibel artinya sebagai polimer alam tidak mempunyai efek
samping, tidak beracun, tidak dapat dicerna, mudah diuraikan oleh mikroba.
2. Dapat berikatan dengan sel mamalia dan mikroba secara agresif.
3. Mampu meningkatkan pembentukan tulang
4. Bersifat hemostatik, fungistatik, spermisidal, anti tumor, anti kolesteroersifat
5. Bersifat sebagai depresan pada sistim saraf pusat. (Rismana, 2008).
Potensi kitosan sebagai sumber daya alam banyak digunakan oleh pelbagai
industri antara lain industri farmasi, kesehatan, biokimia, bioteknologi, pangan,
pengolahan limbah, kosmetik, agroindustri, industri tekstil, industri perkaiuan, industri
kertas, dan industri elektronika.( Agusnar H, 2008 ).
Aplikasi khusus dari sifat yang dimiliki kitosan antara lain untuk pengolahan
limbah cair terutama bahan sebagai penukar ion dalam meminimalisasi logam-logam
berat, mengkoagulasi minyak atau lemak, serta mengurangi kekeruhan, penstabil
minyak, rasa dan lemak dalam produk industri pangan.
2.3.3.Sumber-sumber Kitosan
Kitosan adalah modifikasi dari senyawa polimer karbohidrat yang berasal dari
kitin.Kitin banyak terdapat dalam kulit luar hewan golongan Crustaceae terutama
udang, kepiting dan sotong.( Agusnar H, 2008 ).
Kitosan merupakan senyawa yang tidak larut dalam air,larutan basa kuat,sedikit larut
dalam HCl,HNO3,H3PO4 dan tidak larut dalam H2SO4. Kitosan tidak beracun, mudah
mengalami biodegradasi, bersifat polielektrolit dan dapat berinteraksi dengan zat-zat
organic lainnya seperti protein.Bentuk, sifat daan kegunaan kitosan dapat dilihat pada
Tabel 2.2.Bentuk,sifat dan kegunaan Kitosan.( Hirano.S, 1984 )
No Bentuk Sifat dan Kegunaan
1 Serbuk -Dapat diubah dari kasar menjadi halus
-Mudah dilarutkan
6 Larutan -Sifat kejernihan yang tinggi
-Menghasilkan bentuk garam
-DAPAT MENYERAP LOGAM
7 Pasta -Mudah untuk diformulasikan
-Daya pelembab yang baik.
2.3.4. Pembentukan Kompleks Kitosan dengan Logam
Kitosan bersifat polikationik dapat mengikat lemak dan logam berat pencemar.
Kitosan memiliki gugus amina yaitu pada unsur N yang bersifat sangat reaktif dan
bersifat basa. Limbah cair yang mengandung logam berat apabila direaksikan dengan
kitosan maka akan berubah menjadi koloid yang disebut flok. Prinsip koagulasi
asam akan mempertukarkan proton yang dimiliki logam dengan electron yang dimiliki
Gambar 2.3: Mekanisme pengikatan logam besi oleh kitosan.( Schmuhl R, 2001)
2.3.5. Interaksi Kitosan Dengan Ion Logam
Interaksi kitosan dengan ion logam terjadi karena proses pengkompleksan dimana
pertukaran ion,penyerapan dan pengkhelatan terjadi selama proses berlangsung.
Ketiga proses tersebut tergantung dari ion logam masing – masing. Kitosan menunjukkan afinitas yang tinggi pada logam transisi golongan 3, begitu pula pada
logam yang bukan golongan alkali dengan konsentrasi rendah.( Muzzarelli., 1973, dan
1977 ). Sifat penyerapan ion logam yang sangat baik oleh kitosan dengan selektif dan
kapasitas penyerapan yang tinggi yang disebabkan tiga sifat yaitu :
1. Sifat hidrofilik kitosan dengan jumlah yang besar pada gugusan hidroksil.
2. Gugus amina primer dengan aktivitas yang tinggi.
3. Struktur rantai polimer kitosan yang fleksibel yang dapat membentuk konfigurasi
untuk pengkompleksan kitosan dengan ion logam. Kitosan mempunyai
oH
kemampuan untuk mengikat logam dan membentuk kompleks logam - kitosan.
(Mc Kay , 1987 ) Contoh mekanisme yang terjadi seperti dibawah ini.
2R-NH3 + Fe+²+2Cl¯ 2 ( RNH3 )FeCl2
Dalam larutan asam gugus amina bebas sangat cocok sebagai polikationik
untuk mengkhelat logam atau membentuk disperse.Karena dalam larutan asam kitosan
akan menjadi polimer dengan struktur lurus sehingga berguna untuk flokulasi
(Ornum,1992).
Dalam suasana asam gugus amina dari kitosan akan terprotonasi membentuk gugus
amina kationik NH3+.(Sanford,1989).
Kitosan mempunyai satu kumpulan amino linier bagi setiap unit glukosa. Kumpulan
amino ini mempunyai sepasang elektron yang dapat berkoordinat untuk membentuk
ikatan – ikatan aktif dengan kation – kation logam. Unsur nitrogen pada setiap monomer kitosan dikatakan sebagai gugus yang aktif berkordinat dengan kation
logam. ( Hutahahean., 2001 ).
2.4. Pengkelatan
Pengkelatan merupakan proses pengikatan logam dengan cara menambah senyawa
pengkelat yang membentuk kompleks logam (Ekholm, 2003). Proses pengkelatan
dilakukan dengan cara yang sama dengan adsorpsi hanya dengan mengganti adsorben
dengan senyawa pengkelat. Beberapa senyawa yang dapat berfungsi sebagai bahan
pengkelat diantaranya asam sitrat, asam oksalat, asam malat, asam tartarat dan EDTA
(Karmelita, 1991). Proses pengikatan logam merupakan proses keseimbangan
pembentukan komplek logam dengan senyawa pengkelat membentuk senyawa
kompleks. Proses pengkelatan dipengaruhi oleh konsentrasi senyawa yang ada, jenis
pengkelat, kecepatan dan cara pengadukan, pH waktu kontak dan teknik penyaringan
(Karmelita, 1991). Proses pengikatan logam merupakan proses keseimbangan
pembentukan kompleks ion logam dengan ligan (sequestran). Secara umum
L + S LS dimana:
L = ion logam
S = sequestran (ligan)
LS= komplek logam squestran
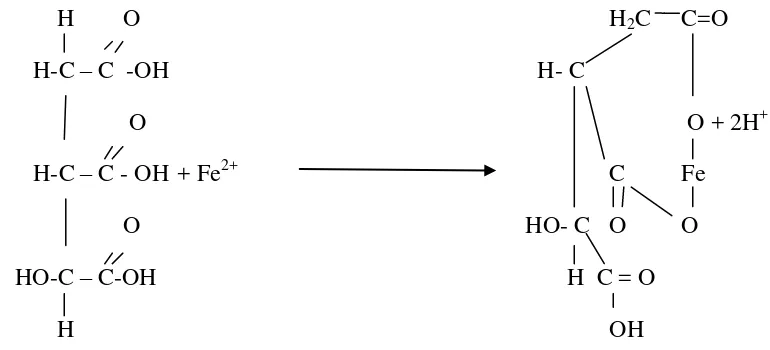
Proses pengikatan logam oleh asam sitrat dan asam oksalat dapat dilihat dalam
Gambar 2.4 dibawah ini :
H O H2C C=O
H-C – C -OH H- C
O O + 2H+
H-C – C - OH + Fe2+ C Fe
O HO- C O O
HO-C – C-OH H C = O
H OH
Gambar 2.4: Mekanisme pengikatan logam Fe2+ oleh Asam sitrat (Muller B, 1997).
O O
C - OH C O
+ Fe2+ Fe + 2H+
C - OH C O
O O
Bahan-bahan yang dapat digunakan sebagai pembentuk kompleks adalah asam
sitrat, asam oksalat, asam tartarat, asam glukonat, asam etilen diamin tetra asetat
(EDTA), asam nitrotriasetat (NTA), polifosfat, poliamin, dan asam isoaskorbat (Kirk ,
1965). Asam sitrat atau β-3-hidroksi trikarbosiklis, 2-hidroksi-1,2,3-propana
trikarbosiklis, mempunyai rumus kimia C6H8O7. Sifat dari asam sitrat adalah agen
pengkelat (chelating agent) dimana senyawa ini dapat mengikat logam-logam divalen
atau lebih, seperti Mn, Mg dan Fe yang sangat diperlukan sebagai katalisator dalam
reaksi oksidasi sehingga reaksi ini dapat dihambat dengan penambahan asam sitrat
(Laksmi, 1974). Asam sitrat berfungsi sebagai agen pengkelat dimana senyawa ini
memiliki kemampuan untuk mengikat logam-logam divalen seperti Mn, Mg, dan
Fe.Asam sitrat merupakan larutan asam yang paling populer digunakan untuk tujuan
Asam sitrat merupakan asamorganiklemah yang ditemukan pada daun dan
buah tumbuhan genus Citrus (jeruk-jerukan). Senyawa ini merupakan bahan pengawet yang baik dan alami, selain digunakan sebagai penambah rasa masam pada makanan
dan minuman ringan.
Dalam biokimia, asam sitrat dikenal sebagai senyawa antara dalam siklus asam sitrat
yang terjadi di dalam mitokondria, yang penting dalam metabolisme makhluk hidup.
Zat ini juga dapat digunakan sebagai zat pembersih yang ramah lingkungan dan
sebagai antioksidan.
Asam sitrat terdapat pada berbagai jenis buah dan sayuran, namun ditemukan pada
konsentrasi tinggi, yang dapat mencapai 8% bobot kering, pada jeruk lemon dan limau
(misalnya jeruk nipis dan jeruk purut). Temperatur
Efek akut Menimbulkan iritasi kulit dan mata.
Rumus kimia asam sitrat adalah C6H8O7 (strukturnya ditunjukkan pada tabel informasi
di sebelah kanan). Struktur asam ini tercermin pada nama IUPAC-nya, asam
2-hidroksi-1,2,3-propanatrikarboksilat.
2.5.1. Sifat Fisika dan Kimia
Sifat-sifat fisis asam sirat dirangkum pada tabel di sebelah kanan. Keasaman asam sirat
didapatkan dari tiga gugus karboksil COOH yang dapat melepas proton dalam larutan.
Jika hal ini terjadi, ion yang dihasilkan adalah ion sitrat. Sitrat sangat baik digunakan
dalam larutan penyangga untuk mengendalikan pH larutan. Ion sitrat dapat bereaksi
dengan banyak ion logam membentuk garam sitrat. Selain itu, sitrat dapat mengikat
ion-ion logam dengan pengkelatan, sehingga digunakan sebagai pengawet dan
penghilang kesadahan air (lihat keterangan tentang kegunaan di bawah).
Pada temperatur kamar, asam sitrat berbentuk serbuk kristal berwarna putih. Serbuk
kristal tersebut dapat berupa bentuk anhydrous (bebas air), atau bentuk monohidrat yang mengandung satu molekul air untuk setiap molekul asam sitrat. Bentuk
anhydrous asam sitrat mengkristal dalam air panas, sedangkan bentuk monohidrat didapatkan dari kristalisasi asam sitrat dalam air dingin. Bentuk monohidrat tersebut
dapat diubah menjadi bentuk anhydrous dengan pemanasan di atas 74 °C.
Secara kimia, asam sitrat bersifat seperti asam karboksilat lainnya. Jika dipanaskan di
atas 175 °C, asam sitrat terurai dengan melepaskan karbon dioksida dan air.
2.5.2. Sejarah
Asam sitrat diyakini ditemukan oleh alkimiawan Arab-Yemen (kelahiran Iran) yang
hidup pada abad ke-8, Jabir Ibn Hayyan. Pada zaman pertengahan, para ilmuwan
Eropa membahas sifat asam sari buah lemon dan limau; hal tersebut tercatat dalam
ensiklopediaSpeculum Majus (Cermin Agung) dari abad ke-13 yang dikumpulkan oleh Vincent dari Beauvais. Asam sitrat pertama kali diisolasi pada tahun 1784 oleh
lemon. Pembuatan asam sitrat skala industri dimulai pada tahun 1860, terutama
mengandalkan produksi jeruk dari Italia.
Pada tahun 1893, C. Wehmer menemukan bahwa kapang Penicillium dapat membentuk asam sitrat dari gula. Namun demikian, pembuatan asam sitrat dengan
mikroba secara industri tidaklah nyata sampai Perang Dunia I mengacaukan ekspor
jeruk dari Italia.
Pada tahun 1917, kimiawan pangan Amerika, James Currie menemukan bahwa galur
tertentu kapang Aspergillus niger dapat menghasilkan asam sitrat secara efisien, dan perusahaan kimia Pfizer memulai produksi asam sitrat skala industri dengan cara
tersebut dua tahun kemudian.
2.5.3. Pembuatan
Dalam proses produksi asam sitrat yang sampai saat ini lazim digunakan, biakan
kapang Aspergillus niger diberi sukrosa agar membentuk asam sitrat. Setelah kapang disaring dari larutan yang dihasilkan, asam sitrat diisolasi dengan cara
mengendapkannya dengan kalsium hidroksida membentuk garam kalsium sitrat. Asam
sitrat di-regenerasi-kan dari kalsium sitrat dengan penambahan asam sulfat.
Cara lain pengisolasian asam sitrat dari hasil fermentasi adalah dengan ekstraksi
menggunakan larutan hidrokarbon senyawa basa organik trilaurilamina yang diikuti
dengan re-ekstraksi dari larutan organik tersebut dengan air.
2.5.4. Kegunaan
Limun, jeruk dan buah-buahan semacam ini mengandung banyak asam sitrat.
Penggunaan utama asam sitrat saat ini adalah sebagai zat pemberi cita rasa dan
pengawet makanan dan minuman, terutama minuman ringan. Kode asam sitrat sebagai
zat aditif makanan (E number ) adalah E330. Garam sitrat dengan berbagai jenis logam digunakan untuk menyediakan logam tersebut (sebagai bentuk biologis) dalam banyak
Sifat sitrat sebagai larutan penyangga digunakan sebagai pengendali pH dalam
larutan pembersih dalam rumah tangga dan obat-obatan.
Kemampuan asam sitrat untuk meng-kelat logam menjadikannya berguna
sebagai bahan sabun dan deterjen. Dengan meng-kelat logam pada air sadah, asam
sitrat memungkinkan sabun dan deterjen membentuk busa dan berfungsi dengan baik
tanpa penambahan zat penghilang kesadahan. Demikian pula, asam sitrat digunakan
untuk memulihkan bahan penukar ion yang digunakan pada alat penghilang kesadahan
dengan menghilangkan ion-ion logam yang terakumulasi pada bahan penukar ion
tersebut sebagai kompleks sitrat.
Asam sitrat digunakan di dalam industri bioteknologi dan obat-obatan untuk
melapisi (passivate) pipa mesin dalam proses kemurnian tinggi sebagai ganti asam nitrat, karena asam nitrat dapat menjadi zat berbahaya setelah digunakan untuk
keperluan tersebut, sementara asam sitrat tidak.Asam sitrat dapat pula ditambahkan
pada es krim untuk menjaga terpisahnya gelembung-gelembung lemak.Dalam resep
makanan, asam sitrat dapat digunakan sebagai pengganti sari jeruk.
2.5.5. Keamanan
Asam sitrat dikategorikan aman digunakan pada makanan oleh semua badan
pengawasan makanan nasional dan internasional utama. Senyawa ini secara alami
terdapat pada semua jenis makhluk hidup, dan kelebihan asam sitrat dengan mudah
dimetabolisme dan dihilangkan dari tubuh.
Paparan terhadap asam sitrat kering ataupun larutan asam sitrat pekat dapat
menyebabkan iritasi kulit dan mata. Pengenaan alat protektif (seperti sarung tangan
atau kaca mata pelindung) perlu dilakukan saat menangani bahan-bahan tersebut.
2.6. Asam oksalat, dan sifat-sifatnya.
Asam Oksalat terdapat pada selada, kobis, bunga kol (terutama brokoli), kacang hijau,
buncis dan dalam jumlah sedikit pada semua sayuran dan buah-buahan.Tapi tau ga,
asam oksalat bersama-sama dengan kalsium dalam tubuh manusia membentuk
kalsium yang juga terdapat dalam produk-produk yang mengandung oksalat.
Asam oksalat adalah asam dikarboksilat yang hanya terdiri dari dua atom C pada
masing-masing molekul, sehingga dua gugus karboksilat berada berdampingan.
Karena letak gugus karboksilat yang berdekatan, asam oksalat mempunyai konstanta
dissosiasi yang lebih besar daripada asam-asam organik lain. Besarnya konstanta
disosiasi (K1) = 6,24.10-2 dan K2 = 6,1.10-5). Dengan keadaan yang demikian dapat
dikatakan asam oksalat lebih kuat daripada senyawa homolognya dengan rantai atom
karbon lebih panjang.
Asam oksalat dalam keadaan murni berupa senyawa kristal, larut dalam air (8% pada
10o C) dan larut dalam alkohol. Asam oksalat membentuk garam netral dengan logam
alkali (Na, K), yang larut dalam air (5-25 %), sementara itu dengan logam dari alkali
tanah, termasuk Mg atau dengan logam berat, mempunyai kelarutan yang sangat kecil
dalam air. Jadi kalsium oksalat secara praktis tidak larut dalam air.Berdasarkan sifat
tersebut asam oksalat digunakan untuk menentukan jumlah kalsium.
Asam oksalat dapat ditemukan dalam bentuk bebas ataupun dalam bentuk
garam.Bentuk yang lebih banyak ditemukan adalah bentuk garam.Bahan makanan
yang mengandung oksalat dapat diklasifikasikan menjadi tiga kelompok, yaitu;
1. Produk-produk dimana miliequivalen asam oksalat yang terkandung jumlahnya 2-7
kali lebih besar daripada kalsium, seperti bayam, orach, daun beet dan akar
beet,sorrel, sorrel kebun, kelembak dan bubuk kakao.
2. Pada produk-produk seperti kentang, amaranth, gooseberries, dan currants,
asamoksalat dan kalsium terdapat dalam jumlah yang hampir setara (1±0,2),
dengan demikian diantara keduanya saling menetralkan/menghapuskan, oleh
karena itu tidak memberikan kalsium yang tersedia bagi tubuh. Tetapi mereka tidak
merngganggu penggunaan kalsium yang diberikan oleh produk lain dan oleh
karena itu tidak menimbulkan pengaruh anti mineralisasi.
3. Bahan makanan yang meskipun mengandung asam oksalat dalam jumlah yang
cukup banyak, tapi karena pada bahan tersebut kaya akan kalsium, maka bahan
adalah selada, dandelion, cress, kobis, bunga kol (terutama brokoli), kacang hijau,
dan terutam green peas, koherabbi, block raddish, green turnip, dan dalam jumlah
sedikit pada semua sayuran dan buah-buahan.
2.6.1. Pengaruh Asam Oksalat terhadap tubuh manusia.
Asam oksalat bersama-sama dengan kalsium dalam tubuh manusia membentuk
senyawa yang tak larut dan tak dapat diserap tubuh, hal ini tak hanya mencegah
penggunaan kalsium yang juga terdapat dalam produk-produk yang mengandung
oksalat, tetapi menurunkan CDU dari kalsium yang diberikan oleh bahan pangan lain.
Hal tersebut menekan mineralisasi kerangka dan mengurangi pertambahan berat
badan. Asam oksalat dan garamnya yang larut air dapat membahayakan, karena
senyawa tersebut bersifat toksis. Pada dosis 4-5 gram asam oksalat atau kalium oksalat
dapat menyebabkan kematian pada orang dewasa, tetapi biasanya jumlah yang
menyebabkan pengaruh fatal adalah antara 10 dan 15 gram. Gejala pada pencernaan
(pyrosis, abdominal kram, dan muntah-muntah) dengan cepat diikuti kegagalan
peredaran darah dan pecahnya pembuluh darah inilah yang dapat menyebabkan
kematian. Mengurangi Konsumsi senyawa Asam Oksalat
Karena pengaruh distropik oleh oksalat tergantung pada ratio molar antara asam
oksalat dan kalsium, hal itu dapat dicegah melalui cara, yaitu
1. Menghilangkan oksalat dengan membatasi konsumsi bahan makanan yang
banyak mengandung oksalat yang larut, yaitu dengan menghindari makan
dalam jumlah besar atau juga menghindari makan dalam jumlah kecil tetapi
berulang-ulang. Mengkombinasikan beberapa makanan yang banyak
mengandung oksalat perlu juga dihindari.
2. Dengan cara menaikkan supply kalsium yang akan dapat menetralkan pengaruh
dari oksalat.
3. Memasak bahan makanan yang mengandung asam oksalat hingga mendidih
4. Dan membuang airnya sehingga dapat memperkecil proporsi asam oksalat
2.7. Adsorpsi
2.7.1.Pengertian Adsorpsi
Peristiwa penyerapan suatu zat pada permukaan zat lain disebut adsorbs. Zat yang
diserap disebut fase terserap sedangkan zat yang menyerap disebut adsorben.Kecuali
zat padat, adsorbens dapat pula berupa zat cair. Karena itu adsorbsi dapat terjadi
antara: zat padat dan zat cair, zat padat dan gas, zat cair dan zat zat cair, atau gas dan
zat cair.
Proses adsorbs ini disebabkan oleh gaya tarik molekul-molekul di permukaan
adsorben. Adsorbsi berbeda dengan adsorbs, karena pada adsorbsi zat yang diserap
masuk ke dalam adsorbens.
Berkat selektivitasnya yang tinggi, proses adsorbs sangat sesuai untuk memisahkan
bahan dengan konsentrasi yang kecil dari campuran yang mengandung bahan lain yang
berkonsentrasi tinggi.
Adsorbsi digunakan dalam pegolahan air buangan industri, terutama untuk
mengurangi komponen-komponen organik misalnya warna, fenol, detergen, zat-zat
toksik dan zat-zat organik yang sukar diuraikan(nonbiodeyadable).
Sesuai dengan jenis ikatan yang terdapat antara bahan yang diadsorbsi dan
adsorbennya, maka dibedakan antara adsorbsi fisika dan adsorbsi kimia.
Adsorbsi fisika, merupakan interaksi van der waals antara adsorben dengan
adsorbat yang berarti pembentukan ikatan sementara, oleh karena itu adsorbsi fisika
merupakan reaksi reversible.
Sedangkan adsorbsi kimia adalah merupakan interaksi antara elektron-elektron pada
permukaan adsorben dengan molekul-molekul adsorbat membentuk ikatan yang lebih
kuat dibandingkan dengan adsorbsi fisika dan proses ini merupakan
irreversible(Bemasconi, 1995).
Kecepatan adsorbs tidak hanya tergantung pada perbedaan konsentrasi dan
pada luas permukaan adsorben, melainkan juga pada suhu, tekanan(untuk gas), ukuran
partikel dan porositas adsorben.Juga tergantung pada ukuran molekul bahan yang akan
bahan yang akan dipisahkan, adsorben yang paling cocok, metode regenerasi yang di
perlukan maupun pertimbangan ekonominya.
Proses adsorbsi meliputi 3 tahap mekanisme yaitu:
a. Pergerakan molekul-molekul adsorbat menuju permukaan adsorben.
b. Penyebaran molekul-molekul adsorbat ke dalam rongga-rongga adsorben.
c. Penarikan molekul-molekul adsorbat oleh pennukaan aktif membentuk
ikatan, yang berlangsung sangat cepat (Metcalf , 1979).
Pada adsorbs di dalam hamparan tetap konsentrasi fase fluida dan fase zat
padat berubah menurut waktu dan menurut posisinya di dalam hamparan. Kinetika
adsorbsi dapat di anggap sebagai laju reaksi yang merupakan perubahan waktu.
2.7.2. Faktor-faktor yang mempengaruhi Adsorpsi
1. Pengadukan
Kecepatan adsorpsi dipengaruhi oleh difusi pori tergantung pada jumlah atau lama
pengadukan dam sistem.
2.Ukuran Partikel
Ukuran partikel dan luas permukaan adalah sifat penting dari kitosan yang
berhubungan dengan kegunaannya sebagai adsorben. Kecepatan adsorpsi meningkat
dengan ukuran partikel kitosan yang menurun.
3. Jumlah Adsorben
Waktu yang dibutuhkan untuk proses adsorpsi berbanding terbalik terhadap jumlah
adsorben yang dibutuhkan. Artinya semakin besar jumlah adsorben maka waktu yang
dibutuhkan semakin sedikit.
4. pH
Asam organic lebih cepat diadsorpsi pada pH rendah, sedangkan basa organic lebih
cepat pada pH tinggi. pH optimum untuk proses adsorpsi ditentukan oleh uji
2.7.3. Menentukan konsentrasi logam yang terserap dengan menggunakan persamaan :
Konsentrasi ion logam terserap = C awal – C akhir
2.7.4. Menentukan persen desorpsi besidihitungdenganrumus :
Konsentrasi besi ter-desorpsi
% Besi terdesorpsi = __________________________________ x 100 %
Konsentrasi besi ter-adsorpsi
2.7.5. Tipe Sistem Adsorpsi
Sistem adsorbsi dapat dilakukan dengan 2 cara yaitu:
a. Cara Batch
Cara ini menggunakan bejana, air limbah yang akan diaiialiasis di aduk bersama
adsorben dengan kecepatan dan waktu tertentu. Selanjutnya proses adsorbs dibiarkan
sampai mencapai kesetimbangan.
Sistem batch sering digunakan apabila air limbah yang akan diolah volumenya relatif
tidak terlalu besar, dan digunakan untuk proses penjemihan air (Mc.Cabe , 1999).
b.Cara kolom
Cara kolom adalah menggunakan silinder vertical atau horizontal. Air limbah yang
akan diolah dialirkan secara tenis-menerus ke dalam suatu kolom adsorbsi. Sistem
kolom ini luas penggunaanya, rerutama untuk pengolahan limbah cair industridan
sangat cocok untuk air limbah ke dalam kolom vertikal dapat dilakukan dan atas ke
bawah, atau dari bawah ke atas.
Cara vertical ini dapat dibagi atas pararel ataupun san, dan ini juga ditentukan oleh
sifat adsorben dan adsorbat (Mc.Cabe , 1999).
2.8. Adsorben
Adsorben (untuk adsorbsi fisik) adalah bahan padat dengan luas permukaan dalam
halus pada padatan tersebut. Biasanya luasnya berada dalam order 200 – 1000 m2 /g adsorben. Diameter pori sebesar 0.0003 – 0,002mm.
Disamping luas spesifik dan diameter pori, maka kerapatan unggun, distribusi
ukuran partikel maupun kekerasannya merupakan data karakteristik yang penting dari
suatu adsorben. Tergantung pada tujuan penggunaannya, adborsen dapat berupa
granulat (dengan ukuran butir sebesa rbeberapa mm) atau serbuk (khusus untuk
adborsi campuran air) (Mc.Cabe ,1999).
Beberapa bahan yang dapat digunakan sebagai adsorben diantaranya yaitu:
a. Karbonaktif
Karbon aktif dibuat dan bahan organik yang dapat di karbonisasi,misalnya kayu,
humus, batubara coklat, dan tempurung kelapa.
Dari segi bentuknya, karton aktif terbagi atas karbon cetak (misalnya granujat
berbentuk sihinder), karbon bongkahan (bentuknya tak teratur) dan karbon serbuk.
Yang terakhir ini terutama dimanfaatkan untuk adsorbs, cairan (penghilangan warna).
Karena sifatnya yang hidrofobik, karbon aktif sangat sesuai untuk adsorbs pelarut yang
tidak dapat bercampur dengan air (misalnya benzene) (Bemasconi,1995).
Untuk tujuan penggunaannya, seringkali diameter pori dari karbon aktif
menjadi dasar pemilihan Misalnya untuk adsorbsi karbon bahan bennolekul besar
digunakan jenis karbon dengan pori yang besar dan untuk bahan bennolekul kecil yang
sesuai adalah karbon berpori halus.
b.Silika gel
Silika gel terdiri atas silisium dioksida (SiO2) yang berbentuk koloida, hampir tidak
mengandung air dan mempunyai banyak sekali pori yang halus. Bahan ini dibuat
secara sintetik dengan mengolah silikat alkali dengan asam sulfat.Silika gel seringkali
dibuat dengan bentuk butiran (sebagai granulat) dan tergantung pada tujuan
pemanfaatannya, dapat berpori sempit atau lebar. Kemampuan adsorbsi terhadap uap
air yang sangat besar dank arena itu seringkali digunakan untuk pengeringan gas yang
lembab, contohnya pada instalasi pengeringan udara atuapun di gunakan untuk
Silika gel yang dilengkapi dengan indikator kelembaban disebut sebagai gel biro.
Dengan indikator ini. Yang mempuyai warna reversibel yaitu biru (kering) dan merah
jambu (lembab), dapat diketahui apakah adsorben sudah terbebani dan sudah waktunya
harus diregenasi atau di ganti.
Silika gel dapat diregenasi dengan cara yang sederhana yaitu dengan
pemanasan pada 120-180 0C .Pemanasan dapat dilakukan secara langsung, misalnya
dengan mengalirkan udara panas atau secara tidak langsung dengan perantaran alat
penukar panas (Bernasconi, 1995).
c. Tapis molekuler (molecular sieves)
Tapis molekuler adalah silikat alkali atau silikat alumunium alkali tanah dengan
ukuran lubang dan rongga yang telah tertentu sesuai dengan struktur Kristal
bahan.Tapis ini dibuat secara sintetik, misalnya dari natrium silikat, tanah liat dan
natrium hidroksida.
Setelah air Kristal dikeluarkan, bahan akan memiliki struktur yang sangat
berpori. Diameter pori berkisar antara 0,3 -1nm (3 – 10A0)dan merupakan besaran karakteristik terpenting dari adsorben ini.
Tapis molekuler tidak hanya mampu mengadsorbsi bahan tunggal, melainkan
juga dapat memisahkan campuran berdasarkan ukuran molekul, polaritas, jenis ikatan
karbon (jenuh atau tidak jenuh) dan massa molekul (Dixon, 1989).
2.9. Desorpsi
Dua tipe eksperiman desorpsi yaitu:
1. Desorpsi tahap tunggal
Dalam eksperimen tahap tunggal, ion cadmium yang diserap padakitosan dilepas
kembali ke dalam larutan dengan penambahan sejumlah besar ion H+.(Tzu and
2. Desorpsi multi tahap
Dalam eksperimen multi tahap, cadmium yang diserap diperlihatkan oleh serangkaian
penambahan dosis kecil H+.( Tzu and Yu, 2012).
pH optimum dan konsumsi ion hidrogen ditambahkan untuk menggantikan
ion cadmium yang diserap pada gugus amina dari bead kitosan. Oleh karena itu,
jumlah ion hidrogen yang berbeda ditambahkan ke dalam bejana untuk
menentukan pengaruh konsumsi ion hidrogen pada persentase desorpsi cadmium
dan nilai pH akhir dari larutan cadmium yang diperoleh dalam satu proses
desorpsi tahapan tunggal.( Tzu and Yu, 2012).
Konsumsi ion hidrogen dan kisaran pH optimum untuk regenerasi kitosan
setelah adsorpsi cadmium akan dilakukan dalam reaktor spining bakset dengan
pengukuran pH untuk menentukan pengaruh pH dan konsumsi H+ atas desorpsi
Beberapa cara analisis logam telah banyak dilakukan baik untuk secara kualitatif
maupun secara kuantitatif. Sistem kualitatif dilakukan jika hanya ingin mengetahui
jenis logam yang ada tetapi tidak jumlahnya. Sedangkan system kuantatif dilakukan
untuk mengetahui secara detail berapa ppm logam tersebut (Darmono, 1995).
Destruksi merupakan suatu cara perlakuan pemecahan senyawa menjadi
unsure-unsur sehingga dapat di analisa, dengan kata lain perombakan bentuk organic
dari logam menjadi bentuk logam – logam anorganik. Pada dasarnya ada dua jenis destruksi yang dikenal yaitu : destruksi kering dan destruksi basah(Raimon, 1992)
a. Destruksi Kering
Destruksi kering adalah perombakan sampel oraganik dengan jalan pengabuan dalam
kering merupakan perombakan logam yang tidak mudah menguap yang akan
membentuk oksidasi logamnya. Oksidasi ini kemudian dilarutkan kedalam pelarut
asam, setelah itu dianalisa dengan menggunakan Spektrofotometer Serapan Atom
(SSA).
b. Destruksi Basah
Destruksi basah adalah perombakan sampel organic dengan asam – asam kuat baik tunggal maupun campuran. Metode destruksi basah digunakan untuk merombak logam – logam yang mudah menguap . Asam – asam yang digunakan adalah asam Nitrat (HNO3), asam sulfat (H2SO4), asam klorida (HCl) dan dapat digunakan secara tunggal
maupun campuran.
2.11. Prinsip Dasar Analisa Spektrometri Serapan Atom (SSA).
Prinsip penentuan metode ini didasarkan pada penyerapan energi radiasi oleh
atom-atom netral pada keadaan dasar, dengan panjang gelombang tertentu yang
menyebabkan tereksitasinya dalam berbagai tingkat energi. Keadaan eksitasi ini tidak
stabil dan kembali ke tingkat dasar dengan melepaskan sebagian atau seluruh
energieksitasinya dalam bentuk radiasi.Sumber radiasi tersebut dikenal sebagai lampu
katoda berongga.
Bagan Instrumen Spektrofotometer Serapan Atom (SSA) dapatdilihat dalam
Gambar 2.6 dibawah ini.
2.11.1.Sumber Radiasi
Suatu sumber radiasi yang digunakan harus memancarkan spektrum atom dari unsur
yang ditentukan. Spektrum atom yang dipancarkan harus terdiri dari garis tajam yang
mempunyai setengah lebar yang sama dengan garis serapan yang dibutuhkan oleh
atom-atom dalam contoh.Sumber sinar yang lazim dipakai adalah
lampukatodaberongga (hallow chatode lamp).Untuk penerapan apa saja yang diminta,
lampu katoda berongga yang digunakan mempunyai sebuah katoda pemancar yang
tebuat dari unsur yang sama yang akan dipelajari dalam nyala ini.(Bassett ,1994).
2.11.2. Nyala.
Nyala digunakan untuk mengubah sampel yang berupa padatan atau cairan menjdi
bentuk uap atomnya dan juga berfungsi untuk atomisasi. Untuk Spektroskopi nya
suatu persyaratan yang penting adalah bahwa nyala yang dipakai hendaknya
menghasilkan temperatur lebih dari 20000K. Konsentrasi atom-atom dalam bentuk gas
dalam nyala, baik dalam keadaan dasar maupun keadaan tereksitasi, dipengaruhi oleh
komposisi nyala.
Komposisi nyala asitilen-udara sangat baik digunakan untuk lebih dari 30 unsur
sedangkan komposisi nyala propane-udara disukai untuk logam yang mudah diubah
menjadi uapatomi.(Bassett, 1994).
2.11.3.Sistem Pembakar-Pengabut (nebulizer)
Tujuan sitem pembakar-pengabut adalah untuk mengubah larutan uji menjdi
atom-atom dalam bentuk gas. Fungsi pengabut adalah menghasilkan kabut atau aerosol
larutan uji. Larutan yang akan dikabutkan ditarik kedalam pipa kapiler,diperlukan
2.11.4. Monokromotor
Dalam Spektroskopi Serapan Atom fungsi monokromator adalah untuk memisahkan
garis resonansi dari semua garis yang tak diserap yang dipancarkan oleh sumber
radiasi.
Dalam kebanyakan instrument komersial digunakan kisidifraksi karena sebaran yang
dilakukan oleh kisi seragam daripada yang dilakukan oleh prisma dan akibatnya
instrument kisi dapat memelihara daya pisah yang lebih tinggi sepanjang jangka
panjang gelombang yang lebih besar (Braun,R.D,1982).
2.11.5.Detektor.
Detektor pada spektrofotometer absorpsi serapan atom berfungsi mengubah intensitas
radiasi yang datang menjadi arus listrik. Pada Spektrofotometer Serapan Atom yang
umum dipakai sebagai detector adalah tabung penggandaan foton.(PMT=Photo
Multiplier Tube Detektor) (Mulja,1997).
2.11.6.Read Out.
Reat out merupakan Systim pencatatan hasil.Hasil pembacaan dapat berupa angka atau
berupa kuva dari suatu recorder yang menggambarkan absorbansi atau intensitas emisi
(Braun,R.D,1982).
2.11.7.Cara Kerja SSA :
1. Pertama-tama gas di buka terlebih dahulu, kemudian kompresor, lalu ducting, main
unit, dan komputer secara berurutan.
2. Di buka program SAA (Spectrum Analyse Specialist), kemudian muncul perintah
”apakah ingin mengganti lampu katoda, jika ingin mengganti klik Yes dan jika
tidak No.
3. Dipilih yes untuk masuk ke menu individual command, dimasukkan nomor lampu
katoda yang dipasang ke dalam kotak dialog, kemudian di klik setup, kemudian
soket lampu katoda akan berputar menuju posisi paling atas supaya lampu katoda
4. Dipilih No jika tidak ingin mengganti lampu katoda yang baru.
5. Pada program SAS 3.0, dipilih menu select element and workingmode. Dipilih
unsur yang akan dianalisis dengan mengklik langsung pada symbol unsur yang
diinginkan
6. Jika telah selesai klik ok, kemudian muncul tampilan condition settings. Diatur
Parameter yang dianalisis dengan mensetting fuel flow :1,2 ;measurement;
concentration ; number ofsample: 2 ; unit concentration : ppm ; number of standard
: 3; standard list : 1 ppm, ppm, 9 ppm.
7. Diklik ok and setup, ditunggu hingga selesai warming up.
8. Diklik icon bergambar burner/ pembakar, setelah pembakar dan lampu menyala
alat siap digunakan untuk mengukur logam.
9. Pada menu measurements pilih measure sample.
10.Untuk meluruskan kurva, diukur dengan tahapanyang sama untuk
11.Jika data kurang baik akan ada perintah untuk pengukuran ulang, dilakukan
pengukuran blanko, hingga kurva yang dihasilkan turun danlurus.
12.Dimasukkan ke sampel 1 hingga kurva naik dan belok baru dilakukan pengukuran
13.Dimasukkan blanko kembali dan dilakukan pengukuran sampel ke 2.
14.Setelah pengukuran selesai, data dapat diperoleh dengan mengklik icon print atau
pada baris menu dengan mengklik file lalu print.
15.Apabila pengukuran telah selesai, aspirasikan air deionisasi untuk membilas
Burner selama 10 menit, api dan lampu burner dimatikan, program pada komputer
dimatikan,lalu main unit AAS, kemudian kompresor, setelah itu ducting dan
BAB 3
METODE PENELITIAN
3.1. Alat dan Bahan
3.1.1. Alat-alat yang digunakan
1. Spektrofotometer Serapan Atom (SSA) Shimadzu AA-6300
2. Alat-alat gelas yang biasa digunakan di laboratoriun Pyrex
3. Beaker glas Pyrex
4. Erlenmeyer Pyrex
5. Gelas Kimia Pyrex
6. Neraca Analitis, Presisi 0,001 g Mettler PM 2000
7. Gelas Ukur
13. Kertas saring Whatman No 1.
3.1.2. Bahan-bahan yang digunakan
1. Air Suling
2. HCl(p) 37 % p.a (E.Merck)
3. Larutan Standar Besi 1000 ppm (Fe) p.a (E.Merck)