ABSTRAK
EFEKTIVITAS EKSTRAK BAWANG PUTIH (Allium sativumL.) SEBAGAI OVISIDAAedes aegypti
Oleh
APGA REPINDO
World Health Organization mencatat hingga saat ini sekitar 50 juta kasus demam dengue ditemukan setiap tahun, dengan jumlah kematian sekitar 25.000 pertahunnya hingga tahun 2010, terutama pada daerah tropis dan subtropis termasuk Indonesia. Bawang putih diketahui mengandung allicin, saponin dan
flavonoid yang dapat menghambat daya tetas telur Aedes aegypti sehingga dapat mengendalikan populasi vektor penyakit ini. Tujuan penelitian ini adalah untuk mengetahui apakah ekstrak bawang putih efektif sebagai ovisidaAedes aegypti.
Penelitian eksperimen yang menggunakan rancangan acak lengkap ini dilakukan pada bulan November 2013 di Laboratorium Zoologi, Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung. Kosentrasi ekstrak yang digunakan adalah 0%, 0,1%, 0,3%, 0,5%, 0,7% dan 1% dengan 4 kali pengulangan untuk tiap perlakuan. Selanjutnya, diletakkan 20 butir telur pada tiap perlakuan dan pengulangan, sehingga didapatkan jumlah total sampel sebanyak 480 butir telur. Kemudian, diamati jumlah telur yang tidak menetas tiap 6 jam selama tiga hari. Pada akhir penelitian, uji hipotesis one way
ANOVA menghasilkan nilai p <0,001. Pada analisis post hoc Bonferroni diketahui konsentrasi yang efektif dibandingkan kontrol (0%) adalah 1%.
Hasil penelitian didapatkan penurunan daya tetas telur Aedes aegyptipada kosentrasi 0,1%, 0,3%, 0,5%, 0,7% dan 1% dibandingkan dengan kontrol negatif. Semakin tinggi konsentrasi ekstrak maka daya hambat pada penetasan telur akan semakin tinggi pula. Hal ini menunjukkan bahwa Ekstrak bawang putih efektif sebagai ovisidaAedes aegypti.
ABSTRACT
EFFECTIVENESS OF GARLIC (Allium sativum L.) EXTRACT AS THE OVICIDE ofAedes Aegypti
By
APGA REPINDO
The World Health Organization (WHO) noted to date approximately 50 million cases of dengue fever are found every year, about 25,000 deaths per year until 2010, mainly in tropical and subtropical regions, including Indonesia. Garlics is known contains allicin, saponin and flavonoid that can inhbite hatchability of Aedes aegypti’s eggs. This research objective was to know if garlics extract effective asAedes aegyptiovicide.
This experimental studies which used completely randomized design was performed in November 2013 in Laboratory of Zoology, Department of Biology, Faculty of Mathematics and Natural Sciences, University of Lampung. Concentration of the extract used was 0%, 0.1%, 0.3%, 0.5%, 0.7% and 1% with 4 repetitions for each treatment. Furthermore, was laid 20 eggs in each treatment and repetition, so was getten the total number of samples of 480 eggs. Then, was observed number of eggs that did not hatch every 6 hours for three days. At the end of the study, hypothesis test of one-way ANOVA resulted p-value <0.001. In the post hoc Bonferroni analysis was known effective concentration than controls (0%) was 1%.
The results showed a decrease in hatchability of eggs of Aedes aegypti at concentrations of 0.1%, 0.3%, 0.5%, 0.7% and 1% compared to the negative control. The higher the concentration of the extract on the inhibition of hatching eggs will be higher as well. This indicates that garlic extract effective as the ovicide ofAedes aegypti.
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung pada tanggal 3 April 1991, sebagai anak
pertama dari dua bersaudara, pasangan Bapak Berchah Pitoewas dan Ibu Retno
Winarsih.
Pendidikan Sekolah Dasar (SD) diselesaikan di SD Al-Kautsar, Lampung pada
tahun 2003, Sekolah Menengah Pertama (SMP) di SMP Al-Kautsar Bandar
Lampung diselesaikan pada tahun 2006, dan Sekolah Menengah Atas (SMA) di
SMA YP Unila Bandar Lampung pada tahun 2009, dan pada tahun yang sama
penulis diterima sebagai mahasiswa Jurusan Pendidikan Dokter FK UNILA
melalui jalur Mandiri.
Selama menjadi mahasiswa penulis aktif pada organisasi mahasiswa seperti
SANWACANA
Alhamdulillahi Robbil ‘Alamin, puji syukur penulis panjatkan kehadirat Allah SWT, karena atas berkah, rahmat, dan hidayah-Nya skripsi ini dapat terselesaikan.
Skripsi dengan judul “Pengaruh Ekstrak Bawang Putih (Allium sativum L.) sebagai Ovisida Nyamuk Aedes aegypti” ini disusun sebagai salah satu persyaratan untuk memperoleh gelar Sarjana Kedokteran di Program Studi
Pendidikan Dokter Universitas Lampung.
Dalam kesempatan ini penulis mengucapkan terima kasih kepada:
1. Bapak Dr. Sutyarso, M.Biomed., selaku Dekan Fakultas Kedokteran
Universitas Lampung;
2. Ibu Dra. Endah Setyaningrum, M.Biomed., selaku Pembimbing I atas
kesediaannya dan ketelatenannya memberikan bimbingan, bantuan, saran,
dan motivasi kepada penulis dalam penyusunan skripsi ini dari awal hingga
selesai;
3. dr. Syazili Mustofa, selaku Pembimbing II atas kesediaan meluangkan waktu
dan membimbing serta memberikan masukannya hingga penulis
4. dr. Betta Kurniawan, M.Kes., selaku Pembahas atas kesediaan meluangkan
waktu dan memberikan masukan, kritik, dan saran yang membangun dan
bermanfaat bagi penulis dalam menyelesaikan skripsi ini;
5. dr. Agustyas, selaku Pembimbing Akademik yang telah memberikan saran
dan masukkan kepada penulis;
6. Papa dan Mama yang selalu menyebut nama saya dalam doanya,
membimbing, mendukung, dan memberikan yang terbaik;
7. Adik saya (MD Hasabi Ruzain) dan Noviyanti AW yang telah memberikan
doa, semangat dan dukungannya;
8. Seluruh Keluarga besar atas perhatian, dukungan, dan doa yang telah
diberikan;
9. Seluruh Staf Dosen FK Unila atas ilmu yang telah diberikan kepada penulis
untuk menambah wawasan yang menjadi landasan untuk mencapai cita-cita;
10. Seluruh Staf TU, Administrasi, dan Akademik FK Unila, serta pegawai yang
turut membantu dalam proses penelitian dan penyusunan skripsi ini;
11. Seluruh Staf TU, Administrasi, dan Akademik FMIPA Unila, serta pegawai
yang turut membantu dalam proses penelitian dan penyusunan skripsi ini;
12. Teman-teman saya yang merangkap sebagai Tim Bantuan Skripsi, Toto,
Fajar, Wirda dan Tini terima kasih banyak atas bantuannya yang berharga;
13. Bian, Fahmi, Deem yang telah membantu dan menemani selama penelitian;
14. Teman-teman angkatan 2009 atas kekeluargaan yang telah terjalin selama ini,
semangat, bantuan dan kebahagiaan yang telah diberikan;
15. Teman-teman propti; Toto, Deem, Fahmi, Wayan, Angga, dan Kharisma atas
16. Teman-teman KKN desa Hurun yang memberi semangat dalam penyelesaian
skripsi ini;
17. Kakak-kakak dan adik-adik tingkat saya (angkatan 2002–2012) yang sudah memberikan semangat kebersamaan dalam satu kedokteran.
Penulis berharap semoga skripsi ini dapat bermanfaat dan menjadi masukan bagi
yang membacanya. Semoga Allah senantiasa melindungi dan memberi
rahmat-Nya kepada kita. Aamiin.
Bandar Lampung, 21 Juli 2014
Penulis
DAFTAR ISI
Halaman
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
DAFTAR GRAFIK ... vii
I. PENDAHULUAN
A. Latar Belakang ... 1
B. Peumusan Masalah... 3
C. Tujuan Penelitian
1. Tujuan Umum ... 4
2. Tujuan Khusus ... 4
D. Manfaat Penelitian ... 4
E. Kerangka Penelitian
1. Kerangka Teori ... 5
2. Kerangka Konsep ... 6
F. Hipotesis ... 6
II. TINJAUAN PUSTAKA
A. Aedes aegypti
3. MorfologiAedes aegypti... 9
B. Juvenile HormonedanEcdison HormonepadaAedes aegypti 1. SintesisJuvenile Hormone... 17
2.Juvenile Hormonesebagai kontrol pertumbuhan ... 18
3. Hormon Juvenile terhadap Sintesis Vitellogenin... 20
C. Bawang Putih (Allium sativumL.) 1. Taksonomi Bawang Putih ... 22
2. Kandungan Senyawa Bawang Putih ... 22
3. Ekstrak Bawang Putih ... 23
3. Bawang Putih Sebagai Insektisida ... 23
D. Insektisida ... 24
E. Teknik Ekstraksi Senyawa... 26
1. Ekstraksi cair-cair ... 26
2. Maserasi ... 27
3. Ekstraksi Sinambung ... 28
4. Perkolasi ... 29
III. METODE PENELITIAN A. Desain Penelitian ... 30
B. Tempat dan Waktu Penelitian ... 30
C. Populasi dan Sampel ... 30
D. Identifikasi Variabel dan Definisi Operasional Variabel 1. Identifikasi Variabel... 31
2. Definisi Operasional Variabel... 32
F. Prosedur Penelitian
1. Penyediaan Sampel ... 33
2. Pembuatan Ekstrak Bawang Putih ... 33
3. Uji Daya Tetas Telur ... 34
4. Pengamatan ... 35
5. Analisis Data ... 35
6. Diagram Alir Kerja ... 35
G. Analisis Data ... 36
IV. HASIL DAN PEMBAHASAN A. Hasil Penelitian ... 37
B. Pembahasan... 40
V. SIMPULAN DAN SARAN A. Simpulan ... 45
B. Saran ... 45
DAFTAR PUSTAKA ... 46
DAFTAR TABEL
Tabel Halaman
1. Jumlah Sampel yang Digunakan dalam Penelitian ... 24
2. Definisi Operasional ... 25
3. Jumlah Ekstrak Bawang Putih yang Dibutuhkan dalam Penelitian... 27
4. Hasil Uji Normalitas Data Persentase Jumlah Telur Aedes aegypti
yang Tidak Menetas...
5. Hasil analisisOne WayANOVA... 6. Hasil analisis ujipost hocBonferroni dengan konsentrasi 0% (kontrol)
sebagai pembanding...
7. Nilai pH dan suhu yang terukur pada berbagai konsentrasi ekstrak
bawang putih...
8. Hasil pengamatan jumlah telur yang tidak menetas selama tiga hari ... 51
9. Hasil analisis deskriptif jumlah telur Aedes aegypti yang tidak menetas pada berbagai kosentrasi ekstrak bawang putih ...
10. Hasil uji normalitas data Shapiro-Wilk pada berbagai kelompok
kosentrasi ekstrak bawang putih ...
11. Hasil uji varians Levene untuk jumlah telur yang tidak menetas pada
seluruh kelompok konsentrasi ...
DAFTAR GAMBAR
Gambar Halaman
1. Kerangka Teori ... 5
2. Kerangka Konsep ... 6
3. Siklus HidupAedes aegypti... 9
4. Panjang teluraedes aegypti... 10
5. StrukturMicropyles(MP) danOuter Chorionic Cellpada TelurAedes aegypti ... 10
6. Struktur PenunjangMicropylespada TelurAedes aegypti ... 11
7. StrukturExochrionicTelurAedes Aegypti... 13
8. Larva Instar IAedes aegypti... 14
9. Larva Instar IIAedes aegypti ... 14
10. Larva Instar IIIAedes aegypti ... 15
11. Larva Instar IVAedes aegypti ... 15
12. PupaAedes aegypti... 16
13. Biosintesis JH III pada Serangga ... 18
14. Diagram Alir Penelitian ... 35
15. Sisa ekstrak murni bawang putih yang telah di filtrasi ... 57
16. Rotary evaporator yang digunakan untuk menguapkan pelarut etanol ekstrak bawang putih... 57
18. Perbandingan tingkat kejernihan antara kontrol (a) dan ekstrak
1
I. PENDAHULUAN
A. Latar Belakang
Nyamuk Aedes Agypti merupakan vektor virus dengue penyebab penyakit Demam Berdarah Dengue (DBD) terutama di daerah tropis dan subtropis.
Walaupun beberapa spesies dari Aedes sp. dapat pula berperan sebagai
vektor tetapi Aedes aegypti tetap merupakan vektor utama dalam penyebaran penyakit DBD ( Soegijanto, 2006). Peningkatan populasi Aedes aegyptiberhubungan dengan insidensi DBD.
Insidensi DBD meningkat secara dramatis di seluruh dunia dalam beberapa
dekade ini. Mereka terutama tinggal di daerah perkotaan negara-negara
tropis dan subtropis. Diperkirakan saat ini sekitar 50 juta kasus demam
dengue ditemukan setiap tahun, dengan 500.000 kasus memerlukan
penanganan di rumah sakit. Dari kasus di atas, sekitar 25.000 jumlah
kematian terjadi setiap tahunnya (WHO, 2010). Untuk menurunkan
insidensi tersebut diperlukan penanganan yang tepat.
Salah satu cara pemberantasan penyakit DBD adalah dengan pengendalian
2
dapat dilakukan dengan cara menggunakan pestisida, insektisida.
Penggunaan insektisida yang berlebihan dan berulang dapat menimbulkan
dampak yang tidak diinginkan yaitu pencemaran lingkungan dan mungkin
timbul keracunan pada manusia dan hewan. Untuk mengurangi efek
samping dari bahan kimia maka perlu dikembangkan pestisida dari bahan
yang terdapat di alam yang lebih aman untuk manusia dan lingkungan, serta
sumbernya tersedia dalam jumlah yang besar. Pemanfaatan biopestisida
dalam pemberantasan vektor diharapkan mampu menurunkan kasus DBD
(Kardinan, 2004).
Biopestisida yang berupa agen hayati dan bahan nabati merupakan salah
satu alternatif pengendalian yang ramah lingkungan, mudah diaplikasikan
dan tidak berbahaya bagi musuh alami dan serangga menguntungkan
lainnya. Insektisida dari tanaman mudah terurai (terdegradasi) di alam
sehingga tidak meninggalkan residu di tanah, air dan udara. Selain itu
insektisida nabati mempunyai tingkat keamanan yang lebih tinggi bila
dibandingkan dengan menggunakan bahan kimia. (Adebowale, 2006).
Tanaman yang bersifat insektisida biasanya mengandung senyawa bioaktif
seperti terpenoid, fenilpropan, alkaloid, asetogenin, steroid, dan tanin. Uji
toksisitas dari berbagai jenis tanaman terhadap telur dan larva nyamuk telah
banyak dilakukan, seperti kamandrah dan jarak pagar yang mampu
3
Bawang putih mengandung senyawa yang diantaranya adalah alisin yang
bersifat larvasida. Kandungan dari bawang putih lain yang diduga berperan
adalah garlic oil, flavonoid serta saponin. Kandungan alisin dan flavonoid dalam bawang akan mengganggu aktivitas juvenile hormone, sedangkan kandungan saponin dalam bawang putih akan menghasilkan efek ecdycson blocker, dimana pada serangga ecdyson hormone digunakan untuk pertumbuhan larva. (Bloomquist, 2004).
Informasi bawang putih sebagai insektisida masih terbatas, sehingga perlu
dilakukan penelitian tentang ekstrak bawang putih sebagai jenis insektisida
lainnya, seperti ovisida yang menghambat penetasan telur sehingga efektif
dalam menekan perkembangbiakan vektor nyamuk Aedes aegypti. Selain itu, bawang putih merupakan bahan yang mudah didapatkan. Oleh sebab itu,
peneliti tertarik untuk meneliti efektivitas ekstrak Bawang putih sebagai
ovisidaAedes aegypti.
B. Perumusan Masalah
Pengendalian nyamuk Aedes aegypti dengan menggunakan insektisida sintesis memiliki dampak yang tidak diinginkan yaitu pencemaran
lingkungan dan dapat menyebabkan sifat resisten pada vektor. Salah satu
alternatif pengendalian vektor adalah dengan menggunakan biopestisida.
“Apakah ekstrak bawang putih (Allium sativum L.) efektif sebagai ovisida
4
C. Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah
1. Tujuan umum
Mengetahui efektivitas ekstrak bawang putih (Allium sativum L.) sebagai ovisidaAedes aegypti.
2. Tujuan khusus
Mengetahui konsentrasi optimum ekstrak bawang putih (Allium sativum L.) yang efektif sebagai ovisidaAedes aegypti.
D. Manfaat Penelitian
Adapun manfaat dari penelitian ini adalah
1. Bagi ilmu kajian parasitologi, hasil penelitian ini diharapkan dapat
menambah informasi ilmiah mengenai khasiat ekstrak bawang putih
(Allium sativum L.) sebagai ovisida dan dapat digunakan sebagai pengembangan ilmu parasitologi khususnya entomologi dalam lingkup
pengendalian vektor penyebab demam berdarah.
2. Bagi peneliti, memberikan informasi ilmiah tentang pengaruh ekstrak
bawang putih (Allium sativum L.) sebagai ovisida terhadap telur nyamuk
Aedes aegyptidan dapat mengembangkan wawasan keilmuan peneliti. 3. Bagi masyarakat, dapat memberikan informasi awal bahwa ekstrak
5
E. Kerangka Penelitian
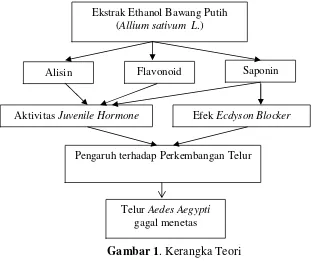
1. Kerangka teori
Bawang putih mengandung senyawa yang diantaranya adalah alisin
yang bersifat larvasida. Kandungan dari bawang putih lain yang diduga
berperan adalah garlic oil, flavonoid serta saponin. Senyawa-senyawa insektisida seperti saponin dan flavonoid berperan sebagai ecdyson blocker dalam metabolism serangga, sehingga proses perubahan telur menjadi larva akan terganggu. Selain itu, ecdyson hormone
diseimbangkan oleh juvenile hormone. Dimana aktivitas juvenile hormoneakan terganggu oleh senyawa trepenoid, flavonoid dan alkaloid, sehingga dapat pula mempengaruhi penetesan telur.
Gambar 1. Kerangka Teori
Ekstrak Ethanol Bawang Putih (Allium sativum L.)
Alisin
TelurAedes Aegypti gagal menetas AktivitasJuvenile Hormone
Pengaruh terhadap Perkembangan Telur Flavonoid Saponin
6
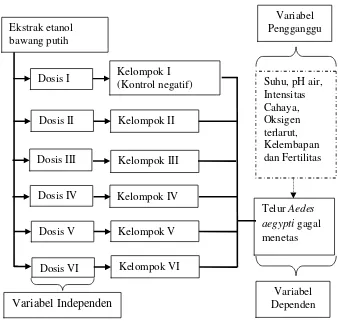
2. Kerangka konsep
Gambar 2. Kerangka Konsep
F. Hipotesis
Ekstraks bawang putih (Allium sativum L.) efektif sebagai ovisida nyamuk
Aedes aegypti.
II. TINJAUAN PUSTAKA
A. Aedes aegypti
1. Aedes aegyptisebagai vektor Demam Berdarah Dengue (DBD)
Aedes aegypti merupakan jenis nyamuk yang dapat membawa virus
dengue penyebab penyakit demam berdarah. Penyebaran jenis ini sangat luas, meliputi hampir semua daerah tropis di seluruh dunia. Aedes aegypti
merupakan pembawa utama (primary vector) dan bersama Aedes albopictus menciptakan siklus persebaran dengue di desa-desa dan perkotaan (Anggraeni, 2011).
Nyamuk ini berpotensi untuk menularkan penyakit demam berdarah
dengue (DBD). DBD adalah suatu penyakit yang ditandai dengan demam
mendadak, perdarahan baik di kulit maupun di bagian tubuh lainnya serta
dapat menimbulkan syok dan kematian. Penyakit DBD ini terutama
menyerang anak-anak termasuk bayi, meskipun sekarang proporsi
penderita dewasa meningkat.
8
Aedes aegypti. Nyamuk betina terinfeksi melalui pengisapan darah dari orang yang sakit.
Tempat perindukanAedes aegyptidapat dibedakan atas tempat perindukan sementara, permanen, dan alamiah. Tempat perindukan sementara terdiri
dari berbagai macam tempat penampungan air (TPA) yang dapat
menampung genangan air bersih. Tempat perindukan permanen adalah
TPA untuk keperluan rumah tangga dan tempat perindukan alamiah
berupa genangan air pada pohon. (Suhendro, 2006)
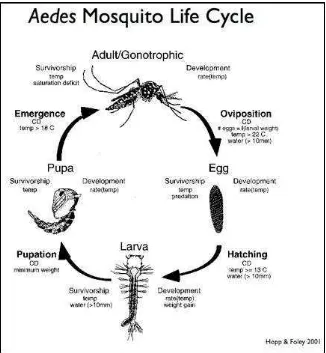
2. Siklus HidupAedes aegypti
Nyamuk Aedes aegypti mengalami metamorfosa sempurna, yaitu dari bentuk telur, jentik, kepompong dan nyamuk dewasa. Stadium telur, jentik,
dan kepompong hidup di dalam air (aquatik), sedangkan nyamuk hidup
secara teresterial (di udara bebas). Pada umumnya telur akan menetas
menjadi larva dalam waktu kira-kira 2 hari setelah telur terendam air.
Nyamuk betina meletakkan telur di dinding wadah di atas permukaan air
dalam keadaan menempel pada dinding perindukannya. Nyamuk betina
setiap kali bertelur dapat mengeluarkan telurnya sebanyak 100 butir. Fase
aquatik berlangsung selama 8-12 hari yaitu stadium jentik berlangsung 6-8
hari, dan stadium kepompong (pupa) berlangsung 2-4 hari. Pertumbuhan
mulai dari telur sampai menjadi nyamuk dewasa berlangsung selama
9
Gambar 3. Siklus HidupAedes aegypti(Sumber : Hopp & Foley, 2001)
3. MorfologiAedes aegypti I. Stadium Telur
Menurut Herms (2006), telur nyamuk Aedes aegypti berbentuk ellips atau oval memanjang, berwarna hitam, berukuran 0,5-0,8 mm, dan
tidak memiliki alat pelampung. Nyamuk Aedes aegypti meletakkan telur-telurnya satu per satu pada permukaan air, biasanya pada tepi air
di tempat-tempat penampungan air bersih dan sedikit di atas
10
tempat kering (tanpa air) dapat bertahan sampai 6 bulan. Telur-telur
ini kemudian akan menetas menjadi jentik setelah sekitar 1-2 hari
terendam air (Herms, 2006).
Telur Aedes aegypti diperkirakan memiliki berat 0,0010 - 0,015 mg dan (Astuti dkk ,2004). Telur Aedes aegypti tidak memiliki pelampung. Pada permukaan luar dinding sel tersebar suatu struktur
sel yang disebutouter chorionic cell(Suman dkk, 2011).
Gambar 4.Panjang teluraedes aegypti.(Sumber: Suman dkk 2011).
11
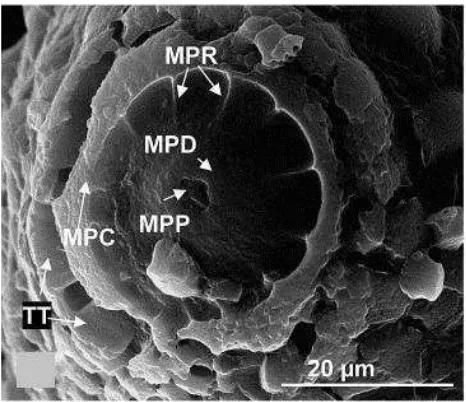
Pada salah satu ujung telur terdapat poros yang disebut dengan
micropyles. Micropyles berfungsi sebagai tempat masuknya
spermatozoid ke dalam telur sehingga dapat terjadi pembuahan. Pada
micropyles terdapat struktur-struktur penting yang menunjang fungsinya tersebut, yaitu micropylar corolla, micropylar disc, micropylar pore, micropylar ridge dan tooth-like tubercle (Suman dkk, 2011).
Gambar 6. Struktur PenunjangMicropylespada TelurAedes aegypti. MPC, micropylar corolla;MPD, micropylar disc;MPP, micropylar pore;MPR, micropylar ridge;TC, central tubercle;TP, peripheral tubercle;TT, tooth-like tubercle.
(Sumber: Suman dkk 2006).
Meskipunchoriontelur nyamuk Aedes aegyptiadalah struktur protein padat, namun rentan terhadap pengeringan dan unresistant terhadap deterjen atau zat pereduksi. Misalnya, ketika telur dipindahkan ke
lingkungan yang sangat kering segera setelah oviposisi, akan cepat
12
Pada dasarnya semua proteinchorionakan terlarut ketika telur matang diletakkan dalam larutan yang mengandung agen pereduksi
kuat. Namun, dalam lingkungan yang lembab, chorion akan menjadi sangat tahan terhadap kekeringan dalam waktu 2 jam setelah
oviposisi, sebuah proses yang disebut chorion hardening. Protein merupakan komponen utama dalamchoriondan mereka menjadi tidak larut setelah proses chorion hardeningatau “pengerasan korion”. Hal ini kemungkinan disebabkan oleh modifikasi struktural protein
chorion yang mengarah ke insolubilization (Junsuo dan Jianyong, 2006).
Studi ultrastruktur mengungkapkan bahwa ada dua lapisan dalam
chorion nyamuk Aedes aegypti, yaitu endochorion dan
exochorion. Pada nyamuk,endochorion adalah lapisan elektron padat homogen dan exochorion terdiri dari lapisan pipih dengan tubecle
menonjol (Junsuo dan Jianyong, 2006).
Dalam waktu 1-2 jam setelah peletakan telur, lapisan endokorion akan
berubah dari lunak menjadi keras dan gelap serta kadang menjadi
impermeable. Telur dari nyamukAedes aegyptipada saat pertama kali diletakkan berwarna putih, kemudian berubah menjadi gelap sampai
hitam dalam waktu 12-24 jam. Perubahan warna pada telur terjadi
karena adanya lapisan endokorion yang merupakan lapisan pelindung
13
Tuberclepada lapisanexochorion terdiri daritubercle centraldan
tubercle perifer.Tubercle central dikelilingi olehturbercle perifer
yang membentuk bidang heksagonal yang dihubungkan oleh
exochorionic network(suman dkk, 2011).
Gambar 7. StrukturExochrionicTelurAedes Aegypti.
TC, Central Tubercle; TP, Peripheral Tubercle; EN,
Exochorion Network. (Sumber: Suman dkk 2011).
II. Stadium Larva (Jentik)
Menurut Herms (2006), larva nyamuk Aedes aegypti mempunyai ciri khas memiliki siphon yang pendek, besar dan berwarna hitam. Larva
ini tubuhnya langsing, bergerak sangat lincah, bersifat fototaksis
negatif dan pada waktu istirahat membentuk sudut hampir tegak lurus
dengan permukaan air. Larva menuju ke permukaan air dalam waktu
kira-kira setiap ½-1 menit, guna mendapatkan oksigen untuk
14
Berdasarkan data dari Depkes RI (2005), ada empat tingkat (instar)
jentik sesuai dengan pertumbuhan larva tersebut, yaitu:
a. Larva instar I; berukuran paling kecil yaitu 1-2 mm atau satu
[image:30.595.264.419.250.402.2]sampai dua hari setelah telur menetas, duri-duri (spinae) pada dada belum jelas dan corong pernapasan pada siphon belum menghitam (Hoedojo, 1993).
Gambar 8. Larva Instar IAedes aegypti(Sumber: Gama, Z.P.,et al., 2010)
b. Larva instar II; berukuran 2,5-3,5 mm berumur dua sampai tiga hari
setelah telur menetas, duri-duri dada belum jelas, corong
pernapasan sudah mulai menghitam (Hoedojo, 1993).
[image:30.595.270.414.527.686.2]15
c. Larva instar III; berukuran 4-5 mm berumur tiga sampai empat hari
setelah telur menetas, duri-duri dada mulai jelas dan corong
[image:31.595.268.415.167.340.2]pernapasan berwarna coklat kehitaman (Hoedojo, 1993).
Gambar 10. Larva Instar IIIAedes aegypti(Sumber: Gama, Z.P.,et al., 2010)
d. Larva instar IV; berukuran paling besar yaitu 5-6 mm berumur
empat sampai enam hari setelah telur menetas dengan warna kepala
gelap (Hoedojo, 1993).
[image:31.595.273.412.478.639.2]16
III. Stadium Pupa
Pupa berbentuk koma, gerakan lambat, sering ada di permukaan air.
Pada pupa terdapat kantong udara yang terletak diantara bakal sayap
nyamuk dewasa dan terdapat sepasang sayap pengayuh yang saling
menutupi sehingga memungkinkan pupa untuk menyelam cepat dan
mengadakan serangkaian jungkiran sebagai reaksi terhadap rangsang.
Bentuk nyamuk dewasa timbul setelah sobeknya selongsong pupa
oleh gelembung udara karena gerakan aktif pupa. Pupa bernafas pada
permukaan air melalui sepasang struktur seperti terompet yang kecil
[image:32.595.267.416.360.502.2]pada toraks (Aradilla, 2009).
Gambar 12. PupaAedes aegypti(Sumber: Zettel, 2010)
IV. Nyamuk dewasa
NyamukAedes aegypti dewasa berukuran lebih kecil daripada ukuran nyamuk rumah (Culex quinquefasciatus) (Djakaria, 2006). Nyamuk
Aedes aegyptidikenal dengan sebutan black white mosquitoatau tiger mosquito karena tubuhnya memiliki ciri yang khas, yaitu dengan adanya garis-garis dan bercak-bercak putih keperakan di atas dasar
17
dua garis lengkung yang berwarna putih keperakan di kedua sisi
lateral dan dua buah garis lengkung sejajar di garis median dari
punggungnya yang berwarna dasar hitam (lyre shaped marking) (Soegijanto, 2006).
B. Juvenile HormonedanEcdysone HormonepadaAedes aegypti
1. SintesisJuvenile Hormone(JH)
Moulting dan metomorfosis serangga diatur oleh dua hormon yaitu
ecdysteroid dan juvenile hormone(JH) (Gilbertet al., 1996). Ecdysteroid
adalah golongan dari steroid polyhydroxylated yang merupakan hormon
moulting. Pada sebagian besar larva serangga, kelenjar prothoracic akan mensintesis dan mengeluarkan ecdysone dan kemudian mengalami hidroksilasi menjadi bentuk 20-hydroxyecdysone. Bentuk
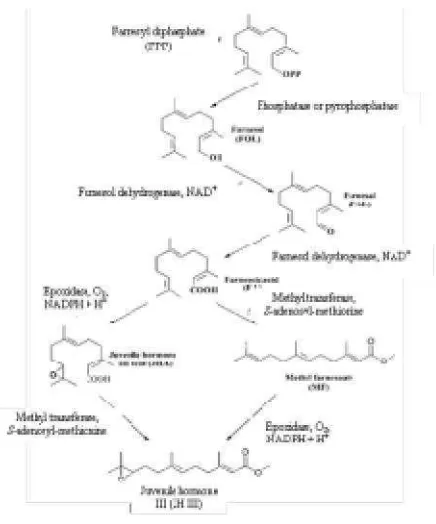
20-hydroxyecdysone akan diterima oleh target seperti epidermis yang selanjutnya akan timbul pengaruh hormon (Smith 1985, Gilbertet al,.. 2002). JH merupakan sesquiterpene yang disintesis dan disekresikan oleh
corpora allata (Kou & Chen, 2000). Selama perkembangan serangga,
ecdysteroiddan JH akan mempengaruhi perubahan larva dari satu tahap ke tahap berikutnya.
JH merupakan kelompok sesquiterpenoids yang mengatur banyak aspek dari fisiologi serangga, seperti pertumbuhan dan perkembangan serangga,
reproduksi, diapause, dan polyphenism. Pada serangga JH merupakan
corpora allat
pertumbuhan da
JH disintesis
di samping ot
[image:34.595.206.424.247.509.2]proses produksi
Gambar 13
2. Juvenile Hor
Metamorfosis
peranan yang
JH berperan d
dimulai dari se
allatotropin y
allata (CA) dan mempunyai peranan yang b buhan dan perkembangan serangga (Martinez, 2007
sis dan dilepaskan dari sepasang kelenjar endok
otak yang disebut corpora allata. JH juga oduksi telur pada serangga betina.
ar 13.Biosintesis JH III pada Serangga (Sumber
ormoneSebagai Kontrol Pertumbuhan
osis serangga dikendalikan oleh JH. Regulasi
g penting dalam mengendalikan metamorfosis.
n dalam mengatur pertumbuhan dan perkemba
i sel neurosecretory yang ada pada otak aka n yang digunakan untuk menstimulasi corpora
18
besar di dalam
2007).
ndokrin yang terletak
uga penting untuk
ber: Bede, 2001)
si JH mempunyai
osis. Proses dimana
bangan serangga,
kan menghasilkan
19
memproduksi JH (Liet al., 2005). Proses selanjutnya JH akan dikeluarkan oleh corpora allata ke dalam hemolymph. JH yang berada pada
hemolymphakan diikat olehjuvenile hormon binding protein(JHBP) yang berfungsi untuk memudahkan larut dalam hemolymph dan didistribusikan pada sel epidermis. JHBP kemudian akan terdistribusi pada sel epidermis
yang kemudian akan terjadi moulting. Konsentrasi JH dalam hemolymph
menentukan apakah larva akan moulting pada fase berikutnya atau akan
berubah bentuk menjadi pupa demikian juga menentukan apakah pupa
akan berubah bentuk menjadi dewasa. Jika dalam hemolymph larva konsentrasi JH tinggi maka larva akan melakukan moulting tetapi jika
konsentrasi JH rendah sedangkan hormon 20-hydroxyecdysone rendah makan akan memberi signal larva untuk berubah menjadi pupa. Proses
pengaturan JH pada serangga dapat dilihat pada gambar 3 (Gilbertet al.,1980).
Eweret al.(1997) memberi gambaran bagaimana pengaktifan hormon mempengaruhi perilaku yaitu proses ecdysis larvaManduca sexta. Ecdysis merupakan pergantian kulit dari kulit lama pada saat moulting, proses ini
tergantung positive feedback antara hormon eclosion dan JH. Pelepasan hormon neuropeptide dari sel neurosecretory dalam sistem syaraf pusat menyebabkan peripheral yang terletak pada kelenjar epitrakheal
20
3. Hormon Juvenile terhadap Sintesis Vitellogenin
Perkembangan dan reproduksi tergantung dari JH dan ecdysteroids. Pada sebagian besar serangga, JH merupakan hormon yang berperan besar
dalam proses regulasi sintesis dan pengambilan vitellogenin, tetapi faktor
ecdysteroidjuga diperlukan dalam proses ini.
Martinez, (2007) juga melaporkan bahwa JH merupakan hormon yang
mempunyai peranan penting dalam mengatur perkembangan
previtellogonic ovarian. Bukti yang menunjukkan bahwa JH mengatur perkembangan previtellogonic ovarianyaitu penelitian yang dilakukan oleh Martinez, (2007) terhadap nyamuk. JH di dalamAedes aegyptijumlahnya sedikit pada saat eclosion, dan meningkat pada hari pertama setelah imago muncul. Jumlah JH yang naik pada saat awal sangat
penting untuk menyempurnakan organ reproduksi serangga betina.
Kecepatan biosintesis JH oleh corpora allata secara in vitro
mencerminkan tingkat JH dalam nyamuk, biosintesis JH sangat rendah
pada serangga betina baru yang muncul dan meningkat drastis selama 24
jam setelah eclosion. Aktivitas corpora allata nyamuk dikendalikan oleh faktor-faktor yang terdapat di kepala (Li et al., 2005), dan signal nutrisi akan mempengaruhi aktivasi sintesis JH atau menghambat sintesis JH..
Pemenggalan kepala dalam 1 h dariemergenceatau penghilangan CA setelah eclosion mencegah pertumbuhanovarian previtellogenic.
Menurut Hagedorn, (1997 dalam Caroci, 2004) mekanisme JH
21
neurosecretorypada otak akan menghasilkan allatotropin yang selanjutnya memerintah corpora allata untuk menghasilkan JH. JH yang sudah dihasilkan oleh corpora allata akan menstimuli fat body dari incompetence menjadi competence untuk menghasilkan vitellogenin. Pada
kondisi ini JH hanya menstimuli fat body menjadi kompeten (siap untuk menghasilkan vitellogenin), JH tidak memerintah fat body untuk menghasilkan vitellogenin. JH juga mempengaruhi ovary dari immature
ovary menjadi ovary yang mature tetapi inaktif (keadaan ovary siap untuk
menjalankan perintah berikutnya). JH juga mempengaruhi perilaku mating
dan feeding serangga, setelah nyamuk menghisap darah maka otak akan
menyuruh neurosecretory sel untuk menghasilkan Egg development neurohormone (EDNH) dan selanjutnya akan dilepaskan dalam hemolymp. EDNH dalam hemolym kemudian akan diterima oleh ovary
yang inaktif (resting stage ovary) dan menstimuli sel folikel untuk
menghasilkan ecdysteroid. Ecdysteroid selanjutnya akan memerintah fat body yang sudah kompeten untuk menghasilkan vitellogenin. Vitellogenin kemudian akan diambil oleh ovary untuk menyusun kuning telur, dan
22
C. Bawang Putih (Allium sativum L.) 1. Taksonomi Bawang Putih
Menurut Takhtajan, taksonomi bawang putih adalah sebagai berikut
Kelas :Liliopsida
Subkelas :Liliidae
Superordo :Liliianae
Ordo :Amaryllidales
Famili :Alliaceae
Subfamili :Alliodeae
Suku :Allieae
Genus :Allium
Spesies :Allium sativum L.
2. Kandungan Senyawa Bawang Putih
Bawang putih mengandung senyawa-senyawa seperti S-allilsistein, S-allil
merkaptosistein, saponin, N-fruktosil arginin, g-glutamil-S-allil-L-sistein
dan S-allil-L-sistein sulfoksida (aliin), meetiin,
(1)-S-(trans-1-propenil)-L-sistein sulfoksida, dan sikloalliin (13), serta alliinase. Melalui pengolahan
semua jenis alliin kecuali sikloalliin menjadi senyawa tiosulfinat (allisin).
Allisin yang ada akan terdegradasi menjadi diallilsulfida (DAS),
diallildisulfida (DADS), diallil trisulfida, metilallil sulfida, metilallil
trisulfida, 2-vinil-4H-1, 3-dithiin, 3-vinil-4H-1, 2-thiin, dan (E,Z)-ajoene
23
3. Ekstrak Bawang Putih
Yang dimaksud dengan ekstrak bawang putih adalah sebuah sediaan yang
mengandung zat aktif atau konsentrat (ekstrak) sebuah bahan, dimana
bahan tersebut berasal dari sebuah tanaman bawang yang umbinya terbagi
menjadi beberapa siung dan memiliki wangi dan rasa yang tajam (bawang
putih/Allium sativum L.) (Dorland, 2007).
4. Bawang Putih sebagai Insektisida
Kandungan senyawa yang sudah diketemukan pada bawang putih
diantaranya adalah ”allicin” dan ”sulfur amonia acid alliin”. Sulfur amonia acid alliin ini oleh enzim allicin lyase diubah menjadi piruvic acid, amonia, dan allicin anti mikroba. Selanjutnya allicin mengalami
perubahan menjadi ”diallyl sulphide”. Senyawaallicindandiallyl sulphide
inilah yang memiliki banyak kegunaan dan berkhasiat obat. Allicin dan turunannya juga bersifat larvasida.
Mekanisme insektisida dari bawang putih diduga diperankan oleh zat aktif
yang terkandung di dalamnya. Kandungan allicin dan dialil sulphide
memiliki sifat bakterisida dan bakteristatik. Allicin bekerja dengan cara menggangu sintesis membran sel parasit sehingga parasit tidak dapat
24
Kandungan dari bawang putih lain yang diduga berperan adalah garlic oil
dan flavonoid. Garlic oil bekerja dengan mengubah tegangan permukaan air sedangkan flavonoid bekerja sebagai inhibitor pernapasan.Flavonoid
diduga mengganggu metabolisme energi di dalam mitokondria dengan
menghambat sistem pengangkutan elektron. Adanya hambatan pada sistem
pengangkutan elektron akan menghalangi produksi ATP dan menyebabkan
penurunan pemakaian oksigen oleh mitokondria (Bloomquist, 2004).
D. Insektisida
Insektisida adalah pestisida khusus yang digunakan untuk membunuh
serangga dan invertebrata lain. Secara harfiah insektisida berarti pembunuh
serangga, berasal dari Bahasa Latin “cida” yang berarti pembunuh.
Berdasarkan sifat dan cara memperolehnya insektisida dibagi menjadi
insektisida anorganik dan insektisida organik. Pada umumnya insektisida
modern adalah insektisida organik dan insektisida ini dibagi menjadi
insektisida organik alami dan buatan. Insektisida organik alami diperoleh
dengan cara penyulingan zat-zat alami. Insektisida ini terdiri dari insektisida
botanis yaitu yang diperoleh dari bahan tumbuhan dan insektisida mineral
yang diperoleh dari penyulingan minyak bumi. Metode penggolongan
insektisida yang lain adalah berdasarkan sifat kimianya. Kelas senyawa kimia
25
1. Ovisida Botani
Ovisida merupakan salah satu jenis insektisida. Ovisida berasal dari kata
latin ovum yang berarti telur dan cide yang berrmakna “pembunuh”.
Ovisida merupakan salah satu golongan insektisida yang mekanisme
kerjanya membunuh atau menghambat perkembangbiakan telur (Hoedjojo,
2003).
Salah satu contoh ovisida alami adalah ovisida botani, yaitu insektisida
yang bahan aktifnya berasal dari tumbuhan atau bagian tumbuhan
seperti akar, daun, batang atau buah. Bahan-bahan ini diolah menjadi
berbagai bentuk, antara lain bahan mentah berbentuk tepung, ekstrak atau
resin yang merupakan hasil pengambilan cairan metabolit sekunder dari
bagian tumbuhan atau bagian tumbuhan dibakar untuk diambil abunya dan
digunakan sebagai ovisida (Novizan, 2002).
2. Mekanisme Kerja Ovisida
Proses penghambatan terhadap daya tetas telur Aedes aegypti diduga terjadi karena masuknya zat aktif insektisida ke dalam telur melalui proses
difusi pada bagian permukaan cangkang melalui titik-titik poligonal yang
terdapat pada seluruh permukaan telur serangga tersebut. Masuknya zat
aktif insektisida disebabkan potensial insektisida dalam air yang berada di
lingkungan luar telur lebih tinggi (hipertonis) dari pada potensial air yang
terdapat di dalam telur (hipotonis). Masuknya zat aktif insektisida ke
dalam telur akan mengganggu proses metabolisme dan menyebabkan
26
E. Teknik Ekstraksi Senyawa
Ekstraksi adalah proses penarikan komponen atau zat aktif suatu simplisia
dengan menggunakan pelarut tertentu. Pemikiran metode ekstraksi senyawa
bukan atom dipergunakan oleh beberapa faktor, yaitu sifat jaringan tanaman,
sifat kandungan zat aktif serta kelarutan dalam pelarut yang digunakan.
Prinsip ekstraksi adalah melarutkan senyawa polar dalam pelarut polar
dan senyawa nonpolar dalam senyawa non polar. Secara umum ekstraksi
dilakukan secara berturut-turut mulai dengan pelarut non polar (n-heksan),
lalu pelarut kepolarannya menengah (diklor metan atauetilasetat) kemudian
pelarut bersifat polar (metanol atau etanol) (Harborne, 1987).
Ekstraksi digolongkan ke dalam dua bagian besar berdasarkan bentuk
fase yang diekstraksi yaitu ekstraksi cair-cair dan ekstraksi cair padat,
ekstraksi cair padat terdiri dari beberapa cara yaitu maserasi, perkolasi dan
ekstraksi sinambung (Harborne, 1987).
1. Ekstraksi Cair–Cair
Ekstraksi cair-cair diperlukan untuk mengekstraksi senyawa glikosida
yang umumnya polar (aglikon berikatan dengan gula monosakarida dan
disakarida). Ekstraksi cair-cair untuk glikosida biasanya dilakukan
terhadap ekstrak etanol atau metanol awal. Ekstrak awal ini dilarutkan
dalam air kemudian diekstraksi dengan etil asetat dan n-butanol. Glikosida
27
Selain itu, ekstraksi cair-cair dilakukan terhadap reaksi awal untuk
menghilangkan lemak dan ekstrak tersebut jika bagian tumbuhan yang
diekstraksi belum dihilangkan lemaknya pada ekstrak awal (Harborne,
1987).
2. Maserasi
Metode ekstraksi umum digunakan dalam mengisolasi senyawa metabolit
sekunder adalah maserasi (penggunaan pelarut organik). Maserasi
merupakan proses perendaman sampel dengan pelarut organik dengan
beberapa kali pengocokan atau pengadukan dalam temperatur ruangan.
Proses ini sangat menguntungkan karena dengan perendaman sampel tanaman akan
mengakibatkan pemecahan dinding sel dan membran sel akibat perbedaaan
tekanan antara di dalam sel dan di luar sel sehingga metabolit sekunder
yang ada dalam sitoplasma akan terlarut dalam pelarut organik dan
ektraksi senyawa akan sempurna karena dapat diatur lama perendaman
yang dilakukan. Pemilihan pelarut dalam proses maserasi akan
memberikan efektifitas yang tinggi dalam memperhatikan kelarutan
senyawa bahan alam dalam pelarut tersebut. Secara umum, pelarut
metanol merupakan pelarut yang paling banyak digunakan dalam proses
isolasi senyawa organik bahan alam karena dapat melarutkan golongan
metabolit sekunder (Darwis, 2000;).
Hasil yang diperoleh berupa ekstrak kasar yang telah diuapkan pelarutnya
28
terlarut dalam pelarut yang akan digunakan berada dalam ekstrak kasar
tersebut. Selanjutnya ekstrak kasar tersebut akan dapat dipisahkan
berdasarkan komponen-komponen dengan metode fraksinasi partisi
dengan menggunakan corong pisah.
3. Ekstraksi Sinambung
Ekstraksi sinambung dilakukan dengan menggunakan alat Soxhlet. Pelarut
penyair yang ditempatkan di dalam labu akan menguap ketika dipanaskan,
melewati pipa samping alat Soxhlet dan mengalami pendinginan saat
melewati kondensor. Pelarut yang telah berkondensasi tersebut akan jatuh
pada bagian dalam alat Soxhlet yang bersimplisia dibungkus kertas saring
dan menyisiknya hingga mencapai bagian atas tabung sifon. Seharusnya
seluruh bagian linarut tersebut akan tertarik dan ditampung pada labu
tempat pelarut awal. Proses ini berlangsung terus menerus sampai
diperloleh hasil ekstraksi yang dikehendaki (Harborne, 1987).
Keuntungan ekstraksi sinambung adalah pelarut yang digunakan lebih
sedikit dan pelarut murni sehingga dapat menyaring senyawa dalam
simplisia lebih banyak dalam waktu lebih singkat dibandingkan dengan
maserasi atau perkolasi. Kerugian cara ini adalah tidak dapat digunakan
29
4. Perkolasi
Perkolasi dilakukan dengan cara dibasahkan 10 bagian simplisia dengan
derajat halus yang cocok, menggunakan 2,5 bagian sampai 5 bagian cairan
penyari dimasukkan dalam bejana tertutup sekurang-kurangnya 3 jam.
Massa dipindahkan sedikit demi sedikit ke dalam perkolator, ditambahkan
cairan penyari. Perkolator ditutup dibiarkan selama 24 jam, kemudian kran
dibuka dengan kecepatan 1 ml permenit, sehingga simplisia tetap
terendam. Filtrat dipindahkan ke dalam bejana, ditutup dan dibiarkan
30
III. METODE PENELITIAN
A. Desain Penelitian
Penelitian ini termasuk jenis penelitian eksperimental laboratorium, dengan
menggunakan Rancangan Acak Lengkap (RAL). Perlakuan yang diberikan
adalah dengan pemberian berbagi konsentrasi ekstrak bawang puith dengan
pengulangan sebanyak 4 kali.
B. Tempat dan Waktu Penelitian
Penelitian efektivitas ekstrak bawang putih (Allium sativum L.) sebagai ovisida Aedes aegypti ini dilakukan di Laboratorium Zoologi, Jurusan
Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas
Lampung. Sedangkan pembuatan ekstrak bawang putih (Allium sativum L.) dilakukan di Laboratorium Kimia Dasar, Jurusan Kimia, Fakultas Matematika
dan Ilmu Pengetahuan Alam, Universitas Lampung. Keseluruhan penelitian
dilakukan pada bulan November 2013.
C. Populasi dan Sampel
Populasi yang digunakan dalam penelitian ini adalah telur instar III Aedes aegypti. Telur nyamuk ini diperoleh dari Loka Litbang P2B2 (Penelitian dan Pengembangan Pemberantasan Penyakit Bersumber Binatang) Ciamis dalam
31
Sampel yang digunakan berdasarkan acuan WHO (2005), yaitu untuk setiap
perlakuan dipakai jumlah sampel 20-30 telur dengan pengulangan sebanyak
4-6 kali. Akhirnya didapatkan jumlah total sampel 480 telur dengan rincian tabel
[image:47.595.150.506.228.408.2]berikut.
Tabel 1. Jumlah Sampel yang Digunakan dalam Penelitian
Perlakuan
Jumlah Telur X Jumlah
Pengulangan Total
Kontrol (-): 0% 20 telur x 4 80 telur
Perlakuan I: 0,1% 20 telur x 4 80 telur
Perlakuan II: 0,3% 20 telur x 4 80 telur
Perlakuan III: 0,5% 20 telur x 4 80 telur
Perlakuan IV: 0,7% 20 telur x 4 80 telur
Perlakuan V: 1% 20 telur x 4 80 telur
Jumlah total telur yang dipakai dalam penelitian
480 telur
D. Identifikasi Variabel dan Definisi Operasional Variabel
1. Identifikasi Variabel
a. Variabel Independen
Berbagai konsentrasi ekstrak bawang putih (Allium sativum L.) dengan enam taraf konsentrasi yaitu 0%, 01%, 0,3%, 0,5%, 0,7% dan 1%
b. Variabel Dependen
Jumlah telur yang tidak berhasil menetas.
c. Variabel Pengganggu
Suhu media, pH media, intensitas cahaya, kandungan oksigen terlarut,
kelembaban udara dan fertilitas telur. Pada penelitian dilakukan
pengukuran pH dan suhu media untuk memantau pengaruh variable
32
2. Definisi Operasional Variabel
Untuk memudahkan pelaksanaan penelitian dan agar penelitian tidak
[image:48.595.115.504.212.625.2]menjadi terlalu luas maka dibuat definisi operasional sebagai berikut.
Tabel 2.Definisi Operasional
Variabel Definisi Cara Ukur Skala Berbagai konsentrasi ekstrak bawang putih (Allium sativum L.) Ekstrak Bawang putih yang di encerkan untuk mendapatkan berbagai konsentrasi ekstrak yang diinginkan dalam penelitian Menggunakan Rumus: M1V1=M2V2
V1= Volume ekstrak yang akan di encerkan (ml)
M1= Konsentrasi ekstrak bawang putih yang tersedia (100%)
V2= Volume larutan (air+ekstrak) yang diinginkan (200ml)
M2= Konsentrasi ekstrak bawang putih yang akan dibuat (%), yaitu 0; 0,1; 0,3; 0,5; 0,7; dan 1% =
konsentrasi sesudah diencerkan
Ordinal
TelurAedes aegypti yang tidak menetas
Telur tidak menjadi larva setelah diletakkan di dalam media air
Hitung jumlah telur yang tidak menetas tiap perlakuan dan pengulangan setiap 6 jam sekali selama 3 hari pengamatan
Rasio
E. Alat dan Bahan
Alat yang digunakan dalam penelitian ini antara lain timbangan yang
33
maserasi bawang putih, rotary evaporator digunakan untuk mendapatkan ekstrak bawang putih, gelas plastik 250 ml yang digunakan sebagai wadah
untuk meletakkan telur dan media, pipet tetes yang digunakan untuk
mengambil ekstrak bawang putih dari gelas ukur, termometer yang digunakan
untuk mengukur suhu media, dan pH stick yang digunakan untuk mengukur
nilai keasaman pada media. Bahan yang digunakan adalah ekstrak bawang
putih 100%, telur Aedes aegypti dari strain Liverpool F‒ 48, etanol 96% dan
aquades sebagai pelarut.
F. Prosedur Penelitian
1. Penyediaan Sampel
Telur nyamukAedes aegyptiF-48 strain Liverpool yang digunakan kali ini diperoleh dari ruang insektarium loka Litbang P2B2 Ciamis, Jawa Barat.
2. Pembuatan Ekstrak Bawang Putih
Ekstrak bawang putih dibuat dengan ekstraksi maserasi menggunakan
pelarut etanol 96%. Bawang putih yang telah didapat kemudian
dibersihkan dengan menggunakan air kemudian dicacah halus atau
diblender (tanpa air). Setelah diblender potongan bawang putih
dikeringkan dengan cara dijemur. Setelah kering, timbang potong bawang
putih seberat 200g kemudian potongan bawang putih direndam selama 24
jam di dalam ethanol 96% sebanyak 1000 ml untuk membuat larutan stok.
Setelah direndam selanjutnya bahan tersebut disaring sehingga diperoleh
34
Untuk membuat berbagai konsentrasi yang diperlukan dapat menggunakan
rumus:
Keterangan:
V1 = volume larutan mula-mula (ml)
M1 = konsentrasi mula-mula (%)
V2 = volume larutan sesudah diencerkan (ml)
[image:50.595.159.513.351.520.2]M2 = konsentrasi sesudah diencerkan (%)
Tabel 3. Jumlah Ekstrak Bawang Putih yang Dibutuhkan pada Penelitian
M1 V2 M2 1 =
. Pengulangan
(V1 x 4)
100% 200 ml 0,1% 0,2 ml 0,8 ml
100% 200 ml 0,3% 0,6 ml 2,4 ml
100% 200 ml 0,5% 1,0 ml 4,0 ml
100% 200 ml 0,7% 1,4 ml 5,6 ml
100% 200 ml 1% 2,0 ml 8,0 ml
Total 20,8 ml
3. Uji daya tetas telur
- Dilakukan untuk mengetahui efektivitas dari ekstrak Bawang putih
(Allium sativum L.) sebagai ovisida dengan konsentrasi ekstrak yaitu 0,1%, 0,3%, 0,5%, 0,7% dan 1% serta 0% sebagai kontrol.
- Dimasukkan telur Aedes aegypti ke dalam gelas plastic berukuran 250 ml yang telah berisi 200 ml campuran air dan ekstrak bawang putih
35
4. Pengamatan
Pengamatan untuk efektivitas ekstrak bawang putih dilakukan setiap 6 jam
sekali sampai hari ketiga. Parameter yang diamati adalah jumlah telur yang
tidak menetas menjadi larva.
5. Analisis data
Jumlah telur yang tidak menetas menjadi larva akan diolah dan dianalisis
dengan uji hipotesis one way ANOVA menggunakan program komputer untuk mengolah data.
6. Diagram Alir Kerja
Untuk memperjelas proses penelitian, maka disajikan diagram alur
[image:51.595.116.548.421.687.2]penelitian sebagai berikut.
Gambar 14. Diagram Alir Penelitian
Ekstrak Bawang Putih
Analisis Konsentrasi
0%
Konsentrasi 0,1%
Konsentrasi 0,3%
Konsentrasi 0,5%
Konsentrasi 0,7%
Konsentrasi 1%
Kelompok I Kelompok II Kelompok III Kelompok IV Kelompok V Kelompok IV
Setiap kelompok perlakuan dilakukan dengan empat kali pengulangan
36
G. Analisis Data
Data yang diperoleh di uji analisis statistik menggunakan program pengolah
data di komputer.Data hasil penelitian dianalisis secara statistik menggunakan
uji analisis one wayANOVA. Berikut adalah langkah-langkah melakukan uji
analisisone wayANOVA
1. Memeriksa syarat uji parametik one way ANOVA untuk lebih dari 2 kelompok tidak berpasangan:
a. Distribusi data harus normal (wajib);
b. Varians data harus sama;
2. Jika tidak memenuhi syarat, maka akan diupayakan melakukan
transformasi data supaya distribusi menjadi normal dan varians sama;
3. Jika variable hasil transformasi tidak memenuhi syarat, maka akan dipilih
uji nonparametric Kruskal-Wallis;
4. Jika pada uji one way ANOVA atau Kruskal-Wallis menghasilkan nilai p<0,05 (hipotesis dianggap bermakna), dilanjutkan dengan melakukan
45
V. SIMPULAN DAN SARAN
A. Simpulan
1. Simpulan Umum
Pemberian ekstrak bawangputih(Allium sativumL.) efektif sebagai ovisida
Aedes aegypti.
2. Simpulan Khusus
Konsentrasi ekstrak bawangputih (Allium sativumL.)yang paling efektif dalam menghambat perkembangan telurAedes aegypti menjadi larva instar 1adalahkonsentrasi 1% dengan rerata jumlah telur yang tidak menetas
19,25±0,957.
B. Saran
Dari hasil penelitian peneliti menyarankan agar:
1. Perlu dilakukan penelitian lebih lanjutmengenai pengaruhekstrak bawang
putih (Allium sativumL.) sebagai ovisida terhadap spesies-spesies nyamuk lainnya yang berperan sebagai vektor penyakit.
46
Daftar Pustaka
Adebowale, A. 2006. Chemical composition and insectisidal properties of the underutilized Jatropha curcas seed oil. African Journal Biotechnology.5. Amagase, H. 2006. Clarifying the Real Bioactive Constituent of Garlic. The
Journal of Nutrition 136.
Ansel, H.C. 2005. Pengantar Bentuk Sediaan Farmasi. Edisi keempat. UI Press. Jakarta.
Araujo, M., Goretti, dan I. Cassandra. 2006.Effect Of Stalk And Leaf Ekstract From Euphorbiaceae Species On Aedes aegypti (Diptera, Culicidae) Larva. Rev. Inst. Med. Trop. S. Paulo.
Astuti, E.P. 2008. Efektivitas Minyak Biji Kamandrah (Croto tiglium) dan jarak Pagar (Jatropha curcas) Sebagai Larvasida, Anti-Oviposisi dan Ovisida Nyamuk Aedes aegypti dan Aedes Albopictus. Tesis Entomologi Kesehatan. Sekolah Pascasarjana. Institut Pertanian Bogor. Bogor.
Astuti, U.N.W., Cahyani R.W. dan Ardiansyah M. 2004.Pengaruh Ekstrak Etanol Daun Mindi (Melia azedarach) Terhadap Daya Tetas Telur, Perkembangan dan Mortalitas Larva Aedes aegypty. Laboratorium Parasitologi, Fakultas Biologi, Universitas Gajah Mada, Yogyakarta.
Bede, J. C dan S.S. Tobe. 2000. Activity of insect juvenile hormon III: seed germination dan seedling growth studies.Chemoecology Vol. 10.
Bede, J. C, Peter E.A. Teal, Walter G. Goodman, dan Stephen S. Tobe. 2001. Biosynthetic Pathway of Insect Juvenile Hormon III in Cell Suspension Cultures of the SedgeCyperus iria.Plant Physiology.
Bloomquist J.R. 2004.Insectisides: Chemisteries and characteristics.Department of Entomology, Virginia Polytechnic Institute and State University, Virginia.
47
Centers for Disease Control and Prevention (CDC). 2012. Dengue and the Aedes aegypti Mosquito. San Juan.
Christhoper, S. R. 1960.Aedes aegypti (L), The Yellow Fever Mosquito. London Cambridge University Press.
Dahlan, M. S. 2008. Statistik untuk Kedokteran Kesehatan. Salemba Medika. Jakarta.
Direktorat Jenderal Pengendalian Penyakit dan Penyehatan Lingkungan Kemenkes RI. 2012. Profil kesehatan Indonesia tahun 2011. Kementrian Kesehatan Republik Indonesia. Jakarta.
Dorland. 2007. Kamus Kedokteran Dorland. Jakarta: EGC
Elekonich, M.M dan G.E. Robinson. 2000. Organizational and activational effects of hormones on insect behavior.Journal of Insect Physiology 46(2000) : 1509–1515
Elimam AM, Elmalik KH, Ali FS. 2009. Larvicidal, adult emergence inhibition and oviposition deterrent effects of foliage extract from Ricinuscommunis L. against Anopheles arabiensisand Culexquinquefasciatus in Sudan.
Tropical Biomedicine, vol.26, no. 2, hh 130–139
Emlen, D.J dan H.F. Nijhout. 1999. The Development Dan Evolution Of Exaggerated Morphologies In Insects.Annu. Rev. Entomol. 2000. 45:661– 708.
Fitria, A. 2008. Efek Ekstrak Etanol Daun Dewa (Gynura pseudochina L) Terhadap Penurunan Kadar Asam Urat Mencit Putih Jantan Galur Balb-C Hiperurisemia. Skripsi. Fakultas Farmasi, Universitas Muhamadiyah Surakarta, Surakarta.
Kardinan, A. .2003. Tanaman Pengusir dan Pembasmi Nyamuk. Jakarta: Agromedia Pustaka. Hal. 1-4
Kardinan, A. .2004. Pestisida Nabati, Ramuan dan Aplikasi. Jakarta: Penebar Swadaya. Hal. 29
Kardinan A, Dhalimi A. 2003. Mimba (Azadirachta indica Juss.) tanaman multimanfaat,perkembangan teknologi tanaman rempah dan obat. Balai Penelitian Tanaman Rempah Dan Obat. Bogor. vol. 15, no 1
48
Li, S., Y.C. Ouyang, E. Ostrowski, D.W. Borst. 2005. Allatotropin regulation of juvenile hormone synthesis by the corpora allata from the lubber grasshopper,Romalea microptera.Peptides 26 (2005) 63–72
Listiawati, Y. 2010. Uji Efek Antipiretik Ekstrak Etanol Daun Legundi (Vitex Trifolia Linn) pada Kelinci Yang Diinduksi Vaksin Dpt-Hb. Skripsi. Fakultas Farmasi Universitas Muhammadiyah Surakarta. Surakarta.
Lorenz, M.W., K.H.Hoffmann, G.G.de. 1999. Juvenile hormone biosynthesis in larval and adult stick insects,Carausius morosus. Journal of Insect Physiology 45(1999) : 443–452
Mardacena, M. 2009.Efektivitas Ekstrak Daun Nimba (Azadirachta indica Juss.) Sebagai Ovisida Aedes aegypti Linn.Skripsi. Fakultas Matematika Dan Ilmu Pengetahuan Alam, Universitas Lampung, Bandar Lampung.
Martinez, S. H, J. G. Mayoral, Y. Li, F. G. Noriega. 2007. Role of juvenile hormon dan allatotropin on nutrient allocation, ovarian development dan survivorship in mosquitoes.Journal of Insect Physiology 53.
Moczek, P.A., dan H.F. Nijhout. 2003. Developmental mechanisms of threshold evolution in a polyphenic beetle.Evolution and Development 4.
Nijhout, H.F. 2003. The control of body size in insects.Developmental Biology 261.
Novizan. 2004.Membuat dan Memanfaatkan Pestisida Ramah Lingkungan, Cetakan 2. Jakarta: Agromedia Pustaka.
Ridad A., Ochadian H., Natadisastra D. 1999. Bunga Rampai Entomologi Medik. Edisi ke-2. Bagian Parasitologi FK Unpad.
Robinson, G.E dan E. L. Vargo. 1997. Juvenile Hormone in Adult Eusocial Hymenoptera: Gonadotropin and Behavioral Pacemaker.Insect Biochemistry and Physiology 35:559–583
Sen, S.E., A.E. Sperry, M. Childress, D.E. Hannemann. 2003. Juvenile hormon biosynthesis in moths: synthesis dan evaluation of farnesol homologs as alternate substrates of farnesol oxidase.Insect Biochemistry dan Molecular Biology 33 (2003) 601–607
Shelby, J.A, R. Madewell, A.P. Moczek. 2007. Juvenile Hormone Mediates Sexual Dimorphism in Horned Beetles.J. Exp. Zool. (Mol. Dev. Evol.) DOI 10.1002/jez.: 1-11
49
Soegijanto, S. 2006. Demam Berdarah Dengue. Jakarta, Airlangga University Press
Suhendro, Nainggolan, L., Chen, K., Pohan, H.T., 2006. Demam Berdarah Dengue. Dalam: Buku Ajar Ilmu Penyakit Dalam Jilid III Edisi IV, Departemen Ilmu Penyakit Dalam FKUI, Jakarta.
Suwasono dan Soekirno. 2004. Uji Coba Beberapa Insektisida Golongan Pyrethroid Sintetik Terhadap Vektor Demam Berdarah Dengue Aedes Aegypti Di Wilayah Jakarta Utara. Jurnal Ekologi Kesehatan. 3 (1): 43-47.
Verma, K.K. 2007. Polyphenism in insects and the juvenile hormone.J. Biosci.32(2) (2007) : 415–420.
WHO. 2005.Guidelines for Laboratory and Field Testing of Mosquito Larvicides. Geneva.
WHO. 2010. Dengue: The Fastest Growing Mosquito-Borne Disease in The World. Geneva.