1
ABSTRAK
ARIF SADONO. Aktivitas Antioksidan dan Analisis Komposisi Senyawa Fenolik dari
Pohon Bidara Laut (Strychnos ligustrina). Dibimbing oleh DUDI TOHIR dan
BAMBANG WIYONO.
Pohon bidara laut (Strychnos ligustrina) memiliki kemampuan antioksidan. Tujuan
penelitian ini
menentukan aktivitas antioksidan pada ekstrak pohon bidara laut,
komposisi total fenol, dan analisis senyawa bioaktif dengan kromatografi
gas-spektrometer massa (GCMS).
Aktivitas antioksidan ditentukan menggunakan metode
1,1-difenil-2-pikril-hidrazil. Hasil penelitian menunjukkan bahwa bagian pohon yang
memiliki aktivitas antioksidan paling besar ialah ekstrak metanol kayu dengan nilai IC50
148.41 mg L
-1. Nilai IC50 setelah dipartisi menggunakan
n-heksana ialah 103.14 mg L
-1dengan butil hidroksil toluena sebagai kontrol positif memiliki nilai IC50 sebesar 10.86
mg L
-1. Kandungan total fenol menggunakan metode Folin-Ciocalteau diperoleh sebesar
1936.844 mg kg
-1sampel kering. Hasil analisis senyawa dengan GCMS menunjukkan
terdapat senyawa fenolik dengan komponen utama 1,2,3-benzenatriol sebanyak 2.66%
(RT 10.77).
ABSTRACT
ARIF SADONO. Antioxidant Activities and Phenolic Compound Analysis of Bidara Laut
(Strychnos ligustrina). Supervised by DUDI TOHIR and BAMBANG WIYONO.
1
PENDAHULUAN
Radikal bebas diketahui memiliki reaktivitas yang tinggi sehingga dapat memicu reaksi berantai dalam sel tubuh. Hal ini dapat merusak sel dan akan menyebabkan munculnya berbagai penyakit dalam tubuh, seperti inflamasi, kanker, katarak, dan penuaan dini. Selain itu, juga dapat menyebabkan penyakit kardiovaskular dan aterosklerosis (Hertog et al. 1995). Aktivitas radikal tersebut dapat dihambat oleh antioksidan. Oleh karena itu, penelitian mengenai antioksidan dalam dekade ini banyak dilakukan.
Antioksidan alami mampu melindungi tubuh terhadap kerusakan yang disebabkan oleh spesies oksigen reaktif, dan mampu menghambat terjadinya penyakit degeneratif, serta mampu menghambat peroksidase lipid makanan. Antioksidan alami umumnya mempunyai gugus fenolik dalam struktur molekulnya. Antioksidan dapat diperoleh dari asupan makanan yang banyak mengandung vitamin C, vitamin E, β-karoten, dan senyawa fenolik (Sunarni 2005).
Banyak pohon di Indonesia yang belum dieksplorasi secara luas, salah satunya ialah pohon bidara laut (Strychnos ligustrina). Pohon tumbuh di Kabupaten Bima, Nusa Tenggara Barat pada ketinggian 10 sampai 100 meter di atas permukaan laut, dan biasanya di daerah berbatu. Kayu bidara laut banyak digunakan oleh masyarakat sebagai obat kencing manis, penyakit darah tinggi, dan malaria. Fraksi etil asetat kayu bidara laut pada dosis 2.30 mg kg-1 bb telah dilaporkan memiliki aktivitas antimalaria (Lubis 2008). Kayu bidara laut memiliki aktivitas antiradang dan menurunkan kadar gula darah. Ekstrak metanol daun bidara laut dapat berfungsi sebagai antidot dan stomatis (Subehan et al. 2006). Fitokimia kayu bidara laut terdiri atas alkaloid, tanin, brusin, striknin, dan steroid/triterpenoid (Kartika 2009). Secara alami, tanin dan flavonoid dapat berfungsi sebagai antioksidan (Ciddi & Kaleab 2005). Karena kayu bidara laut mengandung tanin serta memiliki aktivitas antiinflamasi dan antiradang, kayu bidara laut diperkirakan dapat digunakan sebagai antioksidan.
Penelitian ini bertujuan menentukan bagian pohon bidara laut yang mempunyai aktivitas antioksidan. Kandungan total fenol dan analisis senyawa bioaktif dilakukan dengan kromatografi gas-spektrometer massa (GCMS).
TINJAUAN PUSTAKA
Bidara Laut
Bidara laut (Gambar 1) merupakan tumbuhan yang berasal dari Kabupaten Bima, Nusa Tenggara Barat. Tumbuh pada ketinggian 10 sampai 100 meter di atas permukaan laut dan umumnya hidup di daerah bebatuan. Secara taksonomi pohon bidara laut diklasifikasikan kerajaan Plantae, divisi Magnoliophyta, kelas Magnoliopsida, bangsa Gentianales, suku Loganiaceae, marga Strychnos, dan jenis Strychnos ligustrina. Pohon bidara laut sering digunakan oleh masyarakat setempat sebagai obat kencing manis, penyakit darah tinggi, dan malaria (Edinur et al. 1979).
Gambar 1 Pohon bidara laut.
Ekstrak metanol daun dan kayu bidara laut telah ditunjukkan berpotensi sebagai antidot, stomatis, antelmentik, dan dapat menghambat enzim sitokrom P450 yang dapat mengganggu metabolisme oksidatif pada hati manusia (Subehan et al. 2006). Ekstrak air kayu bidara laut dengan dosis efektif 50% (ED50) 0.45 mg kg-1 bb berpotensi sebagai antimalaria (Huda 2006). Fraksi etil asetat kayu bidara laut pada dosis 2.30 mg kg-1 bb memiliki aktivitas antimalaria (Lubis 2008). Senyawa yang terkandung pada kayu bidara laut di antaranya alkaloid, tanin, brusin, striknin, dan steroid/triterpenoid (Kartika 2009). Menurut Dzulkarnain (1996), pohon bidara laut dapat digunakan sebagai bahan kosmetik alami. Selain itu, kulit batang pohon bidara laut berpotensi sebagai antijamur dan antibakteri serta dapat menyembuhkan penyakit bisul.
Antioksidan
1
PENDAHULUAN
Radikal bebas diketahui memiliki reaktivitas yang tinggi sehingga dapat memicu reaksi berantai dalam sel tubuh. Hal ini dapat merusak sel dan akan menyebabkan munculnya berbagai penyakit dalam tubuh, seperti inflamasi, kanker, katarak, dan penuaan dini. Selain itu, juga dapat menyebabkan penyakit kardiovaskular dan aterosklerosis (Hertog et al. 1995). Aktivitas radikal tersebut dapat dihambat oleh antioksidan. Oleh karena itu, penelitian mengenai antioksidan dalam dekade ini banyak dilakukan.
Antioksidan alami mampu melindungi tubuh terhadap kerusakan yang disebabkan oleh spesies oksigen reaktif, dan mampu menghambat terjadinya penyakit degeneratif, serta mampu menghambat peroksidase lipid makanan. Antioksidan alami umumnya mempunyai gugus fenolik dalam struktur molekulnya. Antioksidan dapat diperoleh dari asupan makanan yang banyak mengandung vitamin C, vitamin E, β-karoten, dan senyawa fenolik (Sunarni 2005).
Banyak pohon di Indonesia yang belum dieksplorasi secara luas, salah satunya ialah pohon bidara laut (Strychnos ligustrina). Pohon tumbuh di Kabupaten Bima, Nusa Tenggara Barat pada ketinggian 10 sampai 100 meter di atas permukaan laut, dan biasanya di daerah berbatu. Kayu bidara laut banyak digunakan oleh masyarakat sebagai obat kencing manis, penyakit darah tinggi, dan malaria. Fraksi etil asetat kayu bidara laut pada dosis 2.30 mg kg-1 bb telah dilaporkan memiliki aktivitas antimalaria (Lubis 2008). Kayu bidara laut memiliki aktivitas antiradang dan menurunkan kadar gula darah. Ekstrak metanol daun bidara laut dapat berfungsi sebagai antidot dan stomatis (Subehan et al. 2006). Fitokimia kayu bidara laut terdiri atas alkaloid, tanin, brusin, striknin, dan steroid/triterpenoid (Kartika 2009). Secara alami, tanin dan flavonoid dapat berfungsi sebagai antioksidan (Ciddi & Kaleab 2005). Karena kayu bidara laut mengandung tanin serta memiliki aktivitas antiinflamasi dan antiradang, kayu bidara laut diperkirakan dapat digunakan sebagai antioksidan.
Penelitian ini bertujuan menentukan bagian pohon bidara laut yang mempunyai aktivitas antioksidan. Kandungan total fenol dan analisis senyawa bioaktif dilakukan dengan kromatografi gas-spektrometer massa (GCMS).
TINJAUAN PUSTAKA
Bidara Laut
Bidara laut (Gambar 1) merupakan tumbuhan yang berasal dari Kabupaten Bima, Nusa Tenggara Barat. Tumbuh pada ketinggian 10 sampai 100 meter di atas permukaan laut dan umumnya hidup di daerah bebatuan. Secara taksonomi pohon bidara laut diklasifikasikan kerajaan Plantae, divisi Magnoliophyta, kelas Magnoliopsida, bangsa Gentianales, suku Loganiaceae, marga Strychnos, dan jenis Strychnos ligustrina. Pohon bidara laut sering digunakan oleh masyarakat setempat sebagai obat kencing manis, penyakit darah tinggi, dan malaria (Edinur et al. 1979).
Gambar 1 Pohon bidara laut.
Ekstrak metanol daun dan kayu bidara laut telah ditunjukkan berpotensi sebagai antidot, stomatis, antelmentik, dan dapat menghambat enzim sitokrom P450 yang dapat mengganggu metabolisme oksidatif pada hati manusia (Subehan et al. 2006). Ekstrak air kayu bidara laut dengan dosis efektif 50% (ED50) 0.45 mg kg-1 bb berpotensi sebagai antimalaria (Huda 2006). Fraksi etil asetat kayu bidara laut pada dosis 2.30 mg kg-1 bb memiliki aktivitas antimalaria (Lubis 2008). Senyawa yang terkandung pada kayu bidara laut di antaranya alkaloid, tanin, brusin, striknin, dan steroid/triterpenoid (Kartika 2009). Menurut Dzulkarnain (1996), pohon bidara laut dapat digunakan sebagai bahan kosmetik alami. Selain itu, kulit batang pohon bidara laut berpotensi sebagai antijamur dan antibakteri serta dapat menyembuhkan penyakit bisul.
Antioksidan
1
radikal bebas tersebut dapat diredam. Antioksidan memiliki peranan yang cukup penting bagi kesehatan khususnya dalam mempertahankan tubuh dari kerusakan sel akibat adanya spesies radikal bebas. Berdasarkan sumbernya, terdapat antioksidan alami dan sintetik. Antioksidan alami mampu melindungi tubuh dari kerusakan yang disebabkan oleh spesies oksigen reaktif. Antioksidan alami umumnya memiliki gugus fenolik dalam struktur molekulnya (Sunarni 2005). Antioksidan sintetik seperti butil hidroksi toluena (BHT), butil hidroksi anisol (BHA) dan t-butil hidroksi kuinon (TBHQ) dapat memberikan dampak negatif bagi kesehatan. Selain itu, antioksidan sintetik mempunyai kelarutan yang rendah dibandingkan dengan antioksidan alami (Barlow 1990).
Aktivitas antioksidan dari suatu bahan alam dapat diuji dengan berbagai metode di antaranya xantin oksidase, tiosianat, kemampuan mereduksi ion feri (FRAP), kapasitas mereduksi kupri (CUPRAC), dan 1,1-difenil-2-pikrilhidrazil (DPPH). Metode DPPH banyak digunakan dalam penentuan aktivitas antioksidan ekstrak tanaman karena sederhana, cepat, dan tidak membutuhkan banyak reagen.
Metode DPPH
Salah satu metode uji aktivitas antioksidan senyawa alam adalah metode DPPH (Gambar 2a). Delokalisasi elektron pada molekul DPPH akan memberikan warna ungu yang dicirikan dengan pita serapan pada panjang gelombang 520 nm. Ketika DPPH ditambahkan ke dalam senyawa yang dapat memberikan atom hidrogen, DPPH akan berubah warna menjadi kuning, yakni warna bentuk tereduksinya, difenilpikrilhidrazin (Gambar 2b) (Molyneux 2004).
(a) (b)
Gambar 2 Struktur DPPH: radikal bebas (a) bentuk tereduksi (b).
Senyawa Fenolik
Senyawa fenolik meliputi aneka ragam senyawa dari tumbuhan yang mempunyai cincin aromatik dengan satu atau dua gugus hidroksil. Senyawa fenolik mudah larut dalam air, umumnya berikatan dengan gula sebagai glikosida, dan biasanya terdapat dalam vakuola sel. Beberapa ribu senyawa fenolik telah diketahui strukturnya. Flavonoid merupakan golongan terbesar, tetapi fenol monosiklik sederhana, fenilpropanoid, dan kuinon fenolik juga terdapat dalam jumlah besar. Beberapa golongan bahan polimer penting dalam tumbuhan seperti lignin, melanin, dan tanin adalah senyawa polifenol dan terkadang unit fenolik terdapat pada protein, alkaloid, dan di antara terpenoid. Semua senyawa fenol aromatik, maka menunjukkan serapan kuat di daerah spektrum tampak. Selain itu, secara khas senyawa fenolik menunjukkan geseran batokromik pada spektrumnya bila ditambahkan basa (Harborne 1996).
Analisis GCMS
Analisis dengan GCMS merupakan gabungan dari instrumen kromatografi gas (GC) dan spektrometer massa (MS) yang umumnya digunakan untuk mengidentifikasi senyawa atsiri dan semi-atsiri serta memisahkannya berdasarkan bobot per fragmennya. Sampel yang hendak dianalisis diidentifikasi dahulu dengan alat GC, kemudian dengan alat MS (Lynam & Smith 2009).
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan adalah akar, daun, kayu, dan kulit pohon bidara laut dari daerah Bima, Nusa Tenggara Barat, DPPH, metanol p.a, BHT, akuabides, asam galat, reagen Folin-Ciocalteau, Na2CO3, n-heksana, dan
etanol. Selain itu, digunakan pula pereaksi Meyer, Dragendorf, Wagner, dan Lieberman-Buchard.
Alat-alat yang digunakan adalah alat distilasi, peralatan kaca yang lazim di laboratorium, radas ekstraksi, wadah pengembang, penguap putar, botol uji (vial), neraca analitik, spektrofotometer UV Beckman DU-700, dan instrumen GCMS (Agilent Technologies).
1
radikal bebas tersebut dapat diredam. Antioksidan memiliki peranan yang cukup penting bagi kesehatan khususnya dalam mempertahankan tubuh dari kerusakan sel akibat adanya spesies radikal bebas. Berdasarkan sumbernya, terdapat antioksidan alami dan sintetik. Antioksidan alami mampu melindungi tubuh dari kerusakan yang disebabkan oleh spesies oksigen reaktif. Antioksidan alami umumnya memiliki gugus fenolik dalam struktur molekulnya (Sunarni 2005). Antioksidan sintetik seperti butil hidroksi toluena (BHT), butil hidroksi anisol (BHA) dan t-butil hidroksi kuinon (TBHQ) dapat memberikan dampak negatif bagi kesehatan. Selain itu, antioksidan sintetik mempunyai kelarutan yang rendah dibandingkan dengan antioksidan alami (Barlow 1990).
Aktivitas antioksidan dari suatu bahan alam dapat diuji dengan berbagai metode di antaranya xantin oksidase, tiosianat, kemampuan mereduksi ion feri (FRAP), kapasitas mereduksi kupri (CUPRAC), dan 1,1-difenil-2-pikrilhidrazil (DPPH). Metode DPPH banyak digunakan dalam penentuan aktivitas antioksidan ekstrak tanaman karena sederhana, cepat, dan tidak membutuhkan banyak reagen.
Metode DPPH
Salah satu metode uji aktivitas antioksidan senyawa alam adalah metode DPPH (Gambar 2a). Delokalisasi elektron pada molekul DPPH akan memberikan warna ungu yang dicirikan dengan pita serapan pada panjang gelombang 520 nm. Ketika DPPH ditambahkan ke dalam senyawa yang dapat memberikan atom hidrogen, DPPH akan berubah warna menjadi kuning, yakni warna bentuk tereduksinya, difenilpikrilhidrazin (Gambar 2b) (Molyneux 2004).
(a) (b)
Gambar 2 Struktur DPPH: radikal bebas (a) bentuk tereduksi (b).
Senyawa Fenolik
Senyawa fenolik meliputi aneka ragam senyawa dari tumbuhan yang mempunyai cincin aromatik dengan satu atau dua gugus hidroksil. Senyawa fenolik mudah larut dalam air, umumnya berikatan dengan gula sebagai glikosida, dan biasanya terdapat dalam vakuola sel. Beberapa ribu senyawa fenolik telah diketahui strukturnya. Flavonoid merupakan golongan terbesar, tetapi fenol monosiklik sederhana, fenilpropanoid, dan kuinon fenolik juga terdapat dalam jumlah besar. Beberapa golongan bahan polimer penting dalam tumbuhan seperti lignin, melanin, dan tanin adalah senyawa polifenol dan terkadang unit fenolik terdapat pada protein, alkaloid, dan di antara terpenoid. Semua senyawa fenol aromatik, maka menunjukkan serapan kuat di daerah spektrum tampak. Selain itu, secara khas senyawa fenolik menunjukkan geseran batokromik pada spektrumnya bila ditambahkan basa (Harborne 1996).
Analisis GCMS
Analisis dengan GCMS merupakan gabungan dari instrumen kromatografi gas (GC) dan spektrometer massa (MS) yang umumnya digunakan untuk mengidentifikasi senyawa atsiri dan semi-atsiri serta memisahkannya berdasarkan bobot per fragmennya. Sampel yang hendak dianalisis diidentifikasi dahulu dengan alat GC, kemudian dengan alat MS (Lynam & Smith 2009).
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan adalah akar, daun, kayu, dan kulit pohon bidara laut dari daerah Bima, Nusa Tenggara Barat, DPPH, metanol p.a, BHT, akuabides, asam galat, reagen Folin-Ciocalteau, Na2CO3, n-heksana, dan
etanol. Selain itu, digunakan pula pereaksi Meyer, Dragendorf, Wagner, dan Lieberman-Buchard.
Alat-alat yang digunakan adalah alat distilasi, peralatan kaca yang lazim di laboratorium, radas ekstraksi, wadah pengembang, penguap putar, botol uji (vial), neraca analitik, spektrofotometer UV Beckman DU-700, dan instrumen GCMS (Agilent Technologies).
1
Persiapan sampelSampel kayu, daun, akar, dan kulit batang bidara laut, dikeringudarakan hingga kering. Setelah itu, sampel diserbukkan dengan ukuran 40 mesh.
Kadar Air
Sampel sebanyak 3 g ditimbang ke dalam cawan yang telah diketahui bobot keringnya, kemudian dipanaskan pada suhu 105 oC selama 3 jam. Setelah didinginkan dalam eksikator, cawan yang berisi sampel ditimbang. Pemanasan dan penimbangan dilakukan berulang kali sampai diperoleh bobot tetap (stabil).
Ekstraksi
Serbuk akar, daun, kayu, dan kulit kayu bidara laut masing-masing 100 gram diekstraksi berturut-turut menggunakan pelarut metanol, metanol:air (1:1), dan air pada suhu 80 oC selama 8 jam. Ekstraksi dilakukan dua kali, kemudian ekstrak dipekatkan pada tekanan rendah dengan penguap putar. Setiap ekstraknya diuji fitokimia dan aktivitas antioksidan. Ekstrak yang memiliki aktivitas antioksidan paling tinggi dipartisi dengan n-heksana hingga lapisan n-heksana tidak berwarna dari warna semula. Ekstrak hasil partisi dipekatkan dengan penguap putar untuk selanjutnya dianalisis menggunakan instrumen GCMS.
Uji Aktivitas Antioksidan dengan Metode DPPH
Satu mL larutan ekstrak dimasukkan ke dalam tabung reaksi dan ditambahkan 3 mL larutan DPPH 0.004% (b/v) dalam metanol. Campuran dikocok kuat dan diinkubasi pada suhu 37 oC selama 30 menit lalu, diukur absorbansnya menggunakan spektrofotometer UV-tampak pada λ 515.5 nm. BHT digunakan sebagai kontrol positif. Nilai konsentrasi penghambat 50% (IC50) dihitung
menggunakan persamaan regresi linear hubungan antara konsentrasi dan % inhibisi.
Kandungan Total Fenol
Kandungan total fenol ditentukan dengan menggunakan metode Folin-Ciocalteau. Ekstrak metanol kayu bidara laut yang mengandung 1–5 mg bahan kering ekstrak
dilarutkan dalam 2 mL etanol dalam sederet tabung reaksi. Ke dalam setiap tabung reaksi ditambahkan 5 mL akuabides dan 0.5 mL reagen Folin-Ciocalteau 50% (v/v). Setelah 5 menit, ditambahkan 1 mL larutan Na2CO3 5%
(b/v) lalu campuran dihomogenisasi dan diinkubasi pada ruang gelap selama 1 jam. Campuran dihomogenisasi kembali dan absorbansnya diukur pada panjang gelombang 954 nm. Kurva standar fenol dibuat dengan menggunakan standar asam galat (5–50 mg L
-1
).
Analisis Senyawa
Senyawa bioaktif ekstrak metanol kayu hasil partisi dianalisis dengan GCMS menggunakan metode ionisasi Electron Impact pada GC yang digabung dengan MS 6890N; kolom kapiler HP-5MS (60 0.25 mm; suhu kolom 70 oC (44.67 menit) hingga 290 oC pada laju 15 oC/menit; gas pembawa helium pada tekanan tetap 18.39 psi.
Uji Fitokimia Alkaloid
Sebanyak 1 g ekstrak dilarutkan dalam 10 mL CHCl3 dan beberapa tetes NH4OH
kemudian disaring. Filtratnya (ekstrak CHCl3)
dimasukkan ke dalam tabung reaksi bertutup dan dikocok dengan 10 tetes H2SO4 2 M
sampai terbentuk 2 lapisan. Lapisan asam (tak berwarna) diteteskan pada lempeng tetes lalu ditambahkan pereaksi Meyer, Wagner, dan Dragendorf yang akan menimbulkan berturut-turut endapan putih, coklat, dan merah jingga.
Saponin
Sebanyak 1 g ekstrak dididihkan dengan 25 mL etanol selama 25 menit, disaring dalam keadaan panas, kemudian pelarut diuapkan sampai kering. Residu dikocok kuat dengan CHCl3, ditambahkan air suling lalu dibiarkan
sampai terbentuk 2 lapisan. Sebanyak 1 mL lapisan air dikocok selama 1 menit. Terbentuknya busa yang tidak hilang dalam 5 menit menandakan adanya saponin.
Fenol
Sebanyak 2 mL lapisan air pada uji saponin ditempatkan dalam tabung reaksi dan ditambahkan FeCl3. Timbulnya warna ungu,
biru, dan hijau menunjukkan positif fenolik.
Steroid dan Triterpenoid
Lapisan kloroform pada uji saponin diteteskan pada lempeng tetes dan dibiarkan
1
kering. Ditambahkan 3 tetes anhidrat asam asetat anhidrat dan 1 tetes H2SO4 pekat
(pereaksi Liebermann Buchard). Terbentuknya warna merah atau ungu menunjukkan kandungan senyawa triterpernoid, sedangkan warna hijau atau biru menunjukkan kandungan steroid.
Flavonoid
Sebanyak 0.1 g ekstrak ditambahkan 10 mL air panas dan dididihkan selama 5 menit. Setelah itu, disaring dan filtratnya digunakan untuk pengujian. Filtrat dimasukkan ke dalam tabung reaksi, ditambahkan 0.5 g serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol, lalu dikocok kuat. Warna merah/kuning/jingga pada lapisan alkohol menunjukkan kandungan flavonoid.
Tanin
Sebanyak 0.1 g ekstrak dimasukkan ke dalam tabung reaksi kemudian ditambahkan 10 mL air panas dan dikocok sampai dingin. Setelah itu, ditambahkan 4 tetes NaCl 10%, disaring, dan filtratnya dibagi dua. Filtrat pertama diberi 5 tetes gelatin 1%, endapan putih menunjukkan kandungan tanin. Filtrat kedua diberi 5 tetes FeCl3 1%, warna
hijau-kebiruan menunjukkan kandungan tanin. Diagram alir penelitian ini dapat ditunjukkan pada Lampiran 1.
HASIL DAN PEMBAHASAN
Kadar Air
Penentuan kadar air berfungsi untuk mengetahui cara penyimpanan terbaik untuk sampel simplisia dan dapat memperkirakan jumlah sampel yang dibutuhkan. Sampel simplisia dikeringudarakan dengan bantuan cahaya matahari. Pengeringan bertujuan agar simplisia dapat disimpan relatif lebih lama. Kadar air kayu, kulit kayu, daun, dan akar bidara laut berturut-turut ialah 9.12, 11.39, 10.90, dan 10.50% (Lampiran 2). Nilai kadar air menunjukkan bahwa hanya bagian kayu yang tahan terhadap pertumbuhan mikrob dan dapat disimpan dalam jangka relatif lama. Menurut Winarno (1997), suatu bahan berada dalam keadaan yang stabil dan pertumbuhan mikrob dapat dikurangi jika kadar air bahan kurang dari 10%.
Ekstraksi
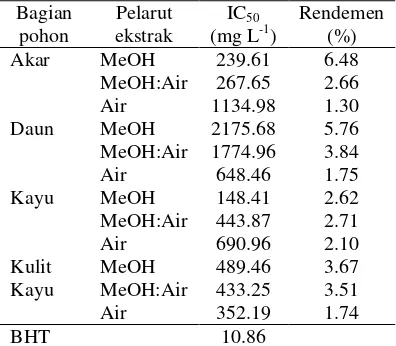
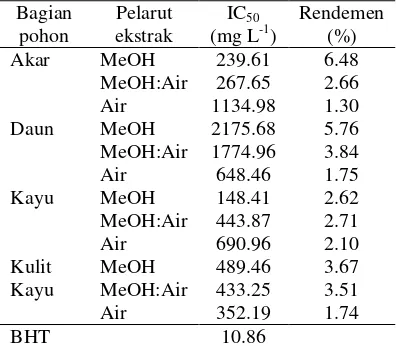
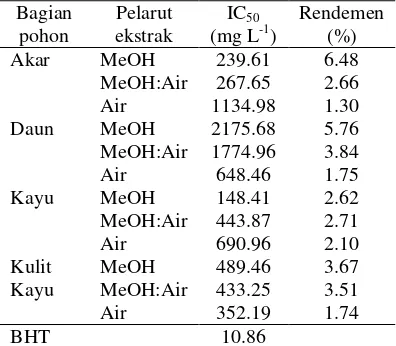
Metode ekstraksi yang digunakan adalah ekstraksi dengan bantuan pemanasan (refluks) dengan suhu 80 oC. Metode ini digunakan karena rendemen yang dihasilkan cukup besar dan tidak membutuhkan banyak pelarut. Selain itu, sampel yang digunakan memiliki sifat tahan panas sebagaimana dapat dilihat dari morfologi simplisia yang rigid baik akar, daun, kayu, maupun kulit kayu. Hasil rendemen ekstrak dapat dilihat Tabel 1 dan Lampiran 3. Rendemen ekstrak terbesar terdapat pada ekstrak metanol akar, yaitu 6.84%, sedangkan rendemen ekstrak terkecil adalah ekstrak air akar (1.30%).
Tabel 1 Aktivitas antioksidan dan rendemen ekstrak
Bagian Pelarut IC50 Rendemen
pohon ekstrak (mg L-1) (%) Akar MeOH 239.61 6.48 MeOH:Air 267.65 2.66 Air 1134.98 1.30 Daun MeOH 2175.68 5.76 MeOH:Air 1774.96 3.84 Air 648.46 1.75 Kayu MeOH 148.41 2.62 MeOH:Air 443.87 2.71 Air 690.96 2.10 Kulit MeOH 489.46 3.67 Kayu MeOH:Air 433.25 3.51 Air 352.19 1.74 BHT 10.86
Ekstraksi menggunakan pelarut dengan perbedaan kepolaran, yaitu metanol, metanol:air, dan air. Perbedaan pelarut ini bertujuan mengetahui aktivitas antioksidan dari tiap bagian simplisia. Tabel 1 menunjukkan bahwa rendemen ekstrak tidak memengaruhi aktivitas antioksidan. Ekstrak yang memiliki aktivitas antioksidan paling besar selanjutnya dipartisi dengan n-heksana. Hal ini bertujuan meningkatkan aktivitas antioksidan dan menghilangkan lemak, steroid/triterpenoid, serta senyawa nonpolar lainnya yang ikut terekstraksi.
Aktivitas Antioksidan
Metode yang digunakan dalam pengujian aktivitas antioksidan adalah metode serapan radikal DPPH. Metode ini sederhana, mudah, dan menggunakan sampel dalam jumlah sedikit dengan waktu yang singkat (Hanani et al. 2005). Pengukuran aktivitas antioksidan sampel dilakukan dengan spektrofotometer
1
kering. Ditambahkan 3 tetes anhidrat asam asetat anhidrat dan 1 tetes H2SO4 pekat
(pereaksi Liebermann Buchard). Terbentuknya warna merah atau ungu menunjukkan kandungan senyawa triterpernoid, sedangkan warna hijau atau biru menunjukkan kandungan steroid.
Flavonoid
Sebanyak 0.1 g ekstrak ditambahkan 10 mL air panas dan dididihkan selama 5 menit. Setelah itu, disaring dan filtratnya digunakan untuk pengujian. Filtrat dimasukkan ke dalam tabung reaksi, ditambahkan 0.5 g serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol, lalu dikocok kuat. Warna merah/kuning/jingga pada lapisan alkohol menunjukkan kandungan flavonoid.
Tanin
Sebanyak 0.1 g ekstrak dimasukkan ke dalam tabung reaksi kemudian ditambahkan 10 mL air panas dan dikocok sampai dingin. Setelah itu, ditambahkan 4 tetes NaCl 10%, disaring, dan filtratnya dibagi dua. Filtrat pertama diberi 5 tetes gelatin 1%, endapan putih menunjukkan kandungan tanin. Filtrat kedua diberi 5 tetes FeCl3 1%, warna
hijau-kebiruan menunjukkan kandungan tanin. Diagram alir penelitian ini dapat ditunjukkan pada Lampiran 1.
HASIL DAN PEMBAHASAN
Kadar Air
Penentuan kadar air berfungsi untuk mengetahui cara penyimpanan terbaik untuk sampel simplisia dan dapat memperkirakan jumlah sampel yang dibutuhkan. Sampel simplisia dikeringudarakan dengan bantuan cahaya matahari. Pengeringan bertujuan agar simplisia dapat disimpan relatif lebih lama. Kadar air kayu, kulit kayu, daun, dan akar bidara laut berturut-turut ialah 9.12, 11.39, 10.90, dan 10.50% (Lampiran 2). Nilai kadar air menunjukkan bahwa hanya bagian kayu yang tahan terhadap pertumbuhan mikrob dan dapat disimpan dalam jangka relatif lama. Menurut Winarno (1997), suatu bahan berada dalam keadaan yang stabil dan pertumbuhan mikrob dapat dikurangi jika kadar air bahan kurang dari 10%.
Ekstraksi
Metode ekstraksi yang digunakan adalah ekstraksi dengan bantuan pemanasan (refluks) dengan suhu 80 oC. Metode ini digunakan karena rendemen yang dihasilkan cukup besar dan tidak membutuhkan banyak pelarut. Selain itu, sampel yang digunakan memiliki sifat tahan panas sebagaimana dapat dilihat dari morfologi simplisia yang rigid baik akar, daun, kayu, maupun kulit kayu. Hasil rendemen ekstrak dapat dilihat Tabel 1 dan Lampiran 3. Rendemen ekstrak terbesar terdapat pada ekstrak metanol akar, yaitu 6.84%, sedangkan rendemen ekstrak terkecil adalah ekstrak air akar (1.30%).
Tabel 1 Aktivitas antioksidan dan rendemen ekstrak
Bagian Pelarut IC50 Rendemen
pohon ekstrak (mg L-1) (%) Akar MeOH 239.61 6.48 MeOH:Air 267.65 2.66 Air 1134.98 1.30 Daun MeOH 2175.68 5.76 MeOH:Air 1774.96 3.84 Air 648.46 1.75 Kayu MeOH 148.41 2.62 MeOH:Air 443.87 2.71 Air 690.96 2.10 Kulit MeOH 489.46 3.67 Kayu MeOH:Air 433.25 3.51 Air 352.19 1.74 BHT 10.86
Ekstraksi menggunakan pelarut dengan perbedaan kepolaran, yaitu metanol, metanol:air, dan air. Perbedaan pelarut ini bertujuan mengetahui aktivitas antioksidan dari tiap bagian simplisia. Tabel 1 menunjukkan bahwa rendemen ekstrak tidak memengaruhi aktivitas antioksidan. Ekstrak yang memiliki aktivitas antioksidan paling besar selanjutnya dipartisi dengan n-heksana. Hal ini bertujuan meningkatkan aktivitas antioksidan dan menghilangkan lemak, steroid/triterpenoid, serta senyawa nonpolar lainnya yang ikut terekstraksi.
Aktivitas Antioksidan
Metode yang digunakan dalam pengujian aktivitas antioksidan adalah metode serapan radikal DPPH. Metode ini sederhana, mudah, dan menggunakan sampel dalam jumlah sedikit dengan waktu yang singkat (Hanani et al. 2005). Pengukuran aktivitas antioksidan sampel dilakukan dengan spektrofotometer
1
UV-tampak pada panjang gelombang 515.5 nm yang merupakan panjang gelombang maksimum DPPH dengan konsentrasi 0.004% (b/v). Adanya aktivitas antioksidan dari sampel mengakibatkan perubahan warna larutan DPPH yang semula berwarna violet menjadi kuning pucat (Permana et al. 2003). Besarnya aktivitas antioksidan ditandai dengan nilai IC50, yaitu konsentrasi larutan
sampel yang dibutuhkan untuk menghambat 50% radikal bebas DPPH.
Bagian pohon bidara laut yang berpotensi sebagai antioksidan ialah bagian kayu (Lampiran 4). Ekstrak metanol kayu bidara laut memiliki nilai IC50 148 mg L-1. Menurut
Blouis (1958), suatu bahan dapat berpotensi sebagai antioksidan yang kuat jika memiliki nilai IC50 kurang dari 200 mg L-1.
Dibandingkan dengan ekstrak lainnya, ekstrak metanol kayu memiliki aktivitas antioksidan yang paling besar. Bagian pohon yang memiliki aktivitas antioksidan terendah adalah daun dengan nilai IC50 pada ekstrak metanol,
metanol:air, dan air berturut-turut 2175.68, 1774.96, dan 648.46 mg L-1.
Nilai IC50 ekstrak metanol setelah dipartisi
dengan n-heksana lebih kecil dibandingkan dengan ekstrak metanol kasar kayu, yaitu 103.14 mg L-1. Meskipun terdapat peningkatan aktivitas antioksidan, nilainya masih lebih kecil daripada BHT sebagai kontrol positif yang memiliki nilai IC50 10.86
mg L-1. Semakin kecil nilai IC50-nya
menunjukkan semakin besar aktivitas antioksidannya (Molyneux 2004).
Kandungan Total Fenol
Penentuan kandungan total fenol pada ekstrak metanol kayu bidara laut
menggunakan metode Folin-Ciocalteau dan asam galat sebagai larutan standar. Kurva kalibrasi larutan standar dibuat dengan deret konsentrasi 20, 25, 30, 35, 40, 45, 50 mg L-1. Dari deret konsentrasi larutan standar diperoleh persamaan regresi y = 0.0241 + 0.0107x dengan R2 = 0.99946. Nilai R2 yang mendekati 1 membuktikan bahwa persamaan regresi tersebut adalah linear. Konsentrasi larutan sampel diperoleh dengan menggunakan kurva kalibrasi dengan cara mengukur absorbans sampel, lalu kandungan total fenol ditentukan dengan menggunakan persamaan regresi linear. Kandungan total fenol dalam ekstrak metanol, metanol:air, dan air kayu bidara laut berturut-turut ialah 1936.844, 1874.051, dan 829.437 mg kg-1 sampel kering (Lampiran 5).
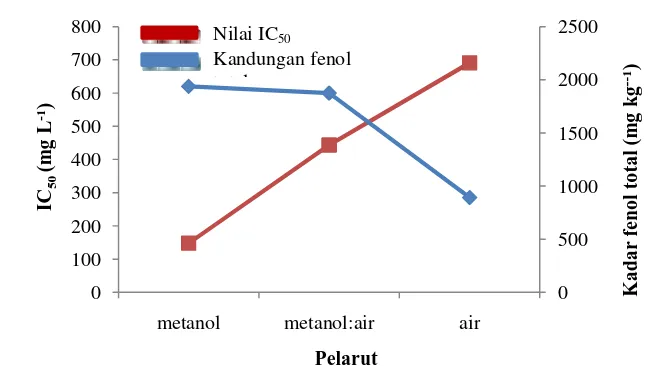
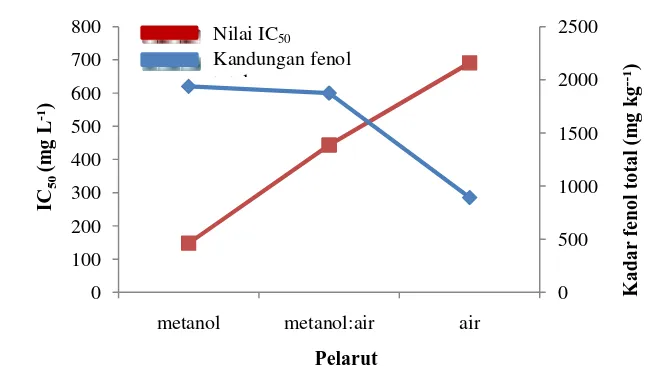
Hubungan aktivitas antioksidan terhadap kandungan total fenol ditunjukkan pada Gambar 3. Aktivitas antioksidan meningkat seiring dengan meningkatnya kandungan total fenol pada kayu bidara laut. Menurut Holasova et al. (2002) dalam Kazutaka et al. (2009), kandungan total fenol meningkat seiring dengan meningkatnya aktivitas antioksidan. Senyawa fenolik mampu menangkap radikal bebas dengan cara memberikan atom hidrogen pada radikal bebas sehingga menghasilkan radikal bebas yang stabil. Senyawa fenolik memiliki sifat biologis yang berhubungan erat dengan aktivitas antioksidan (Pool-Zobel et al. 1999 dan Smith et al. 2000). Faktor-faktor yang memengaruhi ekstraksi senyawa fenolik, yaitu metode ekstraksi yang digunakan, pelarut ekstrak, banyaknya sampel, waktu ekstraksi, dan kondisi penyimpanan sampel (Cao & Prior 1990).
Gambar 3 Hubungan antara aktivitas antioksidan terhadap kandungan total fenol. 0 500 1000 1500 2000 2500 0 100 200 300 400 500 600 700 800
metanol metanol:air air
K a d a r fe n o l to ta l (m g k g --1) IC 50 (m g L -1)
Nilai IC50
Kandungan fenol total
Pelarut
1
Analisis Senyawa
Hasil analisis komponen senyawa dengan GCMS terhadap ekstrak metanol kayu bidara laut hasil partisi memberikan kromatogram dengan 31 senyawa (Lampiran 6). Empat komponen utama adalah striknin sebanyak 3.10 % (RT 40.52), 1,2,3-benzenatriol sebanyak 2.66% (RT 10.77), loganin aglikon sebanyak 2.44% (RT 31.96), dan asam-3-hidroksi-4-metoksibenzoat sebanyak 1.67% (RT 12.41). Komponen senyawa minor lainnya dapat dilihat pada Lampiran 6. Senyawa-senyawa tersebut diperoleh berdasarkan database GCMS dengan menggunakan Wiley7n.1 dengan nilai quality atau kedekatan dengan database di atas 90%. Dari adanya senyawa fenolik pada ekstrak metanol kayu bidara laut hasil partisi, diduga ekstrak tersebut berpotensi kuat sebagai antioksidan.
Fitokimia
Hasil uji fitokimia pada pohon bidara laut dapat dilihat pada Lampiran 7. Diketahui bahwa pada bagian daun, kayu, kulit kayu, dan akar terdapat golongan flavonoid, fenol, dan tanin, baik pada ekstrak metanol, maupun ekstrak metanol:air, dan air. Adanya senyawa golongan flavonoid, fenol, dan tanin pada tiap ekstrak pohon bidara laut menunjukkan bahwa pohon bidara laut berpotensi sebagai antioksidan. Menurut Taran et al. (2010), sebagian besar antioksidan alami berasal dari tanaman, antara lain berupa senyawaan tokoferol, karetenoid, asam askorbat, fenol, dan flavonoid. Tanin dan flavonoid dapat berfungsi sebagai antioksidan (Ciddi & Kaleab 2005).
SIMPULAN DAN SARAN
Simpulan
Bagian pohon bidara laut yang memiliki aktivitas antikosidan paling besar adalah bagian kayu. Hal ini ditunjukkan pada ekstrak metanol kayu dengan nilai IC50 148.41 mg L-1
dan nilai IC50 ekstrak metanol kayu hasil
partisi 103.14 mg L-1. Kadar total fenol pada ekstrak ini adalah 1936.844 mg kg-1 sampel kering. Hasil analisis senyawa dengan GCMS menunjukkan terdapat senyawa fenolik dengan komponen utama 1,2,3-benzenatriol sebanyak 2.66% (RT 10.77).
Saran
Perlu dilakukan fraksionasi dan pencirian ekstrak metanol kayu hasil partisi untuk menentukan golongan senyawa yang aktif sebagai antioksidan serta identifikasi struktur senyawa aktif menggunakan HPLC, spektrum IR, dan spektrum resonans magnet inti 1H dan
13
.
DAFTAR PUSTAKA
Barlow SM. 1990. Toxicological aspect of antioxidants used as food additives. London: Elsevier.
Blouis MS. 1958. Antioxidant determinations by the use of a stable free radical. Nature 181:1199-1200.
Cao G, Prior R. 1990. Measurements of oxygen radical absorbance capacity in biological samples. Methods in Enzymol 299:50-63.
Ciddi V, Kaleab A. 2005. Antioxidants of plant origin. J Nat. Prod 21:3-17.
Dzulkarnain. 1996. Penelitian Tanaman Obat di Beberapa perguruan Tinggi Indonesia. Pusat Penelitian dan Pengembangan Kesehatan, Departemen Kesehatan RI.
Edinur, Kosasih P, Hoyaranda E. 1979. Efek perasan Averrhoa carambola Linn., infus kayu Strychnos ligustrina Bl. 10%, infus daun Persea americana Mill.10%, infus daun Barleria dichotoma Roxb.10%, infus daun Symphytum ssp. 10% terhadap tekanan darah tikus. [skripsi]. Fakultas Farmasi, Institut Teknologi Bandung.
Hanani et al. 2005. Identifikasi senyawa antioksidan dalam spons Callysongia sp dari Kepulauan Seribu. Maj Ilmu Kefarmasian 2:127-133.
Harborne JB. 1996. Metode Fitokimia. Ed ke-2. Padmawinata K, Soediro I. Penerjemah; Niksolihin S, editor. Bandung: ITB. Terjemahan dari: Phytochemical Methods.
Hertog et al. 1995. Flavonoid intake and long-term risk of coronary heart disease and
1
Analisis Senyawa
Hasil analisis komponen senyawa dengan GCMS terhadap ekstrak metanol kayu bidara laut hasil partisi memberikan kromatogram dengan 31 senyawa (Lampiran 6). Empat komponen utama adalah striknin sebanyak 3.10 % (RT 40.52), 1,2,3-benzenatriol sebanyak 2.66% (RT 10.77), loganin aglikon sebanyak 2.44% (RT 31.96), dan asam-3-hidroksi-4-metoksibenzoat sebanyak 1.67% (RT 12.41). Komponen senyawa minor lainnya dapat dilihat pada Lampiran 6. Senyawa-senyawa tersebut diperoleh berdasarkan database GCMS dengan menggunakan Wiley7n.1 dengan nilai quality atau kedekatan dengan database di atas 90%. Dari adanya senyawa fenolik pada ekstrak metanol kayu bidara laut hasil partisi, diduga ekstrak tersebut berpotensi kuat sebagai antioksidan.
Fitokimia
Hasil uji fitokimia pada pohon bidara laut dapat dilihat pada Lampiran 7. Diketahui bahwa pada bagian daun, kayu, kulit kayu, dan akar terdapat golongan flavonoid, fenol, dan tanin, baik pada ekstrak metanol, maupun ekstrak metanol:air, dan air. Adanya senyawa golongan flavonoid, fenol, dan tanin pada tiap ekstrak pohon bidara laut menunjukkan bahwa pohon bidara laut berpotensi sebagai antioksidan. Menurut Taran et al. (2010), sebagian besar antioksidan alami berasal dari tanaman, antara lain berupa senyawaan tokoferol, karetenoid, asam askorbat, fenol, dan flavonoid. Tanin dan flavonoid dapat berfungsi sebagai antioksidan (Ciddi & Kaleab 2005).
SIMPULAN DAN SARAN
Simpulan
Bagian pohon bidara laut yang memiliki aktivitas antikosidan paling besar adalah bagian kayu. Hal ini ditunjukkan pada ekstrak metanol kayu dengan nilai IC50 148.41 mg L-1
dan nilai IC50 ekstrak metanol kayu hasil
partisi 103.14 mg L-1. Kadar total fenol pada ekstrak ini adalah 1936.844 mg kg-1 sampel kering. Hasil analisis senyawa dengan GCMS menunjukkan terdapat senyawa fenolik dengan komponen utama 1,2,3-benzenatriol sebanyak 2.66% (RT 10.77).
Saran
Perlu dilakukan fraksionasi dan pencirian ekstrak metanol kayu hasil partisi untuk menentukan golongan senyawa yang aktif sebagai antioksidan serta identifikasi struktur senyawa aktif menggunakan HPLC, spektrum IR, dan spektrum resonans magnet inti 1H dan
13
.
DAFTAR PUSTAKA
Barlow SM. 1990. Toxicological aspect of antioxidants used as food additives. London: Elsevier.
Blouis MS. 1958. Antioxidant determinations by the use of a stable free radical. Nature 181:1199-1200.
Cao G, Prior R. 1990. Measurements of oxygen radical absorbance capacity in biological samples. Methods in Enzymol 299:50-63.
Ciddi V, Kaleab A. 2005. Antioxidants of plant origin. J Nat. Prod 21:3-17.
Dzulkarnain. 1996. Penelitian Tanaman Obat di Beberapa perguruan Tinggi Indonesia. Pusat Penelitian dan Pengembangan Kesehatan, Departemen Kesehatan RI.
Edinur, Kosasih P, Hoyaranda E. 1979. Efek perasan Averrhoa carambola Linn., infus kayu Strychnos ligustrina Bl. 10%, infus daun Persea americana Mill.10%, infus daun Barleria dichotoma Roxb.10%, infus daun Symphytum ssp. 10% terhadap tekanan darah tikus. [skripsi]. Fakultas Farmasi, Institut Teknologi Bandung.
Hanani et al. 2005. Identifikasi senyawa antioksidan dalam spons Callysongia sp dari Kepulauan Seribu. Maj Ilmu Kefarmasian 2:127-133.
Harborne JB. 1996. Metode Fitokimia. Ed ke-2. Padmawinata K, Soediro I. Penerjemah; Niksolihin S, editor. Bandung: ITB. Terjemahan dari: Phytochemical Methods.
Hertog et al. 1995. Flavonoid intake and long-term risk of coronary heart disease and
1
AKTIVITAS ANTIOKSIDAN DAN ANALISIS
KOMPOSISI SENYAWA FENOLIK DARI POHON
BIDARA LAUT (Strychnos ligustrina)
ARIF SADONO
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
1
Analisis Senyawa
Hasil analisis komponen senyawa dengan GCMS terhadap ekstrak metanol kayu bidara laut hasil partisi memberikan kromatogram dengan 31 senyawa (Lampiran 6). Empat komponen utama adalah striknin sebanyak 3.10 % (RT 40.52), 1,2,3-benzenatriol sebanyak 2.66% (RT 10.77), loganin aglikon sebanyak 2.44% (RT 31.96), dan asam-3-hidroksi-4-metoksibenzoat sebanyak 1.67% (RT 12.41). Komponen senyawa minor lainnya dapat dilihat pada Lampiran 6. Senyawa-senyawa tersebut diperoleh berdasarkan database GCMS dengan menggunakan Wiley7n.1 dengan nilai quality atau kedekatan dengan database di atas 90%. Dari adanya senyawa fenolik pada ekstrak metanol kayu bidara laut hasil partisi, diduga ekstrak tersebut berpotensi kuat sebagai antioksidan.
Fitokimia
Hasil uji fitokimia pada pohon bidara laut dapat dilihat pada Lampiran 7. Diketahui bahwa pada bagian daun, kayu, kulit kayu, dan akar terdapat golongan flavonoid, fenol, dan tanin, baik pada ekstrak metanol, maupun ekstrak metanol:air, dan air. Adanya senyawa golongan flavonoid, fenol, dan tanin pada tiap ekstrak pohon bidara laut menunjukkan bahwa pohon bidara laut berpotensi sebagai antioksidan. Menurut Taran et al. (2010), sebagian besar antioksidan alami berasal dari tanaman, antara lain berupa senyawaan tokoferol, karetenoid, asam askorbat, fenol, dan flavonoid. Tanin dan flavonoid dapat berfungsi sebagai antioksidan (Ciddi & Kaleab 2005).
SIMPULAN DAN SARAN
Simpulan
Bagian pohon bidara laut yang memiliki aktivitas antikosidan paling besar adalah bagian kayu. Hal ini ditunjukkan pada ekstrak metanol kayu dengan nilai IC50 148.41 mg L-1
dan nilai IC50 ekstrak metanol kayu hasil
partisi 103.14 mg L-1. Kadar total fenol pada ekstrak ini adalah 1936.844 mg kg-1 sampel kering. Hasil analisis senyawa dengan GCMS menunjukkan terdapat senyawa fenolik dengan komponen utama 1,2,3-benzenatriol sebanyak 2.66% (RT 10.77).
Saran
Perlu dilakukan fraksionasi dan pencirian ekstrak metanol kayu hasil partisi untuk menentukan golongan senyawa yang aktif sebagai antioksidan serta identifikasi struktur senyawa aktif menggunakan HPLC, spektrum IR, dan spektrum resonans magnet inti 1H dan
13
.
DAFTAR PUSTAKA
Barlow SM. 1990. Toxicological aspect of antioxidants used as food additives. London: Elsevier.
Blouis MS. 1958. Antioxidant determinations by the use of a stable free radical. Nature 181:1199-1200.
Cao G, Prior R. 1990. Measurements of oxygen radical absorbance capacity in biological samples. Methods in Enzymol 299:50-63.
Ciddi V, Kaleab A. 2005. Antioxidants of plant origin. J Nat. Prod 21:3-17.
Dzulkarnain. 1996. Penelitian Tanaman Obat di Beberapa perguruan Tinggi Indonesia. Pusat Penelitian dan Pengembangan Kesehatan, Departemen Kesehatan RI.
Edinur, Kosasih P, Hoyaranda E. 1979. Efek perasan Averrhoa carambola Linn., infus kayu Strychnos ligustrina Bl. 10%, infus daun Persea americana Mill.10%, infus daun Barleria dichotoma Roxb.10%, infus daun Symphytum ssp. 10% terhadap tekanan darah tikus. [skripsi]. Fakultas Farmasi, Institut Teknologi Bandung.
Hanani et al. 2005. Identifikasi senyawa antioksidan dalam spons Callysongia sp dari Kepulauan Seribu. Maj Ilmu Kefarmasian 2:127-133.
Harborne JB. 1996. Metode Fitokimia. Ed ke-2. Padmawinata K, Soediro I. Penerjemah; Niksolihin S, editor. Bandung: ITB. Terjemahan dari: Phytochemical Methods.
Hertog et al. 1995. Flavonoid intake and long-term risk of coronary heart disease and
1
cancer in the seven countries study. Arch Int Med 155:381-386.
Huda. 2006. Aktivitas antimalaria ekstrak air kayu bidara laut (Strychnos ligustrina BI) terhadap Plasmodium berghei in vivo [tesis]. Fakultas Farmasi, Universitas Airlangga.
Kartika.2009. Strychnii lignum. http:// farrmasi. usd. ac. id/ projects/simplisia/ indeks.php/ detail_simplisia/25. (14 Jul 2010).
Kazutaka I, Tachibana S, Arthur R. 2009. In vitro antioxidative activities and polyphenol content of Eugenia polyantha weight grown in Indonesia. Pakistan J Biol Sci 12:1564-1570.
Lubis. 2008. Aktivitas antimalaria fraksi etil asetat kayu bidara laut (Strychnos ligustrina BI) pada Plasmodium berghei in vivo [tesis]. Fakultas Farmasi, Universitas Airlangga.
Lynam K, Smith D. 2009.GC/MS analysis of European Union (EU) priority polycyclic aromatic hydrocarbons (PAHs) using an agilent J&W DB-EUPAH GC Column with a column performance comparison. USA: Agilent Technologies I.
Molyneux P. 2004. The use of stable free radical diphenylpicrylhydrazyl (DPPH) for estimazing antioxidant activity. Songklanakarin J Sci Technol 26:211-219.
Permana et al. 2003. Antioxidantive constituents of Hedotis diffusa Wild. Nat Prod Sci 9:7-9.
Pool-Zobel B, Bub A, Schroeder N, Rechkemmer G. 1999. Anthocyanins are potent antioxidants in model systems but do not reduce endogenous oxidative DNA damage in human colon cells. Eur J Nutr 38:227-234.
Smith M et al. 2000. Bioactive properties of wild blueberry fruits. J Food Sci 65:352-356.
Subehan et al. 2006. Mechanism-based inhibition of CYP3A4 & CYP2D6 by indonesian medicinal plants. J Ethnopharmacol 105:449-455.
Sunarni T. 2005. Aktivitas antioksidan penangkap radikal bebas beberapa kecambah dari biji tanaman familia Papilionaceae. J Farm Indones 2:53-61.
Taran M, Rezazadeh S, Khanahmadi M. 2010. In vitro antimicrobial and antioxidant properties of Smyrnium cordifolium boiss. (Umbelliferae) extract. Asian J Plant Sc 9:99-103.
Winarno FG. 1997. Kimia Pangan dan Gizi. Jakarta: Gramedia.
1
AKTIVITAS ANTIOKSIDAN DAN ANALISIS
KOMPOSISI SENYAWA FENOLIK DARI POHON
BIDARA LAUT (Strychnos ligustrina)
ARIF SADONO
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
1
ABSTRAK
ARIF SADONO. Aktivitas Antioksidan dan Analisis Komposisi Senyawa Fenolik dari
Pohon Bidara Laut (Strychnos ligustrina). Dibimbing oleh DUDI TOHIR dan
BAMBANG WIYONO.
Pohon bidara laut (Strychnos ligustrina) memiliki kemampuan antioksidan. Tujuan
penelitian ini
menentukan aktivitas antioksidan pada ekstrak pohon bidara laut,
komposisi total fenol, dan analisis senyawa bioaktif dengan kromatografi
gas-spektrometer massa (GCMS).
Aktivitas antioksidan ditentukan menggunakan metode
1,1-difenil-2-pikril-hidrazil. Hasil penelitian menunjukkan bahwa bagian pohon yang
memiliki aktivitas antioksidan paling besar ialah ekstrak metanol kayu dengan nilai IC50
148.41 mg L
-1. Nilai IC50 setelah dipartisi menggunakan
n-heksana ialah 103.14 mg L
-1dengan butil hidroksil toluena sebagai kontrol positif memiliki nilai IC50 sebesar 10.86
mg L
-1. Kandungan total fenol menggunakan metode Folin-Ciocalteau diperoleh sebesar
1936.844 mg kg
-1sampel kering. Hasil analisis senyawa dengan GCMS menunjukkan
terdapat senyawa fenolik dengan komponen utama 1,2,3-benzenatriol sebanyak 2.66%
(RT 10.77).
ABSTRACT
ARIF SADONO. Antioxidant Activities and Phenolic Compound Analysis of Bidara Laut
(Strychnos ligustrina). Supervised by DUDI TOHIR and BAMBANG WIYONO.
1
AKTIVITAS ANTIOKSIDAN DAN ANALISIS
KOMPOSISI SENYAWA FENOLIK DARI POHON
BIDARA LAUT (Strychnos ligustrina)
ARIF SADONO
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
1
Judul : Aktivitas Antioksidan dan Analisis Komposisi Senyawa Fenolik dari
Pohon Bidara Laut (
Strychnos ligustrina
)
Nama : Arif Sadono
NIM : G44060841
Menyetujui
Pembimbing I,
Pembimbing II,
Drs. Dudi Tohir, MS
Dr. Ir. Bambang Wiyono, M.For.Sc
NIP 19571104 198903 1 001
NIP 19590326198703 104
Mengetahui
Ketua Departemen,
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 195012271976032002
1
PRAKATA
Puji dan syukur ke hadirat Allah SWT atas segala rahmat dan karunia-Nya,
sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul “Aktivitas
Antioksidan dan Analisis Senyawa Fenolik pada Pohon Bidara Laut (
Strychnos
ligustrina
)” yang dilaksanakan sejak bulan Juni 2010 di Laboratorium Kimia
Organik Departemen Kimia, FMIPA IPB dan Laboratorium Hasil Hutan Bukan
Kayu, Pusat Penelitian dan Pengembangan Hasil Hutan, Gunung Batu, Bogor.
Penulis mengucapkan terima kasih kepada Drs. Dudi Tohir, MS dan Dr. Ir.
Bambang Wiyono, M.For.Sc selaku pembimbing yang telah memberikan
pengarahan dan bimbingannya kepada penulis. Penulis juga mengucapkan terima
kasih kepada keluarga dan ibu tercinta atas didikan, doa, dan kasih sayangnya
yang tiada terkira, serta untuk seluruh keluarga besar di rumah, terima kasih atas
dukungan dan dorongannya.
Penulis juga mengucapkan terima kasih kepada Bapak Sabur, Mba Nia, Ibu
Yenni Karmila, Ibu Nunung, Bapak Arya, dan Ibu Siti Robiah atas bantuan yang
diberikan. Tak lupa, ungkapan terima kasih penulis kepada seluruh rekan-rekan
peneliti di Laboratorium Kimia Organik (Wulan, Ela, Ina, Saki, Farid, Tifah,
Dinda, Risal, Ridho, Luthfan Irfana), serta teman-teman Kimia 43 atas bantuan,
motivasi, diskusi, dan kebersamaan selama penulis menempuh studi dan
menjalankan penelitian.
Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Februari 2011
1
RIWAYAT HIDUP
Penulis dilahirkan di Madiun pada tanggal 15 November 1987 dari Alm.
Bapak Budi Supangat dan Ibu Tundjiati. Penulis merupakan anak keenam dari
enam bersaudara. Penulis menyelesaikan studi di SMAN 86 Jakarta pada tahun
2006. Pada tahun yang sama penulis diterima di Institut Pertanian Bogor (IPB)
melalui jalur Undangan Seleksi Masuk IPB (USMI). Tahun 2007 penulis diterima
pada Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
1
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Bidara Laut ... 1
Antioksidan ... 1
Metode DPPH ... 2
Senyawa Fenolik ... 2
Analisis GCMS ... 2
BAHAN DAN METODE
Bahan dan Alat ... 2
Persiapan Sampel ... 3
Kadar Air ... 3
Ekstraksi ... 3
Uji Aktivitas Antioksidan dengan Metode DPPH ... 3
Kandungan Total Fenol ... 3
Analisis Senyawa ... 3
Uji Fitokimia ... 3
HASIL DAN PEMBAHASAN
Kadar Air ... 4
Ekstraksi ... 4
Aktivitas Antioksidan ... 4
Kandungan Total Fenol ... 5
Analisis Senyawa ... 6
Fitokimia ... 6
SIMPULAN DAN SARAN
Simpulan ... 6
Saran ... 6
DAFTAR PUSTAKA ... 6
viii
DAFTAR TABEL
Halaman
1 Aktivitas antioksidan dan rendemen ekstrak ... 4
DAFTAR GAMBAR
Halaman
1 Pohon bidara laut ... 1
2 Sruktur DPPH: radikal bebas (a) bentuk tereduksi (b) ... 2
3 Hubungan antara aktivitas antioksidan terhadap kandungan total fenol ... 5
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 9
2 Kadar air pohon bidara laut ... 10
3 Rendemen hasil ekstraksi ... 10
4 Hasil uji aktivitas antioksidan ... 11
5 Kandungan total fenol ... 13
6 Kromatogram GCMS ekstrak metanol kayu hasil partisi ... 14
1
PENDAHULUAN
Radikal bebas diketahui memiliki reaktivitas yang tinggi sehingga dapat memicu reaksi berantai dalam sel tubuh. Hal ini dapat merusak sel dan akan menyebabkan munculnya berbagai penyakit dalam tubuh, seperti inflamasi, kanker, katarak, dan penuaan dini. Selain itu, juga dapat menyebabkan penyakit kardiovaskular dan aterosklerosis (Hertog et al. 1995). Aktivitas radikal tersebut dapat dihambat oleh antioksidan. Oleh karena itu, penelitian mengenai antioksidan dalam dekade ini banyak dilakukan.
Antioksidan alami mampu melindungi tubuh terhadap kerusakan yang disebabkan oleh spesies oksigen reaktif, dan mampu menghambat terjadinya penyakit degeneratif, serta mampu menghambat peroksidase lipid makanan. Antioksidan alami umumnya mempunyai gugus fenolik dalam struktur molekulnya. Antioksidan dapat diperoleh dari asupan makanan yang banyak mengandung vitamin C, vitamin E, β-karoten, dan senyawa fenolik (Sunarni 2005).
Banyak pohon di Indonesia yang belum dieksplorasi secara luas, salah satunya ialah pohon bidara laut (Strychnos ligustrina). Pohon tumbuh di Kabupaten Bima, Nusa Tenggara Barat pada ketinggian 10 sampai 100 meter di atas permukaan laut, dan biasanya di daerah berbatu. Kayu bidara laut banyak digunakan oleh masyarakat sebagai obat kencing manis, penyakit darah tinggi, dan malaria. Fraksi etil asetat kayu bidara laut pada dosis 2.30 mg kg-1 bb telah dilaporkan memiliki aktivitas antimalaria (Lubis 2008). Kayu bidara laut memiliki aktivitas antiradang dan menurunkan kadar gula darah. Ekstrak metanol daun bidara laut dapat berfungsi sebagai antidot dan stomatis (Subehan et al. 2006). Fitokimia kayu bidara laut terdiri atas alkaloid, tanin, brusin, striknin, dan steroid/triterpenoid (Kartika 2009). Secara alami, tanin dan flavonoid dapat berfungsi sebagai antioksidan (Ciddi & Kaleab 2005). Karena kayu bidara laut mengandung tanin serta memiliki aktivitas antiinflamasi dan antiradang, kayu bidara laut diperkirakan dapat digunakan sebagai antioksidan.
Penelitian ini bertujuan menentukan bagian pohon bidara laut yang mempunyai aktivitas antioksidan. Kandungan total fenol dan analisis senyawa bioaktif dilakukan dengan kromatografi gas-spektrometer massa (GCMS).
TINJAUAN PUSTAKA
Bidara Laut
Bidara laut (Gambar 1) merupakan tumbuhan yang berasal dari Kabupaten Bima, Nusa Tenggara Barat. Tumbuh pada ketinggian 10 sampai 100 meter di atas permukaan laut dan umumnya hidup di daerah bebatuan. Secara taksonomi pohon bidara laut diklasifikasikan kerajaan Plantae, divisi Magnoliophyta, kelas Magnoliopsida, bangsa Gentianales, suku Loganiaceae, marga Strychnos, dan jenis Strychnos ligustrina. Pohon bidara laut sering digunakan oleh masyarakat setempat sebagai obat kencing manis, penyakit darah tinggi, dan malaria (Edinur et al. 1979).
Gambar 1 Pohon bidara laut.
Ekstrak metanol daun dan kayu bidara laut telah ditunjukkan berpotensi sebagai antidot, stomatis, antelmentik, dan dapat menghambat enzim sitokrom P450 yang dapat mengganggu metabolisme oksidatif pada hati manusia (Subehan et al. 2006). Ekstrak air kayu bidara laut dengan dosis efektif 50% (ED50) 0.45 mg kg-1 bb berpotensi sebagai antimalaria (Huda 2006). Fraksi etil asetat kayu bidara laut pada dosis 2.30 mg kg-1 bb memiliki aktivitas antimalaria (Lubis 2008). Senyawa yang terkandung pada kayu bidara laut di antaranya alkaloid, tanin, brusin, striknin, dan steroid/triterpenoid (Kartika 2009). Menurut Dzulkarnain (1996), pohon bidara laut dapat digunakan sebagai bahan kosmetik alami. Selain itu, kulit batang pohon bidara laut berpotensi sebagai antijamur dan antibakteri serta dapat menyembuhkan penyakit bisul.
Antioksidan
1
radikal bebas tersebut dapat diredam. Antioksidan memiliki peranan yang cukup penting bagi kesehatan khususnya dalam mempertahankan tubuh dari kerusakan sel akibat adanya spesies radikal bebas. Berdasarkan sumbernya, terdapat antioksidan alami dan sintetik. Antioksidan alami mampu melindungi tubuh dari kerusakan yang disebabkan oleh spesies oksigen reaktif. Antioksidan alami umumnya memiliki gugus fenolik dalam struktur molekulnya (Sunarni 2005). Antioksidan sintetik seperti butil hidroksi toluena (BHT), butil hidroksi anisol (BHA) dan t-butil hidroksi kuinon (TBHQ) dapat memberikan dampak negatif bagi kesehatan. Selain itu, antioksidan sintetik mempunyai kelarutan yang rendah dibandingkan dengan antioksidan alami (Barlow 1990).
Aktivitas antioksidan dari suatu bahan alam dapat diuji dengan berbagai metode di antaranya xantin oksidase, tiosianat, kemampuan mereduksi ion feri (FRAP), kapasitas mereduksi kupri (CUPRAC), dan 1,1-difenil-2-pikrilhidrazil (DPPH). Metode DPPH banyak digunakan dalam penentuan aktivitas antioksidan ekstrak tanaman karena sederhana, cepat, dan tidak membutuhkan banyak reagen.
Metode DPPH
Salah satu metode uji aktivitas antioksidan senyawa alam adalah metode DPPH (Gambar 2a). Delokalisasi elektron pada molekul DPPH akan memberikan warna ungu yang dicirikan dengan pita serapan pada panjang gelombang 520 nm. Ketika DPPH ditambahkan ke dalam senyawa yang dapat memberikan atom hidrogen, DPPH akan berubah warna menjadi kuning, yakni warna bentuk tereduksinya, difenilpikrilhidrazin (Gambar 2b) (Molyneux 2004).
(a) (b)
Gambar 2 Struktur DPPH: radikal bebas (a) bentuk tereduksi (b).
Senyawa Fenolik
Senyawa fenolik meliputi aneka ragam senyawa dari tumbuhan yang mempunyai cincin aromatik dengan satu atau dua gugus hidroksil. Senyawa fenolik mudah larut dalam air, umumnya berikatan dengan gula sebagai glikosida, dan biasanya terdapat dalam vakuola sel. Beberapa ribu senyawa fenolik telah diketahui strukturnya. Flavonoid merupakan golongan terbesar, tetapi fenol monosiklik sederhana, fenilpropanoid, dan kuinon fenolik juga terdapat dalam jumlah besar. Beberapa golongan bahan polimer penting dalam tumbuhan seperti lignin, melanin, dan tanin adalah senyawa polifenol dan terkadang unit fenolik terdapat pada protein, alkaloid, dan di antara terpenoid. Semua senyawa fenol aromatik, maka menunjukkan serapan kuat di daerah spektrum tampak. Selain itu, secara khas senyawa fenolik menunjukkan geseran batokromik pada spektrumnya bila ditambahkan basa (Harborne 1996).
Analisis GCMS
Analisis dengan GCMS merupakan gabungan dari instrumen kromatografi gas (GC) dan spektrometer massa (MS) yang umumnya digunakan untuk mengidentifikasi senyawa atsiri dan semi-atsiri serta memisahkannya berdasarkan bobot per fragmennya. Sampel yang hendak dianalisis diidentifikasi dahulu dengan alat GC, kemudian dengan alat MS (Lynam & Smith 2009).
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan adalah akar, daun, kayu, dan kulit pohon bidara laut dari daerah Bima, Nusa Tenggara Barat, DPPH, metanol p.a, BHT, akuabides, asam galat, reagen Folin-Ciocalteau, Na2CO3, n-heksana, dan
etanol. Selain itu, digunakan pula pereaksi Meyer, Dragendorf, Wagner, dan Lieberman-Buchard.
Alat-alat yang digunakan adalah alat distilasi, peralatan kaca yang lazim di laboratorium, radas ekstraksi, wadah pengembang, penguap putar, botol uji (vial), neraca analitik, spektrofotometer UV Beckman DU-700, dan instrumen GCMS (Agilent Technologies).
1
Persiapan sampelSampel kayu, daun, akar, dan kulit batang bidara laut, dikeringudarakan hingga kering. Setelah itu, sampel diserbukkan dengan ukuran 40 mesh.
Kadar Air
Sampel sebanyak 3 g ditimbang ke dalam cawan yang telah diketahui bobot keringnya, kemudian dipanaskan pada suhu 105 oC selama 3 jam. Setelah didinginkan dalam eksikator, cawan yang berisi sampel ditimbang. Pemanasan dan penimbangan dilakukan berulang kali sampai diperoleh bobot tetap (stabil).
Ekstraksi
Serbuk akar, daun, kayu, dan kulit kayu bidara laut masing-masing 100 gram diekstraksi berturut-turut menggunakan pelarut metanol, metanol:air (1:1), dan air pada suhu 80 oC selama 8 jam. Ekstraksi dilakukan dua kali, kemudian ekstrak dipekatkan pada tekanan rendah dengan penguap putar. Setiap ekstraknya diuji fitokimia dan aktivitas antioksidan. Ekstrak yang memiliki aktivitas antioksidan paling tinggi dipartisi dengan n-heksana hingga lapisan n-heksana tidak berwarna dari warna semula. Ekstrak hasil partisi dipekatkan dengan penguap putar untuk selanjutnya dianalisis menggunakan instrumen GCMS.
Uji Aktivitas Antioksidan dengan Metode DPPH
Satu mL larutan ekstrak dimasukkan ke dalam tabung reaksi dan ditambahkan 3 mL larutan DPPH 0.004% (b/v) dalam metanol. Campuran dikocok kuat dan diinkubasi pada suhu 37 oC selama 30 menit lalu, diukur absorbansnya menggunakan spektrofotometer UV-tampak pada λ 515.5 nm. BHT digunakan sebagai kontrol positif. Nilai konsentrasi penghambat 50% (IC50) dihitung
menggunakan persamaan regresi linear hubungan antara konsentrasi dan % inhibisi.
Kandungan Total Fenol
Kandungan total fenol ditentukan dengan menggunakan metode Folin-Ciocalteau. Ekstrak metanol kayu bidara laut yang mengandung 1–5 mg bahan kering ekstrak
dilarutkan dalam 2 mL etanol dalam sederet tabung reaksi. Ke dalam setiap tabung reaksi ditambahkan 5 mL akuabides dan 0.5 mL reagen Folin-Ciocalteau 50% (v/v). Setelah 5 menit, ditambahkan 1 mL larutan Na2CO3 5%
(b/v) lalu campuran dihomogenisasi dan diinkubasi pada ruang gelap selama 1 jam. Campuran dihomogenisasi kembali dan absorbansnya diukur pada panjang gelombang 954 nm. Kurva standar fenol dibuat dengan menggunakan standar asam galat (5–50 mg L
-1
).
Analisis Senyawa
Senyawa bioaktif ekstrak metanol kayu hasil partisi dianalisis dengan GCMS menggunakan metode ionisasi Electron Impact pada GC yang digabung dengan MS 6890N; kolom kapiler HP-5MS (60 0.25 mm; suhu kolom 70 oC (44.67 menit) hingga 290 oC pada laju 15 oC/menit; gas pembawa helium pada tekanan tetap 18.39 psi.
Uji Fitokimia Alkaloid
Sebanyak 1 g ekstrak dilarutkan dalam 10 mL CHCl3 dan beberapa tetes NH4OH
kemudian disaring. Filtratnya (ekstrak CHCl3)
dimasukkan ke dalam tabung reaksi bertutup dan dikocok dengan 10 tetes H2SO4 2 M
sampai terbentuk 2 lapisan. Lapisan asam (tak berwarna) diteteskan pada lempeng tetes lalu ditambahkan pereaksi Meyer, Wagner, dan Dragendorf yang akan menimbulkan berturut-turut endapan putih, coklat, dan merah jingga.
Saponin
Sebanyak 1 g ekstrak dididihkan dengan 25 mL etanol selama 25 menit, disaring dalam keadaan panas, kemudian pelarut diuapkan sampai kering. Residu dikocok kuat dengan CHCl3, ditambahkan air suling lalu dibiarkan
sampai terbentuk 2 lapisan. Sebanyak 1 mL lapisan air dikocok selama 1 menit. Terbentuknya busa yang tidak hilang dalam 5 menit menandakan adanya saponin.
Fenol
Sebanyak 2 mL lapisan air pada uji saponin ditempatkan dalam tabung reaksi dan ditambahkan FeCl3. Timbulnya warna ungu,
biru, dan hijau menunjukkan positif fenolik.
Steroid dan Triterpenoid
Lapisan kloroform pada uji saponin diteteskan pada lempeng tetes dan dibiarkan
1
kering. Ditambahkan 3 tetes anhidrat asam asetat anhidrat dan 1 tetes H2SO4 pekat
(pereaksi Liebermann Buchard). Terbentuknya warna merah atau ungu menunjukkan kandungan senyawa triterpernoid, sedangkan warna hijau atau biru menunjukkan kandungan steroid.
Flavonoid
Sebanyak 0.1 g ekstrak ditambahkan 10 mL air panas dan dididihkan selama 5 menit. Setelah itu, disaring dan filtratnya digunakan untuk pengujian. Filtrat dimasukkan ke dalam tabung reaksi, ditambahkan 0.5 g serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol, lalu dikocok kuat. Warna merah/kuning/jingga pada lapisan alkohol menunjukkan kandungan flavonoid.
Tanin
Sebanyak 0.1 g ekstrak dimasukkan ke dalam tabung reaksi kemudian ditambahkan 10 mL air panas dan dikocok sampai dingin. Setelah itu, ditambahkan 4 tetes NaCl 10%, disaring, dan filtratnya dibagi dua. Filtrat pertama diberi 5 tetes gelatin 1%, endapan putih menunjukkan kandungan tanin. Filtrat kedua diberi 5 tetes FeCl3 1%, warna
hijau-kebiruan menunjukkan kandungan tanin. Diagram alir penelitian ini dapat ditunjukkan pada Lampiran 1.
HASIL DAN PEMBAHASAN
Kadar Air
Penentuan kadar air berfungsi untuk mengetahui cara penyimpanan terbaik untuk sampel simplisia dan dapat memperkirakan jumlah sampel yang dibutuhkan. Sampel simplisia dikeringudarakan dengan bantuan cahaya matahari. Pengeringan bertujuan agar simplisia dapat disimpan relatif lebih lama. Kadar air kayu, kulit kayu, daun, dan akar bidara laut berturut-turut ialah 9.12, 11.39, 10.90, dan 10.50% (Lampiran 2). Nilai kadar air menunjukkan bahwa hanya bagian kayu yang tahan terhadap pertumbuhan mikrob dan dapat disimpan dalam jangka relatif lama. Menurut Winarno (1997), suatu bahan berada dalam keadaan yang stabil dan pertumbuhan mikrob dapat dikurangi jika kadar air bahan kurang dari 10%.
Ekstraksi
Metode ekstraksi yang digunakan adalah ekstraksi dengan bantuan pemanasan (refluks) dengan suhu 80 oC. Metode ini digunakan karena rendemen yang dihasilkan cukup besar dan tidak membutuhkan banyak pelarut. Selain itu, sampel yang digunakan memiliki sifat tahan panas sebagaimana dapat dilihat dari morfologi simplisia yang rigid baik akar, daun, kayu, maupun kulit kayu. Hasil rendemen ekstrak dapat dilihat Tabel 1 dan Lampiran 3. Rendemen ekstrak terbesar terdapat pada ekstrak metanol akar, yaitu 6.84%, sedangkan rendemen ekstrak terkecil adalah ekstrak air akar (1.30%).
Tabel 1 Aktivitas antioksidan dan rendemen ekstrak
Bagian Pelarut IC50 Rendemen
pohon ekstrak (mg L-1) (%) Akar MeOH 239.61 6.48 MeOH:Air 267.65 2.66 Air 1134.98 1.30 Daun MeOH 2175.68 5.76 MeOH:Air 1774.96 3.84 Air 648.46 1.75 Kayu MeOH 148.41 2.62 MeOH:Air 443.87 2.71 Air 690.96 2.10 Kulit MeOH 489.46 3.67 Kayu MeOH:Air 433.25 3.51 Air 352.19 1.74 BHT 10.86
Ekstraksi menggunakan pelarut dengan perbedaan kepolaran, yaitu metanol, metanol:air, dan air. Perbedaan pelarut ini bertujuan mengetahui aktivitas antioksidan dari tiap bagian simplisia. Tabel 1 menunjukkan bahwa rendemen ekstrak tidak memengaruhi aktivitas antioksidan. Ekstrak yang memiliki aktivitas antioksidan paling besar selanjutnya dipartisi dengan n-heksana. Hal ini bertujuan meningkatkan aktivitas antioksidan dan menghilangkan lemak, steroid/triterpenoid, serta senyawa nonpolar lainnya yang ikut terekstraksi.
Aktivitas Antioksidan
Metode yang digunakan dalam pengujian aktivitas antioksidan adalah metode serapan radikal DPPH. Metode ini sederhana, mudah, dan menggunakan sampel dalam jumlah sedikit dengan waktu yang singkat (Hanani et al. 2005). Pengukuran aktivitas antioksidan sampel dilakukan dengan spektrofotometer
1
UV-tampak pada panjang gelombang 515.5 nm yang merupakan panjang gelombang maksimum DPPH dengan konsentrasi 0.004% (b/v). Adanya aktivitas antioksidan dari sampel mengakibatkan perubahan warna larutan DPPH yang semula berwarna violet menjadi kuning pucat (Permana et al. 2003). Besarnya aktivitas antioksidan ditandai dengan nilai IC50, yaitu konsentrasi larutan
sampel yang dibutuhkan untuk menghambat 50% radikal bebas DPPH.
Bagian pohon bidara laut yang berpotensi sebagai antioksidan ialah bagian kayu (Lampiran 4). Ekstrak metanol kayu bidara laut memiliki nilai IC50 148 mg L-1. Menurut
Blouis (1958), suatu bahan dapat berpotensi sebagai antioksidan yang kuat jika memiliki nilai IC50 kurang dari 200 mg L-1.
Dibandingkan dengan ekstrak lainnya, ekstrak metanol kayu memiliki aktivitas antioksidan yang paling besar. Bagian pohon yang memiliki aktivitas antioksidan terendah adalah daun dengan nilai IC50 pada ekstrak metanol,
metanol:air, dan air berturut-turut 2175.68, 1774.96, dan 648.46 mg L-1.
Nilai IC50 ekstrak metanol setelah dipartisi
dengan n-heksana lebih kecil dibandingkan dengan ekstrak metanol kasar kayu, yaitu 103.14 mg L-1. Meskipun terdapat peningkatan aktivitas antioksidan, nilainya masih lebih kecil daripada BHT sebagai kontrol positif yang memiliki nilai IC50 10.86
mg L-1. Semakin kecil nilai IC50-nya
menunjukkan semakin besar aktivitas antioksidannya (Molyneux 2004).
Kandungan Total Fenol
Penentuan kandungan total fenol pada ekstrak metanol kayu bidara laut
menggunakan metode Folin-Ciocalteau dan asam galat sebagai larutan standar. Kurva kalibrasi larutan standar dibuat dengan deret konsentrasi 20, 25, 30, 35, 40, 45, 50 mg L-1. Dari deret konsentrasi larutan standar diperoleh persamaan regresi y = 0.0241 + 0.0107x dengan R2 = 0.99946. Nilai R2 yang mendekati 1 membuktikan bahwa persamaan regresi tersebut adalah linear. Konsentrasi larutan sampel diperoleh dengan menggunakan kurva kalibrasi dengan cara mengukur absorbans sampel, lalu kandungan total fenol ditentukan dengan menggunakan persamaan regresi linear. Kandungan total fenol dalam ekstrak metanol, metanol:air, dan air kayu bidara laut berturut-turut ialah 1936.844, 1874.051, dan 829.437 mg kg-1 sampel kering