ISOLASI BAKTERI AMILOLITIK ASAL PUPA SUTRA
Attacus atlas
DAN KARATERISASI ENZIM AMILASENYA
FANY SORAYA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
Fany Soraya. Isolasi Bakteri Amilolitik Asal Pupa Sutra Attacus atlas dan Karakterisasi Enzim Amilasenya. Di bawah bimbingan NISA RACHMANIA MUBARIK dan DEDY DURYADI SOLIHIN.
Enzim amilase merupakan salah satu enzim yang menguasai pasar enzim dunia, selain itu enzim ini memiliki peranan penting pada berbagai industri di Indonesia. Permintaan akan enzim amilase cukup besar dan memiliki nilai ekonomis yang tinggi. Oleh karena itu, dibutuhkan sumber penghasil enzim amilase yang mudah dikembangkan. Mikroorganisme merupakan salah satu penghasil enzim ektraselular yang mudah untuk dikembangkan. Penelitian ini menggunakan bahan berupa larva dan pupa sutra Attacus atlas. Adapun tujuan dari penelitian ini ialah mengisolasi bakteri amilolitik asal pupa sutra Attacus atlas dan karakterisasi enzim amilase yang dihasilkan isolat bakteri terpilih. Isolasi dilakukan dengan menggunakan media nutrient agar yang ditambahkan inducer 1% pati, sehingga lebih mudah untuk memperoleh bakteri amilolitik. Sebanyak 12 isolat bakteri asal pupa sakit, pupa sehat, ulat sakit, dan ulat sehat yang akan diukur indeks amilolitiknya. Berhasil diperoleh 6 isolat bakteri yang memiliki indeks amilolitik tertinggi yang akan dilakukan tahap penelitian selanjutnya. Isolat USK 1 dan USK 8 memiliki aktivitas spesifik enzim tertinggi yaitu sebesar 0,285 U/mg protein dan 0,40 U/mg protein. Hasil karakterisasi enzim menunjukkan bahwa amilase isolat USK 1 memiliki suhu optimum 30°C, pH optimum sebesar 5, dan termasuk metaloamilase. Adapun keadaan optimum untuk amilase isolat USK 8 meliputi : suhu optimum 30°C, pH optimum 4, dan termasuk ke dalam metaloamilase. Identifikasi hanya dilakukan pada isolat terpilih yaitu isolat USK 1 menggunakan Microgen Bioproduct uji fisiologis. Hasil identifikasi isolat USK 1 merupakan bakteri Burkholderia pseudomallei yang berbentuk batang, Gram negatif, dan bersifat patogen.
Kata kunci: isolasi, bakteri amilolitik, aktivitas amilase, karakterisasi enzim.
ABSTRACT
Fany Soraya. Isolation of Amylolitic Bacteria from Attacus atlas’s Silk Pupa and The Characterization of Its Amylase Enzyme. Surpervised by NISA RACHMANIA MUBARIK and DEDY DURYADI SOLIIHIN.
Amylase is one of an enzyme that controls of the world enzyme market, beside it enzyme plays an important role in various industries in Indonesia. The demands of amylase are quite large and have high economic value. Therefore, sources of the enzyme are needed. Microorganism is one of the producer of extracellular enzymes. The materials used in this study were Attacus
atlas’s larva and pupas. The purpose of this study was to isolate amilolytic bacteria from Attacus
atlas’s larva and pupas, and to characterize the amylase enzyme that is produced by the selected bacterial isolates. Isolation is done by using media that were added inducer of 1% starch. 12 bacteria were obtained from sick pupas, healthy pupas, sick caterpillars and healthy caterpillars, which will be measured amylolytic index. Selected six amylolytic isolates which had the highest index that will used to the next experiment. Isolates USK 1 and 8, had the highest specific enzyme activity that is equal to 0.285 U / mg protein and 0.40 U / mg protein. The result of enzyme characterization showed isolates USK 1 had a temperature optimum at 30°C, pH optimum of 5, with the increased consistency of enzymes, and produced a metaloamilase enzyme. The optimum condition of isolates USK 8 amylase included 30 °C and pH 4. The amylase was catagorised metalloamylase. Identification is only performed on selected isolates the USK 1 using Microgen Bioproduct (physiological testing). The identification of bacterial isolates USK 1 showed that the bacteria is a rod-shaped Burkholderia pseudomallei, which is Gram negative, and pathogenic.
ISOLASI BAKTERI AMILOLITIK ASAL PUPA SUTRA
Attacus atlas
DAN KARATERISASI ENZIM AMILASENYA
FANY SORAYA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Isolasi Bakteri Amilolitik Asal Pupa Sutra
Attacus atlas
dan
Karaterisasi Amilasenya
Nama
: Fany Soraya
NIM
: G34080048
Menyetujui,
Dr. Nisa Rachmania Mubarik, M.Si.
Pembimbing I
Dr. Dedy Duryadi Solihin, DEA.
Pembimbing II
Mengetahui,
Dr. Ir. Ence Darmo Jaya Supena, M.Si.
Ketua Departemen Biologi
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya, sehingga
karya ilmiah ini dapat diselesaikan. Penelitian dengan judul “Isolasi Bakteri Amilolitik Asal Pupa Sutra Attacus atlas dan Karakterisasi Enzim Amilasenya” ini dilakukan mulai Januari 2012 sampai dengan Juni 2012 di Laboratorium Mikrobiologi, Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor (FMIPA IPB).
Terima kasih penulis ucapkan kepada Dr. Nisa Rachmania Mubarik, M.Si. dan Dr. Dedy Duryadi Solihin, DEA atas bimbingan, arahan serta semangat yang diberikan dalam penelitian ini. Tak lupa ucapan terima kasih disampaikan kepada bapak Prof. Dr. Alex Hartana sebagai wakil komisi pendidikan atas saran dan diskusi yang diberikan. Ungkapan terima kasih juga disampaikan kepada Direktorat Jendral Pendidikan Tinggi (Dikti) yang telah mendanai penelitian ini, tak lupa kepada Ibu Heni dan Pak Jaka selaku laboran di laboratorium Mikrobiologi IPB atas segala bantuan dan saran selama melakukan penelitian ini. Penulis juga mengucapkan terima kasih kepada keluarga tercinta yang senantiasa memberikan doa, dan dukungan, serta kepada seluruh teman-teman Biologi Angkatan 45 khususnya Satria, Tri Lugina, Retno, Annisa dan Ayang Eka Yuromiati, serta teman-teman kosan yang telah memberi bantuan dan semangat.
Penulis berharap semoga karya tulis ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
Bogor, Agustus 2012
RIWAYAT HIDUP
Penulis dilahirkan di Bekasi pada tanggal 5 Mei 1990 dari pasangan Haryadi dan Lutfiah. Penulis merupakan anak kedua dari dua bersaudara. Penulis menyelesaikan pendidikan dasar dan menengah di SDN Harapanjaya IX pada tahun 2002, SMPN 5 Bekasi pada tahun 2005, dan SMAN 4 Bekasi pada tahun 2008. Setelah itu, penulis melanjutkan pendidikan tinggi pada Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Udangan Seleksi Masuk IPB (USMI).
Penulis mempunyai pengalaman sebagai asisten praktikum pada mata kuliah Fisiologi Tumbuhan 2011/2012. Penulis juga pernah aktif dalam organisasi di antaranya KOPMA (Koperasi Mahasiswa) Insititut Pertanian Bogor 2008/2009, Himpunan Mahasiswa Biologi (Himabio) anggota divisi Biosains tahun 2009/2010. Selain itu, penulis juga pernah bergabung dalam beberapa kepanitiaan, di antaranya sebagai bendahara LCTB (Lomba Cepat Tepat Biologi) rangkaian PESTA SAINS 2009/2010, sekretaris MPD (Masa Perkenalan Departemen) 2010,serta berpartisipasi dalam berbagai aktivitas keorganisasian di FMIPA IPB. Selama masa kuliah penulis berkesempatan menerima beasiswa dari Beasiswa Bantuan Mahasiswa (BBM) dan menjadi peserta PIMNAS (Pekan Ilmiah Mahasiswa Nasional) 2012 di UMY (Universitas Muhammadiyah Yogyakarta) yang berhasil meraih medali perak.
DAFTAR ISI
Halaman
DAFTAR TABEL ...viii
DAFTAR GAMBAR ...viii
DAFTAR LAMPIRAN ...viii
PENDAHULUAN Latar belakang ... 1
Tujuan ... 1
BAHAN DAN METODE Waktu dan Tempat ... 1
Bahan ... 1
Isolasi dan Seleksi Bakteri Amilolitik ... 1
Seleksi Isolat Amilolitik Berdasarkan Aktivitas Enzim Amilasenya ... 2
Pengamatan Laju Pertumbuhan dan Produksi Amilase ... 2
Karakterisasi Amilase dari Isolat Terpilih ... 2
Uji Kestabilan Aktivitas Enzim Amilase ... 3
Identifikasi Bakteri dari Isolat Terpilih ... 3
HASIL Isolasi dan Seleksi Bakteri Amilolitik ... 3
Seleksi Isolat Amilolitik Berdasarkan Aktivitas Enzim Amilasenya ... 4
Pengamatan Laju Pertumbuhan dan Produksi Amilase ... 4
Karakterisasi Amilase dari Isolat Terpilih ... 4
Uji Kestabilan Akivitas Enzim Amilase ... 5
Identifikasi Bakteri dari Isolat Terpilih ... 6
PEMBAHASAN... 6
SIMPULAN ... 7
DAFTAR PUSTAKA ... 7
viii
DAFTAR TABEL
Halaman
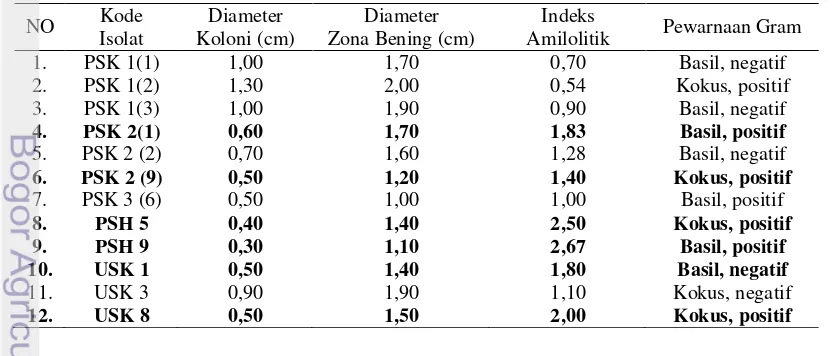
1 Ciri-ciri isolat amilolitik asal pupa sakit, pupa sehat, ulat sakit, dan ulat sehat Attacus atlas. 3
2 Aktivitas spesifik dari enam isolat terpilih, diukur pada suhu 40°C ... 5
DAFTAR GAMBAR Halaman 1 Kurva pertumbuhan sel dan aktivitas spesifik enzim isolat USK 1... 4
2 Kurva pertumbuhan sel dan aktivitas spesifik enzim isolat USK 8... 5
3 Pengaruh suhu terhadap aktivitas amilase isolat USK 1 dan USK 8 ... 5
4 Pengaruh pH terhadap aktivitas amilase isolat USK1 dan USK 8 ... 5
5 Pengaruh penambahan kation dan EDTA terhadap aktivitas amilase isolat USK 1 dan USK 8 5 6 Kestabilan aktivitas enzim amilase isolat USK 1diukur pada pH 5 dengan suhu 30°C ... 5
7 Kestabilan aktivitas enzim amilase isolat USK 8 diukur pada pH 4 dengan suhu 30°C ... 6
DAFTAR LAMPIRAN Halaman 1 Skema metode Bernfeld (1955) ... 10
2 Kurva standar maltosa ... 11
3 Metode pengukuran kadar protein (Bradford 1976) ... 12
4 Log jumlah sel dan aktivitas amilase USK 1 ... 13
5 Log jumlah sel dan aktivitas amilase USK 8 ... 13
6 Aktivitas amilase isolat USK 1 dan USK 8 pada berbagai suhu ... 13
7 Aktivitas amilase isolat USK 1 dan USK 8 pada berbagai pH ... 14
8 Aktivitas amilase isolat USK 1 dan USK 8 pada berbagai pH ... 14
1
PENDAHULUAN Latar belakang
Salah satu jenis enzim yang banyak dihasilkan oleh mikroorganisme ialah enzim amilase. Enzim amilase memiliki distribusi perdagangan yang sangat luas dan merupakan salah satu jenis enzim yang paling banyak dipelajari baik di Indonesia maupun di luar Indonesia. Aplikasi enzim ini memiliki cakupan yang sangat luas mulai dari industri tekstil sampai ke pengujian-pengujian laboratorium (Aiyer 2005). Kebutuhan amilase di dunia sangat tinggi, pada tahun 2004 saja mencapai penjualan sekitar US $2 milyar, sedangkan amilase yang digunakan untuk industri makanan dan minuman pada tahun 2004 bernilai sekitar US $11juta. Produksi amilase oleh Bacillus lichineformis
dan Aspergillus sp. sekitar 300 ton enzim murni per tahun (Sivaramakrisnan et al.
2000).
Amilase adalah kelompok enzim yang mampu mengkatalisis proses hidrolisis pati, suatu polimer glukosa yang terdapat pada polisakarida tumbuh-tumbuhan. Amilase yang
terlibat dalam hidrolisis pati ialah α-amilase, β
amilase, glikoamilase, α glukosidase, dan
enzim pemutus cabang yang terdiri atas pullulanase serta isoamilase (Lehninger 2011). Ulat sutra merupakan salah satu serangga berguna yang dipandang mempunyai nilai ekonomis tinggi karena mampu menghasilkan serat sutra. Salah satu kelebihan dari ulat sutra liar Attacus atlas diantaranya memiliki warna alami yang bervariasi dari seratnya yang eksklusif. Attacus atlas adalah hewan tersebar luas di Indonesia, serangga ini adalah polyvoltin yang dapat hidup lebih dari dua generasi dalam setahun (Peigler 1989). Serangga ini dapat mengkonsumsi lebih dari 90 jenis tanaman pakan, dengan bobot kokon dan benang yang jauh lebih besar dari ulat sutra domestik, dan harga benangnya sangat mahal serta bagian - bagian lain dari serangga dapat dimanfaatkan untuk kebutuhan manusia (Awan 2007).
Indonesia kaya akan biodiversitas yang memiliki potensi untuk dikembangkan, salah satunya mikroorganisme yang menjadi sasaran dalam penghasil enzim khusunya enzim amilase. Fase larva Attacus atlas
merupakan pemakan daun yang diharapkan di dalam tubuh larva dan pupanya memiliki enzim amilase yang berkualitas baik. Sehingga pada penelitian ini dilakukan isolasi bakteri amilolitik asal pupa dan ulat sutra
Attacus atlas.
Tujuan
Penelitian ini bertujuan untuk mengisolasi bakteri amilolitik asal pupa sutra
Attacus atlas dan mengkarakterisasi enzim amilase yang dihasilkan isolat bakteri terpilih.
BAHAN DAN METODE Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari 2012 sampai bulan Juni 2012 bertempat di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
Bahan
Bahan yang digunakan dalam penelitian ini ialah sampel pupa dan ulat dari serangga penghasil sutra alami yaitu Attacus atlas asal kebun teh Kabupaten Purwakarta, Provinsi Jawa Barat.
Isolasi dan Seleksi Bakteri Amilolitik Sebanyak 0,3 gram pupa atau ulat dimasukkan ke dalam 30 ml media nutrient broth (NB) yang mengandung 1% pati tapioka dalam Erlenmeyer 50 ml. Kultur lalu digoyang di atas mesin penggoyang dan diinkubasi selama 24 jam pada suhu ruang ± 25°C. Pengenceran serial dari 10-1 sampai 10-5dilakukan dalam garam fisiologis NaCl 0,85%. Sebanyak 1 ml suspensi dituang di dalam media NA (nutrient agar) yang mengandung 1% pati tapioka, dan diinkubasi selama 24 jam pada inkubator pada suhu ± 37°C. Bakteri yang menghasilkan zona bening, diambil lalu digoreskan ke media NA yang mengandung 1% pati tapioka lain dengan metode cawan gores.
2
didapat aktivitas spesifik dari parameter tersebut.
Seleksi Isolat Amilolitik Berdasarkan Aktivitas Enzim Amilasenya
Metode yang digunakan ialah metode hitungan cawan dan turbiditas untuk membuat kurva standar (Hadioetomo 1990). Sebanyak 2 cuplik isolat terpilih dari biakan agar-agar miring ditumbuhkan di media NB (mengandung 1% pati tapioka) dalam 50 ml Erlenmeyer dan diinkubasi dalam inkubator goyang dengan kecepatan 120 rpm pada suhu 25°C selama 8 jam. Tahap berikutnya dilakukan pengenceran serial 10-1 hingga 10-7 untuk menghitung jumlah sel bakteri dengan metode total plate count (Hadioetomo 1990). Selanjutnya dibuat grafik yang menyatakan hubungan OD (Optical Density) terkoreksi dan jumlah organism per ml. Pengukuran jumlah sel dilakukan dengan spektrofotometer pada panjang gelombang 620 nm.
Pengamatan Laju Pertumbuhan dan Produksi Amilase
Sebanyak 1-2 lup bakteri ditumbuhkan pada 50 ml media cair NB ditambah 1% pati kecepatan 120 rpm selama 8 jam. Setiap 3 jam kultur diambil sebanyak 10 ml untuk mengukur turbiditas sel dan untuk pengujian aktivitas amilase serta kadar protein.
Enzim ekstrak kasar diperoleh dengan mensentrifugasi kultur pada kecepatan 10000 rpm pada suhu 4°C selama 10 menit. Supernatan yang mengandung ekstrak enzim kasar dipisahkan dari endapannya dan diuji aktivitas serta kadar proteinnya. Pengujian
aktivitas enzim α-amilase dilakukan menggunakan metode Bernfeld (1955). Sebanyak 1 ml enzim ekstrak kasar dicampur dengan 1 ml larutan tepung tapioka 1% (dalam bufer fosfat pH 7 dengan konsentrasi 0.05 M), lalu diinkubasi pada suhu 40°C selama 15 menit. Campuran tersebut direaksikan dengan 1 ml pereaksi dinitrosalisilat (DNS) dan direndam dalam air mendidih selama 5 menit pada suhu 100°C. Absorbansi diukur dengan spektrofotometer pada panjang gelombang 540 nm (Lampiran 1). Maltosa digunakan sebagai standar. Satu
unit (U) aktivitas α-amilase adalah jumlah enzim yang dapat memproduksi 1µmol maltosa per menit per ml dan satu unit aktivitas enzim setara dengan 16,67 nkat/ml (Dybkaer 2001). Larutan standar maltosa dibuat dengan melarutkan 50 mg maltosa dalam 50 ml akuades (1 mg/ml). Larutan stok diencerkan hingga diperoleh konsentrasi maltosa dari 0, 0,2, 0,4, 0,6, 0,8, sampai 1,0 mg/ml. Sebanyak 1 ml larutan stok standar maltosa ditambah 1 ml tepung tapioka 1%, lalu inkubasi selama 15 menit pada suhu 40°C. Campuran tersebut direaksikan dengan 1 ml pereaksi dinitrosalisilat (DNS) dan dididihkan dalam penangas air selama 5 menit pada suhu 100°C. Larutan didinginkan lalu diukur absorbansinya dengan spektrofotometer pada panjang gelombang 540 nm. Dari hasil absorbansi dan konsentrasi maltosa, maka akan didapatkan regresi linear dan persamaan matematik untuk standar maltosa, yang akan digunakan dalam pengukuran kadar enzim (Lampiran 2).
Kadar protein diukur dengan metode Bradford (Bradford 1976). Sebanyak 100 µl sampel enzim ditambahkan dengan 5 ml pereaksi Bradford, dikocok kuat dan dibiarkan selama 10 menit lalu diukur dengan spektrofotometer pada panjang gelombang 595 nm. Standar menggunakan Bovin Serum Albumin (BSA) dengan konsentrasi 0-1 mg/ml protein. Blanko menggunakan 100 µl akuades dicampur dengan 5 ml pereaksi Bradford, kemudian dikocok dan diukur absorbansinya (Lampiran 3). Kurva hubungan log sel dan aktivitas spesifik amilase dibuat berdasarkan hasil pengamatan laju pertumbuhan sel dan produksi amilase isolat terpilih. Aktivitas spesifik adalah jumlah unit enzim per milligram protein. Aktivitas spesifik merupakan suatu ukuran kemurnian enzim.
3
dilakukan dalam karakterisasi, dengan menggunakan kation dari bentuk garam klorida FeCl3, CuCl2, CaCl2, CoCl2, NaCl,
ZnCl2, dan MgCl2 dengan konsentrasi 2mM
sebanyak 1 ml. Kemudian dilakukan penambahan etilen diamin tetra asetat (EDTA) sebanyak 1 ml. Seluruh karakterisasi ini dilakukan sebanyak 2 kali ulangan.
Uji Kestabilan Enzim Amilase
Enzim ekstrak kasar dari dua isolat optimum enzim berdasarkan hasil karaterisasi. Setelah itu dibuat grafik hubungan antara waktu inkubasi dan aktivitas enzim amilase dari data yang didapat.
Identifikasi Bakteri dari Isolat Terpilih Identifikasi dilakukan dengan menggunakan Microgen Bioproduct kode 12A dan 12B. Isolat terpilih diambil 1-2 lup untuk dipindahkan pada agar-agar miring segar. Biakan diinkubasi selama 24 jam, setelah itu dimasukkan pada garam fisiologis sebanyak 1-2 lup dan dihomogenisasi. Cairan yang telah dihomogenisasi dimasukkan pada lubang-lubang kit Microgen Bioproduct ±1µl per lubang. Biakan diinkubasi kembali pada suhu 37°C selama 24 jam, dan diamati perubahan warna uji fisiologis. Nilai hasil uji
fisiologis diinterpretasikan pada Microbact Software.
HASIL
Isolasi dan Seleksi Bakteri Amilolitik Bakteri diisolasi pada sampel pupa sakit (PSK), pupa sehat (PSH), ulat sakit (USK), dan ulat sehat (USH). Isolat amilolitik yang diperoleh berjumlah 12 (Tabel 1), hasilnya menunjukkan indeks amilolitik yang terbentuk berkisar antara 0,54-2,67. Dari 12 isolat sebanyak 7 isolat bakteri Gram positif berbentuk batang (basil) dan bulat (kokus), 5 isolat bakteri Gram negatif berbentuk batang (basil) juga bulat (kokus) (Tabel 1). Isolat diseleksi berdasarkan indeks amilolitik terbesar yang dihasilkan masing-masing isolat. Isolat dipilih 6 dari 12 isolat yang memiliki indeks amilolitik terbesar. Berdasarkan seleksi tersebut didapatkan 6 isolat : PSK 2(1), PSK 2(9), PSH 5, PSH 9, USK 1, dan USK 8 (Tabel 1). Setiap isolat dilakukan pewarnaan Gram untuk mengetahui ciri-ciri morfologi masing-masing isolat.
Indeks amilolitik diperoleh dari selisih antara diameter zona bening dan diameter koloni yang hasilnya dibagi dengan diameter koloni itu sendiri. Pengukuran indeks amilolitik merupakan seleksi awal secara kualitatif untuk menentukan adanya aktivitas enzim amilase yang dihasilkan oleh bakteri. Uji kuantitatif dengan mengukur aktivitas spesifik enzim amilase dilakukan pada 6 isolat yang memiliki indeks amilolitik (IA) tinggi.
Tabel 1 Ciri-ciri isolat amilolitik asal pupa sakit, pupa sehat, ulat sakit, dan ulat sehat Attacus
Amilolitik Pewarnaan Gram
4
Seleksi Isolat Amilolitik Berdasarkan Aktivits Enzim Amilasenya
Sebanyak 6 isolat terbaik yang dipilih untuk perhitungan jumlah sel yaitu PSK 2(1), PSK 2(9), PSH 5, PSH 9, USK 1, dan USK 8. Hasil perhitungan jumlah sel dari 6 isolat diperoleh jumlah sel/ml yang optimal berkisar
antara 1,4.109- 8.109 (Tabel 2). Jumlah sel yang optimal ini baik untuk dilakukan pengukuran aktivitas spesifik enzim. Persamaan pada kurva standar digunakan untuk menentukan jumlah sel pada pembuatan kurva tumbuh. Setelah dihitung jumlah selnya/ml, enzim amilase dan kadar protein (Tabel 2) dari keenam isolat ini diukur, sehingga dapat dihitung nilai aktivitas spesifiknya. Dua isolat ternyata tidak memiliki aktivitas enzim amilase yaitu PSH 5 dan PSH 9, namun kedua isolat ini memiliki kadar protein yang cukup tinggi (Tabel 2). Berdasarkan aktivitas spesifik enzim amilasenya, terdapat dua isolat yang memiliki aktivitas spesifik enzim tertinggi yaitu isolat USK 1 dan USK 8. Pengukuran laju tumbuh hanya dilakukan pada dua isolat tersebut, yaitu USK 1 dan USK 8 yang memiliki aktivitas enzim amilase terbesar.
Pengamatan Laju Pertumbuhan dan Produksi Amilase
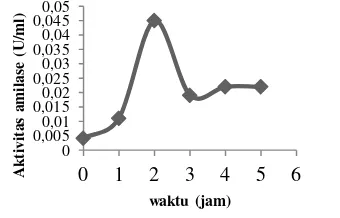
Laju pertumbuhan sel untuk isolat USK 1 dan USK 8, diamati bersamaan dengan kadar protein, dan aktivitas amilasenya selama 24 jam. Pengukuran dilakukan setiap 3 jam sekali (pertumbuhan sel, kadar protein, dan aktivitas enzim amilase). Pertumbuhan dari isolat USK 1 menunjukkan bahwa selama selang waktu inkubasi 24 jam terjadi peningkatan log jumlah sel hingga jam ke-12, selanjutnya relatif stabil sampai jam ke-24 (Lampiran 4). Peningkatan log jumlah sel, seiring dengan peningkatan nilai aktivitas spesifik enzim amilase yang dihasilkan.
Aktivitas spesifik tertinggi untuk isolat USK 1 terjadi pada jam ke-12 yaitu sebesar 0,580 U/mg protein, kemudian menurun pada jam ke-15 (Gambar 1). Selama selang waktu inkubasi 24 jam, log jumlah sel isolat USK 8 mengalami peningkatan yang signifikan hingga jam ke-24 (Lampiran 5). Fluktuatif log jumlah sel ini, diikuti pula oleh nilai aktivitas spesifik isolat USK 8. Aktivitas spesifik maksimum untuk isolat USK 8 terjadi pada jam ke-18 yaitu sebesar 3,2 U/mg protein, seiring dengan nilai log jumlah sel yang maksimum (Gambar 2). Keadaan ini terjadi ketika sel berada pada fase stasioner.
Gambar 1 Kurva pertumbuhan sel dan aktivitas spesifik enzim isolat USK 1.
Gambar 2 Kurva pertumbuhan sel dan aktivitas spesifik enzim USK 8.
Karakterisasi Amilase dari Isolat Terpilih Karakterisasi enzim dilakukan pada beberapa parameter, meliputi : suhu, pH kation, dan senyawa EDTA. Hasil karakterisasi terhadap suhu yang dilakukan pada kisaran 25-60°C menunjukkan aktivitas enzim amilase yang dihasilkan oleh isolat USK 1 dan USK 8 tertinggi pada suhu 30°C, (Gambar 3) (Lampiran 6). Aktivitas enzim amilase tertinggi untuk isolat USK 1 pada pH 5, sedangkan untuk isolat USK 8 memiliki pH optimum 4. (Gambar 4) (Lampiran 7). Perlakuan penambahan kation Fe3+, Cu2+, Ca2+, Co2+, Na+, Zn2+, dan Mg2+ dilakukan bersamaan dengan penambahan senyawa pengkelat logam EDTA yang mempengaruhi aktivitas enzim amilase. Penambahan kation Fe3+, Ca2+, dan Zn2+ berpengaruh dapat
meningkatkan aktivitas enzim amilase isolat USK 1 (Gambar 5) (Lampiran 8). Kation yang dapat meningkatkan aktivitas enzim amilase USK 8 diantaranya : Fe3+, Ca2+, Co2+, Zn2+,
5 dan USK 8 dapat menurunkan aktivitas enzim amilase. Oleh karena itu, untuk meyakinkan penurunan aktivitas enzim amilase akibat penambahan EDTA dilakukan perlakuan penambahan EDTA dengan kation FeCl3
sebagai kation yang paling tinggi dalam meningkatkan aktivitas enzim amilase. Hasilnya menunjukkan, dapat mengakibatkan penurunan aktivitas enzim amilase, bahkan untuk isolat USK 8 mengalami penurunan aktivitas enzim amilase yang cukup drastis (Gambar 5) (Lampiran 8).
Gambar 3 Pengaruh suhu terhadap aktivitas amilase isolat USK 1 dan USK 8.
Gambar 4 Pengaruh pH terhadap aktivitas amilase isolat USK1 dan USK 8.
Gambar 5 Pengaruh penambahan kation dan EDTA terhadap aktivitas amilase isolat USK 1 dan USK 8.
Uji Kestabilan Akivitas Enzim Amilase Pengukuran kestabilan aktivitas enzim amilase kedua isolat USK 1 dan USK 8 dilakukan selama 5 jam dengan jeda setiap 1 jam.
6
Gambar 7 Kestabilan aktivitas enzim amilase isolat USK 8 diukur pada pH 4 dengan suhu 30°C.
Kestabilan enzim amilase untuk isolat USK 1 mengalami kenaikan dari jam ke-1 hingga jam ke-2 (Gambar 6), berbeda dengan enzim amilase yang dihasilkan oleh USK 8 karena cenderung mengalami kenaikan dan penurunan (Gambar 7).
Identifikasi Bakteri dari Isolat Terpilih Identifikasi dilakukan hanya pada isolat USK 1 yang merupakan isolat terpilih, dengan nilai aktivitas enzim amilase yang dihasilkan lebih baik daripada isolat USK8. Isolat USK 1 merupakan bakteri Burcholderia pseudomallei yang memiliki bentuk sel batang dengan Gram negatif (Lampiran 9).
PEMBAHASAN
Uji kualitatif terhadap adanya enzim amilase yang bekerja dilakukan dengan pengamatan zona bening pada medium padat yang mengandung 1% pati. Zona bening menandakan terdapat aktivitas enzim amilase ektraseluler yang dihasilkan bakteri dalam mendegradasi pati yang terdapat di medium padat selektif. Setelah zona bening terbentuk, dapat dihitung indeks amilolitik yang dihasilkan. Jika dibandingkan dengan hasil penelitian Kurniasih (2012) dari isolat asal tanah yang memiliki indeks amilolitik antara 0,33-0,80, isolat amilolitik yang berasal dari ulat sutra dengan indeks amilolitik yang lebih tinggi berkisar 0,54-2,67. Indeks amilolitik yang dihasilkan dibandingkan juga dengan diameter koloni, Jamilah (2011) menyeleksi isolat penghasil enzim potensial berdasarkan indeks aktivitas yang tertinggi dari isolat yang didapatkan. Isolat yang menghasilkan diameter zona bening dua kali diameter koloni merupakan produser enzim yang potensial (Ochoa-Solani & Olmos-Soto 2006). Penelitian ini menghasilkan isolat amilolitik
yang memiliki potensi tinggi dalam menghasilkan enzim amilase. Isolat USK 1 merupakan isolat terpilih yang diidentifikasi dengan uji fisiologis Microgen Bioproducts
dan isolat ini digolongkan sebagai bakteri
Burkholderia pseudomallei. Menurut Mayasari (2006) bakteri Burkholderia pseudomallei merupakan bakteri patogen yang dapat menghasilkan enzim amilase untuk mendegradasi pati dan disakarida lainnya. Bakteri ini juga dapat memfermentasi glukosa, galaktosa, dan sukrosa.
Ashger (2007) melaporkan bahwa
aktivitas α-amilase B. subtilis JS-2004 terjadi pada jam ke-48 setelah inkubasi atau pada saat sel mengalami fase stasioner. Isolat USK 8 telah mencapai fase stasioner saat menghasilkan aktivitas enzim amilase tertinggi, namun isolat USK 1 belum mencapai fase stasioner dalam menghasilkan enzim amilase tertinggi. Setiap bakteri memiliki kondisi berbeda-beda dalam menghasilkan enzim ekstraseluler, tidak harus terakumulasi pada fase stasioner.
Hasil dari pengukuran aktivitas enzim amilase, menunjukkan terdapat dua isolat (PSH 5 dan PSH 9) yang tidak memiliki aktivitas enzim amilase. Padahal, kedua isolat ini memiliki indeks amilolitik yang cukup tinggi. Hal ini disebabkan pada saat pengukuran aktivitas enzim amilase, ada beberapa faktor yang mempengaruhi kerja enzim yang tidak sesuai dengan optimasi enzim yang dihasilkan PSH 5 dan PSH 9, misalnya saja pH dan suhu yang sangat mempengaruhi kerja enzim. Pada pengukuran pH, yang dipakai adalah pH netral dan suhu ruang (25°C) belum diketahui pH dan suhu optimumnya. Menurut Copeland (2000) pH dari suatu larutan enzim dapat mempengaruhi keseluruhan aktivitas katalitik dengan berbagai cara dan sebagian besar enzim paling stabil pada pH fisiologi (7,4), tetapi beberapa di antaranya memperlihatkan maksimal pada nilai pH sedikit lebih rendah atau lebih tinggi.
7
menyebabkan terjadinya denaturasi enzim yaitu kerusakan struktur protein enzim, terutama kerusakan pada ikatan ion dan ikatan hidrogennya. Demikian pula dengan pH, banyak enzim yang sensitif terhadap perubahan pH dan setiap enzim memiliki pH optimum untuk aktivitasnya. Perubahan pH dapat menyebabkan berhentinya aktivitas enzim akibat proses denaturasi pada struktur tiga dimensi enzim (Palmer 1985). Kedua isolat ini berada pada keadaan optimum di suhu 30°C dan pH 5 (USK 1) pH 4 (USK 1). Antara kedua isolat tidak memiliki perbedaan pH yang begitu signifikan, ini diduga karena habitatnya sama. Habitat isolat USK 1 dan USK 8 adalah ulat sutera yang sakit dan pH ulat sutera yang sakit itu berkisar antara pH 4-6 (Atmosoedarjo 2000). Hal ini sesuai dengan pH optimum isolat USK 1 dan USK 8. Sementara untuk suhu, dinyatakan optimum apabila mengalami kenaikan aktivitas enzim, selanjutnya akan mengalami penurunan dan tidak ditandai kenaikan aktivitas enzim lagi (Baehaki et al. 2004). Menurut penelitian yang dilakukan oleh Pujoyuwono et al. (1997) suhu optimum enzim amilase sekitar 25-30°C, yang sesuai dengan suhu optimum 30°C pada kedua isolat karena tidak ditandai kenaikan signifikan setelah terjadi penurunan.
Kation yang digunakan sebagai karakterisasi enzim dipilih berdasarkan kompleks ion logam terhadap EDTA diantaranya ialah Mg2+, Ca2+, Ba2+, Fe3+/Fe2+, Co2+, Ni2+, Cu2+, Ag2+, Cd2+, dan Pb2+ (Harvey 2000). Hasil karakterisasi kation menunjukkan bahwa aktivitas enzim tertinggi ada pada Fe3+ untuk kedua isolat. Terjadi penurunan aktivitas enzim amilase, pada perlakuan EDTA dan NaCl selain itu untuk perlakuan kation Fe3+ dan EDTA juga menurun. Senyawa EDTA menyebabkan terganggunya kofaktor enzim sehingga terjadi penurunan aktivitas enzim, karena kation logam berhasil dikelat oleh EDTA. Ini membuktikan bahwa kedua jenis enzim amilase yang dihasilkan dapat digolongkan kepada metaloamilase. Menurut Lehninger (1993) turunnya aktivitas enzim dengan penambahan NaCl dapat terjadi karena perubahan konformasi protein enzim akibat adanya ion Na+ dan Cl- yang berikatan dengan gugus funsional asam amino sehingga mengubah muatan listriknya. Hal ini dapat mempengaruhi struktur sisi aktif protein, sehingga aktivitas enzim menjadi berubah.
Hasil uji kestabilan hanya menunjukkan aktivitas enzim yang fluktuatif, namun jika dibandingkan antara isolat USK 1 dan USK 8 terlihat aktivitas enzim amilase
USK 1 (Burkholderia pseudomallei)
cenderung naik daripada aktivitas enzim amilase USK 8 yang mengalami penurunan. Jika dibandingkan dengan penelitian Jamilah (2011), kestabilan enzim amilase yang dihasilkan Bacilus sp. mengalami penurunan selama 6 jam inkubasi, sehingga dapat dikatakan kestabilan enzim amilase yang dihasilkan Burkholderia pseudomallei lebih baik. Konsistensi enzim atau kestabilan enzim berhubungan dengan ketahanan enzim dalam mempertahankan konformasinya terhadap kondisi lingkungan sehingga tidak mengubah kedudukan sisi aktif ( Lehninger et al. 1993).
Scopes (1997) menyatakan bahwa semakin jauh pH optimum suatu enzim dari kondisi fisiologi suatu organisme, semakin kurang stabil enzim tersebut. Pada kondisi percobaan enzim lebih stabil pada pH optimum tidak selalu benar, karena aktivitas enzim pada kejenuhan substrat kondisi percobaan tidak sama dengan kondisi fisiologis alamiahnya. Menurut Whitaker (1994) ada beberapa faktor yang dapat mempengaruhi stabilitas enzim antara lain pH, suhu, proteolisis, dan waktu inkubasi. Copeland (2000) menjelaskan perubahan pH pada reaksi enzim berpengaruh dalam tahap katalisis yaitu mengkonversi substrat sehingga terjadi ionisasi pada komplek enzim substrat. Beberapa hal di atas yang membuat naik turunnya aktivitas enzim pada uji kestabilan, sehingga menjauhi suatu kestabilan enzim.
SIMPULAN
Isolasi bakteri dari ulat dan pupa sutra
Attacus atlas berhasil diperoleh 12 isolat, USK 1 dan USK 8 merupakan isolat amilolitik yang paling baik dalam menghasilkan enzim dengan pH optimum 4-5, suhu optimum 30°C, dan enzimnya termasuk ke dalam
metaloamilase. Isolat bakteri amilolitik terpilih berhasil diidentifikasi yang diduga bakteri Burkholderia pseudomallei yang memiliki kestabilan enzim yang meningkat.
DAFTAR PUSTAKA
Aiyer PV. 2005. Amylases and their applications. Afric-Biotechnol 4: 125– 1529.
Ashger M, Asad MJ, Rahman SU, Legee RL.
2007. A thermostable α-amylase from moderately thermophilic Bacillus subtilis
strain for starch processing. J Food Eng
8
Atmosoedarjo S. 2000. Sutera Alam Indonesia. Jakarta: Yayasan Sarana Wana Jaya.
Awan A. 2007. Domestikasi ulat sutra liar
Attacus atlas (Lepidoptera: Saturniidae) dalam usaha meningkatkan persutraan nasional. [disertasi]. Bogor: Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Baehaki A, Nurhayati T, Suharsono MT. 2004. Karakterisasi protease dari bakteri
Aeromonas hydrophyla. Bul Teknol Hasil Perik 8: 60-72.
Bernfeld P. 1955. Amylases α and β: Methods
in Enzymol I. New York: Academic of protein-dye binding. Anal Biochem 72: 248 – 254.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem 72: 248 – 254.
Copeland RA . 2000.“Methods for Protein Analysis: A Practical Guide to Laboratory Protocols". New York: Chapman and Hall. Dybkaer R. 2001. Unit katal for catalytic
activity. Pure Appl Chem 73: 927-931. Hadioetomo RS. 1990. Mikrobiologi Dasar
dalam Praktek. Jakarta: PT. Gramedia. Harvey D. 2000. Modern Analytical
Chemistry. Boston: McGraw-Hill.
Jamilah I. 2011. Penapisan Bacillus dan karakterisasi protease dan amilase ekstraseluler yang dihasilkan untuk degradasi sisa pakan budi daya udang. [disertasi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Kurniasih H. 2012. Isolasi bakteri amilolitik dan karakterisasi enzim amilase asal tanah Pulau Gili Meno Nusa Tenggara Barat. [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lehninger AL, Nelson DL, Cox MM. 1993.
Principles of Biochemistry. Ed ke-2. New York: Worth Publisher.
Mayasari E. 2006. Karakterisasi, infeksi, dan penanganan Burcholderia pseudomallei.
http://repository.usu.ac.id. [Selasa 14 Agustus 2012].
Ochoa-Solano J, Olmos-Soto J. 2006 The functional property of Bacillus for shrimp feeds. Food Microbiology 23: 519-525. Palmer T. 1985. Understanding Enzyme.
Amsterdam: Ellishorwood Publisher. Peigler RS. 1989. A Revision of The
Indo-Australian Genus Attacus. Beverly Hills: The Lepidoptera Researc Foundation, Inc. Pujoyuwono M, Trinovia D, Richana N,
Damardjati DS, Murdiyatmo U. 1997. Karakterisasi enzim amilase dari beberapa strain bakteri indigenous indonesia. Prosiding Seminar Teknologi Pangan; Bogor, 14 April 1997 hlm: 117-120. Scopes RK. 1997. Protein Purification
Principles and Practice. Ed ke-2. New York: Springer Verlag.
Sivaramakrishnan S, Gangadharan D, Nampoothiri KD, Sossol CR & Pandey A.2006.α-amylase from microbial sources- An overview on recent developments.
Food Technol Biotechnol 44: 173-184. Whitaker JR. 1994. Principles of Enzimology
10
Lampiran 1 Skema metode Bernfeld (1955)
Keterangan :
EEK : Enzim Ekstrak Kasar
Komposisi pereaksi Dinitrosalisilat (DNS) terdiri atas:
NaOH 1 g
KNa tartat 18,2 g
Na2SO3 (sodium sulfit) 0,05 g
DNS (asam dinitrosalisilat) 1 g
Akuades steril 100 ml
Cara membuat DNS :
Masukkan sebanyak 1 gram NaOH, 18,2 gram KNa tartat, dan 0,05 gram Na2SO3 ke
dalam 100 ml akuades steril kemudian diaduk hingga larut. Kemudian, tambahkan 1 gram DNS bubuk sedikit demi sedikit sambil diaduk hingga rata.
Sampel
1 ml EEK
1 ml substrat pati 1%
Homogenisasi
Inkubasi pada 40 oC 15
menit
1 ml DNS
Homogenisasi
Inkubasi pada 100 oC 15
menit
Pengukuran absorbansi pada λ 540 nm
Kontrol
1 ml substrat pati 1%
Inkubasi pada 40°C 15 menit
1 ml EEK
1 ml DNS
Inkubasi pada 100 oC 15
menit
Pengukuran absorbansi pada λ 540 nm
Blanko
Akuades
1 ml substrat pati 1%
Inkubasi pada 40°C 15 menit
1 ml DNS
Inkubasi pada 100 oC 15
menit
11
y = 0,946x + 0,006 R² = 0,993
0 0,2 0,4 0,6 0,8 1 1,2
0 0,2 0,4 0,6 0,8 1 1,2
A
b
so
rb
a
n
si
λ
=5
4
0
n
m
Konsentrasi maltosa (mg/ml)
Lampiran 2 Kurva standar maltosa
Nilai absorbansi blanko digunakan untuk mengurangi nilai absorbansi sampel dan kontrol menjadi nilai absorban sampel dan kontrol terkoreksi. Absorbansi terkoreksi dimasukkan ke dalam kurva standar maltosa sebagai nilai Y untuk memperoleh nilai X (konsentrasi maltosa).
y = 0,946x + 0,006 (maltosa)
Absorbansi maltosa =(As - Ab) - (Ak - Ab)
Keterangan : As = Absorbansi sampel Ab = Absorbansi blanko Ak = Absorbansi kontrol
Konsentrasi maltosa (x) = y – 0,006 0,946
Aktivitas enzim dihitung sebagai unit nanokatal (nkat) yang menunjukkan jumlah enzim yang dibutuhkan untuk menaikkan laju reaksi 1 nmol/s pada kondisi tertentu. Aktivitas enzim diukur dengan menggunakan rumus sebagai berikut.
Aktivitas α-amilase (nkat/ml) =
Keterangan :
FP : faktor pengenceran
BM : berat molekul maltosa(360,32 g/mol) V : volume enzim yang digunakan (1 ml) t : waktu inkubasi (15 menit)
12
y = 0,4871x + 0,2853 R² = 0,9832
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 1,1
A
b
so
rb
a
n
si
λ
=
5
9
5
n
m
Konsentrasi BSA (mg/ml)
Lampiran 3 Metode pengukuran kadar protein (Bradford 1976)
Komposisi pereaksi Bradford (Bradford 1976) lima kali terdiri atas:
Coomasie brilliant blue G-250 0,025 g Ethanol 95% 12,5 ml Asam ortofosfat 25 ml
Akuades 250 ml
Cara membuat pereaksi Bradford:
Sebanyak 0,025 g Coomasie brilian blue (CBB) G-250 dilarutkan dalam 12,5 ml etanol 95%, lalu ditambahkan 25 ml asam fosfor 85%, kemudian tambahkan akuades sebanyak 250 ml.
Campuran dihomogenkn (dikocok kuat) lalu disaring dengan kertas saring dan simpan dalam botol gelap dan suhu rendah.
Sebelum digunakan untuk mengukur kadar protein, pereaksi diencerkan dengan akuades (perbandingan 1:4) dan larutan BSA 1 mg/ml diencerkan dengan akuades (perbandingan 1:9). Kurva standar BSA dibuat dengan menambahkan sebanyak 5 ml pereaksi Bradford ke dalam 0,1 ml larutan BSA (bovine serum albumin) dengan konsentrasi 0,00 mg/ml – 1,0 mg/ml. selanjutnya campuran tersebut diinkubasi selama 10 menit pada suhu ruang dan absorbansinya dibaca pada panjang gelombang 595 nm. Sedangkan blanko dibuat dengan mencampurkan 0,1 ml akuades dengan 5 ml pereaksi Bradford, kemudian dikocok dan diukur absorbansinya pada panjang gelombang 595 nm.
Sampel yang akan diukur kadar proteinnya diperlakukan sama. Sebanyak 5 ml pereaksi Bradford ditambahkan ke dalam 0,1 ml sampel dan diinkubasi pada suhu ruang selama 10 menit. Selanjutnya absorbansi dibaca pada panjang gelombang 595 nm.
13
Lampiran 4 Log jumlah sel dan aktivitas amilase USK 1
Waktu (jam)
Log Jumlah Sel Kadar Protein (mg/ml)
Aktivitas Amilase (U/ml)
Aktivitas Spesifik (U/mg protein)
0 10,1 0,20 0,057 0,285
3 10,3 0,43 0,107 0,25
6 10,44 0,54 0,28 0,52
9 10,9 0,57 0,301 0,526
12 11,24 0,461 0,268 0,581
15 11,5 0,34 0,040 0,118
18 12 0,34 0,094 0,276
21 12,14 0,266 0,106 0,398
24 12,5 0,256 0,058 0,226
Lampiran 5 Log jumlah sel dan aktivitas amilase USK 8
Waktu (jam)
Log Jumlah Sel Kadar Protein (mg/ml)
Aktivitas Amilase
(U/ml)
Aktivitas Spesifik (U/mg protein)
0 7,16 0,260 0,088 0,4
3 7,21 0,266 0,093 0,35
6 7,41 0,369 0,192 0,52
9 7,55 0,539 0,301 0,558
12 8,15 0,564 0,048 0,085
15 8,3 0,303 8,8 x 10-3 0,029
18 8,43 0, 307 0,982 3,2
21 8,58 0,328 0,044 0,134
24 8,67 0,067 7,86 x 10-3 0,117
Lampiran 6 Aktivitas amilase isolat USK 1 dan USK 8 pada berbagai suhu
Suhu (°C) Aktivitas Amilase (U/ml)
USK 1 USK 8
25 0 0,104
30 0,358 0,195
35 0,0163 0,071
40 0,0496 0,073
45 0,136 0,111
50 0,028 0,04
55 0,013 0,068
14
Lampiran 7 Aktivitas amilase isolat USK 1 dan USK 8 pada berbagai pH
Lampiran 8 Aktivitas amilase isolat USK 1 dan USK 8 pada berbagai kation dan EDTA
Lampiran 9 Hasil identifikasi bakteri dengan menggunakan Microgen Bioproduct
A. B.
pH Aktivitas Amilase (U/ml)
USK 1 USK 8
4 0,073 0,107
5 0,105 0,0015
6 0,067 0,077
7 0,046 0,033
8 0,0015 0,013
9 0,032 0,035
Kation Aktivitas Amilase (U/ml)
USK 1 USK 8
FeCl3 0,263 0,25
CuCl2 0,0038 0,04
CaCl2 0,151 0,15
CoCl2 0,021 0,17
NaCl 0,025 0,01
EDTA 0,00296 0,063
ZnCl2 0,111 0,236
MgCl2 0,053 0,195
EDTA + FeCl3 0,05 0,033