ABSTRAK
TRIE NENNY FEBRIYANTI. Pengolahan Limbah Cair Praktikum Analisis Kualitatif
Logam Berat Menggunakan Polialuminium Klorida sebagai Koagulan. Dibimbing oleh
ETI ROHAETI dan IRMANIDA BATUBARA.
Kegiatan penelitian di laboratorium sering menggunakan bahan-bahan yang
mengandung logam berat. Salah satunya ialah analisis kualitatif golongan klorida dan
spot test
yang mengukur keberadaan logam berat dalam suatu sampel.
Air limbah ini
mengandung berbagai jenis bahan kimia terutama logam berat dan bahan-bahan yang
bersifat asam. Hal ini ditunjukkan oleh rendahnya nilai pH, tingginya kadar zat warna,
dan logam berat. Tempat penyimpanan limbah pun perlu mendapat perhatian.
Berdasarkan pengamatan, botol polipropilena
menjadi berwarna kehitaman setelah diisi
limbah logam berat selama 2 tahun. Penelitian ini mencoba mengolah limbah dengan
proses koagulasi dengan tujuan menentukan kondisi optimum penggunakan koagulan
polyaluminum chloride
(PAC) serta identifikasi botol polipropilena menggunakan
scanning electron microscope and energy dispersive spectrometer
.
Koagulasi yang
dilakukan menggunakan kombinasi konsentrasi PAC 500, 600, 700, 800 mg/L, dan pH 7,
8, 9, 10. Parameter yang diujikan adalah pH, warna, dan kadar logam berat Cr, Ni, dan
Pb. Dari hasil pengujian tersebut, penurunan tertinggi terlihat pada kadar logam Cr yang
mencapai 97,79% pada pH koagulasi 10 dan konsentrasi PAC 700 mg/L. Hasil
identifikasi botol polipropilena menunjukkan kandungan karbon yang menurun pada
ketiga botol sampel, sedangkan kandungan unsur-unsur lainnya relatif tidak terpengaruh.
ABSTRACT
TRIE NENNY FEBRIYANTI. Processing Laboratory Wastewater from Heavy Metal
Qualitative Experiments using Polyaluminum Chloride as Coagulant. Supervised by ETI
ROHAETI and IRMANIDA BATUBARA.
PENGOLAHAN LIMBAH CAIR PRAKTIKUM
ANALISIS KUALITATIF LOGAM BERAT
MENGGUNAKAN POLIALUMINIUM KLORIDA
SEBAGAI KOAGULAN
TRIE NENNY FEBRIYANTI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
TRIE NENNY FEBRIYANTI. Pengolahan Limbah Cair Praktikum Analisis Kualitatif
Logam Berat Menggunakan Polialuminium Klorida sebagai Koagulan. Dibimbing oleh
ETI ROHAETI dan IRMANIDA BATUBARA.
Kegiatan penelitian di laboratorium sering menggunakan bahan-bahan yang
mengandung logam berat. Salah satunya ialah analisis kualitatif golongan klorida dan
spot test
yang mengukur keberadaan logam berat dalam suatu sampel.
Air limbah ini
mengandung berbagai jenis bahan kimia terutama logam berat dan bahan-bahan yang
bersifat asam. Hal ini ditunjukkan oleh rendahnya nilai pH, tingginya kadar zat warna,
dan logam berat. Tempat penyimpanan limbah pun perlu mendapat perhatian.
Berdasarkan pengamatan, botol polipropilena
menjadi berwarna kehitaman setelah diisi
limbah logam berat selama 2 tahun. Penelitian ini mencoba mengolah limbah dengan
proses koagulasi dengan tujuan menentukan kondisi optimum penggunakan koagulan
polyaluminum chloride
(PAC) serta identifikasi botol polipropilena menggunakan
scanning electron microscope and energy dispersive spectrometer
.
Koagulasi yang
dilakukan menggunakan kombinasi konsentrasi PAC 500, 600, 700, 800 mg/L, dan pH 7,
8, 9, 10. Parameter yang diujikan adalah pH, warna, dan kadar logam berat Cr, Ni, dan
Pb. Dari hasil pengujian tersebut, penurunan tertinggi terlihat pada kadar logam Cr yang
mencapai 97,79% pada pH koagulasi 10 dan konsentrasi PAC 700 mg/L. Hasil
identifikasi botol polipropilena menunjukkan kandungan karbon yang menurun pada
ketiga botol sampel, sedangkan kandungan unsur-unsur lainnya relatif tidak terpengaruh.
ABSTRACT
TRIE NENNY FEBRIYANTI. Processing Laboratory Wastewater from Heavy Metal
Qualitative Experiments using Polyaluminum Chloride as Coagulant. Supervised by ETI
ROHAETI and IRMANIDA BATUBARA.
PENGOLAHAN LIMBAH CAIR PRAKTIKUM
ANALISIS KUALITATIF LOGAM BERAT
MENGGUNAKAN POLIALUMINIUM KLORIDA
SEBAGAI KOAGULAN
TRIE NENNY FEBRIYANTI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
sarjana sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Pengolahan Limbah Cair Praktikum Analisis Kualitatif Logam Berat
Menggunakan Polialuminium Klorida Sebagai Koagulan
Nama : Trie Nenny Febriyanti
NIM : G44204054
Menyetujui
Pembimbing I,
Pembimbing II,
Dr. Eti Rohaeti, MS
NIP 19600807 198703 2 002
Dr. Irmanida Batubara, M.Si
NIP 19750807 200501 2 001
Mengetahui
Ketua Departemen,
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya
sehingga karya ilmiah ini dapat diselesaikan. Karya ilmiah ini berjudul Pengolahan
Limbah Cair Praktikum Analisis Kualitatif Logam Berat Menggunakan Polialuminium
Klorida Sebagai Koagulan dan merupakan penelitian yang dilaksanakan mulai bulan
Februari 2010 sampai Juni 2010 di Laboratorium Kimia Analitik Departemen Kimia IPB.
Penulis mengucapkan terima kasih kepada Ibu Dr. Eti Rohaeti, MS dan Ibu Dr.
Irmanida Batubara, M.Si selaku pembimbing yang sudah memberikan masukan dan
pengarahan selama pelaksanaan penelitian dan penulisan karya ilmiah ini. Terima kasih
penulis ucapkan kepada suami, orang tua, dan keluarga atas segala kasih sayang,
semangat, dan doa yang telah diberikan. Terima kasih juga penulis sampaikan kepada Ibu
Prof. Dr. Ir. Latifah K. Darusman, MS selaku Kepala Bagian Kimia Analitik, Pak Eman,
Pak Dede, Ibu Nunung, Pak Ridwan, Pak Kosasih atas bantuan yang telah diberikan
kepada penulis.
Penulis berharap skripsi ini bermanfaat bagi banyak pihak.
Bogor, Agustus 2010
RIWAYAT HIDUP
Penulis dilahirkan di Palembang, Sumatera Selatan pada tanggal 9 Februari 1987
sebagai anak ketiga dari enam bersaudara pasangan R. Guntur dan Ida Fitriani.
Tahun 2004 penulis masuk Institut Pertanian Bogor melewati jalur Undangan
Seleksi Masuk IPB (USMI). Setelah mengikuti Tahap Persiapan Bersama (TPB), tahun
2005 penulis masuk Departemen Kimia IPB Fakultas Matematika dan Ilmu Pengetahuan
Alam.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... i
DAFTAR LAMPIRAN ... i
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Limbah Laboratorium ... 1
Logam Berat ... 2
Warna ... 3
Derajat Keasaman ... 3
Koagulasi
... 3
Polialuminium Klorida (PAC) ... 3
BAHAN DAN METODE
Bahan dan Alat ... 3
Metode ... 4
HASIL DAN PEMBAHASAN
pH Koagulasi ... 5
Warna ... 5
Kurva Stándar Logam Cr, Ni, dan Pb ... 6
Kadar Logam Terlarut ... 6
Identifikasi Unsur pada Botol Polipropilena (PP)
... 8
SIMPULAN DAN SARAN
Simpulan ... 8
Saran ... 9
DAFTAR PUSTAKA ... 9
DAFTAR GAMBAR
Halaman
1 Limbah Laboratorium Sebelum dan Setelah Perlakuan ... 5
2 Hubungan antara Konsentrasi PAC dan pH dengan Penurunan Warna ... 6
3 Kurva Standar Logam Cr, Ni, dan Pb ... 6
4 Hubungan Konsentrasi PAC dan pH dengan Penurunan Nikel ... 6
5 Hubungan Konsentrasi PAC dan pH dengan Penurunan Kromium ... 7
6 Hubungan Konsentrasi PAC dan pH dengan Penurunan Timbal ... 7
7 Hubungan Konsentrasi PAC dan pH Terhadap Bobot Endapan ... 7
8 Wadah Polipropilena
yang Telah Menghitam ... 8
9 Grafik Kandungan Unsur Pada Botol Polipropilena ... 8
DAFTAR LAMPIRAN
Halaman
1 Data Pemakaian Bahan Kimia dan Perkiraan Konsentrasinya ... 11
2 Diagram Variasi Konsentrasi Koagulan dan pH Koagulasi ... 12
3 Diagram Alir Penelitian ... 13
4 Pengaruh Konsentrasi Koagulan Terhadap pH Campuran ... 14
5 Pengaruh Konsentrasi PAC dan pH Terhadap Penurunan Warna ... 15
6 Data Pengukuran Larutan Standar Cr, Ni, dan Pb ... 16
7 Pengaruh Konsentrasi PAC dan pH Terhadap Penurunan Logam Ni ... 17
8 Pengaruh Konsentrasi PAC dan pH Terhadap Penurunan Logam Cr ... 18
9 Pengaruh Konsentrasi PAC dan pH Terhadap Penurunan Logam Pb ... 19
10 Nilai Perbandingan
Q
dan
Ksp
Pada Limbah Cair ... 20
11
Data Bobot Endapan Total Hasil Pengolahan Limbah dengan Koagulasi ... 21
12 Hasil Analisis Botol Polipropilena ... 22
PENDAHULUAN
Laboratorium di perguruan tinggi
merupakan fasilitas penunjang untuk
mewujudkan pendidikan, penelitian, dan pengabdian masyarakat. Di laboratorium, para mahasiswa memperoleh pengalaman praktis guna memahami teori-teori yang dipelajari di bangku kuliah melalui kegiatan praktikum dan
pembuatan tugas, sedangkan dosen
memerlukan laboratorium untuk memperoleh data ilmiah. Kegiatan di laboratorium ini menggunakan bahan kimia yang tentunya menghasilkan sejumlah bahan buangan atau limbah. Sebagian limbah tersebut beberapa diantaranya bersifat pencemar dan bahkan tergolong limbah bahan berbahaya beracun (B3) yang memerlukan penanganan khusus.
Kegiatan praktikum dan penelitian di laboratorium sering menggunakan bahan-bahan yang mengandung logam berat. Salah satunya ialah Analisis Kualitatif Terbatas:
Golongan Klorida dan Spot Test yang
mengukur keberadaan logam-logam seperti Hg, Pb, Ag, Cr, Fe, Mn, dan Ni secara kualitatif dalam suatu larutan contoh. Data pemakaian bahan kimia dan perkiraan konsentrasinya dalam limbah pada analisis tersebut dapat dilihat pada Lampiran 1. Logam berat tergolong limbah B3 yang pada
kadar tertentu dapat membahayakan
lingkungan sekitarnya karena bersifat toksik bagi hewan dan manusia (La Grega 2001).
Tempat penampungan limbah logam berat pun perlu mendapat perhatian. Berdasarkan pengamatan di laboratorium, limbah analisis
spot test yang disimpan selama kurang lebih 2
tahun dalam botol polipropilena
mengakibatkan warna dinding botol menjadi
hitam. Beberapa senyawa diduga
mengakibatkan perubahan warna tersebut dan perlu dianalisis lebih lanjut. Di samping itu,
lamanya penyimpanan limbah tersebut
sebelum dimanfaatkan sudah menyimpang dari Peraturan Pemerintah No. 18/1999 yang membatasi paling lama 90 hari.
Salah satu cara menanggulangi
pencemaran logam berat yang bisa diterapkan dalam pengolahan limbah laboratorium ialah
metode koagulasi. Metode koagulasi
merupakan proses absorpsi oleh koagulan terhadap partikel koloid yang menyebabkan destabilisasi pertikel. Ada beberapa jenis koagulan di antaranya adalah polialuminium
klorida (PAC) yang digunakan untuk
mengendapkan logam berat. Koagulan PAC mempunyai kelebihan, yaitu PAC lebih cepat
membentuk flok daripada koagulan biasa. Hal ini disebabkan adanya gugus aktif aluminat yang bekerja efektif dalam mengikat koloid yang ikatan ini diperkuat dengan rantai polimer dari gugus polielektrolit sehingga
gumpalan floknya menjadi lebih padat (Gao et
al. 2005). Karamah et al (2008)
mengungkapkan bahwa peningkatan dosis koagulan PAC dapat meningkatkan persen pemisahan logam berat besi, tembaga, dan nikel dari limbah serta dapat menurunkan nilai kebutuhan oksigen kimiawi (COD) dalam air limbah.
Setiap koagulan memiliki karakteristik yang berbeda-beda. Oleh karena itu, kondisi optimum koagulasi dengan koagulan tertentu perlu diketahui. Ada dua parameter utama yang memengaruhi proses koagulasi, yaitu konsentrasi koagulan dan pH koagulasi. Oleh karena itu, variasi kedua parameter tersebut dapat dilakukan untuk mencari kondisi optimum koagulasi. Penelitian ini bertujuan menentukan kondisi optimum kerja koagulan PAC pada limbah cair praktikum analisis
kualitatif logam berat (spot test) serta
mengidentifikasi unsur-unsur yang terdapat
pada botol kemasan polipropilena (PP) yang
digunakan untuk menampung limbah.
TINJAUAN PUSTAKA
Limbah Laboratorium
Limbah laboratorium pada dasarnya
merupakan limbah yang terbentuk dari
aktivitas laboratorium, seperti kegiatan
praktikum dan penelitian. Adanya bahan kimia di universitas dimulai dari pemberian bahan kimia yang diperlukan dari gudang kimia kepada pekerja atau mahasiswa yang
mengambil mata kuliah praktik atau
mahasiswa yang sedang melakukan penelitian di laboratorium. Bahan tersebut digunakan untuk sintesis maupun analisis. Oleh karena tujuan penggunaannya, maka terbentuklah bahan awal, produk samping, pelarut yang
digunakan dan bahan kimia yang
terkontaminasi sehingga bahan tersebut harus diurai atau dibuang jika daur ulang tidak mungkin dilakukan (Jamhari 2009).
Limbah laboratorium tidak boleh dibuang secara langsung begitu saja ke badan air.
Beberapa tipe limbah berbahaya yang
dapat membantu mengurangi atau menghilangkan sifat racunnya. Keuntungan dari penghilangan sifat racun juga mengurangi resiko kontaminasi pada pekerja laboratorium atau mahasiswa yang melakukan kegiatan di laboratorium (Jamhari 2009). Limbah yang dibuang sembarangan jika masuk ke badan air tanah dan mengalir ke pemukiman penduduk akan menimbulkan bahaya, terutama logam-logam berat. Jika tidak ditangani dengan dengan baik dapat membahayakan makhluk hidup dan merusak lingkungan (Saputra 2008).
Secara umum diketahui bahwa limbah dari
laboratorium umumnya bersifat sangat
beragam dibandingkan dengan limbah dari
sumber lainnya. Beberapa limbah
laboratorium itu berpotensi mengandung bahan dengan kategori B3 (Bahan Berbahaya Beracun) yang memerlukan penanganan secara khusus. Pengolahan limbah B3 dapat dilakukan secara fisika, kimia, dan biologi atau kombinasinya. Sebelum diolah, limbah B3 terlebih dahulu harus dianalisis parameter fisika, kimia dan/atau biologinya sebagai dasar untuk menentukan proses pengolahan limbah yang tepat, yang dapat memenuhi ketetapan baku mutu pembuangan dan/atau lingkungan. Terdapat beberapa alternatif teknologi proses pengolahan limbah B3 secara kimia, di antaranya netralisasi, presipitasi,
koagulasi-flokulasi, oksidasi, inaktivasi,
stabilisasi, dan insinerasi (Departemen Kimia 2007).
Logam Berat
Logam berat merupakan unsur-unsur logam yang memiliki densitas lebih besar dari 5 mg/l. Unsur-unsur ini terletak di bagian tengah dari daftar periodik. Logam-logam tersebut meliputi Ni, Mn, Pb, Cr, Cd, Zn, Cu, Fe, dan Hg. Diantara logam tersebut
merupakan unsur renik esensial bagi
pertumbuhan tanaman, hewan, dan manusia karena logam tersebut dibutuhkan hanya sedikit sekali untuk pertumbuhan dan bila kadarnya berlebih maka logam-logam tersebut bersifat racun. Oleh karena itu perlu adanya kontrol terhadap logam-logam berat dalam lingkungan (Departemen Kimia 2007).
Menurut Widowati et al. (2008), logam
berat bersifat toksik karena tidak bisa dihancurkan oleh organisme hidup yang ada
di lingkungan. Logam-logam tersebut
terakumulasi ke lingkungan, terutama
mengendap di dasar perairan dan membentuk senyawa kompleks bersama bahan organik
dan anorganik. Lebih lanjut dijelaskan urutan toksisitas logam berat terhadap hewan air dari yang paling toksik, yaitu merkuri (Hg), kadmium (Cd), seng (Zn), timbal (Pb), krom (Cr), nikel (Ni), dan kobalt (Co). Sedangkan urutan toksisitas logam terhadap manusia yaitu Hg, Cd, Ag, Ni, Pb, As, Cr, Sn, dan Zn. Berikut adalah logam-logam berat yang berbahaya bagi lingkungan dan kesehatan, antara lain:
1. Timbal (Pb)
Timbal merupakan jenis logam lunak yang berwarna coklat kehitaman serta mudah dimurnikan dalam proses pertambangan. Dalam pertambangan, logam ini berbentuk sulfida logam (PbS) yang sering disebut galena. Penggunaan paling banyak adalah bahan pada produksi baterai pada kendaraan bermotor (Darmono, 1995). Kebanyakan garam timbal hanya larut sebagian dalam air
dan beberapa diantaranya misalnya PbSO4
atau PbCrO4 tidak larut (Cotton FA &
Wilkinson G 1989). Timbal dapat diendapkan
sebagai Pb(OH)2 pada pH 10 dengan sisa
kadar timbal di bawah 0,05 mg/l (Teng 2000).
2. Kromium (Cr)
Kromium merupakan unsur yang terdapat melimpah di alam dengan berbagai bentuk oksida, yaitu Cr (0), Cr (III), Cr (IV), atau Cr (VI). Kromium merupakan logam yang tahan
korosi, dan mudah larut dalam HCl, H2SO4,
dan HClO4 tetapi menjadi pasif oleh HNO3
(Cotton FA & Wilkinson G 1989).
Pengolahan limbah yang mengandung
kromium terdiri dari 2 tahap yaitu mengubah Cr (VI) menjadi bentuk Cr (III) dan tahap
kedua Cr (III) diendapkan dengan
menggunakan kapur atau kaustik sampai pada pH kelarutan minimum Cr (III) yang berada pada rentang pH 7-8 (Teng 2000).
3. Nikel (Ni)
Nikel berwarna putih keperak-perakan dengan pemolesan tingkat tinggi. Bersifat keras, mudah ditempa, sedikit ferromagnetis, dan merupakan konduktor yang agak baik terhadap panas dan listrik. Nikel tergolong
dalam grup logam besi-kobal, yang dapat
Warna
Warna merupakan parameter yang penting untuk diukur dalam pengolahan air limbah. Warna yang timbul dalam perairan dapat disebabkan oleh bahan organik, alga atau mikroorganisme lainnya. Air yang berwarna dapat mengganggu keindahan dan dapat bersifat racun. Genangan air yang berwarna banyak menyerap oksigen dalam air, sehingga meningkatkan nilai COD dan dalam waktu lama akan membuat air berwarna hitam dan berbau (Sugiharto 2006).
Derajat Keasaman (pH)
Nilai derajat keasaman (pH) dapat
didefinisikan sebagai ukuran dari aktivitas ion
hidrogen (H+) yang menunjukkan suasana
asam atau basa. Penentuan pH harus seketika setelah sampel diambil dan sampel tidak dapat diawetkan karena nilai pH ditentukan oleh interaksi berbagai zat dalam air, termasuk zat-zat yang secara kimia maupun biokimia tidak stabil (Saeni 1989).
Pengaturan pH merupakan hal yang penting dalam proses pengolahan limbah
logam berat secara kimiawi melalui
pengendapan. Hal ini karena proses koagulasi-flokulasi terjadi pada pH tertentu tergantung
dari bahan koagulan yang digunakan.
Pengaturan pH dapat dilakukan dengan penambahan asam atau basa (Teng 2000).
Koagulasi
Prinsip pengendapan polutan berupa
partikel koloid adalah berdasarkan proses koagulasi dan flokulasi. Koagulasi adalah proses adsorpsi oleh koagulan terhadap
partikel-partikel koloid sehingga
menyebabkan destabilisasi partikel. Proses ini biasa disebut juga proses netralisasi partikel.
Setiap koagulan memiliki kondisi
optimumnya masing-masing dalam
mengendapkan polutan dalam limbah cair.
Proses koagulasi dilakukan dengan
pengadukan. Setelah selesai dengan proses koagulasi, proses dilanjutkan dengan tahap kedua yaitu flokulasi. Pada proses flokulasi terjadi penggabungan partikel yang tidak stabil sehingga membentuk flok yang lebih besar dan lebih cepat dapat dipisahkan (Teng 2000).
Mekanisme pengendapan dengan koagulan pada partikel koloid, berkaitan dengan muatan listrik pada partikel koloid tersebut. Partikel koloid memiliki muatan yang sama satu sama
lain. Akibatnya partikel koloid saling tolak menolak satu sama lain dan pembentukan partikel yang lebih besar menjadi terhalang. Koagulan yang mengandung muatan yang berlawanan dengan muatan partikel koloid akan mengadsorpsi koloid tersebut pada permukaannya dan menurunkan gaya tolak menolak antara koloid sehingga partikel tidak terhalang lagi untuk berkoagulasi, membentuk
partikel yang lebih besar dan dapat
mengendap (Aminzadeh et al. 2007).
Polialuminium Klorida (PAC)
Salah satu koagulan polimer utama adalah polialuminium klorida yang digunakan secara luas pada pengolahan air dan air limbah. Penggunaan PAC dimulai lebih dari 30 tahun yang lalu dan hingga sekarang penggunaannya
semakin berkembang. (Li et al. 2010). PAC
dengan rumus kimia Al13(OH)20(SO4)2Cl15
terbuat dari hidrolisis parsial asam alumunium klorida menggunakan reaktor yang spesifik
(Gao et al. 2005). PAC efektif bekerja pada
rentang pH yang cukup luas yaitu pH 6
sampai dengan 9 (Karamah et al. 2008).
Beberapa keunggulan PAC dalam proses
koagulasi adalah sangat baik untuk
menghilangkan kekeruhan dan warna,
memadatkan dan menghentikan penguraian flok, membutuhkan kebasaan rendah untuk hidrolisisnya, serta sedikit mempengaruhi pH. Keunggulan PAC lainnya, yaitu tidak menjadi
keruh bila pemakaiannya berlebihan,
sedangkan koagulan lain (seperti aluminium sulfat, besi klorida, dan ferro sulfat) bila dosis berlebihan bagi air yang kekeruhannya rendah maka akan bertambah keruh akibat dari flok yang berlebihan (Dempsey 1998).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah PAC,
NaOH 13%, HNO3 pekat, HCl pekat, botol
kemasan polipropilena, Pb(NO3)2, AgNO3,
CrCl3·6H2O, Ni(NO3)2·6H2O, air bebas ion,
dan akuades. Sampel adalah limbah yang
berasal dari praktikum mahasiswa di
Laboratorium Kimia Analitik dengan materi
“Analisis Kualitatif Terbatas Golongan
Klorida dan Spot Test” yang diadakan pada
semester genap 2009/2010 dengan jumlah sampel sebanyak 5,23 liter.
Alat-alat yang digunakan adalah
0.45 µm, pH meter HM-20S, spektrofotometer serapan atom (AAS) Analytic Jena Nova 300,
spektrofotometer DR 2000 Hach, SEM-EDS
EVO50, oven, neraca analitik, corong, pompa
vakum, dan peralatan kaca yang lazim di laboratorium
.
Metode
Penelitian ini dilakukan dalam beberapa tahap: pengukuran kondisi awal limbah, perlakuan dengan PAC, dan pengukuran kondisi akhir limbah, serta identifikasi
unsur-unsur yang terdapat dalam wadah
polipropilena. Pengukuran kondisi awal
limbah meliputi pengukuran pH, warna, dan kadar logam Ni, Cr, Hg, Pb, Fe, dan Mn.
Perlakuan terhadap contoh meliputi
pengaturan pH dan penambahan koagulan PAC. Penentuan kondisi optimum koagulasi dengan PAC dilakukan dengan meragamkan konsentrasi PAC sebesar 500, 600, 700, dan 800 mg/l, serta meragamkan pH menjadi 7, 8, 9, dan 10 (Lampiran 2).
Koagulasi dilakukan dengan menggunakan
pengaduk bermagnet. Setiap labu Erlenmeyer
diisi 150 ml contoh limbah, kemudian diatur pH dengan penambahan NaOH 13% untuk mencapai pH yang diinginkan. Selanjutnya campuran ditambahkan koagulan PAC dan
diaduk selama 10 menit. Pengadukan
dihentikan dan didiamkan selama 30 menit. Filtrat yang diperoleh diukur kembali pH, warna, dan kadar logamnya. Endapan yang terbentuk dikeringkan dalam oven sampai
bobot konstan lalu ditimbang. Setiap
perlakuan dilakukan sebanyak 2 ulangan (Ma dan Xia 2009). Diagram alir penelitian dapat dilihat pada Lampiran 3.
Pengukuran Warna
Warna diukur menggunakan metode
APHA 2120C 2005 dengan spektrofotometer DR 2000 Hach. Selanjutnya, diatur program untuk pengukuran warna, lalu diatur panjang gelombangnya. Larutan blanko dan larutan
contoh yang diuji dipersiapkan dan
dimasukkan ke dalam kuvet yang sesuai.
Contoh limbah diukur sampai alat
menunjukkan pembacaan skala atau angka yang tetap.
Pengukuran Kadar Logam Terlarut a) Tembaga (Pb)
Larutan standar Pb dibuat dengan
konsentrasi 1, 5, 10, 20, 30, dan 40 mg/l dan diukur pada panjang gelombang 283,3 nm menggunakan AAS. Setelah diperoleh kurva
standar, dilanjutkan pengukuran kadar Pb dalam contoh sebelum dan setelah koagulasi (SNI 06-6989.8-2004).
b) Nikel (Ni)
Larutan standar Ni dibuat dengan
konsentrasi 0.5; 1; 3; dan 4 mg/l dan diukur
pada panjang gelombang 232.0 nm
menggunakan AAS. Setelah diperoleh kurva standar, dilanjutkan pengukuran kadar Ni dalam contoh sebelum dan setelah koagulasi (SNI 06-6989.18-2004).
c) Kromium (Cr)
Larutan standar Cr dibuat dengan
konsentrasi 0.2; 0.5; 2; 4; 8; 16; 20; dan 30 mg/l dan diukur pada panjang gelombang 425.4 nm menggunakan AAS. Setelah
diperoleh kurva standar, dilanjutkan
pengukuran kadar Cr dalam contoh sebelum dan setelah koagulasi (SNI 06-6989.17-2004).
Identifikasi Unsur pada Botol Kemasan polipropilena (PP)
Bagian botol PP yang menghitam
dipotong dengan ukuran diameter kurang dari
2 cm. Selanjutnya sampel dianalisis
menggunakan Scanning Electron Microscope and Energy Dispersive Spectrometer (SEM EDS).
HASIL DAN PEMBAHASAN
Limbah cair buangan praktikum ”Analisis
Kualitatif Terbatas Golongan Klorida dan
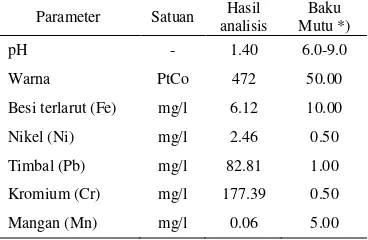
Spot Test” memiliki warna merah kecokelatan dan berbau menyengat. Data kondisi limbah cair sebelum mendapat perlakuan beserta baku mutu air limbah sebelum dibuang ke perairan dapat dilihat pada Tabel 1.
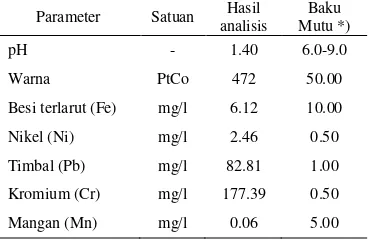
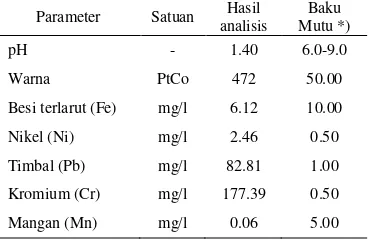
Tabel 1 Kondisi awal limbah cair praktikum
Parameter Satuan analisis Hasil Mutu *) Baku
pH - 1.40 6.0-9.0 Warna PtCo 472 50.00 Besi terlarut (Fe) mg/l 6.12 10.00 Nikel (Ni) mg/l 2.46 0.50 Timbal (Pb) mg/l 82.81 1.00 Kromium (Cr) mg/l 177.39 0.50 Mangan (Mn) mg/l 0.06 5.00 *Sumber: SK Gub.Jawa Barat No.6 /1999
dibuang ke lingkungan menurut SK. Gubernur Jawa Barat No. 6 Tahun 1999. Kelima parameter tersebut adalah pH, warna, serta logam Cr, Pb, dan Ni. Hal ini cukup membuktikan bahwa limbah cair buangan
praktikum analisis logam berat cukup
berbahaya. Kelima parameter tersebut
memiliki nilai lebih tinggi dari baku mutu sehingga perlu dilakukan lagi pengolahan
yang dapat menurunkan nilai kelima
parameter tersebut sehingga memenuhi baku mutu air limbah.
Limbah praktikum diukur kondisi awal,
kemudian diberi perlakuan koagulasi
menggunakan PAC. Limbah ini disaring terlebih dahulu sebelum pengaturan pH dan penambahan koagulan untuk memisahkan padatan limbah dari cairannya. Penambahan koagulan ke dalam limbah menyebabkan koloid dan partikel tersuspensi lainnya bergabung membentuk partikel berat (flok) yang dapat dihilangkan dengan penyaringan.
Proses koagulasi dapat menghilangkan
kontaminan seperti bahan pengotor padatan
yang tidak dapat dihilangkan dengan
penyaringan biasa (Gao et al. 2005).
Penambahan koagulan PAC ke dalam limbah akan menetralisasi partikel bermuatan negatif. Hal tersebut karena PAC memiliki muatan positif yang tinggi dan dapat mengikat koloid secara kuat untuk membentuk agregat. (Dempsey 1998).
pH Koagulasi
pH memiliki pengaruh yang besar terhadap pengendapan logam. Tiap logam memiliki pH tertentu saat kelarutannya minimum, sehingga
dapat mengendap secara maksimum.
Pengaturan pH koagulasi diperlukan karena koagulan PAC dapat bekerja efektif pada pH 6-9. Hasil pengukuran pH setelah koagulasi menunjukkan terjadinya penurunan pH pada berbagai nilai pH koagulasi (Tabel 2 dan Lampiran 4). Hal tersebut karena PAC merupakan bahan koagulan yang bersifat asam (memiliki tapak keasaman Bronsted-Lowry) sehingga semakin banyak PAC yang ditambahkan, semakin besar penurunan pH-nya pada pH akhir setelah proses koagulasi
(Karamah et al. 2008).
Tabel 2 pH akhir pada ragam pH koagulasi pada limbah cair
Konsentrasi pH Koagulasi & pH akhir PAC (mg/l) 7.0 8.0 9.0 10.0
500 5.43 5.66 7.22 8.57 600 5.29 5.60 6.88 8.90 700 5.25 5.41 7.05 8.74 800 5.16 5.36 6.63 8.63
Pada Tabel 2 terlihat bahwa beberapa nilai pH limbah setelah perlakuan belum memenuhi
baku mutu pH air limbah, yaitu pH 6,0–9,0
berdasarkan SK. Gubernur Jawa Barat No. 6 Tahun 1999. Pengaturan pH koagulasi 7 dan 8 menghasilkan nilai pH di bawah kisaran pH baku mutu air limbah sehingga limbah belum boleh dibuang ke lingkungan. Pada pH koagulasi 9 dan 10, nilai pH telah berada pada kisaran pH baku mutu air limbah.
Warna
Warna merupakan salah satu parameter dalam pengolahan limbah terutama limbah berwarna, seperti pada limbah laboratorium, limbah percetakan, limbah tekstil, dan tinta. Warna dengan satuan Pt-Co ini berbeda dengan tingkat kekeruhan. Semakin keruh tidak berarti warna akan semakin gelap. Warna pada limbah laboratorium ini berasal dari kandungan logam-logam yang terdapat di
dalamnya. Sebagi contoh, adanya [Fe(SCN)]2+
dan Fe3+ menyebabkan limbah berwarna
merah kecokelatan.
Warna awal limbah lebih gelap, yaitu coklat kemerahan dengan nilai sebesar 472 Pt-Co. Setelah diberi perlakuan dengan koagulan PAC, warna limbah tersebut menjadi kuning
cerah (Gambar 1). Warna tersebut
menandakan bahwa ion Fe3+ di dalam larutan
semakin berkurang dan terdapat CrO42- dalam
jumlah banyak (Keenan et al. 1991). Secara
visual warna yang dihasilkan setelah
perlakuan sangat berbeda dengan kondisi limbah awal, yaitu lebih jernih. Hasil analisis warna juga menunjukkan nilai di bawah warna limbah awal (Lampiran 5).
(a) (b)
Pengaruh ragam konsentrasi koagulan
PAC terhadap perubahan warna tidak
menunjukkan perbedaan yang signifikan, tidak demikian halnya dengan faktor pH
(Gambar 2). Diantara semua kisaran
konsentrasi PAC, penurunan warna tertinggi terjadi pada pH 7 dan konsentrasi koagulan 500 mg/l, yaitu sebesar 20,66%. Walaupun demikian, warna pada limbah setelah diberi perlakuan dengan PAC semuanya belum memenuhi baku mutu air limbah sehingga masih harus diolah agar intensitas warna berada di bawah baku mutu air limbah.
Gambar 2 Hubungan konsentrasi PAC dan pH dengan penurunan warna ( pH 7, pH 8, pH 9, dan pH 10)
Kurva Standar Logam
Logam terlarut dalam contoh limbah diukur menggunakan AAS didahului dengan pengukuran larutan standar logam Ni, Pb, dan Cr. Hal ini diperlukan agar diperoleh persamaan kurva standar sehingga konsentrasi logam terlarut pada sampel dapat diketahui.
Pengukuran larutan standar Cr, Ni, dan Pb menunjukkan hasil yang baik. Hal ini dilihat
dari nilai R yang diperoleh, yaitu lebih besar
dari 99% (Gambar 3) pada ketiga logam. Masing-masing logam diukur pada panjang gelombang yang berbeda, yaitu 283,3 nm untuk Pb, 232,0 nm untuk Ni, dan 425,4 nm untuk Cr Perbedaan pengaturan panjang gelombang yang digunakan pada ketiga logam dikarenakan atom-atom menyerap cahaya pada panjang gelombang tertentu bergantung pada sifat unsurnya.
Gambar 3 Kurva standar logam ( kromium (Cr), timbal (Pb), dan Nikel (Ni))
Persamaan garis yang diperoleh untuk larutan standar Cr, Ni, dan Pb berturut-turut
y = 0,0077x + 0,0038, y = 0,1428x + 0,0012,
dan y = 0,0172x + 0,0170. Persamaan garis
tersebut diperoleh dengan memasukkan nilai
konsentrasi standar sebagai x dan hasil
pengukuran absorban pada konsentrasi standar
tersebut sebagai y. Data absorban dan
konsentrasi larutan standar dapat dilihat pada Lampiran 6.
Kadar Logam Terlarut
Praktikum dengan judul ”Analisis Kualitatif Terbatas Golongan Klorida dan
Spot Test” merupakan praktikum yang
menganalisis kandungan logam-logam berat dalam sampel cair secara kualitatif. Dalam praktikum tersebut, banyak digunakan
bahan-bahan yang mengandung logam berat
(Lampiran 1) sehingga limbah yang dihasilkan pun pasti mengandung logam berat. Pada Tabel 1, telah diuraikan bahwa logam-logam yang masih belum memenuhi baku mutu air limbah adalah logam kromium, tembaga, dan nikel sehingga logam-logam tersebut diukur kembali kadarnya setelah diberi perlakuan dengan PAC.
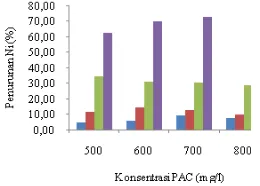
Pada kondisi awal, kandungan nikel yang terdapat dalam limbah adalah 2,46 mg/l. Nilai tersebut masih berada di atas batas baku mutu air limbah, yaitu maksimum 0,50 mg/l.
Pengaturan pH dengan NaOH dan
penambahan koagulan PAC dapat
menurunkan kandungan Ni hingga mencapai 72,36% (Gambar 4). Penurunan logam Ni terbesar ini terjadi pada pH koagulasi 10 dan konsentrasi PAC sebesar 700 mg/l dengan kadar Ni sisa sebesar 0,68 mg/l (Lampiran 7).
Gambar 4 Hubungan konsentrasi PAC dan pH
dengan penurunan kadar Ni
terlarut ( pH 7, pH 8, pH 9, dan pH 10)
dibandingkan kondisi awal Ni. Nilai tersebut masih jauh di atas batas baku mutu air limbah, yaitu maksimum sebesar 0,50 mg/l untuk Cr dan 1,00 mg/l untuk Pb. Pengaturan pH dengan NaOH dan penambahan koagulan PAC ternyata dapat menurunkan kandungan Cr dan Pb. Penurunan kandungan Cr terbesar mencapai 97,79% (Gambar 5) dengan kadar Cr sisa sebesar 3,39 mg/l (Lampiran 8) sedangkan penurunan kandungan Pb terbesar mencapai 90,13% (Gambar 6) dengan kadar Pb sisa sebesar 8,18 mg/l (Lampiran 9). Sama halnya dengan Ni, penurunan logam Cr terbesar terjadi pada pH campuran 8,74 (pH koagulasi 10) dan konsentrasi PAC sebesar 700 mg/l, sedangkan untuk Pb, penurunan terbesar terjadi pada pH campuran 8,57 (pH koagulasi 10) dan konsentrasi PAC 500 mg/l.
Gambar 5 Hubungan konsentrasi PAC dan pH
dengan penurunan kadar Cr
terlarut ( pH 7, pH 8, pH 9, dan pH 10)
Gambar 6 Hubungan konsentrasi PAC dan pH
dengan penurunan kadar Pb
terlarut ( pH 7, pH 8, pH 9, dan pH 10)
Dari Gambar 4, 5 dan 6, terlihat bahwa
pengaruh konsentrasi PAC terhadap
penurunan kadar logam Ni, Cr, dan Pb tidak menunjukkan perbedaan yang signifikan, tidak demikian halnya dengan faktor pH. Semakin besar pH koagulasi, kadar logam Ni, Cr, dan Pb sisa dalam limbah setelah proses
koagulasi semakin kecil. Berdasarkan
perhitungan secara teoritis bila logam
mengendap sebagai hidroksidanya seperti terlihat pada Lampiran 10, hanya logam Cr
yang mengendap pada berbagai variasi pH koagulasi sedangkan pada logam Pb dan Ni
hanya pada pH koagulasi 10 terjadi
pengendapan sehingga pada pH 10 inilah semua logam mengendap. Hal ini dibuktikan
dengan besarnya bobot endapan yang
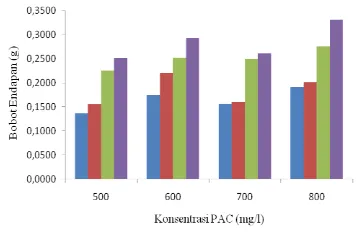
dihasilkan pada pH 10 dibandingkan pH 7, 8, dan 9 pada semua variasi konsentrasi PAC. Pengendapan terjadi jika hasil kali konsentrasi telah melampaui tetapan hasil kali kelarutan (Ksp). Penimbangan bobot endapan setelah koagulasi dimaksudkan untuk mengetahui pengaruh koagulasi baik pada perbedaan konsentrasi maupun pH terhadap endapan yang dihasilkan. Semakin besar bobotnya, maka proses koagulasi berlangsung baik.
Bobot endapan terbesar terdapat pada
kombinasi konsentrasi PAC 800 mg/l pada pH 10 (Gambar 7 dan Lampiran 11).
Gambar 7 Hubungan konsentrasi PAC dan pH
terhadap bobot endapan yang dihasilkan ( pH 7, pH 8, pH 9, dan pH 10)
Penurunan kandungan logam Ni, Cr, dan Pb dalam limbah terjadi karena terbentuknya
endapan Ni(OH)2, Cr(OH)3, dan Pb(OH)2.
Endapan yang dihasilkan semakin besar dengan bertambahnya pH larutan. Adanya
logam yang mengendap mengakibatkan
konsentrasi logam yang terlarut semakin kecil.
Adapun reaksi yang terjadi dengan
penambahan NaOH adalah sebagai berikut:
Pengaturan pH dan penambahan koagulan PAC sangat berperan terhadap penurunan kadar logam yang terlarut dalam limbah. Walaupun pengaturan pH dengan NaOH telah
dapat mengendapkan sebagian logam,
yang berbentuk koloid dapat membentuk
flock. Oleh karena itu, dengan dibantu pengadukan, logam-logam dapat mengendap sempurna.
Penambahan koagulan PAC menyebabkan unsur-unsur dalam limbah (dalam hal ini, Ni, Cr, dan Pb) mengalami ketidakstabilan. Ketika koagulan PAC ditambahkan ke dalam air limbah, PAC akan terdisosiasi dan ion
logam akan mengalami hidrolisis dan
menghasilkan ion kompleks hidrokso yang bermuatan positif sehingga teradsorpsi pada permukaan koloid negatif. PAC memiliki karakteristik muatan positif yang tinggi dan dapat mengikat agregat dengan kuat sehingga dapat menarik dan mengggabungkan partikel tersuspensi di dalam air limbah tersebut
(Al-Kdasi et al. 2004).
Identifikasi Unsur pada Botol Polipropilena (PP)
Lama penyimpanan limbah dalam suatu wadah penampungan, terlebih limbah tersebut adalah limbah logam berat perlu diperhatikan. Limbah logam berat yang disimpan dalam wadah poliproilena (PP) selama 2 tahun, teramati dapat mengubah warna wadah yang semula putih bersih menjadi kehitaman. Ketiga botol seperti terlihat pada Gambar 8 merupakan wadah yang digunakan untuk menyimpan limbah. Adanya perbedaan warna pada ketiga botol disebabkan isi dari botol yang berbeda-beda didukung dengan fakta banyaknya sesi praktikum dengan materi yang sama tidak mutlak menghasilkan limbah logam berat dengan kandungan yang sama. Perbedaan isi botol tersebut menyebabkan perbedaan warna botol PP . Warna hitam yang timbul bukan seperti endapan yang menempel melainkan menyatu dengan bahan dari botol tersebut. Warna hitam ini dapat disebabkan adanya reaksi antara logam dalam limbah tersebut. Lamanya penyimpanan limbah menyebabkan warna hitam dari limbah tersebut terserap ke dalam pori-pori wadah PP.
Gambar 8 Wadah poli propilena (a) botol 1, (b) botol 2, dan (c) botol 3
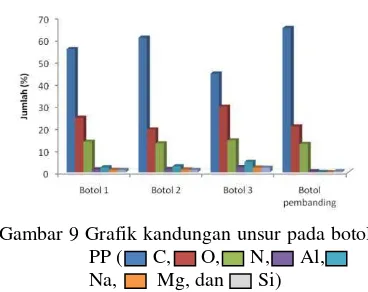
Identifikasi unsur diperlukan agar
diketahui unsur–unsur yang menempel pada
botol PP yang menyebabkan botol tersebut berwarna hitam. Dapat dilihat pada Gambar 9, karbon menunjukkan jumlah yang tinggi dibandingkan dengan unsur-unsur lainnya. Hal ini karena penyusun dari polipropilena itu
sendiri salah satunya adalah karbon.
Kandungan karbon terbesar terdapat pada botol pembanding, sedangkan pada ketiga botol sampel menunjukkan pengurangan kandungan karbon (Lampiran 12).
Gambar 9 Grafik kandungan unsur pada botol PP ( C, O, N, Al, Na, Mg, dan Si)
Kandungan unsur lainnya yang terdeteksi oleh SEM-EDS antara lain oksigen, nitrogen, aluminium, natrium, magnesium, dan silikon
sedangkan unsur-unsur logam yang
terkandung dalam limbah tidak tampak pada hasil analisis oleh SEM-EDS karena kadar yang terlalu kecil pada botol PP (Lampiran 13).
SIMPULAN DAN SARAN
Simpulan
Pengolahan limbah praktikum yang mengandung logam berat dengan koagulasi PAC dan pengaturan pH berhasil menurunkan warna limbah serta kadar logam Ni, Cr, dan Pb. Penurunan tertinggi terlihat pada kadar logam Cr mencapai 97,79 % pada pH koagulasi 10 dan konsentrasi PAC 700 mg/l. Namun demikian, penurunan warna dan kadar logam belum ada yang memenuhi batas baku mutu air limbah.
Hasil identifikasi botol polipropilena dengan SEM-EDS menunjukkan kandungan karbon yang menurun pada ketiga botol sampel, sedangkan kandungan unsur-unsur lainnya relatif tidak terpengaruh. Kandungan unsur lainnya yang terdeteksi oleh SEM-EDS antara lain oksigen, nitrogen, aluminium, natrium, magnesium, dan silikon.
Saran
Tahap selanjutnya yang perlu dilakukan adalah pengolahan limbah dengan menambah ragam konsentrasi PAC dan penjerapan untuk mengurangi warna dan kadar logam sehingga berada dalam batas baku mutu air limbah.
DAFTAR PUSTAKA
Al-Kdasi A, Idris A, Saed K, Guan CT. 2004. Treatment of textile wastewater by advanced oxidation processes a review.
Global Nest 6:222-230.
Aminzadeh B, Sarparastzadeh H, Saeedi M, Naeimpoor F. 2007. Pretreatment of
municipal wastewater by enhanced
chemical coagulation. Int J Environ Res
1:104-113.
[APHA] American Public Health Association.
2005. Standard Methods for the
Examination of Water and Wastewater
ADMI Weighted Ordinate
Spectrophotometric Methods. APHA
2120C.
[BSN] Badan Standardisasi Nasional. 2004.
SNI 06-6989.8-2004. Air dan Air
Limbah-Cara Uji Tibal (Pb) dengan Metode Spektrofotometri Serapan Atom (SSA)-Nyala. Serpong: BSN.
[BSN] Badan Standardisasi Nasional. 2004.
SNI 06-6989.17-2004. Air dan Air
Limbah-Cara Uji Krom Total (Cr-T) dengan Metode Spektrofotometri Serapan Atom (SSA)-Nyala. Serpong: BSN.
[BSN] Badan Standardisasi Nasional. 2004.
SNI 06-6989.18-2004. Air dan Air
Limbah-Cara Uji Nikel (Ni) dengan Metode Spektrofotometri Serapan Atom (SSA)-Nyala. Serpong: BSN.
Cotton FA, Wilkinson G. 1989. Kimia
Anorganik Dasar. S Suharto, penerjemah.
Jakarta: UI-Press. Terjemahan dari: Basic
Inorganic Chemistry.
Darmono. 1995. Logam Dalam Sistem Biologi
Makhluk hidup. Jakarta: UI-Press.
Dempsey BA. 1998. Synthesis and speciation of polyaluminum chloride for water
treatment.Environt Int 24:899-910.
Departemen Kimia. 2007. Inventarisasi dan pemetaan limbah cair dalam upaya peningkatan kualitas air danau [laporan penelitian]. Bogor: Departemen Kimia,
Fakultas Matematika dan Ilmu
Pengetahuan Alam, Institut Pertanian Bogor.
Gao BY, Yue QY, Wang BJ, Wang SG. 2005. Characterization and coagulation of a Polyaluminum Chloride (PAC) coagulant
with high Al13 content. J Environ Mgmt.
76:143-147.
Jamhari. 2009. Reduksi logam berat Hg, Ag, dan Cr limbah laboratorium menggunakan metode presipitasi dan adsorpsi [skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
[KLH]. Kementrian Lingkungan Hidup.
Peraturan Pemerintah Nomor 18 Tahun 1999 tentang Pengelolaan Limbah Bahan
Berbahaya dan Beracun. Jakarta:
Departemen Lingkungan Hidup.
Karamah EF, Bismo S, Simbolon HM. 2008. Pengaruh ozon dan konsentrasi zeolit terhadap kinerja proses pengolahan limbah cair yang mengandung logam dengan
proses flotasi. Makara 12:43-47.
Keenan, Charles W, Donald C, Kenfelter,
Jesse HW. 1991. Ilmu Kimia untuk
Universitas Jilid 1. Ed ke-6. Jakarta: Erlangga.
La Grega. 2001. Hazardous Waste
Management. Ed ke-2. Singapore: McGraw-Hill International.
Li F, Jiang JQ, Shengju W, Bingru Z. 2010. Preparation and performance of
high-purity-poly-aluminum-chloride. Chem Eng
156: 64-69.
Ma XJ, Xia HL. 2009. Treatment of water-based printing ink wastewater by fenton
process combined with coagulation.
Journal of Hazardous Materials. 162: 386-390.
[SK. Gub]. Surat Keputusan Gubernur Kepala Daerah Tingkat I Jawa Barat Nomor 6 Tahun 1999 tentang Baku Mutu Limbah Cair Bagi Kegiatan Industri di Jawa Barat. Jakarta: Departemen Lingkungan Hidup.
Saeni MS. 1989. Kimia Lingkungan. Bogor:
Dirjen Pendidikan Tinggi Departemen Pendidikan dan Kebudayaan Pusat Antar Universitas Ilmu Hayati IPB.
Saputra YE. 2008. Pembuangan dan
penanganan bahan kimia tumpahan di
laboratorium.
http://www.chem-is-try.org/artikel_kimia/kimia_lingkungan/ pembuangan-dan-penanganan-bahan-kimia-tumpahan-di-laboratorium. html [1 jan 2010]
Sugiharto. 2006. Dasar-Dasar Pengelolaan
Air Limbah. Jakarta: UI Press.
Teng ST. 2000. Gambaran Umum
Widowati W, Astiana S, Raymond JR. 2008.
Efek Toksik Logam: Pencegahan dan
Lampiran 1 Pemakaian bahan kimia dan perkiraan konsentrasinya dalam limbah
No Bahan Jumlah mahasiswa
*Jumlah
Konsentrasi Larutan
Perkiraan Konsentrasi
(mg/l)
Perkiraan bobot tiap semester
(mg)
Produk Reaksi Pemakaian
(ml)
1 AgNO3
253
25,3 0.1 M 2247,74 429,8 AgCl
2 (Pb(CH3COO)2 25,3 0.1 M 4304,34 823,0 PbCrO4
3 Hg2(NO3)2 25,3 0.1 M 6949,26 1328,7 HgI2
4 HCl 25,3 1 N 4824,43 922,5
5 KI 25,3 1 N 21965,32 4199,9 I2
6 H2SO4 25,3 0.1 M 1297,77 248,1
7 K2CrO4 25,3 5%
8 NH4OH 25,3 4 N 18548,90 3546,6
9 HNO3 25,3 0.1 M 833,78 159,4
10 (NH4)2S 25,3 1 M 9016,61 1724,0
11 Co(NO3)2 25,3 0.1 M 2420,68 462,8 [Co(SCN)4]
2-12 Na2S2O3 25,3 1 M 20920,96 4000,2
13 NH4SCN 25,3 1 M 10072,39 1925,9
14 Aseton 25,3 0.1 M
15 FeCl3 25,3 0.1 M 2146,25 410,4 [Fe(SCN)6]
3-16 MnSO4 25,3 0.1 M 1998,04 382,0 HMnO4
17 KIO4 25,3 20%
18 NiSO4 25,3 0.1 M 2047,73 391,5 Ni(NC2H3)4 ·2H2O
19 Dimetilglioksim 25,3 0.1 M
20 Amonium molibdat 25,3 2% [MoO(SCN)5]
2-21 SnCl2 25,3 10%
22 NaWolframat 25,3 2% W2O5
23 K3Fe(CN)6 25,3 0.1 M 4356,54 833,0
* Pemakaian per mahasiswa rata-rata sebanyak 0.1 ml
Lampiran 2 Diagram variasi konsentrasi koagulan PAC dan pH koagulasi
500 mg/l
600 mg/l
500 mg/l
Koagulan
PAC
800 mg/l
700 mg/l
pH 10
pH 10
pH 9
pH 8
pH 8
pH 9
pH 10
pH 7
pH 8
pH 9
pH 10
pH 7
pH 8
pH 9
pH 7
Lampiran 3 Diagram alir penelitian
Pencarian kondisi
optimum
dikeringkan
Nilai memenuhi baku mutu
air limbah
Limbah cair analisis
Spot test
Ragam konsentrasi koagulan PAC dan pH
koagulasi
Filtrat
Kadar
logam berat
Warna
pH
awal
Bobot
endapan
Pengukuran pH,
warna & kadar
Lampiran 4 Pengaruh konsentrasi koagulan PAC terhadap pH campuran setelah
koagulasi
Perlakuan
pH
Limbah Awal Sebelum Koagulasi Setelah Koagulasi Ulangan
1
Ulangan 2
Ulangan 1
Ulangan 2
Ulangan 1
Ulangan
2 Rerata 500 mg/l pH 7 1.47 0.87 7.01 7.02 5.40 5.45 5.43
500 mg/l pH 8 1.48 0.94 8.04 8.09 5.68 5.63 5.66
500 mg/l pH 9 1.49 0.86 9.01 9.02 7.67 6.77 7.22
500 mg/l pH 10 1.52 0.93 10.01 10.01 8.86 8.27 8.57
600 mg/l pH 7 1.69 0.97 7.08 7.11 5.25 5.33 5.29
600 mg/l pH 8 1.54 0.85 8.13 8.16 5.67 5.52 5.60
600 mg/l pH 9 1.49 0.88 9.03 9.06 7.34 6.42 6.88
600 mg/l pH 10 1.56 0.95 10.06 10.00 9.06 8.74 8.90
700 mg/l pH 7 1.58 0.91 7.06 7.08 5.24 5.26 5.25
700 mg/l pH 8 1.63 0.86 8.05 8.08 5.44 5.37 5.41
700 mg/l pH 9 1.56 0.90 9.01 9.02 7.62 6.48 7.05
700 mg/l pH 10 1.55 0.94 10.01 10.01 8.89 8.58 8.74
800 mg/l pH 7 1.61 0.91 7.16 7.00 5.13 5.19 5.16
800 mg/l pH 8 1.57 0.90 8.03 8.01 5.34 5.41 5.36
800 mg/l pH 9 1.59 0.91 9.01 9.02 7.46 5.80 6.63
Lampiran 5 Pengaruh Konsentrasi PAC dan pH terhadap % penurunan warna
Perlakuan Warna (PtCo)
Ulangan 1 Ulangan 2 Rerata Penurunan warna (%)
500 mg/l pH 7 373 376 375 2.66
500 mg/l pH 8 387 386 387 18.11 500 mg/l pH 9 446 411 429 9.22
500 mg/l pH 10 471 442 457 3.28
600 mg/l pH 7 382 379 381 19.39 600 mg/l pH 8 393 381 387 18.01
600 mg/l pH 9 444 421 433 8.37 600 mg/l pH 10 459 437 448 5.08
700 mg/l pH 7 384 375 380 19.60
700 mg/l pH 8 380 377 379 19.81 700 mg/l pH 9 435 404 420 11.12
700 mg/l pH 10 454 437 446 5.61
800 mg/l pH 7 378 378 378 19.92 800 mg/l pH 8 380 377 379 19.81
800 mg/l pH 9 431 386 409 13.45
Lampiran 6 Data pengukuran larutan standar kromium (Cr), timbal (Pb), dan
nikel (Ni)
Standar Cr
Standar Pb
Standar Ni
Konsentrasi
(mg/l)
Absorbans Konsentrasi
(mg/l)
Absorbans Konsentrasi
(mg/l)
Absorbans
0.2
0.0020
1.0
0.0234
0.5
0.0694
0.5
0.0053
5.0
0.1020
1.0
0.1436
2.0
0.0202
10.0
0.1977
3.0
0.4236
4.0
0.0391
20.0
0.3696
4.0
0.5720
8.0
0.0671
30.0
0.5375
16.0
0.1269
40.0
0.6971
20.0
0.1575
Lampiran 7 Pengaruh konsentrasi PAC dan pH terhadap penurunan kadar logam
Ni dalam limbah
Perlakuan Kadar Ni (mg/l)
Ulangan 1 Ulangan 2 Rerata Penurunan (%)
500 mg/l pH 7 2.33 2.37 2.35 4.47
500 mg/l pH 8 2.18 2.19 2.19 11.18
500 mg/l pH 9 1.51 1.71 1.61 34.55
500 mg/l pH 10 0.81 1.04 0.93 62.40
600 mg/l pH 7 2.34 2.30 2.32 5.69
600 mg/l pH 8 2.08 2.15 2.12 14.02
600 mg/l pH 9 1.47 1.93 1.70 30.89
600 mg/l pH 10 0.70 0.78 0.74 69.92
700 mg/l pH 7 2.19 2.27 2.23 9.35
700 mg/l pH 8 2.07 2.23 2.15 12.60
700 mg/l pH 9 1.38 2.05 1.72 30.28
700 mg/l pH 10 0.60 0.76 0.68 72.36
800 mg/l pH 7 2.17 2.38 2.28 7.52
800 mg/l pH 8 2.16 2.28 2.22 9.76
800 mg/l pH 9 1.41 2.10 1.76 28.66
Lampiran 8 Pengaruh konsentrasi PAC dan pH terhadap penurunan kadar logam
Cr dalam limbah
Perlakuan Kadar Cr (mg/l)
Ulangan 1 Ulangan 2 Rerata Penurunan (%)
500 mg/l pH 7 70.31 80.71 75.51 57.43
500 mg/l pH 8 29.97 49.56 39.77 77.58
500 mg/l pH 9 4.29 10.10 7.20 95.94
500 mg/l pH 10 4.21 4.12 4.17 97.65
600 mg/l pH 7 72.77 47.19 59.98 66.19
600 mg/l pH 8 21.14 74.36 47.75 73.08
600 mg/l pH 9 4.44 13.17 8.81 95.04
600 mg/l pH 10 5.22 4.45 4.84 97.27
700 mg/l pH 7 57.77 77.94 67.86 61.75
700 mg/l pH 8 25.84 58.73 42.29 76.16
700 mg/l pH 9 3.71 18.73 11.22 93.67
700 mg/l pH 10 3.82 4.03 3.93 97.79
800 mg/l pH 7 55.64 88.83 72.24 59.28
800 mg/l pH 8 28.23 63.90 46.07 74.03
800 mg/l pH 9 3.66 26.70 15.18 91.44
Lampiran 9 Pengaruh konsentrasi PAC dan pH terhadap penurunan kadar logam
Pb dalam limbah
Perlakuan Kadar Pb (mg/l)
Ulangan 1 Ulangan 2 Rerata Penurunan (%)
500 mg/l pH 7 48.33 57.49 52.91 36.11
500 mg/l pH 8 32.91 45.03 38.97 52.94
500 mg/l pH 9 9.99 20.43 15.21 81.63
500 mg/l pH 10 11.44 4.91 8.18 90.13
600 mg/l pH 7 61.16 47.37 54.27 34.47
600 mg/l pH 8 30.73 58.78 44.76 45.95
600 mg/l pH 9 10.56 23.47 17.02 79.45
600 mg/l pH 10 11.12 9.00 10.06 87.85
700 mg/l pH 7 57.03 66.69 61.86 25.30
700 mg/l pH 8 40.08 62.45 51.27 38.09
700 mg/l pH 9 11.43 28.59 20.01 75.84
700 mg/l pH 10 9.65 9.32 9.49 88.55
800 mg/l pH 7 53.24 71.56 62.40 24.65
800 mg/l pH 8 46.88 66.91 56.90 31.29
800 mg/l pH 9 12.48 37.98 25.23 69.53
Lampiran 10 Nilai perbandingan
Q
dan
Ksp
pada limbah
Perlakuan
Q Perbandingan dengan Ksp
Cr(OH)3 Pb(OH)2 Ni(OH)2 Cr(OH)3 Pb(OH)2 Ni(OH)2
500 mg/l pH 7 3,36 x 10-29 2,49 x 10-21 1,92 x 10-22 Mengendap Tidak Mengendap Tidak Mengendap
500 mg/l pH 8 1,64 x 10-28 7,17 x 10-21 5,54 x 10-22 Mengendap Tidak Mengendap Tidak Mengendap
500 mg/l pH 9 7,87 x 10-24 9,46 x 10-18 7,31 x 10-19 Mengendap Tidak Mengendap Tidak Mengendap
500 mg/l pH 10 8,83 x 10-20 4,74 x 10-15 3,66 x 10-16 Mengendap Mengendap Mengendap
600 mg/l pH 7 1,28 x 10-29 1,31 x 10-21 1,01 x 10-22 Mengendap Tidak Mengendap Tidak Mengendap
600 mg/l pH 8 1,09 x 10-28 5,44 x 10-21 4,21 x 10-22 Mengendap Tidak Mengendap Tidak Mengendap
600 mg/l pH 9 7,52 x 10-25 1,98 x 10-18 1,53 x 10-19 Mengendap Tidak Mengendap Tidak Mengendap
600 mg/l pH 10 8,63 x 10-19 2,17 x 10-14 1,67 x 10-15 Mengendap Mengendap Mengendap
700 mg/l pH 7 9,68 x 10-30 1,09 x 10-21 8,39 x 10-23 Mengendap Tidak Mengendap Tidak Mengendap
700 mg/l pH 8 2,92 x 10-29 2,27 x 10-21 1,75 x 10-22 Mengendap Tidak Mengendap Tidak Mengendap
700 mg/l pH 9 2,43 x 10-24 4,32 x 10-18 3,34 x 10-19 Mengendap Tidak Mengendap Tidak Mengendap
700 mg/l pH 10 2,86 x 10-19 1,04 x 10-14 8,01 x 10-16 Mengendap Mengendap Mengendap
800 mg/l pH 7 5,20 x 10-30 7,17 x 10-22 5,54 x 10-23 Mengendap Tidak Mengendap Tidak Mengendap
800 mg/l pH 8 2,07 x 10-29 1,80 x 10-21 1,39 x 10-22 Mengendap Tidak Mengendap Tidak Mengendap
800 mg/l pH 9 1,34 x 10-25 6,25 x 10-19 4,83 x 10-20 Mengendap Tidak Mengendap Tidak Mengendap
800 mg/l pH 10 1,34 x 10-19 6,25 x 10-15 4,83 x 10-16 Mengendap Mengendap Mengendap
*Nilai
Ksp
Cr(OH)
3= 6.30x10
-31, Pb(OH)
2= 2.80x10
-16, dan Ni(OH)
2= 2.80 x10
-16Contoh Perhitungan
:
Pada perlakuan PAC 500 mg/l pH 7
pH akhir setelah koagulasi = 5,43 (Lampiran 4)
POH
= 14
–
pH
= 14
–
5.43
= 8.57
[OH-]
= 10
-POH= 10
-8.57= 2.69 x 10
-9
Q
Cr(OH)
3= [OH
-]
3 Akhirx [Cr
3+]
AwalOleh karena
Q
Cr(OH)
3>
Ksp
Cr(OH)
3maka endapan Cr(OH)
3akan terbentuk
Lampiran 11 Data bobot endapan total hasil pengolahan limbah
Perlakuan
Bobot (g)
Wadah Wadah + Isi Endapan total
Ulangan 1 Ulangan 2 Ulangan 1 Ulangan 2 Ulangan 1 Ulangan 2 Rerata
500 mg/l pH 7 1.0810 1.1186 1.1838 1.2888 0.1028 0.1702 0.1365 500 mg/l pH 8 1.1090 1.1142 1.2446 1.2889 0.1356 0.1747 0.1552 500 mg/l pH 9 1.0473 1.1094 1.2770 1.3308 0.2297 0.2214 0.2256 500 mg/l pH 10 1.0555 1.1034 1.2754 1.3854 0.2199 0.2820 0.2510
600 mg/l pH 7 1.0723 1.0725 1.1902 1.3028 0.1179 0.2303 0.1741 600 mg/l pH 8 1.0599 1.0831 1.2386 1.3437 0.1787 0.2606 0.2197 600 mg/l pH 9 1.0715 1.0937 1.3175 1.3517 0.2460 0.2580 0.2520 600 mg/l pH 10 1.0780 1.0760 1.3365 1.4043 0.2585 0.3283 0.2934
700 mg/l pH 7 1.0556 1.0780 1.1973 1.2487 0.1417 0.1707 0.1562 700 mg/l pH 8 1.0564 1.1032 1.2094 1.2703 0.1530 0.1671 0.1601 700 mg/l pH 9 1.0675 1.1016 1.3659 1.3038 0.2984 0.2022 0.2503 700 mg/l pH 10 1.0610 1.0852 1.3284 1.3397 0.2674 0.2545 0.2610
Lampiran 12 Hasil analisis botol polipropilena
Nama Unsur
Jumlah (%)
Botol 1
Botol 2
Botol 3
Botol 4
Karbon
55.67
60.89
44.66
65.26
Oksigen
24.68
19.39
29.68
20.75
Nitrogen
13.85
13.12
14.43
12.82
Aluminium
1.33
1.51
2.28
0.53
Natrium
2.26
2.74
4.73
0.12
Magnesium
1.15
1.30
2.14
0.03
Lampiran 13 Gambar hasil analisis botol polipropilena pada botol 1, 2, dan 3
dengan SEM EDS
Botol 1
Botol 2
Botol 3 C N O Na Mg Al Si
C N O Na Mg Al Si
PENDAHULUAN
Laboratorium di perguruan tinggi
merupakan fasilitas penunjang untuk
mewujudkan pendidikan, penelitian, dan pengabdian masyarakat. Di laboratorium, para mahasiswa memperoleh pengalaman praktis guna memahami teori-teori yang dipelajari di bangku kuliah melalui kegiatan praktikum dan
pembuatan tugas, sedangkan dosen
memerlukan laboratorium untuk memperoleh data ilmiah. Kegiatan di laboratorium ini menggunakan bahan kimia yang tentunya menghasilkan sejumlah bahan buangan atau limbah. Sebagian limbah tersebut beberapa diantaranya bersifat pencemar dan bahkan tergolong limbah bahan berbahaya beracun (B3) yang memerlukan penanganan khusus.
Kegiatan praktikum dan penelitian di laboratorium sering menggunakan bahan-bahan yang mengandung logam berat. Salah satunya ialah Analisis Kualitatif Terbatas:
Golongan Klorida dan Spot Test yang
mengukur keberadaan logam-logam seperti Hg, Pb, Ag, Cr, Fe, Mn, dan Ni secara kualitatif dalam suatu larutan contoh. Data pemakaian bahan kimia dan perkiraan konsentrasinya dalam limbah pada analisis tersebut dapat dilihat pada Lampiran 1. Logam berat tergolong limbah B3 yang pada
kadar tertentu dapat membahayakan
lingkungan sekitarnya karena bersifat toksik bagi hewan dan manusia (La Grega 2001).
Tempat penampungan limbah logam berat pun perlu mendapat perhatian. Berdasarkan pengamatan di laboratorium, limbah analisis
spot test yang disimpan selama kurang lebih 2
tahun dalam botol polipropilena
mengakibatkan warna dinding botol menjadi
hitam. Beberapa senyawa diduga
mengakibatkan perubahan warna tersebut dan perlu dianalisis lebih lanjut. Di samping itu,
lamanya penyimpanan limbah tersebut
sebelum dimanfaatkan sudah menyimpang dari Peraturan Pemerintah No. 18/1999 yang membatasi paling lama 90 hari.
Salah satu cara menanggulangi
pencemaran logam berat yang bisa diterapkan dalam pengolahan limbah laboratorium ialah
metode koagulasi. Metode koagulasi
merupakan proses absorpsi oleh koagulan terhadap partikel koloid yang menyebabkan destabilisasi pertikel. Ada beberapa jenis koagulan di antaranya adalah polialuminium
klorida (PAC) yang digunakan untuk
mengendapkan logam berat. Koagulan PAC mempunyai kelebihan, yaitu PAC lebih cepat
membentuk flok daripada koagulan biasa. Hal ini disebabkan adanya gugus aktif aluminat yang bekerja efektif dalam mengikat koloid yang ikatan ini diperkuat dengan rantai polimer dari gugus polielektrolit sehingga
gumpalan floknya menjadi lebih padat (Gao et
al. 2005). Karamah et al (2008)
mengungkapkan bahwa peningkatan dosis koagulan PAC dapat meningkatkan persen pemisahan logam berat besi, tembaga, dan nikel dari limbah serta dapat menurunkan nilai kebutuhan oksigen kimiawi (COD) dalam air limbah.
Setiap koagulan memiliki karakteristik yang berbeda-beda. Oleh karena itu, kondisi optimum koagulasi dengan koagulan tertentu perlu diketahui. Ada dua parameter utama yang memengaruhi proses koagulasi, yaitu konsentrasi koagulan dan pH koagulasi. Oleh karena itu, variasi kedua parameter tersebut dapat dilakukan untuk mencari kondisi optimum koagulasi. Penelitian ini bertujuan menentukan kondisi optimum kerja koagulan PAC pada limbah cair praktikum analisis
kualitatif logam berat (spot test) serta
mengidentifikasi unsur-unsur yang terdapat
pada botol kemasan polipropilena (PP) yang
digunakan untuk menampung limbah.
TINJAUAN PUSTAKA
Limbah Laboratorium
Limbah laboratorium pada dasarnya
merupakan limbah yang terbentuk dari
aktivitas laboratorium, seperti kegiatan
praktikum dan penelitian. Adanya bahan kimia di universitas dimulai dari pemberian bahan kimia yang diperlukan dari gudang kimia kepada pekerja atau mahasiswa yang
mengambil mata kuliah praktik atau
mahasiswa yang sedang melakukan penelitian di laboratorium. Bahan tersebut digunakan untuk sintesis maupun analisis. Oleh karena tujuan penggunaannya, maka terbentuklah bahan awal, produk samping, pelarut yang
digunakan dan bahan kimia yang
terkontaminasi sehingga bahan tersebut harus diurai atau dibuang jika daur ulang tidak mungkin dilakukan (Jamhari 2009).
Limbah laboratorium tidak boleh dibuang secara langsung begitu saja ke badan air.
Beberapa tipe limbah berbahaya yang
PENDAHULUAN
Laboratorium di perguruan tinggi
merupakan fasilitas penunjang untuk
mewujudkan pendidikan, penelitian, dan pengabdian masyarakat. Di laboratorium, para mahasiswa memperoleh pengalaman praktis guna memahami teori-teori yang dipelajari di bangku kuliah melalui kegiatan praktikum dan
pembuatan tugas, sedangkan dosen
memerlukan laboratorium untuk memperoleh data ilmiah. Kegiatan di laboratorium ini menggunakan bahan kimia yang tentunya menghasilkan sejumlah bahan buangan atau limbah. Sebagian limbah tersebut beberapa diantaranya bersifat pencemar dan bahkan tergolong limbah bahan berbahaya beracun (B3) yang memerlukan penanganan khusus.
Kegiatan praktikum dan penelitian di laboratorium sering menggunakan bahan-bahan yang mengandung logam berat. Salah satunya ialah Analisis Kualitatif Terbatas:
Golongan Klorida dan Spot Test yang
mengukur keberadaan logam-logam seperti Hg, Pb, Ag, Cr, Fe, Mn, dan Ni secara kualitatif dalam suatu larutan contoh. Data pemakaian bahan kimia dan perkiraan konsentrasinya dalam limbah pada analisis tersebut dapat dilihat pada Lampiran 1. Logam berat tergolong limbah B3 yang pada
kadar tertentu dapat membahayakan
lingkungan sekitarnya karena bersifat toksik bagi hewan dan manusia (La Grega 2001).
Tempat penampungan limbah logam berat pun perlu mendapat perhatian. Berdasarkan pengamatan di laboratorium, limbah analisis
spot test yang disimpan selama kurang lebih 2
tahun dalam botol polipropilena
mengakibatkan warna dinding botol menjadi
hitam. Beberapa senyawa diduga
mengakibatkan perubahan warna tersebut dan perlu dianalisis lebih lanjut. Di samping itu,
lamanya penyimpanan limbah tersebut
sebelum dimanfaatkan sudah menyimpang dari Peraturan Pemerintah No. 18/1999 yang membatasi paling lama 90 hari.
Salah satu cara menanggulangi
pencemaran logam berat yang bisa diterapkan dalam pengolahan limbah laboratorium ialah
metode koagulasi. Metode koagulasi
merupakan proses absorpsi oleh koagulan terhadap partikel koloid yang menyebabkan destabilisasi pertikel. Ada beberapa jenis koagulan di antaranya adalah polialuminium
klorida (PAC) yang digunakan untuk
mengendapkan logam berat. Koagulan PAC mempunyai kelebihan, yaitu PAC lebih cepat
membentuk flok daripada koagulan biasa. Hal ini disebabkan adanya gugus aktif aluminat yang bekerja efektif dalam mengikat koloid yang ikatan ini diperkuat dengan rantai polimer dari gugus polielektrolit sehingga
gumpalan floknya menjadi lebih padat (Gao et
al. 2005). Karamah et al (2008)
mengungkapkan bahwa peningkatan dosis koagulan PAC dapat meningkatkan persen pemisahan logam berat besi, tembaga, dan nikel dari limbah serta dapat menurunkan nilai kebutuhan oksigen kimiawi (COD) dalam air limbah.
Setiap koagulan memiliki karakteristik yang berbeda-beda. Oleh karena itu, kondisi optimum koagulasi dengan koagulan tertentu perlu diketahui. Ada dua parameter utama yang memengaruhi proses koagulasi, yaitu konsentrasi koagulan dan pH koagulasi. Oleh karena itu, variasi kedua parameter tersebut dapat dilakukan untuk mencari kondisi optimum koagulasi. Penelitian ini bertujuan menentukan kondisi optimum kerja koagulan PAC pada limbah cair praktikum analisis
kualitatif logam berat (spot test) serta
mengidentifikasi unsur-unsur yang terdapat
pada botol kemasan polipropilena (PP) yang
digunakan untuk menampung limbah.
TINJAUAN PUSTAKA
Limbah Laboratorium
Limbah laboratorium pada dasarnya
merupakan limbah yang terbentuk dari
aktivitas laboratorium, seperti kegiatan
praktikum dan penelitian. Adanya bahan kimia di universitas dimulai dari pemberian bahan kimia yang diperlukan dari gudang kimia kepada pekerja atau mahasiswa yang
mengambil mata kuliah praktik atau
mahasiswa yang sedang melakukan penelitian di laboratorium. Bahan tersebut digunakan untuk sintesis maupun analisis. Oleh karena tujuan penggunaannya, maka terbentuklah bahan awal, produk samping, pelarut yang
digunakan dan bahan kimia yang
terkontaminasi sehingga bahan tersebut harus diurai atau dibuang jika daur ulang tidak mungkin dilakukan (Jamhari 2009).
Limbah laboratorium tidak boleh dibuang secara langsung begitu saja ke badan air.
Beberapa tipe limbah berbahaya yang
dapat membantu mengurangi atau menghilangkan sifat racunnya. Keuntungan dari penghilangan sifat racun juga mengurangi resiko kontaminasi pada pekerja laboratorium atau mahasiswa yang melakukan kegiatan di laboratorium (Jamhari 2009). Limbah yang dibuang sembarangan jika masuk ke badan air tanah dan mengalir ke pemukiman penduduk akan menimbulkan bahaya, terutama logam-logam berat. Jika tidak ditangani dengan dengan baik dapat membahayakan makhluk hidup dan merusak lingkungan (Saputra 2008).
Secara umum diketahui bahwa limbah dari
laboratorium umumnya bersifat sangat
beragam dibandingkan dengan limbah dari
sumber lainnya. Beberapa limbah
laboratorium itu berpotensi mengandung bahan dengan kategori B3 (Bahan Berbahaya Beracun) yang memerlukan penanganan secara khusus. Pengolahan limbah B3 dapat dilakukan secara fisika, kimia, dan biologi atau kombinasinya. Sebelum diolah, limbah B3 terlebih dahulu harus dianalisis parameter fisika, kimia dan/atau biologinya sebagai dasar untuk menentukan proses pengolahan limbah yang tepat, yang dapat memenuhi ketetapan baku mutu pembuangan dan/atau lingkungan. Terdapat beberapa alternatif teknologi proses pengolahan limbah B3 secara kimia, di antaranya netralisasi, presipitasi,
koagulasi-flokulasi, oksidasi, inaktivasi,
stabilisasi, dan insinerasi (Departemen Kimia 2007).
Logam Berat
Logam berat merupakan unsur-unsur logam yang memiliki densitas lebih besar dari 5 mg/l. Unsur-unsur ini terletak di bagian tengah dari daftar periodik. Logam-logam tersebut meliputi Ni, Mn, Pb, Cr, Cd, Zn, Cu, Fe, dan Hg. Diantara logam tersebut
merupakan unsur renik esensial bagi
pertumbuhan tanaman, hewan, dan manusia karena logam tersebut dibutuhkan hanya sedikit sekali untuk pertumbuhan dan bila kadarnya berlebih maka logam-logam tersebut bersifat racun. Oleh karena itu perlu adanya kontrol terhadap logam-logam berat dalam lingkungan (Departemen Kimia 2007).
Menurut Widowati et al. (2008), logam