PENAPISAN INHIBITOR TIROSINASE PADA EMPAT
SPESIES FAMILI ASTERACEAE
Chrysantemum morifolium
R,
Gerbera jamesonii
A,
Dahlia rosea
Cav, DAN
Tagetes erecta
MEYSI ANNA FRANSISKA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
MEYSI ANNA FRANSISKA. Penapisan Inhibitor Tirosinase pada Empat Spesies
Famili Asteraceae
C
hrysantemum morifolium
R,
Gerbera jamesonii
A,
Dahlia
rosea
Cav, dan
Tagetes erecta
. Dibimbing oleh IRMANIDA BATUBARA dan
LATIFAH K DARUSMAN
Tujuan penelitian ini adalah menapis potensi inhibitor tirosinase dari 4
spesies famili Asteraceae. Penapisan ini dilakukan pada daun dan bunga
Chrysantemum morifolium
R,
Gerbera jamesonii
A,
Dahlia rosea
Cav, dan
Tagetes erecta
. Sampel dikeringkan, lalu diekstraksi dengan
n
-heksana, etil asetat,
dan metanol. Aktivitas inhibisi diuji menggunakan spektrofotometer
microplate
reader
pada panjang gelombang 492 nm. Ekstrak etil asetat bunga
D. rosea
Cav
paling berpotensi sebagai inhibitor tirosinase (IC
50untuk monofenolase 18.42
µg/mL dan untuk difenolase 687.79 µg/mL) dibandingkan dengan jenis
Asteraceae lainnya. Sementara minyak atsiri yang paling aktif sebagai inhibitor
tirosinase diperoleh dari bunga
T. erecta
(IC
50monofenolase 1882.62 µg/mL dan
difenolase 1884.33 µg/mL). Kontrol positif yang digunakan ialah asam kojat yang
memiliki nilai IC
50untuk monofenolase sebesar 11.024 µg/mL dan difenolase
sebesar 84.19
µg/mL. Fraksionasi ekstrak teraktif dengan kromatografi lapis tipis
preparatif dengan fase gerak kloroform menghasilkan 12 fraksi. Fraksi teraktif
memiliki IC
505.55 µg/mL untuk monofenolase dan 109.96 µg/mL untuk
difenolase dan diidentifikasi sebagai flavonoid.
ABSTRACT
MEYSI ANNA FRANSISKA. Screening of Tyrosinase Inhibitor from Four
Species of Asteraceae Family C
hrysantemum morifolium
R,
Gerbera jamesonii
A,
Dahlia rosea
Cav, and
Tagetes erecta
. Supervised by IRMANIDA BATUBARA
and LATIFAH K DARUSMAN
The research was conducted to screen the potency of tyrosinase inhibitor
from 4 species of Asteraceae family. The screening was performed on the leaves
and flowers of C
hrysantemum morifolium
R,
Gerbera jamesonii
A,
Dahlia rosea
Cav, and
Tagetes erecta
. The samples were dried and then extracted with
n
-hexane, ethyl acetate, and methanol. The inhibition activity was tested by a
microplate reader spectrophotometer in 492 nm. The ethyl acetate extract of
D.
rosea
Cav flower was the most potent tyrosinase inhibitor (IC
50for
monophenolase 18.42 µg/mL and for diphenolase 687.79 µg/mL) compared with
the other Asteraceae species. The most active essential oils as inhibitor of
tyrosinase was obtained from
T. erecta
flower (IC
50for monophenolase 1882.62
µg/mL and for diphenolase 1884.33 µg/mL). Positive control used was kojic acid
with IC
50value of 11.02 µg/mL for monophenolase and 84.19 µg/mL for
diphenolase. Fractionation of the extract by preparative thin layer chromatography
with chloroform as mobile phase gave 12 fractions. The most active fraction had
IC
50of 5.55 µg/mL for monophenolase and 109.96 µg/mL for diphenolase, and
PENAPISAN INHIBITOR TIROSINASE PADA EMPAT
SPESIES FAMILI ASTERACEAE
Chrysantemum morifolium
R,
Gerbera jamesonii
A,
Dahlia rosea
Cav, DAN
Tagetes erecta
MEYSI ANNA FRANSISKA
Skripsi
Sebagai salah satu syarat memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Penapisan Inhibitor Tirosinase pada Empat Spesies Famili
Asteraceae C
hrysantemum morifolium
R,
Gerbera jamesonii
A,
Dahlia rosea
Cav, dan
Tagetes erecta
.
Nama
: Meysi Anna Fransiska
NIM
: G44096019
Disetujui,
Pembimbing I
Dr Irmanida Batubara, SSi, MSi
NIP 19750807 200501 2 001
Pembimbing II
Prof Dr Ir Latifah K Darusman, MS
NIP 19530824 197603 2 003
Diketahui,
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Tiada kata terindah selain ungkapan rasa syukur dan terima kasih penulis
pada Tuhan Sang Pencipta yang telah memberikan inspirasi pada penulis sehingga
dapat menyelesaikan karya ilmiah berjudul “
Penapisan Inhibitor Tirosinase pada
Empat Spesies Famili Asteraceae C
hrysantemum morifolium
R,
Gerbera
jamesonii
A,
Dahlia rosea
Cav, dan
Tagetes erecta
”.
Karya ilmiah ini disusun
berdasarkan penelitian yang dilaksanakan pada bulan Agustus 2011 hingga Mei
2012 di Laboratorium Kimia Analitik Institut Pertanian Bogor (IPB) Dramaga dan
Laboratorium Pusat Studi Biofarmaka Taman Kencana.
Penulis mengucapkan terima kasih kepada Dr Irmanida Batubara, SSi, MSi
dan Prof Dr Ir Latifah K Darusman, MS selaku pembimbing yang telah
memberikan arahan, pengetahuan, motivasi, bimbingan, saran, dan doa selama
penelitian. Terima kasih kepada Pusat Studi Biofarmaka (PSB) Taman Kencana
yang sudah memberikan kesempatan penulis untuk melakukan penelitian di
laboratorium PSB. Terima kasih kepada Bapak dan Mama tercinta untuk
dukungan, motivasi, doa, serta kasih sayang yang tak pernah berhenti diberikan.
Terima kasih juga buat abang dan kakak iparku tersayang Bang Jeffry dan Kak
Diana, Robby Parlo, dan kedua adikku yang kusayangi Leo dan Adi atas
dukungannya dan kesetiaannya membantu penulis dengan penuh kasih selama
masa studi hingga proses penyusunan karya ilmiah ini.
Ucapan terima kasih juga penulis sampaikan kepada para laboran Kimia
Analitik Bu Nunung, Om Eman, Pak Engkos, Pak Dede, kepada seluruh analis di
laboratorium PSB, Mba Salina, teman-temanku Diah Daru, Lia, Irma, Fitri Siddiq,
Gina, Kak Doni, Kak Yana, Lalu, Zuzu, Niati, Ichsan, dan Cahya dan teman kos
di Bagunde 14 (Kak Epi, Kak Fina, Dyanika, Wisty, Friska, Naomi, Besty, Icha,
Ana Barokah, Shelo, Lesmi, Dina, dan Tri), seluruh teman peneliti di
Laboratorium Kimia Analitik, dan semua teman seperjuanganku di Ekstensi
Kimia atas bantuan dan kebersamaannya selama ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2012
RIWAYAT HIDUP
Penulis dilahirkan di Medan pada tanggal 18 Mei 1988 dari pasangan Bapak
Bahtera Peranginangin dan Ibu Rantemalem Purba sebagai putri kedua dari empat
bersaudara. Penulis lulus dari SMA Negeri 10 Pekanbaru pada tahun 2006 dan
pada tahun yang sama diterima di Program Diploma 3 Analisis Kimia IPB melalui
jalur reguler. Penulis lulus pada tahun 2009 dan melanjutkan pendidikan S1
melalui Program Alih Jenis Departemen Kimia IPB pada tahun yang sama.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN... 1
BAHAN DAN METODE
Alat dan Bahan ... 1
Metode Penelitian ... 2
HASIL DAN PEMBAHASAN
Identitas Sampel ...
Error! Bookmark not defined.
Kadar Air dan Abu ... 4
Ekstrak ... 4
Aktivitas Inhibitor Tirosinase Ekstrak Kasar ... 5
Fitokimia Ekstrak Kasar Aktif ... 6
Hasil Analisis GC-MS ... 6
Eluen Terbaik ... 7
Fraksi-fraksi KLTP ... 7
Analisis Spektrum FTIR Fraksi Teraktif ... 9
SIMPULAN DAN SARAN
Simpulan ... 9
Saran ... 9
DAFTAR PUSTAKA ... 9
DAFTAR TABEL
Halaman
1 Kadar air dan abu famili Asteraceae ... 4
2 Rendemen ekstrak
n
-heksana, etil asetat, dan metanol serta minyak atsiri
famili Asteraceae ... 4
3 IC
50ekstrak
n
-heksana, etil asetat, dan metanol serta minyak atsiri
famili Asteraceae ... 5
4 Fitokimia ekstrak kasar dengan aktivitas inhibitor tirosinase ... 6
5 Senyawa dalam minyak atsiri bunga
T. erecta
... 7
6 Rendemen fraksi hasil pemisahan dengan KLTP ekstrak etil asetat
bunga
D. rosea
Cav ... 8
7 IC
50fraksi-fraksi hasil KLTP ekstrak etil asetat bunga
D
.
rosea
Cav ... 8
8 Absorpsi inframerah gugus fungsi fraksi 1 (F1) pada ekstrak etil asetat
bunga
D
.
rosea
Cav ... 9
DAFTAR GAMBAR
Halaman
1 Struktur piperiton dan piperitenon oksida ... 7
2 Struktur linalool . ... 7
3 Kromatogram ekstrak kasar etil asetat (*) dan 12 fraksi (F1
–
F12)
hasil KLTP. ... 8
4 Warna hasil uji kualitatif flavonoid dengan KLT. Deteksi dilakukan
DAFTAR LAMPIRAN
Halaman
1 Prosedur penelitian ... 12
2 Identifikasi sampel famili Asteraceae ... 15
3 Kadar air serbuk daun dan bunga
D. rosea
Cav... 18
4 Kadar abu serbuk daun dan bunga
D. rosea
Cav ... 19
5 Rendemen ekstrak daun dan bunga
D. rosea
Cav... 20
6 Contoh perhitungan IC
50monofenolase dan difenolase ekstrak
etil asetat bunga
D. rosea
Cav ... 21
7 Kromatogram GC-MS minyak atsiri
T
.
erecta
... 22
8 Kromatogram eluen terbaik... 22
PENDAHULUAN
Warna kulit bergantung pada 3 (tiga) komponen menurut derajat yang bervariasi. Jaringan memiliki warna inheren kekuningan diakibatkan oleh kandungan karotena. Adanya hemoglobin (Hb) beroksigen di dasar kapiler dermis memberikan warna kemerahan. Warna kecokelatan sampai kehitaman diakibatkan oleh variasi jumlah pigmen melanin, satu-satunya pigmen yang dihasilkan di kulit. Prinsip utama dari produk pencerah kulit ialah menghambat pembentukan melanin.
Enzim merupakan biokatalis yang mampu meningkatkan laju reaksi kimia tertentu tanpa ikut bereaksi (Montgomery et al. 1993). Tirosinase merupakan enzim yang mengatur biosintesis melanin. Pembentukan melanin dapat dihambat dengan cara menurunkan sintesis tirosinase atau menghambat aktivitasnya (Hartanti & Setiawan 2009). Enzim tirosinase bekerja mengubah tirosin menjadi 3,4-dihidroksifenilalanin (DOPA) dan kemudian menjadi dopakuinonyang selanjutnya melalui beberapa tahap transformasi dikonversi menjadi melanin (Fitrie 2004).
Inhibitor tirosinase akan menghambat reaksi pencokelatan atau pembentukan melanin. Berbagai inhibitor tirosinase telah banyak digunakan dalam bahan kosmetik sebagai pencegah hiperpigmentasi, di antaranya adalah asam askorbat, arbutin, asam kojat, merkuri, dan hidrokuinon. Dari beberapa senyawa tersebut, asam kojat memiliki efek inhibisi dan kestabilan paling besar, namun menurut Miyazawa dan Tamura (2007), asam kojat bersifat karsinogenik.
Bunga famili Asteraceae memiliki ragam yang sangat banyak di dunia maupun di Indonesia sekalipun. Famili Asteraceae atau Compositae diwakili oleh sekitar 900 genus dan 13000 spesies antara lain
Chrysanthemum, Gerbera, Dahlia, dan
Tagetes. Bunga Chrysanthemum atau krisan aslinya berasal dari negara-negara Asia Timur, seperti Jepang, Cina, dan Korea. Krisan memiliki sekitar 30 spesies tanaman berbunga. Ekstrak bunga spesies Bellis perennis (Daisy) yang termasuk ke dalam genus Chrysantemum famili Asteraceae dapat digunakan sebagai pencerah (pemutih) kulit alami, membantu mengencangkan kulit, mengontrol bintik-bintik akibat usia, dan
menyeimbangkan hiperpigmentasi (Jhon et al. 2005). Beberapa contoh spesies
Chrysanthemum ialah C. morifolium R, C. indicum, dan C. daisy (Allison 2010).
Gerbera merupakan tanaman bunga hias yang diduga berasal dari Afrika Selatan dan Swaziland. Salah satunya ialah Gerbera jamesonii (Mattjik 2010). Tanaman hias
Gerbera merupakan salah satu penghasil minyak atsiri dan digunakan sebagai bahan baku industri minyak atsiri dan digunakan sebagai bahan baku industri minyak wangi, sabun, dan kosmetik (Agronomi 2010).
Bunga Dahlia termasuk tanaman perdu atau akar berumbi yang sifatnya tahunan, salah satunya ialah Dahlia rosea Cav. Tanaman dahlia memiliki kandungan kimia flavonoid. Bila ditinjau dari sejarahnya,
Dahlia sudah sejak lama digunakan sebagai tanaman obat (Mattjik 2010).
Secara umum, Tagetes disebut bunga marigold. Tanaman ini aslinya berasal dari Amerika Utara dan Selatan. Tanaman ini termasuk famili Asteraceae, beberapa spesies di antaranya lebih dikenal dengan nama
“Tagette”. Selain itu, minyak ini dapat diaplikasikan dalam produk makanan, antara lain kola, minuman beralkohol, permen, gelatin, puding, dan bumbu (Babu & Kaul 2007). Spesies Tagetes minuta diketahui memiliki potensi sebagai inhibitor tirosinase (Chairi et al. 2009). Beberapa spesies lainnya dari genus ini ialah Tagetes erecta, T. filifolia,
T. lacera, T. lucida, T. patula, T. tenuifolia
(Sukarman & Chumaidi 2010).
Penelitian ini dilakukan untuk menentukan senyawa aktif sebagai inhibitor tirosinase pada beberapa spesies dalam famili Asteraceae. Spesies yang diteliti meliputi C.
morifolium R, G. jamesonii A, D. rosea Cav,
dan T. erecta
BAHAN DAN METODE
Alat dan Bahan
Bahan-bahan yang digunakan dalam penelitian ini antara lain ialah bunga dan daun
C. morifolium Ramat, G. jamesonii Adlam, D.
rosea Cav dari Berastagi Sumatra Utara, dan
T. erecta dari daerah Cipanas, Jawa Barat, metanol, etanol, kloroform p.a, etil asetat, aseton, dietil eter, dimetil sulfoksida (DMSO), bufer fosfat pH 6.5, dietil eter, serbuk Mg, H2SO4 p.a, NH4OH, amil alkohol, n-heksana,
diklorometana, FeCl3 1 %, akuades, enzim
tirosinase dari jamur (Sigma, 333 unit/mL), asam kojat, dan L-DOPA 2 mM atau L-tirosin 2 mM.
Metode Penelitian
Metode penelitian ini meliputi penyulingan minyak atsiri, persiapan sampel, uji pendahuluan, ekstraksi, uji fitokimia (alkaloid, saponin, flavonoid, steroid, dan tanin), penentuan eluen terbaik, uji inhibisi tirosinase, analisis kromatografi gas-spektrometri massa (GC-MS), serta identifikasi gugus fungsi dengan FTIR. Metode keseluruhan dapat dilihat pada Lampiran 1
Penyulingan Minyak Atsiri (Harborne 1987).
Bunga atau daun T. erecta dan D. rosea
Cav yang telah dirajang dimasukkan dalam labu bulat yang berisi air lalu direbus. Uap air yang bercampur dengan minyak atsiri berubah fase menjadi cair setelah melewati kondensor. Minyak yang dihasilkan ditampung, lalu dipartisi dengan etil asetat dan diuapkan dengan penguap putar.
Preparasi dan Ekstraksi (Batubara et al. 2010)
Bagian daun dan bunga dipisahkan, masing-masing dikeringkan kemudian digiling. Setelah itu, sampel direndam dalam
n-heksana, etil asetat, dan metanol dengan nisbah 1:10 selama 24 jam sebanyak 3 kali ulangan. Ekstrak disaring dengan kertas saring dan filtrat dipekatkan dengan penguap putar pada suhu 30 oC. Rendemen tiap ekstrak ditentukan.
Penentuan Kadar Air (Sulaiman et al. 2005)
Cawan porselen dikeringkan di dalam oven 105 oC selama 30 menit, didinginkan dalam desikator selama 30 menit dan ditimbang (W1). Sebanyak 3 g sampel (W2)
dimasukkan dalam cawan lalu dikeringkan
dalam oven bersuhu 105 oC selama 4 jam, didinginkan dalam desikator selama 15 menit, dan ditimbang. Pengukuran bobot sampel ini diulangi setiap 1 jam sampai diperoleh bobot konstan (W3).
Kadar air (%) = 100%
1 2 3 2 W W W W
Penetapan Kadar Abu (Sulaiman et al. 2005)
Cawan porselen dikeringkan di dalam tanur 600 oC selama 30 menit, kemudian didinginkan dalam desikator selama 30 menit dan bobot awal ditimbang (X). Sebanyak 3 g sampel (Y) dimasukkan ke dalam cawan, dipijarkan di atas nyala pembakar Bunsen sampai tidak berasap lagi, kemudian dimasukkan ke dalam tanur 600 oC selama 30 menit. Cawan berisi abu ditimbang kembali (Z).
Kadar abu (%) = 100%
Y X Z
Uji Inhibisi Tirosinase (Batubara et al. 2010)
Ekstrak n-heksana, etil asetat, metanol dan minyak atsiri yang sudah dipartisi dengan etil asetat (daun dan bunga Asteraceae) dilarutkan dalam DMSO hingga konsentrasi 10000 µg/mL. Larutan stok kemudian disiapkan dengan melarutkan ekstrak ke dalam bufer fosfat 50 mM (pH 6.5) hingga diperoleh konsentrasi 2857 µg/mL.
Setelah itu, ekstrak dan asam kojat sebagai kontrol positif diuji mulai konsentrasi 7.81 hingga 2000 µg/mL dalam pelat tetes 96 sumur. Sebanyak 70 µL ekstrak pengenceran ini masing-masing digabungkan dengan 30 µL enzim tirosinase (Sigma, 333 unit/mL dalam bufer fosfat). Pelat diinkubasi pada suhu kamar selama 5 menit, kemudian ditambahkan 110 µL substrat L-tirosin 2 mM atau L-DOPA 2 mM dan diinkubasi kembali selama 30 menit pada suhu kamar. Larutan pada setiap sumur diukur dengan menggunakan multi-well plate reader pada panjang gelombang 492 nm untuk menentukan persen inhibisi dan nilai konsentrasi hambat 50% (IC50). Persen
inhibisi dihitung dengan cara membandingkan serapan sampel sebelum penambahan ekstrak (A) dengan setelah penambahan ekstrak (B):
Inhibisi (%) = 100%
A B
Uji Fitokimia
Uji fitokimia merupakan uji pendahuluan untuk mengetahui kandungan kimia alkaloid, steroid, saponin, flavonoid, tanin, dan fenol secara kualitatif (Harborne 1987). Uji fitokimia dilakukan terhadap ekstrak n -heksana, etil asetat, dan metanol.
Uji Alkaloid. Ekstrak dengan bobot tertentu dilarutkan dengan 10 mL kloroform dan beberapa tetes NH4OH kemudian disaring
ke dalam tabung tertutup. Ekstrak kloroform dalam tabung reaksi dikocok dengan 10 tetes H2SO4 2 M dan lapisan asamnya dipisahkan
ke dalam tabung reaksi lain. Lapisan asam ini diteteskan ke lempeng tetes dan ditambahkan pereaksi Mayer, Wagner, dan Dragendorf yang akan menimbulkan endapan dengan warna berturut-turut putih, cokelat, dan merah jingga jika ekstrak mengandung alkaloid.
Uji Saponin dan Flavonoid. Ekstrak dengan bobot tertentu dimasukkan ke dalam gelas piala besar kemudian ditambahkan 100 mL air panas, dididihkan selama 5 menit. Setelah itu, disaring dan filtratnya digunakan untuk pengujian. Uji saponin dilakukan dengan mengocok 10 mL filtrat di dalam tabung reaksi tertutup selama 10 detik kemudian dibiarkan selama 10 menit. Adanya saponin ditunjukkan dengan terbentuknya buih stabil. Sebanyak 10 mL filtrat yang lain ditambahkan 0.5 g serbuk Mg, 2 mL alkohol klohidrat (campuran HCl 37% dan etanol 95% dengan volume yang sama), dan 20 mL amil alkohol kemudian dikocok kuat-kuat. Terbentuknya warna merah, kuning, dan jingga pada lapisan amil alkohol menunjukkan adanya flavonoid.
Uji Steroid. Ekstrak dilarutkan dengan 25 mL etanol panas (50 oC) kemudian disaring ke dalam pinggan porselen dan diuapkan sampai kering. Residu ditambahkan eter, dipindahkan ke lempeng tetes, lalu ditambahkan 3 tetes anhidrida asam asetat dan 1 tetes H2SO4 pekat (uji Lieberman-Buchard).
Warna merah atau ungu atau biru menunjukkan adanya steroid.
Uji Tanin dan Fenol. Ekstrak ditambahkan 100 mL air panas, dididihkan selama 5 menit, dan disaring. Ke dalam sebagian filtrat ditambahkan larutan FeCl3 1
%. Warna hitam kehijauan menunjukkan adanya tanin, sedangkan warna ungu, biru tua, atau hijau menunjukkan senyawa fenolik.
Penentuan Eluen Terbaik
Sedikit ekstrak pekat sampel ditotolkan pada pelat KLT. Setelah kering, pelat dielusi dalam bejana yang telah dijenuhkan oleh uap eluen pengembang. Eluen yang digunakan adalah metanol, aseton, etil asetat, kloroform, diklorometana, dietil eter, dan n-heksana. Pemisahan dilanjutkandengan berbagai nisbah campuran eluen yang menghasilkan noda banyak dan terpisah. Noda hasil elusi diamati di bawah lampu UV pada panjang gelombang 254 dan 365 nm.
Pemisahan Secara Kromatografi Lapis Tipis Preparatif (Nohong 2009)
Ekstrak pekat sebanyak ±0.2000 g dilarutkan dalam etil asetat. Ekstrak ditotolkan 2 cm dari tepi bawah pelat KLT preparatif berukuran 20
20 cm2 sebagai fase diam, dan dielusi dengan eluen kloroform p.a. Campuran akan terpisah menjadi beberapa fraksi. Pelat KLT preparatif yang telah dielusi dibiarkan kering udara dan disinari dengan lampu UV pada panjang gelombang 254 dan 365 nm. Pita-pita pemisahan yang tampak ditandai dengan pensil. Masing-masing dikerok, ditampung dalam tabung reaksi, dan diekstraksi dengan etil asetat. Residu disaring, filtrat dikumpulkan dan diuapkan pelarutnya untuk mendapatkan padatan.Identifikasi Senyawa
Sebanyak ±0.8000 mg sampel dihaluskan bersama dengan 0.2004 g KBr dalam mortar agat. Setelah halus dan bercampur, serbuk dimasukkan ke dalam alat pencetak. Lempengan yang diperoleh dimasukkan ke dalam spektrofotometer FTIR.
Penentuan Senyawa dalam Distilat Kasar Minyak Atsiri dengan GC-MS
Identifikasi senyawa dilakukan dengan membandingkan puncak spektrum massa dengan yang terdapat dalam library index MS
Wiley Library. Persentase komposisi dihitung dari luas puncak kromatogram.
HASIL DAN PEMBAHASAN
Identitas Sampel
Sampel yang digunakan adalah berbagai spesies dari famili Asteraceae yang diperoleh dari Cipanas, Jawa Barat. Bagian batang, bunga, dan daun diidentifikasi di Herbarium Bogoriensis, Bidang Botani Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong, Jawa Barat.
Berdasarkan hasil identifikasi, sampel bunga krisan, Gerbera, dahlia, dan Tagetes
yang digunakan adalah Chrysanthemum morifolium Ramat dengan nomor spesimen 1135/IPH.1.02/If.8/VIII/2011, Gerbera jamesonii Adlam dengan nomor spesimen 1180/IPH.1.02/If.8/VIII/2011, Dahlia rosea Cav dengan nomor spesimen 1532/IPH.1.02/If.8/XI/2011, dan Tagetes erecta dengan nomor spesimen 1136/IPH.1.02/If.8/VIII/2011. Hasil identifikasi terlampir (Lampiran 2).
Kadar Air dan Abu
Jumlah air yang terkandung dalam suatu bahan berbeda-beda bergantung pada perlakuan yang dialami serta kelembapan tempat penyimpanan bahan tersebut (Harjadi 1986). Suatu sampel dikatakan baik dan dapat disimpan dalam jangka waktu lama bila memiliki kadar air <10% karena akan relatif terhindar dari kerusakan oleh mikrob (Winarno 1992). Penentuan kadar air juga berguna sebagai faktor koreksi rendemen serta untuk memperkirakan masa simpan bahan serta ketahanannya terhadap mikrob. Kandungan air pada serbuk kering daun dan bunga Asteraceae berkisar antara 7.84 dan 16.56% (Tabel 1). Perhitungan kadar air dapat dilihat pada Lampiran 3.
Kadar abu menunjukkan kandungan mineral, kemurnian, serta kebersihan suatu bahan. Kadar abu yang diperoleh berkisar 5.61–15.91% (Tabel 1). Kadar abu pada sampel daun lebih tinggi dibandingkan dengan sampel bunga, menunjukkan kandungan mineral yang lebih besar pada sampel serbuk daun. Perhitungan kadar abu ditunjukkan pada Lampiran 4.
Tabel 1 Kadar air dan abu famili Asteraceae
Spesies Bagian Kadar (%)
Air Abu
C. morifolium Daun 7.84±0.05 15.59±0.24
Bunga 12.36±0.01 8.70±0.05
G. jamesonii Daun 9.81±0.04 10.02±0.22
Bunga 16.56±0.13 5.61±0.16
D. rosea Cav Daun 8.12±0.01 12.47±0.13
Bunga 9.51±0.05 7.39±0.03
T. erecta Daun 9.76±0.42 15.91±0.41
Bunga 8.71±0.03 6.67±0.03
Ekstrak
Ekstraksi bertingkat secara maserasi dilakukan dengan menggunakan pelarut n -heksana, etil asetat, dan metanol secara berturut-turut selama 24 jam. Banyaknya senyawa yang terekstraksi dapat dilihat dari persen rendemen yang diperoleh (Tabel 2).
Pelarut n-heksana non polar sehingga diharapkan mampu mengekstraksi senyawa-senyawa yang mempunyai kepolaran rendah. Pelarut etil asetat dengan kepolaran sedang diharapkan mampu mengekstraksi senyawa-senyawa dengan kepolaran sedang, sedangkan pelarut metanol dengan kepolaran yang tinggi diharapkan dapat mengekstraksi senyawa-senyawa berkepolaran tinggi.
Tabel 2 Rendemen ekstrak n-heksana, etil asetat, dan metanol serta minyak atsiri famili Asteraceae
Spesies Bagian Rendemen ekstrak kering (%b/b)
n-heksana Etil asetat Metanol Minyak atsiri
C. morifolium R Daun 5.64±0.42 2.49±0.25 11.84±0.30 (-)
Bunga 4.76±0.11 2.29±0.33 28.54±0.32 (-)
G. jamesonii A Daun 4.88±0.67 10.73±0.18 20.97±0.49 (-)
Bunga 2.90±0.11 6.35±0.32 49.61±1.09 (-)
D. rosea Cav Daun 2.18±0.01 1.94±0.09 13.89±1.29 0.0263
Bunga 5.52±0.06 1.71±0.06 40.75±0.83 0.0019
T. erecta Daun 1.61±0.08 3.58±0.02 8.18±0.11 0.0116
Bunga 6.69±0.01 3.52±0.16 24.27±0.27 0.0091
Keterangan: (-) tidak dilakukan
Minyak atsiri diperoleh dari bunga dan daun D. rosea Cav dan T. erecta yang memiliki aroma paling khas. Rendemen paling tinggi diperoleh dari bagian daun (Tabel 2). Rendemen tertinggi (0.2630%) berasal dari daun D. rosea Cav, terendah (0.0019%) berasal dari bunganya. Rendemen minyak atsiri sangat kecil dibandingkan dengan ekstrak kasar. Hal ini dapat disebabkan jumlah minyak atsiri dalam sampel sangat sedikit dan distilasi minyak tidak menggunakan sampel basah.
Aktivitas Inhibitor Tirosinase Ekstrak Kasar
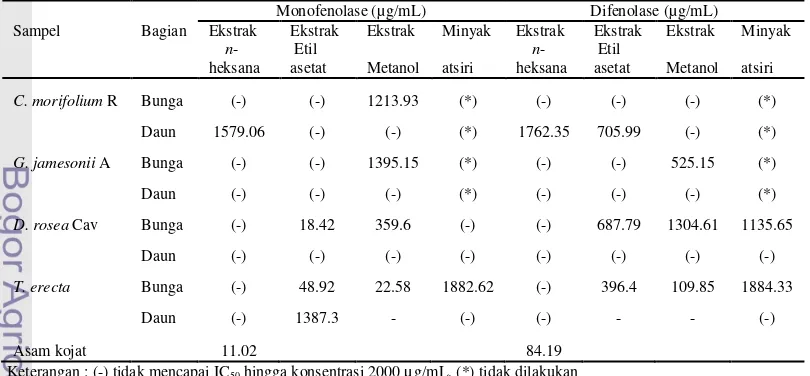
Daya inhibisi tirosinase ekstrak dan minyak atsiri diukur sebagai nilai IC50
terhadap monofenolase dan difenolase. Ekstrak etil asetat bunga D. rosea Cav didapat memiliki aktivitas tertinggi sebagai inhibitor tirosinase. IC50-nya tidak jauh berbeda dengan
kontrol positif (asam kojat) (Tabel 3), yaitu 18.42 µg/mL untuk monofenolase dan 687.79 µg/mL untuk difenolase. Perhitungan nilai IC50 ekstrak kasar diberikan pada Lampiran 6.
Tabel 3 menunjukkan bahwa minyak atsiri bunga T. erecta memiliki aktivitas paling baik bila dibandingkan dengan bunga/daun D. rosea Cav, namun nilai IC50-nya sangat kecil,
yaitu 1882.62 µg/mL untuk monofenolase dan 1884.33 µg/mL untuk difenolase. Minyak atsiri bunga T. erecta dianalisis lebih lanjut dengan GC-MS.
Tabel 3 IC50 ekstrak n-heksana, etil asetat, metanol, dan minyak atsiri famili Asteraceae
Monofenolase (µg/mL) Difenolase (µg/mL)
Sampel Bagian Ekstrak Ekstrak Ekstrak Minyak Ekstrak Ekstrak Ekstrak Minyak
n -heksana
Etil
asetat Metanol atsiri
n -heksana
Etil
asetat Metanol atsiri
C. morifolium R Bunga (-) (-) 1213.93 (*) (-) (-) (-) (*)
Daun 1579.06 (-) (-) (*) 1762.35 705.99 (-) (*)
G. jamesonii A Bunga (-) (-) 1395.15 (*) (-) (-) 525.15 (*)
Daun (-) (-) (-) (*) (-) (-) (-) (*)
D. rosea Cav Bunga (-) 18.42 359.6 (-) (-) 687.79 1304.61 1135.65
Daun (-) (-) (-) (-) (-) (-) (-) (-)
T. erecta Bunga (-) 48.92 22.58 1882.62 (-) 396.4 109.85 1884.33
Daun (-) 1387.3 - (-) (-) - - (-)
Asam kojat 11.02 84.19
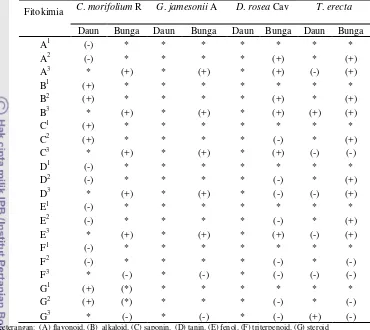
Tabel 4 Fitokimia ekstrak kasar dengan aktivitas inhibitor tirosinase Fitokimia C. morifolium R G. jamesonii A D. rosea Cav T. erecta Daun Bunga Daun Bunga Daun Bunga Daun Bunga
A1 (-) * * * * * * * A2 (-) * * * * (+) * (+) A3 * (+) * (+) * (+) (-) (+) B1 (+) * * * * * * * B2 (+) * * * * (+) * (+) B3 * (+) * (+) * (+) (+) (+) C1 (+) * * * * * * * C2 (+) * * * * (-) * (+) C3 * (+) * (+) * (+) (-) (-) D1 (-) * * * * * * * D2 (-) * * * * (-) * (+) D3 * (+) * (+) * (-) (-) (+) E1 (-) * * * * * * * E2 (-) * * * * (-) * (+) E3 * (+) * (+) * (+) (-) (+) F1 (-) * * * * * * * F2 (-) * * * * (-) * (-) F3 * (-) * (-) * (-) (-) (-) G1 (+) (*) * * * * * * G2 (+) (*) * * * (-) * (-) G3 * (-) * (-) * (-) (+) (-)
Keterangan: (A) flavonoid, (B) alkaloid, (C) saponin, (D) tanin, (E) fenol, (F) triterpenoid, (G) steroid (1) ekstrak n-heksana, (2) ekstrak etil asetat, (3) ekstrak metanol
(*) tidak diuji karena nilai IC50 monofenolase dan difenolasenya melebihi 2000 µg/mL.
Fitokimia Ekstrak Kasar Aktif
Ekstrak yang aktif terhadap inhibitor tirosinase (Tabel 3) diuji fitokimia, hasilnya ditunjukkan pada Tabel 4. Alkaloid terdapat pada ekstrak metanol bunga C. morifolium R,
G. jamesonii A, dan D. rosea Cav serta ekstrak etil asetat dan metanol bunga T. erecta. Flavonoid terdapat pada semua ekstrak yang aktif terhadap inhibitor tirosinase. Saponin terdapat pada semua ekstrak bunga C. morifolium R dan G. jamesonii A, ekstrak metanol bunga D. rosea Cav, dan ekstrak etil asetat bunga T. erecta.
Tanin terdapat pada ekstrak metanol bunga C. morifolium R dan bunga G. jamesonii A, serta ekstrak etil asetat dan metanol bunga T. erecta. Senyawa fenolik terdapat pada ekstrak metanol bunga C. morifolium R, G. jamesonii A, dan D. rosea
Cav serta ekstrak etil asetat dan metanol bunga T. erecta. Senyawa triterpenoid tidak ada pada semua ekstrak yang aktif terhadap
inhibitor tirosinase. Senyawa steroid ditemukan pada seluruh ekstrak daun T. erecta. Dalam penelitian Chang (2009) dinyatakan bahwa kandungan flavonoid dalam ekstrak diduga akan memberikan efek inhibisi yang cukup besar terhadap enzim tirosinase.
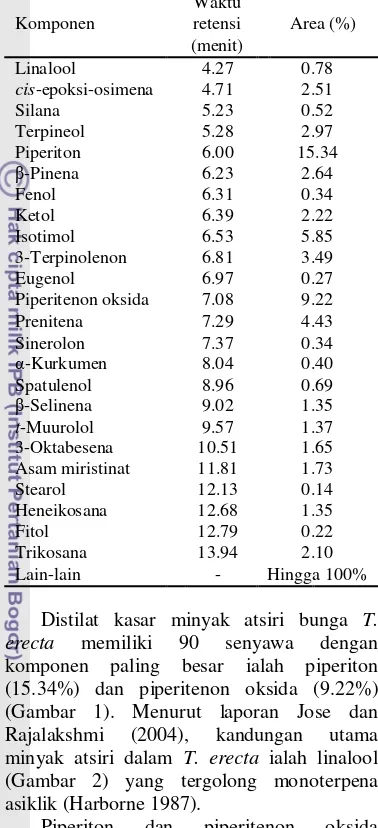
Hasil Analisis GC-MS
Identifikasi kandungan senyawa dalam minyak atsiri bunga T. erecta dilakukan dengan menggunakan instrumen GC-MS (Shimadzu-QP-5050A) dan menghasilkan kromatogram seperti ditunjukkan pada Lampiran 7. Analisis kandungan senyawa dilakukan dengan membandingkan m/z
Tabel 5 Senyawa dalam minyak atsiri bunga
T. erecta
Waktu
Komponen retensi Area (%)
(menit)
Linalool 4.27 0.78
cis-epoksi-osimena 4.71 2.51
Silana 5.23 0.52
Terpineol 5.28 2.97
Piperiton 6.00 15.34
β-Pinena 6.23 2.64
Fenol 6.31 0.34
Ketol 6.39 2.22
Isotimol 6.53 5.85
3-Terpinolenon 6.81 3.49
Eugenol 6.97 0.27
Piperitenon oksida 7.08 9.22
Prenitena 7.29 4.43
Sinerolon 7.37 0.34
α-Kurkumen 8.04 0.40
Spatulenol 8.96 0.69
β-Selinena 9.02 1.35
t-Muurolol 9.57 1.37
3-Oktabesena 10.51 1.65
Asam miristinat 11.81 1.73
Stearol 12.13 0.14
Heneikosana 12.68 1.35
Fitol 12.79 0.22
Trikosana 13.94 2.10
Lain-lain - Hingga 100%
Distilat kasar minyak atsiri bunga T. erecta memiliki 90 senyawa dengan komponen paling besar ialah piperiton (15.34%) dan piperitenon oksida (9.22%) (Gambar 1). Menurut laporan Jose dan Rajalakshmi (2004), kandungan utama minyak atsiri dalam T. erecta ialah linalool (Gambar 2) yang tergolong monoterpena asiklik (Harborne 1987).
Piperiton dan piperitenon oksida berfungsi meningkatkan aktivitas antijamur (Romagnoli et al. 2005). Sementara senyawa linalool dilaporkan dapat menghambat enzim tirosinase dengan nilai inhibisi 50.50% (Nakatsu 2000). Oleh karena itu, senyawa linalool pada minyak atsiri bunga T. erecta
diduga berperan sebagai inhibitor tirosinase.
. . O . . . O O.
.
CH4Gambar 1 Struktur piperiton (a) dan piperitenon oksida (b) (Brown 2010).
. .
. .
OH
Gambar 2 Struktur linalool (Nakatsu et al. 2010).
Eluen Terbaik
Pemilihan pelarut untuk fase gerak KLTP dimulai dengan menguji 7 pelarut tunggal, yaitu aseton, n-heksana, etil asetat, metanol, diklorometana, kloroform, dan dietil eter. Sampel yang digunakan ialah ekstrak yang teraktif sebagai inhibitor tirosinase, yaitu ekstrak kasar etil asetat bunga D. rosea Cav dengan deteksi noda menggunakan lampu UV 254 dan 365 nm. Terlihat pada Lampiran 8, pelarut kloroform menghasilkan noda terbanyak dan terpisah dengan baik, berjumlah 12 noda, maka dipilih sebagai eluen terbaik.
Fraksi-fraksi KLTP
Fraksionasi ekstrak etil asetat bunga D.
Gambar 3 Kromatogram ekstrak kasar etil asetat (*) dan 12 fraksi (F1–F12) hasil KLTP.
Tabel 6 Rendemen fraksi hasil pemisahan dengan KLTP ekstrak etil asetat bunga D. rosea Cav
Fraksi Jumlah Nilai Rf Bobot Rendemen
KLTP noda (g) (%)
1 2 0.06, 0.14 0.0382 15.33
2 3 5 4 0.03, 0.05, 0.13, 1.17, 0.21 0.04, 0.11, 0.23, 0.26 0.0135 0.0135 0.0079 0.0079 5.42 3.17 3.17 4 4 0.04, 0.09,
0.14, 0.33
0.0111 4.45
5 6 2 6 0.04, 0.09 0.04, 0.15, 0.0089 0.0130 3.57 5.22 0.24, 0.53, 0.67, 0.81
7 5 0.04, 0.09, 0.58, 0.72,
0.0131 5.26
8 6
0.77
0.04, 0.71, 0.0086 3.45 0.77, 0.84,
0.86, 0.91
9 6 0.04, 0.09, 0.13, 0.84,
0.017 6.82
10 4
0.86, 0.91
0.03, 0.13, 0.0127 5.10 0.86, 0.91,
0.86, 0.91 0.0127
11 6 0.03, 0.06, 0.12, 0.15,
0.0148 5.94
12 8
0.15, 0.99
0.03, 0.13, 0.0103 4.13 0.14, 0.18,
0.23, 0.40, 0.78, 0.93
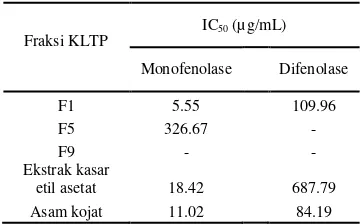
Fraksi hasil KLTP kemudian diuji aktivitas inhibitor tirosinasenya dan dibandingkan dengan ekstrak kasar. Fraksi 1 (F1) memiliki daya inhibisi paling besar, IC50
sebesar 5.55 µg/mL untuk monofenolase dan 109.96 µg/mL untuk difenolase (Tabel 7). Aktivitas inhibitor tirosinase fraksi 1 (F1) lebih besar daripada ekstrak kasarnya. Hal ini menunjukkan bahwa pemisahan komponen-komponen ekstrak akan menghasilkan senyawa lebih murni dan lebih berpotensi sebagai inhibitor tirosinase.
Tabel 7 IC50 fraksi-fraksi hasil KLTP ekstrak
etil asetat bunga D. rosea Cav
Fraksi KLTP
IC50 (µg/mL)
Monofenolase Difenolase
F1 5.55 109.96
F5 326.67 -
F9 - -
Ekstrak kasar
etil asetat 18.42 687.79
Asam kojat 11.02 84.19
Keterangan: (-) tidak mencapai IC50 hingga konsentrasi
2000 µg/mL.
Uji fitokimia lanjutan dilakukan dan diperoleh bahwa F1 mengandung flavonoid. Hasil ini didukung dengan analisis kualitatif KLT menggunakkan eluen terbaik. Warna noda yang tampak ketika disinari dengan lampu UV 365 nm ialah kuning pucat (Gambar 4a) dan setelah diuapi dengan amonia menjadi kuning kunyit (kuning semakin pekat) (Gambar 4b). Berdasarkan hasil ini, F1 diduga merupakan golongan flavon (Harborne 1987).
(a) (b)
Gambar 4 Warna hasil uji kualitatif flavonoid dengan KLT. Deteksi dilakukan dengan sinar UV 365 nm (a) dan dengan uap amonia (b).
Analisis Spektrum FTIR Fraksi Teraktif
Fraksi F1 kemudian dianalisis dengan spektrofotometer FTIR untuk menentukan gugus-gugus fungsi yang ada. Serapan yang dihasilkan memperkuat dugaan bahwa F1 tersebut merupakan flavonoid. Spektrum FTIR dari F1 dapat dilihat pada Lampiran 9. Analisis pada Tabel 8 menunjukkan serapan ulur OH fenol, ulur C-H, C=O (ulur), C=C aromatik, ulur C-O, dan C-C aromatik (tekuk). Beberapa golongan senyawa flavonoid yang diketahui dapat menginhibisi enzim tirosinase di antaranya ialah flavanon, flavonol, flavon, isoflavon, kalkon, dan isoflavon (Chang 2009).
Tabel 8 Absorpsi inframerah gugus fungsi fraksi 1 (F1) pada ekstrak etil asetat bunga D. rosea Cav
Bilangan
Literatur* Gugus
Gelombang (cm-1) Dugaan
3383.63 3650–3300 ulur OH fenol
2851.55–2921.85 2700–3000 ulur C-H
1512.93 1550–1900 C=O (ulur)
1630.84 1400–1600 C=C aromatik
1165.42 795.17
1150–1200 675–900
uluran C-O C-C aromatik
(tekuk) Keterangan: * Pavia et al. (2001).
SIMPULAN DAN SARAN
Simpulan
Ekstrak kasar etil asetat bunga D. rosea
Cav merupakan inhibitor tirosinase teraktif dibandingkan dengan ekstrak dan minyak atsiri spesies Asteraceae lainnya yang diujikan. IC50 monofenolase dan difenolase
berturut-turut 18.42 dan 687.79 µg/mL. Fraksionasi ekstrak tersebut dengan KLTP menghasilkan fraksi 1 (Rf 0.06 dan 0.14)
sebagai inhibitor tirosinase teraktif dengan IC50 monofenolase dan difenolase sebesar
5.55 dan 109.96 µg/mL dan diduga mengandung flavonoid.
Saran
Perlu dilakukan uji lebih lanjut agar diperoleh senyawa yang berperan dalam menghambat enzim tirosinase pada fraksi dan minyak atsiri yang teraktif.
DAFTAR PUSTAKA
Agronomi R. 2010. Tip Merawat Tanaman Hias. Jakarta: AgroMedia Pustaka. Allison R. 2010. Cosmeuceutical Skin
Nutrition Workbook. America: Wheeler Pr.
Babu KG, Kaul VK. 2007. Variations in quantitative and qualitative characteristics of wild marigold (Tagetes minuta L.) oils distilled under vacuum and at NTP.
Industrial Crops and Product: An Int J
26:241-251.
Batubara I, Darusman LK, Mitsunaga T, Rahminiwati M, Djauhari E. 2010. Potency of Indonesia medicinal plant as tyrosinase inhibitor and antioxidant agent.
J Biol Sci 10:138-144.
Brown GW. 2010. The biosynthesis of artemisinin (Qinghaosu) and the phytochemistry of Artemisia annua L. (Qinghao). Molecules 15:7603-7698. Chang TS. 2009. An updated review of
tyrosinase inhibitor. J Mol Sci 10:2440-2475.
Chairi ME, Joray MB, Ruiz G, Palacios SM, Carpinella MC. 2010. Tyrosinase inhibitory activity of native plants from central Argentina: Isolation of an active principle from Lithrea molleoides. Food Chem 120:10-14.
Fitrie AA. 2004. Histologi dari melanosit. e-USU Repository Universitas Sumatera Utara 5:1-6.
Harborne. 1987. Metode Fitokimia. Padmawinata K, penerjemah; Bandung: Penerbit ITB. Terjemahan dari:
Phytochemical Methods.
Harjadi W. 1986. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia.
Hartanti L, Setiawan HK. 2009. Inhibitory potential of some synthetic cinnamic acid derivatives towards tyrosinase enzyme.
Indo J Chem 9:158-168.
Jose J, Rajalakshmi R. 2004. Karyomorphometrical analysis and chemical polymorphism in Tagetes erecta
and Tagetes patula. Philippine J Sci.133:135-144. Mattjik NA. 2010. Budidaya Bunga dan Tanaman Hias. Bogor: IPB Pr.
Miyazawa M, Tamura N. 2007. Inhibitory compound of tyrosinase activity from the sprout of Polygonum hydropiper L. (Benitade). Biol Pharm Bull 30:595-597. Montgomery R, Conway TW, Spector AA.
1993. Biokimia Berorientasi pada Kasus-Klinik. Staf Pengajar FKUI, penerjemah; Jakarta: Binarupa Aksara. Terjemahan dari: Biochemistry: A Case-Oriented Approarch.
Nakatsu T, Lupo AT, Chinn JW, Kang RK. 2000. Biological activity of essential oils and their constituents. Studies Nat Prod Chem 21:571-631.
Nohong. 2009. Skrining fitokimia
Ophiopogon jaburan Lodd dari Kabupaten Kolaka Provinsi Sulawesi Tenggara. J Pembelajaran Sains 5:172-178.
Pavia DL, Lampman GM, Kriz GS. 2001.
Introduction of Spectroscopy: a Guide for Student of Organic Chemistry. Ed ke-2. Philadelphia: Saunders Coll.
Romagnoli C, Bruni R, Andreotti E, Rai MK, Vicentini CB, Mares D. 2005. Chemical characterization and antifungal activity of essential oil of capitula from wild Indian
Tagetes patula L. Protoplasma 225:57-65.
Sukarman, Chumaidi. 2010. Bunga tai kotok (Tagetas sp.) sebagai sumber karotenoid pada ikan hias. Di dalam: Perkembangan Teknologi Pertanian. Prosiding Forum Inovasi Teknologi Akuakultur; Yoyakarta, 25 Apr 2010. Yogyakarta: Perhimpunan Teknologi Indonesia. hlm 803-807. Sulaiman, Suparto, Eviati. 2005. Petunjuk
Teknis Analisis Kimia Tanah, Tanaman, Air, dan Pupuk. Bogor: Balai Penelitian Tanah.
Winarno FG. 1992. Kimia Pangan dan Gizi.
- Diidentifikasi (determinasi) - Dipisahkan
Pengeringan dan pembuatan serbuk
Lampiran 1 Prosedur penelitian
a
Preparasi sampel
Famili Asteraceae
Bunga
Serbuk bunga
Daun
Serbuk Daun
Penentuan kadar air
Maserasi dengan n-heksana
Maserasi dengan etil asetat
Maserasi dengan metanol
-Uji aktivitas inhibitor tirosinase
Didistilasi
b.
Ekstraksi, distilasi, dan uji aktivitas awal sampel (lanjutan)
Serbuk bunga
Serbuk daun
Ekstrak
n
-heksana
bunga dan daun
Ampas
Ekstrak etil asetat
bunga dan daun
Ampas
Ekstrak metanol
bunga dan daun
Ampas
Ekstrak teraktif
inhibitor tirosinase
Bunga
Daun
Minyak
atsiri bunga
Minyak atsiri teraktif
inhibitor tirosinase
Minyak
atsiri daun
Identifikasi GC-MS
-
Uji fitokimia- Penentuan eluen terbaik - Fraksionasi dengan KLTP
Uji aktivitas
- Uji kualitatif fitokimia
- Identifikasi dengan spektrofotometer IR
c. Fraksionasi ekstrak teraktif inhibitor tirosinase (lanjutan)
Ekstrak teraktif
inhibitor tirosinase
Fraksi hasil KLT
preparatif
Fraksi KLTP teraktif
Lampiran 2 Identifikasi sampel famili Asteraceae
Lampiran 3 Kadar air serbuk daun dan bunga
D. rosea
Cav
Sampel Ulangan
Bobot (g) Kadar air (%b/b) Rerata kadar air (%b/b) SD Cawan kosong Contoh awal Cawan+contoh kering Contoh kering
Daun 1 1.9154 3.0109 4.6818 2.7664 8.12 8.12 0.01 2 1.9265 3.0225 4.7033 2.7768 8.13
3 1.9531 3.0248 4.7323 2.7792 8.12
Bunga 1 1.9157 3.0245 4.6543 2.7386 9.45 9.51 0.05 2 1.9260 3.0227 4.6612 2.7352 9.51
3 1.9533 3.0810 4.7400 2.7867 9.55
Contoh perhitungan kadar air:
Sampel daun
D. rosea
Cav (ulangan 1)
Bobot kering = (bobot kering bahan + bobot cawan kosong) - (bobot cawan kosong)
= 4.6818 g - 1.9154 g
= 2.7664 g
100
%
bahan
basah
bobot
kering
bobot
-bahan
basah
bobot
air
Kadar
=
100%g 3.0109 g 2.7664 -g 3.0109
= 8.12%
n 3i i
n
x
x
3
%
12
.
8
%
13
.
8
%
12
.
8
8
.
12
%
3 2 1 SD n i i n x x
1
3
12
.
8
12
.
8
12
.
8
13
.
8
12
.
8
12
.
8
=
SD
2 2 2
Lampiran 4 Kadar abu serbuk daun dan bunga
D. rosea
Cav
Sampel Ulangan
Bobot (g) Kadar abu (%b/b) (%b/b) Rerata kadar abu (%b/b) SD Cawan kosong Contoh awal Cawan+contoh kering Contoh kering
Daun 1 25.2091 3.0238 25.5841 0.375 12.4 12.47 0.13 2 28.6702 3.0015 29.0419 0.3717 12.38
3 28.1068 3.0145 28.487 0.3802 12.61
Bunga 1 22.8908 3.0044 23.1133 0.2225 7.41 7.39 0.03 2 27.9965 3.0020 28.2175 0.2210 7.36
3 26.7722 3.0085 26.9951 0.2229 7.41
C
ontoh perhitngan kadar abu:
Sampel daun
D. rosea
Cav (ulangan 1)
Bobot abu
= (bobot cawan + bobot sampel) - (bobot cawan kosong)
= 25.5841 g
–
25.5841 g
= 0.3750 g
%
100
sampel
bobot
abu
bobot
abu
Kadar
%
100
0238
.
3
3750
.
0
%
40
.
12
n 3i i
n
x
x
3
%
61
.
12
%
38
.
12
%
40
.
12
%
47
.
12
3 2Lampiran 5 Rendemen ekstrak daun dan bunga
D. rosea
Cav
Bobot (g)
Faktor koreksi kadar air
Rendemen (%) Rata-rata (%b/b) SD Sampel Ulangan
Sampel
Ekstrak Ekstrak Ekstrak ekstrak
n -Heksana
Etil
asetat Metanol
n -Heksana
Etil
asetat Metanol
n -Heksana
Etil
asetat Metanol
n -heksana
Etil
asetat Metanol Daun 1 10.0028 0.2002 0.1845 1.3371 0.0812 2.18 2.01 14.55 2.12 1.94 13.89 0.01 0.09 1.29
2 10.0087 0.2013 0.1685 1.1410 0.0812 2.19 1.83 12.41 3 10.0105 0.1991 0.1815 1.3539 0.0812 2.16 1.97 14.72
Bunga 1 10.0097 0.1601 0.1601 3.6709 0.0951 1.77 1.77 40.53 1.71 1.71 40.75 0.05 0.06 0.83 2 10.0056 0.1554 0.1554 3.7733 0.0951 1.72 1.72 41.67
3 10.0008 0.1498 0.1498 3.6255 0.0951 1.66 1.66 40.06
Contoh perhitungan rendemen ekstrak
n
-heksana daun
D. rosea
Cav (ulangan 1)
100
%
sampel
bobot
air
kadar
koreksi
faktor
1
kasar
ekstrak
bobot
Rendemen
100
%
g
0028
.
10
)
0812
.
0
1
(
g
2002
.
0
2
.
18
%
n 3i i
n
x
x
3
%
16
.
2
%
19
.
2
%
18
.
2
Lampiran 6 Contoh perhitungan IC
50monofenolase dan difenolase ekstrak etil
asetat bunga
D. rosea
Cav
Kurva inhibisi monofenolase
y
= 12.04 ln
x
+ 14.92
50
= 12.04 ln
x
+ 14.92
ln
x
= (50
–
14.92) / 12.04
x
= 18.42 µg/mL (IC
50monofenolase)
Kurva inhibisi difenolase
y
= 15.14 ln
x
–
48.92
50
= 15.14 ln
x
–
48.92
ln
x
= (50 + 48.92) /15.14
x
= 687.79 µg/mL (IC
50difenolase)
Konsentrasi
Inhibisi (%)
(µg/mL)
monofenolase
difenolase
2000
95.38
67.90
1000
96.31
56.81
500
95.69
52.80
250
92.00
21.65
125
82.31
23.02
62.50
67.08
8.55
Lampiran 7 Kromatogram GC-MS minyak atsiri
T
.
erecta
5 . 0 0 1 0 . 0 0 1 5 . 0 0 2 0 . 0 0 2 5 . 0 0 3 0 . 0 0 3 5 . 0 0 4 0 . 0 0 2 0 0 0 0 0 0
4 0 0 0 0 0 0 6 0 0 0 0 0 0 8 0 0 0 0 0 0 1 e + 0 7 1 . 2 e + 0 7 1 . 4 e + 0 7 1 . 6 e + 0 7 1 . 8 e + 0 7 2 e + 0 7 2 . 2 e + 0 7 2 . 4 e + 0 7 2 . 6 e + 0 7
T i m e - - > A b u n d a n c e
T I C: S A M P E L . D
Lampiran 8 Kromatogram eluen terbaik