BUDIDAYA DAN KEDELAI LIAR
HASEP SODIKIN
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
askorbat akibat cekaman kekeringan dan herbisida paraquat pada kedelai budidaya dan kedelai liar. Dibimbing oleh HAMIM dan TRIADIATI.
Untuk mengetahui mekanisme pertahanan terhadap peningkatan senyawa oksidatif pada kedelai budidaya (Tidar, Burangrang dan Panderman) dan kedelai liar akibat cekaman kekeringan dan paraquat maka dilakukan pengamatan terhadap perubahan aktivitas enzim superoksida dismutase (SOD), askorbat peroksidase (APX) dan akumulasi antioksidan asam askorbat (ASA).
Tanaman disiram setiap hari dan dihentikan pada umur tanaman 30 hari setelah tanam (HST) (kedelai budidaya dan jagung) dan 40 HST (kedelai liar). Untuk perlakuan kontrol dan paraquat penyiraman tetap dilakukan hingga panen, sedangkan tanaman yang diberi perlakuan cekaman kekeringan dibiarkan selama 10 hari (kedelai budidaya dan jagung) dan 20 hari (kedelai liar). Perlakuan paraquat dilakukan dengan cara menyemprot paraquat (dosis 90 g active ingredient
(ai/ha)) sebanyak satu kali. Pengaruh perlakuan terhadap perubahan aktivitas enzim dan akumulasi antioksidan diuji dengan menggunakan uji t-student.
Perlakuan kekeringan menurunkan Kadar Air Media (KAM) dan Kadar Air Relatif (KAR). Kekeringan juga mampu menurunkan tinggi tajuk namun tidak menunjukkan pengaruh yang nyata terhadap panjang akar. Selain itu, kekeringan dapat mengakibatkan penurunan bobot kering total tanaman, bobot dan jumlah biji per tanaman. Perlakuan paraquat dapat menurunkan KAR namun tidak berpengaruh terhadap tinggi tajuk, panjang akar maupun bobot kering total tanaman. Pada cekaman kekeringan peningkatan aktivitas SOD kurang responsif dibandingkan APX. Berbeda dengan cekaman kekeringan, perlakuan paraquat meningkatkan aktivitas enzim SOD dan APX lebih besar. Peningkatan akumulasi ASA akibat cekaman kekeringan jauh lebih besar dibandingkan cekaman paraquat
ABSTRACT
HASEP SODIKIN. Activities of superoxide dismutase, ascorbate peroxidase and accumulation of ascorbic acid affected by drought and paraquat herbicide on cultivated and wild soybean. Supervised by HAMIM and TRIADIATI.
In order to obtain knowledge about defense mechanisms towards the increase of oxidative substance in cultivated soybeans (Tidar, Burangrang, and Panderman) and wild soybeans affected by drought stress and paraquat application, observations were made to the change in the activities of superoxide dismutase (SOD), ascorbate peroxidase (APX), and the accumulation of ascorbic acid antioxidant (ASA).
Plants were watered every day until 30 days after planting (DAP) (cultivated soybean and corn) and 40 DAP (wild soybean). Control and paraquat treatment watering is continued until harvest time, while plants with drought stress treatment were left without watering for 10 days (cultivated soybean and corn) and 20 days (wild soybean). Paraquat treatment was done by spraying paraquat (dosage of 90 g active ingredient (ai/ha)) for one time. Treatments effecting the changes in enzymes activities and antioxidant accumulation were analyzed using the t-student test.
BUDIDAYA DAN KEDELAI LIAR
HASEP SODIKIN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Asam Askorbat Akibat Cekaman Kekeringan dan Herbisida Paraquat
pada Kedelai Budidaya dan Kedelai Liar
Nama : Hasep Sodikin
NIM
: G34103038
Menyetujui :
Pembimbing I,
Pembimbing II,
Dr. Ir. Hamim, M.Si
Dr. Triadiati, M.Si
NIP 19650322 199002 1 001
NIP 19600224 198603 2 001
Mengetahui :
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Drh. Hasim, DEA
NIP 19610328 198601 1 002
dari tiga bersaudara dari Bapak Haerudin dan Ibu Saodah. Pada tahun 2003 penulis lulus dari SMU Negeri 30 Jakarta dan diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB) melalui Undangan Seleksi Masuk IPB.
Selama mengikuti perkuliahan, penulis pernah mendapatkan beasiswa Student Equity/DIKTI (periode 2003-2008). Selain itu, penulis juga aktif di beberapa organisasi kemahasiswaan seperti, anggota Wahana Muslim Himabio (WMH) pada tahun 2004/2005 dan ketua divisi Syiar dan Kajian Islam WMH pada tahun 2005/2006, anggota Paguyuban Mahasiswa Biologi (Pamabi) pada tahun 2005/2006 dan ketua Badan Pengawas Himpro Himabio pada tahun 2005/2006.
penulis dapat menyelesaikan karya ilmiah ini. Penelitian yang berjudul Aktivitas Superoksida Dismutase, Askorbat Peroksidase dan Akumulasi Asam Askorbat Akibat Cekaman Kekeringan dan Herbisida Paraquat pada Kedelai Budidaya dan Kedelai Liar ini dilaksanakan sejak bulan Februari 2007 hingga Februari 2008 di rumah kaca kampus IPB Baranangsiang, Laboratorium Fisiologi Tumbuhan dan Laboratorium Terpadu, Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Dr. Ir. Hamim, M.Si. dan Dr. Triadiati, M.Si. selaku dosen pembimbing yang telah memberikan saran dan bimbingannya dalam pelaksanaan penelitian dan penyusunan karya ilmiah ini. Terima kasih penulis sampaikan kepada Dr. Anja Meryandini, M.S. selaku dosen penguji yang telah memberikan saran dan kritik untuk perbaikan skripsi ini. Ucapan terima kasih penulis sampaikan juga kepada Pa Hind, Irfan, Yusi, Mba Vil, Eki, Sari, Arip, Dendi, Iwan, Bu Hilda dan Dania atas bantuan dan semangat yang telah diberikan selama penelitian ini. Penghargaan terbesar penulis berikan kepada Mimih, Bapak, a Azis, a Uus dan Yulia atas segala do’a, kasih sayang serta dukungan baik material maupun moral yang telah diberikan kepada penulis selama ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2009
DAFTAR TABEL ...vi
DAFTAR GAMBAR ...vi
DAFTAR LAMPIRAN ...vi
PENDAHULUAN ... 1
BAHAN DAN METODE ... 1
Bahan... 2
Rancangan Penelitian ... 2
Metode... 2
HASIL ... 3
Kadar Air Media (KAM) ... 3
Kadar Air Relatif Pada Daun (KAR) ... 4
Respon Umum Pertumbuhan ... 4
Aktivitas Enzim Superoksida dismutase (SOD) ... 6
Aktivitas Enzim Askorbat peroksidase (APX) ... 6
Kandungan Asam Askorbat (ASA) ... 7
PEMBAHASAN ... 10
SIMPULAN ... 12
SARAN ... 12
1 Nilai rata-rata KAM (%) perlakuan cekaman kekeringan selama 10 hari
(kedelai budidaya dan jagung) dan 20 hari (kedelai liar) ... 4
2 Kadar air relatif (%) tanaman kedelai dan jagung yang diberi perlakuan
cekaman kekeringan selama 10 hari (kedelai budidaya dan jagung) dan 20 hari
(kedelai liar) ... 4
3 Kadar air relatif (%) tanaman kedelai dan jagung pada perlakuan herbisida
paraquat selama 5 hari ... 4
4 Bobot biji per tanaman dan jumlah biji pada perlakuan cekaman kekeringan. .. 6
DAFTAR GAMBAR
Halaman
1 Skema penghambatan transpor elektron fotosintesis oleh herbisida paraquat
(Taiz & Zeiger 2002). ... 1
2 Tinggi tajuk tanaman kedelai dan jagung pada perlakuan kekeringan. ... 5
3 Tinggi tajuk tanaman kedelai dan jagung pada perlakuan paraquat. ... 5
4 Panjang akar tanaman kedelai dan jagung pada perlakuan kekeringan ... 5
5 Panjang akar tanaman kedelai dan jagung pada perlakuan paraquat. ... 5
6 Bobot kering total tanaman kedelai dan jagung pada perlakuan kekeringan. ... 5
7 Bobot kering total tanaman kedelai dan jagung pada perlakuan paraquat. ... 5
8 Nisbah akar-tajuk tanaman kedelai dan jagung pada perlakuan kekeringan. ... 6
9 Nisbah akar-tajuk tanaman kedelai dan jagung pada perlakuan paraquat. ... 6
10 Aktivitas SOD pada perlakuan cekaman kekeringan 10 hari (kedelai budidaya
dan jagung) dan 20 hari (kedelai liar). Tanda panah menunjukkan saat
tanaman disiram kembali. ... 7
11 Aktivitas SOD pada perlakuan paraquat selama 5 hari. ... 7
12 Aktivitas APX pada perlakuan cekaman kekeringan 10 hari (kedelai budidaya
dan jagung) dan 20 hari (kedelai liar). Tanda panah menunjukkan saat
tanaman disiram kembali. ... 8
13 Aktivitas APX pada perlakuan paraquat selama 5 hari ... 8
14 Kandungan ASA pada perlakuan cekaman kekeringan 10 hari (kedelai
budidaya dan jagung) dan 20 hari (kedelai liar). Tanda panah menunjukkan
saat tanaman disiram kembali. ... 9
15 Kandungan ASA pada perlakuan paraquat selama 5 hari ... 9
DAFTAR LAMPIRAN
Halaman
1 Rumus menghitung nilai KAM ... 15
2 Rumus menghitung nilai KAR ... 15
3 Daftar perhitungan aktivitas enzim antioksidan dan kandungan antioksidan ... 15
Kekeringan merupakan kondisi alamiah yang dihadapi tanaman dalam siklus hidupnya. Kondisi kekeringan merupakan salah satu faktor yang dapat menekan per-tumbuhan dan perkembangan tanaman di seluruh dunia (Schwanz & Polle 2001).
Pada tumbuhan, gejala pertama yang disebabkan oleh cekaman kekeringan ialah penurunan potensial air kemudian diikuti oleh penutupan stomata (Chaves 1991; Brodribb & Holbrook 2003) sehingga menyebabkan pengambilan CO2 untuk fotosintesis ter-hambat yang pada akhirnya menurunkan laju fotosintesis (Lawlor 2002; Neumann 2008). Apabila kekeringan berlanjut maka akan menyebabkan pertumbuhan fase generatif terganggu, terjadinya senesense dan bahkan kematian (Neumann 2008).
Selain itu, cekaman kekeringan mungkin juga dapat menginduksi cekaman oksidatif (Borsani et al. 2001; Iturbe-Ormaetxe et al
1998). Cekaman oksidatif merupakan suatu kondisi saat lingkungan seluler mengalami peningkatan produksi Reactive Oxygen Species (ROS) akibat over-reduksi dari sistem cahaya fotosintesis karena senyawa reduktan yang tidak termanfaatkan akibat terhambatnya CO2 selama cekaman kekeringan, cekaman suhu, intensitas cahaya yang tinggi dan polusi (Borsani et al. 2001). Cekaman oksidatif akan menyebabkan kerusakan sel pada tanaman. Selain disebabkan oleh cekaman kekeringan, pembentukan senyawa oksidatif dapat di-induksi oleh pemberian herbisida (McKersie & Leshem 1994).
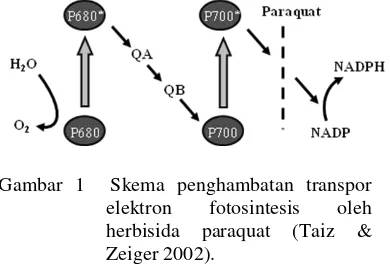
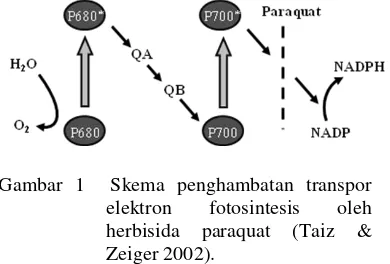
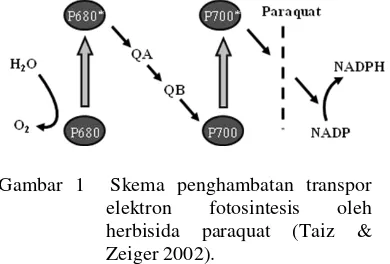
Paraquat merupakan salah satu herbisida yang penggunaannya begitu luas. Paraquat merupakan herbisida kontak non selektif yang diaplikasi ke daun. Penggunaan her-bisida paraquat akan mempengaruhi proses fotosintesis, yaitu menyebabkan aliran elektron ke NADP+ pada sistem cahaya I (PSI) terhenti. Paraquat bertindak sebagai penerima elektron kemudian mereaksikannya dengan oksigen membentuk superoksida (O2¯ ) yang dapat merusak komponen lipid dan membran kloroplas (Gambar 1) (Taiz & Zeiger 2002).
Beberapa tanaman toleran paraquat memiliki mekanisme pertahanan untuk mencegah kerusakan yang terjadi akibat paraquat, yaitu mereduksi pergerakan paraquat di daun, eksklusi herbisida dari dalam sel dan menghambat translokasi paraquat ke jaringan daun muda (Fuerst et al.
oksigen aktif yang terbentuk secara enzimatis (Fuerst & Vaughn 1990).
Gambar 1 Skema penghambatan transpor elektron fotosintesis oleh herbisida paraquat (Taiz & Zeiger 2002).
Tumbuhan memiliki mekanisme pertahan-an terhadap peningkatpertahan-an senyawa-senyawa oksidatif yang terbentuk akibat cekaman kekeringan dan aplikasi paraquat. Pembentuk-an senyawa Pembentuk-antioksidPembentuk-an, seperti askorbat (ASA), -tokoferol dan glutation, merupakan salah satu sistem pertahanan tanaman tersebut. Selain itu, peningkatan karotenoid (Munné-Bosch et al. 1999) dan aktivitas enzim antioksidan, seperti enzim superoksida dismutase (SOD), askorbat peroksidase (APX) (Prohazkova et al 2001), glutation reduktase (GR) (Keleş & Öncel 2002) juga bisa terjadi jika senyawa-senyawa oksidatif terbentuk. Oleh karena itu perlu dilakukan penelitian yang berhubungan dengan dampak cekaman kekeringan dan paraquat terhadap perubahan aktivitas enzim-enzim seperti SOD, APX dan ASA khususnya pada tanaman budidaya masih diperlukan.
Tujuan
Penelitian ini bertujuan mengetahui aktivitas APX, SOD dan kandungan ASA pada kedelai budidaya dan kedelai liar yang diberi perlakuan cekaman kekeringan dan herbisida paraquat.
BAHAN DAN METODE
Waktu dan Tempat
Bahan
Bahan tanaman yang digunakan ialah biji kedelai yaitu varietas Burangrang, Panderman, Tidar dari Balai Penelitian Tanaman Kacang-Kacangan dan Ubi-Ubian (Balitkabi) Malang, kedelai liar yang diperoleh dari Pusat Penelitian Sumber Daya Hayati dan Bioteknologi Tumbuhan IPB dan jagung hibrida (sebagai pembanding tanaman C4) yang diperoleh dari toko komersil. Bahan media tanam ialah tanah jenis latosol dan pasir dengan perbandingan 1:1 (v/v). Selain itu juga digunakan bahan-bahan untuk analisis ASA, APX, SOD dan herbisida paraquat dengan merek dagang Gramoxon 276 g l-1.
Rancangan Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap faktorial (RAL faktorial) yang terdiri atas 2 faktor dengan 3 ulangan. Faktor pertama adalah jenis tanaman yang terdiri atas 1 kedelai liar, 1 jagung dan 3 kedelai budidaya, yaitu varietas Burangrang, Panderman dan Tidar. Faktor yang kedua terdiri atas perlakuan kekeringan dan paraquat, serta tanpa perlakuan sebagai kontrol. Analisis data secara statistik dilakukan menggunakan analisis Independent-Simple T Test.
Metode
Persiapan Media Tanam
Tanah latosol dari daerah Sindangbarang Bogor dikering-anginkan selama 2 minggu
.
Kemudian tanah dihaluskan dan disaring (ukuran 1x1 cm) agar diperoleh ukuran yang seragam. Tanah hasil saringan dicampur dengan pasir (1:1) hingga homogen, kemudian dimasukkan ke dalam polybag ukuran 35 x 35 cm sebanyak 8 kg dan diberi air hingga jenuh untuk mengetahui kapasitas lapangnya.Penanaman dan Pemeliharaan Tanaman
Penanaman dilakukan setelah tanah dijenuhkan dengan air satu hari sebelumnya. Setiap polybag ditanam benih sebanyak 4 biji. Pada umur tanaman 7 hari setelah tanam (HST) dibuat penjarangan menjadi 2 tanaman per polybag.
Pemeliharaan meliputi pemberian pupuk dan penyiraman tanaman. Pemberian pupuk dilakukan sebanyak dua kali, yaitu sebelum penanaman dan sebelum perlakuan. Pupuk yang diberikan ialah NPK dengan dosis sebanyak 1,67 g dan TSP dengan dosis 1,12 g per polybag. Pupuk diletakkan di bagian
tengah polybag dengan kedalaman 3-5 cm kemudian ditutup kembali dengan tanah. Penyiraman tanaman dilakukan setiap hari dan dihentikan pada umur tanaman 30 HST (varietas Tidar, Burangrang, Panderman dan jagung) dan 40 HST (kedelai liar). Pada umur tersebut perlakuan kekeringan diberikan. Setelah perlakuan usai, tanaman disiram kembali seperti sediakala. Pemeliharaan tanaman yang dilakukan juga meliputi penyiangan gulma.
Perlakuan Cekaman Kekeringan dan Paraquat
Perlakuan kekeringan dilakukan dengan cara menunda penyiraman pada umur tanaman 30 HST selama 10 hari hingga tanaman layu kemudian diamati pada hari ke-4, 8, 10 dan 12. Untuk kedelai liar perlakuan kekeringan diberikan pada umur tanaman 40 HST (agar diperoleh ukuran daun yang relatif sama dengan kedelai budidaya) selama 20 hari hingga tanaman layu kemudian diamati pada hari ke-4, 8, 10, 18, 20 dan 22. Setelah perlakuan usai, yaitu hari ke-12 (varietas Tidar, Burangrang, Panderman dan jagung) tanaman kembali diberi air (rewatering) untuk melihat kemampuan recovery. Pada kedelai liar rewatering dilakukan pada hari ke-22.
Perlakuan paraquat dilakukan dengan cara menyemprot paraquat (dosis 90 g active ingredient (ai/ha) sebanyak satu kali pada umur tanaman 30 HST (varietas Tidar, Burangrang, Panderman dan jagung) dan 40 HST (kedelai liar), kemudian diamati sebanyak 4 kali, yaitu 4 jam setelah perlakuan (JSP), 1, 3 dan 5 hari setelah perlakuan (HSP).
Pengukuran Kadar Air Media
Kadar air media (KAM) ditentukan dengan cara mengambil tiga bagian (atas, tengah, bawah) media tanam. Tanah yang telah diambil kemudian ditimbang dengan meng-gunakan timbangan digital untuk mengetahui bobot basah (BB) tanah. Kemudian tanah dikeringkan di oven pada suhu 80oC selama tiga hari lalu ditimbang untuk mengetahui bobot kering (BK) tanah. Perhitungan nilai KAM berdasarkan rumus sebagaimana ter-lampir pada Lampiran 1.
Pengukuran Kadar Air Relatif Pada Daun
kemudian dilakukan hidrasi selama 24 jam di botol kecil. Setelah 24 jam dilakukan penimbangan untuk mengetahui bobot jenuh (BJ). Untuk mengetahui bobot kering (BK) maka potongan daun tersebut dikeringkan di oven pada suhu 80oC selama 24 jam. Perhitungan nilai KAR berdasarkan rumus sebagaimana terlampir pada Lampiran 2.
Pengamatan Pertumbuhan dan Produksi
Parameter pertumbuhan yang diamati meliputi tinggi tajuk (cm), panjang akar (cm), bobot tajuk (g) dan bobot akar (g).
Parameter produksi meliputi jumlah biji dan bobot biji (g).
Tinggi Tajuk dan Panjang Akar
Tinggi tanaman diukur mulai dari per-mukaan tanah hingga titik tumbuh (pucuk) untuk tanaman kedelai, sedangkan untuk tanaman jagung pengukuran tinggi tanaman hingga bagian ujung daun.
Panjang akar diukur mulai dari bagian pangkal akar hingga ujung akar.
Pengamatan tinggi tanaman dan panjang akar dilakukan pada saat panen atau 8 minggu setelah tanam (MST).
Bobot Tajuk dan Bobot Akar
Bobot basah tajuk dan akar ditimbang pada saat panen (8 MST). Bagian tajuk tanaman dipisahkan dari akarnya. Kemudian masing-masing bagian ditimbang untuk mendapatkan BB tajuk dan akar tanaman. Tajuk dan akar dibungkus dengan menggunakan kertas buram kemudian dikeringkan dengan oven pada suhu 80oC selama 36 jam. Kemudian ditimbang untuk mengetahui BK.
Jumlah dan Bobot Biji
Jumlah dan bobot biji pertanaman diukur pada saat panen (8 MST). Biji yang diperoleh dikeringkan dengan dijemur selama 1 minggu. Kemudian dilakukan penimbangan.
Analisis Superoksida dismutase (SOD)
Aktivitas SOD dianalisis berdasarkan metode yang dikembangkan oleh Giannopolitis dan Ries (1977) yang telah dimodifikasi. Sampel daun (0,2 g) digerus dengan larutan yang mengandung 50 mM buffer fosfat pH 7, 1% PVP, 0,2 mM asam askorbat. Hasil gerusan disentrifugasi pada kecepatan 3000 rpm selama 30 menit sehingga diperoleh supernatan.
Supernatan yang diperoleh dimasukkan ke dalam kuvet berisi larutan yang mengandung: 50 mM buffer fosfat (pH 7,8), EDTA 0,1 mM
dan riboflavin 0,3 mM. Kemudian diinkubasi selama 5 menit pada suhu kamar lalu ditambahkan nitroblue tetrazolium (NBT) 0,03 mM. Setelah penambahan NBT, larutan tersebut diberi cahaya lampu (55W, 20 cm di atas larutan) selama 30 detik dalam 2,5 menit lalu dilakukan pengukuran dengan spektro-fotometer pada panjang gelombang 560 nm. Larutan tanpa ekstrak daun digunakan sebagai kontrol. Aktivitas enzim dinyatakan dalam unit mg-1 protein. Perhitungan SOD berdasar-kan rumus sebagaimana terlampir pada Lampiran 3.
Kandungan protein diukur dengan meng-gunakan bovine serum albumin sebagai standar berdasarkan metode Bradford (1976).
Analisis Askorbat peroksidase (APX)
Aktivitas APX dianalisis berdasarkan metode Nakano dan Asada (1981). Ekstrak enzim dicampur dengan larutan yang mengandung 50 mM buffer fosfat pH 7, asam askorbat 0,5 mM, EDTA 0,1 mM dan H2O2 0,1 mM. Larutan tanpa sampel dan H2O2 0,1 mM digunakan sebagai blangko.
Pengukuran aktivitas APX dilakukan dengan spektrofotometer setiap 10 detik selama 1 menit pada panjang gelombang 290 nm. Perhitungan APX berdasarkan rumus sebagaiman terlampir pada Lampiran 3.
Analisis Asam Askorbat (ASA)
Kandungan ASA dianalisis berdasarkan metode yang dikembangkan Reiss (1993) yang telah dimodifikasi. Kandungan ASA diukur dengan menggunakan metode titrasi. Sampel daun (0,5 g) digerus dengan asam metafosforik 5% kemudian difiltrasi dengan menggunakan kertas saring Whatman no 1.
Filtrat yang diperoleh kemudian dititrasi dengan dichlorophenol-indophenol (DCIP) 0,8 g/l. Larutan DCIP yang digunakan untuk titrasi distandarisasi dengan larutan ASA murni dengan cara titrasi. Sebanyak 1 ml larutan ASA murni (4 mg/l) dan 9 ml asam metafosforik 5%. Titrasi dihentikan ketika terjadi perubahan warna menjadi merah muda. Kandungan ASA dihitung berdasarkan rumus sebagaimana terlampir pada Lampiran 3.
HASIL
Kadar Air Media (KAM)
Tabel 1 Nilai rata-rata KAM (%) perlakuan cekaman kekeringan selama 10 hari (kedelai budidaya dan jagung) dan 20 hari (kedelai liar)
Kadar Air Relatif Pada Daun (KAR)
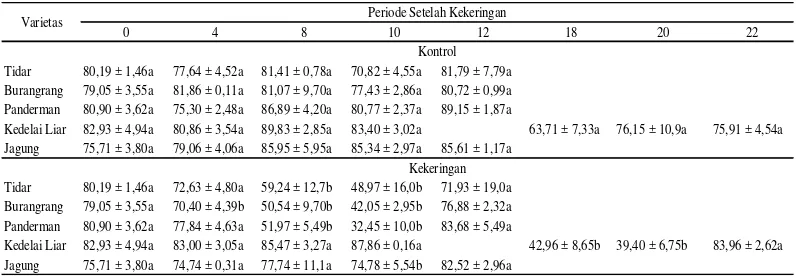
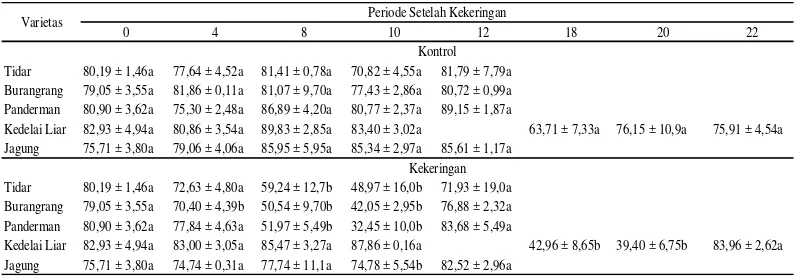
Cekaman kekeringan dapat mengakibat-kan penurunan nilai KAR mulai dari 30% hingga lebih dari 50% kecuali pada jagung yaitu sebesar 12%. Penurunan nilai KAR tertinggi terjadi pada hari ke-10 untuk semua tanaman kecuali pada kedelai liar yang terjadi pada hari ke-20. Penurunan nilai KAR tertinggi terdapat pada varietas Panderman yaitu 59%, sedangkan penurunan nilai KAR
Tabel 2 Kadar air relatif (%) tanaman kedelai dan jagung yang diberi perlakuan cekaman kekeringan selama 10 hari (kedelai budidaya dan jagung) dan 20 hari (kedelai liar)
Tabel 3 Kadar air relatif (%) tanaman kedelai
dan jagung pada perlakuan
herbisida paraquat selama 5 hari
terkecil terjadi pada jagung yaitu 12% namun tidak berbeda nyata dengan kontrol (Tabel 2).
Perlakuan herbisida paraquat juga me-nurunkan nilai KAR. Secara umum penurun-an nilai KAR mulai dari 20 hingga lebih dari 75%. Penurunan nilai KAR tertinggi terjadi pada jagung yaitu 76% pada hari ke-3 setelah aplikasi paraquat, sedangkan penurunan nilai KAR terkecil terjadi pada varietas Tidar yaitu 20% pada 4 jam setelah aplikasi paraquat (Tabel 3).
Respon Umum Pertumbuhan
Tinggi Tajuk dan Panjang Akar
Secara umum, cekaman kekeringan mengakibatkan penurunan tinggi tajuk. Penurunan tinggi tajuk terbesar pada cekaman kekeringan terjadi pada varietas Tidar yaitu 41%, sedangkan penurunan tinggi tajuk terkecil terjadi pada kedelai liar yaitu 4%. Penurunan tinggi tajuk kedelai liar dan varietas Panderman tidak berbeda nyata dengan kontrol (Gambar 2).
kontrol kering Tidar 22,86 ± 4,44a 14,12 ± 2,72b Burangrang 17,48 ± 1,60a 12,58 ± 1,81b Panderman 20,86 ± 5,09a 13,03 ± 2,13b Kedelai Liar 22,13 ± 5,04a 14.35 ± 3,29b Jagung 23,29 ± 1,43a 13,96 ± 3,24b
Varietas KAM (%)
Tabel 1 Nilai rata-rata KAM (%) perlakuan cekaman kekeringan selama 10 hari (kedelai budidaya dan jagung) dan 20 hari (kedelai liar)
Ket: - Data menunjukkan nilai rata-rata ± standar deviasi -Angka yang diikuti huruf yang sama pada baris yang
sama tidak berbeda nyata secara T-Test.
0 4 8 10 12 18 20 22
Tidar 80,19 ± 1,46a 77,64 ± 4,52a 81,41 ± 0,78a 70,82 ± 4,55a 81,79 ± 7,79a
Burangrang 79,05 ± 3,55a 81,86 ± 0,11a 81,07 ± 9,70a 77,43 ± 2,86a 80,72 ± 0,99a
Panderman 80,90 ± 3,62a 75,30 ± 2,48a 86,89 ± 4,20a 80,77 ± 2,37a 89,15 ± 1,87a
Kedelai Liar 82,93 ± 4,94a 80,86 ± 3,54a 89,83 ± 2,85a 83,40 ± 3,02a 63,71 ± 7,33a 76,15 ± 10,9a 75,91 ± 4,54a
Jagung 75,71 ± 3,80a 79,06 ± 4,06a 85,95 ± 5,95a 85,34 ± 2,97a 85,61 ± 1,17a
Tidar 80,19 ± 1,46a 72,63 ± 4,80a 59,24 ± 12,7b 48,97 ± 16,0b 71,93 ± 19,0a
Burangrang 79,05 ± 3,55a 70,40 ± 4,39b 50,54 ± 9,70b 42,05 ± 2,95b 76,88 ± 2,32a
Panderman 80,90 ± 3,62a 77,84 ± 4,63a 51,97 ± 5,49b 32,45 ± 10,0b 83,68 ± 5,49a
Kedelai Liar 82,93 ± 4,94a 83,00 ± 3,05a 85,47 ± 3,27a 87,86 ± 0,16a 42,96 ± 8,65b 39,40 ± 6,75b 83,96 ± 2,62a
Jagung 75,71 ± 3,80a 74,74 ± 0,31a 77,74 ± 11,1a 74,78 ± 5,54b 82,52 ± 2,96a
Varietas Periode Setelah Kekeringan
Kontrol
Kekeringan
Tabel 2 Kadar air relatif (%) tanaman kedelai dan jagung yang diberi perlakuan cekaman kekeringan selama 10 hari (kedelai budidaya dan jagung) dan 20 hari (kedelai liar)
Ket: - Data menunjukkan nilai rata-rata ± standar deviasi
-Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata secara T-Test.
0 4 24 72 120
Tidar 80,19 ± 1,46a 80,19 ± 1,46a 64,82 ± 4,86a 80,17 ± 1,62a 77,97 ± 0,03a
Burangrang 79,05 ± 3,55a 83,74 ± 2,84a 61,49 ± 9,95a 63,27 ± 10,8a 78,30 ± 6,26a
Panderman 80,90 ± 3,62a 80,90 ± 3,62a 77.87 ± 2,90a 71,79 ± 6,32a 75,67 ± 4,53a
Kedelai Liar 82,93 ± 4,94a 85,15 ± 4,39a 77,69 ± 2,33a 80,86 ± 3,54a 82,00 ± 0,55a
Jagung 75,71 ± 3,80a 74,77 ± 3,15a 74,60 ± 4,87a 77,18 ± 4,34a 80,02 ± 1,03a
Tidar 80,19 ± 1,46a 63,62 ± 8,47b 63,37 ± 20,9a 73,19 ± 0,82b 70,69 ± 0,03b
Burangrang 79,05 ± 3,55a 80,82 ± 2,53a 74,10 ± 4,24b 81,81 ± 0,08b 77,46 ± 0,42a
Panderman 80,90 ± 3,62a 68,59 ± 7,21b 37,17 ± 11,7b 61,92 ± 7,98a 74,44 ± 8,47a
Kedelai Liar 82,93 ± 4,94a 74,55 ± 7,02a 22,51 ± 0,05b 79,24 ± 5,62a 69,86 ± 6,10a
Jagung 75,71 ± 3,80a 56,58 ± 23,7a 32,31 ± 8,86b 19,1 ± 16,60b 39,46 ± 30,7b
Varietas Jam Setelah Aplikasi Paraquat
Kontrol
Paraquat
Tabel 3 Kadar air relatif (%) tanaman kedelai dan jagung pada perlakuan herbisida paraquat selama 5 hari
Ket: - Data menunjukkan nilai rata-rata ± standar deviasi
Gambar 2 Tinggi tajuk tanaman kedelai dan jagung pada perlakuan kekeringan.
Pada perlakuan paraquat, penurunan tinggi tajuk terjadi pada semua kedelai budidaya dan kedelai liar. Namun, penurunan tinggi tajuk hanya nyata terjadi pada varietas Tidar yaitu sebesar 16%, sedangkan pada varietas Burangrang, Panderman dan kedelai liar penurunannya tidak nyata dibandingkan dengan kontrol. Hal yang berbeda terjadi pada tanaman jagung. Pada tanaman jagung tidak terjadi perbedaan tinggi tajuk akibat perlakuan paraquat (Gambar 3).
Gambar 3 Tinggi tajuk tanaman kedelai dan jagung pada perlakuan paraquat.
Berdasarkan nilai panjang akar, perlakuan cekaman kekeringan tidak menunjukkan pengaruh yang nyata terhadap nilai panjang akar, meskipun ada kecenderungan penurun-an nilai ppenurun-anjpenurun-ang akar kecuali pada kedelai liar (Gambar 4). Hal sama juga terjadi pada perlakuan paraquat (Gambar 5).
Gambar 4 Panjang akar tanaman kedelai dan jagung pada perlakuan kekeringan
Gambar 5 Panjang akar tanaman kedelai dan jagung pada perlakuan paraquat.
Bobot Kering Total Tanaman dan Nisbah Akar-Tajuk
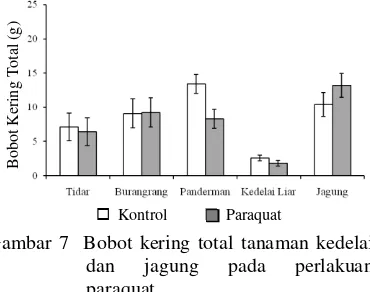
Secara umum cekaman kekeringan menyebabkan penurunan bobot kering total pada semua tanaman yang diuji. Pada varietas Burangrang dan kedelai liar penurunan bobot kering total hingga lebih dari 50% (Gambar 6). Penurunan bobot kering total tersebut baik disebabkan oleh penurunan bobot kering tajuk maupun akar tanaman.
Gambar 6 Bobot kering total tanaman kedelai dan jagung pada perlakuan ke-keringan.
Perlakuan paraquat mengakibatkan pe-nurunan bobot kering total tanaman pada varietas Panderman dan kedelai liar. Penurun-an bobot kering total terbesar terjadi pada varietas Panderman yaitu sebesar 37%. Pada tanaman jagung perlakuan paraquat meng-akibatkan peningkatan bobot kering total tanaman, tetapi peningkatan tersebut tidak berbeda nyata dengan kontrol (Gambar 7).
Gambar 7 Bobot kering total tanaman kedelai
dan jagung pada perlakuan
paraquat.
Gambar 2 Tinggi tajuk tanaman kedelai dan jagung pada perlakuan kekeringan.
Ti n g g i ta ju k ( cm)
Kontrol Kekeringan
Gambar 3 Tinggi tajuk tanaman kedelai dan jagung pada perlakuan paraquat.
Ti n g g i ta ju k ( cm)
Kontrol Paraquat
Gambar 4 Panjang akar tanaman kedelai dan jagung pada perlakuan kekeringan
P an ja n g ak ar ( cm)
Kontrol Kekeringan
Gambar 5 Panjang akar tanaman kedelai dan jagung pada perlakuan paraquat.
P an ja n g ak ar ( cm)
Kontrol Paraquat
Gambar 6 Bobot kering total tanaman kedelai dan jagung pada perlakuan ke-keringan. B o b o t K er in g To ta l (g )
Kontrol Kekeringan
Gambar 7 Bobot kering total tanaman kedelai dan jagung pada perlakuan paraquat. B o b o t K er in g To ta l (g )
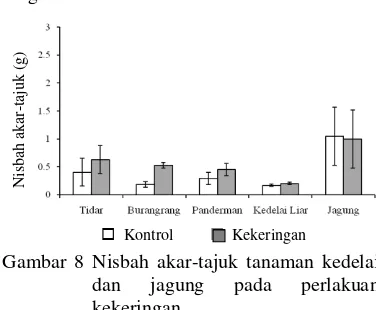
Berdasarkan nilai nisbah akar-tajuk, cekaman kekeringan cenderung meningkatkan nilai nisbah akar-tajuk pada semua varietas kedelai budidaya dan kedelai liar. Peningkatan nilai nisbah akar-tajuk pada varietas Tidar, Panderman, kedelai liar dan jagung tidak menunjukkan pengaruh yang nyata terhadap kontrol, kecuali pada varietas Burangrang (Gambar 8). Meskipun demikian hanya Burangrang yang mengalami peningkatan nisbah akar tajuk secara nyata, sedangkan tanaman lainnya tidak mengalami pe-ningkatan.
Gambar 8 Nisbah akar-tajuk tanaman kedelai dan jagung pada perlakuan kekeringan.
Berbeda dengan cekaman kekeringan, peningkatan nilai nisbah akar-tajuk pada perlakuan paraquat tidak menunjukkan pengaruh yang nyata terhadap kontrol pada semua tanaman yang diuji (Tabel 9).
Gambar 9 Nisbah akar-tajuk tanaman kedelai
dan jagung pada perlakuan
paraquat.
Bobot Biji per Tanaman dan Jumlah Biji
Pada pengamatan produksi hanya diban-dingkan tiga varietas kedelai budidaya saja mengingat bahwa kedelai liar dan jagung memiliki tingkat kematangan umur produksi yang berbeda.
Secara umum cekaman kekeringan menurunkan produksi biji. Penurunan nilai bobot biji terjadi pada semua tanaman yang diuji. Pada kedelai budidaya penurunan nilai bobot biji tertinggi terjadi pada varietas Panderman yaitu 25%, sedangkan penurunan
nilai bobot biji terkecil terjadi pada varietas Tidar yaitu 4%.
Penurunan jumlah biji tertinggi juga terjadi pada varietas Panderman hingga 21%, sedangkan penurunan jumlah biji terkecil terjadi pada varietas Tidar yaitu 1% namun tidak berbeda nyata dengan kontrol (Tabel 4).
Tabel 4 Bobot biji per tanaman dan jumlah
biji pada perlakuan cekaman
kekeringan.
Aktivitas Enzim Superoksida dismutase (SOD)
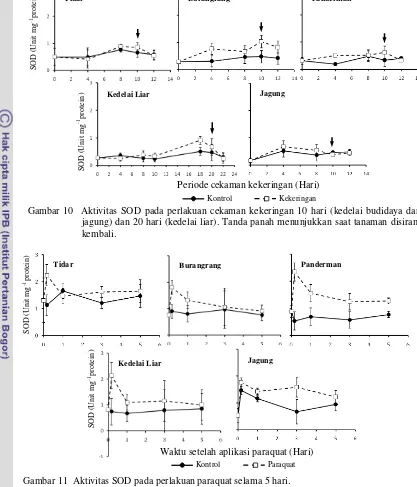
Secara umum cekaman kekeringan mengakibatkan peningkatan aktivitas SOD meskipun tidak terlalu besar jika dibanding-kan dengan perlakuan paraquat. Aktivitas SOD akibat cekaman kekeringan meningkat hingga 1,5 kali kontrol yang terjadi sejak hari ke-4 setelah perlakuan pada varietas Burangrang, sedangkan peningkatan SOD pada varietas Tidar, Panderman dan jagung tidak berbeda nyata dengan kontrol. Peningkatan aktivitas SOD tertinggi terjadi pada hari ke-10 (varietas Burangrang) setelah kekeringan yaitu 1,33 unit mg-1 protein (Gambar 10). Peningkatan aktivitas SOD pada perlakuan paraquat terjadi pada awal per-lakuan yaitu 4 jam setelah aplikasi paraquat. Aktivitas SOD tertinggi terjadi pada varietas Panderman yaitu sebesar 2,33 unit mg-1 protein (Gambar 11).
Aktivitas Enzim Askorbat peroksidase (APX)
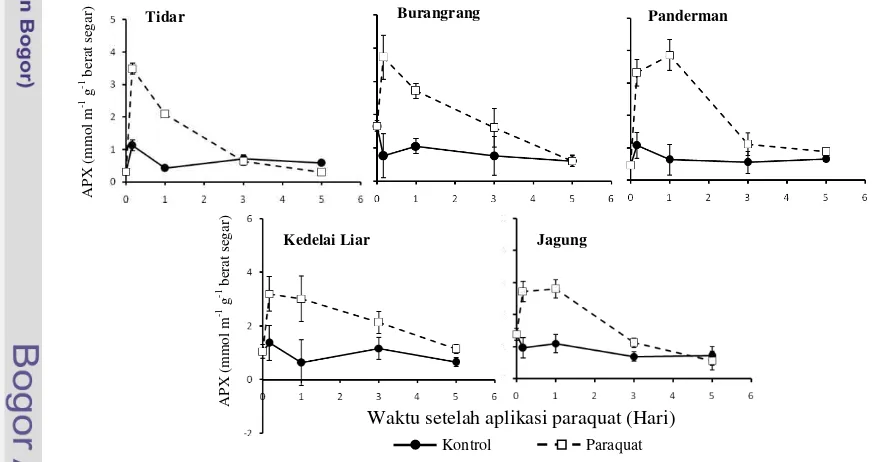
Cekaman kekeringan mengakibatkan peningkatan aktivitas APX. Peningkatan aktivitas APX pada cekaman kekeringan terjadi sejak hari ke-4 (varietas Tidar, Burangrang dan Panderman) dan hari ke-8 (kedelai liar dan jagung) setelah perlakuan. Aktivitas APX tertinggi terjadi pada varietas Panderman yaitu 3,89 mmol m-1 g-1 berat segar (Gambar 12). Pemberian air ( rewater-ing) pada akhir perlakuan dapat menurunkan aktivitas enzim hingga mendekati kontrol (Gambar 12).
Pada perlakuan paraquat, peningkatan APX terjadi pada 4 jam setelah aplikasi paraquat kemudian mengalami penurunan hingga hari ke-5 setelah perlakuan (varietas Gambar 8 Nisbah akar-tajuk tanaman kedelai
dan jagung pada perlakuan kekeringan. N isb ah a k ar -t aj u k ( g )
Kontrol Kekeringan
Gambar 9 Nisbah akar-tajuk tanaman kedelai dan jagung pada perlakuan paraquat. N isb ah a k ar -t aj u k ( g )
Kontrol Paraquat
kontrol kering kontrol kering
Tidar 7,98 ± 1,67a 7,66 ± 2,91a 132 ± 26,68a 131 ± 40,21a
Burangrang 10,69 ± 2,40a 9,41 ± 3,57a 85 ± 12,46a 77 ± 22,67a
Panderman 13,80 ± 3,22a 10,39 ± 3,60a 89 ± 13,55a 69 ± 20,82b
Varietas Bobot biji (gram) Jumlah biji
Tabel 4 Bobot biji per tanaman dan jumlah biji pada perlakuan cekaman kekeringan.
Ket: - Data menunjukkan nilai rata-rata ± standar deviasi -Angka yang diikuti huruf yang sama pada baris
Gambar 10 Aktivitas SOD pada perlakuan cekaman kekeringan 10 hari (kedelai budidaya dan jagung) dan 20 hari (kedelai liar). Tanda panah menunjukkan saat tanaman disiram kembali.
Gambar 11 Aktivitas SOD pada perlakuan paraquat selama 5 hari.
Tidar, Burangrang dan kedelai liar). Pada varietas Panderman dan jagung peningkatan aktivitas APX terjadi hingga hari ke-1 setelah aplikasi kemudian menurun hingga akhir pengamatan. Aktivitas APX tertinggi terjadi pada varietas Panderman yaitu 3,87 mmol m-1 g-1 berat segar (Gambar 13).
Kandungan Asam Askorbat (ASA)
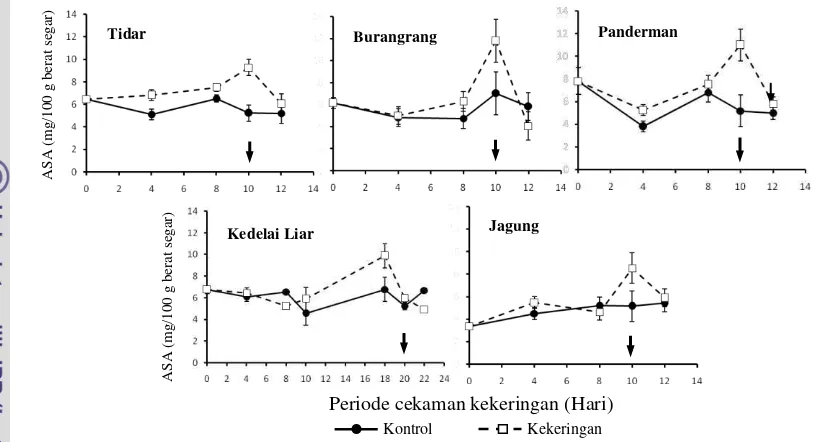
Cekaman kekeringan meningkatkan kan-dungan ASA hingga melebihi 50%. Pening-katan kandungan ASA terjadi sejak hari ke-4 setelah perlakuan pada varietas Tidar (Gambar 14). Nilai kandungan ASA tertinggi terdapat
pada varietas Burangrang yaitu 11,59 mg / 100 g berat segar (Gambar 14).
Perlakuan paraquat juga dapat meng-akibatkan peningkatan kandungan ASA. Rata-rata peningkatan kandungan ASA hingga 42%. Secara umum, peningkatan kandungan ASA terjadi pada 4 jam setelah aplikasi paraquat (Gambar 15). Nilai kandungan ASA tertinggi terdapat pada varietas Burangrang yaitu 13,85 mg / 100 g berat segar.
S
O
D
(
U
n
it
mg
-1
pr
o
te
in
Gambar 2 Kandungan ASA daun kedelai dan jagung pada perlakuan herbisida paraquat. )
Burangrang
Tidar Panderman
S
O
D
(
U
n
it
mg
-1 p
ro
te
in
Gambar 2 Kandungan ASA daun kedelai dan jagung pada perlakuan herbisida paraquat. ) Kedelai Liar Jagung
Gambar 10 Aktivitas SOD pada perlakuan cekaman kekeringan 10 hari (kedelai budidaya dan jagung) dan 20 hari (kedelai liar). Tanda panah menunjukkan saat tanaman disiram kembali.
Periode cekaman kekeringan (Hari) Kontrol Kekeringan
Panderman Tidar
S
O
D
(
U
n
it
mg
-1 p
ro
te
in
Gambar 2 Kandungan ASA daun kedelai dan jagung pada perlakuan herbisida paraquat. )
Burangrang
Gambar 11 Aktivitas SOD pada perlakuan paraquat selama 5 hari. Waktu setelah aplikasi paraquat (Hari)
Kontrol Paraquat Kedelai Liar
S
O
D
(
U
n
it
mg
-1 p
ro
te
in
Gambar 2 Kandungan ASA daun kedelai dan jagung pada perlakuan herbisida paraquat. )
Gambar 12 Aktivitas APX pada perlakuan cekaman kekeringan 10 hari (kedelai budidaya dan jagung) dan 20 hari (kedelai liar). Tanda
panah menunjukkan saat
tanaman disiram kembali.
Gambar 13 Aktivitas APX pada perlakuan paraquat selama 5 hari
A
P
X
(mm
o
l
m
-1 g -1 b
era
t
se
g
ar) Tidar Burangrang Panderman
A
P
X
(mm
o
l
m
-1 g -1 b
era
t
se
g
ar) Kedelai Liar
Jagung
Gambar 12 Aktivitas APX pada perlakuan cekaman kekeringan 10 hari (kedelai budidaya dan jagung) dan 20 hari (kedelai liar). Tanda panah menunjukkan saat tanaman disiram kembali.
Periode cekaman kekeringan (Hari) Kontrol Kekeringan
A
P
X
(mm
o
l
m
-1 g -1 b
era
t
se
g
ar) Tidar Burangrang Panderman
AP
X
(mm
o
l
m
-1 g -1 b
era
t
se
g
ar)
Kedelai Liar Jagung
Gambar 13 Aktivitas APX pada perlakuan paraquat selama 5 hari. Waktu setelah aplikasi paraquat (Hari)
Gambar 14 Kandungan ASA pada perlakuan cekaman kekeringan 10 hari (kedelai budidaya dan jagung) dan 20 hari (kedelai liar). Tanda panah menunjukkan saat tanaman disiram kembali.
Gambar 15 Kandungan ASA pada perlakuan paraquat selama 5 hari
A
S
A
(m
g
/1
0
0
g
b
era
t
se
g
ar
)
Tidar Burangrang Panderman
A
S
A
(m
g
/1
0
0
g
b
era
t
se
g
ar
)
Kedelai Liar Jagung
Gambar 14 Kandungan ASA pada perlakuan cekaman kekeringan 10 hari (kedelai budidaya dan jagung) dan 20 hari (kedelai liar). Tanda panah menunjukkan saat tanaman disiram kembali.
Periode cekaman kekeringan (Hari) Kontrol Kekeringan
A
S
A
(m
g
/1
0
0
g
b
era
t
se
g
ar
)
Jagung Kedelai Liar
A
S
A
(m
g
/1
0
0
g
b
era
t
se
g
ar
) Tidar Burangrang Panderman
Gambar 15 Kandungan ASA pada perlakuan paraquat selama 5 hari. Waktu setelah aplikasi paraquat (Hari)
PEMBAHASAN
Cekaman Kekeringan Menghambat Pertumbuhan dan Produksi Tanaman
Kadar air relatif (KAR) merupakan indikator utama kekeringan. Secara umum cekaman kekeringan dan pemberian herbisida paraquat menurunkan KAR hingga 50% (Tabel 2 dan 3). Perlakuan kekeringan selama 10 hari mengakibatkan penurunan nilai KAR pada varietas Panderman hingga 59%. Sementara itu varietas kedelai toleran (Tidar), hanya mengalami penurunan KAR sebesar 31% pada akhir periode cekaman kekeringan. Hal ini menunjukkan bahwa varietas Panderman mengalami penurunan tekanan turgor yang lebih besar akibat cekaman kekeringan, sedangkan pada tanaman jagung, perlakuan kekeringan selama 10 hari meng-akibatkan penurunan nilai KAR hingga 12% (Tabel 2). Hal ini diduga terkait dengan kemampuan jagung untuk beradaptasi terhadap cekaman kekeringan.
Penurunan KAR karena cekaman ke-keringan mengindikasikan terjadinya penurun-an potensial air di daun akibat penurunpenurun-an kadar air media (KAM) (Tabel 1). Nilai KAM yang rendah menunjukkan potensial air di tanah sangat negatif sehingga air bergerak sangat lambat di dalam tanah. Kondisi ini membuat tanaman tidak mampu menyerap air cukup cepat untuk menyesuaikan diri dengan laju transpirasi, akibatnya tanaman menjadi layu (Salisbury & Ross 1995).
Pada perlakuan paraquat, penurunan nilai KAR terjadi sejak 4 jam setelah aplikasi hingga hari ke-3 setelah aplikasi (Tabel 3). Penurunan nilai KAR karena cekaman paraquat diduga akibat rusaknya membran sel karena meningkatnya oksigen aktif. Smirnoff (1995) menjelaskan bahwa peningkatan oksigen aktif akan menyebabkan kerusakan membran sel karena peningkatan peroksidasi lipid. Kerusakan membran sel akan meng-akibatkan terganggunya potensial air di daun. Cekaman kekeringan mengakibatkan ter-hambatnya pertumbuhan tanaman. Hal ini diduga terkait dengan penutupan stomata yang diikuti berkurangnya asimilasi CO2 sehingga potensial fotosintesis menurun (Chaves 1991; Lawlor 2002). Pada tanaman yang mendapat perlakuan cekaman kekeringan, penghambat-an tajuk lebih besar dibpenghambat-andingkpenghambat-an akar. Tinggi tajuk mengalami penurunan sebesar 4-41% sedangkan akar sebesar 3-17% (Gambar 2 dan 4). Hal yang sama juga dilaporkan Hamim et al. (1996) bahwa perlakuan cekaman ke-keringan menekan pertumbuhan kedelai baik
tajuk maupun akar, dimana penghambatan pertumbuhan tajuk lebih besar daripada penghambatan pertumbuhan akar. Hal ini diperlukan untuk menjaga keseimbangan air dalam tubuh tumbuhan melalui reduksi permukaan daun dan mempertahankan per-kembangan akarnya sehingga mampu me-nyuplai air dengan cukup. Selain itu, penurun-an pertumbuhpenurun-an pada kondisi kekeringpenurun-an disebabkan karena terjadinya penghambatan pemanjangan sel dan sintesis protein (Lambers et al. 1998).
Akibat terganggunya pertumbuhan tanam-an, baik tajuk maupun akar, cekaman ke-keringan juga menyebabkan penurunan bobot kering total tanaman (Gambar 6). Penurunan bobot kering total tanaman terbesar terjadi pada kedelai liar pada hari ke-20 setelah perlakuan sebesar 57% dan penurunan terendah terjadi pada jagung pada hari ke-10 sebesar 5% namun tidak berbeda nyata dengan kontrol (Gambar 6). Meskipun kedelai liar memiliki nilai penurunan bobot kering total yang paling besar, kedelai liar lebih tahan terhadap cekaman dibandingkan varietas Burangrang yang memiliki penurunan bobot kering total sebesar 44% (Gambar 6). Schütz & Fangmeir (2001) melaporkan bahwa cekaman kekeringan pada gandum dapat menurunkan biomassa tajuk sebesar 40%. Penurunan bobot tajuk dan akar diduga karena penurunan laju fotosintesis akibat rendahnya asimilasi CO2 akibat penutupan stomata. Penutupan stomata pada daun merupakan fenomena yang umum pada tanaman yang mendapat cekaman kekeringan, hal ini terkait dengan meningkatnya hormon asam absisat (ABA) sebagai respon cekaman kekeringan. Konsentrasi ABA dapat meningkat hingga 20 kali di daun akibat kekeringan (Salisbury & Ross 1995).
Secara umum nisbah akar-tajuk akibat cekaman kekeringan selama 10 hari me-ngalami peningkatan pada kedelai budidaya hingga lebih dari 50% dan kedelai liar hingga 19% (Gambar 8). Peningkatan nisbah akar-tajuk merupakan respon terhadap cekaman kekeringan. Fusiana (1997) melaporkan bahwa ada korelasi antara toleransi cekaman kekeringan dengan peningkatan nisbah akar-tajuk.
tanaman. Selain itu, kekeringan juga dapat mengganggu pengangkutan fotosintat dari
source ke sink (Salisbury & Ross 1995). Terhambatnya pengangkutan fotosintat dari source ke sink (biji merupakan salah satu
sink) diduga dapat menurunkan bobot biji. Penurunan bobot dan jumlah biji akibat cekaman kekeringan juga dapat disebabkan karena kemampuan akar untuk menyerap hara tereduksi (Lambers et al. 1998) sehingga suplai hara untuk pembentukan biji tidak terpenuhi.
Cekaman Kekeringan dan Paraquat Meningkatkan Aktivitas Enzim SOD
Potensial air yang rendah akibat cekaman kekeringan dapat memicu terjadinya cekaman oksidatif sehingga terbentuk ROS (Borsani et. al 2001). Tanaman memiliki mekanisme pertahanan terhadap peningkatan senyawa-senyawa oksidatif, baik secara enzimatik maupun non-enzimatik (Jiang & Huang 2001).
Hasil pengamatan menunjukkan bahwa terjadi peningkatan aktivitas enzim SOD, baik pada cekaman kekeringan maupun cekaman paraquat (Gambar 10 & 11). Namun, pe-ningkatan aktivitas enzim SOD akibat cekaman kekeringan membutuhkan waktu yang lebih lama dibandingkan paraquat. Peningkatan aktivitas enzim SOD bertambah seiring dengan bertambahnya periode cekaman kekeringan.
Pemberian air pada akhir perlakuan (rewatering) mampu menurunkan aktivitas enzim SOD hingga mendekati kontrol. Menurut Jiang dan Huang (2001) penurunan aktivitas enzim SOD mungkin disebabkan karena telah terjadi penurunan sintesis SOD. Hal ini diduga karena pembentukan ROS di daun telah mengalami penurunan.
Berbeda dengan cekaman kekeringan, peningkatan aktivitas SOD akibat perlakuan paraquat lebih besar dibandingkan cekaman kekeringan (Gambar 10 & 11). Selain itu, peningkatan aktivitas SOD akibat perlakuan paraquat memiliki respon yang lebih cepat dibandingkan cekaman kekeringan. Hal ini karena paraquat merupakan generator radikal bebas yang mampu menerima elektron pada PSI kemudian mereaksikannya dengan oksigen sehingga terbentuk senyawa ROS
(McKersie & Leshem 1994).
Cekaman Kekeringan dan Paraquat Meningkatkan Aktivitas Enzim APX
Superoksida dismutase bukan satu-satunya enzim yang terlibat dalam mengurangi
oksigen radikal yang terbentuk. Kombinasi antara SOD dan APX dapat mengurangi pengaruh cekaman oksidatif yang terbentuk (Gupta et al 1993; Shigeoka et al. 2002). Cekaman kekeringan dan perlakuan paraquat mengakibatkan peningkatan enzim APX.
Peningkatan aktivitas enzim APX pada perlakuan kekeringan meningkat seiring dengan lamanya perlakuan kemudian menurun hingga mendekati kontrol setelah
rewatering (Gambar12). Penurunan aktivitas APX setelah rewatering pada perlakuan cekaman kekeringan diduga karena cekaman oksidatif telah berkurang sehingga aktivitas APX kembali normal.
Peningkatan aktivitas APX seiring dengan peningkatan aktivitas SOD. Hal ini terjadi diduga karena peningkatan aktivitas APX terkait meningkatnya H2O2 akibat aktivitas SOD. Ada kecenderungan bahwa peningkatan aktivitas APX lebih besar dibandingkan peningkatan aktivitas SOD. Hal yang sama juga dilaporkan oleh Shigeoka et al. (2002) yang menyebutkan bahwa terdapat peningkat-an aktivitas APX ypeningkat-ang lebih besar di-bandingkan peningkatan SOD pada tanaman tembakau transgenik yang mengalami over-ekspresi SOD maupun pada kontrol.
Enzim APX menggunakan ASA sebagai penerima elektron untuk mereduksi H2O2 menjadi air dan monodehidroaskorbat (MDHA) (Shigeoka et al. 2002).
Perlakuan paraquat juga meningkatkan aktivitas APX. Peningkatan aktivitas APX akibat perlakuan paraquat jauh lebih besar dibandingkan cekaman kekeringan (Gambar 12 dan 13). Hal ini diduga karena paraquat merupakan herbisida yang berpotensi menambah produksi ROS dan merupakan senyawa yang dapat memicu cekaman oksidatif (Bowler et al. 1994).
Cekaman Kekeringan dan Paraquat Meningkatkan Kandungan ASA
Selain mekanisme pertahanan secara enzimatik, cekaman kekeringan juga meng-induksi akumulasi ASA (Pignocchi et al.
2003).
Pada cekaman kekeringan kandungan ASA mengalami peningkatan seiring bertambahnya periode cekaman (Gambar 14). Iturbe-Ormaetxe et al. (1998) menjelaskan bahwa antioksidan seperti ASA dan glutation mengalami peningkatan di kloroplas pada kondisi kekeringan. Peningkatan ASA pada tanaman berfungsi untuk mereduksi radikal bebas yang terbentuk akibat cekaman oksidatif (Mc Kersie & Leshem 1994). ASA yang disintesis di sitosol akan bereaksi dengan H2O2 sehingga menghasilkan MDHA dan air.
Kandungan ASA juga meningkat akibat perlakuan paraquat. Peningkatan kandungan ASA pada perlakuan paraquat terjadi sejak awal perlakuan (4 jam setelah aplikasi paraquat) (Gambar 15). Namun nilai rata-rata peningkatan ASA pada perlakuan paraquat lebih rendah dibandingkan cekaman ke-keringan.
SIMPULAN
Secara umum cekaman kekeringan dapat menekan pertumbuhan akar lebih besar daripada tajuk sehingga menyebabkan terjadinya peningkatan nisbah akar tajuk. Berdasarkan nilai bobot dan jumlah biji, varietas Tidar relatif lebih tahan terhadap cekaman kekeringan.
Perlakuan cekaman kekeringan juga menyebabkan peningkatan enzim-enzim oksidatif, seperti SOD dan APX, dan kandungan antioksidan askorbat. Terdapat perbedaan waktu peningkatan aktivitas enzim dan akumulasi antioksidan akibat cekaman kekeringan dan paraquat. Pada cekaman kekeringan peningkatan aktivitas enzim dan akumulasi antioksidan terjadi pada saat tanaman mengalami cekaman berat yaitu 10 (kedelai budidaya dan jagung) dan 18 hari setelah kekeringan (kedelai liar), sedangkan pada perlakuan paraquat, peningkatan aktivitas enzim dan akumulasi antioksidan terjadi sejak awal perlakuan (4 jam setelah aplikasi).
SARAN
Perlu dilakukan pengujian enzim-enzim dan antioksidan lainnya yang terlibat akibat
cekaman oksidatif. Selain itu, perlu dilakukan penelitian lebih lanjut secara molekuler untuk mengetahui ekspresi gen pada tanaman yang mengalami cekaman oksidatif .
DAFTAR PUSTAKA
Borsani O, Diaz P, Agius MF, Valpuesta V, Monza J. 2001. Water stress generates an oxidative stress through the induction of a specific Cu/Zn superoxide dismutase in
Lotus corniculatuss leaves. Plant Sci
161:757-763.
Bowler C, Van Camp W, Van Montagu M Inzé D. 1994. Superoxide dismutase in plants. CRC Critical Reviews in Plant Sciences 13:199-218.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of the protein. Anal Biochem 72:248-254. Brodribb TJ, Holbrok NM. 2003. Stomatal
closure during leaf dehydration, correlation with other leaf physiological traits. Plant Physiol 132:2166-2173. Chaves M. 1991. Effect water deficit on
carbon assimilation. J Exp Bot 42:1-6. Fuerst EP, Nakatani HY, Dodge AD, Penner
D, Arnzen CJ. 1985. Paraquat resistance in
Conyza. Plant Physiol 77:984-989. Fuerst EP, Vaughn KC. 1990. Mechanism of
paraquat resistance. J Weed Tech 4:150-156.
Fusiana A. 1997. Studi perakaran dan analisis prolin beberapa galur lokal padi gogo asal kalimantan pada kondisi kekeringan [skripsi]. Bogor: Departemen Biologi, FMIPA IPB.
Giannopolitis CN, Ries SK. 1977. Superoxide dismutase. Plant Physiol 59:309-314. Gupta AS, Webb RP, Holaday S, Allen RD.
1993. Overexpression of superoxide dismutase protects plants from oxidative stress. Plant Physiol 103:1067-1073. Hamim, Soepandi D, Jusuf M. 1996.
Beberapa karakteristik morfologi dan fisiologi kedelai toleran dan peka terhadap cekaman kekeringan. Hayati 3(1):30-34. Iturbe-Ormaetxe I, Escuredo PR, Arrese-Igor
C, Becana M. 1998. Oxidative damage in pea plant exposed to water defisit or paraquat. Plant physiol 132:173-181. Jiang Y, Huang B. 2001. Drought and stress
injury to two cool-season turfgrasses in relation to antioxidant metabolism and lipid peroxidation. Crop Sci 41:436-442. Keleş Y, Öncel I. 2002. Response of
temperature and water stress combination in wheat seedlings. Plant Sci 163:783-790. Lambers H, Chapin FS, Pons TL. 1998. Plant
Physiological Ecology. New York:
Springer-Verlag Inc.
Lawlor DW. 2002. Limitation to photosynthesis in water-stressed leaves: stomata vs metabolism and the role of ATP. Ann Bot 89:871-885.
McKersie DB, Leshem YY 1994. Stress and Stress Coping in Cultivated Plants. Netherlands: Kluwer Academic Publisher. Munné-Bosch S, Schwarz K, alegre L. 1999.
Enhaced formation of α-tokoferol and highlyoxidizedabieten diterpenes in water-stressed rosemary plants. Plant Physiol
121:1061-1068.
Nakano Y, Asada K. 1981. Hydrogen peroxide is scavenged by ascorbate-specific peroxidedase in spinach chloroplast. Plant & Cell Physiol
22(5):867-880.
Neumann PM. 2008. Coping mechanisms for crop plants in drought-prone environ-ments. Ann Bot 101:901-907.
Pignocchi C, Fletcher JM, Wilkinson JE, Barnes JD, Foyer CH. 2003. The Function of Ascorbate Oxidase in Tobacco. Plant Physiol 132:1631–1641.
Preston C, Holtum JAM, Powles SB. 1992. On the mechanisme of resistance to paraquat in Hordeum glaucum and H. leporinum. Plant Physiol 100:630-636.
Prohazkova D, Sairam RK, Srivastava GC, Singh DV. 2001. Oxidative stress and antioxidant activity as the basis of senescence in maize leaves. Plant Sci
161:765-771.
Reiss C. 1993. Experiment in plant physiology: Part I; plant biochemistry, determination of ascorbic acid content of cabbage. p 1-7.
Salisbury FB, Ross CW. 1995. Fisiologi
Tumbuhan. Jilid ke-3. Lukman DR,
Sumaryono, penerjemah; Niksolihin S, editor. Bandung: ITB. Terjemahan dari:
Plant Physiology.
Schütz M, Fangmeir A. 2001. Growth and yield responses of spring wheat (Triticum aestivum L. cv. Minaret) to elevated CO2 and water limitation. Environ Pollut
114:187-194.
Schwanz P, Polle A. 2001. Differential stress responses of antioxidative systems to drought in penduculate oak (Quercus robur) and maritime pine (Pine pinaster) grown under high CO2 concentration. J Exp Bot 52(354):133-143.
Shigeoka S et al. 2002. Regulation and function of ascorbate peroxidase isozymes.
J Exp Bot 53(372):1305-1319.
Smirnoff N. 1995 Antioxidant Systems and Plants Response to Environment. United Kingdom: Bios Scientific.
Taiz L, Zeiger E. 2002. Plant Physiology.
Lampiran 1 Rumus menghitung nilai KAM
% 100 x BB
BK -BB
KAM
Lampiran 2 Rumus menghitung nilai KAR
100% x BK -BJ
BK -BS
KAR
Lampiran 3 Daftar perhitungan aktivitas enzim antioksidan dan kandungan antioksidan
Analisis Perhitungan
1. Aktivitas enzim Superoksida
dismutase (SOD) 0,5 tangen kontrol
Sampel T angen
-Kontrol T angen
SOD Aktifitas
2. Aktivitas Askorbat
perosidase (APX)
sampel Volume
total Volume ε
Menit) Absorban
(
segar Bobot APX
Aktifitas
3. Kandungan Asam Akorbat (ASA)
1. Standarisasi larutan ASA (4 mg ASA murni equivalen dengan 1 ml dye):
dititrasi yang
murni ASA 4mg
ml 1
(mg) ASA
dye dye
2. Kandungan ASA pada daun (ASA/100 g jaringan daun):
(g) sampel Bobot
100
(ml) aliquot Volume
(ml) ekstrak volume
Total aliquot
Lampiran 4 Formulasi dosis paraquat
Paraquat yang digunakan yaitu Gramoxon 276 gl-1 Dosis paraquat yang digunakan = 90 g ai/ha Dosis Formulasi = 90 g ai/ha = 0,32609 l/ha
276 g/l
= 326,09 ml/ha
Dosis aktif (ml/250ml) = 5 m2 x (326,09 ml/1000 m2) = 0,16304 ml
BUDIDAYA DAN KEDELAI LIAR
HASEP SODIKIN
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
askorbat akibat cekaman kekeringan dan herbisida paraquat pada kedelai budidaya dan kedelai liar. Dibimbing oleh HAMIM dan TRIADIATI.
Untuk mengetahui mekanisme pertahanan terhadap peningkatan senyawa oksidatif pada kedelai budidaya (Tidar, Burangrang dan Panderman) dan kedelai liar akibat cekaman kekeringan dan paraquat maka dilakukan pengamatan terhadap perubahan aktivitas enzim superoksida dismutase (SOD), askorbat peroksidase (APX) dan akumulasi antioksidan asam askorbat (ASA).
Tanaman disiram setiap hari dan dihentikan pada umur tanaman 30 hari setelah tanam (HST) (kedelai budidaya dan jagung) dan 40 HST (kedelai liar). Untuk perlakuan kontrol dan paraquat penyiraman tetap dilakukan hingga panen, sedangkan tanaman yang diberi perlakuan cekaman kekeringan dibiarkan selama 10 hari (kedelai budidaya dan jagung) dan 20 hari (kedelai liar). Perlakuan paraquat dilakukan dengan cara menyemprot paraquat (dosis 90 g active ingredient
(ai/ha)) sebanyak satu kali. Pengaruh perlakuan terhadap perubahan aktivitas enzim dan akumulasi antioksidan diuji dengan menggunakan uji t-student.
Perlakuan kekeringan menurunkan Kadar Air Media (KAM) dan Kadar Air Relatif (KAR). Kekeringan juga mampu menurunkan tinggi tajuk namun tidak menunjukkan pengaruh yang nyata terhadap panjang akar. Selain itu, kekeringan dapat mengakibatkan penurunan bobot kering total tanaman, bobot dan jumlah biji per tanaman. Perlakuan paraquat dapat menurunkan KAR namun tidak berpengaruh terhadap tinggi tajuk, panjang akar maupun bobot kering total tanaman. Pada cekaman kekeringan peningkatan aktivitas SOD kurang responsif dibandingkan APX. Berbeda dengan cekaman kekeringan, perlakuan paraquat meningkatkan aktivitas enzim SOD dan APX lebih besar. Peningkatan akumulasi ASA akibat cekaman kekeringan jauh lebih besar dibandingkan cekaman paraquat
ABSTRACT
HASEP SODIKIN. Activities of superoxide dismutase, ascorbate peroxidase and accumulation of ascorbic acid affected by drought and paraquat herbicide on cultivated and wild soybean. Supervised by HAMIM and TRIADIATI.
In order to obtain knowledge about defense mechanisms towards the increase of oxidative substance in cultivated soybeans (Tidar, Burangrang, and Panderman) and wild soybeans affected by drought stress and paraquat application, observations were made to the change in the activities of superoxide dismutase (SOD), ascorbate peroxidase (APX), and the accumulation of ascorbic acid antioxidant (ASA).
Plants were watered every day until 30 days after planting (DAP) (cultivated soybean and corn) and 40 DAP (wild soybean). Control and paraquat treatment watering is continued until harvest time, while plants with drought stress treatment were left without watering for 10 days (cultivated soybean and corn) and 20 days (wild soybean). Paraquat treatment was done by spraying paraquat (dosage of 90 g active ingredient (ai/ha)) for one time. Treatments effecting the changes in enzymes activities and antioxidant accumulation were analyzed using the t-student test.
Kekeringan merupakan kondisi alamiah yang dihadapi tanaman dalam siklus hidupnya. Kondisi kekeringan merupakan salah satu faktor yang dapat menekan per-tumbuhan dan perkembangan tanaman di seluruh dunia (Schwanz & Polle 2001).
Pada tumbuhan, gejala pertama yang disebabkan oleh cekaman kekeringan ialah penurunan potensial air kemudian diikuti oleh penutupan stomata (Chaves 1991; Brodribb & Holbrook 2003) sehingga menyebabkan pengambilan CO2 untuk fotosintesis ter-hambat yang pada akhirnya menurunkan laju fotosintesis (Lawlor 2002; Neumann 2008). Apabila kekeringan berlanjut maka akan menyebabkan pertumbuhan fase generatif terganggu, terjadinya senesense dan bahkan kematian (Neumann 2008).
Selain itu, cekaman kekeringan mungkin juga dapat menginduksi cekaman oksidatif (Borsani et al. 2001; Iturbe-Ormaetxe et al
1998). Cekaman oksidatif merupakan suatu kondisi saat lingkungan seluler mengalami peningkatan produksi Reactive Oxygen Species (ROS) akibat over-reduksi dari sistem cahaya fotosintesis karena senyawa reduktan yang tidak termanfaatkan akibat terhambatnya CO2 selama cekaman kekeringan, cekaman suhu, intensitas cahaya yang tinggi dan polusi (Borsani et al. 2001). Cekaman oksidatif akan menyebabkan kerusakan sel pada tanaman. Selain disebabkan oleh cekaman kekeringan, pembentukan senyawa oksidatif dapat di-induksi oleh pemberian herbisida (McKersie & Leshem 1994).
Paraquat merupakan salah satu herbisida yang penggunaannya begitu luas. Paraquat merupakan herbisida kontak non selektif yang diaplikasi ke daun. Penggunaan her-bisida paraquat akan mempengaruhi proses fotosintesis, yaitu menyebabkan aliran elektron ke NADP+ pada sistem cahaya I (PSI) terhenti. Paraquat bertindak sebagai penerima elektron kemudian mereaksikannya dengan oksigen membentuk superoksida (O2¯ ) yang dapat merusak komponen lipid dan membran kloroplas (Gambar 1) (Taiz & Zeiger 2002).
Beberapa tanaman toleran paraquat memiliki mekanisme pertahanan untuk mencegah kerusakan yang terjadi akibat paraquat, yaitu mereduksi pergerakan paraquat di daun, eksklusi herbisida dari dalam sel dan menghambat translokasi paraquat ke jaringan daun muda (Fuerst et al.
oksigen aktif yang terbentuk secara enzimatis (Fuerst & Vaughn 1990).
Gambar 1 Skema penghambatan transpor elektron fotosintesis oleh herbisida paraquat (Taiz & Zeiger 2002).
Tumbuhan memiliki mekanisme pertahan-an terhadap peningkatpertahan-an senyawa-senyawa oksidatif yang terbentuk akibat cekaman kekeringan dan aplikasi paraquat. Pembentuk-an senyawa Pembentuk-antioksidPembentuk-an, seperti askorbat (ASA), -tokoferol dan glutation, merupakan salah satu sistem pertahanan tanaman tersebut. Selain itu, peningkatan karotenoid (Munné-Bosch et al. 1999) dan aktivitas enzim antioksidan, seperti enzim superoksida dismutase (SOD), askorbat peroksidase (APX) (Prohazkova et al 2001), glutation reduktase (GR) (Keleş & Öncel 2002) juga bisa terjadi jika senyawa-senyawa oksidatif terbentuk. Oleh karena itu perlu dilakukan penelitian yang berhubungan dengan dampak cekaman kekeringan dan paraquat terhadap perubahan aktivitas enzim-enzim seperti SOD, APX dan ASA khususnya pada tanaman budidaya masih diperlukan.
Tujuan
Penelitian ini bertujuan mengetahui aktivitas APX, SOD dan kandungan ASA pada kedelai budidaya dan kedelai liar yang diberi perlakuan cekaman kekeringan dan herbisida paraquat.
BAHAN DAN METODE
Waktu dan Tempat
Kekeringan merupakan kondisi alamiah yang dihadapi tanaman dalam siklus hidupnya. Kondisi kekeringan merupakan salah satu faktor yang dapat menekan per-tumbuhan dan perkembangan tanaman di seluruh dunia (Schwanz & Polle 2001).
Pada tumbuhan, gejala pertama yang disebabkan oleh cekaman kekeringan ialah penurunan potensial air kemudian diikuti oleh penutupan stomata (Chaves 1991; Brodribb & Holbrook 2003) sehingga menyebabkan pengambilan CO2 untuk fotosintesis ter-hambat yang pada akhirnya menurunkan laju fotosintesis (Lawlor 2002; Neumann 2008). Apabila kekeringan berlanjut maka akan menyebabkan pertumbuhan fase generatif terganggu, terjadinya senesense dan bahkan kematian (Neumann 2008).
Selain itu, cekaman kekeringan mungkin juga dapat menginduksi cekaman oksidatif (Borsani et al. 2001; Iturbe-Ormaetxe et al
1998). Cekaman oksidatif merupakan suatu kondisi saat lingkungan seluler mengalami peningkatan produksi Reactive Oxygen Species (ROS) akibat over-reduksi dari sistem cahaya fotosintesis karena senyawa reduktan yang tidak termanfaatkan akibat terhambatnya CO2 selama cekaman kekeringan, cekaman suhu, intensitas cahaya yang tinggi dan polusi (Borsani et al. 2001). Cekaman oksidatif akan menyebabkan kerusakan sel pada tanaman. Selain disebabkan oleh cekaman kekeringan, pembentukan senyawa oksidatif dapat di-induksi oleh pemberian herbisida (McKersie & Leshem 1994).
Paraquat merupakan salah satu herbisida yang penggunaannya begitu luas. Paraquat merupakan herbisida kontak non selektif yang diaplikasi ke daun. Penggunaan her-bisida paraquat akan mempengaruhi proses fotosintesis, yaitu menyebabkan aliran elektron ke NADP+ pada sistem cahaya I (PSI) terhenti. Paraquat bertindak sebagai penerima elektron kemudian mereaksikannya dengan oksigen membentuk superoksida (O2¯ ) yang dapat merusak komponen lipid dan membran kloroplas (Gambar 1) (Taiz & Zeiger 2002).
Beberapa tanaman toleran paraquat memiliki mekanisme pertahanan untuk mencegah kerusakan yang terjadi akibat paraquat, yaitu mereduksi pergerakan paraquat di daun, eksklusi herbisida dari dalam sel dan menghambat translokasi paraquat ke jaringan daun muda (Fuerst et al.
oksigen aktif yang terbentuk secara enzimatis (Fuerst & Vaughn 1990).
Gambar 1 Skema penghambatan transpor elektron fotosintesis oleh herbisida paraquat (Taiz & Zeiger 2002).
Tumbuhan memiliki mekanisme pertahan-an terhadap peningkatpertahan-an senyawa-senyawa oksidatif yang terbentuk akibat cekaman kekeringan dan aplikasi paraquat. Pembentuk-an senyawa Pembentuk-antioksidPembentuk-an, seperti askorbat (ASA), -tokoferol dan glutation, merupakan salah satu sistem pertahanan tanaman tersebut. Selain itu, peningkatan karotenoid (Munné-Bosch et al. 1999) dan aktivitas enzim antioksidan, seperti enzim superoksida dismutase (SOD), askorbat peroksidase (APX) (Prohazkova et al 2001), glutation reduktase (GR) (Keleş & Öncel 2002) juga bisa terjadi jika senyawa-senyawa oksidatif terbentuk. Oleh karena itu perlu dilakukan penelitian yang berhubungan dengan dampak cekaman kekeringan dan paraquat terhadap perubahan aktivitas enzim-enzim seperti SOD, APX dan ASA khususnya pada tanaman budidaya masih diperlukan.
Tujuan
Penelitian ini bertujuan mengetahui aktivitas APX, SOD dan kandungan ASA pada kedelai budidaya dan kedelai liar yang diberi perlakuan cekaman kekeringan dan herbisida paraquat.
BAHAN DAN METODE
Waktu dan Tempat
Bahan
Bahan tanaman yang digunakan ialah biji kedelai yaitu varietas Burangrang, Panderman, Tidar dari Balai Penelitian Tanaman Kacang-Kacangan dan Ubi-Ubian (Balitkabi) Malang, kedelai liar yang diperoleh dari Pusat Penelitian Sumber Daya Hayati dan Bioteknologi Tumbuhan IPB dan jagung hibrida (sebagai pembanding tanaman C4) yang diperoleh dari toko komersil. Bahan media tanam ialah tanah jenis latosol dan pasir dengan perbandingan 1:1 (v/v). Selain itu juga digunakan bahan-bahan untuk analisis ASA, APX, SOD dan herbisida paraquat dengan merek dagang Gramoxon 276 g l-1.
Rancangan Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap faktorial (RAL faktorial) yang terdiri atas 2 faktor dengan 3 ulangan. Faktor pertama adalah jenis tanaman yang terdiri atas 1 kedelai liar, 1 jagung dan 3 kedelai budidaya, yaitu varietas Burangrang, Panderman dan Tidar. Faktor yang kedua terdiri atas perlakuan kekeringan dan paraquat, serta tanpa perlakuan sebagai kontrol. Analisis data secara statistik dilakukan menggunakan analisis Independent-Simple T Test.
Metode
Persiapan Media Tanam
Tanah latosol dari daerah Sindangbarang Bogor dikering-anginkan selama 2 minggu
.
Kemudian tanah dihaluskan dan disaring (ukuran 1x1 cm) agar diperoleh ukuran yang seragam. Tanah hasil saringan dicampur dengan pasir (1:1) hingga homogen, kemudian dimasukkan ke dalam polybag ukuran 35 x 35 cm sebanyak 8 kg dan diberi air hingga jenuh untuk mengetahui kapasitas lapangnya.Penanaman dan Pemeliharaan Tanaman
Penanaman dilakukan setelah tanah dijenuhkan dengan air satu hari sebelumnya. Setiap polybag ditanam benih sebanyak 4 biji. Pada umur tanaman 7 hari setelah tanam (HST) dibuat penjarangan menjadi 2 tanaman per polybag.
Pemeliharaan meliputi pemberian pupuk dan penyiraman tanaman. Pemberian pupuk dilakukan sebanyak dua kali, yaitu sebelum penanaman dan sebelum perlakuan. Pupuk yang diberikan ialah NPK dengan dosis sebanyak 1,67 g dan TSP dengan dosis 1,12 g per polybag. Pupuk diletakkan di bagian
tengah polybag dengan kedalaman 3-5 cm kemudian ditutup kembali dengan tanah. Penyiraman tanaman dilakukan setiap hari dan dihentikan pada umur tanaman 30 HST (varietas Tidar, Burangrang, Panderman dan jagung) dan 40 HST (kedelai liar). Pada umur tersebut perlakuan kekeringan diberikan. Setelah perlakuan usai, tanaman disiram kembali seperti sediakala. Pemeliharaan tanaman yang dilakukan juga meliputi penyiangan gulma.
Perlakuan Cekaman Kekeringan dan Paraquat
Perlakuan kekeringan dilakukan dengan cara menunda penyiraman pada umur tanaman 30 HST selama 10 hari hingga tanaman layu kemudian diamati pada hari ke-4, 8, 10 dan 12. Untuk kedelai liar perlakuan kekeringan diberikan pada umur tanaman 40 HST (agar diperoleh ukuran daun yang relatif sama dengan kedelai budidaya) selama 20 hari hingga tanaman layu kemudian diamati pada hari ke-4, 8, 10, 18, 20 dan 22. Setelah perlakuan usai, yaitu hari ke-12 (varietas Tidar, Burangrang, Panderman dan jagung) tanaman kembali diberi air (rewatering) untuk melihat kemampuan recovery. Pada kedelai liar rewatering dilakukan pada hari ke-22.
Perlakuan paraquat dilakukan dengan cara menyemprot paraquat (dosis 90 g active ingredient (ai/ha) sebanyak satu kali pada umur tanaman 30 HST (varietas Tidar, Burangrang, Panderman dan jagung) dan 40 HST (kedelai liar), kemudian diamati sebanyak 4 kali, yaitu 4 jam setelah perlakuan (JSP), 1, 3 dan 5 hari setelah perlakuan (HSP).
Pengukuran Kadar Air Media
Kadar air media (KAM) ditentukan dengan cara mengambil tiga bagian (atas, tengah, bawah) media tanam. Tanah yang telah diambil kemudian ditimbang dengan meng-gunakan timbangan digital untuk mengetahui bobot basah (BB) tanah. Kemudian tanah dikeringkan di oven pada suhu 80oC selama tiga hari lalu ditimbang untuk mengetahui bobot kering (BK) tanah. Perhitungan nilai KAM berdasarkan rumus sebagaimana ter-lampir pada Lampiran 1.
Pengukuran Kadar Air Relatif Pada Daun
kemudian dilakukan hidrasi selama 24 jam di botol kecil. Setelah 24 jam dilakukan penimbangan untuk mengetahui bobot jenuh (BJ). Untuk mengetahui bobot kering (BK) maka potongan daun tersebut dikeringkan di oven pada suhu 80oC selama 24 jam. Perhitungan nilai KAR berdasarkan rumus sebagaimana