i
KOMPARASI RESPON FISIOLOGI TANAMAN KEDELAI
YANG MENDAPAT CEKAMAN KEKERINGAN DAN
PERLAKUAN HERBISIDA PARAQUAT
VIOLITA
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
ii ABSTRAK
VIOLITA. Komparasi respon fisiologi tanaman kedelai yang mendapat cekaman kekeringan dan perlakuan herbisida paraquat. Dibimbing oleh HAMIM dan SOEKISMAN TJITROSEMITO.
Telah dilakukan penelitian tentang respon fisiologi tanaman kedelai yang mendapat cekaman kekeringan dan herbisida paraquat pada 3 kedelai budidaya (Glycine max L.), kedelai liar (G. Tomentella) dan jagung. Media tanam berupa campuran tanah dan pasir (1:1, v/v) pada pot seberat 8 kg di rumah kaca. Perlakuan kekeringan diberikan dengan membiarkan tanaman tanpa air selama 12 hari untuk kedelai budidaya dan jagung, dan 22 hari untuk G. Tomentella, sementara perlakuan paraquat diberikan dengan penyemprotan pada daun tanaman dosis 90 g ai/ha. Pengamatan dilakukan pada Kadar Air Media (KAM), Kadar Air Relatif (KAR), tinggi tajuk, panjang akar, bobot tajuk, bobot akar, laju fotosintesis (Pn), laju transpirasi (E), malondialdehid (MDA), aktivitas enzim antioksidan, asam askorbat (ASA) dan kandungan prolin daun.
Perlakuan cekaman kekeringan mengakibatkan penurunan KAM dan KAR tanaman. Walaupun tidak mempengaruhi tinggi tajuk dan panjang akar, pada umumnya cekaman kekeringan akan mengakibatkan penurunan bobot kering tanaman dan produksi biji. Selain itu perlakuan kekeringan mengakibatkan penurunan Pn dan E, dan peningkatan kandungan MDA pada semua tanaman. Namun kandungan MDA jagung tidak menunjukkan peningkatan berarti dengan semakin lamanya kekeringan. Aktivitas enzim antioksidan umumnya meningkat sampai 10 hari setelah perlakuan (HSP) kekeringan, dan kemudian menurun ketika KAR daun mengalami penurunan dibawah 50% (12 HSP kekeringan). Kandungan ASA daun terjadi peningkatan sampai hari 10 (Tidar) dan hari ke-12 (Panderman dan jagung), namun tidak terjadi peningkatan ASA pada G.
Tomentella dan Burangrang. Adapun kandungan prolin kedelai meningkat tajam
ketika tanaman mengalami stres berat (12 HSP kekeringan). Namun pada jagung tidak terjadi peningkatan yang berarti sampai hari terakir perlakuan kekeringan.
Pada perlakuan herbisida paraquat, tanaman juga mengalami penurunan KAR, E, dan Pn, dan peningkatan kandungan MDA serta aktivitas enzim antioksidan. Berbeda halnya dengan cekaman kekeringan, perlakuan PQ tidak menyebabkan peningkatan kandungan ASA daun yang berarti pada semua tanaman. Begitu juga dengan kandungan prolin, perlakuan PQ tidak mengakibatkan kenaikan kandungan prolin daun. Hal ini mengindikasikan bahwa prolin mungkin merupakan senyawa yang spesifik terhadap stres kekeringan dan bukan senyawa yang spesifik untuk stres oksidatif.
iii
ABSTRACT
VIOLITA. Comparison of physiological response of soybean to drought and paraquat application. Under the direction of HAMIM and SOEKISMAN TJITROSEMITO.
Physiological responses of plant to drought and paraquat herbicide (PQ) application were observed on 3 cultivated soybeans (Glycine max L.), wild soybean (G. tomentella) and maize. Plants were grown in 8 kg pot containing soil and sand (1:1, v/v) in the greenhouse. Drought stress was provided by withholding water for 12 days for cultivated soybean and maize, and 22 days for
G. tomentella, while PQ was applied by once spray using 90 g ai/ha. Observation
was carried out by measuring media water content (MWC), plant growth, dry weight, relative water content (RWC), photosynthesis (Pn), transpiration (E), malondyaldehid (MDA) antioxidant enzymes activity, ascorbic acid (ASA) and prolin content.
Drought stress caused decrease of MWC and RWC, but generally did not influence plant growth. Meanwhile drought stress caused decrease of plant dry weight and seed production. Reduction of RWC due to drought caused decrease of Pn, E, and increase of MDA content of all the plants. However, MDA content of maize did not significantly increase due to drought. Antioxidant enzyme activities generally increased in response to drought until 10 days of the treatment, and then decreased when leaf RWC dropped below 50% (12 days after drought stressed). ASA as an antioksidant, generally increase until 10 days after drought treatment (Tidar) and 12 days after drought treatment (Panderman and maize), but it was not significantly different to Burangrang and G. tomentella. In soybean prolin content increased dramatically when the drought was getting severe. On the other hand, it was not increased significantly on maize.
In accordance to drought stressed, PQ treatment also caused decrease of leaf RWC, E, and Pn, while it coused increase of MDA content and antioxidant enzyme activities. There was no effect of PQ on ASA content for all the plant. Paraquat did not also affect prolin content which is indication that prolin might be a specific substance to drought stressed, not to oxidative stress.
iv ©Hak cipta milik IPB tahun 2007
Hak cipta dilindungi undag-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB.
v
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan dengan sebenarnya bahwa tesis yang berjudul Komparasi Respon Fisiologi Tanaman Kedelai yang Mendapat Cekaman Kekeringan dan Perlakuan Herbisida Paraquat, adalah hasil karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis.
Bogor, Agustus 2007
Violita
vi
KOMPARASI RESPON FISIOLOGI TANAMAN KEDELAI
YANG MENDAPAT CEKAMAN KEKERINGAN DAN
PERLAKUAN HERBISIDA PARAQUAT
VIOLITA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Biologi
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
vii Judul Tesis : Komparasi Respon Fisiologi Tanaman Kedelai yang
Mendapat Cekaman Kekeringan dan Perlakuan Herbisida Paraquat
Nama : Violita
NRP : G 351050021
Disetujui Komisi Pembimbing
Dr. Ir. Hamim, M.Si. Dr. Soekisman Tjitrosemito, M.Sc.
Ketua Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana IPB
Dr. Ir. Dedy Duryadi, DEA. Prof. Dr. Ir.Khairil Anwar Notodiputro, MS
viii
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT, karena atas limpahan belas kasih, kemudahan dan petunjuk-Nya semata, penulis dapat menyelesaikan Tesis ini. Tesis ini merupakan salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Biologi Sekolah Pasca Sarjana Institut Pertanian Bogor.
Terimakasih penulis sampaikan kepada Bapak Dr. Ir. Hamim, M.Si dan Bapak Dr. Soekisman Tjitrosemito, M.Sc selaku dosen pembimbing atas bimbingan dan arahan yang diberikan. Penghargaan penulis sampaikan kepada Dr. Ir. Dedy Duryadi, DEA selaku ketua Program Studi Biologi, Sekolah Pasca Sarjana (SPS) IPB, Dr. Ir. Munif Ghulamahdi, MS selaku penguji dari Departemen Agronomi dan Hortikultura. Terima kasih kepada Departemen Geofisika dan Meteorologi IPB atas bantuannya dalam penggunaan alat fotosintesis. Terima kasih juga kepada kepala Laboratorium Mikrobiologi Lingkungan LIPI atas arahannya dalam analisis enzim, dan juga kepada Pusat penelitian Sumber daya Hayati dan Bioteknologi IPB.
Ucapan terima kasih juga disampaikan kepada Papa, Mama, Mak etek, Uni, @dek, Da Pong atas do’a, kasih sayang dan pengertiannya. Selain itu penulis juga mengucapkan terima kasih pada Adisti, Jovany, Bu Dewi, Ina, Ninda, Ela, Rina, Rina 39, atas diskusi dan sarannya dan juga pada Hasep dan Yusi atas bantuannya serta kepada teman-teman di Program Studi Biologi SPS IPB. Penulis juga mengucapkan terima kasih pada Mba Een, Mba Agustina atas saran dan nasehatnya. Ucapan terima kasih pada semua pihak yang telah membantu sehingga dapat terselesaikannya tesis ini.
Sebagai penutup, penulis mengharapkan semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2007
ix
RIWAYAT HIDUP
Penulis dilahirkan di Payakumbuh pada tanggal 04 Juli 1981 dari ayah Azwin, S.Sos dan ibu Hildarnis. Penulis merupakan puteri kedua dari tiga bersaudara. Pendidikan sarjana ditempuh di Program Studi Biologi Universitas Andalas Padang, lulus pada tahun 2003 dengan predikat ”dengan pujian”. Pada tahun 2005 penulis diterima sebagai mahasiswa Pasca Sarjana Program Studi Biologi IPB.
x
DAFTAR ISI
Halaman
DAFTAR TABEL... xi
DAFTAR GAMBAR ... xiii
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 4
Hipotesis ... 4
TINJAUAN PUSTAKA Peranan Air bagi Pertumbuhan Tanaman ... 5
Cekaman Kekeringan pada Tanaman... 6
Efek Kekeringan terhadap Fotosintesis... 7
Cekaman Oksidatif... 9
Penyelamatan dari ROS ... 11
Penghambatan Fotosintesis oleh Herbisida... 14
BAHAN DAN METODE Waktu dan Tempat ... 16
Bahan dan Alat... 16
Rancangan Percobaan ... 16
Pelaksanaan ... 17
HASIL DAN PEMBAHASAN Kandungan Air Media (KAM)... 23
Kandungan Air Relatif (KAR) ... 25
Pertumbuhan Tanaman... 28
Produksi Tanaman... 32
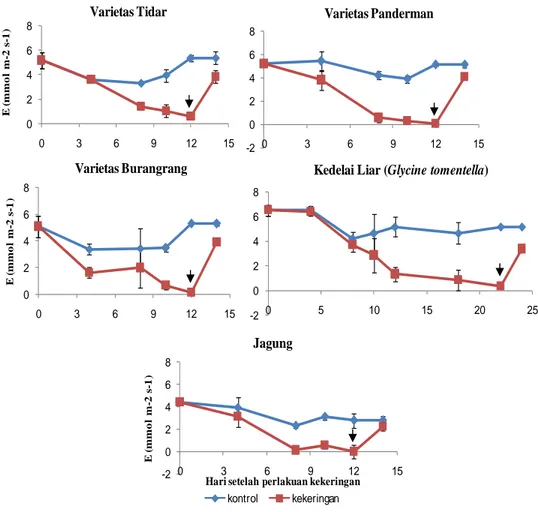
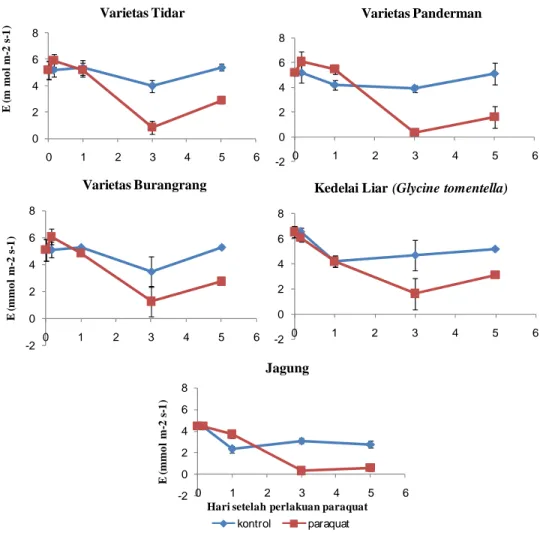
Morfologi Daun Tanaman yang Mendapat Perlakuan Hebisida Paraquat 33 Laju Transpirasi ... 35
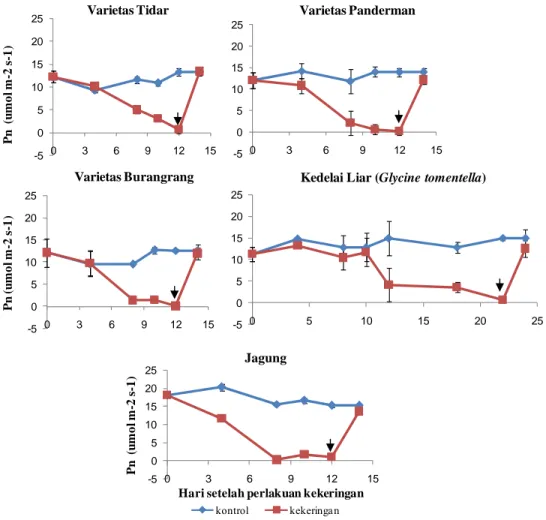
Laju Fotosintesis ... 37
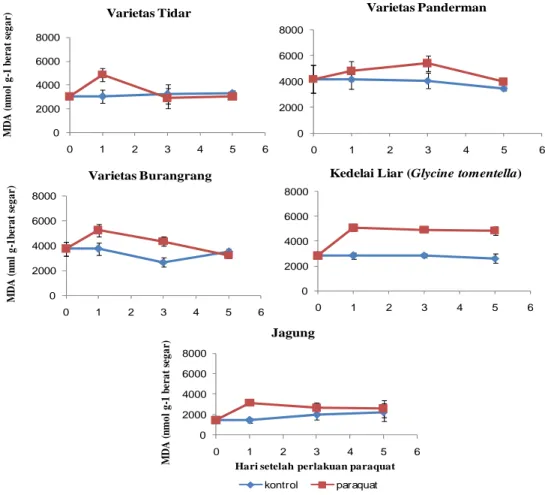
Peroksidasi Lipid... 42
Aktivitas Enzim Antioksidan ... 45
Kandungan Asam Askorbat (ASA)... 54
Kandungan Prolin ... 57
KESIMPULAN DAN SARAN Kesimpulan ... 60
Saran ... 60
DAFTAR PUSTAKA ... 61
xi
DAFTAR TABEL
Teks
Halaman 1. Rasio bobot akar/bobot tajuk pada tanaman kedelai dan jagung
setelah 12 hari perlakuan kekeringan ... 31 Lampiran
Halaman
1. Bahan-bahan pengukuran fotosintesis, analisis enzim antioksidan, asam askorbat dan prolin... 68 2. ANOVA dari pertumbuhan tanaman pada perlakuan cekaman
kekeringan ... 69 3. ANOVA dari produksi tanaman pada perlakuan cekaman kekeringan... 71 4. ANOVA dari Kadar Air Media (KAM) pada perlakuan cekaman
kekeringan ... 72 5. ANOVA dari Kadar Air Relatif (KAR) tanaman pada perlakuan
cekaman kekeringan ... 74 6. ANOVA dari laju transpirasi tanaman pada perlakuan cekaman
kekeringan ... 76 7. ANOVA dari laju fotosintesis tanaman pada perlakuan cekaman
kekeringan ... 78 8. ANOVA dari peroksidasi lipid tanaman pada perlakuan cekaman
kekeringan ... 80 9. ANOVA dari aktivitas glutation reduktase tanaman pada perlakuan
cekaman kekeringan ... 82 10. ANOVA dari aktivitas supeoksida dismutase tanaman pada
perlakuan cekaman kekeringan ... 84 11. ANOVA dari aktivitas askorbat peroksidase tanaman pada perlakuan
cekaman kekeringan ... 86 12. ANOVA dari kandungan asam askorbat tanaman pada perlakuan
cekaman kekeringan ... 88 13. ANOVA dari kandungan prolin tanaman pada perlakuan cekaman
xii 14. ANOVA dari laju transpirasi tanaman pada perlakuan herbisida
paraquat ... 92 15. ANOVA dari laju fotosintesis tanaman pada perlakuan herbisida
paraquat. ... 93 16. ANOVA dari laju peroksidasi lipid tanaman pada perlakuan
herbisida paraquat... 95 17. ANOVA dari aktivitas glutation reduktase tanaman pada perlakuan
herbisida paraquat... 96 18. ANOVA dari aktivitas superoksida dismutase tanaman pada
perlakuan herbisida paraquat... 98 19. ANOVA dari aktivitas askorbat peroksidase tanaman pada perlakuan
herbisida paraquat... 99 20. ANOVA dari kandungan asam askorbat tanaman pada perlakuan
herbisida paraquat... 101 21. ANOVA dari kandungan prolin tanaman pada perlakuan herbisida
xiii
DAFTAR GAMBAR
Halaman
22. Mekanisme pembentukan ROS ... 10
23. Produksi ROS pada transport elektron fotosintesis pada kondisi cahaya tinggi... 11
24. Metabolisme redok asam askorbat ... 12
25. Siklus askorbat-glutation ... 13
26. Skema penghambatan transport elektron fotosintesis oleh herbisida paraquat dan DCMU ... 14
27. Struktur kimia paraquat ... 15
28. Kandungan Air Media (%) pada 0 sampai 12 HSP kekeringan dan recovery ... 24
29. Kandungan air relatif (%) kedelai dan jagung pada 0, sampai 12 HSP kekeringan dan recovery ... 26
30. Kandungan air relatif (%) daun dari 0, 4 jam, 1 hari sampai 5 HSP herbisida paraquat... 27
31. Tinggi tajuk (a) dan panjang akar (b) 12 HSP kekeringan ... 29
32. Bobot kering tajuk (a) dan bobot kering akar (b) 12 HSP kekeringan ... 31
33. Jumlah biji per tanaman pada perlakuan kontrol dan kekeringan ... 32
34. Bobot kering biji per tanaman pada perlakuan kontrol dan kekeringan.... 32
35. Daun jagung (kiri) dan kedelai (kanan) 1 HSP herbisida paraquat ... 34
36. Laju transpirasi (E) kedelai dan jagung pada 0, sampai 12 HSP kekeringan dan recovery ... 35
37. Laju transpirasi (E) dari 0, 4 jam, 1 hari sampai 5 HSP herbisida paraquat ... 37
38. Laju fotosintesis (Pn) kedelai dan jagung pada 0, sampai 12 HSP kekeringan dan recovery ... 38
xiv 40. Kandungan MDA kedelai dan jagung 0, sampai 12 HSP kekeringan
dan recovery ... 43 41. Kandungan MDA kedelai dan jagung pada 0, 1, 3 dan 5 HSP
herbisida paraquat... 44 42. Aktivitas GR kedelai dan jagung pada 0, sampai 12 HSP kekeringan
dan recovery ... 46 43. Aktivitas GR kedelai dan jagung pada 0, 1, 3 dan 5 HSP herbisida
paraquat ... 48 44. Aktivitas SOD kedelai dan jagung pada 0, sampai 12 HSP
kekeringan dan recovery ... 49 45. Aktivitas SOD kedelai dan jagung pada 0, 1, 3 dan 5 HSP herbisida
paraquat ... 51 46. Aktivitas APX kedelai dan jagung pada 0, sampai 12 HSP
kekeringan dan recovery ... 52 47. Aktivitas APX kedelai dan jagung pada 0, 1, 3, dan 5 HSP herbisida
paraquat ... 53 48. Kandungan ASA daun kedelai dan jagung pada 0, sampai 12 HSP
kekeringan dan recovery ... 54 49. Kandungan ASA daun kedelai dan jagung pada 0, 1, 3, dan 5 HSP
herbisida paraquat... 56 50. Konsentrasi prolin kedelai dan jagung pada 0, sampai 12 HSP
kekeringan dan recovery ... 57 51. Konsentrasi prolin kedelai dan jagung 0, 1, 3, dan 5 HSP herbisida
paraquat ... 59
xvi Penguji Luar Komisi pada Ujian Tesis : Dr. Ir. Munif Ghulamahdi, MS.
1
PENDAHULUAN
Latar Belakang
Kedelai (Glycine max (L.) Merr.) merupakan tanaman kacang-kacangan yang digunakan sebagai bahan baku makanan tradisional seperti tempe, tahu dan kecap yang menjadi sumber protein nabati utama bagi sebagian besar penduduk Indonesia. Namun produktifitas kedelai nasional relatif rendah, yaitu hanya 1,2 ton/ha jika dibandingkan dengan produktifitas Cina yang sebesar 1,7 ton/ha dan Amerika Serikat yang sebesar 2,5 ton/ha (Agroindonesia 2001). Jumlah penduduk Indonesia yang sebesar 216 juta jiwa saat ini membutuhkan kedelai sekurang-kurangnya 3,0 juta ton per tahun, sementara itu produktifitas kedelai di Indonesia semakin menurun. Sejak tahun 2000, kondisi tersebut semakin parah, dimana impor kedelai semakin besar, yaitu sekitar 70% dari kebutuhan kedelai penduduk Indonesia (Hutapea dan Zum 2004).
Kendala utama dalam peningkatan produksi kedelai di lapangan salah satunya adalah kondisi cekaman kekeringan (Darman 2000). Kondisi ini semakin sulit karena Indonesia memiliki lahan kering yang cukup luas dibandingkan dengan lahan yang berpengairan. Faktor kekeringan diketahui merupakan faktor lingkungan utama yang akan menghambat pertumbuhan tanaman dan menurunkan produksi.
Purwanto (2003) telah melakukan penelitian tentang aktivitas fotosintesis kedelai akibat cekaman kekeringan. Pada penelitian tersebut didapatkan bahwa (1) fotosintesis, transpirasi dan daya hantar stomata menurun dengan semakin lamanya perlakuan kekeringan dan (2) tanaman dalam kondisi cekaman kekeringan memiliki luas daun dan rasio berat daun yang lebih rendah dibanding dengan yang tidak mengalami cekaman.
Jusuf et al. (1993) telah melakukan penelitian tentang aspek toleransi tanaman kedelai terhadap cekaman kekeringan dengan mengevaluasi 750 plasma nutfah. Berdasarkan penelitian tersebut diperoleh 20 genotipe toleran, yang dilanjutkan dengan identifikasi morfologi dan fisiologi oleh Hamim (1995) dan Sopandie et al. (1996). Melalui identifikasi tersebut diketahui bahwa tanaman kedelai pada kondisi cekaman kekeringan mengalami penurunan potensial osmotik dan peningkatan akumulasi prolin. Galur-galur tersebut merupakan
2 materi yang baik untuk mempelajari mekanisme adaptasi tanaman terhadap cekaman kekeringan.
Hamim (2004) menyatakan bahwa pada tahap awal, kekeringan menyebabkan berkurangnya pembukaan stomata untuk meminimalisir kehilangan air di bawah kondisi cahaya berlebihan. Peristiwa ini mengakibatkan terjadinya penurunan konsentrasi CO2 intrasel, sehingga tanaman mengalami overreduksi
pada transfer elektron fotosintesis (Berkowitz 1998). Overreduksi ini terjadi karena pembentukan NADPH pada reaksi terang tidak diimbangi oleh pemakaian NADPH pada reaksi gelap karena penurunan konsentrasi CO2 intrasel. Hal ini
mengakibatkan terbentuknya reactive oxygen species (ROS) yang diawali dengan pengikatan elektron pada transpor elektron fotosintesis oleh oksigen. Proses selanjutnya akan terbentuk berbagai bentuk senyawa ROS seperti; superoksida (O2-), singlet oksigen (·O2), radikal hidroksil (OH) dan hidrogen peroksida (H2O2)
(Mckersie and Leshem, 1994). Senyawa ROS ini akan dapat menimbulkan kerusakan pada tanaman (Aroca et al. 2001). Jika hal ini dibiarkan, maka lama kelamaan tanaman akan mati (Apel and Hirt 2004).
Disisi lain ROS juga dapat diinduksi pada tanaman dengan adanya senyawa herbisida, yang salah satunya adalah herbisida paraquat. Herbisida paraquat ini akan dapat mengambil elektron pada transfer elektron fotosintesis pada pusat reaksi fotosistem I. Herbisida paraquat memiliki afinitas tinggi terhadap elektron, sehingga dengan mudah akan mengikat elektron fotosintesis. Pada keadaan ini paraquat menjadi tidak stabil dan segera melepaskan elektron tersebut. Elektron ini akan langsung diikat oleh oksigen sehingga terbentuk superoksida (salah satu bentuk ROS) (McKersie and Leshem 1994; Reade and Cobb 2002).
Berdasarkan penelitian yang telah dilakukan oleh Gossett et al. (1996) diperoleh bahwa pemberian paraquat dapat menghambat pertumbuhan tanaman kapas (Gossypium hirsutum L.). Taylor et al. (2002) juga menyatakan bahwa perlakuan paraquat dan stres air pada biji kacang kapri (Pisum sativum L.) dapat menginduksi terbentuknya peroksidasi lipid yang akan menghambat kemampuan mitokondria dalam mengoksidasi glysin. Belum diketahui secara jelas apakah
3 kerusakan yang ditimbulkan oleh ROS akibat cekaman kekeringan sama dengan yang ditimbulkan oleh herbisida paraquat.
Pada kenyataannya, tanaman memiliki mekanisme tertentu untuk mempertahankan diri dari kerusakan ketika terjadi akumulasi ROS diantaranya melalui mekanisme enzimatik (enzim antioksidan) dan non-enzimatik (senyawa antioksidan). Enzim dan senyawa antioksidan ini akan menghambat pembentukan ROS baik pada kondisi cekaman kekeringan (Apel and Hirt 2004) maupun pada tanaman yang terkena herbisida paraquat (McKersie dan Leshem 1994). Walaupun demikian masih sedikit informasi yang diperoleh terkait dengan perubahan fisiologi tanaman yang terkena cekaman kekeringan dan herbisida paraquat. Keduanya sama-sama mempengaruhi metabolisme tanaman terutama pada transpor elektron fotosintesis dan dapat menginduksi stres oksidatif.
Berdasarkan hal tersebut diperlukan informasi yang cukup tentang komparasi respon fisiologi tanaman kedelai yang mendapat cekaman kekeringan dan perlakuan herbisida paraquat. Hal ini juga diharapkan dapat memberikan informasi tambahan tentang usaha pemuliaan tanaman pada lahan kering di Indonesia.
4 Tujuan
1. Melihat respon fotosintesis dan transpirasi kedelai selama perlakuan cekaman kekeringan dan setelah mendapat perlakuan herbisida paraquat. 2. Membandingkan tingkat akumulasi malonialdehid sebagai indikator
terbentuknya ROS pada tanaman yang mendapat cekaman kekeringan dan tanaman yang mendapat perlakuan paraquat.
3. Mengamati aktivitas enzim antioksidan dan akumulasi senyawa antioksidan pada tanaman yang mendapat cekaman kekeringan dan perlakuan paraquat.
4. Mengamati akumulasi prolin pada tanaman yang mendapat cekaman kekeringan dan perlakuan paraquat.
Hipotesa
1. Terdapat perbedaan respon laju fotosintesis dan laju transpirasi pada perlakuan cekaman kekeringan dan pelakuan paraquat.
2. Perlakuan cekaman kekeringan dan perlakuan herbisida paraquat memberikan pengaruh yang sama dalam menginduksi senyawa ROS.
3. Perkembangan tingkat antioksidan dan aktivitas enzim akan mengalami peningkatan akibat cekaman kekeringan dan perlakuan paraquat.
4. Terdapat perbedaan akumulasi prolin pada tanaman yang mendapat cekaman kekeringan dan pemberian herbisida paraquat.
5
TINJAUAN PUSTAKA
Peranan Air bagi Pertumbuhan Tanaman
Air merupakan komponen utama tanaman, yaitu membentuk 80-90 % bobot segar jaringan yang sedang tumbuh aktif. Air sebagai komponen esensial tanaman memiliki peranan antara lain: (a) sebagai pelarut, di dalamnya terdapat gas, garam, dan zat terlarut lainnya, yang bergerak keluar masuk sel, (b) sebagai pereaksi dalam fotosintesis dan pada berbagai proses hidrolisis, (c) air esensial untuk menjaga turgiditas diantaranya dalam pembesaran sel, pembukaan stomata dan menyangga bentuk daun-daun muda atau struktur lainnya (Levitt 1980).
Pada keadaan normal tanaman membutuhkan keseimbangan potensial air antara tanah-akar-daun-atmosfer. Keseimbangan ini berarti gradien potensial air antara bagian-bagian tersebut yang memungkinkan tanaman untuk melakukan transpor air dan hara dari akar ke daun. Air akan mengalir dari potensial air tinggi ke potensial air rendah, sehingga potensial air di tanah haruslah lebih tinggi dibandingkan dengan potensial air di akar, daun dan atmosfer yang dipengaruhi oleh proses transpirasi (Taiz and Zeiger 2002).
Proses transpirasi di daun terutama terjadi pada siang hari. Transpirasi dipengaruhi oleh cahaya matahari. Ketika terjadi proses transpirasi pada tanaman, maka tekanan turgor akan mengalami penurunan. Penurunan ini menyebabkan potensial air di daun lebih rendah dari pada di akar, sehingga akan mempermudah aliran air di xylem dari akar sampai ke daun. Peningkatan aliran air ini dibutuhkan untuk pertumbuhan sel tanaman. Aliran air ke sel akan mengakibatkan perbesaran dan pemanjangan sel, sehingga sel dapat tumbuh (Kramer and Boyer 1995).
Pada kondisi lingkungan tertentu tanaman dapat mengalami defisit air. Defisit air berarti terjadi penurunan gradien potensial air antara tanah-akar-daun-atmosfer, sehingga laju transpor air dan hara menurun (Taiz and Zeiger 2002). Penurunan ini akan mengakibatkan gangguan pada pertumbuhan tanaman, terutama pada jaringan yang sedang tumbuh (Kramer and Boyer 1995). Hal ini biasanya terjadi pada tanah yang kekurangan air, sehingga gradien potensial air di tanah dan akar menurun. Itulah sebabnya tanaman yang tumbuh pada tanah yang kering mengalami hambatan pertumbuhan.
6 Cekaman Kekeringan pada Tanaman
Cekaman kekeringan akan mengakibatkan rendahnya laju penyerapan air oleh akar tanaman. Ketidakseimbangan antara penyerapan air oleh akar dan kehilangan air akibat transpirasi membuat tanaman menjadi layu. Cekaman kekeringan atau “drought stress” dapat terjadi karena beberapa hal yaitu: (1) tingginya kecepatan evaporasi yang melebihi persediaan air dari tanah ke akar yang akan mengakibatkan penurunan potensial air, (2) adanya senyawa yang bersifat osmotik, seperti pada tanah garam, yang dapat menurunkan pengambilan air sehingga terjadi penurunan potensial osmosis dan tidak cukupnya pengambilan air oleh tanaman yang diserap dari tanah (Borges 2003).
Tanaman yang berada pada kondisi cekaman kekeringan akan memberikan respon tertentu baik secara morfologis, anatomis maupun fisiologis. Pada keadaan cekaman kekeringan tersebut terdapat dua mekanisme utama yang mungkin terjadi pada tanaman, yaitu: (a) tanaman berusaha menghindari cekaman, baik dengan cara melakukan perubahan struktur morfologi dan anatomi, maupun dengan meningkatkan efisiensi penggunaaan air dengan cara mengatur laju transpirasi, dan (b) meningkatkan toleransi terhadap cekaman kekeringan melalui perubahan kimia sel, baik dalam bentuk peningkatan akumulasi senyawa terlarut yang berperan sebagai pengatur tekanan osmotik sel (osmotic adjustment), dengan mengakumulasi senyawa kimia seperti; prolin dan gula (Meyer dan Boyer 1981).
Cekaman kekeringan dapat menghambat pertumbuhan tanaman. Penghambatan pertumbuhan ini salah satunya dapat dilihat pada perluasan daun. Penurunan luas daun merupakan respon pertama tanaman terhadap kekeringan. Keterbatasan air akan menghambat pemanjangan sel yang secara perlahan akan menghambat pertumbuhan luas daun. Kecilnya luas daun mengakibatkan rendahnya transpirasi, sehingga menurunkan laju suplai air dari akar ke daun. Jika kondisi ini dibiarkan terus menerus, lama kelamaan akan terjadi absisi daun (Taiz and Zeiger 2002). Luas daun pada tanaman sangatlah penting karena proses fotosintesis terjadi di kloroplas daun, dan fotosintesis merupakan salah satu faktor yang mempengaruhi proses pertumbuhan tanaman.
7 Efek Kekeringan terhadap Fotosintesis
Penurunan potensial air tanaman pada kondisi kekeringan menyebabkan terjadinya penurunan laju fotosintesis. Hal ini terjadi karena adanya hambatan yang ditimbulkan oleh penutupan stomata (stomatal limitation) maupun hambatan akibat penurunan proses biokimia dalam tumbuhan (non-stomatal limitation) (Kalefetoglu dan Ekmekci 2005).
Hambatan stomata
Pada kondisi cekaman kekeringan ringan (moderat) tanaman akan segera mengurangi pembukaan stomata. Penurunan pembukaan stomata ini dilakukan untuk meminimalisir kehilangan air yang berlebihan. Dengan terjadinya penurunan pembukaan stomata, maka konsentrasi CO2 daun akan menurun
sehingga dengan sendirinya proses fotosintesis juga akan menurun (Flexas and Medrano 2002).
Comstock (2002) menambahkan bahwa pengaturan konduktan stomata berkaitan dengan signal hidrolik (hydraulic signaling) dan signal kimia (chemichal signaling). Ketika tumbuhan mengalami kondisi cekaman kekeringan, terjadi perubahan potensial air pada tanaman. Pada keadaan ini terjadi penurunan gradien potensial air antara akar dan tanah, sehingga laju penyerapan air oleh akar menurun. Penurunan laju penyerapan air ini dan ditambah dengan peningkatan transpirasi akibat radiasi matahari membuat tanaman mengalami kekurangan air (Levitt 1980). Gradien potensial air akan menimbulkan hydraulic signaling terhadap konduktansi stomata sebagai respon tanaman terhadap cekaman kekeringan sehingga stomata menutup (Comstock 2002).
Chemical signalling berkaitan dengan terjadinya peningkatan konsentrasi
asam absisat (ABA) pada akar tumbuhan. Ketika cekaman kekeringan terdapat bukti bahwa terjadi peningkatan sintesis ABA pada akar tanaman sebagai respon terhadap keadaan defisit air tanah. Peningkatan ABA ini terkait dengan status air akar tanaman. Proses selanjutnya ABA akan ditranspor melalui xylem terus ke daun. Selain di akar, tanaman juga mensintesis ABA di daun, sehingga terjadi peningkatan ABA di daun (Srivastava 2002). Pada kondisi ini protein channel Kout
8 akan dihambat oleh ABA, sehingga banyak ion K+ yang keluar dari sel penjaga. Kondisi ini akan menurunkan potensial osmotik sel penjaga sehingga stomata menutup (Roberts dan Snowman 2000). Proses pensignalan oleh ABA dari akar ke daun ini dikenal dengan istilah long-distance chemichal signaling (Comstock 2002).
Kehilangan ion ataupun larutan pada sel penjaga dapat disebabkan oleh penurunan kandungan air daun, dan ABA memegang peranan penting dalam proses ini. ABA disintesis secara lambat terus menerus di sel mesofil dan terakumulasi di kloroplas. Ketika mesofil terdehidrasi, maka ada dua hal yang akan terjadi yaitu:
1. Beberapa ABA yang disimpan di kloroplas akan dilepas ke apoplas (permukaan dinding sel) sel mesofil. Redistribusi ABA ini bergantung kepada gradien pH pada daun, keasaman properti molekul ABA dan permeabilitas membran sel. Redistribusi ABA memungkinkan aliran transpirasi untuk membawa beberapa ABA ke sel penjaga.
2. ABA disintesis dengan kecepatan tinggi di akar mengakibatkan lebih banyak ABA yang diakumulasi pada apoplas daun (Taiz and Zeiger 2002).
Menurut Lizana et al. (2006), ABA telah diketahui menjadi faktor yang mengatur konduktansi stomata. Hasil penelitian pada dua varietas Phaseolus
vulgaris (Arroz and Orfeo) diperoleh bahwa peningkatan konsentrasi ABA seiring
dengan penurunan konduktan stomata dengan semakin lamanya kondisi kekeringan.
Hambatan non-stomata
Hambatan non-stomata berkaitan dengan proses metabolik yaitu pada proses transpor elektron fotosintesis. Jika kondisi kekeringan terus terjadi maka tanaman akan mengalami penurunan proses metabolik, karena berkurangnya difusi CO2 ke kloroplas (Chaves and Oliveira 2004) yang nantinya akan mengarah
kepada penurunan kandungan ribulosa 1,5-biphosphat (RuBP) pada proses fotosintesis (Flexas and Medrano 2002). Vu et al. (1987) menambahkan bahwa
9 peningkatan stres kekeringan pada kedelai akan menurunkan total aktivitas rubisko.
Cekaman kekeringan akan menginduksi terjadinya fotoinhibisi, selanjutnya akan menurunkan kandungan protein D1 pada fotosistem II (PS II) (Pastenes et al. 2004). PS II sebagai sistem penangkap cahaya (light harvesting
system) memiliki dua fungsi esensial yaitu: (1) menangkap cahaya pada proses
fotosintesis, (2) melepas energi tereksitasi apabila terjadi kelebihan energi. Berdasarkan hal tersebut, maka PS II akan merespon signal eksternal dari lingkungan. Hal ini berkaitan dengan peningkatan trans-membran tilakoid ΔpH. Peningkatan trans-membran tilakoid ΔpH ini berfungsi sebagai kontrol balik terhadap kelebihan transpor elektron fotosintesis. Proses ini dikenal dengan
non-photochemical quenching (NPQ) yang bergantung pada siklus xanthophyll dan
protein PsbS pada fotosistem (Horton and Ruban 2004), sebagai mekanisme pertahanan tanaman terhadap fotoinhibisi (Taiz and Zeiger 2002).
Cekaman Oksidatif
Perubahan lingkungan yang tidak menguntungkan termasuk kekeringan pada tanaman, dapat menyebabkan terbentuknya senyawa oksidatif. Jika kondisi ini dibiarkan, tanaman akan mengalami stres oksidatif. Pembentukan senyawa oksidatif pada tanaman diawali dengan reduksi oksigen pada membran sel kloroplas membentuk superoksida (O2-). Jika hal itu terjadi akan terbentuk
reactive oxygen species (ROS) yang meliputi molekul-molekul seperti:
superoksida (O2-), singlet oxygen (.O2), radikal hidroksil (OH) dan hydrogen
peroksida (H2O2) (Blokhina et al. 2003). Radikal bebas merupakan molekul yang
sangat reaktif sekali, karena memiliki elektron yang tidak berpasangan dan merupakan molekul yang dapat mengakibatkan kerusakan pada membran (Mckersie and Leshem 1994). Contoh reaksi tersebut adalah:
2 O2 + 2 Fdred 2 O2- + 2 Fdox
Molekul O2- yang reaktif akan berusaha melepaskan elektron bebasnya dan
bereaksi dengan H+ membentuk H2O2(1). Proses selanjutnya hidrogen peroksida
dan superoksida bereaksi membentuk molekul yang sangat reaktif yaitu radikal hidroksil (2). Selain itu radikal hidroksil bisa dibentuk dengan keberadaan ion besi
10 melalui reaksi fenton (3). Keberadaan besi atau ion metal lainnya dapat meningkatkan kerusakan oksidatif (Mckersie and Leshem 1994). Berikut ini adalah skema pembentukan radikal bebas:
O2- + O2- + H+ H2O2 + O2 (1)
O2- + H2O2 O2 + OH. + OH- (2)
Fe3+ + O2- Fe2+ + O2
Fe2+ + H2O2 OH. + OH + Fe3+ (3)
Secara keseluruhan, reaksi pembentukan ROS dapat dilihat sebagai berikut:
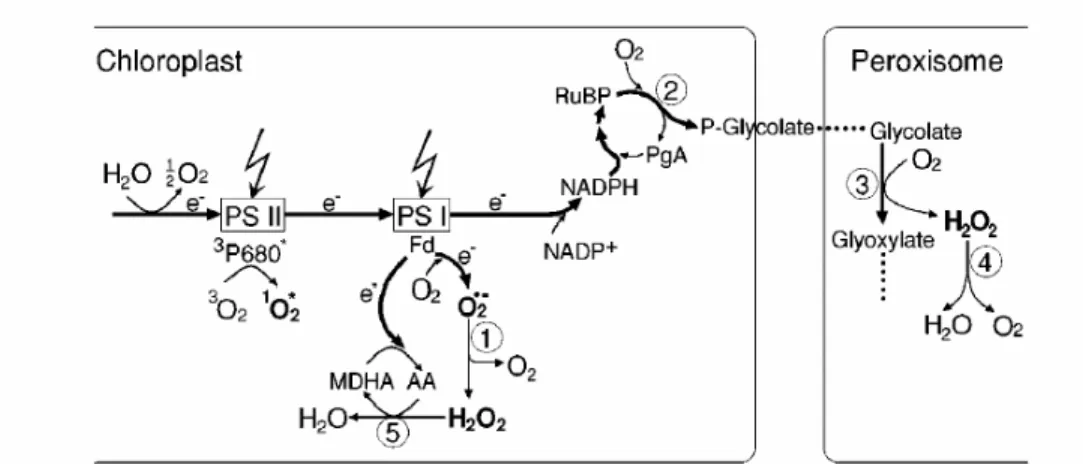
Gambar 1 Mekanisme pembentukan ROS (Apel and Hirt 2004)
Menurut Mckersie and Leshem (1994) ada beberapa peluang terjadinya pembentukan ROS pada proses fotosintesis
1. Pada PS I dapat terjadi reduksi oksigen melalui reaksi mehler. Reduksi oksigen ini terjadi pada transport elektron feredoksin, reduksi ini terjadi ketika NADP+ terbatas yang salah satunya disebabkan oleh berkurangnya
penggunaan NADPH untuk fiksasi CO2 pada siklus kalvin.
2. Pada PS II terjadi oksidasi dengan mentransfer empat single elektron dari H2O membentuk triplet atau ground state oksigen. Selain itu alkohol
tertentu juga bisa direduksi oleh PS II.
3. Fotoaktifasi dari kloroplas secara normal mentransfer energi ke pusat reaksi PS, namun pada kondisi yang tidak menguntungkan klorofil akan menangkap energi cahaya pada sistem transpor elektron, sehingga dapat mengeksitasi oksigen dari bentuk triplet ke bentuk singlet.
4. Fotorespirasi merupakan lintasan yang paling mudah untuk menghasilkan proses oksigenasi. Walaupun tidak terjadi pengaktifan oksigen di dalam
11 kloroplas, namun terjadi subsequent metabolisme glikolat di dalam peroksisom (Gambar 2).
Gambar 2 Produksi ROS pada transpor elektron fotosintesis pada kondisi cahaya tinggi (Apel and Hirt 2004)
Peningkatan ROS dapat menimbulkan kerusakan pada komponen-membran sel. Komponen komponen-membran sel tersebut antara lain: lipid (peroksidasi dari asam lemak tidak jenuh pada membran), protein (denaturasi), karbohidrat, dan asam nukleat. Kerusakan membran ini dapat dilihat dari perubahan komposisi dan kandungan lipid, pengaktifan lipid peroksidase dan meningkatnya kebocoran membran (Blokhina et al. 2003).
Penyelamatan dari ROS
Selama proses fotosintesis ROS dibentuk dan dirombak kembali untuk. Pembentukan ROS akan meningkat ketika kondisi lingkungan tidak menguntungkan terus terjadi, namun tanaman mempunyai suatu mekanisme penyelamatan terhadap kondisi tersebut. Mekanisme penyelamatan ini antara lain melalui mekanisme antioksidan baik yang bersifat enzimatik maupun non-enzimatik untuk menghindari kerusakan yang terjadi akibat stres oksidatif. Mekanisme non-enzimatik antioksidasi meliputi senyawa-senyawa antioksidan seperti: asam askorbat (ASA), glutation (GSH), termasuk juga tocopherol, flavonoid, alkaloid dan karotenoid (Apel and Hirt 2004).
12 ASA atau vitamin C merupakan asam organik dengan kemampuan antioksidan. ASA dapat larut dalam air dan sangat mudah dioksidasi yaitu sebagai senyawa reduktan. ASA akan rusak ketika ditempatkan pada cahaya atau panas yang akan berubah dalam bentuk teroksidasi yaitu asam dehidroaskorbat (Wikipedia 2006).
Gambar 3 Metabolisme redok asam askorbat (Wikipedia 2006).
Askorbat memenuhi banyak fungsi penting pada biologi tanaman (Noctor and Foyer 1998). Askorbat juga digunakan sebagai ko-faktor untuk violaxanthin de-epoxidase pada siklus xanthophyll. Proses ini dilibatkan dalam perlindungan pelepasan penyerapan cahaya dalam bentuk panas dan bisa diukur sebagai NPQ dari klorofil fluorescence (Sonja et al. 2001).
ASA sebagai senyawa antioksidan dapat berinteraksi dengan membran plasma dan mendonorkan elektronnya ke radikal -tocopheroxyl dan aktivitas trans-membran plasma oksidoreduktase. Recycling -tocopheroxyl dapat membantu melindungi membran plasma dari peroksidasi (May 1999).
Mekanisme penyelamatan secara enzimatik melibatkan enzim antioksidan antara lain yaitu: superoksida dismutase (SOD); askorbat peroksidase (APX); monodehidroaskorbat reduktase (MDHAR); dehidroaskorbat reduktase (DHAR); glutation reduktase (GR); katalase (CAT) dan glutation peroksidase (GPX), sebagai akibat dari peningkatan radikal bebas di kloroplas (Aroca 2000; Becana et
13
al. 2000; Borsani et al. 2001; Jiang and Huang 2001; Noctor and Foyer 1998;
Sonja et al. 2001).
Enzim antioksidan seperti SOD, dibutuhkan untuk merubah superoksida menjadi bentuk radikal oksigen (O2) dan H2O2. Hidrogen peroksida ini
merupakan oksidan kuat yang dapat mengganggu proses fotosintesis di kloroplas. Keberadaan enzim CAT dapat merubah H2O2 menjadi air dan oksigen Reduksi
H2O2 ini membutuhkan senyawa reduktan yaitu ASA. Enzim APX dengan 2
molekul ASA akan mereduksi H2O2 menjadi air dan membentuk MDHA. MDHA
memiliki elektron bebas sehingga harus segera direduksi menjadi ASA atau dehidroaskorbat (DHA). DHA reduktase selanjutnya akan mereduksi DHA menjadi ASA. Pada reaksi ini digunakan glutation (GSH) sebagai substrat dan membentuk glutation disulpida (GSSG). GSSG dapat kembali membentuk GSH oleh NADPH yang dikatalisis oleh GR (Noctor and Foyer 1998). Siklus askorbat-glutathione dapat dilihat pada Gambar 4.
14 Penghambatan Fotosintesis oleh Herbisida
Selain kondisi kekeringan, laju transpor elektron fotosintesis juga dapat dihambat oleh beberapa herbisida diantaranya adalah herbisida paraquat dan diklorofenil dimetil urea (DCMU). Herbisida paraquat akan menghambat transpor elektron fotosintesis pada PS I (P700), sedangkan DCMU akan menghambat transpor elektron fotosintesis pada PS II (P680) (Taiz and Zeiger 2002). Secara skematik mekanisme penghambatan oleh herbisida paraquat dan DCMU dapat dilihat sebagai berikut:
Gambar 5 Skema penghambatan transpor elektron fotosintesis oleh herbisida paraquat dan DCMU (Taiz and Zeiger 2002)
Paraquat
Herbisida paraquat termasuk kelompok herbisida Bipyridylium, yaitu memiliki dua cincin pyridyl. Kelompok herbisida ini dapat merusak jaringan tanaman dengan cepat, yang mengakibatkan tanaman kelihatan terbakar yang mengarah kepada kerusakan membran sel. Herbisida ini termasuk senyawa bermuatan positif, yang akan direduksi oleh fotosintesis untuk membentuk radikal bebas yang relatif tidak stabil. Radikal bebas ini mudah dioksidasi dengan adanya oksigen untuk membentuk kembali ion aslinya dan hidrogen peroksida, yang akan merusak jaringan tanaman. Pada tingkat selular akan menyebabkan pecahnya membran sel dan kloroplas (Chia et al. 1982). Paraquat diaplikasikan melalui daun dan tidak bisa lewat akar, karena struktur kimia paraquat yang bermuatan positif cenderung untuk berikatan dengan tanah yang bermuatan negatif (Mckersie and Leshem 1994).
15 Herbisida paraquat merupakan herbisida yang memiliki ikatan elektrolit yang kuat. Paraquat bekerja secara kontak non-selektif dengan cara merebut elektron pada rantai transpor elektron fotosintesis PS I. Pada keadaan ini paraquat menjadi tidak stabil sehingga berusaha untuk melepaskan elektron tersebut. Reaksi ini menghasilkan radikal bipyridyl yang akan bereaksi dengan oksigen membentuk superoksida, proses selanjutnya akan terbentuk hidrogen peroksida dan radikal hidroksil. ROS ini akan menginduksi terjadinya peroksidasi lipid, penurunan laju fotosintesis, dan kehilangan integritas membran (Chia et al. 1982).
Gambar 6 Struktur kimia paraquat, 1,1’-dimethyl- 4,4’-bipyridilium ion (diklorid) Kerusakan membran ini terjadi karena reaksi antara radikal bebas yang sangat reaktif berikatan dengan asam lemak pada membran. Asam lemak merupakan bagian dari fosfolipid, komponen utama penyusun membran. Pada bagian ekor fosfolipid ini terdapat ikatan ganda yang akan cenderung diikat oleh molekul reaktif tersebut. Ikatan ini mengakibatkan asam lemak yang semula tidak jenuh, menjadi jenuh. Hal ini akan merubah struktur membran dan menurunkan permeabilitas membran, pada tahap selanjutnya dapat mengakibatkan kebocoran pada membran (Chia et al. 1982).
Perlakuan dengan paraquat dapat menurunkan kandungan klorofil dan protein daun sehingga terjadi peningkatan penghambatan fotosintesis tanaman. Perlakuan paraquat tidak mempengaruhi aktivitas rubisko tapi dapat meningkatkan laju fotorespirasi (Popova et al. 2003). Gejala kerusakan akibat perlakuan paraquat dapat menimbulkan nekrosis pada daun dan juga menimbulkan bintik-bintik pada jaringan daun.
16
BAHAN DAN METODE
Waktu dan Tempat
Percobaan dilaksanakan di rumah kaca kampus IPB Baranangsiang, kemudian dilanjutkan di Laboratorium Terpadu dan Laboratorium Fisiologi Tumbuhan Biologi Fakultas MIPA IPB. Percobaan ini telah dilakukan mulai bulan Agustus 2006 sampai Juli 2007.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini antara lain: tanah, pasir, pupuk NPK dan TSP, paraquat Gramoxon 276 g l-1, beberapa varietas benih kedelai, benih jagung, nitrogen cair, kantong kertas, mulsa plastik, aluminium foil, kertas saring, bahan-bahan untuk pengukuran laju fotosintesis, laju transpirasi, peroksidasi lipid, aktivitas enzim antioksidan, kandungan asam askorbat, dan untuk analisis prolin (Tabel lampiran 1).
Alat-alat yang dibutuhkan untuk keperluan penanaman adalah: rumah kaca, polybag kapasitas 10 kg (25 cm x 25 cm), gayung, timbangan duduk kapasitas 25 kg, gunting, sprayer. Alat-alat laboratorium yang digunakan adalah: timbangan analitik, oven, cork borer, desikator, petridis, botol kecil, tabung reaksi, mortar, Miracloth, pipet 10 ml, pipet mikro, lampu 20 W (2 buah), lampu 15 W (1 buah), corong, gelas ukur (250 ml dan 500 ml), biuret 50 ml, sarung tangan tahan panas, pH meter, thermometer, tabung nitrogen cair, Photosynthetic Leaf
Chamber Analyser tipe LCA-4, freezer -300C, spektrofotometer, dan sentrifus.
Rancangan Percobaan
Percobaan dirancang dan dilaksanakan dengan metode rancangan faktorial dalam rancangan acak lengkap dengan 3 ulangan. Sedangkan faktor yang diamati ada dua yaitu :
1. Jenis tanaman :
a. Tiga varietas kedelai budidaya yaitu: Tidar (V1), Burangrang (V2), dan Panderman (V3) dan satu kedelai liar yaitu: Glycine tomentella (V4)
17 2. Fakor perlakuan tanaman:
a. disiram setiap hari (N1) b. tanpa disiram (N2)
c. disiram setiap hari dan penyemprotan paraquat (N3) dosis 90 g ai ha-1 (Lampiran 1)
Data diolah dengan menggunakan SPSS 13 dengan ANOVA dan uji t-student dengan perbandingan 2 faktor.
Pelaksanaan Materi tanaman dan persiapan penanaman
Pada percobaan ini digunakan empat varietas kedelai dan satu jagung yang diberi tiga perlakuan. Varietas kedelai budidaya diperoleh dari varietas pilihan pada Balai Penelitian Kacang-kacangan dan Umbi-umbian (Balitkabi) Malang dan varietas kedelai liar diperoleh dari Pusat Penelitian Bioteknologi IPB.
Sebelum penanaman, dilakukan persiapan rumah kaca dan media tanam. Media tanam yang digunakan adalah campuran antara tanah dan pasir dengan perbandingan 1:1. Sebelum dicampur, pasir diayak terlebih dahulu, setelah dicampur, dilakukan pengukuran kadar air media pada kondisi kapasitas lapang untuk menentukan jumlah air yang harus ditambahkan pada media.
Penanaman dan pemeliharaan
Benih ditanam di dalam polybag yang telah disiapkan, sebanyak 2 biji per polybag untuk setiap perlakuan. Pada saat penanaman dilakukan pemupukan dasar dengan menggunakan NPK dan TSP masing-masing 1,67 dan 1,12 g per polybag. Pemupukan juga diberikan pada tanaman sebelum perlakuan yaitu 0,85 g NPK per polybag.
Pemberian perlakuan kekeringan dan pemberian paraquat
Setiap varietas tanaman mendapatkan tiga perlakuan, yaitu perlakuan disiram setiap (N1), tanpa disiram (N2), pemberian paraquat (N3). Pemberian perlakuan cekaman kekeringan dilakukan dengan membiarkan tanaman tanpa air selama 12 hari untuk kedelai budidaya dan jagung, dan 22 hari untuk kedelai liar.
18 Selama perlakuan, media ditutupi dengan mulsa plastik untuk mengurangi evaporasi. Pemberian paraquat pada tanaman dilakukan dengan cara disemprotkan pada daun tanaman. Sebelum disemprotkan, dilakukan formulasi paraquat dengan cara penambahan air dan surfaktan sehingga larutan menjadi homogen.
Pengamatan
Pengamatan tanaman dilakukan terhadap panjang akar, tinggi tanaman, bobot kering akar dan tajuk, jumlah dan bobot biji, Kadar Air Media (KAM), Kandungan Air Relatif (KAR), laju fotosintesis, laju transpirasi, peroksidasi lipid, aktivitas enzim antioksidan, kandungan asam askorbat, dan akumulasi prolin. Pengukuran laju fotosintesis, laju transpirasi, dan pengambilan bahan analisis untuk peroksidasi lipid, aktivitas enzim antioksidan, kandungan asam askorbat, dan akumulasi prolin dilakukan pada 0, 4, 8, 12 hari setelah perlakuan (HSP) kekeringan dan 2 hari setelah rewatering, sedangkan pengukuran panjang akar, tinggi tanaman, bobot kering akar dan tajuk, dilakukan pada saat tanaman berumur 12 HSP. Jumlah dan bobot biji diukur setelah tanaman berproduksi. Pengambilan sampel untuk perlakuan paraquat dilakukan pada hari ke 0, 1, 3, dan 5 setelah pemberian paraquat.
Tinggi tanaman diukur mulai dari permukaan tanah sampai bagian pucuk (untuk tanaman kedelai) dan sampai daun terpanjang (untuk tanaman jagung). Panjang akar diukur mulai dari pangkal akar hingga ujung akar yang paling panjang, sedangkan bobot kering akar dan tajuk diukur secara terpisah dengan menggunakan oven 800C selama 2 x 24 jam.
KAR diukur dengan mengambil sampel daun menggunakan cork borer diameter 1 cm. Sampel daun yang diperoleh ditimbang untuk mendapatkan berat segar (BS), kemudian dilakukan hidrasi selama 24 jam dalam botol kecil untuk mendapatkan berat jenuh (BJ). Sampel selanjutnya di oven pada suhu 800C selama 24 jam untuk memperoleh berat kering (BK) setelah sebelumnya didinginkan dalam desikator (Barr and Weatherley 1962). KAR didapat dengan rumus :
KAR = BS - BK x 100% BJ - BK
19 KAM diukur dengan mengambil sampel tanah di bagian atas, tengah dan bawah. Sampel tanah ditimbang untuk memperoleh berat basah (BB), kemudian dioven pada suhu 800C untuk mendapatkan berat kering (BK). KAM diperoleh dengan rumus:
KAM = BB - BK x 100 % BB
Pengukuran laju fotosintesis dan laju transpirasi
Laju fotosintesis diukur dengan menggunakan Photosynthetic Leaf
Chamber Analyser tipe LCA-4. Pengukuran dilakukan berdasarkan pertukaran
CO2 dan H2O pada daun tanaman yang dihubungkan dengan Leaf Chamber. Laju
fotosintesis dan laju transpirasi diukur langsung pada hari ke 0, 4, 8, 10, 12 HSP kekeringan untuk kedelai budidaya dan jagung, dan 22 HSP kekeringan untuk kedelai liar, dan 2 hari setelah rewatering.
Analisis peroksidasi lipid
Peroksidasi lipid dianalisis dengan metode yang dikembangkan oleh Ono
et al. (1995) yang dimodifikasi yaitu berdasarkan pengujian thiobarbituric acid
(TBA), dengan malondialdehid (MDA) sebagai hasil akhir dari peroksidasi lipid. Daun (0,2 g) digerus dengan penambahan 0,5 ml trichloroasetic acid (TCA) 0,1% pada es. Ekstrak daun yang diperoleh ditambahkan 3 ml H3PO4 1% dan 1 ml TBA
0,6% dalam TCA 20%. Larutan yang diperoleh di oven pada suhu 1000C selama 30 menit. Setelah didinginkan, larutan ditambahkan 4 ml n-butanol dan disentrifus 4200 rpm suhu 280C selama 20 menit. Supernatan yang diperoleh diukur absorban
pada panjang gelombang 532 nm dan 520 nm. Selisih kedua absorban merupakan nilai nonspesifik dan jumlah MDA diperoleh dari koefisien (ε=155 L mmol-1 cm
-1). Dengan rumus sebagai berikut:
((Selisih absorban antara 532 nm dan 520)/ 155 L mmol-1 cm-1) x 106
berat segar
20 Persiapan ekstrak enzim
Daun diekstak dengan menggunakan metode Jiang and Huang (2001), 0,2g sampel daun digerus dengan 4 ml larutan yang mengandung 50 mM buffer fosfat (PH 7,0), 1 % polyvinypolypyrrolidona dan 0,2 mM asam askorbat. Hasil gerusan disentrifus pada 15 000 g selama 30 menit sehingga diperoleh supernatan. Supernatan disimpan di -300C yang digunakan untuk analisis enzim Glutation reduktase (GR), superoksida dismutase (SOD), dan askorbat peroksidase (APX).
Analisis glutation reduktase (GR)
Aktivitas GR berdasarkan penurunan absorban pada 340 nm selama 1 menit (Cakmak et al. 1993). Campuran reaksi mengandung 1 mM EDTA, 0,5 mM GSSG, 0,15 mM NADPH, 100 mM buffer sodium phosphate (pH 7,8) dan 0,5 ml ekstrak enzim. Aktivitas enzim dinyatakan dalam per berat unit protein. Kandungan protein diukur dengan menggunakan bovine serum albumin sebagai standar berdasarkan metode Bradford (1976).
Analisis superoksida dismutase (SOD)
Aktivitas SOD diukur dengan spektrofotometer. Pengukuran dilakukan dengan menghambat pembentukan blue diformazan dengan keberadaan riboflavin/nitrobule tetrazolium (NBT) dan cahaya. Ekstrak daun (90 μl) dimasukkan kedalam tabung yang mengandung 1 ml sodium fosfat 50 mM (pH 7.8), EDTA 0,1 mM, riboflavin 0,3 mM. Setelah inkubasi selama 5 menit pada suhu kamar, ditambahkan (NBT) 0,03 mM. Larutan tersebut diberi cahaya lampu (55 W, 20 cm di bawah larutan) tiap 30 detik selama 1 menit dan diukur dengan spektrofotometer pada panjang gelombang 560 nm. Larutan tanpa ekstrak daun digunakan sebagai kontrol. Aktivitas enzim dinyatakan dalam unit mg-1 protein; satu unit merupakan 50% penghambatan pembentukan blue diformazan (Beauchamp and Fridovish 1971 cit Pritchard et al. 2000 ).
Askorbat peroksidase (APX)
Aktivitas Askorbat peroksidase (APX) diukur bedasarkan penurunan absorban pada 290 nm selama 1 menit (Nakano dan Asada 1981). Campuran
21 reaksi mengandung 50 mM bufer fosfat (pH 7,0), 0,5 mM asam askorbat, 0,1 mM EDTA dan 0,1 mM hidrogen peroksida.
Analisis askorbat (ASA)
Kandungan ASA dianalisis berdasarkan metode yang dikembangkan oleh Reiss (1993) yang dimodifikasi. Kandungan ASA diukur dengan menggunakan metode titrasi. Sampel daun (0,5 g) digerus dengan asam metafosforik 5% untuk mencegah terjadinya oksidasi dari asam askorbat. Hasil gerusan disaring dengan menggunakan filter Wathman. Larutan yang diperoleh dititrasi dengan dichlorophenol-indophenol (DCIP) 0,8 g l-1. Sebelum titrasi, larutan DCIP distandarisasi dengan larutan asam askorbat murni, yaitu 1 ml larutan asam askorbat (4,0 mg l-1) dan 9 ml asam metaphosphorik 5%. Titrasi dihentikan ketika terjadi perubahan warna larutan menjadi warna pink. Kandungan ASA diperoleh dengan rumus sebagai berikut:
1. Untuk standarisasi larutan ASA (4 mg ASA murni equivalen dengan 1ml
dye.
ASA (mg) = 4 mg ASA murni 1 ml dye dye yang dititrasi (ml)
2. Untuk mengetahui kandungan ASA daun tanaman (ASA 100 g-1 jaringan daun):
mg ASA per aliquot x [total volume ekstrak (ml)/ volume aliquot (ml)] x (100/ berat sampel)
Pengukuran akumulasi prolin
Kandungan prolin bebas dianalisis berdasarkan metode yang dikembangkan oleh Bates (1973), dengan menggunakan Beckman DB-G spectrophotometer. Sampel daun yang dipakai adalah daun yang berkembang sempurna. Untuk menentukan kadar prolin dalam sampel digunakan prolin murni sebagai standar. Asam-ninhydrin disiapkan sebagai pereaksi dengan menghangatkan 1,25 g ninhydrin dalam 30 ml asam asetat glacial dan 20 ml 6 mol asam fosfat dengan cara dipanaskan sampai larut. Kemudian didinginkan dan disimpan pada suhu 40C. Pereaksi ini telah siap setelah 24 jam. Kira-kira 0,5 g
22 bahan tanaman (daun) diekstraksi dalam 10 ml asam sulfosalisilik 3% dan difiltrasi filter whatman. Sebanyak 2 ml filtrat direaksikan dengan 2 ml asam ninhydrin dan 2 ml asam asetat glasial pada tabung reaksi selama 1 jam pada suhu 1000C, kemudian proses reaksi diakhiri dalam “ice-bath”. Campuran ini selanjutnya diekstraksi dengan 4 ml toluene, dikocok dengan kuat menggunakan “test tube strirrer” selama 15-20 detik. Kemudian diukur absorbansinya pada 520nm dengan spektrofotometer. Untuk blanko digunakan toluene. Konsentrasi prolin ditentukan dari kurva standar dan dihitung berdasarkan berat segar yaitu:
(μg prolin / ml x ml toluene) / 115.5 μg / μmol (g sample) / 5
23
DAFTAR PUSTAKA
Agroindonesia. 2001. Produktivitas Tanaman Kedelai Indonesia. http://www.agroindonesia.com/news/ind/2001/mei/03-05-01.html. Kamis, 23 Februari 2006.
Apel K, Hirt H. 2004. Reactive Oxygen Species: metabolism, oxydative stress, and signal transduction. Plant Biol 55:373-399.
Aroca.R, Juan JI, Manuel SD. 2001. Photosynthetic characteristics and protective mechanisms against oxidative stress during chilling and subsequent recovery in two maize varieties differing in chilling sensitivity. Plant Science 161:719–726.
Bates LS. 1973. Rapid determination of free proline for water-stress studies. Plant and Siol. 39:205-207.
Barr HD, Weatherley PE. 1962. A re-examination of the relative turgidity technique for estimating water deficit in leaves. Aust. J. Biol. Sci 15:413-428.
Berkowitz GA. 1998. Water and Salt Stress. In: Raghavendra AS (ed). Photosynthesis: A Comprehensive Treatise. Cambridge: Cambridge University Pr; p. 226-237.
Blokhina O, Virolainen E, Fagerstedt. 2003. Antioxidant, oxidative damage and oxygen deprivation stress [review]. Annals of Botany 91: 179-194.
Borges R. 2003. How soybeans respond to drought stress. Issues in Agriculture. www.uwex.edu/ces/ag/issues/ drought2003/soybeansrespondstress.html - 16k - . Kamis 09 Maret 2006.
Cakmak I, Strbac D, Marschner H. 1993. activities of hydrogen peroxide-scavenging enzymes in germinating wheat seeds. J. Exp. Bot 44:127-132. Calzyme Laboratories. 1997. Glutathione peroxidase. Calzyme Laboratories.
[terhubung berkala]. http://www.calzyme-laboratories.com.html.
Chaves MM, Oliveira MM. 2004. Mechanisms underlying plant resilience to water deficits: prospects for water-saving agriculture. J. Exp. Bot. 55(407):2365-2384.
Chia, L.S., D.G. McRae and J.E. Thompson. 1982. Light-dependence of paraquat- initiated membrane deterioration in bean plants. Evidence for the involvement of superoxide. Plant Physiol. 56:492-499.
24 Comstock JP. 2002. Hydraulic and chemical signaling in the control of stomatal
conductance and transpiration. Journal of [Short papers]. J Exp Bot 53:195-200.
Darman MA. 2000. Varietas unggul dan strategi pemuliaan kedelai di Indonesia. Di dalam: Penelitian dan Pengembangan Produksi Kedelai di Indonesia. Prosiding lokakarya; Jakarta, 6-7 Agustus 1996. Jakarta: BPP Teknologi; hlm 39-42.
Flexas J, Medrano H. 2002. Drought_inhibition of photosynthesis in C3 plants: stomatal and non-stomatal limitations revisited. Annals bot 89:183-189. Gossett DR, Banks SW, Millhollon EP, Lucas MC. 1996. Antioxidant respone to
NaCl stress in a control and an NaCl-tolerant cotton cell line grown in the presence of paraquat, buthionine sulfoximine, and exogenous glutathione. Plant physiol 112:803-809.
Hamim. 1995. Toleransi kedelai terhadap cekaman kekeringan: Pendekatan morfologi dan fisiologi [tesis]. Bogor: Program Pascasarjana, Instutut Pertanian Bogor.
Hamim. 2004. Underlying drought stress effects on plant: Inhibition of photosynthesis [ulasan]. Hayati 11:164–169.
Horton P, Ruban A. 2004. Molecular design of photosystem II light-harvesting antenna: photosynthesis and photoprotection. J Expt Bot 56 (411):365-373.
Hutapea J, Zum AM. 2004. Ketahanan pangan dan teknologi produktivitas menuju kemandirian pertanian Indonesia. Depnakertrans. http://www.nakertrans.go.id. Kamis, 23 Februari 2006.
James R, Mahan, Wanjura DF. 2005. Seasonal patterns of glutathione and ascorbate metabolism in field-grown cotton under water stress. Crop sci 45:193-201.
Jiang Y, Huang B. 2001. Drought and heat stress injury to two cool-season turgrasses in relation to antioxidant metabolism and lipid peroxidation. Crop Sci 41:436– 442.
Jusuf M, A Kasno, D. Sopandie, EDJ Supena, U Widyastuti, Miftahudin, Hamim dan Supiyatno. 1993. Evolusi plasma nutfah kedelai untuk lahan kering atau ber-PH rendah serta berkualitas nutrisi baik. F MIPA, IPB. 37 hal. Kramer PJ, Boyer JS. 1995. Water Relations of Plants and Soils. San diego:
Academic Press.
Levitt J. 1980. Responses of Plants to Enviromental Stresses. Vol 2. academic Press. New York. 606 p.
25 Lizana C et al. 2006. Differential adaptation of two varieties of common bean to
abiotic stress [Research paper]. J Exp Bot 57(3):685-697.
Lukaszewski KM, Blevins DG. 1996. Root growth inhibition in boron-deficient or aluminum-stressed squash may be a result of impaired ascorbate metabolism. Plant Physiol 112: 1135-1140.
Mattjik AA, Sumertajaya IM. 2002. Perancangan percobaan: dengan aplikasi SAS dan minitab ( ed. 2). Jurusan statistik FMIPA IPB: IPB Press.
May Jm. 1999. Is ascorbic asid an antioxidant for plasma membrane ?. Faseb Journal 13:995-1006.
Meyer RF, Boyer JS. 1981. Osmoregulation solute distribution and growth in soybean seedlings having low water potensial. Planta 151:482-489.
McKersie BD, Leshem YY. 1994. Stress and Stress Coping in Cultivated Plants. Netherlands: Kluwer Academic Publishers.
Medrano H, Escalona JM, Bota J, Gulias J, Flexas J. 2002. Regulation of photosynthesis of C3 plants in response to progressive drought: stomatal
conductance as a reference parameter. Annals Bot 89:895-905.
Maroco J, Rodrigues ML, Lopes C, Chaves MM. 2002. Limitations to leaf photosynthesis in grapevine under drought: metabolic and modeling approaches. Functional Plant Biology 29:451–459.
Meyer S, Genty B. 1998. Mapping intercellular CO2 mole fraction (Ci) in Rosa
rubiginosa leaves fed with abscisic acid by using chlorophyll fluorescence
imaging: significance of Ci estimated from leaf gas exchange. Plant
Physiol 116:947–957.
Noctor G, Foyer GH. 1998. Ascorbate and glutathione: Keeping active oxygen under control. Plant Physiol 49:249-279.
Ono K, Yamamoto Y, Hachiya A. 1995. Synergistic inhibition of growth by aluminium and iron of tobacco (Nicotiana tabacum L.) cells in suspension culture. Plant Cell Physiol 36(1):115-125.
Palm EC. 1971. Weed Control: Principle of plant and animal pest control. National Academy of Sciences. Washington DC.
Pastenes C, Pimentel P, Lillo J. 2004. Leave movements and photoinhibition in relation to water stressing field-grown beans. J Exp Bot 56 (411):425-433. Popova L, et al. 2003. Salisylic acid – and methyl jasmonate – induced protection
on photosynthesis to paraquat oxidative stress. Bulg. J. Plant. Physiol [special issue] 133-152.
26 Pritchard GS, et al. 2000. The influence of elevated CO2 on the activities of
antioxidative enzymes in two soybean genotypes. Aust. J. Plant Physiol 27: 1061-1068.
Prochazkova D, Sairam RK, Srivastava GC, Singh DV. 2001. Oxidative stress and antioxidant activity as the basis of senescence in maize leaves. Plant science 161:765-771.
Purwanto E. 2003. Photosynthesis activity of soybean (Glycine max L.) under drought stress. Agrosains 5(1):13-18.
Reade JPH, Cobb AH. 2002. Herbicides: modes of action and metabolism. In: Naylor REL, editor. Weed Management Handbook. Ed ke-9. British: Blackwell Science. p.134-170.
Sonja D, Veljovic-Jovanovic, Cristina P, Graham N, Christine HF. 2001. Low askorbic acid in the vtc-1 mutant of Arabidopsis is associated with decreased growth and intracellular redistribution of the antioxidant system. Plant Physiol 127:426–435.
Sopandie D, Hamim, M Jusuf dan Supiyatno. 1996. Toleransi tanaman kedelai terhadap cekaman air: Uji lapangan beberapa genotipe toleran. Bul Agron 24(2):20-23.
Taiz L, Zeiger E. 2002. Plant Physiology. Sunderland: Sinauer Associates.
Taylor NL, Day DA, Millar AH. 2002. Environmental stress causes oxidative damage to plant mitochondria leading to inhibition of glycine decarboxylase. J Biol Chem 277(45):42663-42668.
Tezara W, Mitchell V, Driscoll SP, Lawlor DW. 2002. Effects of water deficit and its interaction with CO2 supply on the biochemistry and physiology of
photosynthesis in sunflower. J. Exp. Bot 53:1781-1791.
Vu JCV, Allen LH, Bowes G. 1987. Drought stress and elevated CO2 effects on
soybean ribulose bisphosphate carboxylase activity and canopy photosynthetic rates [abstract]. Plant physiol 83(3):573-578.
Winterbourn CR, Hawkins M, Brian Carrell. 1975. The estimation of red cell superoksida dismutase actiity. J Lab Clin Med 85:337-342.
Wikipedia. 2006. Ascorbic acid. Free encyclopedia. en.wikipedia.org/wiki/Ascorbic_acid. 25 Mei 2006.
Yen GC, Chen HY. 1995. Antioxidant activity of various tea extract in relation to their antimutagenicity. J Agric Food Chem 43:27-32.
27 Table 3. Rincian biaya penelitian
28
Nama bahan Biaya (Rp)
1. folibek ukuran 35 x 35 cm 5 kg 2. tanah 25 karung @ 5.000 3. pasir 1 pick up
4. transport tanah dan pasir 5. pupuk
6. upah pekerja 7. laboratorium
8. biaya pemakaian alat CI-500 9. biaya analisis SOD
10. biaya analisis APX 11. biaya analisis GPX
12. biaya analisis asam askorbat 13. biaya analisis prolin
65.000 125.000 120.000 50.000 50.000 200.000 100.000 2.000.000 500.000 500.000 500.000 500.000 500.000 Total biaya 5.210.000
Tabel 4. Rincian biaya pembuatan laporan
Kegiatan Biaya (Rp)
1. pemakaian internet 2. print out laporan 3. foto kopi laporan 4. biaya lain-lain 200.000 100.000 100.000 100.000 Total biaya 500.000
23
HASIL DAN PEMBAHASAN
Kandungan Air Media (KAM)
Air memegang peranan penting bagi tanaman. Untuk setiap gram zat organik yang dibuat oleh tanaman kira-kira 500 gram air diserap oleh akar dari tanah, yang nantinya akan ditranspor ke seluruh bagian tanaman dan beberapa akan hilang ke atmosfer (Taiz dan Zeiger 2002). Kandungan air pada tanaman akan dipengaruhi oleh faktor lingkungan, dan salah satunya adalah kandungan air tanah itu sendiri.
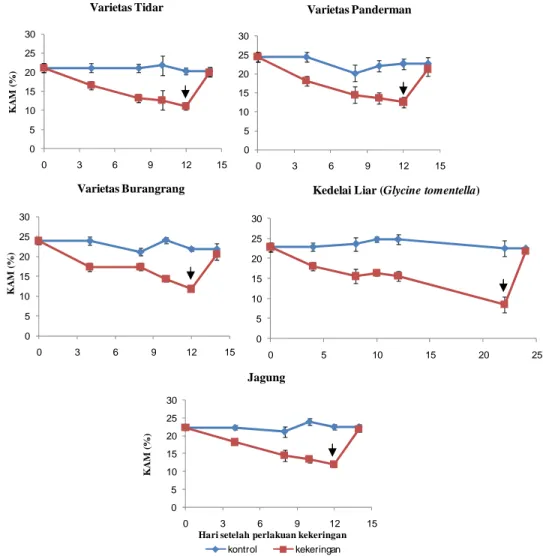
Perlakuan cekaman kekeringan dengan menunda penyiraman dapat menurunkan KAM hingga mencapai rata-rata 51%, seperti pada Gambar 7. KAM terendah setelah 12 hari perlakuan kekeringan terdapat pada varietas Tidar yaitu 11,13% dan yang tertinggi pada varietas Panderman yaitu 12,54%. Dari data terlihat bahwa Panderman termasuk kedelai peka terhadap kekeringan, sehingga dengan KAM sebesar 12,54% tanaman telah layu seperti tanaman lainnya. Berbeda dengan kedelai budidaya, kedelai liar bisa mempertahankan turgornya sampai hari ke-22 ketika KAM mencapai nilai sebesar 8,53%. Seperti halnya kedelai budidaya, jagung juga hanya bisa bertahan sampai hari ke-12 setelah perlakuan kekeringan. Hal ini bisa dimengerti, karena struktur tanaman jagung lebih besar dari pada tanaman kedelai, sehingga jagung membutuhkan jumlah air yang lebih besar dibandingkan kedelai.
Penurunan KAM dapat mengakibatkan terjadinya ketidakseimbangan aliran air pada tanaman, sehingga terjadi defisit air dan gangguan fungsi fisiologis di dalam sel tanaman. Menurut Taiz dan Zeiger (2002) laju aliran air dalam tanah bergantung pada dua faktor yaitu: besarnya gradien tekanan air tanah, dan konduktivitas hidrolik tanah. Aliran air ini terkait dengan potensial air, potensial osmotik dan gradien tekanan. Ketika kandungan air tanah menurun, konduktivitas hidrolik tanah juga akan menurun drastis. Penurunan ini terjadi karena adanya penguapan. Pada tanah yang sangat kering, potensial air akan menurun dibawah titik layu permanen. Pada titik ini potensial air tanah sangat rendah dimana tanaman tidak bisa mempetahankan tekanan turgor walaupun kehilangan air lewat
24 transpirasi berhenti. Pada kondisi ini berarti potensial air tanah lebih rendah dari atau sama dengan potensial osmotik tanaman (Levitt 1980).
Aliran air di tanah terjadi dalam bentuk aliran bulk yang terjadi karena adanya gradien tekanan. Air ini kemudian akan diserap oleh tanaman secara osmosis melalui membran sel akar. Penyerapan air ini terjadi karena adanya gradien potensial osmotik ataupun gradien potensial air antara tanaman dan tanah (Taiz dan Zeiger 2002).
0 5 10 15 20 25 30 0 3 6 9 12 15 KA M ( % ) Varietas Tidar 0 5 10 15 20 25 30 0 3 6 9 12 15 KA M ( % ) Varietas Burangrang 0 5 10 15 20 25 30 0 3 6 9 12 15 Varietas Panderman 0 5 10 15 20 25 30 0 5 10 15 20 25
Kedelai Liar (Glycine tomentella)
0 5 10 15 20 25 30 0 3 6 9 12 15 KA M ( % )
Hari setelah perlakuan kekeringan Jagung
kontrol kekeringan
Gambar 7 Kandungan Air Media (%) pada 0 sampai 12 HSP kekeringan dan
recovery. Tanda panah menunjukan titik rewatering.
Ketika kondisi kekeringan, tanah akan mengalami penurunan potensial air, sehingga laju penyerapan air oleh tanaman juga menurun. Telah diketahui bahwa aliran air terjadi dari potensial air tinggi ke potensial air rendah, sehingga tanaman
25 berusaha untuk menjaga agar potensial air tanaman lebih rendah dari pada potensial air tanah, sehingga air dapat diserap oleh tanaman (Kramer dan Boyer 1995).
Rewatering akan dapat meningkatkan KAM kembali (Gambar 7).
Peningkatan KAM mencapai nilai yang tidak berbeda nyata dengan kontrol. Menurut Marschner (1995), peningkatan kandungan air tanah dapat mengurangi faktor stres yang disebabkan oleh cekaman kekeringan dan dapat menurunkan kerusakan akibat stres yang terjadi. Dengan sendirinya tanaman dapat tumbuh kembali dan terhindar dari kerusakan akibat stres air.
Kandungan Air Relatif (KAR)
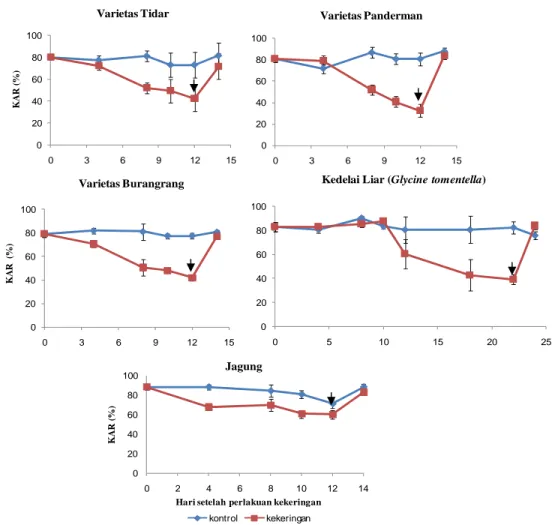
Penurunan KAM akibat perlakuan cekaman kekeringan menyebabkan penurunan KAR daun tanaman, seperti pada Gambar 8. Penurunan KAR daun mulai terlihat pada hari ke-4 setelah perlakuan cekaman kekeringan. Penurunan ini terus terjadi sampai hari terakhir perlakuan (hari ke-12). Nilai KAR tertinggi setelah 12 hari perlakuan cekaman kekeringan terdapat pada jagung yaitu 60,7%, sedangkan KAR terendah pada kedelai varietas Panderman yaitu 32,45%.
Secara umum hari ke-12 setelah perlakuan kekeringan tanaman mengalami penurunan KAR sampai dibawah 50%, kecuali pada kedelai liar dan jagung. Pada kedelai liar penurunan dibawah 50% baru terjadi pada hari ke-18 setelah perlakuan kekeringan, sedangkan pada tanaman jagung penurunan KAR mencapai nilai 60%. Penurunan KAR daun ini diikuti oleh kehilangan turgor daun dan akhirnya terjadi kelayuan, penutupan stomata, penurunan fotosintesis dan mempengaruhi proses metabolisme dasar lainnya (Kramer 1995).
Kehilangan turgor akibat penurunan KAR daun berkaitan dengan kondisi air media tanam. Pada kondisi normal, dimana potensial air media lebih tinggi dari pada potensial air tanaman, tanaman akan dapat menyerap air dengan baik. Proses ini berlangsung hingga terjadi keseimbangan, yaitu potensial air sel tanaman akan meningkat sama dengan potensial air media sehingga tekanan turgor benilai positif (Taiz dan Zeiger 2002). Ketika cekaman kekeringan terjadi, dimana KAM rendah, laju penyerapan air oleh tanaman menurun, sehingga KAR daun juga ikut menurun dan akan menurunkan tekanan turgor sel.
26 Penurunan KAR daun akan menurunkan konduktansi stomata daun dan dengan perlahan akan menurunkan konsentrasi CO2 di dalam daun. Karena
penurunan konduktansi stomata menyebabkan penurunan konsentrasi CO2 dan
dengan sendirinya akan menurunkan laju fotosintesis (Lawlor 2002). Penurunan konduktansi stomata ini terjadi pada tanaman untuk mengurangi kehilangan air yang berlebihan akibat stres air yang terjadi (Levitt 1980).
0 20 40 60 80 100 0 5 10 15 20 25
Kedelai Liar (Glycine tomentella) 0 20 40 60 80 100 0 3 6 9 12 15 KA R ( % ) Varietas Tidar 0 20 40 60 80 100 0 3 6 9 12 15 KA R (% ) Varietas Burangrang 0 20 40 60 80 100 0 3 6 9 12 15 Varietas Panderman 0 20 40 60 80 100 0 2 4 6 8 10 12 14 KA R ( % )
Hari setelah perlakuan kekeringan Jagung
kontrol kekeringan
Gambar 8 Kandungan Air Relatif (%) kedelai dan jagung pada 0, sampai 12 HSP kekeringan dan recovery. Tanda panah menunjukkan titik rewatering.
Rewatering dapat meningkatkan KAR daun sampai pada tingkat yang
sama dengan KAR daun tanaman kontrol setelah dua hari recovery (Gambar 8). Peningkatan KAR (Gambar 8) seiring dengan peningkatan KAM (Gambar 7). Peningkatan KAR daun ini diperlukan untuk perbaikan tanaman dari kerusakan akibat perlakuan cekaman kekeringan. Blanco-shanchez et al. (2002) telah
27 melakukan penelitian pada tanaman Cistus albidus dan Cistus monspeliensis, dan dari penelitian ini diperoleh bahwa pemberian air kembali pada tanaman yang mendapat perlakuan kekeringan dapat meningkatkan KAR daun sampai mencapai nilai yang sama dengan kontrol. Air sebagai komponen utama tanaman dibutuhkan untuk berbagai proses metabolisme tanaman untuk pertumbuhan dan perkembangan tanaman termasuk transportasi air dan mineral. Pada kondisi ini tanaman telah mampu kembali menjaga keseimbangan gradien potensial osmotik antara media-akar dan tajuk (Marschner 1995).
0 20 40 60 80 100 0 1 2 3 4 5 6 K AR (% ) Varietas Tidar 0 20 40 60 80 100 0 1 2 3 4 5 6 K AR (% ) Varietas Burangrang 0 20 40 60 80 100 0 1 2 3 4 5 6 Varietas Panderman 0 20 40 60 80 100 0 1 2 3 4 5 6 K AR (% )
Hari setelah perlakuan paraquat
Jagung kontrol paraquat 0 20 40 60 80 100 0 1 2 3 4 5 6
Kedelai Liar (Glycine tomentella)
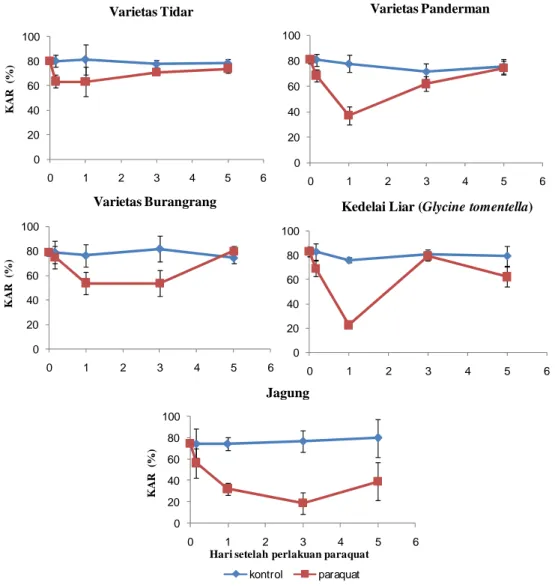
Gambar 9 Kandungan Air Relatif (%) daun dari 0, 4 jam, 1 hari sampai 5 HSP herbisida paraquat.